Exámenes de detección de los cánceres de cavidad oral y nasofaringe (PDQ®)–Versión para profesionales de salud
Aspectos generales
Los cánceres de cavidad oral, orofaringe, hipofaringe y laringe a veces se denominan cánceres de células escamosas de cabeza y cuello. El cáncer de células escamosas de la cavidad oral por lo general surge en la mucosa que reviste la cavidad oral. El cáncer de células escamosas de faringe se subdivide en cáncer de nasofaringe, cáncer de orofaringe y cáncer de hipofaringe de acuerdo con las características anatómicas. En la Figura 1 se observan las características anatómicas de la faringe.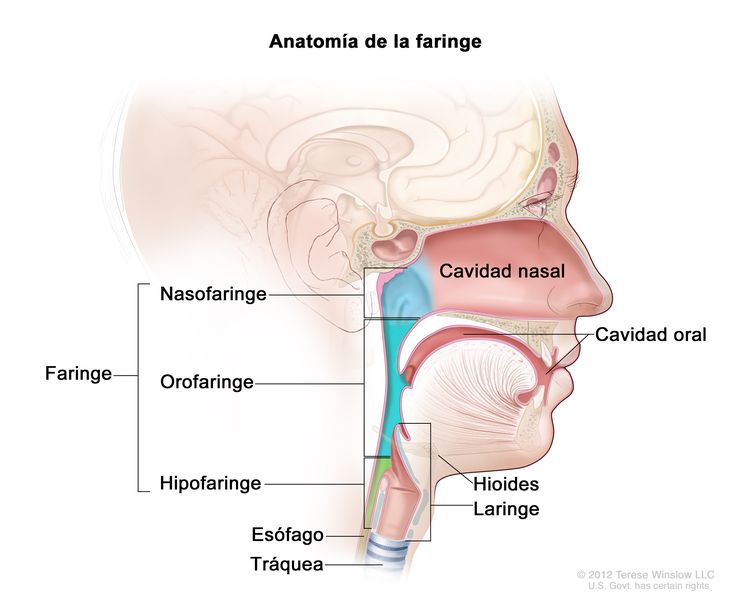
Nota: En esta sección, se resume la evidencia científica publicada sobre la prevención de este tipo de cáncer. En el resto del resumen, se describe la evidencia con más detalle.
También están disponibles otros resúmenes del PDQ relacionados: Prevención del cáncer de cavidad oral, orofaringe, hipofaringe y laringe y Tratamiento del cáncer de labio y de cavidad oral.
Beneficios
La evidencia es insuficiente para determinar si los exámenes de detección disminuirían la mortalidad por los cánceres de cavidad oral y nasofaringe.
Magnitud del efecto: no hay evidencia del beneficio; los perjuicios no se han cuantificado.
- Diseño del estudio: evidencia obtenida de un ensayo controlado aleatorizado y estudios de observación.
- Validez interna: deficiente.
- Congruencia: no aplica (N/A).
- Validez externa: deficiente.
Perjuicios
Los perjuicios, aunque son inevitables, no se han cuantificado según la bibliografía médica. Sin embargo, el empleo periódico de exámenes de detección conlleva algunos perjuicios inevitables, como los siguientes:
- Tratamiento innecesario por sobrediagnóstico.
- Consecuencias psicológicas de resultados positivos falsos de las pruebas.
- Diagnóstico erróneo debido a la variabilidad en la evaluación de las biopsias.
Magnitud del efecto: desconocida.
- Diseño del estudio: estudios de observación.
- Validez interna: deficiente.
- Congruencia: N/A.
- Validez externa: deficiente.
Incidencia y mortalidad
El número estimado de casos nuevos de cánceres de cavidad oral y orofaringe que se diagnosticarán en los Estados Unidos en 2025 es de 59 660, y se calcula que 12 770 personas morirán por estas enfermedades.[1] La incidencia general anual en los Estados Unidos es de cerca de 11 casos por 100 000 hombres y mujeres; la tasa de incidencia es mayor en personas de 75 a 84 años.[2]
Entre 2012 y 2021, las tasas de incidencia aumentaron un 0,7 % por año.[1] La incidencia ha ido en aumento para los cánceres de cavidad oral y orofaringe que se vinculan con la infección por el virus del papiloma humano (VPH). Alrededor del 60 % de los cánceres de boca o faringe se encuentran en un estadio moderadamente avanzado (estadio regional) o son metastásicos en el momento del diagnóstico.[2] La tasa de supervivencia relativa a 5 años es del 69 %.[1]
A nivel mundial, el número estimado anual de casos de cáncer de cavidad oral y orofaringe se acerca a 275 000, con una variación geográfica 20 veces mayor en algunas zonas.[3] Las tasas son elevadas sobre todo en el sur y el sudeste de Asia (India, Sri Lanka, Pakistán y Bangladesh), Francia y Brasil. En la mayoría de los países, los hombres exhiben tasas más elevadas de cáncer de cavidad oral (debido al consumo de tabaco) y de cáncer de labio (debido a la exposición solar ocupacional al aire libre) que las mujeres.[3]
Los cánceres de nasofaringe son raros en los Estados Unidos; la tasa de incidencia anual es de 0,7 casos por 100 000 personas.[4] No obstante, hay diferencias geográficas marcadas: la incidencia general en la China es 40 a 380 veces más alta que en los Estados Unidos.[4] Las tasas de cánceres de nasofaringe son elevadas en la población cantonesa del sur de la China (incluso en Hong Kong), y se observan tasas intermedias en varias poblaciones indígenas del sudeste asiático, así como en nativos de la región del Polo Ártico, África del norte y el Oriente medio. Los inmigrantes chinos de primera generación en los Estados Unidos conservan una tasa de incidencia alta, mientras que los descendientes nacidos en este país exhiben una incidencia reducida. La tasa de supervivencia a 5 años del carcinoma de células escamosas queratinizante, el subtipo de cáncer de nasofaringe más frecuente en los Estados Unidos, es del 46 %.[5]
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Surveillance Research Program, National Cancer Institute: SEER*Explorer: An interactive website for SEER cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed December 30, 2024.
- Warnakulasuriya S: Global epidemiology of oral and oropharyngeal cancer. Oral Oncol 45 (4-5): 309-16, 2009 Apr-May. [PUBMED Abstract]
- Richey LM, Olshan AF, George J, et al.: Incidence and survival rates for young blacks with nasopharyngeal carcinoma in the United States. Arch Otolaryngol Head Neck Surg 132 (10): 1035-40, 2006. [PUBMED Abstract]
- Ou SH, Zell JA, Ziogas A, et al.: Epidemiology of nasopharyngeal carcinoma in the United States: improved survival of Chinese patients within the keratinizing squamous cell carcinoma histology. Ann Oncol 18 (1): 29-35, 2007. [PUBMED Abstract]
Factores de riesgo
Los principales factores de riesgo del cáncer de cavidad oral en hombres y mujeres en los Estados Unidos son el tabaco (incluso el tabaco sin humo), las bebidas alcohólicas, el betel masticable y la infección por el virus del papiloma humano (VPH).
Entre los factores de riesgo del cáncer de nasofaringe se incluye la infección persistente por el virus de Epstein-Barr (VEB).[1]
Para obtener más información sobre los factores de aumento o disminución del riesgo de cánceres de células escamosas de cavidad oral, consultar Prevención del cáncer de cavidad oral, orofaringe, hipofaringe y laringe y Tratamiento del cáncer de labio y de cavidad oral.
Infección por el virus de Epstein-Barr
A partir de evidencia sólida, la infección por el virus de Epstein-Barr (VEB) causa cáncer de nasofaringe en áreas de incidencia alta.[1] La evidencia en conjunto abarca muchos estudios de casos y controles y estudios de cohortes en donde se observó una proporción más alta de pacientes con cáncer de nasofaringe que tienen anticuerpos anti-VEB en comparación con los controles, y se determinó que el estado de seropositividad precede el diagnóstico del tumor.[2,3] En estudios recientes también se encontró DNA del VEB libre circulante en pacientes con cáncer de nasofaringe pero no en los controles.[4] El VEB por sí solo no es una causa suficiente porque el 90 % de los adultos a nivel mundial están infectados por este virus, pero solo una pequeña proporción presenta cáncer de nasofaringe.[5] La infección por el VEB es subclínica y se presenta en la niñez temprana. Se piensa que la etiopatogenia implica una latencia de la infección vírica en las células epiteliales que han sufrido cambios genéticos premalignos.
Uno de los primeros estudios donde se observó una asociación fue un estudio de cohorte donde se encontraron valores de anticuerpos anti-VEB más altos en el 84 % de 235 pacientes con cáncer de nasofaringe del este del África y China.[2,5] En el mismo estudio se encontraron títulos de anticuerpos anti-VEB más altos a mayor estadio tumoral; además, en un componente de casos y controles del estudio se reveló que los valores de anticuerpos anti-VEB elevados fueron 6 veces más probables en los pacientes con carcinoma de nasofaringe en comparación con los pacientes con cánceres de cabeza y cuello en otros sitios.
En otros estudios se observó elevación de los valores de anticuerpos IgG e IgA contra el antígeno de la cápside vírica del VEB y otros antígenos víricos latentes, que precede en varios años la formación del tumor y se correlaciona con la carga tumoral, la remisión y la recidiva.[2,3] En un estudio de cohorte grande con 9699 hombres se midieron las concentraciones de anticuerpos IgA contra el antígeno de la cápside del VEB y los anticuerpos neutralizantes de la DNasa específica del VEB, luego se hizo seguimiento para determinar si ocurría un diagnóstico de cáncer de nasofaringe.[3] El riesgo relativo de carcinoma de nasofaringe fue de 32,8 en los pacientes con ambos marcadores de anticuerpos (intervalo de confianza [IC] 95 %, 7,3–147,2; P < 0,001), y de 4,0 en los pacientes con un marcador (IC 95 %, 1,6–10,2; P = 0,003), en comparación con los pacientes sin ningún marcador. Se observó una relación temporal en cuanto a la diferencia en la incidencia acumulada entre los pacientes seropositivos y seronegativos que aumentó con un seguimiento más prolongado. En otro estudio se encontró DNA del VEB libre circulante en el 95 % de los pacientes con cáncer de nasofaringe avanzado, pero no en los controles ni en los pacientes curados.[4]
Bibliografía
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans: Biological agents. Volume 100 B. A review of human carcinogens. IARC Monogr Eval Carcinog Risks Hum 100 (Pt B): 1-441, 2012. [PUBMED Abstract]
- Henle W, Henle G, Ho HC, et al.: Antibodies to Epstein-Barr virus in nasopharyngeal carcinoma, other head and neck neoplasms, and control groups. J Natl Cancer Inst 44 (1): 225-31, 1970. [PUBMED Abstract]
- Chien YC, Chen JY, Liu MY, et al.: Serologic markers of Epstein-Barr virus infection and nasopharyngeal carcinoma in Taiwanese men. N Engl J Med 345 (26): 1877-82, 2001. [PUBMED Abstract]
- Lin JC, Wang WY, Chen KY, et al.: Quantification of plasma Epstein-Barr virus DNA in patients with advanced nasopharyngeal carcinoma. N Engl J Med 350 (24): 2461-70, 2004. [PUBMED Abstract]
- Chang ET, Adami HO: The enigmatic epidemiology of nasopharyngeal carcinoma. Cancer Epidemiol Biomarkers Prev 15 (10): 1765-77, 2006. [PUBMED Abstract]
Evidencia de los beneficios de los exámenes de detección
En los países desarrollados no se han establecido programas poblacionales de exámenes de detección para los cánceres de células escamosas de cavidad oral, aunque se ha promovido la detección incidental durante los exámenes periódicos de la cavidad oral, el único sitio evaluable sin endoscopia.[1,2]
Exámenes de detección de los cánceres de cavidad oral
Hay diferentes métodos para la detección de los cánceres de cavidad oral. Los cánceres de cavidad oral surgen en una región del cuerpo que, por lo general, es accesible al examen físico por parte del paciente, el odontólogo y el médico. El examen visual es el método más común para detectar lesiones visibles. Se han utilizado otros métodos para aumentar la detección clínica de las lesiones orales, como el empleo de azul de toluidina, la biopsia por cepillado y la tinción con fluorescencia.
La inspección de la cavidad oral suele ser parte del examen físico en el consultorio del médico o el odontólogo. Es importante mencionar que las personas con riesgo alto visitan con mayor frecuencia al médico que al odontólogo. Aunque es más probable que los médicos brinden orientación sobre los factores de riesgo (como el cese del consumo de tabaco), es menos probable que examinen la boca para detectar un cáncer de la boca en comparación con los odontólogos.[3] En general, solo una fracción (~20 %) de las personas en Estados Unidos se someten a un examen para cáncer de boca. Los pacientes negros, hispanos y aquellos con un grado de escolaridad más bajo tienen menos probabilidades de someterse a este tipo de examen, quizá por falta de acceso a la atención médica.[3] Un examen oral a menudo incluye la búsqueda de lesiones leucoplásicas y eritroplásicas que pueden progresar y convertirse en cáncer.[4,5] En un estudio, se observó que la visualización directa con fluorescencia (con un dispositivo manual sencillo en el quirófano) permitió identificar campos subclínicos de riesgo alto con cambios cancerosos o precancerosos que se extienden hasta 25 mm del borde del tumor primario en 19 de 20 pacientes sometidos a cirugía oral por tumores de células escamosas invasivos o in situ.[6] Sin embargo, este resultado todavía no se ha evaluado en el entorno de los exámenes de detección. Los datos indican que los marcadores moleculares quizás sean útiles para determinar el pronóstico de estas lesiones orales premalignas.[7]
El examen de rutina en pacientes asintomáticos y sintomáticos conduce a la detección de cánceres en estadios más tempranos y lesiones premalignas. Sin embargo, no hay evidencia definitiva que demuestre que este examen de detección reduce la mortalidad por cáncer de boca; tampoco hay ensayos controlados aleatorizados (ECA) en ningún tipo de población occidental ni en otras poblaciones de riesgo bajo.[5,8-11]
En un solo ECA de exámenes de detección versus atención habitual, los habitantes de 13 conglomerados geográficos en el distrito de Kerala en Trivandrum (India) se asignaron al azar a someterse a exámenes de detección sistemática mediante inspección visual de la boca a cargo de personal de salud capacitado (7 conglomerados de participantes sometidos al examen, 6 conglomerados de control) cada 3 años durante 4 rondas de detección entre 1996 y 2008. Durante el período de seguimiento de 15 años, hubo 138 defunciones por cáncer de boca en el grupo de exámenes de detección, con una tasa de mortalidad por causa específica de 15,4 por 100 000 años-persona y 154 defunciones en el grupo de control, con una tasa de mortalidad de 17,1 por 100 000 años-persona (riesgo relativo [RR], 0,88; intervalo de confianza [IC] 95 %, 0,69–1,12). En un análisis de un subconjunto restringido a los consumidores de tabaco o bebidas alcohólicas, las tasas de mortalidad fueron de 30 y 39 por 100 000 años-persona, respectivamente (RR, 0,76; IC 95 %, 0,60–0,97). No se hizo ajuste de los IC para el diseño por conglomerados. En otro análisis de subgrupos, se calcularon los cocientes de riesgos instantáneos de mortalidad de grupos definidos por el número de veces que los participantes se sometieron a exámenes de detección, pero se hizo una comparación inadecuada de cada caso con el grupo de control de todo el estudio. No se presentaron datos sobre el tratamiento de los cánceres de boca.[12-15]
Además del problema de la generalización a otras poblaciones y la ausencia de un resultado general estadísticamente significativo para la mortalidad por causa específica, la interpretación de los resultados se dificulta por la falta de información detallada sobre la metodología del proceso de aleatorización, el ocultamiento de la asignación, el ajuste por el efecto de los conglomerados y la información sobre el tratamiento. El número total de conglomerados aleatorizados fue bajo y hubo diferentes distribuciones según el nivel de ingresos y los bienes del hogar en los dos grupos del estudio. Los retiros y abandonos no se describieron bien. En resumen, el único ensayo aleatorizado no proporciona evidencia sólida de un beneficio para la mortalidad por causa específica relacionado con un examen visual sistemático de la cavidad oral.
Los métodos que emplean tinción con azul de toluidina, una biopsia o examen citológico por cepillado, o imágenes con fluorescencia como herramientas primarias o complementarias de los exámenes de detección no han demostrado tener una sensibilidad y especificidad superiores al examen visual solo y tampoco demostraron mejores desenlaces sanitarios.[5,16] En un ECA realizado en el condado de Keelung (Taiwán), un grupo de 7975 pacientes con riesgo alto de cáncer de boca por consumo de tabaco o de palma de betel masticable se asignó al azar a someterse una sola vez a un examen de cáncer de boca después de hacer gárgaras con azul de toluidina o con un placebo de tinte azul.[17] Las tasas de resultados positivos de las pruebas fueron del 9,5 % versus el 8,3 %, respectivamente, (P = 0,047). La detección de lesiones premalignas no fue estadísticamente diferente (razón de tasas, 1,05; IC 95 %, 0,74–1,41). El número de diagnósticos de cáncer de boca durante el corto período de seguimiento de 5 años fue demasiado pequeño para una comparación válida (6 en cada grupo).
No se establecieron bien las características de rendimiento diagnóstico de los métodos utilizados como complemento del examen visual oral. En una revisión sistemática de la bibliografía sobre el azul de toluidina, otros complementos de la visualización y un análisis citopatológico en el contexto de los exámenes de detección, se observó variación en la sensibilidad, especificidad y valor predictivo positivo cuando se usó la confirmación mediante biopsia como criterio de referencia para evaluar el resultado.[18] Esta variación en los resultados se puede atribuir, en parte, a diferencias de las poblaciones estudiadas, el tamaño y entorno de las muestras, así como los criterios para determinar un resultado positivo en una evaluación clínica o considerar la positividad del resultado de una biopsia.
Exámenes de detección del cáncer de nasofaringe
Se han usado pruebas en suero de anticuerpos del virus de Epstein-Barr (VEB) y de DNA del VEB libre circulante para la detección y el diagnóstico del cáncer de nasofaringe. En un estudio de observación de 20 349 hombres de 40 a 62 años, se usó la prueba de DNA del VEB libre circulante para detectar el cáncer de nasofaringe.[19,20] Un total de un 1,5 % de los participantes obtuvieron en 2 oportunidades resultados positivos en la prueba de DNA del VEB y se sometieron a una evaluación diagnóstica completa que condujo a un diagnóstico de cáncer de nasofaringe en 34 participantes. La prueba de DNA del VEB tuvo una sensibilidad del 97,1 % (IC 95 %, 95,5–98,7 %) y una especificidad del 98,6 % (IC 95 %, 98,6–98,7 %). En ausencia de un grupo de control en este estudio, el estadio en el momento del diagnóstico se comparó con el de una cohorte histórica y se encontró una proporción más alta de enfermedad en estadio I y estadio II (71 % vs. 20 %; P < 0,001), además de una supervivencia sin progresión a 3 años más alta en la población sometida a exámenes de detección. Sin embargo, es posible que el beneficio de supervivencia del estudio lo causara el sesgo de anticipación diagnóstica.
En otros programas de exámenes de detección del sur de la China se usan los anticuerpos del VEB, pero es difícil determinar su efecto debido a la falta de controles para establecer comparaciones de desenlaces de supervivencia.[20-22] En resumen, los estudios actuales sobre los exámenes de detección para el cáncer de nasofaringe no ofrecen evidencia sólida de beneficios de la detección en este tipo de cáncer; en especial, en regiones que no son endémicas como los Estados Unidos.
Bibliografía
- Opportunistic oral cancer screening: a management strategy for dental practice. BDA Occasional Paper 6: 1-36, 2000. Also available online. Last accessed April 14, 2025.
- Smith RA, Cokkinides V, Brooks D, et al.: Cancer screening in the United States, 2011: A review of current American Cancer Society guidelines and issues in cancer screening. CA Cancer J Clin 61 (1): 8-30, 2011 Jan-Feb. [PUBMED Abstract]
- Kerr AR, Changrani JG, Gany FM, et al.: An academic dental center grapples with oral cancer disparities: current collaboration and future opportunities. J Dent Educ 68 (5): 531-41, 2004. [PUBMED Abstract]
- Warnakulasuriya S, Johnson NW, van der Waal I: Nomenclature and classification of potentially malignant disorders of the oral mucosa. J Oral Pathol Med 36 (10): 575-80, 2007. [PUBMED Abstract]
- Brocklehurst P, Kujan O, Glenny AM, et al.: Screening programmes for the early detection and prevention of oral cancer. Cochrane Database Syst Rev (11): CD004150, 2010. [PUBMED Abstract]
- Poh CF, Zhang L, Anderson DW, et al.: Fluorescence visualization detection of field alterations in tumor margins of oral cancer patients. Clin Cancer Res 12 (22): 6716-22, 2006. [PUBMED Abstract]
- Poh CF, Zhang L, Lam WL, et al.: A high frequency of allelic loss in oral verrucous lesions may explain malignant risk. Lab Invest 81 (4): 629-34, 2001. [PUBMED Abstract]
- Screening for oral cancer. In: Fisher M, Eckhart C, eds.: Guide to Clinical Preventive Services: an Assessment of the Effectiveness of 169 Interventions. Report of the U.S. Preventive Services Task Force. Williams & Wilkins, 1989, pp 91-94.
- Antunes JL, Biazevic MG, de Araujo ME, et al.: Trends and spatial distribution of oral cancer mortality in São Paulo, Brazil, 1980-1998. Oral Oncol 37 (4): 345-50, 2001. [PUBMED Abstract]
- U.S. Preventive Services Task Force: Screening for Oral Cancer: Recommendation Statement. Rockville, Md: U.S. Preventive Services Task Force, 2013. Available online. Last accessed April 14, 2025.
- Scattoloni J: Screening for Oral Cancer: Brief Evidence Update. Rockville, Md: U.S. Preventive Services Task Force, 2004. Available online. Last accessed April 14, 2025.
- Sankaranarayanan R, Mathew B, Jacob BJ, et al.: Early findings from a community-based, cluster-randomized, controlled oral cancer screening trial in Kerala, India. The Trivandrum Oral Cancer Screening Study Group. Cancer 88 (3): 664-73, 2000. [PUBMED Abstract]
- Ramadas K, Sankaranarayanan R, Jacob BJ, et al.: Interim results from a cluster randomized controlled oral cancer screening trial in Kerala, India. Oral Oncol 39 (6): 580-8, 2003. [PUBMED Abstract]
- Sankaranarayanan R, Ramadas K, Thomas G, et al.: Effect of screening on oral cancer mortality in Kerala, India: a cluster-randomised controlled trial. Lancet 365 (9475): 1927-33, 2005 Jun 4-10. [PUBMED Abstract]
- Sankaranarayanan R, Ramadas K, Thara S, et al.: Long term effect of visual screening on oral cancer incidence and mortality in a randomized trial in Kerala, India. Oral Oncol 49 (4): 314-21, 2013. [PUBMED Abstract]
- Lingen MW, Kalmar JR, Karrison T, et al.: Critical evaluation of diagnostic aids for the detection of oral cancer. Oral Oncol 44 (1): 10-22, 2008. [PUBMED Abstract]
- Su WW, Yen AM, Chiu SY, et al.: A community-based RCT for oral cancer screening with toluidine blue. J Dent Res 89 (9): 933-7, 2010. [PUBMED Abstract]
- Patton LL, Epstein JB, Kerr AR: Adjunctive techniques for oral cancer examination and lesion diagnosis: a systematic review of the literature. J Am Dent Assoc 139 (7): 896-905; quiz 993-4, 2008. [PUBMED Abstract]
- Chan KCA, Woo JKS, King A, et al.: Analysis of Plasma Epstein-Barr Virus DNA to Screen for Nasopharyngeal Cancer. N Engl J Med 377 (6): 513-522, 2017. [PUBMED Abstract]
- Cao SM, Simons MJ, Qian CN: The prevalence and prevention of nasopharyngeal carcinoma in China. Chin J Cancer 30 (2): 114-9, 2011. [PUBMED Abstract]
- Zeng Y, Zhang LG, Li HY, et al.: Serological mass survey for early detection of nasopharyngeal carcinoma in Wuzhou City, China. Int J Cancer 29 (2): 139-41, 1982. [PUBMED Abstract]
- Zeng Y, Zhong JM, Li LY, et al.: Follow-up studies on Epstein-Barr virus IgA/VCA antibody-positive persons in Zangwu County, China. Intervirology 20 (4): 190-4, 1983. [PUBMED Abstract]
Evidencia de los perjuicios de los exámenes de detección
Los perjuicios de los exámenes de detección de los cánceres de células escamosas de cabeza y cuello se han estudiado poco en cualquier forma cuantificable.[1] Sin embargo, el empleo periódico de exámenes de detección conlleva algunos perjuicios inevitables, como los siguientes:
- Tratamiento innecesario de lesiones que no progresarían (sobrediagnóstico).
- Consecuencias psicológicas de resultados positivos falsos de las pruebas.[2]
Otro posible perjuicio es un diagnóstico erróneo que lleva a un tratamiento insuficiente o excesivo debido a interpretaciones subjetivas de los patólogos en los informes de las biopsias de lesiones orales. Cuando en un estudio multicéntrico de pacientes con antecedentes de cánceres del tubo aerodigestivo superior se compararon 87 diagnósticos obtenidos por biopsias de lesiones orales entre 21 patólogos locales y una interpretación duplicada por 2 de 3 patólogos centrales, el consenso solo fue entre moderado y bueno (coeficiente κ ponderado, 0,59; intervalo de confianza [IC] 95 %, 0,45–0,72).[3] En una clasificación bivariante de carcinoma in situ y de carcinoma versus lesiones menos graves, el acuerdo fue escaso, pero con IC muy amplios (coeficiente κ, 0,39; IC 95 %, -0,12 a -0,97). Los investigadores del mismo estudio analizaron el grado de acuerdo entre los patólogos locales y centrales usando el tejido adyacente con características clínicas normales de 67 lesiones sospechosas en la evaluación clínica que fueron sometidas a biopsia. El consenso sobre el tejido con características clínicas normales fue mejor que el de las lesiones visiblemente anormales, pero no se obtuvo un intervalo excelente (coeficiente κ ponderado, 0,75; IC 95 %, 0,64–0,86).[4]
Bibliografía
- Scattoloni J: Screening for Oral Cancer: Brief Evidence Update. Rockville, Md: U.S. Preventive Services Task Force, 2004. Available online. Last accessed April 14, 2025.
- Speight PM, Zakrzewska J, Downer MC: Screening for oral cancer and precancer. Eur J Cancer B Oral Oncol 28B (1): 45-8, 1992. [PUBMED Abstract]
- Fischer DJ, Epstein JB, Morton TH, et al.: Interobserver reliability in the histopathologic diagnosis of oral pre-malignant and malignant lesions. J Oral Pathol Med 33 (2): 65-70, 2004. [PUBMED Abstract]
- Fischer DJ, Epstein JB, Morton TH, et al.: Reliability of histologic diagnosis of clinically normal intraoral tissue adjacent to clinically suspicious lesions in former upper aerodigestive tract cancer patients. Oral Oncol 41 (5): 489-96, 2005. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (05/16/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2025 (se citó a la American Cancer Society como referencia 1).
Se revisó el texto para indicar que entre 2012 y 2021, las tasas de incidencia aumentaron un 0,7 % por año.
El Consejo editorial del PDQ sobre los exámenes de detección y la prevención es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre los exámenes de detección de los cánceres de cavidad oral y nasofaringe. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre los exámenes de detección y la prevención, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre los exámenes de detección y la prevención emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre los exámenes de detección y la prevención. PDQ Exámenes de detección de los cánceres de cavidad oral y nasofaringe. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/cabeza-cuello/pro/deteccion-cavidad-oral-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
La información en estos resúmenes no se debe utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.