¿Qué son las hormonas y los receptores hormonales?
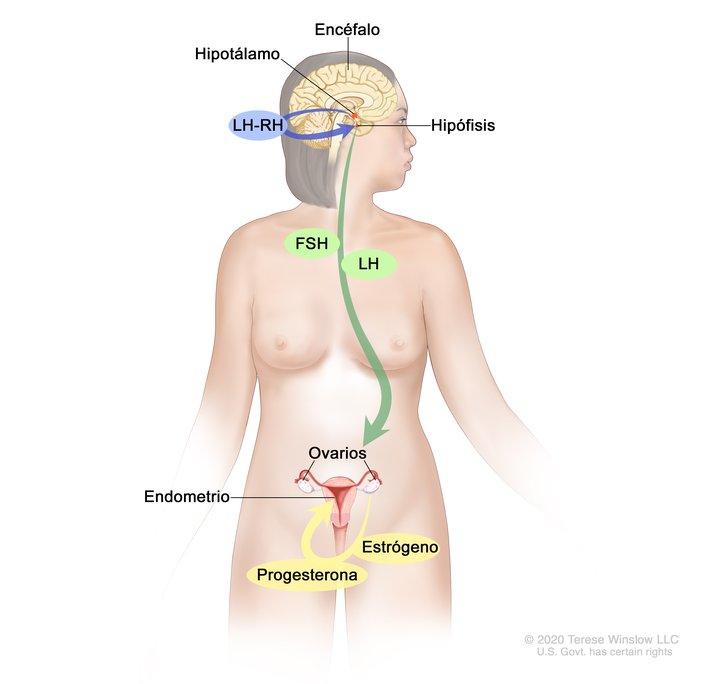
Las hormonas son sustancias que funcionan como mensajeros químicos en el cuerpo. Afectan la actividad de las células y los tejidos en distintos lugares del cuerpo, y suelen llegar a su destino a través de la sangre.
Las hormonas estrógeno y progesterona se producen en los ovarios de las mujeres premenopáusicas (antes de la menopausia). Estas hormonas también se producen en otros tejidos, como la piel y los tejidos grasos de los hombres y de las mujeres premenopáusicas y posmenopáusicas (después de la menopausia). El estrógeno ayuda a formar y mantener las características sexuales femeninas y a que crezcan los huesos largos. La progesterona participa en el ciclo menstrual y el embarazo.
El estrógeno y la progesterona también estimulan algunos cánceres de mama (seno), que se llaman cánceres de mama sensibles a las hormonas (o dependientes de las hormonas). Las células del cáncer de mama sensibles a las hormonas tienen proteínas llamadas receptores hormonales que se activan cuando las hormonas se unen a estos. Hay dos tipos de receptores hormonales: receptores de estrógeno (ER) y receptores de progesterona (PR). Cuando se activan los receptores, cambia la expresión de genes específicos que estimulan la multiplicación de las células.
Para determinar si las células del cáncer de mama tienen receptores hormonales, los médicos analizan muestras de tejido tumoral que se extraen mediante cirugía. Si las células tumorales contienen receptores de estrógeno, es un cáncer positivo para el receptor de estrógeno (positivo para ER). También se describe como cáncer sensible al estrógeno o receptivo al estrógeno. De la misma manera, si las células tumorales tienen receptores de progesterona, es un cáncer positivo para el receptor de progesterona (positivo para PR o PgR). Cuando el cáncer tiene receptores de estrógeno o de progesterona (o ambos), se llama cáncer positivo para receptores hormonales (positivos para RH). La mayoría de los cánceres de mama positivos para el receptor de estrógeno son también cánceres de mama positivos para el receptor de progesterona.
Cuando el cáncer no presenta receptores de estrógeno, se llama cáncer negativo para el receptor de estrógeno (negativo para ER). Si no tiene ninguno de los receptores hormonales (ni el de estrógeno ni el de progesterona), se llama cáncer negativo para receptores hormonales.
Entre el 67 % y el 80 % de los cánceres de mama en las mujeres dan positivo para el receptor de estrógeno (1, 2). Alrededor de 90 % de los cánceres de mama en los hombres dan positivo para el receptor de estrógeno y alrededor de 80 % dan positivo para el receptor de progesterona (3).
¿Qué es la terapia hormonal?
La terapia hormonal también se llama terapia con hormonas, tratamiento con hormonas o terapia endocrina. La terapia hormonal disminuye o impide el crecimiento de los tumores que son sensibles a las hormonas: bloquea la producción de hormonas o interfiere con los efectos que tienen las hormonas en las células del cáncer de mama. Los tumores que no son sensibles a las hormonas no tienen receptores hormonales y no responden a la terapia hormonal.
No se debe confundir la terapia hormonal para el cáncer de mama con la terapia hormonal para la menopausia, que es un tratamiento con estrógeno solo, o en combinación con progesterona, para aliviar los síntomas de la menopausia. Estos dos tipos de terapia producen efectos contrarios: la terapia hormonal para el cáncer de mama impide la multiplicación del cáncer de mama positivo para el receptor hormonal, mientras que la terapia hormonal para la menopausia estimula la formación del cáncer de mama positivo para el receptor hormonal. Por este motivo, cuando una mujer recibe terapia hormonal para la menopausia y recibe un diagnóstico de cáncer de mama positivo para el receptor hormonal, se suele interrumpir el tratamiento para la menopausia.
¿Qué tipos de terapia hormonal se usan para el cáncer de mama?
Se usan varios enfoques para tratar el cáncer de mama sensible a las hormonas:
Bloqueo del funcionamiento de los ovarios: como los ovarios son la fuente principal de estrógeno en las mujeres premenopáusicas, es posible disminuir la concentración de estrógeno al eliminar los ovarios o limitar el funcionamiento de estos. El bloqueo del funcionamiento de los ovarios se llama ablación ovárica.
Para la ablación ovárica, a veces se extirpan los ovarios en una operación llamada ooforectomía o se tratan con radioterapia. Por lo general, este tipo de ablación ovárica es permanente.
Otra opción es inhibir el funcionamiento de los ovarios por un tiempo con medicamentos que se llaman agonistas de la hormona liberadora de gonadotropina (HLGn). Estos también se llaman agonistas de la hormona liberadora de hormona luteinizante (LHRH).
Los medicamentos agonistas imitan a la HLGn e interfieren con las señales que estimulan los ovarios para que produzcan estrógeno.
Por ejemplo, dos medicamentos para la supresión ovárica son la goserelina (Zoladex) y la leuprolida (Lupron).
Bloqueo de la producción de estrógeno: los inhibidores de la aromatasa son medicamentos que se usan para impedir que actúe la enzima (aromatasa), que el cuerpo usa para producir estrógeno en los ovarios y en otros tejidos. Los inhibidores de la aromatasa se usan sobre todo en las mujeres posmenopáusicas porque durante la premenopausia los ovarios producen demasiada aromatasa y los inhibidores no son eficaces. No obstante, es posible usar estos medicamentos en las mujeres premenopáusicas si se administran con otro medicamento que suprime el funcionamiento de los ovarios.
Algunos ejemplos de inhibidores de la aromatasa que la FDA aprobó son el anastrozol (Arimidex) y el letrozol (Femara), que inactivan la aromatasa de forma temporal; y el exemestano (Aromasin), que inactiva la aromatasa de forma permanente.
Efectos del bloqueo de estrógeno: varios tipos de medicamentos interfieren con la función del estrógeno de estimular el crecimiento de las células del cáncer de mama:
- Los moduladores selectivos del receptor de estrógeno (MSRE) se unen a los receptores de estrógeno e impiden que el estrógeno se una. Algunos ejemplos de MSRE que la FDA aprobó para el tratamiento del cáncer de mama son el tamoxifeno (Nolvadex) y el toremifeno (Fareston).
Como se unen a los receptores de estrógeno, los MSRE no solo bloquean la actividad del estrógeno porque impiden que esta hormona se una al receptor de estrógeno, sino que también imitan los efectos del estrógeno, según dónde estén en el cuerpo. Por ejemplo, el tamoxifeno bloquea los efectos del estrógeno en el tejido de la mama, pero actúa como si fuera estrógeno en el útero y el hueso.
- Otros antiestrógenos, como el fulvestrant (Faslodex), funcionan de una manera un poco diferente para bloquear los efectos del estrógeno. Al igual que los MSRE, el fulvestrant se une al receptor de estrógeno y funciona como bloqueador de estrógeno. A diferencia de los MSRE, el fulvestrant no imita el estrógeno. Por esta razón se llama antiestrógeno puro. Además, cuando el fulvestrant se une al receptor de estrógeno, el receptor queda marcado para su destrucción.
¿Cómo se usa la terapia hormonal para tratar el cáncer de mama?
Estas son tres formas en que se usa la terapia hormonal para tratar el cáncer de mama sensible a las hormonas:
Terapia adyuvante para el cáncer de mama en estadio temprano: la FDA aprobó el tamoxifeno para la terapia hormonal adyuvante en las mujeres premenopáusicas y posmenopáusicas, y para los hombres con cáncer de mama en estadio temprano positivo para ER. Los inhibidores de la aromatasa anastrozol, letrozol y exemestano también se aprobaron para su uso en mujeres posmenopáusicas.
En las investigaciones se observó que las mujeres que recibieron al menos 5 años de terapia adyuvante con tamoxifeno después de una cirugía de cáncer de mama positivo para ER en estadio temprano, tienen una disminución del riesgo de recidiva del cáncer de mama, incluso de un nuevo cáncer de mama en la otra mama, y disminución del riesgo de muerte después de 15 años (4).
Hasta hace poco, la mayoría de las mujeres que recibieron terapia hormonal adyuvante para disminuir la posibilidad de recidiva de cáncer de mama, tomaban tamoxifeno todos los días durante 5 años. Sin embargo, con la introducción de nuevas terapias hormonales (como los inhibidores de la aromatasa), algunas de las cuales se compararon con el tamoxifeno en estudios clínicos, ahora son más comunes otras formas de terapias hormonales (5–7).
Por ejemplo, en lugar de tamoxifeno, algunas mujeres toman un inhibidor de la aromatasa todos los días durante 5 años. Otras mujeres tal vez reciban un tratamiento adicional con un inhibidor de la aromatasa después de 5 años de tratamiento con tamoxifeno. Por último, hay mujeres que cambian su tratamiento a un inhibidor de la aromatasa después de 2 o 3 años de tratamiento con tamoxifeno, y así completan 5 o más años de terapia hormonal. En las investigaciones se indicó que en las mujeres posmenopáusicas que recibieron tratamiento del cáncer de mama en estadio temprano, la terapia adyuvante con un inhibidor de la aromatasa disminuyó el riesgo de recidiva y mejoró la supervivencia general, en comparación con el tamoxifeno adyuvante (8).
Algunas mujeres premenopáusicas con cáncer de mama positivo para el receptor de estrógeno en estadio temprano reciben tratamiento de supresión ovárica y un inhibidor de la aromatasa. Se halló que con esta combinación se disminuye la tasa de recidiva, en comparación con el tratamiento de supresión ovárica y tamoxifeno o el tratamiento con tamoxifeno solo (9).
Los hombres con cáncer de mama positivo para ER en estadio temprano que reciben terapia adyuvante, en general, reciben primero el tratamiento con tamoxifeno. Quienes reciben tratamiento con un inhibidor de la aromatasa suelen recibir también un agonista de la hormona liberadora de gonadotropina (HLGn).
Las decisiones sobre el tipo y la duración de la terapia hormonal adyuvante son difíciles y el paciente debe consultar con un oncólogo.
Tratamiento de cáncer de mama avanzado o metastásico: se aprobaron varios tipos de terapia hormonal para tratar el cáncer de mama metastásico o recidivante que es sensible a las hormonas. La terapia hormonal es también una opción de tratamiento cuando el cáncer de mama positivo para el receptor de estrógeno vuelve después del tratamiento, ya sea en la mama, la pared torácica o cerca de los ganglios linfáticos. Esto se conoce como recidiva locorregional.
Se aprobaron dos moduladores selectivos del receptor de estrógeno (MSRE), el tamoxifeno y el toremifeno, para tratar el cáncer de mama metastásico. El antiestrógeno fulvestrant se aprobó para uso en las mujeres posmenopáusicas que tienen cáncer de mama positivo para el receptor de estrógeno que es metastásico y que se diseminó después del tratamiento con otros antiestrógenos (10). Fulvestrant también se aprobó para uso en las mujeres posmenopáusicas, que no recibieron terapia hormonal antes y que tienen cáncer de mama metastásico o localmente avanzado, positivo para receptores hormonales y negativo para el receptor 2 del factor de crecimiento epidérmico humano (HER2) (11). Además, se puede usar en mujeres premenopáusicas después de una ablación ovárica.
Se aprobó el uso de los inhibidores de la aromatasa anastrozol y letrozol como terapia inicial para tratar a mujeres posmenopáusicas con cáncer de mama sensible a las hormonas, localmente avanzado o metastásico (12, 13). Estos dos medicamentos y el inhibidor de la aromatasa exemestano también se aprobaron para tratar a mujeres posmenopáusicas con cáncer de mama avanzado cuya enfermedad empeoró después del tratamiento con tamoxifeno (14). Los hombres con cáncer de mama avanzado que reciben tratamiento con un inhibidor de la aromatasa, también reciben un agonista de la HLGn.
Algunas mujeres con cáncer de mama avanzado reciben tratamiento con una combinación de terapia hormonal y alguna de las múltiples terapias dirigidas disponibles:
- El palbociclib (Ibrance) se aprobó para su uso en combinación con letrozol como terapia inicial en mujeres posmenopáusicas con cáncer de mama metastásico o avanzado que es positivo para el receptor hormonal y negativo para HER2. El palbociclib inhibe dos cinasas dependientes de ciclina (CDK4 y CDK6) que parecen facilitar la multiplicación de las células del cáncer de mama positivo para el receptor hormonal (15).
También se aprobó el palbociclib para su uso en combinación con el fulvestrant para tratar a mujeres posmenopáusicas con cáncer de mama metastásico o avanzado, positivo para el receptor hormonal y negativo para HER2, cuyo cáncer empeoró después del tratamiento con otra terapia hormonal (16).
- El abemaciclib (Verzenio), otro inhibidor de CDK4 y CDK6, se aprobó también para su uso en combinación con el fulvestrant en mujeres posmenopáusicas con cáncer de mama metastásico o avanzado que es positivo para el receptor hormonal y negativo para HER2, cuya enfermedad avanzó después del tratamiento con terapia hormonal (17).
También se aprobó el abemaciclib para su uso como medicamento único en mujeres y hombres con cáncer de mama metastásico o avanzado que es positivo para el receptor hormonal y negativo para HER2, cuya enfermedad empeoró después de la terapia hormonal y de la quimioterapia administrada antes para la enfermedad metastásica (18).
Igualmente se aprobó el abemaciclib para uso con un inhibidor de la aromatasa como terapia hormonal de primera línea en mujeres posmenopáusicas con cáncer de mama metastásico o avanzado que es positivo para el receptor hormonal y negativo para HER2.
- El ribociclib (Kisqali), otro inhibidor de CDK4 y CDK6, se aprobó para su uso en combinación con el fulvestrant en mujeres posmenopáusicas con cáncer de mama metastásico o avanzado que es positivo para el receptor hormonal y negativo para HER2, y que no se trató antes con terapia hormonal (19, 20).
También se aprobó el ribociclib para su uso en combinación con el fulvestrant en mujeres posmenopáusicas con cáncer de mama metastásico o avanzado que es positivo para el receptor hormonal y negativo para HER2, que no se trató antes con terapia hormonal o cuya enfermedad empeoró durante la terapia hormonal (21).
- El lapatinib (Tykerb) se aprobó para su uso en combinación con el letrozol en mujeres posmenopáusicas para tratar el cáncer de mama metastásico que es positivo para el receptor hormonal y positivo para HER2, a quienes se les indica terapia hormonal. Este medicamento es un inhibidor de las tirosinas cinasas micromoleculares HER2 y del receptor del factor de crecimiento epidérmico (EGFR).
- El alpelisib (Piqray) se aprobó para tratar el cáncer de mama positivo para el receptor hormonal, negativo para HER2 y con una mutación en el gen PIK3CA. Se usa con el fulvestrant para tratar a mujeres posmenopáusicas y a hombres con cáncer de mama avanzado o metastásico, cuya enfermedad empeoró durante o después del tratamiento con terapia hormonal (22).
- Algunas mujeres con cáncer de mama avanzado que es positivo para HER2 y para HR, a veces reciben terapia hormonal y trastuzumab con pertuzumab o sin este (23).
Tratamiento neoadyuvante para el cáncer de mama : se investigó en estudios clínicos el uso de la terapia hormonal para el tratamiento del cáncer de mama para achicar el tumor antes de la cirugía (terapia neoadyuvante) (24). En estos estudios, se observó que la terapia hormonal neoadyuvante, en particular con inhibidores de la aromatasa, es eficaz para disminuir el tamaño de los tumores de mama en mujeres posmenopáusicas, pero aún no está claro si es eficaz en mujeres premenopáusicas.
La terapia hormonal a veces se usa para el tratamiento neoadyuvante del cáncer de mama positivo para el receptor hormonal en mujeres posmenopáusicas que no pueden recibir quimioterapia, o cuando se debe posponer la cirugía.
¿Se puede usar la terapia hormonal para prevenir el cáncer de mama?
Sí. La mayoría de los cánceres de mama son positivos para el receptor de estrógeno. Por este motivo, en los estudios clínicos se investiga si la terapia hormonal sirve para prevenir el cáncer de mama en mujeres con un mayor riesgo de tener la enfermedad.
En un estudio clínico aleatorizado grande patrocinado por el NCI, llamado Estudio de Prevención del Cáncer de Mama (BCPT), se halló que cuando el tamoxifeno se administra durante 5 años, es posible disminuir en casi el 50 % el riesgo de cáncer de mama invasivo en mujeres posmenopáusicas que corren más riesgo de tener la enfermedad (25). En el seguimiento a largo plazo de otro estudio aleatorizado, el Estudio Internacional de Intervención contra el Cáncer de Mama I (IBIS-I), se indicó que es posible disminuir la incidencia del cáncer de mama en por lo menos 20 años mediante 5 años de tratamiento con tamoxifeno (26). En un estudio aleatorizado grande posterior, el Estudio del Tamoxifeno y del Raloxifeno (STAR), que también patrocinó el NCI, se halló que el tratamiento con raloxifeno (un MSRE) por 5 años disminuyó el riesgo de cáncer de mama en las mujeres del estudio en casi un 38 % (27).
Debido al resultado de estos estudios, la FDA aprobó el tamoxifeno y el raloxifeno para disminuir el riesgo de cáncer de mama en mujeres con riesgo alto de la enfermedad. El tamoxifeno se aprobó para su uso en mujeres antes y después de la menopausia. El raloxifeno se aprobó para su uso solo en mujeres posmenopáusicas.
Se halló que dos inhibidores de la aromatasa, el exemestano y el anastrozol, también disminuyen el riesgo de cáncer de mama en las mujeres posmenopáusicas con riesgo alto de la enfermedad. Después de 3 años de seguimiento en un estudio aleatorizado, fue un 65 % menos probable que las mujeres que recibieron exemestano tuvieran cáncer de mama que las que tomaron un placebo (28). Después de 7 años de seguimiento en un estudio aleatorizado, fue un 50 % menos probable que las mujeres que recibieron exemestano tuvieran cáncer de mama que las que tomaron un placebo (29). La FDA aprobó el exemestano y el anastrozol para el tratamiento de mujeres con cáncer de mama positivo para el receptor de estrógeno. Aunque ambos medicamentos se usan también para la prevención del cáncer de mama, ninguno recibió la aprobación para esa indicación.
¿Cuáles son los efectos secundarios de la terapia hormonal?
Los efectos secundarios de la terapia hormonal dependen sobre todo del medicamento específico o del tipo de tratamiento (7). Los beneficios y daños de la terapia hormonal para las personas se deben evaluar con cuidado en cada caso. Quizás sea posible lograr un equilibrio entre los beneficios y los daños de estos dos tipos de terapia hormonal si se usa una estrategia que cambie el medicamento como se hace en la terapia adyuvante. En esos casos, los pacientes toman tamoxifeno por 2 o 3 años, y luego un inhibidor de la aromatasa por 2 o 3 años (30).
Los sofocos, los sudores nocturnos y la sequedad vaginal son efectos secundarios comunes de todas las terapias hormonales. La terapia hormonal también altera el ciclo menstrual en las mujeres premenopáusicas.
Los efectos secundarios menos comunes pero graves de los medicamentos de la terapia hormonal se mencionan a continuación.
Tamoxifeno
- Riesgo de coágulos sanguíneos, en especial, en los pulmones y las piernas
- Accidentes cerebrovasculares
- Cataratas
- Cáncer de endometrio y sarcoma uterino
- Disminución de la masa ósea en las mujeres premenopáusicas, pero sin aumento del riesgo de fracturas
- Cambios del estado de ánimo, depresión y disminución de la libido (deseo sexual)
- En los hombres: dolores de cabeza, náuseas, vómitos, erupción cutánea, impotencia y disminución de la libido
Raloxifeno
- Riesgo de coágulos sanguíneos, en especial, en los pulmones y las piernas
- Accidentes cerebrovasculares en ciertos subgrupos
Supresión ovárica
- Disminución de la masa ósea
- Cambios del estado de ánimo, depresión y disminución de la libido
Inhibidores de la aromatasa
- Riesgo de ataque al corazón, angina de pecho, insuficiencia cardíaca e hipercolesterolemia
- Disminución de la masa ósea
- Dolor en las articulaciones
- Cambios del estado de ánimo y depresión
Fulvestrant
- Síntomas gastrointestinales, como náuseas, vómitos y estreñimiento
- Debilidad y fatiga
- Dolor, como dolor osteomuscular (huesos y músculos) y dolor en las articulaciones, los huesos, la espalda y las extremidades
- Dolor de cabeza
- Sofocos
- Dificultades para respirar, como dolor al respirar, falta de aire y tos
- Pérdida del apetito
¿Hay medicamentos que interfieren con la terapia hormonal?
Algunos medicamentos inhiben la enzima CYP2D6, como varios antidepresivos que se recetan con frecuencia y se llaman inhibidores selectivos de la recaptación de serotonina (ISRS). Esta enzima cumple una función esencial ya que ayuda al cuerpo a metabolizar (descomponer en metabolitos) el tamoxifeno, que son mucho más activos que el propio tamoxifeno.
La posibilidad de que, al inhibir la enzima CYP2D6, los ISRS disminuyan el metabolismo del tamoxifeno y disminuyan su eficacia es un problema porque un cuarto de los pacientes con cáncer de mama tienen depresión clínica y reciben tratamiento con ISRS. Además, los ISRS a veces se usan para tratar los sofocos que produce la terapia hormonal.
Muchos expertos recomiendan que los pacientes que toman antidepresivos junto con el tamoxifeno hablen sobre las opciones de tratamiento con su médico. Una de las opciones puede ser cambiar de un ISRS, que es un inhibidor potente de la enzima CYP2D6, como el clorhidrato de paroxetina (Paxil), a otro que es un inhibidor más débil, como la sertralina (Zoloft) o el citalopram (Celexa), o a un antidepresivo que no tenga ningún inhibidor, como la venlafaxina (Effexor) (31). Incluso, los médicos podrían sugerir a las pacientes posmenopáusicas que tomen un inhibidor de la aromatasa en lugar de tamoxifeno.
Estos son otros ejemplos de medicamentos que inhiben la enzima CYP2D6:
- Quinidina, que se usa para el tratamiento de ritmos cardíacos anormales
- Difenhidramina, que es un antihistamínico
- Cimetidina, que se usa para disminuir el ácido estomacal
Las personas a las que se les receta el tamoxifeno deben hablar con su médico sobre el uso de cualquier otro medicamento.