Tratamiento del cáncer de páncreas (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer de páncreas
Este resumen proporciona información sobre el tratamiento del cáncer de páncreas exocrino.
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por cáncer de páncreas en los Estados Unidos para 2025:[1]
- Casos nuevos: 67 440.
- Defunciones: 51 980.
La incidencia del cáncer de páncreas ha tenido un incremento significativo durante las últimas décadas. En los Estados Unidos, este cáncer es la cuarta causa principal de muerte por cáncer en los hombres y la tercera en las mujeres.[1] A pesar de las altas tasas de mortalidad relacionadas con el cáncer de páncreas, no se comprenden bien sus características etiológicas.
Factores de riesgo
Los factores de riesgo del cáncer de páncreas son los siguientes:[2,3]
- Antecedentes familiares de cáncer de páncreas.
- Hábito de fumar cigarrillos.
- Obesidad.
- Pancreatitis crónica.
- Ciertos trastornos genéticos (por ejemplo, los relacionados con los genes BRCA1, BRCA2, PALB2 y ATM).
Características anatómicas
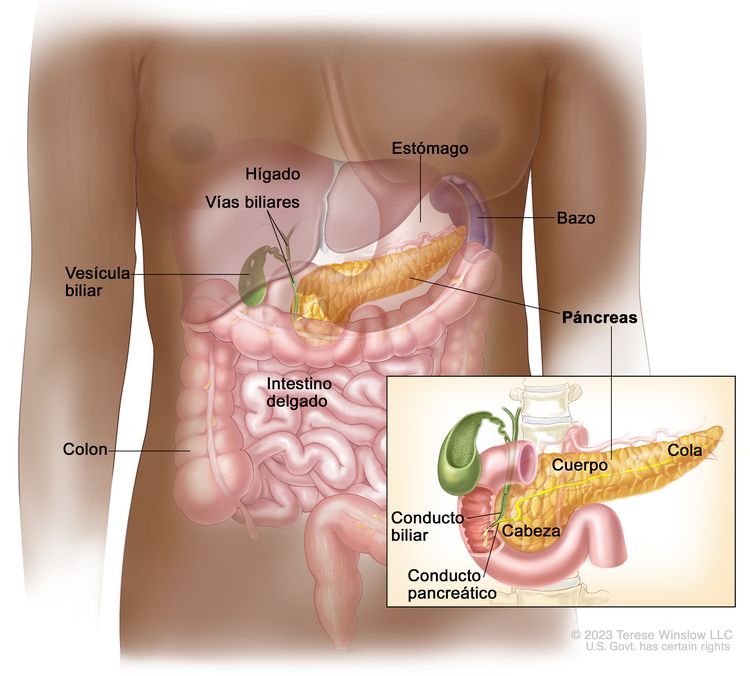
Por lo general, los cánceres de páncreas se identifican según el sitio comprometido en el órgano. Los abordajes quirúrgicos difieren según se encuentren masas en la cabeza, el cuerpo, la cola o el gancho del páncreas.
Características clínicas
Los síntomas del cáncer de páncreas dependen del sitio del tumor en el páncreas y del grado de compromiso tumoral.
En los estadios tempranos del cáncer de páncreas no hay muchos síntomas perceptibles. A medida que el cáncer crece, es posible que desencadene los siguientes síntomas:
- Ictericia.
- Materia fecal de color claro u orina de color oscuro.
- Dolor en el abdomen superior o medio, y en la espalda.
- Pérdida de peso sin razón conocida.
- Pérdida de apetito.
- Fatiga.
Evaluación diagnóstica y estadificación
El cáncer de páncreas es difícil de detectar y diagnosticar por las siguientes razones:
- No hay síntomas o signos perceptibles en los estadios tempranos del cáncer de páncreas.
- Los signos del cáncer de páncreas, cuando están presentes, se parecen a los de muchas otras enfermedades, como la pancreatitis o una úlcera.
- El páncreas está oculto por otros órganos del abdomen y es difícil de visualizar con claridad en las pruebas de imágenes.
Para tratar el cáncer de páncreas de forma adecuada, es primordial evaluar si el cáncer se puede resecar.
Imágenes
Las pruebas con imágenes en ocasiones ayudan a diagnosticar el cáncer de páncreas y a identificar a los pacientes con una enfermedad que no se puede resecar. Las siguientes son las pruebas de imágenes que se usan:[4]
Citología peritoneal
En una serie de casos de 228 pacientes, un resultado positivo en la prueba de citología peritoneal tuvo un valor pronóstico positivo de 94 %, especificidad de 98 % y sensibilidad de 25 % para determinar la irresecabilidad.[7]
Marcadores tumorales
No hay marcadores tumorales específicos para el cáncer de páncreas. Los marcadores como el antígeno de cáncer (CA) 19-9 sérico tienen especificidad baja. La mayoría de los pacientes con cáncer de páncreas tienen una concentración de CA 19-9 elevada en el momento del diagnóstico. El aumento de las concentraciones de CA 19-9 después del tratamiento definitivo, o durante el mismo, quizás permita identificar a los pacientes con crecimiento tumoral progresivo.[8][Nivel de evidencia C2] Sin embargo, la presencia de concentraciones de CA 19-9 normales no excluye una recidiva.
Pronóstico y supervivencia
Los siguientes son los factores primarios que influyen en el pronóstico:
- Si el tumor está localizado y se puede resecar por completo.
- Si el tumor se diseminó a los ganglios linfáticos u otros sitios.
El cáncer de páncreas exocrino casi nunca es curable y la tasa de supervivencia general (SG) es menor de 6 %.[9] El cáncer de páncreas se relaciona con una morbilidad y mortalidad importantes y las decisiones sobre el tratamiento son complejas. Se debe considerar que un equipo multidisciplinario integral se encargue del tratamiento.
La tasa de curación más alta se produce cuando el tumor está verdaderamente localizado en el páncreas; sin embargo, este estadio de la enfermedad se presenta en menos de 20 % de los casos. Para los pacientes con enfermedad localizada y tumores pequeños (<2 cm) sin metástasis en los ganglios linfáticos ni diseminación más allá de la cápsula del páncreas, la resección quirúrgica completa se relaciona con una tasa de supervivencia actuarial a 5 años de 18 a 24 %.[10][Nivel de evidencia C1]
La resección quirúrgica es la base del tratamiento curativo y proporciona un beneficio de supervivencia para los pacientes con tumores de páncreas pequeños y localizados, pero solo se debe considerar si se acompaña de terapia sistémica. Los pacientes de enfermedad irresecable, metastásica o recidivante tienen menores probabilidades de beneficiarse con una resección quirúrgica.
Los pacientes con cáncer de páncreas en cualquier estadio son aptos para participar en ensayos clínicos debido a la respuesta precaria a la quimioterapia, la radioterapia y la cirugía tal como se utilizan convencionalmente.
Para obtener más información sobre los ensayos clínicos en curso de cáncer de páncreas, consultar el portal de Internet del NCI.
Terapia paliativa
La paliación de los síntomas se puede lograr con un tratamiento convencional (quimioterapia sistémica).
Las siguientes son las intervenciones paliativas que mejoran la calidad de vida sin afectar la SG:[11,12]
- Descompresión biliar quirúrgica o radiológica.
- Alivio de la obstrucción de la salida gástrica.
- Control del dolor.
- Atención psicológica para hacer frente a las situaciones psicológicas potencialmente discapacitantes relacionadas con el diagnóstico y el tratamiento del cáncer de páncreas.[13]
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Tersmette AC, Petersen GM, Offerhaus GJ, et al.: Increased risk of incident pancreatic cancer among first-degree relatives of patients with familial pancreatic cancer. Clin Cancer Res 7 (3): 738-44, 2001. [PUBMED Abstract]
- Nöthlings U, Wilkens LR, Murphy SP, et al.: Meat and fat intake as risk factors for pancreatic cancer: the multiethnic cohort study. J Natl Cancer Inst 97 (19): 1458-65, 2005. [PUBMED Abstract]
- Riker A, Libutti SK, Bartlett DL: Advances in the early detection, diagnosis, and staging of pancreatic cancer. Surg Oncol 6 (3): 157-69, 1997. [PUBMED Abstract]
- John TG, Greig JD, Carter DC, et al.: Carcinoma of the pancreatic head and periampullary region. Tumor staging with laparoscopy and laparoscopic ultrasonography. Ann Surg 221 (2): 156-64, 1995. [PUBMED Abstract]
- Minnard EA, Conlon KC, Hoos A, et al.: Laparoscopic ultrasound enhances standard laparoscopy in the staging of pancreatic cancer. Ann Surg 228 (2): 182-7, 1998. [PUBMED Abstract]
- Merchant NB, Conlon KC, Saigo P, et al.: Positive peritoneal cytology predicts unresectability of pancreatic adenocarcinoma. J Am Coll Surg 188 (4): 421-6, 1999. [PUBMED Abstract]
- Willett CG, Daly WJ, Warshaw AL: CA 19-9 is an index of response to neoadjunctive chemoradiation therapy in pancreatic cancer. Am J Surg 172 (4): 350-2, 1996. [PUBMED Abstract]
- Siegel R, Naishadham D, Jemal A: Cancer statistics, 2013. CA Cancer J Clin 63 (1): 11-30, 2013. [PUBMED Abstract]
- Yeo CJ, Abrams RA, Grochow LB, et al.: Pancreaticoduodenectomy for pancreatic adenocarcinoma: postoperative adjuvant chemoradiation improves survival. A prospective, single-institution experience. Ann Surg 225 (5): 621-33; discussion 633-6, 1997. [PUBMED Abstract]
- Sohn TA, Lillemoe KD, Cameron JL, et al.: Surgical palliation of unresectable periampullary adenocarcinoma in the 1990s. J Am Coll Surg 188 (6): 658-66; discussion 666-9, 1999. [PUBMED Abstract]
- Baron TH: Expandable metal stents for the treatment of cancerous obstruction of the gastrointestinal tract. N Engl J Med 344 (22): 1681-7, 2001. [PUBMED Abstract]
- Passik SD, Breitbart WS: Depression in patients with pancreatic carcinoma. Diagnostic and treatment issues. Cancer 78 (3 Suppl): 615-26, 1996. [PUBMED Abstract]
Clasificación celular del cáncer de páncreas
El cáncer de páncreas incluye los siguientes carcinomas:
Malignos
- Carcinoma de células ductales (90 % de los casos).
- Carcinoma de células acinosas.
- Carcinoma adenoescamoso.
- Cistoadenocarcinoma (tipos seroso y mucinoso).
- Carcinoma de células gigantes.
- Adenocarcinoma invasivo relacionado con neoplasia quística mucinosa o neoplasia mucinosa papilar intraductal.
- Tipo mixto (ductal endocrino o acinar endocrino).
- Carcinoma mucinoso.
- Pancreatoblastoma.
- Neoplasia papilar quística (tumor de Frantz). Este tumor tiene un potencial maligno más bajo y a veces se cura con cirugía sola.[1,2]
- Carcinoma mucinoso papilar.
- Carcinoma de células en anillo de sello.
- Carcinoma de células pequeñas.
- Sin clasificación.
- Carcinoma indiferenciado.
Neoplasias malignas limítrofes
- Tumor mucinoso papilar intraductal con displasia.[3]
- Tumor quístico mucinoso con displasia.
- Tumor sólido pseudopapilar.
Bibliografía
- Sanchez JA, Newman KD, Eichelberger MR, et al.: The papillary-cystic neoplasm of the pancreas. An increasingly recognized clinicopathologic entity. Arch Surg 125 (11): 1502-5, 1990. [PUBMED Abstract]
- Warshaw AL, Compton CC, Lewandrowski K, et al.: Cystic tumors of the pancreas. New clinical, radiologic, and pathologic observations in 67 patients. Ann Surg 212 (4): 432-43; discussion 444-5, 1990. [PUBMED Abstract]
- Sohn TA, Yeo CJ, Cameron JL, et al.: Intraductal papillary mucinous neoplasms of the pancreas: an increasingly recognized clinicopathologic entity. Ann Surg 234 (3): 313-21; discussion 321-2, 2001. [PUBMED Abstract]
Información sobre los estadios del cáncer de páncreas
El sistema de estadificación del cáncer de páncreas exocrino continúa en evolución. La estadificación clínica se orienta según la resecabilidad, que está muy influida por el criterio quirúrgico. Las directrices de consenso sobre la resecabilidad quirúrgica (por ejemplo, de la National Comprehensive Cancer Network, el MD Anderson Cancer Center, la American Hepato-Pancreato-Biliary Association y la International Hepato-Pancreato-Biliary Association) se siguen perfeccionando, pero por lo habitual se estratifican de acuerdo a las siguientes características tumorales:
- Resecable: tumores sin compromiso vascular.
- Resecabilidad limítrofe: tumores con compromiso del sistema vascular, compromiso de estructuras locales u otros indicios de una resección R1 de riesgo alto.
- Localmente avanzado: tumores con invasión local (sobre todo compromiso vascular) que impide la intervención quirúrgica.
- Metastásico: cáncer que se ha diseminado a otros órganos más allá del tumor pancreático primario.
El American Joint Committee on Cancer (AJCC) designó los estadios mediante la clasificación TNM (tumor, ganglio linfático y metástasis).[1]
Agrupamiento por estadios y definiciones TNM del American Joint Committee on Cancer
| Estadio | TNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Exocrine Pancreas. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 337–47. | |||
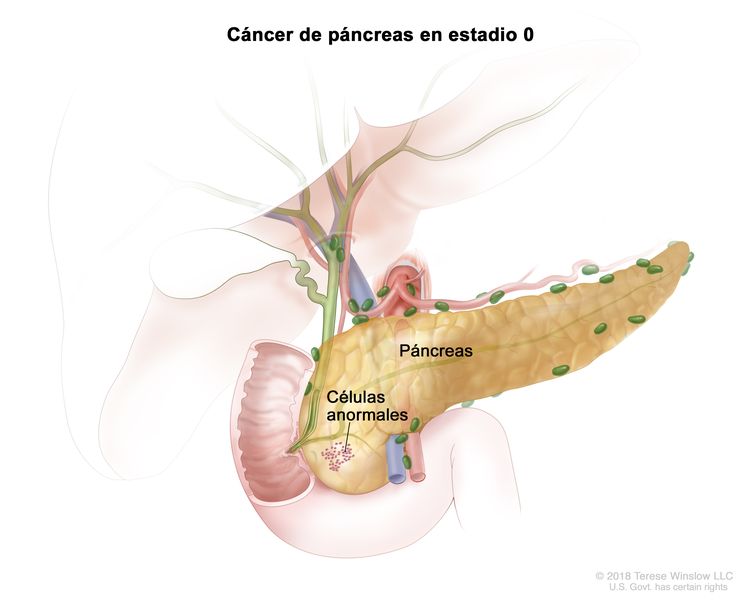
| 0 | Tis, N0, M0 | Tis = carcinoma in situ. Este incluye la neoplasia intraepitelial pancreática de grado alto (PanIn-3), la neoplasia mucinosa papilar intraductal con displasia de grado alto, la neoplasia intraductal tubulopapilar con displasia de grado alto y la neoplasia cística mucinosa con displasia de grado alto. |
 |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Exocrine Pancreas. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 337–47. | |||
| IA | T1, N0, M0 | T1 = tumor que mide ≤2 cm en su mayor dimensión. |
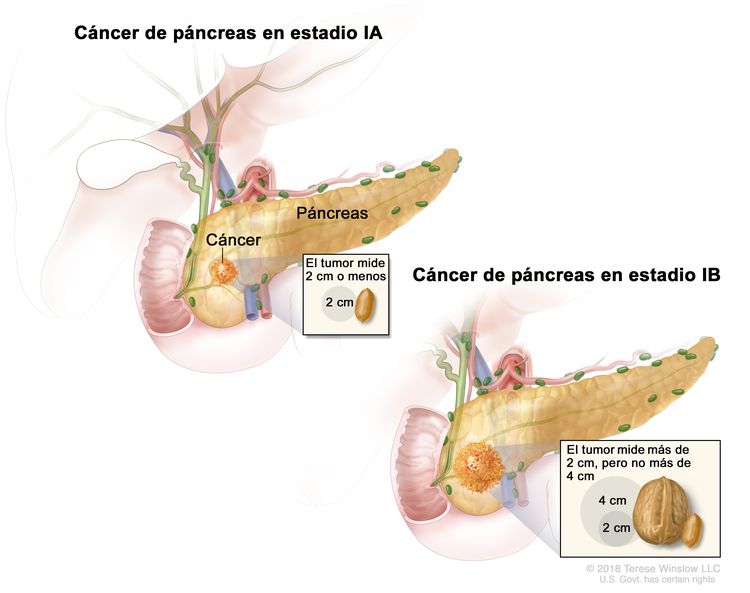 |
| –T1a = tumor que mide ≤0,5 cm en su mayor dimensión. | |||
| –T1b = tumor que mide >0,5, pero <1 cm en su mayor dimensión. | |||
| –T1c = tumor que mide 1–2 cm en su mayor dimensión. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| IB | T2, N0, M0 | T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión. | |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Exocrine Pancreas. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 337–47. | |||
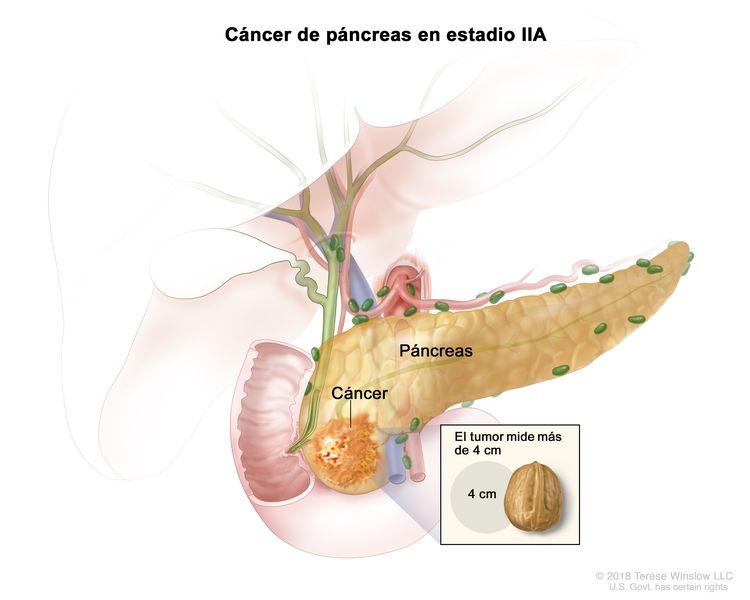
| IIA | T3, N0, M0 | T3 = tumor que mide >4 cm en su mayor dimensión. |
 |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
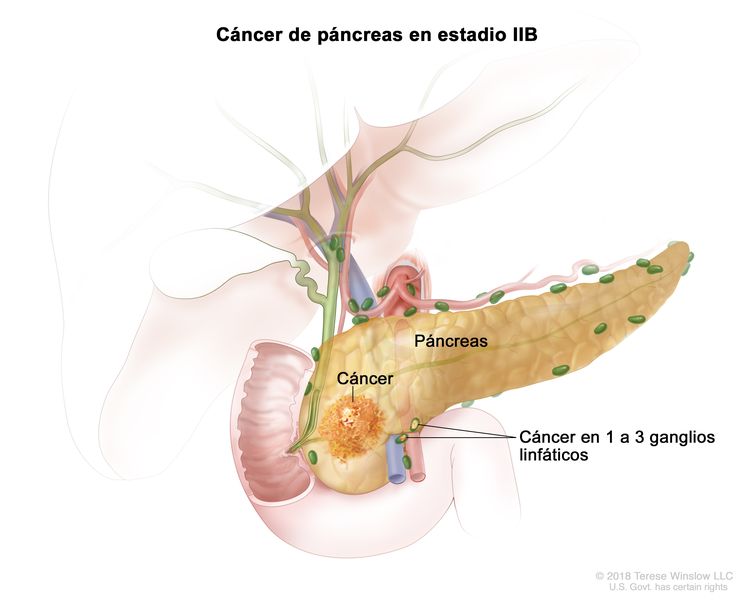
| IIB | T1, N1, M0 | T1 = tumor que mide ≤2 cm en su mayor dimensión. |
 |
| –T1a = tumor que mide ≤0,5 cm en su mayor dimensión. | |||
| –T1b = tumor que mide >0,5, pero <1 cm en su mayor dimensión. | |||
| –T1c = tumor que mide 1–2 cm en su mayor dimensión. | |||
| N1 = metástasis en 1 a 3 ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T2, N1, M0 | T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión. | ||
| N1 = metástasis en 1 a 3 ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T3, N1, M0 | T3 = tumor que mide que mide >4 cm en su mayor dimensión. | ||
| N1 = metástasis en 1 a 3 ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Exocrine Pancreas. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 337–47. | |||
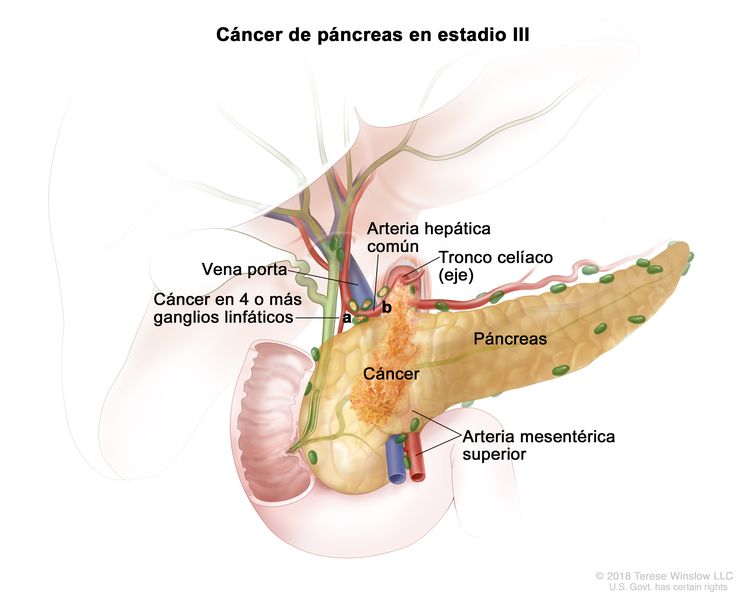
| III | T1, N2, M0 | T1 = tumor que mide ≤2 cm en su mayor dimensión. |
 |
| –T1a = tumor que mide ≤0,5 cm en su mayor dimensión. | |||
| –T1b = tumor que mide >0,5, pero <1 cm en su mayor dimensión. | |||
| –T1c = tumor que mide 1–2 cm en su mayor dimensión. | |||
| N2 = metástasis en 4 o más ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T2, N2, M0 | T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión. | ||
| N2 = metástasis en 4 o más ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T3, N2, M0 | T3 = tumor que mide >4 cm en su mayor dimensión. | ||
| N2 = metástasis en 4 o más ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T4, cualquier N, M0 | T4 = tumor que compromete el tronco celíaco, la arteria mesentérica superior o la arteria hepática común, sin importar su tamaño. | ||
| NX = ganglios linfáticos regionales no evaluables. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| N1 = metástasis en 1 a 3 ganglios linfáticos regionales. | |||
| N2 = metástasis en 4 o más ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Exocrine Pancreas. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 337–47. | |||
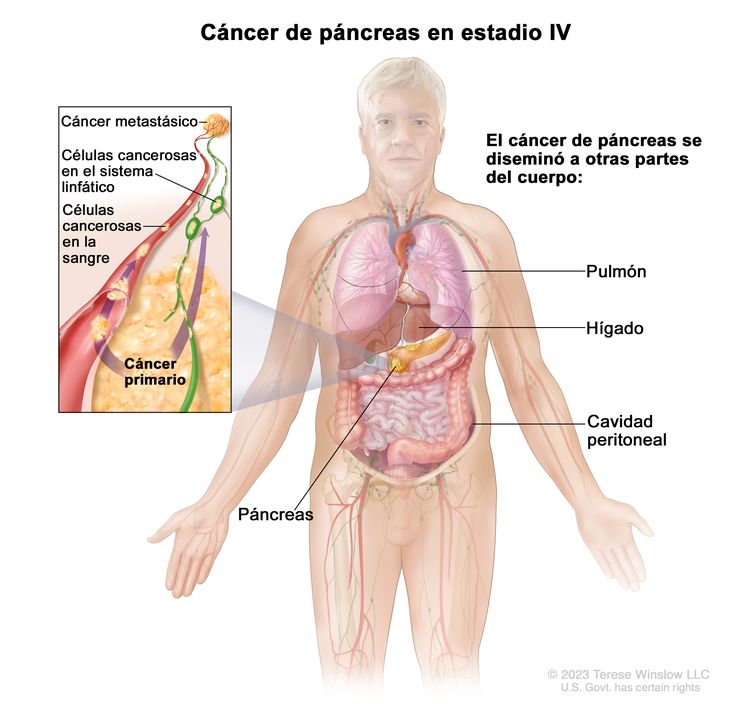
| IV | Cualquier T, cualquier N, M1 | TX = tumor primario no evaluable. |
 |
| T0 = sin indicios de tumor primario. | |||
| Tis = carcinoma in situ. Este incluye la neoplasia intraepitelial pancreática de grado alto (PanIn-3), la neoplasia mucinosa papilar intraductal con displasia de grado alto, la neoplasia intraductal tubulopapilar con displasia de grado alto y la neoplasia cística mucinosa con displasia de grado alto. | |||
| T1 = tumor que mide ≤2 cm en su mayor dimensión. | |||
| –T1a = tumor que mide ≤0,5 cm en su mayor dimensión. | |||
| –T1b = tumor que mide >0,5, pero <1 cm en su mayor dimensión. | |||
| –T1c = tumor que mide 1–2 cm en su mayor dimensión. | |||
| T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión. | |||
| T3 = tumor que mide >4 cm en su mayor dimensión. | |||
| T4 = tumor que compromete el tronco celíaco, la arteria mesentérica superior o la arteria hepática común, sin importar su tamaño. | |||
| NX = ganglios linfáticos regionales no evaluables. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| N1 = metástasis en 1 a 3 ganglios linfáticos regionales. | |||
| N2 = metástasis en 4 o más ganglios linfáticos regionales. | |||
| M1 = metástasis a distancia. | |||
Bibliografía
- Kakar S, Pawlik TM, Allen PJ: Exocrine Pancreas. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 337–47.
Aspectos generales de las opciones de tratamiento del cáncer de páncreas
La resección quirúrgica continúa siendo la modalidad de tratamiento principal para pacientes con cáncer de páncreas, siempre que sea factible. En algunas ocasiones, la resección lleva a la supervivencia a largo plazo y ofrece una paliación eficaz.[1-3][Nivel de evidencia C1] A menudo el tratamiento se orienta según la resecabilidad, pero a veces varía según el criterio quirúrgico y la experiencia. Se debe considerar la derivación a un centro con un número alto de casos.[4]
La quimioterapia posoperatoria mejora la supervivencia general, pero la función de la quimiorradioterapia continúa siendo polémica.
Las complicaciones del cáncer de páncreas son las siguientes:
- Malabsorción: con frecuencia, la malabsorción causada por insuficiencia exocrina contribuye a la desnutrición. La restitución de las enzimas pancreáticas puede ayudar a aliviar este problema.
- Dolor: los bloqueos en los nervios del tronco celíaco y en los nervios intrapleurales pueden ofrecer un control analgésico muy eficaz y a largo plazo para algunos pacientes. Para obtener más información, consultar El dolor y el cáncer.
La tasa de supervivencia de los pacientes con cáncer de páncreas exocrino en cualquier estadio es precaria. La participación en ensayos clínicos es conveniente para el tratamiento de pacientes con cualquier estadio de la enfermedad y se debe tener en cuenta antes de escoger abordajes paliativos.
La información sobre ensayos clínicos en curso para el cáncer de páncreas está disponible en el portal de Internet del NCI.
| Estadio clínico | Opciones de tratamiento |
|---|---|
| Cáncer de páncreas resecable o de resecabilidad limítrofe | Terapia neoadyuvante |
| Cirugía | |
| Quimioterapia posoperatoria | |
| Quimiorradioterapia posoperatoria | |
| Quimioterapia preoperatoria o radioterapia (en evaluación clínica) | |
| Técnicas de radiación alternativas (en evaluación clínica) | |
| Cáncer de páncreas localmente avanzado | Quimioterapia con terapia dirigida o sin esta |
| Quimiorradioterapia | |
| Cirugía | |
| Cirugía paliativa | |
| Participación en ensayos clínicos en los que se evalúan fármacos nuevos en combinación con quimioterapia o quimiorradioterapia, para los pacientes con tumores irresecables | |
| Radioterapia intraoperatoria o implante de fuentes de radiactividad (en evaluación clínica) | |
| Cáncer de páncreas metastásico o recidivante | Quimioterapia con terapia dirigida o sin esta |
| Participación en ensayos clínicos en los que se evalúan fármacos nuevos solos o en combinación con quimioterapia |
Es posible considerar terapias paliativas para los pacientes en cualquier estadio de la enfermedad. Para obtener más información, consultar la sección Terapia paliativa.
Administración de capecitabina y fluorouracilo
El gen DPYD codifica la enzima que cataboliza las pirimidinas y las fluoropirimidinas, como la capecitabina y el fluorouracilo. Se estima que entre el 1 % y el 2 % de la población tiene variantes defectuosas de DPYD que reducen la función de la proteína DPD y la acumulación de pirimidinas y fluoropirimidinas en el cuerpo.[5,6] Los pacientes con la variante DPYD*2A que reciben fluoropirimidinas quizás presenten efectos tóxicos graves que ponen en riesgo la salud, y a veces son mortales. Se han identificado muchas otras variantes de DPYD, con diferentes efectos clínicos.[5-7] Es posible que se recomiende evitar la fluoropirimidina o reducir la dosis al 50 % según el genotipo DPYD del paciente y el número de alelos funcionales de DPYD.[8-10] Las pruebas genéticas para DPYD cuestan menos de $200, pero la cobertura del seguro varía debido a la falta de directrices nacionales.[11] Además, es posible que las pruebas retrasen el tratamiento por 2 semanas, lo que no sería aconsejable en casos de urgencia. Este tema es objeto de controversia y requiere evaluación adicional.[12]
Bibliografía
- Yeo CJ, Cameron JL, Lillemoe KD, et al.: Pancreaticoduodenectomy for cancer of the head of the pancreas. 201 patients. Ann Surg 221 (6): 721-31; discussion 731-3, 1995. [PUBMED Abstract]
- Conlon KC, Klimstra DS, Brennan MF: Long-term survival after curative resection for pancreatic ductal adenocarcinoma. Clinicopathologic analysis of 5-year survivors. Ann Surg 223 (3): 273-9, 1996. [PUBMED Abstract]
- Yeo CJ, Abrams RA, Grochow LB, et al.: Pancreaticoduodenectomy for pancreatic adenocarcinoma: postoperative adjuvant chemoradiation improves survival. A prospective, single-institution experience. Ann Surg 225 (5): 621-33; discussion 633-6, 1997. [PUBMED Abstract]
- Lidsky ME, Sun Z, Nussbaum DP, et al.: Going the Extra Mile: Improved Survival for Pancreatic Cancer Patients Traveling to High-volume Centers. Ann Surg 266 (2): 333-338, 2017. [PUBMED Abstract]
- Sharma BB, Rai K, Blunt H, et al.: Pathogenic DPYD Variants and Treatment-Related Mortality in Patients Receiving Fluoropyrimidine Chemotherapy: A Systematic Review and Meta-Analysis. Oncologist 26 (12): 1008-1016, 2021. [PUBMED Abstract]
- Lam SW, Guchelaar HJ, Boven E: The role of pharmacogenetics in capecitabine efficacy and toxicity. Cancer Treat Rev 50: 9-22, 2016. [PUBMED Abstract]
- Shakeel F, Fang F, Kwon JW, et al.: Patients carrying DPYD variant alleles have increased risk of severe toxicity and related treatment modifications during fluoropyrimidine chemotherapy. Pharmacogenomics 22 (3): 145-155, 2021. [PUBMED Abstract]
- Amstutz U, Henricks LM, Offer SM, et al.: Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing: 2017 Update. Clin Pharmacol Ther 103 (2): 210-216, 2018. [PUBMED Abstract]
- Henricks LM, Lunenburg CATC, de Man FM, et al.: DPYD genotype-guided dose individualisation of fluoropyrimidine therapy in patients with cancer: a prospective safety analysis. Lancet Oncol 19 (11): 1459-1467, 2018. [PUBMED Abstract]
- Lau-Min KS, Varughese LA, Nelson MN, et al.: Preemptive pharmacogenetic testing to guide chemotherapy dosing in patients with gastrointestinal malignancies: a qualitative study of barriers to implementation. BMC Cancer 22 (1): 47, 2022. [PUBMED Abstract]
- Brooks GA, Tapp S, Daly AT, et al.: Cost-effectiveness of DPYD Genotyping Prior to Fluoropyrimidine-based Adjuvant Chemotherapy for Colon Cancer. Clin Colorectal Cancer 21 (3): e189-e195, 2022. [PUBMED Abstract]
- Baker SD, Bates SE, Brooks GA, et al.: DPYD Testing: Time to Put Patient Safety First. J Clin Oncol 41 (15): 2701-2705, 2023. [PUBMED Abstract]
Tratamiento del cáncer de páncreas resecable o de resecabilidad limítrofe
Opciones de tratamiento para el cáncer de páncreas resecable o de resecabilidad limítrofe
Las siguientes son las opciones de tratamiento para el cáncer de páncreas resecable o de resecabilidad limítrofe:
- Terapia neoadyuvante: quimioterapia neoadyuvante con quimiorradioterapia o sin esta.
- Cirugía: resección radical del páncreas que incluye:
- Quimioterapia posoperatoria: resección radical del páncreas seguida de quimioterapia.[3]
- Quimiorradioterapia posoperatoria: resección radical del páncreas seguida de quimioterapia con fluorouracilo (5-FU), y radioterapia.[4-8]
- Quimioterapia preoperatoria o radioterapia (en evaluación clínica).
- Técnicas de radiación alternativas (en evaluación clínica).
Es posible considerar las terapias paliativas para los pacientes en cualquier estadio de la enfermedad. Para obtener más información, consultar la sección Terapia paliativa.
Terapia neoadyuvante
La terapia neoadyuvante es quimioterapia con quimiorradioterapia o sin esta, que se administra antes de la cirugía. La función de la terapia neoadyuvante se ha evaluado en estudios retrospectivos (base de datos del Surveillance, Epidemiology, and End Results [SEER] Program y la National Cancer Database) y se recomienda en múltiples directrices de consenso para el tratamiento de pacientes con cáncer de páncreas de resecabilidad limítrofe. En varios ensayos en curso, se está evaluando en pacientes con cáncer de páncreas resecable o de resecabilidad limítrofe.[9-11]
Evidencia (quimioterapia neoadyuvante con quimiorradioterapia o sin esta):
- En el ensayo de fase II, multicéntrico, aleatorizado A021501 (NCT02839343) se incluyó a 126 pacientes con cáncer de páncreas de resecabilidad limítrofe atendidos en instituciones incluidas en los grupos cooperativos de la National Clinical Trials Network entre 2017 y 2019. Los pacientes se asignaron a recibir 8 ciclos de 2 semanas de FOLFIRINOX modificado (oxaliplatino, leucovorina, irinotecán y 5-FU) (n = 65), o 7 ciclos de 2 semanas de FOLFIRINOX modificado seguido de radioterapia corporal estereotáctica (33 Gy–40 Gy en 5 fracciones) o radioterapia hipofraccionada guiada por imágenes (25 Gy en 5 fracciones) (n = 55). Después, los pacientes sin progresión de la enfermedad se sometieron a cirugía seguida de 4 ciclos de 2 semanas de FOLFOX6 adyuvante (oxaliplatino, leucovorina y 5-FU).[12]
- En el grupo de quimioterapia neoadyuvante sola, la mediana de supervivencia general (SG) fue de 29,8 meses (intervalo de confianza 95 % [IC], 21,1–36,6), con una tasa de resección con márgenes microscópicos negativos (R0) del 43 %. Esto se comparó con los controles históricos estimados de la mediana de SG a 18 meses.[12][Nivel de evidencia C3]
- Se presentaron efectos adversos de grado 3 o superior relacionados con el tratamiento en el 57 % de los pacientes que recibieron quimioterapia neoadyuvante sola.
- El grupo de quimioterapia neoadyuvante con radioterapia se suspendió al hacerse el análisis interino de futilidad, debido a tasas bajas de resección R0 (33 %) en los primeros 30 pacientes incluidos.
- El ensayo multicéntrico de fase III PREOPANC incluyó a 246 pacientes con diagnóstico de cáncer de páncreas resecable o de resecabilidad limítrofe entre 2013 y 2017. Pacientes de 16 centros holandeses se asignaron al azar para someterse a laparoscopia diagnóstica, quimiorradioterapia neoadyuvante, resección quirúrgica y 4 ciclos de gemcitabina adyuvante o cirugía inicial con 6 ciclos de gemcitabina neoadyuvante. La quimiorradioterapia neoadyuvante incluyó lo siguiente: ciclo 1 (21 días) con gemcitabina 1000 mg/m2 en los días 1 y 8; ciclo 2 (28 días) con gemcitabina en los días 1, 8 y 15, acompañado de 15 fracciones simultáneas de radioterapia hipofraccionada (36 Gy) dirigida al tumor y los ganglios linfáticos sospechosos asociados; y ciclo 3 (21 días) con gemcitabina en los días 1 y 8.[13]
- La tasa de SG a 5 años fue del 20,5 % (IC 95 %, 14,2 %–29,8 %) en los pacientes que recibieron quimiorradioterapia neoadyuvante y del 6,5 % (IC 95 %, 3,1%–13,7%) en los pacientes sometidos a cirugía inicial (cociente de riesgos instantáneos [CRI], 0,73; IC 95 %, 0,56–0,96; P = 0,025).[13][Nivel de evidencia A1]
- La mediana de SG fue de 15,7 meses en el grupo de quimiorradioterapia neoadyuvante y de 14,3 meses en el grupo de cirugía inicial.
- En el grupo por intención de tratar, el 61 % de los pacientes que recibió quimiorradioterapia neoadyuvante se sometió a resección, que se tradujo en una resección R0 en el 41 % de los pacientes y una enfermedad sin compromiso ganglionar en el 65 % de los pacientes. La tasa de resección fue del 72 % en el grupo de cirugía inicial, lo que se tradujo en resección R0 en el 28 % de los pacientes y enfermedad sin compromiso ganglionar en el 18 % de los pacientes.
No está claro el régimen de terapia neoadyuvante óptimo, y otros regímenes de quimioterapia están en evaluación en los siguientes ensayos: ALLIANCE (NCT04340141), PREOPANC-3 (NCT04927780), PANACHE-01-PRODIGE (NCT02959879) y NorPACT-01 (NCT02919787).
Cirugía
La resección completa produce tasas de supervivencia a 5 años de 18 a 24 %, pero el control definitivo continúa siendo precario debido a la alta incidencia de recidiva local y a distancia del tumor. En consecuencia, también se recomienda la terapia sistémica.[14-16][Nivel de evidencia C1]
Alrededor de 20 % de los pacientes presentan cáncer de páncreas susceptible de tratarse con resección quirúrgica local; las tasas de mortalidad operatoria son de entre 1 a 16 %.[17-21] A partir de la información de la base de datos de reclamos de Medicare, un estudio nacional de cohorte de más de 7000 pacientes sometidos a pancreoduodenectomía entre 1992 y 1995 reveló tasas de mortalidad intrahospitalaria más elevadas en hospitales con carga asistencial baja (<1 pancreoduodenectomía por año), en comparación con hospitales con carga asistencial alta (>5 por año) (16 vs. 4 %, respectivamente; P < 0,01).[17]
Quimioterapia posoperatoria
Anteriormente, en múltiples ensayos aleatorizados se estableció que la monoterapia con gemcitabina adyuvante [22] o la monoterapia con 5-FU adyuvante [3] mejoran la SG a los 6 meses de la resección quirúrgica en comparación con la cirugía sola. En estudios más recientes se evaluaron los regímenes de combinación que podrían mejorar aún más los desenlaces después de la resección quirúrgica.
Para los pacientes con buen estado funcional, se debe considerar la quimioterapia con FOLFIRINOX adyuvante o la combinación de gemcitabina y capecitabina. Sin embargo, para pacientes de más edad o aquellos con estado funcional precario, se puede considerar la gemcitabina adyuvante o la monoterapia con 5-FU. En Asia, la combinación S-1 (tegafur, gimeracilo y oteracilo potásico) es una opción apropiada para reemplazar las terapias con gemcitabina.
Evidencia (quimioterapia posoperatoria):
- FOLFIRINOX: en el ensayo de fase III, aleatorizado y sin enmascaramiento PRODIGE-24 (NCT01526135), se asignaron al azar 493 pacientes con resecciones R0/R1 en una proporción 1:1 para recibir 6 ciclos de gemcitabina (1000 mg/m2 los días 1, 8 y 15 de un ciclo de 28 días) o 12 ciclos de FOLFIRINOX (oxaliplatino 85 mg/m2, leucovorina 400 mg/m2, irinotecán 150 mg/m2 y 5-FU 2400 mg/m2 durante 46 horas cada 2 semanas).[23,24][Nivel de evidencia A1]
- Al cabo de una mediana de seguimiento de 69,7 meses, la mediana de supervivencia sin enfermedad (SSE) fue de 21,4 meses (IC 95 %, 17,5–26,7) en el grupo de FOLFIRINOX y de 12,8 meses en el grupo de gemcitabina (IC 95 %, 11,6–15,2) (CRI, 0,66; IC 95 %, 0,54–0,82; P < 0,001).
- La mediana de SG fue de 53,5 meses (IC 95 %, 43,5–58,4) en el grupo de FOLFIRINOX y de 35,5 meses (IC 95 %, 30,1–40,3) en el grupo de gemcitabina (CRI, 0,68; IC 95 %, 0,54–0,85; P = 0,001). La tasa de SG a 5 años fue del 43,2 % en el grupo de FOLFIRINOX y del 31,4 % en el grupo de gemcitabina.
- Los efectos tóxicos fueron más altos con la quimioterapia combinada; 75,9 % de los pacientes que recibieron FOLFIRINOX tuvieron efectos tóxicos de grado 3 o 4 (comparados con 52,9 % de aquellos que recibieron gemcitabina), con tasas similares de neutropenia (aunque 62,2 % de los pacientes del grupo de FOLFIRINOX recibieron un factor estimulante de colonias de granulocitos). De los pacientes que recibieron FOLFIRINOX, 33 % interrumpieron el tratamiento en forma prematura, comparados con 21 % de los pacientes que recibieron gemcitabina sola.
- Gemcitabina y capecitabina: en el ensayo European Study for Pancreatic Cancer (ESPAC-4 [(NCT00058201]), se asignó al azar a 732 pacientes con cáncer de páncreas resecado para recibir 6 ciclos de gemcitabina sola (1000 mg/m2 administrados semanalmente durante 3 de cada 4 semanas) o capecitabina oral (1660 mg/m2) administrada durante 21 días, seguida de 7 días de descanso [un ciclo]).[25][Nivel de evidencia A1]
- Al cabo de una mediana de seguimiento de 43,2 meses, la mediana de SG de los pacientes en el grupo de gemcitabina/capecitabina fue de 28,0 meses (IC 95 %, 23,5–31,5) comparada con 25,5 meses para el grupo de gemcitabina sola (IC 95 %, 22,7–27,9; CRI, 0,82; P = 0,032). El tratamiento con gemcitabina/capecitabina produjo una mejora en la tasa de SG calculada a 5 años desde 16,3 % con gemcitabina sola hasta 28,8% con gemcitabina/capecitabina.
- No hubo diferencias significativas en las tasas generales de efectos tóxicos de grado 3/4 entre los grupos de tratamiento. En comparación con la gemcitabina sola, la capecitabina se relacionó con tasas más altas de diarrea grado 3/4 (5 vs. 2 %), neutropenia (38 vs. 24 %) y eritrodisestesia palmoplantar (7 vs. 0 %).
- No se presentaron efectos significativos en la calidad de vida de los grupos de tratamiento.
- A partir de estos resultados, la combinación adyuvante de gemcitabina y capecitabina es el nuevo estándar de atención después de una resección por cáncer de páncreas.
- S-1: el estudio Japan Adjuvant Study Group of Pancreatic Cancer (JASPAC-01) fue un ensayo multicéntrico de ausencia de inferioridad de fase III que se llevó a cabo en el Japón, en el que se asignó al azar a 385 pacientes para recibir 6 ciclos de gemcitabina (1000 mg/m2 administrados semanalmente durante 3 de cada 4 semanas) o S-1 (tegafur, gimeracilo y oteracilo potásico) (administrado por vía oral 2 veces al día durante 4 semanas, seguido de un descanso de 2 semanas).[26][Nivel de evidencia A1]
- El criterio predeterminado para la descontinuación temprana se cumplió en el análisis provisional de eficacia cuando se completaron todos los protocolos de tratamiento. En el análisis provisional temprano, el CRIde mortalidad fue de 0,57 (IC 95 %, 0,44–0,72; P de la ausencia de inferioridad < 0,001, P de la superioridad < 0,001). Estos resultados se relacionaron con una tasa de SG a 5 años de 24,4 % en el grupo de gemcitabina y 44,1 % en el grupo de S-1.
- La leucopenia de grado 3/4, la neutropenia y la transaminitis hepática se observaron con mayor frecuencia en el grupo de gemcitabina; la estomatitis y la diarrea se presentaron con mayor frecuencia en el grupo de S-1.
- En los pacientes japoneses, la quimioterapia adyuvante con S-1 puede ser el nuevo estándar de atención para los pacientes sometidos a resección pancreática. Se necesitan más estudios para validar estos resultados en pacientes de otras razas y etnias.
- Es posible que el perfil farmacocinético y farmacodinámico de S-1 sea diferente en las poblaciones de pacientes orientales y occidentales porque en la población occidental se han notificado con mayor frecuencia los efectos tóxicos gastrointestinales de grado 3/4, en especial la diarrea. La Administración de Alimentos y Medicamentos de los Estados Unidos no ha aprobado el uso de ES-1.
- Gemcitabina: el Charité Onkologie (CONKO)-001 fue un ensayo multicéntrico de fase III con 368 pacientes con cáncer de páncreas resecado, que se asignaron al azar para recibir 6 ciclos de gemcitabina adyuvante u observación.[22][Nivel de evidencia B1] A diferencia de los ensayos anteriores, el criterio principal de valoración fue la SSE.
- En el seguimiento a largo plazo del estudio CONKO-001, con una mediana de seguimiento de 136 meses, se demostró una mejora significativa de la SG que favorece la gemcitabina (mediana de supervivencia 22,8 meses vs. 20,2 meses; CRI, 0,76; IC 95 %, 0,61–0,95, P = 0,01). Cuando se comparó con la observación sola, la gemcitabina, produjo una mejora de la tasa de supervivencia a 5 años de 20,7 % para el grupo de gemcitabina versus 10,4 % para el grupo de observación sola; a los 10 años, los valores de las tasas de supervivencia fueron de 12,2 % para el grupo de gemcitabina versus 7,7 % para el grupo de observación sola.[27][Nivel de evidencia A1]
- Gemcitabina o 5-FU: en el ensayo ESPAC-3 (NCT00058201), se asignó al azar a 1088 pacientes que se habían sometido a resección macroscópica completa, a 6 meses de 5-FU (425 mg/m2) y leucovorina (20 mg/m2) los días 1 al 5, cada 28 días, o a 6 meses de gemcitabina (1000 mg/m2) los días 1, 8 y 15, cada 28 días.[3][Nivel de evidencia A1]
- La mediana de SG fue de 23,0 meses (IC 95 %, 21,1– 25,0) para los pacientes tratados con 5-FU y leucovorina y de 23,6 meses (IC 95 %, 21,4–26,4) para aquellos tratados con gemcitabina (CRI, 0,94; IC 95 %, 0,81–1,08; P = 0,39).
Quimiorradioterapia posoperatoria
La función de la terapia posoperatoria (quimioterapia con quimiorradioterapia o sin esta) para el tratamiento de esta enfermedad sigue siendo polémica porque los datos disponibles de ensayos clínicos aleatorizados no tienen suficiente potencia estadística y proporcionan resultados contradictorios.[4-8]
Evidencia (quimiorradioterapia posoperatoria):
En varios ensayos de fase III, se examinó el beneficio posible para la SG de la quimiorradioterapia posoperatoria adyuvante con 5-FU:
- Gastrointestinal Study Group (GITSG): en un pequeño ensayo aleatorizado conducido por el GITSG en 1985, se comparó la cirugía sola con la cirugía seguida de quimiorradiación.[4][Nivel de evidencia A1];[5][Nivel de evidencia B4]
- Los investigadores notificaron una mejora significativa, pero moderada, en la supervivencia a medio y largo plazo en comparación con la resección sola con un bolo posoperatorio de 5-FU y un ciclo dividido de radiación regional en una dosis de 40 Gy.
- European Organisation for the Research and Treatment of Cancer (EORTC): un intento realizado por la EORTC para reproducir los resultados del ensayo del GITSG no permitió confirmar un beneficio importante de la quimiorradioterapia adyuvante en comparación con la resección sola;[6][Nivel de evidencia A1] sin embargo, en este ensayo se trató a pacientes de cáncer de páncreas y de cánceres periampulares (con un posible mejor pronóstico).
- Un análisis del subconjunto de pacientes con tumores primarios de páncreas indicó una tendencia hacia mejor mediana de SG a 2 años y 5 años con la terapia adyuvante (17,1 meses, 37 y 20 %, respectivamente) que con la cirugía sola (12,6 meses, 23 y 10 %, respectivamente); P = 0,09 de la mediana de supervivencia).
- En un análisis actualizado de un ensayo ESPAC-1 posterior, se examinó solo a los pacientes sometidos a una aleatorización estricta después de la resección pancreática. Los pacientes se asignaron a 1 de 4 grupos (observación, quimioterapia con un bolo de 5-FU, quimiorradioterapia con un bolo de 5-FU o quimiorradioterapia seguida de quimioterapia adicional).[7,8,28][Nivel de evidencia A1]
- Con un diseño factorial de 2 × 2 notificado en el momento de una mediana de seguimiento de 47 meses, solo se observó una mediana del beneficio para la supervivencia en los pacientes que recibieron quimioterapia posoperatoria con 5-FU. No obstante, la interpretación de estos resultados fue difícil por una tasa alta de incumplimiento con el tratamiento y la ausencia de un análisis de los cuatro grupos por separado en el diseño de 2 × 2.
- U.S. Gastrointestinal Intergroup: este grupo notificó los resultados de un ensayo aleatorizado de fase III (Radiation Therapy Oncology Group [RTOG]-9704) en el que participaron 451 pacientes con cáncer de páncreas resecado que se asignaron para recibir infusión posoperatoria de 5-FU con infusión de 5-FU y radioterapia simultánea, o gemcitabina adyuvante con infusión de 5-FU y radiación simultánea.[29][Nivel de evidencia A1] Los criterios principales de valoración fueron la SG de todos los pacientes y la SG de los pacientes con tumores en la cabeza del páncreas.
- En una actualización del ensayo RTOG-9704 que se realizó 5 años después, se notificó que los pacientes con tumores en la cabeza del páncreas (n = 388) tuvieron una mediana de supervivencia de 20,5 meses y una tasa de SG a 5 años de 22 % con gemcitabina, versus una mediana de supervivencia de 17,1 meses y una tasa de SG a 5 años de 18 % con 5-FU (CRI, 0,84; IC 95 %, 0,67–1,05; P = 0,12).[30]
- El análisis univariante no mostró diferencias en la SG. Sin embargo, en el análisis multivariante, los pacientes del grupo de gemcitabina con tumores en la cabeza del páncreas exhibieron una tendencia a la mejoría de la SG (P = 0,08). La recaía a distancia sigue siendo el sitio predominante de fracaso inicial (78 %).
El ensayo de fase III RTOG-0848 del EORTC/U.S. Gastrointestinal Intergroup en el que se evalúa el efecto de la quimiorradioterapia adyuvante después de un ciclo completo de gemcitabina con erlotinib se cerró y sus resultados están pendientes.
Se justifica la realización de más ensayos para determinar cuál es la terapia sistémica más eficaz para esta enfermedad.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Dalton RR, Sarr MG, van Heerden JA, et al.: Carcinoma of the body and tail of the pancreas: is curative resection justified? Surgery 111 (5): 489-94, 1992. [PUBMED Abstract]
- Brennan MF, Moccia RD, Klimstra D: Management of adenocarcinoma of the body and tail of the pancreas. Ann Surg 223 (5): 506-11; discussion 511-2, 1996. [PUBMED Abstract]
- Neoptolemos JP, Stocken DD, Bassi C, et al.: Adjuvant chemotherapy with fluorouracil plus folinic acid vs gemcitabine following pancreatic cancer resection: a randomized controlled trial. JAMA 304 (10): 1073-81, 2010. [PUBMED Abstract]
- Further evidence of effective adjuvant combined radiation and chemotherapy following curative resection of pancreatic cancer. Gastrointestinal Tumor Study Group. Cancer 59 (12): 2006-10, 1987. [PUBMED Abstract]
- Kalser MH, Ellenberg SS: Pancreatic cancer. Adjuvant combined radiation and chemotherapy following curative resection. Arch Surg 120 (8): 899-903, 1985. [PUBMED Abstract]
- Klinkenbijl JH, Jeekel J, Sahmoud T, et al.: Adjuvant radiotherapy and 5-fluorouracil after curative resection of cancer of the pancreas and periampullary region: phase III trial of the EORTC gastrointestinal tract cancer cooperative group. Ann Surg 230 (6): 776-82; discussion 782-4, 1999. [PUBMED Abstract]
- Neoptolemos JP, Dunn JA, Stocken DD, et al.: Adjuvant chemoradiotherapy and chemotherapy in resectable pancreatic cancer: a randomised controlled trial. Lancet 358 (9293): 1576-85, 2001. [PUBMED Abstract]
- Neoptolemos JP, Stocken DD, Friess H, et al.: A randomized trial of chemoradiotherapy and chemotherapy after resection of pancreatic cancer. N Engl J Med 350 (12): 1200-10, 2004. [PUBMED Abstract]
- Stessin AM, Meyer JE, Sherr DL: Neoadjuvant radiation is associated with improved survival in patients with resectable pancreatic cancer: an analysis of data from the surveillance, epidemiology, and end results (SEER) registry. Int J Radiat Oncol Biol Phys 72 (4): 1128-33, 2008. [PUBMED Abstract]
- Versteijne E, Vogel JA, Besselink MG, et al.: Meta-analysis comparing upfront surgery with neoadjuvant treatment in patients with resectable or borderline resectable pancreatic cancer. Br J Surg 105 (8): 946-958, 2018. [PUBMED Abstract]
- Mokdad AA, Minter RM, Zhu H, et al.: Neoadjuvant Therapy Followed by Resection Versus Upfront Resection for Resectable Pancreatic Cancer: A Propensity Score Matched Analysis. J Clin Oncol 35 (5): 515-522, 2017. [PUBMED Abstract]
- Katz MHG, Shi Q, Meyers J, et al.: Efficacy of Preoperative mFOLFIRINOX vs mFOLFIRINOX Plus Hypofractionated Radiotherapy for Borderline Resectable Adenocarcinoma of the Pancreas: The A021501 Phase 2 Randomized Clinical Trial. JAMA Oncol 8 (9): 1263-1270, 2022. [PUBMED Abstract]
- Versteijne E, van Dam JL, Suker M, et al.: Neoadjuvant Chemoradiotherapy Versus Upfront Surgery for Resectable and Borderline Resectable Pancreatic Cancer: Long-Term Results of the Dutch Randomized PREOPANC Trial. J Clin Oncol 40 (11): 1220-1230, 2022. [PUBMED Abstract]
- Cameron JL, Crist DW, Sitzmann JV, et al.: Factors influencing survival after pancreaticoduodenectomy for pancreatic cancer. Am J Surg 161 (1): 120-4; discussion 124-5, 1991. [PUBMED Abstract]
- Yeo CJ, Cameron JL, Lillemoe KD, et al.: Pancreaticoduodenectomy for cancer of the head of the pancreas. 201 patients. Ann Surg 221 (6): 721-31; discussion 731-3, 1995. [PUBMED Abstract]
- Yeo CJ, Abrams RA, Grochow LB, et al.: Pancreaticoduodenectomy for pancreatic adenocarcinoma: postoperative adjuvant chemoradiation improves survival. A prospective, single-institution experience. Ann Surg 225 (5): 621-33; discussion 633-6, 1997. [PUBMED Abstract]
- Birkmeyer JD, Finlayson SR, Tosteson AN, et al.: Effect of hospital volume on in-hospital mortality with pancreaticoduodenectomy. Surgery 125 (3): 250-6, 1999. [PUBMED Abstract]
- Cameron JL, Pitt HA, Yeo CJ, et al.: One hundred and forty-five consecutive pancreaticoduodenectomies without mortality. Ann Surg 217 (5): 430-5; discussion 435-8, 1993. [PUBMED Abstract]
- Spanknebel K, Conlon KC: Advances in the surgical management of pancreatic cancer. Cancer J 7 (4): 312-23, 2001 Jul-Aug. [PUBMED Abstract]
- Balcom JH, Rattner DW, Warshaw AL, et al.: Ten-year experience with 733 pancreatic resections: changing indications, older patients, and decreasing length of hospitalization. Arch Surg 136 (4): 391-8, 2001. [PUBMED Abstract]
- Sohn TA, Yeo CJ, Cameron JL, et al.: Resected adenocarcinoma of the pancreas-616 patients: results, outcomes, and prognostic indicators. J Gastrointest Surg 4 (6): 567-79, 2000 Nov-Dec. [PUBMED Abstract]
- Oettle H, Post S, Neuhaus P, et al.: Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA 297 (3): 267-77, 2007. [PUBMED Abstract]
- Conroy T, Hammel P, Hebbar M, et al.: FOLFIRINOX or Gemcitabine as Adjuvant Therapy for Pancreatic Cancer. N Engl J Med 379 (25): 2395-2406, 2018. [PUBMED Abstract]
- Conroy T, Castan F, Lopez A, et al.: Five-Year Outcomes of FOLFIRINOX vs Gemcitabine as Adjuvant Therapy for Pancreatic Cancer: A Randomized Clinical Trial. JAMA Oncol 8 (11): 1571-1578, 2022. [PUBMED Abstract]
- Neoptolemos JP, Palmer DH, Ghaneh P, et al.: Comparison of adjuvant gemcitabine and capecitabine with gemcitabine monotherapy in patients with resected pancreatic cancer (ESPAC-4): a multicentre, open-label, randomised, phase 3 trial. Lancet 389 (10073): 1011-1024, 2017. [PUBMED Abstract]
- Uesaka K, Boku N, Fukutomi A, et al.: Adjuvant chemotherapy of S-1 versus gemcitabine for resected pancreatic cancer: a phase 3, open-label, randomised, non-inferiority trial (JASPAC 01). Lancet 388 (10041): 248-57, 2016. [PUBMED Abstract]
- Oettle H, Neuhaus P, Hochhaus A, et al.: Adjuvant chemotherapy with gemcitabine and long-term outcomes among patients with resected pancreatic cancer: the CONKO-001 randomized trial. JAMA 310 (14): 1473-81, 2013. [PUBMED Abstract]
- Choti MA: Adjuvant therapy for pancreatic cancer--the debate continues. N Engl J Med 350 (12): 1249-51, 2004. [PUBMED Abstract]
- Regine WF, Winter KA, Abrams RA, et al.: Fluorouracil vs gemcitabine chemotherapy before and after fluorouracil-based chemoradiation following resection of pancreatic adenocarcinoma: a randomized controlled trial. JAMA 299 (9): 1019-26, 2008. [PUBMED Abstract]
- Regine WF, Winter KA, Abrams R, et al.: Fluorouracil-based chemoradiation with either gemcitabine or fluorouracil chemotherapy after resection of pancreatic adenocarcinoma: 5-year analysis of the U.S. Intergroup/RTOG 9704 phase III trial. Ann Surg Oncol 18 (5): 1319-26, 2011. [PUBMED Abstract]
Tratamiento del cáncer de páncreas localmente avanzado
Opciones de tratamiento del cáncer de páncreas localmente avanzado
Si bien el cáncer de páncreas localmente avanzado y el metastásico son incurables, es posible que la evolución natural de de ambos sea diferente. En una serie de autopsias, se demostró que 30 % de los pacientes que presentaban enfermedad localmente avanzada murió sin indicios de metástasis a distancia.[1][Nivel de evidencia A1] Por lo tanto, los investigadores han tenido dificultades para determinar si se justifica la administración de quimiorradioterapia a los pacientes con enfermedad localmente avanzada.
Las siguientes son las opciones de tratamiento para el cáncer de páncreas localmente avanzado:
- Quimioterapia con terapia dirigida o sin esta.
- Quimiorradioterapia: quimioterapia seguida de quimiorradiación, para los pacientes sin enfermedad metastásica.
- Cirugía: resección pancreática radical.
- Cirugía paliativa: derivación quirúrgica biliar o gástrica paliativa, colocación percutánea radiológica de una endoprótesis biliar o colocación endoscópica de una endoprótesis biliar.[2,3]
- Participación en ensayos clínicos en los que se evalúan fármacos nuevos en combinación con quimioterapia o quimiorradioterapia, para los pacientes con tumores irresecables.
- Radioterapia intraoperatoria o implante de fuentes de radiactividad (en evaluación clínica).[4,5]
Es posible considerar terapias paliativas para los pacientes en cualquier estadio de la enfermedad. Para obtener más información, consultar la sección Terapia paliativa.
Quimioterapia con terapia dirigida o sin esta
La quimioterapia es la modalidad principal de tratamiento para los pacientes con cánceres de páncreas localmente avanzados; se utilizan los mismos regímenes que los usados para tratar pacientes con enfermedad metastásica.
Evidencia (quimioterapia):
- FOLFIRINOX versus gemcitabina: en un ensayo multicéntrico de fase II/III, se incluyó a 342 pacientes con adenocarcinoma de páncreas metastásico con un puntaje de estado funcional del Eastern Cooperative Oncology Group (ECOG) de 0 a 1.[6][Nivel de evidencia A1] Los pacientes se asignaron al azar para recibir FOLFIRINOX (oxaliplatino [85 mg/m2], irinotecán [180 mg/m2], leucovorina [400 mg/m2] y fluorouracilo [5-FU, 400 mg/m2] administrado como bolo, seguido de 2400 mg/m2 administrado durante 46 horas como infusión continua cada 2 semanas) o gemcitabina (1000 mg/m2 semanales durante 7 de 8 semanas y luego semanalmente durante 3 de 4 semanas).
- La mediana de supervivencia general (SG) fue de 11,1 meses en el grupo de FOLFIRINOX en comparación con 6,8 meses en el grupo de gemcitabina (cociente de riesgos instantáneos [CRI]de muerte = 0,57; intervalo de confianza [IC] 95 %, 0,45–0,73; P < 0,001).
- La mediana de supervivencia sin progresión (SSP) fue de 6,4 meses en el grupo de FOLFIRINOX y de 3,3 meses en el grupo de gemcitabina (CRIde progresión de la enfermedad = 0,47; IC 95 %, 0,37–0,59; P < 0,001).
- FOLFIRINOX fue más tóxico que la gemcitabina; 5,4 % de los pacientes en este grupo presentaron neutropenia febril. Al cabo de 6 meses, 31 % de los pacientes del grupo de FOLFIRINOX presentaron un deterioro específico de la calidad de vida en comparación con 66 % del grupo de gemcitabina (CRI = 0,47; IC 95 %, 0,30–0,70; P < 0,001).
- A partir de este ensayo, FOLFIRINOX se considera una opción de tratamiento estándar para los pacientes con cáncer de páncreas avanzado.
- Gemcitabina y nab-paclitaxel versus gemcitabina: en un ensayo multicéntrico internacional de fase III (NCT00844649) participaron 861 pacientes con adenocarcinoma de páncreas metastásico. Los pacientes tenían un estado funcional de Karnofsky de al menos 70 y no habían recibido quimioterapia para la enfermedad metastásica.[7][Nivel de evidencia A1] Se excluyó a los pacientes que recibieron gemcitabina adyuvante o cualquier otra quimioterapia. Los pacientes se asignaron al azar para recibir gemcitabina semanal (1000 mg/m2) y nab-paclitaxel (125 mg/m2 de área de superficie corporal) durante 3 de 4 semanas, o monoterapia con gemcitabina (1000 mg/m2 semanal durante 7 de 8 semanas y luego semanal durante 3 de 4 semanas).
- La mediana de SG fue de 8,5 meses en el grupo de nab-paclitaxel y gemcitabina en comparación con 6,7 meses en el grupo de gemcitabina (CRIde muerte 0,72; IC 95 %, 0,62–0,83; P < 0,001).
- La mediana de SSP fue de 5,5 meses en el grupo de nab-paclitaxel y gemcitabina, y de 3,7 meses en el grupo de gemcitabina (CRIde progresión de la enfermedad 0,69; IC 95 %, 0,58–0,82; P < 0,001).
- La combinación de nab-paclitaxel y gemcitabina fue más tóxica que la gemcitabina. Los efectos tóxicos de grado 3 más comunes en el grupo de nab-paclitaxel y gemcitabina fueron neutropenia (38 %), fatiga (17 %) y neuropatía (17 %), la neutropenia febril se presentó en 3 % de los pacientes. En el grupo de gemcitabina sola los efectos tóxicos más comunes de grado 3 fueron neutropenia (27 %), fatiga (1 %) y neuropatía (1 %); la neutropenia febril se presentó en 1 % de los pacientes.
- En el grupo de nab-paclitaxel y gemcitabina, la mediana de tiempo desde la neuropatía de grado 3 a la neuropatía de grado 1 o su resolución fue de 29 días. De los pacientes con neuropatía periférica de grado 3, 44 % fueron aptos para reiniciar el tratamiento con una dosis reducida dentro de una mediana de 23 días desde el inicio de un episodio de grado 3.
- A partir de este ensayo, la combinación de nab-paclitaxel y gemcitabina es una opción de tratamiento estándar para los pacientes con cáncer de páncreas avanzado.
- No se midieron los datos sobre la calidad de vida de este régimen, y este estudio no aborda la eficacia de paclitaxel y gemcitabina versus FOLFIRINOX.
- Gemcitabina versus 5-FU: la gemcitabina ha mostrado actividad en pacientes con cáncer de páncreas y es un fármaco útil para paliación.[8-10] En un ensayo de fase III de gemcitabina versus 5-FU como tratamiento de primera línea para pacientes con adenocarcinoma de páncreas avanzado o metastásico, se notificó una mejora significativa de la supervivencia para los pacientes tratados con gemcitabina (la tasa de supervivencia a 1 año fue de 18 % con gemcitabina en comparación con 2 % con 5-FU; P = 0,003).[9][Nivel de evidencia A1]
- Gemcitabina sola versus gemcitabina y erlotinib: el National Cancer Institute of Canada realizó un ensayo de fase III (CAN-NCIC-PA3 [NCT00026338]) en el que se comparó la gemcitabina sola con la combinación de gemcitabina y erlotinib (100 mg/d) para pacientes con carcinomas de páncreas avanzados o metastásicos.[11][Nivel de evidencia A1]
- La adición de erlotinib prolongó la supervivencia de forma moderada cuando se combinó con gemcitabina en comparación con gemcitabina sola (CRI = 0,81; IC 95 %, 0,69–0,99; P = 0,038).
- La mediana de supervivencia fue de 6,2 meses y la tasa de supervivencia a 1 año fue de 23 % para los pacientes que recibieron erlotinib. La mediana de supervivencia fue de 5,9 meses y la tasa de supervivencia a 1 año fue de 17 % para los pacientes que recibieron un placebo.
- Análogo del platino o fluoropirimidina versus gemcitabina como fármaco único: en muchos estudios de fase III se evaluó un régimen combinado con un análogo del platino (cisplatino u oxaliplatino) o una fluoropirimidina en comparación con la gemcitabina como fármaco único.[12,13]
- En ninguno de estos ensayos de fase III se observó una ventaja estadísticamente significativa en favor del uso de la quimioterapia combinada como tratamiento de primera línea para el cáncer de páncreas metastásico.
- 5-FU, leucovorina y oxaliplatino (régimen OFF) versus el mejor cuidado médico de apoyo (MCA): la quimioterapia de segunda línea podría ser beneficiosa después de la progresión de la enfermedad durante un régimen con gemcitabina. Los investigadores del Charité Onkologie (CONKO)-003 asignaron al azar al régimen OFF o al MCA a aquellos pacientes que necesitaban una segunda línea de quimioterapia .[14]; [15][Nivel de evidencia C1] El régimen OFF consistió en leucovorina (200 mg/m2) seguida de 5-FU (2000 mg/m2 [infusión continua de 24 horas] los días 1, 8, 15 y 22) y oxaliplatino (85 mg/m2 los días 8 y 22). Luego de un descanso de 3 semanas, el siguiente ciclo comenzó el día 43. El ensayo se terminó de forma prematura debido a la falta de participantes y solo se asignó al azar a 46 pacientes al régimen OFF o al MCA.
- La mediana de supervivencia con la quimioterapia fue de 4,82 meses (IC 95 %, 4,29–5,35) con el régimen de tratamiento OFF y de 2,30 meses (IC 95 %, 1,76–2,83) con MCA solo (CRI = 0,45; IC 95 %, 0,24–0,83).
- La mediana de SG fue de 9,09 meses para la secuencia de gemcitabina con el régimen OFF y de 7,90 meses para gemcitabina con el MCA.
- El cierre prematuro del estudio y la cantidad tan reducida de pacientes hicieron engañosos los valores de P. Por tanto, es posible que la quimioterapia de segunda línea con el régimen OFF se relacione de forma equivocada con una mejor supervivencia.
Quimiorradioterapia
La función de la quimiorradiación en el cáncer de páncreas localmente avanzado continúa siendo polémica. En el Cuadro 7 se resumen los estudios aleatorizados de fase III de quimiorradiación para el cáncer de páncreas localmente avanzado.
| Ensayo | Régimen | Quimiorradiación | Radiación sola | Quimioterapia sola | Valor de P |
|---|---|---|---|---|---|
| 5-FU = fluorouracilo; ECOG = Eastern Cooperative Oncology Group; FFCD = Fédération Francophone de Cancérologie Digestive; GEM = gemcitabina; GITSG = Gastrointestinal Tumor Study Group; Gy = gray (unidad de radiación absorbida de radiación ionizante); valor de P = valor de probabilidad; XRT = radioterapia. | |||||
| Pre-2000 | |||||
| GITSG [16] | Radiación sola vs. 5-FU/60 Gy XRT | 40 semanas | 20 semanas | <0,01 | |
| ECOG [17] | Radiación vs. 5-FU, mitomicina C/59 Gy XRT | 8,4 meses | 7,1 meses | 0,16 | |
| Post-2000 | |||||
| FFCD [18] | GEM vs. GEM, cisplatino, 60 Gy XRT | 8,6 meses | 13 meses | 0,03 | |
| ECOG [19] | GEM vs. GEM/50,4 Gy XRT | 11,1 meses | 9,2 meses | 0,017 | |
Evidencia (quimiorradioterapia):
En tres estudios se evaluó el tratamiento de modalidad combinada con la radioterapia sola.[16-18] Los ensayos tuvieron deficiencias importantes en el diseño o el análisis. En un principio, la práctica estándar era administrar quimiorradioterapia de acuerdo con los datos de los primeros dos estudios. Sin embargo, con la publicación del tercer estudio, la práctica estándar cambió a la quimioterapia seguida de quimiorradiación en ausencia de metástasis.
- LAP07 [NCT00634725]: LAP07 fue un estudio internacional, aleatorizado de fase III que se basó en los resultados del estudio del Groupe Coopérateur Multidisciplinaire en Oncologie (GERCOR). Se inscribieron 449 pacientes entre 2008 y 2011, que se asignaron al azar mediante un proceso de aleatorización de dos pasos. En el primer paso, los pacientes se asignaron al azar a inducción con gemcitabina (n = 223) o gemcitabina y erlotinib (n = 219) durante 4 ciclos. En el segundo paso, los pacientes con tumores controlados (n = 269) se asignaron al azar una segunda vez para recibir quimioterapia (n = 136) o quimiorradioterapia (n = 133). Se recetó una dosis total de 54 Gy en 30 fracciones diarias con capecitabina simultánea en una dosis de 800 mg/m2 2 veces al día los mismos días que recibían radioterapia.[20][Nivel de evidencia A1]
- El criterio principal de valoración fue la SG. Luego de un análisis provisional, el estudio se detuvo por su inutilidad.
- Después de una mediana de seguimiento de 36,7 meses, la mediana de SG desde la fecha de la primera aleatorización no fue significativamente diferente entre el grupo de quimioterapia a los 16,5 meses (IC 95 %, 14,5–18,5) y el grupo de quimiorradioterapia a los 15,2 meses (IC 95 %, 13,9–17,3, P = 0,83).
- La mediana de SG después de la primera aleatorización fue de 13,6 meses (IC 95 %, 12,3–15,3) para los pacientes que recibieron gemcitabina y de 11,9 meses (IC 95 %, 10,4–13,5, P = 0,09) para los pacientes que recibieron gemcitabina y erlotinib.
El estudio LAP07 ofrece los datos más robustos, prospectivos y aleatorizados de fase III sobre la función de la quimiorradioterapia en el entorno de la quimioterapia de inducción con gemcitabina, que no demuestra ningún beneficio para la SG. Sin embargo, este estudio se inició antes de la aparición de la quimioterapia FOLFIRINOX, que se adoptó de manera amplia en el entorno de la enfermedad localmente avanzada. Todavía no se ha evaluado la función de la quimiorradiación cuando se utilizan regímenes de quimioterapia más activos, como gemcitabina/paclitaxel y FOLFIRINOX.
- Ensayo del Gastrointestinal Tumor Study Group (GITSG)-9273: antes del año 2000, en varios ensayos de fase III se evaluó la terapia de modalidad combinada en comparación con la radioterapia sola. Antes del uso de gemcitabina para pacientes de cáncer de páncreas localmente avanzado o metastásico, los investigadores del GITSG asignaron al azar a 106 pacientes de adenocarcinoma de páncreas localmente avanzado a recibir radioterapia de haz externo (RHE) (60 Gy) sola o RHE simultánea, (40 o 60 Gy) con bolo de 5-FU.[16][Nivel de evidencia A1]
- El estudio se suspendió de forma prematura cuando se encontró que los grupos de quimiorradioterapia obtenían una mejor eficacia. La tasa de supervivencia a 1 año fue de 11 % para los pacientes que recibieron RHE sola, en comparación con 38 % para los pacientes que recibieron 40 Gy de quimiorradioterapia y 36 % para los pacientes que recibieron 60 Gy de quimiorradioterapia.
- Después de la inscripción de 88 pacientes adicionales en los grupos de modalidad combinada, hubo una tendencia hacia una mejora en la supervivencia con 60 Gy de RHE y 5-FU, pero la diferencia en el tiempo transcurrido hasta la progresión y la SG no fue estadísticamente significativa cuando se la comparó con la del grupo de 40 Gy.[21]
- ECOG E-8282: los investigadores del ECOG asignaron al azar a 114 pacientes para recibir radioterapia (59,4 Gy) sola o con 5-FU por infusión simultánea (1000 mg/m2/d los días 2–5 y 28–31) y mitomicina (10 mg/m2 el día 2).[17]
- Se notificó que no hubo ninguna diferencia de la SG entre los dos grupos.
- Ensayo de la Fédération Francophone de Cancérologie Digestive-Société Française de Radiothérapie Oncologie (FFCD-SFRO): tan pronto quedó claro que la radioterapia sola era un tratamiento inadecuado, los investigadores evaluaron abordajes de modalidad combinada en comparación con la quimioterapia sola. Los investigadores del FFCD-SFRO asignaron al azar a 119 pacientes a quimiorradioterapia de inducción (60 Gy en fracciones de 2 Gy con 300 mg/m2/d de infusión continua de 5-FU los días 1–5 por 6 semanas y 20 mg/m2/d de cisplatino los días 1–5 durante las semanas 1 y 5) o inducción con gemcitabina (1000 mg/m2 semanales por 7 semanas). La gemcitabina de mantenimiento se administró en ambos grupos hasta que se suspendió debido a la progresión de la enfermedad o la interrupción del tratamiento como resultado de la toxicidad.[22][Nivel de evidencia A1]
- La mediana de supervivencia fue superior en el grupo de gemcitabina (13 vs. 8,6 meses; P = 0,03).
- Los efectos tóxicos no hematológicos de grado 3 a 4 (principalmente gastrointestinales) fueron significativamente más comunes en el grupo de quimiorradioterapia (44 vs. 18 %; P = 0,004), y menos pacientes llegaron a completar por lo menos 75 % de la terapia de inducción (42 vs. 73 %).
- No obstante, el beneficio de supervivencia persistió en un análisis según el protocolo para los pacientes que recibieron por lo menos 75 % de tratamiento planificado. Se debe destacar que la intensidad de la dosis de gemcitabina de mantenimiento fue significativamente menor en el grupo de quimiorradioterapia debido a una mayor incidencia de efectos tóxicos hematológicos de grado 3 a 4 (71 vs. 27 %; P = 0,0001).
- Como resultado de este estudio, la quimioterapia de inducción ha caído en desuso.
- ECOG: los resultados del estudio FFCD-SFRO contrastan con los resultados de un estudio del ECOG en el que los investigadores asignaron al azar a 74 pacientes a gemcitabina sola o a gemcitabina con radiación seguida de gemcitabina.[19] Se debe notar que el estudio se cerró de forma prematura por falta de inscripciones.
- El criterio principal de valoración fue la supervivencia, que fue de 9,2 meses (IC, 95 %, 7,9–11,4) para la quimioterapia y de 11,1 meses (IC 95 %, 7,6–15,5) para la terapia de modalidad combinada (P unilateral = 0,017 mediante la prueba de rango logarítmico estratificada).
- La toxicidad de grados 4 y 5 fue mayor en el grupo de quimiorradioterapia que en el grupo de quimioterapia (41 vs. 9 %).
- GERCOR: dado el aumento de la toxicidad de la quimiorradioterapia y la aparición precoz de enfermedad metastásica en un alto porcentaje de pacientes de cáncer de páncreas localmente avanzado, los investigadores buscan una estrategia para seleccionar pacientes con enfermedad localizada con el fin de administrarles quimiorradioterapia. Con esta estrategia, los pacientes seleccionados muestran una ausencia de enfermedad progresiva local o sistémica luego de varios meses de quimioterapia.[23][Nivel de evidencia C1]
- En un análisis retrospectivo de 181 pacientes inscritos en los estudios prospectivos de fase II y III del GERCOR, se reveló que 29 % de los pacientes tenían enfermedad metastásica después de 3 meses de quimioterapia con gemcitabina.
- Para el 71 % restante, la mediana de SG fue significativamente más larga para los pacientes que recibieron quimiorradioterapia que para aquellos tratados con quimioterapia adicional (15,0 vs.11,7 meses; P = 0,0009).
Cirugía
Los pacientes con cáncer de páncreas localmente avanzado tienen tumores que son técnicamente irresecables debido a la compresión o invasión del tumor en un vaso local. Sin embargo, con la combinación de la quimioterapia y la quimiorradioterapia, algunos pacientes quizá lleguen a ser candidatos para la resección pancreática radical.
Cirugía paliativa
Una proporción importante (cerca de un tercio) de los pacientes de cáncer de páncreas presentan enfermedad localmente avanzada. Los pacientes quizás se beneficien de la paliación de la obstrucción biliar por medios endoscópicos, quirúrgicos o radiológicos.[24]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Iacobuzio-Donahue CA, Fu B, Yachida S, et al.: DPC4 gene status of the primary carcinoma correlates with patterns of failure in patients with pancreatic cancer. J Clin Oncol 27 (11): 1806-13, 2009. [PUBMED Abstract]
- van den Bosch RP, van der Schelling GP, Klinkenbijl JH, et al.: Guidelines for the application of surgery and endoprostheses in the palliation of obstructive jaundice in advanced cancer of the pancreas. Ann Surg 219 (1): 18-24, 1994. [PUBMED Abstract]
- Baron TH: Expandable metal stents for the treatment of cancerous obstruction of the gastrointestinal tract. N Engl J Med 344 (22): 1681-7, 2001. [PUBMED Abstract]
- Tepper JE, Noyes D, Krall JM, et al.: Intraoperative radiation therapy of pancreatic carcinoma: a report of RTOG-8505. Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys 21 (5): 1145-9, 1991. [PUBMED Abstract]
- Reni M, Panucci MG, Ferreri AJ, et al.: Effect on local control and survival of electron beam intraoperative irradiation for resectable pancreatic adenocarcinoma. Int J Radiat Oncol Biol Phys 50 (3): 651-8, 2001. [PUBMED Abstract]
- Conroy T, Desseigne F, Ychou M, et al.: FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med 364 (19): 1817-25, 2011. [PUBMED Abstract]
- Von Hoff DD, Ervin T, Arena FP, et al.: Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med 369 (18): 1691-703, 2013. [PUBMED Abstract]
- Rothenberg ML, Moore MJ, Cripps MC, et al.: A phase II trial of gemcitabine in patients with 5-FU-refractory pancreas cancer. Ann Oncol 7 (4): 347-53, 1996. [PUBMED Abstract]
- Burris HA, Moore MJ, Andersen J, et al.: Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol 15 (6): 2403-13, 1997. [PUBMED Abstract]
- Storniolo AM, Enas NH, Brown CA, et al.: An investigational new drug treatment program for patients with gemcitabine: results for over 3000 patients with pancreatic carcinoma. Cancer 85 (6): 1261-8, 1999. [PUBMED Abstract]
- Moore MJ, Goldstein D, Hamm J, et al.: Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 25 (15): 1960-6, 2007. [PUBMED Abstract]
- Poplin E, Feng Y, Berlin J, et al.: Phase III, randomized study of gemcitabine and oxaliplatin versus gemcitabine (fixed-dose rate infusion) compared with gemcitabine (30-minute infusion) in patients with pancreatic carcinoma E6201: a trial of the Eastern Cooperative Oncology Group. J Clin Oncol 27 (23): 3778-85, 2009. [PUBMED Abstract]
- Colucci G, Labianca R, Di Costanzo F, et al.: Randomized phase III trial of gemcitabine plus cisplatin compared with single-agent gemcitabine as first-line treatment of patients with advanced pancreatic cancer: the GIP-1 study. J Clin Oncol 28 (10): 1645-51, 2010. [PUBMED Abstract]
- Pelzer U, Kubica K, Stieler J, et al.: A randomized trial in patients with gemcitabine refractory pancreatic cancer. Final results of the CONKO 003 study. [Abstract] J Clin Oncol 26 (Suppl 15): A-4508, 2008.
- Pelzer U, Schwaner I, Stieler J, et al.: Best supportive care (BSC) versus oxaliplatin, folinic acid and 5-fluorouracil (OFF) plus BSC in patients for second-line advanced pancreatic cancer: a phase III-study from the German CONKO-study group. Eur J Cancer 47 (11): 1676-81, 2011. [PUBMED Abstract]
- A multi-institutional comparative trial of radiation therapy alone and in combination with 5-fluorouracil for locally unresectable pancreatic carcinoma. The Gastrointestinal Tumor Study Group. Ann Surg 189 (2): 205-8, 1979. [PUBMED Abstract]
- Cohen SJ, Dobelbower R, Lipsitz S, et al.: A randomized phase III study of radiotherapy alone or with 5-fluorouracil and mitomycin-C in patients with locally advanced adenocarcinoma of the pancreas: Eastern Cooperative Oncology Group study E8282. Int J Radiat Oncol Biol Phys 62 (5): 1345-50, 2005. [PUBMED Abstract]
- Chauffert B, Mornex F, Bonnetain F, et al.: Phase III trial comparing initial chemoradiotherapy (intermittent cisplatin and infusional 5-FU) followed by gemcitabine vs. gemcitabine alone in patients with locally advanced non metastatic pancreatic cancer: a FFCD-SFRO study. [Abstract] J Clin Oncol 24 (Suppl 18): A-4008, 180s, 2006.
- Loehrer PJ, Feng Y, Cardenes H, et al.: Gemcitabine alone versus gemcitabine plus radiotherapy in patients with locally advanced pancreatic cancer: an Eastern Cooperative Oncology Group trial. J Clin Oncol 29 (31): 4105-12, 2011. [PUBMED Abstract]
- Hammel P, Huguet F, van Laethem JL, et al.: Effect of Chemoradiotherapy vs Chemotherapy on Survival in Patients With Locally Advanced Pancreatic Cancer Controlled After 4 Months of Gemcitabine With or Without Erlotinib: The LAP07 Randomized Clinical Trial. JAMA 315 (17): 1844-53, 2016. [PUBMED Abstract]
- Moertel CG, Frytak S, Hahn RG, et al.: Therapy of locally unresectable pancreatic carcinoma: a randomized comparison of high dose (6000 rads) radiation alone, moderate dose radiation (4000 rads + 5-fluorouracil), and high dose radiation + 5-fluorouracil: The Gastrointestinal Tumor Study Group. Cancer 48 (8): 1705-10, 1981. [PUBMED Abstract]
- Chauffert B, Mornex F, Bonnetain F, et al.: Phase III trial comparing intensive induction chemoradiotherapy (60 Gy, infusional 5-FU and intermittent cisplatin) followed by maintenance gemcitabine with gemcitabine alone for locally advanced unresectable pancreatic cancer. Definitive results of the 2000-01 FFCD/SFRO study. Ann Oncol 19 (9): 1592-9, 2008. [PUBMED Abstract]
- Huguet F, André T, Hammel P, et al.: Impact of chemoradiotherapy after disease control with chemotherapy in locally advanced pancreatic adenocarcinoma in GERCOR phase II and III studies. J Clin Oncol 25 (3): 326-31, 2007. [PUBMED Abstract]
- Sohn TA, Lillemoe KD, Cameron JL, et al.: Surgical palliation of unresectable periampullary adenocarcinoma in the 1990s. J Am Coll Surg 188 (6): 658-66; discussion 666-9, 1999. [PUBMED Abstract]
Tratamiento del cáncer de páncreas metastásico o recidivante
Opciones de tratamiento para el cáncer de páncreas metastásico o recidivante
Las opciones de tratamiento para el cáncer de páncreas metastásico o recidivante son las siguientes:
- Quimioterapia con terapia dirigida o sin esta.
- Participación en ensayos clínicos en los que se evalúan fármacos anticancerígenos nuevos solos o en combinación con quimioterapia.
Es posible considerar terapias paliativas para los pacientes en cualquier estadio de la enfermedad. Para obtener más información, consultar la sección Terapia paliativa.
Quimioterapia con terapia dirigida o sin esta
Debido a la tasa de respuesta objetiva baja y la poca eficacia de los regímenes de quimioterapia paliativa, todos los pacientes con diagnóstico nuevo deben considerar la inscripción en ensayos clínicos. Las combinaciones multifarmacológicas de quimioterapia han demostrado que prolongan los desenlaces en comparación con la gemcitabina como fármaco único.[1-3]
Evidencia (quimioterapia de fármaco único):
- Gemcitabina versus fluorouracilo (5-FU): en un ensayo de fase III de gemcitabina versus 5-FU como tratamiento de primera línea para pacientes con adenocarcinoma de páncreas avanzado o metastásico, se notificó una mejora significativa de la supervivencia de los pacientes tratados con gemcitabina (la tasa de supervivencia a 1 año fue de 18 % con gemcitabina vs. 2 % con 5-FU; P = 0,003).[1][Nivel de evidencia A1]
Evidencia (quimioterapia multifarmacológica):
- FOLFIRINOX (leucovorina, 5-FU, irinotecán y oxaliplatino) versus gemcitabina: en un ensayo multicéntrico de fase II/III, se incluyó a 342 pacientes con adenocarcinoma de páncreas metastásico con un puntaje de estado funcional del Eastern Cooperative Oncology Group de 0 a 1.[4][Nivel de evidencia A1] Los pacientes se asignaron al azar para recibir FOLFIRINOX (oxaliplatino [85 mg/m2], irinotecán [180 mg/m2], leucovorina [400 mg/m2] y 5-FU [400 mg/m2] administrado como bolo y seguido de 2400 mg/m2 administrados durante 46 horas como infusión continua, cada 2 semanas) o gemcitabina (1000 mg/m2 semanales durante 7 de 8 semanas y luego semanalmente durante 3 de 4 semanas).
- La mediana de supervivencia general (SG) fue de 11,1 meses en el grupo de FOLFIRINOX en comparación con 6,8 meses en el grupo de gemcitabina (cociente de riesgos instantáneos [CRI]de muerte = 0,57; intervalo de confianza (IC) 95 %, 0,45–0,73; P < 0,001).
- La mediana de supervivencia sin progresión (SSP) fue de 6,4 meses en el grupo de FOLFIRINOX y de 3,3 meses en el grupo de gemcitabina (CRIde progresión de la enfermedad0,47; intervalo de confianza (IC) 95 %, 0,37–0,59; P < 0,001).
- FOLFIRINOX fue más tóxico que la gemcitabina; 5,4 % de los pacientes de este grupo presentaron neutropenia febril. Al cabo de 6 meses, 31 % de los pacientes del grupo de FOLFIRINOX presentaron un deterioro definitivo de la calidad de vida en comparación con 66 % del grupo de gemcitabina (CRI, 0,47; IC 95 %, 0,30–0,70; P < 0,001).
- A partir de este ensayo, FOLFIRINOX se considera una opción de tratamiento estándar para los pacientes con cáncer de páncreas avanzado.
- NALIRIFOX (5-FU, sucrosofato de irinotecán [también llamado irinotecán nanoliposomal] y oxaliplatino) versus gemcitabina y nab-paclitaxel: en el estudio de fase III, multicéntrico, sin enmascaramiento NAPOLI 3 (NCT04083235) se incluyeron 770 pacientes con confirmación de adenocarcinoma ductal de páncreas que no habían recibido tratamiento para la enfermedad metastásica. Los pacientes se asignaron al azar en una proporción 1:1 para recibir NALIRIFOX (sucrosofato de irinotecán [50 mg/m2], oxaliplatino [60 mg/m2], leucovorina [400 mg/m2] y 5-FU [2400 mg/m2] como infusión intravenosa durante 46 horas los días 1 y 15 en ciclos de 28 días de duración) o nab-paclitaxel (125 mg/m2) y gemcitabina (1000 mg/m2 intravenosos los días 1, 8 y 15 en ciclos de 28 días de duración). El criterio principal de valoración fue la SG desde la aleatorización hasta la muerte por cualquier causa, para NALIRIFOX versus gemcitabina y nab-paclitaxel. Los criterios de valoración secundarios fueron la SSP y la tasa de respuesta general según RECIST versión 1.1.[5]
- La mediana de SG fue de 11,1 meses (IC 95 %, 10,0–12,1) en el grupo de NALIRIFOX y de 9,2 meses (IC 95 %, 8,3–10,6) en el grupo de nab-paclitaxel y gemcitabina (CRI, 0,83; IC 95 %, 0,7–0,99; P = 0,036). La mediana de seguimiento fue de 16,1 meses.[5][Nivel de evidencia A1]
- La mediana de SSP fue de 7,4 meses en el grupo de NALIRIFOX y de 5,6 meses en el grupo de nab-paclitaxel y gemcitabina (CRI, 0,69; IC 95 %, 0,58–0,83; P < 0,0001).
- La tasa de respuesta general fue del 42 % en el grupo de NALIRIFOX y del 36 % en el grupo de nab-paclitaxel y gemcitabina (P = 0,11). La mediana de duración de la respuesta fue de 7,3 meses en el grupo de NALIRIFOX y de 5 meses en el grupo de nab-paclitaxel y gemcitabina (CRI, 0,67; IC 95 %, 0,48–0,93).
- Se presentaron efectos adversos en 369 pacientes (>99 %) del grupo de NALIRIFOX y en 376 pacientes (99 %) del grupo de nab-paclitaxel y gemcitabina. Los efectos tóxicos de grado 3 o 4 más frecuentes en el grupo de NALIRIFOX fueron diarrea (20 %), hipopotasiemia (15 %), neutropenia (14 %) y náuseas (12 %). Los efectos tóxicos de grado 3 o 4 más frecuentes en el grupo de nab-paclitaxel y gemcitabina fueron neutropenia (25 %) y anemia (17 %). Cabe destacar, que los efectos tóxicos hematológicos (es decir, neutropenia, anemia y trombocitopenia) fueron más bajos en el grupo NALIRIFOX que en el grupo de nab-paclitaxel y gemcitabina. La neuropatía periférica se notificó en el 3 % de los pacientes del grupo de NALIRIFOX en comparación con el 6 % de los pacientes del grupo de gemcitabina y nab-paclitaxel.
De acuerdo a este ensayo, NALIRIFOX es una opción de tratamiento de primera línea estándar para los pacientes con cáncer de páncreas avanzado.
- Gemcitabina y nab-paclitaxel versus gemcitabina: un ensayo multicéntrico internacional de fase lll (NCT00844649) contó con la participación de 861 pacientes con adenocarcinomas pancreáticos metastásicos. Los pacientes tenían un estado funcional de Karnofsky de al menos 70 y no habían recibido tratamiento previo para la enfermedad metastásica.[6][Nivel de evidencia A1] Se excluyó a los pacientes que recibieron gemcitabina adyuvante o cualquier otra quimioterapia. A los pacientes se los asignó a recibir gemcitabina (1000 mg/m2) y nab-paclitaxel (125 mg/m2 de la superficie corporal) de forma semanal durante 3 de 4 semanas o gemcitabina como monoterapia (1000 mg/m2 semanalmente durante 7 de 8 semanas y luego de forma semanal durante 3 de 4 semanas).
- La mediana de SG fue de 8,5 meses en el grupo de nab-paclitaxel y gemcitabina en comparación con 6,7 meses en el grupo de gemcitabina (CRIde muerte 0,72; IC 95 %, 0,62–0,83; P < 0,001).
- La mediana de SSP fue de 5,5 meses en el grupo de nab-paclitaxel y gemcitabina y de 3,7 meses en el grupo de gemcitabina (CRIde progresión de la enfermedad 0,69; IC 95 %, 0,58–0,82; P < 0,001).
- El uso de nab-paclitaxel y gemcitabina fue más tóxico que el uso de la gemcitabina. Los efectos tóxicos de grado 3 más comunes en el grupo de nab-paclitaxel y gemcitabina fueron neutropenia (38 %), fatiga (17 %), y neuropatía (17 %); la neutropenia febril se presentó en 3 % de los pacientes. En el grupo de gemcitabina sola, los efectos tóxicos de grado 3 más comunes fueron neutropenia (27 %), fatiga (1 %) y neuropatía (1 %); la neutropenia febril se presentó en 1 % de los pacientes.
- En el grupo de nab-paclitaxel y gemcitabina, la mediana de tiempo desde la neuropatía de grado 3 a la neuropatía de grado 1 o su resolución fue de 29 días. De los pacientes con neuropatía periférica de grado 3, 44 % fueron aptos para reiniciar el tratamiento con una dosis reducida dentro de una mediana de 23 días desde el inicio de un episodio de grado 3.
- A partir de este ensayo el nab-paclitaxel y gemcitabina es una opción de tratamiento estándar para pacientes con cáncer de páncreas avanzado.
- Para este régimen no se midieron los datos de la calidad de vida, y el estudio no abordó la eficacia de nab-paclitaxel y gemcitabina versus FOLFIRINOX.
- Gemcitabina sola versus gemcitabina y erlotinib: el National Cancer Institute of Canada realizó un ensayo de fase III (CAN-NCIC-PA3 [NCT00026338]) en el que se comparó la gemcitabina sola con la combinación de gemcitabina y erlotinib (100 mg/d) para pacientes con carcinomas de páncreas avanzados o metastásicos.[7][Nivel de evidencia A1]
- La adición de erlotinib prolongó la supervivencia de forma moderada cuando se combinó con gemcitabina sola (CRI = 0,81; IC 95 %, 0,69–0,99; P = 0,038).
- La mediana de la tasa de supervivencia correspondiente para los pacientes que recibieron erlotinib fue de 6,2 meses en comparación con 5,9 meses para los pacientes que recibieron un placebo. La tasa de supervivencia a 1 año para los pacientes que recibieron erlotinib fue de 23 % en comparación con 17 % para aquellos que recibieron un placebo.
Evidencia (quimioterapia de segunda línea):
- Sucrosofato de irinotecán con 5-FU y leucovorina o sin estos: en el NAPOLI-1 trial (NCT01494506) se evaluó la función del sucrosofato de irinotecán para pacientes con cáncer de páncreas metastásico que ya se habían tratado con terapias que incluían gemcitabina.[8] El sucrosofato de irinotecán es una formulación encapsulada de irinotecán diseñada con el fin de aumentar las concentraciones intratumorales de irinotecán y su metabolito activo. En este estudio, 417 pacientes se asignaron al azar para recibir monoterapia con sucrosofato de irinotecán (120 mg/m2 cada 3 semanas; n = 151), 5-FU y leucovorina (n = 149), o sucrosofato de irinotecán (80 mg/m2 cada 2 semanas con 5-FU) y leucovorina (n = 117).[8][Nivel de evidencia B1]
- La mediana de SG fue de 6,1 meses (IC 95 %, 4,8–8,9) en los pacientes que recibieron sucrosofato de irinotecán con 5-FU y de 4,2 meses (IC 95 %, 3,6–4,9) en aquellos que recibieron 5-FU y leucovorina (P = 0,012). La mediana de SG fue de 4,9 meses (IC 95 %, 4,2–5,6) para los pacientes que recibieron monoterapia de sucrosofato de irinotecán en comparación con 4,2 meses (IC 95 %, 3,6–4,9) en aquellos que recibieron 5-FU y leucovorina (CRI no estratificado, 0,99; P = 0,94). En el análisis multivariante, el sucrosofato de irinotecán con 5-FU y leucovorina se relacionó con mejora de la SG (CRI, 0,58; IC 95 %, 0,42–0,81).
- Se presentaron efectos adversos de grado 3 o 4 con mayor frecuencia en los pacientes que recibieron sucrosofato de irinotecán con 5-FU y leucovorina, e incluyeron neutropenia (27 %), diarrea (13 %), vómito (11 %) y fatiga (14 %).
- A pesar de las diferencias de supervivencia y toxicidad entre los regímenes, la calidad de vida no fue significativamente diferente entre los grupos de tratamiento.
- No se ha establecido el beneficio de usar sucrosofato de irinotecán en lugar del irinotecán no encapsulado porque el régimen del grupo de control en este estudio incluyó 5-FU/leucovorina. Además, no está clara la utilidad de usar sucrosofato de irinotecán después de FOLFIRINOX en el entorno de primera línea.
- 5-FU, leucovorina y oxaliplatino (régimen OFF) versus el mejor cuidado médico de apoyo (MCA): la quimioterapia de segunda línea podría ser beneficiosa después de la progresión de la enfermedad durante un régimen con gemcitabina. Los investigadores del Charité Onkologie (CONKO)-003 asignaron al azar a los pacientes que necesitaban quimioterapia de segunda línea al régimen OFF o a MCA.[2]; [3][Nivel de evidencia C1] El régimen OFF consistió de leucovorina (200 mg/m2) seguida de 5-FU (2000 mg/m2 [infusión continua por 24 horas] los días 1, 8, 15 y 22) y oxaliplatino (85 mg/m2 los días 8 y 22). Luego de un descanso de 3 semanas, el ciclo siguiente comenzó el día 43. El ensayo se terminó de forma prematura debido a la falta de participantes y solo se asignó al azar a 46 pacientes al régimen OFF o a MCA.
- La mediana de supervivencia fue de 4,82 meses (IC 95 %, 4,29–5,35) para el tratamiento con el régimen OFF y de 2,30 meses (IC 95 %, 1,76–2,83) con MCA solo (CRI = 0,45; IC 95 %, 0,24–0,83).
- La mediana de SG fue de 9,09 meses para la secuencia de gemcitabina con el régimen OFF y de 7,90 meses para gemcitabina con el MCA.
- El cierre prematuro del estudio y la cantidad tan reducida de pacientes hicieron engañosos los valores de P. Por tanto, es posible que la quimioterapia de segunda línea con el régimen OFF se relacione de forma equivocada con una mayor supervivencia.
- FOLFOX (leucovorina, 5-FU y oxaliplatino) versus 5-FU y leucovorina después de quimioterapia con gemcitabina: en el ensayo multicéntrico prospectivo PANCREOXse incluyeron 108 pacientes con cáncer de páncreas avanzado ya tratados antes con quimioterapia de primera línea con gemcitabina. Los pacientes se asignaron al azar para recibir 5-FU y leucovorina con oxaliplatino (n = 54) o sin oxaliplatino (n = 54), administrado como FOLFOX-6 modificado (FOLFOX-6m).[9][Nivel de evidencia C1]
La meta de inscripción fue de 128 pacientes; el estudio se cerró de manera anticipada por una inscripción baja.
- Al cabo de una mediana de seguimiento de 8,8 meses, la mediana de SSP fue de 3,1 meses en el grupo de FOLFOX-6m y de 2,9 meses en el grupo de 5-FU administrado por infusión (CRI, 1,00; IC 95 %, 0,66–1,53, P = 0,989).
- La tasa de respuesta general y la calidad de vida no fueron significativamente diferentes en los dos grupos.
- La incidencia general de efectos adversos de grado 3/4 fue de 63 % en el grupo de FOLFOX-6m versus 11 % en el grupo de 5-FU y leucovorina. No obstante, más pacientes en el grupo de FOLFOX-6m se retiraron del estudio debido a los efectos adversos que los pacientes del grupo 5-FU y leucovorina (20 vs. 2 %).
- A partir de este estudio, no se observó beneficio de añadir oxaliplatino, administrado en el régimen FOLFOX-6m, versus 5-FU y leucovorina administrado por infusión en los pacientes con cáncer de páncreas avanzado después de la quimioterapia de primera línea con gemcitabina. Es posible que estos resultados indiquen que los regímenes con oxaliplatino para el cáncer de páncreas metastásico produzcan el mayor beneficio en el entorno de primera línea.
- Gemcitabina y paclitaxel versus gemcitabina después de fracaso del tratamiento o intolerancia a FOLFIRINOX: en el estudio de fase III, prospectivo, sin enmascaramiento GEMPAX (NCT03943667) se incluyeron 211 pacientes con cáncer de páncreas metastásico que progresó durante el tratamiento de primera línea con FOLFIRINOX (incluso tratamiento con FOLFIRINOX como terapia adyuvante) o en los 3 meses siguientes a la finalización del tratamiento. También se incluyeron aquellos que eran intolerantes a esta terapia. Los pacientes se asignaron al azar a uno los siguientes grupos de tratamiento:[10]
- Gemcitabina y paclitaxel: gemcitabina (1000 mg/m2) y paclitaxel con disolvente (80 mg/m2) los días 1, 8 y 15 en un ciclo de 28 días.
- Gemcitabina sola: gemcitabina (1000 mg/m2) los días 1, 8 y 15 en un ciclo de 29 días.
Se observaron los siguientes resultados:
- No hubo diferencias significativas en la SG de los pacientes que recibieron gemcitabina y paclitaxel (6,4 meses después de una mediana de seguimiento de 13,4 meses) o gemcitabina sola (5,9 meses después de 13,8 meses de seguimiento) (CRI, 0,87; IC 95 %, 0,63–1,20; P = 0,4095). Sin embargo, la SG mejoró en los siguientes subgrupos de pacientes que recibieron gemcitabina y paclitaxel: (1) pacientes de 65 años o menos (CRI, 0,66; IC 95 %, 0,44–0,99) y (2) pacientes con concentraciones de CA 19-9 de 59 veces el límite superior normal, o más elevadas, al inicio del estudio (CRI, 0,64; IC 95 %, 0,42–0,97).[10][Nivel de evidencia B1]
- La SSP fue de 3,1 meses en el grupo de gemcitabina y paclitaxel y de 2,0 meses en el grupo de gemcitabina sola (CRI, 0,64; IC 95 %, 0,47–0,89, P = 0,0067). La tasa de respuesta objetiva fue del 17,1 % en el grupo de gemcitabina y paclitaxel y del 4,2 % en el grupo de gemcitabina sola (P = 0,008).
- Se administraron terapias de tercera línea al 32,1 % de los pacientes en el grupo de gemcitabina y paclitaxel y al 46,5 % de los pacientes del grupo gemcitabina sola.
- La incidencia general de efectos adversos de grado 3 o superior relacionados con el tratamiento fue del 58 % en el grupo de gemcitabina y paclitaxel y del 27,1 % en el grupo de gemcitabina sola. En el grupo de gemcitabina y paclitaxel, el 13 % de los pacientes presentaron efectos adversos graves relacionados con el tratamiento, en comparación con el 7,1 % de los pacientes en el grupo de gemcitabina sola. Los efectos adversos de grado 3 o superior más frecuentes relacionados con el tratamiento entre los pacientes del grupo de gemcitabina y paclitaxel en comparación con los del grupo de gemcitabina sola fueron anemia (15,2 vs. 4,3 %), trombocitopenia (19,6 vs. 4,3 %), neutropenia (15,9 vs. 15,7 %), neuropatía periférica (12,3 vs. 0 %) y astenia (10,1 vs. 2,9 %). Hubo 1 efecto adverso de grado 5 relacionado con el tratamiento con gemcitabina y paclitaxel, que se atribuyó a disnea aguda.
- De acuerdo a este estudio, no se observaron beneficios en la SG con gemcitabina y paclitaxel en comparación con la gemcitabina sola. Sin embargo, hubo un beneficio en la SG de ciertos subgrupos (pacientes de 65 años o menos y pacientes con concentraciones elevadas de CA 19-9 al inicio del estudio). La SSP y la tasa de respuesta objetiva fueron significativamente más altas en el grupo de gemcitabina y paclitaxel. Por lo tanto, la combinación del tratamiento con gemcitabina y paclitaxel se puede considerar para los pacientes adecuados, teniendo en cuenta la tasa más alta de efectos adversos relacionados con el tratamiento.
Consideraciones especiales para los pacientes con variantes de la línea germinal en BRCA1/BRCA2
Las variantes germinales de BRCA1 o BRCA2 se presentan en un 4 % a un 8 % de los pacientes con adenocarcinoma de páncreas.[11,12] BRCA1/BRCA2 codifican las proteínas de la vía de reparación homóloga y de la reparación de rupturas del ADN bicatenario, por lo tanto quizás estos pacientes sean más sensibles a lesiones adicionales en el ADN. Los tumores de páncreas con variantes de BRCA1/BRCA2 exhiben mejores respuestas a las terapias a base de derivados del platino.[13] Se ha propuesto que la inhibición de la poli adenosina difosfato ribosa polimerasa (PARP) actúa de manera sinérgica con las variantes de BRCA1/BRCA2 mediante el bloqueo de la reparación de rupturas monocatenarias. Varios inhibidores de PARP se han aprobado para el tratamiento de pacientes de cáncer de ovario o de mama avanzado con mutaciones en BRCA1/BRCA2, y se están estudiando de manera activa para usarlos en el tratamiento de los pacientes con adenocarcinoma de páncreas con mutaciones en BRCA1/BRCA2.
Olaparib
La terapia de mantenimiento con olaparib (un inhibidor de PARP) a veces se considera para los pacientes con variantes germinales de BRCA1/BRCA2 y adenocarcinoma de páncreas metastásico que responden a la terapia de primera línea a base de derivados del platino durante más de 4 meses.
Evidencia (olaparib):
- Ensayo POLO [NCT02184195]: ensayo multicéntrico aleatorizado con enmascaramiento doble y controlado con placebo de fase III en el que participaron 154 pacientes con adenocarcinoma de páncreas metastásico con variantes de la línea germinal en BRCA1 o BRCA2 cuya enfermedad no progresó después de 16 semanas de quimioterapia de primera línea a base de derivados del platino.[14][Nivel de evidencia B1] Los pacientes se asignaron en una proporción de 3:2 a recibir olaparib (300 mg 2 veces al día) o placebo, y se evaluó la SSP.
- De los 3315 pacientes seleccionados, se identificaron 247 con variantes de la línea germinal en BRCA.
- La mediana de SSP fue de 7,4 meses en el grupo de olaparib y de 3,8 meses en el grupo de placebo (CRI, 0,53; 95% IC, 0,35‒0,82; P = 0,004).
- La mediana de SG fue de 18,9 meses en el grupo de olaparib y 18,1 meses en el grupo de placebo (CRI, 0,91; 95% IC, 0,56‒1,46; P = 0,68).
- Se presentaron más efectos adversos relacionados con el tratamiento de grado 3 y 4 con olaparib (40 %) en comparación con el placebo (23 %).
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Burris HA, Moore MJ, Andersen J, et al.: Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol 15 (6): 2403-13, 1997. [PUBMED Abstract]
- Pelzer U, Kubica K, Stieler J, et al.: A randomized trial in patients with gemcitabine refractory pancreatic cancer. Final results of the CONKO 003 study. [Abstract] J Clin Oncol 26 (Suppl 15): A-4508, 2008.
- Pelzer U, Schwaner I, Stieler J, et al.: Best supportive care (BSC) versus oxaliplatin, folinic acid and 5-fluorouracil (OFF) plus BSC in patients for second-line advanced pancreatic cancer: a phase III-study from the German CONKO-study group. Eur J Cancer 47 (11): 1676-81, 2011. [PUBMED Abstract]
- Conroy T, Desseigne F, Ychou M, et al.: FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med 364 (19): 1817-25, 2011. [PUBMED Abstract]
- Wainberg ZA, Melisi D, Macarulla T, et al.: NALIRIFOX versus nab-paclitaxel and gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma (NAPOLI 3): a randomised, open-label, phase 3 trial. Lancet 402 (10409): 1272-1281, 2023. [PUBMED Abstract]
- Von Hoff DD, Ervin T, Arena FP, et al.: Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med 369 (18): 1691-703, 2013. [PUBMED Abstract]
- Moore MJ, Goldstein D, Hamm J, et al.: Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 25 (15): 1960-6, 2007. [PUBMED Abstract]
- Wang-Gillam A, Li CP, Bodoky G, et al.: Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy (NAPOLI-1): a global, randomised, open-label, phase 3 trial. Lancet 387 (10018): 545-57, 2016. [PUBMED Abstract]
- Gill S, Ko YJ, Cripps C, et al.: PANCREOX: A Randomized Phase III Study of Fluorouracil/Leucovorin With or Without Oxaliplatin for Second-Line Advanced Pancreatic Cancer in Patients Who Have Received Gemcitabine-Based Chemotherapy. J Clin Oncol 34 (32): 3914-3920, 2016. [PUBMED Abstract]
- De La Fouchardière C, Malka D, Cropet C, et al.: Gemcitabine and Paclitaxel Versus Gemcitabine Alone After 5-Fluorouracil, Oxaliplatin, and Irinotecan in Metastatic Pancreatic Adenocarcinoma: A Randomized Phase III PRODIGE 65-UCGI 36-GEMPAX UNICANCER Study. J Clin Oncol 42 (9): 1055-1066, 2024. [PUBMED Abstract]
- Holter S, Borgida A, Dodd A, et al.: Germline BRCA Mutations in a Large Clinic-Based Cohort of Patients With Pancreatic Adenocarcinoma. J Clin Oncol 33 (28): 3124-9, 2015. [PUBMED Abstract]
- Cancer Genome Atlas Research Network. Electronic address: andrew_aguirre@dfci.harvard.edu, Cancer Genome Atlas Research Network: Integrated Genomic Characterization of Pancreatic Ductal Adenocarcinoma. Cancer Cell 32 (2): 185-203.e13, 2017. [PUBMED Abstract]
- Golan T, Kanji ZS, Epelbaum R, et al.: Overall survival and clinical characteristics of pancreatic cancer in BRCA mutation carriers. Br J Cancer 111 (6): 1132-8, 2014. [PUBMED Abstract]
- Golan T, Hammel P, Reni M, et al.: Maintenance Olaparib for Germline BRCA-Mutated Metastatic Pancreatic Cancer. N Engl J Med 381 (4): 317-327, 2019. [PUBMED Abstract]
Terapia paliativa
Las opciones de terapia paliativa para pacientes con cáncer de páncreas son las siguientes:
- Procedimientos de derivación quirúrgica paliativa, como la colocación endoscópica o radiológica de endoprótesis.[1,2]
- Procedimientos de radiación paliativa.
- Alivio del dolor mediante el bloqueo (percutáneo) nervioso del tronco celíaco o bloqueo intrapleural.[3]
- Otro tipo de cuidado médico paliativo solo.
Bibliografía
- Sohn TA, Lillemoe KD, Cameron JL, et al.: Surgical palliation of unresectable periampullary adenocarcinoma in the 1990s. J Am Coll Surg 188 (6): 658-66; discussion 666-9, 1999. [PUBMED Abstract]
- Baron TH: Expandable metal stents for the treatment of cancerous obstruction of the gastrointestinal tract. N Engl J Med 344 (22): 1681-7, 2001. [PUBMED Abstract]
- Polati E, Finco G, Gottin L, et al.: Prospective randomized double-blind trial of neurolytic coeliac plexus block in patients with pancreatic cancer. Br J Surg 85 (2): 199-201, 1998. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (03/21/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Información general sobre el cáncer de páncreas
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2025 (se citó a la American Cancer Society como referencia 1).
Tratamiento del cáncer de páncreas resecable o de resecabilidad limítrofe
Se revisó el texto sobre los resultados del ensayo de fase III, aleatorizado y sin enmascaramiento PRODIGE-24, en el que se asignaron al azar 493 pacientes con resecciones R0/R1 para recibir 6 ciclos de gemcitabina o 12 ciclos de FOLFIRINOX (oxaliplatino, leucovorina, irinotecán y fluorouracilo) (se citó a Conroy et al. como referencia 24).
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de páncreas en adultos. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de páncreas son:
- Amit Chowdhry, MD, PhD (University of Rochester Medical Center)
- Leon Pappas, MD, PhD (Massachusetts General Hospital)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de páncreas. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/pancreas/pro/tratamiento-pancreas-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.