Exámenes de detección del cáncer de seno (mama) (PDQ®)–Versión para profesionales de salud
Aspectos generales
Nota: En esta sección, se resume la evidencia científica publicada sobre la detección de este tipo de cáncer. En el resto del resumen, se describe la evidencia con más detalle.
También están disponibles otros resúmenes del PDQ relacionados:
La mamografía constituye la modalidad de examen de detección que más se usa para la detección del cáncer de mama. Hay evidencia de que disminuye la mortalidad por cáncer de mama en las mujeres de 50 a 69 años y que se relaciona con perjuicios; entre estos, la detección de cánceres que carecen de importancia clínica y que no ponen en peligro la vida del paciente (sobrediagnóstico). Es incierto el beneficio de la mamografía para las mujeres de 40 a 49 años.[1,2] En ensayos aleatorizados en India, Irán y Egipto, se analizó el uso del examen clínico de la mama (ECM) como examen de detección. En algunos de estos estudios, se indicó un cambio de la enfermedad en estadio tardío; sin embargo, todavía no hay suficiente evidencia para concluir que hay un beneficio con respecto a la mortalidad.[3-8] Se ha demostrado que el autoexamen de la mama no ofrece ningún beneficio con respecto a la mortalidad.
Se encuentran en evaluación técnicas como la ecografía, las imágenes por resonancia magnética y otras técnicas de imágenes moleculares de la mama que, a menudo, se usan para complementar la mamografía. Estas técnicas no son los instrumentos de detección primaria en la población general.
Tomar una decisión compartida con pleno conocimiento de causa, es algo que cada vez se recomienda más a las personas que contemplan someterse a un examen de detección del cáncer. Se han estudiado distintas formas de ofrecer ayuda para la toma de decisiones. Para obtener más información, consultar Aspectos generales de los exámenes de detección del cáncer.
Exámenes de detección con mamografía
Beneficios
Los ensayos clínicos controlados aleatorizados (ECA) que se iniciaron hace 50 años ofrecen evidencia de que la detección con mamografía reduce la mortalidad específica por cáncer de mama de las mujeres de 60 a 69 años (evidencia sólida) y las mujeres de 50 a 59 años (evidencia aceptable). En los estudios de población más recientes, se plantean dudas acerca del beneficio para las poblaciones que se someten a exámenes de detección durante períodos más prolongados.
Magnitud del efecto: a partir de un metanálisis de ECA, el número de mujeres que se necesita invitar a participar en los exámenes de detección para evitar una muerte por cáncer de mama depende de la edad de la mujer: entre 39 y 49 años, se necesitan 1904 mujeres (intervalo de confianza [IC], 95 %; 929–6378); entre 50 y 59 años, se necesitan 1339 mujeres (IC, 95 %; 322–7455); y entre 60 y 69 años, se necesitan 377 mujeres (IC, 95 %, 230–1050).[9]
- Diseño del estudio: ECA, evidencia poblacional.
- Validez interna: variable, pero el metanálisis de los ECA es bueno.
- Congruencia: deficiente.
- Validez externa: incierta.
La validez de los metanálisis de ECA que demuestran un beneficio para la mortalidad está limitada por los avances en las técnicas de diagnóstico por imágenes y tratamiento que se produjeron en las décadas posteriores a los ensayos. En el Canadian National Breast Screening Study (CNBSS) de 25 años de seguimiento,[10] que se completó en 2014, no se observó un beneficio de mortalidad relacionada con el uso de las mamografías de detección.
Perjuicios
A partir de una evidencia sólida, es posible que las mamografías de detección produzcan los siguientes perjuicios:
- Sobrediagnóstico y tratamiento resultante de cánceres insignificantes: algunos de los cánceres que se encuentran mediante los exámenes de detección amenazan la vida de la persona y otros no; no hay una forma definitiva de distinguir entre estos. Por lo tanto, los tratamientos estándar del cáncer, que incluyen cirugía, radiación, terapia endocrina, quimioterapia y terapias dirigidas al receptor HER2, se recomiendan en todos los casos, incluso para los pacientes que no se beneficiarán.
- Magnitud del efecto: entre el 20 % y el 50 % de los cánceres que se encuentran mediante los exámenes de detección representan sobrediagnósticos según la edad, la expectativa de vida y el tipo de tumor (carcinoma ductal in situ o invasivo).[11,12] Estos cálculos se basan en dos métodos analíticos imperfectos:[11,13]
- Diseño del estudio: ECA, comparaciones descriptivas de población, series de autopsias y series de muestras de reducción mamaria.
-
Resultados positivos falsos con pruebas adicionales y ansiedad.
- Magnitud del efecto: en los Estados Unidos, se vuelve a llamar a cerca del 10 % de las mujeres para que se sometan a pruebas adicionales después de un examen de detección. Sin embargo, solo el 0,5 % de las mujeres que lo hacen presentan cáncer. Por lo tanto, alrededor del 9,5 % de las mujeres tendrán una prueba con resultado positivo falso.[14,15] Cerca del 50 % de las mujeres que se someten a exámenes de detección anuales durante 10 años en los Estados Unidos obtienen un resultado positivo falso, y del 7 % al 17 % de estas mujeres se someterán a biopsias.[16,17] Es menos probable que se necesiten pruebas adicionales cuando se dispone de mamografías anteriores para hacer una comparación.
- Diseño del estudio: descriptivos y de población.
-
Resultados negativos falsos, con un falso sentido de seguridad y posible retraso en el diagnóstico de cáncer.
- Magnitud del efecto: la mamografía no detecta el cáncer de mama invasivo en el 6 % al 46 % de los exámenes de detección (resultado negativo falso). Es más probable que se obtenga un resultado negativo falso en los cánceres de tipo mucinoso y lobulillar, y en los tumores de intervalo de crecimiento rápido, los cuales se detectan en el lapso que hay entre mamografías que se hacen con regularidad y en las mamas densas, que son comunes en las mujeres jóvenes.[18-20]
- Diseño del estudio: descriptivos y de población.
- Cáncer de mama inducido por radiación: las mutaciones provocadas por la radiación se producen con dosis de radiación más altas que las que se utilizan en una sola mamografía; por lo tanto, es muy improbable que la exposición durante una mamografía típica de dos proyecciones cause cáncer.[21,22]
La validez interna, la congruencia y la validez externa son buenas para todas las conclusiones sobre los posibles perjuicios de los exámenes de detección con mamografía.
Examen clínico de la mama
Beneficios
En el ensayo CNBSS, no se estudió la eficacia del examen clínico de la mama (ECM) en comparación con la ausencia de exámenes de detección. Los ensayos aleatorizados en curso, dos en India y uno en Egipto, se diseñaron para evaluar la eficacia del ECM pero no se notificaron datos de mortalidad.[3-8] Por este motivo, aún no es posible evaluar la eficacia del ECM como método de detección.
- Magnitud del efecto: la evidencia actual es insuficiente para evaluar los beneficios y perjuicios adicionales del ECM. En el único ECA en el que se comparó el ECM de calidad alta con los exámenes de detección con mamografía se observó el mismo beneficio. La precisión en el entorno comunitario quizás sea menor que en el de los ECA.[3-6]
- Diseño del estudio: un solo ECA, estudios de cohortes de población.
- Validez interna: buena.
- Congruencia y validez externa: deficiente.
Perjuicios
Los exámenes de detección con ECM pueden tener los siguientes perjuicios:
-
Resultados positivos falsos con pruebas adicionales y ansiedad.
- Magnitud del efecto: la especificidad en las mujeres de 50 a 59 años fue del 88 % al 99 %, lo que dio lugar a una tasa de resultados positivos falsos del 1 % al 12 % para todas las mujeres que se sometieron a exámenes de detección.[23]
- Diseño del estudio: descriptivos y de población.
- Validez interna, congruencia y validez externa: buena.
-
Resultados negativos falsos con posible confirmación falsa y retraso en el diagnóstico de cáncer.
- Magnitud del efecto: de las mujeres con cáncer, entre el 17 % y el 43 % tiene un ECM que da resultado negativo. La sensibilidad es más alta con una duración más larga y una calidad más alta del examen cuando lo lleva a cabo personal capacitado.
- Diseño del estudio: descriptivos y de población.
- Validez interna y externa: buena.
- Congruencia: razonable.
Autoexamen de la mama
Beneficios
El autoexamen de la mama (AEM) se comparó con la ausencia de exámenes de detección y no se observó ningún beneficio para disminuir la mortalidad por cáncer de mama.
Perjuicios
A partir de evidencia sólida, la educación formal y la motivación para realizarse el AEM conduce a más biopsias de mama y más diagnósticos de lesiones de mama benignas.
- Magnitud de los efectos en los resultados de salud: la tasa de biopsia fue del 1,8 % en la población de estudio, en comparación con el 1,0 % en el grupo de control.[24]
- Diseño del estudio: dos ECA, estudios de cohortes.
- Validez interna: buena.
- Congruencia: razonable.
- Validez externa: deficiente.
Bibliografía
- Moss SM, Cuckle H, Evans A, et al.: Effect of mammographic screening from age 40 years on breast cancer mortality at 10 years' follow-up: a randomised controlled trial. Lancet 368 (9552): 2053-60, 2006. [PUBMED Abstract]
- Moss SM, Wale C, Smith R, et al.: Effect of mammographic screening from age 40 years on breast cancer mortality in the UK Age trial at 17 years' follow-up: a randomised controlled trial. Lancet Oncol 16 (9): 1123-32, 2015. [PUBMED Abstract]
- Hassan LM, Mahmoud N, Miller AB, et al.: Evaluation of effect of self-examination and physical examination on breast cancer. Breast 24 (4): 487-90, 2015. [PUBMED Abstract]
- Anderson BO, Bevers TB, Carlson RW: Clinical Breast Examination and Breast Cancer Screening Guideline. JAMA 315 (13): 1403-4, 2016. [PUBMED Abstract]
- Yen AM, Tsau HS, Fann JC, et al.: Population-Based Breast Cancer Screening With Risk-Based and Universal Mammography Screening Compared With Clinical Breast Examination: A Propensity Score Analysis of 1 429 890 Taiwanese Women. JAMA Oncol 2 (7): 915-21, 2016. [PUBMED Abstract]
- Myers ER, Moorman P, Gierisch JM, et al.: Benefits and Harms of Breast Cancer Screening: A Systematic Review. JAMA 314 (15): 1615-34, 2015. [PUBMED Abstract]
- Mittra I, Mishra GA, Singh S, et al.: A cluster randomized, controlled trial of breast and cervix cancer screening in Mumbai, India: methodology and interim results after three rounds of screening. Int J Cancer 126 (4): 976-84, 2010. [PUBMED Abstract]
- Sankaranarayanan R, Ramadas K, Thara S, et al.: Clinical breast examination: preliminary results from a cluster randomized controlled trial in India. J Natl Cancer Inst 103 (19): 1476-80, 2011. [PUBMED Abstract]
- Nelson HD, Tyne K, Naik A, et al.: Screening for breast cancer: an update for the U.S. Preventive Services Task Force. Ann Intern Med 151 (10): 727-37, W237-42, 2009. [PUBMED Abstract]
- Miller AB, Wall C, Baines CJ, et al.: Twenty five year follow-up for breast cancer incidence and mortality of the Canadian National Breast Screening Study: randomised screening trial. BMJ 348: g366, 2014. [PUBMED Abstract]
- Welch HG, Black WC: Overdiagnosis in cancer. J Natl Cancer Inst 102 (9): 605-13, 2010. [PUBMED Abstract]
- Bleyer A, Welch HG: Effect of three decades of screening mammography on breast-cancer incidence. N Engl J Med 367 (21): 1998-2005, 2012. [PUBMED Abstract]
- Yen MF, Tabár L, Vitak B, et al.: Quantifying the potential problem of overdiagnosis of ductal carcinoma in situ in breast cancer screening. Eur J Cancer 39 (12): 1746-54, 2003. [PUBMED Abstract]
- Jørgensen KJ, Gøtzsche PC: Overdiagnosis in publicly organised mammography screening programmes: systematic review of incidence trends. BMJ 339: b2587, 2009. [PUBMED Abstract]
- Rosenberg RD, Yankaskas BC, Abraham LA, et al.: Performance benchmarks for screening mammography. Radiology 241 (1): 55-66, 2006. [PUBMED Abstract]
- Elmore JG, Barton MB, Moceri VM, et al.: Ten-year risk of false positive screening mammograms and clinical breast examinations. N Engl J Med 338 (16): 1089-96, 1998. [PUBMED Abstract]
- Hubbard RA, Kerlikowske K, Flowers CI, et al.: Cumulative probability of false-positive recall or biopsy recommendation after 10 years of screening mammography: a cohort study. Ann Intern Med 155 (8): 481-92, 2011. [PUBMED Abstract]
- Rosenberg RD, Hunt WC, Williamson MR, et al.: Effects of age, breast density, ethnicity, and estrogen replacement therapy on screening mammographic sensitivity and cancer stage at diagnosis: review of 183,134 screening mammograms in Albuquerque, New Mexico. Radiology 209 (2): 511-8, 1998. [PUBMED Abstract]
- Kerlikowske K, Grady D, Barclay J, et al.: Likelihood ratios for modern screening mammography. Risk of breast cancer based on age and mammographic interpretation. JAMA 276 (1): 39-43, 1996. [PUBMED Abstract]
- Porter PL, El-Bastawissi AY, Mandelson MT, et al.: Breast tumor characteristics as predictors of mammographic detection: comparison of interval- and screen-detected cancers. J Natl Cancer Inst 91 (23): 2020-8, 1999. [PUBMED Abstract]
- Ronckers CM, Erdmann CA, Land CE: Radiation and breast cancer: a review of current evidence. Breast Cancer Res 7 (1): 21-32, 2005. [PUBMED Abstract]
- Goss PE, Sierra S: Current perspectives on radiation-induced breast cancer. J Clin Oncol 16 (1): 338-47, 1998. [PUBMED Abstract]
- Fenton JJ, Rolnick SJ, Harris EL, et al.: Specificity of clinical breast examination in community practice. J Gen Intern Med 22 (3): 332-7, 2007. [PUBMED Abstract]
- Thomas DB, Gao DL, Ray RM, et al.: Randomized trial of breast self-examination in Shanghai: final results. J Natl Cancer Inst 94 (19): 1445-57, 2002. [PUBMED Abstract]
- Semiglazov VF, Manikhas AG, Moiseenko VM, et al.: [Results of a prospective randomized investigation [Russia (St.Petersburg)/WHO] to evaluate the significance of self-examination for the early detection of breast cancer]. Vopr Onkol 49 (4): 434-41, 2003. [PUBMED Abstract]
Descripción de la evidencia
Incidencia del cáncer de mama y mortalidad
El cáncer de mama es el cáncer no cutáneo más común en las mujeres en los Estados Unidos, y se estima que durante 2025 se presentarán 316 950 casos de enfermedad invasiva, 59 080 casos de enfermedad in situ y 42 170 defunciones.[1] Las mujeres con riesgo hereditario, incluso las portadoras de mutaciones en los genes BRCA1 y BRCA2, representan alrededor del 5 % al 10 % de los casos de cáncer de mama.[2] Los hombres representan un 1 % de los casos de cáncer de mama y de las muertes por este tipo de cáncer.[1]
El factor de riesgo principal del cáncer de mama es ser mujer, seguido por la edad avanzada. Otros factores de riesgo se relacionan con aspectos hormonales (como menarquia, menopausia tardía, nuliparidad, primer embarazo tardío, y el uso de hormonoterapia posmenopáusica), el consumo de bebidas alcohólicas y la exposición a la radiación ionizante.
La incidencia del cáncer de mama es más alta en las mujeres blancas que en las mujeres negras que, además, tienen una tasa de supervivencia más baja en todos los estadios de la enfermedad.[3] Esta disparidad quizás refleje diferencias en la calidad de la detección, la oportunidad del seguimiento después de resultados anormales en los exámenes de detección, la calidad del tratamiento del cáncer de mama y el tipo tumoral.[4] Las mujeres hispanas, asiáticas o de las islas del Pacífico, y las indígenas de las Américas o nativas de Alaska tienen tasas de incidencia y mortalidad menores que las mujeres blancas o negras.[5]
La incidencia del cáncer de mama depende de aspectos vinculados a la reproducción (como el embarazo precoz o tardío, la multiparidad y la lactancia materna), la participación en los exámenes de detección y el uso de hormonas en la posmenopausia. Se observó un aumento considerable en la incidencia del cáncer de mama (en especial del carcinoma ductal in situ [CDIS]) después de la adopción generalizada de los exámenes de detección con mamografía en los Estados Unidos y en el Reino Unido.[6] El uso generalizado de la hormonoterapia posmenopáusica se relacionó con un aumento notable en la incidencia de cáncer de mama, una tendencia que se revirtió cuando disminuyó su uso.[7]
La adopción de los exámenes de detección no es seguida por una disminución en la incidencia de cáncer en estadio avanzado en ninguna población.
Evaluación de los síntomas mamarios
Las mujeres con síntomas de cáncer de mama se someten al diagnóstico por mamografía, en vez de la mamografía de detección, que se lleva a cabo con mujeres asintomáticas. En un estudio de 10 años de síntomas de cáncer de mama para los que se necesitó atención médica, una masa en la mama condujo a un diagnóstico de cáncer en el 10,7 % de los casos, mientras que el dolor se relacionó con el cáncer en solo el 1,8 % de los casos.[8]
Evaluación anatomopatológica del tejido mamario
Cáncer de mama invasivo
Es posible diagnosticar el cáncer de mama mediante la extracción de células de tejido mamario durante una biopsia para su estudio al microscopio. La anomalía en el tejido mamario se identifica en una muestra mediante un estudio de imágenes o al palparlo. Para las biopsias de mama se usa una jeringa con aguja fina (aspiración con aguja fina), una aguja gruesa (biopsia con aguja gruesa) o se extrae la muestra por escisión (biopsia por escisión). A veces se utilizan imágenes que mejoran la precisión. Mediante las biopsias con aguja se extraen muestras de un área anormal bastante grande que permiten realizar un diagnóstico. Las biopsias por escisión tienen como fin extirpar el área anormal por completo.
Carcinoma ductal in situ
El carcinoma ductal in situ (CDIS) es una afección no invasiva que se relaciona con el cáncer invasivo o evoluciona hasta convertirse en cáncer invasivo, con frecuencia y tiempo variables.[9] Algunos autores incluyen el CDIS en las estadísticas de cáncer de mama invasivo, pero otros argumentan que sería mejor que el término se reemplace por neoplasia intraepitelial ductal, de acuerdo con la terminología que se usa para designar las lesiones precursoras del cuello uterino y la próstata, y que se debe considerar la exclusión de estos casos de CDIS de las estadísticas de cáncer de mama.
El CDIS se diagnostica con más frecuencia mediante mamografía. En los Estados Unidos, solo 4900 mujeres recibieron un diagnóstico de CDIS en 1983 antes de la adopción de exámenes de detección con mamografía. En comparación, se anticipa que 59 080 mujeres recibirán este diagnóstico en 2025.[1,9,10] En el Canadian National Breast Screening Study-2 de mujeres de 50 a 59 años, se observó un aumento cuádruple de casos de CDIS en las mujeres que se sometieron al examen clínico de la mama (ECM) y la mamografía, en comparación con quienes se sometieron solo al ECM, sin diferencia en la mortalidad por cáncer de mama.[11] Para obtener más información, consultar Tratamiento del cáncer de seno (mama).
La evolución natural del CDIS no se entiende por completo porque casi todos los casos de CDIS se encuentran durante los exámenes de detección y casi todos se tratan. La presentación del cáncer de mama después del tratamiento del CDIS depende de las características patológicas de la lesión, así como del tratamiento que se administre. En un ensayo aleatorizado, se encontró que el 13,4 % de las mujeres con CDIS que se sometieron a una sola lumpectomía presentaron cáncer de mama invasivo ipsilateral en el término de 90 meses, en comparación con el 3,9 % de las mujeres tratadas con lumpectomía y radiación.[12] De las mujeres diagnosticadas con CDIS y que recibieron tratamiento, el porcentaje de mujeres que murieron por cáncer de mama es más bajo que el de la población general de la misma edad.[13,14] Es posible que este desenlace favorable refleje la naturaleza benigna de la afección, los beneficios del tratamiento o el efecto voluntario (es decir, las mujeres que se someten a exámenes de detección del cáncer de mama son, por lo general, más saludables que quienes no lo hacen).
Atipia
La atipia, que es un factor de riesgo de riesgo de cáncer de mama, se encuentra en el 4 % al 10 % de las biopsias de mama.[15,16] La atipia es una clasificación diagnóstica con una variación importante entre los anatomopatólogos.[17]
Variabilidad entre los diagnósticos de los anatomopatólogos en cuanto a la interpretación de las muestras de biopsia de mama.
El diagnóstico de los anatomopatólogos del tejido mamario abarca desde benigno sin atipia, atipia, CDIS y cáncer de mama invasivo. La incidencia de la atipia y el CDIS ha aumentado en las últimas tres décadas debido al uso generalizado de las mamografías, aunque la atipia suele estar oculta en las mamografías.[18,19] La clasificación incorrecta de las lesiones mamarias podría contribuir al exceso de tratamiento o a un tratamiento insuficiente de estas lesiones; en especial, con variabilidad en los diagnósticos de atipia y CDIS.[17,20-24]
En el estudio más grande sobre este tema, el estudio B-Path, participaron 115 anatomopatólogos en ejercicio de la profesión en los Estados Unidos que interpretaron una biopsia de mama de un solo corte histológico por caso; luego, se compararon sus interpretaciones con un diagnóstico de referencia derivado de un consenso de expertos.[17] Aunque el acuerdo general entre las interpretaciones individuales de los anatomopatólogos y los diagnósticos de referencia de los expertos fue más alta en los casos de carcinoma invasivo, hubo mucho menos acuerdo para las interpretaciones del CDIS y la atipia.[17] Dado que en el estudio B-Path se incluyó una mayor proporción de casos de atipia y CDIS que los que se suelen observar en la práctica clínica, los autores ampliaron su labor y aplicaron el teorema de Bayes para calcular la forma en que la variabilidad diagnóstica influye en la precisión desde el punto de vista de una mujer en los Estados Unidos de 50 a 59 años que se somete a una biopsia.[20] Para la población de los Estados Unidos, se calcula que el 92,3 % (intervalo de confianza [IC] 95 %, 91,4–93,1 %) de los diagnósticos de biopsia de mama serían verificados por un diagnóstico de referencia derivado del consenso de expertos; se calcula una sobreinterpretación del 4,6 % (IC 95 %, 3,9–5,3 %) y una subinterpretación de 3,2 % (IC 95 %, 2,7–3,6 %) de las biopsias de mama iniciales. En la Figura 1 se observan los desenlaces previstos, globales y por categoría diagnóstica, de 100 biopsias de mama.
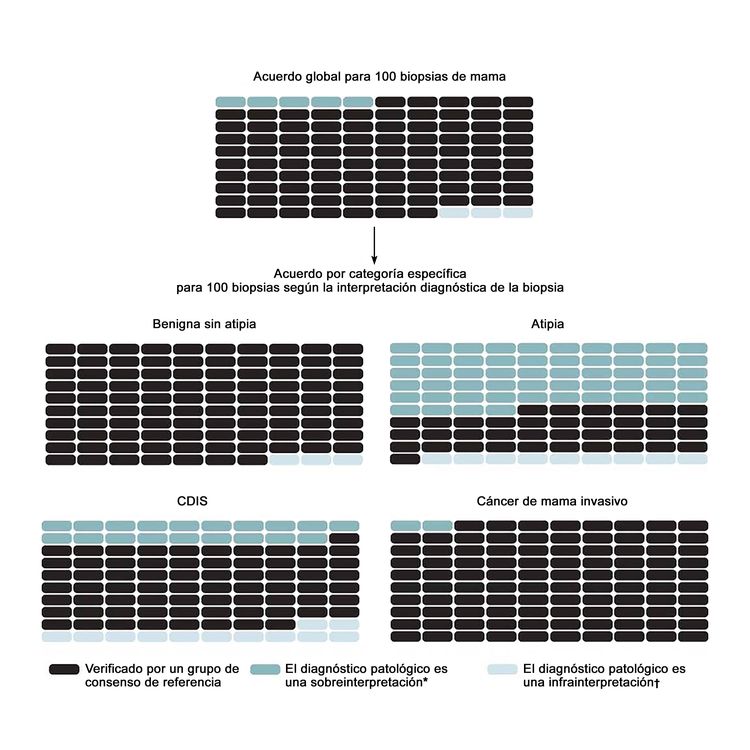
Para abordar las tasas altas de discordancia en el diagnóstico del tejido de mama, cada vez es más común que en las directrices de los laboratorios se exija una segunda opinión. En una encuesta nacional de 252 anatomopatólogos expertos en la mama que participaron en el estudio B-Path, se encontró que el 65 % de los encuestados informaron que contaban con una directriz del laboratorio que exige una segunda opinión para todos los diagnósticos iniciales de casos de enfermedad invasiva. Además, el 56 % de los encuestados informaron que contaban con directrices en las que se exige una segunda opinión para el diagnóstico inicial de CDIS, mientras que el 36 % informaron que la segunda opinión era obligatoria para los casos con diagnóstico inicial de hiperplasia ductal atípica.[25] En esta misma encuesta, el acuerdo entre los anatomopatólogos fue contundente en cuanto a la mayor exactitud del diagnóstico al obtener un segundo diagnóstico (96 %).
En un estudio de simulación para el que se emplearon datos del estudio B-Path, se evaluaron 12 estrategias para obtener segundas opiniones que mejoraran la interpretación de la histopatología mamaria.[26] La precisión mejoró de forma significativa en todas las estrategias que incorporaron una segunda opinión, salvo en el caso de estrategias que limitaron la segunda opinión solo a casos de cáncer invasivo. La precisión fue mayor con independencia de la confianza que tuvieran los anatomopatólogos en su propio diagnóstico o grado de experiencia. Aunque las segundas opiniones mejoraron la precisión, no se eliminó por completo la variabilidad diagnóstica; en particular, en el caso problemático de las muestras de tejido mamario con atipia.
Poblaciones especiales
Mujeres con mayor riesgo que tal vez se beneficien más de los exámenes de detección
Mujeres que exhiben las mutaciones genéticas BRCA1 y BRCA2
Las mujeres con aumento de riesgo de presentar cáncer de mama debido a una mutación genética BRCA1 o BRCA2 tal vez obtengan beneficio de someterse a más exámenes de detección. Para obtener más información, consultar el resumen en inglés BRCA1 and BRCA2: Cancer Risks and Management.
Mujeres sometidas a radiación torácica
Las mujeres con linfoma de Hodgkin y linfoma no Hodgkin que se trataron con irradiación dirigida al manto tienen un aumento de riesgo de cáncer de mama a partir de los 10 años posteriores al tratamiento y durante el resto de su vida. Por lo tanto, se promueve el uso de mamografías de detección, a pesar de que comience a una edad relativamente temprana.[27,28]
Mujeres negras
En los Estados Unidos, las mujeres que se autoidentifican como negras tienen un riesgo de por vida general de cáncer de mama más bajo que el riesgo de las mujeres blancas, aunque presentan una incidencia de cáncer de mama un poco más alta entre los 30 y 50 años de edad. Sin embargo, las mujeres negras tienen una mortalidad por cáncer de mama un 40 % más alta que las mujeres blancas, un hallazgo que se atribuye a varios factores, como demora en el seguimiento de mamografías con resultados anormales, diagnostico en un estadio más tardío, un tratamiento inferior del cáncer de mama y tipos tumorales de mayor malignidad.
Se encargó un estudio de modelización para informar las recomendaciones del 2024 sobre los exámenes de detección del cáncer de mama de la U.S. Preventive Services Task Force (USPSTF). En este estudio se usaron los seis modelos de la Cancer Intervention and Surveillance Modeling Network (CISNET) para evaluar los peligros y beneficios de la detección mamográfica comenzando a diferentes edades y frecuencias en la población de riesgo promedio de mujeres en los Estados Unidos en general, y para mujeres negras de manera específica. En los modelos se incorporaron datos específicos de raza en la incidencia de cáncer de mama, los subtipos tumorales, la distribución por estadios, la calidad y eficacia del tratamiento y la mortalidad. Debido a que los desenlaces de las mujeres negras con cáncer de mama son inferiores, con los modelos se encontró que las mujeres negras presentaron un poco más de beneficio absoluto (es decir, mayor número de muertes por cáncer de mama prevenidas) de la detección mamográfica en comparación con la población general.[29] Por ejemplo, con los modelos se estimó que la detección en 1000 mujeres de la población general cada 2 años entre los 50 y los 74 años (como se recomendaba en las directrices previas de la USPSTF) podría evitar un número estimado de 6,7 muertes por cáncer de mama, mientras que la detección bienal que comienza a los 40 años podría evitar 1,3 muertes por cáncer de mama adicionales. Entre las mujeres negras, la detección cada 2 años entre los 50 y 74 años de edad podría evitar un número estimado de 9,2 muertes por cáncer de mama por cada 1000 mujeres sometidas a detección, mientras que la detección bienal que comienza a los 40 años podría evitar 1,8 muertes por cáncer de mama adicionales. (Consultar el Cuadro 1).
En respuesta a estos hallazgos y con el fin de abordar las inequidades en los desenlaces del cáncer de mama, la USPSTF recomendó que todas las mujeres de riesgo promedio comiencen la detección a los 40 años (en lugar de 50 años, que era la recomendación anterior) y que continúen la detección cada 2 años hasta los 74 años. Si bien este abordaje quizás salve más vidas, con los modelos se demostró que la detección más temprana también aumenta la probabilidad de daño por la detección mamográfica. En la población general de mujeres, la detección bienal desde los 40 a los 74 años de edad, en lugar del intervalo de 50 a 74 años, podría conllevar 503 resultados positivos falsos adicionales, 65 biopsias adicionales y 2 sobrediagnósticos de cáncer de mama adicionales por cada 1000 mujeres sometidas a la detección. Entre las mujeres negras, de manera específica, la detección bienal comenzando a los 40 años, en lugar de los 50 años, podría conllevar 439 resultados positivos falsos adicionales, 75 biopsias adicionales y 2 sobrediagnósticos de cáncer de mama adicionales por cada 1000 mujeres sometidas a detección. (Consultar el Cuadro 1).
Aunque cada vez se usan más los modelos matemáticos para estimar los beneficios y daños de las mamografías, este método tiene varias limitaciones que se describen más adelante en este resumen. Las limitaciones abarcan la dependencia de los modelos en múltiples supuestos y su incapacidad de predecir e incorporar factores muy dinámicos como son el diagnóstico y tratamiento del cáncer de mama. Los supuestos y los métodos usados por los modelos matemáticos son difíciles de comprender para quienes no usan los modelos. Por lo tanto, quizás sea riesgoso basar decisiones de política en los hallazgos de modelos matemáticos. Además, como lo indicó la USPSTF, para abordar la mortalidad por cáncer de mama más alta en mujeres negras, se necesitan abordajes sistemáticos que se dirijan a las inequidades existentes en la calidad de la detección, los procesos diagnósticos y la calidad del tratamiento. No está claro si el inicio de la detección a una edad más temprana en la población general mejore los desenlaces en mujeres negras si no se establecen esfuerzos específicos dirigidos a las inequidades documentadas.
| Grupo de detección | Número de mamografías | Número de muertes por cáncer de mama evitadas | Número de resultados positivos falsos | Número de biopsias innecesarias | Número de sobrediagnósticos de cáncer de mama |
|---|---|---|---|---|---|
| CISNET = Cancer Intervention and Surveillance Modeling Network; USPSTF = U.S. Preventive Services Task Force. | |||||
| aAdaptación de Trentham-Dietz et al.[29] | |||||
| Todas las mujeres | |||||
| Edad 50–74 años (bienal) | 11 192 | 6,7 | 873 | 136 | 12 |
| Edad 40–74 años (bienal) | 16 116 | 8,2 | 1376 | 201 | 14 |
| Mujeres negras | |||||
| Edad 50–74 años (bienal) | 10 905 | 9,2 | 814 | 158 | 16 |
| Edad 40–74 años (bienal) | 15 801 | 10,7 | 1253 | 233 | 18 |
Personas que se benefician menos de los exámenes de detección
Mujeres con expectativa de vida limitada
Los beneficios potenciales de la mamografía de detección se presentan mucho después del examen, con frecuencia muchos años después, mientras que los perjuicios son inmediatos. En consecuencia, es posible que las mujeres con expectativa de vida limitada y comorbilidades sufran de perjuicios sin ningún beneficio. De todas formas, muchas de estas mujeres se someten a mamografías de detección.[30] En un estudio, alrededor del 9 % de las mujeres con cáncer avanzado se sometieron a exámenes de detección del cáncer.[31]
Mujeres de edad avanzada
Es posible que la mamografía de detección resulte en diagnósticos de cáncer en alrededor del 1 % de las mujeres de 66 a 79 años, pero la mayoría de estos cánceres son de riesgo bajo.[32] El interrogante es si el diagnóstico y el tratamiento del cáncer de mama localizado en mujeres de edad avanzada es beneficioso.
Mujeres jóvenes
No se ha comprobado el beneficio de la mamografía de detección en mujeres menores de 40 años con riesgo promedio.
Hombres
Alrededor del 1 % de todos los cánceres de mama se presenta en hombres.[33] La mayoría de los casos se diagnostica durante una evaluación de lesiones palpables que son, por lo general, fáciles de detectar. El tratamiento consiste en cirugía, radiación y hormonoterapia sistémica adyuvante o quimioterapia. Para obtener más información, consultar Tratamiento del cáncer de seno (mama) masculino. En esta población, es poco probable que los exámenes de detección ofrezcan beneficios.
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Kurian AW, Griffith KA, Hamilton AS, et al.: Genetic Testing and Counseling Among Patients With Newly Diagnosed Breast Cancer. JAMA 317 (5): 531-534, 2017. [PUBMED Abstract]
- Ellington TD, Henley SJ, Wilson RJ, et al.: Trends in breast cancer mortality by race/ethnicity, age, and US census region, United States─1999-2020. Cancer 129 (1): 32-38, 2023. [PUBMED Abstract]
- Jatoi I, Sung H, Jemal A: The Emergence of the Racial Disparity in U.S. Breast-Cancer Mortality. N Engl J Med 386 (25): 2349-2352, 2022. [PUBMED Abstract]
- Surveillance Research Program, National Cancer Institute: SEER*Explorer: An interactive website for SEER cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed December 30, 2024.
- Johnson A, Shekhdar J: Breast cancer incidence: what do the figures mean? J Eval Clin Pract 11 (1): 27-31, 2005. [PUBMED Abstract]
- Haas JS, Kaplan CP, Gerstenberger EP, et al.: Changes in the use of postmenopausal hormone therapy after the publication of clinical trial results. Ann Intern Med 140 (3): 184-8, 2004. [PUBMED Abstract]
- Barton MB, Elmore JG, Fletcher SW: Breast symptoms among women enrolled in a health maintenance organization: frequency, evaluation, and outcome. Ann Intern Med 130 (8): 651-7, 1999. [PUBMED Abstract]
- Allegra CJ, Aberle DR, Ganschow P, et al.: National Institutes of Health State-of-the-Science Conference statement: Diagnosis and Management of Ductal Carcinoma In Situ September 22-24, 2009. J Natl Cancer Inst 102 (3): 161-9, 2010. [PUBMED Abstract]
- Virnig BA, Tuttle TM, Shamliyan T, et al.: Ductal carcinoma in situ of the breast: a systematic review of incidence, treatment, and outcomes. J Natl Cancer Inst 102 (3): 170-8, 2010. [PUBMED Abstract]
- Miller AB, To T, Baines CJ, et al.: Canadian National Breast Screening Study-2: 13-year results of a randomized trial in women aged 50-59 years. J Natl Cancer Inst 92 (18): 1490-9, 2000. [PUBMED Abstract]
- Fisher B, Dignam J, Wolmark N, et al.: Lumpectomy and radiation therapy for the treatment of intraductal breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-17. J Clin Oncol 16 (2): 441-52, 1998. [PUBMED Abstract]
- Ernster VL, Barclay J, Kerlikowske K, et al.: Mortality among women with ductal carcinoma in situ of the breast in the population-based surveillance, epidemiology and end results program. Arch Intern Med 160 (7): 953-8, 2000. [PUBMED Abstract]
- Welch HG, Prorok PC, O'Malley AJ, et al.: Breast-Cancer Tumor Size, Overdiagnosis, and Mammography Screening Effectiveness. N Engl J Med 375 (15): 1438-1447, 2016. [PUBMED Abstract]
- Weaver DL, Rosenberg RD, Barlow WE, et al.: Pathologic findings from the Breast Cancer Surveillance Consortium: population-based outcomes in women undergoing biopsy after screening mammography. Cancer 106 (4): 732-42, 2006. [PUBMED Abstract]
- Rubin E, Visscher DW, Alexander RW, et al.: Proliferative disease and atypia in biopsies performed for nonpalpable lesions detected mammographically. Cancer 61 (10): 2077-82, 1988. [PUBMED Abstract]
- Elmore JG, Longton GM, Carney PA, et al.: Diagnostic concordance among pathologists interpreting breast biopsy specimens. JAMA 313 (11): 1122-32, 2015. [PUBMED Abstract]
- Bleyer A, Welch HG: Effect of three decades of screening mammography on breast-cancer incidence. N Engl J Med 367 (21): 1998-2005, 2012. [PUBMED Abstract]
- Hall FM: Identification, biopsy, and treatment of poorly understood premalignant, in situ, and indolent low-grade cancers: are we becoming victims of our own success? Radiology 254 (3): 655-9, 2010. [PUBMED Abstract]
- Elmore JG, Nelson HD, Pepe MS, et al.: Variability in Pathologists' Interpretations of Individual Breast Biopsy Slides: A Population Perspective. Ann Intern Med 164 (10): 649-55, 2016. [PUBMED Abstract]
- Rosai J: Borderline epithelial lesions of the breast. Am J Surg Pathol 15 (3): 209-21, 1991. [PUBMED Abstract]
- Schnitt SJ, Connolly JL, Tavassoli FA, et al.: Interobserver reproducibility in the diagnosis of ductal proliferative breast lesions using standardized criteria. Am J Surg Pathol 16 (12): 1133-43, 1992. [PUBMED Abstract]
- Wells WA, Carney PA, Eliassen MS, et al.: Statewide study of diagnostic agreement in breast pathology. J Natl Cancer Inst 90 (2): 142-5, 1998. [PUBMED Abstract]
- Della Mea V, Puglisi F, Bonzanini M, et al.: Fine-needle aspiration cytology of the breast: a preliminary report on telepathology through Internet multimedia electronic mail. Mod Pathol 10 (6): 636-41, 1997. [PUBMED Abstract]
- Geller BM, Nelson HD, Carney PA, et al.: Second opinion in breast pathology: policy, practice and perception. J Clin Pathol 67 (11): 955-60, 2014. [PUBMED Abstract]
- Elmore JG, Tosteson AN, Pepe MS, et al.: Evaluation of 12 strategies for obtaining second opinions to improve interpretation of breast histopathology: simulation study. BMJ 353: i3069, 2016. [PUBMED Abstract]
- Mariscotti G, Belli P, Bernardi D, et al.: Mammography and MRI for screening women who underwent chest radiation therapy (lymphoma survivors): recommendations for surveillance from the Italian College of Breast Radiologists by SIRM. Radiol Med 121 (11): 834-837, 2016. [PUBMED Abstract]
- Allen SD, Wallis MG, Cooke R, et al.: Radiologic features of breast cancer after mantle radiation therapy for Hodgkin disease: a study of 230 cases. Radiology 272 (1): 73-8, 2014. [PUBMED Abstract]
- Trentham-Dietz A, Chapman CH, Jayasekera J, et al.: Collaborative Modeling to Compare Different Breast Cancer Screening Strategies: A Decision Analysis for the US Preventive Services Task Force. JAMA 331 (22): 1947-1960, 2024. [PUBMED Abstract]
- Walter LC, Lindquist K, Covinsky KE: Relationship between health status and use of screening mammography and Papanicolaou smears among women older than 70 years of age. Ann Intern Med 140 (9): 681-8, 2004. [PUBMED Abstract]
- Sima CS, Panageas KS, Schrag D: Cancer screening among patients with advanced cancer. JAMA 304 (14): 1584-91, 2010. [PUBMED Abstract]
- Smith-Bindman R, Kerlikowske K, Gebretsadik T, et al.: Is screening mammography effective in elderly women? Am J Med 108 (2): 112-9, 2000. [PUBMED Abstract]
- Fentiman IS, Fourquet A, Hortobagyi GN: Male breast cancer. Lancet 367 (9510): 595-604, 2006. [PUBMED Abstract]
Mamografía
Descripción y antecedentes
Para la mamografía se usa radiación ionizante a fin de obtener imágenes del tejido mamario. El examen se lleva a cabo mediante la compresión firme de la mama entre dos placas; esta compresión despliega los tejidos superpuestos y reduce la cantidad de radiación necesaria para tomar la imagen. En los Estados Unidos, las pruebas se toman en proyecciones oblicuas mediolaterales y craneocaudales en los exámenes de detección de rutina.[1] Ambas proyecciones incluyen tejido mamario desde el pezón hasta el músculo pectoral. La exposición a la radiación es de 4 a 24 mSv por examen de detección estándar con dos proyecciones. Los exámenes con dos proyecciones tienen una tasa más baja de repetición que aquellos con una sola proyección, debido a que se presentan menos problemas de anomalías causadas por la superposición de las estructuras mamarias normales.[2] Los exámenes con dos proyecciones se relacionan con una tasa de cánceres de intervalos más baja que los exámenes con una sola proyección.[3]
Según la Mammography Quality Standards Act (MQSA), sancionada por el Congreso en 1992, todos los establecimientos que realicen mamografías en los Estados Unidos deben tener certificación de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) a fin de asegurar el empleo de personal entrenado y el uso de una técnica mamográfica estandarizada con dosis bajas de radiación.[4] (Consultar la información en inglés de la página de Internet de la FDA Mammography Facility Surveys, Mammography Equipment Evaluations, and Medical Physicist Qualification Requirement under MQSA). La MQSA Reauthorization Act de 1998 establece que los pacientes reciban un resumen escrito en lenguaje sencillo de los resultados de la mamografía.
Para notificar los resultados de las mamografías, se emplean las siguientes categorías del Breast Imaging Reporting and Data System (BI-RADS):[5]
- 0: hallazgo incompleto; se necesitan realizar evaluaciones adicionales de la imagen o mamografías anteriores para comparar.
- 1: hallazgo negativo; el riesgo de un diagnóstico de cáncer dentro de 1 año es del 1 %.
- 2: hallazgo benigno; el riesgo de un diagnóstico de cáncer dentro de 1 año es del 1 %.
- 3: hallazgo probablemente benigno; el riesgo de un diagnóstico de cáncer dentro de 1 año es del 2 %.
- 4: hallazgo sospechoso; el riesgo de un diagnóstico de cáncer dentro de 1 año es del 2–95 %.
- 4a: 2–10 %.
- 4b: 10–50 %.
- 4c: 50–95 %.
- 5: hallazgo altamente indicativo de neoplasia maligna; el riesgo de un diagnóstico de cáncer dentro de 1 año es del 95 %.
- 6: biopsia conocida; neoplasia maligna comprobada.
La mayoría de las mamografías de detección se interpretan como negativas o benignas (BI-RADS 1 o 2, respectivamente); a alrededor del 10 % de las mujeres en los Estados Unidos se les pide que regresen para una evaluación adicional.[6] El porcentaje de mujeres a las que se les pide que regresen para una evaluación adicional varía no solo por las características particulares de cada mujer sino, también, por el establecimiento radiológico y el radiólogo.
La detección tumoral no se ha validado como un criterio indirecto de validación propiamente dicho para la mortalidad por cáncer de mama, y los nuevos métodos de detección que tan solo aumentan las tasas de detección quizás no se traduzcan en una reducción del riesgo de morir por cáncer de mama. No obstante, hay numerosos estudios que demuestran mejoras en las tasas de detección de tumores de mama mediante técnicas de imagen modernas, sin datos de mortalidad. Entre 1963 y 1990, la mamografía de detección se evaluó en 9 ensayos aleatorizados; la mortalidad específica por cáncer de mama fue el criterio principal de valoración y las recomendaciones para la mamografía de detección se hicieron teniendo en cuenta en gran medida los resultados de estos ensayos. Sin embargo, en los últimos años, nuevas tecnologías para la detección del cáncer de mama a menudo se han evaluado en ensayos clínicos y estudios de observación con criterios de valoración que no se validaron como medidas alternativas de desenlace adecuadas para la mortalidad por cáncer de mama.[7]
En una revisión sistemática de estudios con datos de 488 099 pacientes se comparó la tomosíntesis digital de mama (TDM) sola, la TDM combinada con mamografía digital (MD) y la MD sola. La TDM sola y la combinada con MD fueron más sensibles que la MD sola para la detección del cáncer de mama, pero no se encontraron diferencias significativas en la exactitud diagnóstica entre la TDM sola y la combinación de TDM y MD. Los resultados de una revisión sistemática y metanálisis posteriores apoyan el uso de la mamografía bidimensional sintetizada (S2D) combinada con TDM en lugar de la MD para la detección del cáncer de mama, debido a que la combinación de S2D y TDM mejora las tasas de detección del tumor y reducen las tasas de retornos, la dosis de radiación y los costos en general.[7-9]
Mamografía digital y detección asistida por computadora
La MD es más costosa que la mamografía con película radiográfica (MPR), pero es más fácil gestionar su almacenamiento e intercambio de datos. En varios ensayos se compararon directamente la MPR con la MD para determinar la tasa de detección del cáncer, la sensibilidad, la especificidad y el valor predictivo positivo (VPP); los ensayos produjeron resultados similares en la mayoría de los grupos de pacientes.
En el Digital Mammographic Imaging Screening Trial (DMIST) se compararon los hallazgos de MD y MPR de 42 760 mujeres en 33 centros de los Estados Unidos. Aunque con la MD se detectaron más cánceres en mujeres menores de 50 años (área bajo la curva [ABC] de 0,84 +/- 0,03 con MD; ABC de 0,69 +/- 0,05 con película radiográfica; P = 0,002), no hubo diferencias en la detección del cáncer de mama en general.[10] En un segundo informe del DMIST se encontró que, en las mujeres de 65 años y más, la tendencia de ABC fue más alta con el uso de la MPR que con la MD.[11]
En otro estudio de cohortes grande en los Estados Unidos [12] también se encontró que, en las mujeres menores de 50 años, la sensibilidad fue un poco más alta con la mamografía de película radiográfica, pero la especificidad fue la misma.
En un estudio neerlandés se compararon los hallazgos de 1,5 millones de MD con 4,5 millones de MPR que se realizaron entre 2004 y 2010. Se observaron tasas más altas de repetición y de detección de cáncer con el uso de pantallas digitales.[13] En un metanálisis [14] de 10 estudios, incluso el DMIST [10,11] y el estudio de cohortes en los Estados Unidos,[12] se comparó el uso de MD y MPR en 82 573 mujeres que se sometieron a ambos tipos de exámenes. En un modelo de efectos aleatorios, no hubo diferencia con significación estadística entre los dos tipos de mamografía (ABC de 0,92 con MPR; ABC de 0,91 con MD) para la detección del cáncer. En todos los estudios se encontró que, en las mujeres menores de 50 años, la sensibilidad fue más alta con la MD, pero la especificidad fue la misma o más alta con la mamografía con película radiográfica.
Los sistemas de detección asistida por computadora (CAD) destacan regiones sospechosas como las microcalcificaciones en racimo y masas,[15] que en general aumentan la sensibilidad, disminuyen la especificidad,[16] y aumentan la detección de carcinoma ductal in situ (CDIS).[17] Hay varios sistemas de CAD en uso. En un estudio grande de población, en el que se compararon las tasas de repetición y las tasas de detección del cáncer de mama antes y después de la adopción de los sistemas de CAD, se encontró que no hubo cambio en ninguna de las tasas.[15,18] En otro estudio grande, se notó un aumento en la tasa de repetición y detección del CDIS, pero ninguna mejoría en la tasa de detección del cáncer invasivo.[17,19] En otro estudio para el que se usó una base de datos grande y MD de mujeres de 40 a 89 años, se halló que la CAD no mejoró la sensibilidad, la especificidad ni la detección de los cánceres de intervalo, pero detectó más CDIS.[20]
A partir de la base de datos del Surveillance, Epidemiology, and End Results (SEER) vinculada a Medicare, se analizó el uso de nuevas modalidades de exámenes de detección por mamografía en más de 270 000 mujeres de 65 años o más en dos períodos: de 2001 a 2002 y de 2008 a 2009. La MD aumentó del 2 % al 30 %, la CAD aumentó del 3 % al 33 % y los gastos se incrementaron de $660 a $962 millones de dólares. La CAD se utilizó en el 74 % de los exámenes de detección por mamografía que pagó Medicare en 2008, casi el doble de las mamografías de detección de 2004. No hubo diferencia en las tasas de detección de tumores en estadio temprano (CDIS o estadio I) ni en estadio avanzado (estadio IV).[21]
Tomosíntesis digital de mama
La TDM es una técnica mamográfica aprobada por la FDA (abril 2018).[22] Al igual que la mamografía estándar, la TDM comprime la mama y usa rayos X para crear imágenes. En la TDM, un tubo de rayos X se mueve en un arco alrededor de la mama comprimida, y se obtienen múltiples imágenes desde diferentes ángulos, que una computadora luego reconstruye o sintetiza en un conjunto de imágenes tridimensionales. Algunos cánceres se observan mejor con este método que con la MD convencional o la ecografía.
En corto tiempo la TDM se ha vuelto un método importante de detección del cáncer de mama en los Estados Unidos, en especial en las regiones de ingresos más altos con predominio de población blanca. El uso de TDM para la detección del cáncer de mama aumentó del 13 % en 2015 al 40 % en 2017.[23] Entre los centros para la detección, en el 73 % de ellos se notifica ahora el uso de TDM.[22]
Con los datos de observación de ocho centros de detección en Vermont se compararon los hallazgos de 86 379 TDM y 97 378 MD de campo completo realizados entre 2012 y 2016. Se incluyeron mujeres sin antecedentes de cáncer de mama o implantes mamarios. La información demográfica y de factores de riesgo se obtuvo por cuestionario; el informe patológico de todas las biopsias se obtuvo a través del Vermont Breast Cancer Surveillance System. La tasa de recuperación fue menor con la TDM que con la MD (7,9 vs. 10,9 %; oportunidad relativa [OR], 0,81; intervalo de confianza [IC] 95 %, 0,77–0,85), pero no hubo diferencias en las tasas de biopsia o la detección de enfermedad benigna o maligna.[24]
El Oslo Tomosynthesis Screening Trial se llevó a cabo entre noviembre de 2010 y diciembre de 2012 e incluyó a 24 301 mujeres con 281 cánceres. En el ensayo se comparó la sensibilidad de la MD, la MD con TDM y la MD con detección asistida por computadora (CAD), además se comparó la sensibilidad de la MD con TDM y la mamografía bidimensional sintetizada con TDM. Los investigadores notificaron que la TDM con la MD detectó más cánceres de mama que la MD sola (230 vs. 177, un aumento relativo del 22,7 % [IC 95 %, 17–28,6 %]). En el ensayo también se notificaron menos hallazgos falsos positivos con la TDM y MD en comparación con la MD sola (2081 vs. 2466, una disminución relativa del 0,8 % [IC 95 %, -1,03 a -0,57]), excepto en las mujeres con mamas muy densas.[25] La diferencia entre la CAD con MD y la MD sola no fue estadísticamente significativa.
En el Tomosynthesis Trial en Bergen (To-Be) se compararon la TDM y mamografía sintetizada (MS) con la MD convencional en exámenes de detección poblacionales. Se invitó a participar a todas las mujeres de 50 a 69 años que se sometieron a un examen de detección en Bergen, Noruega. El examen de detección se realizó con TDM de dos proyecciones y MS o con MD convencional de dos proyecciones. Un grupo de 8 radiólogos realizó, de manera independiente, una doble lectura de las mamografías de detección. En los resultados provisionales del primer año del ensayo se observó lo siguiente:[26]
- Tiempo de interpretación más largo para la TDM con MS (71 vs. 41 segundos).
- Dosis de radiación glandular media equivalente.
- Tasa de repeticiones general más baja para TDM con MS (3,6 vs. 3,0 %), a pesar de una tasa de repeticiones equivalente en las mujeres con mamas densas (3,6 %).
Los resultados del criterio principal de valoración se publicaron más tarde.[27] Los autores propusieron explicaciones para las diferencias entre estos resultados y los de estudios anteriores. En primer lugar, la MS quizás produzca imágenes de calidad inferior si se la compara con la MD convencional, incluso una visualización deficiente de las microcalcificaciones. En segundo lugar, los 8 radiólogos tenían una amplia variación en cuanto a la experiencia (de 0 a 19 años) en la lectura de imágenes en pantalla o de MD con TDM en exámenes de detección de cáncer de mama poblacionales.
En otro estudio se usaron 3 modelos diferentes de cáncer de mama de la Red de Modelos de Intervención y Vigilancia del Cáncer (CISNET) y se incorporaron los datos de desempeño de la detección con TDM a los modelos para determinar el costo y los beneficios de la TDM versus la MD. En el estudio se concluyó que el uso de la TDM en lugar de la MD reduce los falsos positivos y las tasas de repetición y se previó que reducirá las muertes por cáncer de mama (0–0,21 muertes cada 1000 mujeres) y aumentará los años de vida ajustados por la calidad (AVAC) (1,97–3,27 cada 1000 mujeres). Sin embargo, estas mejoras fueron por lo general pequeñas y se vincularon con costos altos en relación con los beneficios: las relaciones de costo-eficacia oscilaron de $195 026 a $270 135 por AVAC ganado. Estos son más altos que los umbrales por lo común aceptados de $50 000 a $150 000 por AVAC.[28]
Una limitación importante de los estudios disponibles y del modelado estadístico es la falta de evidencia de la significación clínica de los cánceres de mama adicionales detectados con la TDM (con MD o sin esta) en comparación con la MD sola. Se desconoce hasta qué punto la TDM contribuye al sobrediagnóstico de lesiones que no ponen en riesgo la vida o lesiones que se habrían detectado en una mujer asintomática en una futura MD. Hasta ahora, no hay estudios sobre la TDM que muestren una disminución de la enfermedad metastásica u otra enfermedad en la etapa tardía.
Se espera que 5 ensayos controlados aleatorizados en curso, realizados en Europa, el Reino Unido y los Estados Unidos, con una inscripción de 430 000 mujeres en total, proporcionen información sobre los desenlaces clínicos del cáncer de mama de los exámenes de detección mamográficos con TDM en comparación con la MD.[25,29]
En el ensayo aleatorizado TOSYMA se evaluó la TDM con mamografía sintetizada versus la mamografía de detección digital sola para la detección del cáncer de mama. Los criterios principales de valoración fueron la detección del cáncer de mama invasivo y la tasa de detección del cáncer de intervalo invasivo a 24 meses. Sin embargo, ninguno de estos criterios de valoración se validaron como medidas alternativas de desenlace adecuadas para la mortalidad. Es posible que la detección de un mayor número de cánceres en etapa temprana no confiera ningún beneficio en la mortalidad, ya que muchos de estos cánceres pueden no progresar o hacerlo de forma tan lenta que no representan una amenaza para la vida del paciente (es decir, producen un sobrediagnóstico). Además, si la detección de cánceres que no ponen en riesgo la vida aumenta de manera sustancial, las tasas de detección de cáncer de intervalo quizás disminuyan sin que haya una reducción posterior de la mortalidad.[7]
En un estudio de cohorte en el que se comparó la TDM con la MD se observó que ninguna de las dos modalidades se relacionaba con una diferencia significativa en el riesgo de cáncer de intervalo invasivo. Sin embargo, la TDM se vinculó con un riesgo significativamente menor de cáncer de mama avanzado entre las mujeres con mamas muy densas con riesgo alto de desarrollar cáncer de mama.[30] Quizás este tema se esclarezca en el Tomosynthesis Mammographic Imaging Screening Trial (TMIST), que está en curso. En este ensayo las mujeres se asignan de manera aleatoria a estudios de imágenes mamarias digitales estándar o a TDM, y el criterio principal de valoración es la tasa de cánceres avanzados, un criterio de valoración mixto que incluye la metástasis a distancia.
Características de los cánceres identificados mediante imágenes de mama
Con independencia del estadio, el estado ganglionar y el tamaño tumoral, los cánceres identificados con exámenes de detección tuvieron un mejor pronóstico que los que no se diagnosticaron mediante exámenes de detección.[2] Esto parece indicar que, desde el punto de vista biológico, son menos mortales (quizás de crecimiento más lento y con menos probabilidad de invasión local o metástasis). Esto es congruente con el efecto de sesgo de duración relacionado con los exámenes de detección. O sea, que es más probable que con los exámenes de detección se diagnostiquen cánceres de mama de escasa malignidad (es decir, de crecimiento lento), mientras que los cánceres más malignos se diagnostican en los intervalos entre los exámenes de detección.
En un estudio de seguimiento a 10 años de 1983 mujeres finlandesas con cáncer de mama invasivo, se demostró que el método de detección del cáncer es una variable pronóstica independiente. Cuando se controlaron por edad, compromiso ganglionar y tamaño tumoral, los cánceres identificados con exámenes de detección tuvieron un riesgo más bajo de recaída y una mejor supervivencia general. Para las mujeres cuyos cánceres se identificaron sin exámenes de detección, el cociente de riesgos instantáneos (CRI) de muerte fue de 1,90 (IC 95 %, 1,15–3,11), a pesar de que era más probable que hubieran recibido tratamiento sistémico adyuvante.[31]
De igual modo, en un análisis de cánceres de mama en tres ensayos aleatorizados de exámenes de detección (Health Insurance Plan, National Breast Screening Study [NBSS]-1, y NBSS-2), se tuvo en cuenta el estadio, el estado ganglionar y el tamaño del tumor; se determinó que las pacientes cuyo cáncer se identificó con exámenes de detección tuvieron un pronóstico más favorable. Los riesgos relativos (RR) de muerte fueron de 1,53 (IC 95 %, 1,17–2,00) para cánceres de intervalo y nuevos, en comparación con cánceres que se identificaron con exámenes de detección, y de 1,36 (IC 95 %, 1,10–1,68) para los cánceres en el grupo de control, en comparación con los cánceres que se identificaron con exámenes de detección.[32]
En un tercer estudio, se compararon los desenlaces de 5604 mujeres inglesas con cánceres de mama que se identificaron entre 1998 y 2003 mediante el diagnóstico por exámenes de detección o el diagnóstico sintomático. Tras realizar ajustes de control por el tamaño del tumor, el estado ganglionar y la edad de la paciente, los investigadores hallaron que les fue mejor a las mujeres con cánceres identificados mediante exámenes de detección. El CRI de supervivencia de las mujeres sintomáticas fue de 0,79 (IC 95 %, 0,63–0,99).[31,33]
Los hallazgos de estos estudios también son congruentes con la evidencia que indica que algunos cánceres que se identifican con exámenes de detección son de riesgo bajo y reflejan un sobrediagnóstico.
Concepto de sesgos en los exámenes de detección
En varios ensayos no controlados y series retrospectivas, se documentó la capacidad de la mamografía de diagnosticar cánceres de mama pequeños en estadio temprano que tienen una evolución clínica favorable.[34] Las personas cuyo cáncer se encuentra durante los exámenes de detección presentan tasas de supervivencia más altas que las personas con cáncer que no se encontró durante los exámenes de detección, aunque la detección no haya prolongado la vida de nadie. Este concepto se explica mediante cuatro tipos de sesgo estadístico.
- Sesgo de anticipación diagnóstica: identificación temprana del cáncer mediante exámenes de detección antes que la detección por la presentación de síntomas; no hace más que adelantar la fecha del diagnóstico. La detección y el tratamiento tempranos no alteran la progresión natural de la enfermedad. La tasa de supervivencia a 5 años desde el momento del diagnóstico es más alta cuando el cáncer se encuentra temprano, aunque la detección precoz no haga ninguna diferencia en la cantidad de tiempo que vive la persona.
- Sesgo de duración: identificación por mamografía de detección de cánceres de crecimiento lento que tiene un pronóstico más favorable que el cáncer que se presenta en la clínica (detectado por el médico o la persona cuando se enferma). Agrupar estos cánceres sin progresión con los cánceres potencialmente mortales (cuyo tratamiento temprano no influye en el desenlace) aumenta la tasa de supervivencia a 5 años, aunque los exámenes de detección no producen ninguna diferencia en la cantidad de vidas que se salvan.
- Sesgo de sobrediagnóstico: identificación por mamografía de detección de cánceres que nunca causarían síntomas o la muerte, pero aumentan las tasas de supervivencia sin cambiar el tiempo de vida.
- Sesgo de voluntarias sanas: participación de voluntarias en los exámenes de detección que quizás sean las más sanas y más preocupadas por su salud en la población general. En consecuencia, los desenlaces serán mejores que los de las mujeres que no son sanas ni se preocupan por su salud, con independencia de los beneficios del diagnóstico temprano. En un estudio, se observó que las mujeres que aceptan someterse a exámenes de detección están más preocupadas por la salud, tienen mejor acceso a los servicios de atención de la salud y forman parte de un grupo con tasas de mortalidad más bajas por causas distintas al cáncer de mama.[35]
No se conoce la repercusión de estos sesgos. Se necesita un nuevo ensayo controlado aleatorizado (ECA) con un criterio de valoración de mortalidad por causa específica para determinar el beneficio de supervivencia y la repercusión de los sesgos relacionados con el sobrediagnóstico, la anticipación diagnóstica, la duración y las voluntarias sanas. No es posible lograr esto. La aleatorización de pacientes a grupos que se someten a exámenes de detección y que no se someten a estos sería contraria a la ética; además se necesitaría un seguimiento mínimo de tres décadas, tiempo durante el cual los cambios en los tratamientos y las técnicas de obtención de imágenes quitarían validez a los resultados. Por ende, las decisiones se deben fundamentar en los ECA disponibles, a pesar de sus limitaciones, y en estudios ecológicos o de cohortes con grupos de control adecuados y ajuste por variables de confusión. Para obtener más información, consultar Aspectos generales de los exámenes de detección del cáncer.
Evaluación de la eficacia y la precisión
Los parámetros de eficacia de los exámenes de detección con mamografía en los Estados Unidos se describen en inglés en la página de Internet del Breast Cancer Surveillance Consortium (BCSC). Para obtener más información, consultar Aspectos generales de los exámenes de detección del cáncer.
Sensibilidad
La sensibilidad de la mamografía se mide según el porcentaje de mujeres con cáncer de mama que se identifican mediante los exámenes de detección con mamografía. La sensibilidad depende del tamaño del tumor, el grado de visibilidad del tumor, la sensibilidad hormonal, la densidad del tejido mamario, la edad de la paciente, la etapa del ciclo menstrual, la calidad general de la imagen y la habilidad de interpretación del radiólogo. La sensibilidad general es de alrededor del 79 %, pero es más baja en las mujeres más jóvenes y en aquellas con tejido mamario denso (consultar la información en inglés del portal de Internet del BCSC).[36-38] La sensibilidad no equivale al beneficio ya que algunas mujeres que podrían tener cáncer de mama se ven perjudicadas por el sobrediagnóstico. De acuerdo con la Physician's Insurance Association of America (PIAA), la demora en el diagnóstico del cáncer de mama y los errores de diagnóstico son causas comunes de litigio por negligencia médica. En los datos de la PIAA de 2002 a 2011, se destaca que las indemnizaciones más altas por demandas relacionadas con el cáncer de mama se deben a errores de diagnóstico.[39]
Tasa de especificidad y de positivos falsos
La especificidad de la mamografía se mide según el porcentaje total de mujeres sin cáncer de mama que obtienen resultados negativos en los exámenes de detección con mamografía. La tasa de positivos falsos es la probabilidad de que la prueba tenga un resultado positivo en mujeres sin cáncer de mama. La especificidad baja junto con una tasa de positivos falsos alta dan lugar a exámenes y procedimientos de seguimiento innecesarios. Debido a que la especificidad tiene como denominador a todas las mujeres sin cáncer, el número de positivos falsos es muy alto en términos absolutos, aunque el porcentaje sea bajo. Por lo tanto, para los exámenes de detección, una especificidad satisfactoria debe ser muy alta. Incluso el 95 % de especificidad es bastante bajo para un examen de detección.
Cánceres de intervalos
Los cánceres de intervalos son cánceres que se diagnostican en el intervalo entre un examen de detección normal y la fecha anticipada de la siguiente mamografía de detección. En un estudio, se encontró que los cánceres de intervalo se presentaron con mayor frecuencia en mujeres menores de 50 años con características histológicas mucinosas o lobulillares, grado histológico alto, actividad proliferativa alta con mamografías de características relativamente benignas y sin calcificaciones. Por el contrario, los cánceres que se identificaron por medio de exámenes de detección con frecuencia presentaron características histológicas de tipo tubular, tamaño más pequeño, estadio bajo, sensibilidad a las hormonas y un componente importante de CDIS.[40] En general, los cánceres de intervalo tienen características de crecimiento rápido,[40,41] se diagnostican en estadio avanzado y tienen un pronóstico precario.[42]
El análisis del sesgo de duración de los exámenes de detección mediante mamografía detecta sobre todo cánceres de escasa malignidad que crecen de forma más lenta (por ejemplo, pasan un tiempo más largo en la fase preclínica). Por el contrario, los cánceres de mayor malignidad crecen más rápido (por ejemplo, tienen una fase preclínica más corta) y a menudo se detectan clínicamente en los intervalos entre exámenes de detección. Para obtener una explicación más detallada sobre el sesgo de duración y de anticipación diagnóstica en los exámenes de detección del cáncer, consultar Aspectos generales de los exámenes de detección del cáncer.
En los últimos años, se han evaluado nuevas tecnologías de detección del cáncer de mama en ensayos clínicos donde el criterio principal de valoración de interés fue la tasa de detección del cáncer de intervalo, y se han recomendado métodos de detección más nuevos a partir de las disminuciones en las tasas de detección del cáncer de intervalo. Sin embargo, la tasa de detección del cáncer de intervalo no se ha convalidado como un sustituto adecuado de la mortalidad por cáncer de mama, y su uso como medida sustituta del desenlace en los ensayos sobre detección del cáncer de mama sigue siendo objeto de polémica.
Los casos de cáncer de mama que se encuentran mediante los exámenes de un programa de detección tienden a presentar mejor pronóstico que los casos identificados durante el intervalo entre exámenes de detección (cáncer de mama de intervalo). Esto se confirmó en un estudio de cohorte basado en registros de Manitoba, en donde fue más probable que los casos de cáncer de intervalo fueran de grado alto y negativos para el receptor de estrógeno, y el riesgo de mortalidad fue más de tres veces el riesgo de las pacientes con casos de cáncer de mama identificados con exámenes de detección.[43]
En el Nova Scotia Breast Screening Program se definieron los cánceres no detectados como aquellos que exhibieron resultados negativos falsos durante el examen de detección anterior; esto se produjo con una frecuencia menor de 1 por cada 1000 mujeres. Se llegó a la conclusión de que los cánceres de intervalo se producen en alrededor de 1 de cada 1000 mujeres de 40 a 49 años y en 3 de cada 1000 mujeres de 50 a 59 años.[44]
Por el contrario, en un estudio más numeroso se encontró que los cánceres de intervalo fueron más prevalentes en las mujeres de 40 a 49 años. Esos cánceres, que se presentaron dentro de los 12 meses de un examen de detección con resultado negativo, se atribuyeron por lo general a una mayor densidad mamaria. Aquellos que se presentaron en el intervalo de 24 meses, se relacionaron con una disminución de la sensibilidad mamográfica debido a una densidad mamaria más alta o a un crecimiento tumoral rápido.[45]
Variables relacionadas con la precisión
Características de la paciente
Se ha indicado que la precisión de las mamografías varía de acuerdo con características de la paciente, como su edad, la densidad mamaria, si se trata de su primer examen o de uno posterior, y del tiempo transcurrido desde la última mamografía. Las mujeres jóvenes tienen una sensibilidad más baja y tasas de resultados positivos falsos más altas que las mujeres de más edad.
En el Million Women Study del Reino Unido, se encontró disminución de la sensibilidad y la especificidad de los exámenes de detección en mujeres de 50 a 64 años si usaban hormonoterapia posmenopáusica, se habían sometido antes a cirugía de la mama o tenían un índice de masa corporal inferior a 25.[46] Un intervalo más largo desde la última mamografía aumenta la sensibilidad, la tasa de repeticiones y la tasa de detección del cáncer, además de disminuir la especificidad.[47]
En el United Kingdom Age Trial se evaluó la eficacia de la detección mediante mamografía en mujeres de menos de 50 años. Al cabo de una mediana de seguimiento de 22,8 años, no hubo diferencia en la mortalidad por cáncer de mama entre las mujeres que se asignaron al azar para iniciar la detección a la edad de 39 a 41 años hasta que ingresaron en el programa de detección del cáncer de mama del National Health Service (NHS) entre los 50 y los 52 años, versus el grupo que no comenzó con las mamografías hasta que ingresó en el programa del NHS (CRI, 0,98; IC 95 %, 0,79–1,22; P = 0,86).[48]
Es posible mejorar la sensibilidad programando el examen para después del inicio de la menstruación o durante una interrupción de la hormonoterapia.[49] Las mujeres obesas tienen un aumento de más del 20 % de riesgo de obtener una mamografía con resultado positivo falso, aunque la sensibilidad no cambie.[50]
Densidad mamaria
En ocasiones, las mamas densas oscurecen la detección de masas pequeñas en la mamografía y, por lo tanto, se reduce la sensibilidad de la prueba.[12] Para las mujeres de todas las edades, la densidad alta de la mama se relaciona con un 10 % a un 29 % menos de sensibilidad.[37] La densidad mamaria alta también se relaciona con un aumento moderado del riesgo de cáncer de mama,[51] pero no confiere un mayor riesgo de muerte por dicho cáncer.
La densidad mamaria es un rasgo intrínseco que se puede heredar [52,53] o verse afectado por la edad, las hormonas [54] endógenas y exógenas,[55-57] los moduladores selectivos del receptor de estrógeno, como el tamoxifeno,[58] y la alimentación.[59] La hormonoterapia se relaciona con un aumento de la densidad mamaria, sensibilidad baja de la mamografía y un aumento en la tasa de cánceres de intervalo.[60]
El tejido mamario denso no es anormal. La densidad mamaria es una descripción de la proporción entre tejido denso versus graso en una imagen radiográfica.[61] El American College of Radiology’s BI-RADS clasifica la densidad mamaria como sigue:
- Casi completamente grasa.
- Densidad fibroglandular dispersa.
- Heterogéneamente densa.
- Extremadamente densa.
Las dos últimas categorías se consideran tejido mamario denso, que es una descripción que afecta al 43 % de las mujeres de entre 40 y 74 años.[62] La asignación de la densidad mamaria realizada por un radiólogo es subjetiva y, en cualquier mujer, puede variar con el tiempo.[62,63]
Hay poca evidencia de alta calidad que sirva de guía para la óptima detección del cáncer de mama en las personas con mamas densas. Con la tomosíntesis digital de mama se mejoró la sensibilidad y se redujo de forma moderada la tasa de falsos positivos, en comparación con la mamografía digital convencional.[64]
Algunos grupos indicaron que se tomaran imágenes complementarias con ultrasonografía o imágenes de resonancia magnética (IRM) de la mama para evaluar a mujeres con mamas densas; sin embargo, no hay datos que muestren que esta estrategia reduzca la mortalidad por cáncer de mama. El daño potencial de agregar estos exámenes de detección complementarios es la probabilidad de producir más resultados positivos falsos que conducen a la obtención de imágenes adicionales y biopsias de mama, con la ansiedad y el costo resultantes.[65] Es posible que los exámenes de detección complementarios aumenten el sobrediagnóstico de cáncer de mama y resulten en sobretratamiento.
En un estudio, en el que se examinaron los criterios de valoración para detectar el cáncer en mujeres con mamas densas sometidas a exámenes de detección complementarios (por ejemplo, ecografía, IRM, exámenes con técnicas digitales), se observó mayor detección del cáncer de mama; sin embargo, no se sabe si estos exámenes se traducen en una mayor protección contra el cáncer.[66] En los Países Bajos, se realizó un ECA sobre el uso de la IRM complementaria versus la mamografía sola en 40 373 personas de entre 50 y 75 años con mamas sumamente densas.[67] En el estudio se demostró menor incidencia de cánceres de intervalo a los 2 años de seguimiento en el grupo de IRM (2,5 por cada 1000 exámenes de detección en el grupo al que se le ofreció realizar la IRM, 0,8 por cada 1000 en el grupo que finalmente se sometió a IRM y 5,0 por 1000 en el grupo que solo se sometió a mamografía). Estos hallazgos indican que, al menos, algunos de los cánceres adicionales que se detectaron mediante IRM en dicho grupo eran diagnósticos tempranos de cáncer que se habrían vuelto un cáncer evidente desde el punto de vista clínico. No obstante, no se demostró que el diagnóstico temprano facilitado por la IRM mejorara el desenlace clínico. Como era de esperar, los cánceres que se detectaron mediante IRM fueron más propensos a tener características tumorales favorables que los cánceres de intervalo. Los exámenes de detección mediante IRM se relacionaron con 79,8 resultados falsos positivos por cada 1000 evaluaciones.[67]
En el estudio prospectivo multicéntrico, Dense Breast Tomosynthesis Ultrasound Screening Trial (DBTUST), se investigó si la ecografía mejoraba la detección del cáncer tras una tomosíntesis digital de mama (DBT) en mujeres con mamas densas.[68] Entre diciembre de 2015 y junio de 2021, 6179 mujeres de 3 locaciones en Pennsylvania, se sometieron a 3 rondas de exámenes de detección anuales mediante DBT y ecografías hechas por un técnico con un ecógrafo portátil. Dos radiólogos interpretaron las imágenes al inicio, a los 12 meses y a los 24 meses. En el estudio se llegó a la conclusión de que los exámenes de detección realizados mediante ecografías hechas por un técnico produjeron una leve mejora en la detección del cáncer en las mujeres con mamas densas en 1,3 de los casos por cada 1000 en el año 1, y en 1 caso por cada 1000 en los años 2 al 3. Este examen de detección también aumentó la tasa de repetición de exámenes debido a resultados falsos positivos. En 3 años, 1007 (16,3 %) mujeres tuvieron que repetir el examen por un resultado falso positivo con DBT, y otras 761 (12,3 %) mujeres tuvieron que repetir el examen por un resultado falso positivo con ecografía.
La FDA indica que los centros de mamografía deben notificar a los pacientes la presencia de tejido mamario denso y recomienda que estos evalúen con el médico de atención primaria la posibilidad de someterse a exámenes de detección complementarios.[69] Sin embargo, la escasa evidencia, las directrices contradictorias y la forma en que se han redactado los informes sobre densidad mamaria han generado confusión y ansiedad entre pacientes y proveedores de atención de la salud.[70]
Características tumorales
Las mamografías detectan los cánceres de tipo mucinoso y lobulillar con mayor facilidad. En ocasiones, los cánceres de crecimiento rápido se pueden confundir con el tejido mamario normal; por ejemplo, carcinomas medulares: un tipo poco común de cáncer de mama ductal invasivo que se relaciona con frecuencia con la mutación BRCA1 y que tiene características activas, pero que a veces demuestra respuestas comparativamente favorables al tratamiento.[40,71] Es posible que tampoco se detecten algunos cánceres relacionados con mutaciones BRCA1/2 que parezcan de crecimiento lento.[72,73]
Características de los médicos
El desempeño de los radiólogos varía y depende del grado de experiencia y la cantidad de mamografías que interpretan.[74] Los radiólogos del ámbito académico exhiben un valor pronóstico positivo (VPP) más alto en sus recomendaciones para la práctica de una biopsia que aquellos en la comunidad.[75] La capacitación de especialistas durante su formación tal vez ayude a mejorar la detección por imágenes mamográficas.[10]
La eficacia también depende del establecimiento. La precisión de la detección mamográfica fue más alta en centros donde solo se ofrecían exámenes de detección que en los que se realizaban otros exámenes de diagnóstico. Se observó una mayor precisión en centros dotados con un especialista permanente en imaginología de la mama que realizaba lecturas simples en lugar de dobles y se sometían a auditorías de sus prestaciones dos o más veces por año.[76]
Las tasas de resultados positivos falsos son más altas en establecimientos donde hay una mayor preocupación por negligencia médica y atienden a mujeres vulnerables (mujeres de minorías raciales o étnicas y mujeres con menor nivel educativo, ingreso familiar limitado o que viven en zonas rurales).[77] Es posible que estas poblaciones presenten una prevalencia de cáncer más alta y carezcan de seguimiento.[78]
Algoritmos de inteligencia artificial
Se están elaborando algoritmos de inteligencia artificial (IA) para interpretar las mamografías de detección y las muestras de biopsias de mama.[79-81] Si bien estos instrumentos quizás mejoren la velocidad de interpretación y la reproducibilidad en el futuro, no se sabe si exacerbarán el sobrediagnóstico [82] y si ejercerán una influencia en las valoraciones definitivas de los médicos.
Comparaciones internacionales
En comparaciones internacionales de los exámenes de detección por mamografía, se determinó que la especificidad es más alta en países con sistemas de detección mucho más centralizados y programas nacionales de garantía de la calidad.[83,84]
La tasa de repetición es dos veces más alta en los Estados Unidos que en el Reino Unido; sin embargo, no hay diferencia en la tasa de cánceres que se detectan.[83]
Comparación entre el examen prevalente y el examen posterior, e intervalo entre exámenes
La probabilidad de diagnosticar cáncer es más alta con el examen de detección prevalente (el primero) y oscila entre 9 y 26 cánceres por 1000 exámenes de detección, según la edad de la mujer. La probabilidad disminuye para los exámenes de seguimiento y oscila entre 1 y 3 cánceres por 1000 exámenes de detección.[85]
Se desconoce el intervalo óptimo entre las mamografías de detección; hay poca variabilidad entre los ensayos a pesar de las diferencias de protocolos y los intervalos de los exámenes de detección. En un ensayo prospectivo realizado en el Reino Unido, se asignó al azar a mujeres de 50 a 62 años a someterse a mamografías cada año o cada 3 años. Aunque el grado del tumor y el estado ganglionar fueron similares en ambos grupos, se detectaron más cánceres de tamaño un poco más pequeño en el grupo de exámenes de detección anuales que en el grupo de exámenes de detección trienales.[86]
En un estudio de observación grande, se encontró un aumento leve del riesgo de enfermedad en estadio avanzado en el momento del diagnóstico en mujeres de 40 a 49 años que se adhirieron a un plan de 2 años en lugar de 1 año (28 vs. 21 %; OR, 1,35; intervalo de confianza [IC] 95 %, 1,01–1,81), pero no se observó diferencia debido a los cronogramas en mujeres de 50 a 59 años y de 60 a 69 años.[87,88]
En un estudio finlandés de 14 765 mujeres de 40 a 49 años, se asignó al azar a las mujeres a exámenes de detección anuales y trienales. Hubo 18 defunciones por cáncer de mama en 100 738 años-vida en el grupo sometido a exámenes de detección trienales, y 18 defunciones por cáncer de mama en 88 780 años-vida en el grupo de exámenes de detección anuales (cociente de riesgos instantáneos [CRI], 0,88; IC 95 %, 0,59–1,27).[89]
Beneficio de los exámenes de detección con mamografía en la mortalidad por cáncer de mama
Ensayos controlados aleatorizados
Se realizaron ensayos controlados aleatorizados (ECA) sobre la mortalidad por cáncer de mama entre 1963 y 2015, con la participación de más de medio millón de mujeres en cuatro países. En un ensayo, el Canadian National Breast Screening Study-2 (CNBSS-2), se llevó a cabo una comparación entre el uso de la mamografía con el examen clínico de la mama (ECM) y el uso del ECM solo; en los otros ensayos se compararon la mamografía de detección con el ECM o sin este, y la atención de rutina. Para obtener una descripción detallada de los ensayos, consultar Apéndice de ensayos controlados aleatorizados.
Los ensayos se diferenciaron con respecto al diseño, la inscripción de las participantes, las intervenciones (tanto de examen de detección como de tratamiento), el manejo del grupo de control, el cumplimiento de la asignación a grupos de exámenes de detección y de control, y el análisis de los resultados. En algunos ensayos, se utilizó la aleatorización individual, mientras que en otros se utilizó la aleatorización por grupos en la que se identificaron cohortes y luego se les ofrecieron exámenes de detección; en un ensayo, se hizo una asignación no aleatorizada por día de nacimiento en cualquier mes dado. Algunas veces, la aleatorización por grupos produjo desequilibrios entre los grupos de intervención y de control. En varios ensayos, se identificaron diferencias de edad, aunque no tuvieron un efecto importante en el resultado del ensayo.[90] En el Edinburgh Trial, el índice socioeconómico, que se correlaciona con el riesgo de mortalidad por cáncer de mama, difirió de forma notable entre los grupos de intervención y de control; esto impidió interpretar los resultados.
La mortalidad por cáncer de mama fue el parámetro principal del desenlace en cada uno de estos ensayos, por lo que las causas de muerte atribuidas exigieron una atención meticulosa. Se incorporó el uso de un comité de vigilancia anónimo (Nueva York) y una vinculación a fuentes de datos independientes, como los registros nacionales de mortalidad (ensayos suecos), pero no se pudo asegurar la atribución imparcial de la causa de muerte en el caso de las mujeres en los grupos de exámenes de detección o los grupos de control. Se indicó una posible clasificación errónea de las muertes por cáncer de mama en el Two-County Trial, que pudieron tener sesgos en los resultados a favor de los exámenes de detección.[91]
También hubo diferencias en la metodología que se usó para analizar los resultados de estos ensayos. Cuatro de los cinco ensayos suecos se diseñaron para incluir una sola mamografía de detección en el grupo de control, con sincronización para que se correspondiera con el final de la serie de mamografías de detección en el grupo de estudio. El análisis inicial de estos ensayos se utilizó con fines de evaluación, ya que solo se tuvieron en cuenta las muertes por cáncer de mama de mujeres cuyo cáncer se descubrió en la última mamografía del estudio o antes de este. En algunos de los ensayos, se presentó un retraso en la realización de la mamografía prevista para el final del estudio, con lo cual las mujeres en el grupo de control tuvieron más tiempo para presentar o recibir un diagnóstico de cáncer de mama. En otros ensayos, se utilizó un análisis de seguimiento, que tiene en cuenta todas las muertes atribuidas al cáncer de mama, sin importar el momento del diagnóstico. Este tipo de análisis se usó en un metanálisis de 4 de los 5 ensayos suecos como solución al problema de los análisis de evaluación.[91]
Asimismo, hubo variaciones en la facilidad de acceso a los datos de auditoría y verificación internacionales; solo los ensayos canadienses llevaron a cabo una auditoría formal. Hay otros ensayos sometidos a auditorías de diferentes grados, pero fueron menos rigurosas.[92]
Todos estos estudios se diseñaron para analizar la mortalidad por cáncer de mama en lugar de la mortalidad por todas las causas, ya que las defunciones por cáncer de mama son solo una proporción pequeña del número total de defunciones en cualquier población. Cuando se hicieron análisis retrospectivos de la mortalidad por todas las causas en estos ensayos, solo se observó una diferencia marcada en el Edinburgh Trial, que se atribuye a diferencias socioeconómicas observadas con anterioridad en los grupos del estudio. El metanálisis (métodos de seguimiento) de los cuatro ensayos suecos también reveló una mejora pequeña de la mortalidad por todas las causas.
La mejora relativa en la mortalidad por cáncer de mama que se atribuye a los exámenes de detección es de alrededor del 15 % al 20 %, y la mejora absoluta a nivel individual es mucho menor. El posible beneficio de los exámenes de detección del cáncer de mama se traduce en el número de vidas prolongadas debido a la detección temprana de este cáncer.[93,94]
Los resultados de los ECA representan experiencias en un plazo determinado de exámenes periódicos pero, en la práctica, las mujeres se someten a 20 o 30 años de exámenes de detección durante toda su vida.[88,95]
El uso de esos ECA que se realizaron hace 50 años o más presenta varios problemas para calcular el beneficio actual de los exámenes de detección para la mortalidad del cáncer de mama. Estos problemas son los siguientes:
- Mejoras en la tecnología mamográfica, con la capacidad de identificar anomalías cada vez más sutiles.
- Mayor conciencia de la población general sobre el cáncer de mama, que hace que las mujeres soliciten evaluaciones y tratamiento más temprano.
- Cambios en la distribución de los factores de riesgo en la población (incluso la edad de la menarquia, la edad del primer embarazo, la obesidad y el tratamiento hormonal posmenopáusico).
- Mejoras en el tratamiento del cáncer de mama, con tasas de curación más altas que las anteriores para cánceres más grandes y en estadio más avanzado.
- Aplicación de resultados de ECA de corto plazo (por ejemplo, de 5 a 10 años) para calcular los efectos durante toda la vida de los exámenes de detección del cáncer de mama.
Por estos motivos, la reducción de la mortalidad del cáncer de mama por los exámenes de detección vigentes se calcula a partir de estudios de cohortes y ecológicos bien realizados, además de los ECA.
Eficacia de los programas poblacionales de exámenes de detección
Es posible calcular la eficacia de los exámenes de detección mediante estudios controlados no aleatorizados de poblaciones que se sometieron a exámenes de detección comparadas con poblaciones que no lo hicieron, estudios de casos y controles de exámenes de detección en comunidades reales y estudios de modelos que evalúan el efecto de los exámenes de detección en poblaciones numerosas. Estos estudios se deben diseñar para reducir al mínimo o eliminar los efectos de tendencias no relacionadas que influyen en la mortalidad del cáncer de mama; por ejemplo, mejoras en el tratamiento y mayor sensibilización sobre el cáncer de mama en la comunidad.
En tres estudios de observación de una población de Suecia, se comparó la mortalidad por cáncer de mama frente a la presencia y la ausencia de programas de exámenes de detección con mamografía. En un estudio se compararon dos períodos contiguos en 7 de los 25 condados suecos y se halló una reducción con significación estadística de la mortalidad por cáncer de mama del 18 % al 32 % atribuible a los exámenes de detección.[96] El sesgo más importante en este estudio es que la adopción de los exámenes de detección se presentó en estos países en un período en el que se realizaban mejoras considerables en la eficacia del tratamiento adyuvante de cáncer de mama que los autores del estudio no tuvieron en cuenta. En el segundo estudio se consideró un período de 11 años en el que se compararon 7 condados con programas de exámenes de detección con 5 que no los tenían.[97] Hubo una tendencia en favor de los exámenes de detección pero, una vez más, los autores no tuvieron en cuenta el efecto del tratamiento adyuvante ni las diferencias geográficas (áreas urbanas vs. rurales) que podrían afectar la administración del tratamiento.
En el tercer estudio se intentaron explicar los efectos del tratamiento mediante un análisis detallado por condado. Se encontró que los exámenes de detección tuvieron poco efecto, una conclusión debilitada por varios errores de diseño y análisis.[98]
En un programa poblacional de exámenes de detección realizado en 1975 en Nimega (Países Bajos), se halló en un estudio de casos y cohortes que las mujeres que se sometieron a exámenes de detección tuvieron una disminución de la mortalidad (oportunidad relativa [OR] = 0,48).[99] Sin embargo, en un estudio posterior se compararon las tasas de mortalidad por cáncer de mama de Nimega con las de la ciudad vecina de Arnhem (Países Bajos), en donde no había un programa de exámenes de detección, y no se observó ninguna diferencia en la mortalidad por cáncer de mama.[100]
En un estudio comunitario de casos y controles de exámenes de detección realizados entre 1983 y 1998 en sistemas de atención sanitaria de alta calidad de los Estados Unidos, no se encontró ninguna relación entre los exámenes de detección anteriores y la disminución de la mortalidad por cáncer de mama; sin embargo, las tasas de exámenes de detección por mamografía fueron bajas en general.[101]
En un estudio ecológico bien realizado, se compararon tres pares de países europeos vecinos, compatibles en cuanto a la similitud de sus sistemas de salud y su estructura demográfica; uno de estos países había iniciado un programa nacional de exámenes de detección algunos años antes que los otros países. Los investigadores determinaron que cada país tuvo una reducción de la mortalidad por cáncer de mama, sin diferencia entre los pares compatibles, que se podría atribuir a los exámenes de detección. Los autores indicaron que era más probable que las mejoras en el tratamiento del cáncer de mama o en las organizaciones de atención de la salud produjeran la disminución en la mortalidad que el uso de los exámenes de detección.[102]
En una revisión sistemática de estudios ecológicos y de cohortes grandes publicada en marzo de 2011, se comparó la mortalidad por cáncer de mama en poblaciones numerosas de mujeres de 50 a 69 años que se comenzaron a someter a exámenes de detección del cáncer de mama en distintos momentos. Hubo 17 estudios que cumplieron con los criterios de participación, pero todos presentaron problemas metodológicos, como diferencias en los grupos de control, ajuste insuficiente por las diferencias entre las áreas de riesgo de cáncer de mama y su tratamiento, además de problemas de similitud de mediciones para la mortalidad por cáncer de mama entre las zonas comparadas. Hubo una variación considerable en los resultados de los estudios: en 4 estudios se encontró una reducción relativa en la mortalidad por cáncer de mama del 33 % o más (con IC amplios); en otros 5 estudios no se encontró una reducción de la mortalidad por cáncer de mama. Dado que solo una parte de la disminución general de la mortalidad por cáncer de mama se podía atribuir a los exámenes de detección, en la conclusión de la revisión se indicó que era probable que la disminución relativa en la mortalidad por cáncer de mama como resultado de los exámenes de detección no superaría el 10 %.[103]
En un análisis ecológico en los Estados Unidos, realizado entre 1976 y 2008, se examinó la incidencia del cáncer de mama en estadio temprano versus estadio avanzado en mujeres de 40 años o más. A fin de evaluar el efecto de los exámenes de detección, los autores compararon la magnitud del aumento de cáncer en estadio temprano con la magnitud de la disminución prevista del cáncer en estadio avanzado. A lo largo del estudio, el aumento absoluto de la incidencia del cáncer en estadio temprano fue de 122 cánceres por 100 000 mujeres, mientras que la disminución absoluta de los cánceres en estadio avanzado fue de 8 casos por 100 000 mujeres. Después de un ajuste por los cambios en la incidencia que produjo la hormonoterapia y otras causas indefinidas, los autores llegaron a las siguientes conclusiones: 1) el beneficio de los exámenes de detección para la mortalidad fue pequeño; 2) entre el 22 % y el 31 % de los cánceres diagnosticados representaron sobrediagnósticos; y 3) es probable que la mejora observada en la tasa de mortalidad por cáncer de mama sea atribuible a las mejoras de tratamiento y no a los exámenes de detección.[104]
Se utilizó un enfoque analítico para aproximar los aportes de los exámenes de detección versus el tratamiento en cuanto a la disminución de la tasa de mortalidad por cáncer de mama y la magnitud del sobrediagnóstico.[105] El cambio en el tamaño de la distribución de los cánceres de mama en los Estados Unidos desde antes de la introducción de la mamografía hasta después de su difusión generalizada en 2012, se investigó mediante el uso de datos del SEER para mujeres de 40 años o más. Se partió de la base que la tasa del cáncer de mama con importancia clínica permaneció estable durante este período. Los autores documentaron una incidencia más baja de tumores más grandes (≥ 2 cm), al igual que una disminución de la tasa de letalidad por cáncer de mama. La mortalidad más baja para las mujeres con tumores de mayor tamaño se atribuyó a las mejoras del tratamiento. Dos tercios de la disminución en la tasa de letalidad por tamaño se atribuyeron a las mejoras del tratamiento.
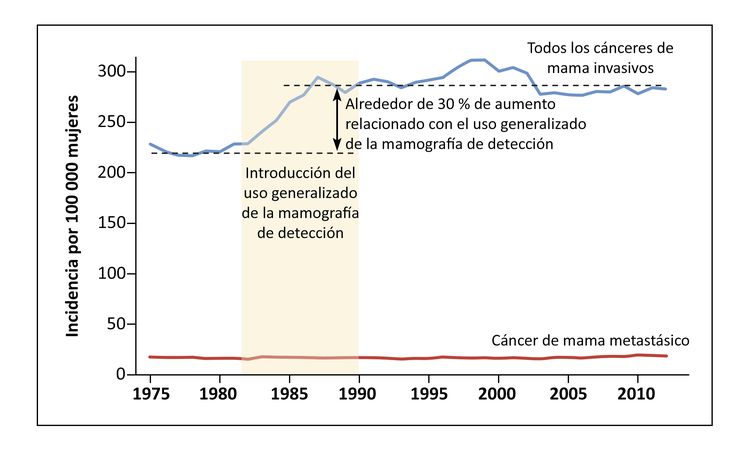
En un estudio prospectivo de cohortes de los programas comunitarios de detección de los Estados Unidos, se encontró que la mamografía de detección anual comparada con la bienal no redujo la proporción de cánceres de mama desfavorables detectados en mujeres de 50 a 74 años o en mujeres de 40 a 49 años sin mamas sumamente densas. Las mujeres de 40 a 49 años con mamas sumamente densas sí exhibieron una reducción en los cánceres de más de 2,0 cm con los exámenes de detección anuales (OR, 2,39; IC 95 %, 1,37–4,18).[106]
En un estudio de observación de mujeres de 40 a 74 años que se realizó en 7 de 12 programas de detección canadienses, se comparó la mortalidad por cáncer de mama de las participantes sometidas a exámenes de detección al menos una vez entre 1990 y 2009 (85 % del grupo de población) con la mortalidad de quienes no se sometieron a estos exámenes (15 % del grupo de población). En el resumen del estudio, se notificó que el promedio de mortalidad de cáncer de mama de las participantes fue del 40 %; sin embargo, es probable que la intención fuese notificar una disminución del 40 % en la mortalidad del cáncer de mama según se expone en la sección descriptiva del estudio.[107]
Entre otras limitaciones del estudio, se encuentran las siguientes: ausencia de datos sobre mortalidad por todas las causas, alcance de los exámenes de detección, exámenes de detección fuera del estudio, exámenes de detección antes del estudio, método de cálculo de la mortalidad prevista y las tasas de referencia de quienes no participaron, supervivencia de quienes no participaron, diferencias poblacionales en provincias específicas, grado en que las limitaciones de la base de datos impidió el ajuste por edad y por otras diferencias en las participantes, posibilidad de generalización de los datos de subgrupo de una sola provincia (Columbia Británica) y el efecto potencialmente grande del sesgo de selección. En general, en este estudio faltaron datos importantes y hubo limitaciones relacionadas con la metodología y el análisis de los datos.
Modelo estadístico de la incidencia del cáncer de mama y la mortalidad en los Estados Unidos
Los diseñadores del modelo abordaron el intervalo de detección óptimo. La creación de modelos plantea hipótesis que tal vez no sean correctas; sin embargo, la credibilidad de los modelos es superior cuando producen resultados generales que son congruentes con los ensayos aleatorizados y cuando el modelo se usa para interpolar o extrapolar. Por ejemplo, si el resultado de un modelo concuerda con los resultados de un ECA para la detección anual, la credibilidad es mayor en la comparación de la eficacia relativa del examen de detección bienal con el anual.
En el año 2000, el Instituto Nacional del Cáncer formó un consorcio de grupos para la formulación de modelos (Red de Modelos de Intervención y Vigilancia del Cáncer [CISNET]) a fin de abordar la contribución relativa de los exámenes de detección y el tratamiento adyuvante a la disminución de la mortalidad por cáncer de mama observada en los Estados Unidos.[108] Estos modelos predijeron reducciones de la mortalidad por cáncer de mama similares a las previstas en las circunstancias de los ECA, pero actualizadas según el uso de terapias adyuvantes modernas. En 2009, los autores de modelos de CISNET abordaron varias preguntas sobre los perjuicios y beneficios de la mamografía, incluso la comparación entre los exámenes de detección anuales y bienales.[88] Las mujeres de 50 a 74 años obtuvieron el mayor beneficio de mortalidad por exámenes de detección anuales con mamografía cada 2 años. La disminución de la mortalidad por cáncer de mama que se mantiene al pasar de un examen de detección anual a uno bienal osciló en los seis modelos del 72 % al 95 %, con una mediana del 80 %.
Hay pocos datos sobre la reducción de la mortalidad, vista a lo largo del tiempo a partir de 1990, que se puede atribuir a los avances en las técnicas de imágenes que se usan como exámenes de detección y qué tanta reducción es el resultado de la mejora en la eficacia del tratamiento. En un estudio de la CISNET de seis modelos de simulación, cerca de un tercio de la disminución en la mortalidad por cáncer de mama en 2012 se atribuyó a la detección y el resto se atribuyó al tratamiento.[109] En este estudio de la CISNET, el cálculo de la media de reducción en la tasa de mortalidad por cáncer de mama fue del 49 % (intervalo del modelo, 39–58 %), en relación con la tasa de referencia calculada en 2012 sin exámenes de detección ni tratamiento; el 37 % (intervalo del modelo, 26–51 %) de esta reducción se relacionó con la detección y el 63 % (intervalo del modelo, 49–74 %) de esta reducción se relacionó con el tratamiento.
Perjuicios de los exámenes de detección con mamografía
Los efectos perjudiciales de las mamografías de detección son: sobrediagnóstico (positivos verdaderos que no tendrán importancia clínica), positivos falsos (relacionados con la especificidad de la prueba), negativos falsos (relacionados con la sensibilidad de la prueba), molestias vinculadas al examen, riesgo de la radiación, perjuicios psicológicos, tensión financiera y costos de oportunidad.
En el Cuadro 2, se proporciona un resumen del cálculo de beneficios y perjuicios de la detección por mamografía para 10 000 mujeres sometidas a este examen anual durante un período de 10 años.[110]
| Edad (años) | Número de muertes por cáncer de mama evitadas mediante exámenes de detección con mamografía durante los próximos 15 añosb | Número (IC 95 %) con ≥1 resultados positivos falsos durante los 10 añosc | Número (IC 95 %) con ≥1 resultados positivos falsos que condujeron a una biopsia durante los 10 añosc | Número de cánceres de mama o CDIS diagnosticados durante los 10 años que nunca habrían pasado a tener importancia clínica (sobrediagnóstico)d | |
|---|---|---|---|---|---|
| IC = intervalo de confianza; CDIS = carcinoma ductal in situ. | |||||
| aAdaptado de Pace y Keating.[110] | |||||
| bEl número de muertes evitadas proviene de Welch y Passow.[111] El límite más bajo representa la disminución de la mortalidad por cáncer de mama si el riesgo relativo fuera de 0,95 (según el beneficio mínimo de los ensayos canadienses [112,113]) y el límite más alto representa la disminución de la mortalidad por cáncer de mama si el riesgo relativo fuera de 0,64 (según el Swedish 2-County Trial [114]). | |||||
| cLos cálculos de los resultados positivos falsos y de las biopsias, y los intervalos de confianza del 95 % son riesgos acumulados a 10 años notificados por Hubbard et al. [115] y Braithwaite et al.[116] | |||||
| dEl número de casos sobrediagnosticados se tomó de Welch y Passow.[111] El límite más bajo representa el sobrediagnóstico según los resultados del ensayo de Malmö,[117] mientras que el límite más alto representa el cálculo de Bleyer y Welch.[104] | |||||
| eEl cálculo más bajo de sobrediagnóstico notificado por Welch y Passow [111] proviene del estudio Malmö.[117] En este estudio no se inscribieron mujeres menores de 50 años. | |||||
| 40 | 1–16 | 6130 (5940–6310) | 700 (610–780) | ?–104e | |
| 50 | 3–32 | 6130 (5800–6470) | 940 (740–1150) | 30–137 | |
| 60 | 5–49 | 4970 (4780–5150) | 980 (840–1130) | 64–194 | |
Sobrediagnóstico
El sobrediagnóstico se presenta cuando los procedimientos de detección permiten detectar cánceres que nunca se hubieran vuelto clínicamente aparentes sin estos procedimientos. Esto genera una preocupación especial porque la identificación de este cáncer no beneficia a la persona, mientras que los efectos secundarios de los procedimientos diagnósticos y el tratamiento del cáncer quizás produzcan perjuicios importantes. Se discute la magnitud del sobrediagnóstico, en particular, en cuanto a CDIS, un precursor del cáncer con una evolución natural desconocida. Debido a esta incapacidad de predecir con confianza el comportamiento del tumor en el momento del diagnóstico, el tratamiento estándar de los cánceres invasivos y el CDIS puede conducir a sobretratamiento. Los perjuicios relacionados incluyen los efectos secundarios vinculados con el tratamiento y el número de perjuicios relacionados con el diagnóstico del cáncer, que son inmediatos. Por el contrario, un beneficio de mortalidad se presenta en un momento incierto en el futuro.
Un abordaje para entender el sobrediagnóstico es examinar la prevalencia de cáncer oculto en las mujeres que mueren por otras causas no vinculadas al cáncer. En un resumen de 7 estudios de autopsia, la mediana de la prevalencia de cáncer de mama invasivo fue del 1,3 % (intervalo, 0–1,8 %) y de CDIS fue del 8,9 % (intervalo, 0–14,7 %).[118,119]
Es posible medir el sobrediagnóstico de forma indirecta al comparar la incidencia del cáncer de mama en poblaciones sometidas a exámenes de detección versus la incidencia del cáncer de mama en poblaciones no sometidas a detección. Estas comparaciones crean confusión debido a las diferencias de tipo temporal y geográfico en las poblaciones, o a diferencias de comportamientos de salud y uso de hormonas. Los cálculos de sobrediagnóstico varían según el ajuste por el sesgo de anticipación diagnóstica.[120,121] En un resumen de 29 estudios se describieron tasas calculadas de sobrediagnóstico de 0–54 %; las tasas de los estudios aleatorizados oscilaron entre el 11 % y el 22 %.[122] En Dinamarca, país donde hubo al mismo tiempo poblaciones sometidas o no a exámenes de detección, se calculó con dos metodologías diferentes que la tasa de sobrediagnóstico de cáncer invasivo fue del 14 % y el 39 %. Cuando se incluyeron los casos de CDIS, las tasas de sobrediagnóstico fueron del 24 % y el 48 %. La segunda metodología tiene en cuenta las diferencias regionales en mujeres que eran más jóvenes que las mujeres en la edad de detección y es probable que sea más precisa.[123]
En teoría, la detección de más cánceres de mama en estadio temprano en una población dada produciría una reducción posterior de la incidencia de cánceres en estadio avanzado. Esto no ocurrió en ninguna de las poblaciones estudiadas hasta la fecha. En consecuencia, es probable que la detección de cánceres en estadio temprano represente un sobrediagnóstico. En un estudio poblacional realizado en los Países Bajos, se observó que cerca de la mitad de todos los cánceres de mama detectados mediante exámenes de detección, incluso el CDIS, representarían un sobrediagnóstico; esto es congruente con otros estudios en los que se observaron tasas importantes de sobrediagnóstico relacionadas con los exámenes de detección.[124]
En un estudio de cohortes realizado en Noruega, se comparó el aumento de la incidencia del cáncer en las mujeres aptas para someterse a exámenes de detección, con la incidencia del cáncer en mujeres más jóvenes que no eran aptas para la detección; los criterios de selección fueron la edad y el lugar de residencia. Se observó que las mujeres aptas para la detección exhibieron un aumento del 60 % en la incidencia de cánceres localizados (RR, 1,60; IC 95 %, 1,42–1,79), mientras que la incidencia de cánceres en estadio avanzado permaneció similar en ambos grupos (RR, 1,08; IC 95 %, 0,86–1,35).[125]
En un estudio de población en el que se compararon diferentes condados de los Estados Unidos, se observó que las tasas más altas de uso de exámenes de detección con mamografía se relacionaban con tasas más altas de diagnósticos de cáncer de mama; sin embargo, no se observó una disminución correspondiente en la mortalidad a 10 años por cáncer de mama.[126] Los puntos fuertes de este estudio son el gran tamaño de la muestra (16 millones de mujeres), además de la potencia y la congruencia de la correlación observada entre los condados. Las limitaciones de este estudio incluyen la autonotificación de las mamografías realizadas, el uso de un período de 2 años para calcular la prevalencia de los exámenes de detección y el período analizado (con uso de hormonas para la menopausia).[126]
En el CNBSS, un ensayo clínico aleatorizado, se calculó la magnitud del sobrediagnóstico. Al final de los cinco ciclos de exámenes de detección, se diagnosticó un exceso de 142 casos de cáncer de mama invasivo en el grupo de mamografía en comparación con el grupo de control.[127] A los 15 años, el exceso del número de casos de cáncer en el grupo de mamografía versus el grupo de control fue de 106; esto representa una tasa de sobrediagnóstico del 22 % de los 484 cánceres invasivos identificados mediante exámenes de detección.[127]
Como consecuencia del uso de las mamografías de detección, ahora se identifican un mayor número de cánceres de mama de crecimiento lento que resulta en una posibilidad de sobretratamiento. En un análisis secundario de un ensayo aleatorizado de tamoxifeno versus ninguna terapia sistémica en pacientes con cáncer de mama, los autores utilizaron la prueba MammaPrint que analiza 70 genes e identificaron al 15 % los pacientes con un riesgo sumamente bajo, con tasas de supervivencia a 20 años por enfermedad específica del 97 % en el grupo de tamoxifeno y del 94 % en el grupo de control. Por lo tanto, es probable que estos pacientes tengan desenlaces excelentes con cirugía sola. La frecuencia de estos cánceres de riesgo sumamente bajo en la población que se somete a exámenes de detección es de alrededor del 25 %. Es posible que se utilicen pruebas como MammaPrint de 70 genes en el futuro para identificar estos canceres y así disminuir el riesgo de sobretratamiento. Sin embargo, se necesitan nuevos estudios prospectivos para confirmar estos resultados.[128]
En el CNBSS de Canadá, un ensayo aleatorizado de exámenes de detección con 25 años de seguimiento, en 2016 se volvió a calcular el sobrediagnóstico de cáncer de mama mediante la detección con mamografía por grupo de edad. Se concluyó que cerca del 30 % de los cánceres invasivos detectados mediante pruebas en mujeres de 40 a 49 años y hasta el 20 % de los detectados en mujeres de 50 a 59 años estaban sobrediagnosticados. Cuando se incluyeron los cánceres in situ, los riesgos calculados de sobrediagnósticos son del 40 % en mujeres de 40 a 49 años y del 30 % en mujeres de 50 a 59 años. El sobrediagnóstico se definió como la incidencia del exceso persistente en el grupo examinado versus el grupo de control dividido por el número de casos detectados en la pantalla (método de incidencia del exceso). Los requisitos para calcular de manera adecuada el diagnóstico excesivo mediante este método son los siguientes:
- Interrupción de los exámenes de detección para las participantes en el grupo de detección cuando el protocolo del ensayo de detección se completa.
- El seguimiento después de la interrupción de la detección necesita ser tan extenso como el tiempo más extenso de anticipación diagnóstica (el tiempo transcurrido entre la identificación del cáncer detectado mediante un examen de detección hasta el diagnóstico sintomático de ese cáncer en ausencia de la detección) entre los casos detectados mediante los exámenes de detección.
- Es necesario que la población de comparación para determinar la incidencia de cáncer durante la administración de los exámenes de detección y luego de la interrupción de estos en el grupo sometido a detección esté compuesta por personas con un riesgo de cáncer comparable en ausencia de la detección, como en un grupo de control aleatorizado.
- El cumplimiento con los exámenes de detección es alto durante el protocolo del ensayo de detección; la contaminación (sin protocolo de detección) en el grupo de control es bajo.
Estas condiciones se cumplieron en gran medida en el CNBSS debido a que los exámenes de detección poblacionales no estuvieron disponibles en todo el Canadá hasta por lo menos 2 años más tarde y, en la mayoría de los casos, de 5 a 10 años más tarde (lo que permitió el cese de la detección después del período de prueba del ensayo y el seguimiento más largo que la mayoría de los cálculos del tiempo de anticipación diagnóstica); de este modo, la contaminación fue mínima y la asignación al azar de las personas produjo 44 factores demográficos y factores de riesgo distribuidos de manera casi idéntica entre los dos grupos del ensayo.
Desde la conclusión del período de detección del ensayo en 1988, las diferencias en la calidad, la intensidad, el intervalo de edad de las participantes y los umbrales de biopsia disminuyen la generalización de estos resultados. Es probable que estos factores y la mejora en la técnica y calidad de las imágenes, así como el umbral bajo para la biopsia, contribuyan a cálculos más bajos de sobrediagnóstico del cáncer in situ que los del cáncer invasivo.[129]
En el Cuadro 2, se muestran los resultados de un período de 10 años de exámenes de detección en 10 000 mujeres, con un cálculo del número de mujeres identificadas con cáncer de mama o CDIS que nunca hubieran tenido importancia clínica (sobrediagnóstico). Probablemente, no hubo sobrediagnósticos en el estudio Health Insurance Plan, en el que se realizaron mamografías de tecnología antigua y ECM. El sobrediagnóstico ha adquirido mayor importancia en la era de la mamografía de tecnología mejorada. No obstante, no se ha demostrado que la tecnología mejorada produzca una disminución adicional de mortalidad en comparación con la tecnología original. En síntesis, el sobrediagnóstico del cáncer de mama es un tema complejo. En los estudios en los que se usaron muchos métodos diferentes, se notificó un amplio abanico de cálculos. Así, en el presente no hay manera de evaluar si los nuevos casos de cáncer se diagnostican en exceso o representan un daño real para las pacientes.[110]
Resultados positivos falsos que conducen a intervenciones adicionales
Debido a que menos de 5 de cada 1000 mujeres que se someten a exámenes de detección tienen cáncer de mama, la mayoría de las mamografías anormales son positivos falsos, incluso con un 90 % de especificidad de la mamografía (es decir, 90 % de todas las mujeres que no tienen cáncer de mama obtendrán un resultado negativo en la mamografía).[85]
Este cálculo de tasas altas de positivos falsos de la mamografía es muy bajo y tal vez parezca ilógico debido a un sesgo cognitivo estadístico que se llama falacia de las tasas de base. Debido a que la tasa de base del cáncer de mama es baja (5/1000), la tasa de positivos falsos supera de forma amplia la tasa positiva verdadera, aunque se use una prueba muy precisa.
La verdadera tasa positiva de la mamografía de alrededor del 90 % significa que, de las mujeres con cáncer de mama, alrededor del 90 % tendrá un resultado positivo. La verdadera tasa negativa de la mamografía de alrededor del 90 % significa que, de las mujeres sin cáncer de mama, alrededor del 90 % tendrá un resultado negativo. Una tasa positiva falsa del 10 % por 1000 personas significa que habrá 100 positivos falsos en 1000 personas. Si 5 de cada 1000 mujeres tienen cáncer de mama, entonces 4,5 mujeres con cáncer de mama tendrán un examen con resultado positivo. Es decir, se producen alrededor de 100 positivos falsos por cada 4,5 positivos verdaderos.
Asimismo, los resultados anormales de las mamografías de detección generan pruebas y procedimientos adicionales, como más proyecciones mamográficas de la región que motiva preocupación, ecografías, IRM y extracción de muestras de tejido (por aspiración con aguja fina, biopsia por punción con aguja gruesa o biopsia por escisión). En general, se deben sopesar los perjuicios provocados por la realización de pruebas y tratamientos innecesarios con el beneficio de la detección precoz.
En un estudio de exámenes de detección del cáncer de mama con 2400 mujeres inscritas en una organización de mantenimiento de la salud, se encontró que, en un período de 10 años, se diagnosticaron 88 cánceres, 58 de los cuales se identificaron con mamografía. Un tercio de las mujeres tuvieron un resultado anormal para la mamografía que necesitó pruebas adicionales: 539 mamografías adicionales, 186 ecografías y 188 biopsias. La tasa acumulada de biopsias (la tasa de resultados positivos verdaderos) fundamentada en hallazgos mamográficos fue de alrededor de 1 en 4 (23,6 %). El VPP de un examen de detección anormal con mamografía en esta población fue del 6,3 % para las mujeres de 40 a 49 años, el 6,6 % para las mujeres de 50 a 59 años y el 7,8 % para las mujeres de 60 a 69 años.[130] En un análisis posterior en el que se modelaron los datos de la misma cohorte de mujeres, se calculó que el riesgo de tener al menos un resultado positivo falso de la mamografía era del 7,4 % (IC 95 %, 6,4–8,5 %) en la primera mamografía, el 26,0 % (IC 95 %, 24,0–28,2 %) en la quinta mamografía y el 43,1 % (IC 95 %, 36,6–53,6 %) en la novena mamografía.[131] El riesgo acumulado de por lo menos un resultado positivo falso, dependió de cuatro variables relacionadas con las pacientes (edad más joven, mayor número de biopsias de mama anteriores, antecedentes familiares de cáncer de mama y uso vigente de estrógeno) y tres variables radiológicas (tiempo más prolongado entre los exámenes de detección, falta de comparación entre de las mamografías actuales con las anteriores y la tendencia individual del radiólogo a interpretar las mamografías como anormales). En términos generales, el mayor factor de riesgo para un resultado positivo falso de la mamografía fue la tendencia individual del radiólogo a interpretarlas como anormales.
En un estudio prospectivo de cohortes sobre exámenes comunitarios de detección, se encontró que una mayor proporción de mujeres sometidas a exámenes selectivos anuales recibieron por lo menos un resultado positivo falso después de 10 años que las mujeres sometidas cada 2 años a estos exámenes, independientemente de la densidad de la mama. Para las mujeres de 40 años con densidades fibroglandulares dispersas, la diferencia fue del 68,9 % (exámenes anuales) versus el 46,3 % (exámenes bienales). Para las mujeres de 50 a 74 años, la diferencia para este grupo de densidad fue del 49,8 % (exámenes anuales) versus el 30,7 % (exámenes bienales).[106]
Como se muestra en el Cuadro 2, el número calculado de cada 10 000 mujeres sometidas cada año a una mamografía de detección durante un período de 10 años que tendrá por lo menos un resultado positivo falso de una prueba es de 6130 mujeres de 40 a 50 años y 4970 de mujeres de 60 años. Se calcula que el número de mujeres con un resultado positivo falso de una prueba que conduce a una biopsia es de 700 a 980, según la edad.[110]
Relación entre los resultados de los exámenes de detección previos y el diagnóstico posterior de cáncer de mama
En un estudio longitudinal noruego se correlacionaron los resultados anormales benignos de los exámenes de detección con los desenlaces a largo plazo del cáncer de mama. Las mujeres con cualquier examen de detección anormal tuvieron un riesgo más alto de cáncer de mama subsiguiente a pesar de una evaluación negativa (consultar el Cuadro 3). Las características del cáncer de mama subsiguiente fueron más favorables en las mujeres con anomalías de detección previas, posiblemente debido a que la anomalía de mama prexistente fue un marcador de enfermedad premaligna de crecimiento lento.[132]
| Resultado del examen de detección | Riesgo absoluto por 1000 mujeres-años | Riesgo relativo vs. mujeres con resultados negativos en los exámenes de detección |
|---|---|---|
| Benigno con imágenes adicionales | 4,4 | 1,8 |
| Biopsia negativa | 4,7 | 2,0 |
| Atipia | 6,9 | 2,9 |
| Cáncer in situ | 9,5 | 3,8 |
Resultados negativos falsos que conducen a una posible sensación falsa de seguridad
La sensibilidad de la mamografía oscila entre el 70 y el 90 %, según las características del radiólogo a cargo de su interpretación (nivel de experiencia) y las características de la mujer (edad y densidad mamaria, estado hormonal y alimentación). Al suponer una sensibilidad media del 80 %, las mamografías no identificarán alrededor del 20 % de los cánceres de mama que están presentes en el momento de los exámenes de detección (resultados negativos falsos). Muchos de estos cánceres que se pasan por alto son de riesgo alto y tienen características biológicas adversas. Si un resultado normal de una mamografía hace que la mujer o su médico demoren la evaluación de síntomas mamarios o piensen que no la necesitan, la mujer podría sufrir consecuencias indeseables. Por lo tanto, una mamografía con resultado negativo nunca debe disuadir a una mujer o su médico de realizar una evaluación adicional de los síntomas mamarios.
Incomodidad
La compresión de la mama reduce distorsiones por el movimiento y mejora la calidad de la imagen. Se notificó dolor e incomodidad en el 90 % de las mujeres sometidas la mamografía; el 12 % calificaron la sensación como intensa e intolerable.[133] En una revisión sistemática de 22 estudios de investigación sobre el dolor y la incomodidad relacionados con la mamografía se encontraron variaciones amplias, algunas vinculadas con la etapa del ciclo menstrual, la ansiedad y la anticipación del dolor antes de someterse a la mamografía.[134]
Exposición a la radiación
Los factores de riesgo principales para el cáncer de mama relacionado con la radiación son la edad temprana en el momento de la exposición y la dosis; sin embargo, en muy pocas ocasiones, algunas mujeres presentan una predisposición heredada a sufrir daños provocados por la radiación que deben evitar la exposición a la radiación a cualquier edad.[135,136] Para las mujeres mayores de 40 años, los beneficios de las mamografías anuales probablemente compensan los posibles riesgos.[137,135,138] La mamografía de detección estándar con dos proyecciones expone a las mamas a una dosis media de 4 mSv, y a todo el cuerpo a una dosis de 0,29 mSv.[136,139] Por lo tanto, es posible que se induzca hasta 1 cáncer de mama cada 1000 mujeres de 40 a 80 años sometidas a mamografías anuales. Este riesgo se duplica en las mujeres con senos grandes que necesitan dosis radiactivas más elevadas y en mujeres que necesitan proyecciones adicionales debido a implantes que se hicieron para agrandar las mamas. El riesgo de cáncer de mama inducido por radiación se podría reducir a un quinto si las mujeres comenzaran los exámenes de detección bianuales a partir de los 50 años, en vez de comenzarlos anualmente a partir de los 40 años.[140]
Prejuicios psicológicos de los resultados positivos falsos
En una encuesta telefónica de 308 mujeres 3 meses después de las mamografías de detección, se reveló que cerca de un cuarto de las 68 mujeres a quienes se volvió a llamar para someterse a más exámenes aún sentían preocupación que se manifestaba en su estado de ánimo o funcionamiento, a pesar de que los exámenes habían descartado un diagnóstico de cáncer.[141] Durante la investigación sobre el efecto psicológico prolongado de una prueba con resultado positivo falso se encontraron resultados contradictorios. En un estudio de cohortes realizado en España en 2002, se encontró un efecto psicológico inmediato en la mujer que recibe un resultado positivo falso de una mamografía; sin embargo, estos efectos se disiparon en pocos meses.[142] En un estudio de cohortes realizado en Dinamarca en 2013 para medir los efectos psicológicos de un resultado positivo falso varios años después de recibirlo, se halló que hubo consecuencias psicológicas negativas a largo plazo.[143] Sin embargo, en varios estudios se indica que la ansiedad después de la evaluación de un examen con resultado positivo falso conduce a la participación en exámenes de detección futuros.[144-147]
Tensión financiera y costo de oportunidad
No se han investigado a fondo los perjuicios posibles de los exámenes de detección, pero es evidente que existen.
Bibliografía
- Siu AL; U.S. Preventive Services Task Force: Screening for Breast Cancer: U.S. Preventive Services Task Force Recommendation Statement. Ann Intern Med 164 (4): 279-96, 2016. [PUBMED Abstract]
- Sickles EA: Findings at mammographic screening on only one standard projection: outcomes analysis. Radiology 208 (2): 471-5, 1998. [PUBMED Abstract]
- Dibden A, Offman J, Parmar D, et al.: Reduction in interval cancer rates following the introduction of two-view mammography in the UK breast screening programme. Br J Cancer 110 (3): 560-4, 2014. [PUBMED Abstract]
- Lillie-Blanton M: Mammography Quality Standards Act : X-ray Quality Improved, Access Unaffected, but Impact on Health Outcomes Unknown: Testimony Before the Subcommittee on Health and the Environment, Committee on Commerce, House of Representatives. Washington, D.C.: Committee on Commerce, 1998. Available online. Last accessed April 9, 2025.
- Magny SJ, Skikhman R, Keppke AL: Breast Imaging Reporting and Data System. StatPearls Publishing, 2025. Also available online. Last accessed April 10, 2025.
- Rosenberg RD, Yankaskas BC, Abraham LA, et al.: Performance benchmarks for screening mammography. Radiology 241 (1): 55-66, 2006. [PUBMED Abstract]
- Jatoi I, Pinsky PF: Breast Cancer Screening Trials: Endpoints and Overdiagnosis. J Natl Cancer Inst 113 (9): 1131-1135, 2021. [PUBMED Abstract]
- Alabousi M, Zha N, Salameh JP, et al.: Digital breast tomosynthesis for breast cancer detection: a diagnostic test accuracy systematic review and meta-analysis. Eur Radiol 30 (4): 2058-2071, 2020. [PUBMED Abstract]
- Alabousi M, Wadera A, Kashif Al-Ghita M, et al.: Performance of Digital Breast Tomosynthesis, Synthetic Mammography, and Digital Mammography in Breast Cancer Screening: A Systematic Review and Meta-Analysis. J Natl Cancer Inst 113 (6): 680-690, 2021. [PUBMED Abstract]
- Pisano ED, Gatsonis C, Hendrick E, et al.: Diagnostic performance of digital versus film mammography for breast-cancer screening. N Engl J Med 353 (17): 1773-83, 2005. [PUBMED Abstract]
- Pisano ED, Hendrick RE, Yaffe MJ, et al.: Diagnostic accuracy of digital versus film mammography: exploratory analysis of selected population subgroups in DMIST. Radiology 246 (2): 376-83, 2008. [PUBMED Abstract]
- Kerlikowske K, Hubbard RA, Miglioretti DL, et al.: Comparative effectiveness of digital versus film-screen mammography in community practice in the United States: a cohort study. Ann Intern Med 155 (8): 493-502, 2011. [PUBMED Abstract]
- van Luijt PA, Fracheboud J, Heijnsdijk EA, et al.: Nation-wide data on screening performance during the transition to digital mammography: observations in 6 million screens. Eur J Cancer 49 (16): 3517-25, 2013. [PUBMED Abstract]
- Souza FH, Wendland EM, Rosa MI, et al.: Is full-field digital mammography more accurate than screen-film mammography in overall population screening? A systematic review and meta-analysis. Breast 22 (3): 217-24, 2013. [PUBMED Abstract]
- Gur D, Sumkin JH, Rockette HE, et al.: Changes in breast cancer detection and mammography recall rates after the introduction of a computer-aided detection system. J Natl Cancer Inst 96 (3): 185-90, 2004. [PUBMED Abstract]
- Ciatto S, Del Turco MR, Risso G, et al.: Comparison of standard reading and computer aided detection (CAD) on a national proficiency test of screening mammography. Eur J Radiol 45 (2): 135-8, 2003. [PUBMED Abstract]
- Fenton JJ, Taplin SH, Carney PA, et al.: Influence of computer-aided detection on performance of screening mammography. N Engl J Med 356 (14): 1399-409, 2007. [PUBMED Abstract]
- Elmore JG, Carney PA: Computer-aided detection of breast cancer: has promise outstripped performance? J Natl Cancer Inst 96 (3): 162-3, 2004. [PUBMED Abstract]
- Fenton JJ, Xing G, Elmore JG, et al.: Short-term outcomes of screening mammography using computer-aided detection: a population-based study of medicare enrollees. Ann Intern Med 158 (8): 580-7, 2013. [PUBMED Abstract]
- Lehman CD, Wellman RD, Buist DS, et al.: Diagnostic Accuracy of Digital Screening Mammography With and Without Computer-Aided Detection. JAMA Intern Med 175 (11): 1828-37, 2015. [PUBMED Abstract]
- Killelea BK, Long JB, Chagpar AB, et al.: Evolution of breast cancer screening in the Medicare population: clinical and economic implications. J Natl Cancer Inst 106 (8): , 2014. [PUBMED Abstract]
- U.S. Food and Drug Administration: Mammography Quality Standards Act (MQSA) National Statistics. Silver Spring, Md: Food and Drug Administration, 2021. Available online. Last accessed April 9, 2025.
- Richman IB, Hoag JR, Xu X, et al.: Adoption of Digital Breast Tomosynthesis in Clinical Practice. JAMA Intern Med 179 (9): 1292-1295, 2019. [PUBMED Abstract]
- Fujii MH, Herschorn SD, Sowden M, et al.: Detection Rates for Benign and Malignant Diagnoses on Breast Cancer Screening With Digital Breast Tomosynthesis in a Statewide Mammography Registry Study. AJR Am J Roentgenol 212 (3): 706-711, 2019. [PUBMED Abstract]
- Østerås BH, Martinsen ACT, Gullien R, et al.: Digital Mammography versus Breast Tomosynthesis: Impact of Breast Density on Diagnostic Performance in Population-based Screening. Radiology 293 (1): 60-68, 2019. [PUBMED Abstract]
- Aase HS, Holen ÅS, Pedersen K, et al.: A randomized controlled trial of digital breast tomosynthesis versus digital mammography in population-based screening in Bergen: interim analysis of performance indicators from the To-Be trial. Eur Radiol 29 (3): 1175-1186, 2019. [PUBMED Abstract]
- Hofvind S, Holen ÅS, Aase HS, et al.: Two-view digital breast tomosynthesis versus digital mammography in a population-based breast cancer screening programme (To-Be): a randomised, controlled trial. Lancet Oncol 20 (6): 795-805, 2019. [PUBMED Abstract]
- Lowry KP, Trentham-Dietz A, Schechter CB, et al.: Long-Term Outcomes and Cost-Effectiveness of Breast Cancer Screening With Digital Breast Tomosynthesis in the United States. J Natl Cancer Inst 112 (6): 582-589, 2020. [PUBMED Abstract]
- Melnikow J, Fenton JJ: Digital Breast Tomosynthesis-Diffusion Into Practice Preceding Evidence. JAMA Intern Med 179 (9): 1295-1296, 2019. [PUBMED Abstract]
- Kerlikowske K, Su YR, Sprague BL, et al.: Association of Screening With Digital Breast Tomosynthesis vs Digital Mammography With Risk of Interval Invasive and Advanced Breast Cancer. JAMA 327 (22): 2220-2230, 2022. [PUBMED Abstract]
- Joensuu H, Lehtimäki T, Holli K, et al.: Risk for distant recurrence of breast cancer detected by mammography screening or other methods. JAMA 292 (9): 1064-73, 2004. [PUBMED Abstract]
- Shen Y, Yang Y, Inoue LY, et al.: Role of detection method in predicting breast cancer survival: analysis of randomized screening trials. J Natl Cancer Inst 97 (16): 1195-203, 2005. [PUBMED Abstract]
- Wishart GC, Greenberg DC, Britton PD, et al.: Screen-detected vs symptomatic breast cancer: is improved survival due to stage migration alone? Br J Cancer 98 (11): 1741-4, 2008. [PUBMED Abstract]
- Moody-Ayers SY, Wells CK, Feinstein AR: "Benign" tumors and "early detection" in mammography-screened patients of a natural cohort with breast cancer. Arch Intern Med 160 (8): 1109-15, 2000. [PUBMED Abstract]
- Walpole E, Dunn N, Youl P, et al.: Nonbreast cancer incidence, treatment received and outcomes: Are there differences in breast screening attendees versus nonattendees? Int J Cancer 147 (3): 856-865, 2020. [PUBMED Abstract]
- Carney PA, Miglioretti DL, Yankaskas BC, et al.: Individual and combined effects of age, breast density, and hormone replacement therapy use on the accuracy of screening mammography. Ann Intern Med 138 (3): 168-75, 2003. [PUBMED Abstract]
- Rosenberg RD, Hunt WC, Williamson MR, et al.: Effects of age, breast density, ethnicity, and estrogen replacement therapy on screening mammographic sensitivity and cancer stage at diagnosis: review of 183,134 screening mammograms in Albuquerque, New Mexico. Radiology 209 (2): 511-8, 1998. [PUBMED Abstract]
- Kerlikowske K, Grady D, Barclay J, et al.: Likelihood ratios for modern screening mammography. Risk of breast cancer based on age and mammographic interpretation. JAMA 276 (1): 39-43, 1996. [PUBMED Abstract]
- Lee MV, Konstantinoff K, Gegios A, et al.: Breast cancer malpractice litigation: A 10-year analysis and update in trends. Clin Imaging 60 (1): 26-32, 2020. [PUBMED Abstract]
- Porter PL, El-Bastawissi AY, Mandelson MT, et al.: Breast tumor characteristics as predictors of mammographic detection: comparison of interval- and screen-detected cancers. J Natl Cancer Inst 91 (23): 2020-8, 1999. [PUBMED Abstract]
- Hakama M, Holli K, Isola J, et al.: Aggressiveness of screen-detected breast cancers. Lancet 345 (8944): 221-4, 1995. [PUBMED Abstract]
- Tabár L, Faberberg G, Day NE, et al.: What is the optimum interval between mammographic screening examinations? An analysis based on the latest results of the Swedish two-county breast cancer screening trial. Br J Cancer 55 (5): 547-51, 1987. [PUBMED Abstract]
- Niraula S, Biswanger N, Hu P, et al.: Incidence, Characteristics, and Outcomes of Interval Breast Cancers Compared With Screening-Detected Breast Cancers. JAMA Netw Open 3 (9): e2018179, 2020. [PUBMED Abstract]
- Payne JI, Caines JS, Gallant J, et al.: A review of interval breast cancers diagnosed among participants of the Nova Scotia Breast Screening Program. Radiology 266 (1): 96-103, 2013. [PUBMED Abstract]
- Buist DS, Porter PL, Lehman C, et al.: Factors contributing to mammography failure in women aged 40-49 years. J Natl Cancer Inst 96 (19): 1432-40, 2004. [PUBMED Abstract]
- Banks E, Reeves G, Beral V, et al.: Influence of personal characteristics of individual women on sensitivity and specificity of mammography in the Million Women Study: cohort study. BMJ 329 (7464): 477, 2004. [PUBMED Abstract]
- Yankaskas BC, Taplin SH, Ichikawa L, et al.: Association between mammography timing and measures of screening performance in the United States. Radiology 234 (2): 363-73, 2005. [PUBMED Abstract]
- Duffy SW, Vulkan D, Cuckle H, et al.: Effect of mammographic screening from age 40 years on breast cancer mortality (UK Age trial): final results of a randomised, controlled trial. Lancet Oncol 21 (9): 1165-1172, 2020. [PUBMED Abstract]
- American Cancer Society: Breast Density and Your Mammogram Report. Atlanta, Ga: American Cancer Society, 2017. Available online. Last accessed date April 9, 2025.
- Elmore JG, Carney PA, Abraham LA, et al.: The association between obesity and screening mammography accuracy. Arch Intern Med 164 (10): 1140-7, 2004. [PUBMED Abstract]
- McCormack VA, dos Santos Silva I: Breast density and parenchymal patterns as markers of breast cancer risk: a meta-analysis. Cancer Epidemiol Biomarkers Prev 15 (6): 1159-69, 2006. [PUBMED Abstract]
- Pankow JS, Vachon CM, Kuni CC, et al.: Genetic analysis of mammographic breast density in adult women: evidence of a gene effect. J Natl Cancer Inst 89 (8): 549-56, 1997. [PUBMED Abstract]
- Boyd NF, Dite GS, Stone J, et al.: Heritability of mammographic density, a risk factor for breast cancer. N Engl J Med 347 (12): 886-94, 2002. [PUBMED Abstract]
- White E, Velentgas P, Mandelson MT, et al.: Variation in mammographic breast density by time in menstrual cycle among women aged 40-49 years. J Natl Cancer Inst 90 (12): 906-10, 1998. [PUBMED Abstract]
- Harvey JA, Pinkerton JV, Herman CR: Short-term cessation of hormone replacement therapy and improvement of mammographic specificity. J Natl Cancer Inst 89 (21): 1623-5, 1997. [PUBMED Abstract]
- Laya MB, Larson EB, Taplin SH, et al.: Effect of estrogen replacement therapy on the specificity and sensitivity of screening mammography. J Natl Cancer Inst 88 (10): 643-9, 1996. [PUBMED Abstract]
- Baines CJ, Dayan R: A tangled web: factors likely to affect the efficacy of screening mammography. J Natl Cancer Inst 91 (10): 833-8, 1999. [PUBMED Abstract]
- Brisson J, Brisson B, Coté G, et al.: Tamoxifen and mammographic breast densities. Cancer Epidemiol Biomarkers Prev 9 (9): 911-5, 2000. [PUBMED Abstract]
- Boyd NF, Greenberg C, Lockwood G, et al.: Effects at two years of a low-fat, high-carbohydrate diet on radiologic features of the breast: results from a randomized trial. Canadian Diet and Breast Cancer Prevention Study Group. J Natl Cancer Inst 89 (7): 488-96, 1997. [PUBMED Abstract]
- Crouchley K, Wylie E, Khong E: Hormone replacement therapy and mammographic screening outcomes in Western Australia. J Med Screen 13 (2): 93-7, 2006. [PUBMED Abstract]
- Melnikow J, Fenton JJ, Whitlock EP, et al.: Supplemental Screening for Breast Cancer in Women With Dense Breasts: A Systematic Review for the U.S. Preventive Services Task Force. Ann Intern Med 164 (4): 268-78, 2016. [PUBMED Abstract]
- Sprague BL, Gangnon RE, Burt V, et al.: Prevalence of mammographically dense breasts in the United States. J Natl Cancer Inst 106 (10): , 2014. [PUBMED Abstract]
- Ho JM, Jafferjee N, Covarrubias GM, et al.: Dense breasts: a review of reporting legislation and available supplemental screening options. AJR Am J Roentgenol 203 (2): 449-56, 2014. [PUBMED Abstract]
- Ho TH, Bissell MCS, Kerlikowske K, et al.: Cumulative Probability of False-Positive Results After 10 Years of Screening With Digital Breast Tomosynthesis vs Digital Mammography. JAMA Netw Open 5 (3): e222440, 2022. [PUBMED Abstract]
- Smetana GW, Elmore JG, Lee CI, et al.: Should This Woman With Dense Breasts Receive Supplemental Breast Cancer Screening?: Grand Rounds Discussion From Beth Israel Deaconess Medical Center. Ann Intern Med 169 (7): 474-484, 2018. [PUBMED Abstract]
- Comstock CE, Gatsonis C, Newstead GM, et al.: Comparison of Abbreviated Breast MRI vs Digital Breast Tomosynthesis for Breast Cancer Detection Among Women With Dense Breasts Undergoing Screening. JAMA 323 (8): 746-756, 2020. [PUBMED Abstract]
- Bakker MF, de Lange SV, Pijnappel RM, et al.: Supplemental MRI Screening for Women with Extremely Dense Breast Tissue. N Engl J Med 381 (22): 2091-2102, 2019. [PUBMED Abstract]
- Berg WA, Zuley ML, Chang TS, et al.: Prospective Multicenter Diagnostic Performance of Technologist-Performed Screening Breast Ultrasound After Tomosynthesis in Women With Dense Breasts (the DBTUST). J Clin Oncol 41 (13): 2403-2415, 2023. [PUBMED Abstract]
- U.S. Food and Drug Administration: Mammography Quality Standards Act. Food and Drug Administration, 2023. Available online. Last accessed April 9, 2025.
- DenseBreast-info: Legislation and Regulations for Dense Breast [News]. Deer Park, NY: DenseBreast-info, Inc., 2019. Available online. May 6, 2019.
- Wallis MG, Walsh MT, Lee JR: A review of false negative mammography in a symptomatic population. Clin Radiol 44 (1): 13-5, 1991. [PUBMED Abstract]
- Tilanus-Linthorst M, Verhoog L, Obdeijn IM, et al.: A BRCA1/2 mutation, high breast density and prominent pushing margins of a tumor independently contribute to a frequent false-negative mammography. Int J Cancer 102 (1): 91-5, 2002. [PUBMED Abstract]
- Ganott MA, Harris KM, Klaman HM, et al.: Analysis of False-Negative Cancer Cases Identified with a Mammography Audit. Breast J 5 (3): 166-175, 1999. [PUBMED Abstract]
- Elmore JG, Jackson SL, Abraham L, et al.: Variability in interpretive performance at screening mammography and radiologists' characteristics associated with accuracy. Radiology 253 (3): 641-51, 2009. [PUBMED Abstract]
- Meyer JE, Eberlein TJ, Stomper PC, et al.: Biopsy of occult breast lesions. Analysis of 1261 abnormalities. JAMA 263 (17): 2341-3, 1990. [PUBMED Abstract]
- Taplin S, Abraham L, Barlow WE, et al.: Mammography facility characteristics associated with interpretive accuracy of screening mammography. J Natl Cancer Inst 100 (12): 876-87, 2008. [PUBMED Abstract]
- Jackson SL, Taplin SH, Sickles EA, et al.: Variability of interpretive accuracy among diagnostic mammography facilities. J Natl Cancer Inst 101 (11): 814-27, 2009. [PUBMED Abstract]
- Goldman LE, Walker R, Miglioretti DL, et al.: Accuracy of diagnostic mammography at facilities serving vulnerable women. Med Care 49 (1): 67-75, 2011. [PUBMED Abstract]
- Schaffter T, Buist DSM, Lee CI, et al.: Evaluation of Combined Artificial Intelligence and Radiologist Assessment to Interpret Screening Mammograms. JAMA Netw Open 3 (3): e200265, 2020. [PUBMED Abstract]
- McKinney SM, Sieniek M, Godbole V, et al.: International evaluation of an AI system for breast cancer screening. Nature 577 (7788): 89-94, 2020. [PUBMED Abstract]
- Mercan E, Mehta S, Bartlett J, et al.: Assessment of Machine Learning of Breast Pathology Structures for Automated Differentiation of Breast Cancer and High-Risk Proliferative Lesions. JAMA Netw Open 2 (8): e198777, 2019. [PUBMED Abstract]
- Adamson AS, Welch HG: Machine Learning and the Cancer-Diagnosis Problem - No Gold Standard. N Engl J Med 381 (24): 2285-2287, 2019. [PUBMED Abstract]
- Smith-Bindman R, Chu PW, Miglioretti DL, et al.: Comparison of screening mammography in the United States and the United kingdom. JAMA 290 (16): 2129-37, 2003. [PUBMED Abstract]
- Elmore JG, Nakano CY, Koepsell TD, et al.: International variation in screening mammography interpretations in community-based programs. J Natl Cancer Inst 95 (18): 1384-93, 2003. [PUBMED Abstract]
- Kerlikowske K, Grady D, Barclay J, et al.: Positive predictive value of screening mammography by age and family history of breast cancer. JAMA 270 (20): 2444-50, 1993. [PUBMED Abstract]
- The Breast Screening Frequency Trial Group: The frequency of breast cancer screening: results from the UKCCCR Randomised Trial. United Kingdom Co-ordinating Committee on Cancer Research. Eur J Cancer 38 (11): 1458-64, 2002. [PUBMED Abstract]
- White E, Miglioretti DL, Yankaskas BC, et al.: Biennial versus annual mammography and the risk of late-stage breast cancer. J Natl Cancer Inst 96 (24): 1832-9, 2004. [PUBMED Abstract]
- Mandelblatt JS, Cronin KA, Bailey S, et al.: Effects of mammography screening under different screening schedules: model estimates of potential benefits and harms. Ann Intern Med 151 (10): 738-47, 2009. [PUBMED Abstract]
- Parvinen I, Chiu S, Pylkkänen L, et al.: Effects of annual vs triennial mammography interval on breast cancer incidence and mortality in ages 40-49 in Finland. Br J Cancer 105 (9): 1388-91, 2011. [PUBMED Abstract]
- Gøtzsche PC, Olsen O: Is screening for breast cancer with mammography justifiable? Lancet 355 (9198): 129-34, 2000. [PUBMED Abstract]
- Gøtzsche PC, Nielsen M: Screening for breast cancer with mammography. Cochrane Database Syst Rev (4): CD001877, 2006. [PUBMED Abstract]
- Nyström L, Andersson I, Bjurstam N, et al.: Long-term effects of mammography screening: updated overview of the Swedish randomised trials. Lancet 359 (9310): 909-19, 2002. [PUBMED Abstract]
- Kerlikowske K: Efficacy of screening mammography among women aged 40 to 49 years and 50 to 69 years: comparison of relative and absolute benefit. J Natl Cancer Inst Monogr (22): 79-86, 1997. [PUBMED Abstract]
- Glasziou PP, Woodward AJ, Mahon CM: Mammographic screening trials for women aged under 50. A quality assessment and meta-analysis. Med J Aust 162 (12): 625-9, 1995. [PUBMED Abstract]
- Nelson HD, Tyne K, Naik A, et al.: Screening for breast cancer: an update for the U.S. Preventive Services Task Force. Ann Intern Med 151 (10): 727-37, W237-42, 2009. [PUBMED Abstract]
- Duffy SW, Tabár L, Chen HH, et al.: The impact of organized mammography service screening on breast carcinoma mortality in seven Swedish counties. Cancer 95 (3): 458-69, 2002. [PUBMED Abstract]
- Jonsson H, Nyström L, Törnberg S, et al.: Service screening with mammography of women aged 50-69 years in Sweden: effects on mortality from breast cancer. J Med Screen 8 (3): 152-60, 2001. [PUBMED Abstract]
- Autier P, Koechlin A, Smans M, et al.: Mammography screening and breast cancer mortality in Sweden. J Natl Cancer Inst 104 (14): 1080-93, 2012. [PUBMED Abstract]
- Broeders MJ, Peer PG, Straatman H, et al.: Diverging breast cancer mortality rates in relation to screening? A comparison of Nijmegen to Arnhem and the Netherlands, 1969-1997. Int J Cancer 92 (2): 303-8, 2001. [PUBMED Abstract]
- Verbeek AL, Hendriks JH, Holland R, et al.: Reduction of breast cancer mortality through mass screening with modern mammography. First results of the Nijmegen project, 1975-1981. Lancet 1 (8388): 1222-4, 1984. [PUBMED Abstract]
- Elmore JG, Reisch LM, Barton MB, et al.: Efficacy of breast cancer screening in the community according to risk level. J Natl Cancer Inst 97 (14): 1035-43, 2005. [PUBMED Abstract]
- Autier P, Boniol M, Gavin A, et al.: Breast cancer mortality in neighbouring European countries with different levels of screening but similar access to treatment: trend analysis of WHO mortality database. BMJ 343: d4411, 2011. [PUBMED Abstract]
- Harris R, Yeatts J, Kinsinger L: Breast cancer screening for women ages 50 to 69 years a systematic review of observational evidence. Prev Med 53 (3): 108-14, 2011. [PUBMED Abstract]
- Bleyer A, Welch HG: Effect of three decades of screening mammography on breast-cancer incidence. N Engl J Med 367 (21): 1998-2005, 2012. [PUBMED Abstract]
- Welch HG, Prorok PC, O'Malley AJ, et al.: Breast-Cancer Tumor Size, Overdiagnosis, and Mammography Screening Effectiveness. N Engl J Med 375 (15): 1438-1447, 2016. [PUBMED Abstract]
- Kerlikowske K, Zhu W, Hubbard RA, et al.: Outcomes of screening mammography by frequency, breast density, and postmenopausal hormone therapy. JAMA Intern Med 173 (9): 807-16, 2013. [PUBMED Abstract]
- Coldman A, Phillips N, Wilson C, et al.: Pan-Canadian study of mammography screening and mortality from breast cancer. J Natl Cancer Inst 106 (11): , 2014. [PUBMED Abstract]
- Berry DA, Cronin KA, Plevritis SK, et al.: Effect of screening and adjuvant therapy on mortality from breast cancer. N Engl J Med 353 (17): 1784-92, 2005. [PUBMED Abstract]
- Plevritis SK, Munoz D, Kurian AW, et al.: Association of Screening and Treatment With Breast Cancer Mortality by Molecular Subtype in US Women, 2000-2012. JAMA 319 (2): 154-164, 2018. [PUBMED Abstract]
- Pace LE, Keating NL: A systematic assessment of benefits and risks to guide breast cancer screening decisions. JAMA 311 (13): 1327-35, 2014. [PUBMED Abstract]
- Welch HG, Passow HJ: Quantifying the benefits and harms of screening mammography. JAMA Intern Med 174 (3): 448-54, 2014. [PUBMED Abstract]
- Miller AB, To T, Baines CJ, et al.: The Canadian National Breast Screening Study-1: breast cancer mortality after 11 to 16 years of follow-up. A randomized screening trial of mammography in women age 40 to 49 years. Ann Intern Med 137 (5 Part 1): 305-12, 2002. [PUBMED Abstract]
- Miller AB, To T, Baines CJ, et al.: Canadian National Breast Screening Study-2: 13-year results of a randomized trial in women aged 50-59 years. J Natl Cancer Inst 92 (18): 1490-9, 2000. [PUBMED Abstract]
- Tabár L, Vitak B, Chen TH, et al.: Swedish two-county trial: impact of mammographic screening on breast cancer mortality during 3 decades. Radiology 260 (3): 658-63, 2011. [PUBMED Abstract]
- Hubbard RA, Kerlikowske K, Flowers CI, et al.: Cumulative probability of false-positive recall or biopsy recommendation after 10 years of screening mammography: a cohort study. Ann Intern Med 155 (8): 481-92, 2011. [PUBMED Abstract]
- Braithwaite D, Zhu W, Hubbard RA, et al.: Screening outcomes in older US women undergoing multiple mammograms in community practice: does interval, age, or comorbidity score affect tumor characteristics or false positive rates? J Natl Cancer Inst 105 (5): 334-41, 2013. [PUBMED Abstract]
- Zackrisson S, Andersson I, Janzon L, et al.: Rate of over-diagnosis of breast cancer 15 years after end of Malmö mammographic screening trial: follow-up study. BMJ 332 (7543): 689-92, 2006. [PUBMED Abstract]
- Welch HG, Black WC: Using autopsy series to estimate the disease "reservoir" for ductal carcinoma in situ of the breast: how much more breast cancer can we find? Ann Intern Med 127 (11): 1023-8, 1997. [PUBMED Abstract]
- Black WC, Welch HG: Advances in diagnostic imaging and overestimations of disease prevalence and the benefits of therapy. N Engl J Med 328 (17): 1237-43, 1993. [PUBMED Abstract]
- Duffy SW, Lynge E, Jonsson H, et al.: Complexities in the estimation of overdiagnosis in breast cancer screening. Br J Cancer 99 (7): 1176-8, 2008. [PUBMED Abstract]
- Gøtzsche PC, Jørgensen KJ, Maehlen J, et al.: Estimation of lead time and overdiagnosis in breast cancer screening. Br J Cancer 100 (1): 219; author reply 220, 2009. [PUBMED Abstract]
- Nelson HD, Pappas M, Cantor A, et al.: Harms of Breast Cancer Screening: Systematic Review to Update the 2009 U.S. Preventive Services Task Force Recommendation. Ann Intern Med 164 (4): 256-67, 2016. [PUBMED Abstract]
- Jørgensen KJ, Gøtzsche PC, Kalager M, et al.: Breast Cancer Screening in Denmark: A Cohort Study of Tumor Size and Overdiagnosis. Ann Intern Med 166 (5): 313-323, 2017. [PUBMED Abstract]
- Autier P, Boniol M, Koechlin A, et al.: Effectiveness of and overdiagnosis from mammography screening in the Netherlands: population based study. BMJ 359: j5224, 2017. [PUBMED Abstract]
- Lousdal ML, Kristiansen IS, Møller B, et al.: Effect of organised mammography screening on stage-specific incidence in Norway: population study. Br J Cancer 114 (5): 590-6, 2016. [PUBMED Abstract]
- Harding C, Pompei F, Burmistrov D, et al.: Breast Cancer Screening, Incidence, and Mortality Across US Counties. JAMA Intern Med 175 (9): 1483-9, 2015. [PUBMED Abstract]
- Miller AB, Wall C, Baines CJ, et al.: Twenty five year follow-up for breast cancer incidence and mortality of the Canadian National Breast Screening Study: randomised screening trial. BMJ 348: g366, 2014. [PUBMED Abstract]
- Esserman LJ, Yau C, Thompson CK, et al.: Use of Molecular Tools to Identify Patients With Indolent Breast Cancers With Ultralow Risk Over 2 Decades. JAMA Oncol 3 (11): 1503-1510, 2017. [PUBMED Abstract]
- Baines CJ, To T, Miller AB: Revised estimates of overdiagnosis from the Canadian National Breast Screening Study. Prev Med 90: 66-71, 2016. [PUBMED Abstract]
- Elmore JG, Barton MB, Moceri VM, et al.: Ten-year risk of false positive screening mammograms and clinical breast examinations. N Engl J Med 338 (16): 1089-96, 1998. [PUBMED Abstract]
- Christiansen CL, Wang F, Barton MB, et al.: Predicting the cumulative risk of false-positive mammograms. J Natl Cancer Inst 92 (20): 1657-66, 2000. [PUBMED Abstract]
- Lilleborge M, Falk RS, Russnes H, et al.: Risk of breast cancer by prior screening results among women participating in BreastScreen Norway. Cancer 125 (19): 3330-3337, 2019. [PUBMED Abstract]
- Freitas R, Fiori WF, Ramos FJ, et al.: [Discomfort and pain during mammography]. Rev Assoc Med Bras 52 (5): 333-6, 2006 Sep-Oct. [PUBMED Abstract]
- Armstrong K, Moye E, Williams S, et al.: Screening mammography in women 40 to 49 years of age: a systematic review for the American College of Physicians. Ann Intern Med 146 (7): 516-26, 2007. [PUBMED Abstract]
- Swift M, Morrell D, Massey RB, et al.: Incidence of cancer in 161 families affected by ataxia-telangiectasia. N Engl J Med 325 (26): 1831-6, 1991. [PUBMED Abstract]
- Kopans DB: Mammography and radiation risk. In: Janower ML, Linton OW, eds.: Radiation Risk: a Primer. American College of Radiology, 1996, pp 21-22.
- Feig SA, Ehrlich SM: Estimation of radiation risk from screening mammography: recent trends and comparison with expected benefits. Radiology 174 (3 Pt 1): 638-47, 1990. [PUBMED Abstract]
- Helzlsouer KJ, Harris EL, Parshad R, et al.: Familial clustering of breast cancer: possible interaction between DNA repair proficiency and radiation exposure in the development of breast cancer. Int J Cancer 64 (1): 14-7, 1995. [PUBMED Abstract]
- Suleiman OH, Spelic DC, McCrohan JL, et al.: Mammography in the 1990s: the United States and Canada. Radiology 210 (2): 345-51, 1999. [PUBMED Abstract]
- Miglioretti DL, Lange J, van den Broek JJ, et al.: Radiation-Induced Breast Cancer Incidence and Mortality From Digital Mammography Screening: A Modeling Study. Ann Intern Med 164 (4): 205-14, 2016. [PUBMED Abstract]
- Lerman C, Trock B, Rimer BK, et al.: Psychological side effects of breast cancer screening. Health Psychol 10 (4): 259-67, 1991. [PUBMED Abstract]
- Sandin B, Chorot P, Valiente RM, et al.: Adverse psychological effects in women attending a second-stage breast cancer screening. J Psychosom Res 52 (5): 303-9, 2002. [PUBMED Abstract]
- Brodersen J, Siersma VD: Long-term psychosocial consequences of false-positive screening mammography. Ann Fam Med 11 (2): 106-15, 2013 Mar-Apr. [PUBMED Abstract]
- Gram IT, Lund E, Slenker SE: Quality of life following a false positive mammogram. Br J Cancer 62 (6): 1018-22, 1990. [PUBMED Abstract]
- Burman ML, Taplin SH, Herta DF, et al.: Effect of false-positive mammograms on interval breast cancer screening in a health maintenance organization. Ann Intern Med 131 (1): 1-6, 1999. [PUBMED Abstract]
- Pisano ED, Earp J, Schell M, et al.: Screening behavior of women after a false-positive mammogram. Radiology 208 (1): 245-9, 1998. [PUBMED Abstract]
- Brewer NT, Salz T, Lillie SE: Systematic review: the long-term effects of false-positive mammograms. Ann Intern Med 146 (7): 502-10, 2007. [PUBMED Abstract]
Otras modalidades de obtención de imágenes: ecografía, imágenes por resonancia magnética y termografía
Ecografía
La ecografía se usa para la evaluación diagnóstica de masas palpables o identificadas con mamografía, no como modalidad primaria de detección. En una revisión de la bibliografía médica y las opiniones de expertos del European Group for Breast Cancer Screening, se concluyó que "la evidencia es insuficiente para respaldar el uso de la ecografía como examen de detección del cáncer de mama en la población de cualquier edad".[1] El Japan Strategic Anti-cancer Randomized Trial (J-START) es un ensayo de exámenes de detección en mujeres de 40 a 49 años que se asignaron al azar a mamografía y ecografía de detección (grupo de intervención) o mamografía sola (grupo de control). Los resultados iniciales de este ensayo indicaron que la detección adicional con ecografía (por ejemplo, mamografía con ecografía versus mamografía sola) aumentó la tasa de detección del cáncer de mama en estadio temprano, pero su efecto en la mortalidad no está claro.[2]
Imágenes por resonancia magnética de la mama
Las imágenes por resonancia magnética (IRM) de la mama se usan en las mujeres para una evaluación diagnóstica, incluso la evaluación de la integridad de los implantes mamarios de silicona, la evaluación de masas palpables posterior a la cirugía o la radioterapia, la detección de cáncer de mama inadvertido por mamografía y ecografía en pacientes con metástasis ganglionar axilar, así como la planificación preoperatoria de algunas pacientes con cáncer de mama identificado. No hay exposición a la radiación ionizante durante este procedimiento. Las IRM de la mama se promovieron como examen de detección para el cáncer de mama de mujeres con riesgo elevado de presentar este cáncer por mutaciones en BRCA1/2, antecedentes familiares importantes de cáncer de mama o varios síndromes genéticos como el de Li-Fraumeni o la enfermedad de Cowden.[3-5] Las IRM de la mama es más sensible, pero menos específica que los exámenes de detección con mamografía [6,7] y es hasta 35 veces más costosa.[8-12]
Termografía
Con el uso de técnicas de obtención de imágenes infrarrojas, la termografía de la mama identifica cambios de temperatura en la piel que tal vez indiquen un tumor subyacente porque muestran estos cambios en patrones de colores. La Administración de Alimentos y Medicamentos de los Estados Unidos aprobó el uso de los dispositivos termográficos mediante el proceso 510(k); sin embargo, no se realizaron ensayos aleatorizados que comparen la termografía con otras modalidades de detección. En estudios de cohortes pequeños, no se indica ningún beneficio adicional por el uso de la termografía como una modalidad auxiliar.[13,14]
Bibliografía
- Teh W, Wilson AR: The role of ultrasound in breast cancer screening. A consensus statement by the European Group for Breast Cancer Screening. Eur J Cancer 34 (4): 449-50, 1998. [PUBMED Abstract]
- Ohuchi N, Suzuki A, Sobue T, et al.: Sensitivity and specificity of mammography and adjunctive ultrasonography to screen for breast cancer in the Japan Strategic Anti-cancer Randomized Trial (J-START): a randomised controlled trial. Lancet 387 (10016): 341-348, 2016. [PUBMED Abstract]
- Warner E, Plewes DB, Hill KA, et al.: Surveillance of BRCA1 and BRCA2 mutation carriers with magnetic resonance imaging, ultrasound, mammography, and clinical breast examination. JAMA 292 (11): 1317-25, 2004. [PUBMED Abstract]
- Kriege M, Brekelmans CT, Boetes C, et al.: Efficacy of MRI and mammography for breast-cancer screening in women with a familial or genetic predisposition. N Engl J Med 351 (5): 427-37, 2004. [PUBMED Abstract]
- Warner E, Hill K, Causer P, et al.: Prospective study of breast cancer incidence in women with a BRCA1 or BRCA2 mutation under surveillance with and without magnetic resonance imaging. J Clin Oncol 29 (13): 1664-9, 2011. [PUBMED Abstract]
- Lord SJ, Lei W, Craft P, et al.: A systematic review of the effectiveness of magnetic resonance imaging (MRI) as an addition to mammography and ultrasound in screening young women at high risk of breast cancer. Eur J Cancer 43 (13): 1905-17, 2007. [PUBMED Abstract]
- Lehman CD, Gatsonis C, Kuhl CK, et al.: MRI evaluation of the contralateral breast in women with recently diagnosed breast cancer. N Engl J Med 356 (13): 1295-303, 2007. [PUBMED Abstract]
- Pataky R, Armstrong L, Chia S, et al.: Cost-effectiveness of MRI for breast cancer screening in BRCA1/2 mutation carriers. BMC Cancer 13: 339, 2013. [PUBMED Abstract]
- Saadatmand S, Tilanus-Linthorst MM, Rutgers EJ, et al.: Cost-effectiveness of screening women with familial risk for breast cancer with magnetic resonance imaging. J Natl Cancer Inst 105 (17): 1314-21, 2013. [PUBMED Abstract]
- Ahern CH, Shih YC, Dong W, et al.: Cost-effectiveness of alternative strategies for integrating MRI into breast cancer screening for women at high risk. Br J Cancer 111 (8): 1542-51, 2014. [PUBMED Abstract]
- Pistolese CA, Ciarrapico AM, della Gatta F, et al.: Inappropriateness of breast imaging: cost analysis. Radiol Med 118 (6): 984-94, 2013. [PUBMED Abstract]
- Cott Chubiz JE, Lee JM, Gilmore ME, et al.: Cost-effectiveness of alternating magnetic resonance imaging and digital mammography screening in BRCA1 and BRCA2 gene mutation carriers. Cancer 119 (6): 1266-76, 2013. [PUBMED Abstract]
- Wishart GC, Campisi M, Boswell M, et al.: The accuracy of digital infrared imaging for breast cancer detection in women undergoing breast biopsy. Eur J Surg Oncol 36 (6): 535-40, 2010. [PUBMED Abstract]
- Arora N, Martins D, Ruggerio D, et al.: Effectiveness of a noninvasive digital infrared thermal imaging system in the detection of breast cancer. Am J Surg 196 (4): 523-6, 2008. [PUBMED Abstract]
Modalidades de detección sin imágenes
Examen clínico de la mama
Aún no se ha establecido por completo la repercusión del examen clínico de la mama (ECM) en la mortalidad por cáncer de mama. En el Canadian National Breast Screening Study (CNBSS), se comparó el uso del ECM de calidad alta junto con la mamografía, con el uso del ECM solo en mujeres de 50 a 59 años. Profesionales de la salud capacitados llevaron a cabo ECM que duraron de 5 a 10 minutos por mama y se incluyeron evaluaciones periódicas de la calidad del procedimiento. La frecuencia del diagnóstico de cáncer, el estadio de cáncer, los casos de cáncer de intervalo y la mortalidad por cáncer de mama fueron similares en los dos grupos y los desenlaces similares al uso de la mamografía sola.[1] Tras un seguimiento promedio de 13 años, la mortalidad por cáncer de mama fue semejante en los dos grupos (cociente de tasa de mortalidad, 1,02; intervalo de confianza [IC] 95 %, 0,78–1,33).[2] Los investigadores calcularon las características operatorias del ECM solo; en 19 965 mujeres de 50 a 59 años, la sensibilidad fue del 83 %, 71 %, 57 %, 83 % y 77 % en los años 1, 2, 3, 4 y 5 del ensayo, respectivamente, y la especificidad osciló entre el 88 % y el 96 %. El valor pronóstico positivo (VPP), que es la proporción de cánceres que se detectan por examen anormal, se calculó entre el 3 % y el 4 %. Para 25 620 mujeres de 40 a 49 años que solo se sometieron a un examen al ingresar en el ensayo, se calculó una sensibilidad del 71 %, una especificidad del 84 %, y un VPP del 1,5 %.[3]
En los ensayos clínicos en los que participaron médicos comunitarios, el ECM tuvo una especificidad más alta (97–99 %) [4] y una sensibilidad más baja (22–36 %) que la obtenida por los examinadores.[5-8] En un estudio de exámenes de detección practicados a mujeres con antecedentes familiares de cáncer de mama, se observó que, tras una evaluación inicial normal, la paciente misma o el médico que realizó el ECM identificó más cánceres que la mamografía.[9]
En otro estudio, se evaluó la utilidad de agregar el ECM a los exámenes de detección con mamografía; en 61 688 mujeres mayores de 40 años y sometidas a mamografía y ECM, la sensibilidad de la mamografía fue del 78 %, y la de la mamografía y el ECM combinados fue del 82 %. La especificidad fue más baja en las mujeres que se sometieron a ambas modalidades de exámenes de detección, que en las que solo se sometieron a mamografía (97 vs. 99 %).[10] En otro estudio se notificaron los resultados de un ensayo grande de conglomerados controlado aleatorizado, realizado en la India, donde se evaluó la eficacia de los exámenes de detección con ECM versus la ausencia de exámenes de detección en la mortalidad por cáncer de mama.[11] En este ensayo se incluyeron 151 538 mujeres con edades entre 35 y 64 años sin antecedentes de cáncer de mama. Al cabo de 20 años de seguimiento, hubo una disminución general estadísticamente no significativa del 15 % en la mortalidad por cáncer de mama en el grupo de exámenes de detección con ECM versus el grupo de control, pero en un análisis a posteriori de subgrupos se demostró una disminución relativa estadísticamente significativa del 30 % en la mortalidad atribuible a la detección con ECM en mujeres mayores de 50 años. Sin embargo, los resultados del análisis de subgrupos se deben interpretar con cautela, ya que fue un ensayo de conglomerados aleatorizado con solo 20 conglomerados, lo que deja dudas sobre posibles desequilibrios entre los grupos control y los grupos de estudio del ensayo. Otros ensayos internacionales de ECM se encuentran en curso: uno en India y otro en Egipto.
Autoexamen de la mama
Se ha promovido el autoexamen de la mama (AEM) mensual, pero no se ha comprobado su eficacia en la reducción de la mortalidad por cáncer de mama.[12,13] En el único ensayo clínico aleatorizado grande bien realizado de AEM, se asignó al azar a 266 064 mujeres trabajadoras de una fábrica en Shanghái a recibir educación sobre el AEM con refuerzo y motivación para hacérselo, o educación para la prevención del lumbago. Ningún grupo se sometió a otro examen de detección del cáncer de mama. Al cabo de 10 a 11 años de seguimiento, hubo 135 muertes por cáncer de mama en el grupo que recibió la capacitación y 131, en el grupo de control (riesgo relativo [RR] = 1,04; IC 95 %, 0,82–1,33). Si bien el número de cánceres de mama invasivos que se diagnosticó en los dos grupos fue prácticamente el mismo, las mujeres del grupo de capacitación tuvieron más biopsias de mama y más lesiones benignas que las mujeres del grupo de control.[14]
Otros resultados de investigación sobre AEM provienen de tres ensayos. En primer lugar, más de 100 000 mujeres de Leningrado se asignaron a la capacitación para el AEM o a grupos de control aleatorizados; el grupo con capacitación en AEM se sometió a más biopsias de mama sin que mejorara la mortalidad por cáncer de mama.[15] En segundo lugar, en el Trial of Early Detection of Breast Cancer en dos distritos del Reino Unido, se invitó a más de 63 500 mujeres de 45 a 64 años a sesiones educativas sobre el AEM. Al cabo de 10 años de seguimiento, las tasas de mortalidad por cáncer de mama fueron similares a las tasas observadas en los centros sin capacitación organizada para el AEM (RR = 1,07; IC 95 %, 0,93–1,22).[16] En tercer lugar, y por el contrario, en un estudio anidado de casos y controles del CNBSS, se comparó la frecuencia de la realización del AEM, informada por las mismas pacientes antes de su inscripción, con la mortalidad por cáncer de mama. Las mujeres que se examinaron las mamas visualmente y utilizaron la yema de los tres dedos del medio para palparlas tuvieron una tasa de mortalidad por cáncer de mama más baja.[17]
Muestreo de tejido (aspiración con aguja fina, aspiración de pezón, aspiración de lavado ductal)
Se han propuesto distintos métodos para analizar el tejido mamario para encontrar neoplasias malignas mediante la detección del cáncer de mama, pero ninguno de estos se relaciona con una disminución de la mortalidad.
Bibliografía
- Baines CJ: The Canadian National Breast Screening Study: a perspective on criticisms. Ann Intern Med 120 (4): 326-34, 1994. [PUBMED Abstract]
- Miller AB, To T, Baines CJ, et al.: Canadian National Breast Screening Study-2: 13-year results of a randomized trial in women aged 50-59 years. J Natl Cancer Inst 92 (18): 1490-9, 2000. [PUBMED Abstract]
- Baines CJ, Miller AB, Bassett AA: Physical examination. Its role as a single screening modality in the Canadian National Breast Screening Study. Cancer 63 (9): 1816-22, 1989. [PUBMED Abstract]
- Fenton JJ, Rolnick SJ, Harris EL, et al.: Specificity of clinical breast examination in community practice. J Gen Intern Med 22 (3): 332-7, 2007. [PUBMED Abstract]
- Fenton JJ, Barton MB, Geiger AM, et al.: Screening clinical breast examination: how often does it miss lethal breast cancer? J Natl Cancer Inst Monogr (35): 67-71, 2005. [PUBMED Abstract]
- Bobo JK, Lee NC, Thames SF: Findings from 752,081 clinical breast examinations reported to a national screening program from 1995 through 1998. J Natl Cancer Inst 92 (12): 971-6, 2000. [PUBMED Abstract]
- Oestreicher N, White E, Lehman CD, et al.: Predictors of sensitivity of clinical breast examination (CBE). Breast Cancer Res Treat 76 (1): 73-81, 2002. [PUBMED Abstract]
- Kolb TM, Lichy J, Newhouse JH: Comparison of the performance of screening mammography, physical examination, and breast US and evaluation of factors that influence them: an analysis of 27,825 patient evaluations. Radiology 225 (1): 165-75, 2002. [PUBMED Abstract]
- Gui GP, Hogben RK, Walsh G, et al.: The incidence of breast cancer from screening women according to predicted family history risk: Does annual clinical examination add to mammography? Eur J Cancer 37 (13): 1668-73, 2001. [PUBMED Abstract]
- Oestreicher N, Lehman CD, Seger DJ, et al.: The incremental contribution of clinical breast examination to invasive cancer detection in a mammography screening program. AJR Am J Roentgenol 184 (2): 428-32, 2005. [PUBMED Abstract]
- Mittra I, Mishra GA, Dikshit RP, et al.: Effect of screening by clinical breast examination on breast cancer incidence and mortality after 20 years: prospective, cluster randomised controlled trial in Mumbai. BMJ 372: n256, 2021. [PUBMED Abstract]
- Baxter N; Canadian Task Force on Preventive Health Care: Preventive health care, 2001 update: should women be routinely taught breast self-examination to screen for breast cancer? CMAJ 164 (13): 1837-46, 2001. [PUBMED Abstract]
- Humphrey LL, Helfand M, Chan BK, et al.: Breast cancer screening: a summary of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med 137 (5 Part 1): 347-60, 2002. [PUBMED Abstract]
- Thomas DB, Gao DL, Ray RM, et al.: Randomized trial of breast self-examination in Shanghai: final results. J Natl Cancer Inst 94 (19): 1445-57, 2002. [PUBMED Abstract]
- Semiglazov VF, Moiseyenko VM, Bavli JL, et al.: The role of breast self-examination in early breast cancer detection (results of the 5-years USSR/WHO randomized study in Leningrad). Eur J Epidemiol 8 (4): 498-502, 1992. [PUBMED Abstract]
- Ellman R, Moss SM, Coleman D, et al.: Breast cancer mortality after 10 years in the UK trial of early detection of breast cancer. UK Trial of Early Detection of Breast Cancer Group. The Breast 2 (1): 13-20, 1993.
- Harvey BJ, Miller AB, Baines CJ, et al.: Effect of breast self-examination techniques on the risk of death from breast cancer. CMAJ 157 (9): 1205-12, 1997. [PUBMED Abstract]
Apéndice de ensayos controlados aleatorizados
Health Insurance Plan, Estados Unidos, 1963 [1,2]
- Edad en el momento del ingreso: 40 a 64 años.
- Aleatorización: individual, pero con desequilibrios marcados en la distribución de las mujeres entre los grupos asignados, según se confirmó por el estado menopáusico (P < 0,0001) y el grado de escolaridad (P = 0,05).
- Tamaño de la muestra: de 30 000 a 31 092 en el grupo de estudio y de 30 565 a 30 765 en el grupo de control.
- Congruencia de los informes: variación en los informes sobre el tamaño de las muestras.
- Intervención: mamografía con dos proyecciones (MMG) y examen clínico de la mama (ECM) anual durante 3 años.
- Control: atención normal.
- Cumplimiento: las mujeres que faltaron al primer examen de detección (35 % de la población examinada) no recibieron una segunda invitación.
- Contaminación: el examen de detección con MMG no se ofreció fuera del ensayo; se desconoce la frecuencia del ECM en las mujeres del grupo de control.
- Atribución de la causa de muerte: las mujeres que se diagnosticaron antes de ingresar al estudio y que murieron por cáncer de mama se excluyeron de la comparación entre los grupos de examen de detección y de control. Sin embargo, estas exclusiones se determinaron de manera diferente en los dos grupos. Las mujeres del grupo de exámenes de detección se excluyeron según decisiones tomadas durante el período del estudio en que se sometieron a exámenes de detección tras las consultas iniciales. Estas mujeres no se volvieron a tener en cuenta en el estudio. Desde el punto de vista del diseño, los controles no recibieron consultas clínicas sistemáticas, por lo que no se determinó el estado del cáncer de estas pacientes antes del estudio. Ante la muerte de una paciente del grupo de control por cáncer de mama, se realizó un análisis retrospectivo a fin de determinar la fecha de diagnóstico de la enfermedad. Si la fecha era anterior al período de estudio, el paciente del grupo de control se excluyó del análisis. Es posible que esta diferencia en la metodología cree un sesgo marcado en la comparación de la mortalidad por cáncer de mama entre los dos grupos, y es probable que dicho sesgo favorezca los exámenes de detección.
- Análisis: seguimiento.
- Auditoría externa: ninguna.
- Duración del seguimiento: 18 años.
- Riesgo relativo de muerte por cáncer de mama en el grupo de exámenes de detección en comparación con el grupo de control (intervalo de confianza [IC] 95 %): 0,71 (0,55–0,93) a 10 años y 0,77 (0,61–0,97) a 15 años.
- Comentarios: la calidad de las MMG fue precaria en comparación con las que se realizaron en ensayos posteriores debido a equipos y técnicas obsoletos. La intervención incluyó tanto MMG como ECM. Las preocupaciones principales sobre la eficacia del ensayo son la validez de la aleatorización inicial y la exclusión diferencial de las mujeres con antecedentes de cáncer de mama.
- Edad en el momento del ingreso: 45 a 69 años.
- Aleatorización: individual, para cada cohorte de año de nacimiento para el ensayo de detección con MMG en la primera fase (MMST I). Individual para toda la cohorte constituida por fecha de nacimiento entre 1933 y 1945 para MMST II, pero con variaciones impuestas por la escasez de recursos. La validación por análisis de edad en ambos grupos no revela ninguna diferencia marcada.
- Exclusiones: en un metanálisis sueco, se excluyó a 393 mujeres con cáncer de mama prexistente del grupo de intervención y a 412 del grupo de control. Sin embargo, en general, se excluyó a 86 mujeres más del grupo de intervención que del grupo de control.
- Tamaño de la muestra: 21 088 en el grupo de estudio y 21 195 en el grupo de control.
- Congruencia de los informes: los números de pacientes no se modificaron.
- Intervención: MMG de dos proyecciones cada 18 a 24 meses × 5.
- Control: atención normal, con MMG al final del estudio.
- Cumplimiento: no se les dio seguimiento a las participantes que migraron de Malmö (2 % por año). La tasa de participación de las mujeres en el estudio fue del 74 % para el primer ciclo y del 70 % para los ciclos posteriores.
- Contaminación: el 24 % de todas las mujeres del grupo de control se sometieron al menos a una MMG, al igual que el 35 % de las mujeres del grupo de control de 45 a 49 años.
- Atribución de la causa de muerte: tasa de autopsia del 76 % en el informe preliminar, tasa más baja después. Evaluación de la causa de muerte con anonimato para las mujeres con diagnóstico de cáncer de mama. Vinculado al Swedish Cause of Death Registry.
- Análisis: evaluación inicial. Análisis de seguimiento, como parte del metanálisis sueco.[5]
- Auditoría externa: ninguna.
- Duración del seguimiento: 12 años.
- Riesgo relativo de muerte por cáncer de mama, en el grupo de exámenes de detección en comparación con el grupo de control (IC 95 %): 0,81 (0,62–1,07).
- Comentarios: el análisis evaluativo exigió un factor de ajuste para el retraso en la realización de la MMG en el grupo de control. En la mayoría de los análisis, se combinaron los dos ensayos de Malmö: MMST I y MMST II.
Östergötland (County E of Two-County Trial), Suecia, 1977 [6-8]
- Edad en el momento del ingreso: 40 a 74 años.
- Aleatorización: agrupación geográfica con estratificación conforme a la residencia (urbana o rural), factores socioeconómicos y tamaño. La incidencia del cáncer de mama y mortalidad de referencia fueron comparables entre los grupos geográficos asignados al azar. Las mujeres del estudio eran mayores que las mujeres del grupo de control, P < 0,0001, lo que no afectaría mucho el resultado del ensayo.
- Exclusiones: las mujeres con cáncer de mama prexistente se excluyeron de ambos grupos, pero los números se notifican de manera diferente en las distintas publicaciones. El metanálisis sueco excluyó a todas las mujeres con diagnóstico previo de cáncer de mama, independientemente del grupo al que se asignaron.
- Tamaño de la muestra: notificación variable, que osciló entre 38 405 y 39 034 en el grupo de estudio y entre 37 145 y 37 936 en el grupo de control.
- Congruencia de los informes: variable.
- Intervención: 3 MMG de proyección única cada 2 años para las mujeres menores de 50 años, y cada 33 meses para las mujeres de 50 años y más.
- Referencia: atención normal, con MMG al final del estudio.
- Cumplimiento: el 89 % de quienes se sometieron a detección.
- Contaminación: el 13 % de las mujeres en el ensayo Two-County se sometieron a MMG como parte de la atención sistemática; la mayoría en 1983 y 1984.
- Atribución de la causa de muerte: determinada por un equipo de médicos locales. Cuando se recalcularon los resultados en el metanálisis sueco, con datos del Swedish Cause of Death Registry, el beneficio de los exámenes de detección fue inferior al que se notificó antes.
- Análisis: evaluación en un inicio, con ajuste por retraso en la MMG del grupo de control. Análisis de seguimiento, como parte del metanálisis sueco.[5]
- Auditoría externa: no. Sin embargo, un grupo sueco conformado por los investigadores del ensayo adjudicó los casos de cáncer de mama y las muertes.[9]
- Duración del seguimiento: 12 años.
- Riesgo relativo de muerte por cáncer de mama, en el grupo de exámenes de detección en comparación con el grupo de control (IC 95 %): 0,82 (0,64–1,05), Ostrogotia.
- Comentarios: se expresaron inquietudes sobre la metodología de aleatorización y el análisis de evaluación, que exigieron un ajuste por la realización tardía de la MMG en el grupo de control. El metanálisis sueco resolvió estas cuestiones correctamente.
Kopparberg (County W of Two-County Trial), Suecia, 1977 [6-8]
- Edad en el momento del ingreso: 40 a 74 años.
- Aleatorización: agrupación geográfica con estratificación conforme a la residencia (urbana o rural), factores socioeconómicos y tamaño. No se describió el proceso de aleatorización. Las mujeres del estudio eran mayores que las mujeres del grupo de control, P < 0,0001, pero esto no debería haber tenido un efecto importante en el resultado del ensayo.
- Exclusiones: las mujeres con cáncer de mama prexistente se excluyeron de ambos grupos, pero los números se notificaron de manera diferente en las publicaciones.
- Tamaño de la muestra: notificación variable, que osciló entre 38 562 y 39 051 en el grupo de intervención, y entre 18 478 y 18 846 en el grupo de control.
- Congruencia de los informes: variable.
- Intervención: 3 MMG de proyección única cada 2 años para mujeres menores de 50 años, y cada 33 meses para mujeres de 50 años y más.
- Control: atención normal, con MMG al final del estudio.
- Cumplimiento: el 89 % de las participantes.
- Contaminación: el 13 % de las mujeres en el Two-County Trial se sometieron a MMG como parte de la atención sistemática, en la mayoría de los casos entre 1983 y 1984.
- Atribución de la causa de muerte: se determinó por parte de un equipo de médicos locales (ver Ostrogotia).
- Análisis: evaluación.
- Auditoría externa: no. Sin embargo, un grupo sueco conformado por los investigadores del ensayo adjudicó los casos de cáncer de mama y las muertes.[9]
- Duración del seguimiento: 12 años.
- Riesgo relativo de muerte por cáncer de mama, en el grupo de detección en comparación con el grupo de control (IC 95 %): 0,68 (0,52–0,89).
Edimburgo, Reino Unido, 1976 [10]
- Edad en el momento del ingreso: 45 a 64 años.
- Aleatorización: agrupación por consultorios médicos, si bien se modificaron muchas asignaciones a aleatorización después del inicio del estudio. En cada consultorio, la inscripción de mujeres fue incongruente y dependió de la opinión del médico sobre la aptitud de cada mujer para el ensayo. No se reconocieron grandes diferencias en el nivel socioeconómico entre los consultorios hasta después del final del estudio.
- Exclusiones: se excluyó a más mujeres con cáncer de mama prexistente del grupo de intervención (338) que del grupo de control (177).
- Tamaño de la muestra: 23 226 en el grupo de estudio y 21 904 en el grupo de control.
- Congruencia de los informes: buena.
- Intervención: al inicio, MMG de 2 proyecciones y ECM; luego, ECM anual con MMG de proyección única en el tercer, quinto y séptimo año.
- Control: atención normal.
- Cumplimiento: el 61 % de quienes se sometieron a detección.
- Contaminación: ninguna.
- Atribución de la causa de muerte: datos del registro de cáncer.
- Análisis: seguimiento.
- Auditoría externa: ninguna.
- Duración del seguimiento: 10 años.
- Riesgo relativo de muerte por cáncer de mama: grupo de detección en comparación con el grupo de control (IC 95 %): 0,84 (0,63-1,12).
- Comentarios: el proceso de aleatorización presentó fallas. Es probable que las diferencias socioeconómicas entre los grupos de estudio y de control expliquen la mortalidad más alta por todas las causas en las mujeres del grupo de control, en comparación con las mujeres que se sometieron a los exámenes de detección. Esta diferencia en la mortalidad por todas las causas fue cuatro veces superior a la mortalidad por cáncer de mama en el grupo de control y, por lo tanto, es posible explicar la mortalidad más alta por cáncer de mama en el grupo de control, en comparación con las mujeres que se sometieron a exámenes de detección. Si bien se utilizó un factor de corrección en el análisis final, es posible que este no ajuste el análisis lo suficiente.
El diseño y la realización del estudio dificultan la evaluación de estos resultados o su combinación con los resultados de otros ensayos.
Canadian National Breast Screening Study (CNBSS)-1, Canadá, 1980 [11]
- Edad en el momento del ingreso: 40 a 49 años.
- Aleatorización: voluntarias individuales, con nombres ingresados sucesivamente en las listas de asignación. Si bien se presentaron críticas con respecto al procedimiento de aleatorización, en una revisión independiente y minuciosa no se hallaron pruebas de subversión; además, esa subversión fue improbable a una escala lo suficientemente grande como para influir en los resultados.[12]
- Exclusiones: pocas, equilibradas entre los grupos.
- Tamaño de la muestra: 25 214 en el grupo de estudio (100 % sometido a exámenes de detección después del ECM de ingreso) y 25 216 en el grupo de control.
- Congruencia de los informes: buena.
- Intervención: MMG anual de 2 proyecciones y ECM durante 4 a 5 años.
- Control: atención normal.
- Cumplimiento: del 100 % al inicio, disminuyó al 85,5 % en el quinto examen de detección.
- Contaminación: del 26,4 % en el grupo de atención usual.
- Atribución de la causa de muerte: partidas de defunción, con revisión de casos cuestionables por parte de un grupo de revisión con anonimato. Vinculada también con las estadísticas de la Canadian Mortality Data Base, Statistics Canada.
- Análisis: seguimiento.
- Auditoría externa: sí. Independiente, con el análisis de datos realizado por varios revisores.
- Duración del seguimiento: 25 años.
- Riesgo relativo de muerte por cáncer de mama: grupo de detección en comparación con el grupo de control (IC 95 %): 1,09 (0,80-1,49).
- Comentarios: este es el único ensayo diseñado específicamente para estudiar a mujeres de 40 a 49 años. Se incluyeron los cánceres que se diagnosticaron en el momento del ingreso en los grupos de estudio y control. Antes de finalizar el ensayo, se expresaron inquietudes sobre la suficiencia técnica de las MMG, la capacitación de los radiólogos y la homologación de los equipos, lo cual llevó a una revisión externa independiente. La deficiencia principal que identificó esta revisión fue el uso de la proyección mediolateral entre 1980 y 1985, en lugar de la proyección oblicua mediolateral que se utilizó después de 1985.[13] En análisis posteriores, se determinó que el tamaño y el estadio de los cánceres que se detectaron con mamografía en este ensayo eran equivalentes a los de otros ensayos.[14] Este ensayo y el NBSS-2 difieren de los otros ensayos controlados aleatorizados (ECA) en el uso congruente de la hormonoterapia y quimioterapia adyuvantes tras el tratamiento local del cáncer de mama en mujeres con enfermedad en los ganglios axilares.
CNBSS-2, Canadá, 1980 [15]
- Edad en el momento del ingreso: 50 a 59 años.
- Aleatorización: voluntaria individual (ver NBSS-1).
- Exclusiones: pocas, equilibradas entre los grupos.
- Tamaño de la muestra: 19 711 en el grupo de estudio (100 % sometido a exámenes de detección después del ECM de ingreso) y 19 694 en el grupo de control.
- Intervención: MMG de 2 proyecciones y ECM anuales.
- Control: ECM anual.
- Cumplimiento: el 100 % inicialmente; disminuyó al 86,7 % en el quinto examen de detección en el grupo que se sometió a MMG y ECM. El 100 % inicialmente; disminuyó al 85,4 % en el quinto examen de detección en el grupo que se sometió solo a ECM.
- Contaminación: el 16,9 % del grupo que solo se sometió a ECM.
- Atribución de la causa de muerte: partidas de defunción, con revisión de casos cuestionables por parte de un grupo de revisión con anonimato. Vinculada también con las estadísticas de la Canadian Mortality Data Base, Statistics Canada.
- Análisis: seguimiento.
- auditoría externa: sí. Independiente, con el análisis de los datos por varios revisores.
- Duración del seguimiento: 25 años.
- Riesgo relativo de muerte por cáncer de mama, detección vs. control: 1,02 (IC 95 %, 0,77–1,36).
- Comentarios: este ensayo es único debido a que se compara una modalidad de exámenes de detección con otra y no incluye a un grupo de control que no se somete a los exámenes. En relación con las críticas y los comentarios sobre este ensayo, ver el NBSS-1.
Estocolmo, Suecia, 1981 [16]
- Edad en el momento del ingreso: 40 a 64 años.
- Aleatorización: agrupación por fecha de nacimiento. Se realizaron dos ensayos secundarios, con aleatorización equilibrada en el primero y un desequilibrio marcado en el segundo, con 508 mujeres más en el grupo de exámenes de detección que en el grupo de control.
- Exclusiones: notificación incongruente.
- Tamaño de la muestra: en los informes publicados, el tamaño disminuyó de 40 318 a 38 525 en el grupo de intervención y aumentó de 19 943 a 20 978 en el grupo de control.
- Congruencia de los informes: variable.
- Intervención: MMG de proyección única cada 28 meses × 2.
- Control: MMG en el quinto año.
- Cumplimiento: el 82 % sometidas a exámenes de detección.
- Contaminación: al 25 % de las mujeres que ingresaron en el estudio se les realizó una MMG en los tres años previos al ingreso.
- Atribución de la causa de muerte: vinculada con el Swedish Cause of Death Registry.
- Análisis: evaluación, con retraso de 1 año en la MMG posterior al ensayo en el grupo de control. Análisis de seguimiento, como parte del metanálisis sueco.[5]
- auditoría externa: ninguna.
- Duración del seguimiento: 8 años.
- Riesgo relativo de muerte por cáncer de mama, grupo de exámenes de detección en comparación con el grupo de control (IC 95 %): 0,80 (0,53–1,22).
- Comentarios: hubo inquietudes sobre la aleatorización, en particular en el segundo ensayo secundario, así como sobre las exclusiones y el retraso en la MMG en el grupo de control. La inclusión de estos datos en el metanálisis sueco resuelve muchos de estos interrogantes.
Gotemburgo, Suecia, 1982
- Edad en el momento del ingreso: 39 a 59 años.
- Aleatorización: compleja; agrupación al azar según el año de nacimiento por día de nacimiento en el grupo de mayor edad (de 50 a 59 años) y por individuo en el grupo más joven (de 39 a 49 años); el cociente entre el grupo de estudio y el de control se modificó según el año, de acuerdo con la disponibilidad de la MMG (la aleatorización se realizó entre 1982 y 1984).
- Exclusiones: se excluyó una proporción similar de mujeres de ambos grupos debido a diagnóstico de cáncer de mama previo (1,2 % cada uno).
- Tamaño de la muestra en la publicación más reciente: 21 650 en el grupo de estudio; 29 961 en el grupo de control.
- Congruencia de los informes: variable.
- Intervención: MMG inicial con 2 proyecciones, luego MMG de proyección única cada 18 meses × 4. Lectura simple en las tres primeras rondas, luego lectura doble.
- Control: el grupo de control se sometió a un examen de detección entre 3 y 8 meses después del examen de detección final en el grupo de estudio.
- Atribución de la causa de muerte: vinculada al Swedish Cause of Death Registry; también participó un comité independiente de criterios de valoración.
- Análisis: métodos de evaluación y de seguimiento.[5]
- Auditoría externa: ninguna.
- Duración del seguimiento: 12 a 14 años.
- Riesgo relativo de muerte por cáncer de mama, grupo de exámenes de detección en comparación con el grupo de control (IC 95 %): mujeres entre 39 y 59 años: 0,79 (0,58–1,08) [evaluación]; 0,77 (0,60–1,00) [seguimiento].
- Comentarios: no hubo reducción para las mujeres de 50 a 54 años, pero hubo reducciones similares para otros grupos que abarcaban 5 años de edad.
- Conclusiones: el retraso en realizar la MMG en el grupo de control y los números desiguales de mujeres en el grupo invitado y el de control (proceso de aleatorización complejo) complica la interpretación.
- Edad en el momento del ingreso: 39 a 41 años.
- Aleatorización: mujeres de listas de médicos generales en zonas geográficamente definidas de Inglaterra, Gales y Escocia; se ocultó la asignación.
- Exclusiones: número pequeño (n = 30 en el grupo invitado y n = 51 en el grupo no invitado) en cada grupo porque no se pudo ubicar a las personas o fallecieron.
- Tamaño de la muestra: 160 921 (53 884 invitadas; 106 956 no invitadas).
- Congruencia de los informes: no corresponde.
- Intervención: se ofreció un examen de detección anual con MMG (primer examen de detección de dos proyecciones, seguida de proyección oblicua mediolateral única en adelante) al grupo invitado de 48 años y menos; el 68 % aceptó el examen de detección en la primera ocasión. Luego, se volvió a invitar a alrededor de 69–70 % de las mujeres (81 % asistió a por lo menos 1 examen de detección).
- Control: las mujeres no invitadas recibieron atención médica habitual, sin saber si participaban o no; pocas se habían sometido a un examen de detección antes de la aleatorización.
- Atribución de la causa de muerte: según el código de la partida de defunción aceptado en el registro central del National Health Service (NHS).
- Análisis: método de seguimiento con intención de tratar (si bien el NHS ofrecería exámenes de detección a todas las mujeres de 50 años).
- Auditoría externa: ninguna.
- Duración del seguimiento: 10,7 años.
- Riesgo relativo de muerte por cáncer de mama, grupo de exámenes de detección en comparación con el grupo de control (IC 95 %): 0,83 (0,66–1,04).
- Conclusiones: no es un resultado con significación estadística, pero se corresponde con otros estudios.
- Duración del seguimiento: restringido a 10 años después de la aleatorización.
- Riesgo relativo de muerte por cáncer de mama: grupo de detección en comparación con el grupo de control (IC 95 %): 0,75 (0,58–0,97).
- Conclusiones: resultado con significación estadística.
- Duración del seguimiento: mediana de 17,7 años.
- Riesgo relativo de muerte por cáncer de mama: grupo de detección en comparación con el grupo de control (IC 95 %): 0,88 (0,74–1,04).
- Conclusiones: resultado sin significación estadística.
- Duración del seguimiento: mediana de 17,7 años.
- Riesgo relativo de mortalidad por todas las causas, detección vs. control (IC 95 %): 0,98 (0,93–1,03).
- Conclusiones: resultado sin significación estadística.
En el United Kingdom Age Trial, un ECA grande, se evaluó el efecto de los exámenes de detección mamográficos en la mortalidad por cáncer de mama en mujeres de 40 años o más a las que se invitó a someterse a una mamografía anual, en comparación con los programas de detección del NHS que comenzaban a los 50 años. El criterio principal de valoración del ensayo AGE fue la mortalidad por cáncer de mama diagnosticado durante el período de intervención hasta inmediatamente antes del primer examen de detección del NHS. Este ensayo sigue siendo el único diseñado para estudiar de forma específica el efecto de los exámenes de detección mamográficos a partir de los 40 años y es uno de 3 ECA en los que, según el metanálisis de 2013 del grupo Cochrane, la aleatorización se hizo de manera adecuada.
En 2006, se publicaron resultados del ensayo AGE sobre la mortalidad por cáncer de mama al cabo de una media de seguimiento de 10,7 años: una disminución en la mortalidad por cáncer de mama en el grupo de intervención, que no alcanzó significación estadística (105 muertes por cáncer de mama en el grupo de intervención vs. 251 muertes por cáncer de mama en el grupo de control).
En 2015, se publicaron resultados del ensayo AGE sobre la mortalidad por cáncer de mama al cabo de una mediana de seguimiento de 17,7 años: ausencia de disminución estadísticamente significativa después de más de 10 años de seguimiento y ausencia de disminución estadísticamente significativa de la mortalidad por todas las causas. En ese momento, también se publicaron resultados de un reanálisis del conjunto de datos originales: una disminución pequeña, temporal, estadísticamente significativa en la mortalidad por cáncer de mama en el grupo de intervención durante los primeros 10 años siguientes a la aleatorización (83 muertes por cáncer de mama en el grupo de intervención vs. 219 muertes por cáncer de mama en el grupo de control).
En 2020, se publicaron los siguientes resultados finales del ensayo AGE a partir de una mediana de seguimiento de 22,9 años:
- Efecto positivo en los primeros 10 años siguientes a la aleatorización. La diferencia absoluta en la mortalidad por cáncer de mama fue de -0,6 muertes cada 1667 mujeres en el grupo de 40 a 49 años; 1150 mujeres tendrían que someterse a exámenes de detección para prevenir una muerte por cáncer de mama en este grupo etario. En un análisis a posteriori se observó que los años perdidos debido a la mortalidad por cáncer de mama fueron 67,4 años por cada 1000 mujeres en el grupo de intervención versus 78,9 años por cada 1000 mujeres en el grupo de control; esto equivale a 11,5 años de vida preservados por cada 1000 mujeres invitadas a someterse a exámenes de detección en el grupo de intervención y un total de 620 años de vida salvados.
- No hubo una disminución estadísticamente significativa de la mortalidad por cáncer de mama ni de la mortalidad por todas las causas en el grupo de intervención en comparación con el grupo de control.
- En el grupo de intervención, el 18,1 % de las mujeres tuvieron al menos un resultado positivo falso.
Esta evidencia es insuficiente para corroborar la conclusión de una disminución en la mortalidad por cáncer de mama de importancia clínica atribuible a la iniciación de exámenes de detección con mamografía en mujeres de 39 a 49 años. La disminución en la mortalidad por cáncer de mama notificada es pequeña y transitoria según un análisis de subconjunto a posteriori, un protocolo de pruebas por imágenes sin estandarizar y un umbral para las biopsias sin estandarizar (no se tomaron biopsias de las microcalcificaciones). En términos absolutos, la diferencia en la mortalidad por cáncer de mama fue de -0,6 muertes cada 1667 mujeres en el grupo etario de 40 a 49 años según un reanálisis del conjunto de datos originales, que no fue estadísticamente significativo, y el nuevo cálculo de mortalidad por cáncer de mama en un subconjunto que se restringió a 10 años de seguimiento. Al cabo de una mediana de seguimiento de 22,9 años, no hubo una disminución estadísticamente significativa del riesgo de muerte por cáncer de mama o por todas las causas.[18]
Esta evidencia es insuficiente para determinar la magnitud del sobrediagnóstico. Debido a que la evidencia se sustenta en un análisis de subgrupo y un esquema de pruebas por imágenes sin estandarizar, un protocolo de pruebas por imágenes sin estandarizar y un umbral para las biopsias sin estandarizar (no se tomaron biopsias de las microcalcificaciones) de relevancia incierta para la población general, no corrobora la conclusión de los investigadores de que "en el peor de los casos hay una cantidad pequeña de sobrediagnósticos".[18]
Bibliografía
- Shapiro S, Venet W, Strax P, et al.: Ten- to fourteen-year effect of screening on breast cancer mortality. J Natl Cancer Inst 69 (2): 349-55, 1982. [PUBMED Abstract]
- Shapiro S: Periodic screening for breast cancer: the Health Insurance Plan project and its sequelae, 1963-1986. Johns Hopkins University Press, 1988.
- Andersson I, Aspegren K, Janzon L, et al.: Mammographic screening and mortality from breast cancer: the Malmö mammographic screening trial. BMJ 297 (6654): 943-8, 1988. [PUBMED Abstract]
- Nyström L, Rutqvist LE, Wall S, et al.: Breast cancer screening with mammography: overview of Swedish randomised trials. Lancet 341 (8851): 973-8, 1993. [PUBMED Abstract]
- Nyström L, Andersson I, Bjurstam N, et al.: Long-term effects of mammography screening: updated overview of the Swedish randomised trials. Lancet 359 (9310): 909-19, 2002. [PUBMED Abstract]
- Tabár L, Fagerberg CJ, Gad A, et al.: Reduction in mortality from breast cancer after mass screening with mammography. Randomised trial from the Breast Cancer Screening Working Group of the Swedish National Board of Health and Welfare. Lancet 1 (8433): 829-32, 1985. [PUBMED Abstract]
- Tabàr L, Fagerberg G, Duffy SW, et al.: Update of the Swedish two-county program of mammographic screening for breast cancer. Radiol Clin North Am 30 (1): 187-210, 1992. [PUBMED Abstract]
- Tabar L, Fagerberg G, Duffy SW, et al.: The Swedish two county trial of mammographic screening for breast cancer: recent results and calculation of benefit. J Epidemiol Community Health 43 (2): 107-14, 1989. [PUBMED Abstract]
- Holmberg L, Duffy SW, Yen AM, et al.: Differences in endpoints between the Swedish W-E (two county) trial of mammographic screening and the Swedish overview: methodological consequences. J Med Screen 16 (2): 73-80, 2009. [PUBMED Abstract]
- Roberts MM, Alexander FE, Anderson TJ, et al.: Edinburgh trial of screening for breast cancer: mortality at seven years. Lancet 335 (8684): 241-6, 1990. [PUBMED Abstract]
- Miller AB, To T, Baines CJ, et al.: The Canadian National Breast Screening Study-1: breast cancer mortality after 11 to 16 years of follow-up. A randomized screening trial of mammography in women age 40 to 49 years. Ann Intern Med 137 (5 Part 1): 305-12, 2002. [PUBMED Abstract]
- Bailar JC, MacMahon B: Randomization in the Canadian National Breast Screening Study: a review for evidence of subversion. CMAJ 156 (2): 193-9, 1997. [PUBMED Abstract]
- Baines CJ, Miller AB, Kopans DB, et al.: Canadian National Breast Screening Study: assessment of technical quality by external review. AJR Am J Roentgenol 155 (4): 743-7; discussion 748-9, 1990. [PUBMED Abstract]
- Fletcher SW, Black W, Harris R, et al.: Report of the International Workshop on Screening for Breast Cancer. J Natl Cancer Inst 85 (20): 1644-56, 1993. [PUBMED Abstract]
- Miller AB, Baines CJ, To T, et al.: Canadian National Breast Screening Study: 2. Breast cancer detection and death rates among women aged 50 to 59 years. CMAJ 147 (10): 1477-88, 1992. [PUBMED Abstract]
- Frisell J, Eklund G, Hellström L, et al.: Randomized study of mammography screening--preliminary report on mortality in the Stockholm trial. Breast Cancer Res Treat 18 (1): 49-56, 1991. [PUBMED Abstract]
- Moss SM, Cuckle H, Evans A, et al.: Effect of mammographic screening from age 40 years on breast cancer mortality at 10 years' follow-up: a randomised controlled trial. Lancet 368 (9552): 2053-60, 2006. [PUBMED Abstract]
- Moss SM, Wale C, Smith R, et al.: Effect of mammographic screening from age 40 years on breast cancer mortality in the UK Age trial at 17 years' follow-up: a randomised controlled trial. Lancet Oncol 16 (9): 1123-32, 2015. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (05/07/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2025 (se citó a la American Cancer Society como referencia 1).
Se añadió a Magny et al. como referencia 5.
El Consejo editorial del PDQ sobre los exámenes de detección y la prevención es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre los exámenes de detección del cáncer de mama. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre los exámenes de detección y la prevención, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre los exámenes de detección y la prevención emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre los exámenes de detección y la prevención. PDQ Exámenes de detección del cáncer de seno (mama). Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/seno/pro/deteccion-seno-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
La información en estos resúmenes no se debe utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.