Tratamiento del cáncer de endometrio (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer de endometrio
El cáncer de endometrio es la neoplasia maligna ginecológica más común en los Estados Unidos: representa el 7 % de todos los cánceres en mujeres. La mayoría de los casos se diagnostican en estadio temprano y son susceptibles de tratamiento con cirugía sola.[1] Sin embargo, las pacientes con características patológicas que predicen una tasa alta de recaída y las pacientes con metástasis extrauterinas en el momento del diagnóstico tienen una tasa alta de recaída incluso tras recibir terapia adyuvante.
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por cáncer en el cuerpo del útero, que incluye el endometrio, en los Estados Unidos para 2024:[1]
- Casos nuevos: 67 880.
- Defunciones: 13 250.
En general, el cáncer de endometrio se diagnostica y trata en estadio temprano. La enfermedad cardiovascular es la causa más común de muerte en pacientes de cáncer de endometrio debido a los factores de riesgo metabólico relacionados.[2]
Características anatómicas
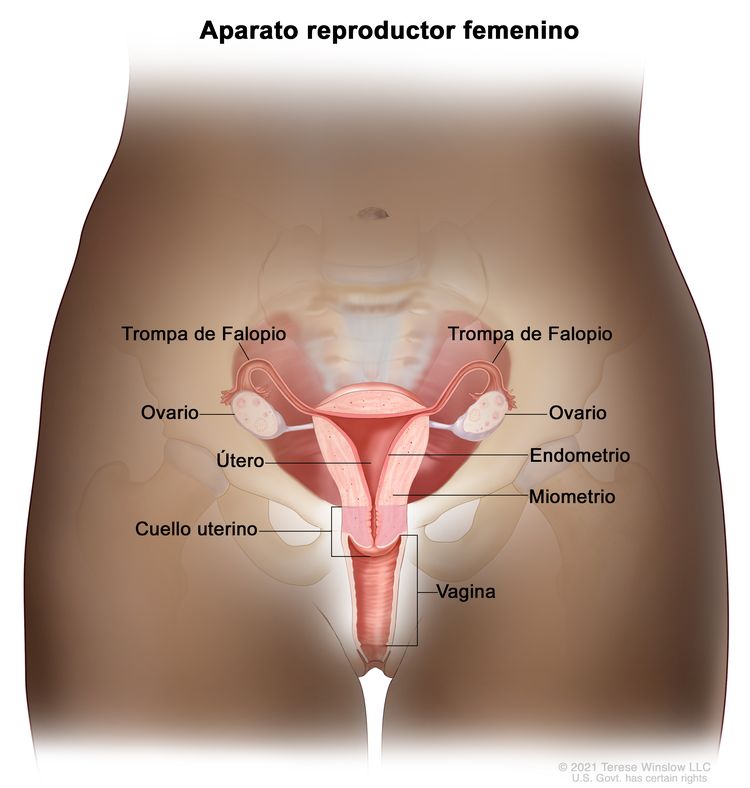
El endometrio es el revestimiento más interno del útero y tiene capas funcionales y basales. La capa funcional es sensible a las hormonas y se desprende de modo cíclico durante la menstruación de las mujeres en edad reproductiva. Tanto el estrógeno como la progesterona son necesarios para mantener el revestimiento endometrial en condiciones normales. Sin embargo, los factores que conducen a un exceso de estrógeno, como la obesidad y la anovulación, aumentan los depósitos del revestimiento endometrial. Estos cambios pueden causar hiperplasia en el endometrio y, en algunos casos, cáncer de endometrio. Cualquiera que sea su causa, el engrosamiento del revestimiento conducirá a un desprendimiento del tejido endometrial a través del conducto endocervical hacia la vagina. Como resultado, el sangrado menstrual abundante o el sangrado posmenopáusico son, con frecuencia, los signos iniciales del cáncer de endometrio. Como este síntoma tiende a presentarse temprano en el curso de la enfermedad, permite identificar la enfermedad en un estadio temprano en la mayoría de las mujeres.
Factores de riesgo
El envejecimiento es el factor de riesgo más importante para la mayoría de cánceres. Otros factores de riesgo del cáncer de endometrio son los siguientes:
Para obtener más información, consultar Prevención del cáncer de endometrio.
La exposición prolongada y sin oposición a estrógenos se ha relacionado con un aumento de riesgo de cáncer de endometrio.[9,32] Sin embargo la terapia combinada de estrógeno y progesterona previene el aumento de este riesgo.[33,34]
El tamoxifeno, que se usa para prevenir y tratar el cáncer de mama NSABP-B-14, se relaciona con un aumento de riesgo de cáncer de endometrio relacionado con el efecto estrogénico del tamoxifeno en el endometrio.[15,35] Es importante que las pacientes que reciben tamoxifeno y presentan un sangrado uterino anómalo se sometan a exámenes de seguimiento y biopsia del revestimiento endometrial. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) emitió una advertencia en recuadro negro que incluye datos sobre el aumento de neoplasias uterinas malignas relacionadas con el uso del tamoxifeno.
Características clínicas
El sangrado vaginal irregular es el signo de presentación más común del cáncer de endometrio. En general, ocurre al comienzo de la enfermedad y es la razón por la que a la mayoría de las pacientes se les diagnostica cáncer de endometrio en estadio I, que es muy curable.
Evaluación diagnóstica
Para diagnosticar un cáncer de cuello uterino, es posible utilizar los siguientes procedimientos:
- Ecografía transvaginal.
- Biopsia del endometrio.
- Examen pélvico.
- Dilatación y legrado (DyL).
- Histeroscopia.
Para el diagnóstico definitivo del cáncer de endometrio se necesita realizar un procedimiento para extraer muestras directamente del tejido endometrial.
El frotis de Pap no es un procedimiento confiable para detectar el cáncer de endometrio, aunque en un estudio retrospectivo se encontró una correlación firme entre los resultados positivos de los estudios citológicos del cuello uterino y la enfermedad endometrial de riesgo alto (es decir, tumor de grado alto e invasión profunda del miometrio).[36] En un estudio prospectivo se encontró una relación estadísticamente significativa entre las características malignas en el estudio citológico y el aumento del riesgo de enfermedad ganglionar.[37]
Factores pronósticos
Los siguientes son los factores pronósticos del cáncer de endometrio:
Estadio y grado del tumor (incluso diseminación ganglionar extrauterina)
En el cuadro siguiente se subraya el riesgo de metástasis ganglionares de acuerdo con los hallazgos en el momento de la cirugía para la estadificación:[38]
| Grupo pronóstico | Características de la paciente | Riesgo de compromiso ganglionar |
|---|---|---|
| A | Tumores de grado 1 que solo comprometen el endometrio | <5 % |
| No hay indicios de diseminación intraperitoneal | ||
| B | Tumores de grado 2–3 | 5–9 % de los ganglios pélvicos |
| Invasión de <50 % del miometrio | ||
| No hay diseminación intraperitoneal | 4 % de los ganglios paraaórticos | |
| C | Invasión profunda de los músculos | 20–60 % de los ganglios pélvicos |
| Tumores de grado alto | 10–30 % de los ganglios paraaórticos | |
| Diseminación intraperitoneal |
En un estudio del Gynecologic Oncology Group, se relacionaron los parámetros quirúrgico-patológicos y el tratamiento posoperatorio con el intervalo libre de recidiva y el sitio de recidiva. Las características histológicas de grado 3 y la invasión profunda del miometrio en pacientes sin diseminación extrauterina fueron los mayores determinantes de la recidiva. En este estudio, la frecuencia de la recidiva aumentó mucho ante la presencia de lo siguiente:[39,40]
- Ganglios pélvicos positivos.
- Metástasis anexial.
- Estudio citológico positivo del peritoneo.
- Compromiso del espacio capilar.
- Compromiso del istmo o el cuello uterino.
- Ganglios paraórticos positivos (incluye todos los grados y profundidades de la invasión). De los casos con metástasis en los ganglios aórticos, el 98 % correspondieron a pacientes con ganglios pélvicos positivos, metástasis intraabdominal o invasión tumoral del 33 % (porción más externa) del miometrio.
Cuando el único indicio de diseminación extrauterina es un estudio citológico positivo, la influencia en el desenlace no es clara. El valor del tratamiento dirigido según este hallazgo citológico no está bien fundamentado [41-46] y algunos datos son contradictorios.[47] Aunque todavía se indica la recolección de muestras citológicas, un resultado positivo no sobrestadifica el cáncer. Antes de considerar terapia posoperatoria adicional, se debe determinar la presencia de otra enfermedad extrauterina.
El compromiso del espacio capilar linfático en el examen histopatológico se correlaciona con la diseminación extrauterina y ganglionar del tumor.[48]
Estado del receptor hormonal
En la evaluación de pacientes con cáncer en estadio I y estadio II, cuando es posible, se incluyen los estados de los receptores de progesterona y estrógeno analizados mediante métodos bioquímicos o inmunohistoquímicos.[49-51]
En un informe se encontró que las concentraciones de progesterona fueron el indicador pronóstico más importante de la supervivencia a 3 años para la enfermedad en estadios clínicos I y II. Las pacientes con concentraciones de progesterona de 100 o más altas tuvieron una tasa de supervivencia sin enfermedad a 3 años de 93 % comparada con 36 % en aquellas con una concentración inferior a 100. Después del ajuste por las concentraciones de los receptores de progesterona, las únicas variables pronósticas importantes fueron el compromiso del cuello uterino y las características citológicas peritoneales.[52]
En otros informes se confirmó la importancia del estado del receptor hormonal como factor pronóstico independiente.[53] Además, se observó que la tinción inmunohistoquímica de tejido embebido en parafina, tanto para los receptores de estrógeno como de progesterona, se correlaciona con el grado y la supervivencia que establece la Fédération Internationale de Gynécologie et d'Obstétrique (FIGO).[49-51]
Otros factores pronósticos
Otros factores que predicen un pronóstico precario son los siguientes:[51,54,55]
- Fracción de fase S alta.
- Aneuploidía.
- Ausencia de PTEN.
- Estado de la mutación de PIK3CA.
- Estado de la mutación de TP53.
- Sobreexpresión de HER2/neu.
- Expresión de un oncogén (por ejemplo, la sobreexpresión del oncogén HER2/neu se ha relacionado con un pronóstico general precario).
Se publicó una revisión general de factores pronósticos.[56]
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2024. American Cancer Society, 2024. Available online. Last accessed December 30, 2024.
- Ward KK, Shah NR, Saenz CC, et al.: Cardiovascular disease is the leading cause of death among endometrial cancer patients. Gynecol Oncol 126 (2): 176-9, 2012. [PUBMED Abstract]
- Beral V, Bull D, Reeves G, et al.: Endometrial cancer and hormone-replacement therapy in the Million Women Study. Lancet 365 (9470): 1543-51, 2005 Apr 30-May 6. [PUBMED Abstract]
- Anderson GL, Limacher M, Assaf AR, et al.: Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women's Health Initiative randomized controlled trial. JAMA 291 (14): 1701-12, 2004. [PUBMED Abstract]
- Furness S, Roberts H, Marjoribanks J, et al.: Hormone therapy in postmenopausal women and risk of endometrial hyperplasia. Cochrane Database Syst Rev (2): CD000402, 2009. [PUBMED Abstract]
- Grady D, Gebretsadik T, Kerlikowske K, et al.: Hormone replacement therapy and endometrial cancer risk: a meta-analysis. Obstet Gynecol 85 (2): 304-13, 1995. [PUBMED Abstract]
- Smith DC, Prentice R, Thompson DJ, et al.: Association of exogenous estrogen and endometrial carcinoma. N Engl J Med 293 (23): 1164-7, 1975. [PUBMED Abstract]
- Mack TM, Pike MC, Henderson BE, et al.: Estrogens and endometrial cancer in a retirement community. N Engl J Med 294 (23): 1262-7, 1976. [PUBMED Abstract]
- Ziel HK, Finkle WD: Increased risk of endometrial carcinoma among users of conjugated estrogens. N Engl J Med 293 (23): 1167-70, 1975. [PUBMED Abstract]
- Walker AM, Jick H: Cancer of the corpus uteri: increasing incidence in the United States, 1970--1975. Am J Epidemiol 110 (1): 47-51, 1979. [PUBMED Abstract]
- Gray LA, Christopherson WM, Hoover RN: Estrogens and endometrial carcinoma. Obstet Gynecol 49 (4): 385-9, 1977. [PUBMED Abstract]
- McDonald TW, Annegers JF, O'Fallon WM, et al.: Exogenous estrogen and endometrial carcinoma: case-control and incidence study. Am J Obstet Gynecol 127 (6): 572-80, 1977. [PUBMED Abstract]
- Antunes CM, Strolley PD, Rosenshein NB, et al.: Endometrial cancer and estrogen use. Report of a large case-control study. N Engl J Med 300 (1): 9-13, 1979. [PUBMED Abstract]
- Shapiro S, Kelly JP, Rosenberg L, et al.: Risk of localized and widespread endometrial cancer in relation to recent and discontinued use of conjugated estrogens. N Engl J Med 313 (16): 969-72, 1985. [PUBMED Abstract]
- Fisher B, Costantino JP, Redmond CK, et al.: Endometrial cancer in tamoxifen-treated breast cancer patients: findings from the National Surgical Adjuvant Breast and Bowel Project (NSABP) B-14. J Natl Cancer Inst 86 (7): 527-37, 1994. [PUBMED Abstract]
- Cummings SR, Eckert S, Krueger KA, et al.: The effect of raloxifene on risk of breast cancer in postmenopausal women: results from the MORE randomized trial. Multiple Outcomes of Raloxifene Evaluation. JAMA 281 (23): 2189-97, 1999. [PUBMED Abstract]
- DeMichele A, Troxel AB, Berlin JA, et al.: Impact of raloxifene or tamoxifen use on endometrial cancer risk: a population-based case-control study. J Clin Oncol 26 (25): 4151-9, 2008. [PUBMED Abstract]
- Bergström A, Pisani P, Tenet V, et al.: Overweight as an avoidable cause of cancer in Europe. Int J Cancer 91 (3): 421-30, 2001. [PUBMED Abstract]
- Aune D, Navarro Rosenblatt DA, Chan DS, et al.: Anthropometric factors and endometrial cancer risk: a systematic review and dose-response meta-analysis of prospective studies. Ann Oncol 26 (8): 1635-48, 2015. [PUBMED Abstract]
- Esposito K, Chiodini P, Capuano A, et al.: Metabolic syndrome and endometrial cancer: a meta-analysis. Endocrine 45 (1): 28-36, 2014. [PUBMED Abstract]
- Troisi R, Potischman N, Hoover RN, et al.: Insulin and endometrial cancer. Am J Epidemiol 146 (6): 476-82, 1997. [PUBMED Abstract]
- Tsilidis KK, Kasimis JC, Lopez DS, et al.: Type 2 diabetes and cancer: umbrella review of meta-analyses of observational studies. BMJ 350: g7607, 2015. [PUBMED Abstract]
- Dossus L, Allen N, Kaaks R, et al.: Reproductive risk factors and endometrial cancer: the European Prospective Investigation into Cancer and Nutrition. Int J Cancer 127 (2): 442-51, 2010. [PUBMED Abstract]
- Brown SB, Hankinson SE: Endogenous estrogens and the risk of breast, endometrial, and ovarian cancers. Steroids 99 (Pt A): 8-10, 2015. [PUBMED Abstract]
- Barry JA, Azizia MM, Hardiman PJ: Risk of endometrial, ovarian and breast cancer in women with polycystic ovary syndrome: a systematic review and meta-analysis. Hum Reprod Update 20 (5): 748-58, 2014 Sep-Oct. [PUBMED Abstract]
- Win AK, Reece JC, Ryan S: Family history and risk of endometrial cancer: a systematic review and meta-analysis. Obstet Gynecol 125 (1): 89-98, 2015. [PUBMED Abstract]
- Daniels MS: Genetic testing by cancer site: uterus. Cancer J 18 (4): 338-42, 2012 Jul-Aug. [PUBMED Abstract]
- Dunlop MG, Farrington SM, Nicholl I, et al.: Population carrier frequency of hMSH2 and hMLH1 mutations. Br J Cancer 83 (12): 1643-5, 2000. [PUBMED Abstract]
- Lynch HT, Lynch J, Conway T, et al.: Familial aggregation of carcinoma of the endometrium. Am J Obstet Gynecol 171 (1): 24-7, 1994. [PUBMED Abstract]
- Lu KH, Schorge JO, Rodabaugh KJ, et al.: Prospective determination of prevalence of lynch syndrome in young women with endometrial cancer. J Clin Oncol 25 (33): 5158-64, 2007. [PUBMED Abstract]
- Widra EA, Dunton CJ, McHugh M, et al.: Endometrial hyperplasia and the risk of carcinoma. Int J Gynecol Cancer 5 (3): 233-235, 1995. [PUBMED Abstract]
- Jick SS, Walker AM, Jick H: Estrogens, progesterone, and endometrial cancer. Epidemiology 4 (1): 20-4, 1993. [PUBMED Abstract]
- Jick SS: Combined estrogen and progesterone use and endometrial cancer. Epidemiology 4 (4): 384, 1993. [PUBMED Abstract]
- Bilezikian JP: Major issues regarding estrogen replacement therapy in postmenopausal women. J Womens Health 3 (4): 273-82, 1994.
- van Leeuwen FE, Benraadt J, Coebergh JW, et al.: Risk of endometrial cancer after tamoxifen treatment of breast cancer. Lancet 343 (8895): 448-52, 1994. [PUBMED Abstract]
- DuBeshter B, Warshal DP, Angel C, et al.: Endometrial carcinoma: the relevance of cervical cytology. Obstet Gynecol 77 (3): 458-62, 1991. [PUBMED Abstract]
- Larson DM, Johnson KK, Reyes CN, et al.: Prognostic significance of malignant cervical cytology in patients with endometrial cancer. Obstet Gynecol 84 (3): 399-403, 1994. [PUBMED Abstract]
- Takeshima N, Hirai Y, Tanaka N, et al.: Pelvic lymph node metastasis in endometrial cancer with no myometrial invasion. Obstet Gynecol 88 (2): 280-2, 1996. [PUBMED Abstract]
- Morrow CP, Bundy BN, Kurman RJ, et al.: Relationship between surgical-pathological risk factors and outcome in clinical stage I and II carcinoma of the endometrium: a Gynecologic Oncology Group study. Gynecol Oncol 40 (1): 55-65, 1991. [PUBMED Abstract]
- Lanciano RM, Corn BW, Schultz DJ, et al.: The justification for a surgical staging system in endometrial carcinoma. Radiother Oncol 28 (3): 189-96, 1993. [PUBMED Abstract]
- Ambros RA, Kurman RJ: Combined assessment of vascular and myometrial invasion as a model to predict prognosis in stage I endometrioid adenocarcinoma of the uterine corpus. Cancer 69 (6): 1424-31, 1992. [PUBMED Abstract]
- Turner DA, Gershenson DM, Atkinson N, et al.: The prognostic significance of peritoneal cytology for stage I endometrial cancer. Obstet Gynecol 74 (5): 775-80, 1989. [PUBMED Abstract]
- Piver MS, Recio FO, Baker TR, et al.: A prospective trial of progesterone therapy for malignant peritoneal cytology in patients with endometrial carcinoma. Gynecol Oncol 47 (3): 373-6, 1992. [PUBMED Abstract]
- Kadar N, Homesley HD, Malfetano JH: Positive peritoneal cytology is an adverse factor in endometrial carcinoma only if there is other evidence of extrauterine disease. Gynecol Oncol 46 (2): 145-9, 1992. [PUBMED Abstract]
- Lurain JR: The significance of positive peritoneal cytology in endometrial cancer. Gynecol Oncol 46 (2): 143-4, 1992. [PUBMED Abstract]
- Lurain JR, Rice BL, Rademaker AW, et al.: Prognostic factors associated with recurrence in clinical stage I adenocarcinoma of the endometrium. Obstet Gynecol 78 (1): 63-9, 1991. [PUBMED Abstract]
- Garg G, Gao F, Wright JD, et al.: Positive peritoneal cytology is an independent risk-factor in early stage endometrial cancer. Gynecol Oncol 128 (1): 77-82, 2013. [PUBMED Abstract]
- Hanson MB, van Nagell JR, Powell DE, et al.: The prognostic significance of lymph-vascular space invasion in stage I endometrial cancer. Cancer 55 (8): 1753-7, 1985. [PUBMED Abstract]
- Carcangiu ML, Chambers JT, Voynick IM, et al.: Immunohistochemical evaluation of estrogen and progesterone receptor content in 183 patients with endometrial carcinoma. Part I: Clinical and histologic correlations. Am J Clin Pathol 94 (3): 247-54, 1990. [PUBMED Abstract]
- Chambers JT, Carcangiu ML, Voynick IM, et al.: Immunohistochemical evaluation of estrogen and progesterone receptor content in 183 patients with endometrial carcinoma. Part II: Correlation between biochemical and immunohistochemical methods and survival. Am J Clin Pathol 94 (3): 255-60, 1990. [PUBMED Abstract]
- Gurpide E: Endometrial cancer: biochemical and clinical correlates. J Natl Cancer Inst 83 (6): 405-16, 1991. [PUBMED Abstract]
- Ingram SS, Rosenman J, Heath R, et al.: The predictive value of progesterone receptor levels in endometrial cancer. Int J Radiat Oncol Biol Phys 17 (1): 21-7, 1989. [PUBMED Abstract]
- Creasman WT: Prognostic significance of hormone receptors in endometrial cancer. Cancer 71 (4 Suppl): 1467-70, 1993. [PUBMED Abstract]
- Friberg LG, Norén H, Delle U: Prognostic value of DNA ploidy and S-phase fraction in endometrial cancer stage I and II: a prospective 5-year survival study. Gynecol Oncol 53 (1): 64-9, 1994. [PUBMED Abstract]
- Hetzel DJ, Wilson TO, Keeney GL, et al.: HER-2/neu expression: a major prognostic factor in endometrial cancer. Gynecol Oncol 47 (2): 179-85, 1992. [PUBMED Abstract]
- Binder PS, Mutch DG: Update on prognostic markers for endometrial cancer. Womens Health (Lond Engl) 10 (3): 277-88, 2014. [PUBMED Abstract]
Clasificación celular del cáncer de endometrio
Los cánceres de endometrio se clasifican en los siguientes tipos:
- Tipo 1: surge de una hiperplasia atípica compleja y se vincula en su patogenia con estimulación estrogénica sin oposición.
- Tipo 2: surge en un endometrio atrófico y no se vincula con patogenia hormonal.
El tipo más común de cáncer de endometrio es el adenocarcinoma endometrioide.
La frecuencia de los tipos de células de cáncer de endometrio es la siguiente:
- Adenocarcinoma endometrioide (75 %); compuesto por elementos malignos de epitelio glandular; no es infrecuente una mezcla de metaplasia escamosa.
- Adenocarcinoma ciliado.
- Adenocarcinoma secretor.
- Adenocarcinomas papilar y velloglandular con características histológicas similares a las observadas en el ovario y la trompa de Falopio. El pronóstico es más precario para estos tumores.[1]
- Adenocarcinoma con diferenciación escamosa.
- Adenoacantoma.
- Células adenoescamosas con elementos epiteliales glandulares y de células escamosas malignos.[2]
- Mixto; definido por la presencia de dos tipos de células carcinomatosas, con un componente más pequeño de por lo menos 10 % del total (10 %).
- Seroso papilar uterino (<10 %).
- Células claras (4 %), similares desde el punto de vista histológico a aquellas observadas en el ovario y la trompa de Falopio. El pronóstico de los tumores de células claras es más precario.[1]
- Carcinosarcoma (3 %), también conocido como tumor mesodérmico mixto maligno, presenta tanto elementos carcinomatosos como sarcomatosos. En el pasado, este tumor se categorizaba como subtipo de los sarcomas uterinos; sin embargo, la evidencia reciente indica que se origina como adenocarcinoma sometido a una diferenciación de sus elementos sarcomatosos.
- Mucinoso (10 %)
- Células escamosas (<1 %).
- Indiferenciado (<1 %).
Subgrupos moleculares
Las mutaciones en PTEN son más comunes en los cánceres de endometrio de tipo 1; las sobreexpresiones de TP53 y HER2/neu son más comunes en los cánceres de endometrio de tipo 2; sin embargo, hay cierta superposición.
En la visualización genética completa del Atlas del Genoma del Cáncer de cientos de cánceres de endometrio, se identificaron cuatro subtipos para caracterizar aún más los cánceres de endometrio:[3]
- Tumores con POLE ultramutado. Este subtipo tiene importancia clínica y se evita la administración de terapias adyuvantes.
- Inestabilidad de microsatélites con hipermutación.
- Número bajo de copias.
- Número alto de copias.
Estas categorías se pueden usar para estratificar a las pacientes en categorías pronósticas de riesgo bajo y alto. Una modificación de los métodos del Atlas del Genoma del Cáncer en pruebas más accesibles también tuvo éxito en la discriminación de cánceres en categoría pronósticas importantes. Sin embargo, una combinación de factores de riesgo previamente conocidos con datos genéticos fue más eficaz para determinar categorías pronósticas.[4]
Bibliografía
- Gusberg SB: Virulence factors in endometrial cancer. Cancer 71 (4 Suppl): 1464-6, 1993. [PUBMED Abstract]
- Zaino RJ, Kurman R, Herbold D, et al.: The significance of squamous differentiation in endometrial carcinoma. Data from a Gynecologic Oncology Group study. Cancer 68 (10): 2293-302, 1991. [PUBMED Abstract]
- Kandoth C, Schultz N, Cherniack AD, et al.: Integrated genomic characterization of endometrial carcinoma. Nature 497 (7447): 67-73, 2013. [PUBMED Abstract]
- Talhouk A, McConechy MK, Leung S, et al.: A clinically applicable molecular-based classification for endometrial cancers. Br J Cancer 113 (2): 299-310, 2015. [PUBMED Abstract]
Información sobre los estadios del cáncer de endometrio
El modelo de diseminación del cáncer de endometrio depende, en parte, del grado de diferenciación celular. Los tumores bien diferenciados tienden a limitar su diseminación a la superficie del endometrio; la invasión del miometrio es menos común. La invasión del miometrio se presenta con más frecuencia en pacientes con tumores pobremente diferenciados y, a menudo, presagia el compromiso de los ganglios linfáticos y las metástasis a distancia.[1,2]
La diseminación metastásica tiene un modelo característico. La diseminación regional a los ganglios pélvicos y paraaórticos es común. La diseminación a distancia por lo común compromete los siguientes sitios:
- Pulmones.
- Ganglios inguinales y supraclaviculares.
- Hígado.
- Huesos.
- Encéfalo.
- Vagina.
Estadificación FIGO
La Fédération Internationale de Gynécologie et d’Obstétrique (FIGO) y el American Joint Committee on Cancer (AJCC) han definido sistemas de estadificación para el cáncer de endometrio. El sistema FIGO es el sistema de estadificación que se usa con mayor frecuencia para estadificar el cáncer de endometrio.[3-5] La actualización de la estadificación FIGO 2023 no ha sido adoptada de manera amplia porque incorpora resultados a nivel molecular, y algunos médicos no tienen acceso a esos datos de sus pacientes. Además, debido a los cambios significativos en el sistema de estadificación FIGO 2023, en especial en la definición de la enfermedad en estadio temprano, se necesitan más datos sobre los desenlaces, por lo que podría ser más prudente utilizar el sistema 2021 en un entorno clínico mientras se habla con las pacientes sobre el pronóstico y el tratamiento. Por lo tanto, en esta sección se presentan tanto el sistema de estadificación FIGO 2023 como el sistema FIGO 2021.
Los estadios FIGO I a IV se subdividen según el grado histológico del tumor (G); por ejemplo, estadio IB G2. Los carcinosarcomas, que antes se designaban como sarcomas, ahora se consideran adenocarcinomas pobremente diferenciados; por lo tanto, se incluyen en este sistema.[5]
Estadificación FIGO 2023 del cáncer de endometrio
| Estadio | Descripción | |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; p = patológico; AJCC = American Joint Committee on Cancer; ESGO-ESTRO-ESP = European Society of Gynaecological Oncology, European Society for Radiotherapy and Oncology, European Society of Pathology; FIGO = Fédération Internationale de Gynécologie et d’Obstétrique; ; dMMR = deficiencia en MMR; POLEmut = mutación patogénica en el gen POLE; p53abn = TP53 anormal; OMS = Organización Mundial de la Salud. | ||
| aAdaptación del FIGO Committee on Gynecologic Oncology.[3] | ||
| bEl cáncer de endometrio se estadifica de forma quirúrgica y se somete a examen anatomopatológico. En todos los estadios deben registrarse el grado de la lesión, el tipo histológico y la presencia de infiltración del espacio linfovascular. Si está disponible y es factible, se recomienda la realización de una clasificación molecular completa (POLEmut, dMMR, p53abn o cáncer sin perfil molecular específico) en todos los casos de cáncer de endometrio para la estratificación por grupos de riesgo pronóstico y como factores que podrían influir en las decisiones de tratamiento adyuvante y sistémico (consultar el Cuadro 6). | ||
| cEn el cáncer de endometrio temprano, la cirugía estándar es una histerectomía total con salpingooforectomía bilateral mediante un abordaje laparoscópico de carácter poco invasivo. Los procedimientos de estadificación incluyen la omentectomía infracólica en subtipos histológicos específicos, como el carcinoma endometrial seroso e indiferenciado, así como el carcinosarcoma, debido al riesgo alto de metástasis microscópica en el omento (epiplón). La estadificación de los ganglios linfáticos debe realizarse en pacientes con enfermedad de riesgo intermedio-alto o alto. La biopsia de ganglio linfático centinela es una alternativa adecuada a la linfadenectomía sistemática para propósitos de estadificación. Esta biopsia también se considera en pacientes con enfermedad de riesgo bajo o bajo-intermedio para descartar metástasis ganglionares ocultas e identificar la enfermedad realmente confinada al útero. Así pues, las directrices de ESGO-ESTRO-ESP permiten un abordaje de ganglio linfático centinela en todas las pacientes con carcinoma endometrial, lo cual está avalado por la FIGO. En el supuesto de cáncer de endometrio temprano, una biopsia de ganglio linfático centinela en una alternativa adecuada a la linfadenectomía sistemática en casos de riesgo alto-intermedio y alto para el propósito de estadificación ganglionar y también se considera en enfermedad de riesgo bajo o intermedio para descartar metástasis ganglionares ocultas. La biopsia de ganglio linfático centinela debe realizarse junto a una estadificación exhaustiva (ultraestadificación), ya que aumentará la detección de enfermedad de volumen bajo en los ganglios linfáticos. | ||
| dSe considera que los carcinomas endometrioides de grado bajo que afectan tanto al endometrio como al ovario tienen un pronóstico favorable, y no se recomienda ningún tratamiento adyuvante si se cumplen todos los criterios que se indican a continuación. La enfermedad limitada a carcinomas endometrioides de grado bajo que afectan al endometrio y a los ovarios (estadio IA3) debe distinguirse de la diseminación extensa del carcinoma endometrial al ovario (estadio IIIA1) de acuerdo con los siguientes criterios: 1) no hay más que invasión superficial del miometrio (<50 %); 2) ausencia de infiltración del espacio linfovascular extensa o sustancial; 3) ausencia de metástasis adicionales; y 4) el tumor ovárico es unilateral, limitado a un ovario, sin invasión o ruptura de la cápsula (equivalente a pT1a). | ||
| eInfiltración del espacio linfovascular tal y como se definió por la OMS en 2021: extensa o sustancial, ≥5 vasos afectados. | ||
| fEl grado y el tipo histológico son los siguientes: 1) Los adenocarcinomas serosos, los adenocarcinomas de células claras, los carcinomas de tipo mesonéfrico, el carcinoma endometrial mucinoso de tipo gastrointestinal, los carcinomas indiferenciados y los carcinosarcomas se consideran de grado alto por definición. Para los carcinomas endometrioides, el grado se basa en la proporción de áreas sólidas: grado bajo = grado 1 (≤5 %) y grado 2 (6–50 %); y grado alto = grado 3 (>50 %). Una atipia nuclear excesiva para el grado eleva en uno el grado de un tumor de grado 1 o 2. La presencia de atipia nuclear inusual en un tumor con estructura de grado bajo debe impulsar la evaluación de TP53 y la consideración de carcinoma seroso. Los adenocarcinomas con diferenciación escamosa se clasifican según las características microscópicas del componente glandular; 2) Los tipos histológicos que no son de gran malignidad están compuestos por carcinomas endometrioides de grado bajo (grados 1 y 2). Los tipos histológicos de gran malignidad se componen de carcinomas endometrioides de grado alto (grado 3), carcinomas serosos, de células claras, indiferenciados, mixtos, de tipo mesonéfrico, carcinomas gastrointestinales de tipo mucinoso y carcinosarcomas; y 3) cabe señalar que los carcinomas endometrioides de grado alto (grado 3) son una enfermedad heterogénea desde los puntos de vista pronóstico, clínico y molecular, y el tipo de tumores que más se benefician de la aplicación de la clasificación molecular para mejorar el pronóstico y la toma de decisiones sobre el tratamiento. Sin una clasificación molecular, los carcinomas endometrioides de grado alto no pueden asignarse de manera adecuada a un grupo de riesgo, por lo que se recomienda especialmente la realización de perfiles moleculares en estas pacientes. Si se desconoce la clasificación molecular, a efectos prácticos, y para evitar el infratratamiento de las pacientes, los carcinomas endometrioides de grado alto se agruparon junto con los tipos histológicos de gran malignidad en la clasificación FIGO. | ||
| gLas micrometástasis se consideran compromiso metastásico (pN1 [mi]). La importancia pronóstica de las células tumorales aisladas no está clara. La presencia de células tumorales aisladas debe documentarse y se considera pN0(i+). Según la estadificación de la 8.ª edición del AJCC, las macrometástasis tienen un tamaño de >2 mm, las micrometástasis tienen un tamaño de >0,2–2 mm o >200 células, y las células tumorales aisladas tienen un tamaño ≤0,2 mm y ≤200 células. Estas definiciones se basan en la estadificación establecida por la FIGO y la 8.ª edición del AJCC Cancer Staging Manual. | ||
| I | Tumor confinado en el cuerpo del útero y ovario.d | |
| IA | Enfermedad limitada al endometrio o tipo histológico que no es de gran malignidad, es decir, endometrioide de grado bajo, con invasión de menos de la mitad del miometrio sin infiltración del espacio linfovascular o con infiltración del espacio linfovascular focal, o enfermedad de pronóstico favorable. | |
| IA1 | Tipo histológico que no es de gran malignidad limitado a un pólipo endometrial o confinado al endometrio. | |
| IA2 | Tipos histológicos que no son de gran malignidad que comprometen menos de la mitad del miometrio sin infiltración del espacio linfovascular o con infiltración del espacio linfovascular focal. | |
| IA3 | Carcinomas endometrioides de grado bajo limitados al útero y ovario.d | |
| IB | Tipos histológicos que no son de gran malignidad con invasión de la mitad o más del miometrio, sin infiltración del espacio linfovascular o con infiltración del espacio linfovascular focal.e | |
| IC | Tipos histológicos de gran malignidadf limitados a un pólipo o confinados al endometrio. | |
| Estadio | Descripción |
|---|---|
| FIGO = Fédération Internationale de Gynécologie et d’Obstétrique. | |
| aAdaptación del FIGO Committee on Gynecologic Oncology.[3] | |
| Para las explicaciones de las notas a pie de página b−f, consultar el Cuadro 2. | |
| II | Invasión del estroma cervical sin extensión extrauterina o con infiltración del espacio linfovascular sustancial o tipos histológicos de gran malignidad con invasión miometrial. |
| IIA | Invasión del estroma cervical de tipos histológicos que no son de gran malignidad. |
| IIB | Infiltración del espacio linfovasculare sustancial de tipos histológicos que no son de gran malignidad. |
| IIC | Tipos histológicos de gran malignidadf con cualquier compromiso miometrial. |
| Estadio | Descripción | |
|---|---|---|
| FIGO = Fédération Internationale de Gynécologie et d’Obstétrique. | ||
| aAdaptación del FIGO Committee on Gynecologic Oncology.[3] | ||
| Para ver las explicaciones de las notas a pie de página b−d y g, consultar el Cuadro 2. | ||
| III | Extensión local o regional del tumor de cualquier subtipo histológico. | |
| IIIA | Invasión de la serosa uterina, los anexos uterinos o ambos por extensión directa o metástasis. | |
| IIIA1 | Diseminación a ovario o trompa de Falopio (excepto cuando se cumplen los criterios del estadio IA3).d | |
| IIIA2 | Compromiso de la subserosa uterina o diseminación a través de la serosa uterina. | |
| IIIB | Metástasis o diseminación directa a la vagina, los parametrios o al peritoneo pélvico. | |
| IIIB1 | Metástasis o diseminación directa a la vagina o los parametrios. | |
| IIIB2 | Metástasis al peritoneo pélvico. | |
| IIIC | Metástasis a los ganglios linfáticos pélvicos, paraaórticos o ambos.g | |
| IIIC1 | Metástasis a los ganglios linfáticos pélvicos. | |
| IIIC1i | Micrometástasis. | |
| IIIC1ii | Macrometástasis. | |
| IIIC2 | Metástasis a los ganglios linfáticos paraaórticos hasta los vasos renales, con metástasis a los ganglios linfáticos pélvicos o sin esta. | |
| IIIC2i | Micrometástasis. | |
| IIIC2ii | Macrometástasis. | |
| Estadio | Descripción |
|---|---|
| FIGO = Fédération Internationale de Gynécologie et d’Obstétrique. | |
| aAdaptación del FIGO Committee on Gynecologic Oncology.[3] | |
| Para ver las explicaciones de las notas a pie de página b−c, consultar el Cuadro 2. | |
| IV | Diseminación a la mucosa de la vejiga, la mucosa intestinal o metástasis a distancia. |
| IVA | Invasión de la mucosa de la vejiga o de la mucosa intestinal. |
| IVB | Metástasis peritoneal abdominal fuera de la pelvis. |
| IVC | Metástasis a distancia, incluso metástasis a cualquier ganglio linfático extrabdominal o intrabdominal por encima de los vasos renales, así como metástasis pulmonares, hepáticas, encefálicas u óseas. |
| Designación del estadio | Hallazgos moleculares en pacientes con cáncer de endometrio temprano (estadios I y II tras la estadificación quirúrgica) |
|---|---|
| FIGO = Fédération Internationale de Gynécologie et d’Obstétrique; dMMR = deficiencia en MMR; IMS = inestabilidad microsatelital; POLEmut = mutación patogénica en el gen POLE; p53abn = TP53 anormal. | |
| aAdaptación del FIGO Committee on Gynecologic Oncology.[3] | |
| bCuando es factible, añadir el subtipo molecular a los criterios de estadificación permite una mejor predicción del pronóstico en un esquema de estadificación o pronóstico. Se recomienda la realización de una clasificación molecular completa (POLEmut, dMMR, p53abn o cáncer sin perfil molecular específico) en todos los casos de cáncer de endometrio para la estratificación por grupos de riesgo pronostico y como factores que podrían influir en las decisiones de tratamiento adyuvante y sistémico. La asignación del subtipo molecular se realiza mediante una biopsia, en cuyo caso no es necesario repetirla en la pieza quirúrgica de la histerectomía. Cuando se realicen, estas clasificaciones moleculares deben registrarse en todos los estadios. Una mutación patogénica en el gen POLE (POLEmut) se relaciona con un pronóstico favorable. La clasificación del cáncer como dMMR, IMS o cáncer sin perfil molecular específico se asocian a un pronóstico intermedio. El gen TP53 (p53abn) anormal se relaciona con un pronóstico precario. Cuando se conoce la clasificación molecular, la estadificación se modifica de la siguiente manera: 1) Los estadios FIGO I y II se basan en los hallazgos anatomoquirúrgicos e histológicos. En caso de que la clasificación molecular revele el estado POLEmut o p53abn, el estadio FIGO se modifica en la fase inicial de la enfermedad. Esto se representa en el estadio FIGO mediante la adición de «m» para la clasificación molecular, y se añade un subíndice para denotar el estado POLEmut o p53abn, como se muestra en el cuadro. El estado dMMR o el estado de cáncer sin perfil molecular específico no modifica los estadios FIGO tempranos; sin embargo, estas clasificaciones moleculares deben registrarse a efectos de recopilación de datos. Cuando la clasificación molecular revela dMMR o un cáncer sin perfil molecular específico (NSMP), debe registrarse como estadio ImdMMR o estadio ImNSMP y estadio IImdMMR o estadio IImNSMP; 2) Los estadios FIGO III y IV se basan en hallazgos quirúrgicos o anatómicos. La categoría de estadio no se modifica por la clasificación molecular; no obstante, la clasificación molecular debe registrarse si se conoce. Cuando se conoce la clasificación molecular, debe registrarse como estadio IIIm o estadio IVm con el subíndice apropiado para el propósito de la recopilación de datos. Por ejemplo, cuando la clasificación molecular revele p53abn, deberá registrarse como estadio IIImp53abn o estadio IVm p53abn. | |
| IAmPOLEmut | Carcinoma endometrial POLEmut, confinado al cuerpo del útero o con extensión al cuello uterino, con independencia del grado de infiltración del espacio linfovascular o del tipo histológico. |
| IICmp53abn | Carcinoma endometrial p53abn confinado al cuerpo del útero con cualquier invasión miometrial, con invasión del cuello uterino o sin esta, con independencia del grado de infiltración del espacio linfovascular o del tipo histológico. |
Estadificación FIGO 2021 del cáncer de endometrio
| Estadio | Descripción | Ilustración |
|---|---|---|
| FIGO = Fédération Internationale de Gynécologie et d’Obstétrique. | ||
| aAdaptación del FIGO Committee on Gynecologic Oncology.[4] | ||
| bG1, G2 o G3 (G = grado). | ||
| Ib | Tumor confinado en el cuerpo del útero. |
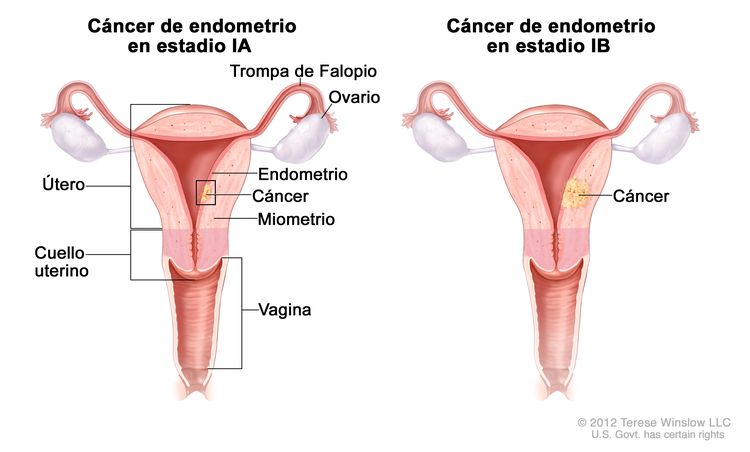 |
| IAb | Ausencia de invasión al endometrio o invasión a menos de la mitad del miometrio. | |
| IBb | Invasión a la mitad o más de la mitad del miometrio. | |
| Estadio | Descripción | Ilustración |
|---|---|---|
| FIGO = Fédération Internationale de Gynécologie et d’Obstétrique. | ||
| aAdaptación del FIGO Committee on Gynecologic Oncology.[4] | ||
| bG1, G2 o G3 (G = grado). | ||
| cEl compromiso endocervical glandular se considera estadio I; ya no se considera estadio II. | ||
| IIb | Tumor con invasión del estroma del cuello uterino, pero sin diseminación fuera del útero.c |
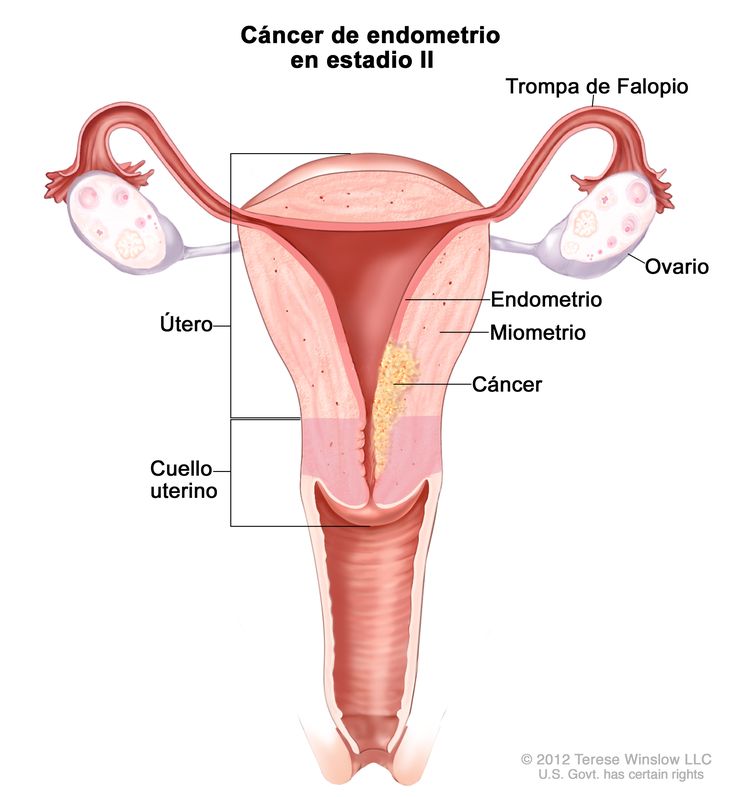 |
| Estadio | Descripción | Ilustración |
|---|---|---|
| FIGO = Fédération Internationale de Gynécologie et d’Obstétrique. | ||
| aAdaptación del FIGO Committee on Gynecologic Oncology.[4] | ||
| bG1, G2 o G3 (G = grado). | ||
| cSe deben notificar los estudios citológicos con resultado positivo por separado sin cambiar el estadio. | ||
| IIIb | Diseminación local o regional del tumor. | |
| IIIAb | Tumor con invasión de la serosa del cuerpo del útero o los anexos uterinos.c |
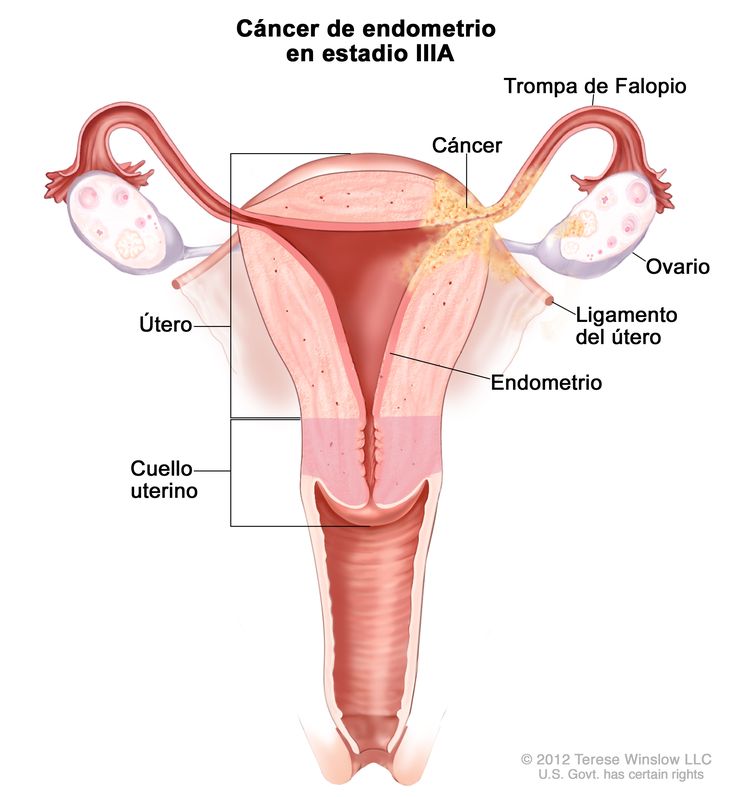 |
| IIIBb | Compromiso de la vagina o el parametrio.c |
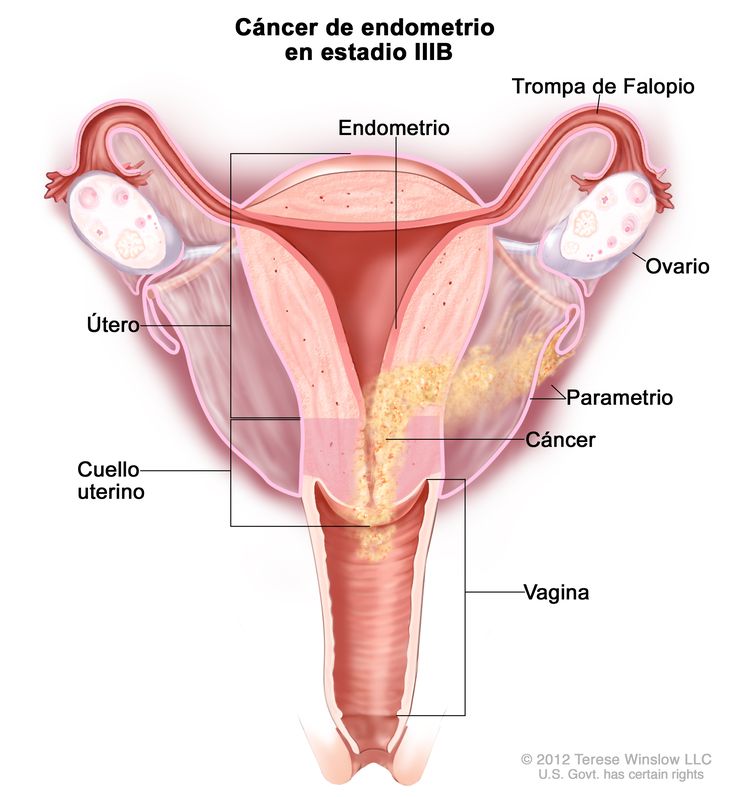 |
| IIICb | Metástasis en los ganglios linfáticos pélvicos o paraaórticos.c |
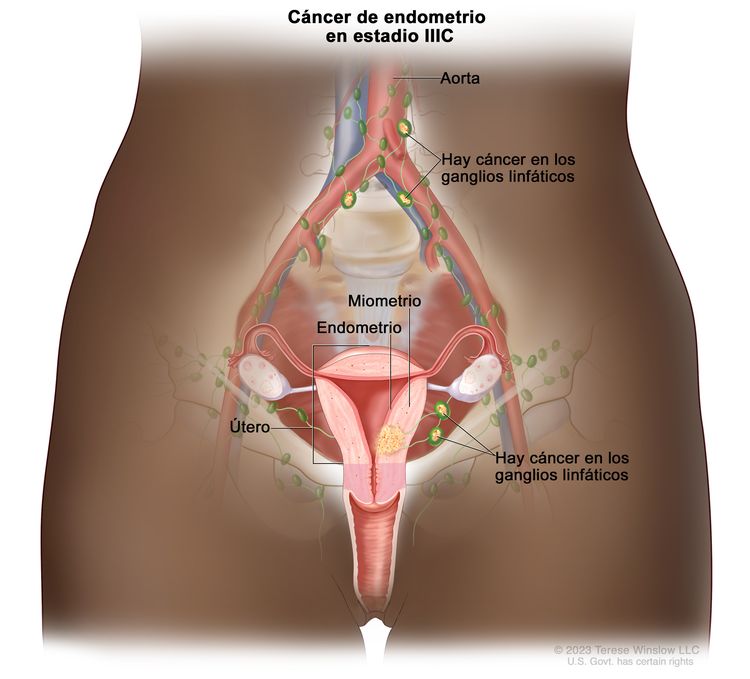 |
| IIIC1b | Compromiso de ganglios pélvicos. | |
| IIIC2b | Compromiso de ganglios linfáticos paraaórticos con compromiso de ganglios linfáticos pélvicos o sin este. | |
| Estadio | Descripción | Ilustración |
|---|---|---|
| FIGO = Fédération Internationale de Gynécologie et d’Obstétrique. | ||
| aAdaptación del FIGO Committee on Gynecologic Oncology.[4] | ||
| bG1, G2 o G3 (G = grado). | ||
| IVb | Tumor con invasión de la vejiga o la mucosa intestinal, o metástasis a distancia. | |
| IVAb | Invasión tumoral de la vejiga o la mucosa intestinal. |
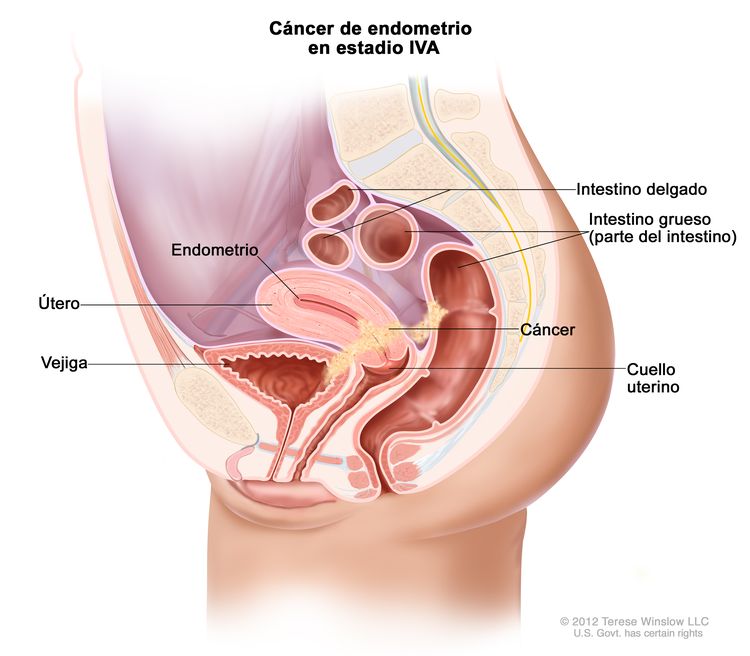 |
| IVBb | Metástasis a distancia, incluso metástasis intraabdominales o a los ganglios linfáticos inguinales. |
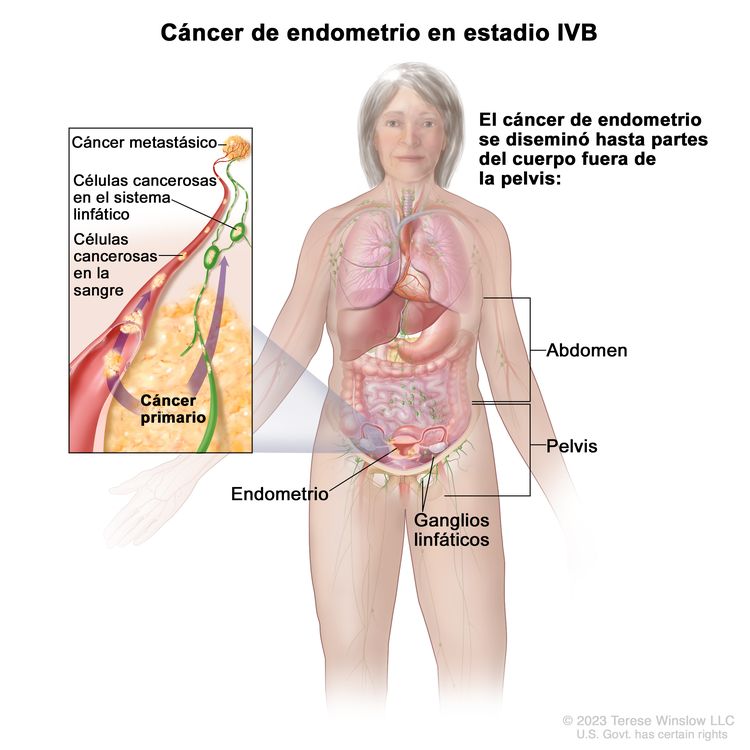 |
Bibliografía
- Hendrickson M, Ross J, Eifel PJ, et al.: Adenocarcinoma of the endometrium: analysis of 256 cases with carcinoma limited to the uterine corpus. Pathology review and analysis of prognostic variables. Gynecol Oncol 13 (3): 373-92, 1982. [PUBMED Abstract]
- Nori D, Hilaris BS, Tome M, et al.: Combined surgery and radiation in endometrial carcinoma: an analysis of prognostic factors. Int J Radiat Oncol Biol Phys 13 (4): 489-97, 1987. [PUBMED Abstract]
- Berek JS, Matias-Guiu X, Creutzberg C, et al.: FIGO staging of endometrial cancer: 2023. Int J Gynaecol Obstet 162 (2): 383-394, 2023. [PUBMED Abstract]
- Koskas M, Amant F, Mirza MR, et al.: Cancer of the corpus uteri: 2021 update. Int J Gynaecol Obstet 155 (Suppl 1): 45-60, 2021. [PUBMED Abstract]
- Corpus uteri – carcinoma and carcinosarcoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 661-69.
Aspectos generales de las opciones de tratamiento del cáncer de endometrio
El grado de diferenciación tumoral tiene un efecto importante en la evolución natural de esta enfermedad y en la selección del tratamiento.
Las pacientes de cáncer de endometrio que tienen la enfermedad localizada se suelen curar. Los mejores resultados se obtienen con cualquiera de los dos tratamientos estándar:
- Histerectomía con salpingooforectomía bilateral.
- Histerectomía con salpingooforectomía bilateral y radioterapia adyuvante (cuando hay invasión profunda del músculo del miometrio [más de 50 % del miometrio] o cuando hay un tumor de grado 3 con invasión del miometrio).
Las pacientes con metástasis regionales y a distancia se curan con muy poca frecuencia, aunque en ocasiones responden a la terapia hormonal estándar.
En varios ensayos aleatorizados se evaluaron sustancias progestacionales para administrarlas como terapia adyuvante. En un metanálisis del grupo Cochrane se confirmó que no hay un beneficio clínico de los progestágenos adyuvantes en el entorno de la enfermedad en estadio clínico I.[1][Nivel de evidencia A1]
Las opciones de tratamiento para cada estadio del cáncer de endometrio se presentan en el Cuadro 11.
| Estadio (definiciones FIGO de estadificación) | Opciones de tratamiento | |
|---|---|---|
| FIGO = Fédération Internationale de Gynécologie et d’Obstétrique. | ||
| Cáncer de endometrio en estadio I y estadio II | Grados 1 y 2 | Cirugía con muestreo de ganglios linfáticos o sin este |
| Braquiterapia vaginal posoperatoria | ||
| Radioterapia sola | ||
| Ensayos clínicos | ||
| Grado 3 (incluye carcinoma seroso y de células claras, y carcinosarcoma) | Cirugía | |
| Quimioterapia posoperatoria con radioterapia o sin esta | ||
| Ensayos clínicos | ||
| Cáncer de endometrio en estadio III, estadio IV y recidivante | Enfermedad operable | Cirugía seguida de quimioterapia o radioterapia |
| Enfermedad inoperable | Quimioterapia y radioterapia | |
| Enfermedad inoperable en una paciente que no es apta para radioterapia | Terapia hormonal | |
| Terapia biológica | ||
| Enfermedad avanzada o recidivante | Inmunoterapia | |
| Ensayos clínicos | ||
Bibliografía
- Martin-Hirsch PP, Bryant A, Keep SL, et al.: Adjuvant progestagens for endometrial cancer. Cochrane Database Syst Rev (6): CD001040, 2011. [PUBMED Abstract]
Tratamiento del cáncer de endometrio en estadio I y estadio II
Opciones de tratamiento del cáncer de endometrio en estadio I y estadio II
El tratamiento del cáncer de endometrio en estadio I y estadio II depende del grado y el tipo histológico.
En el sistema actual de estadificación de la Fédération Internationale de Gynécologie et d’Obstétrique (FIGO), el estadio II describe un tumor que invade el estroma del cuello uterino; esto equivale al estadio IIB del sistema anterior. En casi todos los ensayos aleatorizados de cáncer en estadio temprano se excluyó a pacientes en estadio IIB. Como resultado, hay pocos datos de calidad para tomar decisiones clínicas en el caso de pacientes en estadio II.
Características histológicas de riesgo bajo:
Los tumores de grados 1 y 2 se consideran de riesgo bajo, a menos que sean de subtipos histológicos serosos o de células claras.
Las opciones de tratamiento para pacientes de cáncer de endometrio de subtipos histológicos de riesgo bajo son las siguientes:
- Cirugía: histerectomía con salpingooforectomía bilateral y posible disección de ganglios linfáticos.
- Braquiterapia vaginal posoperatoria.
- Radioterapia sola.
La mayoría de las pacientes evolucionan bien con cirugía sola. No obstante, los pacientes con enfermedad en estadio I que tiene subtipos histológicos de riesgo alto tienen riesgo más alto de recidiva y son aptas para recibir terapia adyuvante.
Características histológicas de riesgo alto:
Se consideran de riesgo alto los tumores de grado 3, cualesquiera sean sus características histológicas, así como todos los tumores serosos y de células claras, o los carcinosarcomas.
Las opciones de tratamiento para pacientes de cáncer de endometrio en estadio I o estadio II con subtipos histológicos de riesgo alto son las siguientes:
- Cirugía: histerectomía con salpingooforectomía bilateral, y disección de ganglios linfáticos pélvicos y paraaórticos.
- Quimioterapia posoperatoria con radioterapia o sin esta.
Las pacientes con características histológicas serosas o de células claras tienen tasas más altas de recidiva que las pacientes con otros carcinomas endometrioides en estadio I o estadio II. Las pautas de tratamiento se basan en los desenlaces publicados en series de casos institucionales en las que se utilizó un régimen de carboplatino adyuvante con paclitaxel que, en ocasiones, incluyó radioterapia para pacientes con este subtipo histológico.[1-9]
Los carcinosarcomas se evaluaron en ensayos clínicos por separado o con otros sarcomas debido a su clasificación anterior en este grupo. En un estudio no aleatorizado del Gynecologic Oncology Group (GOG) de pacientes con carcinosarcomas en estadio I o II, las pacientes sometidas a radioterapia pélvica presentaron una reducción importante de recidivas dentro del campo de radioterapia, pero no mejoró la supervivencia.[10] En un estudio no aleatorizado con predominio de pacientes de carcinosarcoma, pareció observarse un beneficio de la terapia adyuvante con cisplatino y doxorrubicina.[11]
Cirugía
En el caso de compromiso del cuello uterino, las opciones de tratamiento son las siguientes:
- Histerectomía estándar con salpingooforectomía bilateral seguidas de radioterapia adyuvante.
- Histerectomía radical.
- Disección de ganglios linfáticos pélvicos y paraaórticos.
En una revisión de una sola institución se indica que la histerectomía radical es más beneficiosa que la histerectomía estándar en casos de compromiso tumoral del cuello uterino.[12-14]
Cirugía con muestreo de ganglios linfáticos o sin este
En el cuadro siguiente se subraya el riesgo de metástasis ganglionares de acuerdo con los hallazgos en el momento de la cirugía para la estadificación:[15]
| Grupo pronóstico | Características de la paciente | Riesgo de compromiso ganglionar |
|---|---|---|
| A | Tumores de grado 1 que solo comprometen el endometrio | <5 % |
| No hay indicios de diseminación intraperitoneal | ||
| B | Tumores de grado 2–3 | 5–9 % de los ganglios pélvicos |
| Invasión de <50 % del miometrio | ||
| No hay diseminación intraperitoneal | 4 % de los ganglios paraaórticos | |
| C | Invasión profunda de los músculos | 20–60 % de los ganglios pélvicos |
| Tumores de grado alto | 10–30 % de los ganglios paraaórticos | |
| Diseminación intraperitoneal |
La disección de ganglios linfáticos es de utilidad limitada para las pacientes del grupo A. Por el contrario, la disección completa de ganglios linfáticos pélvicos y paraaórticos es importante para pacientes del grupo C debido a la probabilidad de hallazgos positivos. La dificultad reside en determinar el manejo adecuado de las pacientes del grupo B.
Hay varios abordajes quirúrgicos aceptados para pacientes de cáncer de endometrio que se presume que son de estadio I con riesgo intermedio de diseminación linfática.
Tanto los datos retrospectivos como los prospectivos apoyan la estratificación de pacientes de cáncer de endometrio que se presume que son de estadio I en dos grupos según las siguientes características:
- Riesgo bajo: tumor bien diferenciado o moderadamente diferenciado, o profundidad de la invasión del miometrio de menos de 50 % y el tumor mide menos de 2 cm.
- Riesgo alto: tumor pobremente diferenciado o profundidad de la invasión del miometrio de 50 % o más, y el tumor mide 2 cm o más.
Evidencia (disección de ganglios linfáticos):
- En dos estudios, las pacientes de cáncer de riesgo bajo presentaron un riesgo de metástasis ganglionares bajo que permitió omitir el muestreo de ganglios linfáticos. Para las pacientes que satisfacían los criterios de riesgo alto, se indicó una disección de ganglios linfáticos pélvicos y paraaórticos completa.[16,17]
- Una estrategia alternativa es usar la disección de ganglios linfáticos centinela de pacientes con presumible cáncer de endometrio en estadio I.[18] Aunque esta estrategia es de amplia aceptación en varios centros académicos, no hay un ensayo prospectivo multicéntrico para determinar la tasa de resultados negativos falsos de este protocolo. En los casos en los que se identifican células tumorales aisladas con el abordaje del ganglio linfático centinela, no está claro si se necesita tratamiento.
- El abordaje estándar para las pacientes con características histológicas de riesgo alto (carcinosarcoma seroso y de células claras, o tumores indiferenciados) es la histerectomía y la salpingooforectomía bilateral con disección de ganglios linfáticos pélvicos y paraaórticos.
- La laparotomía fue el abordaje estándar. Sin embargo, en la actualidad se favorece la laparoscopia debido a la mejora en la recuperación posoperatoria de las pacientes sin efectos importantes en los desenlaces.
Evidencia (tratamiento o estadificación quirúrgica mediante laparoscopia vs. laparotomía):
- Para las pacientes de cáncer de endometrio en estadio temprano, en varios ensayos aleatorizados se comparó la histerectomía laparoscópica total (HLT) con el procedimiento estándar, histerectomía abdominal total (HAT). La factibilidad del abordaje laparoscópico ha sido confirmada, pero este abordaje exige un período operatorio más largo.[15,19,20] La HLT tiene un perfil de episodios adversos mejor [15,19] o similar [20], y una hospitalización más breve [15,19,20] que la HAT.
- La HLT se relaciona con menos dolor y una reanudación más rápida de las actividades diarias,[20,21] aunque en un estudio se encontró que, si bien la mayor parte de las ganancias en la calidad de vida favorecieron la laparoscopia en el período posquirúrgico de 6 semanas, ya no fueron significativas a los 6 meses.[20,21]
- En un ensayo del GOP (GOG-LAP2), se asignó al azar a 2616 pacientes con enfermedad en estadios clínicos I y IIA en una proporción 2:1 a una estadificación quirúrgica exhaustiva con laparoscopia o laparotomía.[22][Nivel de evidencia A1]
El criterio primario de valoración fue el tiempo hasta la recidiva, y la ausencia de inferioridad se definió como una diferencia en la tasa de recidiva a 3 años menor de 5,3 % entre los dos grupos.
- La tasa de recidiva a 3 años fue de 10,24 % para las pacientes del grupo de laparotomía y de 11,39 % para las pacientes del grupo de laparoscopia, con una diferencia calculada entre los grupos de 1,14 % (límite inferior de 90 %, -1278; límite superior de 95 %, 3996).
- Aunque esta diferencia fue más baja que el límite preespecificado, no se reunieron los requisitos estadísticos de ausencia de inferioridad debido a un número de recidivas menor del previsto en ambos grupos.
- La tasa de supervivencia general (SG) a 5 años fue de 89,8 % en ambos grupos.
- La tasa de recidiva a 3 años fue de 10,24 % para las pacientes del grupo de laparotomía y de 11,39 % para las pacientes del grupo de laparoscopia, con una diferencia calculada entre los grupos de 1,14 % (límite inferior de 90 %, -1278; límite superior de 95 %, 3996).
- En una revisión de Cochrane sobre el uso de la estadificación laparoscópica, se incluyeron cuatro ensayos controlados aleatorizados que notificaron SG y supervivencia sin progresión (SSP). Noventa por ciento de las pacientes pertenecían al ensayo GOG-LAP2.[23][ Nivel de evidencia A1]
- En general, la laparoscopia y la laparotomía se vincularon con tasas similares de SG y SSP.
En los análisis futuros tal vez sea posible determinar si hay subgrupos de pacientes que presentan una disminución clínicamente significativa cuando se utiliza la estadificación laparoscópica.[22][Nivel de evidencia B1]
Braquiterapia vaginal posoperatoria
Si bien la radioterapia adyuvante reducirá la incidencia de recidivas locales y locorregionales, no se comprobó una mejora de la supervivencia y los efectos tóxicos son peores con la radioterapia.[24-28] La braquiterapia en la cúpula vaginal se vincula con menor morbilidad relacionada con la radiación que la radioterapia de haz externo (RHE) y mostró ser equivalente a la RHE en el corto plazo para pacientes con enfermedad en estadio I.[29] Sin embargo, en el seguimiento a largo plazo de un ensayo aleatorizado en el que se comparó el uso combinado de la RHE y la braquiterapia vaginal (BTV) con la BTV sola, se encontró una disminución de la SG y un aumento de los efectos tóxicos en el grupo que recibió RHE además de BTV.[30]
Evidencia (braquiterapia vaginal):
- En los resultados de dos ensayos aleatorios en los que se usó radioterapia adyuvante para pacientes con enfermedad en estadio I, no se observó una mejora de la supervivencia pero se observó una reducción de la recidiva locorregional (3–4 % en el grupo de radioterapia vs. 12–14 % en el grupo de control después de mediana de seguimiento de 5–6 años; P < 0,001), con un aumento de los efectos secundarios.[27,31,32][Nivel de evidencia B1]
- Los resultados de un estudio realizado por el Danish Endometrial Cancer Group indican que la ausencia de radioterapia no mejora la supervivencia de las pacientes con enfermedad de riesgo intermedio en estadio I (grados 1 y 2 con >50 % de invasión del miometrio, o grado 3 con <50 % de invasión miometrial).[33]
- En el ensayo PORTEC-2 (NCT00411138), se asignó al azar a pacientes de cáncer de endometrio en estadio I que no se sometieron a disección de ganglios linfáticos a recibir BTV o RHE; el criterio primario de valoración fue la prevención de la recidiva vaginal.[29,34][Nivel de evidencia A1]
- A los 5 años, no hubo ninguna diferencia en las tasas de recidiva vaginal, recidiva locorregional, SSP o SG (84,8 % intervalo de confianza [IC] 95 %, 79,3–90,3 % para la BTV vs. 79,6 % [IC 95 %, 71,2–88,0 %] para la RHE; P = 0,57).
- En el grupo de BTV se presentaron considerablemente menos efectos tóxicos gastrointestinales y mejoró la calidad de vida; esto hizo que la BTV se convirtiera en la opción preferida de tratamiento adyuvante para las pacientes con enfermedad en estadio I.
- Entre 1968 y 1974 (antes del inicio de la estadificación quirúrgica de FIGO), en el ensayo Norwegian Radium Hospital se incluyó a 568 pacientes de cáncer de endometrio en estadio clínico I.[30][Nivel de evidencia A1]. Después de la histerectomía y la salpingooforectomía bilateral, las pacientes se asignaron al azar para recibir RHE y BTV, o BTV sola.
- En un informe actualizado en el que se presentaron datos de más de 20 años de seguimiento, no se observó diferencias de SG entre los grupos de tratamiento. La mediana de SG fue de 20,5 años en el grupo de RHE y BTV, y de 20,48 en el grupo de BTV sola (P = 0,186). Todas las mujeres presentaron un aumento de riesgo de cánceres secundarios después de la RHE (cociente de riesgos instantáneos [CRI], 1,42; IC 95 %, 1,01–2,0).
- En un análisis posterior de subconjuntos de las mujeres menores de 60 años en el momento de la inscripción en el ensayo, se observó un aumento de mortalidad en el grupo de RHE (CRI, 1,36; IC 95 %, 1,06–1,76). Además, el riesgo de cánceres secundarios se duplicó en este grupo (CRI, 2,02; IC 95%, 1,3–3,15).
Radioterapia posoperatoria
Si el cuello uterino no está comprometido desde el punto de vista clínico, pero se observa diseminación al cuello uterino en el análisis patológico posoperatorio, se considera la administración de radioterapia.[22][Nivel de evidencia A1]
Radioterapia sola
Es posible que las pacientes con contraindicaciones médicas para la cirugía se traten con radioterapia sola, pero a veces esto disminuye las tasas de curación que se logran con la cirugía.[35-37]
Ensayos clínicos
En los ensayos clínicos se están evaluando opciones de tratamiento para el cáncer de endometrio en estadio I.
- En el ensayo GOG-0249 (NCT00807768) se comparó el uso combinado de carboplatino y paclitaxel adyuvantes, además de la braquiterapia en la cúpula o muñón vaginal versus la RHE pélvica en el cáncer de endometrio de riesgo alto en pacientes con enfermedad en estadio I o II. El estudio ya dejó de inscribir participantes y los hallazgos preliminares no indicaron diferentes entre los dos grupos de tratamiento.
- En el ensayo GOG-0261 (NCT00954174) se comparó el paclitaxel y el carboplatino con el paclitaxel y la ifosfamida en pacientes con cáncer de útero, ovario, trompa de Falopio o cavidad peritoneal resistente al tratamiento o recidivante en estadios I a IV de diagnóstico reciente.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Kiess AP, Damast S, Makker V, et al.: Five-year outcomes of adjuvant carboplatin/paclitaxel chemotherapy and intravaginal radiation for stage I-II papillary serous endometrial cancer. Gynecol Oncol 127 (2): 321-5, 2012. [PUBMED Abstract]
- Boruta DM, Gehrig PA, Fader AN, et al.: Management of women with uterine papillary serous cancer: a Society of Gynecologic Oncology (SGO) review. Gynecol Oncol 115 (1): 142-53, 2009. [PUBMED Abstract]
- Huh WK, Powell M, Leath CA, et al.: Uterine papillary serous carcinoma: comparisons of outcomes in surgical Stage I patients with and without adjuvant therapy. Gynecol Oncol 91 (3): 470-5, 2003. [PUBMED Abstract]
- Fader AN, Drake RD, O'Malley DM, et al.: Platinum/taxane-based chemotherapy with or without radiation therapy favorably impacts survival outcomes in stage I uterine papillary serous carcinoma. Cancer 115 (10): 2119-27, 2009. [PUBMED Abstract]
- Kelly MG, O'malley DM, Hui P, et al.: Improved survival in surgical stage I patients with uterine papillary serous carcinoma (UPSC) treated with adjuvant platinum-based chemotherapy. Gynecol Oncol 98 (3): 353-9, 2005. [PUBMED Abstract]
- Havrilesky LJ, Secord AA, Bae-Jump V, et al.: Outcomes in surgical stage I uterine papillary serous carcinoma. Gynecol Oncol 105 (3): 677-82, 2007. [PUBMED Abstract]
- Dietrich CS, Modesitt SC, DePriest PD, et al.: The efficacy of adjuvant platinum-based chemotherapy in Stage I uterine papillary serous carcinoma (UPSC). Gynecol Oncol 99 (3): 557-63, 2005. [PUBMED Abstract]
- Townamchai K, Berkowitz R, Bhagwat M, et al.: Vaginal brachytherapy for early stage uterine papillary serous and clear cell endometrial cancer. Gynecol Oncol 129 (1): 18-21, 2013. [PUBMED Abstract]
- Barney BM, Petersen IA, Mariani A, et al.: The role of vaginal brachytherapy in the treatment of surgical stage I papillary serous or clear cell endometrial cancer. Int J Radiat Oncol Biol Phys 85 (1): 109-15, 2013. [PUBMED Abstract]
- Hornback NB, Omura G, Major FJ: Observations on the use of adjuvant radiation therapy in patients with stage I and II uterine sarcoma. Int J Radiat Oncol Biol Phys 12 (12): 2127-30, 1986. [PUBMED Abstract]
- Peters WA, Rivkin SE, Smith MR, et al.: Cisplatin and adriamycin combination chemotherapy for uterine stromal sarcomas and mixed mesodermal tumors. Gynecol Oncol 34 (3): 323-7, 1989. [PUBMED Abstract]
- Ayhan A, Taskiran C, Celik C, et al.: The long-term survival of women with surgical stage II endometrioid type endometrial cancer. Gynecol Oncol 93 (1): 9-13, 2004. [PUBMED Abstract]
- Eltabbakh GH, Moore AD: Survival of women with surgical stage II endometrial cancer. Gynecol Oncol 74 (1): 80-5, 1999. [PUBMED Abstract]
- Orezzoli JP, Sioletic S, Olawaiye A, et al.: Stage II endometrioid adenocarcinoma of the endometrium: clinical implications of cervical stromal invasion. Gynecol Oncol 113 (3): 316-23, 2009. [PUBMED Abstract]
- Walker JL, Piedmonte MR, Spirtos NM, et al.: Laparoscopy compared with laparotomy for comprehensive surgical staging of uterine cancer: Gynecologic Oncology Group Study LAP2. J Clin Oncol 27 (32): 5331-6, 2009. [PUBMED Abstract]
- Mariani A, Dowdy SC, Cliby WA, et al.: Prospective assessment of lymphatic dissemination in endometrial cancer: a paradigm shift in surgical staging. Gynecol Oncol 109 (1): 11-8, 2008. [PUBMED Abstract]
- Mariani A, Webb MJ, Keeney GL, et al.: Low-risk corpus cancer: is lymphadenectomy or radiotherapy necessary? Am J Obstet Gynecol 182 (6): 1506-19, 2000. [PUBMED Abstract]
- Barlin JN, Khoury-Collado F, Kim CH, et al.: The importance of applying a sentinel lymph node mapping algorithm in endometrial cancer staging: beyond removal of blue nodes. Gynecol Oncol 125 (3): 531-5, 2012. [PUBMED Abstract]
- Janda M, Gebski V, Brand A, et al.: Quality of life after total laparoscopic hysterectomy versus total abdominal hysterectomy for stage I endometrial cancer (LACE): a randomised trial. Lancet Oncol 11 (8): 772-80, 2010. [PUBMED Abstract]
- Mourits MJ, Bijen CB, Arts HJ, et al.: Safety of laparoscopy versus laparotomy in early-stage endometrial cancer: a randomised trial. Lancet Oncol 11 (8): 763-71, 2010. [PUBMED Abstract]
- Kornblith AB, Huang HQ, Walker JL, et al.: Quality of life of patients with endometrial cancer undergoing laparoscopic international federation of gynecology and obstetrics staging compared with laparotomy: a Gynecologic Oncology Group study. J Clin Oncol 27 (32): 5337-42, 2009. [PUBMED Abstract]
- Walker JL, Piedmonte MR, Spirtos NM, et al.: Recurrence and survival after random assignment to laparoscopy versus laparotomy for comprehensive surgical staging of uterine cancer: Gynecologic Oncology Group LAP2 Study. J Clin Oncol 30 (7): 695-700, 2012. [PUBMED Abstract]
- Galaal K, Bryant A, Fisher AD, et al.: Laparoscopy versus laparotomy for the management of early stage endometrial cancer. Cochrane Database Syst Rev 9: CD006655, 2012. [PUBMED Abstract]
- Aalders J, Abeler V, Kolstad P, et al.: Postoperative external irradiation and prognostic parameters in stage I endometrial carcinoma: clinical and histopathologic study of 540 patients. Obstet Gynecol 56 (4): 419-27, 1980. [PUBMED Abstract]
- Morrow CP, Bundy BN, Kurman RJ, et al.: Relationship between surgical-pathological risk factors and outcome in clinical stage I and II carcinoma of the endometrium: a Gynecologic Oncology Group study. Gynecol Oncol 40 (1): 55-65, 1991. [PUBMED Abstract]
- Marchetti DL, Caglar H, Driscoll DL, et al.: Pelvic radiation in stage I endometrial adenocarcinoma with high-risk attributes. Gynecol Oncol 37 (1): 51-4, 1990. [PUBMED Abstract]
- Creutzberg CL, van Putten WL, Koper PC, et al.: Surgery and postoperative radiotherapy versus surgery alone for patients with stage-1 endometrial carcinoma: multicentre randomised trial. PORTEC Study Group. Post Operative Radiation Therapy in Endometrial Carcinoma. Lancet 355 (9213): 1404-11, 2000. [PUBMED Abstract]
- Kong A, Johnson N, Kitchener HC, et al.: Adjuvant radiotherapy for stage I endometrial cancer: an updated Cochrane systematic review and meta-analysis. J Natl Cancer Inst 104 (21): 1625-34, 2012. [PUBMED Abstract]
- Nout RA, Smit VT, Putter H, et al.: Vaginal brachytherapy versus pelvic external beam radiotherapy for patients with endometrial cancer of high-intermediate risk (PORTEC-2): an open-label, non-inferiority, randomised trial. Lancet 375 (9717): 816-23, 2010. [PUBMED Abstract]
- Onsrud M, Cvancarova M, Hellebust TP, et al.: Long-term outcomes after pelvic radiation for early-stage endometrial cancer. J Clin Oncol 31 (31): 3951-6, 2013. [PUBMED Abstract]
- Keys HM, Roberts JA, Brunetto VL, et al.: A phase III trial of surgery with or without adjunctive external pelvic radiation therapy in intermediate risk endometrial adenocarcinoma: a Gynecologic Oncology Group study. Gynecol Oncol 92 (3): 744-51, 2004. [PUBMED Abstract]
- Scholten AN, van Putten WL, Beerman H, et al.: Postoperative radiotherapy for Stage 1 endometrial carcinoma: long-term outcome of the randomized PORTEC trial with central pathology review. Int J Radiat Oncol Biol Phys 63 (3): 834-8, 2005. [PUBMED Abstract]
- Bertelsen K, Ortoft G, Hansen ES: Survival of Danish patients with endometrial cancer in the intermediate-risk group not given postoperative radiotherapy: the Danish Endometrial Cancer Study (DEMCA). Int J Gynecol Cancer 21 (7): 1191-9, 2011. [PUBMED Abstract]
- Nout RA, Putter H, Jürgenliemk-Schulz IM, et al.: Five-year quality of life of endometrial cancer patients treated in the randomised Post Operative Radiation Therapy in Endometrial Cancer (PORTEC-2) trial and comparison with norm data. Eur J Cancer 48 (11): 1638-48, 2012. [PUBMED Abstract]
- Eltabbakh GH, Piver MS, Hempling RE, et al.: Excellent long-term survival and absence of vaginal recurrences in 332 patients with low-risk stage I endometrial adenocarcinoma treated with hysterectomy and vaginal brachytherapy without formal staging lymph node sampling: report of a prospective trial. Int J Radiat Oncol Biol Phys 38 (2): 373-80, 1997. [PUBMED Abstract]
- Stokes S, Bedwinek J, Kao MS, et al.: Treatment of stage I adenocarcinoma of the endometrium by hysterectomy and adjuvant irradiation: a retrospective analysis of 304 patients. Int J Radiat Oncol Biol Phys 12 (3): 339-44, 1986. [PUBMED Abstract]
- Grigsby PW, Kuske RR, Perez CA, et al.: Medically inoperable stage I adenocarcinoma of the endometrium treated with radiotherapy alone. Int J Radiat Oncol Biol Phys 13 (4): 483-8, 1987. [PUBMED Abstract]
Tratamiento del cáncer de endometrio en estadio III, estadio IV y recidivante
Opciones de tratamiento del cáncer de endometrio en estadio III, estadio IV y recidivante
Las opciones de tratamiento para pacientes de cáncer de endometrio en estadio III, estadio IV y recidivante son las siguientes:
El tratamiento de las pacientes con cáncer de endometrio en estadio IV se determina según el sitio de la enfermedad metastásica y los síntomas relacionados con los sitios de la enfermedad.
Cirugía seguida de quimioterapia o radioterapia
En general, las pacientes de cáncer de endometrio en estadio III o estadio IV se tratan con cirugía seguida de quimioterapia, radioterapia o ambas. Si bien hay estudios de observación que respaldan la cirugía de citorreducción máxima para las pacientes con enfermedad en estadio IV, estas conclusiones se deben interpretar con cautela debido al número pequeño de casos y los posibles sesgos de selección.[1,2]
Durante muchos años, la radioterapia fue el tratamiento adyuvante estándar para las pacientes de cáncer de endometrio. Sin embargo, en varios estudios aleatorizados se confirmó una mejora de la supervivencia con la quimioterapia adyuvante en lugar de la radioterapia.
Tradicionalmente, la doxorrubicina fue el fármaco más activo utilizado contra el cáncer, con respuestas útiles pero temporarias obtenidas en por lo menos 33 % de las pacientes con enfermedad recidivante. El paclitaxel, combinado con quimioterapia con derivados del platino o como fármaco único también tiene un efecto importante sobre el cáncer.[3]
Evidencia (cirugía seguida de quimioterapia o radioterapia):
- En varios ensayos aleatorizados realizados por el Gynecologic Oncology Group (GOG), se empleó doxorrubicina debido a su conocida actividad antitumoral.[4]
- La adición de cisplatino a la doxorrubicina produjo un aumento en las tasas de respuesta y la supervivencia sin progresión (SSP) en relación con las de doxorrubicina sola, pero sin efecto en la supervivencia general (SG).
- El régimen de tres fármacos (doxorrubicina, cisplatino y paclitaxel) con el factor estimulante de colonias de granulocitos (G-CSF) fue significativamente superior a la combinación de cisplatino y doxorrubicina como se puede notar en lo siguiente:[5,6][Nivel de evidencia B3]
- La tasa de respuesta fue del 57 % con el régimen de tres fármacos comparada con 34 % con el régimen de cisplatino y doxorrubicina.
- La SSP fue de 8,3 meses con el régimen de tres fármacos, comparada con 5,3 meses con el régimen de cisplatino y doxorrubicina.
- La SG fue de 15,3 meses con el régimen de tres fármacos, comparada con 12,3 meses con el régimen de cisplatino y doxorrubicina.
- El régimen superior (doxorrubicina, cisplatino y paclitaxel con G-CSF) se relacionó con el 12 % de neuropatía periférica de grado 3 y el 27 % con la de grado 2.
Dados los efectos tóxicos y la eficacia limitada de estos regímenes, se han buscado extensamente otras opciones de tratamiento. En varios estudios de observación [7,8] y estudios de fase II,[9-12] se indicó actividad clínica con la combinación de quimioterapia con derivados del platino y paclitaxel para pacientes de cáncer de endometrio con enfermedad mensurable después de la cirugía primaria o la recidiva.
- El protocolo GOG-0209 (NCT000063999) del GOG, corresponde a un ensayo con ausencia de inferioridad en el que se comparó la combinación de paclitaxel, doxorrubicina y cisplatino (TAP) con G-CSF, con carboplatino y paclitaxel.[13]
- En los resultados intermedios, actualmente disponibles en forma de resumen, se observa que la combinación de carboplatino con paclitaxel no fue inferior a la combinación TAP. Estos resultados conducen al uso de la combinación de carboplatino y paclitaxel como el tratamiento adyuvante estándar para pacientes con enfermedad en estadios III y IV.
- En un ensayo con pacientes de enfermedad en estadio III o IV con tumores residuales menores de 2 cm y sin compromiso de órganos parenquimatosos, se estudió el uso de cisplatino y doxorrubicina comparado con la radioterapia abdominal total.[14][Nivel de evidencia A1]
- Los resultados indican que el cisplatino y la doxorrubicina mejoraron la SG en comparación con la radioterapia abdominal total (ajuste de cociente de riesgos instantáneos [CRI], 0,68; intervalo de confianza [IC] 95 %, 0,52–0,89; P = 0,02; tasas de supervivencia a 5 años de 55 % del cisplatino y la doxorrubicina vs. 42 % de la radioterapia abdominal total).
- En varios ensayos se sustenta la quimioterapia combinada para pacientes de carcinosarcoma en estadio III, estadio IV y recidivante.
- En el ensayo GOG-108 de ifosfamida con cisplatino o sin este como tratamiento de primera línea para pacientes de carcinosarcomas en estadio avanzado o recidivantes, se demostró una tasa más alta de respuesta (54 vs. 34 %) y SSP más prolongada en el grupo de combinación (6 vs. 4 meses), pero no hubo una mejora significativa en la supervivencia (9 vs. 8 meses).[15][Nivel de evidencia A1]
- En el estudio de seguimiento GOG-0161 (NCT00003128), se utilizaron regímenes de 3 días de ifosfamida (en lugar del régimen más tóxico de 5 días utilizado en el estudio anterior) para el grupo de control e ifosfamida combinada con paclitaxel (con G-CSF desde el día 4) para el grupo de estudio.[16]
- El régimen de combinación produjo tasas de respuesta superiores (45 vs. 29 %), SSP (8,4 vs. 5,8 meses) y SG (13,5 vs. 8,4 meses). El CRI para la muerte también favoreció el régimen de combinación (CRI, 0,69; IC 95 %, 0,49–0,97).[16][Nivel de evidencia A1]
- En este estudio, el 52 % de 179 pacientes evaluables tenían enfermedad recidivante; el 18 % enfermedad en estadio III y el 30 % enfermedad en estadio IV. Además, hubo desequilibrios entre los grupos de tratamiento con respecto a los sitios de la enfermedad y el uso de radioterapia previa; se excluyó a 30 pacientes por características patológicas incorrectas.
- En un estudio de fase II, se evaluó el carboplatino con paclitaxel en pacientes de carcinosarcoma en estadio III, estadio IV o recidivante.[17] Después de observarse una tasa de respuesta favorable, el GOG activó el GOG-0261 (NCT00954174), un ensayo aleatorizado de fase III de carboplatino con paclitaxel versus ifosfamida con paclitaxel. En este estudio no se reciben más pacientes y se esperan sus resultados.
Quimioterapia y radioterapia
Es posible tratar a las pacientes con enfermedad inoperable causada por un tumor que se extiende a la pared pélvica con una combinación de quimioterapia y radioterapia. El abordaje habitual de la radioterapia es el uso de una combinación de radioterapia intracavitaria y radioterapia de haz externo.[18,19]
Es posible que la radioterapia sea paliativa para pacientes con recidivas localizadas (ganglios pélvicos y paraaórticos) o metástasis a distancia en sitios seleccionados. La radioterapia pélvica es a veces curativa de la recidiva vaginal pura cuando no se administró antes radioterapia.
Terapia hormonal
En los tejidos del carcinoma endometrial se suelen encontrar receptores hormonales de progesterona y estrógeno. La respuesta a la terapia hormonal se correlaciona con la presencia y las concentraciones de receptores hormonales, y el grado de diferenciación del tumor.[20] Las pacientes con tumores con receptores de estrógeno y progesterona responden mejor al tratamiento con progestina.
Se indica la terapia hormonal cuando hay metástasis a distancia; en especial, metástasis pulmonares. Es posible que las pacientes que no son aptas para cirugía ni radioterapia se traten con fármacos progestacionales, que es el tratamiento hormonal más común. Los fármacos progestacionales producen buenas respuestas antitumorales en el 15 % al 30 % de las pacientes. Estas respuestas se relacionan con una mejora significativa de la supervivencia.[20]
Los fármacos progestacionales estándar son los siguientes:[20]
- Hidroxiprogesterona.
- Medroxiprogesterona.
- Megestrol.
Evidencia (terapia con progestina):
- En un estudio se realizó el seguimiento de 115 pacientes de cáncer de endometrio en estadio avanzado que se trataron con progestinas.[21]
- Respondieron al tratamiento el 75 % de las pacientes (42 de 56) con tumores con receptores de progesterona.
- De las pacientes sin receptores de progesterona detectables, el 7 % (4 de 59) respondieron al tratamiento.
Algunas veces, la escasez de receptores predice tanto una respuesta precaria a las progestinas como una respuesta mejor a la quimioterapia citotóxica.[22]
Se observó que otros fármacos hormonales son beneficiosos en el tratamiento del cáncer de endometrio. El tamoxifeno (20 mg dos veces al día) produce una tasa de respuesta del 20 % en pacientes que no responden a la terapia estándar con progesterona.[23]
Si bien se evaluaron los inhibidores de la aromatasa para el tratamiento del cáncer de endometrio en estadio avanzado y recidivante, estos producen tasas más bajas de respuesta que los fármacos progestacionales.[24]
Terapia biológica
Para el tratamiento del cáncer de endometrio se han evaluado varias sustancias biológicas.
- Inhibidores del blanco de la rapamicina en los mamíferos (mTOR).
Los cánceres de endometrio a menudo exhiben alteraciones en la vía AKT-PI3K; esto hace que los inhibidores mTOR sean una opción atractiva para el estudio clínico de pacientes con enfermedad metastásica o recidivante. En estudios de fase II del fármaco único everólimus [25] y ridaforólimus [26,27] se observó predominantemente la estabilización de la enfermedad. En un estudio de fase II de la combinación de everólimus y letrozol, se observó una tasa de respuesta del 32 %.[28][Nivel de evidencia C3]
- Bevacizumab.
- El bevacizumab se utilizó como fármaco único en un ensayo de fase II; la tasa general de respuesta fue del 13,5 %.[29][Nivel de evidencia C3]
- Se usó bevacizumab combinado con temsirólimus.[30]
Inmunoterapia
Con la publicación de los resultados del Atlas del Genoma del Cáncer, y a medida que se conocen mejor los factores moleculares desencadenantes del cáncer de endometrio, se ha evaluado el uso de la inmunoterapia para el tratamiento de la enfermedad avanzada y recidivante.
Evidencia (inmunoterapia):
- El ensayo Study 309/KEYNOTE-775 NCT03517449 fue un estudio aleatorizado, multicéntrico, internacional y de gran tamaño en el que se comparó la combinación de pembrolizumab (200 mg por vía intravenosa [IV] cada 3 semanas durante un máximo de 35 ciclos) y lenvatinib (20 mg diarios por vía oral) con la quimioterapia elegida por el médico. El estudio incluyó a mujeres con cáncer de endometrio avanzado o recidivante que habían presentado progresión de la enfermedad tras un régimen a base de derivados del platino (se requería enfermedad mensurable). Se permitieron todos los subtipos histológicos, excepto el carcinosarcoma y el sarcoma. Se estratificó a las pacientes según el estado de reparación de errores de emparejamiento (MMR). Los dos criterios de valoración primarios fueron la SSP y la SG.[31]
- Al cabo de una mediana de seguimiento de alrededor de 12 meses en ambos grupos, la supervivencia fue estadísticamente mayor en las pacientes del grupo de pembrolizumab-lenvatinib. El beneficio persistió a pesar del estado de MMR de las pacientes. Entre todos las pacientes, la mediana de SSP fue de 7,3 meses para las que recibieron pembrolizumab y lenvatinib y de 3,8 meses para las que recibieron quimioterapia (CRI, 0,56; IC 95 %, 0,48–0,66; P < 0,001). La mediana de SG fue de 18,7 meses para las pacientes que recibieron pembrolizumab y lenvatinib y de 11,9 meses para las pacientes que recibieron quimioterapia (CRI, 0,65; IC 95 %, 0,55–0,77; P < 0,001).[31][Nivel de evidencia A1]
- El efecto secundario grave más frecuente en el grupo experimental fue la hipertensión.
- En otro ensayo aleatorizado de fase III (NRG-GY018 [NCT03914612]) se evaluó la respuesta del pembrolizumab en mujeres con enfermedad mensurable en estadio III o IVA, o aquellas con enfermedad en estadio IVB o recidivante. Las mujeres se asignaron a recibir una combinación de carboplatino y paclitaxel, con pembrolizumab o sin este, como tratamiento de primera línea. Las pacientes recibieron 6 ciclos de quimioterapia seguidos de 14 ciclos de mantenimiento. Se estratificó a las pacientes según su estado de MMR. El resultado primario fue la SSP.[32]
- Después de 12 meses, el CRI de progresión o muerte fue de 0,3 (IC 95 %, 0,19–0,48; P < 0,001) para el grupo con deficiencia en MMR y de 0,54 (IC 95 %, 0,41–0,71; P < 0,001) para el grupo con deficiencia en MMR, ambos favoreciendo la adición de pembrolizumab.[32][Nivel de evidencia A1]
- El ensayo RUBY (NCT03981796) fue un estudio multicéntrico a gran escala en mujeres con cáncer de endometrio de todos los subtipos histológicos en estadios III, IV o recidivante no susceptible de tratamiento curativo, según la Fédération Internationale de Gynécologie et d'Obstétrique. A diferencia de los ensayos Study 309/KEYNOTE-775 y NRG-GY018, algunas pacientes sin enfermedad mensurable cumplían los requisitos para su inclusión. Las mujeres se asignaron al azar a recibir carboplatino y paclitaxel con dostarlimab (500 mg IV) o sin este cada 3 semanas durante 6 ciclos, seguidos de dostarlimab de mantenimiento (1000 mg IV cada 6 semanas) durante un máximo de 3 años. Se estratificó a las pacientes según su estado de MMR. La variable principal fue la SSP.[33]
- Al cabo de una mediana de seguimiento de alrededor de 2 años, el grupo de dostarlimab de la población general tuvo un riesgo un 36 % menor de progresión o muerte (CRI, 0,64; IC 95 %, 0,51–0,80; P < 0,001). El grupo de dostarlimab de la población con deficiencia en MMR tuvo un riesgo un 72 % menor de progresión o muerte (CRI, 0,28; IC 95 %, 0,16–0,50; P < 0,001). Se observó un beneficio similar en la SG (CRI, 0,64; IC 95 %, 0,46–0,87; P = 0,0021 para la población general; CRI, 0,30; IC 95 %, 0,13–0,70 para la población con deficiencia en MMR).[33][Nivel de evidencia B1]
En estos tres estudios se demuestran la actividad y el beneficio de la inmunoterapia en el tratamiento de pacientes con cáncer de endometrio en estadio avanzado y recidivante. Estos resultados también pueden facilitar la incorporación de dichos tratamientos en el entorno inicial. Se necesitan más datos para ayudar a discernir el papel de la inmunoterapia en pacientes que tradicionalmente se tratarían con radioterapia como parte del plan de tratamiento.
Ensayos clínicos
Se deberá considerar a todas las pacientes con enfermedad en estadio avanzado para que participen en ensayos clínicos en los que se evalúe el tratamiento con monoterapia o en combinación.
En los estudios de modelos de fracaso de tratamiento se encontró una tasa alta de metástasis a distancia en la parte superior del abdomen y en sitios extrabdominales.[34] Por esta razón, es posible que las pacientes con enfermedad en estadio III sean aptas para participar en ensayos clínicos innovadores.
Las opciones de tratamiento en evaluación clínica para el cáncer de endometrio en estadio IV incluyen los siguientes fármacos:
- Paclitaxel y carboplatino con metformina o sin esta para cáncer de endometrio en estadios III, IV y recidivante (GOG-0286B [NCT02065687]).
- Inhibidor de PI3K/mTOR para el cáncer de endometrio recidivante o persistente (15-079 [NCT02549989]).
- Everólimus y letrozol o terapia hormonal para el cáncer de endometrio recidivante o persistente (GOG-3007 [NCT02228681]).
- Everólimus, letrozol y metformina para el cáncer de endometrio avanzado o recidivante (2012-0543 [NCT01797523]).
- Paclitaxel y carboplatino versus paclitaxel e ifosfamida para el cáncer de útero, ovario, trompa de Falopio o cavidad peritoneal en estadios I a IV recién diagnosticado persistente o recidivante (GOG-0261 [NCT00954174]).
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Shih KK, Yun E, Gardner GJ, et al.: Surgical cytoreduction in stage IV endometrioid endometrial carcinoma. Gynecol Oncol 122 (3): 608-11, 2011. [PUBMED Abstract]
- Barlin JN, Puri I, Bristow RE: Cytoreductive surgery for advanced or recurrent endometrial cancer: a meta-analysis. Gynecol Oncol 118 (1): 14-8, 2010. [PUBMED Abstract]
- Ball HG, Blessing JA, Lentz SS, et al.: A phase II trial of paclitaxel in patients with advanced or recurrent adenocarcinoma of the endometrium: a Gynecologic Oncology Group study. Gynecol Oncol 62 (2): 278-81, 1996. [PUBMED Abstract]
- Thigpen JT, Brady MF, Homesley HD, et al.: Phase III trial of doxorubicin with or without cisplatin in advanced endometrial carcinoma: a Gynecologic Oncology Group study. J Clin Oncol 22 (19): 3902-8, 2004. [PUBMED Abstract]
- Fleming GF, Brunetto VL, Cella D, et al.: Phase III trial of doxorubicin plus cisplatin with or without paclitaxel plus filgrastim in advanced endometrial carcinoma: a Gynecologic Oncology Group Study. J Clin Oncol 22 (11): 2159-66, 2004. [PUBMED Abstract]
- Fleming GF, Filiaci VL, Bentley RC, et al.: Phase III randomized trial of doxorubicin + cisplatin versus doxorubicin + 24-h paclitaxel + filgrastim in endometrial carcinoma: a Gynecologic Oncology Group study. Ann Oncol 15 (8): 1173-8, 2004. [PUBMED Abstract]
- Arimoto T, Nakagawa S, Yasugi T, et al.: Treatment with paclitaxel plus carboplatin, alone or with irradiation, of advanced or recurrent endometrial carcinoma. Gynecol Oncol 104 (1): 32-5, 2007. [PUBMED Abstract]
- Sovak MA, Hensley ML, Dupont J, et al.: Paclitaxel and carboplatin in the adjuvant treatment of patients with high-risk stage III and IV endometrial cancer: a retrospective study. Gynecol Oncol 103 (2): 451-7, 2006. [PUBMED Abstract]
- Hoskins PJ, Swenerton KD, Pike JA, et al.: Paclitaxel and carboplatin, alone or with irradiation, in advanced or recurrent endometrial cancer: a phase II study. J Clin Oncol 19 (20): 4048-53, 2001. [PUBMED Abstract]
- Pectasides D, Xiros N, Papaxoinis G, et al.: Carboplatin and paclitaxel in advanced or metastatic endometrial cancer. Gynecol Oncol 109 (2): 250-4, 2008. [PUBMED Abstract]
- Nomura H, Aoki D, Takahashi F, et al.: Randomized phase II study comparing docetaxel plus cisplatin, docetaxel plus carboplatin, and paclitaxel plus carboplatin in patients with advanced or recurrent endometrial carcinoma: a Japanese Gynecologic Oncology Group study (JGOG2041). Ann Oncol 22 (3): 636-42, 2011. [PUBMED Abstract]
- Dimopoulos MA, Papadimitriou CA, Georgoulias V, et al.: Paclitaxel and cisplatin in advanced or recurrent carcinoma of the endometrium: long-term results of a phase II multicenter study. Gynecol Oncol 78 (1): 52-7, 2000. [PUBMED Abstract]
- Miller D, Filiaci V, Fleming G, et al.: Late-breaking abstract 1: Randomized phase III noninferiority trial of first line chemotherapy for metastatic or recurrent endometrial carcinoma: A Gynecologic Oncology Group study. [Abstract] Gynecol Oncol 125 (3): 771, 2012.
- Randall ME, Filiaci VL, Muss H, et al.: Randomized phase III trial of whole-abdominal irradiation versus doxorubicin and cisplatin chemotherapy in advanced endometrial carcinoma: a Gynecologic Oncology Group Study. J Clin Oncol 24 (1): 36-44, 2006. [PUBMED Abstract]
- Sutton G, Brunetto VL, Kilgore L, et al.: A phase III trial of ifosfamide with or without cisplatin in carcinosarcoma of the uterus: A Gynecologic Oncology Group Study. Gynecol Oncol 79 (2): 147-53, 2000. [PUBMED Abstract]
- Homesley HD, Filiaci V, Markman M, et al.: Phase III trial of ifosfamide with or without paclitaxel in advanced uterine carcinosarcoma: a Gynecologic Oncology Group Study. J Clin Oncol 25 (5): 526-31, 2007. [PUBMED Abstract]
- Powell MA, Filiaci VL, Rose PG, et al.: Phase II evaluation of paclitaxel and carboplatin in the treatment of carcinosarcoma of the uterus: a Gynecologic Oncology Group study. J Clin Oncol 28 (16): 2727-31, 2010. [PUBMED Abstract]
- Wegner RE, Beriwal S, Heron DE, et al.: Definitive radiation therapy for endometrial cancer in medically inoperable elderly patients. Brachytherapy 9 (3): 260-5, 2010 Jul-Sep. [PUBMED Abstract]
- Kupelian PA, Eifel PJ, Tornos C, et al.: Treatment of endometrial carcinoma with radiation therapy alone. Int J Radiat Oncol Biol Phys 27 (4): 817-24, 1993. [PUBMED Abstract]
- Lentz SS: Advanced and recurrent endometrial carcinoma: hormonal therapy. Semin Oncol 21 (1): 100-6, 1994. [PUBMED Abstract]
- Kauppila A: Oestrogen and progestin receptors as prognostic indicators in endometrial cancer. A review of the literature. Acta Oncol 28 (4): 561-6, 1989. [PUBMED Abstract]
- Kauppila A, Friberg LG: Hormonal and cytotoxic chemotherapy for endometrial carcinoma. Steroid receptors in the selection of appropriate therapy. Acta Obstet Gynecol Scand Suppl 101: 59-64, 1981. [PUBMED Abstract]
- Quinn MA, Campbell JJ: Tamoxifen therapy in advanced/recurrent endometrial carcinoma. Gynecol Oncol 32 (1): 1-3, 1989. [PUBMED Abstract]
- Lindemann K, Malander S, Christensen RD, et al.: Examestane in advanced or recurrent endometrial carcinoma: a prospective phase II study by the Nordic Society of Gynecologic Oncology (NSGO). BMC Cancer 14: 68, 2014. [PUBMED Abstract]
- Slomovitz BM, Lu KH, Johnston T, et al.: A phase 2 study of the oral mammalian target of rapamycin inhibitor, everolimus, in patients with recurrent endometrial carcinoma. Cancer 116 (23): 5415-9, 2010. [PUBMED Abstract]
- Colombo N, McMeekin DS, Schwartz PE, et al.: Ridaforolimus as a single agent in advanced endometrial cancer: results of a single-arm, phase 2 trial. Br J Cancer 108 (5): 1021-6, 2013. [PUBMED Abstract]
- Tsoref D, Welch S, Lau S, et al.: Phase II study of oral ridaforolimus in women with recurrent or metastatic endometrial cancer. Gynecol Oncol 135 (2): 184-9, 2014. [PUBMED Abstract]
- Slomovitz BM, Jiang Y, Yates MS, et al.: Phase II study of everolimus and letrozole in patients with recurrent endometrial carcinoma. J Clin Oncol 33 (8): 930-6, 2015. [PUBMED Abstract]
- Aghajanian C, Sill MW, Darcy KM, et al.: Phase II trial of bevacizumab in recurrent or persistent endometrial cancer: a Gynecologic Oncology Group study. J Clin Oncol 29 (16): 2259-65, 2011. [PUBMED Abstract]
- Alvarez EA, Brady WE, Walker JL, et al.: Phase II trial of combination bevacizumab and temsirolimus in the treatment of recurrent or persistent endometrial carcinoma: a Gynecologic Oncology Group study. Gynecol Oncol 129 (1): 22-7, 2013. [PUBMED Abstract]
- Makker V, Colombo N, Casado Herráez A, et al.: Lenvatinib Plus Pembrolizumab in Previously Treated Advanced Endometrial Cancer: Updated Efficacy and Safety From the Randomized Phase III Study 309/KEYNOTE-775. J Clin Oncol 41 (16): 2904-2910, 2023. [PUBMED Abstract]
- Eskander RN, Sill MW, Beffa L, et al.: Pembrolizumab plus Chemotherapy in Advanced Endometrial Cancer. N Engl J Med 388 (23): 2159-2170, 2023. [PUBMED Abstract]
- Mirza MR, Chase DM, Slomovitz BM, et al.: Dostarlimab for Primary Advanced or Recurrent Endometrial Cancer. N Engl J Med 388 (23): 2145-2158, 2023. [PUBMED Abstract]
- Greven KM, Curran WJ, Whittington R, et al.: Analysis of failure patterns in stage III endometrial carcinoma and therapeutic implications. Int J Radiat Oncol Biol Phys 17 (1): 35-9, 1989. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (02/12/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes hechos a este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este resumen.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de endometrio. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de endometrio son:
- Olga T. Filippova, MD (Lenox Hill Hospital)
- Marina Stasenko, MD (New York University Medical Center)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de endometrio. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/uterino/pro/tratamiento-endometrio-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.