Tratamiento del cáncer de tiroides (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer de tiroides
Hay cuatro tipos principales de cáncer de tiroides:
- Papilar.
- Folicular.
- Medular.
- Anaplásico.
Para el abordaje clínico del paciente, el cáncer de tiroides por lo general se divide en dos categorías:[1]
- Cáncer de tiroides diferenciado, que incluye los tumores bien diferenciados, los tumores pobremente diferenciados y los tumores indiferenciados (papilar, folicular o anaplásico).
- Cáncer de tiroides medular.
Los tumores bien diferenciados (cáncer de tiroides folicular y papilar) son muy tratables y se suelen curar. Los tumores pobremente diferenciados e indiferenciados (cáncer de tiroides anaplásico) son menos frecuentes, de gran malignidad, producen metástasis con rapidez y tienen un pronóstico más precario. El cáncer de tiroides medular es un cáncer neuroendocrino con pronóstico intermedio.
En ocasiones, la glándula tiroidea es el sitio de otros tumores primarios, como sarcomas, linfomas, carcinomas epidermoides y teratomas. Además, es posible que la tiroides sea el sitio de metástasis de otros cánceres; en particular de pulmón, mama y riñón.
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por cáncer de tiroides en los Estados Unidos para 2025:[2]
- Casos nuevos: 44 020.
- Defunciones: 2290.
El cáncer de tiroides afecta con mayor frecuencia a las mujeres que a los hombres y se suele presentar en personas de 25 a 65 años. La incidencia de esta neoplasia maligna ha aumentado durante la última década. El cáncer de tiroides se presenta por lo general como un nódulo frío. Este se detecta como una glándula tiroidea palpable durante un examen físico y se evalúa con gammagrafías con yodo I 131. En esta centellografía se observa un área de la glándula que no absorbe el isótopo. La incidencia general de cáncer en un nódulo frío es del 12 al 15 %, pero es más alta en las personas menores de 40 años y en quienes tienen calcificaciones en la ecografía preoperatoria.[3,4]
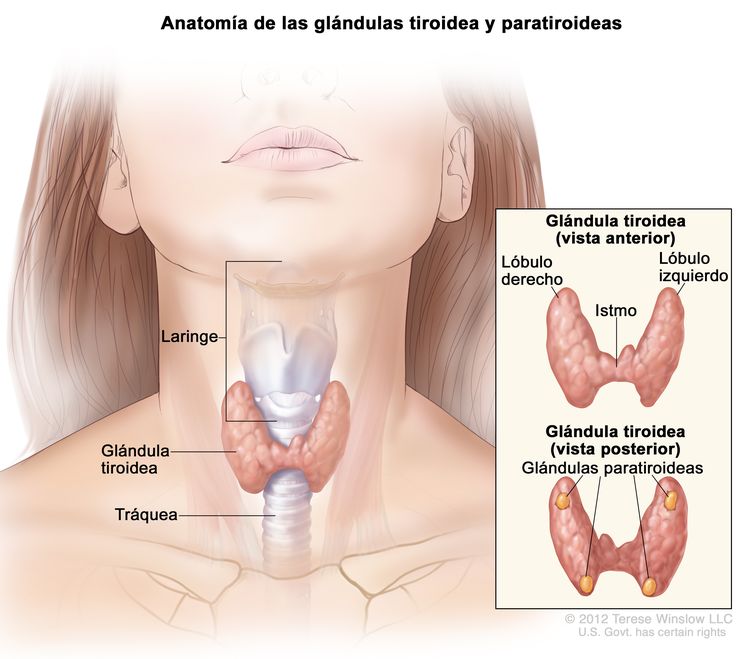
Características anatómicas
El tejido de la glándulas tiroideas rodea la parte superior de la tráquea, justo debajo de los cartílagos que componen la laringe: el tiroides y el cricoides. La glándula tiene un istmo y lóbulos (derecho e izquierdo) que, a menudo, son asimétricos; por lo general hay cuatro glándulas paratiroideas en la parte posterior. Durante la deglución, a veces se siente que la tiroides asciende con la laringe; esto es más común cuando hay un proceso patológico.
Factores de riesgo
Los pacientes que recibieron radioterapia durante la lactancia o la niñez para tratar afecciones benignas de la cabeza y el cuello (como agrandamiento del timo, las amígdalas o las adenoides; o acné) tienen más riesgo de presentar cáncer y otras anomalías de la glándula tiroidea. En este grupo de pacientes, las neoplasias malignas de la glándula tiroidea aparecen apenas 5 años después de la radioterapia o mucho después de esta, tras 20 o más años.[5] También se estableció una relación entre la exposición a la radiación durante una lluvia radiactiva y un riesgo alto de cáncer de tiroides; en especial, en los niños.[6-8]
Otros factores de riesgo de cáncer de tiroides son los siguientes:[9]
Evaluación diagnóstica y estadificación
Es posible que se usen las siguientes pruebas y procedimientos para el diagnóstico y la estadificación del cáncer de tiroides:
- Examen físico y antecedentes.
- Laringoscopia.
- Estudios hormonales de la sangre.
- Estudios bioquímicos de la sangre.
- Ecografía.
- Tomografía computarizada.
- Biopsia por aspiración con aguja fina de la tiroides.
- Extirpación quirúrgica.
Factores pronósticos del cáncer de tiroides bien diferenciado
Parece que la edad es el factor pronóstico individual más importante.[11] El pronóstico del carcinoma diferenciado (papilar o folicular) sin diseminación extracapsular o invasión vascular es mejor para los pacientes menores de 40 años.[11-15]
Los pacientes que se consideran de riesgo bajo de acuerdo con los criterios de riesgo de edad, metástasis, extensión y tamaño son las mujeres menores de 50 años y los hombres menores de 40 años sin indicios de metástasis a distancia. En el grupo de riesgo bajo también se incluyen a los pacientes mayores con tumores papilares primarios que miden menos de 5 cm sin indicios de invasión macroscópica extratiroidea y a los pacientes mayores con cáncer folicular sin invasión capsular o vascular de importancia.[13] En un estudio retrospectivo de 1019 pacientes en el que se usaron estos criterios, se observó que la tasa de supervivencia a 20 años fue del 98 % en los pacientes con enfermedad de riesgo bajo y del 50 % en los pacientes con enfermedad de riesgo alto.[13]
En una serie retrospectiva de 931 pacientes de cáncer de tiroides diferenciado sin tratamiento previo que se sometieron a cirugía, se encontraron los siguientes factores de pronóstico adverso: edad mayor de 45 años, características histológicas foliculares, tumor primario de más de 4 cm (T2–T3), diseminación extratiroidea (T4) y metástasis a distancia.[16,17] Los factores de pronóstico favorable fueron el sexo femenino, la multifocalidad y el compromiso de ganglio linfático regional.[16] No obstante, en otros estudios se observó que el compromiso de ganglio linfático regional no tuvo efecto [18,19] o tuvo un efecto adverso en la supervivencia.[14,15,20]
En otra serie retrospectiva de 1807 pacientes, se encontró que las metástasis a distancia, seguidas por la edad, fueron los factores que permitieron predecir mejor la supervivencia.[21] Se identificó que el límite de edad de 55 años tuvo el mayor valor predictivo para la supervivencia. Por este motivo, el límite de 55 años de edad se sometió a validación internacional multinstitucional para la estratificación del riesgo en el sistema de estadificación del American Joint Committee on Cancer/Union for International Cancer Control (AJCC/UICC) para el cáncer de tiroides bien diferenciado. A partir de este análisis con 9484 pacientes se cambió el límite de edad de 45 a 55 años en la 8.a edición del AJCC Cancer Staging Manual para la estadificación AJCC/UICC del cáncer de tiroides bien diferenciado.[22]
La importancia pronóstica del estado de los ganglios linfáticos es objeto de controversia. Es posible que la biopsia de ganglio linfático centinela ayude a identificar a pacientes con metástasis ocultas que se podrían beneficiar de la disección central del cuello.[23]
La inmunotinción intensa y difusa del factor de crecimiento endotelial vascular en pacientes que tienen cáncer papilar se relacionó con una tasa alta de recidiva local y metástasis a distancia.[24] Una concentración elevada de tiroglobulina sérica tiene una correlación sólida con la recidiva tumoral cuando se halla en pacientes con cáncer de tiroides diferenciado durante las evaluaciones posoperatorias.[25,26] Las concentraciones séricas de tiroglobulina son más sensibles cuando los pacientes tienen hipotiroidismo y concentraciones altas de la hormona estimulante de la tiroides.[27] La expresión del gen supresor de tumores TP53 también se relaciona con un pronóstico adverso para los pacientes con cáncer de tiroides.[28]
Para obtener más información, consultar la sección Características clínicas y pronóstico de la sección Cáncer de tiroides medular y la sección Características clínicas y pronóstico de la sección Cáncer de tiroides anaplásico.
Bibliografía
- LiVolsi VA: Pathology of thyroid disease. In: Falk SA: Thyroid Disease: Endocrinology, Surgery, Nuclear Medicine, and Radiotherapy. Lippincott-Raven, 1997, pp 127-175.
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Tennvall J, Biörklund A, Möller T, et al.: Is the EORTC prognostic index of thyroid cancer valid in differentiated thyroid carcinoma? Retrospective multivariate analysis of differentiated thyroid carcinoma with long follow-up. Cancer 57 (7): 1405-14, 1986. [PUBMED Abstract]
- Khoo ML, Asa SL, Witterick IJ, et al.: Thyroid calcification and its association with thyroid carcinoma. Head Neck 24 (7): 651-5, 2002. [PUBMED Abstract]
- Carling T, Udelsman R: Thyroid tumors. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1457-72.
- Pacini F, Vorontsova T, Molinaro E, et al.: Prevalence of thyroid autoantibodies in children and adolescents from Belarus exposed to the Chernobyl radioactive fallout. Lancet 352 (9130): 763-6, 1998. [PUBMED Abstract]
- Cardis E, Kesminiene A, Ivanov V, et al.: Risk of thyroid cancer after exposure to 131I in childhood. J Natl Cancer Inst 97 (10): 724-32, 2005. [PUBMED Abstract]
- Tronko MD, Howe GR, Bogdanova TI, et al.: A cohort study of thyroid cancer and other thyroid diseases after the chornobyl accident: thyroid cancer in Ukraine detected during first screening. J Natl Cancer Inst 98 (13): 897-903, 2006. [PUBMED Abstract]
- Iribarren C, Haselkorn T, Tekawa IS, et al.: Cohort study of thyroid cancer in a San Francisco Bay area population. Int J Cancer 93 (5): 745-50, 2001. [PUBMED Abstract]
- Salvatore G, Giannini R, Faviana P, et al.: Analysis of BRAF point mutation and RET/PTC rearrangement refines the fine-needle aspiration diagnosis of papillary thyroid carcinoma. J Clin Endocrinol Metab 89 (10): 5175-80, 2004. [PUBMED Abstract]
- Mazzaferri EL: Treating differentiated thyroid carcinoma: where do we draw the line? Mayo Clin Proc 66 (1): 105-11, 1991. [PUBMED Abstract]
- Grant CS, Hay ID, Gough IR, et al.: Local recurrence in papillary thyroid carcinoma: is extent of surgical resection important? Surgery 104 (6): 954-62, 1988. [PUBMED Abstract]
- Sanders LE, Cady B: Differentiated thyroid cancer: reexamination of risk groups and outcome of treatment. Arch Surg 133 (4): 419-25, 1998. [PUBMED Abstract]
- Staunton MD: Thyroid cancer: a multivariate analysis on influence of treatment on long-term survival. Eur J Surg Oncol 20 (6): 613-21, 1994. [PUBMED Abstract]
- Mazzaferri EL, Jhiang SM: Long-term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer. Am J Med 97 (5): 418-28, 1994. [PUBMED Abstract]
- Shah JP, Loree TR, Dharker D, et al.: Prognostic factors in differentiated carcinoma of the thyroid gland. Am J Surg 164 (6): 658-61, 1992. [PUBMED Abstract]
- Andersen PE, Kinsella J, Loree TR, et al.: Differentiated carcinoma of the thyroid with extrathyroidal extension. Am J Surg 170 (5): 467-70, 1995. [PUBMED Abstract]
- Coburn MC, Wanebo HJ: Prognostic factors and management considerations in patients with cervical metastases of thyroid cancer. Am J Surg 164 (6): 671-6, 1992. [PUBMED Abstract]
- Voutilainen PE, Multanen MM, Leppäniemi AK, et al.: Prognosis after lymph node recurrence in papillary thyroid carcinoma depends on age. Thyroid 11 (10): 953-7, 2001. [PUBMED Abstract]
- Sellers M, Beenken S, Blankenship A, et al.: Prognostic significance of cervical lymph node metastases in differentiated thyroid cancer. Am J Surg 164 (6): 578-81, 1992. [PUBMED Abstract]
- Nixon IJ, Kuk D, Wreesmann V, et al.: Defining a Valid Age Cutoff in Staging of Well-Differentiated Thyroid Cancer. Ann Surg Oncol 23 (2): 410-5, 2016. [PUBMED Abstract]
- Nixon IJ, Wang LY, Migliacci JC, et al.: An International Multi-Institutional Validation of Age 55 Years as a Cutoff for Risk Stratification in the AJCC/UICC Staging System for Well-Differentiated Thyroid Cancer. Thyroid 26 (3): 373-80, 2016. [PUBMED Abstract]
- Cunningham DK, Yao KA, Turner RR, et al.: Sentinel lymph node biopsy for papillary thyroid cancer: 12 years of experience at a single institution. Ann Surg Oncol 17 (11): 2970-5, 2010. [PUBMED Abstract]
- Lennard CM, Patel A, Wilson J, et al.: Intensity of vascular endothelial growth factor expression is associated with increased risk of recurrence and decreased disease-free survival in papillary thyroid cancer. Surgery 129 (5): 552-8, 2001. [PUBMED Abstract]
- van Herle AJ, van Herle KA: Thyroglobulin in benign and malignant thyroid disease. In: Falk SA: Thyroid Disease: Endocrinology, Surgery, Nuclear Medicine, and Radiotherapy. Lippincott-Raven, 1997, pp 601-618.
- Ruiz-Garcia J, Ruiz de Almodóvar JM, Olea N, et al.: Thyroglobulin level as a predictive factor of tumoral recurrence in differentiated thyroid cancer. J Nucl Med 32 (3): 395-8, 1991. [PUBMED Abstract]
- Duren M, Siperstein AE, Shen W, et al.: Value of stimulated serum thyroglobulin levels for detecting persistent or recurrent differentiated thyroid cancer in high- and low-risk patients. Surgery 126 (1): 13-9, 1999. [PUBMED Abstract]
- Godballe C, Asschenfeldt P, Jørgensen KE, et al.: Prognostic factors in papillary and follicular thyroid carcinomas: p53 expression is a significant indicator of prognosis. Laryngoscope 108 (2): 243-9, 1998. [PUBMED Abstract]
Clasificación celular del cáncer de tiroides
El tipo celular constituye un determinante importante del pronóstico para el cáncer de tiroides. La tiroides tiene dos tipos de células: foliculares y C parafoliculares. El tratamiento del cáncer de tiroides depende de la célula de origen y de que se mantenga la integridad del tipo celular. Los cuatro tipos principales de cáncer de tiroides se dividen en dos categorías para el abordaje clínico:[1]
Cánceres de tiroides diferenciados (células foliculares).
- Bien diferenciados.
- Pobremente diferenciado.
- Indiferenciado.
- Carcinoma de tiroides anaplásico.
Cánceres de tiroides de células C parafoliculares.
- Carcinoma de tiroides medular.
Otros tipos (que no se derivan de células tiroideas).
- Linfoma.
- Sarcoma.
- Carcinosarcoma.
Bibliografía
- LiVolsi VA: Pathology of thyroid disease. In: Falk SA: Thyroid Disease: Endocrinology, Surgery, Nuclear Medicine, and Radiotherapy. Lippincott-Raven, 1997, pp 127-175.
- Kushchayeva Y, Duh QY, Kebebew E, et al.: Comparison of clinical characteristics at diagnosis and during follow-up in 118 patients with Hurthle cell or follicular thyroid cancer. Am J Surg 195 (4): 457-62, 2008. [PUBMED Abstract]
- Mills SC, Haq M, Smellie WJ, et al.: Hürthle cell carcinoma of the thyroid: Retrospective review of 62 patients treated at the Royal Marsden Hospital between 1946 and 2003. Eur J Surg Oncol 35 (3): 230-4, 2009. [PUBMED Abstract]
Información sobre los estadios del cáncer de tiroides
Definiciones TNM
El American Joint Committee on Cancer designó los estadios mediante la clasificación TNM (tumor, ganglio linfático y metástasis) para definir el cáncer de tiroides.[1,2] Para obtener información sobre las definiciones TNM para los estadios de cada tipo de cáncer de tiroides, consultar las siguientes secciones:
Bibliografía
- Tuttle RM, Morris LF, Haugen BR, et al.: Thyroid--Differentiated and Anaplastic Carcinoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 873-90.
- Rosen Je, Lloyd RV, Brierley JD, et al.: Thyroid--Medullary. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 891-901.
Aspectos generales de las opciones de tratamiento del cáncer de tiroides
Las opciones de tratamiento del cáncer de tiroides se describen en el Cuadro 1.
| Tipo de cáncer de tiroides | Estado de la enfermedad | Opciones de tratamiento | |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; RHE = radioterapia de haz externo; YRA = yodo radiactivo. | |||
| Papilar y folicular | Localizado o regional | Cirugía | |
| –Tiroidectomía total | |||
| –Lobectomía | |||
| Terapia con YRA | |||
| Terapia de inhibición tiroidea | |||
| RHE | |||
| Papilar y folicular | Metastásico | Sensible al yodo: | |
| Terapia con YRA | |||
| Terapia de inhibición tiroidea | |||
| Resistente al yodo: | |||
| Terapia de inhibición tiroidea | |||
| Terapia dirigida | |||
| Cirugía | |||
| RHE | |||
| Quimioterapia (en evaluación clínica) | |||
| Ensayos clínicos | |||
| Cáncer de tiroides papilar y folicular recidivante | Cirugía y terapia con YRA posoperatoria, o sin esta | ||
| Terapia dirigida | |||
| RHE | |||
| Quimioterapia | |||
| Ensayos clínicos | |||
| Cáncer de tiroides medular | Enfermedad localizada | Tiroidectomía total | |
| RHE | |||
| Enfermedad localmente avanzada y metastásica | Terapia dirigida | ||
| Quimioterapia paliativa | |||
| Cáncer de tiroides anaplásico | Cirugía | ||
| RHE | |||
| Terapia sistémica | |||
Cáncer de tiroides papilar y folicular
Características clínicas y pronóstico
Las características clínicas y el pronóstico de los tumores de tiroides bien diferenciados varían según el estadio.
La mayoría de los cánceres papilares tienen algunos elementos foliculares. Es posible que estos elementos foliculares sean más numerosos que las formaciones papilares, pero no cambian el pronóstico.
Los adenomas foliculares, que se caracterizan porque no invaden los tejidos tiroideos circundantes a través de la cápsula, se deben diferenciar del carcinoma de tiroides folicular. Aunque el cáncer folicular tiene un buen pronóstico, este es menos favorable que el del carcinoma papilar. La supervivencia a 10 años es mejor para los pacientes con carcinoma folicular sin invasión vascular que para los pacientes con invasión vascular.
Los carcinomas papilares metastatizan con más frecuencia a los ganglios linfáticos regionales que a sitios distantes. Los carcinomas foliculares por lo general invaden los vasos sanguíneos y metastatizan por vía hematógena a los pulmones y los huesos en vez de diseminarse por el sistema linfático. Cuando hay metástasis, la terapia con yodo radiactivo es eficaz al comienzo, pero el pronóstico empeora a medida que sobreviene la resistencia al yodo radiactivo.
La estadificación y el pronóstico del cáncer de tiroides papilar y folicular se determinan según la edad del paciente y el sitio de la enfermedad. Las características clínicas y el pronóstico de los pacientes con cáncer de tiroides papilar son las siguientes:
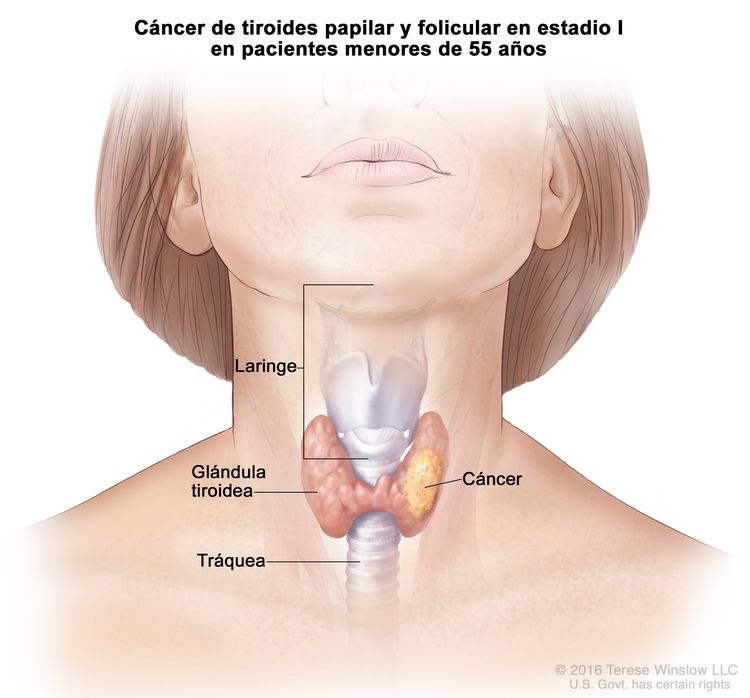
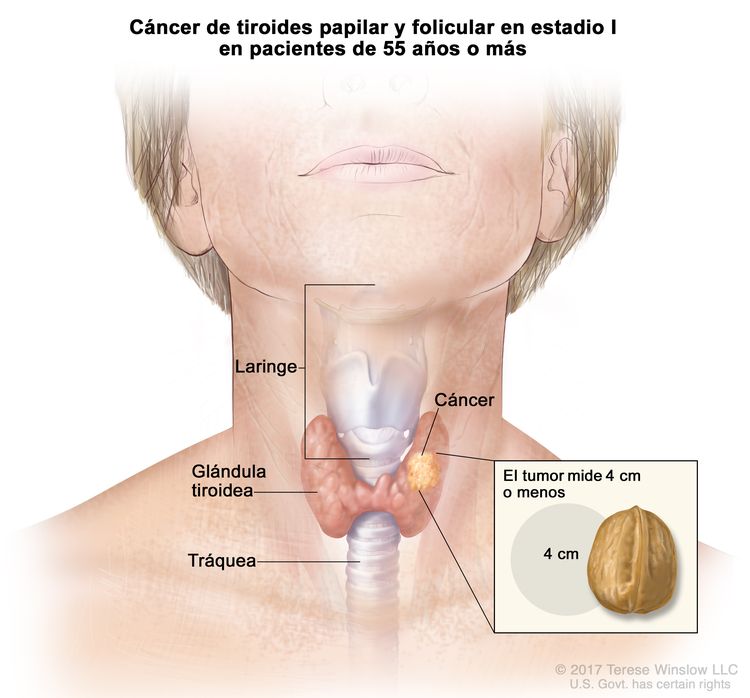
- El cáncer de tiroides papilar o folicular en estadio I está localizado en la glándula tiroidea de pacientes de 55 años o más. En los pacientes menores de 55 años, es posible que el cáncer se haya diseminado a los tejidos y ganglios linfáticos cercanos, pero no a otras partes del cuerpo. En casi el 50 % de los casos, el cáncer de tiroides papilar es multifocal.
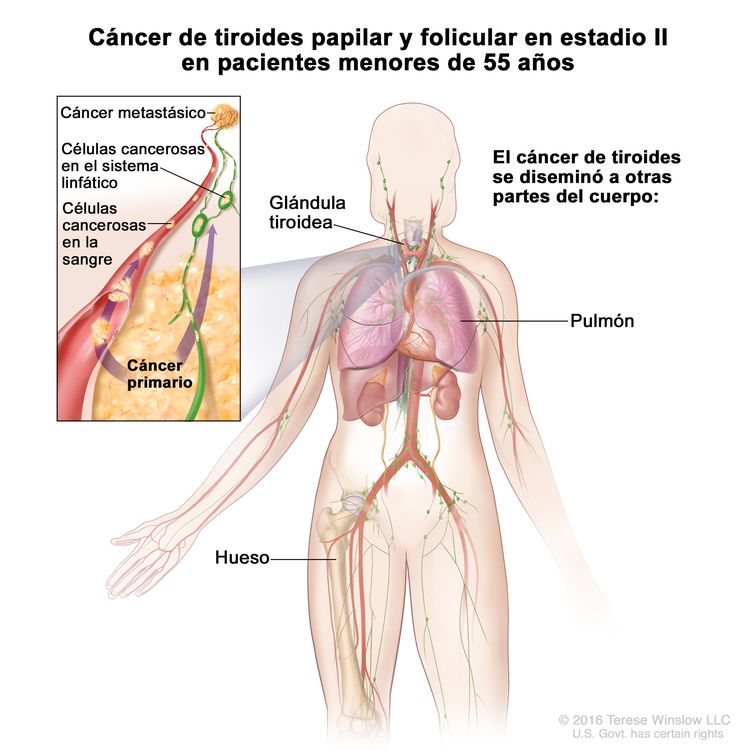
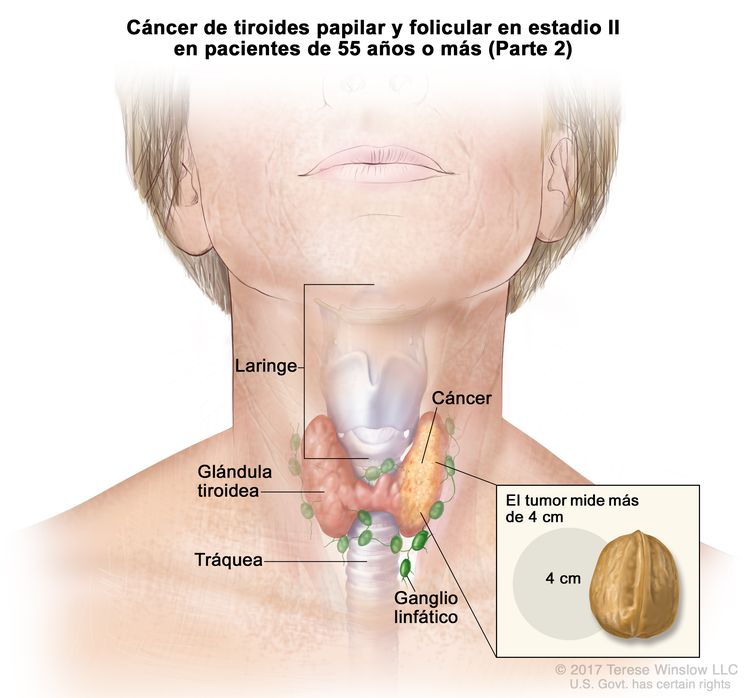
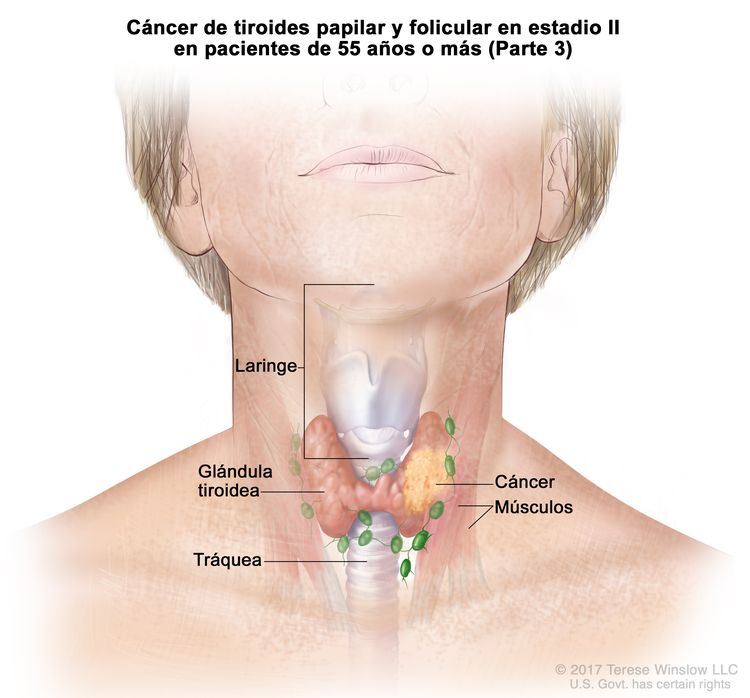
- El cáncer de tiroides papilar o folicular en estadio II se define según una de las siguientes descripciones: 1) pacientes menores de 55 años con un tumor que se diseminó desde la tiroides hasta partes distantes del cuerpo, o 2) pacientes de 55 años o más con un tumor confinado a la tiroides, o que presenta invasión limitada fuera de la tiroides, con o sin compromiso de ganglio linfático, pero sin diseminación a partes distantes del cuerpo. El estadio II es el estadio más avanzado posible para pacientes menores de 55 años.
- El cáncer de tiroides papilar o folicular en estadio III solo se presenta en pacientes de 55 años o más. Se encuentra extensión del tumor tiroideo en los tejidos blandos circundantes, la laringe, la tráquea, el esófago o el nervio laríngeo recurrente. A veces hay compromiso de ganglio linfático, pero no hay diseminación a otras partes distantes del cuerpo.
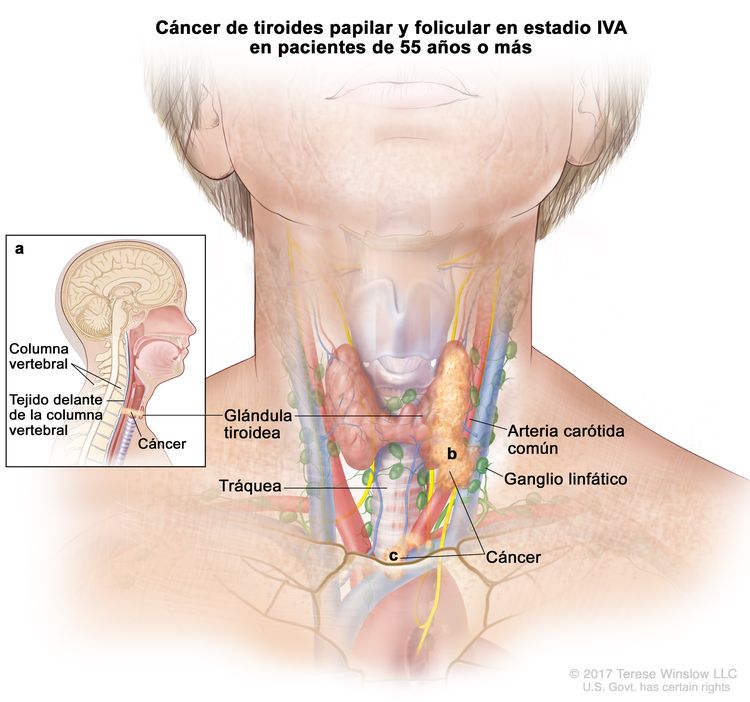
- El cáncer de tiroides papilar o folicular en estadio IVA solo se utiliza para pacientes de 55 años o más. Se encuentra extensión del tumor tiroideo en los tejidos blandos circundantes, incluso la fascia prevertebral; o hay atrapamiento de la arteria carótida o de vasos mediastínicos. A veces hay compromiso de ganglio linfático, pero no hay diseminación a otras partes distantes del cuerpo.
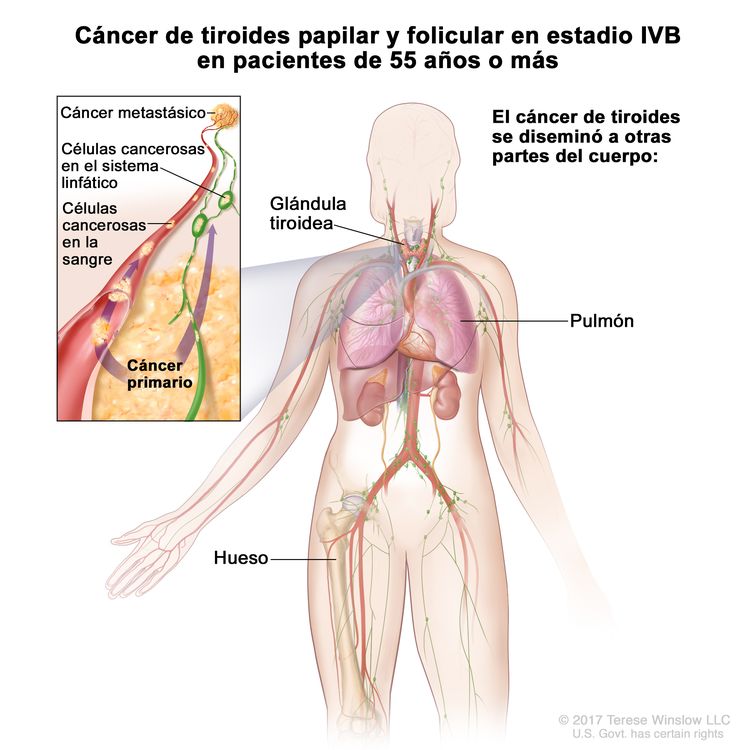
- El cáncer de tiroides papilar o folicular en estadio IVB solo se utiliza para pacientes de 55 años o más. Se define por la diseminación a otras partes distantes del cuerpo. Los pulmones y los huesos son los sitios de diseminación distante más frecuente.
El carcinoma de células de Hürthle es una variante de carcinoma folicular con un pronóstico similar y se trata de la misma forma que un estadio equivalente de carcinoma folicular de células no Hürthle.[1]
Información sobre los estadios del cáncer de tiroides papilar y folicular
| Estadio | TbNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Thyroid--Differentiated and Anaplastic Carcinoma. En: Amin, MB, Edge Sb, Greene FL et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 873–90. | |||
| bTodas las categorías se pueden subdividir en: (s) tumor solitario y (m) tumor multifocal (el tumor más grande determina la clasificación). | |||
| Edad en el momento del diagnóstico <55 años: | |||
| I | Cualquier T, cualquier N, M0 | TX = tumor primario no evaluable. |
 |
| T0 = sin indicios de tumor primario. | |||
| T1 = tumor que mide ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1a = tumor que mide ≤1 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1b = tumor que mide >1 cm, pero menos ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión y se limita a la tiroides. | |||
| T3 = tumor que mide >4 cm y se limita a la tiroides, o diseminación extratiroidea macroscópica con invasión solo de los músculos infrahioideos. | |||
| –T3a = tumor que mide >4 cm y se limita a la tiroides. | |||
| –T3b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión solo de los músculos infrahioideos (músculos esternohioideo, esternotiroideo, tirohioideo u omohioideo). | |||
| T4 = incluye la diseminación extratiroidea macroscópica más allá de los músculos infrahioideos. | |||
| –T4a = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión de los tejidos blandos subcutáneos, la laringe, la tráquea, el esófago o el nervio laríngeo recurrente. | |||
| –T4b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión de la fascia prevertebral, o atrapamiento de la arteria carótida o los vasos mediastínicos. | |||
| NX = ganglios linfáticos regionales no evaluables. | |||
| N0 = sin indicios de metástasis en ganglios linfáticos locorregionales. | |||
| –N0a = uno o más ganglios linfáticos benignos según confirmación citológica o histológica. | |||
| –N0b = sin indicios radiológicos o clínicos de metástasis en ganglios linfáticos locorregionales. | |||
| N1 = metástasis en ganglios linfáticos regionales. | |||
| –N1a = metástasis en ganglios linfáticos de los grupos VI o VII (pretraqueales, paratraqueales o prelaríngeos/délficos o mediastínicos superiores). La enfermedad puede ser unilateral o bilateral. | |||
| –N1b = metástasis en ganglios linfáticos cervicales unilaterales, bilaterales o contralaterales (grupos I, II, III, IV o V) o ganglios linfáticos retrofaríngeos. | |||
| M0 = sin metástasis a distancia. | |||
| Edad en el momento del diagnóstico ≥55 años: | |||
| I | T1, N0/NX, M0 | T1 = tumor que mide ≤2 cm en su mayor dimensión y se limita a la tiroides. |
 |
| N0 = sin indicios de metástasis en ganglios linfáticos locorregionales. | |||
| NX = ganglios linfáticos regionales no evaluables. | |||
| M0 = sin metástasis a distancia. | |||
| T2, N0/NX, M0 | T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión y se limita a la tiroides. | ||
| N0 = sin indicios de metástasis en ganglios linfáticos locorregionales. | |||
| NX = ganglios linfáticos regionales no evaluables. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TbNM | Descripción | Imagen |
|---|---|---|---|
| Edad en el momento del diagnóstico <55 años: | |||
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Thyroid--Differentiated and Anaplastic Carcinoma. En: Amin, MB, Edge Sb, Greene FL et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 873–90. | |||
| bTodas las categorías se pueden subdividir en: (s) tumor solitario y (m) tumor multifocal (el tumor más grande determina la clasificación). | |||
| II | Cualquier T, cualquier N, M1 | Cualquier T = consultar las descripciones en el Cuadro 2. |
 |
| Cualquier N = consultar las descripciones en el Cuadro 2. | |||
| Edad en el momento del diagnóstico ≥55 años: | |||
| II | T1, N1, M0 | T1 = tumor que mide ≤2 cm en su mayor dimensión y se limita a la tiroides. |
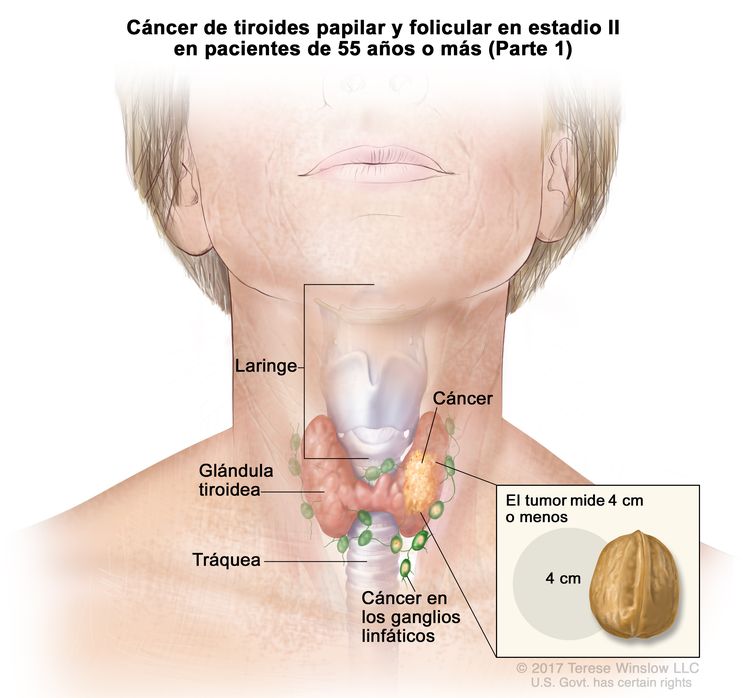   |
| –T1a = tumor que mide ≤1 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1b = tumor que mide >1 cm, pero menos ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| N1 = metástasis en ganglios linfáticos regionales. | |||
| –N1a = metástasis en ganglios linfáticos de los grupos VI o VII (pretraqueales, paratraqueales o prelaríngeos/délficos, o mediastínicos superiores). La enfermedad puede ser unilateral o bilateral. | |||
| –N1b = metástasis en ganglios linfáticos cervicales unilaterales, bilaterales o contralaterales (grupos I, II, III, IV o V) o ganglios linfáticos retrofaríngeos. | |||
| M0 = sin metástasis a distancia. | |||
| T2, N1, M0 | T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión y se limita a la tiroides. | ||
| N1 = metástasis en ganglios linfáticos regionales. | |||
| –N1a = metástasis en ganglios linfáticos de los grupos VI o VII (pretraqueales, paratraqueales o prelaríngeos/délficos, o mediastínicos superiores). La enfermedad puede ser unilateral o bilateral. | |||
| –N1b = metástasis en ganglios linfáticos cervicales unilaterales, bilaterales o contralaterales (grupos I, II, III, IV o V) o ganglios linfáticos retrofaríngeos. | |||
| M0 = sin metástasis a distancia. | |||
| T3a/T3b, cualquier N, M0 | –T3a = tumor que mide >4 cm y se limita a la tiroides. | ||
| –T3b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión solo de los músculos infrahioideos (músculos esternohioideo, esternotiroideo, tirohioideo u omohioideo). | |||
| Cualquier N = consultar las descripciones en el Cuadro 2. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TbNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Thyroid--Differentiated and Anaplastic Carcinoma. En: Amin, MB, Edge Sb, Greene FL et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 873–90. | |||
| bTodas las categorías se pueden subdividir en: (s) tumor solitario y (m) tumor multifocal (el tumor más grande determina la clasificación). | |||
| Edad en el momento del diagnóstico ≥55 años: | |||
| III | T4a, cualquier N, M0 | –T4a = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión de los tejidos blandos subcutáneos, la laringe, la tráquea, el esófago o el nervio laríngeo recurrente. |
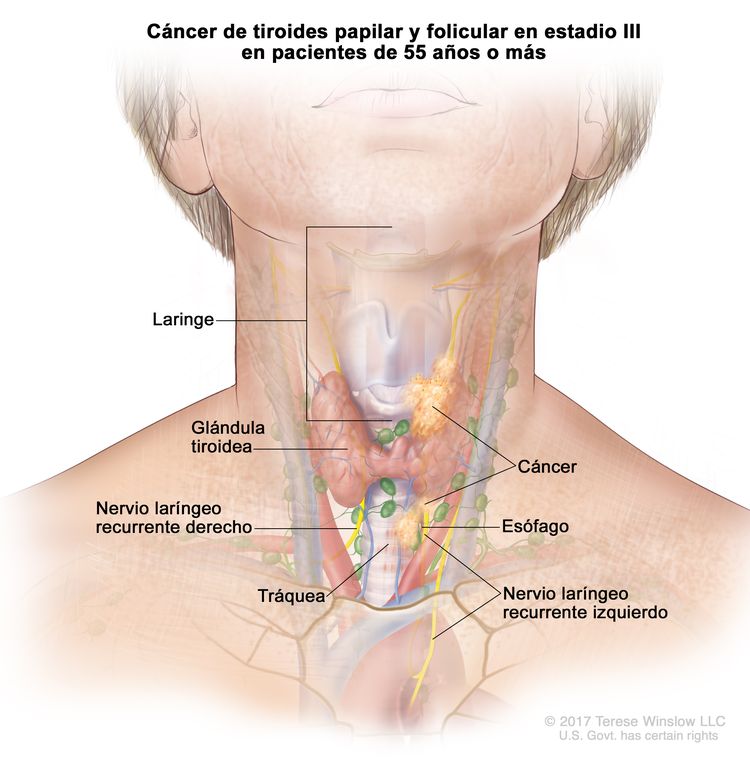 |
| Cualquier N = consultar las descripciones en el Cuadro 2. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TbNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Thyroid--Differentiated and Anaplastic Carcinoma. En: Amin, MB, Edge Sb, Greene FL et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 873–90. | |||
| bTodas las categorías se pueden subdividir en: (s) tumor solitario y (m) tumor multifocal (el tumor más grande determina la clasificación). | |||
| Edad en el momento del diagnóstico ≥55 años: | |||
| IVA | T4, cualquier N, M0 | –T4b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión de la fascia prevertebral, o atrapamiento de la arteria carótida o los vasos mediastínicos. |
 |
| Cualquier N = consultar las descripciones en el Cuadro 2. | |||
| M0 = sin metástasis a distancia. | |||
| IVB | Cualquier T, cualquier N, M1 | Cualquier T = consultar las descripciones en el Cuadro 2. |
 |
| Cualquier N = consultar las descripciones en el Cuadro 2. | |||
| M1 = metástasis a distancia. | |||
| Estadio | TbNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Thyroid--Differentiated and Anaplastic Carcinoma. En: Amin, MB, Edge Sb, Greene FL et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 873–90. | |||
| bTodas las categorías se pueden subdividir en: (s) tumor solitario y (m) tumor multifocal (el tumor más grande determina la clasificación). | |||
| IVA | T1–T3a, N0/NX, M0 | T1 = tumor que mide ≤2 cm en su mayor dimensión y se limita a la tiroides. |
 |
| –T1a = tumor que mide ≤1 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1b = tumor que mide >1 cm, pero menos ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión y se limita a la tiroides. | |||
| T3 = tumor que mide >4 cm y se limita a la tiroides, o diseminación extratiroidea macroscópica con invasión solo de los músculos infrahioideos. | |||
| –T3a = tumor que mide >4 cm y se limita a la tiroides. | |||
| N0 = sin indicios de metástasis en ganglios linfáticos locorregionales. | |||
| –N0a = uno o más ganglios linfáticos benignos según confirmación citológica o histológica. | |||
| –N0b = sin indicios radiológicos o clínicos de metástasis en ganglios linfáticos locorregionales. | |||
| NX = ganglios linfáticos regionales no evaluables. | |||
| M0 = sin metástasis a distancia. | |||
| IVB | T1–T3a, N1, M0 | T1 = tumor que mide ≤2 cm en su mayor dimensión y se limita a la tiroides. |
 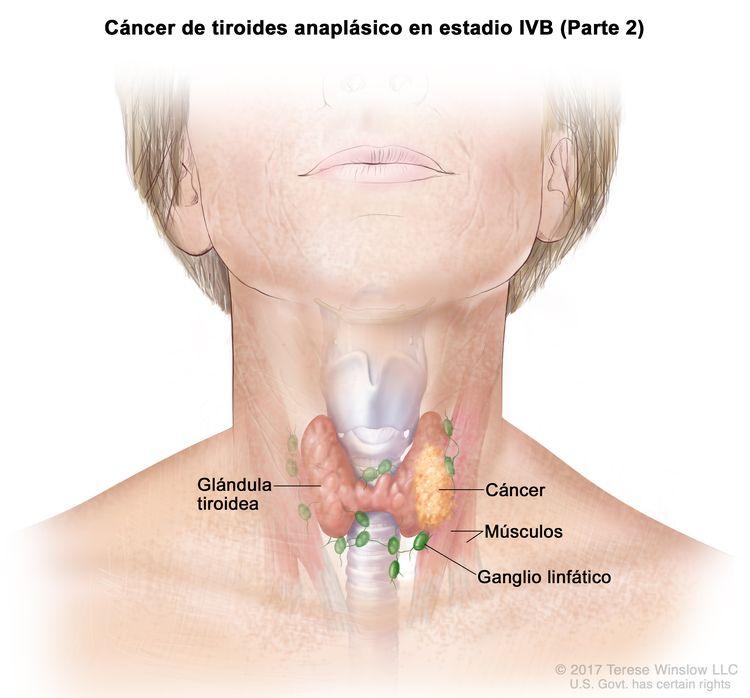  |
| –T1a = tumor que mide ≤1 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1b = tumor que mide >1 cm, pero menos ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión y se limita a la tiroides. | |||
| T3 = tumor que mide >4 cm y se limita a la tiroides, o diseminación extratiroidea macroscópica con invasión solo de los músculos infrahioideos. | |||
| –T3a = tumor que mide >4 cm y se limita a la tiroides. | |||
| N1 = metástasis en ganglios linfáticos regionales. | |||
| –N1a = metástasis en ganglios linfáticos de los grupos VI o VII (pretraqueales, paratraqueales o prelaríngeos/délficos o mediastínicos superiores). La enfermedad puede ser unilateral o bilateral. | |||
| –N1b = metástasis en ganglios linfáticos cervicales unilaterales, bilaterales o contralaterales (grupos I, II, III, IV o V) o ganglios linfáticos retrofaríngeos. | |||
| M0 = sin metástasis a distancia. | |||
| T3b, cualquier N, M0 | –T3b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión solo de los músculos infrahioideos (músculos esternohioideo, esternotiroideo, tirohioideo u omohioideo). | ||
| Cualquier N = consultar las descripciones en el Cuadro 2. | |||
| M0 = sin metástasis a distancia. | |||
| T4, cualquier N, M0 | T4 = incluye la diseminación extratiroidea macroscópica más allá de los músculos infrahioideos. | ||
| –T4a = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión de los tejidos blandos subcutáneos, la laringe, la tráquea, el esófago o el nervio laríngeo recurrente. | |||
| –T4b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión de la fascia prevertebral, o atrapamiento de la arteria carótida o los vasos mediastínicos. | |||
| Cualquier N = consultar las descripciones en el Cuadro 2. | |||
| M0 = sin metástasis a distancia. | |||
| IVC | Cualquier T, cualquier N, M1 | Cualquier T = consultar las descripciones en el Cuadro 2. |
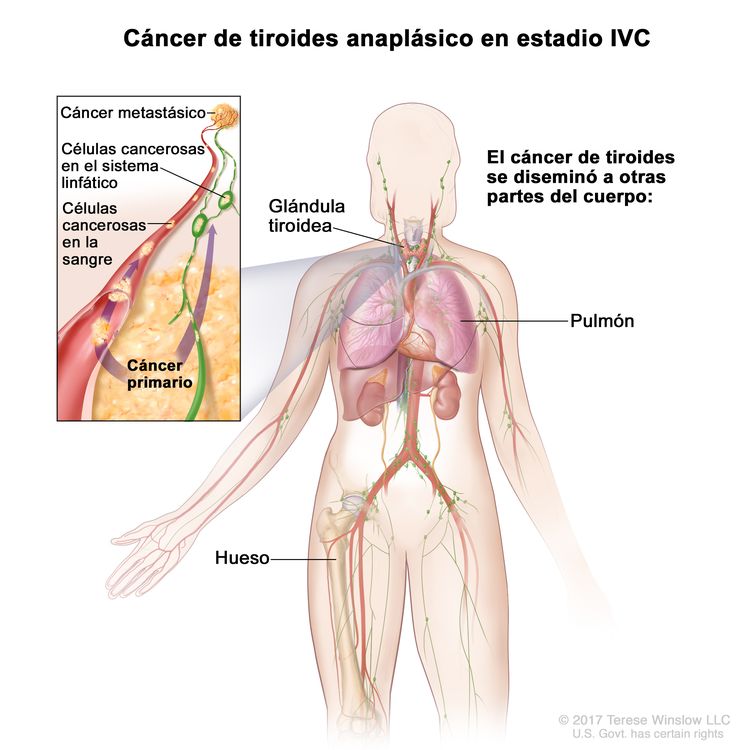 |
| Cualquier N = consultar las descripciones en el Cuadro 2. | |||
| M1 = metástasis a distancia. | |||
Opciones de tratamiento del cáncer de tiroides papilar y folicular
Cáncer de tiroides papilar y folicular localizado o regional
La cirugía es el tratamiento de elección para todas las lesiones primarias. Las opciones quirúrgicas incluyen tiroidectomía total y lobectomía. La elección del procedimiento depende sobre todo de la edad del paciente y el tamaño del nódulo. Cuando se comparan los dos procedimientos, las tasas de supervivencia de los pacientes con enfermedad en estadio temprano son similares; sin embargo, las tasas de complicaciones quirúrgicas y de recidivas locales son diferentes.[2-8]
Opciones de tratamiento del cáncer de tiroides papilar y folicular localizado o regional
Las opciones de tratamiento del cáncer de tiroides papilar y folicular localizado o regional son las siguientes:
Cirugía
El objetivo de la cirugía es extirpar por completo el tumor primario; además de reducir al mínimo la morbilidad relacionada con el tratamiento y orientar la terapia posoperatoria con YRA. La meta de esta terapia es destruir el tejido tiroideo residual para mejorar la especificidad de las pruebas de tiroglobulina que permiten detectar la enfermedad persistente mediante el seguimiento con gammagrafía corporal total. La extirpación de todo el tejido tiroideo normal es un objetivo quirúrgico importante para los pacientes que reciben YRA. Además, para lograr una vigilancia exacta a largo plazo se necesita la tiroidectomía total o casi total porque el tejido tiroideo residual afecta la gammagrafía corporal total con YRA y la medición de la tiroglobulina sérica. Este abordaje facilita el seguimiento con gammagrafía tiroidea.
Tiroidectomía total
La tiroidectomía total a menudo se usa por la incidencia alta de compromiso multifocal en ambos lóbulos glandulares y por la posibilidad de que cualquier tumor residual sufra desdiferenciación hacia el tipo de células anaplásicas.
Evidencia (tiroidectomía total):
- En un análisis del registro de la National Cancer Center Data Base (NCDB) se identificaron 52 173 pacientes sometidos a cirugía para un cáncer papilar de tiroides. De estos, 43 227 (82,9 %) pacientes se sometieron a tiroidectomía total y 8946 (17,1 %) se sometieron a lobectomía.[9][Nivel de evidencia C1]
- Para los tumores de cáncer de tiroides papilar que midieron menos de 1 cm, la diseminación de la cirugía no afectó la recidiva (P = 0,24) ni la supervivencia (P = 0,83).
- Para los tumores que midieron 1 cm o más, la lobectomía se vinculó con un riesgo más alto de recidiva (P = 0,04) y muerte (P = 0,009).
- Con el fin de disminuir el efecto de los tumores más grandes, se examinaron por separado las lesiones de 1 a 2 cm. La lobectomía derivó en un riesgo más alto de recidiva (P = 0,04) y muerte (P = 0,04).
- La tiroidectomía total, en comparación con la lobectomía, produjo disminución de las tasas de recidiva y mejoría de la supervivencia en los pacientes de cáncer de tiroides papilar con tumores de 1 cm o más grandes.
- En un estudio de pautas de atención en el que se usaron datos de 1985 a 2003 del registro NCDB, 57 243 pacientes de cáncer de tiroides papilar con tumores de 1 cm o más grandes se sometieron a tiroidectomía total o lobectomía. Se examinaron las tendencias durante más de dos decenios de la extensión quirúrgica en los pacientes con cáncer de tiroides papilar. Se usó regresión logística para identificar los factores que predicen el empleo de tiroidectomía total en comparación con una lobectomía.[10][Nivel de evidencia C1]
- La tiroidectomía total aumentó del 70,8 % en 1985 al 90,4 % en 2003 (P < 0,0001).
- La probabilidad de someterse a una tiroidectomía total fue más alta para los pacientes tratados en establecimientos médicos o centros académicos con un volumen alto de pacientes, en comparación con los pacientes examinados en establecimientos médicos u hospitales comunitarios con un volumen más bajo de pacientes (P < 0,0001).
Lobectomía
Es posible que la lobectomía tiroidea sola sea un tratamiento suficiente para los carcinomas papilares intratiroideos unifocales pequeños (<1 cm) de riesgo bajo en pacientes que no hayan recibido irradiación dirigida a la cabeza y el cuello ni tengan compromiso clínico debido a metástasis ganglionares en el cuello. Este procedimiento se relaciona con una incidencia más baja de complicaciones, pero entre el 5 % y el 10 % de los pacientes presentará recidiva en la tiroides después de la lobectomía.[11]
En el momento de la cirugía, se realiza una biopsia de los ganglios linfáticos regionales anormales. Los ganglios linfáticos que se sabe que están comprometidos se extirpan durante la cirugía inicial, pero es posible extirpar los ganglios de forma selectiva y, por lo general, no se necesita una disección radical del cuello. Esto disminuye la tasa de recidiva, aunque no se ha demostrado que mejore la supervivencia. El cáncer de tiroides folicular suele presentar metástasis en los pulmones y los huesos. Cuando hay un lóbulo residual, se altera la posibilidad de usar terapia ablativa con yodo I 131 porque el residuo de tejido tiroideo normal absorberá el yodo radiactivo de manera preferencial en comparación con el tumor.
Terapia con yodo radiactivo
En estudios se observó que un curso posoperatorio con dosis terapéuticas (ablativas) de yodo radiactivo 131I disminuye la tasa de recidiva en los pacientes con carcinomas papilares y foliculares de riesgo alto.[5] Es posible administrar YRA además de hormona tiroidea exógena, pero esto no es lo habitual.[12] La terapia con YRA es óptima después de la tiroidectomía total con mínimo residuo tiroideo. Cuando hay residuos tiroideos grandes, no es posible obtener una concentración de tiroglobulina baja, lo que aumenta la probabilidad de que se necesiten múltiples dosis de YRA.
La determinación de usar YRA para la ablación del residuo tiroideo se sustenta en características de riesgo patológicas como las siguientes:
- Tamaño del tumor primario.
- Presencia de invasión linfovascular.
- Invasión capsular.
- Cantidad de ganglios linfáticos afectados.
Es posible administrar YRA con uno de dos métodos de estimulación de la hormona estimulante de la tiroides (TSH/tirotropina):
- Interrupción de la hormona tiroidea.
- Administración de tirotropina recombinante humana (rhTSH).
La administración de rhTSH mantiene la calidad de vida y reduce la dosis de radiación que recibe el cuerpo en comparación con la interrupción de la hormona tiroidea.[13] Durante la presentación inicial, los pacientes con microcarcinomas papilares en la tiroides (tumores <10 mm), que se consideran de riesgo muy bajo, tienen un pronóstico excelente cuando se someten a tratamiento quirúrgico. No se anticipa que la administración de terapia adicional con 131I mejore el pronóstico.[14]
No resulta clara la función del YRA para los pacientes de riesgo bajo porque no se han logrado demostrar beneficios en la supervivencia sin enfermedad (SSE) ni la supervivencia general (SG).
Evidencia (cirugía con o sin YRA):
- En un estudio se analizó a 1298 pacientes con enfermedad de riesgo bajo del French Thyroid Cancer Registry.[15] Los participantes se identificaron como pacientes de cáncer folicular o papilar de riesgo bajo según la definición de los criterios de la American Thyroid Association y la European Thyroid Association que se presentan a continuación:
- Resección tumoral completa.
- Tumores multifocales que miden 1 cm o menos y están confinados a la tiroides.
- Tumores que miden más de 1 cm, pero no más de 4 cm y están confinados a la tiroides.
- Sin compromiso de ganglio linfático o enfermedad metastásica a distancia.
De los 1298 pacientes, 911 recibieron YRA después de la cirugía y 387 no recibieron esta terapia después de la cirugía. El periodo de seguimiento fue de 10,3 años.
- En un análisis multivariante, no se encontraron diferencias en la SG (P = 0,243) o la SSE (P = 0,2659) de acuerdo con el uso del YRA.[15]
Las complicaciones a largo plazo de emplear YRA tipo 131I son las siguientes:
- Segundas neoplasias malignas.
- Sialoadenitis.
- Disfunción de las glándulas lagrimales y salivales.
Se han explorado otra opciones para pacientes con cáncer de tiroides de riesgo bajo. Estas opciones incluyen la reducción de la cantidad de YRA por dosis y administrar YRA combinado con inyecciones de rhTSH.
Evidencia (interrupción de la hormona tiroidea o uso de rhTSH con 131I):
- En un estudio aleatorizado de fase III de ausencia de inferioridad se incluyeron pacientes con cáncer de tiroides de riesgo bajo. En el estudio se compararon dos métodos de estimulación de tirotropina (interrupción de la hormona tiroidea o uso de rhTSH) y dos dosis de 131I (1,1 GBq [30 mCi] y 3,7 GBq [100 mCi]) mediante un diseño factorial de 2 × 2.[16][Nivel de evidencia C1]
- Las tasas de ablación tiroidea fueron equivalentes para las dosis altas y bajas de 131I entre los 6 y 10 meses posteriores a la administración de 131I.
- Se inscribieron pacientes con estadio T más avanzado (T1–T3, N0–1) sometidos a tiroidectomía subtotal y con una tasa de ablación general más baja, del 85 %.
- En otro estudio aleatorizado de fase III de ausencia de inferioridad de pacientes con cáncer de tiroides de riesgo bajo se compararon dos métodos de estimulación de tirotropina (interrupción de la hormona tiroidea o uso de rhTSH) y dos dosis de 131I (1,1 GBq [30 mCi] y 3,7 GBq [100 mCi]) mediante un diseño factorial de 2 × 2. Los criterios de inclusión delimitaron una cohorte homogénea de riesgo bajo. Todos los pacientes se sometieron a tiroidectomía total y presentaban estadio patológico TNM pT1 (≤1 cm) y N1 o NX, pT1 (>1–2 cm), además de cualquier estadio N, o pT2, N0 sin diseminación a la cápsula tiroidea o metástasis a distancia.[17][Nivel de evidencia C1]
- Las tasas de ablación tiroidea fueron equivalentes para las dosis altas y bajas de 131I entre los 6 y 10 meses posteriores a la administración de 131I.
- La tasa de ablación tiroidea completa en este estudio fue del 92 %.
- Los pacientes que interrumpieron la hormona tiroidea presentaron más síntomas de hipotiroidismo relacionados con deterioro de la calidad de vida que el grupo de rhTSH.
En ninguno de los estudios se evaluó el efecto de dosis bajas de YRA en las recidivas a largo plazo o la supervivencia. En los estudios tampoco se abordó si es posible omitir el YRA de manera inocua en grupos específicos de riesgo bajo.
Terapia de inhibición tiroidea
Después de la cirugía tiroidea, todos los pacientes, excepto los sometidos a lobectomías, necesitan terapia de reemplazo con hormona tiroidea. Los pacientes que se someten a tiroidectomía reciben de rutina dosis supraterapéuticas de hormona tiroidea con el fin de inhibir la TSH. El grado recomendado de inhibición de la TSH depende del riesgo de recidiva y las comorbilidades del paciente. En estudios se indicó que la inhibición de la TSH mejora la supervivencia sin progresión (SSP), pero no hay evidencia definitiva de que mejore la SG.[18,19]
Radioterapia de haz externo
Por lo general, la RHE se reserva para el tratamiento paliativo del cáncer de tiroides papilar o folicular irresecable o metastásico. En algunos casos, quizás sea apropiado administrar la RHE en el entorno adyuvante si se sospecha o se confirmó una enfermedad residual microscópica que se sospecha o se confirmó que es resistente a la terapia con YRA. No hay ensayos aleatorizados que orienten la selección de los pacientes que quizás se beneficien del tratamiento con RHE. La decisión de usar RHE se justifica en datos retrospectivos y juicio clínico.[20]
Cáncer de tiroides papilar y folicular metastásico
Todavía se recomienda la tiroidectomía total como tratamiento inicial para el cáncer de tiroides papilar y folicular metastásico. El YRA es el segundo tratamiento que se administra para destruir el tejido tiroideo residual y tratar la enfermedad metastásica. Si el paciente no se somete a una tiroidectomía total, entonces el YRA no es una opción de tratamiento. Los sitios más comunes de metástasis a distancia son los pulmones y los huesos. El tratamiento de las metástasis a distancia por lo general no es curativo, pero es posible que produzca un efecto paliativo importante. Las pruebas genómicas para identificar variantes accionables como las fusiones génicas de RET y NTRK se deben considerar para los pacientes con enfermedad progresiva avanzada. Las opciones de tratamiento del cáncer de tiroides papilar y folicular en estadio IV metastásico sensible al yodo y resistente al yodo se describen a continuación.
Opciones de tratamiento del cáncer de tiroides sensible al yodo
Las opciones de tratamiento del cáncer de tiroides sensible al yodo son las siguientes:
- Terapia con YRA: las metástasis que absorben este isótopo se pueden destruir con dosis terapéuticas de 131I.
- Terapia de inhibición tiroidea.
Opciones de tratamiento del cáncer de tiroides resistente al yodo
Las opciones de tratamiento del cáncer de tiroides resistente al yodo son las siguientes:
- Terapia de inhibición tiroidea.
- Terapia dirigida.
- Cirugía.
- Radioterapia de haz externo (RHE).
- Quimioterapia (en evaluación clínica).
- Ensayos clínicos.
Terapia de inhibición tiroidea
La inhibición de la TSH con tiroxina es eficaz para muchas de las lesiones que no son sensibles al 131I.
Terapia dirigida
Inhibidores de tirosina–cinasas
Sorafenib
El sorafenib es un inhibidor de múltiples tirosina–cinasas que se administra por vía oral.
Evidencia (sorafenib):
- En un estudio de aleatorizado de fase III, con enmascaramiento doble y controlado con placebo (DECISION [NCT00984282]) se evaluó la actividad del sorafenib en pacientes con cáncer de tiroides diferenciado y progresivo resistente a la terapia con yodo.[21] En este ensayo se incluyeron 417 pacientes con cáncer de tiroides localmente avanzado o metastásico resistente a la terapia con YRA en los que la enfermedad había progresado durante los 14 meses previos. Los pacientes se asignaron al azar a recibir sorafenib (400 mg 2 veces por día) o placebo. Estos pacientes tenían tumores papilares, foliculares (incluso de células de Hürthle), pobremente diferenciados y no anaplásicos, definidos como tumores más que bien diferenciados o tumores bien diferenciados que se volvieron resistentes a la terapia con yodo radiactivo. Se excluyó a los pacientes que habían recibido quimioterapia, talidomida o terapia dirigida.[21][Nivel de evidencia B1]
- La mediana de SSP fue de 10,8 en el grupo de sorafenib y de 5,8 meses en el grupo de placebo (cociente de riesgos instantáneos [CRI], 0,59; intervalo de confianza [IC] 95 %, 0,45–0,76; P < 0,0001).
- La SG no mejoró de manera significativa (CRI, 0,80; IC 95 %, 0,54–1,19; P unilateral = 0,14), pero la mediana de SG no se había alcanzado en el momento límite para los datos del análisis primario y se permitió el cruce entre grupos.
- La tasa de respuesta objetiva (todas respuestas parciales) fue del 12,2 % en el grupo de sorafenib y del 0,5 % en el grupo de placebo.
- La mediana de tiempo transcurrido hasta la progresión fue de 11,1 meses en el grupo de sorafenib y de 5,7 meses en el grupo de placebo (CRI, 0,56; IC 95 %, 0,43–0,72; P < 0,001).
- Se presentaron efectos adversos en el 98,6 % de los pacientes tratados con sorafenib y el 87,6 % de los pacientes tratados con placebo. Los efectos adversos más comunes en el grupo de sorafenib fueron reacciones cutáneas de eritrodisestesia palmoplantar (76,3 %), diarrea (68,6 %), alopecia (67,1 %), y exantema o descamación (50,2 %). La mayoría de los efectos fueron de grado 1 o 2. Se presentaron 7 carcinomas de células escamosas de la piel en el grupo de sorafenib.
Lenvatinib
El lenvatinib es un inhibidor dirigido a múltiples tirosina–cinasas que se administra por vía oral.
Evidencia (lenvatinib):
- En un estudio aleatorizado de fase III, con enmascaramiento doble y controlado con placebo (SELECT [NCT01321554]) se evaluó la actividad del lenvatinib en pacientes con cáncer de tiroides diferenciado, progresivo y resistente a la terapia con yodo.[22] En este ensayo, se asignaron al azar a 261 pacientes para recibir lenvatinib (24 mg cada día), y a 131 pacientes para recibir un placebo. Los pacientes aptos para participar tenían cáncer de tiroides diferenciado (papilar, folicular, pobremente diferenciado y carcinomas de células de Hürthle), enfermedad resistente a la terapia con YRA e indicios radiológicos de progresión durante los 13 meses previos. En el momento de la progresión de la enfermedad, los pacientes del grupo de placebo podían recibir lenvatinib sin anonimato. El criterio principal de valoración fue la SSP; y los criterios secundarios de valoración fueron la SG, la tasa de respuesta y la inocuidad.[22][Nivel de evidencia B1]
- La mediana de SSP fue de 18,3 en el grupo de lenvatinib y de 3,6 meses en el grupo de placebo (CRIde progresión o muerte, 0,21; IC 99 %, 0,14–0,31; P < 0,001). Se observó una diferencia de SSP en los pacientes de todos los tipos histológicos de cáncer de tiroides inscritos en este ensayo.
- No hubo diferencias significativas en la SG entre los 2 grupos (CRIde muerte, 0,73; IC 95 %, 0,50–1,07; P = 0,10), incluso con el diseño cruzado del estudio.
- La tasa de respuesta objetiva fue del 64,8 % en el grupo de lenvatinib y del 1,5 % en el grupo de placebo (oportunidad relativa [OR], 28,87; IC 95 %, 12,46–66,86; P < 0,001).
- Se presentaron efectos adversos relacionados con el tratamiento (todos los grados) en el 97,3 % de los pacientes del grupo de lenvatinib y el 59,5 % de los pacientes del grupo de placebo.
- Se observaron efectos adversos de grado 3 o más alto en el 75,9 % de los pacientes que recibieron lenvatinib y en el 9,9 % de los pacientes que recibieron placebo.
- Los efectos adversos más comunes en el grupo de lenvatinib fueron hipertensión (67,8 %), diarrea (59,4 %), fatiga (59 %), disminución del apetito (50,2 %), pérdida de peso (46,4 %) y náuseas (41 %).
- Los efectos adversos condujeron a la interrupción del fármaco del estudio en el 14,2 % de los pacientes que recibieron lenvatinib y en el 2,3 % de los pacientes que recibieron placebo.
- En el grupo de lenvatinib, 6 de las 20 defunciones que ocurrieron durante el período de tratamiento se consideraron relacionadas con el tratamiento.
Cirugía
La resección de metástasis limitadas, en especial de metástasis sintomáticas, se debe sopesar cuando el tumor no absorbe 131I.
Radioterapia de haz externo
La RHE se considera para los pacientes con lesiones localizadas que no responden al 131I.[23]
Quimioterapia (en evaluación clínica)
La quimioterapia produce respuestas completas prolongadas ocasionales.[24-26]
Ensayos clínicos
Los pacientes con cáncer de tiroides papilar y folicular resistente a la terapia con yodo radiactivo pueden considerar la participación en ensayos clínicos en los que se evalúen nuevos abordajes de tratamiento. Los inhibidores orales que se dirigen a variantes de un solo nucleótido específicas están en evaluación clínica, al igual que nuevos abordajes de inmunoterapia.[27-29][Nivel de evidencia B4]
Cáncer de tiroides papilar y folicular recidivante
Entre el 10 % y el 30 % de los pacientes que se piensa que no tienen enfermedad después del tratamiento inicial presentan recidivas o metástasis. De estos pacientes con recidivas, casi el 80 % presentarán recidiva solo en el cuello y el 20 % tendrán metástasis a distancia. El sitio más común de metástasis a distancia son los pulmones. En una serie única de 289 pacientes que padecieron recidivas después de la cirugía inicial, el 16 % murió por cáncer al cabo de una mediana de 5 años después de la recidiva.[5]
El pronóstico de los pacientes con recidivas clínicamente detectables suele ser precario, sin importar el tipo celular.[30] Los pacientes que tienen recidiva tumoral local o regional detectable solo mediante gammagrafías con 131I tienen mejor pronóstico.[31]
La selección del tratamiento adicional depende de muchos factores, como los siguientes:
- Tipo celular.
- Absorción de 131I.
- Tratamiento previo.
- Sitio de recidiva.
- Características individuales del paciente.
- Presencia de una fusión génica activadora de RET o NTRK.
Los pacientes que recibieron tratamiento por un cáncer de tiroides diferenciado se someten a vigilancia minuciosa con exámenes físicos, análisis cuantitativos de las concentraciones séricas de tiroglobulina y estudios radiológicos de acuerdo con el riesgo individual de recidiva.[32]
Opciones de tratamiento del cáncer de tiroides papilar y folicular recidivante
Las opciones de tratamiento del cáncer de tiroides papilar y folicular recidivante son las siguientes:
Cirugía y terapia con yodo radiactivo posoperatoria, o sin esta
La cirugía con terapia de ablación con 131I, o sin esta, puede resultar útil para controlar las recidivas locales, las metástasis en ganglios linfáticos regionales y, a veces, las metástasis localizadas en otros sitios.[33] Casi el 50 % de los pacientes sometidos a cirugía por tumores recidivantes se consideran sin enfermedad después de una segunda cirugía.[30] Las recidivas locales y regionales detectadas en una gammagrafía con 131I que no producen manifestaciones clínicas notorias se pueden tratar con ablación con 131I y tienen un pronóstico excelente.[34]
Hasta el 25 % de las recidivas y metástasis de cáncer de tiroides bien diferenciado no absorben 131I. En estos pacientes, es posible que la enfermedad metastásica o recidivante se detecte con otras técnicas de imágenes como ecografía, tomografía computarizada, imágenes por resonancia magnética y tomografía por emisión de positrones.
Los pacientes que no responden al 131I deben considerar la participación en ensayos clínicos en los que se prueban nuevos abordajes de tratamiento de esta enfermedad.
Terapia dirigida
Inhibidores de tirosina–cinasas
Sorafenib
El sorafenib es un inhibidor de múltiples tirosina–cinasas que se administra por vía oral. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el sorafenib como opción de tratamiento cuando una enfermedad recidivante no concentra el 131I o la enfermedad recidiva después de la ablación con 131I.
Evidencia (sorafenib):
- En un estudio de aleatorizado de fase III, con enmascaramiento doble y controlado con placebo (DECISION [NCT00984282]), se evaluó el sorafenib en pacientes de cáncer de tiroides diferenciado y progresivo resistente a la terapia con yodo.[21] En este ensayo se incluyeron 417 pacientes con cáncer de tiroides localmente avanzado o metastásico resistente a la terapia con YRA en los que la enfermedad había progresado durante los 14 meses previos. Los pacientes se asignaron al azar a recibir sorafenib (400 mg 2 veces por día) o placebo. Estos pacientes tenían tumores papilares, foliculares (incluso de células de Hürthle) y pobremente diferenciados. Se excluyó a los pacientes que habían recibido quimioterapia, talidomida o terapia dirigida.[21][Nivel de evidencia B1]
- La mediana de SSP fue de 10,8 en el grupo de sorafenib y de 5,8 meses en el grupo de placebo (CRI, 0,59; IC 95 %, 0,45–0,76; P < 0,001).
- La SG no mejoró de manera significativa (CRI, 0,80; IC 95 %, 0,54–1,19; P unilateral = 0,14), pero la mediana de SG no se había alcanzado en el momento límite para los datos del análisis primario y se permitió el cruce entre grupos.
- Las tasas de respuesta objetiva (todas respuestas parciales) fueron del 12,2 % en el grupo de sorafenib y del 0,5 % en el grupo de placebo.
- La mediana de tiempo transcurrido hasta la progresión fue de 11,1 meses en el grupo de sorafenib y de 5,7 meses en el grupo de placebo (CRI, 0,56; IC 95 %, 0,43–0,72; P < 0,001).
- Se presentaron efectos adversos en el 98,6 % de los pacientes tratados con sorafenib y el 87,6 % de los pacientes tratados con placebo. Los efectos adversos más comunes en el grupo de sorafenib fueron reacciones cutáneas de eritrodisestesia palmoplantar (76,3 %), diarrea (68,6 %), alopecia (67,1 %) y exantema o descamación (50,2 %). La mayoría de los efectos fueron de grado 1 o 2. Se presentaron 7 carcinomas de células escamosas de la piel en el grupo de sorafenib.
Lenvatinib
El lenvatinib es un inhibidor dirigido a múltiples tirosina–cinasas que se administra por vía oral.
Evidencia (lenvatinib):
- En un estudio aleatorizado de fase III, con enmascaramiento doble y controlado con placebo (SELECT [NCT01321554]) se evaluó la actividad del lenvatinib en pacientes con cáncer de tiroides diferenciado, progresivo y resistente a la terapia con yodo.[22] En este ensayo, se asignaron al azar a 261 pacientes para recibir lenvatinib (24 mg cada día) y a 131 pacientes para recibir un placebo. Los pacientes aptos para participar tenían cáncer de tiroides diferenciado (papilar, folicular, pobremente diferenciado y carcinomas de células de Hürthle), enfermedad resistente a la terapia con YRA e indicios radiológicos de progresión durante los 13 meses previos. En el momento de la progresión de la enfermedad, los pacientes del grupo de placebo podían recibir lenvatinib sin anonimato. El criterio principal de valoración fue la SSP; y los criterios secundarios de valoración fueron la SG, la tasa de respuesta y la inocuidad.[22][Nivel de evidencia B1]
- La mediana de SSP en el grupo de lenvatinib fue de 18,3 versus 3,6 meses en el grupo de placebo (CRIde progresión o muerte, 0,21; IC 99 %, 0,14–0,31; P < 0,001). Se observó una diferencia de SSP en los pacientes de todos los tipos histológicos de cáncer de tiroides inscritos en este ensayo.
- No hubo diferencias significativas en la SG entre los 2 grupos (CRIde muerte, 0,73; IC 95 %, 0,50–1,07; P = 0,10), incluso con el diseño cruzado del estudio.
- La tasa de respuesta objetiva fue del 64,8 % en el grupo de lenvatinib y del 1,5 % en el grupo de placebo (OR, 28,87; IC 95 %, 12,46–66,86; P < 0,001).
- Se presentaron efectos adversos relacionados con el tratamiento (todos los grados) en el 97,3 % de los pacientes del grupo de lenvatinib y el 59,5 % de los pacientes del grupo de placebo.
- Se observaron efectos adversos de grado 3 o más alto en el 75,9 % de los pacientes que recibieron lenvatinib y en el 9,9 % de los pacientes que recibieron placebo.
- Los efectos adversos más comunes en el grupo de lenvatinib fueron hipertensión (67,8 %), diarrea (59,4 %), fatiga (59 %), disminución del apetito (50,2 %), pérdida de peso (46,4 %) y náuseas (41 %).
- Los efectos adversos condujeron a la interrupción del fármaco del estudio en el 14,2 % de los pacientes que recibieron lenvatinib y el 2,3 % de los pacientes que recibieron placebo.
- En el grupo de lenvatinib, se consideró que 6 de las 20 defunciones que ocurrieron durante el período de tratamiento estuvieron relacionadas con el fármaco.
Cabozantinib
El cabozantinib es un inhibidor de tirosina-cinasas de c-MET y del receptor 2 del factor de crecimiento endotelial vascular (VEGFR-2) biodisponible por vía oral.
Evidencia (cabozantinib):
- Se llevó a cabo un estudio aleatorizado de fase III, con enmascaramiento doble y controlado con placebo (COSMIC-311 [NCT03690388]), para evaluar la eficacia del cabozantinib en pacientes de 16 años o más con cáncer de tiroides diferenciado y resistente a la terapia con YRA. En los primeros 100 pacientes asignados al azar, el criterio principal de valoración fue la tasa de respuesta objetiva (población por intención de tratar para la tasa de respuesta objetiva [OITT]) y la SSP fue el criterio principal de valoración en todos los pacientes asignados al azar (población por intención de tratar [ITT]).[35]
- De los 187 pacientes, el 63 % había recibido tratamiento previo con lenvatinib, el 60 % con sorafenib y el 24 % con lenvatinib y sorafenib. La mayoría de los pacientes (76 %) había experimentado progresión de la enfermedad mientras recibían sorafenib o lenvatinib.
- En la población OITT, el 15 % de los pacientes (IC 99 %, 5,8–29,3 %) en el grupo de cabozantinib tuvieron una respuesta parcial confirmada, y la mediana de duración de la respuesta no se había alcanzado en el momento límite para los datos.
- En la población ITT, después de una mediana de seguimiento de 6,2 meses, los pacientes que recibieron cabozantinib exhibieron un mejora significativa en la SSP, en comparación con los pacientes que recibieron placebo (no se alcanzó la mediana [IC 96 %, 5,7–no fue estimable (NE)] vs. 1,9 meses [1,8–3,6]) (CRI, 0,22; IC 96 %, 0,13–0,36; P < 0,0001). No se alcanzó la mediana de SG en ninguno de los grupos por intención de tratar (IC 95 %, NE–NE) (CRI, 0,54; IC 95 %, 0,27–1,11). La tasa de SG a 6 meses fue del 85 % (IC 95 %, 75–91 %) en el grupo de cabozantinib y del 73 % (58,4–83,7 %) en el grupo de placebo.
- Se presentaron eventos adversos de grado 3 a 4 relacionados con el tratamiento en el 57 % de los pacientes que recibieron cabozantinib y en el 26 % de los pacientes que recibieron placebo, como eritrodisestesia palmoplantar (10 %), hipertensión (11 %), fatiga (8 %), diarrea (7 %) e hipocalcemia (7 %). Se produjeron efectos adversos graves relacionados con el tratamiento en 20 de los 125 pacientes (16 %) en el grupo de cabozantinib y en 1 de los 62 pacientes (2 %) en el grupo de placebo. No hubo muertes relacionadas con el tratamiento.
- En 2021, la FDA revisó una solicitud de nuevo fármaco para el uso de cabozantinib en pacientes con cáncer de tiroides diferenciado que tienen 12 años o más porque no hay tratamientos estándar para esta población después de la terapia anti-VEGFR, como lenvatinib o sorafenib.
Inhibidores de la cinasa RET
Selpercatinib
El selpercatinib es un inhibidor de la cinasa RET de molécula pequeña, muy selectivo y activo por vía oral.
Evidencia (selpercatinib):
- En un ensayo de fase I/II (LIBRETTO-001 [NCT03157128]), se evaluó la inocuidad y eficacia del selpercatinib en pacientes adolescentes y adultos con cualquier tipo de tumor sólido que albergara una variante patogénica activadora de RET. El criterio principal de valoración fue la respuesta objetiva (completa o parcial). Los pacientes con cáncer de tiroides positivo para la fusión de RET tenían enfermedad resistente al YRA y habían recibido al menos un tratamiento sistémico anterior, diferente al YRA. De los 19 pacientes inscritos con cáncer de tiroides positivo para la fusión de RET, 13 tenían cáncer de tiroides papilar, 3 cáncer de tiroides poco diferenciado, 1 cáncer de tiroides anaplásico y 1 cáncer de tiroides de células de Hürthle. De los pacientes con cáncer de tiroides positivo para la fusión de RET, el 95 % recibió la dosis de la fase II de 160 mg 2 veces por día.[36]
- La tasa de respuesta objetiva fue del 79 % (IC 95 %, 54−94 %).[36][Nivel de evidencia C2]
- Al cabo de 1 año, el 71 % de las respuestas se mantuvieron (IC 95 %, 39−88 %) y el 64 % de los pacientes no presentaron progresión.
- Se presentaron efectos adversos relacionados con el tratamiento (cualquier grado) en el 94 % de los pacientes.
- Se observaron efectos adversos de grado 3 en el 28 % de los pacientes y de grado 4 en el 2 % de los pacientes.
- Los efectos adversos más frecuentes fueron boca seca (46 %), hipertensión (43 %), diarrea (38 %), fatiga (38 %), elevación de las concentraciones de aspartato–aminotransferasa (ASAT) (35 %), náusea (35 %) y estreñimiento (35 %).
- Se redujo la dosis en el 30 % de los pacientes debido a efectos adversos relacionados con el tratamiento y se interrumpió el medicamento en el 2 % de los pacientes a causa de efectos adversos.
- En un ensayo de fase III aleatorizado (NCT04211337) se comparó el selpercatinib de primera línea con cabozantinib o vandetanib, según eligiera el médico (grupo de control). Los pacientes aptos tuvieron enfermedad progresiva en los 14 meses anteriores a la inscripción en el estudio. El criterio principal de valoración en el análisis de eficacia interino especificado por el protocolo fue la SSP, evaluada mediante una revisión central independiente con enmascaramiento. A los pacientes del grupo de control con progresión de la enfermedad se les permitió cambiar al grupo de selpercatinib. La supervivencia sin fracaso de tratamiento, evaluada mediante una revisión central independiente con enmascaramiento, fue un criterio secundario de valoración controlado por el valor α que debía evaluarse solo si la SSP era significativa. Otros criterios de valoración secundarios fueron la respuesta general y la inocuidad.[37]
- Al cabo de una mediana de seguimiento de 12 meses, no se alcanzó la mediana de SSP en el grupo de selpercatinib y fue de 16,8 meses en el grupo de control (IC 95 %, 12,2–25,1) (CRIde progresión de la enfermedad o de muerte, 0,28; IC 95 %, 0,16–0,48; P < 0,001).[37][Nivel de evidencia B1]
- La tasa de SSP a 12 meses fue de 86,8 % (IC 95 %, 79,8–91,6 %) en el grupo de selpercatinib y de 65,7 % (IC 95 %, 51,9–76,4 %) en el grupo de control.
- La tasa de respuesta general fue de 69,4 % (IC 95 %, 62,4–75,8 %) en el grupo de selpercatinib y de 38,8 % (IC 95 %, 29,1–49,2 %) en el grupo de control.
- Debido a los efectos adversos, se redujo la dosis en el 38,9 % de los pacientes en el grupo de selpercatinib y en el 77,3 % de los pacientes en el grupo de control. Los efectos adversos derivaron en la discontinuación del tratamiento en el 4,7 % de los pacientes en el grupo de selpercatinib y en el 26,8 % de los pacientes en el grupo de control.
Pralsetinib
El pralsetinib es una terapia oral dirigida a RET. En diciembre de 2020, la FDA aprobó el pralsetinib para pacientes de 12 años o más y para adultos con cáncer de tiroides medular (CTM) avanzado o metastásico con alteración de RET o cáncer de tiroides diferenciado positivo para una fusión de RET y resistente a la terapia con YRA.
Evidencia (pralsetinib):
- Un estudio de fase I/II, multicéntrico y sin anonimato (ARROW [NCT03037385]) evaluó la eficacia e inocuidad
del pralsetinib.[38]
- En el momento límite para los datos, 147 pacientes tenían CTM con alteración de RET y 22 pacientes tenían cáncer de tiroides diferenciado positivo para una fusión de RET. Un total de 142 pacientes con CTM con alteración de RET o cáncer de tiroides diferenciado positivo para una fusión de RET iniciaron la dosis de fase II de pralsetinib con 400 mg 1 vez por día.
- Había 61 pacientes con CTM con alteración de RET a los que se administró cabozantinib, vandetanib, o ambos, con anterioridad y 23 pacientes no recibieron tratamiento previo.
- En los pacientes con cáncer de tiroides diferenciado positivo para una fusión de RET, la tasa de respuesta general fue del 89 % (IC 95 %, 52–100 %), todas las cuales fueron respuestas parciales. No se alcanzó la duración de la respuesta después de una mediana de seguimiento de 9,5 meses. No se logró la mediana de SSP (IC 95 %, NE), con una tasa de SSP estimada a 1 año del 81 % después de una mediana de seguimiento de 12,9 meses. Tampoco se alcanzó la mediana de SG, con una tasa de SG estimada a 1 año del 91 % (IC 95 %, 74–100 %) después de una mediana de seguimiento de 15,8 meses.
- Los eventos adversos por todas las causas más frecuentes fueron anemia (45 %), dolor osteomuscular (45 %), estreñimiento (44 %), AST elevada (42 %) e hipertensión (40 %). Los efectos adversos de grado 3 a 4 relacionados con el tratamiento fueron hipertensión (17 %), neutropenia (13 %), linfopenia (12 %) y anemia (10 %). Se notificaron eventos adversos graves en 15 % de los pacientes; el evento adverso grave notificado con más frecuencia fue neumonitis (4 %).
- Cabe destacar, que la tasa de respuesta general en los pacientes con CTM que albergaba una alteración de RET y que habían recibido tratamiento en el pasado con cabozantinib, vandetanib, o ambos, fue del 60 % (IC 95 %, 46–73 %). De los pacientes, 1 (2 %) presentó respuesta completa. Sin embargo, la FDA retiró la aprobación de pralsetinib para esta indicación en 2023.[39]
Inhibidores de las proteínas NTRK
Larotrectinib
El larotrectinib es un inhibidor de las proteínas TRKA, TRKB y TRKC de molécula pequeña, potente y muy selectivo.
Evidencia (larotrectinib):
- En un análisis de eficacia ampliado se incluyó a 159 pacientes con cánceres positivos para una fusión génica de TRK tratados con larotrectinib. En el análisis de inocuidad se incluyó a 260 pacientes tratados con larotrectinib sin importar el estado de la fusión de TRK.[40]
- La tasa de respuesta general en 24 pacientes con cáncer de tiroides fue de 79 % (IC 95 %, 58−93 %). La mediana de duración de la respuesta no fue estimable (NE) (14,8 meses−NE).[40][Nivel de evidencia C2]
- De los 260 pacientes del análisis de inocuidad, el 13 % tuvieron efectos adversos de grado 3 relacionados con el tratamiento y menos del 1 % tuvieron efectos adversos de grado 4 relacionados con el tratamiento.
- Los efectos adversos de grados 3 o 4 relacionados con el tratamiento más comunes fueron elevación de la alanina–aminotransferasa (3 %), anemia (2 %) y disminución del recuento de neutrófilos (2 %).
- Se redujeron las dosis en el 8 % de los pacientes con cánceres positivos para la fusión de TRK debido a efectos adversos. Se interrumpió el medicamento en el 2 % de los pacientes por efectos adversos relacionados con el tratamiento.
Entrectinib
El entrectinib es un potente inhibidor de las proteínas TRKA, TRKB, TRKC, ROS1 y ALK de molécula pequeña.
Evidencia (entrectinib):
- En un análisis conjunto de tres ensayos de fases I/II se evaluó la eficacia y la inocuidad del entrectinib en pacientes con tumores sólidos positivos para la fusión de NTRK metastásicos, localmente avanzados o irresecables. El análisis de eficacia incluyó a 54 pacientes adultos con tumores sólidos positivos para la fusión de NTRK avanzados o metastásicos.[41]
- La tasa de respuesta objetiva fue del 57 % (IC 95 %, 34,2−70,8 %). De estos pacientes, el 7 % tuvo una respuesta completa y el 50 % una respuesta parcial.[41][Nivel de evidencia C2]
- La mediana de duración de la respuesta fue de 10 meses (IC 95 %, 7,1−NE), y la mediana de la SSP fue de 11 meses (IC 95 %, 8−14,9).
- En los 5 pacientes con cáncer de tiroides, la tasa de respuesta general fue del 20 % (IC 95 %, 1−72 %).
- En la población de inocuidad general (n = 355), los efectos adversos relacionados con el tratamiento que se notificaron con mayor frecuencia fueron disgeusia (41 %), fatiga (28 %), mareos (26 %), estreñimiento (23 %) y diarrea (22 %).
- Los efectos adversos de grado 3 o 4 más comunes fueron aumento de peso (5 %) y anemia (5 %).
Radioterapia de haz externo
Es posible que la RHE o la radioterapia intraoperatoria sean útiles para controlar los síntomas relacionados con las recidivas tumorales locales.[42]
Quimioterapia
Se puede considerar la quimioterapia sistémica. Se notificó que, en ocasiones, la quimioterapia produce respuestas objetivas, por lo general de corta duración.[26,31]
Ensayos clínicos
Los pacientes con cáncer de tiroides papilar y folicular recidivante deben considerar la participación en ensayos clínicos en los que se evalúan nuevos abordajes de tratamiento para esta enfermedad. Los inhibidores orales que se dirigen a variantes de un solo nucleótido específicas están en evaluación clínica, al igual que nuevos abordajes de inmunoterapia.[27-29][Nivel de evidencia B4
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Haigh PI, Urbach DR: The treatment and prognosis of Hürthle cell follicular thyroid carcinoma compared with its non-Hürthle cell counterpart. Surgery 138 (6): 1152-7; discussion 1157-8, 2005. [PUBMED Abstract]
- Carling T, Udelsman R: Thyroid tumors. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1457-72.
- Grant CS, Hay ID, Gough IR, et al.: Local recurrence in papillary thyroid carcinoma: is extent of surgical resection important? Surgery 104 (6): 954-62, 1988. [PUBMED Abstract]
- Cady B, Rossi R: An expanded view of risk-group definition in differentiated thyroid carcinoma. Surgery 104 (6): 947-53, 1988. [PUBMED Abstract]
- Mazzaferri EL, Jhiang SM: Long-term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer. Am J Med 97 (5): 418-28, 1994. [PUBMED Abstract]
- Staunton MD: Thyroid cancer: a multivariate analysis on influence of treatment on long-term survival. Eur J Surg Oncol 20 (6): 613-21, 1994. [PUBMED Abstract]
- Tollefsen HR, Shah JP, Huvos AG: Follicular carcinoma of the thyroid. Am J Surg 126 (4): 523-8, 1973. [PUBMED Abstract]
- Edis AJ: Surgical treatment for thyroid cancer. Surg Clin North Am 57 (3): 533-42, 1977. [PUBMED Abstract]
- Bilimoria KY, Bentrem DJ, Ko CY, et al.: Extent of surgery affects survival for papillary thyroid cancer. Ann Surg 246 (3): 375-81; discussion 381-4, 2007. [PUBMED Abstract]
- Bilimoria KY, Bentrem DJ, Linn JG, et al.: Utilization of total thyroidectomy for papillary thyroid cancer in the United States. Surgery 142 (6): 906-13; discussion 913.e1-2, 2007. [PUBMED Abstract]
- Hay ID, Grant CS, Bergstralh EJ, et al.: Unilateral total lobectomy: is it sufficient surgical treatment for patients with AMES low-risk papillary thyroid carcinoma? Surgery 124 (6): 958-64; discussion 964-6, 1998. [PUBMED Abstract]
- Beierwaltes WH, Rabbani R, Dmuchowski C, et al.: An analysis of "ablation of thyroid remnants" with I-131 in 511 patients from 1947-1984: experience at University of Michigan. J Nucl Med 25 (12): 1287-93, 1984. [PUBMED Abstract]
- Hänscheid H, Lassmann M, Luster M, et al.: Iodine biokinetics and dosimetry in radioiodine therapy of thyroid cancer: procedures and results of a prospective international controlled study of ablation after rhTSH or hormone withdrawal. J Nucl Med 47 (4): 648-54, 2006. [PUBMED Abstract]
- Hay ID, Grant CS, van Heerden JA, et al.: Papillary thyroid microcarcinoma: a study of 535 cases observed in a 50-year period. Surgery 112 (6): 1139-46; discussion 1146-7, 1992. [PUBMED Abstract]
- Schvartz C, Bonnetain F, Dabakuyo S, et al.: Impact on overall survival of radioactive iodine in low-risk differentiated thyroid cancer patients. J Clin Endocrinol Metab 97 (5): 1526-35, 2012. [PUBMED Abstract]
- Schlumberger M, Catargi B, Borget I, et al.: Strategies of radioiodine ablation in patients with low-risk thyroid cancer. N Engl J Med 366 (18): 1663-73, 2012. [PUBMED Abstract]
- Mallick U, Harmer C, Yap B, et al.: Ablation with low-dose radioiodine and thyrotropin alfa in thyroid cancer. N Engl J Med 366 (18): 1674-85, 2012. [PUBMED Abstract]
- Pujol P, Daures JP, Nsakala N, et al.: Degree of thyrotropin suppression as a prognostic determinant in differentiated thyroid cancer. J Clin Endocrinol Metab 81 (12): 4318-23, 1996. [PUBMED Abstract]
- Cooper DS, Specker B, Ho M, et al.: Thyrotropin suppression and disease progression in patients with differentiated thyroid cancer: results from the National Thyroid Cancer Treatment Cooperative Registry. Thyroid 8 (9): 737-44, 1998. [PUBMED Abstract]
- Giuliani M, Brierley J: Indications for the use of external beam radiation in thyroid cancer. Curr Opin Oncol 26 (1): 45-50, 2014. [PUBMED Abstract]
- Brose MS, Nutting CM, Jarzab B, et al.: Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. Lancet 384 (9940): 319-28, 2014. [PUBMED Abstract]
- Schlumberger M, Tahara M, Wirth LJ, et al.: Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. N Engl J Med 372 (7): 621-30, 2015. [PUBMED Abstract]
- Simpson WJ, Carruthers JS: The role of external radiation in the management of papillary and follicular thyroid cancer. Am J Surg 136 (4): 457-60, 1978. [PUBMED Abstract]
- Gottlieb JA, Hill CS, Ibanez ML, et al.: Chemotherapy of thyroid cancer. An evaluation of experience with 37 patients. Cancer 30 (3): 848-53, 1972. [PUBMED Abstract]
- Harada T, Nishikawa Y, Suzuki T, et al.: Bleomycin treatment for cancer of the thyroid. Am J Surg 122 (1): 53-7, 1971. [PUBMED Abstract]
- Shimaoka K, Schoenfeld DA, DeWys WD, et al.: A randomized trial of doxorubicin versus doxorubicin plus cisplatin in patients with advanced thyroid carcinoma. Cancer 56 (9): 2155-60, 1985. [PUBMED Abstract]
- Sherman SI, Wirth LJ, Droz JP, et al.: Motesanib diphosphate in progressive differentiated thyroid cancer. N Engl J Med 359 (1): 31-42, 2008. [PUBMED Abstract]
- Jin Y, Van Nostrand D, Cheng L, et al.: Radioiodine refractory differentiated thyroid cancer. Crit Rev Oncol Hematol 125: 111-120, 2018. [PUBMED Abstract]
- Naoum GE, Morkos M, Kim B, et al.: Novel targeted therapies and immunotherapy for advanced thyroid cancers. Mol Cancer 17 (1): 51, 2018. [PUBMED Abstract]
- Goretzki PE, Simon D, Frilling A, et al.: Surgical reintervention for differentiated thyroid cancer. Br J Surg 80 (8): 1009-12, 1993. [PUBMED Abstract]
- De Besi P, Busnardo B, Toso S, et al.: Combined chemotherapy with bleomycin, adriamycin, and platinum in advanced thyroid cancer. J Endocrinol Invest 14 (6): 475-80, 1991. [PUBMED Abstract]
- Ross DS: Long-term management of differentiated thyroid cancer. Endocrinol Metab Clin North Am 19 (3): 719-39, 1990. [PUBMED Abstract]
- Pak H, Gourgiotis L, Chang WI, et al.: Role of metastasectomy in the management of thyroid carcinoma: the NIH experience. J Surg Oncol 82 (1): 10-8, 2003. [PUBMED Abstract]
- Coburn M, Teates D, Wanebo HJ: Recurrent thyroid cancer. Role of surgery versus radioactive iodine (I131) Ann Surg 219 (6): 587-93; discussion 593-5, 1994. [PUBMED Abstract]
- Brose MS, Robinson B, Sherman SI, et al.: Cabozantinib for radioiodine-refractory differentiated thyroid cancer (COSMIC-311): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 22 (8): 1126-1138, 2021. [PUBMED Abstract]
- Wirth LJ, Sherman E, Robinson B, et al.: Efficacy of Selpercatinib in RET-Altered Thyroid Cancers. N Engl J Med 383 (9): 825-835, 2020. [PUBMED Abstract]
- Hadoux J, Elisei R, Brose MS, et al.: Phase 3 Trial of Selpercatinib in Advanced RET-Mutant Medullary Thyroid Cancer. N Engl J Med 389 (20): 1851-1861, 2023. [PUBMED Abstract]
- Subbiah V, Hu MI, Wirth LJ, et al.: Pralsetinib for patients with advanced or metastatic RET-altered thyroid cancer (ARROW): a multi-cohort, open-label, registrational, phase 1/2 study. Lancet Diabetes Endocrinol 9 (8): 491-501, 2021. [PUBMED Abstract]
- GAVRETO Full prescribing information. Rigel, 2024. Available online. Last accessed April 2, 2025.
- Hong DS, DuBois SG, Kummar S, et al.: Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol 21 (4): 531-540, 2020. [PUBMED Abstract]
- Doebele RC, Drilon A, Paz-Ares L, et al.: Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol 21 (2): 271-282, 2020. [PUBMED Abstract]
- Vikram B, Strong EW, Shah JP, et al.: Intraoperative radiotherapy in patients with recurrent head and neck cancer. Am J Surg 150 (4): 485-7, 1985. [PUBMED Abstract]
Cáncer de tiroides medular
Cáncer de tiroides medular esporádico y hereditario
El cáncer de tiroides medular (CTM) se presenta en dos formas: esporádica y hereditaria. En la forma esporádica, el tumor por lo general es unilateral. En la forma hereditaria, el tumor casi siempre es bilateral. Además, es posible que la forma hereditaria se relacione con tumores benignos o malignos en otros órganos endocrinos, afección que por lo común se conoce como síndrome de neoplasia endocrina múltiple (NEM) de tipo 2A y 2B (NEM2A o NEM2B). Estos síndromes se relacionan con el feocromocitoma de glándula suprarrenal y con la hiperplasia paratiroidea.
Cerca del 25 % de los casos notificados de CTM son hereditarios. Los síndromes de CTM hereditario incluyen el NEM2A, que es el más frecuente; el síndrome de NEM2B y otros síndromes hereditarios diferentes a la NEM. Todos los pacientes con una variante hereditaria se deben someter a exámenes de detección para otros tumores endocrinos relacionados, en especial, la hiperplasia paratiroidea y el feocromocitoma. En general, el carcinoma medular segrega calcitonina, un marcador hormonal del tumor, que quizás se detecte en la sangre, aunque el tumor esté oculto desde el punto de vista clínico. Es útil medir la concentración de calcitonina para los fines del diagnóstico y para el seguimiento del resultado del tratamiento. Para obtener más información en inglés, consultar Multiple Endocrine Neoplasia Type 2 (MEN2).
Todos los pacientes con CTM (hereditario o esporádico) se someten a pruebas para determinar si tienen variantes patogénicas de RET y, si estas se detectan, también se examina a sus familiares. Los familiares se pueden someter a exámenes de detección de elevación de la calcitonina o de variantes del protooncogén RET. Estas pruebas permiten identificar a otras personas en riesgo de CTM hereditario. Debido a que una elevación pequeña de la calcitonina quizá lleve a un diagnóstico positivo falso de CTM, los análisis genéticos para variante patogénica de RET constituyen la estrategia óptima. Los familiares portadores de la variante patogénica de gen tienen la opción de someterse a una tiroidectomía profiláctica a temprana edad.[1,2]
Características clínicas y pronóstico
El CTM representa entre el 3 % y el 4 % de todos los cánceres de tiroides. Por lo general, estos tumores se presentan como una masa dura en el cuello o la tiroides, a menudo con linfadenopatía.[3] El CTM también se diagnostica mediante una biopsia por aspiración con aguja fina. Por lo general, el análisis citológico revela tumores hipercelulares con células fusiformes y adhesión precaria.[4] Se encuentran metástasis en ganglios linfáticos regionales en casi el 50 % de los casos.
La tasa de supervivencia general (SG) de los pacientes con CTM es del 86 % a los 5 años y del 65 % a los 10 años.
El pronóstico depende de los siguientes factores:[5]
- Extensión de la enfermedad en el cuadro clínico inicial.
- Presencia o ausencia de metástasis en ganglios linfáticos regionales.
- Extensión de la resección quirúrgica.
Los factores de pronóstico adverso son los siguientes:[4,6,7]
- Edad avanzada.
- Estadio avanzado.
- Cirugía previa del cuello.
- Síndrome de NEM2B relacionado.
Información sobre los estadios del carcinoma de tiroides medular
Se han empleado varios sistemas de estadificación para correlacionar la extensión de la enfermedad y la supervivencia a largo plazo de los pacientes con cáncer de tiroides medular (CTM). El sistema clínico de estadificación del American Joint Committee on Cancer (AJCC) correlaciona la supervivencia con el tamaño del tumor primario (T), la presencia o ausencia de metástasis en ganglios linfáticos (N), y la presencia o ausencia de metástasis a distancia (M). Los pacientes con diagnóstico de CTM hereditario después de un resultado positivo en la prueba genética para una variante patogénica de RET tienen el mejor pronóstico.[8]
| Estadio | TNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; CTM = carcinoma de tiroides medular. | |||
| aReproducción autorizada de AJCC: Thyroid--Medullary. En: Amin, MB, Edge Sb, Greene FL et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 891–901. | |||
| I | T1, N0, M0 | T1 = tumor que mide ≤2 cm en su mayor dimensión y se limita a la tiroides. |
 |
| –T1a = tumor que mide ≤1 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1b = tumor que mide >1 cm, pero menos ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| N0 = sin indicios de metástasis en ganglios linfáticos locorregionales. | |||
| –N0a = uno o más ganglios linfáticos benignos según confirmación citológica o histológica. | |||
| –N0b = sin indicios radiológicos o clínicos de metástasis en ganglios linfáticos locorregionales. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; CTM = carcinoma de tiroides medular. | |||
| aReproducción autorizada de AJCC: Thyroid--Medullary. En: Amin, MB, Edge Sb, Greene FL et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 891–901. | |||
| II | T2, N0, M0 | T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión y se limita a la tiroides. |
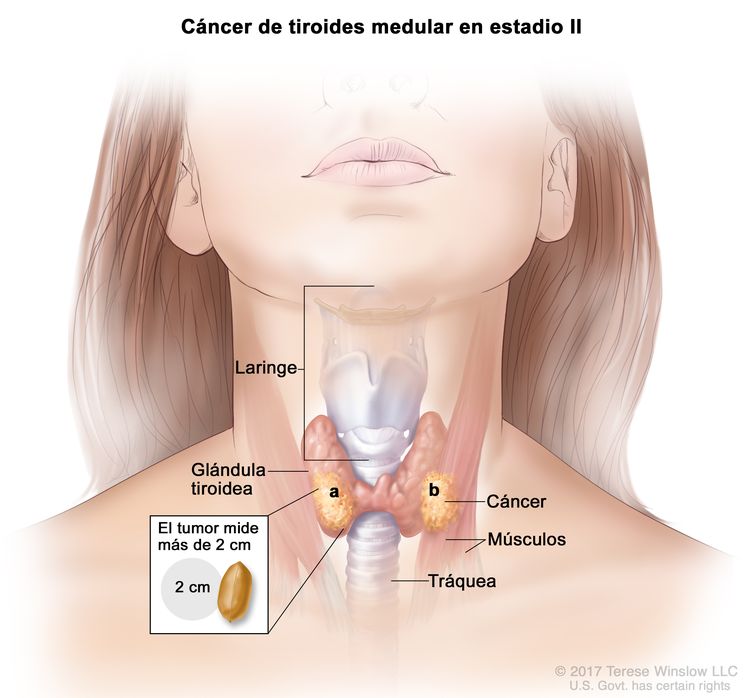 |
| N0 = sin indicios de metástasis en ganglios linfáticos locorregionales. | |||
| –N0a = uno o más ganglios linfáticos benignos según confirmación citológica o histológica. | |||
| –N0b = sin indicios radiológicos o clínicos de metástasis en ganglios linfáticos locorregionales. | |||
| M0 = sin metástasis a distancia. | |||
| T3, N0, M0 | T3 = tumor que mide >4 cm o tiene diseminación extratiroidea. | ||
| –T3a = tumor que mide >4 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T3b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión solo de los músculos infrahioideos (músculos esternohioideo, esternotiroideo, tirohioideo u omohioideo). | |||
| N0 = sin indicios de metástasis en ganglios linfáticos locorregionales. | |||
| –N0a = uno o más ganglios linfáticos benignos según confirmación citológica o histológica. | |||
| –N0b = sin indicios radiológicos o clínicos de metástasis en ganglios linfáticos locorregionales. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; CTM = carcinoma de tiroides medular. | |||
| aReproducción autorizada de AJCC: Thyroid--Medullary. En: Amin, MB, Edge Sb, Greene FL et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 891–901. | |||
| III | T1–3, N1a, M0 | T1 = tumor que mide ≤2 cm en su mayor dimensión y se limita a la tiroides. |
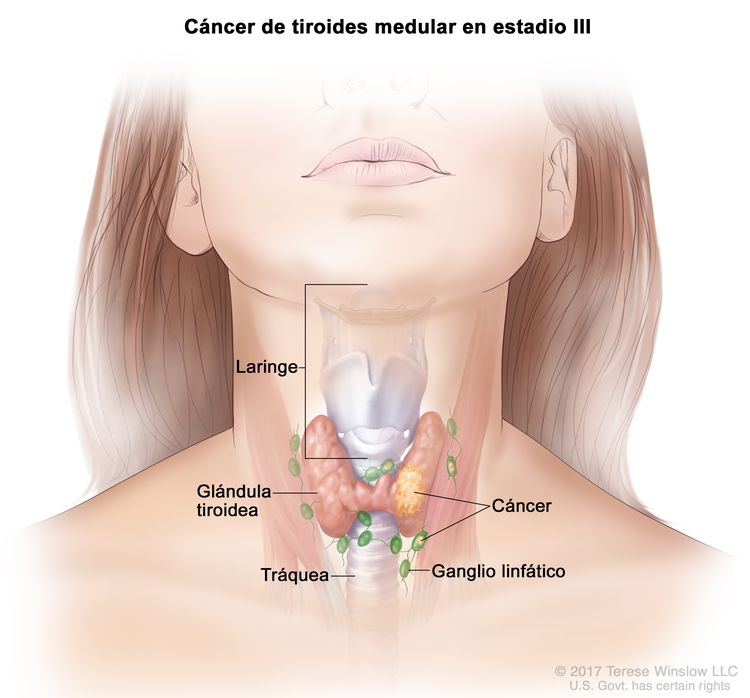 |
| –T1a = tumor que mide ≤1 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1b = tumor que mide >1 cm, pero menos ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión y se limita a la tiroides. | |||
| T3 = tumor que mide >4 cm o tiene diseminación extratiroidea. | |||
| –T3a = tumor que mide >4 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T3b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión solo de los músculos infrahioideos (músculos esternohioideo, esternotiroideo, tirohioideo u omohioideo). | |||
| –N1a = metástasis en ganglios linfáticos de los grupos VI o VII (pretraqueales, paratraqueales o prelaríngeos/délficos, o mediastínicos superiores). La enfermedad puede ser unilateral o bilateral. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; CTM = carcinoma de tiroides medular. | |||
| aReproducción autorizada de AJCC: Thyroid--Medullary. En: Amin, MB, Edge Sb, Greene FL et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 891–901. | |||
| IVA | T4a, cualquier N, M0 | –T4a = enfermedad en estadio moderadamente avanzado; tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión de los tejidos cercanos del cuello, incluso el tejido blando subcutáneo, la laringe, la tráquea, el esófago o el nervio laríngeo recurrente. |
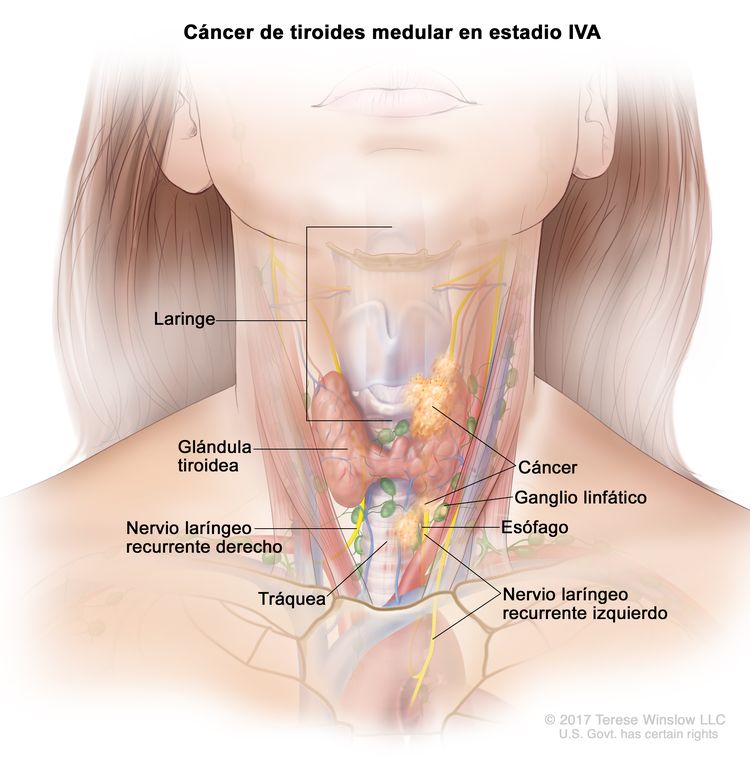 |
| NX = ganglios linfáticos regionales no evaluables. | |||
| N0 = sin indicios de metástasis en ganglios linfáticos locorregionales. | |||
| –N0a = uno o más ganglios linfáticos benignos según confirmación citológica o histológica. | |||
| –N0b = sin indicios radiológicos o clínicos de metástasis en ganglios linfáticos locorregionales. | |||
| N1 = metástasis en ganglios linfáticos regionales. | |||
| –N1a = metástasis en ganglios linfáticos de los grupos VI o VII (pretraqueales, paratraqueales o prelaríngeos/délficos, o mediastínicos superiores). La enfermedad puede ser unilateral o bilateral. | |||
| –N1b = metástasis en ganglios linfáticos cervicales unilaterales, bilaterales o contralaterales (grupos I, II, III, IV o V) o ganglios linfáticos retrofaríngeos. | |||
| M0 = sin metástasis a distancia. | |||
| T1–3, N1b, M0 | T1 = tumor que mide ≤2 cm en su mayor dimensión y se limita a la tiroides. | ||
| –T1a = tumor que mide ≤1 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1b = tumor que mide >1 cm, pero menos ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión y se limita a la tiroides. | |||
| T3 = tumor que mide >4 cm o tiene diseminación extratiroidea. | |||
| –T3a = tumor que mide >4 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T3b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión solo de los músculos infrahioideos (músculos esternohioideo, esternotiroideo, tirohioideo u omohioideo). | |||
| –N1b = metástasis en ganglios linfáticos cervicales unilaterales, bilaterales o contralaterales (grupos I, II, III, IV o V) o ganglios linfáticos retrofaríngeos. | |||
| M0 = sin metástasis a distancia. | |||
| IVB | T4, cualquier N, M0 | T4b = enfermedad en estadio muy avanzado; tumor de cualquier tamaño con diseminación a la columna vertebral o los vasos sanguíneos grandes cercanos, diseminación extratiroidea macroscópica e invasión de la fascia prevertebral o atrapamiento de la arteria carótida o los vasos mediastínicos. |
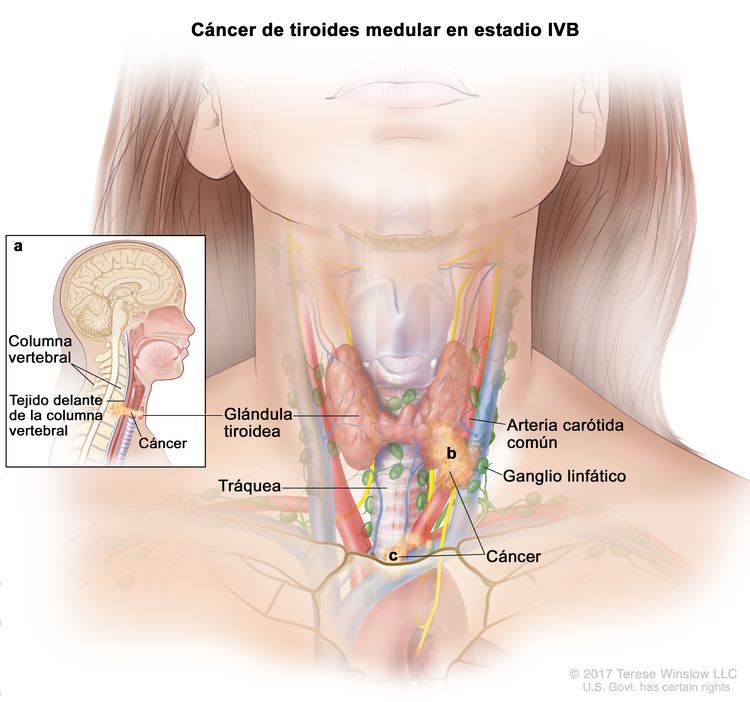 |
| Cualquier N = consultar las descripciones en este cuadro en el estadio IVA. | |||
| M0 = sin metástasis a distancia. | |||
| IVC | Cualquier T, cualquier N, M1 | TX = tumor primario no evaluable. |
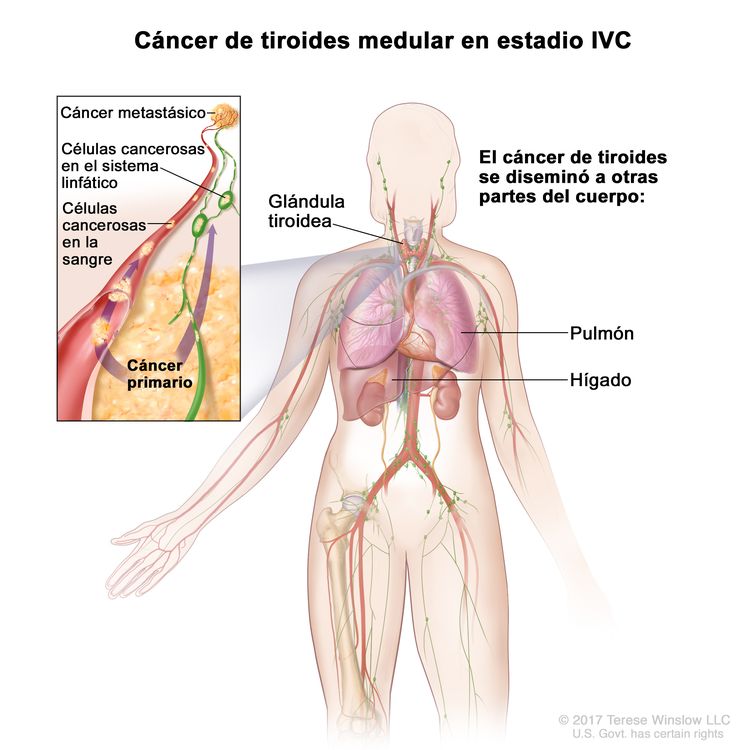 |
| T0 = sin indicios de tumor primario. | |||
| T1 = tumor que mide ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1a = tumor que mide ≤1 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1b = tumor que mide >1 cm, pero menos ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión y se limita a la tiroides. | |||
| T3 = tumor que mide >4 cm o tiene diseminación extratiroidea. | |||
| –T3a = tumor que mide >4 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T3b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión solo de los músculos infrahioideos (músculos esternohioideo, esternotiroideo, tirohioideo u omohioideo). | |||
| T4 = enfermedad en estadio avanzado. | |||
| –T4a = enfermedad en estadio moderadamente avanzado; tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión de los tejidos cercanos del cuello, incluso el tejido blando subcutáneo, la laringe, la tráquea, el esófago o el nervio laríngeo recurrente. | |||
| –T4b = enfermedad en estadio muy avanzado; tumor de cualquier tamaño con diseminación a la columna vertebral o los vasos sanguíneos grandes cercanos, diseminación extratiroidea macroscópica e invasión de la fascia prevertebral o atrapamiento de la arteria carótida o los vasos mediastínicos. | |||
| Cualquier N = consultar las descripciones en este cuadro en el estadio IVA, T4a, cualquier N, M0. | |||
| M1 = metástasis a distancia. | |||
Opciones de tratamiento del cáncer de tiroides medular
Enfermedad localizada
Las opciones de tratamiento del CTM localizado son las siguientes:
El yodo radiactivo no se usa en el tratamiento de los pacientes con CTM.
Tiroidectomía total
Los pacientes de CTM se tratan con tiroidectomía total, a menos que se compruebe metástasis a distancia. En los pacientes con CTM clínicamente palpable, la incidencia de nódulos con compromiso microscópico es de más del 75 %. Por lo general, se hacen disecciones centrales ordinarias y bilaterales modificadas del cuello.[9] Cuando el cáncer está confinado a la glándula tiroidea, el pronóstico es excelente.
Radioterapia de haz externo
La RHE se ha empleado como paliativo para tumores con recidiva local; sin embargo, no hay evidencia de que ofrezca alguna ventaja de supervivencia.[10]
Enfermedad localmente avanzada y metastásica
Las opciones de tratamiento del CTM localmente avanzado y metastásico son las siguientes:
Terapia dirigida
Inhibidores de tirosina-cinasas
Vandetanib
El vandetanib es un inhibidor oral de la cinasa receptora del gen reorganizado durante la transfección (RET), el receptor del factor de crecimiento endotelial vascular (VEGFR) y el receptor del factor de crecimiento epidérmico.
Evidencia (vandetanib):
- En un ensayo prospectivo controlado con placebo (NCT00410761) se evaluó el vandetanib en 331 pacientes con enfermedad localmente avanzada o metastásica. Los pacientes se asignaron al azar en una proporción 2:1 para recibir el fármaco del estudio o placebo.[11][Nivel de evidencia B1]
- Después de una mediana de seguimiento de 24 meses, la supervivencia sin progresión (SSP) favoreció al vandetanib (cociente de riesgos instantáneos [CRI] = 0,46; intervalo de confianza [IC] 95 %, 0,31–0,69; P < 0,001); se calculó una mediana de SSP de 30,5 meses para el vandetanib versus 19,3 meses para el placebo.
- La SG no fue diferente a los 24 meses. Se necesitará un seguimiento más prolongado porque todos los pacientes, excepto 47, estaban vivos en el momento del análisis; además, se dificultó el análisis de la SG porque se permitió el cruce desde el grupo de placebo al grupo del fármaco en estudio en el momento de la progresión de la enfermedad.
- El tratamiento con vandetanib produce efectos secundarios importantes como diarrea, exantema, hipertensión y prolongación del QT. En este ensayo no se evaluó de manera oficial la calidad de vida.
Cabozantinib
El cabozantinib es un inhibidor oral de tirosina–cinasas que actúa en la cinasa receptora de RET, el receptor del factor de crecimiento de hepatocitos tipo MET y el VEGFR-2.
Evidencia (cabozantinib):
- El cabozantinib se evaluó en un ensayo aleatorizado de fase III, con enmascaramiento doble y controlado con placebo (EXAM [NCT00704730]). En el estudio se inscribieron 330 pacientes de CTM metastásico y progresión radiográfica de la enfermedad. Se asignó a los pacientes en una proporción de 2:1 para recibir cabozantinib (140 mg por día) o placebo. No se permitió que los pacientes que recibieron placebo pasaran al grupo de cabozantinib. El criterio principal de valoración del estudio fue la SSP; y los criterios adicionales fueron la tasa de respuesta, la SG y la inocuidad.[12][Nivel de evidencia B1]
- Se calculó una mediana de SSP de 11,2 meses en el grupo de cabozantinib y de 4,0 meses en el grupo de placebo (CRI, 0,28; IC 95 %, 0,19‒0,40; P < 0,001). Se observaron diferencias en la SSP de todos los subgrupos y estas fueron independientes del tratamiento previo con inhibidores de tirosina–cinasas y con el estado de la variante patogénica de RET.
- Durante un análisis intermedio planificado de la SG, no se observó una diferencia estadísticamente significativa entre los dos grupos (CRI, 0,98; IC 95 %, 0,63‒1,52).
- La tasa de respuesta objetiva fue del 28 % en el grupo de cabozantinib (todas respuestas parciales) y del 0 % en el grupo de placebo (P < 0,001). Se calculó una mediana de duración de la respuesta de 14,6 meses (IC 95 %, 11,1‒17,5 meses). Se observaron respuestas sin importar el estado de la variante patogénica de RET.
- Los efectos adversos más comunes relacionados con el cabozantinib (todos los grados) fueron diarrea (63,1%) eritrodisestesia palmoplantar (50 %), pérdida de peso (47,7 %), disminución del apetito (45,8 %), náuseas (43 %) y fatiga (40,7%).
- Los efectos adversos de grado 3 o 4 se notificaron en el 69 % de los pacientes en el grupo de cabozantinib y el 33 % de los pacientes en el grupo de placebo.
- Los efectos adversos provocaron la interrupción del tratamiento en el 16 % de los pacientes tratados con cabozantinib y el 8 % de los pacientes que recibieron placebo.
Inhibidores de la cinasa RET
Selpercatinib
El selpercatinib es un inhibidor de la cinasa RET de molécula pequeña, muy selectivo y activo por vía oral.
Evidencia (selpercatinib):
- En un ensayo de fase I/II (LIBRETTO-001 [NCT03157128]), se evaluó la inocuidad y eficacia del selpercatinib en pacientes adolescentes y adultos con cualquier tipo de tumor sólido que albergara una alteración activadora en RET. El criterio principal de valoración fue la respuesta objetiva (completa o parcial). En el ensayo, se inscribió a 55 pacientes de CTM con alteración de RET que se habían tratado antes con vandetanib, cabozantinib, o ambos; y a 88 pacientes de CTM con alteración de RET que no se habían tratado antes con vandetanib o cabozantinib. De los pacientes tratados antes, el 82 % recibieron la dosis recomendada de la fase II de 160 mg 2 veces por día y de los pacientes que no se habían tratado antes y el 98 % recibieron la dosis de 160 mg 2 veces por día.[13]
- En los pacientes de CTM con alteración de RET que se habían tratado antes con vandetanib o cabozantinib se observaron los siguientes resultados:
- La tasa de respuesta objetiva fue del 69 % (IC 95 %, 55−81 %); de estos pacientes, el 9 % tuvo una respuesta completa y el 60 % tuvo una respuesta parcial.
- Al cabo de 1 año, el 86 % de las respuestas se mantuvieron (IC 95 %, 67−95 %) y el 100 % de los pacientes no presentó progresión.
- En los pacientes de CTM con alteración de RET que no se habían tratado antes con vandetanib o cabozantinib:
- La tasa de respuesta objetiva fue del 73 % (IC 95 %, 62−82 %); de estos pacientes, el 11 % tuvo una respuesta completa y el 61 % tuvo una respuesta parcial.[13][Nivel de evidencia C2]
- Al cabo de 1 año, el 91 % de las respuestas se mantuvieron (IC 95 %, 72−97 %), y el 92 % de los pacientes no presentaron progresión.
- Se presentaron efectos adversos relacionados con el tratamiento (cualquier grado) en el 94 % de los pacientes.
- Se observaron efectos adversos de grado 3 en el 28 % de los pacientes y de grado 4 en el 2 % de los pacientes.
- Los efectos adversos más frecuentes fueron boca seca (46 %), hipertensión (43 %), diarrea (38 %), fatiga (38 %), elevación de la concentración de aspartato–aminotransferasa (35 %), náusea (35 %) y estreñimiento (35 %).
- Se redujo la dosis en el 30 % de los pacientes debido a los efectos adversos relacionados con el tratamiento y se interrumpió el medicamento en el 2 % de los pacientes a causa de los efectos adversos.
- En los pacientes de CTM con alteración de RET que se habían tratado antes con vandetanib o cabozantinib se observaron los siguientes resultados:
Quimioterapia paliativa
Se notificó que la quimioterapia paliativa produce respuestas ocasionales en pacientes con enfermedad metastásica.[14-17] No hay monoterapias farmacológicas que se puedan considerar estándar. Algunos pacientes con metástasis a distancia presentarán una supervivencia prolongada y es posible controlarlos de manera expectante hasta que se tornen sintomáticos.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Lips CJ, Landsvater RM, Höppener JW, et al.: Clinical screening as compared with DNA analysis in families with multiple endocrine neoplasia type 2A. N Engl J Med 331 (13): 828-35, 1994. [PUBMED Abstract]
- Decker RA, Peacock ML, Borst MJ, et al.: Progress in genetic screening of multiple endocrine neoplasia type 2A: is calcitonin testing obsolete? Surgery 118 (2): 257-63; discussion 263-4, 1995. [PUBMED Abstract]
- Soh EY, Clark OH: Surgical considerations and approach to thyroid cancer. Endocrinol Metab Clin North Am 25 (1): 115-39, 1996. [PUBMED Abstract]
- Giuffrida D, Gharib H: Current diagnosis and management of medullary thyroid carcinoma. Ann Oncol 9 (7): 695-701, 1998. [PUBMED Abstract]
- Carling T, Udelsman R: Thyroid tumors. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1457-72.
- Saad MF, Ordonez NG, Rashid RK, et al.: Medullary carcinoma of the thyroid. A study of the clinical features and prognostic factors in 161 patients. Medicine (Baltimore) 63 (6): 319-42, 1984. [PUBMED Abstract]
- Bergholm U, Bergström R, Ekbom A: Long-term follow-up of patients with medullary carcinoma of the thyroid. Cancer 79 (1): 132-8, 1997. [PUBMED Abstract]
- Colson YL, Carty SE: Medullary thyroid carcinoma. Am J Otolaryngol 14 (2): 73-81, 1993 Mar-Apr. [PUBMED Abstract]
- Moley JF, DeBenedetti MK: Patterns of nodal metastases in palpable medullary thyroid carcinoma: recommendations for extent of node dissection. Ann Surg 229 (6): 880-7; discussion 887-8, 1999. [PUBMED Abstract]
- Brierley JD, Tsang RW: External radiation therapy in the treatment of thyroid malignancy. Endocrinol Metab Clin North Am 25 (1): 141-57, 1996. [PUBMED Abstract]
- Wells SA, Robinson BG, Gagel RF, et al.: Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: a randomized, double-blind phase III trial. J Clin Oncol 30 (2): 134-41, 2012. [PUBMED Abstract]
- Elisei R, Schlumberger MJ, Müller SP, et al.: Cabozantinib in progressive medullary thyroid cancer. J Clin Oncol 31 (29): 3639-46, 2013. [PUBMED Abstract]
- Wirth LJ, Sherman E, Robinson B, et al.: Efficacy of Selpercatinib in RET-Altered Thyroid Cancers. N Engl J Med 383 (9): 825-835, 2020. [PUBMED Abstract]
- Shimaoka K, Schoenfeld DA, DeWys WD, et al.: A randomized trial of doxorubicin versus doxorubicin plus cisplatin in patients with advanced thyroid carcinoma. Cancer 56 (9): 2155-60, 1985. [PUBMED Abstract]
- De Besi P, Busnardo B, Toso S, et al.: Combined chemotherapy with bleomycin, adriamycin, and platinum in advanced thyroid cancer. J Endocrinol Invest 14 (6): 475-80, 1991. [PUBMED Abstract]
- Wu LT, Averbuch SD, Ball DW, et al.: Treatment of advanced medullary thyroid carcinoma with a combination of cyclophosphamide, vincristine, and dacarbazine. Cancer 73 (2): 432-6, 1994. [PUBMED Abstract]
- Orlandi F, Caraci P, Berruti A, et al.: Chemotherapy with dacarbazine and 5-fluorouracil in advanced medullary thyroid cancer. Ann Oncol 5 (8): 763-5, 1994. [PUBMED Abstract]
Cáncer de tiroides anaplásico
Características clínicas y pronóstico
El carcinoma indiferenciado (anaplásico) es un tipo de cáncer de tiroides muy maligno. Crece con rapidez y se disemina a estructuras fuera de la tiroides. De manera característica se manifiesta como una masa dura, mal definida que a menudo se extiende a las estructuras que rodean la tiroides. El cáncer de tiroides anaplásico se debe diferenciar muy bien de un linfoma porque tienen una presentación clínica similar. Este tumor se suele presentar en un grupo de edad más avanzada y se caracteriza por invasión local extensa y progresión rápida.[1]
Los pacientes con este tumor presentan tasas de supervivencia a 5 años precarias. La muerte suele ocurrir debido a cáncer local incontrolado en el cuello; a menudo, pocos meses después del diagnóstico.
Información sobre los estadios del cáncer de tiroides anaplásico
Se considera que todos los pacientes con cáncer de tiroides anaplásico tienen enfermedad en estadio IV.
| Estadio | TbNM | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Thyroid--Differentiated and Anaplastic Carcinoma. En: Amin, MB, Edge Sb, Greene FL et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 873–90. | |||
| bTodas las categorías se pueden subdividir en: (s) tumor solitario y (m) tumor multifocal (el tumor más grande determina la clasificación). | |||
| IVA | T1–T3a, N0/NX, M0 | T1 = tumor que mide ≤2 cm en su mayor dimensión y se limita a la tiroides. |
 |
| –T1a = tumor que mide ≤1 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1b = tumor que mide >1 cm, pero menos ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión y se limita a la tiroides. | |||
| T3 = tumor que mide >4 cm y se limita a la tiroides, o diseminación extratiroidea macroscópica con invasión solo de los músculos infrahioideos. | |||
| –T3a = tumor que mide >4 cm y se limita a la tiroides. | |||
| NX = ganglios linfáticos regionales no evaluables. | |||
| N0 = sin indicios de metástasis en ganglios linfáticos locorregionales. | |||
| M0 = sin metástasis a distancia. | |||
| IVB | T1–T3a, N1, M0 | T1 = tumor que mide ≤2 cm en su mayor dimensión y se limita a la tiroides. |
 |
| –T1a = tumor que mide ≤1 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1b = tumor que mide >1 cm, pero menos ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión y se limita a la tiroides. | |||
| T3 = tumor que mide >4 cm y se limita a la tiroides, o diseminación extratiroidea macroscópica con invasión solo de los músculos infrahioideos. | |||
| –T3a = tumor que mide >4 cm y se limita a la tiroides. | |||
| N1 = metástasis en ganglios linfáticos regionales. | |||
| –N1a = metástasis en ganglios linfáticos de los grupos VI o VII (pretraqueales, paratraqueales o prelaríngeos/délficos, o mediastínicos superiores). La enfermedad puede ser unilateral o bilateral. | |||
| –N1b = metástasis en ganglios linfáticos cervicales unilaterales, bilaterales o contralaterales (grupos I, II, III, IV o V) o ganglios linfáticos retrofaríngeos. | |||
| M0 = sin metástasis a distancia. | |||
| T3b, cualquier N, M0 | –T3b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión solo de los músculos infrahioideos (músculos esternohioideo, esternotiroideo, tirohioideo u omohioideo). | ||
| NX = ganglios linfáticos regionales no evaluables. | |||
| N0 = sin indicios de metástasis en ganglios linfáticos locorregionales. | |||
| –N0a = uno o más ganglios linfáticos benignos según confirmación citológica o histológica. | |||
| –N0b = sin indicios radiológicos o clínicos de metástasis en ganglios linfáticos locorregionales. | |||
| N1 = metástasis en ganglios linfáticos regionales. | |||
| –N1a = metástasis en ganglios linfáticos de los grupos VI o VII (pretraqueales, paratraqueales o prelaríngeos/délficos, o mediastínicos superiores). La enfermedad puede ser unilateral o bilateral. | |||
| –N1b = metástasis en ganglios linfáticos cervicales unilaterales, bilaterales o contralaterales (grupos I, II, III, IV o V) o ganglios linfáticos retrofaríngeos. | |||
| M0 = sin metástasis a distancia. | |||
| T4, cualquier N, M0 | T4 = incluye la diseminación extratiroidea macroscópica más allá de los músculos infrahioideos. | ||
| –T4a = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión de los tejidos blandos subcutáneos, la laringe, la tráquea, el esófago o el nervio laríngeo recurrente. | |||
| –T4b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión de la fascia prevertebral, o atrapamiento de la arteria carótida o los vasos mediastínicos. | |||
| Cualquier N = consultar las descripciones en este cuadro en el estadio IVB, T3b, cualquier N, M0. | |||
| M0 = sin metástasis a distancia. | |||
| IVC | Cualquier T, cualquier N, M1 | TX = tumor primario no evaluable. |
 |
| T0 = sin indicios de tumor primario. | |||
| T1 = tumor que mide ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1a = tumor que mide ≤1 cm en su mayor dimensión y se limita a la tiroides. | |||
| –T1b = tumor que mide >1 cm, pero menos ≤2 cm en su mayor dimensión y se limita a la tiroides. | |||
| T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión y se limita a la tiroides. | |||
| T3 = tumor que mide >4 cm y se limita a la tiroides, o diseminación extratiroidea macroscópica con invasión solo de los músculos infrahioideos. | |||
| –T3a = tumor que mide >4 cm y se limita a la tiroides. | |||
| –T3b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión solo de los músculos infrahioideos (músculos esternohioideo, esternotiroideo, tirohioideo u omohioideo). | |||
| T4 = incluye la diseminación extratiroidea macroscópica más allá de los músculos infrahioideos. | |||
| –T4a = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión de los tejidos blandos subcutáneos, la laringe, la tráquea, el esófago o el nervio laríngeo recurrente. | |||
| –T4b = tumor de cualquier tamaño con diseminación extratiroidea macroscópica e invasión de la fascia prevertebral, o atrapamiento de la arteria carótida o los vasos mediastínicos. | |||
| Cualquier N = consultar las descripciones en este cuadro en el estadio IVB, T3b, cualquier N, M0. | |||
| M1 = metástasis a distancia. | |||
Opciones de tratamiento del cáncer de tiroides anaplásico
Las opciones de tratamiento del cáncer de tiroides anaplásico son las siguientes:
Cirugía
Si la enfermedad está localizada, lo que es muy infrecuente, se justifica la tiroidectomía total con el fin de reducir los síntomas causados por la masa tumoral.[2,3] Con frecuencia, se necesita una traqueostomía.
Radioterapia de haz externo
La radioterapia de haz externo (RHE) a veces se usa en los pacientes que no son aptos para someterse a cirugía, o cuyos tumores no se pueden extirpar mediante cirugía.
Terapia sistémica
El cáncer de tiroides anaplásico no responde a la terapia con yodo I 131. Se informó que el tratamiento de monoterapia con fármacos anticancerosos produce remisión parcial en algunos pacientes. Casi el 30 % de los pacientes logran remisión parcial con la doxorrubicina.[4] La combinación de doxorrubicina con cisplatino es más activa que la doxorrubicina sola y produjo un mayor número de respuestas completas.[5]
La combinación de quimioterapia y radioterapia después de una resección completa quizás prolongue la supervivencia de algunos pacientes, pero esta combinación de tratamiento no se ha comparado con ningún otro tratamiento por sí solo.[6,7]
Se calcula que el 25 % de los pacientes con cánceres de tiroides anaplásicos tienen la variante activadora BRAF (V600E).[8]
Evidencia (dabrafenib y trametinib):
- En un ensayo de fase II sobre los inhibidores de BRAF y MEK, dabrafenib y trametinib, se incluyó a 16 pacientes de cáncer de tiroides anaplásico con una variante BRAF V600E.[9][Nivel de evidencia C2]
- La tasa de respuesta general confirmada fue del 69 %. La mediana de duración de la respuesta, la supervivencia sin progresión (SSP) y la supervivencia general (SG) no se alcanzaron.
- Los cálculos a los 12 meses fueron los siguientes: un 90 % de duración de respuesta, un 79 % de SSP y un 80 % de SG.
A partir de estos datos, la Administración de Alimentos y Medicamentos de los Estados Unidos aprobó la combinación de dabrafenib y trametinib para el tratamiento del cáncer de tiroides anaplásico irresecable o metastásico con una variante BRAF V600E. Se recomienda hacer pruebas moleculares para identificar esta variante BRAF V600E en los pacientes con cáncer de tiroides anaplásico.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Neff RL, Farrar WB, Kloos RT, et al.: Anaplastic thyroid cancer. Endocrinol Metab Clin North Am 37 (2): 525-38, xi, 2008. [PUBMED Abstract]
- Goldman JM, Goren EN, Cohen MH, et al.: Anaplastic thyroid carcinoma: long-term survival after radical surgery. J Surg Oncol 14 (4): 389-94, 1980. [PUBMED Abstract]
- Aldinger KA, Samaan NA, Ibanez M, et al.: Anaplastic carcinoma of the thyroid: a review of 84 cases of spindle and giant cell carcinoma of the thyroid. Cancer 41 (6): 2267-75, 1978. [PUBMED Abstract]
- Carling T, Udelsman R: Thyroid tumors. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1457-72.
- Shimaoka K, Schoenfeld DA, DeWys WD, et al.: A randomized trial of doxorubicin versus doxorubicin plus cisplatin in patients with advanced thyroid carcinoma. Cancer 56 (9): 2155-60, 1985. [PUBMED Abstract]
- Haigh PI, Ituarte PH, Wu HS, et al.: Completely resected anaplastic thyroid carcinoma combined with adjuvant chemotherapy and irradiation is associated with prolonged survival. Cancer 91 (12): 2335-42, 2001. [PUBMED Abstract]
- De Crevoisier R, Baudin E, Bachelot A, et al.: Combined treatment of anaplastic thyroid carcinoma with surgery, chemotherapy, and hyperfractionated accelerated external radiotherapy. Int J Radiat Oncol Biol Phys 60 (4): 1137-43, 2004. [PUBMED Abstract]
- Forbes SA, Beare D, Boutselakis H, et al.: COSMIC: somatic cancer genetics at high-resolution. Nucleic Acids Res 45 (D1): D777-D783, 2017. [PUBMED Abstract]
- Subbiah V, Kreitman RJ, Wainberg ZA, et al.: Dabrafenib and Trametinib Treatment in Patients With Locally Advanced or Metastatic BRAF V600-Mutant Anaplastic Thyroid Cancer. J Clin Oncol 36 (1): 7-13, 2018. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (05/14/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este resumen.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de tiroides en adultos. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de tiroides son:
- Andrea Bonetti, MD (Pederzoli Hospital)
- Minh Tam Truong, MD (Boston University Medical Center)
- Jaydira del Rivero, MD (National Cancer Institute)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de tiroides. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/tiroides/pro/tratamiento-tiroides-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.