Tratamiento del cáncer de esófago (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer de esófago
La mayoría de las neoplasias malignas de esófago pertenecen a dos tipos histológicos: adenocarcinoma y carcinoma de células escamosas. Los adenocarcinomas por lo general surgen en la parte inferior del esófago, mientras que el carcinoma de células escamosas se puede presentar en todo el esófago. Las características epidemiológicas de estos dos tipos son muy diferentes.
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por cáncer de esófago en los Estados Unidos para 2025:[1]
- Casos nuevos: 22 070.
- Defunciones: 16 250.
La incidencia de cáncer de esófago ha aumentado en las últimas décadas, lo que coincide con un cambio en el tipo histológico y la ubicación del tumor primario. En todo el mundo, el carcinoma de células escamosas es el tipo histológico predominante, e históricamente fue el más prevalente en los Estados Unidos. Sin embargo, la incidencia del adenocarcinoma ha aumentado de modo notable durante las últimas décadas y ahora es más prevalente que el carcinoma de células escamosas en los Estados Unidos y Europa occidental.[2-4] La incidencia de adenocarcinoma ha aumentado, sobre todo en los hombres blancos.[5] En los Estados Unidos, la mediana de edad de los pacientes que presentan cáncer de esófago es de 68 años.[6] La mayoría de los adenocarcinomas se localizan en el esófago distal. Se desconocen las causas de este aumento en la incidencia y de los cambios demográficos observados.
Características anatómicas
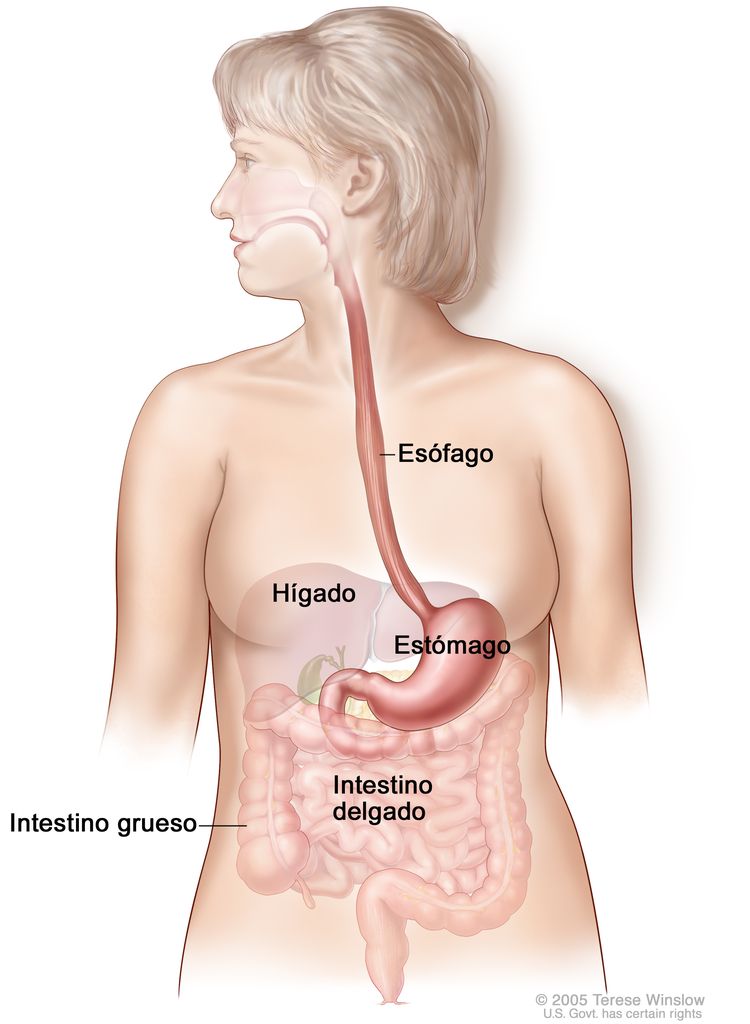
El esófago es un conducto por donde los alimentos pasan al tubo gastrointestinal. El esófago se extiende desde la laringe hasta el estómago y se ubica en el mediastino posterior dentro del tórax en estrecha proximidad con la pleura pulmonar, el peritoneo, el pericardio y el diafragma. En la cavidad abdominal, el esófago hace un giro brusco y se conecta con en el estómago. El esófago, el segmento más muscular del aparato digestivo, se compone de capas musculares circulares internas y longitudinales externas. El esfínter del músculo cricofaríngeo controla el funcionamiento de la parte superior del esófago y el esfínter gastroesofágico controla el funcionamiento de la parte inferior. El esófago tiene una amplia red de canales linfáticos concentrada en la lámina propia y la submucosa que fluye de manera longitudinal por la submucosa.
Por convención, los tumores de esófago se describen en términos de la distancia desde los incisivos hasta el borde superior del tumor. Cuando se mide por vía endoscópica, el esófago mide (desde los incisivos) de 30 cm a 40 cm. El esófago se divide en cuatro segmentos principales:
- Esófago cervical (~15 a 20 cm desde los incisivos).
- Esófago torácico superior (~20 a 25 cm desde los incisivos).
- Esófago torácico medio (~25 a 30 cm desde los incisivos).
- Esófago torácico inferior y unión gastroesofágica (~30 a 40 cm desde los incisivos).
Factores de riesgo
Los factores de riesgo del carcinoma de células escamosas de esófago son los siguientes:
- Consumo de tabaco.
- Consumo de bebidas alcohólicas.
Los factores de riesgo relacionados con el adenocarcinoma de esófago son menos claros.[3] El esófago de Barrett es una excepción, su presencia se vincula con aumento del riesgo de adenocarcinoma de esófago. El reflujo crónico se considera la causa principal de la metaplasia de Barrett. En los resultados de un estudio poblacional de casos y controles realizado en Suecia se indica claramente que el reflujo gastroesofágico sintomático es un factor de riesgo de adenocarcinoma de esófago. La frecuencia, gravedad y duración de los síntomas de reflujo tienen una correlación positiva con el aumento en el riesgo de adenocarcinoma de esófago.[7] Para obtener más información, consultar Prevención del cáncer de esófago.
Factores pronósticos
Los factores pronósticos favorables son los siguientes:
- Enfermedad en estadio temprano.
- Resección completa.
Los pacientes con esófago de Barrett que tienen displasia grave en la mucosa distal, a menudo tienen cáncer in situ o cáncer invasivo circunscrito a la región displásica. Después de la resección, estos pacientes suelen tener un pronóstico excelente.[8]
En la mayoría de los casos, el cáncer de esófago es una enfermedad tratable, pero casi nunca es curable. La supervivencia relativa a 5 años es del 21,6 %. Los pacientes con enfermedad en un estadio temprano tienen mejor probabilidad de supervivencia, al 18,2 % de los pacientes se les diagnostica cáncer en estadio local y tienen una tasa de supervivencia relativa a 5 años del 48,1 %.[6]
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Brown LM, Devesa SS, Chow WH: Incidence of adenocarcinoma of the esophagus among white Americans by sex, stage, and age. J Natl Cancer Inst 100 (16): 1184-7, 2008. [PUBMED Abstract]
- Blot WJ, McLaughlin JK: The changing epidemiology of esophageal cancer. Semin Oncol 26 (5 Suppl 15): 2-8, 1999. [PUBMED Abstract]
- Schmassmann A, Oldendorf MG, Gebbers JO: Changing incidence of gastric and oesophageal cancer subtypes in central Switzerland between 1982 and 2007. Eur J Epidemiol 24 (10): 603-9, 2009. [PUBMED Abstract]
- Kubo A, Corley DA: Marked multi-ethnic variation of esophageal and gastric cardia carcinomas within the United States. Am J Gastroenterol 99 (4): 582-8, 2004. [PUBMED Abstract]
- National Cancer Institute: SEER Cancer Stat Facts: Esophageal Cancer. Bethesda, Md: National Cancer Institute. Available online. Last accessed February 7, 2025.
- Lagergren J, Bergström R, Lindgren A, et al.: Symptomatic gastroesophageal reflux as a risk factor for esophageal adenocarcinoma. N Engl J Med 340 (11): 825-31, 1999. [PUBMED Abstract]
- Reed MF, Tolis G, Edil BH, et al.: Surgical treatment of esophageal high-grade dysplasia. Ann Thorac Surg 79 (4): 1110-5; discussion 1110-5, 2005. [PUBMED Abstract]
Clasificación celular del cáncer de esófago
Los adenocarcinomas, que normalmente surgen en un esófago de Barrett, representan por lo menos el 50 % de las lesiones malignas; la incidencia de este tipo histológico parece estar en aumento. El esófago de Barrett contiene epitelio glandular en dirección cefálica a la unión esofagogástrica.
Se pueden observar tres tipos de epitelio glandular:
- Epitelio cilíndrico metaplásico.
- Epitelio glandular metaplásico de células parietales dentro de la pared esofágica.
- Epitelio intestinal metaplásico de células caliciformes típicas. Es más probable que la displasia se presente en una mucosa de tipo intestinal.
Alrededor del 30 % de los casos de cáncer de esófago en los Estados Unidos son carcinomas de células escamosas.[1]
Los tumores de estroma gastrointestinal a veces se presentan en el esófago y a menudo son benignos. Para obtener más información, consultar Tratamiento de los tumores de estroma gastrointestinal.
Bibliografía
- Howlader N, Noone AM, Krapcho M, et al.: SEER Cancer Statistics Review (CSR) 1975-2017. Bethesda, Md: National Cancer Institute, 2020. Available online. Last accessed February 7, 2025.
Información sobre los estadios del cáncer de esófago
Una de las principales dificultades para asignar y comparar las modalidades de tratamiento en pacientes con cáncer de esófago es la falta de una estadificación preoperatoria precisa. El estadio determina si la estrategia terapéutica se abordará con intención curativa o paliativa.
Evaluación para la estadificación
Las modalidades de estadificación no intervencionista estándar son las siguientes:
- Ecografía endoscópica.
- Tomografía computarizada (TC) del tórax y el abdomen.
- Tomografía por emisión de positrones (TEP) con TC.
La exactitud general de la estadificación según la profundidad tumoral es del 85 % al 90 % cuando se usa ecografía endoscópica en comparación con el 50 % al 80 % para la TC. La exactitud de la estadificación ganglionar regional es del 70 % al 80 % con ecografía endoscópica y del 50 % al 70 % con TC.[1,2]
En una serie retrospectiva se notificó el 93 % de sensibilidad y el 100 % de especificidad para la estadificación ganglionar regional mediante aspiración con aguja fina (AAF) guiada por ecografía endoscópica. El uso de la AAF guiada por ecografía endoscópica para la estadificación de ganglios linfáticos está en evaluación prospectiva.[3]
En algunos centros quirúrgicos, se utiliza toracoscopia y laparoscopia para la estadificación del cáncer de esófago.[4-6] En un ensayo intergrupal, se notificó un aumento de la detección de compromiso ganglionar en el 56 % de 107 pacientes evaluables cuando se usó una toracoscopia o laparoscopia en comparación con el 41 % (con el uso de pruebas de estadificación no intervencionistas; por ejemplo, TC, imágenes por resonancia magnética y ecografía endoscópica) sin que se notificaran complicaciones graves ni muertes.[7]
La TEP no intervencionista que se hace con el análogo de glucosa radiomarcada flúor F 18-fludesoxiglucosa (18F-FDG) para la estadificación preoperatoria del cáncer de esófago es más sensible que la TC o ecografía endoscópica para la detección de las metástasis a distancia. En un estudio reciente con 262 pacientes de cáncer de esófago resecable, se demostró la utilidad de la TEP con 18-FDG para detectar metástasis a distancia confirmadas en por lo menos el 4,8 % de los pacientes sometidos antes a una evaluación estándar.[8-12]
Sistema de estadificación del American Joint Committee on Cancer
El American Joint Committee on Cancer (AJCC) designó los estadios mediante la clasificación TNM (tumor, ganglio linfático y metástasis) para definir el cáncer de esófago y de unión esofagogástrica.[13] Los tumores localizados en el cardias gástrico a menos de 5 cm de la unión gastroesofágica, con diseminación al esófago o la unión gastroesofágica se clasifican como cáncer de esófago. Los tumores con un epicentro tumoral en el cardias gástrico a más de 5 cm de la unión gastroesofágica o sin diseminación al esófago se clasifican como cáncer de estómago.[13] Para obtener más información, consultar la sección Información sobre los estadios del cáncer de estómago en Tratamiento del cáncer de estómago.
La clasificación M1 para una enfermedad con compromiso ganglionar abdominal es polémica. La presencia de compromiso ganglionar abdominal no parece acarrear un pronóstico tan grave como las metástasis a órganos lejanos.[14] Los pacientes con linfadenopatías regionales o en el tronco celiaco no necesariamente tienen una enfermedad considerada irresecable debido a metástasis. Cuando se considera viable se intenta la resección completa del tumor primario y una linfadenectomía adecuada.
| Categoría y criterios T | Categoría y criterios N | Categoría y criterios M | Definición de G | Categoría y criterios Lb | |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; G = grado histológico; L = localización. | |||||
| aReproducción autorizada de AJCC: Esophageal and esophagogastric junction. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 185–202. | |||||
| bLa localización se define a partir de la posición del epicentro tumoral en el esófago. | |||||
| TX = tumor no evaluable. | NX = ganglios linfáticos regionales no evaluables. | M0 = sin metástasis a distancia. | GX = grado no evaluable. | X = localización desconocida. | |
| T0 = sin indicios de tumor primario. | N0 = sin metástasis en ganglios linfáticos regionales. | M1 = metástasis a distancia. | G1 = bien diferenciado. | Superior = del esófago cervical al borde caudal de la vena ácigos. | |
| Tis = displasia de grado alto, definida como células malignas confinadas al epitelio junto a la membrana basal. | N1 = metástasis en 1 o 2 ganglios linfáticos regionales. | G2 = moderadamente diferenciado. | Medio = del borde caudal de la vena ácigos al borde caudal de la vena pulmonar inferior. | ||
| G3 = pobremente diferenciado o indiferenciado. | Inferior = del borde caudal de la vena pulmonar inferior al estómago, incluso en la unión gastroesofágica. | ||||
| T1 = tumor con invasión de la lámina propia, la capa muscular de la mucosa o la submucosa. | N2 = metástasis en 3 a 6 ganglios linfáticos regionales. | ||||
| N3 = metástasis en 7 o más ganglios linfáticos regionales. | |||||
| T1a = tumor con invasión de la lámina propia o la capa muscular de la mucosa. | |||||
| T1b = tumor con invasión de la submucosa. | |||||
| T2 = tumor con invasión de la capa muscular propia. | |||||
| T3 = tumor con invasión de la capa adventicia. | |||||
| T4 = tumor con invasión de las estructuras adyacentes. | |||||
| T4a = tumor con invasión de la pleura, el pericardio, la vena ácigos, el diafragma o el peritoneo. | |||||
| T4b = tumor con invasión de otras estructuras adyacentes, como la aorta, el cuerpo vertebral o la vía aérea. | |||||
Estadificación del carcinoma de células escamosas de esófago
| Estadio | TNM | Grado | Localización del tumor | Descripción | Imagen |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; G = grado; L = localización; NA = no aplicable p = patológico. | |||||
| aReproducción autorizada de AJCC: Esophageal and esophagogastric junction. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 185–202. | |||||
| 0 | Tis, N0, M0 | No aplicable | Cualquiera | Tis = displasia de grado alto, definida como células malignas confinadas al epitelio junto a la membrana basal. |
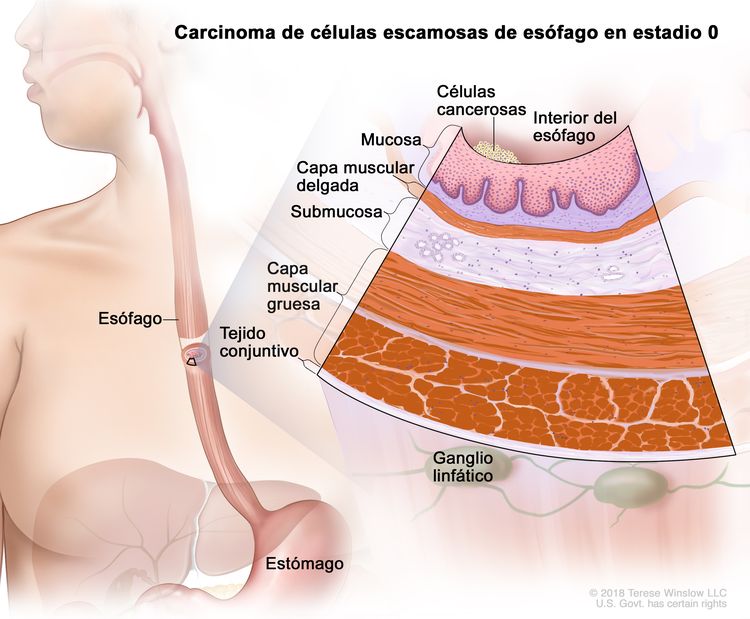 |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| G1 = NA. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| Estadio | TNM | Grado | Localización del tumor | Descripción | Imagen |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; G = grado; L = localización; p = patológico. | |||||
| aReproducción autorizada de AJCC: Esophageal and esophagogastric junction. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 185–202. | |||||
| IA | T1a, N0, M0 | G1 | Cualquiera | –T1a = tumor con invasión de la lámina propia o la capa muscular de la mucosa. |
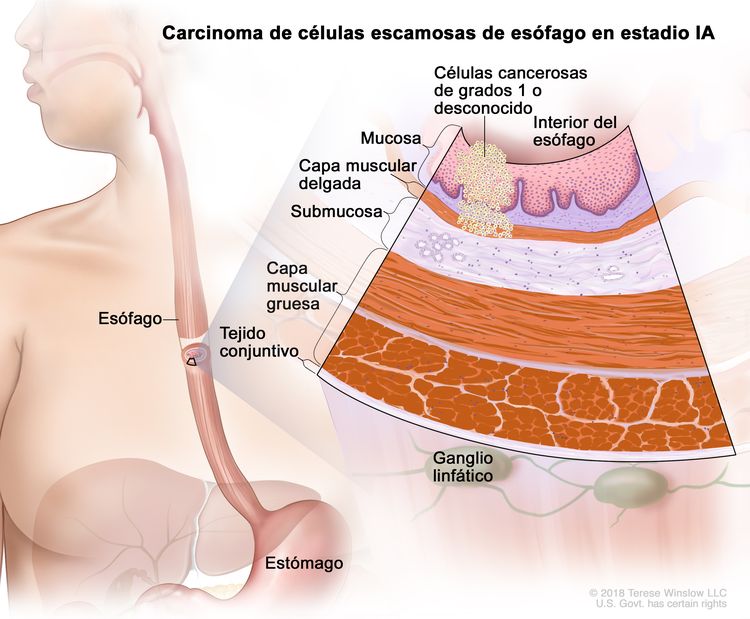 |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| G1 = bien diferenciado. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| T1a, N0, M0 | GX | Cualquiera | –T1a = tumor con invasión de la lámina propia o la capa muscular de la mucosa. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| GX = grado no evaluable. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| IB | T1a, N0, M0 | G2–G3 | Cualquiera | –T1a = tumor con invasión de la lámina propia o la capa muscular de la mucosa. |
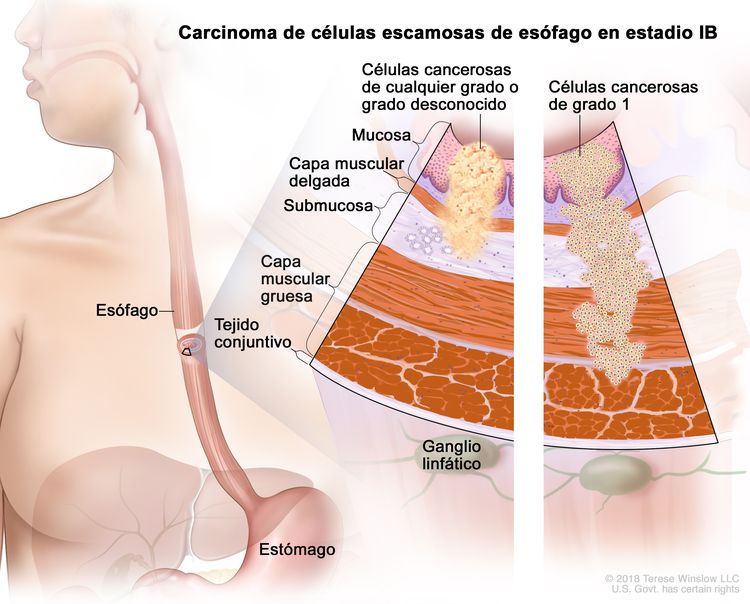 |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| G2 = moderadamente diferenciado. | |||||
| G3 = pobremente diferenciado o indiferenciado. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| T1b, N0, M0 | G1–G3 | Cualquiera | –T1b = tumor con invasión de la submucosa. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| G1 = bien diferenciado. | |||||
| G2 = moderadamente diferenciado. | |||||
| G3 = pobremente diferenciado o indiferenciado. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| T1b, N0, M0 | GX | Cualquiera | –T1b = tumor con invasión de la submucosa. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| GX = grado no evaluable. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| T2, N0, M0 | G1 | Cualquiera | T2 = tumor con invasión de la capa muscular propia. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| G1 = bien diferenciado. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| Estadio | TNM | Grado | Localización del tumorb | Descripción | Imagen |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; G = grado; L = localización; p = patológico. | |||||
| aReproducción autorizada de AJCC: Esophageal and esophagogastric junction. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 185–202. | |||||
| bLa localización se define a partir de la posición del epicentro tumoral en el esófago. | |||||
| IIA | T2, N0, M0 | GX | Cualquiera | T2 = tumor con invasión de la capa muscular propia. |
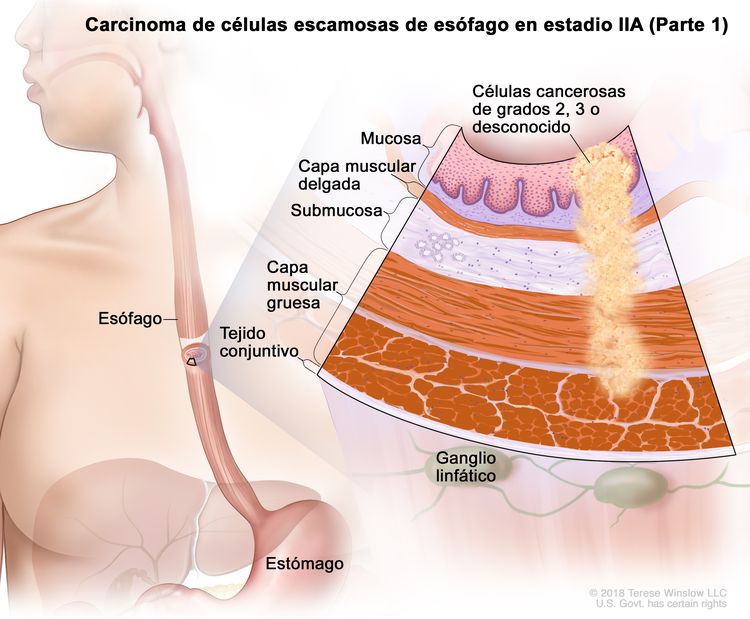 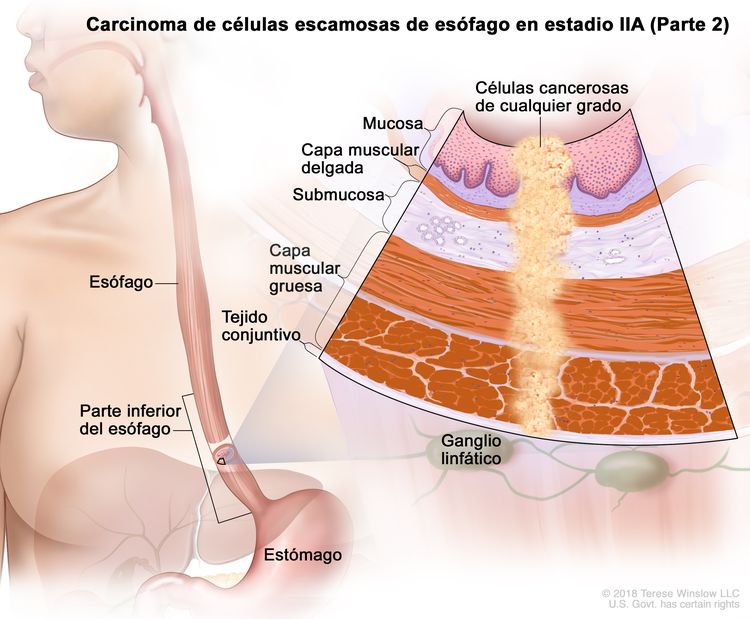 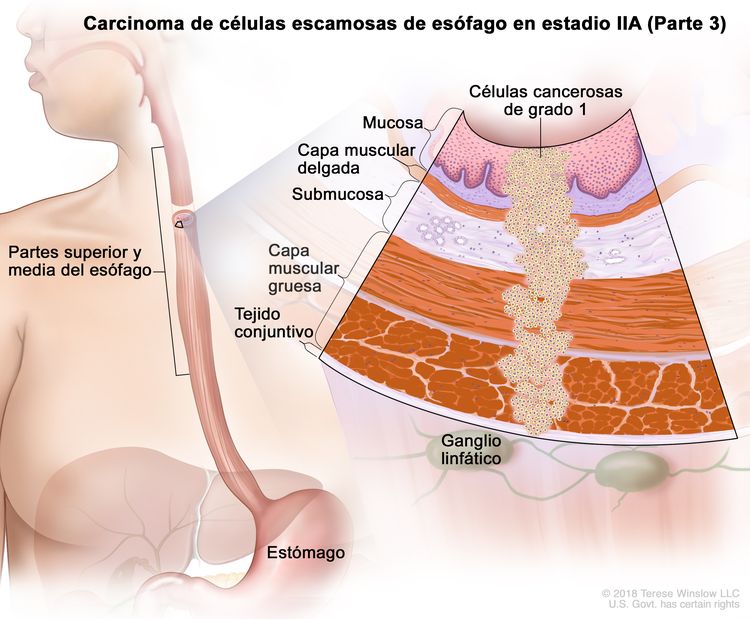 |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| GX = grado no evaluable. | |||||
| Cualquier L = consultar el Cuadro 1 | |||||
| T2, N0, M0 | G2–G3 | Cualquiera | T2 = tumor con invasión de la capa muscular propia. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| G2 = moderadamente diferenciado. | |||||
| G3 = pobremente diferenciado o indiferenciado. | |||||
| Cualquier L = consultar el Cuadro 1 | |||||
| T3, N0, M0 | Cualquiera | Inferior | T3 = tumor con invasión de la capa adventicia. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| Cualquier G = consultar el Cuadro 1. | |||||
| Inferior = del borde caudal de la vena pulmonar inferior al estómago, incluso en la unión gastroesofágica. | |||||
| T3, N0, M0 | G1 | Superior o medio | T3 = tumor con invasión de la capa adventicia. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| G1 = bien diferenciado. | |||||
| Superior = del esófago cervical al borde caudal de la vena ácigos. | |||||
| Medio = del borde caudal de la vena ácigos al borde caudal de la vena pulmonar inferior. | |||||
| IIB | T3, N0, M0 | G2–G3 | Superior o medio | T3 = tumor con invasión de la capa adventicia. |
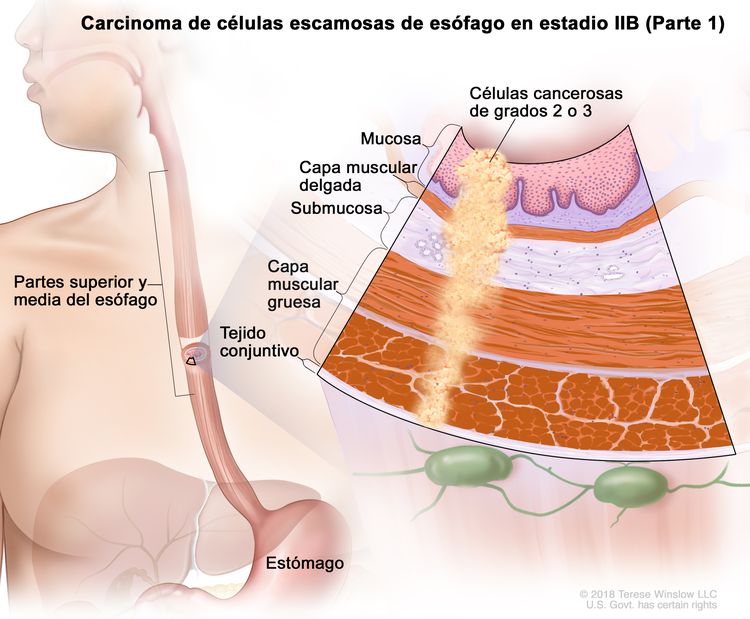 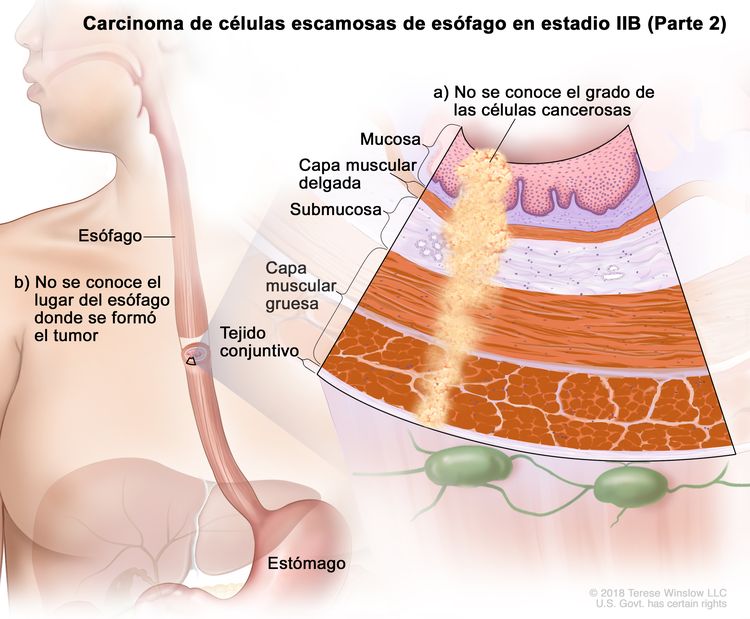  |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| G2 = moderadamente diferenciado. | |||||
| G3 = pobremente diferenciado o indiferenciado. | |||||
| Superior = del esófago cervical al borde caudal de la vena ácigos. | |||||
| Medio = del borde caudal de la vena ácigos al borde caudal de la vena pulmonar inferior. | |||||
| T3, N0, M0 | GX | Cualquiera | T3 = tumor con invasión de la capa adventicia. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| GX = grado no evaluable. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| T3, N0, M0 | Cualquiera | Localización X | T3 = tumor con invasión de la capa adventicia. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| Cualquier G = consultar el Cuadro 1. | |||||
| Localización X = desconocida. | |||||
| T1, N1, M0 | Cualquiera | Cualquiera | T1 = tumor con invasión de la lámina propia, la capa muscular de la mucosa o la submucosa. | ||
| N1 = metástasis en 1 o 2 ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| Cualquier G = consultar el Cuadro 1. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| Estadio | TNM | Grado | Localización del tumorb | Descripción | Imagen |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; G = grado; L = localización; p = patológico. | |||||
| aReproducción autorizada de AJCC: Esophageal and esophagogastric junction. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 185–202. | |||||
| bLa localización se define a partir de la posición del epicentro tumoral en el esófago. | |||||
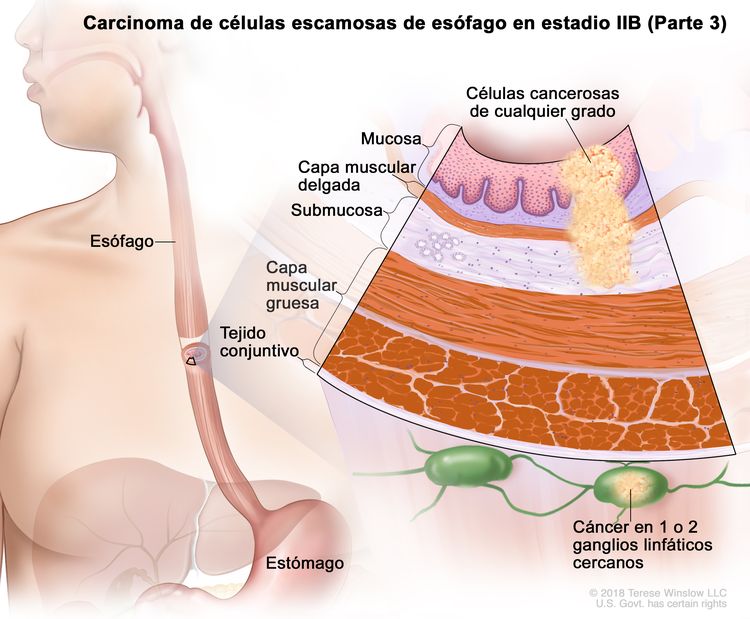
| IIIA | T1, N2, M0 | Cualquiera | Cualquiera | T1 = tumor con invasión de la lámina propia, la capa muscular de la mucosa o la submucosa. |
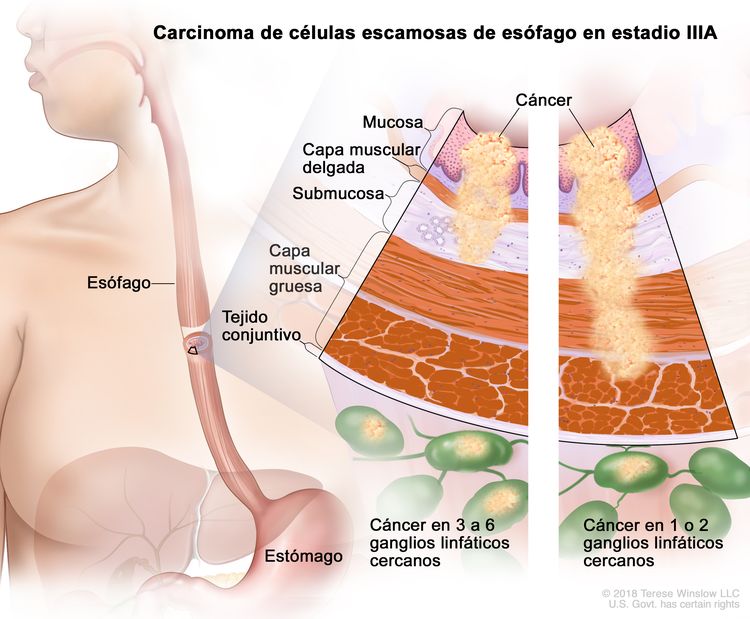 |
| –T1a = tumor con invasión de la lámina propia o la capa muscular de la mucosa. | |||||
| –T1b = tumor con invasión de la submucosa. | |||||
| N2 = metástasis en 3 a 6 ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| Cualquier G = consultar el Cuadro 1. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| T2, N1, M0 | Cualquiera | Cualquiera | T2 = tumor con invasión de la capa muscular propia. | ||
| N1 = metástasis en 1 o 2 ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| Cualquier G = consultar el Cuadro 1. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| IIIB | T2, N2, M0 | Cualquiera | Cualquiera | T2 = tumor con invasión de la capa muscular propia. |
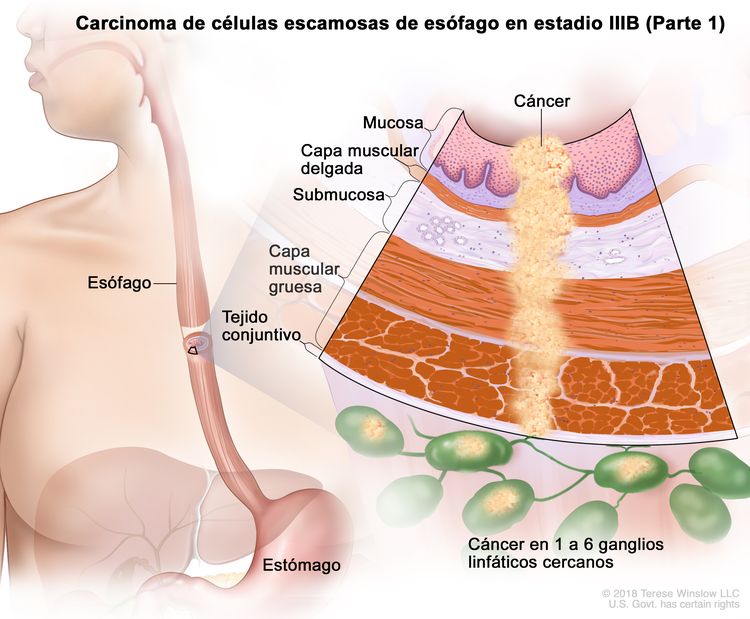 |
| N2 = metástasis en 3 a 6 ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| Cualquier G = consultar el Cuadro 1. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| T3, N1–N2, M0 | Cualquiera | Cualquiera | T3 = tumor con invasión de la capa adventicia. | ||
| N1 = metástasis en 1 o 2 ganglios linfáticos regionales. | |||||
| N2 = metástasis en 3 a 6 ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| Cualquier G = consultar el Cuadro 1. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| T4a, N0–1, M0 | Cualquiera | Cualquiera | –T4a = tumor con invasión de la pleura, el pericardio, la vena ácigos, el diafragma o el peritoneo. |
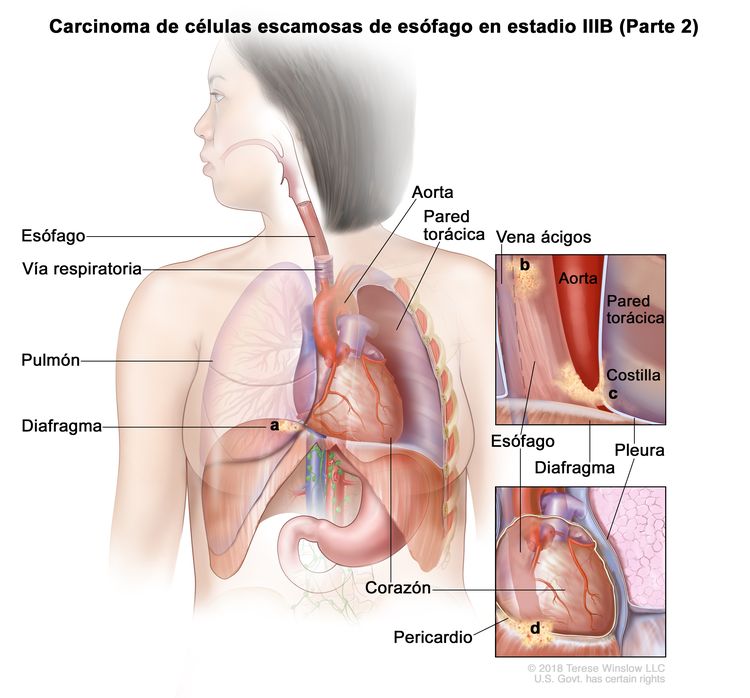 |
|
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| N1 = metástasis en 1 o 2 ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| Cualquier G = consultar el Cuadro 1. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| Estadio | TNM | Grado | Localización del tumorb | Descripción | Imagen |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; G = grado; L = localización; p = patológico. | |||||
| aReproducción autorizada de AJCC: Esophageal and esophagogastric junction. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 185–202. | |||||
| bLa localización se define a partir de la posición del epicentro tumoral en el esófago. | |||||
| IVA | T4a, N2, M0 | Cualquiera | Cualquiera | –T4a = tumor con invasión de la pleura, el pericardio, la vena ácigos, el diafragma o el peritoneo. |
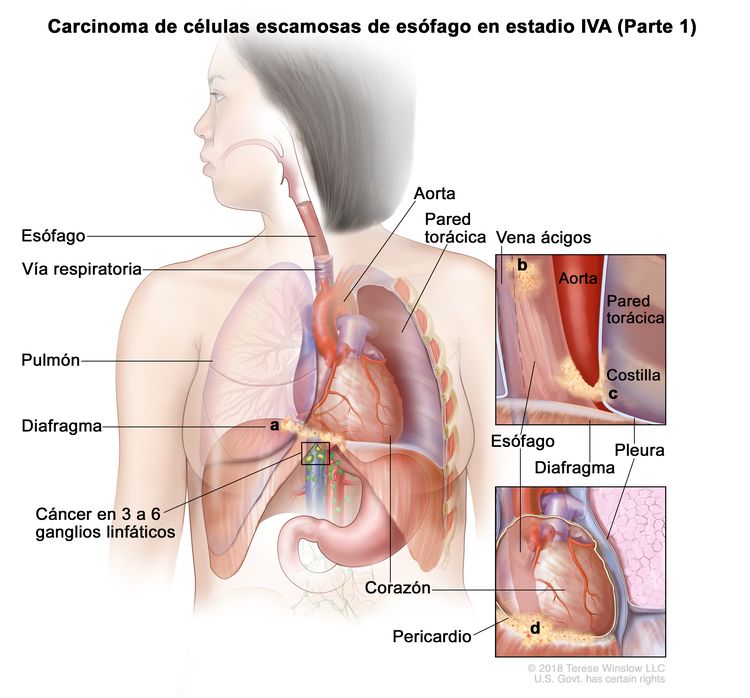 |
| N2 = metástasis en 3 a 6 ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| Cualquier G = consultar el Cuadro 1. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| T4b, N0–2, M0 | Cualquiera | Cualquiera | –T4b = tumor con invasión de otras estructuras adyacentes, como la aorta, el cuerpo vertebral o la vía aérea. |
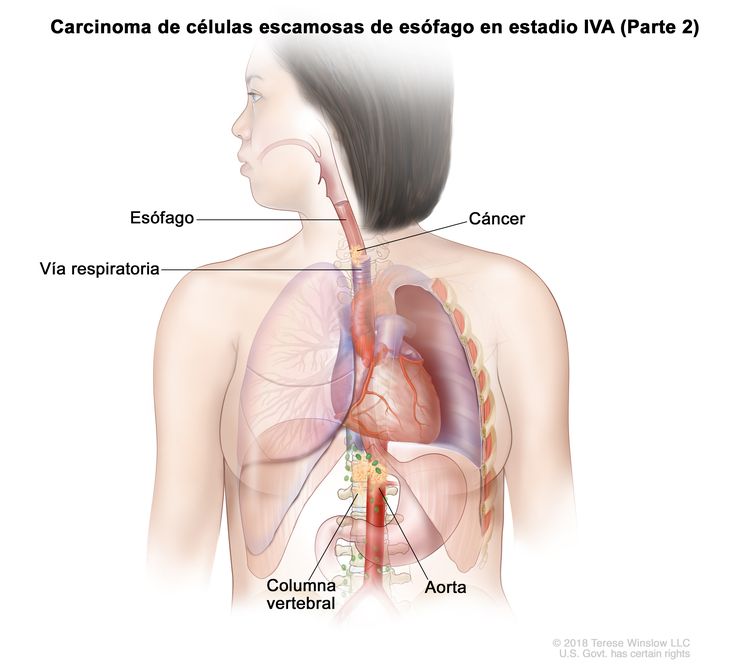 |
|
| N0 = sin metástasis en ganglios linfáticos regionales. | |||||
| N1 = metástasis en 1 o 2 ganglios linfáticos regionales. | |||||
| N2 = metástasis en 3 a 6 ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| Cualquier G = consultar el Cuadro 1. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| Cualquier T, N3, M0 | Cualquiera | Cualquiera | Cualquier T = consultar el Cuadro 1. |
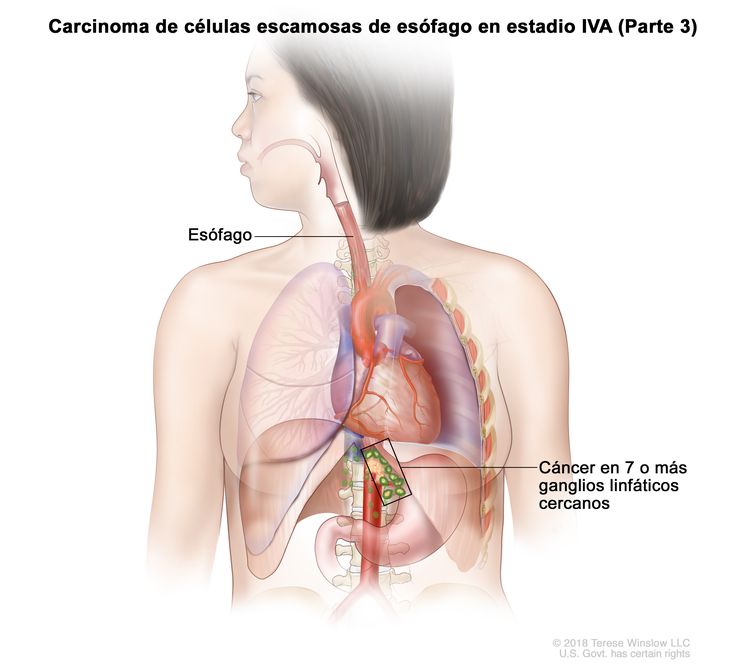 |
|
| N3 = metástasis en 7 o más ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| Cualquier G = consultar el Cuadro 1. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
| IVB | Cualquier T, cualquier N, M1 | Cualquiera | Cualquiera | Cualquier T = consultar el Cuadro 1. |
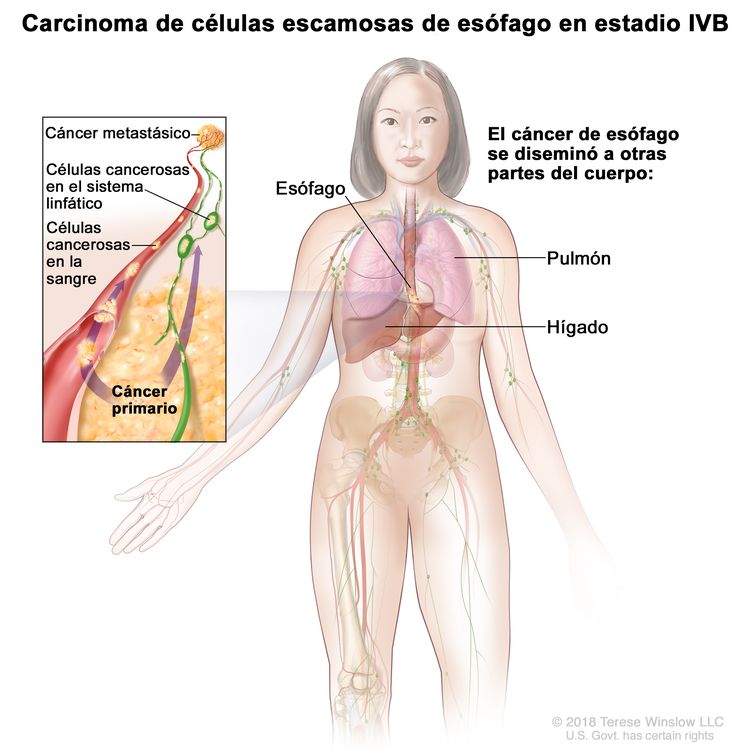 |
| Cualquier N = consultar el Cuadro 1. | |||||
| M1 = metástasis a distancia. | |||||
| Cualquier G = consultar el Cuadro 1. | |||||
| Cualquier L = consultar el Cuadro 1. | |||||
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Estadificación del adenocarcinoma de esófago
| Estadio | TNM | Grado | Descripción | Imagen |
|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; G = grado; p = patológico. | ||||
| aReproducción autorizada de AJCC: Esophageal and esophagogastric junction. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 185–202. | ||||
| 0 | Tis, N0, M0 | No aplicable | Tis = displasia de grado alto, definida como células malignas confinadas al epitelio junto a la membrana basal. |
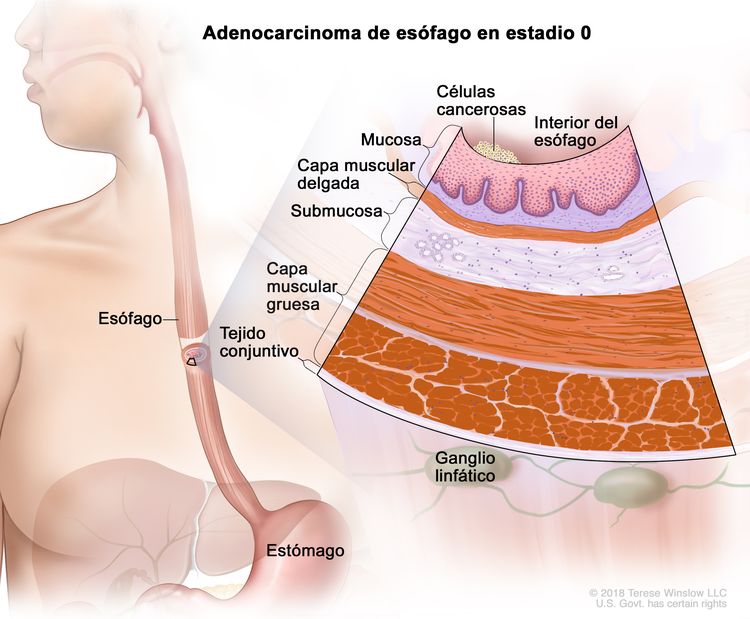 |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| Estadio | TNM | Grado | Descripción | Imagen |
|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; G = grado; p = patológico. | ||||
| aReproducción autorizada de AJCC: Esophageal and esophagogastric junction. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 185–202. | ||||
| IA | T1a, N0, M0 | G1 | –T1a = tumor con invasión de la lámina propia o la capa muscular de la mucosa. |
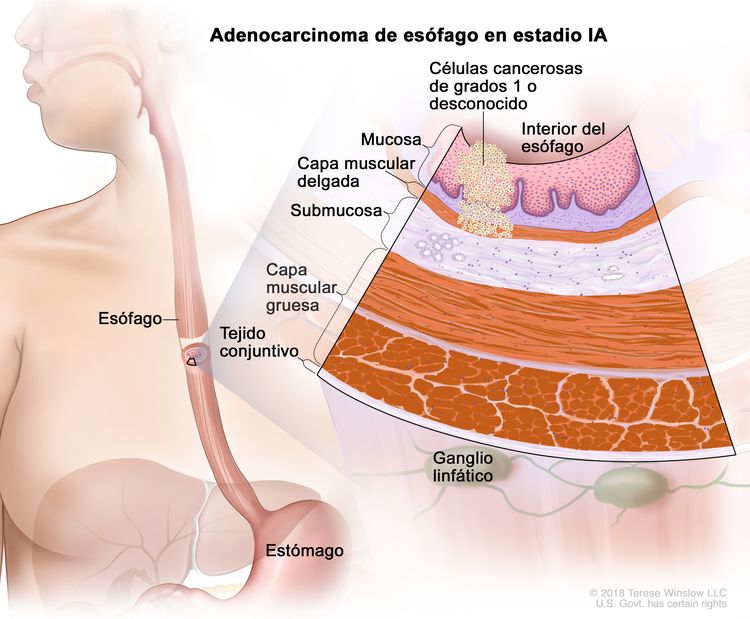 |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| G1 = bien diferenciado. | ||||
| T1a, N0, M0 | GX | –T1a = tumor con invasión de la lámina propia o la capa muscular de la mucosa. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| GX = grado no evaluable. | ||||
| IB | T1a, N0, M0 | G2 | –T1a = tumor con invasión de la lámina propia o la capa muscular de la mucosa. |
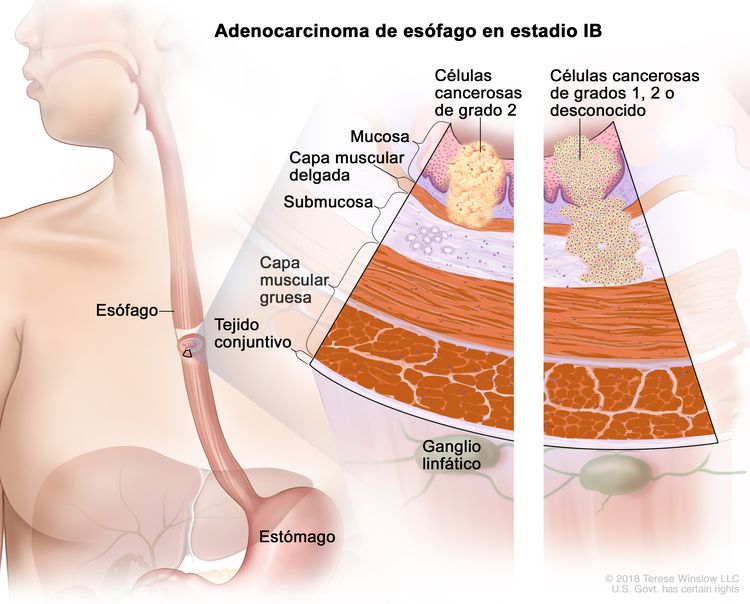 |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| G2 = moderadamente diferenciado. | ||||
| T1b, N0, M0 | G1–2 | –T1b = tumor con invasión de la submucosa. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| G1 = bien diferenciado. | ||||
| G2 = moderadamente diferenciado. | ||||
| T1b, N0, M0 | GX | –T1b = tumor con invasión de la submucosa. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| GX = grado no evaluable. | ||||
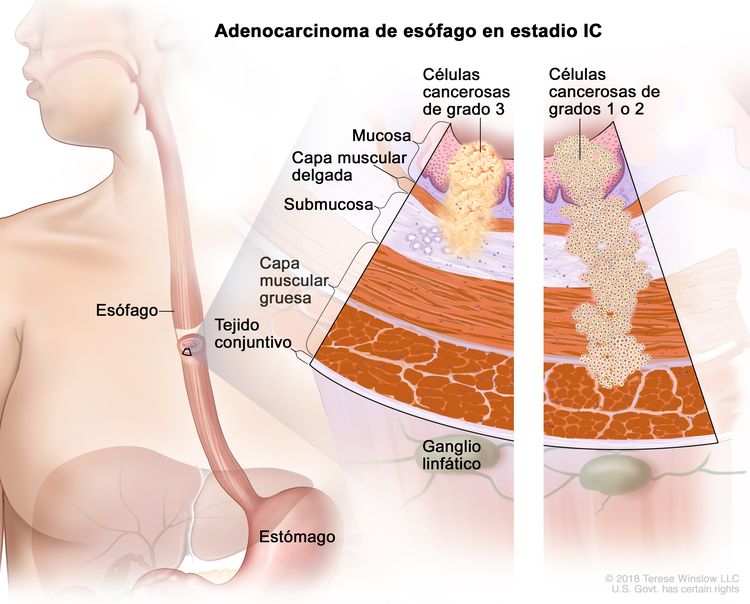
| IC | T1, N0, M0 | G3 | T1 = tumor con invasión de la lámina propia, la capa muscular de la mucosa o la submucosa. |
 |
| –T1a = tumor con invasión de la lámina propia o la capa muscular de la mucosa. | ||||
| –T1b = tumor con invasión de la submucosa. | ||||
| N0 = sin metástasis en ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| G3 = pobremente diferenciado o indiferenciado. | ||||
| T2, N0, M0 | G1–2 | T2 = tumor con invasión de la capa muscular propia. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| G1 = bien diferenciado. | ||||
| G2 = moderadamente diferenciado. | ||||
| Estadio | TNM | Grado | Descripción | Imagen |
|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; G = grado; p = patológico. | ||||
| aReproducción autorizada de AJCC: Esophageal and esophagogastric junction. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 185–202. | ||||
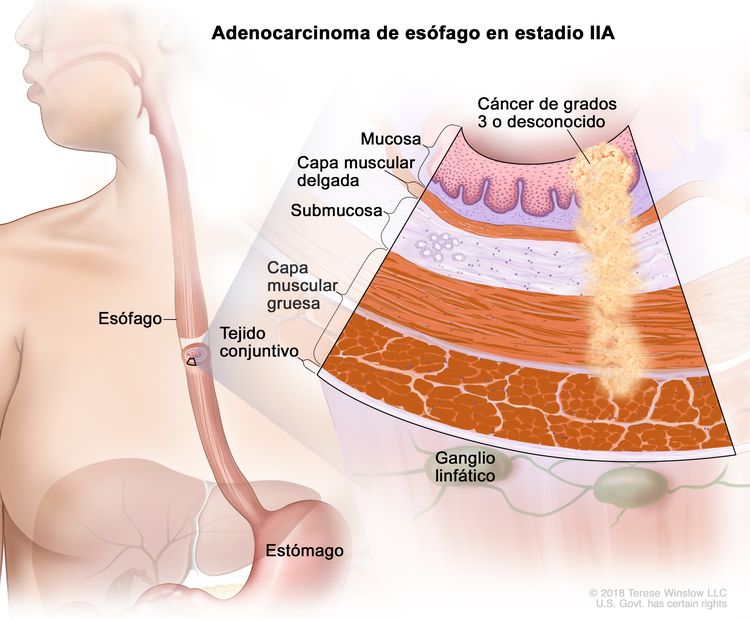
| IIA | T2, N0, M0 | G3 | T2 = tumor con invasión de la capa muscular propia. |
 |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| G3 = pobremente diferenciado o indiferenciado. | ||||
| T2, N0, M0 | GX | T2 = tumor con invasión de la capa muscular propia. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| GX = grado no evaluable. | ||||
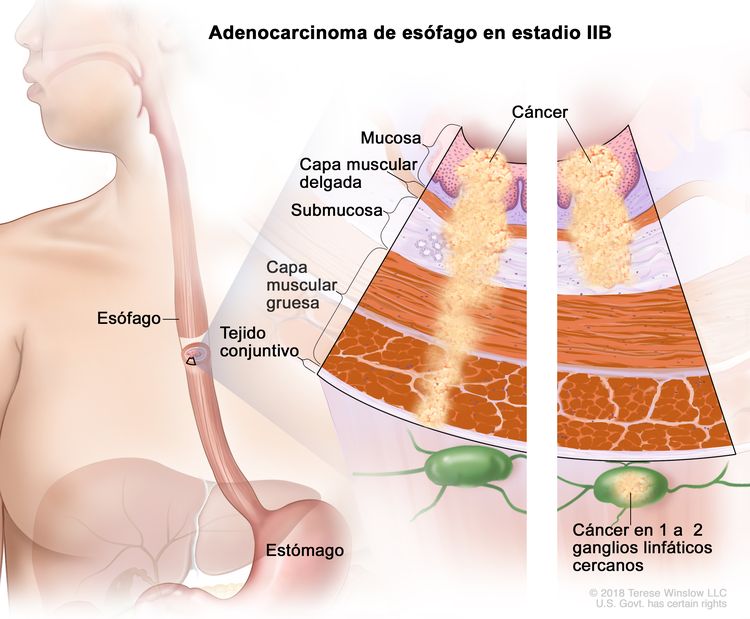
| IIB | T1, N1, M0 | Cualquiera | T1 = tumor con invasión de la lámina propia, la capa muscular de la mucosa o la submucosa. |
 |
| –T1a = tumor con invasión de la lámina propia o la capa muscular de la mucosa. | ||||
| –T1b = tumor con invasión de la submucosa. | ||||
| N1 = metástasis en 1 o 2 ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| Cualquier G = consultar el Cuadro 1. | ||||
| T3, N0, M0 | Cualquiera | T3 = tumor con invasión de la capa adventicia. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| Cualquier G = consultar el Cuadro 1. | ||||
| Estadio | TNM | Grado | Descripción | Imagen |
|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; G = grado; p = patológico. | ||||
| aReproducción autorizada de AJCC: Esophageal and esophagogastric junction. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 185–202. | ||||
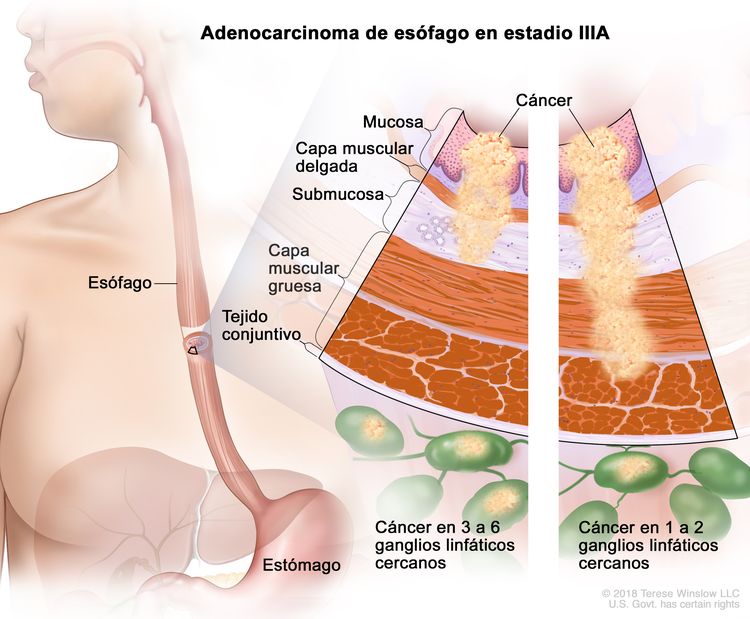
| IIIA | T1, N2, M0 | Cualquiera | T1 = tumor con invasión de la lámina propia, la capa muscular de la mucosa o la submucosa. |
 |
| –T1a = tumor con invasión de la lámina propia o la capa muscular de la mucosa. | ||||
| –T1b = tumor con invasión de la submucosa. | ||||
| N2 = metástasis en 3 a 6 ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| Cualquier G = consultar el Cuadro 1. | ||||
| T2, N1, M0 | Cualquiera | T2 = tumor con invasión de la capa muscular propia. | ||
| N1 = metástasis en 1 o 2 ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| Cualquier G = consultar el Cuadro 1. | ||||
| IIIB | T2, N2, M0 | Cualquiera | T2 = tumor con invasión de la capa muscular propia. |
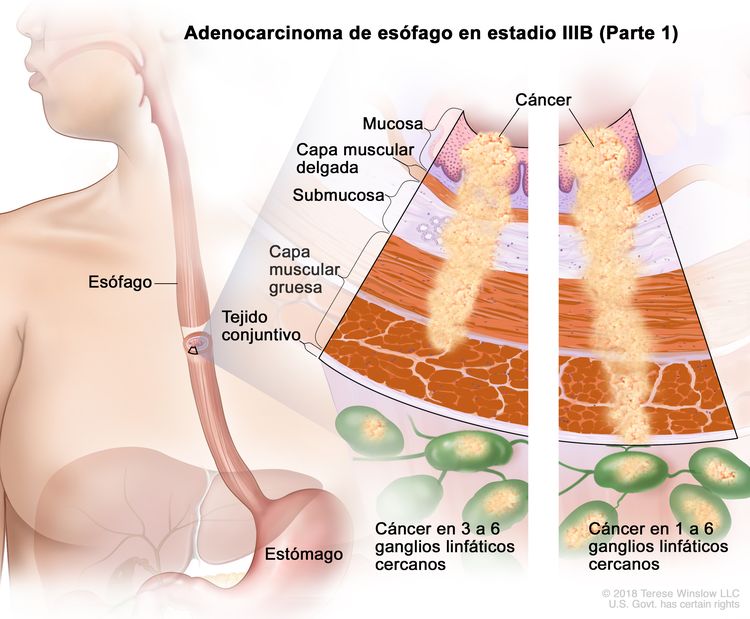 |
| N2 = metástasis en 3 a 6 ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| Cualquier G = consultar el Cuadro 1. | ||||
| T3, N1–2, M0 | Cualquiera | T3 = tumor con invasión de la capa adventicia. | ||
| N1 = metástasis en 1 o 2 ganglios linfáticos regionales. | ||||
| N2 = metástasis en 3 a 6 ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| Cualquier G = consultar el Cuadro 1. | ||||
| T4a, N0–1, M0 | Cualquiera | –T4a = tumor con invasión de la pleura, el pericardio, la vena ácigos, el diafragma o el peritoneo. |
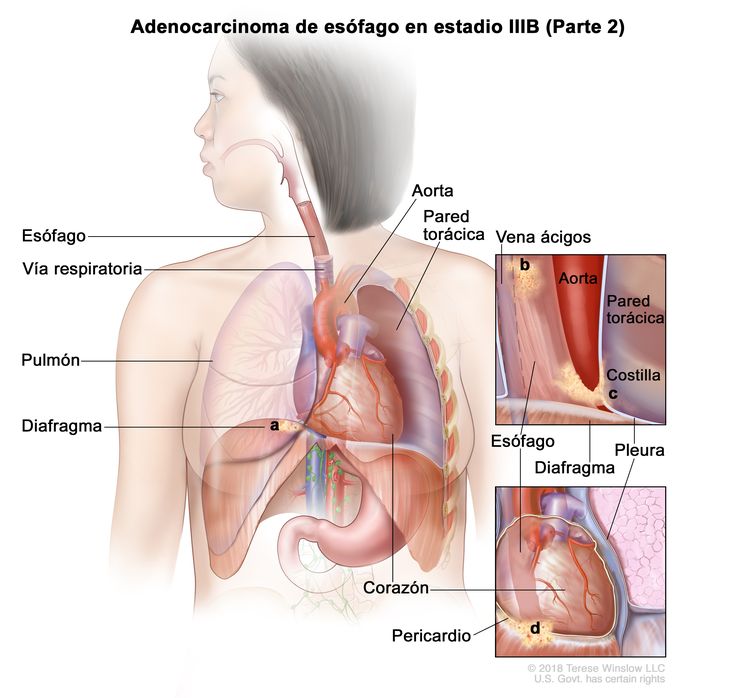 |
|
| N0 = sin metástasis en ganglios linfáticos regionales. | ||||
| N1 = metástasis en 1 o 2 ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| Cualquier G = consultar el Cuadro 1. | ||||
| Estadio | TNM | Grado | Descripción | Imagen |
|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; G = grado; p = patológico. | ||||
| aReproducción autorizada de AJCC: Esophageal and esophagogastric junction. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 185–202. | ||||
| IVA | T4a, N2, M0 | Cualquiera | –T4a = tumor con invasión de la pleura, el pericardio, la vena ácigos, el diafragma o el peritoneo. |
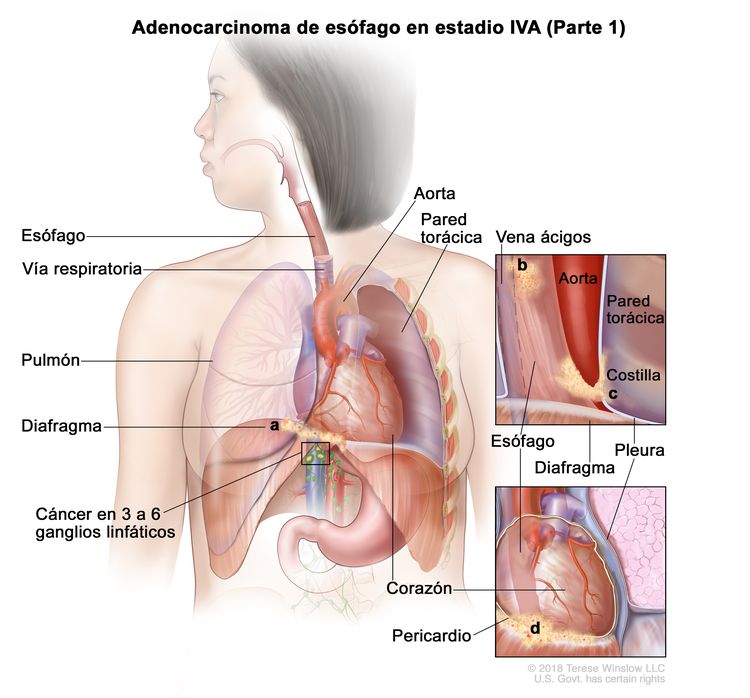 |
| N2 = metástasis en 3 a 6 ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| Cualquier G = consultar el Cuadro 1. | ||||
| T4b, N0–2, M0 | Cualquiera | –T4b = tumor con invasión de otras estructuras adyacentes, como la aorta, el cuerpo vertebral o la vía aérea. |
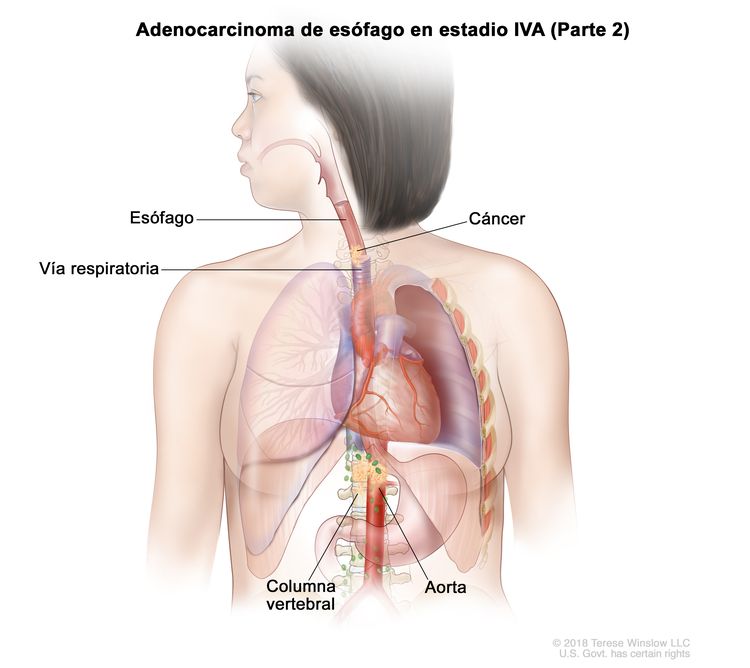 |
|
| N0 = sin metástasis en ganglios linfáticos regionales. | ||||
| N1 = metástasis en 1 o 2 ganglios linfáticos regionales. | ||||
| N2 = metástasis en 3 a 6 ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| Cualquier G = consultar el Cuadro 1. | ||||
| Cualquier T, N3, M0 | Cualquiera | Cualquier T = consultar el Cuadro 1. |
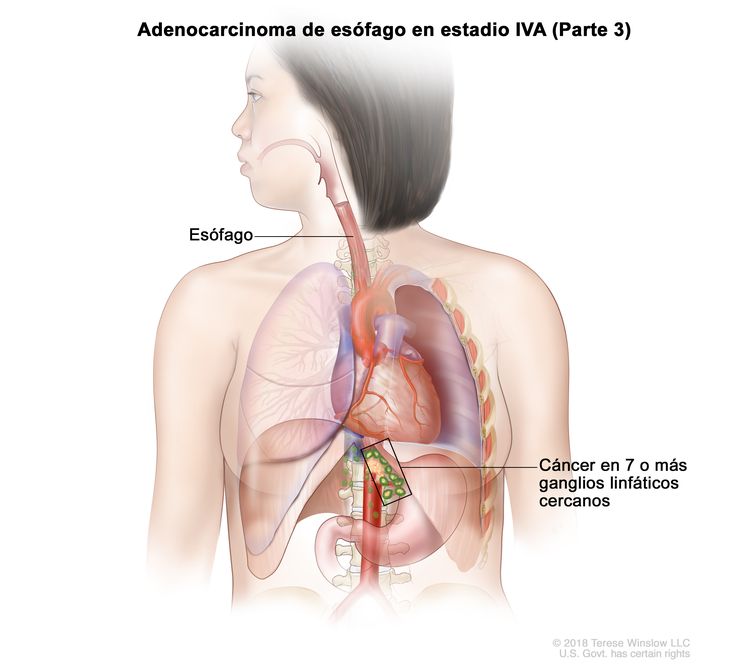 |
|
| N3 = metástasis en 7 o más ganglios linfáticos regionales. | ||||
| M0 = sin metástasis a distancia. | ||||
| Cualquier G = consultar el Cuadro 1. | ||||
| IVB | Cualquier T, cualquier N, M1 | Cualquiera | Cualquier T = consultar el Cuadro 1. |
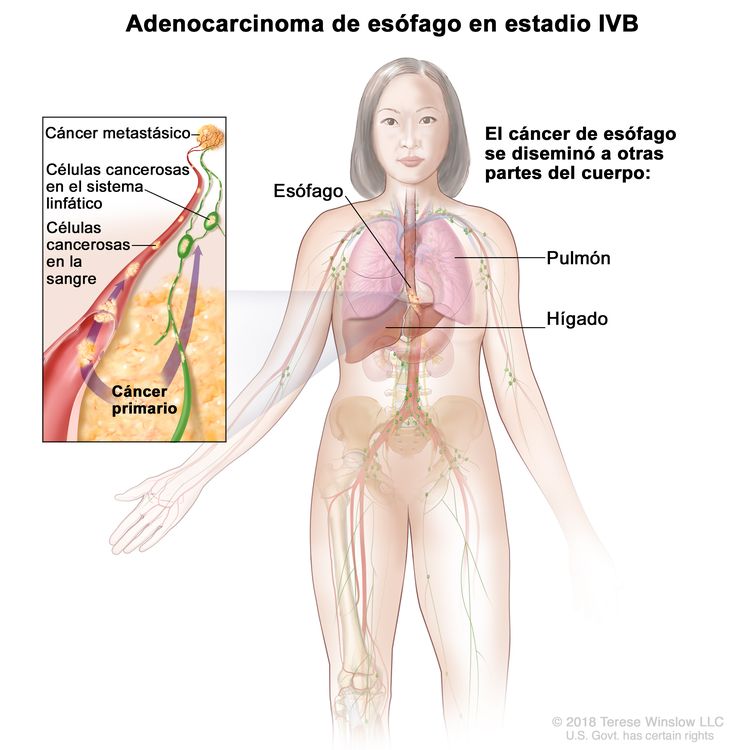 |
| Cualquier N = consultar el Cuadro 1. | ||||
| M1 = metástasis a distancia. | ||||
| Cualquier G = consultar el Cuadro 1. | ||||
Bibliografía
- Ziegler K, Sanft C, Zeitz M, et al.: Evaluation of endosonography in TN staging of oesophageal cancer. Gut 32 (1): 16-20, 1991. [PUBMED Abstract]
- Tio TL, Coene PP, den Hartog Jager FC, et al.: Preoperative TNM classification of esophageal carcinoma by endosonography. Hepatogastroenterology 37 (4): 376-81, 1990. [PUBMED Abstract]
- Vazquez-Sequeiros E, Norton ID, Clain JE, et al.: Impact of EUS-guided fine-needle aspiration on lymph node staging in patients with esophageal carcinoma. Gastrointest Endosc 53 (7): 751-7, 2001. [PUBMED Abstract]
- Bonavina L, Incarbone R, Lattuada E, et al.: Preoperative laparoscopy in management of patients with carcinoma of the esophagus and of the esophagogastric junction. J Surg Oncol 65 (3): 171-4, 1997. [PUBMED Abstract]
- Sugarbaker DJ, Jaklitsch MT, Liptay MJ: Thoracoscopic staging and surgical therapy for esophageal cancer. Chest 107 (6 Suppl): 218S-223S, 1995. [PUBMED Abstract]
- Luketich JD, Schauer P, Landreneau R, et al.: Minimally invasive surgical staging is superior to endoscopic ultrasound in detecting lymph node metastases in esophageal cancer. J Thorac Cardiovasc Surg 114 (5): 817-21; discussion 821-3, 1997. [PUBMED Abstract]
- Krasna MJ, Reed CE, Nedzwiecki D, et al.: CALGB 9380: a prospective trial of the feasibility of thoracoscopy/laparoscopy in staging esophageal cancer. Ann Thorac Surg 71 (4): 1073-9, 2001. [PUBMED Abstract]
- Flamen P, Lerut A, Van Cutsem E, et al.: Utility of positron emission tomography for the staging of patients with potentially operable esophageal carcinoma. J Clin Oncol 18 (18): 3202-10, 2000. [PUBMED Abstract]
- Flamen P, Van Cutsem E, Lerut A, et al.: Positron emission tomography for assessment of the response to induction radiochemotherapy in locally advanced oesophageal cancer. Ann Oncol 13 (3): 361-8, 2002. [PUBMED Abstract]
- Weber WA, Ott K, Becker K, et al.: Prediction of response to preoperative chemotherapy in adenocarcinomas of the esophagogastric junction by metabolic imaging. J Clin Oncol 19 (12): 3058-65, 2001. [PUBMED Abstract]
- van Westreenen HL, Westerterp M, Bossuyt PM, et al.: Systematic review of the staging performance of 18F-fluorodeoxyglucose positron emission tomography in esophageal cancer. J Clin Oncol 22 (18): 3805-12, 2004. [PUBMED Abstract]
- Meyers BF, Downey RJ, Decker PA, et al.: The utility of positron emission tomography in staging of potentially operable carcinoma of the thoracic esophagus: results of the American College of Surgeons Oncology Group Z0060 trial. J Thorac Cardiovasc Surg 133 (3): 738-45, 2007. [PUBMED Abstract]
- Rice TW, Kelsen D, Blackstone EH, et al.: Esophagus and Esophagogastric Junction. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 185-202.
- Korst RJ, Rusch VW, Venkatraman E, et al.: Proposed revision of the staging classification for esophageal cancer. J Thorac Cardiovasc Surg 115 (3): 660-69; discussion 669-70, 1998. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento del cáncer de esófago
La resección quirúrgica sola ofrece la posibilidad de cura para pacientes de cáncer de esófago resecable con invasión mínima. Por el contrario, el tratamiento de pacientes con cáncer de esófago resecable localmente avanzado ha avanzado bastante durante las últimas décadas. Debido al riesgo de metástasis a distancia y recaída local, el tratamiento multimodal con quimioterapia, radioterapia y resección quirúrgica se volvió el estándar de atención.
El tratamiento con combinaciones de las siguientes opciones permite obtener paliación eficaz para determinados pacientes:
| Estadio (criterios de estadificación TNM) | Opciones de tratamiento |
|---|---|
| Cáncer de esófago en estadio 0 | Cirugía |
| Resección endoscópica | |
| Cáncer de esófago en estadio I | Quimiorradioterapia seguida de cirugía |
| Cirugía sola | |
| Cáncer de esófago en estadio II | Quimiorradioterapia seguida de cirugía |
| Cirugía sola | |
| Quimioterapia seguida de cirugía | |
| Quimiorradioterapia definitiva | |
| Cáncer de esófago en estadio III | Quimiorradioterapia seguida de cirugía |
| Quimioterapia preoperatoria seguida de cirugía | |
| Quimiorradioterapia definitiva | |
| Cáncer de esófago en estadio IV | Quimiorradioterapia seguida de cirugía (para pacientes con enfermedad en estadio IVA) |
| Quimioterapia, que proporciona respuestas parciales en pacientes de adenocarcinomas de esófago con metástasis a distancia. | |
| Terapia adyuvante para pacientes con adenocarcinoma de esófago, carcinoma de células escamosas de esófago o cáncer de unión gastroesofágica resecados por completo (márgenes negativos), que presentaban enfermedad patológica residual después de recibir quimiorradioterapia simultánea | |
| Inmunoterapia y quimioinmunoterapia para pacientes con carcinoma de células escamosas de esófago metastásico, recurrente, en estadio avanzado, irresecable, que no han recibido tratamiento | |
| Inmunoterapia y quimioinmunoterapia para pacientes con adenocarcinoma de esófago o cáncer de unión gastroesofágica en estadio avanzado o metastásico que no han recibido tratamiento | |
| Inmunoterapia para pacientes que recaen después de una línea de tratamiento estándar previa | |
| Nivolumab y quimioterapia para pacientes con adenocarcinoma | |
| Destrucción endoluminal del tumor con láser Nd:YAG o electrocoagulación. | |
| Colocación endoscópica de endoprótesis para aliviar la disfagia | |
| Radioterapia con intubación y dilatación intraluminal o sin estas | |
| Braquiterapia intraluminal para aliviar la disfagia | |
| Participación en ensayos clínicos en los que se evalúa quimioterapia en monoterapia o combinada | |
| Cáncer de esófago recidivante | Administración paliativa de cualquier tratamiento , incluso cuidados médicos de apoyo |
| Inmunoterapia y quimioinmunoterapia para pacientes con carcinoma de células escamosas de esófago recidivante |
Cirugía
Cirugía (esófago de Barrett)
La prevalencia de la metaplasia de Barrett en el adenocarcinoma de esófago indica que el esófago de Barrett es una afección premaligna. La vigilancia endoscópica de los pacientes con metaplasia de Barrett a veces permite detectar el adenocarcinoma en un estadio más temprano y lo hace más susceptible de resección curativa. La resección se debe considerar para los pacientes con metaplasia de Barrett que presentan displasia de grado alto.[7]
Cirugía (cáncer de esófago)
La tasa de supervivencia de los pacientes con cáncer de esófago es precaria. El tratamiento quirúrgico del cáncer de esófago resecable produce tasas de supervivencia a 5 años del 5 % al 30 %, la supervivencia es más alta en los pacientes con cáncer en estadio temprano.[8] Los tumores pequeños asintomáticos que están limitados a la mucosa o submucosa esofágica son hallazgos fortuitos. La cirugía es el tratamiento preferido para estos tumores pequeños. Una vez hay síntomas (por ejemplo, disfagia, en la mayoría de los casos), por lo general el cáncer de esófago ya invadió o traspasó la capa muscular propia, y es posible que se encuentren metástasis ganglionares o en otros órganos.
En algunos pacientes con obstrucción esofágica parcial, la disfagia se alivia mediante la colocación de una endoprótesis metálica expansible [9] o mediante radioterapia, si el paciente tiene una enfermedad diseminada o no es apto para someterse a cirugía. Se notificaron métodos alternativos para aliviar la disfagia, como la terapia láser y la electrocoagulación que sirven para destruir el tumor intraluminal.[10-12]
Cuando hay una obstrucción esofágica completa y no hay indicios de metástasis sistémicas, el método tradicional para aliviar la disfagia es la extirpación quirúrgica del tumor con movilización del estómago para reemplazar el esófago.
No se conoce cuál es el procedimiento quirúrgico óptimo para la resección radical del cáncer de esófago. En un abordaje se recomienda la esofagectomía transhiatal con anastomosis del estómago al esófago cervical. En otro abordaje, se recomienda la movilización abdominal del estómago y la extirpación transtorácica del esófago con anastomosis del estómago al esófago torácico superior o al esófago cervical. En un estudio, se concluyó que la esofagectomía transhiatal se vinculó con morbilidad más baja que la esofagectomía transtorácica con linfadenectomía ampliada en bloque; sin embargo, la mediana de supervivencia general sin enfermedad y la supervivencia ajustada a la calidad de vida no difirieron de modo significativo.[13] De forma similar, no se encontraron diferencias en la calidad de vida (CDV) a largo plazo medida con instrumentos validados.[14] En épocas más recientes se han formulado abordajes de cirugía mínimamente invasiva que tienen posibles ventajas por el uso de incisiones más pequeñas, menor pérdida intraoperatoria de sangre, menos complicaciones posoperatorias y disminución del tiempo de hospitalización. Sin embargo, no se ha establecido la capacidad de obtener márgenes quirúrgicos sin compromiso tumoral, la conveniencia de la disección ganglionar y los resultados a largo plazo de este abordaje.[15]
En los Estados Unidos, la mediana de edad de los pacientes que presentan cáncer de esófago es de 68 años.[16] En los resultados de una revisión retrospectiva con 505 pacientes consecutivos operados por un solo equipo quirúrgico durante un período de 17 años, no se encontraron diferencias en la mortalidad perioperatoria, la mediana de supervivencia ni en los beneficios paliativos sobre la disfagia de la esofagectomía cuando se compararon pacientes mayores de 70 años y de menos edad.[17][Nivel de evidencia C1] Todos los pacientes en esta serie se seleccionaron para la cirugía según el riesgo operatorio. La edad por sí sola no debería determinar el tratamiento de los pacientes con enfermedad potencialmente resecable.
Quimioterapia preoperatoria con terapia anti-receptor 2 del factor de crecimiento epidérmico humano, inmunoterapia o ambas
Quimioterapia a base de fluorouracilo, leucovorina, oxaliplatino y docetaxel con trastuzumab y pertuzumab
Evidencia (quimioterapia a base de fluorouracilo [5-FU], leucovorina, oxaliplatino y docetaxel [FLOT] con trastuzumab y pertuzumab):
- En un ensayo multicéntrico de fase II/III (NCT02581462) se incluyó a pacientes con adenocarcinoma gástrico o de la unión gastroesofágica resecable y positivo para el receptor 2 del factor de crecimiento epidérmico humano (HER2) (estadio clínico T2 o mayor, o con compromiso ganglionar clínico). En la fase II del estudio participaron 81 pacientes (61 con cáncer gastroesofágico y 20 con cáncer gástrico). Los pacientes se asignaron al azar para recibir 4 ciclos preoperatorios y postoperatorios de FLOT solo (grupo A, n = 41) o FLOT combinado con trastuzumab y pertuzumab seguido de 9 ciclos de trastuzumab y pertuzumab (grupo B, n = 40). En la fase II del estudio, el criterio principal de valoración
fue la tasa de respuesta patológica completa. El ensayo no pasó a la fase III, ya que se cerró de forma prematura tras conocerse los resultados del ensayo JACOB, en los que se observó que añadir pertuzumab a trastuzumab y quimioterapia no mejoraba significativamente la supervivencia general (SG) en pacientes con cáncer metastásico gástrico o de la unión gastroesofágica positivo para HER2, en comparación con el uso de un placebo.[18]
- La tasa de respuesta patológica completa mejoró significativamente en los pacientes del grupo B, con un 35 %, en comparación con el 12 % de los pacientes del grupo A (P = 0,02).[18][Nivel de evidencia B3]
- La tasa de negatividad patológica de los ganglios linfáticos fue mayor en los pacientes que recibieron trastuzumab y pertuzumab (39 % en el grupo A vs. 68 % en el grupo B).
- La tasa de resección R0 fue del 90 % para los pacientes del grupo A y del 93 % para los del grupo B. La morbilidad quirúrgica también fue comparable, del 43 % para los pacientes del grupo A y del 44 % para los del grupo B.
- La mediana de supervivencia sin enfermedad (SSE) fue de 26 meses para los pacientes del grupo A y no se logró para los pacientes del grupo B (cociente de riesgos instantáneos [CRI], 0,58; P = 0,14).
- Las tasas de SSE a 24 meses fueron del 54 % (intervalo de confianza [IC] 95 %, 38–71 %) en el grupo A y del 70 % (IC 95 %, 55–85 %) en el grupo B. Las tasas de SG a 24 meses fueron del 77 % (IC 95 %, 63–90 %) en el grupo A y del 84 % (IC 95 %, 72–96 %) en el grupo B.
- Se notificaron más eventos adversos de grado 3 o superior entre los pacientes que recibieron trastuzumab y pertuzumab, especialmente diarrea (5 % de los pacientes del grupo A y 41 % de los pacientes del grupo B) y leucopenia (13 % de los pacientes del grupo A y 23 % de los pacientes del grupo B).
Quimiorradioterapia preoperatoria
De acuerdo con los resultados de varios ensayos aleatorizados, la quimiorradioterapia seguida de cirugía es una opción de tratamiento para pacientes con cáncer de esófago en estadios IB, II, III y IVA.
En ensayos de fase III se comparó la quimiorradioterapia preoperatoria simultánea y la cirugía sola para pacientes de cáncer de esófago.[19-25][Nivel de evidencia A1] El beneficio de la quimiorradioterapia neoadyuvante ha sido objeto de polémica debido a resultados contradictorios de los primeros estudios aleatorizados.[19-22] No obstante, en el Chemoradiotherapy for Oesophageal Cancer Followed by Surgery Study (CROSS) se demostró de modo definitivo un beneficio para la supervivencia de la quimiorradioterapia preoperatoria comparada con la cirugía sola en el tratamiento del cáncer de esófago localmente avanzado.[23]
Para los tumores en estadio temprano, la función de la quimiorradioterapia preoperatoria aún es controvertida. Aunque en el estudio CROSS participaron pacientes con enfermedad en estadio temprano, en el estudio Francophone de Cancérologie Digestive (FFCD) 9901 (NCT00047112)[25], participaron solo pacientes en estadio temprano (estadios I o II) y no se logró demostrar una ventaja para la supervivencia en este grupo de pacientes.
Evidencia (quimiorradioterapia preoperatoria):
- En el estudio CROSS, se asignó al azar a 366 pacientes con cánceres de esófago o de unión esofágica resecables a un grupo de cirugía sola o un grupo de administración semanal de carboplatino (dosis ajustada para alcanzar una ABC [área bajo la curva] de 2 mg/ml/minuto) y paclitaxel (50 mg/m2 de ASC [área de superficie corporal]) con radioterapia simultánea (41,4 Gy en 23 fracciones) administrada en el transcurso de 5 semanas. La mayoría de los pacientes inscritos en el ensayo CROSS (75 %) tenían un adenocarcinoma.[23,26][Nivel de evidencia A1]
- Al cabo de una mediana de seguimiento de 84 meses, se encontró que la quimiorradioterapia preoperatoria mejoró la mediana de SG de 24 meses en el grupo de cirugía sola a 48,6 meses en el otro grupo (CRI, 0,68; IC, 95 % 0,53–0,88; P = 0,003). La mediana de SG de los pacientes con carcinomas de células escamosas fue de 81,6 meses en el grupo de quimiorradioterapia preoperatoria, en comparación con 21,1 meses en el grupo de cirugía sola (CRI, 0,48; IC 95 %, 0,28–0,83; orden logarítmico P = 0,008); en los pacientes de adenocarcinomas, la mediana de SG fue de 43,2 meses en el grupo de quimiorradioterapia preoperatoria, en comparación con 27,1 meses en el grupo de cirugía sola (CRI, 0,73; IC 95 %, 0,55–0,98; orden logarítmico P = 0,038).[26]
- Además, la quimiorradioterapia preoperatoria mejoró la tasa de resecciones R0 (92 vs. 69 %; P < 0,001). La R0 se define como una resección completa sin tumor dentro de 1 mm de los márgenes de resección.
- Se obtuvo una respuesta patológica completa en el 29 % de los pacientes sometidos a resección después de quimiorradioterapia. Se observó una respuesta patológica completa en el 23 % de los pacientes con adenocarcinoma en comparación con el 49 % de los pacientes de carcinoma de células escamosas (P = 0,008).
- Las complicaciones posoperatorias y la mortalidad hospitalaria fueron equivalentes en ambos grupos. Los efectos secundarios hematológicos más comunes en el grupo de quimiorradioterapia fueron leucopenia (6 %) y neutropenia (2 %). Los efectos secundarios no hematológicos más comunes fueron anorexia (5 %) y fatiga (3 %).
- Al cabo de una mediana de seguimiento de 84 meses, la tasa de supervivencia sin progresión (SSP) a 5 años fue del 44 % en el grupo de quimiorradioterapia preoperatoria, en comparación con el 27 % en el grupo de cirugía sola (CRI, 0,61; IC 95 % 0,47–0,78). La quimiorradioterapia preoperatoria redujo la recidiva locorregional del 34 % al 14 % (P < 0,001) y la carcinomatosis peritoneal del 14 % al 4 % (P < 0,001). Hubo un efecto pequeño, pero significativo, en la diseminación hematógena a favor del grupo de quimiorradioterapia (35 vs. 29 %; P = 0,025).[24,26][Nivel de evidencia B1]
- En un ensayo aleatorizado prospectivo multicéntrico, se comparó la quimioterapia preoperatoria combinada (es decir, cisplatino) con radioterapia (37 Gy en fracciones de 3,7 Gy) versus la cirugía sola en pacientes de carcinoma de células escamosas.[19][Nivel de evidencia A1]
- En el estudio no se observó una mejora de la SG, y la tasa de mortalidad posoperatoria fue significativamente más alta (12 vs. 4 %) en el grupo de modalidad combinada.
- En un ensayo de fase III realizado en una sola institución participaron pacientes que se trataron con quimiorradioterapia de inducción con 5-FU, cisplatino y 40 Gy (fracciones de 2,67 Gy) combinados con cirugía, en comparación con resección sola.[20][Nivel de evidencia A1]
- En los resultados, se observó un beneficio leve de supervivencia de 16 meses para la modalidad combinada versus 11 meses para la cirugía sola.
- En un ensayo aleatorizado posterior de una sola institución, se asignó al azar a pacientes (75 % con adenocarcinoma) para recibir 5-FU, cisplatino, vinblastina y radioterapia (1,5 Gy 2 veces al día, total de 45 Gy) con resección versus esofagectomía sola.[21][Nivel de evidencia A1]
- Luego de una mediana de seguimiento de más de 8 años, no hubo diferencias significativas entre la cirugía sola y el tratamiento de modalidad combinada con respecto a la mediana de supervivencia (17,6 vs. 16,9 meses), la tasa de SG (16 vs. 30 % a los 3 años) ni la SSE (16 vs. 28 % a los 3 años).
- En un ensayo intergrupal (CALGB-9781 [NCT00003118]), se planificó asignar al azar a 475 pacientes con adenocarcinoma de células escamosas o adenocarcinoma de esófago torácico resecables para recibir tratamiento con quimiorradioterapia preoperatoria (5-FU, cisplatino y 50,4 Gy) seguida de esofagectomía y disección ganglionar o cirugía sola. El ensayo se cerró debido a la inscripción baja de pacientes; sin embargo, se notificaron los resultados de 56 pacientes inscritos seguidos durante una mediana de 6 años.[22][Nivel de evidencia A1]
- La mediana de supervivencia fue de 4,48 años, (IC, 95 %; intervalo de 2,4–tiempo indefinido) en el grupo de modalidad triple versus 1,79 años (IC 95 %, 1,41–2,59) en el grupo de cirugía sola (P = 0,002); la tasa de SG a 5 años fue del 39 % para la modalidad triple (IC 95 %, 21–57 %) versus el 16 % (IC 95 %, 5–33 %) para la cirugía sola.
- Con el fin de evaluar más el efecto de la quimiorradioterapia neoadyuvante para el tratamiento de la enfermedad en estadio temprano, en el estudio FFCD 9901 se asignó al azar a 195 pacientes de cáncer de esófago en estadio I o estadio II a recibir cirugía sola o quimiorradioterapia neoadyuvante (45 Gy en 25 fracciones administradas con 2 ciclos de 5-FU [800 mg/m2] y cisplatino [75 mg/m2]) seguida de cirugía.[25][Nivel de evidencia A1]
- Después de un análisis interino, se suspendió la inscripción para el estudio debido a su intranscendencia.
- Tras una mediana de seguimiento de 94 meses, no hubo una mejora significativa en las tasas de SG a 3 años con quimiorradioterapia (48 vs. 53 %, P = 0,94); en ese grupo la tasa de mortalidad posoperatoria fue significativamente más alta (11,1 vs. 3,4 %, P = 0,049).
- En el ensayo NRG Oncology/RTOG-1010 (NCT01196390) se evaluó la adición de trastuzumab al tratamiento trimodal (paclitaxel con carboplatino y radioterapia, seguido de cirugía) en pacientes con adenocarcinoma de esófago no tratado con sobreexpresión de HER2. En este ensayo de fase III se incluyeron 606 pacientes para la evaluación de HER2. Un total de 203 pacientes con enfermedad positiva para HER2 se asignaron al azar para recibir quimiorradioterapia con trastuzumab (n = 102) o quimiorradioterapia sola (n = 101). El criterio principal de valoración
fue la SSE. La mediana de duración del seguimiento fue de 2,8 años.[27]
- La mediana de la SSE fue de 19,6 meses (IC 95 %, 13,5–26,2) para los pacientes que recibieron quimiorradioterapia con trastuzumab y de 14,2 meses (10,5–23,0) para los que recibieron quimiorradioterapia sola (CRI, 0,99; IC 95 %, 0,71–1,39; orden logarítmico P = 0,97).[27][Nivel de evidencia B1]
- Se produjeron eventos adversos de grado 3 relacionados con el tratamiento en 41 de 95 pacientes (43 %) que recibieron trastuzumab y en 52 de 96 pacientes (54 %) de pacientes que recibieron quimiorradioterapia sola. Se produjeron eventos adversos de grado 4 relacionados con el tratamiento en 20 pacientes (21 %) que recibieron trastuzumab y en 21 pacientes (22 %) que recibieron quimiorradioterapia sola.
- Hubo 5 muertes relacionadas con el tratamiento en el grupo de trastuzumab (fístula broncopleural, fuga anastomótica esofágica, infección pulmonar, muerte súbita y muerte no especificada) y 3 muertes en el grupo de quimiorradioterapia (2 fallos multiorgánicos y 1 sepsis).
En conclusión, en este ensayo se confirmó que el trastuzumab no cumple ninguna función en el tratamiento preoperatorio del cáncer de esófago o gastroesofágico positivo para HER2, ni con quimioterapia sola ni con quimiorradioterapia.
Quimioterapia preoperatoria
Los efectos de la quimioterapia preoperatoria están en evaluación en ensayos aleatorizados. En varios estudios se demostró un beneficio para la supervivencia de la quimioterapia preoperatoria comparada con la cirugía sola.[28-30] Sin embargo, en un estudio aleatorizado grande no se pudo confirmar un beneficio para la supervivencia de la quimioterapia preoperatoria.[31] En comparación con la quimioterapia preoperatoria sola, la quimiorradioterapia preoperatoria mejora la respuesta patológica y quizás mejore los desenlaces.[32]
Evidencia (quimioterapia preoperatoria):
- En un ensayo intergrupal (NCT00525785), se asignó al azar a 440 pacientes de cáncer de esófago (cualquier tipo celular) local y operable a recibir 3 ciclos de 5-FU y cisplatino preoperatorios, seguidos de cirugía y 2 ciclos adicionales de quimioterapia versus cirugía sola.[31][Nivel de evidencia A1]
- Después de una mediana de seguimiento de 55 meses, no se observaron diferencias significativas en la mediana de supervivencia en el grupo de quimioterapia con cirugía (14,6 meses) y el grupo de cirugía sola (16,1 meses). La mediana de la tasa de supervivencia a 2 años fue del 35 % para el grupo de quimioterapia con cirugía, y del 37 % para el grupo de cirugía sola.
- La adición de quimioterapia no aumentó la morbilidad relacionada con la cirugía.
- El Medical Research Council Oesophageal Cancer Working Party asignó al azar a 802 pacientes de cáncer de esófago resecable (cualquier tipo celular), a 2 ciclos de 5-FU y cisplatino preoperatorios seguidos de cirugía versus cirugía sola.[28][Nivel de evidencia A1]
- Luego de una mediana de seguimiento de 37 meses, la mediana de supervivencia mejoró de forma significativa en el grupo de quimioterapia preoperatoria (16,8 vs.13,3 meses con cirugía sola; IC 95 %), al igual que la tasa de SG a 2 años (43 % en el grupo de quimioterapia preoperatoria y 34 % en el grupo de cirugía sola; IC 95 %).
La interpretación de los resultados de los ensayos intergrupales y de quimioterapia preoperatoria es un reto porque no se notificó la estadificación T o N; además, antes de la aleatorización, es posible que el oncólogo haya ofrecido tratamiento con radiación si lo consideraba necesario.
- El Japanese Clinical Oncology Group asignó al azar a 330 pacientes de carcinoma de células escamosas en estadios clínicos II o III (excepto T4), para recibir 2 ciclos de cisplatino y 5-FU preoperatorios seguidos de cirugía, o cirugía seguida de quimioterapia posoperatoria con el mismo régimen. Se llevó a cabo un análisis interino previsto después de la inscripción de pacientes. Aunque no se alcanzó el criterio principal de valoración de SSP, se encontró un beneficio significativo de la SG en los pacientes tratados con quimioterapia preoperatoria (P = 0,01). A partir de estos resultados, el comité de vigilancia de datos e inocuidad recomendó el cierre anticipado del estudio.[29][Nivel de evidencia A3]
- Después de una mediana de seguimiento de 61 meses, la tasa de SG a 5 años fue del 55 % en los pacientes que se trataron con quimioterapia preoperatoria, en comparación con el 43 % en aquellos que se trataron con quimioterapia posoperatoria (P = 0,04). Sin embargo, no hubo una diferencia significativa de la SSP entre los grupos (la tasa de SSP a 5 años, 39 vs. 44 %; P = 0,22).
- Además, no hubo diferencias importantes entre los dos grupos con respecto a las complicaciones posoperatorias o los efectos tóxicos relacionados con el tratamiento.
- La Fédération Nationale des Centres de Lutte contre le Cancer y la FFCD asignaron al azar a 224 pacientes de adenocarcinomas resecables de esófago inferior, de unión gastroesofágica o de estómago para recibir quimioterapia perioperatoria y cirugía (n = 113) o cirugía sola (n = 111). La quimioterapia fue 2 o 3 ciclos preoperatorios de cisplatino intravenoso (IV) (100 mg/m2) el día 1 y una infusión IV continua de 5-FU (800 mg/m2) durante 5 días consecutivos (días 1–5) cada 28 días, y 3 o 4 ciclos posoperatorios del mismo régimen.[30][Nivel de evidencia A1]
- La quimioterapia perioperatoria se relacionó con una mejora de la tasa de SG a 5 años (38 vs. 24 %; CRI, 0,69; P = 0,02).
- Se presentaron efectos tóxicos de grado 3 a 4 en el 38 % de los pacientes tratados con quimioterapia perioperatoria, pero no aumentó la morbilidad posoperatoria.
- En el Preoperative Chemotherapy or Radiochemotherapy in Esophago-gastric Adenocarcinoma Trial (POET), se trató de evaluar el beneficio adicional de la radioterapia sumada a la quimioterapia preoperatoria. Se asignó al azar a los pacientes para recibir quimioterapia de inducción (15 semanas) seguida de cirugía o quimioterapia (12 semanas) seguida de quimiorradioterapia (3 semanas) y cirugía.[32][Nivel de evidencia A1]
- El estudio se cerró de manera anticipada debido a poca inscripción de pacientes. Se asignó al azar a 126 pacientes.
- La radioterapia preoperatoria produjo tasas de supervivencia a 3 años del 27 % al 47 % (orden logarítmico, P = 0,07). La tasa de mortalidad posoperatoria no aumento de manera significativa en el grupo de quimiorradioterapia (10,2 vs. 3,8 %; P = 0,26).
Quimioterapia perioperatoria
- En un ensayo en el que se incluyeron pacientes con adenocarcinoma de estómago, de unión esofagogástrica o de la parte inferior del esófago resecables, se asignaron al azar 250 pacientes a recibir quimioterapia perioperatoria y cirugía, así como 253 pacientes a recibir cirugía sola. La quimioterapia consistió en 3 ciclos preoperatorios y 3 ciclos posoperatorios de epirrubicina (50 mg/m2) y cisplatino (60 mg/m2) IV el día 1 del ciclo, y una infusión IV de 5-FU (200 mg/m2 por día) durante 21 días. El criterio principal de valoración fue la SG.[33]
- Al cabo de una mediana de seguimiento de 4 años, habían muerto 149 pacientes del grupo de quimioterapia perioperatoria y 170 pacientes del grupo de cirugía sola.
- En comparación con el grupo de cirugía sola, el grupo de quimioterapia perioperatoria presentó una probabilidad mayor de SG (CRIde muerte, 0,75; IC 95 %, 0,60–0,93; P = 0,009). La tasa de supervivencia a 5 años fue del 36,3 % en el grupo de quimioterapia perioperatoria (IC 95 %, 29,5–43,0 %) y del 23 % (IC 95 %, 16,6–29,4 %) en el grupo de cirugía sola.[33][Nivel de evidencia A1]
- La tasa de SSP también mejoró en el grupo de quimioterapia perioperatoria (CRIde progresión, 0,66; IC 95 %, 0,53–0,81; P < 0,001) en comparación con el grupo de cirugía sola.
- La tasa de complicaciones posoperatorias fue equivalente en ambos grupos; del 46 % en el grupo de quimioterapia perioperatoria y del 45 % en el grupo de cirugía. El número de muertes en los 30 días posteriores a la cirugía también fue semejante en ambos grupos.
- En un ensayo de fase II/III, aleatorizado, sin enmascaramiento se comparó la eficacia e inocuidad del régimen triple FLOT a base de docetaxel con la combinación de epirrubicina y cisplatino, además de 5-FU administrado como una infusión continua o capecitabina oral. En el ensayo se incluyeron 716 pacientes con adenocarcinoma en estadio clínico cT2 o superior, estadio positivo para el compromiso de los ganglios linfáticos (cN+), o ambos estadios; también se incluyeron pacientes con tumores resecables sin indicios de metástasis a distancia. Los pacientes se asignaron al azar a recibir una de estas opciones: (1) ECF/ECX (3 ciclos preoperatorios y 3 ciclos posoperatorios de 3 semanas con epirrubicina [50 mg/m2] y cisplatino [60 mg/m2] el día 1 con 5-FU [200 mg/m2] administrado como infusión continua o capecitabina [1,250 mg/m2] oral los días 1 al 21), o (2) FLOT (4 ciclos preoperatorios y 4 ciclos posoperatorios de 2 semanas con docetaxel [50 mg/m2], oxaliplatino [85 mg/m2], leucovorina [200 mg/m2], y 5-FU [2600 mg/m2] como una infusión de 24 horas el día 1). El criterio principal de valoración del ensayo fue la SG (superioridad) en la población con intención de tratar.[34]
- La SG fue más prolongada en el grupo de FLOT que en el grupo de ECF/ECX (CRI, 0,77; IC 95 %, 0,63–0,94). La mediana de SG fue de 50 meses en el grupo de FLOT (38,33–no se alcanzó) y de 35 meses en el grupo de ECF/ECX (27,35–46,26).[34][Nivel de evidencia A1]
- El número de pacientes con efectos adversos graves (incluso aquellos que se presentaron durante la internación quirúrgica en el hospital) fue similar entre los 2 grupos: 96 pacientes (27 %) en el grupo de ECF/ECX y 97 pacientes (27 %) en el grupo de FLOT.
- El número de muertes por efectos tóxicos (2 [<1 %]) fue semejante en ambos grupos. Se produjeron hospitalizaciones por efectos tóxicos en 94 pacientes (26 %) del grupo de ECF/ECX y 89 pacientes (25 %) del grupo de FLOT.
- En el ensayo ESOPEC (NCT02509286), que se notificó en forma de resumen, se comparó el FLOT perioperatorio y la cirugía con quimiorradioterapia neoadyuvante con el régimen CROSS (41,4 Gy con carboplatino y docetaxel) seguido de cirugía. En el ensayo se incluyeron 438 pacientes con adenocarcinoma de esófago resecable en estadio clínico (c)T1, cN+, cM0 o cT2–4a, cualquier cN, cM0. El criterio principal de valoración fue la SG.[35]
- Al cabo de una mediana de seguimiento de 55 meses, 218 pacientes habían muerto: 97 pacientes del grupo de FLOT y 121 pacientes del grupo de CROSS. La mediana de SG fue de 66 meses (IC 95 %, 36–no calculable) para los pacientes en el grupo de FLOT y de 37 meses (IC 95 %, 28–43) para los pacientes en el grupo de CROSS.
- Las tasas de SG a 3 años fueron de 57,4 % (IC 95 %, 50,1–64,0 %) para los pacientes en el grupo de FLOT y 50,7 % (IC 95 %, 43,5–57,5 %) para los pacientes en el grupo de CROSS (CRI, 0,70; IC 95 %, 0,53–0,92; P = 0,012).[35][Nivel de evidencia A1]
- El tratamiento neoadyuvante se administró a 403 pacientes: 207 del grupo de FLOT y 196 del grupo de CROSS.
- Se sometieron a cirugía 371 pacientes: 191 del grupo de FLOT y 180 del grupo de CROSS. Se logró una resección R0 en 351 pacientes; 180 de ellos pertenecían al grupo de FLOT y 171 al grupo de CROSS.
- Pudieron completar la terapia neoadyuvante planificada más pacientes que recibieron FLOT (87,3 %) que CROSS (67,7 %).
- La mortalidad en los 90 días posteriores a la cirugía fue del 4,3 %: 3,2 % en el grupo de FLOT y 5,6 % en el grupo de CROSS.
En el ensayo ESOPEC, los pacientes no recibieron nivolumab adyuvante; por lo tanto, no es posible determinar que el FLOT perioperatorio sea superior al CROSS preoperatorio y al nivolumab adyuvante.
Quimiorradioterapia definitiva
Para los pacientes con contraindicaciones médicas para la cirugía o que tienen tumores irresecables, la eficacia de la quimiorradioterapia definitiva se estableció en numerosos ensayos controlados aleatorizados.[36,37] Para los pacientes con carcinoma de células escamosas de esófago, la quimiorradioterapia definitiva quizás produzca desenlaces equivalentes, en comparación con la quimiorradiación preoperatoria seguida de resección quirúrgica.[38,39]
Evidencia (quimiorradioterapia definitiva):
- En un ensayo del Radiation Therapy Oncology Group (RTOG-8501) se asignó al azar a pacientes para recibir radioterapia sola (64 Gy en 32 fracciones) o quimiorradioterapia (50 Gy en 25 fracciones) con cisplatino simultáneo (75 mg/m2) y una infusión continua de 5-FU (1000 mg/m2 los días 1 a 4 en las semanas 1 y 5, seguida de 2 ciclos adicionales de quimioterapia administrada cada 3 semanas).[36][Nivel de evidencia A1]
- Hubo una mejora de la tasa de supervivencia a 5 años en el grupo de modalidad combinada (27 vs. 0 %).
- En un seguimiento a 8 años de este ensayo, se describió una tasa de SG del 22 % para los pacientes que recibieron quimiorradioterapia.
- El ensayo Intergroup-0123 (RTOG-9405 [NCT00002631]) se diseñó con el fin de mejorar los resultados del ensayo RTOG-8501. En el ensayo Intergroup-0123 se asignó al azar a 236 pacientes con tumores de esófago localizados a recibir quimiorradioterapia con dosis altas de radioterapia (64,8 Gy) y 4 ciclos mensuales de 5-FU con cisplatino versus radioterapia en dosis convencionales (50,4 Gy) y el mismo programa de quimioterapia.[37][Nivel de evidencia A1]
- A pesar de que este ensayo se diseñó originalmente para inscribir a 298 pacientes, se cerró en 1999 después de que en un análisis interino se concluyera que era estadísticamente poco probable que se observara alguna ventaja con las dosis altas de radiación.
- Al cabo de una mediana de seguimiento de 2 años, no se observaron diferencias estadísticas significativas en la mediana de supervivencia entre los grupos de radioterapia con dosis altas y convencionales (13 vs. 18 meses), las tasas de supervivencia a 2 años (31 vs. 40 %), ni la tasa de fracaso local o locorregional (56 vs. 52 %).
- La tasa de mortalidad relacionada con el tratamiento fue más alta en el grupo de dosis altas (9 vs. 2 %). Sin embargo, 7 de 11 muertes del grupo de dosis altas ocurrieron en pacientes que habían recibido 50,4 Gy o menos.
- En un ensayo del Eastern Cooperative Oncology Group (EST-1282) se evaluaron 135 pacientes.[40][Nivel de evidencia A1]
- En el ensayo se observó que la quimiorradioterapia resultó en una mejor tasa de supervivencia a 2 años que la radioterapia sola, resultados similares a los del ensayo intergrupal.
- En el ensayo PRODIGE5/ACCORD17 (NCT00861094) se comparó la eficacia e inocuidad de oxaliplatino, 5-FU y leucovorina cálcica (FOLFOX) versus 5-FU y cisplatino como la quimioterapia de base para los pacientes tratados con quimiorradioterapia definitiva por un cáncer de esófago localizado. En este ensayo multicéntrico aleatorizado de fases II y III, se asignó al azar a 267 pacientes a recibir 6 ciclos de FOLFOX (3 ciclos con radioterapia simultánea), oxaliplatino (85 mg/m2), leucovorina (200 mg/m2), bolo de 5-FU (400 mg/m2) e infusión de 5-FU (1600 mg/m2 durante 46 horas) o 4 ciclos de 5-FU (1000 mg/m2 durante 4 días) y cisplatino (75 mg/m2 el día 1). Todos los pacientes recibieron radioterapia (50 Gy en 25 fracciones).[41][Nivel de evidencia B1]
- Luego de una mediana de seguimiento de 25,3 meses, no hubo una diferencia significativa de la SSP (9,7 meses con FOLFOX vs. 9,4 meses con 5-FU y cisplatino; P = 0,64).
- Un paciente murió debido a efectos tóxicos en el grupo de FOLFOX y 6 pacientes murieron en el grupo de 5-FU y cisplatino (P = 0,066).
- No hubo diferencia importante en los efectos adversos de grados 3 o 4 entre los grupos de tratamiento. Entre todos los efectos tóxicos de cualquier grado, los más frecuentes fueron la parestesia, la neuropatía sensorial y el aumento de concentración de aspartato–transaminasa y alanina–transaminasa en el grupo FOLFOX; en el grupo de 5-FU y cisplatino fueron más frecuentes el aumento de la creatinina sérica, la mucositis y la alopecia.
- En un ensayo alemán de fase III, también se comparó la quimioterapia de inducción (3 ciclos de bolo de 5-FU, leucovorina, etopósido y cisplatino) seguida de quimiorradioterapia (cisplatino, etopósido y 40 Gy de radiación) y cirugía (grupo A) versus la misma quimioterapia de inducción seguida de quimiorradioterapia (por lo menos 65 Gy) sin cirugía (grupo B) en pacientes con carcinoma de células escamosas de esófago T3 o T4. La SG fue el criterio principal de valoración.[38][Nivel de evidencia A1]
- En el análisis de 172 pacientes aptos asignados al azar, se observó que las tasas de SG a 2 años no presentaron diferencias estadísticamente significativas entre los dos grupos de tratamiento (grupo A: 39,9 %; IC 95 %, 29,4–50,4 %; grupo B: 35,4 %; IC 95 %, 25,2–45,6 %; prueba de orden logarítmico de equivalencia con 0,15, P < 0,007).
- La tasa de SSP local a 2 años fue más alta en el grupo de cirugía (64,3 %; IC 95 %, 52,1–76,5 %) que en el grupo de quimiorradioterapia (40,7 %; IC 95 %, 28,9–52,5 %; CRI para el grupo B vs. grupo A, 2,1; IC 95 %, 1,3–3,5; P < 0,003).
- La tasa de mortalidad relacionada con el tratamiento fue más alta en el grupo de cirugía (12,8 %) que en el grupo de quimiorradioterapia (3,5 %) (P < 0,03).
- En el ensayo FFCD 9102 (NCT00416858), se asignó al azar a 259 pacientes de cáncer de esófago torácico T3N0–1M0 para recibir 2 ciclos de 5-FU y cisplatino (días 1–5 y 22–26) con radiación convencional (46 Gy en 4,5 semanas) o radiación de ciclo dividido (15 Gy, días 1–5 y 22–26). Los pacientes que respondieron al tratamiento se asignaron a resección quirúrgica (grupo A) o continuación de la quimiorradioterapia (grupo B: 3 ciclos de 5-FU con cisplatino y 20 Gy de radioterapia convencional o 15 Gy de radioterapia de ciclo dividido).[39][Nivel de evidencia A1]
- De los 259 pacientes asignados al azar, 230 (89 %) tenían carcinomas de células escamosas y 29 pacientes (11 %) tenían adenocarcinomas.
- La tasa de SG a 2 años fue del 34 % para los pacientes asignados al azar a cirugía versus el 40 % para los pacientes asignados al azar a quimiorradioterapia (CRI, 0,90; P = 0,44). La mediana de supervivencia fue de 17,7 meses para la cirugía y de 19,3 meses para la quimiorradioterapia definitiva.
- La tasa de mortalidad a 3 meses fue del 9,3 % para el grupo de cirugía, en comparación con el 0,8 % para el grupo de quimiorradioterapia (P = 0,002).
Terapia adyuvante
Evidencia (terapia adyuvante):
- En un ensayo mundial de fase III, con doble enmascaramiento, controlado con placebo y aleatorizado, se evaluó un inhibidor de puntos de control como terapia adyuvante en 794 pacientes con cáncer de esófago o cáncer de la unión gastroesofágica. Se incluyeron adultos con un estado funcional de 0 o 1, enfermedad en estadio II o III y R0 que recibieron quimiorradioterapia neoadyuvante y tenían enfermedad residual patológica. Se asignó al azar a los pacientes en una proporción de 2:1 a recibir nivolumab (240 mg cada 2 semanas por 16 semanas) seguido por nivolumab (480 mg cada 4 semanas) (532 pacientes) o un placebo equivalente (262 pacientes). Se inscribieron los pacientes con independencia de la expresión del ligando de la proteína de muerte programada 1 (PD-L1). La duración máxima del período de intervención del ensayo fue de 1 año. El criterio principal de valoración fue la SSE. La mediana de seguimiento fue de 24,4 meses.[42][Nivel de evidencia B1]
- La mediana de SSE fue de 22,4 meses (IC 95 %, 16,6–34,0) en los pacientes que recibieron nivolumab en comparación con 11,0 meses (IC 95 %, 8,3–14,3) en los pacientes que recibieron placebo. El CRIde recidiva o muerte fue de 0,69 (IC 96,4 %, 0,56–0,86; P < 0,001).
- Se evaluó la mediana de SSE entre los subgrupos predefinidos según el tipo histológico. En los pacientes con adenocarcinoma, la mediana de la SSE fue de 19,4 meses en los 376 pacientes que recibieron nivolumab (IC 95 %, 15,9–29,4), en comparación con 11,1 meses en los 187 pacientes que recibieron placebo (IC 95 %, 8,3–16,8); el CRIde recidiva o muerte fue de 0,75 (IC 95 %, 0,59–0,96). En los pacientes con carcinoma de células escamosas, la mediana de SSE fue de 29,7 meses (IC 95 %, 14,4 a tiempo indefinido) en 155 pacientes que recibieron nivolumab, en comparación con 11 meses (IC 95 %, 7,6–17,8) en 75 pacientes que recibieron placebo; el CRI de recidiva o muerte fue de 0,61 (IC 95 %, 0,42–0,88).
- Los CRIde recidiva o muerte estuvieron muy cerca en los 570 pacientes cuyos tumores expresaron menos del 1 % de PD-L1 (CRI, 0,73;IC 95 %, 0,57–0,92) y en los 129 pacientes cuyos tumores expresaron un 1 % o más PD-L1 (CRI, 0,75;IC 95 %, 0,45–1,24).
- Ocurrieron efectos adversos de grados 3 o 4 por cualquier causa en 183 de 532 pacientes (34 %) del grupo de nivolumab y en 84 de 260 pacientes (32 %) del grupo de placebo, además, ocurrieron efectos adversos graves de cualquier grado en el 30 % de los pacientes de cada grupo (nivolumab: 158 de 532; placebo: 78 de 260). Los efectos adversos que según los investigadores estuvieron relacionados con el régimen del ensayo fueron más frecuentes con el nivolumab que con el placebo, incluidos los efectos de grado 3 o 4 (nivolumab: 71 de 532 pacientes [13 %]; placebo: 15 de 260 pacientes [6 %]) y los efectos que condujeron a la interrupción de la terapia (nivolumab: 48 de 532 pacientes [9 %]; placebo: 8 de 260 pacientes [3 %]).
- En este ensayo, no se notificaron datos de la SG.
Debido a los resultados favorables del uso de nivolumab después de la quimiorradioterapia y la cirugía en pacientes con cáncer de esófago, en un estudio en curso se determinará si el uso adyuvante de la terapia con un inhibidor de puntos de control mejora los desenlaces de los pacientes que se someten a quimiorradioterapia definitiva sin cirugía (KEYNOTE-975 [NCT04210115]). En los estudios también se evalúan los posibles beneficios en pacientes que se someten a quimioterapia perioperatoria sin radioterapia (por ejemplo, KEYNOTE-585 [NCT03221426]).[43]
Inmunoterapia y quimioinmunoterapia
Inmunoterapia y quimioinmunoterapia para pacientes con carcinoma de células escamosas
En ensayos aleatorizados de fase III se comparó la quimioterapia con la quimioinmunoterapia como tratamiento de primera línea para pacientes con carcinoma de células escamosas en estadio avanzado.[44-46]
Evidencia (inmunoterapia y quimioinmunoterapia para pacientes con carcinoma de células escamosas):
- En el ensayo CheckMate 648 (NCT03143153), se incluyeron 970 adultos con carcinoma de células escamosas metastásico, recurrente, en estadio avanzado, irresecable, que no habían recibido tratamiento, con independencia de la expresión de PD-L1. Los pacientes se asignaron al azar para recibir nivolumab (240 mg cada 2 semanas) y quimioterapia con 5-FU y cisplatino (cada 4 semanas), nivolumab (3 mg/kg cada 2 semanas) e ipilimumab (1 mg/kg cada 6 semanas), o quimioterapia sola. Los criterios principales de valoración para todos los grupos fueron la SG y la SSP de acuerdo a revisión central con enmascaramiento en pacientes con un 1 % o más de células tumorales positivas para PD-L1 (se observó en el 49 % de los pacientes). En análisis posteriores se incluyeron todos los pacientes con independencia del estado de PD-L1.[44]
- En pacientes con enfermedad positiva para PD-L1, la mediana de SG fue de 15,4 meses en los pacientes que recibieron nivolumab con quimioterapia (IC 95 %, 11,9–19,5; n = 158), de 13,7 meses en los pacientes que recibieron nivolumab e ipilimumab (IC 95 %, 11,2–17,0; n = 158), y de 9,1 meses en los pacientes que recibieron quimioterapia sola (IC 95 %, 7,7–10,0; n = 157). El CRI correspondiente (vs. quimioterapia) fue de 0,54 (IC 99,5 %, 0,37–0,8; P < 0,0001) en pacientes que recibieron nivolumab con quimioterapia y de 0,64 (IC 98,6 %, 0,46–0,9; P < 0,001) en los pacientes que recibieron nivolumab e ipilimumab.[44][Nivel de evidencia A1]
- También se observó una mejora estadísticamente significativa en la mediana de SG, en comparación con la quimioterapia en todos los pacientes incluidos en el estudio independientemente del estado de PD-L1. La mediana de SG fue de 13,2 meses en los pacientes que recibieron nivolumab con quimioterapia (IC 95 %, 11,1–15,7; n = 321), de 12,8 meses en los pacientes que recibieron nivolumab e ipilimumab (IC 95 %, 11,3–15,5; n = 325), y de 10,7 meses en los pacientes que recibieron quimioterapia sola (IC 95 %, 9,4–11,9; n = 324). El CRI correspondiente (vs. quimioterapia) fue de 0,74 (IC 99,1 %, 0,58–0,96; P = 0,0021) en los pacientes que recibieron nivolumab con quimioterapia y de 0,78 (IC 98,2 %, 0,62–0,98; P = 0,011) en los pacientes que recibieron nivolumab e ipilimumab.[44][Nivel de evidencia A1]
- Sin embargo, entre los pacientes cuyos tumores expresaban menos de un 1 % de PD-L1, la SG no se modificó significativamente con la adición de nivolumab a la quimioterapia (n = 329; mediana de SG, 12,2 meses con quimioterapia y 12 meses con nivolumab y quimioterapia) o con la combinación de nivolumab e ipilimumab (n = 330; mediana de SG, 12,2 meses con quimioterapia y 12 meses con nivolumab e ipilimumab).
- Se presentaron efectos adversos de grado 3 o superior en 147 pacientes (47 %) que recibieron nivolumab y quimioterapia, 102 pacientes (32 %) que recibieron nivolumab e ipilimumab, y 108 pacientes (36 %) que recibieron quimioterapia sola. No se observaron alertas de seguridad nuevas.
- A partir de los resultados del ESCORT-1st (NCT03691090), un ensayo controlado con placebo, aleatorizado, con doble enmascaramiento, multicéntrico realizado en China, se corroboró el efecto positivo de los inhibidores de puntos de control en combinación con la quimioterapia de primera línea en la supervivencia del paciente. En este ensayo, 596 pacientes con cáncer de células escamosas de esófago localmente avanzado o metastásico sin tratamiento previo se asignaron de manera aleatoria (1:1) para recibir el anticuerpo monoclonal humanizado anti-PD-1 camrelizumab (200 mg; n = 298) o placebo (n = 298). Los pacientes de ambos grupos también recibieron hasta 6 ciclos de paclitaxel (175 mg/m2) y cisplatino (75 mg/m2). Todos los medicamentos se administraron por vía intravenosa cada 3 semanas. Los criterios de valoración coprimarios fueron la SG la SSP evaluada por un comité de revisión independiente (IRC).[45]
- Al cabo de una mediana de seguimiento de 10,8 meses, los pacientes que recibieron camrelizumab y quimioterapia tuvieron una mejora significativa de la SG en comparación con aquellos que recibieron placebo y quimioterapia (mediana de SG, 15,3 meses [IC 95 %, 12,8–17,3] vs. 12,0 meses [11,0–13,3]; CRI, 0,70; IC 95 %, 0,56–0,88; P unilateral = 0,0010).
- Se presentaron efectos adversos de grado 3 o superior relacionados con el tratamiento en 189 pacientes (63,4 %) del grupo de camrelizumab y en 201 pacientes (67,7 %) del grupo de placebo. Ocurrieron 9 muertes (3.0 %) relacionadas con el tratamiento en el grupo de camrelizumab y 11 muertes (3,7 %) relacionadas con el tratamiento en el grupo de placebo.
El camrelizumab solo está aprobado en China.
- En el ensayo de fase III controlado con placebo, aleatorizado, con enmascaramiento doble KEYNOTE-590 (NCT03189719), se incluyeron 1020 pacientes con cáncer de esófago o cáncer de unión gastroesofágica de tipo 1 (clasificación Siewert) localmente avanzado, irresecable o metastásico sin tratamiento previo (con independencia del estado de PD-L1).[46] Un total de 749 pacientes se asignaron al azar (1:1) para recibir pembrolizumab (200 mg) o placebo y quimioterapia (800 mg/m2 de 5-FU los días 1–5 y 80 mg/m2 de cisplatino el día 1 [por un máximo de 6 ciclos]). El tratamiento se repitió cada 3 semanas por un máximo de 35 ciclos. Los criterios principales de valoración fueron: 1) la SG en los pacientes con carcinoma de células escamosas de esófago y un puntaje positivo combinado (CPS) de PD-L1 de 10 o más, y 2) la SG y la SSP en pacientes con carcinoma de células escamosas de esófago, en pacientes con un CPS de PD-L1 de 10 o más con independencia de las características histológicas, y en todos los pacientes aleatorizados. Un total de 548 pacientes inscritos (73 %) presentaron características histológicas de células escamosas, de los cuales 286 (52%) tenían un CPS de 10 o más.
- En el primer análisis interino (al cabo de una mediana de seguimiento de 22,6 meses), los pacientes que recibieron pembrolizumab y quimioterapia presentaron SG superiores en comparación con los pacientes que recibieron placebo y quimioterapia en los siguientes subgrupos:[46][Nivel de evidencia A1]
- Pacientes con carcinoma de células escamosas de esófago y un CPS de PD-L1 CPS de 10 o más (mediana de SG, 13,9 meses vs. 8,8 meses; CRI, 0,57; IC 95 %, 0,43–0,75; P < 0,0001).
- Pacientes con carcinoma de células escamosas de esófago (SG, 12,6 meses vs. 9,8 meses; CRI, 0,72; IC 95 %, 0,60–0,88; P = 0,0006).
- Pacientes con un CPS de PD-L1 de 10 o más (SG, 13,5 meses vs. 9,4 meses; CRI, 0,62; IC 95 %, 0,49–0,78; P < 0,0001).
- Todos los pacientes aleatorizados (SG, 12,4 meses vs. 9,8 meses; CRI, 0,73; IC 95 %, 0,62–0,86; P < 0,0001).
- En cada uno de estos subgrupos, la tasa de SG a 24 meses fue el doble en el grupo de pembrolizumab y quimioterapia que en el grupo de placebo y quimioterapia (alrededor del 30 vs. 15 %).
- Se presentaron efectos adversos relacionados con el tratamiento de grado 3 o superior en 266 pacientes (72 %) en el grupo de pembrolizumab y en 250 pacientes (68 %) del grupo de placebo.
Cabe destacar que, en un análisis exploratorio de pacientes con un CPS de PD-L1 menor a 10, la mediana de SG fue de 10,5 meses en el grupo de pembrolizumab y quimioterapia versus 10,6 meses en el grupo de placebo y quimioterapia (CRI, 0,86; IC 95 %, 0,68–1,10).
- En el primer análisis interino (al cabo de una mediana de seguimiento de 22,6 meses), los pacientes que recibieron pembrolizumab y quimioterapia presentaron SG superiores en comparación con los pacientes que recibieron placebo y quimioterapia en los siguientes subgrupos:[46][Nivel de evidencia A1]
Inmunoterapia y quimioinmunoterapia para pacientes con adenocarcinoma
En abril de 2021, después de la publicación de los resultados del ensayo CheckMate-649, la Administración de Alimentos y Medicamentos de los Estados Unidos aprobó el nivolumab en combinación con quimioterapia que contiene fluoropirimidina y derivados del platino para pacientes con cáncer de estómago, cáncer de unión gastroesofágica y adenocarcinoma gastroesofágico en estadio avanzado o metastásico.[47]
Evidencia (inmunoterapia y quimioinmunoterapia para pacientes con adenocarcinoma):
- En un estudio de fase III aleatorizado, sin enmascaramiento, internacional (CheckMate-649 [NCT02872116]), 1581 pacientes (incluso 955 con un CPS de PD-L1 ≥5) con carcinomas de estómago, de unión gastroesofágica o de esófago negativos para HER2 se asignaron al azar (1:1:1) (1:1 después de que se cerró la inscripción en el grupo de nivolumab e ipilimumab). Un total de 789 pacientes (473 con un CPS de PD-L1 ≥5) se asignaron a recibir nivolumab y quimioterapia (360 mg de nivolumab con capecitabina y oxaliplatino cada 3 semanas, o 240 mg de nivolumab con FOLFOX cada 2 semanas). Un total de 792 pacientes (482 con un CPS de PD-L1 ≥5) se asignaron a recibir quimioterapia sola (capecitabina y oxaliplatino cada 3 semanas o FOLFOX cada 2 semanas). El sitio de origen de la enfermedad fue el siguiente: 1100 pacientes (70 %) presentaron adenocarcinoma de estómago, 260 pacientes (17 %) presentaron carcinoma de unión gastroesofágica, y 211 pacientes (13 %) presentaron adenocarcinoma de esófago.[47]
- La mediana de seguimiento de la SG fue de 13,1 meses (intervalo intercuartílico [IIQ], 6,7–19,1) en el grupo de nivolumab y quimioterapia y de 11,1 meses (IIQ, 5,8–16,1) en el grupo de quimioterapia sola. En el grupo de nivolumab y quimioterapia se presentaron mejoras en la SG (14,4 vs. 11,1 meses; CRI, 0,71; IC 98,4 %, 0,59–0,86; P < 0,0001) y en la SSP (CRI, 0,68; IC 98 %, 0,56–0,81; P < 0,0001) en comparación con el grupo de quimioterapia sola en pacientes con un CPS de PD-L1 de 5 o más (seguimiento, al menos 12,1 meses).[47][Nivel de evidencia A1]
- El CRI sin estratificarde SG en pacientes con un CPS de PD-L1 menor a 1 que recibieron nivolumab y quimioterapia versus quimioterapia sola fue de 0,92 (IC 95 %, 0,70–1,23). En los pacientes con un CPS de PD-L1 menor a 5, el CRI fue de 0,94 (0,78–1,13).
- Se presentaron efectos adversos de grados 3 y 4 en 462 pacientes (59 %) del grupo nivolumab y en 341 pacientes (44 %) del grupo de quimioterapia sola.
- En el KEYNOTE-590 (NCT03189719), pacientes con cáncer de esófago o cáncer de unión gastroesofágica recibieron pembrolizumab o placebo y quimioterapia. Un total de 221 pacientes (27 %) presentaron características histológicas de adenocarcinoma. Para obtener detalles del estudio, consultar la sección Inmunoterapia y quimioinmunoterapia para pacientes con adenocarcinoma.[46]
- La función del nivolumab en combinación con la quimioterapia también se evaluó en el ATTRACTION-4 (NCT02746796), un ensayo de fase III controlado con placebo, aleatorizado, con enmascaramiento doble, multicéntrico. En el estudio se incluyeron pacientes con cáncer de estómago o de unión gastroesofágica negativo para HER2, irresecable, en estadio avanzado o recidivante, con independencia de la expresión de PD-L1 sin tratamiento previo (a excepción de quimioterapia neoadyuvante o adyuvante que se completó ≥180 días antes de la recidiva). Solo el 9 % de los pacientes inscritos presentaron cáncer de unión gastroesofágica. Los pacientes se asignaron al azar (1:1) para recibir quimioterapia cada 3 semanas (130 mg/m² de oxaliplatino intravenoso el día 1 con 40 mg/m² de S-1 oral o 1000 mg/m² de capecitabina oral, 2 veces por día los días 1–14), además de recibir 360 mg de nivolumab intravenoso o placebo. El ensayo se realizó en Japón, Corea del Sur y Taiwán, y 724 pacientes se asignaron para recibir tratamiento: 362 pacientes al grupo de nivolumab y quimioterapia y 362 al grupo de placebo y quimioterapia. Los criterios de valoración principales fueron la SSP evaluada por un comité central y la SG en la población con intención de tratar.[48]
- Al cierre de la base de datos, con una mediana de seguimiento de 11,6 meses, la mediana de SSP fue de 10,45 meses (IC 95 %, 8,44–14,75) en el grupo de nivolumab y quimioterapia, y de 8,34 meses (6,97–9,40) en el grupo de placebo y quimioterapia (CRI, 0,68; IC 98,51 %, 0,51–0,90; P = 0,0007).[48][Nivel de evidencia B1]
- Al cierre de la base de datos, con una mediana de seguimiento de 26,6 meses, la mediana de SG al final del análisis fue de 17,45 meses (IC 95 %, 15,67–20,83) en el grupo de nivolumab y quimioterapia y de 17,15 meses (15,18–19,65) en el grupo de placebo y quimioterapia (CRI, 0,90; IC 95 %, 0,75–1,08; P = 0,26).[48][Nivel de evidencia A1]
- Los efectos adversos relacionados con el tratamiento de grado 3 o 4 más frecuentes fueron la disminución del recuento de neutrófilos (se observó en el 20 % de los pacientes del grupo de nivolumab y quimioterapia vs. el 16 % de los pacientes en el grupo de placebo y quimioterapia) y la disminución en el recuento de plaquetas (se observó en el 9 % de los pacientes de ambos grupos).
- Ocurrieron 6 muertes relacionadas con el tratamiento: 3 en el grupo de nivolumab y quimioterapia (1 por neutropenia febril, 1 por disfunción hepática y 1 por muerte súbita) y 3 en el grupo de placebo y quimioterapia (1 por septicemia, 1 por anemia hemolítica y 1 por enfermedad pulmonar intersticial).
- La expresión tumoral de PD-L1 fue ≥1 % en el 16 % de los pacientes asignados al azar al grupo de nivolumab y en el 15 % de los pacientes asignados al azar al grupo de placebo.
Inmunoterapia para pacientes que recaen después de una línea de tratamiento estándar previa
El pembrolizumab o el nivolumab se pueden administrar a pacientes con cáncer de esófago que ya recibieron un régimen de quimioterapia que no incluyó un inhibidor de puntos de control inmunitario. El pembrolizumab se usa para pacientes con características histológicas de adenocarcinoma o de células escamosas y un CPS de 10 o más. El nivolumab se puede administrar a pacientes con características histológicas adenoescamosas o escamosas, con independencia de la expresión de PD-L1.
Evidencia (inmunoterapia para pacientes que recaen después de una línea de tratamiento estándar previa):
- En el estudio de fase II KEYNOTE-181 (NCT02564263) se incluyeron 628 pacientes con carcinoma de esófago de células escamosas (n = 401) o adenocarcinoma (n = 227) en estadio avanzado o metastásico que progresó después de un tratamiento previo. Los pacientes se asignaron al azar (1:1) para recibir pembrolizumab (200 mg cada 3 semanas por hasta 2 años) o quimioterapia (el investigador eligió entre paclitaxel, docetaxel o irinotecán). Los criterios principales de valoración fueron la SG en los pacientes con un CPS de PD-L1 de 10 o más, la SG en los pacientes con carcinoma de células escamosas, y la SG en todos los pacientes (α unilateral, 0,9 %, 0,8 % y 0,8 %, respectivamente).[49]
- En el análisis final que se realizó 16 meses después de la aleatorización del último paciente, la SG fue superior en los pacientes con un CPS de 10 o más que recibieron pembrolizumab en comparación con aquellos que recibieron quimioterapia (mediana de SG, 9,3 vs. 6,7 meses; CRI, 0,69; IC 95 %, 0,52–0,93; P = 0,0074).[49][Nivel de evidencia A1]
- Entre los pacientes con carcinoma de células escamosas, la mediana de SG fue de 8,2 meses para los pacientes que recibieron pembrolizumab y de 7,1 meses para los pacientes que recibieron quimioterapia (CRI, 0,78; IC 95 %, 0,63–0,96; P = 0,0095). Entre todos los pacientes, la mediana de SG fue de 7,1 meses para los pacientes que recibieron pembrolizumab y de 7,1 meses para los pacientes que recibieron quimioterapia (CRI, 0,89; IC 95 %, 0,75–1,05; P = 0,0560).
- Se presentaron efectos adversos de grado 3 a 5 en el 18,2 % de los pacientes que recibieron pembrolizumab y en el 40,9 % de los pacientes que recibieron quimioterapia.
- Los pacientes de este estudio no habían recibido inmunoterapia previa.
- En el estudio ATTRACTION-3 (NCT02569242), un ensayo de fase III aleatorizado, sin enmascaramiento, multicéntrico, se incluyeron 419 pacientes con cáncer de esófago escamoso o adenoescamoso resistente o intolerante a un tratamiento previo con quimioterapia a base de fluoropirimidina y derivados del platino. Los pacientes se aleatorizaron (1:1) para recibir nivolumab (240 mg cada 2 semanas) (n = 210) o la quimioterapia elegida por el investigador (paclitaxel 1 vez por semana o docetaxel cada 3 semanas) (n = 209). El criterio principal de valoración fue la SG.[50]
- Al cabo de 17,6 meses de seguimiento, la SG mejoró significativamente en el grupo de nivolumab en comparación con el grupo de quimioterapia (mediana de SG, 10,9 meses [IC 95 %, 9,2–13,3] vs. 8,4 meses [IC 95 %, 7,2–9,9]) (CRI de muerte, 0,77; IC 95 %, 0,62–0,96; P = 0,019).[50][Nivel de evidencia A1]
- Se presentaron efectos adversos relacionados con el tratamiento de grado 3 o 4 en 38 de 209 pacientes (18 %) en el grupo de nivolumab y 131 de 208 pacientes (63 %) en el grupo de quimioterapia.
- Los efectos adversos relacionados con el tratamiento de grado 3 o 4 más frecuentes fueron anemia (4 pacientes [2 %]) en el grupo de nivolumab y disminución del recuento de neutrófilos (59 pacientes [28 %]) en el grupo de quimioterapia. Ocurrieron 5 muertes relacionadas con el tratamiento: 2 en el grupo de nivolumab (1 por enfermedad pulmonar intersticial y 1 por neumonitis) y 3 en el grupo de quimioterapia (1 por neumonía, 1 por absceso de médula espinal y 1 por enfermedad pulmonar intersticial).
Radioterapia posoperatoria
En dos ensayos aleatorizados no se observó un beneficio significativo para la SG de la radioterapia posoperatoria comparada con la cirugía sola.[51,52][Nivel de evidencia A1] Todos los pacientes con diagnóstico reciente se deben considerar aptos para tratamientos y ensayos clínicos en los que se comparen distintas modalidades de tratamiento. Para obtener más información sobre los ensayos clínicos en curso, consultar el portal de Internet del NCI.
Administración de capecitabina y fluorouracilo
El gen DPYD codifica la enzima que cataboliza las pirimidinas y las fluoropirimidinas, como la capecitabina y el fluorouracilo. Se estima que entre el 1 % y el 2 % de la población tiene variantes defectuosas de DPYD que reducen la función de la proteína DPD y la acumulación de pirimidinas y fluoropirimidinas en el cuerpo.[53,54] Los pacientes con la variante DPYD*2A que reciben fluoropirimidinas quizás presenten efectos tóxicos graves que ponen en riesgo la salud, y a veces son mortales. Se han identificado muchas otras variantes de DPYD, con diferentes efectos clínicos.[53-55] Es posible que se recomiende evitar la fluoropirimidina o reducir la dosis al 50 % según el genotipo DPYD del paciente y el número de alelos funcionales de DPYD.[56-58] Las pruebas genéticas para DPYD cuestan menos de $200, pero la cobertura del seguro varía debido a la falta de directrices nacionales.[59] Además, es posible que las pruebas retrasen el tratamiento por 2 semanas, lo que no sería aconsejable en casos de urgencia. Este tema es objeto de controversia y requiere evaluación adicional.[60]
Bibliografía
- Baron TH: Expandable metal stents for the treatment of cancerous obstruction of the gastrointestinal tract. N Engl J Med 344 (22): 1681-7, 2001. [PUBMED Abstract]
- Javle M, Ailawadhi S, Yang GY, et al.: Palliation of malignant dysphagia in esophageal cancer: a literature-based review. J Support Oncol 4 (8): 365-73, 379, 2006. [PUBMED Abstract]
- Doosti-Irani A, Mansournia MA, Rahimi-Foroushani A, et al.: Complications of stent placement in patients with esophageal cancer: A systematic review and network meta-analysis. PLoS One 12 (10): e0184784, 2017. [PUBMED Abstract]
- Fuccio L, Scagliarini M, Frazzoni L, et al.: Development of a prediction model of adverse events after stent placement for esophageal cancer. Gastrointest Endosc 83 (4): 746-52, 2016. [PUBMED Abstract]
- Litle VR, Luketich JD, Christie NA, et al.: Photodynamic therapy as palliation for esophageal cancer: experience in 215 patients. Ann Thorac Surg 76 (5): 1687-92; discussion 1692-3, 2003. [PUBMED Abstract]
- Katsoulis IE, Karoon A, Mylvaganam S, et al.: Endoscopic palliation of malignant dysphagia: a challenging task in inoperable oesophageal cancer. World J Surg Oncol 4: 38, 2006. [PUBMED Abstract]
- Lerut T, Coosemans W, Van Raemdonck D, et al.: Surgical treatment of Barrett's carcinoma. Correlations between morphologic findings and prognosis. J Thorac Cardiovasc Surg 107 (4): 1059-65; discussion 1065-6, 1994. [PUBMED Abstract]
- Kelsen DP, Bains M, Burt M: Neoadjuvant chemotherapy and surgery of cancer of the esophagus. Semin Surg Oncol 6 (5): 268-73, 1990. [PUBMED Abstract]
- Saxon RR, Morrison KE, Lakin PC, et al.: Malignant esophageal obstruction and esophagorespiratory fistula: palliation with a polyethylene-covered Z-stent. Radiology 202 (2): 349-54, 1997. [PUBMED Abstract]
- Campbell WR, Taylor SA, Pierce GE, et al.: Therapeutic alternatives in patients with esophageal cancer. Am J Surg 150 (6): 665-8, 1985. [PUBMED Abstract]
- Mellow MH, Pinkas H: Endoscopic therapy for esophageal carcinoma with Nd:YAG laser: prospective evaluation of efficacy, complications, and survival. Gastrointest Endosc 30 (6): 334-9, 1984. [PUBMED Abstract]
- Karlin DA, Fisher RS, Krevsky B: Prolonged survival and effective palliation in patients with squamous cell carcinoma of the esophagus following endoscopic laser therapy. Cancer 59 (11): 1969-72, 1987. [PUBMED Abstract]
- Hulscher JB, van Sandick JW, de Boer AG, et al.: Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the esophagus. N Engl J Med 347 (21): 1662-9, 2002. [PUBMED Abstract]
- de Boer AG, van Lanschot JJ, van Sandick JW, et al.: Quality of life after transhiatal compared with extended transthoracic resection for adenocarcinoma of the esophagus. J Clin Oncol 22 (20): 4202-8, 2004. [PUBMED Abstract]
- Santillan AA, Farma JM, Meredith KL, et al.: Minimally invasive surgery for esophageal cancer. J Natl Compr Canc Netw 6 (9): 879-84, 2008. [PUBMED Abstract]
- National Cancer Institute: SEER Cancer Stat Facts: Esophageal Cancer. Bethesda, Md: National Cancer Institute. Available online. Last accessed February 7, 2025.
- Ellis FH, Williamson WA, Heatley GJ: Cancer of the esophagus and cardia: does age influence treatment selection and surgical outcomes? J Am Coll Surg 187 (4): 345-51, 1998. [PUBMED Abstract]
- Hofheinz RD, Merx K, Haag GM, et al.: FLOT Versus FLOT/Trastuzumab/Pertuzumab Perioperative Therapy of Human Epidermal Growth Factor Receptor 2-Positive Resectable Esophagogastric Adenocarcinoma: A Randomized Phase II Trial of the AIO EGA Study Group. J Clin Oncol 40 (32): 3750-3761, 2022. [PUBMED Abstract]
- Bosset JF, Gignoux M, Triboulet JP, et al.: Chemoradiotherapy followed by surgery compared with surgery alone in squamous-cell cancer of the esophagus. N Engl J Med 337 (3): 161-7, 1997. [PUBMED Abstract]
- Walsh TN, Noonan N, Hollywood D, et al.: A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med 335 (7): 462-7, 1996. [PUBMED Abstract]
- Urba SG, Orringer MB, Turrisi A, et al.: Randomized trial of preoperative chemoradiation versus surgery alone in patients with locoregional esophageal carcinoma. J Clin Oncol 19 (2): 305-13, 2001. [PUBMED Abstract]
- Tepper J, Krasna MJ, Niedzwiecki D, et al.: Phase III trial of trimodality therapy with cisplatin, fluorouracil, radiotherapy, and surgery compared with surgery alone for esophageal cancer: CALGB 9781. J Clin Oncol 26 (7): 1086-92, 2008. [PUBMED Abstract]
- van Hagen P, Hulshof MC, van Lanschot JJ, et al.: Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 366 (22): 2074-84, 2012. [PUBMED Abstract]
- Oppedijk V, van der Gaast A, van Lanschot JJ, et al.: Patterns of recurrence after surgery alone versus preoperative chemoradiotherapy and surgery in the CROSS trials. J Clin Oncol 32 (5): 385-91, 2014. [PUBMED Abstract]
- Mariette C, Dahan L, Mornex F, et al.: Surgery alone versus chemoradiotherapy followed by surgery for stage I and II esophageal cancer: final analysis of randomized controlled phase III trial FFCD 9901. J Clin Oncol 32 (23): 2416-22, 2014. [PUBMED Abstract]
- Shapiro J, van Lanschot JJ, Hulshof MC, et al.: Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial. Lancet Oncol 16 (9): 1090-8, 2015. [PUBMED Abstract]
- Safran HP, Winter K, Ilson DH, et al.: Trastuzumab with trimodality treatment for oesophageal adenocarcinoma with HER2 overexpression (NRG Oncology/RTOG 1010): a multicentre, randomised, phase 3 trial. Lancet Oncol 23 (2): 259-269, 2022. [PUBMED Abstract]
- Medical Research Council Oesophageal Cancer Working Group: Surgical resection with or without preoperative chemotherapy in oesophageal cancer: a randomised controlled trial. Lancet 359 (9319): 1727-33, 2002. [PUBMED Abstract]
- Ando N, Kato H, Igaki H, et al.: A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluorouracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907). Ann Surg Oncol 19 (1): 68-74, 2012. [PUBMED Abstract]
- Ychou M, Boige V, Pignon JP, et al.: Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 29 (13): 1715-21, 2011. [PUBMED Abstract]
- Kelsen DP, Ginsberg R, Pajak TF, et al.: Chemotherapy followed by surgery compared with surgery alone for localized esophageal cancer. N Engl J Med 339 (27): 1979-84, 1998. [PUBMED Abstract]
- Stahl M, Walz MK, Stuschke M, et al.: Phase III comparison of preoperative chemotherapy compared with chemoradiotherapy in patients with locally advanced adenocarcinoma of the esophagogastric junction. J Clin Oncol 27 (6): 851-6, 2009. [PUBMED Abstract]
- Cunningham D, Allum WH, Stenning SP, et al.: Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 355 (1): 11-20, 2006. [PUBMED Abstract]
- Al-Batran SE, Homann N, Pauligk C, et al.: Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet 393 (10184): 1948-1957, 2019. [PUBMED Abstract]
- Hoeppner J, Brunner T, Lordick F, et al.: Prospective randomized multicenter phase III trial comparing perioperative chemotherapy (FLOT protocol) to neoadjuvant chemoradiation (CROSS protocol) in patients with adenocarcinoma of the esophagus (ESOPEC trial). [Abstract] J Clin Oncol 42 (Suppl 17): A-LBA1, 2024.
- Cooper JS, Guo MD, Herskovic A, et al.: Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG 85-01). Radiation Therapy Oncology Group. JAMA 281 (17): 1623-7, 1999. [PUBMED Abstract]
- Minsky BD, Pajak TF, Ginsberg RJ, et al.: INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy. J Clin Oncol 20 (5): 1167-74, 2002. [PUBMED Abstract]
- Stahl M, Stuschke M, Lehmann N, et al.: Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus. J Clin Oncol 23 (10): 2310-7, 2005. [PUBMED Abstract]
- Bedenne L, Michel P, Bouché O, et al.: Chemoradiation followed by surgery compared with chemoradiation alone in squamous cancer of the esophagus: FFCD 9102. J Clin Oncol 25 (10): 1160-8, 2007. [PUBMED Abstract]
- Smith TJ, Ryan LM, Douglass HO, et al.: Combined chemoradiotherapy vs. radiotherapy alone for early stage squamous cell carcinoma of the esophagus: a study of the Eastern Cooperative Oncology Group. Int J Radiat Oncol Biol Phys 42 (2): 269-76, 1998. [PUBMED Abstract]
- Conroy T, Galais MP, Raoul JL, et al.: Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer (PRODIGE5/ACCORD17): final results of a randomised, phase 2/3 trial. Lancet Oncol 15 (3): 305-14, 2014. [PUBMED Abstract]
- Kelly RJ, Ajani JA, Kuzdzal J, et al.: Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer. N Engl J Med 384 (13): 1191-1203, 2021. [PUBMED Abstract]
- Ilson DH: Adjuvant Nivolumab in Esophageal Cancer - A New Standard of Care. N Engl J Med 384 (13): 1269-1271, 2021. [PUBMED Abstract]
- Doki Y, Ajani JA, Kato K, et al.: Nivolumab Combination Therapy in Advanced Esophageal Squamous-Cell Carcinoma. N Engl J Med 386 (5): 449-462, 2022. [PUBMED Abstract]
- Luo H, Lu J, Bai Y, et al.: Effect of Camrelizumab vs Placebo Added to Chemotherapy on Survival and Progression-Free Survival in Patients With Advanced or Metastatic Esophageal Squamous Cell Carcinoma: The ESCORT-1st Randomized Clinical Trial. JAMA 326 (10): 916-925, 2021. [PUBMED Abstract]
- Sun JM, Shen L, Shah MA, et al.: Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study. Lancet 398 (10302): 759-771, 2021. [PUBMED Abstract]
- Janjigian YY, Shitara K, Moehler M, et al.: First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet 398 (10294): 27-40, 2021. [PUBMED Abstract]
- Kang YK, Chen LT, Ryu MH, et al.: Nivolumab plus chemotherapy versus placebo plus chemotherapy in patients with HER2-negative, untreated, unresectable advanced or recurrent gastric or gastro-oesophageal junction cancer (ATTRACTION-4): a randomised, multicentre, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 23 (2): 234-247, 2022. [PUBMED Abstract]
- Kojima T, Shah MA, Muro K, et al.: Randomized Phase III KEYNOTE-181 Study of Pembrolizumab Versus Chemotherapy in Advanced Esophageal Cancer. J Clin Oncol 38 (35): 4138-4148, 2020. [PUBMED Abstract]
- Kato K, Cho BC, Takahashi M, et al.: Nivolumab versus chemotherapy in patients with advanced oesophageal squamous cell carcinoma refractory or intolerant to previous chemotherapy (ATTRACTION-3): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 20 (11): 1506-1517, 2019. [PUBMED Abstract]
- Ténière P, Hay JM, Fingerhut A, et al.: Postoperative radiation therapy does not increase survival after curative resection for squamous cell carcinoma of the middle and lower esophagus as shown by a multicenter controlled trial. French University Association for Surgical Research. Surg Gynecol Obstet 173 (2): 123-30, 1991. [PUBMED Abstract]
- Fok M, Sham JS, Choy D, et al.: Postoperative radiotherapy for carcinoma of the esophagus: a prospective, randomized controlled study. Surgery 113 (2): 138-47, 1993. [PUBMED Abstract]
- Sharma BB, Rai K, Blunt H, et al.: Pathogenic DPYD Variants and Treatment-Related Mortality in Patients Receiving Fluoropyrimidine Chemotherapy: A Systematic Review and Meta-Analysis. Oncologist 26 (12): 1008-1016, 2021. [PUBMED Abstract]
- Lam SW, Guchelaar HJ, Boven E: The role of pharmacogenetics in capecitabine efficacy and toxicity. Cancer Treat Rev 50: 9-22, 2016. [PUBMED Abstract]
- Shakeel F, Fang F, Kwon JW, et al.: Patients carrying DPYD variant alleles have increased risk of severe toxicity and related treatment modifications during fluoropyrimidine chemotherapy. Pharmacogenomics 22 (3): 145-155, 2021. [PUBMED Abstract]
- Amstutz U, Henricks LM, Offer SM, et al.: Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing: 2017 Update. Clin Pharmacol Ther 103 (2): 210-216, 2018. [PUBMED Abstract]
- Henricks LM, Lunenburg CATC, de Man FM, et al.: DPYD genotype-guided dose individualisation of fluoropyrimidine therapy in patients with cancer: a prospective safety analysis. Lancet Oncol 19 (11): 1459-1467, 2018. [PUBMED Abstract]
- Lau-Min KS, Varughese LA, Nelson MN, et al.: Preemptive pharmacogenetic testing to guide chemotherapy dosing in patients with gastrointestinal malignancies: a qualitative study of barriers to implementation. BMC Cancer 22 (1): 47, 2022. [PUBMED Abstract]
- Brooks GA, Tapp S, Daly AT, et al.: Cost-effectiveness of DPYD Genotyping Prior to Fluoropyrimidine-based Adjuvant Chemotherapy for Colon Cancer. Clin Colorectal Cancer 21 (3): e189-e195, 2022. [PUBMED Abstract]
- Baker SD, Bates SE, Brooks GA, et al.: DPYD Testing: Time to Put Patient Safety First. J Clin Oncol 41 (15): 2701-2705, 2023. [PUBMED Abstract]
Tratamiento del cáncer de esófago en estadio 0
Opciones de tratamiento del cáncer de esófago en estadio 0
Si bien el cáncer de esófago de células escamosas en estadio 0 es muy infrecuente en los Estados Unidos, se ha utilizado la cirugía para tratarlo. Las técnicas quirúrgicas y endoscópicas proporcionan tasas altas de curación para el cáncer de esófago en estadio temprano con invasión mínima.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Rusch VW, Levine DS, Haggitt R, et al.: The management of high grade dysplasia and early cancer in Barrett's esophagus. A multidisciplinary problem. Cancer 74 (4): 1225-9, 1994. [PUBMED Abstract]
- Heitmiller RF, Redmond M, Hamilton SR: Barrett's esophagus with high-grade dysplasia. An indication for prophylactic esophagectomy. Ann Surg 224 (1): 66-71, 1996. [PUBMED Abstract]
- Pech O, Bollschweiler E, Manner H, et al.: Comparison between endoscopic and surgical resection of mucosal esophageal adenocarcinoma in Barrett's esophagus at two high-volume centers. Ann Surg 254 (1): 67-72, 2011. [PUBMED Abstract]
- Prasad GA, Wu TT, Wigle DA, et al.: Endoscopic and surgical treatment of mucosal (T1a) esophageal adenocarcinoma in Barrett's esophagus. Gastroenterology 137 (3): 815-23, 2009. [PUBMED Abstract]
Tratamiento del cáncer de esófago en estadio I
Opciones de tratamiento del cáncer de esófago en estadio I
Las opciones de tratamiento del cáncer de esófago en estadio I son las siguientes:
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Bosset JF, Gignoux M, Triboulet JP, et al.: Chemoradiotherapy followed by surgery compared with surgery alone in squamous-cell cancer of the esophagus. N Engl J Med 337 (3): 161-7, 1997. [PUBMED Abstract]
- Walsh TN, Noonan N, Hollywood D, et al.: A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med 335 (7): 462-7, 1996. [PUBMED Abstract]
- Urba SG, Orringer MB, Turrisi A, et al.: Randomized trial of preoperative chemoradiation versus surgery alone in patients with locoregional esophageal carcinoma. J Clin Oncol 19 (2): 305-13, 2001. [PUBMED Abstract]
- Tepper J, Krasna MJ, Niedzwiecki D, et al.: Phase III trial of trimodality therapy with cisplatin, fluorouracil, radiotherapy, and surgery compared with surgery alone for esophageal cancer: CALGB 9781. J Clin Oncol 26 (7): 1086-92, 2008. [PUBMED Abstract]
- van Hagen P, Hulshof MC, van Lanschot JJ, et al.: Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 366 (22): 2074-84, 2012. [PUBMED Abstract]
- Conroy T, Galais MP, Raoul JL, et al.: Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer (PRODIGE5/ACCORD17): final results of a randomised, phase 2/3 trial. Lancet Oncol 15 (3): 305-14, 2014. [PUBMED Abstract]
- Mariette C, Dahan L, Mornex F, et al.: Surgery alone versus chemoradiotherapy followed by surgery for stage I and II esophageal cancer: final analysis of randomized controlled phase III trial FFCD 9901. J Clin Oncol 32 (23): 2416-22, 2014. [PUBMED Abstract]
Tratamiento del cáncer de esófago en estadio II
Opciones de tratamiento del cáncer de esófago en estadio II
Las opciones de tratamiento del cáncer de esófago en estadio II son las siguientes:
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Walsh TN, Noonan N, Hollywood D, et al.: A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med 335 (7): 462-7, 1996. [PUBMED Abstract]
- Tepper J, Krasna MJ, Niedzwiecki D, et al.: Phase III trial of trimodality therapy with cisplatin, fluorouracil, radiotherapy, and surgery compared with surgery alone for esophageal cancer: CALGB 9781. J Clin Oncol 26 (7): 1086-92, 2008. [PUBMED Abstract]
- van Hagen P, Hulshof MC, van Lanschot JJ, et al.: Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 366 (22): 2074-84, 2012. [PUBMED Abstract]
- Urba SG, Orringer MB, Turrisi A, et al.: Randomized trial of preoperative chemoradiation versus surgery alone in patients with locoregional esophageal carcinoma. J Clin Oncol 19 (2): 305-13, 2001. [PUBMED Abstract]
- Bosset JF, Gignoux M, Triboulet JP, et al.: Chemoradiotherapy followed by surgery compared with surgery alone in squamous-cell cancer of the esophagus. N Engl J Med 337 (3): 161-7, 1997. [PUBMED Abstract]
- Conroy T, Galais MP, Raoul JL, et al.: Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer (PRODIGE5/ACCORD17): final results of a randomised, phase 2/3 trial. Lancet Oncol 15 (3): 305-14, 2014. [PUBMED Abstract]
- Mariette C, Dahan L, Mornex F, et al.: Surgery alone versus chemoradiotherapy followed by surgery for stage I and II esophageal cancer: final analysis of randomized controlled phase III trial FFCD 9901. J Clin Oncol 32 (23): 2416-22, 2014. [PUBMED Abstract]
- Medical Research Council Oesophageal Cancer Working Group: Surgical resection with or without preoperative chemotherapy in oesophageal cancer: a randomised controlled trial. Lancet 359 (9319): 1727-33, 2002. [PUBMED Abstract]
- Ando N, Kato H, Igaki H, et al.: A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluorouracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907). Ann Surg Oncol 19 (1): 68-74, 2012. [PUBMED Abstract]
- Ychou M, Boige V, Pignon JP, et al.: Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 29 (13): 1715-21, 2011. [PUBMED Abstract]
- Stahl M, Stuschke M, Lehmann N, et al.: Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus. J Clin Oncol 23 (10): 2310-7, 2005. [PUBMED Abstract]
- Bedenne L, Michel P, Bouché O, et al.: Chemoradiation followed by surgery compared with chemoradiation alone in squamous cancer of the esophagus: FFCD 9102. J Clin Oncol 25 (10): 1160-8, 2007. [PUBMED Abstract]
Tratamiento del cáncer de esófago en estadio III
Opciones de tratamiento del cáncer de esófago en estadio III
Las opciones de tratamiento del cáncer de esófago en estadio III son las siguientes:
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Walsh TN, Noonan N, Hollywood D, et al.: A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med 335 (7): 462-7, 1996. [PUBMED Abstract]
- Tepper J, Krasna MJ, Niedzwiecki D, et al.: Phase III trial of trimodality therapy with cisplatin, fluorouracil, radiotherapy, and surgery compared with surgery alone for esophageal cancer: CALGB 9781. J Clin Oncol 26 (7): 1086-92, 2008. [PUBMED Abstract]
- van Hagen P, Hulshof MC, van Lanschot JJ, et al.: Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 366 (22): 2074-84, 2012. [PUBMED Abstract]
- Medical Research Council Oesophageal Cancer Working Group: Surgical resection with or without preoperative chemotherapy in oesophageal cancer: a randomised controlled trial. Lancet 359 (9319): 1727-33, 2002. [PUBMED Abstract]
- Ando N, Kato H, Igaki H, et al.: A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluorouracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907). Ann Surg Oncol 19 (1): 68-74, 2012. [PUBMED Abstract]
- Ychou M, Boige V, Pignon JP, et al.: Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 29 (13): 1715-21, 2011. [PUBMED Abstract]
- Conroy T, Galais MP, Raoul JL, et al.: Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer (PRODIGE5/ACCORD17): final results of a randomised, phase 2/3 trial. Lancet Oncol 15 (3): 305-14, 2014. [PUBMED Abstract]
- Stahl M, Stuschke M, Lehmann N, et al.: Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus. J Clin Oncol 23 (10): 2310-7, 2005. [PUBMED Abstract]
- Bedenne L, Michel P, Bouché O, et al.: Chemoradiation followed by surgery compared with chemoradiation alone in squamous cancer of the esophagus: FFCD 9102. J Clin Oncol 25 (10): 1160-8, 2007. [PUBMED Abstract]
Tratamiento del cáncer de esófago en estadio IV
Opciones de tratamiento del cáncer de esófago en estadio IV
En el momento del diagnóstico, cerca del 50 % de los pacientes con cáncer de esófago tienen enfermedad metastásica y son aptos para recibir terapia paliativa.[1]
Las opciones de tratamiento del cáncer de esófago en estadio IV son las siguientes:
- Quimiorradioterapia seguida de cirugía (para pacientes con enfermedad en estadio IVA)
- Quimioterapia, que proporciona respuestas parciales en pacientes de adenocarcinomas de esófago con metástasis a distancia.[2-4]
- Terapia adyuvante para pacientes con adenocarcinoma de esófago, carcinoma de células escamosas de esófago o cáncer de unión gastroesofágica resecados por completo (márgenes negativos), que presentaban enfermedad patológica residual después de recibir quimiorradioterapia simultánea.[5]
- Inmunoterapia y quimioinmunoterapia para pacientes con carcinoma de células escamosas de esófago metastásico, recurrente, en estadio avanzado, irresecable, que no habían recibido tratamiento.[6-8]
- Inmunoterapia y quimioinmunoterapia para pacientes con adenocarcinoma de esófago o cáncer de unión gastroesofágica en estadio avanzado o metastásico que no habían recibido tratamiento.[8-10]
- Inmunoterapia para pacientes que recaen después de una línea de tratamiento estándar previa.[11,12]
- Nivolumab y quimioterapia para pacientes con adenocarcinoma.[9]
- Destrucción endoluminal del tumor con láser Nd:YAG o electrocoagulación.[13,14]
- Colocación endoscópica de endoprótesis para aliviar la disfagia.[15]
- Radioterapia con intubación y dilatación intraluminal o sin estas.
- Braquiterapia intraluminal para aliviar la disfagia.[16,17]
- Participación en ensayos clínicos en los que se evalúa quimioterapia en monoterapia o combinada.
El tratamiento de los pacientes con cáncer de esófago metastásico o recidivante, inoperable, localmente avanzado, negativo para el receptor 2 del factor de crecimiento epidérmico humano (HER2) mejoró con la adición de quimioinmunoterapia como tratamiento de primera línea e inmunoterapia para los pacientes que recaen después de una primera línea de quimioterapia. La quimioinmunoterapia de primera línea se considera ahora el tratamiento estándar para pacientes con cáncer de esófago en estadio avanzado con características histológicas de células escamosas o adenocarcinoma y expresión del ligando de muerte programada 1 (PD-L1) (sin embargo, queda por definir el punto de corte óptimo). Para obtener más información, consultar la sección Inmunoterapia y quimioinmunoterapia.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Enzinger PC, Ilson DH, Kelsen DP: Chemotherapy in esophageal cancer. Semin Oncol 26 (5 Suppl 15): 12-20, 1999. [PUBMED Abstract]
- Waters JS, Norman A, Cunningham D, et al.: Long-term survival after epirubicin, cisplatin and fluorouracil for gastric cancer: results of a randomized trial. Br J Cancer 80 (1-2): 269-72, 1999. [PUBMED Abstract]
- Ross P, Nicolson M, Cunningham D, et al.: Prospective randomized trial comparing mitomycin, cisplatin, and protracted venous-infusion fluorouracil (PVI 5-FU) With epirubicin, cisplatin, and PVI 5-FU in advanced esophagogastric cancer. J Clin Oncol 20 (8): 1996-2004, 2002. [PUBMED Abstract]
- Taïeb J, Artru P, Baujat B, et al.: Optimisation of 5-fluorouracil (5-FU)/cisplatin combination chemotherapy with a new schedule of hydroxyurea, leucovorin, 5-FU and cisplatin (HLFP regimen) for metastatic oesophageal cancer. Eur J Cancer 38 (5): 661-6, 2002. [PUBMED Abstract]
- Kelly RJ, Ajani JA, Kuzdzal J, et al.: Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer. N Engl J Med 384 (13): 1191-1203, 2021. [PUBMED Abstract]
- Doki Y, Ajani JA, Kato K, et al.: Nivolumab Combination Therapy in Advanced Esophageal Squamous-Cell Carcinoma. N Engl J Med 386 (5): 449-462, 2022. [PUBMED Abstract]
- Luo H, Lu J, Bai Y, et al.: Effect of Camrelizumab vs Placebo Added to Chemotherapy on Survival and Progression-Free Survival in Patients With Advanced or Metastatic Esophageal Squamous Cell Carcinoma: The ESCORT-1st Randomized Clinical Trial. JAMA 326 (10): 916-925, 2021. [PUBMED Abstract]
- Sun JM, Shen L, Shah MA, et al.: Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study. Lancet 398 (10302): 759-771, 2021. [PUBMED Abstract]
- Janjigian YY, Shitara K, Moehler M, et al.: First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet 398 (10294): 27-40, 2021. [PUBMED Abstract]
- Kang YK, Chen LT, Ryu MH, et al.: Nivolumab plus chemotherapy versus placebo plus chemotherapy in patients with HER2-negative, untreated, unresectable advanced or recurrent gastric or gastro-oesophageal junction cancer (ATTRACTION-4): a randomised, multicentre, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 23 (2): 234-247, 2022. [PUBMED Abstract]
- Kojima T, Shah MA, Muro K, et al.: Randomized Phase III KEYNOTE-181 Study of Pembrolizumab Versus Chemotherapy in Advanced Esophageal Cancer. J Clin Oncol 38 (35): 4138-4148, 2020. [PUBMED Abstract]
- Kato K, Cho BC, Takahashi M, et al.: Nivolumab versus chemotherapy in patients with advanced oesophageal squamous cell carcinoma refractory or intolerant to previous chemotherapy (ATTRACTION-3): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 20 (11): 1506-1517, 2019. [PUBMED Abstract]
- Javle M, Ailawadhi S, Yang GY, et al.: Palliation of malignant dysphagia in esophageal cancer: a literature-based review. J Support Oncol 4 (8): 365-73, 379, 2006. [PUBMED Abstract]
- Katsoulis IE, Karoon A, Mylvaganam S, et al.: Endoscopic palliation of malignant dysphagia: a challenging task in inoperable oesophageal cancer. World J Surg Oncol 4: 38, 2006. [PUBMED Abstract]
- Baron TH: Expandable metal stents for the treatment of cancerous obstruction of the gastrointestinal tract. N Engl J Med 344 (22): 1681-7, 2001. [PUBMED Abstract]
- Sur RK, Levin CV, Donde B, et al.: Prospective randomized trial of HDR brachytherapy as a sole modality in palliation of advanced esophageal carcinoma--an International Atomic Energy Agency study. Int J Radiat Oncol Biol Phys 53 (1): 127-33, 2002. [PUBMED Abstract]
- Gaspar LE, Nag S, Herskovic A, et al.: American Brachytherapy Society (ABS) consensus guidelines for brachytherapy of esophageal cancer. Clinical Research Committee, American Brachytherapy Society, Philadelphia, PA. Int J Radiat Oncol Biol Phys 38 (1): 127-32, 1997. [PUBMED Abstract]
Tratamiento del cáncer de esófago recidivante
Opciones de tratamiento del cáncer de esófago recidivante
Todos los pacientes con cáncer de esófago recidivante presentan problemas difíciles de paliar. Por eso, todos ellos se deben considerar aptos para participar en ensayos clínicos como los descritos en la sección Aspectos generales de las opciones de tratamiento del cáncer de esófago.
Las opciones de tratamiento del cáncer de esófago recidivante son las siguientes:
- Administración paliativa de cualquiera de los tratamientos, incluso cuidados médicos de apoyo.
- Inmunoterapia y quimioinmunoterapia para pacientes con carcinoma de células escamosas de esófago recidivante.[1-3]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Doki Y, Ajani JA, Kato K, et al.: Nivolumab Combination Therapy in Advanced Esophageal Squamous-Cell Carcinoma. N Engl J Med 386 (5): 449-462, 2022. [PUBMED Abstract]
- Luo H, Lu J, Bai Y, et al.: Effect of Camrelizumab vs Placebo Added to Chemotherapy on Survival and Progression-Free Survival in Patients With Advanced or Metastatic Esophageal Squamous Cell Carcinoma: The ESCORT-1st Randomized Clinical Trial. JAMA 326 (10): 916-925, 2021. [PUBMED Abstract]
- Sun JM, Shen L, Shah MA, et al.: Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study. Lancet 398 (10302): 759-771, 2021. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (03/21/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Información general sobre el cáncer de esófago
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2025 (se citó a la American Cancer Society como referencia 1).
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de esófago en adultos. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de esófago son:
- Andrea Bonetti, MD (Pederzoli Hospital)
- Amit Chowdhry, MD, PhD (University of Rochester Medical Center)
- Leon Pappas, MD, PhD (Massachusetts General Hospital)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de esófago. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/esofago/pro/tratamiento-esofago-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.