Tratamiento del cáncer de células renales (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer de células renales
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por cáncer de células renales (riñón y pelvis renal) en los Estados Unidos para 2025:[1]
- Casos nuevos: 80 980.
- Defunciones: 14 510.
Seguimiento y supervivencia
El cáncer de células renales, también llamado adenocarcinoma renal o hipernefroma, a menudo se puede curar si se diagnostica y se trata cuando todavía está localizado en el riñón y el tejido circundante inmediato. La probabilidad de curación se relaciona de manera directa con el estadio o el grado de diseminación del tumor. Incluso cuando hay compromiso de los ganglios linfáticos o los vasos sanguíneos regionales, un número significativo de pacientes logra una supervivencia prolongada y una probable curación.[2] Cuando hay metástasis a distancia, la supervivencia sin enfermedad es precaria; sin embargo, algunos pacientes sobrevivirán después de la resección quirúrgica de todo el tumor detectado. Debido a que se diagnostica a la mayoría de pacientes cuando el tumor está todavía relativamente localizado y es susceptible de extirpación quirúrgica, cerca del 75 % de todos los pacientes de cáncer de células renales sobreviven por 5 años.[3] En ocasiones, algunos pacientes con enfermedad local avanzada o metastásica presentan una evolución poco activa durante varios años. A veces, también hay recidiva tardía del tumor muchos años después del tratamiento inicial.
El cáncer de células renales es uno de los pocos tumores de los que hay casos bien documentados de regresión tumoral espontánea sin tratamiento, pero esta regresión es poco frecuente y quizás no conduzca a una supervivencia a largo plazo.
Modalidades de tratamiento
La resección quirúrgica es el componente principal del tratamiento de esta enfermedad. Aún en los pacientes con un tumor diseminado, las formas de tratamiento locorregionales pueden desempeñar una función importante en la paliación de los síntomas del tumor primario o de la producción hormonal ectópica. El tratamiento sistémico solo ha mostrado una eficacia limitada.
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Sene AP, Hunt L, McMahon RF, et al.: Renal carcinoma in patients undergoing nephrectomy: analysis of survival and prognostic factors. Br J Urol 70 (2): 125-34, 1992. [PUBMED Abstract]
- National Cancer Institute: SEER Stat Fact Sheets: Kidney and Renal Pelvis Cancer. Bethesda, Md: National Cancer Institute. Available online. Last accessed February 17, 2025.
Clasificación celular del cáncer de células renales
Cerca del 85 % de los cánceres de células renales son adenocarcinomas, sobre todo de origen tubular proximal. La mayoría de los restantes son carcinomas de células de transición de pelvis renal. Para obtener más información, consultar Tratamiento del cáncer de células de transición de pelvis renal y de uréter. Los adenocarcinomas se dividen en carcinomas de células claras y carcinomas de células granulares; sin embargo, a veces los dos tipos de células se presentan juntas en algunos tumores. Algunos investigadores encontraron que los tumores de células granulares tienen un pronóstico más precario, pero este hallazgo no es universal. La distinción entre adenocarcinomas renales bien diferenciados y adenomas renales puede ser difícil. El diagnóstico se suele hacer de forma arbitraria según el tamaño de la masa, pero el tamaño no debe ser el único criterio para determinar el abordaje de tratamiento porque se producen metástasis de lesiones tan pequeñas como de 0,5 cm.
Información sobre los estadios del cáncer de células renales
El sistema de estadificación para el cáncer de células renales se basa en el grado de diseminación del tumor por fuera del riñón.[1-3] El compromiso de los vasos sanguíneos tal vez no sea un signo de pronóstico precario si, por lo demás, el tumor se limita al parénquima renal. Es posible que los resultados anómalos de las pruebas del funcionamiento hepático se deban a un síndrome paraneoplásico reversible con la extirpación del tumor; estos tipos de resultados no representan necesariamente una enfermedad metastásica. La tomografía computarizada (TC) es tan buena o incluso mejor que las imágenes por resonancia magnética para detectar masas renales, excepto cuando la TC es equívoca o cuando se contraindica el uso de material yodado de contraste.[4]
Agrupamiento por estadios y definiciones TNM del American Joint Committee on Cancer
El American Joint Committee on Cancer (AJCC) designó la estadificación mediante la clasificación TNM (tumor, ganglio linfático y metástasis) para definir el cáncer de células renales.[5]
| Estadio | TNM | Definición | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Kidney. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 739–48. | |||
| I | T1, N0, M0 | T1 = tumor que mide ≤7 cm en su mayor dimensión y se limita al riñón. |
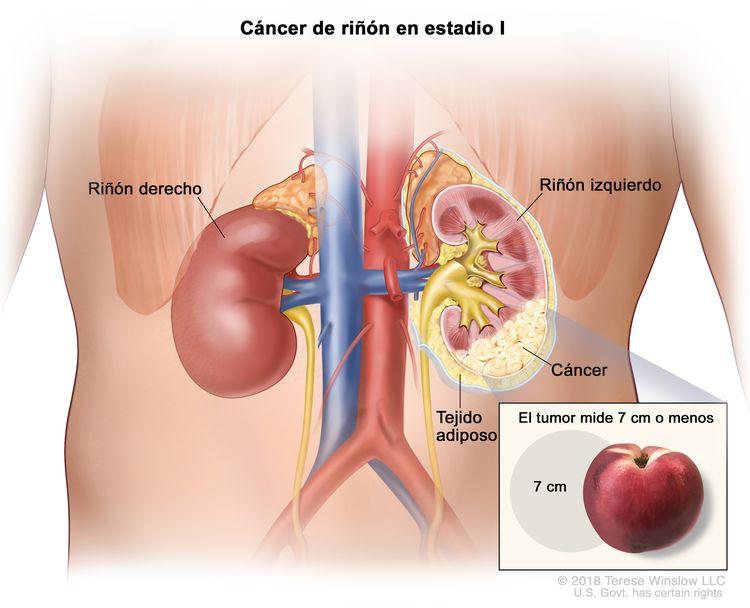 |
| –T1a = tumor que mide ≤4 cm en su mayor dimensión y se limita al riñón. | |||
| –T1b = tumor que mide >4 cm, pero ≤7 cm en su mayor dimensión y se limita al riñón. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Definición | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Kidney. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 739–48. | |||
| II | T2, N0, M0 | T2 = tumor que mide >7 cm en su mayor dimensión y se limita al riñón. |
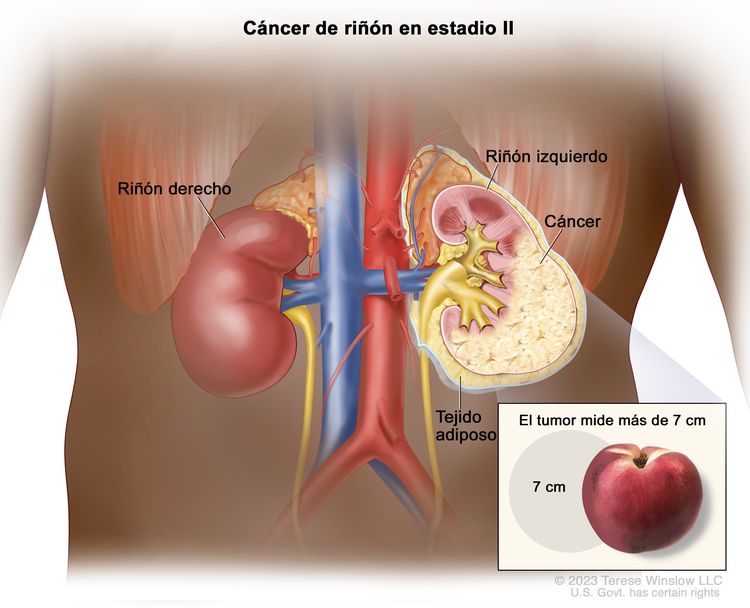 |
| –T2a = tumor que mide >7 cm, pero ≤10 cm en su mayor dimensión y se limita al riñón. | |||
| –T2b = tumor que mide >10 cm y se limita al riñón. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Definición | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Kidney. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 739–48. | |||
| III | T1, N1, M0 | T1 = tumor que mide ≤7 cm en su mayor dimensión y se limita al riñón. |
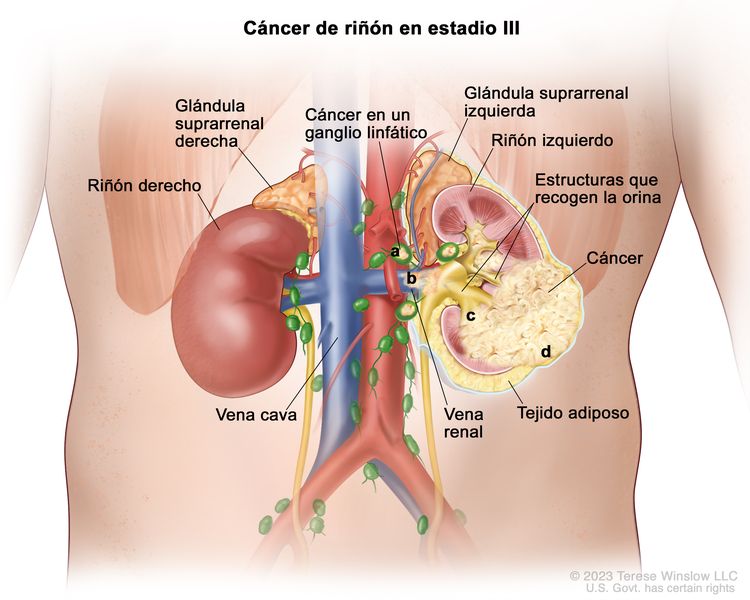 |
| –T1a = tumor que mide ≤4 cm en su mayor dimensión y se limita al riñón. | |||
| –T1b = tumor que mide >4 cm, pero ≤7 cm en su mayor dimensión y se limita al riñón. | |||
| N1 = metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T2, N1, M0 | T2 = tumor que mide >7 cm en su mayor dimensión y se limita al riñón. | ||
| –T2a = tumor que mide >7 cm, pero ≤10 cm en su mayor dimensión y se limita al riñón. | |||
| –T2b = tumor que mide >10 cm y se limita al riñón. | |||
| N1 = metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T3, N0, M0 | T3 = tumor con diseminación a las venas principales o los tejidos perinéfricos, pero no llega a la glándula suprarrenal ipsilateral ni sobrepasa la fascia de Gerota. | ||
| –T3a = tumor con diseminación a la vena renal o sus ramas segmentarias, invasión del sistema pielocalicial, o invasión de la grasa perirrenal o del seno renal, pero no sobrepasa la fascia de Gerota. | |||
| –T3b = tumor con diseminación a la vena cava por debajo del diafragma. | |||
| –T3c = tumor con diseminación a la vena cava por encima del diafragma o invasión de la pared de la vena cava. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T3, N1, M0 | T3 = tumor con diseminación a las venas principales o los tejidos perinéfricos, pero no llega a la glándula suprarrenal ipsilateral ni sobrepasa la fascia de Gerota. | ||
| –T3a = tumor con diseminación a la vena renal o sus ramas segmentarias, invasión del sistema pielocalicial, o invasión de la grasa perirrenal o del seno renal, pero no sobrepasa la fascia de Gerota. | |||
| –T3b = tumor con diseminación a la vena cava por debajo del diafragma. | |||
| –T3c = tumor con diseminación a la vena cava por encima del diafragma o invasión de la pared de la vena cava. | |||
| N1 = metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Definición | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Kidney. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 739–48. | |||
| IV | T4, cualquier N, M0 | T4 = tumor con invasión que se extiende más allá de la fascia de Gerota (incluso extensión contigua hasta la glándula suprarrenal ipsilateral). |
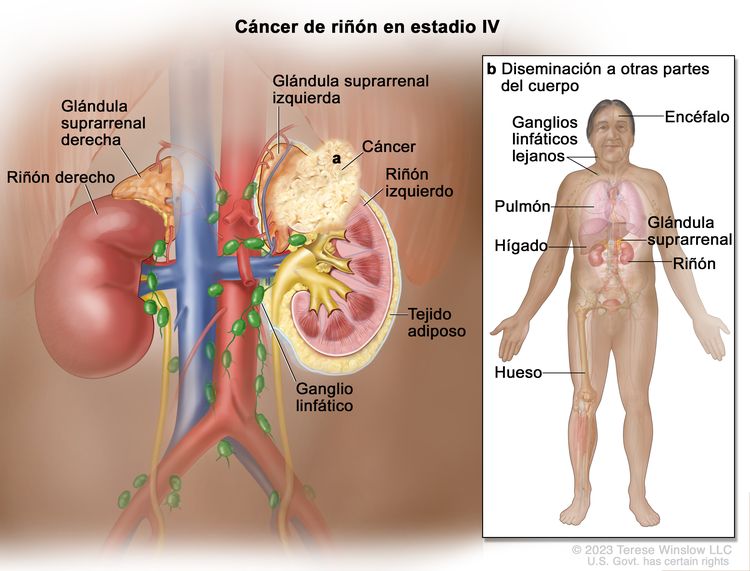 |
| NX = ganglios linfáticos regionales no evaluables. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| N1 = metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| Cualquier T, cualquier N, M1 | TX = tumor primario no evaluable. | ||
| T0 = sin indicios de tumor primario. | |||
| T1 = tumor que mide ≤7 cm en su mayor dimensión y se limita al riñón. | |||
| –T1a = tumor que mide ≤4 cm en su mayor dimensión y se limita al riñón. | |||
| –T1b = tumor que mide >4 cm, pero ≤7 cm en su mayor dimensión y se limita al riñón. | |||
| T2 = tumor que mide >7 cm en su mayor dimensión y se limita al riñón. | |||
| –T2a = tumor que mide >7 cm, pero ≤10 cm en su mayor dimensión y se limita al riñón. | |||
| –T2b = tumor que mide >10 cm y se limita al riñón. | |||
| T3 = tumor con diseminación a las venas principales o los tejidos perinéfricos, pero no llega a la glándula suprarrenal ipsilateral ni sobrepasa la fascia de Gerota. | |||
| –T3a = tumor con diseminación a la vena renal o sus ramas segmentarias, invasión del sistema pielocalicial, o invasión de la grasa perirrenal o del seno renal, pero no sobrepasa la fascia de Gerota. | |||
| –T3b = tumor con diseminación a la vena cava por debajo del diafragma. | |||
| –T3c = tumor con diseminación a la vena cava por encima del diafragma, o invasión de la pared de la vena cava. | |||
| T4 = tumor con invasión que se extiende más allá de la fascia de Gerota (incluso extensión contigua hasta la glándula suprarrenal ipsilateral). | |||
| NX = ganglios linfáticos regionales no evaluables. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| N1 = metástasis en ganglios linfáticos regionales. | |||
| M1 = metástasis a distancia. | |||
Bibliografía
- Bassil B, Dosoretz DE, Prout GR: Validation of the tumor, nodes and metastasis classification of renal cell carcinoma. J Urol 134 (3): 450-4, 1985. [PUBMED Abstract]
- Golimbu M, Joshi P, Sperber A, et al.: Renal cell carcinoma: survival and prognostic factors. Urology 27 (4): 291-301, 1986. [PUBMED Abstract]
- Robson CJ, Churchill BM, Anderson W: The results of radical nephrectomy for renal cell carcinoma. J Urol 101 (3): 297-301, 1969. [PUBMED Abstract]
- Consensus conference. Magnetic resonance imaging. JAMA 259 (14): 2132-8, 1988. [PUBMED Abstract]
- Kidney. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 739–48.
Aspectos generales de las opciones de tratamiento del cáncer de células renales
El tratamiento actual cura a más del 50 % de los pacientes con cáncer de células renales en estadio I, pero los pacientes con enfermedad en estadio IV tienen desenlaces precarios. Todos los pacientes con diagnóstico reciente de cáncer de células renales son aptos para participar en ensayos clínicos.
Tratamiento del cáncer de células renales en estadio I
Opciones de tratamiento del cáncer de células renales en estadio I
Las opciones de tratamiento del cáncer de células renales en estadio I son las siguientes:
- Nefrectomía parcial (pacientes específicos).[1,2]
- Nefrectomía radical.[2]
- Nefrectomía simple.[2]
- Crioterapia.
- Ablación térmica.
- Radioterapia corporal estereotáctica ablativa (RTCE o SABR). También se llama radioterapia ablativa estereotáctica corporal, radioterapia corporal estereotáctica, cirugía por radiación, o radiocirugía estereotáctica o estereotáxica.
- Radioterapia de haz externo (paliativa).[2]
- Embolización arterial (paliativa).[2,3]
- Participación en ensayos clínicos.
La resección quirúrgica es el tratamiento aceptado y, a menudo, curativo para pacientes con cáncer de células renales en estadio I. En pacientes debidamente seleccionados, la nefrectomía parcial tiene desenlaces oncológicos comparables con los desenlaces de la nefrectomía radical. La nefrectomía parcial también produce beneficios en la preservación de un funcionamiento renal mejor y, según algunos estudios, en la reducción de la mortalidad.[4-7] Cuando se extirpa todo el riñón, la resección puede ser simple o radical. La resección radical incluye la extirpación del riñón, la glándula suprarrenal, la grasa perirrenal y la fascia de Gerota, con disección de los ganglios linfáticos regionales o sin esta. La nefrectomía radical es el tratamiento preferido cuando el tumor invade la vena cava inferior.
Para los pacientes con neoplasias bilaterales en estadio I (simultáneas o consecutivas), la nefrectomía parcial bilateral o la nefrectomía parcial unilateral con nefrectomía contralateral radical, cuando es técnicamente factible, a veces son opciones preferibles a la nefrectomía bilateral con diálisis o trasplante.[1] Cada vez hay más evidencia que indica que la nefrectomía parcial es curativa en determinados casos. Un patólogo debe examinar la muestra macroscópica y la sección congelada del margen parenquimatoso de la extirpación.[8]
En los pacientes que no son aptos para la resección, hay varias alternativas curativas, como la crioablación, la ablación térmica y la RTCE (SABR).[9-13]
En los pacientes que no son aptos para los tratamientos mencionados, la radioterapia de haz externo (RHE) o la embolización arterial a veces son paliativas.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Novick AC, Streem S, Montie JE, et al.: Conservative surgery for renal cell carcinoma: a single-center experience with 100 patients. J Urol 141 (4): 835-9, 1989. [PUBMED Abstract]
- deKernion JB, Berry D: The diagnosis and treatment of renal cell carcinoma. Cancer 45 (7 Suppl): 1947-56, 1980. [PUBMED Abstract]
- Swanson DA, Wallace S, Johnson DE: The role of embolization and nephrectomy in the treatment of metastatic renal carcinoma. Urol Clin North Am 7 (3): 719-30, 1980. [PUBMED Abstract]
- Kim SP, Thompson RH, Boorjian SA, et al.: Comparative effectiveness for survival and renal function of partial and radical nephrectomy for localized renal tumors: a systematic review and meta-analysis. J Urol 188 (1): 51-7, 2012. [PUBMED Abstract]
- Larcher A, Capitanio U, Terrone C, et al.: Elective Nephron Sparing Surgery Decreases Other Cause Mortality Relative to Radical Nephrectomy Only in Specific Subgroups of Patients with Renal Cell Carcinoma. J Urol 196 (4): 1008-13, 2016. [PUBMED Abstract]
- Wang Z, Wang G, Xia Q, et al.: Partial nephrectomy vs. radical nephrectomy for renal tumors: A meta-analysis of renal function and cardiovascular outcomes. Urol Oncol 34 (12): 533.e11-533.e19, 2016. [PUBMED Abstract]
- Patel HD, Pierorazio PM, Johnson MH, et al.: Renal Functional Outcomes after Surgery, Ablation, and Active Surveillance of Localized Renal Tumors: A Systematic Review and Meta-Analysis. Clin J Am Soc Nephrol 12 (7): 1057-1069, 2017. [PUBMED Abstract]
- Thrasher JB, Robertson JE, Paulson DF: Expanding indications for conservative renal surgery in renal cell carcinoma. Urology 43 (2): 160-8, 1994. [PUBMED Abstract]
- El Dib R, Touma NJ, Kapoor A: Cryoablation vs radiofrequency ablation for the treatment of renal cell carcinoma: a meta-analysis of case series studies. BJU Int 110 (4): 510-6, 2012. [PUBMED Abstract]
- Gkentzis A, Oades G: Thermal ablative therapies for treatment of localised renal cell carcinoma: a systematic review of the literature. Scott Med J 61 (4): 185-191, 2016. [PUBMED Abstract]
- Zargar H, Atwell TD, Cadeddu JA, et al.: Cryoablation for Small Renal Masses: Selection Criteria, Complications, and Functional and Oncologic Results. Eur Urol 69 (1): 116-28, 2016. [PUBMED Abstract]
- Salagierski M, Wojciechowska A, Zając K, et al.: The Role of Ablation and Minimally Invasive Techniques in the Management of Small Renal Masses. Eur Urol Oncol 1 (5): 395-402, 2018. [PUBMED Abstract]
- Siva S, Ali M, Correa RJM, et al.: 5-year outcomes after stereotactic ablative body radiotherapy for primary renal cell carcinoma: an individual patient data meta-analysis from IROCK (the International Radiosurgery Consortium of the Kidney). Lancet Oncol 23 (12): 1508-1516, 2022. [PUBMED Abstract]
Tratamiento del cáncer de células renales en estadio II
Opciones de tratamiento del cáncer de células renales en estadio II
Las opciones de tratamiento del cáncer de células renales en estadio II son las siguientes:
- Nefrectomía parcial (pacientes específicos).[1]
- Nefrectomía radical.[1]
- Nefrectomía radical seguida de pembrolizumab adyuvante (pacientes de riesgo alto).[2]
- Nefrectomía antes o después de la radioterapia de haz externo (pacientes específicos).[1]
- Radioterapia de haz externo (paliativa).[1]
- Embolización arterial (paliativa).
- Participación en ensayos clínicos.
La resección quirúrgica es el tratamiento aceptado y, a menudo, curativo para pacientes con cáncer de células renales en estadio II. En pacientes debidamente seleccionados, la nefrectomía parcial tiene desenlaces oncológicos comparables con los desenlaces de la nefrectomía radical. La nefrectomía parcial también produce beneficios en la preservación de un funcionamiento renal mejor y, según algunos estudios, en la reducción de la mortalidad.[3-6] Cuando se extirpa todo el riñón, la resección puede ser simple o radical. La resección radical incluye la extirpación del riñón, la glándula suprarrenal, la grasa perirrenal y la fascia de Gerota, con disección de los ganglios linfáticos regionales o sin esta. La nefrectomía radical es el tratamiento preferido cuando el tumor invade la vena cava inferior. Con frecuencia, se usa la linfadenectomía, pero su eficacia no se ha comprobado de manera definitiva.
El tratamiento sistémico posoperatorio con el anticuerpo contra la muerte programada-1 (PD-1) pembrolizumab ha demostrado que prolonga la supervivencia sin enfermedad (SSE), pero no la supervivencia general (SG), en pacientes con tumores pT2 de riesgo alto.
En los pacientes que no son aptos para cirugía, la embolización arterial a veces es paliativa.
Pembrolizumab adyuvante
El pembrolizumab es un inhibidor de puntos de control inmunitario y un anticuerpo monoclonal dirigido a la proteína PD-1.
Evidencia (pembrolizumab adyuvante):
- En un ensayo aleatorizado con enmascaramiento doble y controlado con placebo (KEYNOTE-564 [NCT03142334]) se estudió el efecto de 1 año de administración de pembrolizumab después de nefrectomía. En el estudio se inscribieron 994 pacientes con carcinoma de células renales claras con riesgo alto de recidiva después de nefrectomía. Se consideraron idóneos los pacientes con enfermedad en estadio II con grado nuclear 4 o diferenciación sarcomatoide, enfermedad en estadio III o superior, metástasis en los ganglios linfáticos regionales o estadio M1 sin indicio de enfermedad tras la resección. Se asignaron al azar a los pacientes para recibir pembrolizumab (200 mg) o placebo administrados por vía intravenosa cada 21 días durante hasta 12 meses. El criterio principal de valoración
fue la SSE.[2]
- Al cabo de una mediana de seguimiento de 24 meses, se encontró una relación del pembrolizumab con una tasa de SSE a 2 años superior en comparación con el placebo (77,3 % para el pembrolizumab vs. 68,1 % para el placebo; cociente de riesgos instantáneos [CRI], 0,68; intervalo de confianza [IC], 95 %, 0,53–0,87).[2][Nivel de evidencia B1] En un informe posterior con una mediana de seguimiento de 30 meses, se observó una tasa de SSE del 75,2 % en los pacientes que recibieron pembrolizumab, en comparación con el 65,5 % en los pacientes que recibieron un placebo (CRI, 0,63; IC 95 %, 0,50–0,80).[7]
- Se notificaron efectos adversos de grado 3 o superior en el 32 % de los pacientes que recibieron pembrolizumab; el 20 % de los pacientes tuvieron efectos adversos graves. Los efectos adversos de grado alto más comunes fueron diarrea y elevación de las transaminasas, cada uno se presentó en un 2 % de los pacientes que recibieron pembrolizumab. Los efectos adversos graves más comunes fueron insuficiencia suprarrenal, colitis y cetoacidosis diabética, cada uno se presentó en un 1 % de los pacientes que recibieron pembrolizumab.
- La SG (el criterio secundario de valoración) se evaluará cuando el estudio tenga un seguimiento más largo.
Se han planteado varias preguntas sobre los factores de confusión que tal vez produjeron la mejora significativa de la SSE en el ensayo KEYNOTE-564.[8] Un número desigual de pacientes abandonó el ensayo durante el periodo de seguimiento temprano, lo que condujo a una falta de información sobre la recidiva en el grupo de control para los pacientes que fueron objeto de censura estadística. Solo un 36 % de los 166 pacientes en el grupo de control recibió inmunoterapia en el momento de la recaída, a pesar de la evidencia concluyente de la ventaja en la SG cuando se administra inmunoterapia a los pacientes con enfermedad metastásica. En otros dos ensayos de atezolizumab o nivolumab con ipilimumab no se logró demostrar una diferencia significativa en la SSE ni la SG.[9,10] Esto indica que la aprobación de la Administración de Alimentos y Medicamentos de los Estados Unidos y las pautas que publicaron la Comprehensive Cancer Network y la European Society for Medical Oncology para el pembrolizumab en el entorno adyuvante quizás fueron prematuras. Se requiere de seguimiento adicional para obtener resultados más definitivos de la SSE y en especial de la SG.[8,11]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- deKernion JB, Berry D: The diagnosis and treatment of renal cell carcinoma. Cancer 45 (7 Suppl): 1947-56, 1980. [PUBMED Abstract]
- Choueiri TK, Tomczak P, Park SH, et al.: Adjuvant Pembrolizumab after Nephrectomy in Renal-Cell Carcinoma. N Engl J Med 385 (8): 683-694, 2021. [PUBMED Abstract]
- Kim SP, Thompson RH, Boorjian SA, et al.: Comparative effectiveness for survival and renal function of partial and radical nephrectomy for localized renal tumors: a systematic review and meta-analysis. J Urol 188 (1): 51-7, 2012. [PUBMED Abstract]
- Larcher A, Capitanio U, Terrone C, et al.: Elective Nephron Sparing Surgery Decreases Other Cause Mortality Relative to Radical Nephrectomy Only in Specific Subgroups of Patients with Renal Cell Carcinoma. J Urol 196 (4): 1008-13, 2016. [PUBMED Abstract]
- Wang Z, Wang G, Xia Q, et al.: Partial nephrectomy vs. radical nephrectomy for renal tumors: A meta-analysis of renal function and cardiovascular outcomes. Urol Oncol 34 (12): 533.e11-533.e19, 2016. [PUBMED Abstract]
- Patel HD, Pierorazio PM, Johnson MH, et al.: Renal Functional Outcomes after Surgery, Ablation, and Active Surveillance of Localized Renal Tumors: A Systematic Review and Meta-Analysis. Clin J Am Soc Nephrol 12 (7): 1057-1069, 2017. [PUBMED Abstract]
- Powles T, Tomczak P, Park SH, et al.: Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for clear cell renal cell carcinoma (KEYNOTE-564): 30-month follow-up analysis of a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 23 (9): 1133-1144, 2022. [PUBMED Abstract]
- Tannock IF, Goldstein DA, Ofer J, et al.: Evaluating Trials of Adjuvant Therapy: Is There Benefit for People With Resected Renal Cancer? J Clin Oncol 41 (15): 2713-2717, 2023. [PUBMED Abstract]
- Pal SK, Uzzo R, Karam JA, et al.: Adjuvant atezolizumab versus placebo for patients with renal cell carcinoma at increased risk of recurrence following resection (IMmotion010): a multicentre, randomised, double-blind, phase 3 trial. Lancet 400 (10358): 1103-1116, 2022. [PUBMED Abstract]
- Motzer RJ, Russo P, Grünwald V, et al.: Adjuvant nivolumab plus ipilimumab versus placebo for localised renal cell carcinoma after nephrectomy (CheckMate 914): a double-blind, randomised, phase 3 trial. Lancet 401 (10379): 821-832, 2023. [PUBMED Abstract]
- Merino M, Kasamon Y, Theoret M, et al.: Irreconcilable Differences: The Divorce Between Response Rates, Progression-Free Survival, and Overall Survival. J Clin Oncol 41 (15): 2706-2712, 2023. [PUBMED Abstract]
Tratamiento del cáncer de células renales en estadio III
Opciones de tratamiento del cáncer de células renales en estadio III
Las opciones de tratamiento del cáncer de células renales en estadio II son las siguientes:
- Nefrectomía radical.[1]
- Embolización preoperatoria y nefrectomía radical.[2,3]
- Nefrectomía radical seguida de terapia sistémica adyuvante con pembrolizumab o sunitinib.[4,5]
- Radioterapia de haz externo (paliativa).[2]
- Embolización del tumor (paliativa).[3]
- Nefrectomía paliativa.
- Radioterapia de haz externo preoperatoria o posoperatoria, y nefrectomía radical.[2]
- Participación en ensayos clínicos de interferón α adyuvante.
Terapia sistémica adyuvante
La resección quirúrgica es el tratamiento estándar para los pacientes con cáncer de células renales en estadio clínico III. Varios estudios diferentes han investigado si el tratamiento sistémico adyuvante (posoperatorio) mejora los resultados. Ninguno de estos ensayos ha demostrado efecto en la supervivencia general (SG). Sin embargo, 2 fármacos se relacionan con una mayor supervivencia sin recaída.
Pembrolizumab adyuvante
El pembrolizumab es un anticuerpo monoclonal y un inhibidor de puntos de control inmunitario dirigido a la proteína de muerte programada-1 (PD-1).
Evidencia (pembrolizumab adyuvante):
- En un ensayo aleatorizado con enmascaramiento doble y controlado con placebo (KEYNOTE-564 [NCT03142334]) se estudió el efecto de 1 año de administración de pembrolizumab después de nefrectomía. En el estudio se inscribieron 994 pacientes con carcinoma de células renales claras con riesgo alto de recidiva después de nefrectomía. Se consideraron idóneos los pacientes con enfermedad en estadio II con grado nuclear 4 o diferenciación sarcomatoide, enfermedad en estadio III o superior, metástasis en los ganglios linfáticos regionales o estadio M1 sin indicio de enfermedad tras la resección. Se asignaron al azar a los pacientes para recibir pembrolizumab (200 mg) o placebo administrados por vía intravenosa cada 21 días durante hasta 12 meses. El criterio principal de valoración
fue la SSE.[4]
- Al cabo de una mediana de seguimiento de 24 meses, se encontró una relación del pembrolizumab con una tasa de SSE a 2 años superior en comparación con el placebo (77,3 % para el pembrolizumab vs. 68,1 % para el placebo; cociente de riesgos instantáneos [CRI] , 0,68; intervalo de confianza [IC] 95 %, 0,53–0,87).[4][Nivel de evidencia B1] En un informe posterior con una mediana de seguimiento de 30 meses, se observó una tasa de SSE del 75,2 % en los pacientes que recibieron pembrolizumab, en comparación con el 65,5 % en los pacientes que recibieron un placebo (CRI, 0,63; IC 95 %, 0,50–0,80).[6]
- Se notificaron efectos adversos de grado 3 o superior en el 32 % de los pacientes que recibieron pembrolizumab; el 20 % de los pacientes tuvieron efectos adversos graves. Los efectos adversos de grado alto más comunes fueron diarrea y elevación de las transaminasas, cada uno se presentó en un 2 % de los pacientes que recibieron pembrolizumab. Los efectos adversos graves más comunes fueron insuficiencia suprarrenal, colitis y cetoacidosis diabética, cada uno se presentó en un 1 % de los pacientes que recibieron pembrolizumab.
- La SG (el criterio secundario de valoración) se evaluará cuando el estudio tenga un seguimiento más largo.
Se han planteado varias preguntas sobre los factores de confusión que tal vez produjeron la mejora significativa de la SSE en el ensayo KEYNOTE-564.[7] Un número desigual de pacientes abandonó el ensayo durante el periodo de seguimiento temprano, lo que condujo a una falta de información sobre la recidiva en el grupo de control para los pacientes que fueron objeto de censura estadística. Solo un 36 % de los 166 pacientes en el grupo de control recibió inmunoterapia en el momento de la recaída, a pesar de la evidencia concluyente de la ventaja en la SG cuando se administra inmunoterapia a los pacientes con enfermedad metastásica. En otros dos ensayos de atezolizumab o nivolumab con ipilimumab no se logró demostrar una diferencia significativa en la SSE ni la SG.[8,9] Esto indica que la aprobación de la Administración de Alimentos y Medicamentos de los Estados Unidos y las pautas que publicaron la Comprehensive Cancer Network y la European Society for Medical Oncology para el pembrolizumab en el entorno adyuvante quizás fueron prematuras. Se requiere de seguimiento adicional para obtener resultados más definitivos de la SSE y en especial de la SG.[7,10]
Sunitinib adyuvante
El sunitinib es un inhibidor oral de tirosina–cinasas dirigido a la vía del factor de crecimiento endotelial vascular.
Evidencia (sunitinib):
- En un ensayo aleatorizado con enmascaramiento doble y controlado con placebo (NCT00375674) se estudió el efecto del sunitinib después de nefrectomía en pacientes con cáncer de células renales claras locorregional y de riesgo alto (estadio T3 o superior o metástasis en los ganglios linfáticos regionales). El estudio asignó al azar a 615 pacientes a 1 año de sunitinib (50 mg) o placebo 1 vez al día durante las primeras 4 semanas de un ciclo repetido de 6 semanas (por ejemplo, un programa de 4 semanas de tratamiento seguido de 2 semanas sin tratamiento).[5]
- La mediana de la SSE fue de 6,8 años para los pacientes que recibieron sunitinib y de 5,6 años para los pacientes que recibieron placebo (CRI, 0,76; IC 95 %, 0,59–0,98; P = 0,03). No se notificaron diferencias en la SG (CRI, 1,01; IC 95 %, 0,72–1,44; P = 0,94).
- Se notificaron reducciones de dosis en el 34 % de los pacientes que recibieron sunitinib. Se observaron interrupciones de la dosis en el 46 % de los pacientes, y el 28 % de los pacientes asignados a sunitinib interrumpieron el medicamento.
- El 48 % de los pacientes que recibieron sunitinib, experimentó eventos adversos de grado 3, y el 12 % de grado 4. Los eventos adversos de grado alto más frecuentes fueron eritrodisestesia palmoplantar, hipertensión, fatiga, neutropenia, trombocitopenia e inflamación de las mucosas.
Opciones de tratamiento para los pacientes con enfermedad T3a, N0, M0
La resección radical es el tratamiento aceptado y, a menudo, curativo para los pacientes con cáncer de células renales en estadio III. Esta operación incluye la extirpación del riñón, la glándula suprarrenal, la grasa perirrenal y la fascia de Gerota, con disección de ganglios linfáticos regionales o sin esta.[11] Se suele usar la linfadenectomía, pero su eficacia no se ha comprobado de manera definitiva. Se ha administrado RHE antes o después de la nefrectomía, pero no hay evidencia concluyente de que mejore la supervivencia cuando se compara con los resultados de la cirugía sola. Sin embargo, quizás beneficie a determinados pacientes con tumores más extensos.
Para los pacientes con neoplasias bilaterales en estadio T3a (simultáneas o consecutivas), la nefrectomía parcial bilateral o la nefrectomía parcial unilateral con nefrectomía contralateral radical, cuando es técnicamente factible, a veces son opciones preferibles a la nefrectomía bilateral con diálisis o trasplante.[12]
En los pacientes que no son aptos para cirugía, la embolización arterial a veces es paliativa.
Opciones de tratamiento para los pacientes con enfermedad T3b, N0, M0
La resección radical es el tratamiento aceptado y, a menudo curativo para los pacientes con este estadio del cáncer de células renales. La operación incluye la extirpación del riñón, la glándula suprarrenal, la grasa perirrenal y la fascia de Gerota, con disección de ganglios linfáticos regionales o sin ella. Se suele usar la linfadenectomía, pero su eficacia no se ha comprobado de manera definitiva. La cirugía se extiende para extirpar toda la vena renal, el trombo de la cava y una porción de la vena cava, según sea necesario.[1] La RHE se ha administrado antes o después de la nefrectomía, pero no hay evidencia concluyente de que mejore la supervivencia en comparación con los resultados de la cirugía sola. Sin embargo, quizás beneficie a determinados pacientes con tumores más extensos.
En los pacientes con neoplasias en estadio T3b que tengan un cáncer de células renales simultáneo o consecutivo en el riñón contralateral, la nefrectomía parcial, cuando es técnicamente factible, a veces es preferible a la nefrectomía bilateral con diálisis o trasplante.[12-14]
En los pacientes que no son aptos para cirugía, la embolización arterial a veces es paliativa.
Opciones de tratamiento para los pacientes con enfermedad T1, N1, M0; T2, N1, M0 o T3, N1, M0
Este estadio del cáncer de células renales es curable con cirugía en una pequeña minoría de los pacientes. Es necesario realizar una nefrectomía radical y disección de los ganglios linfáticos. No se ha demostrado el valor de la RHE preoperatoria y posoperatoria, pero es posible emplear la RHE como paliación en pacientes que no son aptos para cirugía. La embolización arterial del tumor con Gelfoam u otros materiales se puede usar antes de la cirugía con el fin de reducir la pérdida de sangre durante la nefrectomía u ofrecer paliación a los pacientes con enfermedad inoperable.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Hatcher PA, Anderson EE, Paulson DF, et al.: Surgical management and prognosis of renal cell carcinoma invading the vena cava. J Urol 145 (1): 20-3; discussion 23-4, 1991. [PUBMED Abstract]
- deKernion JB, Berry D: The diagnosis and treatment of renal cell carcinoma. Cancer 45 (7 Suppl): 1947-56, 1980. [PUBMED Abstract]
- Swanson DA, Wallace S, Johnson DE: The role of embolization and nephrectomy in the treatment of metastatic renal carcinoma. Urol Clin North Am 7 (3): 719-30, 1980. [PUBMED Abstract]
- Choueiri TK, Tomczak P, Park SH, et al.: Adjuvant Pembrolizumab after Nephrectomy in Renal-Cell Carcinoma. N Engl J Med 385 (8): 683-694, 2021. [PUBMED Abstract]
- Ravaud A, Motzer RJ, Pandha HS, et al.: Adjuvant Sunitinib in High-Risk Renal-Cell Carcinoma after Nephrectomy. N Engl J Med 375 (23): 2246-2254, 2016. [PUBMED Abstract]
- Powles T, Tomczak P, Park SH, et al.: Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for clear cell renal cell carcinoma (KEYNOTE-564): 30-month follow-up analysis of a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 23 (9): 1133-1144, 2022. [PUBMED Abstract]
- Tannock IF, Goldstein DA, Ofer J, et al.: Evaluating Trials of Adjuvant Therapy: Is There Benefit for People With Resected Renal Cancer? J Clin Oncol 41 (15): 2713-2717, 2023. [PUBMED Abstract]
- Pal SK, Uzzo R, Karam JA, et al.: Adjuvant atezolizumab versus placebo for patients with renal cell carcinoma at increased risk of recurrence following resection (IMmotion010): a multicentre, randomised, double-blind, phase 3 trial. Lancet 400 (10358): 1103-1116, 2022. [PUBMED Abstract]
- Motzer RJ, Russo P, Grünwald V, et al.: Adjuvant nivolumab plus ipilimumab versus placebo for localised renal cell carcinoma after nephrectomy (CheckMate 914): a double-blind, randomised, phase 3 trial. Lancet 401 (10379): 821-832, 2023. [PUBMED Abstract]
- Merino M, Kasamon Y, Theoret M, et al.: Irreconcilable Differences: The Divorce Between Response Rates, Progression-Free Survival, and Overall Survival. J Clin Oncol 41 (15): 2706-2712, 2023. [PUBMED Abstract]
- Phillips E, Messing EM: Role of lymphadenectomy in the treatment of renal cell carcinoma. Urology 41 (1): 9-15, 1993. [PUBMED Abstract]
- Novick AC, Streem S, Montie JE, et al.: Conservative surgery for renal cell carcinoma: a single-center experience with 100 patients. J Urol 141 (4): 835-9, 1989. [PUBMED Abstract]
- deKernion JB: Management of renal adenocarcinoma. In: deKernion JB, Paulson DF, eds.: Genitourinary Cancer Management. Lea and Febiger, 1987, pp 187-217.
- Angermeier KW, Novick AC, Streem SB, et al.: Nephron-sparing surgery for renal cell carcinoma with venous involvement. J Urol 144 (6): 1352-5, 1990. [PUBMED Abstract]
Tratamiento del cáncer de células renales en estadio IV y recidivante
Opciones de tratamiento de primera línea para el cáncer de células renales en estadio IV
Las opciones de tratamiento de primera línea para el cáncer de células renales en estadio IV son las siguientes:
- Ipilimumab y nivolumab (para pacientes con enfermedad de riesgo intermedio o precario).[1]
- Pembrolizumab y axitinib.[2]
- Pembrolizumab y lenvatinib.[3]
- Nivolumab y cabozantinib.[4]
- Nefrectomía radical (para las lesiones T4, M0).
- Nefrectomía citorreductora (para cualquiera de las lesiones T, M1 en pacientes con enfermedad de riesgo bajo).[5-8]
- Cabozantinib (para pacientes con enfermedad de riesgo intermedio o precario).[9,10]
- Avelumab y axitinib.[11]
- Sunitinib.[12-15]
- Interferón α.[16-19]
- Interleucina 2.[16,20,21]
- Radioterapia de haz externo (RHE) paliativa.
Opciones de tratamiento de segunda línea para el cáncer de células renales en estadio IV
Las opciones de tratamiento de segunda línea para el cáncer de células renales en estadio IV son las siguientes:
- Nivolumab (para pacientes que recibieron tratamiento anterior con sunitinib, pazopanib, sorafenib o axitinib).[22]
- Lenvatinib y everólimus (para pacientes que recibieron tratamiento anterior con sunitinib, pazopanib, cabozantinib, axitinib o sorafenib).[23]
- Cabozantinib (para pacientes que recibieron tratamiento anterior con sunitinib, pazopanib, sorafenib o axitinib).[24]
- Belzutifán.[25]
- RHE paliativa.
Opciones de tratamiento de tercera y cuarta línea para el cáncer de células renales en estadio IV
Las opciones de tratamiento de tercera y cuarta línea para el cáncer de células renales en estadio IV son las siguientes:
El pronóstico es precario para cualquier paciente con cáncer de células renales con enfermedad progresiva, recidivante o en recaída, con independencia del tipo de célula o el estadio. Casi todos los pacientes de cáncer de células renales en estadio IV tienen enfermedad incurable. El uso del tratamiento adicional y la selección de este dependen de muchos factores, incluso del tratamiento previo y el sitio de recidiva, así como de las consideraciones individuales del paciente. Los pacientes que se seleccionan de forma apropiada quizás se beneficien de una resección quirúrgica de la enfermedad metastásica localizada cuando tienen un intervalo prolongado sin enfermedad desde el tratamiento primario.
Inmunoterapia
Inhibidores de puntos de control inmunitario
Los inhibidores de puntos de control inmunitario son fármacos que bloquean ciertas proteínas que inhiben la respuesta del sistema inmunitario frente al cáncer. Estas proteínas reducen la actividad de los linfocitos T y pueden evitar que estas células destruyan las células cancerosas. Cuando se reduce la actividad de las proteínas inhibitorias, los inhibidores de puntos de control inmunitario aumentan la respuesta inmunitaria frente al cáncer. Las proteínas de puntos de control inmunitario a las que se dirige este tipo de fármacos son la proteína de muerte programada 1 (PD-1), el ligando 1 de muerte celular programada (PD-L1) y el antígeno asociado a los linfocitos T citotóxicos 4 (CTLA-4).
Ipilimumab y nivolumab
En un ensayo controlado aleatorizado, la combinación de ipilimumab y nivolumab prolongó la supervivencia general (SG) cuando se comparó con sunitinib como terapia sistémica de primera línea para los pacientes con carcinoma de células renales en estadio avanzado.[1] Ambos fármacos son inhibidores de los puntos de control inmunitario. El ipilimumab es un anticuerpo que se dirige a CTLA-4. El nivolumab es un anticuerpo que se dirige a PD-1.
Evidencia (ipilimumab y nivolumab):
- En un ensayo controlado aleatorizado se comparó la combinación de estos 2 fármacos con el sunitinib. Se administraron 4 dosis de nivolumab (3 mg/kg) e ipilimumab (1 mg/kg) cada 3 semanas, seguidas de mantenimiento con nivolumab (3 mg/kg) cada 2 semanas. Se administró sunitinib en dosis de 50 mg 1 vez por día durante las primeras 4 semanas de cada ciclo periódico de 6 semanas (es decir, cada ciclo constó de 4 semanas de administración del medicamento seguidas de 2 semanas de descanso). El tratamiento continuó hasta la progresión de la enfermedad, excepto cuando se presentaron efectos adversos o se retiró el consentimiento, y se interrumpió la administración. Los criterios principales de valoración fueron la SG, la supervivencia sin progresión (SSP) y la tasa de respuesta objetiva en los pacientes con enfermedad de riesgo intermedio o precario. Cabe notar que, debido a que hubo 3 criterios de valoración coprimarios, el nivel general de α de 0,05 se dividió entre los 3 criterios de valoración. Esto significó que el límite de P para la significación fue de 0,001 para la tasa de respuesta, 0,009 para la SSP y 0,04 para la SG. En el ensayo se incluyó a 1096 pacientes, de los cuales 847 tenían enfermedad de riesgo intermedio o precario.
- Al cabo de una mediana de seguimiento de 25,2 meses de los pacientes de riesgo intermedio y precario, la tasa de SG a 18 meses fue del 75 % para el grupo de ipilimumab y nivolumab en comparación con el 60 % para el grupo de sunitinib. En los pacientes con enfermedad de riesgo intermedio o precario, el cociente de riesgos instantáneos (CRI) de muerte fue de 0,63 intervalo de confianza [IC] 99,8 %, 0,44–0,89; P < 0,001).
- No hubo diferencia estadísticamente significativa para la SSP. La mediana de SSP de los pacientes con enfermedad de riesgo intermedio y riesgo precario fue de 11,6 meses para el grupo de ipilimumab y nivolumab en comparación con 8,4 meses para el grupo de sunitinib (CRI, 0,82; IC 99,1 %, 0,64–1,05).
- La tasa de respuesta objetiva fue mayor en el grupo de ipilimumab y nivolumab que en el grupo de sunitinib (42 vs. 27 %, P < 0,001). En el grupo de ipilimumab y nivolumab, 40 pacientes (9 %) presentaron una respuesta completa en comparación con 5 pacientes (1 %) en el grupo de sunitinib.
Nivolumab
El nivolumab, es el único tratamiento que ha mostrado prolongar la SG en pacientes que previamente recibieron tratamiento antiangiogénico. El nivolumab es un anticuerpo totalmente humano que impide la activación de la proteína PD-1. Al impedir la interacción entre los ligandos 1 y 2 de PD-1 y PD-1, el nivolumab bloquea la vía que inhibe la respuesta celular inmunitaria y restaura la inmunidad celular.
Evidencia (nivolumab):
- En un ensayo de fase II se observaron resultados promisorios y ausencia de respuesta ante la dosis de nivolumab, que se administró cada 3 semanas en dosis de 0,3 mg/kg, 2 mg/kg o 10 mg/kg.[22]
- La mediana de supervivencia fue 25,5 meses con dosis de 2 mg/kg que se administró cada 3 semanas y 24,7 meses con una dosis de 10 mg/kg cada 3 semanas.
- En un ensayo controlado aleatorizado se comparó el nivolumab en dosis de 3 mg/kg cada 2 semanas con everólimus en dosis de 10 mg diarios.[38] En el ensayo se asignó al azar a 821 pacientes con carcinoma de células renales metastásico y un componente de células claras que habían recibido previamente 1 o 2 regímenes antiangiogénicos.
- La tasa de respuesta objetiva fue del 25 % con nivolumab en comparación con el 5 % de everólimus (P < 0,001).
- La mediana de duración del tratamiento fue 5,5 meses con nivolumab en comparación con 3,7 meses con everólimus, y no se observó una diferencia significativa en la SSP (mediana de SSP, 4,6 meses con nivolumab vs. 4,4 meses con everólimus).
- Sin embargo, la SG fue significativamente mayor con nivolumab (mediana de SG, 25,0 meses vs. 19,6 meses; CRI, 0,73; IC 98,5 %, 0,57–0,93).[38]
No está claro si la dosis de 3 mg/kg cada 2 semanas que se usó en el ensayo de fase III ofrece alguna ventaja sobre la de 2 mg/kg cada 3 semanas que se usó en el ensayo de fase II. Sin embargo, esta última dosis ofrece un ahorro sustancial en los costos.
Terapia con citocinas
Interferón α e interleucina 2
La terapia de citocinas con interferón α o interleucina 2 (IL-2) ha mostrado que induce una respuesta objetiva y el interferón α tiene un efecto moderado en la supervivencia en determinados pacientes. El interferón α tiene una tasa de respuesta objetiva de casi el 15 % en personas seleccionadas de forma adecuada.[16] En general, estos pacientes presentan metástasis pulmonares o de tejido blando que no son voluminosas con puntajes excelentes de estado funcional de 0 o 1, de acuerdo con la escala de evaluación del Eastern Cooperative Oncology Group (ECOG), y los pacientes no muestran pérdida de peso. Las dosis de interferón α que se usaron en estudios que indicaron tasas de respuestas buenas, son de intervalo intermedio (6–20 millones de unidades administradas 3 veces a la semana). En un análisis de Cochrane de 6 ensayos aleatorizados, con 963 pacientes, se indicó un CRI de supervivencia de 0,78 (IC, 0,67–0,90) o una mejora promedio ponderada de la supervivencia de 2,6 meses.[16][Nivel de evidencia A1]
Una dosis alta de IL-2 produce una tasa de respuesta general similar al interferón α, pero cerca del 5 % de los pacientes presentaron remisiones completas duraderas.[20,39-43] En ningún ensayo controlado aleatorizado con IL-2 se observaron resultados de una supervivencia más prolongada. Las dosis altas de IL-2 se usan debido a que es el único tratamiento sistémico que se ha relacionado con una inducción a una remisión completa duradera, si bien, en fracciones pequeñas (cerca del 5 %) de los pacientes aptos para este tratamiento. Se desconoce la dosis óptima de IL-2. Las dosis de tratamiento altas parecen estar relacionadas con tasas de respuesta más altas, pero con más efectos tóxicos. Los regímenes de dosis bajas entre los pacientes hospitalizados, muestran actividad contra el carcinoma de células renales con menos efectos tóxicos, sobre todo hipotensión, pero no han mostrado ser superiores al placebo u otro régimen alternativo en términos de supervivencia o calidad de vida (CV).[21] La administración subcutánea y ambulatoria también mostró reacciones con efectos tóxicos aceptables pero, aun así, con beneficios de supervivencia y CV que no resultan claros.[44] Se han estudiado las combinaciones de IL-2 e interferón α pero los resultados no han sido mejores cuando se han usado dosis altas o dosis bajas de IL-2 por sí solas.[17,45]
Combinación de inhibidores de puntos de control inmunitarios y terapias antiangiogénicas dirigidas
Después de que se descubrió que los inhibidores de puntos de control y las terapias antiangiogénicas dirigidas mejoraban los desenlaces, en los ensayos clínicos de la combinación de estos dos abordajes se demostró que producen una SG más prolongada en comparación con la monoterapia.
Pembrolizumab y axitinib
Evidencia (pembrolizumab y axitinib):
- En un ensayo sin anonimato, de fase III aleatorizado y controlado (NCT02853331) que comparó sunitinib con la combinación de pembrolizumab y axitinib, se incluyeron 861 pacientes que no habían recibido terapia sistémica por enfermedad metastásica en el pasado.[2]
- Al cabo de una mediana de seguimiento de 12,8 meses, la SG fue del 90 % en el grupo de pembrolizumab y axitinib en comparación con el 78 % en el grupo de sunitinib (CRI, 0,53; IC 95 %, 0,38–0,74; P < 0,0001).[2][Nivel de evidencia A1]
- La mediana de SSP también se prolongó para los pacientes que recibieron terapia de combinación (15,1 vs. 11,1 meses; CRI, 0,69; IC 95 %, 0,57–0,84).
- La tasa de respuesta objetiva con la terapia combinada fue del 59,3 % en comparación con el 35,7 % en el grupo de sunitinib (P < 0,001).
- Las tasas de eventos adversos de grado 3 o más fueron similares: un 75,8 % de los pacientes en el grupo de pembrolizumab y axitinib en comparación con un 70,6 % de los pacientes en el grupo de sunitinib.
Pembrolizumab y lenvatinib
Evidencia (pembrolizumab y lenvatinib):
- En un ensayo sin enmascaramiento controlado aleatorizado de fase III (NCT02811861) se comparó el sunitinib con la combinación de lenvatinib y pembrolizumab o la combinación de lenvatinib y everólimus. En el estudio se incluyeron 1609 pacientes que no habían recibido terapia sistémica por enfermedad metastásica en el pasado.[3]
- Al cabo de una mediana de seguimiento de 26,6 meses, la tasa de SG fue del 79,2 % en el grupo de pembrolizumab y lenvatinib, en comparación con el 70,4 % del grupo de sunitinib (CRI, 0,66; IC 95 %, 0,49–0,88; P = 0,005).[3][Nivel de evidencia A1] No hubo diferencias en la SG entre el grupo de sunitinib y el grupo de lenvatinib y everólimus.
- La mediana de SSP también fue superior en el grupo de pembrolizumab y lenvatinib que en el grupo de sunitinib (23,9 meses vs. 9,2 meses; CRI, 0,39; IC 95 %, 0,32–0,49; P < 0,001). Así mismo, la SSP fue superior en el grupo de lenvatinib y everólimus (14,7 meses) en comparación con el grupo de sunitinib (CRI, 0,65; IC 95 %, 0,53–0,80; P < 0,001).
- La tasa de respuesta objetiva fue del 71,0 % en el grupo de pembrolizumab y lenvatinib, en comparación con el 36,1% del grupo de sunitinib (P < 0,001). Se notificaron respuestas completas en un 16,1 % de los pacientes en el grupo de pembrolizumab y lenvatinib, en un 4,2 % de los pacientes en el grupo de sunitinib y en un 9,8 % de los pacientes en el grupo lenvatinib y everólimus.
- Los efectos adversos de grado 3 o superior fueron más frecuentes en los grupos de lenvatinib: un 82,4 % de los pacientes en el grupo de pembrolizumab y lenvatinib, y un 83,1 % de los pacientes en el grupo de lenvatinib y everólimus, en comparación con un 71,8 % de los pacientes en el grupo de sunitinib. El tratamiento se discontinuó en un 37,2 % de los pacientes en el grupo de pembrolizumab y lenvatinib, en comparación con 14,4 % de los pacientes en el grupo de sunitinib. En el grupo de pembrolizumab y lenvatinib, los efectos tóxicos de grado alto más frecuentes fueron la hipertensión (27,6 %), la diarrea (9.7%) y la pérdida de peso (8.0 %).
- La calidad de vida relacionada con la salud (CVRS) se evaluó mediante mediciones múltiples. Los resultados mostraron que los pacientes que recibieron pembrolizumab y lenvatinib presentaron un deterioro similar o inferior de los puntajes para la CVRS y para los síntomas relacionados con la enfermedad a lo largo del tiempo cuando se compararon con los pacientes que recibieron sunitinib.[46][Nivel de evidencia B2]
Nivolumab y cabozantinib
Evidencia (nivolumab y cabozantinib):
- En un ensayo sin enmascaramiento controlado aleatorizado de fase III (NCT03141177) se comparó el sunitinib con la combinación de nivolumab y cabozantinib. En el estudio se incluyeron 651 pacientes que no habían recibido terapia sistémica por enfermedad metastásica en el pasado.[47]
- Al cabo de una mediana de seguimiento de 32,9 meses, la SG fue de 37,7 meses en el grupo de nivolumab y cabozantinib, en comparación con 34,3 meses en el grupo de sunitinib (CRI, 0,70; IC 95 %, 0,55–0,90).[47][Nivel de evidencia A1]
- La mediana de SSP también fue superior en el grupo de nivolumab y cabozantinib que en el grupo de sunitinib (16,6 meses vs. 8,3 meses; CRI, 0,51; IC 95 %, 0,41–0,64; P < 0,001).
- La tasa de respuesta objetiva fue del 55,7 % en los pacientes que recibieron el tratamiento con la combinación de fármacos, en comparación con el 27,1 % en los pacientes que recibieron el sunitinib (P < 0,001).
- Se notificaron efectos adversos de grado 3 o superior en un 65 % de los pacientes que recibieron nivolumab y cabozantinib, en comparación con el 54 % en aquellos que recibieron sunitinib. Se informaron efectos adversos graves de grado alto relacionados con el tratamiento en un 22 % de los pacientes del grupo de tratamiento combinado y en un 10 % de los pacientes del grupo de sunitinib. Al menos se interrumpió la administración de uno de los fármacos en el 19,7 % de aquellos que recibieron la terapia de combinación, en comparación con el 16,9 % de aquellos asignados para recibir sunitinib. Los efectos tóxicos de grado alto más frecuentes que se presentaron con la terapia de combinación fueron hipertensión (12,5 %), hiponatremia (9,4 %), diarrea (6,9 %), elevación de la concentración de la lipasa (6,2 %) e hipofosfatemia (5,9 %).
Avelumab y axitinib
Evidencia (avelumab y axitinib):
- En un ensayo sin anonimato de fase III aleatorizado (NCT02684006) se comparó la combinación de avelumab y axitinib con la monoterapia de sunitinib. El estudio incluyó 560 pacientes con carcinoma de células renales en estadio IV positivo para el ligando de muerte celular programada 1 (PD-L1) (la población total en estudio fue de 886 pacientes, incluidos aquellos que fueron negativos para PD-L1).[11] En este ensayo se especificaron dos criterios de valoración primarios: la SSP y la SG de los pacientes con tumores positivos para PD-L1. La SSP de toda la población del estudio fue el criterio de valoración secundario.
- Al cabo de una mediana de seguimiento de menos de 1 año, no hubo diferencias significativas en la SG entre los dos grupos.
- La SSP entre los pacientes con tumores positivos para PD-L1 fue de 13,8 meses en el grupo de terapia combinada en comparación con 7,2 meses en el grupo de sunitinib (CRI, 0,61; IC 95 %, 0,47–0,79).[11][Nivel de evidencia B1]
- La mediana de SSP para toda la población del estudio fue de 13,8 meses en el grupo de combinación en comparación con 8,4 meses en el grupo de sunitinib (CRI, 0,69; IC 95 %, 0,56–0,84).
Tratamiento local
Para los pacientes sin enfermedad metastásica, la resección del tumor primario, cuando sea posible, es el abordaje estándar. Para los pacientes con un cáncer irresecable o metastásico, la embolización tumoral, la RHE y la nefrectomía pueden ayudar a paliar los síntomas del tumor primario o los relacionados con la producción ectópica de hormonas o citocinas.
Nefrectomía citorreductora
En la época anterior a la administración de las terapias dirigidas antiangiogénicas y de los inhibidores de puntos de control inmunitarios, en dos ensayos clínicos aleatorizados se demostró un beneficio para la SG en pacientes específicos sometidos a nefrectomía citorreductora inicial antes de la administración de interferón α.[5,6] Sin embargo, existe evidencia científica que avala que la nefrectomía citorreductora previa a la terapia antiangiogénica no proporciona beneficio para la supervivencia en los pacientes con enfermedad de riesgo intermedio o precario. La nefrectomía citorreductora para los pacientes de riesgo bajo no se ha estudiado en ensayos aleatorizados controlados en la época de las terapias dirigidas y la inmunoterapia. Los datos limitados disponibles de estudios retrospectivos no aleatorizados indican un beneficio para pacientes de riesgo bajo tratados durante la época actual de terapias dirigidas.
En el ensayo CARMENA (NCT00930033), se evaluó la eficacia de la nefrectomía citorreductora antes de la terapia dirigida. En el estudio no se notificó ningún beneficio para los pacientes que se sometieron a una nefrectomía citorreductora antes de recibir tratamiento con sunitinib, un inhibidor de tirosina–cinasas con efecto antiangiogénico.[7] En este estudio, participaron solo pacientes con enfermedad de riesgo intermedio (57 %) o precario (43 %), mientras que en un estudio retrospectivo anterior de la época de sunitinib, se encontró que la nefrectomía citorreductora sola benefició a los pacientes con enfermedad de riesgo bajo o intermedio. De manera similar, los ensayos con resultados favorables de la época del interferón se restringieron solo para pacientes asintomáticos o con muy pocos síntomas que tenían un estado funcional de 0 a 1 de acuerdo con la escala de clasificación del ECOG; además se consideró que estos pacientes eran aptos para recibir inmunoterapia posoperatoria.
Se llevó a cabo un análisis multicéntrico de 351 pacientes con carcinoma de células renales metastásico para determinar el efecto de la nefrectomía citorreductora. En el estudio se evaluó a pacientes tratados con terapia sistémica y se compararon los desenlaces de aquellos sometidos a nefrectomía citorreductora con aquellos que no se sometieron al procedimiento. La mediana de SG fue de 38,1 meses para los pacientes sometidos a nefrectomía en comparación con 16,4 meses para aquellos tratados con terapia sistémica sola (P = 0,03). No obstante, el beneficio de supervivencia se limitó a los pacientes con una clasificación de estado funcional del ECOG de 0 a 1 y enfermedad de riesgo bajo o intermedio.[8] La interpretación del estudio se limita por el sesgo de selección ya que los pacientes no se asignaron al azar al grupo de nefrectomía. No se ha determinado si hay un beneficio de la nefrectomía citorreductora para los pacientes que después no reciben terapia sistémica.
Ensayos controlados aleatorizados de nefrectomía citorreductora:
En un ensayo aleatorizado controlado de no inferioridad con 450 pacientes, se compararon los desenlaces de los pacientes que recibieron sunitinib solo y los pacientes sometidos a nefrectomía citorreductora seguida de sunitinib. El ensayo se diseñó para inscribir a 576 pacientes; por lo tanto, no tuvo suficiente potencia estadística.[7] En este estudio, un 43 % de los pacientes tenían enfermedad de riesgo precario y un 57 % tenían enfermedad de riesgo intermedio.
- Al cabo de una mediana de seguimiento de 50,9 meses, y después de 326 muertes, el CRIde muerte fue de 0,89 (IC 95 %, 0,71–1,10) en favor del sunitinib solo. La mediana de SG fue de 18,4 meses en el grupo de sunitinib solo y de 13,9 meses en el grupo de nefrectomía seguida de sunitinib, pero la diferencia no fue estadísticamente significativa.[7][Nivel de evidencia A1]
Ensayos controlados aleatorizados de interferón precedido de nefrectomía citorreductora o sin esta:
En dos estudios aleatorizados se demostró un beneficio para la SG en pacientes específicos sometidos a nefrectomía citorreductora inicial antes de la administración de interferón α.[5,6]
- En el estudio más numeroso, se asignó al azar a 246 pacientes para someterse a nefrectomía seguida de interferón α o a recibir interferón α solo.[5]
- La mediana de SG fue de 11,1 meses cuando primero se extirpó el tumor primario (IC 95 %, 9,2–16,5) en comparación con 8,1 meses en el grupo de control (IC 95 %, 5,4–9,5; P = 0,05).
- En el estudio más pequeño, 85 pacientes con criterios de selección idénticos al del estudio más numeroso, se asignaron al azar para tratamiento de la misma forma que en el estudio más grande.[6]
- Los pacientes que se sometieron a nefrectomía antes de recibir interferón α tuvieron una mediana de SG de 17 meses en comparación con una SG de 7 meses en los pacientes que recibieron interferón α solo (CRI, 0,54; IC 95 %, 0,31–0,94; P = 0,03).[6][Nivel de evidencia A1]
Resección de la enfermedad oligometastásica
Los pacientes específicos con una metástasis solitaria o un número limitado de metástasis a distancia quizás alcancen una supervivencia prolongada con nefrectomía y resección quirúrgica de las metástasis.[48-53] Incluso los pacientes con metástasis encefálicas tuvieron resultados similares.[54] La probabilidad de lograr un beneficio terapéutico con este abordaje parece ser mejor para pacientes con un intervalo sin enfermedad prolongado entre la nefrectomía inicial y la enfermedad metastásica.
Terapia antiangiogénica y otras terapias dirigidas
Un mayor entendimiento de las características biológicas del cáncer en general y del cáncer de células renales en particular, condujo a la formulación de 6 fármacos que se dirigen a vías específicas de crecimiento y que la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ya aprobó. Dos de las terapias dirigidas bloquean el blanco de la rapamicina en los mamíferos (mTOR) una proteína cinasa de serina y treonina que regula el crecimiento, la multiplicación y la supervivencia celular.
Antifactor de crecimiento endotelial vascular e inhibidores de tirosina–cinasas de múltiples dianas
A partir de investigaciones que revelan que la mayoría de los carcinomas de células renales claras portan una variante que resulta en la producción constitutiva de citocinas que estimulan la angiogénesis, se crearon varias sustancias dirigidas a vías mediadas por el factor de crecimiento endotelial vascular (VEGF). En ensayos controlados aleatorizados, varios de estos fármacos mostraron que demoran de manera significativa la progresión del carcinoma de células renales claras, pero ninguno resultó en un aumento estadísticamente significativo de la SG como se evalúa de manera convencional. Muchos de estos ensayos permitieron un cambio de tratamiento en el momento de la progresión y, en algunas instancias, otros fármacos con actividad biológica similar permanecieron disponibles para los pacientes después de retirarse del ensayo clínico. Es posible que esto hiciera más difícil detectar el beneficio de la SG. Para los médicos, es problemático determinar el beneficio real de estos fármacos para el paciente. Los cuatro fármacos anti-VEGF aprobados por la FDA, incluyen tres inhibidores de tirosina–cinasas (ITC) orales: pazopanib, sorafenib y sunitinib, y un anticuerpo monoclonal anti-VEGF, bevacizumab. El axitinib es el más nuevo, potente y selectivo de los inhibidores de los receptores VEGF 1, 2 y 3. La FDA aprobó este fármaco para el tratamiento del carcinoma de células renales avanzado luego del fracaso de un tratamiento sistémico previo.[55]
Cabozantinib
El cabozantinib es un ITC de administración oral que actúa sobre los receptores MET, AXL y VEGF. Después de que en un ensayo de fase I se observara actividad contra el carcinoma de células renales, en un ensayo controlado aleatorizado de fase III se evaluó la actividad del cabozantinib en el entorno de terapia de segunda línea.
Evidencia (cabozantinib):
- En el ensayo METEOR (NCT01865747) se asignó al azar a 658 pacientes, que antes se habían tratado con un ITC de VEGF, a recibir cabozantinib (60 mg por día) o everólimus (10 mg por día).[24,56] Las dosis se redujeron en el 60 % de los pacientes que recibieron cabozantinib en comparación con el 25 % de los pacientes que se asignaron al everólimus.
- La incidencia de efectos adversos de grados 3 o 4 fue del 68 % con cabozantinib, en comparación con el 58 % con everólimus.
- Los efectos adversos de grado alto más frecuentes fueron hipertensión (15 %), diarrea (11 %) y fatiga (9 %) con el cabozantinib, en comparación con anemia (16 %), fatiga (7 %) e hiperglucemia (5 %) con el everólimus.
- La reducción de la dosis de cabozantinib se debió a la presentación de diarrea, síndrome de eritrodisestesia palmoplantar y fatiga.
- Al cabo de una mediana de seguimiento de 19 meses, la SG fue de 21,4 meses para los pacientes que recibieron cabozantinib y de 16,5 meses para los pacientes que recibieron everólimus (CRI, 0,66; IC 95 %, 0,53–0,83; P = 0,0003).
- Estos resultados se confirmaron cuando se hizo el análisis final predeterminado después de que se notificaran 430 muertes. La mediana de supervivencia fue de 21,4 meses con cabozantinib y 17,1 meses con everólimus (CRI, 0,70; IC 95 %, 0,58–0,85).[57]
- En un ensayo posterior se comparó el cabozantinib con sunitinib en el entorno de primera línea. Se asignó al azar a 157 pacientes con carcinoma de células renales metastásico con riesgo intermedio o precario para recibir cabozantinib o sunitinib.[9,10]
- Se observaron efectos adversos en más del 95 % de los pacientes.
- Los efectos adversos de grado 3 y 4 se observaron en un 68 % de los pacientes del grupo de cabozantinib y en un 65 % de los pacientes del grupo de sunitinib.
- Los efectos adversos incluyeron hipertensión, diarrea, fatiga y trombocitopenia.
- Los efectos adversos de grado 5 se presentaron en un 4 % de los pacientes del grupo de cabozantinib y un 10 % de los pacientes del grupo de sunitinib.
- Al cabo de una mediana de seguimiento de 34,5 meses, no hubo diferencia significativa en la SG entre los dos grupos, y las curvas de SG se cruzaron varias veces.
- No obstante, la SSP fue más prolongada para el grupo de cabozantinib (8,6 vs. 5,3 meses [CRI, 0,48; IC 95 %, 0,31–0,74]), lo que demuestra que la SSP es un substituto inadecuado de la SG.[9,10][Nivel de evidencia B1]
- Se observaron efectos adversos en más del 95 % de los pacientes.
Sunitinib
El sunitinib y la combinación de bevacizumab con interferón α se relacionaron con una mayor SSP que el interferón α solo en ensayos controlados aleatorizados. El sunitinib es un inhibidor multicinasa (VEGFR-1, VEGFR-2, PDGFR, c-Kit) disponible para uso oral.
Evidencia (sunitinib):
- En un ensayo de fase III, se comparó el sunitinib con el interferón α en 750 pacientes con cáncer de células renales claras sin tratamiento previo.[12]
- El sunitinib como tratamiento sistémico de primera línea se relacionó con una mediana de SSP de 11 meses, en comparación con una de 5 meses para el interferón α.
- El CRI para la progresión fue de 0,42 (IC 95 %, 0,32–0,54, P < 0,001).[12][Nivel de evidencia B1]
- Sin embargo, el análisis de la SG mostró una tendencia fuerte, pero no fue estadísticamente significativa hacia una mejora de la supervivencia (26,4 vs. 21,8 meses, CRI, 0,82; IC 95 %, 0,669–1,001; P = 0,051).[13][Nivel de evidencia B1]
El bevacizumab, un anticuerpo monoclonal que se une y neutraliza la proteína VEGF circulante, demoró la progresión del carcinoma de células renales claras cuando se lo comparó con un placebo en pacientes con enfermedad resistente a la terapia biológica.[32] De forma similar, el bevacizumab con interferón α como tratamiento de primera línea resultó en una SSP más prolongada, pero no en una SG más prolongada en comparación con el interferón α solo en dos ensayos aleatorizados controlados de diseño similar.[33,34]
Pazopanib
El pazopanib es un inhibidor multicinasa disponible para uso oral (VEGFR-1, VEGFR-2, VEGFR-3, PDGFR y c-KIT) y también se aprobó para el tratamiento de pacientes de carcinoma de células renales en estadio avanzado.
Evidencia (pazopanib):
- El pazopanib se evaluó en un ensayo internacional aleatorizado controlado con placebo (VEG015192 [NCT00334282]) con la participación de 435 pacientes de carcinoma de células renales claras o con predominio de células claras.[28] Casi el 50 % de los pacientes habían recibido previamente terapia con citocinas, aunque los restantes no habían recibido este tipo de terapia.
- La SSP se prolongó de manera significativa en el grupo de pazopanib con 9,2 meses mientras que en el grupo de placebo fue de 4,2 meses.
- El CRI para la progresión fue de 0,46 (IC 95 %, 0,34–0,62; P < 0,0001) y la mediana de duración de la respuesta fue mayor de 1 año.
- En un ensayo controlado aleatorizado (NCT00720941) en el que se comparó el pazopanib con el sunitinib, participaron 1110 pacientes con carcinoma de células renales metastásicos con un componente de células claras en una proporción de 1:1.[14] El criterio de valoración primario fue la SSP. El estudio se potenció para evaluar la ausencia de inferioridad del pazopanib. Los resultados se dieron a conocer cuando se presentó progresión de la enfermedad en 336 de 557 pacientes (60 %) que recibieron pazopanib y en 323 de 553 pacientes (58 %) que recibieron sunitinib.
- La mediana de SSP fue de 8,4 meses para los que participaron en el grupo de pazopanib y de 9,5 meses para aquellos en el grupo de sunitinib (CRI, 1,05; IC, 0,9–1,22).
- No hubo diferencia en la SG (CRI, 0,91; IC 95 %, 0,76–1,08).
- Aunque en estos estudios se comparó la CV, la diferencia de horarios de administración de los fármacos hizo que esta comparación fuese difícil de interpretar.
- En un ensayo posterior con enmascaramiento doble, aleatorizado, controlado y cruzado, se comparó el sunitinib seguido de pazopanib con el pazopanib seguido de sunitinib. El criterio primario de valoración fue la preferencia del paciente de un fármaco u otro.[15] Los pacientes se trataron durante 10 semanas con sunitinib o pazopanib, seguidos de un período de reposo farmacológico de 2 semanas, seguidos de 10 semanas más de tratamiento con el otro fármaco. La preferencia se evaluó al final del segundo período de tratamiento de 10 semanas. El diseño de este estudio creó un posible sesgo en favor del pazopanib.
Si bien, el régimen de administración tradicional del sunitinib es un ciclo de 6 semanas, con 4 semanas con el fármaco y 2 semanas sin este, en el Patient Preference Study of Pazopanib Versus Sunitinib in Advanced or Metastatic Kidney Cancer (PISCES [NCT01064310]) se escogió un período de tratamiento de 10 semanas en vez de 12 semanas. Debido al cambio en el período de tratamiento, las 10 semanas de tratamiento de sunitinib incluyeron 4 semanas con el fármaco, seguidas de 2 semanas sin este, seguidas de 4 semanas más con el fármaco. A los pacientes asignados al pazopanib seguido de sunitinib se les evaluó la preferencia de tratamiento al final del segundo período de 4 semanas con el fármaco, durante el cual los pacientes recibieron sunitinib diario por 28 días. En ese momento, los efectos secundarios del sunitinib fueron los más graves. El resultado esperado de las evaluaciones que se realizaron al final del ciclo de tratamiento de 6 semanas versus el ciclo de tratamiento de 4 semanas sería la disminución considerable de los efectos secundarios.
Además, el período de reposo farmacológico de 2 semanas, que ocurrió entre los 2 períodos de tratamiento de 10 semanas, constituyó un verdadero descanso del tratamiento para los pacientes asignados a recibir primero pazopanib; sin embargo, para los pacientes que tomaron sunitinib, el período de reposo farmacológico de 2 semanas fue el término de su segundo ciclo de tratamiento de 6 semanas. En otras palabras, los pacientes asignados primero al pazopanib tuvieron un verdadero descanso del tratamiento de 2 semanas y su preferencia por el fármaco se evaluó durante el período de efectos tóxicos máximos del sunitinib; sin embargo, los pacientes asignados primero al sunitinib no tuvieron un verdadero descanso del tratamiento antes de comenzar pazopanib y es posible que hayan tenido menos oportunidad de recuperarse de los efectos secundarios del sunitinib.
- A pesar de estas limitaciones, el 70 % de los pacientes prefirieron pazopanib y el 22 % prefirieron sunitinib (P < 0,001).
- La mayoría de los pacientes prefirieron pazopanib independientemente del tratamiento que recibieron primero; sin embargo, esa diferencia fue mayor para los pacientes que recibieron pazopanib primero (80 vs. 11 %) en comparación con los pacientes que recibieron sunitinib primero (62 vs. 32 %).
- Los principales efectos secundarios que citaron los pacientes que contribuyeron a la preferencia del paciente fueron la diarrea, la CVRS, la fatiga, la pérdida de apetito, los cambios en el gusto, las náuseas y vómitos, el dolor en manos y pies, el dolor de estómago, y el dolor en la boca y la garganta.
- Los pacientes que prefirieron pazopanib citaron menos fatiga y mejor CV como las razones más comunes para su preferencia.
- Los pacientes que prefirieron sunitinib citaron menos diarrea y mejor CV como las razones principales para su preferencia.
- La preferencia del médico fue un criterio secundario de valoración en el estudio; el 61 % de los médicos prefirieron continuar el tratamiento del paciente con pazopanib, en comparación con el 22 % de los médicos que prefirieron continuar el tratamiento del paciente con sunitinib.
Sorafenib
El sorafenib es un inhibidor multicinasa disponible de forma oral (CRAF, BRAF, KIT, FLT-3, VEGFR-2, VEGFR-3 y PDGFRB) y también se aprobó para el tratamiento de pacientes con carcinoma de células renales en estadio avanzado.[58]
Evidencia (sorafenib):
- En un ensayo internacional, multicéntrico, aleatorizado , se estratificó a 769 pacientes según la categoría pronóstica y de riesgo del Memorial Sloan Kettering Cancer Center y país. Los pacientes se asignaron al azar para recibir sorafenib (400 mg 2 veces por día) o un placebo. Casi el 82 % de los pacientes había recibido previamente IL-2 o interferón α en ambos grupos del estudio. Los criterios principales de valoración fueron la SSP y la SG.
- La mediana de SSP de los pacientes asignados al azar para recibir sorafenib fue de 167 días, en comparación con 84 días para los pacientes asignados al azar para recibir un placebo (P < 0,001).
- El CRI calculado para el riesgo de progresión con sorafenib comparado con un placebo fue de 0,44 (IC 95 %, 0,35–0,55). No hubo diferencia significativa en cuanto a la SG.[58][Nivel de evidencia B1]
- En un estudio de fase II se asignaron 189 pacientes de forma aleatorizada a sorafenib o interferón α. [29]
- No se informó diferencia en la SSP (5,7 vs. 5,6 meses), pero el sorafenib se relacionó con una mejor CV en comparación con el interferón α.
Axitinib
El axitinib prologó la SSP cuando se administró como tratamiento sistémico de segunda línea.
Evidencia (axitinib):
- En un ensayo controlado aleatorizado con 723 pacientes llevado a cabo en 175 centros en 22 países, se evaluó el axitinib versus el sorafenib como tratamiento para el carcinoma de células renales. Los pacientes presentaron enfermedad con un componente de células claras y progresión durante o después del tratamiento con sunitinib (54 %), citocinas (35 %), bevacizumab con interferón α (8 %) o temsirólimus (3 %).[36,55] El objetivo principal fue la SSP y los datos se analizaron cuando la enfermedad progresó en el 88 % de los pacientes del grupo de axitinib y el 90 % de los pacientes del grupo de sorafenib, mientras que el 58 % y el 59 %, respectivamente, murieron.
- La mediana de SSP fue de 8,3 meses con el axitinib y de 5,7 meses con el sorafenib (CRIde progresión o muerte, 0,656, IC 95 %, 0,552–0,779, P de orden logarítmico unilateral < 0,0001 y un umbral de P < 0,025 de significación).
- La mediana de SG fue de 20,1 meses con axitinib en comparación con 19,2 meses con sorafenib (CRI, 0,969; IC 95 %, 0,80–1,17, P = 0,374).
- Sin embargo, el mayor beneficio se observó en pacientes que recibieron citocinas como tratamiento de primera línea y cuya mediana de SSP fue de 12,2 meses con axitinib en comparación con 8,2 meses con sorafenib (P < 0,0001), mientras que la mediana de SG fue de 29,4 meses con axitinib en comparación con 27,8 meses con sorafenib (CRI, 0,81; IC 95 %, 0,55–1,19; P = 0,144).
- En contraste, en los pacientes que recibieron previamente sunitinib, el axitinib se relacionó con un aumento de 2,1 meses en la SSP en comparación con sorafenib (6,5 meses vs 4,4 meses P unilateral = 0,002), pero la mediana de SG fue casi idéntica: 15,2 meses con axitinib comparada con 16,5 meses con sorafenib, (CRI, 1,0; IC 95 %, 0,782–1,270; P = 0,49).[36]
La comparación de la toxicidad de los regímenes de axitinib y sorafenib es complicada porque el grupo de axitinib incluyó un componente de aumento gradual de la dosis y solo aquellos pacientes que toleraron la dosis más baja recibieron después las dosis más altas. La hipertensión, las náuseas, la disfonía y el hipotiroidismo fueron más comunes con el axitinib, mientras que la eritrodisestesia palmoplantar, la alopecia y la erupción cutánea fueron más comunes con el sorafenib.[36,55]
Tivozanib
El tivozanib es un ITC selectivo para el receptor del VEGF. En un ensayo controlado aleatorizado de fase III se comparó el tivozanib con el sorafenib para el tratamiento de primera línea de pacientes con cáncer de células renales metastásico. En el estudio se notificó que tivozanib se relacionó con una mediana de SSP superior, pero la SG favoreció al sorafenib.[26] En un ensayo posterior de fase III controlado aleatorizado se compararon los 2 fármacos en pacientes que habían recibido al menos 2 terapias sistémicas, que incluían como mínimo 1 inhibidor de VEGF. En este segundo ensayo se notificó una mediana de SSP superior en los pacientes que se trataron con tivozanib y no hubo diferencias en la SG.[27] En los Estados Unidos, la FDA aprobó el tivozanib para los pacientes que habían recibido 2 o más terapias sistémicas.
Evidencia (tivozanib):
- En un ensayo controlado aleatorizado sin enmascaramiento de fase III, se comparó el tivozanib con el sorafenib como terapia dirigida inicial. En el estudio se incluyeron 517 pacientes con cáncer de células renales metastásico con componente de células claras que habían recibido 1 terapia sistémica o ninguna. No fueron aptos los pacientes que habían recibido tratamientos anteriores con terapia dirigida al VEGF o inhibidores de mTOR. El criterio principal de valoración fue la SSP.[26]
- La mediana de SSP fue superior en los pacientes que recibieron tivozanib que en los pacientes que recibieron sorafenib (11,9 meses vs. 9,1 meses; CRI, 0,797; IC 95 %, 0,639–0,993; P = 0,042). Un total de 156 pacientes (61 %) que presentaron progresión de la enfermedad cuando recibían sorafenib se cambiaron al grupo de tivozanib.[26][Nivel de evidencia B1]
- No hubo diferencias en la SG.
- Los 2 fármacos presentaron diferentes patrones de toxicidad. Entre los efectos adversos que fueron más frecuentes con tivozanib que con sorafenib se incluyen hipertensión (44 vs. 34 %) y disfonía (21 vs. 5 %). Entre los efectos adversos que fueron más frecuentes con sorafenib que con tivozanib se incluyen reacciones cutáneas palmoplantares (54 vs. 14 %) y diarrea (33 vs. 23 %).
- En un ensayo controlado aleatorizado sin enmascaramiento (NCT02627963), se comparó tivozanib con sorafenib. En el estudio se incluyeron 350 pacientes con cáncer de células renales metastásico que en pasado habían recibido al menos 2 terapias sistémicas diferentes, que incluían 1 inhibidor VEGF.[27]
- Al cabo de una mediana de seguimiento de 19,0 meses, la mediana de SSP fue superior en los pacientes que recibieron tivozanib (5,6 meses vs. 3,9 meses; CRI, 0,73; IC 95 %, 0,56–0,94; P = 0,016).[27][Nivel de evidencia B1]
- No se notificaron diferencias en la SSG. La mediana de SG fue de 16,4 meses en los pacientes que recibieron tivozanib y de 19,2 meses en los pacientes recibieron sorafenib (CRI, 0,97; IC 95 %, 0,75–1,24).[59]
- Se notificaron efectos adversos de grados 3 y 4 relacionados con el tratamiento en un 11 % de los pacientes que recibieron tivozanib y un 10 % de los pacientes que recibieron sorafenib.
Inhibidores del blanco de la rapamicina en los mamíferos
Temsirólimus
El temsirólimus es un inhibidor del blanco de la rapamicina en los mamíferos (mTOR).
Evidencia (temsirólimus):
- En un ensayo controlado aleatorizado de fase III se incluyeron pacientes de riesgo intermedio y precario con una variedad de subtipos de carcinoma de células renales. El ensayo no se restringió al cáncer de células renales claras.
- Se observó una SG más prolongada con el temsirólimus que con el interferón α.
- El CRIde muerte fue de 0,73 (IC 95 %, 0,58–0,92, P = 0,008), lo que convierte a temsirólimus en el único tratamiento para el carcinoma de células renales que mostró resultados inequívocos de una SG más prolongada en comparación con el interferón α cuando se usaron análisis estadísticos convencionales.[31]
Everólimus
El everólimus es un inhibidor mTOR de administración oral.
Evidencia (everólimus):
- El everólimus se evaluó en un ensayo aleatorizado de fase III, con enmascaramiento doble y controlado con placebo. En el ensayo se inscribieron pacientes de carcinoma de células renales metastásico con un componente de células claras que progresó durante 6 meses o en un plazo de 6 meses después de interrumpir el tratamiento con sunitinib, sorafenib o ambos fármacos.
- La mediana de SSP fue de 4,0 meses con everólimus en comparación con 1,9 meses con placebo.[37]
- No se informó de diferencias en la SG.
Inhibidores del factor inducible por hipoxia 2α
Belzutifán
El belzutifán es un inhibidor del factor inducible por hipoxia (HIF) 2α usado para el tratamiento del carcinoma renal de células claras avanzado en pacientes con progresión de la enfermedad después de 1 a 3 líneas de terapia sistémica previas, que incluyeron inhibidores de los puntos de control inmunitario y terapias dirigidas a VEGF.
- En el ensayo sin enmascaramiento de fase III LITESPARK-005 (NCT04195750) se comparó el belzutifán con el everólimus en pacientes con carcinoma renal de células claras avanzado que presentaron progresión de la enfermedad después de 1 a 3 líneas de terapia sistémica previas, que incluyeron inhibidores de los puntos de control inmunitario y terapias dirigidas a VEGF. Los criterios de valoración coprimarios del estudio fueron la SSP, evaluada por revisión central independiente y enmascarada con la versión 1.1 de Response Evaluation Criteria in Solid Tumors (RECIST), y la SG.[25]
- En el ensayo se demostró una mejora significativa de la SSP con belzutifán en comparación con everólimus (CRI, 0,75; IC 95 %, 0,63–0,90, P = 0,0016). Las tasas de respuesta objetiva fueron también un 19,2 % más altas en el grupo de belzutifán (IC 95 %, 14,8–24,0 %). Sin embargo, la SG no mejoró de manera significativa (CRI, 0,88; IC 95 %, 0,73–1,07, P = 0,20), lo que indicó la ausencia de una diferencia significativa desde el punto de vista clínico. La falta de beneficio en la SG plantea inquietudes sobre la importancia clínica de la mejora en la SSP.[25][Nivel de evidencia B1]
- Los eventos adversos de grado 3 o superiores de cualquier causa se presentaron en el 61,8 % de los pacientes en el grupo de belzutifán (el grado 5 de intensidad se presentó en el 3,5 % de los pacientes) y en el 62,5 % de los pacientes en el grupo de everólimus (el grado 5 de intensidad se presentó en el 5,3 % de los pacientes). Los eventos adversos que llevaron a la interrupción del tratamiento se presentaron en el 5,9 % de los pacientes del grupo de belzutifán y en el 14,7 % de los pacientes del grupo de everólimus.
La FDA aprobó el belzutifán para el tratamiento del carcinoma renal de células claras avanzado como segunda línea de tratamiento o posterior basada en los beneficios de SSP observados en el ensayo. Sin embargo, el ensayo no cumplió con el criterio primario de SG. Además, el costo del belzutifán es de $31 000 por mes en pacientes no asegurados, mientras que el everólimus, un medicamento genérico, cuesta aproximadamente $450 por mes (en dólares de 2024).
Terapia combinada con inhibidores de tirosina–cinasas de múltiples dianas e inhibidores de mTOR
Lenvatinib y everólimus
El lenvatinib es un inhibidor de tirosina–cinasas (ITC) de múltiples dianas con actividad contra VEGFR-1, VEGFR-2 y VEGFR-3, y con actividad inhibitoria contra los receptores del factor de crecimiento de fibroblastos (FGFR1, FGFR2, FGFR3, and FGFR4), PDGFRA, RET, y KIT.
Evidencia científica (lenvatinib y everólimus):
- En un estudio de fase II controlado, aleatorizado, se comparó la combinación de lenvatinib y everólimus con la administración de cada medicamento como monoterapia en 153 pacientes con carcinoma de células renales que ya habían recibido terapia antiangiogénica.[23] El criterio principal de valoración fue la SSP.
- La mediana de SSP fue significativamente más larga en el grupo de la combinación (14,6 meses) que en el grupo de everólimus (5,5 meses) (CRI, 0,40; IC 95 %, 0,24–0,68).[23][Nivel de evidencia B1]
- La mediana de SSP fue de 7,4 meses para el lenvatinib, no fue significativamente más corta que para el grupo de la combinación (CRI, 0,66; 0,39–1,10), pero fue significativamente más larga que para el grupo de everólimus (CRI, 0,61; IC 95 %, 0,38–0,98; P = 0,048).
- No hubo diferencias significativas en la SG en el momento del cierre de la base de datos. En un análisis a posteriori de la SG con un seguimiento más largo, sí se observó una supervivencia más larga en el grupo de la combinación en comparación con el grupo de everólimus solo (25,5 meses [IC 95 %, 16,4 hasta no evaluable] vs. 15,4 meses [IC 95 %, 11,8–19,6]; CRI, 0,51; IC 95 %, 0,30–0,88; P = 0,024).
- La mediana de SG en el grupo de lenvatinib solo fue de 19,1 meses y no fue significativamente diferente de los otros dos grupos.
- Todos los pacientes presentaron efectos adversos y casi todos se consideraron relacionados con el tratamiento. De los pacientes, el 71 % presentaron efectos adversos de grado 3 o más alto. Las toxicidades más frecuentes en el grupo de la combinación fueron diarrea, hipertensión, cansancio, pérdida del apetito, vómitos y tos. Un paciente en el grupo de la combinación murió de una hemorragia cerebral que se consideró relacionada con el tratamiento.
Quimioterapia
Las respuestas a la quimioterapia citotóxica por lo general no superaron el 10 % en ningún régimen estudiado en un número adecuado de pacientes.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Motzer RJ, Tannir NM, McDermott DF, et al.: Nivolumab plus Ipilimumab versus Sunitinib in Advanced Renal-Cell Carcinoma. N Engl J Med 378 (14): 1277-1290, 2018. [PUBMED Abstract]
- Rini BI, Plimack ER, Stus V, et al.: Pembrolizumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med 380 (12): 1116-1127, 2019. [PUBMED Abstract]
- Motzer R, Alekseev B, Rha SY, et al.: Lenvatinib plus Pembrolizumab or Everolimus for Advanced Renal Cell Carcinoma. N Engl J Med 384 (14): 1289-1300, 2021. [PUBMED Abstract]
- Choueiri TK, Powles T, Burotto M, et al.: Nivolumab plus Cabozantinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med 384 (9): 829-841, 2021. [PUBMED Abstract]
- Flanigan RC, Salmon SE, Blumenstein BA, et al.: Nephrectomy followed by interferon alfa-2b compared with interferon alfa-2b alone for metastatic renal-cell cancer. N Engl J Med 345 (23): 1655-9, 2001. [PUBMED Abstract]
- Mickisch GH, Garin A, van Poppel H, et al.: Radical nephrectomy plus interferon-alfa-based immunotherapy compared with interferon alfa alone in metastatic renal-cell carcinoma: a randomised trial. Lancet 358 (9286): 966-70, 2001. [PUBMED Abstract]
- Méjean A, Ravaud A, Thezenas S, et al.: Sunitinib Alone or after Nephrectomy in Metastatic Renal-Cell Carcinoma. N Engl J Med 379 (5): 417-427, 2018. [PUBMED Abstract]
- Mathieu R, Pignot G, Ingles A, et al.: Nephrectomy improves overall survival in patients with metastatic renal cell carcinoma in cases of favorable MSKCC or ECOG prognostic features. Urol Oncol 33 (8): 339.e9-15, 2015. [PUBMED Abstract]
- Choueiri TK, Halabi S, Sanford BL, et al.: Cabozantinib Versus Sunitinib As Initial Targeted Therapy for Patients With Metastatic Renal Cell Carcinoma of Poor or Intermediate Risk: The Alliance A031203 CABOSUN Trial. J Clin Oncol 35 (6): 591-597, 2017. [PUBMED Abstract]
- Choueiri TK, Hessel C, Halabi S, et al.: Cabozantinib versus sunitinib as initial therapy for metastatic renal cell carcinoma of intermediate or poor risk (Alliance A031203 CABOSUN randomised trial): Progression-free survival by independent review and overall survival update. Eur J Cancer 94: 115-125, 2018. [PUBMED Abstract]
- Motzer RJ, Penkov K, Haanen J, et al.: Avelumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med 380 (12): 1103-1115, 2019. [PUBMED Abstract]
- Motzer RJ, Hutson TE, Tomczak P, et al.: Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med 356 (2): 115-24, 2007. [PUBMED Abstract]
- Motzer RJ, Hutson TE, Tomczak P, et al.: Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma. J Clin Oncol 27 (22): 3584-90, 2009. [PUBMED Abstract]
- Motzer RJ, Hutson TE, Cella D, et al.: Pazopanib versus sunitinib in metastatic renal-cell carcinoma. N Engl J Med 369 (8): 722-31, 2013. [PUBMED Abstract]
- Escudier B, Porta C, Bono P, et al.: Randomized, controlled, double-blind, cross-over trial assessing treatment preference for pazopanib versus sunitinib in patients with metastatic renal cell carcinoma: PISCES Study. J Clin Oncol 32 (14): 1412-8, 2014. [PUBMED Abstract]
- Coppin C, Porzsolt F, Awa A, et al.: Immunotherapy for advanced renal cell cancer. Cochrane Database Syst Rev (1): CD001425, 2005. [PUBMED Abstract]
- Negrier S, Perol D, Ravaud A, et al.: Medroxyprogesterone, interferon alfa-2a, interleukin 2, or combination of both cytokines in patients with metastatic renal carcinoma of intermediate prognosis: results of a randomized controlled trial. Cancer 110 (11): 2468-77, 2007. [PUBMED Abstract]
- Pyrhönen S, Salminen E, Ruutu M, et al.: Prospective randomized trial of interferon alfa-2a plus vinblastine versus vinblastine alone in patients with advanced renal cell cancer. J Clin Oncol 17 (9): 2859-67, 1999. [PUBMED Abstract]
- Interferon-alpha and survival in metastatic renal carcinoma: early results of a randomised controlled trial. Medical Research Council Renal Cancer Collaborators. Lancet 353 (9146): 14-7, 1999. [PUBMED Abstract]
- McDermott DF, Regan MM, Clark JI, et al.: Randomized phase III trial of high-dose interleukin-2 versus subcutaneous interleukin-2 and interferon in patients with metastatic renal cell carcinoma. J Clin Oncol 23 (1): 133-41, 2005. [PUBMED Abstract]
- Yang JC, Topalian SL, Parkinson D, et al.: Randomized comparison of high-dose and low-dose intravenous interleukin-2 for the therapy of metastatic renal cell carcinoma: an interim report. J Clin Oncol 12 (8): 1572-6, 1994. [PUBMED Abstract]
- Motzer RJ, Rini BI, McDermott DF, et al.: Nivolumab for Metastatic Renal Cell Carcinoma: Results of a Randomized Phase II Trial. J Clin Oncol 33 (13): 1430-7, 2015. [PUBMED Abstract]
- Motzer RJ, Hutson TE, Glen H, et al.: Lenvatinib, everolimus, and the combination in patients with metastatic renal cell carcinoma: a randomised, phase 2, open-label, multicentre trial. Lancet Oncol 16 (15): 1473-1482, 2015. [PUBMED Abstract]
- Choueiri TK, Escudier B, Powles T, et al.: Cabozantinib versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med 373 (19): 1814-23, 2015. [PUBMED Abstract]
- Choueiri TK, Powles T, Peltola K, et al.: Belzutifan versus Everolimus for Advanced Renal-Cell Carcinoma. N Engl J Med 391 (8): 710-721, 2024. [PUBMED Abstract]
- Motzer RJ, Nosov D, Eisen T, et al.: Tivozanib versus sorafenib as initial targeted therapy for patients with metastatic renal cell carcinoma: results from a phase III trial. J Clin Oncol 31 (30): 3791-9, 2013. [PUBMED Abstract]
- Rini BI, Pal SK, Escudier BJ, et al.: Tivozanib versus sorafenib in patients with advanced renal cell carcinoma (TIVO-3): a phase 3, multicentre, randomised, controlled, open-label study. Lancet Oncol 21 (1): 95-104, 2020. [PUBMED Abstract]
- Sternberg CN, Davis ID, Mardiak J, et al.: Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J Clin Oncol 28 (6): 1061-8, 2010. [PUBMED Abstract]
- Escudier B, Szczylik C, Hutson TE, et al.: Randomized phase II trial of first-line treatment with sorafenib versus interferon Alfa-2a in patients with metastatic renal cell carcinoma. J Clin Oncol 27 (8): 1280-9, 2009. [PUBMED Abstract]
- Escudier B, Eisen T, Stadler WM, et al.: Sorafenib in advanced clear-cell renal-cell carcinoma. N Engl J Med 356 (2): 125-34, 2007. [PUBMED Abstract]
- Hudes G, Carducci M, Tomczak P, et al.: Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med 356 (22): 2271-81, 2007. [PUBMED Abstract]
- Yang JC, Haworth L, Sherry RM, et al.: A randomized trial of bevacizumab, an anti-vascular endothelial growth factor antibody, for metastatic renal cancer. N Engl J Med 349 (5): 427-34, 2003. [PUBMED Abstract]
- Rini BI, Halabi S, Rosenberg JE, et al.: Bevacizumab plus interferon alfa compared with interferon alfa monotherapy in patients with metastatic renal cell carcinoma: CALGB 90206. J Clin Oncol 26 (33): 5422-8, 2008. [PUBMED Abstract]
- Escudier B, Pluzanska A, Koralewski P, et al.: Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: a randomised, double-blind phase III trial. Lancet 370 (9605): 2103-11, 2007. [PUBMED Abstract]
- Escudier B, Bellmunt J, Négrier S, et al.: Phase III trial of bevacizumab plus interferon alfa-2a in patients with metastatic renal cell carcinoma (AVOREN): final analysis of overall survival. J Clin Oncol 28 (13): 2144-50, 2010. [PUBMED Abstract]
- Motzer RJ, Escudier B, Tomczak P, et al.: Axitinib versus sorafenib as second-line treatment for advanced renal cell carcinoma: overall survival analysis and updated results from a randomised phase 3 trial. Lancet Oncol 14 (6): 552-62, 2013. [PUBMED Abstract]
- Motzer RJ, Escudier B, Oudard S, et al.: Efficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomised, placebo-controlled phase III trial. Lancet 372 (9637): 449-56, 2008. [PUBMED Abstract]
- Motzer RJ, Escudier B, McDermott DF, et al.: Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med 373 (19): 1803-13, 2015. [PUBMED Abstract]
- Rosenberg SA, Lotze MT, Muul LM, et al.: A progress report on the treatment of 157 patients with advanced cancer using lymphokine-activated killer cells and interleukin-2 or high-dose interleukin-2 alone. N Engl J Med 316 (15): 889-97, 1987. [PUBMED Abstract]
- Fisher RI, Coltman CA, Doroshow JH, et al.: Metastatic renal cancer treated with interleukin-2 and lymphokine-activated killer cells. A phase II clinical trial. Ann Intern Med 108 (4): 518-23, 1988. [PUBMED Abstract]
- Weiss GR, Margolin KA, Aronson FR, et al.: A randomized phase II trial of continuous infusion interleukin-2 or bolus injection interleukin-2 plus lymphokine-activated killer cells for advanced renal cell carcinoma. J Clin Oncol 10 (2): 275-81, 1992. [PUBMED Abstract]
- Rosenberg SA, Yang JC, Topalian SL, et al.: Treatment of 283 consecutive patients with metastatic melanoma or renal cell cancer using high-dose bolus interleukin 2. JAMA 271 (12): 907-13, 1994 Mar 23-30. [PUBMED Abstract]
- Fyfe G, Fisher RI, Rosenberg SA, et al.: Results of treatment of 255 patients with metastatic renal cell carcinoma who received high-dose recombinant interleukin-2 therapy. J Clin Oncol 13 (3): 688-96, 1995. [PUBMED Abstract]
- Sleijfer DT, Janssen RA, Buter J, et al.: Phase II study of subcutaneous interleukin-2 in unselected patients with advanced renal cell cancer on an outpatient basis. J Clin Oncol 10 (7): 1119-23, 1992. [PUBMED Abstract]
- Atkins MB, Sparano J, Fisher RI, et al.: Randomized phase II trial of high-dose interleukin-2 either alone or in combination with interferon alfa-2b in advanced renal cell carcinoma. J Clin Oncol 11 (4): 661-70, 1993. [PUBMED Abstract]
- Motzer R, Porta C, Alekseev B, et al.: Health-related quality-of-life outcomes in patients with advanced renal cell carcinoma treated with lenvatinib plus pembrolizumab or everolimus versus sunitinib (CLEAR): a randomised, phase 3 study. Lancet Oncol 23 (6): 768-780, 2022. [PUBMED Abstract]
- Motzer RJ, Powles T, Burotto M, et al.: Nivolumab plus cabozantinib versus sunitinib in first-line treatment for advanced renal cell carcinoma (CheckMate 9ER): long-term follow-up results from an open-label, randomised, phase 3 trial. Lancet Oncol 23 (7): 888-898, 2022. [PUBMED Abstract]
- Murthy SC, Kim K, Rice TW, et al.: Can we predict long-term survival after pulmonary metastasectomy for renal cell carcinoma? Ann Thorac Surg 79 (3): 996-1003, 2005. [PUBMED Abstract]
- van der Poel HG, Roukema JA, Horenblas S, et al.: Metastasectomy in renal cell carcinoma: A multicenter retrospective analysis. Eur Urol 35 (3): 197-203, 1999. [PUBMED Abstract]
- Eggener SE, Yossepowitch O, Kundu S, et al.: Risk score and metastasectomy independently impact prognosis of patients with recurrent renal cell carcinoma. J Urol 180 (3): 873-8; discussion 878, 2008. [PUBMED Abstract]
- Kwak C, Park YH, Jeong CW, et al.: Metastasectomy without systemic therapy in metastatic renal cell carcinoma: comparison with conservative treatment. Urol Int 79 (2): 145-51, 2007. [PUBMED Abstract]
- Russo P, O'Brien MF: Surgical intervention in patients with metastatic renal cancer: metastasectomy and cytoreductive nephrectomy. Urol Clin North Am 35 (4): 679-86; viii, 2008. [PUBMED Abstract]
- Hofmann HS, Neef H, Krohe K, et al.: Prognostic factors and survival after pulmonary resection of metastatic renal cell carcinoma. Eur Urol 48 (1): 77-81; discussion 81-2, 2005. [PUBMED Abstract]
- Wroński M, Arbit E, Russo P, et al.: Surgical resection of brain metastases from renal cell carcinoma in 50 patients. Urology 47 (2): 187-93, 1996. [PUBMED Abstract]
- Rini BI, Escudier B, Tomczak P, et al.: Comparative effectiveness of axitinib versus sorafenib in advanced renal cell carcinoma (AXIS): a randomised phase 3 trial. Lancet 378 (9807): 1931-9, 2011. [PUBMED Abstract]
- Choueiri TK, Escudier B, Powles T, et al.: Cabozantinib versus everolimus in advanced renal cell carcinoma (METEOR): final results from a randomised, open-label, phase 3 trial. Lancet Oncol 17 (7): 917-927, 2016. [PUBMED Abstract]
- Motzer RJ, Escudier B, Powles T, et al.: Long-term follow-up of overall survival for cabozantinib versus everolimus in advanced renal cell carcinoma. Br J Cancer 118 (9): 1176-1178, 2018. [PUBMED Abstract]
- Nexavar® [label information]. Rockville, Md: Center for Drug Evaluation and Research, FDA, 2007. Available online. Last accessed February 17, 2025.
- Pal SK, Escudier BJ, Atkins MB, et al.: Final Overall Survival Results from a Phase 3 Study to Compare Tivozanib to Sorafenib as Third- or Fourth-line Therapy in Subjects with Metastatic Renal Cell Carcinoma. Eur Urol 78 (6): 783-785, 2020. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (03/26/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes hechos a este resumen a partir de la fecha arriba indicada.
Información general sobre el cáncer de células renales
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2025 (se citó a la American Cancer Society como referencia 1).
Tratamiento del cáncer de células renales en estadio IV y recidivante
Se revisó la lista de opciones de tratamiento para la terapia de segunda línea del cáncer de células renales en estadio IV y se incluyó belzutifán (se citó a Choueiri et al. como referencia 25).
Se añadió la subsección nueva Inhibidores del factor inducible por hipoxia 2α.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de células renales. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de células renales son:
- Juskaran S. Chadha, DO (Moffitt Cancer Center)
- Jad Chahoud, MD, MPH (Moffitt Cancer Center)
- Timothy Gilligan, MD (Cleveland Clinic Taussig Cancer Institute)
- Joseph J. Park, MD (Duke University Medical Center)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de células renales. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/rinon/pro/tratamiento-rinon-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.