Tratamiento de gliomas (incluso astrocitomas) y de tumores neuronales o glioneuronales infantiles (PDQ®)–Versión para profesionales de salud
Información general sobre los gliomas, los astrocitomas y los tumores neuronales o glioneuronales infantiles
Los tumores encefálicos primarios, que incluyen los gliomas, son un grupo diverso de enfermedades que en conjunto constituyen los tumores sólidos más frecuentes en la niñez. Los tumores de encéfalo (también llamados tumores encefálicos, tumores cerebrales o cánceres cerebrales) se clasifican según sus características histológicas y moleculares, pero la localización del tumor y la extensión de la diseminación también son factores importantes que afectan el tratamiento y el pronóstico. Las características histológicas, el análisis inmunohistoquímico y los hallazgos citogenéticos y genético-moleculares se utilizan en el diagnóstico y la clasificación tumoral.
Se piensa que los gliomas surgen de las células madre y progenitoras neurales que se encuentran en el encéfalo y la médula espinal. Los gliomas se clasifican según las características histológicas y moleculares, y representan el tipo más habitual de tumor del sistema nervioso central (SNC) en los niños.
Históricamente, los gliomas en pediatría se clasificaban en gliomas de grado bajo (grados 1–2 de la Organización Mundial de la Salud [OMS]) y de grado alto (grados 3–4 de la OMS) según sus características histológicas. Sin embargo, la incorporación de biomarcadores moleculares ha dado lugar a un nuevo esquema de clasificación. De acuerdo con la clasificación de tumores del sistema nervioso central de la OMS de 2021 (5ª edición), los gliomas, los tumores glioneuronales y los tumores neuronales se clasifican en general en gliomas difusos de tipo adulto, gliomas difusos de grado bajo de tipo pediátrico, gliomas difusos de grado alto de tipo pediátrico, gliomas astrocíticos circunscritos, tumores glioneuronales y neuronales y tumores ependimarios.[1,2] Dentro de estos tipos de tumores, se distinguen varios subtipos y se aplica a algunos una clasificación histológica por grados que va desde el grado 1 hasta el grado 4. La mayoría de los niños con gliomas astrocíticos circunscritos, gliomas difusos de grado bajo de tipo pediátrico y tumores glioneuronales y neuronales tienen un pronóstico relativamente favorable, en especial cuando se puede lograr una resección quirúrgica completa. Por lo general, los niños con gliomas difusos de grado alto de tipo pediátrico tienen un pronóstico precario. Para obtener información sobre los tumores ependimarios, consultar Tratamiento del ependimoma infantil.
Los resúmenes del PDQ sobre tratamiento de los tumores encefálicos infantiles se organizan principalmente de acuerdo con la clasificación de tumores del SNC de la OMS de 2021.[1,2]
Características anatómicas
Los gliomas infantiles aparecen en cualquier parte del SNC (consultar la Figura 1). Para conocer la ubicación más frecuente en el SNC de cada tipo de tumor, consultar el Cuadro 2. 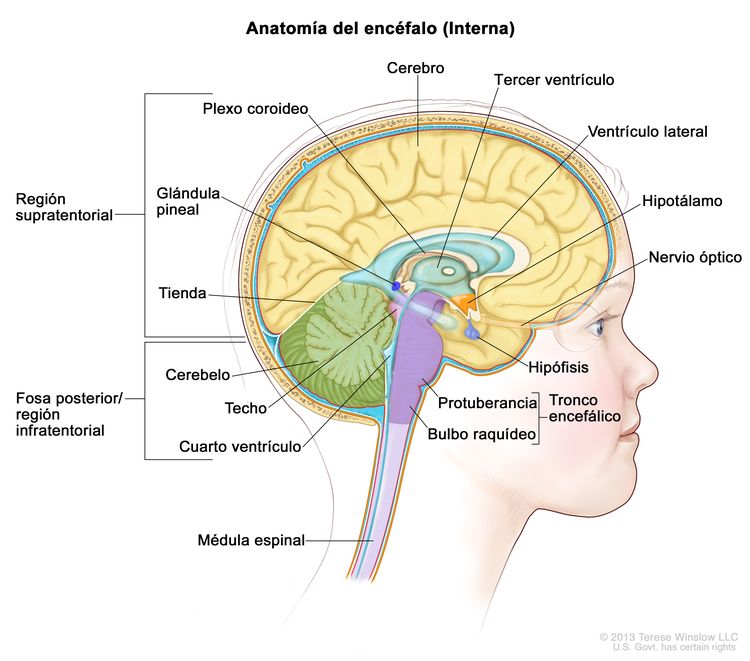
Características clínicas
Los síntomas de presentación inicial de los gliomas infantiles dependen de los siguientes aspectos:
- Ubicación anatómica.
- Tamaño del tumor.
- Tasa de crecimiento tumoral.
- Edad cronológica y de desarrollo del niño.
Los lactantes y niños pequeños con gliomas circunscritos (con mayor frecuencia, astrocitomas pilocíticos) y, con menor frecuencia, astrocitomas difusos que comprometen el hipotálamo, tal vez presenten síndrome diencefálico, que se manifiesta por el retraso del crecimiento en un niño demacrado y aparentemente eufórico. Es posible que estos niños presenten pocos hallazgos neurológicos, pero quizás presenten macrocefalia, letargo intermitente o deterioro visual.[3]
A veces, los niños con gliomas difusos de línea media centrados en la protuberancia (antes llamados gliomas pontinos intrínsecos difusos [GPID]) presentan la siguiente tríada clásica de síntomas; sin embargo, en ocasiones se presentan solo uno o dos de estos síntomas en el momento del diagnóstico:
- Neuropatías craneales, en especial paresia del nervio motor ocular externo.
- Signos de tractos largos.
- Ataxia.
La hidrocefalia obstructiva debida a la expansión de la protuberancia también es un síntoma de presentación inicial en algunos casos. Además, es posible que se presenten síntomas inespecíficos, como cambios conductuales o disminución del rendimiento escolar.
La presentación clínica de los astrocitomas circunscritos (por ejemplo, astrocitomas pilocíticos) en el tronco encefálico depende de la localización del tumor. Algunos de los síntomas de presentación inicial habituales son los siguientes:[4]
- Presión intracraneal elevada con hidrocefalia.
- Hemiparesia unilateral.
- Neuropatías craneales unilaterales.
- Ataxia.
Evaluación diagnóstica
La evaluación diagnóstica inicial de los pacientes con gliomas incluye imágenes por resonancia magnética (IRM) del encéfalo o la columna vertebral, con contraste o sin este. El riesgo de diseminación por el eje encefalomedular depende del tipo tumoral y se pueden tomar imágenes completas del eje encefalomedular, incluso IRM del encéfalo y la columna vertebral completa, en pacientes seleccionados. En la mayoría de los casos, el diagnóstico específico se determina después de la intervención quirúrgica y la clasificación patológica.
Los tumores primarios del tronco encefálico se diagnostican con mayor frecuencia en función de los hallazgos clínicos y los estudios de neuroimágenes mediante IRM, de las siguientes maneras:[5]
- Glioma difuso de línea media centrado en la protuberancia (DIPG). De manera sistemática, cuando no se cuenta con un diagnóstico histológico, se emplea un diagnóstico presunto de DIPG conforme a características clásicas en las imágenes y características clínicas. Sin embargo, cada vez más se obtiene la confirmación histológica para el ingreso en estudios de investigación y para la caracterización molecular del tumor.[6] Debido a los desafíos técnicos de las biopsias de la protuberancia, es preferible que un neurocirujano pediátrico experimentado realice el procedimiento con el fin de reducir el riesgo de complicaciones neurológicas irreversibles.[7-11] Se recomienda la biopsia para los tumores pontinos cuando no se obtiene un diagnóstico definitivo con los resultados de las imágenes.
- Tumores de tronco encefálico diferentes a DIPG. Por lo general, se indica biopsia o resección para los tumores de tronco encefálico diferentes a DIPG.
No se suele realizar la punción lumbar para examinar el líquido cefalorraquídeo en busca de células tumorales circulantes en los niños que presentan estos tipos de tumor.
Clasificación de la Organización Mundial de la Salud de los gliomas, los astrocitomas, y los tumores glioneuronales o neuronales
La clasificación patológica de los tumores encefálicos infantiles es un área de gran especialización que sigue en desarrollo. Los avances rápidos en la genética molecular han producido mejoras importantes en el diagnóstico exacto de los tumores encefálicos en la última década. Al mismo tiempo, se han identificado muchas entidades tumorales nuevas en el encéfalo a partir de características moleculares únicas. Es muy recomendable que un especialista en neuropatología experimentado examine el tejido diagnóstico, junto con las pruebas moleculares, si estuvieran disponibles.
De acuerdo con la clasificación de los tumores del SNC de la OMS de 2021, los gliomas y los tumores glioneuronales o neuronales que se presentan de manera predominante en la infancia se clasifican de la siguiente manera:
- Gliomas difusos de grado alto de tipo pediátrico.
- Gliomas difusos de grado bajo de tipo pediátrico.
- Gliomas astrocíticos circunscritos.
- Tumores glioneuronales y neuronales.
- Tumores ependimarios. Para obtener más información, consultar Tratamiento del ependimoma infantil.
Dentro de cada tipo de tumor, se distinguen varios subtipos según las características histológicas y moleculares.
En la clasificación de los tumores del SNC de la OMS de 2021 se recomienda la siguiente estructura de informes por niveles:[1,2]
- Diagnóstico integrado (diagnóstico histológico y molecular combinado basado en tejidos).
- Diagnóstico histológico.
- Grado de la OMS para los tumores del SNC.
- Información molecular (enumerada).
Clasificación por grados de la Organización Mundial de la Salud para los tumores del sistema nervioso central
Mientras que los tumores del SNC se clasificaron con anterioridad solo en función de sus características histopatológicas y comportamiento clínico (clasificación clinicopatológica), el esquema de clasificación por grados de la OMS de 2021 para los tumores del SNC emplea una clasificación histológica y molecular combinada para muchos tipos de tumores.[1] Los grados histológicos van del 1 al 4, pero no todos los grados se aplican a todos los tipos de tumores y algunos tipos de tumores no se clasifican de esta manera.
En el Cuadro 1 se muestra la clasificación y los grados de la OMS de 2021 para los tipos y subtipos más frecuentes de gliomas, tumores glioneuronales y tumores neuronales (salvo los tumores ependimarios) que se presentan en el SNC durante la infancia y la adolescencia.
| Tipo o subtipo de tumor | Grados de la OMS para los tumores del SNC | |
|---|---|---|
| Gliomas difusos de grado alto de tipo pediátrico: | ||
| Glioma difuso de línea media con alteración H3 K27 | 4 | |
| Glioma difuso de grado alto de tipo pediátrico con H3 natural e IDH natural | 4 | |
| Glioma hemisférico de tipo infantil (de lactantes) | Sin asignación | |
| Gliomas difusos de grado bajo de tipo pediátrico: | ||
| Glioma difuso de grado bajo con alteración de la vía MAPK | Sin asignación | |
| Astrocitoma difuso con alteración de MYB o MYBL1 | 1 | |
| Gliomas astrocíticos circunscritos: | ||
| Astrocitoma pilocítico | 1 | |
| Astrocitoma de grado alto con características piloides | Sin asignación | |
| Xantoastrocitoma pleomórfico | 2, 3 | |
| Astrocitoma subependimario de células gigantes | 1 | |
| Tumores glioneuronales y neuronales: | ||
| Ganglioglioma | 1 | |
| Ganglioglioma desmoplásico infantil o astrocitoma desmoplásico infantil (de lactantes) | 1 | |
| Tumor neuroepitelial disembrioplásico | 1 | |
Ubicación en el sistema nervioso central
Los gliomas infantiles se presentan en cualquier parte del SNC, aunque cada tipo de tumor suele hacerlo en ubicaciones anatómicas específicas (consultar el Cuadro 2).
| Tipo de tumor | Ubicación frecuente en el sistema nervioso central |
|---|---|
| Gliomas astrocíticos circunscritos | Cerebelo, nervio óptico, quiasma óptico o hipotálamo, tálamo y ganglios basales, tronco encefálico, hemisferios cerebrales y médula espinal (infrecuente) |
| Ganglioglioma | Cerebro, tronco encefálico; en ocasiones, otras ubicaciones |
| Glioma difuso de línea media con alteración H3 K27 | Protuberancia, tálamo, médula espinal y otras estructuras de la línea media |
| Glioma difuso de grado alto de tipo pediátrico con H3 natural e IDH natural | Cerebro; en ocasiones, otras ubicaciones |
Cerebelo: más del 80 % de los gliomas ubicados en el cerebelo son astrocitomas pilocíticos (grado I de la OMS) y, con frecuencia, quísticos; la mayoría de los restantes son gliomas difusos de grado bajo de tipo pediátrico.[12] Los gliomas de grado alto en el cerebelo son poco frecuentes.
Tronco encefálico: el término glioma del tronco encefálico es una descripción genérica que hace referencia a cualquier tumor de origen neuroglial que surja en el tronco encefálico, incluso el mesencéfalo, la protuberancia y el bulbo raquídeo. Si bien se presentan otros tipos histológicos (por ejemplo, ganglioglioma) en el tronco encefálico, predominan los dos siguientes:
- Glioma difuso de línea media con alteración H3 K27 centrado en la protuberancia.[13] Estos se han llamado habitualmente gliomas pontinos intrínsecos difusos (GPID) debido a su ubicación anatómica. Para obtener más información sobre el glioma difuso de línea media con alteración H3 K27, consultar la sección Características genómicas de los gliomas, los tumores glioneuronales y los tumores neuronales.
- Astrocitomas pilocíticos, que se presentan en todo el tronco encefálico.
Los tumores con componentes exofíticos son, en su mayoría, astrocitomas pilocíticos.[14] Los DIPG representan alrededor del 75 % al 80 % de los tumores de tronco encefálico infantiles.[15] La mayoría de los niños con DIPG reciben el diagnóstico entre los 5 y los 10 años de edad. Los astrocitomas pilocíticos focales en el tronco encefálico se presentan con menos frecuencia.[4]
Vía óptica e hipotálamo: la mayoría de los tumores que surgen dentro de la vía óptica (es decir, nervio óptico, quiasma y radiaciones ópticas) representan astrocitomas pilocíticos y, en raras ocasiones, gliomas difusos de grado bajo de tipo pediátrico.[12]
Cerebro: la mayoría de los tumores que surgen en los hemisferios cerebrales comprenden gliomas astrocíticos circunscritos y gliomas difusos de grado bajo de tipo pediátrico, seguidos de gliomas difusos de grado alto de tipo pediátrico.[12]
Características genómicas de los gliomas, los tumores glioneuronales y los tumores neuronales
Síndromes de susceptibilidad al cáncer seleccionados relacionados con los gliomas infantiles
Neurofibromatosis de tipo 1
Los niños con neurofibromatosis de tipo 1 (NF1) tienen una mayor propensión a presentar gliomas de grado bajo, en especial en la vía óptica. Hasta el 20 % de los pacientes con NF1 presentarán un glioma de la vía óptica. La mayoría de los niños con gliomas del nervio óptico relacionados con la NF1 son asintomáticos o tienen síntomas no progresivos y no requieren tratamiento antitumoral. Por lo general, no está indicada la detección sistemática con imágenes por resonancia magnética (IRM) en pacientes asintomáticos con NF1, aunque algunos investigadores obtienen una IRM al inicio para niños pequeños que no se pueden someter a exámenes oftalmológicos detallados.[16]
El diagnóstico a menudo se basa en los hallazgos clínicos compatibles y las características de las imágenes. La confirmación histológica casi nunca es necesaria en el momento del diagnóstico. Cuando se realizan biopsias, los tumores que se encuentran son de manera predominante astrocitomas pilocíticos.[12]
Las indicaciones para el tratamiento varían y, a menudo, se basan en el objetivo de preservar la visión.
En muy pocas ocasiones, los pacientes con NF1 presentan gliomas de grado alto. A veces, estos tumores son el resultado de una transformación de un tumor de grado inferior.[17]
Esclerosis tuberosa
Los pacientes con esclerosis tuberosa son más propensos a presentar astrocitoma subependimario de células gigantes (SEGA). Las variantes de TSC1 o TSC2 causan la activación constitutiva de la vía de señalización del complejo 1 del blanco de la rapamicina en los mamíferos (mTORC1), lo que aumenta la proliferación. Los SEGA responden a los abordajes molecularmente dirigidos con inhibidores de la vía mTORC1.[18][Nivel de evidencia C2] Los pacientes con esclerosis tuberosa también tienen riesgo de presentar tuberosidades corticales y nódulos subependimarios.
Características moleculares y alteraciones genómicas recurrentes
Las alteraciones genómicas recurrentes que provocan la activación constitutiva de la vía de la proteína cinasa activada por mitógenos (MAPK), que con mayor frecuencia afecta al gen BRAF, representan el principal (y a menudo único) iniciador oncogénico en la gran mayoría de los gliomas infantiles de grado bajo, como los astrocitomas pilocíticos o pilomixoides, los gangliogliomas y otros.[12] Como resultado, la mayoría de estos tumores se pueden tratar con terapias moleculares dirigidas.
Los genomas tumorales más complejos son característicos de los gliomas difusos de grado alto de tipo pediátrico. Estos genomas complejos incluyen alteraciones genómicas recurrentes en genes codificadores de histonas H3 (por ejemplo, H3F3A, HIST1H3B), genes de las vías de reparación del daño al DNA (por ejemplo, TP53, PPM1D, ATM, MDM2), genes modificadores de la cromatina (por ejemplo, ATRX, BCOR, SETD2), genes de las vías del ciclo celular (por ejemplo, CDKN2A, CDKN2B, RB1) o presentan amplificaciones oncogénicas (PDGFR, VEGFR2, KIT, MYC, MYCN).[19] El tratamiento convencional y las terapias moleculares dirigidas tienen una eficacia limitada para la mayoría de estos tumores.
Un subconjunto infrecuente de gliomas de grado alto de tipo pediátrico que surgen en pacientes con deficiencia hereditaria y bialélica en la reparación de los errores de emparejamiento (bMMRD) se caracteriza por una carga mutacional extremadamente alta. La identificación correcta de estos pacientes en el momento del diagnóstico es fundamental debido a la resistencia intrínseca a la temozolomida y la sensibilidad al tratamiento con inhibidores de puntos de control inmunitario.[20][Nivel de evidencia C3]; [21]
BRAF::KIAA1549
En el astrocitoma pilocítico, la activación de BRAF sucede con mayor frecuencia por una fusión génica BRAF::KIAA1549, que genera una proteína de fusión sin el dominio autorregulador de BRAF.[22] Esta fusión se observa en la mayoría de los astrocitomas pilocíticos infratentoriales y de línea media, pero se presenta con una frecuencia más baja en los tumores supratentoriales (hemisféricos).[12]
La presencia de la fusión BRAF::KIAA1549 se relaciona con una mejora del desenlace clínico (supervivencia sin progresión [SSP] y supervivencia general [SG]) en pacientes con astrocitoma pilocítico.[23]; [24][Nivel de evidencia C1] La progresión a gliomas de grado alto es muy poco frecuente en los gliomas con la fusión BRAF::KIAA1549 que se presentan en edad pediátrica.[24]
Variantes de BRAF
Las variantes puntuales activadoras de BRAF, con mayor frecuencia BRAF V600E, están presentes en un subconjunto de gliomas infantiles y tumores glioneuronales que abarcan varios tipos histológicos, como el xantoastrocitoma pleomórfico, el astrocitoma pilocítico, el ganglioglioma, el astrocitoma o el ganglioglioma desmoplásico infantil (de lactantes), entre otros.[12] En pediatría, algunos gliomas infiltrantes de grado bajo con una alteración en un gen de la vía MAPK, como BRAF, y que a menudo se asemejan desde el punto de vista histológico a un astrocitoma difuso de grado bajo u oligodendroglioma, ahora se clasifican como gliomas difusos de grado bajo con alteración de la vía MAPK.[1,25]
En estudios clínicos retrospectivos se observó lo siguiente:
- En una serie retrospectiva de más de 400 niños con gliomas de grado bajo, el 17 % de los tumores exhibían una variante BRAF V600E. La tasa de SSP a 10 años fue del 27 % en los pacientes que tenían tumores con variante BRAF V600E, en comparación con el 60 % en los pacientes cuyos tumores no albergaban esa variante. Otros factores relacionados con este pronóstico precario fueron la resección subtotal y la deleción de CDKN2A.[26][Nivel de evidencia C2] Incluso en los pacientes sometidos a una resección macroscópica total, se observó recidiva en un tercio de ellos, lo que indica que los tumores que tienen la variante BRAF V600E tienen un fenotipo más invasivo que otras variantes de glioma de grado bajo.
- En un análisis similar, los niños con astrocitomas diencefálicos de grado bajo con una variante BRAF V600E tuvieron una tasa de SSP a 5 años del 22 %, en comparación con una tasa de SSP del 52 % en los niños con BRAF natural.[27][Nivel de evidencia C2]
- La frecuencia de la variante BRAF V600E en casos pediátricos fue significativamente superior en los gliomas de grado bajo que se transformaron en gliomas de grado alto (8 de 18 casos), en comparación con la frecuencia de la variante en los casos sin transformación (10 de 167 casos).[24]
Variantes de NF1
Las alteraciones somáticas en NF1 se observan con mayor frecuencia en niños con NF1 y se relacionan con alteraciones de la línea germinal en el supresor tumoral NF1. La pérdida de heterocigosis para NF1 representa la alteración somática más común en estos pacientes seguida de variantes inactivadoras del segundo alelo de NF1, y es compatible con la lesión secundaria ("segundo golpe") necesaria para la carcinogénesis. Si bien la mayoría de los pacientes con gliomas de grado bajo que presentan alteraciones en NF1 tienen un pronóstico excelente a largo plazo, es posible que se produzca una transformación secundaria a un glioma de grado alto en un subgrupo pequeño de estos casos. Desde el punto de vista genómico, la transformación se vincula con la adquisición de otros iniciadores oncogénicos, como alteraciones funcionales de pérdida de función en CDKN2A, CDKN2B o ATRX. Los pacientes con NF1 también presentan gliomas primarios de grado alto, pero esto es muy infrecuente. Las alteraciones genómicas fuera de NF1 que afectan la vía de señalización MAPK son muy infrecuentes en los gliomas que se presentan en niños con NF1.[17]
Fusiones de los genes ALK, NTRK1, NTRK2, NTRK3 o ROS1
Los gliomas de grado alto con características moleculares típicas surgen en lactantes, por lo general se diagnostican durante el primer año de vida.[28-30] Estos tumores se caracterizan por fusiones génicas oncogénicas recurrentes que afectan ALK, NTRK1, NTRK2, NTRK3 o ROS1 como el principal iniciador oncogénico y, por lo general, único. Los lactantes con este tipo de glioma, que ahora se clasifica como glioma hemisférico de tipo infantil, tienen un pronóstico mucho más favorable, en comparación con los niños mayores con gliomas de grado alto. Es notable que estos tumores evolucionen, con el tiempo, de un tipo histológico de grado alto a un tipo histológico de grado bajo, y aún no está claro en qué medida este fenómeno es consecuencia de la historia natural de la enfermedad o se debe a cambios inducidos por el tratamiento.[28]
Las fusiones génicas de ROS1 también se han notificado en los gliomas que se presentan en niños de más edad y en adultos. En un metanálisis retrospectivo, en el que se incluyeron 40 niños mayores de 1 año, se encontró que las fusiones génicas de ROS1 se presentaron en gliomas de diferentes tipos histológicos, incluso en gliomas difusos de grado alto y de grado bajo, así como en tumores glioneuronales.[30] Al igual que en los casos con alteraciones de ROS1 que se presentan en lactantes, las variantes tumorales de otros genes oncoiniciadores conocidos fueron infrecuentes. Sin embargo, las alteraciones del número de copias en el genoma del tumor fueron más frecuentes en niños que en lactantes.
Otras alteraciones genómicas
Además de la activación de BRAF o la pérdida de NF1, se han observado otras alteraciones primarias iniciadoras oncogénicas en la vía de señalización MAPK en astrocitomas pilocíticos y otros gliomas de tipo pediátrico. Estos incluyen variantes oncogénicas o fusiones que afectan FGFR1, FGFR2, PTPN11, RAF1, NTRK2 y otros genes.[12,31,32]
Los gliomas de grado bajo con reordenamientos en la familia de factores de transcripción MYB [12,33,34] ahora se clasifican como una entidad separada: astrocitoma difuso con alteración de MYB o MYBL1, grado 1 de la OMS.[1]
Gliomas angiocéntricos
Los gliomas angiocéntricos habitualmente surgen en niños y adultos jóvenes como tumores encefálicos que causan convulsiones.[35]
En dos informes de 2016 se identificaron alteraciones en el gen MYB presentes en casi todos los casos diagnosticados como gliomas angiocéntricos; el gen QKI fue el principal compañero de fusión en los casos en los que fue posible obtener pruebas sobre la pareja de fusión.[32,36] Aunque los gliomas angiocéntricos se presentan con mayor frecuencia a nivel supratentorial, también se han notificado gliomas angiocéntricos con fusiones MYB::QKI.[37,38]
Astroblastomas con alteración de MN1
Los astroblastomas se definen según sus características histológicas como neoplasias gliales compuestas de células positivas para GFAP que contienen pseudorosetas astroblásticas, a menudo con esclerosis. Los astroblastomas se diagnostican de manera principal durante la niñez y hasta el comienzo de la edad adulta.[35]
En los siguientes estudios se caracterizaron las alteraciones genómicas asociadas con el astroblastoma:
- En un informe se detalló una clasificación molecular de los tumores neuroectodérmicos primitivos (TNEP) del SNC y se descubrió una entidad nueva llamada tumor neuroepitelial de grado alto del SNC con alteración de MN1 (CNS HGNET-MN1) que se caracterizó por la presencia de fusiones génicas que afectan el gen MN1.[39] La mayoría de los tumores con diagnóstico histológico de astroblastoma (16 de 23) pertenecían a esta entidad definida por sus características moleculares.
- En un informe de 27 casos de astroblastomas definidos por sus características histológicas se encontraron 10 casos con reordenamientos de MN1, 7 casos con reordenamientos de BRAF y 2 casos con reordenamientos de RELA.[40] Con el análisis de matriz de metilación se observó que los casos con reordenamientos de MN1 se agruparon con el CNS HGNET-MN1, los casos con alteraciones de BRAF se agruparon con los xantoastrocitomas pleomórficos, y los casos con alteración en RELA se agruparon con los ependimomas.
- En la evaluación genómica de 8 casos de astroblastomas se detectaron 4 casos con alteraciones de MN1. De los 4 casos restantes, 2 presentaron alteraciones genómicas compatibles con glioma de grado alto y 2 casos no se pudieron clasificar según sus características moleculares.[41]
- En un estudio se caracterizaron 8 casos de astroblastoma. Los 5 casos sometidos a análisis de hibridación fluorescente in situ mostraron reordenamientos de MN1.[42]
En estos informes se indica que el diagnóstico histológico del astroblastoma abarca un grupo heterogéneo de entidades definidas por sus características genómicas. Los astroblastomas con fusiones de MN1 representan un subconjunto diferenciado de los casos diagnosticados por sus características histológicas.[43]
Variantes de IDH1 e IDH2
Los tumores con alteraciones de IDH1 e IDH2 ocurren en la población pediátrica como los gliomas de grado bajo (grado 2 de la OMS), los gliomas de grado alto (grado 3 y 4 de la OMS), y los oligodendrogliomas con codeleción de 1p y 19q. Para obtener más información sobre los gliomas con alteración en IDH1 y IDH2, consultar la sección variantes de IDH1 e IDH2 en Características moleculares de los gliomas de grado alto de tipo pediátrico.
Características moleculares de los gliomas de grado alto de tipo pediátrico
Los gliomas infantiles de grado alto son diferentes, desde el punto de vista biológico, de los que surgen en adultos.[44-47]
Subgrupos definidos mediante los patrones de metilación del DNA
Los gliomas de grado alto de tipo pediátrico se pueden separar en subgrupos característicos a partir de patrones epigenéticos (metilación del DNA). Estos subgrupos exhiben ganancias o pérdidas del número de copias cromosómicas y variantes génicas en el tumor que son características.[19,48,49] Los subtipos más característicos de gliomas infantiles de grado alto son aquellos con variantes recurrentes en aminoácidos específicos en los genes de las histonas; en conjunto, estos representan cerca de la mitad de los gliomas infantiles de grado alto.[19]
Los siguientes subgrupos de glioma de grado alto de tipo pediátrico se identificaron a partir de sus patrones de metilación del DNA y muestran características clínicas y moleculares distintivas:[19]
Alteraciones genómicas asociadas con los gliomas difusos de línea media
Variantes de histonas en K27: variantes de H3.3 (H3F3A) y H3.1 (HIST1H3B y, con menor frecuencia, HIST1H3C) en K27 y variantes de EZHIP
Los casos con alteraciones de histonas en K27 se presentan sobre todo en la mitad de la niñez (mediana de edad, alrededor de 10 años), surgen casi exclusivamente en la línea media (tálamo, tronco encefálico y médula espinal) y acarrean un pronóstico muy precario. En la clasificación de la OMS de 2021 se agrupan estos cánceres en una sola entidad: glioma difuso de línea media con alteración H3 K27. Sin embargo, hay diferencias clínicas y biológicas entre los casos con variantes de H3.3 y H3.1, como se describe a continuación.[1]
Los casos de glioma difuso de línea media con alteración H3 K27 se definen por la pérdida de la trimetilación de H3 K27 debido a una variante H3 K27M, o con menor frecuencia, por sobreexpresión de EZHIP. Esta entidad incluye la mayoría de los gliomas de grado alto del hipotálamo, la protuberancia (gliomas pontinos intrínsecos difusos [GPID]) y la médula espinal, de predominio en niños, pero que también se presenta en adultos.[50]
Gliomas con H3.3 K27M: estos casos surgen por toda la línea media y la protuberancia; corresponden a cerca del 60 % de los casos en estos sitios y, por lo común, aparecen entre los 5 y 10 años de edad.[19] El pronóstico para los pacientes con H3.3 K27M es especialmente precario, con una mediana de supervivencia de menos de 1 año; la tasa de supervivencia a 2 años es inferior al 5 %.[19] Con frecuencia se observa diseminación leptomeníngea en pacientes con el subtipo H3.3 K27M.[51]
Gliomas con H3.1 K27M: los casos con la alteración H3.1 K27M son casi 5 veces menos comunes que los casos con la alteración H3.3 K27M. Surgen de manera primaria en la protuberancia y se presentan a una edad más temprana que los otros casos del subtipo H3.3 K27M (mediana de edad, 5 vs. 6–10 años). Estos pacientes tienen un pronóstico algo más favorable que los casos del subtipo H3.3 K27M (mediana de supervivencia, 15 vs. 11 meses). Las variantes de ACVR1, que también es la variante observada en la afección genética fibrodisplasia osificante progresiva, están presentes en una proporción alta de casos con la alteración H3.1 K27M.[19,52,53]
Gliomas con H3.2 K27M: en escasas ocasiones, también se han identificado variantes K27M en casos con alteración en H3.2 (HIST2H3C).[19]
Un subgrupo de tumores con variantes H3 K27 presentarán al mismo tiempo una variante BRAF V600E o una variante de FGFR1. En una cohorte retrospectiva de 29 tumores, que se combinó con 31 casos que se habían publicado en el pasado, se demostró una predisposición mayor por la ubicación en el tálamo. Estos casos exhibían un grupo de metilación del DNA singular que se diferencia de otros subgrupos de glioma difusos de línea media y subtipos de glioma con alteraciones de BRAF o FGFR1. La mediana de supervivencia de estos pacientes superó los 3 años.[54] En otro estudio retrospectivo de pacientes adultos y pediátricos que presentaban gliomas con la alteración H3 K27 se encontró que las variantes BRAF V600E se presentaban en un 5,8 % (9 de 156) y las variantes de FGFR1 en un 10,9 % (17 de 156) de los pacientes menores de 20 años.[55] Otras alteraciones genéticas recurrentes que se detectaron en los pacientes pediátricos fueron variantes de TP53, ATRX, PIK3CA, y amplificaciones de PDGFRA y KIT. Se observó que las variantes de FGFR1 fueron más frecuentes en los pacientes mayores de 20 años (31,8 %, 47 de 148).
Sobrexpresión de EZHIP: la pequeña minoría de pacientes con gliomas difusos de línea media que carecen de variantes de la histona H3 a menudo exhiben sobrexpresión de EZHIP.[50] EZHIP inhibe la actividad de PRC2, lo que produce la misma pérdida de trimetilación de H3 K27 que inducen las variantes H3 K27M.[56] La sobrexpresión de EZHIP se observa asimismo en los ependimomas de tipo A de fosa posterior, que también exhiben pérdida de metilación de H3 K27.[57]
Variante de H3.3 (H3F3A) en G34
Los subtipos con alteración H3.3 G34 se presentan por variantes de H3.3 cuando cambia la glicina en posición 34 por arginina o valina (G34R/V).[48,49] Este subtipo se presenta en niños mayores y adultos jóvenes (mediana de edad, 14–18 años) y surge exclusivamente en la corteza cerebral.[48,49] Por lo general, los casos con la alteración H3.3 G34 presentan variantes de TP53 y ATRX (95 % y 84 % de los casos, respectivamente, en una serie grande) y exhiben hipometilación generalizada de todo el genoma. En una serie de 95 pacientes con el subtipo H3.3 G34, el 44 % de los pacientes también tenían una variante de PDGFRA en el momento del diagnóstico, y el 81 % de los pacientes tenían variantes de PDGFRA observadas en el momento de la recaída.[58]
Los pacientes con variantes de H3F3A tienen un riesgo alto de fracaso del tratamiento,[59] pero el pronóstico no es tan precario como el de los pacientes con variantes de K27M en las histonas 3.1 o 3.3.[49] La metilación de la O-6-metilguanina-DNA–metiltransferasa (MGMT) se observa en alrededor de dos tercios de los casos, y aparte del subtipo con variante de IDH1 (ver más adelante), el subtipo con alteración H3.3 G34 es el único subtipo de glioma infantil de grado alto que muestra tasas de metilación de MGMT superiores al 20 %.[19]
Variantes de IDH1 e IDH2
Los tumores con alteraciones de IDH1 y de IDH2 se presentan en la población pediátrica como gliomas de grado bajo (grado 2 de la OMS), gliomas de grado alto (grados 3 y 4 de la OMS) y oligodendrogliomas con codeleción de 1p y 19q.[60]
- Las variantes de IDH1 son mucho más comunes que las variantes de IDH2 y se encuentran en alrededor del 90 % de los tumores del SNC con alteración de IDH.
- Los gliomas de grado bajo con alteración de IDH son más comunes que los gliomas de grado alto con alteración de IDH, y representan alrededor de tres cuartas partes de los casos de gliomas pediátricos con alteración de IDH.
- Los oligodendrogliomas con variantes de IDH representan cerca del 20 % de los tumores pediátricos en el SNC con variantes de IDH.
- La mediana de edad en el momento del diagnóstico para los pacientes pediátricos con tumores que exhiben alteración de IDH es de alrededor de 16 años, y los tumores en el SNC con alteración de IDH son muy poco frecuentes en niños de 10 años o menos.
- Al igual que en los astrocitomas con variantes de IDH que se presentan en los adultos, los que se observan en los niños con frecuencia exhiben variantes de TP53 (cerca del 90 % de los casos) y variantes de ATRX (cerca del 50 % de los casos).
- Del mismo modo que los gliomas de grado bajo con alteración de IDH, los tumores de grado bajo en pacientes pediátricos pueden progresar y convertirse en gliomas de grado alto.
Los casos con alteraciones de IDH1 representan una proporción baja de los gliomas de grado alto (cerca del 5–10 %) que se observan en el ámbito pediátrico. La mayoría de los casos corresponden a adolescentes mayores (mediana de edad en una población pediátrica, 16 años) con tumores hemisféricos.[19,60] Estos tumores se clasifican en glioma difuso de tipo adulto, como astrocitoma, con alteración de IDH en la clasificación de tumores del SNC de la OMS de 2021.Los casos con alteración de IDH1 a menudo exhiben variantes de TP53, metilación del promotor MGMT y un fenotipo de glioma metilador de islas CpG (G-CIMP).[48,49]
Los pacientes pediátricos con variantes de IDH1 tienen un pronóstico más favorable que aquellos con otros tipos de gliomas de grado alto.[19] En una revisión retrospectiva multinstitucional de pacientes pediátricos con gliomas que presentaban variante de IDH y de los resultados disponibles (n = 76) se notificó una tasa de SSP a 5 años del 44 % (IC 95 %, 25–59 %) y una tasa de SG a 5 años del 92 % (IC 95 %, 79–97%).[60] Alrededor del 25 % de los gliomas en la cohorte se clasificaron como de grado alto. No se observaron diferencias en la SSP a 5 años según el grado del tumor. Sin embargo, los pacientes con tumores de grado alto tuvieron una tasa de SG a 5 años más precaria del 75 % (IC 95 %, 40–91%).
Se han notificado gliomas de grado alto raros, con alteración de IDH en niños con síndromes de deficiencia en la reparación de errores de emparejamiento (síndrome de Lynch o síndrome de deficiencia constitucional en la reparación de errores de emparejamiento).[61] Estos tumores, denominados astrocitomas con deficiencia primaria en la reparación de errores de emparejamiento y alteración de IDH (PMMRDIA), se diferencian de otros gliomas con alteración de IDH por su perfil de metilación. Los PMMRDIA presentan características moleculares diferentes a las de la mayoría de los gliomas con alteración de IDH, como un fenotipo hipervariante y frecuente activación de las vías de receptores tirosina–cinasas. Los pacientes con PMMRDIA tienen un pronóstico mucho más precario que aquellos con otros gliomas con alteración de IDH, y su mediana de supervivencia es de 15 meses.
Tumor similar al xantoastrocitoma pleomórfico
Alrededor del 10 % de los gliomas infantiles de grado alto exhiben patrones de metilación del DNA que son similares a los del xantoastrocitoma pleomórfico (XAP).[49] Los casos similares al XAP suelen presentar variantes BRAF V600E y un desenlace relativamente favorable (supervivencia de aproximadamente el 50 % a los 5 años).[19,59]
Astrocitoma de grado alto con características piloides
Esta entidad se incluyó en la clasificación de la OMS de 2016 (llamada astrocitoma pilocítico con anaplasia) para describir los tumores con características histológicas del astrocitoma pilocítico, aumento de la actividad mitótica y características adicionales de grado alto. La nomenclatura actual se adoptó en la clasificación de la OMS de 2021. En una publicación más reciente se describió una cohorte de 83 casos con estas características histológicas (tumores denominados astrocitomas anaplásicos con características piloides) que compartían un perfil de metilación del DNA común, distinto de los perfiles de metilación de otros gliomas. Estos tumores se presentaron con más frecuencia en adultos (mediana de edad, 41 años) y con frecuencia albergaban deleciones de CDKN2A/B, alteraciones en la vía MAPK (más a menudo en el gen NF1) y variantes o deleciones de ATRX. Se relacionan con una evolución clínica intermedia entre el astrocitoma pilocítico y el glioblastoma con IDH natural.[62]
Otras variantes
Los pacientes pediátricos con glioma de grado alto tipo glioblastoma multiforme cuyos tumores carecen de variantes de histonas y variantes de IDH1 representan alrededor del 40 % de los casos de glioblastoma multiforme infantil.[19,63] Este corresponde a un grupo heterogéneo con tasas más altas de amplificaciones génicas que otros subtipos de glioma infantil de grado alto. Los genes que estaban amplificados con mayor frecuencia fueron PDGFRA, EGFR, CCND/CDK y MYC/MYCN.[48,49] Las tasas de metilación del promotor de MGMT son bajas en este grupo.[63] En un informe se dividió este grupo en tres subtipos. El subtipo caracterizado por tasas altas de amplificación en MYCN exhibió el pronóstico más precario, mientras que el subtipo caracterizado por variantes del promotor de TERT y amplificación de EGFR acarrea el pronóstico más favorable. El tercer grupo se caracterizó por amplificación de PDGFRA.[63]
Gliomas de grado alto en lactantes
Los lactantes y niños pequeños con gliomas de grado alto tienen tumores con características moleculares típicas [28,29] cuando se comparan con los tumores de niños mayores y adultos con gliomas de grado alto. Se observó una indicación de esta diferencia con la aplicación del análisis de metilación del DNA a los tumores pediátricos de grado alto, donde se encontró que cerca del 7 % de los pacientes pediátricos con diagnóstico histológico de glioma de grado alto tenían tumores con patrones de metilación más parecidos a los de los gliomas de grado bajo.[19] Entre 16 lactantes (menores de 1 año) con diagnóstico de glioma de grado alto, 10 lactantes formaban parte de este grupo definido por la matriz de metilación.[19] La tasa de supervivencia a 5 años de los pacientes menores de 1 año superó el 60 %, mientras que la tasa de supervivencia a 5 años de los pacientes de 1 a 3 años y más fue inferior al 20 %.
En dos estudios de las características moleculares de los gliomas de grado alto en lactantes y niños pequeños se definió la naturaleza distintiva de los tumores que surgen en niños menores de 1 año. Un hallazgo clave de ambos estudios es la importancia de las fusiones de genes relacionados con tirosina–cinasas (por ejemplo, ALK, NTRK1, NTRK2, NTRK3 y ROS1) en pacientes de este grupo de edad. En ambos estudios también se encontró que los lactantes con gliomas de grado alto cuyos tumores tienen estas fusiones génicas tienen tasas de supervivencia mucho más altas que las de los niños mayores con gliomas de grado alto.[28,29]
En el primer estudio se presentaron datos de 118 niños menores de 1 año con diagnóstico de glioma de grado bajo o alto que tenían tejido tumoral disponible para la caracterización genómica.[28] Cerca del 75 % de los casos se clasificaron como de grado bajo, pero la poca utilidad de la clasificación histológica en este grupo de edad se reflejó en una tasa de SG relativamente baja en la cohorte de grado bajo (71 %) y una supervivencia relativamente favorable en la cohorte de grado alto (55 %). Las tasas de resección quirúrgica fueron más altas para los pacientes con tumores de grado alto, como resultado de muchos de los tumores de grado bajo que se presentaron en sitios de la línea media, mientras que los tumores de grado alto se encontraron en ubicaciones supratentoriales. Este hallazgo también puede ayudar a explicar los desenlaces relativos para los dos grupos. La caracterización genómica dividió la población de glioma infantil en los siguientes tres grupos, el primero de los cuales incluyó a pacientes con gliomas de grado alto:
- Los tumores del grupo 1 están determinados por receptores tirosina–cinasas (RTK) y en su mayoría son de grado alto (83 %). Estos tumores albergan lesiones en ALK, ROS1, NTRK y MET. La mediana de edad en el momento del diagnóstico es de 3 meses, y las tasas de SG se acercan al 60 %.
- Los tumores del grupo 2 están determinados por RAS/MAPK; todos son gliomas hemisféricos de grado bajo, lo que representa un cuarto de los gliomas hemisféricos en lactantes. La alteración más común es la variante BRAF V600E, seguida de alteraciones en FGFR1 y fusiones de BRAF. En este grupo, la mediana de edad en el momento de la presentación inicial es de 8 meses y su pronóstico es el más favorable de todos (tasa de SG a 10 años del 93 %).
- Los tumores del grupo 3 están determinados por RAS/MAPK, su tipo histológico es de grado bajo y el sitio de origen es la línea media (alrededor del 80 % son gliomas de vía óptica y de hipotálamo). La mayoría de los tumores del grupo 3 exhiben fusiones de BRAF o alteraciones BRAF V600E. La mediana de edad en el momento del diagnóstico es de 7,5 meses. La tasa de supervivencia sin progresión (SSP) a los 5 años fue de cerca del 20 %, y la tasa de SG a los 10 años fue de alrededor del 50 % (muy inferior a la tasa de los gliomas de vía óptica o hipotálamo en niños >1 año).
El segundo estudio se centró en los tumores de niños menores de 4 años con un diagnóstico patológico de gliomas, astrocitomas o tumores glioneuronales de grado 2, 3 y 4 de la OMS. Entre los 191 tumores estudiados que cumplían los criterios de inclusión, 61 tenían perfiles de metilación compatibles con los subtipos de glioma que se presentan en niños mayores (por ejemplo, IDH1, glioma difuso de línea media con alteración H3 K27, SEGA, xantoastrocitoma pleomórfico, etc.). Los 130 casos restantes se denominaron conjunto intrínseco y fueron objeto de caracterización molecular adicional:[29]
- El conjunto intrínseco contenía a la mayoría de los pacientes diagnosticados antes de tener 1 año de edad (49 de 63 pacientes, 78 %) que tenían una mediana de edad de 7,2 meses. Con frecuencia, los tumores se encontraban en una ubicación hemisférica superficial, a menudo con compromiso de las meninges, pero con un borde bien definido con el encéfalo normal adyacente.
- El clasificador de metilación colocó la mayoría de estos casos en el subgrupo de ganglioglioma desmoplásico infantil o astrocitoma (DIG/DIA) o en el subgrupo de glioma hemisférico infantil.
- En el conjunto intrínseco, se disponía de tejido para la secuenciación del panel génico y del ARN de 41 tumores, entre ellos, 25 tumores presentaron fusiones que afectaban ALK (n = 10), NTRK1 (n = 2), NTRK2 (n = 2) , NTRK3 (n = 8 ), ROS1 (n = 2) o MET (n = 1). Se observaron variantes de BRAF (n = 3) en los casos con puntuación alta en la matriz de metilación para los subgrupos DIG/DIA o similar a DIG/DIA.
- En los pacientes del grupo intrínseco, la tasa de supervivencia a 5 años fue más alta para los pacientes cuyos tumores tenían fusiones génicas, en comparación con los pacientes cuyos tumores no tenían fusiones (80 vs. 60 %, respectivamente). Sin embargo, ambos grupos de pacientes tuvieron tasas de supervivencia mucho más altas que otros niños con gliomas de grado alto.
Gliomas de grado alto secundarios
Los gliomas infantiles de grado alto secundarios (glioma de grado alto precedido por un glioma de grado bajo) son poco comunes (2,9 % en un estudio de 886 pacientes). Ningún glioma infantil de grado bajo con la fusión BRAF::KIAA1549 se transformó en un glioma de grado alto, mientras que los gliomas de grado bajo con variantes BRAF V600E se relacionaron con un aumento del riesgo de transformación. De los 18 pacientes con glioma secundario de grado alto, 7 (aproximadamente el 40 %) presentaron variantes BRAF V600E, y 8 de 14 casos (57 %) presentaron alteraciones en CDKN2A.[24]
Características moleculares de los tumores glioneuronales y neuronales
Los tumores glioneuronales y los tumores neuronales por lo general son tumores de grado bajo. Algunos tipos histológicos reconocidos por la clasificación de la OMS de 2021 son los siguientes:[1]
- Ganglioglioma.
- Ganglioglioma desmoplásico infantil o astrocitoma desmoplásico infantil (de lactantes).
- Tumor neuroepitelial disembrioplásico.
- Tumor glioneuronal papilar.
- Tumor glioneuronal formador de rosetas.
- Gangliocitoma displásico cerebeloso (enfermedad de Lhermitte-Duclos).
- Gangliocitoma.
- Tumor glioneuronal leptomeníngeo difuso.
- Neurocitoma central.
- Neurocitoma extraventricular.
Ganglioglioma
El ganglioglioma se presenta en niños y adultos. Produce convulsiones y aparece con más frecuencia en la corteza cerebral, pero a veces surge en otros sitios, como la médula espinal.[64,65]
El elemento fundamental de la patogénesis molecular del ganglioglioma son las alteraciones genómicas que conducen a la activación de la vía MAPK.[32,66] En cerca del 50 % de los casos de ganglioglioma se observan alteraciones en BRAF; la más común es la alteración V600E. Sin embargo, también se observan otras variantes de BRAF y fusiones génicas. Otros genes alterados con menor frecuencia en el ganglioglioma son KRAS, FGFR1, FGFR2, RAF1, NTRK2 y NF1.[32,66]
Astrocitoma desmoplásico infantil y ganglioglioma desmoplásico infantil
Los astrocitomas desmoplásicos infantiles (DIA) y los gangliogliomas desmoplásicos infantiles (DIG) se presentan con mayor frecuencia en el primer año de vida, es decir en lactantes, y muestran una apariencia característica en las imágenes donde se ve un nódulo sólido que se realza con el contraste y se acompaña de un componente quístico grande.[67,68] El DIG es más común que el DIA,[67] y mediante análisis de matrices de metilación, ambos diagnósticos se agrupan.[69] El desenlace de supervivencia por lo general es favorable con la resección quirúrgica.[67]
Las alteraciones genómicas observadas con mayor frecuencia en el DIA y el DIG son variantes de BRAF que afectan V600. Las fusiones génicas que afectan genes de cinasas se observan con menos frecuencia.
- Entre 16 casos de DIA y DIG confirmados mediante análisis histológico y de perfil de metilación del DNA, se identificaron variantes de BRAF en 7 casos (43,8 %): 4 variantes BRAF V600E y 3 variantes BRAF V600D.[69] Otro caso tenía una fusión EML4::ALK. Se presentaron variantes de BRAF en 4 de 12 (25 %) casos de DIG (3 de 4 casos con la alteración BRAF V600D) y en 3 de 4 (75 %) casos de DIA (3 casos con la alteración BRAF V600E).
- En un estudio de 7 casos de DIG se identificaron alteraciones en la vía MAPK en 4 casos (57 %).[70] Entre ellas, 3 alteraciones que afectaban el gen BRAF (V600E, V600D y una deleción o inserción en V600) y otra se trató de una fusión en el marco de lectura TPM3::NTRK1. Cabe aclarar que la frecuencia de variantes alélicas fue baja (8–27 %), lo que indica que el DIG se caracteriza por un componente no neoplásico abundante que se traduce en frecuencias bajas de alelos con variantes clonales oncoiniciadoras.
- En otro informe también se identificó la variante BRAF V600D en un caso de DIG.[71] Debido a que la variante V600D es mucho menos frecuente que la variante V600E en otros tipos de cáncer, la detección de esta variante en varios casos de DIG indica una relación de la variante con esta enfermedad.
Tumor neuroepitelial disembrioplásico
El tumor neuroepitelial disembrioplásico (TNED) se presenta en niños y adultos con una mediana de edad en el momento del diagnóstico entre la adolescencia media o tardía. Desde el punto histopatológico, se caracteriza por filas de células de apariencia oligodendroglial y células ganglionares corticales flotando en mucina.[72] La ubicación más común es el lóbulo temporal, donde produce epilepsia farmacorresistente.[65,73]
Se han notificado alteraciones en FGFR1 en el 60 % a 80 % de los TNED, entre ellas variantes puntuales activadoras de FGFR1, duplicaciones internas en tándem del dominio cinasa y fusiones génicas activadoras.[32,74,75] Las variantes de BRAF son infrecuentes en los TNED.
Tumor glioneuronal papilar
El tumor glioneuronal papilar es una neoplasia bifásica de grado bajo con diferenciación astrocítica y neuronal que casi siempre aparece en el compartimiento supratentorial.[35] La mediana de edad en el momento de la presentación es de alrededor de los 20 a 25 años, pero se puede observar desde la infancia hasta la edad adulta.
La alteración genómica principal relacionada con el tumor glioneuronal papilar es una fusión génica, SLC44A1::PRKCA, que se relaciona con la translocación t(9:17)(q31;q24).[76,77] En un estudio de 28 casos de tumor glioneuronal papilar diagnosticado por análisis histológico mediante matrices de metilación, 11 casos se agruparon según un tipo de metilación característica, y el resto de los casos presentaron diferentes perfiles de metilación propios de otras entidades tumorales. En el análisis molecular de los casos agrupados por la metilación característica, se encontró que todos exhibían la fusión génica SLC44A1::PRKCA, excepto un caso que tenía la fusión génica NOTCH1::PRKCA.[78] Esto indica que los métodos moleculares para identificar la presencia de una fusión de PRKCA son menos susceptibles a una clasificación errónea durante el diagnóstico del tumor glioneuronal papilar que los métodos basados en la morfología.
Tumor glioneuronal formador de rosetas
El tumor glioneuronal formador de rosetas (TGNR) se presenta en adolescentes y adultos, a menudo se ubica a nivel infratentorial, pero también surge en las regiones mesencefálica y diencefálica.[79] El aspecto histológico típico muestra tanto un componente glial como un componente neurocítico dispuestos en rosetas o pseudorosetas perivasculares.[35] El desenlace de los pacientes con TGFR suele ser favorable, compatible con una designación de grado 1 de la OMS.[79]
El perfil de metilación del DNA indica que el TGNR exhibe un perfil epigenético propio que lo diferencia de otras entidades tumorales glioneuronales o neurogliales de grado bajo.[79] En un estudio de 30 casos de TGNR se observaron puntos calientes con variantes de FGFR1 en todos los tumores analizados.[79] Además, se observaron de manera simultánea variantes activadoras de PIK3CA en 19 de 30 casos (63 %). Las variantes de cambio de sentido o las variantes perjudiciales de NF1 se identificaron en 10 de 30 casos (33 %), y 7 tumores exhibieron variantes de FGFR1, PIK3CA y NF1. La presencia simultánea de variantes que activan las vías MAPK y PI3K produce un perfil de variantes característico del TGNR que lo diferencia de los tumores astrocíticos y glioneuronales.
Tumor glioneuronal leptomeníngeo difuso
El tumor glioneuronal leptomeníngeo difuso (DLGNT) es un tipo raro de tumor del SNC que se caracteriza desde el punto de vista radiográfico por el realce leptomeníngeo en la IRM. Este tumor suele afectar la fosa posterior, la región del tronco encefálico y la médula espinal.[80] Las lesiones intraparenquimatosas, cuando están presentes, suelen comprometer la médula espinal.[80] Se notificaron tumores glioneuronales intramedulares localizados sin diseminación leptomeníngea y con características histomorfológicas, inmunofenotípicas y genómicas similares a las del DLGNT.[81]
El DLGNT exhibió un perfil epigenético específico en las matrices de metilación del DNA, y la agrupación no supervisada de datos de matrices aplicadas en 30 casos permitió determinar dos subtipos según el tipo de metilación: MC-1 (n = 17) y MC-2 (n = 13).[80] Cabe destacar que muchos de los casos definidos por la matriz habían recibido un diagnóstico original diferente (por ejemplo, tumores neuroectodérmicos primitivos, astrocitoma pilocítico y astrocitoma anaplásico). Los pacientes con un DLGNT-MC-1 recibieron el diagnóstico a una edad más temprana que los pacientes con DLGNT-MC-2 (5 vs. 14 años, respectivamente). La tasa de supervivencia general a 5 años fue más alta para los pacientes con DLGNT-MC-1 que para los pacientes con DLGNT-MC-2 (100 vs. 43 %, respectivamente). Los hallazgos genómicos de los 30 casos de DLGNT definidos a partir de las matrices de metilación fueron los siguientes:
- Los 30 casos exhibieron pérdida del cromosoma 1p, pero solo 6 de 17 casos de DLGNT-MC-1 presentaron ganancia adicional del cromosoma 1q, en comparación con todos los casos de DLGNT-MC-2.[80] En otro informe se encontró que la ganancia del cromosoma 1q fue un factor de pronóstico adverso en pacientes con DLGNT (incluso casos con enfermedad localizada),[82] lo que es coherente con el desenlace inferior para los pacientes con DLGNT-MC-2.
- Las codeleciones de 1p/19q fueron más frecuentes en el grupo de DLGNT-MC-1 (7 de 13, 54 %) que en el grupo de DLGNT-MC-2 (2 de 13, 15 %). En contraste con el oligodendroglioma, no se identificaron variantes de IDH1 y IDH2.[80]
- La activación de la vía MAPK es común en los casos de DLGNT.[80] Se encontró la fusión KIAA1549::BRAF en 11 de 15 casos de DLGNT-MC-1 (65 %) y en 9 de 13 casos de DLGNT-MC-2 (69 %). En dos casos se encontraron fusiones que afectaron NTRK1, NTRK2 o NTRK3, y en otro caso se encontró una fusión TRIM33::RAF1.
Neurocitoma extraventricular
El neurocitoma extraventricular es similar, desde el punto de vista histológico, al neurocitoma central y contiene células pequeñas uniformes con diferenciación neuronal. Sin embargo, el neurocitoma extraventricular se presenta en el parénquima encefálico, en lugar del sistema ventricular.[35] Se presenta durante la niñez y hasta la adultez.
En un estudio de 40 tumores con clasificación histológica de neurocitoma extraventricular sometidos a análisis de matriz de metilación, solo 26 se agruparon según el tipo histológico en un grupo diferenciado al de los tumores de referencia de otros tipos histológicos.[83] Entre los casos con una clasificación de matriz de metilación compatible con neurocitoma extraventricular para los que se pudo realizar una caracterización genómica, 11 de 15 (73 %) presentaron reordenamientos que afectaron a miembros de la familia FGFR, siendo FGFR1::TACC1 la alteración más común.[83]
Pronóstico
Gliomas astrocíticos circunscritos, gliomas difusos de grado bajo de tipo pediátrico y tumores glioneuronales o neuronales
Por lo general, estos tumores tienen un pronóstico relativamente favorable, en particular para las lesiones bien circunscritas en las que es posible una resección radical.[84,85] Con la excepción de los tumores glioneuronales leptomeníngeos difusos, la enfermedad diseminada o multifocal es poco frecuente.[86]
Entre las características de pronóstico clínico desfavorables se incluyen las siguientes:[87-89]
- Edad temprana.
- Incapacidad para obtener una resección completa.
- Síndrome diencefálico.
- Enfermedad diseminada o multifocal. La presencia de enfermedad diseminada o multifocal se relaciona con un desenlace a largo plazo más precario.
A nivel molecular, la presencia de una variante BRAF V600E, en especial en combinación con una deleción homocigota de CDKN2A o CDKN2B, se ha percibido como un factor pronóstico negativo, con riesgo de transformación a un tumor de grado más alto. Por el contrario, la presencia de una fusión BRAF::KIAA1549 conlleva un mejor desenlace clínico en pacientes con gliomas astrocíticos circunscritos.[26][Nivel de evidencia C2]
En el caso de los niños con tumores en la vía óptica, son importantes los desenlaces visuales y las evaluaciones clínicas. Los niños con tumores aislados del nervio óptico tienen un pronóstico mejor que los niños con lesiones que comprometen el quiasma o que se extienden a lo largo de la vía óptica.[90,91]; [92][Nivel de evidencia C1] Los niños con NF1 también tienen un pronóstico más favorable, en especial cuando el tumor se encuentra en pacientes asintomáticos.[93] Una mejor agudeza visual y una mayor edad en el momento del diagnóstico, así como la presencia de NF1, se relacionan con mejores resultados visuales.[94]
Gliomas difusos de grado alto de tipo pediátrico
Con los tratamientos disponibles en la actualidad, estos tumores tienen un pronóstico muy precario.
Los pacientes con glioma difuso de línea media con alteración H3 K27 tienen el pronóstico más precario, con tasas de supervivencia a 3 años inferiores al 5 %.[49]
Tumores difusos de tronco encefálico
Se usan las siguientes definiciones de tumores de tronco encefálico:
- Glioma del tronco encefálico. Término general que describe un astrocitoma que surge en el tronco encefálico. Estos tumores son circunscritos o difusos, y se presentan en cualquier lugar del tronco encefálico, incluso el mesencéfalo, la protuberancia y el bulbo raquídeo.
- Glioma pontino intrínseco difuso (GPID). Término que se usa para describir un astrocitoma infiltrante (presunto glioma difuso de línea media) centrado en la protuberancia.
- Glioma difuso de línea media con alteración H3 K27. Es el diagnóstico patológico de la mayoría de los tumores que presentan características de imágenes compatibles con un DIPG.
La mediana de supervivencia de los niños con DIPG es inferior a 1 año, aunque alrededor del 10 % sobreviven más de 2 años.[95,96] Por el contrario, los pacientes con astrocitomas focales (por ejemplo, astrocitomas pilocíticos) tienen un pronóstico notablemente mejor, con tasas de SG a 5 años superiores al 90 %.[4]
Un informe de un ensayo clínico incluyó 42 niños y adolescentes con diagnóstico nuevo de gliomas de grado alto de línea media. En el estudio se encontró que la ubicación, el patrón de realce, la restricción de difusión y el estado de las variantes no afectó de manera significativa la supervivencia.[97] La diseminación metastásica leptomeníngea y las tasas de resección quirúrgica más bajas se asociaron con desenlaces más precarios.
Los siguientes son los factores pronósticos:
- Características histológicas o grado del tumor. Los tumores astrocíticos predominan en el tronco encefálico. Los tumores de grado 1 de la OMS (por ejemplo, astrocitomas pilocíticos y gangliogliomas) tienen un pronóstico favorable y surgen en todo el tronco encefálico, incluso en el techo del mesencéfalo, de manera focal en la protuberancia o en la unión cervicomedular, en donde son, a menudo, exofíticos. Los astrocitomas difusos de grado bajo (grado 2 de la OMS) que se presentan en otros sitios del tronco encefálico fuera de la protuberancia suelen ser tumores con un pronóstico más favorable.[98]
Por el contrario, los DIPG son astrocitomas difusos que, cuando se realiza una biopsia en el momento del diagnóstico, varían desde astrocitomas difusos (grado 2 de la OMS) hasta glioblastomas (grado 4 de la OMS). En la evaluación post mortem, los DIPG suelen ser astrocitomas anaplásicos (grado 3 de la OMS) o glioblastomas (grado 4 de la OMS) según criterios morfológicos, aunque también se identifican regiones correspondientes al grado 2 de la OMS.[52,53,99-101]
Cerca del 80 % de los DIPG, con independencia del grado histológico, muestran una variante de las histonas H3.3 o H3.1 y en la actualidad la OMS los clasifica como gliomas difusos de la línea media con alteración H3 K27M. Todos los gliomas difusos de la línea media con alteración H3 K27M se clasifican como de grado 4 de la OMS, con independencia del grado histológico, lo que refleja un pronóstico precario para los niños con este diagnóstico.
- Edad en el momento del diagnóstico. Se ha observado una supervivencia ligeramente más prolongada en pacientes muy jóvenes (≤3 años) o mayores (≥10 años) en el momento del diagnóstico. Cerca del 4 % de los niños con DIPG reciben el diagnóstico antes de los 3 años de edad. El pronóstico de estos niños es menos precario que el de niños mayores; el 28 % de los niños más pequeños sobreviven a los 2 años, en comparación con el 8 % de los niños de 3 a 10 años en el momento del diagnóstico y el 14 % de los niños mayores de 10 años en el momento del diagnóstico. En los niños de 10 años o más, la supervivencia a largo plazo se relacionó con una edad mayor en el momento de la presentación y con una duración de los síntomas más prolongada.[102] El pronóstico más favorable para los niños pequeños tal vez refleje la presencia de características biológicas diferentes en los distintos grupos de edad.[95,103]
- NF1. Es posible que los niños con NF1 y gliomas de tronco encefálico tengan un pronóstico mejor que otros pacientes con lesiones intrínsecas.[104,105]
- Características clínicas y de las imágenes en el momento del diagnóstico. En niños con DIPG, las características relacionadas con una supervivencia inferior a 2 años comprenden la presencia de parálisis de pares craneales, realce anular, necrosis y expansión por fuera de la protuberancia en el momento del diagnóstico.[95] La tasa de supervivencia a 2 años es inferior al 10 % para los pacientes con estas características.
- Duración de los síntomas en el momento del diagnóstico. La mayor duración de los síntomas se relaciona con un pronóstico más favorable. Las tasas de supervivencia a 2 años oscilan entre el 7 % de los pacientes con una duración de los síntomas inferior a 6 meses y el 29 % de los pacientes con una duración de los síntomas igual o superior a 24 meses.[95]
- Variantes de las histonas. Los pacientes con variantes H3.1 K27M tienen una mediana de supervivencia más prolongada (15 meses) que los pacientes con variantes H3.3 K27M (10,4 meses) o los pacientes sin variantes de histonas (10,5 meses).[95]
Bibliografía
- Louis DN, Perry A, Wesseling P, et al.: The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 23 (8): 1231-1251, 2021. [PUBMED Abstract]
- WHO Classification of Tumours Editorial Board, ed.: WHO Classification of Tumours: Central Nervous System Tumours. Vol. 6. 5th ed. IARC Press; 2021.
- Kilday JP, Bartels U, Huang A, et al.: Favorable survival and metabolic outcome for children with diencephalic syndrome using a radiation-sparing approach. J Neurooncol 116 (1): 195-204, 2014. [PUBMED Abstract]
- Klimo P, Pai Panandiker AS, Thompson CJ, et al.: Management and outcome of focal low-grade brainstem tumors in pediatric patients: the St. Jude experience. J Neurosurg Pediatr 11 (3): 274-81, 2013. [PUBMED Abstract]
- Liu AK, Brandon J, Foreman NK, et al.: Conventional MRI at presentation does not predict clinical response to radiation therapy in children with diffuse pontine glioma. Pediatr Radiol 39 (12): 1317-20, 2009. [PUBMED Abstract]
- Walker DA, Liu J, Kieran M, et al.: A multi-disciplinary consensus statement concerning surgical approaches to low-grade, high-grade astrocytomas and diffuse intrinsic pontine gliomas in childhood (CPN Paris 2011) using the Delphi method. Neuro Oncol 15 (4): 462-8, 2013. [PUBMED Abstract]
- Cage TA, Samagh SP, Mueller S, et al.: Feasibility, safety, and indications for surgical biopsy of intrinsic brainstem tumors in children. Childs Nerv Syst 29 (8): 1313-9, 2013. [PUBMED Abstract]
- Grill J, Puget S, Andreiuolo F, et al.: Critical oncogenic mutations in newly diagnosed pediatric diffuse intrinsic pontine glioma. Pediatr Blood Cancer 58 (4): 489-91, 2012. [PUBMED Abstract]
- Puget S, Beccaria K, Blauwblomme T, et al.: Biopsy in a series of 130 pediatric diffuse intrinsic Pontine gliomas. Childs Nerv Syst 31 (10): 1773-80, 2015. [PUBMED Abstract]
- Gupta N, Goumnerova LC, Manley P, et al.: Prospective feasibility and safety assessment of surgical biopsy for patients with newly diagnosed diffuse intrinsic pontine glioma. Neuro Oncol 20 (11): 1547-1555, 2018. [PUBMED Abstract]
- Pfaff E, El Damaty A, Balasubramanian GP, et al.: Brainstem biopsy in pediatric diffuse intrinsic pontine glioma in the era of precision medicine: the INFORM study experience. Eur J Cancer 114: 27-35, 2019. [PUBMED Abstract]
- Ryall S, Zapotocky M, Fukuoka K, et al.: Integrated Molecular and Clinical Analysis of 1,000 Pediatric Low-Grade Gliomas. Cancer Cell 37 (4): 569-583.e5, 2020. [PUBMED Abstract]
- Buczkowicz P, Bartels U, Bouffet E, et al.: Histopathological spectrum of paediatric diffuse intrinsic pontine glioma: diagnostic and therapeutic implications. Acta Neuropathol 128 (4): 573-81, 2014. [PUBMED Abstract]
- Holzapfel J, Kandels D, Schmidt R, et al.: Favorable prognosis in pediatric brainstem low-grade glioma: Report from the German SIOP-LGG 2004 cohort. Int J Cancer 146 (12): 3385-3396, 2020. [PUBMED Abstract]
- Warren KE: Diffuse intrinsic pontine glioma: poised for progress. Front Oncol 2: 205, 2012. [PUBMED Abstract]
- Packer RJ, Iavarone A, Jones DTW, et al.: Implications of new understandings of gliomas in children and adults with NF1: report of a consensus conference. Neuro Oncol 22 (6): 773-784, 2020. [PUBMED Abstract]
- D'Angelo F, Ceccarelli M, Tala, et al.: The molecular landscape of glioma in patients with Neurofibromatosis 1. Nat Med 25 (1): 176-187, 2019. [PUBMED Abstract]
- Franz DN, Agricola K, Mays M, et al.: Everolimus for subependymal giant cell astrocytoma: 5-year final analysis. Ann Neurol 78 (6): 929-38, 2015. [PUBMED Abstract]
- Mackay A, Burford A, Carvalho D, et al.: Integrated Molecular Meta-Analysis of 1,000 Pediatric High-Grade and Diffuse Intrinsic Pontine Glioma. Cancer Cell 32 (4): 520-537.e5, 2017. [PUBMED Abstract]
- Bouffet E, Larouche V, Campbell BB, et al.: Immune Checkpoint Inhibition for Hypermutant Glioblastoma Multiforme Resulting From Germline Biallelic Mismatch Repair Deficiency. J Clin Oncol 34 (19): 2206-11, 2016. [PUBMED Abstract]
- Das A, Tabori U, Sambira Nahum LC, et al.: Efficacy of Nivolumab in Pediatric Cancers with High Mutation Burden and Mismatch Repair Deficiency. Clin Cancer Res 29 (23): 4770-4783, 2023. [PUBMED Abstract]
- Jones DT, Kocialkowski S, Liu L, et al.: Tandem duplication producing a novel oncogenic BRAF fusion gene defines the majority of pilocytic astrocytomas. Cancer Res 68 (21): 8673-7, 2008. [PUBMED Abstract]
- Hawkins C, Walker E, Mohamed N, et al.: BRAF-KIAA1549 fusion predicts better clinical outcome in pediatric low-grade astrocytoma. Clin Cancer Res 17 (14): 4790-8, 2011. [PUBMED Abstract]
- Mistry M, Zhukova N, Merico D, et al.: BRAF mutation and CDKN2A deletion define a clinically distinct subgroup of childhood secondary high-grade glioma. J Clin Oncol 33 (9): 1015-22, 2015. [PUBMED Abstract]
- López GY, Van Ziffle J, Onodera C, et al.: The genetic landscape of gliomas arising after therapeutic radiation. Acta Neuropathol 137 (1): 139-150, 2019. [PUBMED Abstract]
- Lassaletta A, Zapotocky M, Mistry M, et al.: Therapeutic and Prognostic Implications of BRAF V600E in Pediatric Low-Grade Gliomas. J Clin Oncol 35 (25): 2934-2941, 2017. [PUBMED Abstract]
- Ho CY, Mobley BC, Gordish-Dressman H, et al.: A clinicopathologic study of diencephalic pediatric low-grade gliomas with BRAF V600 mutation. Acta Neuropathol 130 (4): 575-85, 2015. [PUBMED Abstract]
- Guerreiro Stucklin AS, Ryall S, Fukuoka K, et al.: Alterations in ALK/ROS1/NTRK/MET drive a group of infantile hemispheric gliomas. Nat Commun 10 (1): 4343, 2019. [PUBMED Abstract]
- Clarke M, Mackay A, Ismer B, et al.: Infant High-Grade Gliomas Comprise Multiple Subgroups Characterized by Novel Targetable Gene Fusions and Favorable Outcomes. Cancer Discov 10 (7): 942-963, 2020. [PUBMED Abstract]
- Meredith DM, Cooley LD, Dubuc A, et al.: ROS1 Alterations as a Potential Driver of Gliomas in Infant, Pediatric, and Adult Patients. Mod Pathol 36 (11): 100294, 2023. [PUBMED Abstract]
- Jones DT, Hutter B, Jäger N, et al.: Recurrent somatic alterations of FGFR1 and NTRK2 in pilocytic astrocytoma. Nat Genet 45 (8): 927-32, 2013. [PUBMED Abstract]
- Qaddoumi I, Orisme W, Wen J, et al.: Genetic alterations in uncommon low-grade neuroepithelial tumors: BRAF, FGFR1, and MYB mutations occur at high frequency and align with morphology. Acta Neuropathol 131 (6): 833-45, 2016. [PUBMED Abstract]
- Zhang J, Wu G, Miller CP, et al.: Whole-genome sequencing identifies genetic alterations in pediatric low-grade gliomas. Nat Genet 45 (6): 602-12, 2013. [PUBMED Abstract]
- Ramkissoon LA, Horowitz PM, Craig JM, et al.: Genomic analysis of diffuse pediatric low-grade gliomas identifies recurrent oncogenic truncating rearrangements in the transcription factor MYBL1. Proc Natl Acad Sci U S A 110 (20): 8188-93, 2013. [PUBMED Abstract]
- Louis DN, Perry A, Reifenberger G, et al.: The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol 131 (6): 803-20, 2016. [PUBMED Abstract]
- Bandopadhayay P, Ramkissoon LA, Jain P, et al.: MYB-QKI rearrangements in angiocentric glioma drive tumorigenicity through a tripartite mechanism. Nat Genet 48 (3): 273-82, 2016. [PUBMED Abstract]
- D'Aronco L, Rouleau C, Gayden T, et al.: Brainstem angiocentric gliomas with MYB-QKI rearrangements. Acta Neuropathol 134 (4): 667-669, 2017. [PUBMED Abstract]
- Chan E, Bollen AW, Sirohi D, et al.: Angiocentric glioma with MYB-QKI fusion located in the brainstem, rather than cerebral cortex. Acta Neuropathol 134 (4): 671-673, 2017. [PUBMED Abstract]
- Sturm D, Orr BA, Toprak UH, et al.: New Brain Tumor Entities Emerge from Molecular Classification of CNS-PNETs. Cell 164 (5): 1060-72, 2016. [PUBMED Abstract]
- Lehman NL, Usubalieva A, Lin T, et al.: Genomic analysis demonstrates that histologically-defined astroblastomas are molecularly heterogeneous and that tumors with MN1 rearrangement exhibit the most favorable prognosis. Acta Neuropathol Commun 7 (1): 42, 2019. [PUBMED Abstract]
- Wood MD, Tihan T, Perry A, et al.: Multimodal molecular analysis of astroblastoma enables reclassification of most cases into more specific molecular entities. Brain Pathol 28 (2): 192-202, 2018. [PUBMED Abstract]
- Hirose T, Nobusawa S, Sugiyama K, et al.: Astroblastoma: a distinct tumor entity characterized by alterations of the X chromosome and MN1 rearrangement. Brain Pathol 28 (5): 684-694, 2018. [PUBMED Abstract]
- Lucas CG, Solomon DA, Perry A: A review of recently described genetic alterations in central nervous system tumors. Hum Pathol 96: 56-66, 2020. [PUBMED Abstract]
- Paugh BS, Qu C, Jones C, et al.: Integrated molecular genetic profiling of pediatric high-grade gliomas reveals key differences with the adult disease. J Clin Oncol 28 (18): 3061-8, 2010. [PUBMED Abstract]
- Bax DA, Mackay A, Little SE, et al.: A distinct spectrum of copy number aberrations in pediatric high-grade gliomas. Clin Cancer Res 16 (13): 3368-77, 2010. [PUBMED Abstract]
- Ward SJ, Karakoula K, Phipps KP, et al.: Cytogenetic analysis of paediatric astrocytoma using comparative genomic hybridisation and fluorescence in-situ hybridisation. J Neurooncol 98 (3): 305-18, 2010. [PUBMED Abstract]
- Pollack IF, Hamilton RL, Sobol RW, et al.: IDH1 mutations are common in malignant gliomas arising in adolescents: a report from the Children's Oncology Group. Childs Nerv Syst 27 (1): 87-94, 2011. [PUBMED Abstract]
- Sturm D, Witt H, Hovestadt V, et al.: Hotspot mutations in H3F3A and IDH1 define distinct epigenetic and biological subgroups of glioblastoma. Cancer Cell 22 (4): 425-37, 2012. [PUBMED Abstract]
- Korshunov A, Ryzhova M, Hovestadt V, et al.: Integrated analysis of pediatric glioblastoma reveals a subset of biologically favorable tumors with associated molecular prognostic markers. Acta Neuropathol 129 (5): 669-78, 2015. [PUBMED Abstract]
- Castel D, Kergrohen T, Tauziède-Espariat A, et al.: Histone H3 wild-type DIPG/DMG overexpressing EZHIP extend the spectrum diffuse midline gliomas with PRC2 inhibition beyond H3-K27M mutation. Acta Neuropathol 139 (6): 1109-1113, 2020. [PUBMED Abstract]
- Rodriguez Gutierrez D, Jones C, Varlet P, et al.: Radiological Evaluation of Newly Diagnosed Non-Brainstem Pediatric High-Grade Glioma in the HERBY Phase II Trial. Clin Cancer Res 26 (8): 1856-1865, 2020. [PUBMED Abstract]
- Buczkowicz P, Hoeman C, Rakopoulos P, et al.: Genomic analysis of diffuse intrinsic pontine gliomas identifies three molecular subgroups and recurrent activating ACVR1 mutations. Nat Genet 46 (5): 451-6, 2014. [PUBMED Abstract]
- Taylor KR, Mackay A, Truffaux N, et al.: Recurrent activating ACVR1 mutations in diffuse intrinsic pontine glioma. Nat Genet 46 (5): 457-61, 2014. [PUBMED Abstract]
- Auffret L, Ajlil Y, Tauziède-Espariat A, et al.: A new subtype of diffuse midline glioma, H3 K27 and BRAF/FGFR1 co-altered: a clinico-radiological and histomolecular characterisation. Acta Neuropathol 147 (1): 2, 2023. [PUBMED Abstract]
- Williams EA, Brastianos PK, Wakimoto H, et al.: A comprehensive genomic study of 390 H3F3A-mutant pediatric and adult diffuse high-grade gliomas, CNS WHO grade 4. Acta Neuropathol 146 (3): 515-525, 2023. [PUBMED Abstract]
- Jain SU, Do TJ, Lund PJ, et al.: PFA ependymoma-associated protein EZHIP inhibits PRC2 activity through a H3 K27M-like mechanism. Nat Commun 10 (1): 2146, 2019. [PUBMED Abstract]
- Hübner JM, Müller T, Papageorgiou DN, et al.: EZHIP/CXorf67 mimics K27M mutated oncohistones and functions as an intrinsic inhibitor of PRC2 function in aggressive posterior fossa ependymoma. Neuro Oncol 21 (7): 878-889, 2019. [PUBMED Abstract]
- Chen CCL, Deshmukh S, Jessa S, et al.: Histone H3.3G34-Mutant Interneuron Progenitors Co-opt PDGFRA for Gliomagenesis. Cell 183 (6): 1617-1633.e22, 2020. [PUBMED Abstract]
- Mackay A, Burford A, Molinari V, et al.: Molecular, Pathological, Radiological, and Immune Profiling of Non-brainstem Pediatric High-Grade Glioma from the HERBY Phase II Randomized Trial. Cancer Cell 33 (5): 829-842.e5, 2018. [PUBMED Abstract]
- Yeo KK, Alexandrescu S, Cotter JA, et al.: Multi-institutional study of the frequency, genomic landscape, and outcome of IDH-mutant glioma in pediatrics. Neuro Oncol 25 (1): 199-210, 2023. [PUBMED Abstract]
- Suwala AK, Stichel D, Schrimpf D, et al.: Primary mismatch repair deficient IDH-mutant astrocytoma (PMMRDIA) is a distinct type with a poor prognosis. Acta Neuropathol 141 (1): 85-100, 2021. [PUBMED Abstract]
- Reinhardt A, Stichel D, Schrimpf D, et al.: Anaplastic astrocytoma with piloid features, a novel molecular class of IDH wildtype glioma with recurrent MAPK pathway, CDKN2A/B and ATRX alterations. Acta Neuropathol 136 (2): 273-291, 2018. [PUBMED Abstract]
- Korshunov A, Schrimpf D, Ryzhova M, et al.: H3-/IDH-wild type pediatric glioblastoma is comprised of molecularly and prognostically distinct subtypes with associated oncogenic drivers. Acta Neuropathol 134 (3): 507-516, 2017. [PUBMED Abstract]
- Becker AJ: Ganglioglioma. In: Louis DN, Ohgaki H, Wiestler OD: WHO Classification of Tumours of the Central Nervous System. 4th rev.ed. IARC Press, 2016, pp 138-41.
- Blumcke I, Spreafico R, Haaker G, et al.: Histopathological Findings in Brain Tissue Obtained during Epilepsy Surgery. N Engl J Med 377 (17): 1648-1656, 2017. [PUBMED Abstract]
- Pekmezci M, Villanueva-Meyer JE, Goode B, et al.: The genetic landscape of ganglioglioma. Acta Neuropathol Commun 6 (1): 47, 2018. [PUBMED Abstract]
- Bianchi F, Tamburrini G, Massimi L, et al.: Supratentorial tumors typical of the infantile age: desmoplastic infantile ganglioglioma (DIG) and astrocytoma (DIA). A review. Childs Nerv Syst 32 (10): 1833-8, 2016. [PUBMED Abstract]
- Trehan G, Bruge H, Vinchon M, et al.: MR imaging in the diagnosis of desmoplastic infantile tumor: retrospective study of six cases. AJNR Am J Neuroradiol 25 (6): 1028-33, 2004 Jun-Jul. [PUBMED Abstract]
- Wang AC, Jones DTW, Abecassis IJ, et al.: Desmoplastic Infantile Ganglioglioma/Astrocytoma (DIG/DIA) Are Distinct Entities with Frequent BRAFV600 Mutations. Mol Cancer Res 16 (10): 1491-1498, 2018. [PUBMED Abstract]
- Blessing MM, Blackburn PR, Krishnan C, et al.: Desmoplastic Infantile Ganglioglioma: A MAPK Pathway-Driven and Microglia/Macrophage-Rich Neuroepithelial Tumor. J Neuropathol Exp Neurol 78 (11): 1011-1021, 2019. [PUBMED Abstract]
- Greer A, Foreman NK, Donson A, et al.: Desmoplastic infantile astrocytoma/ganglioglioma with rare BRAF V600D mutation. Pediatr Blood Cancer 64 (6): , 2017. [PUBMED Abstract]
- Louis DN, Ohgaki H, Wiestler OD: WHO Classification of Tumours of the Central Nervous System. 4th rev.ed. IARC Press, 2016.
- Stone TJ, Keeley A, Virasami A, et al.: Comprehensive molecular characterisation of epilepsy-associated glioneuronal tumours. Acta Neuropathol 135 (1): 115-129, 2018. [PUBMED Abstract]
- Rivera B, Gayden T, Carrot-Zhang J, et al.: Germline and somatic FGFR1 abnormalities in dysembryoplastic neuroepithelial tumors. Acta Neuropathol 131 (6): 847-63, 2016. [PUBMED Abstract]
- Matsumura N, Nobusawa S, Ito J, et al.: Multiplex ligation-dependent probe amplification analysis is useful for detecting a copy number gain of the FGFR1 tyrosine kinase domain in dysembryoplastic neuroepithelial tumors. J Neurooncol 143 (1): 27-33, 2019. [PUBMED Abstract]
- Pages M, Lacroix L, Tauziede-Espariat A, et al.: Papillary glioneuronal tumors: histological and molecular characteristics and diagnostic value of SLC44A1-PRKCA fusion. Acta Neuropathol Commun 3: 85, 2015. [PUBMED Abstract]
- Bridge JA, Liu XQ, Sumegi J, et al.: Identification of a novel, recurrent SLC44A1-PRKCA fusion in papillary glioneuronal tumor. Brain Pathol 23 (2): 121-8, 2013. [PUBMED Abstract]
- Hou Y, Pinheiro J, Sahm F, et al.: Papillary glioneuronal tumor (PGNT) exhibits a characteristic methylation profile and fusions involving PRKCA. Acta Neuropathol 137 (5): 837-846, 2019. [PUBMED Abstract]
- Sievers P, Appay R, Schrimpf D, et al.: Rosette-forming glioneuronal tumors share a distinct DNA methylation profile and mutations in FGFR1, with recurrent co-mutation of PIK3CA and NF1. Acta Neuropathol 138 (3): 497-504, 2019. [PUBMED Abstract]
- Deng MY, Sill M, Chiang J, et al.: Molecularly defined diffuse leptomeningeal glioneuronal tumor (DLGNT) comprises two subgroups with distinct clinical and genetic features. Acta Neuropathol 136 (2): 239-253, 2018. [PUBMED Abstract]
- Chiang JCH, Harreld JH, Orr BA, et al.: Low-grade spinal glioneuronal tumors with BRAF gene fusion and 1p deletion but without leptomeningeal dissemination. Acta Neuropathol 134 (1): 159-162, 2017. [PUBMED Abstract]
- Chiang J, Dalton J, Upadhyaya SA, et al.: Chromosome arm 1q gain is an adverse prognostic factor in localized and diffuse leptomeningeal glioneuronal tumors with BRAF gene fusion and 1p deletion. Acta Neuropathol 137 (1): 179-181, 2019. [PUBMED Abstract]
- Sievers P, Stichel D, Schrimpf D, et al.: FGFR1:TACC1 fusion is a frequent event in molecularly defined extraventricular neurocytoma. Acta Neuropathol 136 (2): 293-302, 2018. [PUBMED Abstract]
- Wisoff JH, Sanford RA, Heier LA, et al.: Primary neurosurgery for pediatric low-grade gliomas: a prospective multi-institutional study from the Children's Oncology Group. Neurosurgery 68 (6): 1548-54; discussion 1554-5, 2011. [PUBMED Abstract]
- Bandopadhayay P, Bergthold G, London WB, et al.: Long-term outcome of 4,040 children diagnosed with pediatric low-grade gliomas: an analysis of the Surveillance Epidemiology and End Results (SEER) database. Pediatr Blood Cancer 61 (7): 1173-9, 2014. [PUBMED Abstract]
- Lu VM, Di L, Gernsback J, et al.: Contemporary outcomes of diffuse leptomeningeal glioneuronal tumor in pediatric patients: A case series and literature review. Clin Neurol Neurosurg 218: 107265, 2022. [PUBMED Abstract]
- Stokland T, Liu JF, Ironside JW, et al.: A multivariate analysis of factors determining tumor progression in childhood low-grade glioma: a population-based cohort study (CCLG CNS9702). Neuro Oncol 12 (12): 1257-68, 2010. [PUBMED Abstract]
- Gnekow AK, Walker DA, Kandels D, et al.: A European randomised controlled trial of the addition of etoposide to standard vincristine and carboplatin induction as part of an 18-month treatment programme for childhood (≤16 years) low grade glioma - A final report. Eur J Cancer 81: 206-225, 2017. [PUBMED Abstract]
- Chamdine O, Broniscer A, Wu S, et al.: Metastatic Low-Grade Gliomas in Children: 20 Years' Experience at St. Jude Children's Research Hospital. Pediatr Blood Cancer 63 (1): 62-70, 2016. [PUBMED Abstract]
- Due-Tønnessen BJ, Helseth E, Scheie D, et al.: Long-term outcome after resection of benign cerebellar astrocytomas in children and young adults (0-19 years): report of 110 consecutive cases. Pediatr Neurosurg 37 (2): 71-80, 2002. [PUBMED Abstract]
- Massimi L, Tufo T, Di Rocco C: Management of optic-hypothalamic gliomas in children: still a challenging problem. Expert Rev Anticancer Ther 7 (11): 1591-610, 2007. [PUBMED Abstract]
- Campagna M, Opocher E, Viscardi E, et al.: Optic pathway glioma: long-term visual outcome in children without neurofibromatosis type-1. Pediatr Blood Cancer 55 (6): 1083-8, 2010. [PUBMED Abstract]
- Hernáiz Driever P, von Hornstein S, Pietsch T, et al.: Natural history and management of low-grade glioma in NF-1 children. J Neurooncol 100 (2): 199-207, 2010. [PUBMED Abstract]
- Falzon K, Drimtzias E, Picton S, et al.: Visual outcomes after chemotherapy for optic pathway glioma in children with and without neurofibromatosis type 1: results of the International Society of Paediatric Oncology (SIOP) Low-Grade Glioma 2004 trial UK cohort. Br J Ophthalmol 102 (10): 1367-1371, 2018. [PUBMED Abstract]
- Hoffman LM, Veldhuijzen van Zanten SEM, Colditz N, et al.: Clinical, Radiologic, Pathologic, and Molecular Characteristics of Long-Term Survivors of Diffuse Intrinsic Pontine Glioma (DIPG): A Collaborative Report From the International and European Society for Pediatric Oncology DIPG Registries. J Clin Oncol 36 (19): 1963-1972, 2018. [PUBMED Abstract]
- Cohen KJ, Pollack IF, Zhou T, et al.: Temozolomide in the treatment of high-grade gliomas in children: a report from the Children's Oncology Group. Neuro Oncol 13 (3): 317-23, 2011. [PUBMED Abstract]
- Rodriguez D, Calmon R, Aliaga ES, et al.: MRI and Molecular Characterization of Pediatric High-Grade Midline Thalamic Gliomas: The HERBY Phase II Trial. Radiology 304 (1): 174-182, 2022. [PUBMED Abstract]
- McAbee JH, Modica J, Thompson CJ, et al.: Cervicomedullary tumors in children. J Neurosurg Pediatr 16 (4): 357-66, 2015. [PUBMED Abstract]
- Ballester LY, Wang Z, Shandilya S, et al.: Morphologic characteristics and immunohistochemical profile of diffuse intrinsic pontine gliomas. Am J Surg Pathol 37 (9): 1357-64, 2013. [PUBMED Abstract]
- Wu G, Diaz AK, Paugh BS, et al.: The genomic landscape of diffuse intrinsic pontine glioma and pediatric non-brainstem high-grade glioma. Nat Genet 46 (5): 444-50, 2014. [PUBMED Abstract]
- Hoffman LM, DeWire M, Ryall S, et al.: Spatial genomic heterogeneity in diffuse intrinsic pontine and midline high-grade glioma: implications for diagnostic biopsy and targeted therapeutics. Acta Neuropathol Commun 4: 1, 2016. [PUBMED Abstract]
- Erker C, Lane A, Chaney B, et al.: Characteristics of patients ≥10 years of age with diffuse intrinsic pontine glioma: a report from the International DIPG/DMG Registry. Neuro Oncol 24 (1): 141-152, 2022. [PUBMED Abstract]
- Broniscer A, Laningham FH, Sanders RP, et al.: Young age may predict a better outcome for children with diffuse pontine glioma. Cancer 113 (3): 566-72, 2008. [PUBMED Abstract]
- Pascual-Castroviejo I, Pascual-Pascual SI, Viaño J, et al.: Posterior fossa tumors in children with neurofibromatosis type 1 (NF1). Childs Nerv Syst 26 (11): 1599-603, 2010. [PUBMED Abstract]
- Albers AC, Gutmann DH: Gliomas in patients with neurofibromatosis type 1. Expert Rev Neurother 9 (4): 535-9, 2009. [PUBMED Abstract]
Información sobre los estadios de los gliomas, los astrocitomas y los tumores neuronales o glioneuronales
No hay ningún sistema de estadificación reconocido para los gliomas, los astrocitomas y los tumores neuronales o glioneuronales infantiles. La enfermedad unifocal representa, con mucha diferencia, la presentación clínica inicial más frecuente, seguida de la enfermedad multifocal o difusa, incluso la enfermedad leptomeníngea. La diseminación de la enfermedad fuera del sistema nervioso central (SNC) es muy poco frecuente.
Desde el punto de vista clínico, la diseminación de los gliomas de línea media a la protuberancia suele ser contigua, con metástasis a través del espacio subaracnoideo. Esta diseminación a veces se presenta antes de la progresión local, pero, con frecuencia, surge de manera simultánea con la progresión de la enfermedad primaria o después de esta.[1] Sin embargo, en las autopsias se observa una diseminación subclínica más generalizada con extensión al tronco encefálico, el tálamo, el cerebro y las leptomeninges supratentoriales.[2]
Bibliografía
- Sethi R, Allen J, Donahue B, et al.: Prospective neuraxis MRI surveillance reveals a high risk of leptomeningeal dissemination in diffuse intrinsic pontine glioma. J Neurooncol 102 (1): 121-7, 2011. [PUBMED Abstract]
- Caretti V, Bugiani M, Freret M, et al.: Subventricular spread of diffuse intrinsic pontine glioma. Acta Neuropathol 128 (4): 605-7, 2014. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento de los gliomas, los astrocitomas y los tumores neuronales o glioneuronales
Se han logrado mejoras notables en la supervivencia de niños y adolescentes con cáncer. Entre 1975 y 2020, la mortalidad por cáncer infantil disminuyó en más del 50 %.[1] Muchos de los avances en la supervivencia del cáncer infantil se han logrado como resultado de ensayos clínicos en los que se ha intentado mejorar el mejor tratamiento aceptado disponible. Los ensayos clínicos en el ámbito pediátrico se diseñan para comparar un tratamiento nuevo con el tratamiento actual aceptado como estándar. Esta comparación se puede realizar en un estudio aleatorizado con dos grupos de tratamiento o mediante la evaluación de un solo tratamiento nuevo, y la comparación de los resultados con aquellos obtenidos anteriormente con el tratamiento vigente. Debido a que el cáncer es relativamente infrecuente en los niños, todos los pacientes con tumores de encéfalo se deben considerar aptos para participar en un ensayo clínico. La información en inglés sobre los ensayos clínicos en curso patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI.
Para determinar y poner en práctica un tratamiento óptimo, es necesario que la planificación esté a cargo de un equipo multidisciplinario de especialistas en cáncer con experiencia en el tratamiento de tumores de encéfalo en los niños. La irradiación de los tumores de encéfalo durante la niñez es muy exigente desde el punto de vista técnico y se debe llevar a cabo en centros especializados para garantizar resultados óptimos.
La atención a largo plazo de los pacientes con tumores de encéfalo es compleja y exige un abordaje multidisciplinario. Para obtener información sobre la incidencia, el tipo y la vigilancia de los efectos tardíos en los niños y adolescentes sobrevivientes de cáncer, consultar Efectos tardíos del tratamiento anticanceroso en la niñez.
En el Cuadro 3 se describen las opciones de tratamiento estándar de los gliomas, los astrocitomas y los tumores glioneuronales o neuronales infantiles.
| Grupo de tratamiento | Opciones de tratamiento estándar | |
|---|---|---|
| Gliomas astrocíticos circunscritos, gliomas difusos de grado bajo de tipo pediátrico y tumores glioneuronales o neuronales: | ||
| Recién diagnosticados | Observación sin intervención | |
| Cirugía | ||
| Terapia adyuvante: | ||
| —Observación después de la cirugía (sin terapia adyuvante) | ||
| —Quimioterapia | ||
| —Radioterapia | ||
| —Terapia dirigida | ||
| Progresivos o recidivantes | Segunda cirugía | |
| Radioterapia | ||
| Quimioterapia | ||
| Terapia dirigida | ||
| Gliomas difusos de grado alto de tipo pediátrico: | ||
| Recién diagnosticado | Cirugía | |
| Terapia adyuvante: | ||
| —Radioterapia | ||
| —Quimioterapia | ||
| Terapia dirigida | ||
| Inmunoterapia | ||
| Recidivante | Segunda cirugía (no se considera un tratamiento estándar) | |
| Radioterapia (no se considera un tratamiento estándar) | ||
| Radioterapia dirigida (no se considera un tratamiento estándar) | ||
| Inmunoterapia (no se considera un tratamiento estándar) | ||
Bibliografía
- Surveillance Research Program, National Cancer Institute: SEER*Explorer: An interactive website for SEER cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed September 5, 2024.
Tratamiento de los gliomas astrocíticos circunscritos, los gliomas difusos de grado bajo de tipo pediátrico y los tumores glioneuronales o neuronales
Para determinar y poner en práctica una atención óptima, el tratamiento a menudo está a cargo de un equipo multidisciplinario de especialistas con experiencia en el tratamiento de pacientes pediátricos con tumores de encéfalo.
Para los niños con gliomas de la vía óptica, un objetivo principal importante del tratamiento es preservar la función visual.[1]
Las opciones de tratamiento estándar para los gliomas astrocíticos circunscritos recién diagnosticados, los gliomas difusos de grado bajo de tipo pediátrico y los tumores glioneuronales o neuronales son las siguientes:
Observación sin intervención
La observación sin intervención es una opción para los pacientes con neurofibromatosis de tipo 1 (NF1) o cuando se encuentran tumores asintomáticos de manera imprevista.[2] Se han descrito regresiones espontáneas de gliomas de la vía óptica en niños con NF1 y sin esta.[3,4]
Cirugía
La resección quirúrgica es un tratamiento primario,[5,6] y la viabilidad quirúrgica depende de la localización del tumor. Por ejemplo, es posible que la resección quirúrgica inocua no sea factible en muchos pacientes con gliomas de la vía óptica, porque incluso una biopsia tal vez presente riesgos para la visión del paciente. Como resultado, el diagnóstico de un glioma de la vía óptica quizás se base solo en una historia clínica compatible y hallazgos de imágenes. Esto es especialmente cierto en los pacientes con NF1.[5] Para otras presentaciones clínicas de un tumor de la vía óptica, en particular cuando el tumor es más infiltrante, se puede considerar una biopsia para la caracterización molecular del tumor.
En los pacientes que presentan hidrocefalia obstructiva, es posible que también sea necesaria una derivación quirúrgica u otro procedimiento para desviar el líquido cefalorraquídeo.
- Cerebelo: es posible lograr una resección completa o casi completa en el 90 % al 95 % de los pacientes con astrocitomas pilocíticos ubicados en el cerebelo.[6]
- Nervio óptico: en los niños con lesiones aisladas del nervio óptico y síntomas progresivos, la resección quirúrgica completa, aunque curativa, por lo general, produce ceguera en el ojo afectado. Cuando no es posible conservar la visión en el ojo afectado, se puede considerar la resección quirúrgica completa si preocupa el aspecto estético derivado de la exoftalmia.
- Estructuras de la línea media (hipotálamo, tálamo y tronco encefálico): los gliomas astrocíticos circunscritos localizados en estructuras de la línea media a veces se pueden extirpar de manera radical, con el consiguiente control de la enfermedad a largo plazo.[3] A pesar del aumento de la accesibilidad quirúrgica de estos tumores, esta resección puede producir secuelas neurológicas de importancia, en especial en niños menores de 2 años en el momento del diagnóstico.[7][Nivel de evidencia C1] Para las lesiones profundas de los gliomas difusos de grado bajo de tipo pediátrico, es posible que la resección quirúrgica extensa no sea adecuada y se deba considerar solo una biopsia.[8][Nivel de evidencia C2]
En general, se intenta realizar la máxima resección quirúrgica inocua para los gliomas del tronco encefálico focales, en particular los que surgen en la protuberancia y el bulbo raquídeo.[9] Si bien una mayor extensión de la resección se relaciona con una supervivencia sin progresión (SSP) más alta, esto se debe equilibrar con el riesgo de complicaciones posquirúrgicas nuevas. En una serie de 116 pacientes con gliomas de grado bajo del tronco encefálico, 100 pacientes se sometieron a alguna intervención quirúrgica. De los pacientes, 27 se sometieron a una biopsia; solo 1 de los pacientes tenía nuevas alteraciones posoperatorias. Otros 73 pacientes se sometieron a una resección completa o parcial, y casi el 30 % de los pacientes de este grupo presentaron complicaciones posoperatorias importantes, como insuficiencia respiratoria (5 pacientes), mutismo cerebeloso (3 pacientes) y parálisis o paresia de nervios craneales (15 pacientes).[10]
- Cerebro: los gliomas astrocíticos hemisféricos circunscritos suelen ser susceptibles de resección quirúrgica completa.
- Columna vertebral: por lo general, se intenta la resección quirúrgica de los tumores raquídeos, pero a menudo no se puede completar. En una cohorte de 128 pacientes con gliomas primarios de grado bajo de la médula espinal, se logró una resección macroscópica total en una minoría de los pacientes (24 de 128). Se logró un control a largo plazo de la enfermedad en cerca del 87 % de los pacientes de la cohorte, pero con frecuencia se requirió tratamiento posterior en forma de resección repetida, quimioterapia o radioterapia. En particular, la progresión de la enfermedad fue frecuente (51 de 128 pacientes), con habituales episodios de progresión tardía. Las secuelas neurológicas y las complicaciones ortopédicas también fueron frecuentes.[11][Nivel de evidencia C2]
Inmediatamente después de la resección, se obtienen imágenes por resonancia magnética (en las primeras 48 horas tras la resección, según los criterios del Children’s Oncology Group [COG]). Después se toman imágenes para la vigilancia periódica de los tumores resecados por completo, aunque su utilidad es incierta después del período posoperatorio inicial de 3 a 6 meses.[12]; [13][Nivel de evidencia C2]
Los factores relacionados con el desenlace en los niños con gliomas de grado bajo tratados con cirugía seguida de observación se identificaron en un estudio del COG con 518 pacientes evaluables.[6] El resultado global para todo el grupo fue una tasa de SSP a 8 años del 78 % y una tasa de supervivencia general (SG) a 8 años del 96 %. Los siguientes factores se relacionaron con el pronóstico:[6]
- Localización del tumor: los niños con tumores en el cerebelo y el cerebro presentaron una tasa de SSP a 8 años más alta, en comparación con los pacientes con tumores en la línea media o el quiasma (84 ± 1,9 % vs. 51 ± 5,9 %, respectivamente).
- Características histológicas: cerca de tres cuartos de los pacientes presentaban astrocitoma pilocítico; la SSP y la SG fueron superiores para estos pacientes en comparación con los niños que presentaban tumores no pilocíticos.
- Alcance de la resección: los pacientes con resección macroscópica total tenían tasas de SSP a 8 años superiores al 90 % y tasas de SG del 99 %. En comparación, cerca de la mitad de los pacientes con cualquier grado de tumor residual (según el informe operatorio y las imágenes posoperatorias) presentó progresión de la enfermedad a los 8 años, aunque las tasas de SG superaron el 90 %.[6]
En un análisis multivariante se examinó a 100 pacientes con diagnósticos confirmados de gliomas difusos de grado 2 de la Organización Mundial de la Salud (OMS) tratados en un estudio de la International Society of Paediatric Oncology (SIOP). El alcance de la resección del glioma tuvo el efecto más importante en las tasas de supervivencia sin complicaciones (SSC). Las tasas de SSC a 5 años fueron del 75 % al 76 % para los pacientes que se sometieron a una resección completa o subtotal. En comparación, la tasa de SSC a 5 años fue del 56 % para los pacientes sometidos a una resección parcial y del 19 % para los pacientes que se sometieron a una biopsia.[14][Nivel de evidencia B4]
Se desconoce el alcance de la resección necesaria para la curación porque los pacientes con tumor residual microscópico, e incluso macroscópico, después de la cirugía pueden presentar SSP a largo plazo sin terapia posoperatoria.[5,6]
- Edad: en los niños más pequeños (edad <5 años) se observaron tasas más altas de progresión tumoral, pero en análisis multivariantes no hubo ningún efecto significativo de la edad en la SG. En una revisión retrospectiva de una serie diferente de pacientes pediátricos, se observó una SSP inferior en los niños menores de 1 año con gliomas de grado bajo, en comparación con los niños de 1 año o más.[15]
El desenlace funcional a largo plazo de los pacientes con astrocitomas pilocíticos cerebelosos es relativamente favorable. La media del coeficiente intelectual (CI) de escala completa en los pacientes con gliomas de grado bajo tratados con cirugía sola es cercana a la población de referencia. Sin embargo, es posible que estos pacientes presenten alteraciones médicas, psicológicas y educativas a largo plazo.[16]; [17,18][Nivel de evidencia C1]
Terapia adyuvante
Por lo general, no es necesaria la terapia adyuvante después de una resección completa, a menos que haya una recidiva posterior de la enfermedad. Las opciones de tratamiento en los pacientes con tumores parcialmente resecados se deben individualizar, y suelen incluir una o más de las siguientes opciones:
- Observación después de la cirugía (sin terapia adyuvante).
- Quimioterapia.
- Radioterapia.
- Terapia dirigida (para astrocitomas subependimarios de células gigantes).
Observación después de la cirugía
Es posible que a los pacientes a quienes se les resecaron los tumores de manera parcial permanezcan bajo observación sin recibir ningún otro tratamiento dirigido a la enfermedad, en especial si se anticipa que el ritmo de crecimiento tumoral será muy lento. Cerca del 50 % de los pacientes con resecciones macroscópicas casi completas tienen una enfermedad que no progresa en 5 a 8 años, lo que respalda la estrategia de observación en pacientes seleccionados.[6]
Quimioterapia
Dados los efectos secundarios a largo plazo relacionados con la radioterapia, se recomienda la quimioterapia como terapia de primera línea para la mayoría de los pacientes pediátricos que necesitan terapia adyuvante después de la cirugía.
Es posible que la quimioterapia reduzca objetivamente el tamaño del tumor y ayude a evitar, o al menos retrasar, la necesidad de radioterapia en la mayoría de los pacientes.[19-21] La quimioterapia también es una opción para retrasar o evitar la radioterapia en los adolescentes con gliomas de la vía del nervio óptico.[22][Nivel de evidencia C2] Se ha demostrado que este tratamiento reduce el tamaño de los tumores en niños con gliomas hipotalámicos y síndrome diencefálico, lo que produce aumento de peso en aquellos que responden al tratamiento.[23]
Los regímenes que más se usan para el tratamiento de la progresión tumoral o de los gliomas infantiles de grado bajo sintomáticos e irresecables son los siguientes:
- Carboplatino con vincristina o sin esta.[20,24,25]; [26][Nivel de evidencia C2]
- Vinblastina.[27,28]
- Una combinación de tioguanina, procarbazina, lomustina y vincristina (TPCV).[29]; [19] [Nivel de evidencia A1]
El COG notificó los resultados de un ensayo aleatorizado de fase III (COG-A9952) en el que participaron niños menores de 10 años con gliomas de grado bajo en el quiasma o el hipotálamo sin NF1, que recibieron uno de los siguientes dos regímenes: carboplatino y vincristina (CV) o TPCV. La tasa de SSC a 5 años fue del 39 % (± 4 %) para los pacientes que recibieron el régimen CV y del 52 % (± 5 %) para los que se sometieron al régimen TPCV. Las tasas de toxicidad fueron relativamente comparables entre los dos regímenes.[19] En el mismo estudio, los niños con NF1 se asignaron al azar para recibir tratamiento con CV. La tasa de SSC a 5 años para los niños con NF1 fue mucho mejor, de un 69 % (± 4 %), que para los niños sin NF1 que recibieron CV. En el análisis multivariante, la NF1 fue un factor de predicción independiente de mejora de la SSC, pero no de la SG.[30] En un estudio independiente, en el que participaron 100 pacientes con gliomas difusos de grado 2 de la OMS, se trató un subconjunto de pacientes (n = 16) con CV y algunos pacientes también recibieron etopósido. Este subgrupo de pacientes tuvo una tasa de SSP a 5 años del 38 % cuando se excluyó a los pacientes cuyos tumores tenían variantes de la histona H3.[14][Nivel de evidencia B4]
Se han usado otros abordajes quimioterapéuticos para el tratamiento de niños con astrocitomas de grado bajo irresecables, progresivos o sintomáticos; entre ellos, los siguientes:
- Regímenes multifarmacológicos a base de platino.[20,21,31]; [32][Nivel de evidencia B4]; [33][Nivel de evidencia C1] Las tasas de SSP a 5 años notificadas oscilaron entre el 35 % y el 60 % en los niños que recibieron quimioterapia con derivados del platino para los gliomas de la vía óptica,[20,21] sin embargo, la mayoría de los pacientes necesitan tratamiento adicional. Esto es particularmente cierto para los niños que presentan al inicio gliomas en el hipotálamo o el quiasma con diseminación al eje encefalomedular.[34][Nivel de evidencia C2]
- Temozolomida.[35,36]
Entre los niños que recibieron quimioterapia para los gliomas de la vía óptica, aquellos sin NF1 tuvieron tasas más altas de progresión de la enfermedad que aquellos con NF1, y los lactantes tuvieron tasas más altas de progresión de la enfermedad que los niños mayores de 1 año.[20,21,28] El estado visual (incluso la agudeza y el campo) es una medición importante del desenlace y la respuesta al tratamiento. La función visual puede estar alterada y ser variable, incluso en pacientes con respuestas radiográficas, y a menudo es subóptima. Más de un tercio de los pacientes tratados de manera eficaz con quimioterapia tienen disminución de la agudeza visual unilateral o bilateral, y algunos pacientes presentan ceguera a pesar de indicios radiográficos de control tumoral (respuesta o estabilidad). En la mayoría de las series, los niños con gliomas esporádicos de la vía visual tienen desenlaces visuales más precarios que los niños con NF1.[28]; [37,38][Nivel de evidencia C1] Una mejor agudeza visual inicial, edad avanzada y ausencia de compromiso posterior en el quiasma se relacionan con una visión mejorada o estable después de la quimioterapia.[39,40]
Radioterapia
La radioterapia suele reservarse para pacientes con enfermedad que no responde de forma persistente a la quimioterapia.[20,21,41,42]
Para los niños con gliomas de grado bajo en quienes que se indica radioterapia, los abordajes que delimitan la distribución de la radiación al tumor y evitan el tejido encefálico normal (radioterapia conformada tridimensional, radioterapia de intensidad modulada (RTIM), radioterapia estereotáctica y radioterapia de protones [radioterapia con partículas cargadas]) puede reducir los efectos tóxicos agudos y a largo plazo relacionados con estas modalidades.[43,44]; [45][Nivel de evidencia C2] Se suelen utilizar dosis de radiación de 54 Gy en fracciones de 1,8 Gy.[46,47] En un estudio prospectivo de 174 pacientes que recibieron terapia de protones, la tasa actuarial de control local a 5 años fue del 85 % (intervalo de confianza [IC] 95 %, 78–90 %), la tasa de SSP fue del 84 % (IC 95 %, 77–89 %) y la tasa de SG fue del 92 % (IC 95 %, 85–95 %). Las localizaciones del tumor en el tronco encefálico y la médula espinal, así como una dosis de eficacia biológica relativa (EBR) de 54 Gy o inferior se relacionaron con control local (P < 0,01 para ambos).[48] En un estudio independiente, en el que se incluyeron 100 pacientes con gliomas difusos de grado 2 de la OMS, se trató con radioterapia a un subgrupo de pacientes (n = 16). Estos pacientes tuvieron una tasa de SSP a 5 años del 74 % cuando se excluyó a los pacientes cuyos tumores tenían una variantes de la histona H3.[14][Nivel de evidencia B4]
Después de la administración de la radioterapia, se debe prestar atención para distinguir los cambios en las imágenes inducidos por la radiación, llamados pseudoprogresión o progresión espuria,[49] de los cambios a partir de la progresión de la enfermedad. El tiempo máximo de aparición de cambios en las imágenes inducidos por la radioterapia, que a menudo se presentan como un aumento aparente de la masa irradiada, es de 4 a 6 meses, pero es posible que se manifiesten incluso más tarde.[50-53]; [54,55][Nivel de evidencia B4]; [8,56,57][Nivel de evidencia C2] En un informe de 83 pacientes con astrocitomas de grado bajo, la pseudoprogresión fue más frecuente después de dosis de radiación superiores a 50,4 Gy (EBR) (cociente de riesgos instantáneos [CRI], 2,61; P = 0,16). La pseudoprogresión también fue más frecuente después de la radioterapia con protones que después de la RTIM con fotones (CRI, 2,15; P = 0,048), presumiblemente debido al aumento de los efectos en la vasculatura. Los pacientes con un tipo histológico pilocítico presentaron tasas más bajas de pseudoprogresión que aquellos con gliomas no pilocíticos de grado bajo (CRI, 0,47; P = 0,037). No hubo ninguna relación con el control general de la enfermedad.[49]
En un informe del estudio SIOP-LGG 2004 (NCT00276640) y las cohortes del LGG-registry se evaluaron los siguientes criterios radiológicos de pseudoprogresión:[58]
- Aumento total de la lesión T2 relacionada al tumor.
- Aumento focal de la lesión T2 relacionada al tumor.
- Aumento del tumor resaltado por el contraste en los primeros 24 meses siguientes a la radioterapia.
Se observaron los siguientes resultados:
- La pseudoprogresión clara se determinó mediante imágenes radiológicas en 54 de 136 pacientes (39,7 %) sin diferencias en la frecuencia entre las modalidades de radioterapia: radioterapia intersticial con yodo (22 de 48 pacientes), radioterapia de fotones (24 de 54 pacientes) o radioterapia con haz de protones (11 de 20 pacientes) (P = 0,780).
- La pseudoprogresión clara se presentó a una mediana de 6,3 meses (radioterapia intersticial con yodo, 7,2 meses; radioterapia de fotones, 4,4 meses; radioterapia con haz de protones, 6,5 meses) después de comenzar la radioterapia y se mantuvo durante una mediana de 7,2 meses (radioterapia intersticial con yodo, 8,5 meses; radioterapia de fotones, 7 meses; radioterapia con haz de protones, 7,4 meses).
- Se demostró que la presencia de necrosis dentro de la lesión T2 relacionada con el tumor focal era un factor pronóstico importante de pseudoprogresión clara (P < 0,001).
La radioterapia produce un control radiográfico a largo plazo de la enfermedad en la mayoría de los niños con gliomas en el quiasma o en el tracto posterior al quiasma. Sin embargo, a pesar del control radiológico, los desenlaces visuales son variables.
- En un estudio del St. Jude Children’s Research Hospital se informó sobre los desenlaces de agudeza visual a largo plazo después de la radioterapia. Para el ojo peor, la incidencia acumulada a 5 años de disminución de la agudeza visual fue del 17,9 % y la mejora fue del 13,5 %. Para el ojo mejor, la incidencia acumulada a 5 años de disminución de la agudeza visual fue del 11,5 % y la mejora fue del 10,6 %. Después de la radioterapia, la mayoría de los pacientes presentaron estabilización de la visión. Fue más probable que se produjera un cambio visual después de la radioterapia dentro de los 2 años, lo que respalda la importancia de las evaluaciones visuales durante este período.[59]
- En otro estudio de 38 pacientes (media de edad, 3 años; mediana de seguimiento, 8,5 años) con gliomas de vía óptica tratados entre 2000 y 2018 se complementaron los datos previos sobre la preservación de la agudeza visual a largo plazo. Para los pacientes tratados con radioterapia temprana (ya sea por adelantado o como primer rescate), las tasas de supervivencia sin ceguera fueron del 100 % a los 5 y 8 años. En comparación, las tasas de supervivencia sin ceguera fueron del 81 % a los 5 años y del 60 % a los 8 años para los pacientes tratados principalmente con quimioterapia.[60]
- Otras secuelas incluyen deterioro intelectual y endocrinológico, daño cerebrovascular, muerte tardía y, posiblemente, un aumento del riesgo de tumores secundarios.[61-63]; [55][Nivel de evidencia B4] En un estudio poblacional se identificó la radioterapia como el factor de riesgo más importante relacionado con la mortalidad tardía, aunque los pacientes que requirieron radioterapia quizás eran reflejo de una población de riesgo más alto.[63]
El tratamiento de los gliomas astrocíticos circunscritos irresecables, los gliomas difusos de grado bajo de tipo pediátrico, los tumores glioneuronales y los tumores neuronales es controvertido. Para identificar las características pronósticas negativas en los pacientes tratados con radioterapia, en el estudio del St. Jude Children’s Research Hospital se evaluó a 150 niños (mediana de edad, 8 años; intervalo, 1,2–20 años) que recibieron radioterapia y se les controló durante una mediana de 11,4 años (intervalo, 0,24–29,4 años). El análisis de posicionamiento recursivo produjo grupos pronósticos de riesgo bajo y riesgo alto. La tasa de SG a 10 años fue del 95,6 % para los pacientes del grupo de riesgo bajo, versus el 76,4 % para los pacientes del grupo de riesgo alto. Los tumores de riesgo bajo incluyeron astrocitoma pilocítico o ganglioglioma ubicado fuera del mesencéfalo o el tálamo, mientras que los tumores de riesgo alto incluyeron astrocitoma difuso o aquellos ubicados en el encéfalo medio o el tálamo. En el grupo de pacientes de riesgo alto, la radioterapia diferida (definida como aquella que se realiza después de, al menos, una línea de quimioterapia) se relacionó con una disminución de la SG.[64]
Los niños con NF1 a veces presentan un riesgo más alto de tumores secundarios causados por la radiación y morbilidad debido a cambios vasculares. La radioterapia se usa como último recurso en estos pacientes, dado el riesgo más alto de inducir efectos tóxicos neurológicos y una segunda neoplasia maligna.[65]
Terapia dirigida
La Administración de Alimentos y Medicamentos de los Estados Unidos aprobó el uso de la combinación de trametinib (inhibidor de MEK) y dabrafenib (inhibidor de BRAF) para el tratamiento de pacientes pediátricos de 1 año o más con gliomas de grado bajo que tienen una variante BRAF V600E y requieren terapia sistémica. La aprobación se basó en un ensayo clínico aleatorizado en el que se comparó la combinación de dabrafenib con trametinib y la combinación de carboplatino con vincristina. La mediana de edad en el momento de la inscripción de los pacientes fue de 9,5 años, y los subtipos histológicos más comunes fueron ganglioglioma (alrededor del 25 %) y astrocitoma pilocítico (alrededor del 30 %). Los pacientes se asignaron al azar en una proporción de 2 a 1; 73 pacientes recibieron dabrafenib con trametinib y 37 recibieron carboplatino con vincristina. Los pacientes recibieron dabrafenib con trametinib hasta que perdieron el beneficio clínico o presentaron toxicidad inaceptable, y recibieron la combinación de carboplatino con vincristina como un curso de inducción de 10 semanas, seguido de 8 ciclos de 6 semanas.[66]
- La tasa de respuesta objetiva se evaluó de manera independiente usando los criterios de respuesta Response Assessment in Neuro-Oncology (RANO) 2017 para el glioma de grado bajo que utiliza la recuperación de la inversión atenuada de fluido T2 (FLAIR) en lugar del realce por contraste.
- Los pacientes que se asignaron al azar a dabrafenib con trametinib presentaron una tasa de respuesta objetiva significativamente más alta en comparación con los pacientes que recibieron carboplatino y vincristina (47 % vs. 11 %). Otro 41 % de los pacientes de cada grupo de tratamiento presentó enfermedad estable.
- Los pacientes asignados al azar a dabrafenib con trametinib presentaron una SSP significativamente más prolongada en comparación con los pacientes que recibieron carboplatino con vincristina (20,1 meses vs. 7,4 meses).
- Los efectos adversos de grado 3 o más altos fueron más comunes en los pacientes que recibieron carboplatino con vincristina en comparación con los pacientes que recibieron dabrafenib con trametinib (94 % vs. 47 %).
Los inhibidores de IDH se estudian para el tratamiento de los pacientes con gliomas de grado alto y grado bajo con alteración de IDH. Un fármaco, el vorasidenib, mostró evidencia preliminar de actividad para retardar la progresión en comparación con el placebo en adultos con diagnóstico nuevo de gliomas de grado bajo o grado alto con alteración de IDH1 o IDH2.[67]
En los niños sintomáticos con esclerosis tuberosa (ET) y astrocitomas subependimarios de células gigantes (SEGA), se ha estudiado el uso de fármacos inhibidores del blanco de la rapamicina en los mamíferos (mTOR) (por ejemplo, everólimus y sirólimus).
Evidencia (tratamiento de los SEGA con inhibidores de mTOR):
- En series pequeñas se observaron reducciones significativas en el tamaño de estos tumores después de la administración de everólimus o sirólimus, lo que a menudo elimina la necesidad de cirugía.[68]; [69][Nivel de evidencia B4]; [70][Nivel de evidencia C3]; [71][Nivel de evidencia C1]
- En un ensayo multicéntrico de fase III controlado con placebo de 117 pacientes, se confirmaron estos hallazgos anteriores.[72][Nivel de evidencia B3]
- De los pacientes del grupo de everólimus, el 35 % presentó reducción de por lo menos el 50 % en el tamaño de los SEGA, en comparación con el grupo de placebo, que no presentó reducción.
- En un estudio con pacientes que recibieron everólimus durante 5 años, se observaron los siguientes resultados:[73]
- Reducción en el tamaño de la masa en alrededor del 50 % de los pacientes; en muchos casos, la reducción se mantuvo.
- Estos pacientes también presentaron disminución en la frecuencia de las convulsiones.
Opciones de tratamiento en evaluación clínica
Tal vez haya ensayos clínicos terapéuticos de fase inicial para pacientes seleccionados. Es posible que estos ensayos estén disponibles a través del COG, el Pediatric Brain Tumor Consortium u otras entidades. La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación, se presentan ejemplos de ensayos clínicos nacionales o institucionales en curso:
- ACNS1831 (NCT03871257) (A Study of the Drugs Selumetinib Versus Carboplatin/Vincristine in Patients With NF1 and Low-Grade Glioma): En este ensayo de fase III se investiga el uso de selumetinib, en comparación con el tratamiento estándar de CV, para el tratamiento de pacientes con gliomas de bajo grado relacionados con NF1, y la mejora de la visión en pacientes con gliomas de grado bajo de la vía visual (nervios ópticos).
- ACNS1833 (NCT04166409) (A Study of the Drugs Selumetinib versus Carboplatino y Vincristina in Patients with Low-Grade Glioma): En este ensayo de fase III se compara el efecto del selumetinib con el tratamiento estándar con carboplatino y vincristina en el tratamiento de pacientes con glioma de grado bajo recién diagnosticado, o no tratado, que no presenta variante BRAF V600E y no se relaciona con NF1 sistémico.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Nicolin G, Parkin P, Mabbott D, et al.: Natural history and outcome of optic pathway gliomas in children. Pediatr Blood Cancer 53 (7): 1231-7, 2009. [PUBMED Abstract]
- Listernick R, Ferner RE, Liu GT, et al.: Optic pathway gliomas in neurofibromatosis-1: controversies and recommendations. Ann Neurol 61 (3): 189-98, 2007. [PUBMED Abstract]
- Albright AL: Feasibility and advisability of resections of thalamic tumors in pediatric patients. J Neurosurg 100 (5 Suppl Pediatrics): 468-72, 2004. [PUBMED Abstract]
- Piccirilli M, Lenzi J, Delfinis C, et al.: Spontaneous regression of optic pathways gliomas in three patients with neurofibromatosis type I and critical review of the literature. Childs Nerv Syst 22 (10): 1332-7, 2006. [PUBMED Abstract]
- Due-Tønnessen BJ, Helseth E, Scheie D, et al.: Long-term outcome after resection of benign cerebellar astrocytomas in children and young adults (0-19 years): report of 110 consecutive cases. Pediatr Neurosurg 37 (2): 71-80, 2002. [PUBMED Abstract]
- Wisoff JH, Sanford RA, Heier LA, et al.: Primary neurosurgery for pediatric low-grade gliomas: a prospective multi-institutional study from the Children's Oncology Group. Neurosurgery 68 (6): 1548-54; discussion 1554-5, 2011. [PUBMED Abstract]
- Scheinemann K, Bartels U, Huang A, et al.: Survival and functional outcome of childhood spinal cord low-grade gliomas. Clinical article. J Neurosurg Pediatr 4 (3): 254-61, 2009. [PUBMED Abstract]
- Sawamura Y, Kamada K, Kamoshima Y, et al.: Role of surgery for optic pathway/hypothalamic astrocytomas in children. Neuro Oncol 10 (5): 725-33, 2008. [PUBMED Abstract]
- Kestle J, Townsend JJ, Brockmeyer DL, et al.: Juvenile pilocytic astrocytoma of the brainstem in children. J Neurosurg 101 (1 Suppl): 1-6, 2004. [PUBMED Abstract]
- Holzapfel J, Kandels D, Schmidt R, et al.: Favorable prognosis in pediatric brainstem low-grade glioma: Report from the German SIOP-LGG 2004 cohort. Int J Cancer 146 (12): 3385-3396, 2020. [PUBMED Abstract]
- Perwein T, Benesch M, Kandels D, et al.: High frequency of disease progression in pediatric spinal cord low-grade glioma (LGG): management strategies and results from the German LGG study group. Neuro Oncol 23 (7): 1148-1162, 2021. [PUBMED Abstract]
- Sutton LN, Cnaan A, Klatt L, et al.: Postoperative surveillance imaging in children with cerebellar astrocytomas. J Neurosurg 84 (5): 721-5, 1996. [PUBMED Abstract]
- Dorward IG, Luo J, Perry A, et al.: Postoperative imaging surveillance in pediatric pilocytic astrocytomas. J Neurosurg Pediatr 6 (4): 346-52, 2010. [PUBMED Abstract]
- Falkenstein F, Gessi M, Kandels D, et al.: Prognostic impact of distinct genetic entities in pediatric diffuse glioma WHO-grade II-Report from the German/Swiss SIOP-LGG 2004 cohort. Int J Cancer 147 (8): 2159-2175, 2020. [PUBMED Abstract]
- Mirow C, Pietsch T, Berkefeld S, et al.: Children <1 year show an inferior outcome when treated according to the traditional LGG treatment strategy: a report from the German multicenter trial HIT-LGG 1996 for children with low grade glioma (LGG). Pediatr Blood Cancer 61 (3): 457-63, 2014. [PUBMED Abstract]
- Beebe DW, Ris MD, Armstrong FD, et al.: Cognitive and adaptive outcome in low-grade pediatric cerebellar astrocytomas: evidence of diminished cognitive and adaptive functioning in National Collaborative Research Studies (CCG 9891/POG 9130). J Clin Oncol 23 (22): 5198-204, 2005. [PUBMED Abstract]
- Turner CD, Chordas CA, Liptak CC, et al.: Medical, psychological, cognitive and educational late-effects in pediatric low-grade glioma survivors treated with surgery only. Pediatr Blood Cancer 53 (3): 417-23, 2009. [PUBMED Abstract]
- Daszkiewicz P, Maryniak A, Roszkowski M, et al.: Long-term functional outcome of surgical treatment of juvenile pilocytic astrocytoma of the cerebellum in children. Childs Nerv Syst 25 (7): 855-60, 2009. [PUBMED Abstract]
- Ater JL, Zhou T, Holmes E, et al.: Randomized study of two chemotherapy regimens for treatment of low-grade glioma in young children: a report from the Children's Oncology Group. J Clin Oncol 30 (21): 2641-7, 2012. [PUBMED Abstract]
- Gnekow AK, Falkenstein F, von Hornstein S, et al.: Long-term follow-up of the multicenter, multidisciplinary treatment study HIT-LGG-1996 for low-grade glioma in children and adolescents of the German Speaking Society of Pediatric Oncology and Hematology. Neuro Oncol 14 (10): 1265-84, 2012. [PUBMED Abstract]
- Laithier V, Grill J, Le Deley MC, et al.: Progression-free survival in children with optic pathway tumors: dependence on age and the quality of the response to chemotherapy--results of the first French prospective study for the French Society of Pediatric Oncology. J Clin Oncol 21 (24): 4572-8, 2003. [PUBMED Abstract]
- Chong AL, Pole JD, Scheinemann K, et al.: Optic pathway gliomas in adolescence--time to challenge treatment choices? Neuro Oncol 15 (3): 391-400, 2013. [PUBMED Abstract]
- Gropman AL, Packer RJ, Nicholson HS, et al.: Treatment of diencephalic syndrome with chemotherapy: growth, tumor response, and long term control. Cancer 83 (1): 166-72, 1998. [PUBMED Abstract]
- Gururangan S, Cavazos CM, Ashley D, et al.: Phase II study of carboplatin in children with progressive low-grade gliomas. J Clin Oncol 20 (13): 2951-8, 2002. [PUBMED Abstract]
- Mahoney DH, Cohen ME, Friedman HS, et al.: Carboplatin is effective therapy for young children with progressive optic pathway tumors: a Pediatric Oncology Group phase II study. Neuro Oncol 2 (4): 213-20, 2000. [PUBMED Abstract]
- Dodgshun AJ, Maixner WJ, Heath JA, et al.: Single agent carboplatin for pediatric low-grade glioma: A retrospective analysis shows equivalent efficacy to multiagent chemotherapy. Int J Cancer 138 (2): 481-8, 2016. [PUBMED Abstract]
- Bouffet E, Jakacki R, Goldman S, et al.: Phase II study of weekly vinblastine in recurrent or refractory pediatric low-grade glioma. J Clin Oncol 30 (12): 1358-63, 2012. [PUBMED Abstract]
- Lassaletta A, Scheinemann K, Zelcer SM, et al.: Phase II Weekly Vinblastine for Chemotherapy-Naïve Children With Progressive Low-Grade Glioma: A Canadian Pediatric Brain Tumor Consortium Study. J Clin Oncol 34 (29): 3537-3543, 2016. [PUBMED Abstract]
- Prados MD, Edwards MS, Rabbitt J, et al.: Treatment of pediatric low-grade gliomas with a nitrosourea-based multiagent chemotherapy regimen. J Neurooncol 32 (3): 235-41, 1997. [PUBMED Abstract]
- Ater JL, Xia C, Mazewski CM, et al.: Nonrandomized comparison of neurofibromatosis type 1 and non-neurofibromatosis type 1 children who received carboplatin and vincristine for progressive low-grade glioma: A report from the Children's Oncology Group. Cancer 122 (12): 1928-36, 2016. [PUBMED Abstract]
- Massimino M, Spreafico F, Cefalo G, et al.: High response rate to cisplatin/etoposide regimen in childhood low-grade glioma. J Clin Oncol 20 (20): 4209-16, 2002. [PUBMED Abstract]
- Massimino M, Spreafico F, Riva D, et al.: A lower-dose, lower-toxicity cisplatin-etoposide regimen for childhood progressive low-grade glioma. J Neurooncol 100 (1): 65-71, 2010. [PUBMED Abstract]
- Mora J, Perez-Jaume S, Cruz O: Treatment of childhood astrocytomas with irinotecan and cisplatin. Clin Transl Oncol 20 (4): 500-507, 2018. [PUBMED Abstract]
- von Hornstein S, Kortmann RD, Pietsch T, et al.: Impact of chemotherapy on disseminated low-grade glioma in children and adolescents: report from the HIT-LGG 1996 trial. Pediatr Blood Cancer 56 (7): 1046-54, 2011. [PUBMED Abstract]
- Gururangan S, Fisher MJ, Allen JC, et al.: Temozolomide in children with progressive low-grade glioma. Neuro Oncol 9 (2): 161-8, 2007. [PUBMED Abstract]
- Khaw SL, Coleman LT, Downie PA, et al.: Temozolomide in pediatric low-grade glioma. Pediatr Blood Cancer 49 (6): 808-11, 2007. [PUBMED Abstract]
- Moreno L, Bautista F, Ashley S, et al.: Does chemotherapy affect the visual outcome in children with optic pathway glioma? A systematic review of the evidence. Eur J Cancer 46 (12): 2253-9, 2010. [PUBMED Abstract]
- Shofty B, Ben-Sira L, Freedman S, et al.: Visual outcome following chemotherapy for progressive optic pathway gliomas. Pediatr Blood Cancer 57 (3): 481-5, 2011. [PUBMED Abstract]
- Falzon K, Drimtzias E, Picton S, et al.: Visual outcomes after chemotherapy for optic pathway glioma in children with and without neurofibromatosis type 1: results of the International Society of Paediatric Oncology (SIOP) Low-Grade Glioma 2004 trial UK cohort. Br J Ophthalmol 102 (10): 1367-1371, 2018. [PUBMED Abstract]
- Rakotonjanahary J, Gravier N, Lambron J, et al.: Long-term visual acuity in patients with optic pathway glioma treated during childhood with up-front BB-SFOP chemotherapy-Analysis of a French pediatric historical cohort. PLoS One 14 (3): e0212107, 2019. [PUBMED Abstract]
- Fisher BJ, Leighton CC, Vujovic O, et al.: Results of a policy of surveillance alone after surgical management of pediatric low grade gliomas. Int J Radiat Oncol Biol Phys 51 (3): 704-10, 2001. [PUBMED Abstract]
- Tsang DS, Murphy ES, Merchant TE: Radiation Therapy for Optic Pathway and Hypothalamic Low-Grade Gliomas in Children. Int J Radiat Oncol Biol Phys 99 (3): 642-651, 2017. [PUBMED Abstract]
- Greenberger BA, Pulsifer MB, Ebb DH, et al.: Clinical outcomes and late endocrine, neurocognitive, and visual profiles of proton radiation for pediatric low-grade gliomas. Int J Radiat Oncol Biol Phys 89 (5): 1060-8, 2014. [PUBMED Abstract]
- Paulino AC, Mazloom A, Terashima K, et al.: Intensity-modulated radiotherapy (IMRT) in pediatric low-grade glioma. Cancer 119 (14): 2654-9, 2013. [PUBMED Abstract]
- Müller K, Gnekow A, Falkenstein F, et al.: Radiotherapy in pediatric pilocytic astrocytomas. A subgroup analysis within the prospective multicenter study HIT-LGG 1996 by the German Society of Pediatric Oncology and Hematology (GPOH). Strahlenther Onkol 189 (8): 647-55, 2013. [PUBMED Abstract]
- Bitterman DS, MacDonald SM, Yock TI, et al.: Revisiting the Role of Radiation Therapy for Pediatric Low-Grade Glioma. J Clin Oncol 37 (35): 3335-3339, 2019. [PUBMED Abstract]
- Cherlow JM, Shaw DWW, Margraf LR, et al.: Conformal Radiation Therapy for Pediatric Patients with Low-Grade Glioma: Results from the Children's Oncology Group Phase 2 Study ACNS0221. Int J Radiat Oncol Biol Phys 103 (4): 861-868, 2019. [PUBMED Abstract]
- Indelicato DJ, Rotondo RL, Uezono H, et al.: Outcomes Following Proton Therapy for Pediatric Low-Grade Glioma. Int J Radiat Oncol Biol Phys 104 (1): 149-156, 2019. [PUBMED Abstract]
- Ludmir EB, Mahajan A, Paulino AC, et al.: Increased risk of pseudoprogression among pediatric low-grade glioma patients treated with proton versus photon radiotherapy. Neuro Oncol 21 (5): 686-695, 2019. [PUBMED Abstract]
- Chawla S, Korones DN, Milano MT, et al.: Spurious progression in pediatric brain tumors. J Neurooncol 107 (3): 651-7, 2012. [PUBMED Abstract]
- Marcus KJ, Goumnerova L, Billett AL, et al.: Stereotactic radiotherapy for localized low-grade gliomas in children: final results of a prospective trial. Int J Radiat Oncol Biol Phys 61 (2): 374-9, 2005. [PUBMED Abstract]
- Combs SE, Schulz-Ertner D, Moschos D, et al.: Fractionated stereotactic radiotherapy of optic pathway gliomas: tolerance and long-term outcome. Int J Radiat Oncol Biol Phys 62 (3): 814-9, 2005. [PUBMED Abstract]
- Naftel RP, Pollack IF, Zuccoli G, et al.: Pseudoprogression of low-grade gliomas after radiotherapy. Pediatr Blood Cancer 62 (1): 35-9, 2015. [PUBMED Abstract]
- Merchant TE, Kun LE, Wu S, et al.: Phase II trial of conformal radiation therapy for pediatric low-grade glioma. J Clin Oncol 27 (22): 3598-604, 2009. [PUBMED Abstract]
- Merchant TE, Conklin HM, Wu S, et al.: Late effects of conformal radiation therapy for pediatric patients with low-grade glioma: prospective evaluation of cognitive, endocrine, and hearing deficits. J Clin Oncol 27 (22): 3691-7, 2009. [PUBMED Abstract]
- Kano H, Niranjan A, Kondziolka D, et al.: Stereotactic radiosurgery for pilocytic astrocytomas part 2: outcomes in pediatric patients. J Neurooncol 95 (2): 219-29, 2009. [PUBMED Abstract]
- Hallemeier CL, Pollock BE, Schomberg PJ, et al.: Stereotactic radiosurgery for recurrent or unresectable pilocytic astrocytoma. Int J Radiat Oncol Biol Phys 83 (1): 107-12, 2012. [PUBMED Abstract]
- Stock A, Hancken CV, Kandels D, et al.: Pseudoprogression Is Frequent After Front-Line Radiation Therapy in Pediatric Low-Grade Glioma: Results From the German Low-Grade Glioma Cohort. Int J Radiat Oncol Biol Phys 112 (5): 1190-1202, 2022. [PUBMED Abstract]
- Acharya S, Quesada S, Coca K, et al.: Long-term visual acuity outcomes after radiation therapy for sporadic optic pathway glioma. J Neurooncol 144 (3): 603-610, 2019. [PUBMED Abstract]
- Hanania AN, Paulino AC, Ludmir EB, et al.: Early radiotherapy preserves vision in sporadic optic pathway glioma. Cancer 127 (13): 2358-2367, 2021. [PUBMED Abstract]
- Jenkin D, Angyalfi S, Becker L, et al.: Optic glioma in children: surveillance, resection, or irradiation? Int J Radiat Oncol Biol Phys 25 (2): 215-25, 1993. [PUBMED Abstract]
- Khafaga Y, Hassounah M, Kandil A, et al.: Optic gliomas: a retrospective analysis of 50 cases. Int J Radiat Oncol Biol Phys 56 (3): 807-12, 2003. [PUBMED Abstract]
- Krishnatry R, Zhukova N, Guerreiro Stucklin AS, et al.: Clinical and treatment factors determining long-term outcomes for adult survivors of childhood low-grade glioma: A population-based study. Cancer 122 (8): 1261-9, 2016. [PUBMED Abstract]
- Acharya S, Liu JF, Tatevossian RG, et al.: Risk stratification in pediatric low-grade glioma and glioneuronal tumor treated with radiation therapy: an integrated clinicopathologic and molecular analysis. Neuro Oncol 22 (8): 1203-1213, 2020. [PUBMED Abstract]
- Grill J, Couanet D, Cappelli C, et al.: Radiation-induced cerebral vasculopathy in children with neurofibromatosis and optic pathway glioma. Ann Neurol 45 (3): 393-6, 1999. [PUBMED Abstract]
- Bouffet E, Hansford JR, Garrè ML, et al.: Dabrafenib plus Trametinib in Pediatric Glioma with BRAF V600 Mutations. N Engl J Med 389 (12): 1108-1120, 2023. [PUBMED Abstract]
- Mellinghoff IK, van den Bent MJ, Blumenthal DT, et al.: Vorasidenib in IDH1- or IDH2-Mutant Low-Grade Glioma. N Engl J Med 389 (7): 589-601, 2023. [PUBMED Abstract]
- Franz DN, Agricola KD, Tudor CA, et al.: Everolimus for tumor recurrence after surgical resection for subependymal giant cell astrocytoma associated with tuberous sclerosis complex. J Child Neurol 28 (5): 602-7, 2013. [PUBMED Abstract]
- Krueger DA, Care MM, Holland K, et al.: Everolimus for subependymal giant-cell astrocytomas in tuberous sclerosis. N Engl J Med 363 (19): 1801-11, 2010. [PUBMED Abstract]
- Weidman DR, Pole JD, Bouffet E, et al.: Dose-level response rates of mTor inhibition in tuberous sclerosis complex (TSC) related subependymal giant cell astrocytoma (SEGA). Pediatr Blood Cancer 62 (10): 1754-60, 2015. [PUBMED Abstract]
- Franz DN, Leonard J, Tudor C, et al.: Rapamycin causes regression of astrocytomas in tuberous sclerosis complex. Ann Neurol 59 (3): 490-8, 2006. [PUBMED Abstract]
- Franz DN, Belousova E, Sparagana S, et al.: Efficacy and safety of everolimus for subependymal giant cell astrocytomas associated with tuberous sclerosis complex (EXIST-1): a multicentre, randomised, placebo-controlled phase 3 trial. Lancet 381 (9861): 125-32, 2013. [PUBMED Abstract]
- Franz DN, Agricola K, Mays M, et al.: Everolimus for subependymal giant cell astrocytoma: 5-year final analysis. Ann Neurol 78 (6): 929-38, 2015. [PUBMED Abstract]
Tratamiento de los gliomas astrocíticos circunscritos progresivos o recidivantes, los gliomas difusos de grado bajo de tipo pediátrico y los tumores glioneuronales o neuronales
No existe una única opción de tratamiento estándar para los gliomas astrocíticos circunscritos progresivos o recidivantes, los gliomas difusos de grado bajo de tipo pediátrico, los tumores glioneuronales ni los tumores neuronales. Para determinar y poner en práctica una atención óptima, el tratamiento a menudo está a cargo de un equipo multidisciplinario de especialistas en cáncer con experiencia en el tratamiento de pacientes pediátricos con tumores de encéfalo.
Se debe diseñar un plan personalizado a partir de los siguientes aspectos:
- Edad del paciente.
- Localización del tumor.
- Análisis patológico, incluso hallazgos genómicos.
- Hallazgos relevantes en la línea germinal o predisposiciones tumorales hereditarias.
- Tratamiento previo.
La enfermedad recidivante se suele presentar en el sitio del tumor primario, aunque se ha documentado enfermedad multifocal o ampliamente diseminada a otros sitios intracraneales y a las leptomeninges medulares.[1,2] La mayoría de las recidivas son de la misma entidad tumoral; sin embargo, es posible que el tumor se transforme en un tumor de grado más alto y se relaciona con el perfil molecular.[3] Con frecuencia, las imágenes de vigilancia identifican recidivas asintomáticas.[4] En el momento de la recidiva, se indica una evaluación completa para determinar la extensión de la recaída.
La secuenciación de la muestra tumoral se hizo en pacientes pediátricos (n = 48) y adultos jóvenes (n = 6) con gliomas de grado bajo recidivantes o resistentes al tratamiento que se inscribieron en el ensayo Pediatric MATCH del Children's Oncology Group (COG) del Instituto Nacional del Cáncer (NCI). En la prueba se encontraron alteraciones genómicas que se consideraron dianas terapéuticas en grupos del estudio MATCH en 39 de 54 tumores (72,2 %).[5] Se detectaron alteraciones en los genes de la vía MAPK (sobre todo BRAF y NF1) en 26 de 54 tumores (48,1 %). También se identificaron variantes (n = 11) o fusiones (n = 1) de FGFR1 en 12 de 54 tumores (22,2 %).
Las opciones de tratamiento para los gliomas astrocíticos circunscritos progresivos o recidivantes, los gliomas difusos de grado bajo de tipo pediátrico y los tumores glioneuronales o neuronales son las siguientes:
Segunda cirugía
Se debe considerar la intervención quirúrgica caso por caso, a partir de los siguientes aspectos:
- Tipo de tumor inicial.
- Período de tiempo entre el tratamiento inicial y la recidiva o progresión tumoral.
- Cuadro clínico.
La utilidad de la segunda cirugía se ve afectada por el sitio de la recidiva y la probabilidad de obtener una resección casi total o una resección macroscópica total sin lesión neurológica importante.[6]
Radioterapia
La justificación del uso de radioterapia es en esencia la misma para la terapia de primera línea o en el momento de la recidiva. Para obtener más información, consultar la sección Radioterapia. Si el niño nunca ha recibido radioterapia, la radioterapia local sea tal vez una opción de tratamiento, aunque se debe considerar la quimioterapia en lugar de la radiación, según la edad del niño y la extensión y ubicación del tumor.[7][Nivel de evidencia C1]; [8][Nivel de evidencia C2]
Para los niños con gliomas de grado bajo en quienes se indica radioterapia, los abordajes de radioterapia conformada (incluso terapia con haz de protones) son eficaces y ofrecen la posibilidad de reducir los efectos tóxicos agudos y a largo plazo relacionados con esta modalidad.[9-12]
Quimioterapia
Si hay recidiva o progresión en un sitio irresecable, se debe considerar el uso de quimioterapia.
Es posible que la quimioterapia permita un control de la enfermedad a largo plazo relativo.[13,14]. La elección del régimen depende del tipo de quimioterapia previa y de la respuesta a la misma. Se pueden considerar numerosas opciones, como carboplatino con vincristina (CV) o sin esta; tioguanina, procarbazina, lomustina y vincristina (TPCV); vinblastina sola; temozolomida sola; temozolomida en combinación con carboplatino y vincristina; irinotecán y bevacizumab; o lenalidomida.[13-17] Cuando se identifica una alteración molecular terapéutica aplicable en el tumor, la terapia molecular dirigida se usa cada vez más como terapia de segunda línea.
Terapia dirigida
Inhibidores de mTOR
En los niños sintomáticos con esclerosis tuberosa (ET) y astrocitomas subependimarios de células gigantes (SEGA) o gliomas de grado bajo,[18] se ha estudiado el uso de inhibidores del blanco de la rapamicina en los mamíferos (mTOR) (por ejemplo, everólimus y sirólimus).
Evidencia (inhibidores de mTOR):
- En series pequeñas se observaron reducciones significativas en el tamaño de estos tumores después de la administración de everólimus o sirólimus, lo que a menudo elimina la necesidad de cirugía.[19]; [20][Nivel de evidencia B4]; [21][Nivel de evidencia C3]; [22][Nivel de evidencia C1]
- En un ensayo multicéntrico controlado con placebo de fase III de 117 pacientes, se confirmaron los hallazgos anteriores.[23][Nivel de evidencia B3]
- De los pacientes del grupo de everólimus, el 35 % presentó reducción de por lo menos el 50 % en el tamaño de los SEGA, en comparación con el grupo de placebo, que no presentó reducción.
- En un estudio con pacientes que recibieron everólimus durante 5 años, se observaron los siguientes resultados:[24]
- Reducción en el tamaño de la masa en alrededor del 50 % de los pacientes; en muchos casos, la reducción se mantuvo.
- Estos pacientes también presentaron disminución en la frecuencia de convulsiones.
- En una serie de 23 pacientes con gliomas recidivantes de grado bajo tratados con everólimus, se observó lo siguiente:[25]
- El everólimus demostró una actividad modesta, con una tasa supervivencia sin progresión (SSP) a 2 años del 39 % y una tasa de supervivencia general (SG) superior al 93 %.
- En un estudio complementario completado por el Neurofibromatosis Clinical Trials Consortium, se evaluó a 23 niños con neurofibromatosis tipo 1 (NF1) y gliomas progresivos de grado bajo tratados con everólimus.[26]
- De los 22 pacientes evaluables, 15 mostraron una respuesta parcial o estabilización tumoral, y 10 de estos permanecieron sin progresión durante una mediana de seguimiento de 33 meses.
Inhibidores de VEGF
También se observó actividad antitumoral del bevacizumab en combinación con irinotecán que, en algunos casos, además produjo mejoría clínica o visual.[27]
Evidencia (terapia dirigida [bevacizumab]):
- En un estudio de fase II de bevacizumab e irinotecán para niños con gliomas de bajo grado recidivantes, se observaron los siguientes resultados:[28]
- Se observaron respuestas sostenidas a largo plazo en solo 2 pacientes (5,7 %).
- La tasa de SSP a 6 meses fue del 85,4 % (error estándar [EE] ± 5,96 %).
- La tasa de SSP a 2 años fue del 47,8 % (EE ± 9,27 %).
- En un estudio piloto de 14 pacientes con gliomas recidivantes de grado bajo, también se evaluaron las terapias con bevacizumab y se observaron los siguientes aspectos:[29][Nivel de evidencia C2]; [30][Nivel de evidencia C3]
- Se observaron respuestas objetivas en 12 pacientes (86 %).
- Ningún paciente progresó durante el tratamiento (mediana de duración del tratamiento, 12 meses), pero 13 de 14 progresaron después de suspender el bevacizumab al cabo de una mediana de 5 meses.
- En un análisis retrospectivo se incluyó a 88 niños con gliomas de grado bajo que recibieron tratamiento a base de bevacizumab combinado con otra terapia.[31]
- Se observó respuesta parcial en el 40 % de los pacientes y enfermedad estable en el 49 % de los pacientes.
- El 65 % de los pacientes progresó al cabo de una mediana de 8 meses después de la interrupción del tratamiento a base de bevacizumab. La tasa de SSP radiográfica fue del 29 % a los 3 años.
- Se observó estabilidad en el funcionamiento visual del 49 % de los pacientes, y la visión mejoró en el 29 % de los pacientes. A pesar de la progresión radiográfica de muchos pacientes, la tasa de SSP visual a 3 años fue del 53 %.
- El bevacizumab también se ha empleado en niños con gliomas de bajo grado y agrandamiento tumoral sintomático inducido por la radiación.[32,33]
- El tratamiento con bevacizumab produjo mejora en las imágenes (5 de 5 pacientes) y permitió la retirada de los corticoesteroides (4 de 4 pacientes).
Inhibidores de BRAF y MEK
Gracias a que se identificó que las variantes de BRAF son oncoiniciadoras en una proporción significativa de los gliomas de grado bajo, se están llevando a cabo numerosos ensayos clínicos sobre la inhibición de varios elementos de esta vía molecular (por ejemplo, MEK y BRAF) y los resultados preliminares indican actividad importante. Si bien los inhibidores de BRAF de primera generación, como el vemurafenib y el dabrafenib, son activos contra los tumores con variantes BRAF V600E, están contraindicados para los tumores con fusiones del gen BRAF debido a la posibilidad de activación paradójica de la vía MAPK.[34,35] Como se describe a continuación, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó la combinación de dabrafenib y trametinib para pacientes pediátricos de 1 año o más con gliomas de grado bajo en recaída o resistentes al tratamiento que presentan variantes BRAF V600E.
- Para los pacientes con tumores que presentan variantes BRAF V600E, la investigación clínica se enfoca en la evaluación del uso de inhibidores de BRAF en combinación con inhibidores de MEK. Estas combinaciones están aprobadas para el tratamiento de cánceres en adultos con variantes BRAF V600E y son más eficaces que los inhibidores de BRAF o los inhibidores de MEK que se usan como monoterapia.[36]
- Los resultados del uso del dabrafenib (inhibidor de BRAF V600E) indican una reducción del 44 % en la tasa de respuesta general (1 respuesta completa y 13 respuestas parciales) según una revisión central en niños con gliomas de grado bajo con variantes BRAFV600 resistentes al tratamiento o recidivantes. La mediana de duración de la respuesta fue de 26 meses. La tasa del control de la enfermedad (respuesta completa, respuesta parcial y enfermedad estable) fue del 78 %. La terapia se toleró bien, aunque el 91 % de los pacientes presentaron algunos efectos secundarios como fatiga (34 %), exantema (31 %) y pirexia (28 %). De 32 pacientes, 9 presentaron efectos tóxicos de grado 3 a 4, 10 pacientes necesitaron modificaciones de la dosis, y 2 pacientes discontinuaron el tratamiento, entre ellos, 1 niño con coagulación intravascular diseminada e hipertensión. En este estudio pediátrico, no se encontró ningún caso de carcinoma de células escamosas de la piel ni de queratoacantoma.[37]
- En un estudio de fase I/II de trametinib en monoterapia para el tratamiento de pacientes con gliomas de grado bajo con la variante BRAF V600E se inscribieron 13 pacientes pediátricos. La tasa de respuesta objetiva para estos 13 pacientes se evaluó mediante revisión externa usando los criterios de respuesta del Response Assessment in Neuro-Oncology (RANO) de 2017 para gliomas de grado bajo, que emplea la recuperación de inversión atenuada por líquido en T2 (FLAIR) en lugar de la intensificación del contraste.[38]
- De 13 pacientes, 2 (15 %) alcanzaron respuestas parciales y 6 (46%) tuvieron enfermedad estable.
- La tasa de SSP a 24 meses fue del 50 %.
- En un estudio de fase I/II en el que se evaluó la combinación de dabrafenib y trametinib se inscribieron 34 pacientes con gliomas de grado bajo con variantes BRAF V600E y 2 pacientes con gliomas de grado alto que también presentaban dicha variante. La tasa de respuesta objetiva en estos 36 pacientes se analizó mediante revisión externa usando los criterios de respuesta RANO 2017 para gliomas de grado bajo, que emplea la T2-FLAIR en lugar de la intensificación del contraste.[38]
- De 36 pacientes, 9 (25 %) lograron respuestas parciales y 23 (64 %) tuvieron enfermedad estable.
- La tasa de SSP a 24 meses fue del 80 %.
- Los efectos adversos más comunes relacionados con el tratamiento en el grupo de dabrafenib y trametinib fueron fiebre (50 %) y piel seca (42 %). El 22 % de los pacientes presentó efectos adversos que les impidieron continuar con el tratamiento, esto representa una tasa menor a la observada en los pacientes que recibieron trametinib en monoterapia (54 %).
- La FDA aprobó la combinación de trametinib y dabrafenib para pacientes adultos y pediátricos de un año o más con tumores sólidos irresecables o metastásicos con variantes BRAF V600E que progresaron después de un tratamiento anterior y que no cuentan con alternativas de tratamiento adecuadas. En esta indicación se incluye a los pacientes pediátricos de 1 año o más con gliomas de grado bajo que presentan la variante BRAF V600E.
- El inhibidor de MEK selumetinib se ha estudiado en un ensayo clínico de fase I/II para niños con gliomas de grado bajo (PBTC-029 [NCT01089101]).
- En el componente de fase I del ensayo PBTC-029 se observaron los siguientes resultados:[39]
- El selumetinib se toleró en una dosis diaria de 25 mg/m 2.
- Los efectos adversos más comunes que llevaron a la interrupción del tratamiento fueron exantema, paroniquia y elevación de la creatina–fosfocinasa (CPK).
- El estrato 1 del componente de fase II de este ensayo fue para pacientes con alteraciones genómicas en BRAF.[40]
- De 25 pacientes, 9 (36 %) lograron una respuesta parcial; estas respuestas se presentaron en pacientes con variante BRAF V600E y con fusiones del gen BRAF.
- La tasa de SSP a 2 años fue del 70 % en los pacientes del estrato 1.
- El estrato 3 del componente de fase II de este ensayo era para pacientes con gliomas de grado bajo relacionados con NF1.[40]
- La tasa de supervivencia sin complicaciones a 2 años fue del 96 %.
- De 25 pacientes, 10 (40 %) lograron respuestas parciales.
- El estrato 4 del componente de fase II de este ensayo era para pacientes con gliomas recidivantes de bajo grado hipotalámicos y de la vía óptica.[41]
- De los 25 pacientes, 6 (24 %) presentaron una respuesta parcial y otros 14 de 25 pacientes (56 %) presentaron enfermedad estable.
- La tasa de SSP a 2 años fue del 78 %.
- De los 19 pacientes evaluables para agudeza visual, 4 presentaron mejoras en esta y otros 13 presentaron hallazgos estables.
Los efectos tóxicos más comunes en todos los estratos fueron aumentos de la CPK de grado 1 y 2, diarrea, hipoalbuminemia, elevación de la aspartato–aminotransferasa (AST) y exantema. Los efectos tóxicos de grado 3 y 4, aunque infrecuentes, fueron aumento de la CPK, exantema, neutropenia, emesis y paroniquia.
- En el componente de fase I del ensayo PBTC-029 se observaron los siguientes resultados:[39]
Opciones de tratamiento en evaluación clínica
Tal vez haya ensayos clínicos terapéuticos de fase inicial disponibles para pacientes seleccionados. Es posible que estos ensayos estén disponibles a través del COG, el Pediatric Brain Tumor Consortium u otras entidades. La información en inglés sobre los ensayos clínicos patrocinados por el NCI se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación, se presenta un ejemplo de un ensayo clínico nacional o institucional en curso:
- APEC1621 (NCT03155620) (Pediatric MATCH: Targeted Therapy Directed by Genetic Testing in Treating Pediatric Patients with Relapsed or Refractory Advanced Solid Tumors, Non-Hodgkin Lymphomas, or Histiocytic Disorders): en el NCI-COG Pediatric Molecular Analysis for Therapeutic Choice (MATCH), que se conoce como Pediatric MATCH, se emparejarán fármacos dirigidos con cambios moleculares específicos identificados en el tumor (resistente al tratamiento o recidivante) de un paciente. Los niños y adolescentes de 1 a 21 años son aptos para participar en este ensayo.
Los pacientes que presentan tumores con variantes moleculares comprendidas en los grupos de tratamiento del Pediatric MATCH podrán inscribirse para recibir tratamiento en este ensayo. Para obtener más información en inglés, consultar el portal de Internet del NCI y el portal de Internet ClinicalTrials.gov.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Perilongo G, Carollo C, Salviati L, et al.: Diencephalic syndrome and disseminated juvenile pilocytic astrocytomas of the hypothalamic-optic chiasm region. Cancer 80 (1): 142-6, 1997. [PUBMED Abstract]
- Leibel SA, Sheline GE, Wara WM, et al.: The role of radiation therapy in the treatment of astrocytomas. Cancer 35 (6): 1551-7, 1975. [PUBMED Abstract]
- Ryall S, Zapotocky M, Fukuoka K, et al.: Integrated Molecular and Clinical Analysis of 1,000 Pediatric Low-Grade Gliomas. Cancer Cell 37 (4): 569-583.e5, 2020. [PUBMED Abstract]
- Udaka YT, Yeh-Nayre LA, Amene CS, et al.: Recurrent pediatric central nervous system low-grade gliomas: the role of surveillance neuroimaging in asymptomatic children. J Neurosurg Pediatr 11 (2): 119-26, 2013. [PUBMED Abstract]
- Parsons DW, Janeway KA, Patton DR, et al.: Actionable Tumor Alterations and Treatment Protocol Enrollment of Pediatric and Young Adult Patients With Refractory Cancers in the National Cancer Institute-Children's Oncology Group Pediatric MATCH Trial. J Clin Oncol 40 (20): 2224-2234, 2022. [PUBMED Abstract]
- Bowers DC, Krause TP, Aronson LJ, et al.: Second surgery for recurrent pilocytic astrocytoma in children. Pediatr Neurosurg 34 (5): 229-34, 2001. [PUBMED Abstract]
- Scheinemann K, Bartels U, Tsangaris E, et al.: Feasibility and efficacy of repeated chemotherapy for progressive pediatric low-grade gliomas. Pediatr Blood Cancer 57 (1): 84-8, 2011. [PUBMED Abstract]
- de Haas V, Grill J, Raquin MA, et al.: Relapses of optic pathway tumors after first-line chemotherapy. Pediatr Blood Cancer 52 (5): 575-80, 2009. [PUBMED Abstract]
- Merchant TE, Conklin HM, Wu S, et al.: Late effects of conformal radiation therapy for pediatric patients with low-grade glioma: prospective evaluation of cognitive, endocrine, and hearing deficits. J Clin Oncol 27 (22): 3691-7, 2009. [PUBMED Abstract]
- Marcus KJ, Goumnerova L, Billett AL, et al.: Stereotactic radiotherapy for localized low-grade gliomas in children: final results of a prospective trial. Int J Radiat Oncol Biol Phys 61 (2): 374-9, 2005. [PUBMED Abstract]
- Bitterman DS, MacDonald SM, Yock TI, et al.: Revisiting the Role of Radiation Therapy for Pediatric Low-Grade Glioma. J Clin Oncol 37 (35): 3335-3339, 2019. [PUBMED Abstract]
- Cherlow JM, Shaw DWW, Margraf LR, et al.: Conformal Radiation Therapy for Pediatric Patients with Low-Grade Glioma: Results from the Children's Oncology Group Phase 2 Study ACNS0221. Int J Radiat Oncol Biol Phys 103 (4): 861-868, 2019. [PUBMED Abstract]
- Packer RJ, Lange B, Ater J, et al.: Carboplatin and vincristine for recurrent and newly diagnosed low-grade gliomas of childhood. J Clin Oncol 11 (5): 850-6, 1993. [PUBMED Abstract]
- Gnekow AK, Falkenstein F, von Hornstein S, et al.: Long-term follow-up of the multicenter, multidisciplinary treatment study HIT-LGG-1996 for low-grade glioma in children and adolescents of the German Speaking Society of Pediatric Oncology and Hematology. Neuro Oncol 14 (10): 1265-84, 2012. [PUBMED Abstract]
- Lassaletta A, Scheinemann K, Zelcer SM, et al.: Phase II Weekly Vinblastine for Chemotherapy-Naïve Children With Progressive Low-Grade Glioma: A Canadian Pediatric Brain Tumor Consortium Study. J Clin Oncol 34 (29): 3537-3543, 2016. [PUBMED Abstract]
- de Marcellus C, Tauziède-Espariat A, Cuinet A, et al.: The role of irinotecan-bevacizumab as rescue regimen in children with low-grade gliomas: a retrospective nationwide study in 72 patients. J Neurooncol 157 (2): 355-364, 2022. [PUBMED Abstract]
- Warren KE, Vezina G, Krailo M, et al.: Phase II Randomized Trial of Lenalidomide in Children With Pilocytic Astrocytomas and Optic Pathway Gliomas: A Report From the Children's Oncology Group. J Clin Oncol 41 (18): 3374-3383, 2023. [PUBMED Abstract]
- Haas-Kogan DA, Aboian MS, Minturn JE, et al.: Everolimus for Children With Recurrent or Progressive Low-Grade Glioma: Results From the Phase II PNOC001 Trial. J Clin Oncol 42 (4): 441-451, 2024. [PUBMED Abstract]
- Franz DN, Agricola KD, Tudor CA, et al.: Everolimus for tumor recurrence after surgical resection for subependymal giant cell astrocytoma associated with tuberous sclerosis complex. J Child Neurol 28 (5): 602-7, 2013. [PUBMED Abstract]
- Krueger DA, Care MM, Holland K, et al.: Everolimus for subependymal giant-cell astrocytomas in tuberous sclerosis. N Engl J Med 363 (19): 1801-11, 2010. [PUBMED Abstract]
- Weidman DR, Pole JD, Bouffet E, et al.: Dose-level response rates of mTor inhibition in tuberous sclerosis complex (TSC) related subependymal giant cell astrocytoma (SEGA). Pediatr Blood Cancer 62 (10): 1754-60, 2015. [PUBMED Abstract]
- Franz DN, Leonard J, Tudor C, et al.: Rapamycin causes regression of astrocytomas in tuberous sclerosis complex. Ann Neurol 59 (3): 490-8, 2006. [PUBMED Abstract]
- Franz DN, Belousova E, Sparagana S, et al.: Efficacy and safety of everolimus for subependymal giant cell astrocytomas associated with tuberous sclerosis complex (EXIST-1): a multicentre, randomised, placebo-controlled phase 3 trial. Lancet 381 (9861): 125-32, 2013. [PUBMED Abstract]
- Franz DN, Agricola K, Mays M, et al.: Everolimus for subependymal giant cell astrocytoma: 5-year final analysis. Ann Neurol 78 (6): 929-38, 2015. [PUBMED Abstract]
- Wright KD, Yao X, London WB, et al.: A POETIC Phase II study of continuous oral everolimus in recurrent, radiographically progressive pediatric low-grade glioma. Pediatr Blood Cancer 68 (2): e28787, 2021. [PUBMED Abstract]
- Ullrich NJ, Prabhu SP, Reddy AT, et al.: A phase II study of continuous oral mTOR inhibitor everolimus for recurrent, radiographic-progressive neurofibromatosis type 1-associated pediatric low-grade glioma: a Neurofibromatosis Clinical Trials Consortium study. Neuro Oncol 22 (10): 1527-1535, 2020. [PUBMED Abstract]
- Avery RA, Hwang EI, Jakacki RI, et al.: Marked recovery of vision in children with optic pathway gliomas treated with bevacizumab. JAMA Ophthalmol 132 (1): 111-4, 2014. [PUBMED Abstract]
- Gururangan S, Fangusaro J, Poussaint TY, et al.: Efficacy of bevacizumab plus irinotecan in children with recurrent low-grade gliomas--a Pediatric Brain Tumor Consortium study. Neuro Oncol 16 (2): 310-7, 2014. [PUBMED Abstract]
- Hwang EI, Jakacki RI, Fisher MJ, et al.: Long-term efficacy and toxicity of bevacizumab-based therapy in children with recurrent low-grade gliomas. Pediatr Blood Cancer 60 (5): 776-82, 2013. [PUBMED Abstract]
- Packer RJ, Jakacki R, Horn M, et al.: Objective response of multiply recurrent low-grade gliomas to bevacizumab and irinotecan. Pediatr Blood Cancer 52 (7): 791-5, 2009. [PUBMED Abstract]
- Green K, Panagopoulou P, D'Arco F, et al.: A nationwide evaluation of bevacizumab-based treatments in pediatric low-grade glioma in the UK: Safety, efficacy, visual morbidity, and outcomes. Neuro Oncol 25 (4): 774-785, 2023. [PUBMED Abstract]
- Foster KA, Ares WJ, Pollack IF, et al.: Bevacizumab for symptomatic radiation-induced tumor enlargement in pediatric low grade gliomas. Pediatr Blood Cancer 62 (2): 240-245, 2015. [PUBMED Abstract]
- Zhukova N, Rajagopal R, Lam A, et al.: Use of bevacizumab as a single agent or in adjunct with traditional chemotherapy regimens in children with unresectable or progressive low-grade glioma. Cancer Med 8 (1): 40-50, 2019. [PUBMED Abstract]
- Sievert AJ, Lang SS, Boucher KL, et al.: Paradoxical activation and RAF inhibitor resistance of BRAF protein kinase fusions characterizing pediatric astrocytomas. Proc Natl Acad Sci U S A 110 (15): 5957-62, 2013. [PUBMED Abstract]
- Karajannis MA, Legault G, Fisher MJ, et al.: Phase II study of sorafenib in children with recurrent or progressive low-grade astrocytomas. Neuro Oncol 16 (10): 1408-16, 2014. [PUBMED Abstract]
- Odogwu L, Mathieu L, Blumenthal G, et al.: FDA Approval Summary: Dabrafenib and Trametinib for the Treatment of Metastatic Non-Small Cell Lung Cancers Harboring BRAF V600E Mutations. Oncologist 23 (6): 740-745, 2018. [PUBMED Abstract]
- Hargrave DR, Bouffet E, Tabori U, et al.: Efficacy and Safety of Dabrafenib in Pediatric Patients with BRAF V600 Mutation-Positive Relapsed or Refractory Low-Grade Glioma: Results from a Phase I/IIa Study. Clin Cancer Res 25 (24): 7303-7311, 2019. [PUBMED Abstract]
- Bouffet E, Geoerger B, Moertel C, et al.: Efficacy and Safety of Trametinib Monotherapy or in Combination With Dabrafenib in Pediatric BRAF V600-Mutant Low-Grade Glioma. J Clin Oncol 41 (3): 664-674, 2023. [PUBMED Abstract]
- Banerjee A, Jakacki RI, Onar-Thomas A, et al.: A phase I trial of the MEK inhibitor selumetinib (AZD6244) in pediatric patients with recurrent or refractory low-grade glioma: a Pediatric Brain Tumor Consortium (PBTC) study. Neuro Oncol 19 (8): 1135-1144, 2017. [PUBMED Abstract]
- Fangusaro J, Onar-Thomas A, Young Poussaint T, et al.: Selumetinib in paediatric patients with BRAF-aberrant or neurofibromatosis type 1-associated recurrent, refractory, or progressive low-grade glioma: a multicentre, phase 2 trial. Lancet Oncol 20 (7): 1011-1022, 2019. [PUBMED Abstract]
- Fangusaro J, Onar-Thomas A, Poussaint TY, et al.: A phase II trial of selumetinib in children with recurrent optic pathway and hypothalamic low-grade glioma without NF1: a Pediatric Brain Tumor Consortium study. Neuro Oncol 23 (10): 1777-1788, 2021. [PUBMED Abstract]
Tratamiento de los gliomas difusos de grado alto de tipo pediátrico
Para determinar y poner en práctica una atención óptima, el tratamiento a menudo está a cargo de un equipo multidisciplinario de especialistas con experiencia en el tratamiento de pacientes pediátricos con tumores de encéfalo.
El desenlace para los pacientes pediátricos con los tipos más comunes de glioma de grado alto (es decir, glioma difuso de línea media con alteración H3 K27 y glioma difuso de grado alto de tipo pediátrico con H3 natural e IDH natural) sigue siendo muy precario.[1] Por el contrario, el pronóstico para los niños con glioma hemisférico de tipo infantil es relativamente favorable.[2,3]
La máxima resección quirúrgica inocua se puede considerar como tratamiento estándar para todos los pacientes con glioma difuso de grado alto de tipo pediátrico.[4]
La terapia adyuvante estándar para niños con glioma difuso de grado alto de tipo pediátrico con H3 natural e IDH natural, incluye radioterapia y quimioterapia con alquilantes.[5-7]
Para los niños con glioma difuso de línea media con alteración H3 K27 (el subtipo más frecuente), incluso aquellos con glioma pontino intrínseco difuso (GPID), la radioterapia adyuvante sola se puede considerar como el tratamiento estándar dada la aparente falta de beneficio de la quimioterapia.[8,9]
Las opciones de tratamiento estándar para los gliomas difusos de grado alto de tipo pediátrico recién diagnosticados son las siguientes:
Cirugía
La extensión de la resección tumoral en el momento del diagnóstico inicial se relaciona de manera positiva con la supervivencia. Por lo tanto, se recomienda la máxima resección quirúrgica inocua para niños con tumores fuera de la protuberancia.[4,10,11]
En los niños con glioma difuso de línea media en la protuberancia (DIPG), se obtiene cada vez más confirmación histológica, tanto para la inscripción en estudios de investigación como para la caracterización molecular del tumor.[12] Los nuevos abordajes de la biopsia estereotáctica con aguja pueden hacerla más inocua.[13-16] Dadas las dificultades técnicas de las biopsias de la protuberancia, es preferible que las realice un neurocirujano pediátrico con experiencia para minimizar el riesgo de complicaciones neurológicas irreversibles.[13-17] Se recomienda la biopsia para los tumores pontinos cuando no se obtiene un diagnóstico definitivo con los resultados de las imágenes.
Terapia adyuvante
Radioterapia
Para los pacientes con glioma difuso de línea media con alteración H3 K27 y glioma difuso de grado alto de tipo pediátrico con H3 natural e IDH natural, la radioterapia focal se administra de forma rutinaria en un campo que incluye con amplitud todo el tumor. La dosis de radioterapia dirigida al lecho tumoral suele ser de, por lo menos, 54 Gy. A pesar de dicho tratamiento, el pronóstico es muy precario. De manera similar, se observa una supervivencia precaria en niños con tumores primarios de médula espinal y en niños con gliomas talámicos de grado alto (es decir, gliomas difusos de línea media, tumores con variante H3 K27M) tratados con radioterapia.[18,19]; [20,21][Nivel de evidencia C1]
El tratamiento estándar para los niños con gliomas difusos de línea media centrados en la protuberancia es la radioterapia dirigida al sitio afectado. La dosis convencional de radiación oscila entre 54 Gy y 60 Gy y se administra localmente en el sitio del tumor primario en fracciones simples diarias. Este tratamiento dará como resultado un beneficio transitorio para la mayoría de los pacientes, pero más del 90 % de los pacientes morirán dentro de los 18 meses posteriores al diagnóstico.[22]
Los cambios inducidos por la radiación pueden surgir unos pocos meses después de la finalización de la radioterapia y simular una progresión tumoral. Cuando se considera la eficacia de un tratamiento adicional, se debe tener cuidado para diferenciar el cambio inducido por la radiación de la enfermedad progresiva.[23]
En los estudios de investigación en los que se evaluó la eficacia de la radioterapia hiperfraccionada e hipofraccionada y de los radiosensibilizadores no se han demostrado mejores resultados con el uso de estas técnicas de radiación.
- Radioterapia hiperfraccionada (2 veces al día). Se han completado estudios con dosis de hasta 78 Gy. La evidencia demuestra que el aumento de las dosis de radioterapia no mejora la duración ni la tasa de supervivencia de los pacientes con DIPG, tanto si se administran solas [24,25] como si se hace en combinación con quimioterapia, y se relacionaron con un aumento de la toxicidad en las dosis más altas.[26]
- Radioterapia hipofraccionada. Esta técnica produce tasas de supervivencia comparables con las técnicas convencionales de radioterapia fraccionada y, posiblemente, con menos carga de tratamiento.[27]; [28][Nivel de evidencia A1]; [22,29][Nivel de evidencia B4] En un estudio aleatorizado se compararon 3 fracciones de radioterapia (39 Gy en 13 fracciones, 45 Gy en 15 fracciones y 54 Gy en 30 fracciones). En el estudio se concluyó que el régimen hipofraccionado más alto fue inferior, quizás debido al aumento de la toxicidad.[30]
- Radiosensibilizadores. Se completaron estudios en los que se evaluó la eficacia de varios radiosensibilizadores como medio para mejorar el efecto terapéutico de la radioterapia, pero no se observó ninguna mejora significativa en el desenlace.[25,26,31-34]
Quimioterapia
En un ensayo prospectivo aleatorizado, no se probó de manera formal el beneficio de la radioterapia con quimioterapia adyuvante, en comparación con la radioterapia sola, en pacientes con glioma difuso de grado alto de tipo pediátrico con H3 natural e IDH natural. Sin embargo, los datos agregados de numerosos ensayos clínicos prospectivos no aleatorizados para niños con gliomas de grado alto indican un beneficio de la quimioterapia alquilante, similar al de los adultos con glioblastoma primario. Por lo tanto, la terapia adyuvante con una combinación de radioterapia y quimioterapia con alquilantes se puede considerar como el tratamiento estándar. Los regímenes de quimioterapia utilizados habitualmente incluyen temozolomida sola o en combinación con lomustina.[5,6]
En ensayos clínicos prospectivos aleatorizados en adultos con glioblastoma primario se ha determinado que la hipermetilación del promotor de MGMT es un biomarcador pronóstico independiente, con independencia del tratamiento, así como un biomarcador predictivo para el beneficio de la temozolomida.[35,36] Sin embargo, en los niños con glioma difuso de grado alto de tipo pediátrico con H3 natural e IDH natural, el estado de metilación del promotor de MGMT no es pronóstico,[8,37] y se desconoce su valor predictivo del beneficio de la quimioterapia con alquilantes, dada la falta de datos aleatorizados aplicables.
En un ensayo prospectivo aleatorizado, el uso de bevacizumab adyuvante después de la radioterapia no prolongó la supervivencia general (SG) ni la supervivencia sin progresión (SSP) en pacientes pediátricos con gliomas de grado alto recién diagnosticados.[7]
Ningún tipo de quimioterapia (incluso quimioterapia neoadyuvante, simultánea o posradioterapia) o de estrategia de inmunoterapia, cuando se agrega a la radioterapia, ha logrado la supervivencia a largo plazo de los niños con DIPG.[38-40]; [41][Nivel de evidencia B4] Lo anterior incluye el tratamiento con dosis altas de quimioterapia mielosupresora y rescate autógeno de células madre hematopoyéticas, que ha demostrado que no es eficaz para prolongar la supervivencia.[42] Sin embargo, de manera similar al tratamiento de otros tumores de encéfalo, por lo general se omite la radioterapia para los lactantes con DIPG y se usan abordajes de quimioterapia sola. Se carece de datos publicados que respalden la utilidad de este abordaje.
Los niños con gliomas hemisféricos de tipo infantil se clasificaron en tres grupos.[43] Los tumores del grupo 1 son los gliomas de grado alto que son hemisféricos y desencadenados por alteraciones en receptores tirosina–cinasa (RTK), como las causadas por las fusiones de genes ALK, NTRK, ROS1 y MET. Antes, los lactantes con estos tumores se trataron con quimioterapia adyuvante multifarmacológica, en lugar de radioterapia, con desenlaces relativamente favorables.[9,44]
Terapia dirigida
Hay variantes somáticas BRAF V600E que se pueden usar como diana terapéutica en un subgrupo pequeño de pacientes con gliomas difusos de grado alto de tipo pediátrico. Los datos de un estudio retrospectivo no aleatorizado indican que la inclusión inicial de la terapia con inhibidores de BRAF o de MEK, en lugar de quimioterapia, puede mejorar la supervivencia.[45][Nivel de evidencia C2]
Existe evidencia de que los lactantes con gliomas hemisféricos de grado alto del grupo 1 que tienen fusiones génicas oncoiniciadoras específicas de RTK responden a las terapias dirigidas a RTK.[43,46] En un análisis de subgrupo se incluyeron 33 pacientes con tumores del sistema nervioso central positivos para la fusión de NTRK que se trataron con larotrectinib (formaban parte de 2 ensayos más grandes en los que se incluyeron niños y adultos con tumores sólidos y fusiones de NTRK).[47] La tasa de respuesta objetiva fue del 30 %, y el 82 % de los pacientes con enfermedad cuantificable presentó reducción del tumor. La tasa de duración de la respuesta a 12 meses fue del 75 %, la tasa de SSP fue del 56 % y la tasa de SG fue del 85 %.[47] La función de los inhibidores de RTK en el tratamiento inicial de los lactantes con glioma difuso de grado alto de tipo pediátrico continúa en estudio.
Inmunoterapia
Los niños con deficiencia hereditaria bialélica en la reparación de errores de emparejamiento de bases tienen una carga mutacional muy alta y expresión de antígenos nuevos. Estos pacientes tienen riesgo de presentar diferentes tipos de cáncer, como neoplasias malignas hematológicas, cánceres gastrointestinales y gliomas de grado alto. La carga mutacional alta y de neoantígenos se ha relacionado con una respuesta superior a la inhibición de puntos de control inmunitario. En los primeros informes de casos se observaron respuestas clínicas en las imágenes de niños tratados con un inhibidor de la proteína de muerte programada-1.[48]
Opciones de tratamiento en evaluación clínica
Tal vez haya ensayos clínicos terapéuticos para pacientes seleccionados. Es posible que estos ensayos estén disponibles a través del Children’s Oncology Group (COG), el Pediatric Brain Tumor Consortium u otras entidades. La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación, se presenta un ejemplo de un ensayo clínico nacional o institucional en curso:
- ACNS1723 (NCT03919071)(Dabrafenib Combined With Trametinib After Radiation Therapy in Treating Patients With Newly-Diagnosed High-Grade Glioma): en este ensayo de fase II se investiga el uso de la combinación de dabrafenib y trametinib después de la radioterapia en niños y adultos jóvenes con gliomas de grado alto que tienen una variante BRAFV600.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Mackay A, Burford A, Carvalho D, et al.: Integrated Molecular Meta-Analysis of 1,000 Pediatric High-Grade and Diffuse Intrinsic Pontine Glioma. Cancer Cell 32 (4): 520-537.e5, 2017. [PUBMED Abstract]
- Clarke M, Mackay A, Ismer B, et al.: Infant High-Grade Gliomas Comprise Multiple Subgroups Characterized by Novel Targetable Gene Fusions and Favorable Outcomes. Cancer Discov 10 (7): 942-963, 2020. [PUBMED Abstract]
- Guerreiro Stucklin AS, Ryall S, Fukuoka K, et al.: Alterations in ALK/ROS1/NTRK/MET drive a group of infantile hemispheric gliomas. Nat Commun 10 (1): 4343, 2019. [PUBMED Abstract]
- Hatoum R, Chen JS, Lavergne P, et al.: Extent of Tumor Resection and Survival in Pediatric Patients With High-Grade Gliomas: A Systematic Review and Meta-analysis. JAMA Netw Open 5 (8): e2226551, 2022. [PUBMED Abstract]
- Cohen KJ, Pollack IF, Zhou T, et al.: Temozolomide in the treatment of high-grade gliomas in children: a report from the Children's Oncology Group. Neuro Oncol 13 (3): 317-23, 2011. [PUBMED Abstract]
- Jakacki RI, Cohen KJ, Buxton A, et al.: Phase 2 study of concurrent radiotherapy and temozolomide followed by temozolomide and lomustine in the treatment of children with high-grade glioma: a report of the Children's Oncology Group ACNS0423 study. Neuro Oncol 18 (10): 1442-50, 2016. [PUBMED Abstract]
- Grill J, Massimino M, Bouffet E, et al.: Phase II, Open-Label, Randomized, Multicenter Trial (HERBY) of Bevacizumab in Pediatric Patients With Newly Diagnosed High-Grade Glioma. J Clin Oncol 36 (10): 951-958, 2018. [PUBMED Abstract]
- Korshunov A, Ryzhova M, Hovestadt V, et al.: Integrated analysis of pediatric glioblastoma reveals a subset of biologically favorable tumors with associated molecular prognostic markers. Acta Neuropathol 129 (5): 669-78, 2015. [PUBMED Abstract]
- Macy ME, Birks DK, Barton VN, et al.: Clinical and molecular characteristics of congenital glioblastoma. Neuro Oncol 14 (7): 931-41, 2012. [PUBMED Abstract]
- Wisoff JH, Boyett JM, Berger MS, et al.: Current neurosurgical management and the impact of the extent of resection in the treatment of malignant gliomas of childhood: a report of the Children's Cancer Group trial no. CCG-945. J Neurosurg 89 (1): 52-9, 1998. [PUBMED Abstract]
- Yang T, Temkin N, Barber J, et al.: Gross total resection correlates with long-term survival in pediatric patients with glioblastoma. World Neurosurg 79 (3-4): 537-44, 2013 Mar-Apr. [PUBMED Abstract]
- Walker DA, Liu J, Kieran M, et al.: A multi-disciplinary consensus statement concerning surgical approaches to low-grade, high-grade astrocytomas and diffuse intrinsic pontine gliomas in childhood (CPN Paris 2011) using the Delphi method. Neuro Oncol 15 (4): 462-8, 2013. [PUBMED Abstract]
- Cage TA, Samagh SP, Mueller S, et al.: Feasibility, safety, and indications for surgical biopsy of intrinsic brainstem tumors in children. Childs Nerv Syst 29 (8): 1313-9, 2013. [PUBMED Abstract]
- Grill J, Puget S, Andreiuolo F, et al.: Critical oncogenic mutations in newly diagnosed pediatric diffuse intrinsic pontine glioma. Pediatr Blood Cancer 58 (4): 489-91, 2012. [PUBMED Abstract]
- Puget S, Beccaria K, Blauwblomme T, et al.: Biopsy in a series of 130 pediatric diffuse intrinsic Pontine gliomas. Childs Nerv Syst 31 (10): 1773-80, 2015. [PUBMED Abstract]
- Gupta N, Goumnerova LC, Manley P, et al.: Prospective feasibility and safety assessment of surgical biopsy for patients with newly diagnosed diffuse intrinsic pontine glioma. Neuro Oncol 20 (11): 1547-1555, 2018. [PUBMED Abstract]
- Pfaff E, El Damaty A, Balasubramanian GP, et al.: Brainstem biopsy in pediatric diffuse intrinsic pontine glioma in the era of precision medicine: the INFORM study experience. Eur J Cancer 114: 27-35, 2019. [PUBMED Abstract]
- Kramm CM, Butenhoff S, Rausche U, et al.: Thalamic high-grade gliomas in children: a distinct clinical subset? Neuro Oncol 13 (6): 680-9, 2011. [PUBMED Abstract]
- Tendulkar RD, Pai Panandiker AS, Wu S, et al.: Irradiation of pediatric high-grade spinal cord tumors. Int J Radiat Oncol Biol Phys 78 (5): 1451-6, 2010. [PUBMED Abstract]
- Wolff B, Ng A, Roth D, et al.: Pediatric high grade glioma of the spinal cord: results of the HIT-GBM database. J Neurooncol 107 (1): 139-46, 2012. [PUBMED Abstract]
- Ononiwu C, Mehta V, Bettegowda C, et al.: Pediatric spinal glioblastoma multiforme: current treatment strategies and possible predictors of survival. Childs Nerv Syst 28 (5): 715-20, 2012. [PUBMED Abstract]
- Janssens GO, Jansen MH, Lauwers SJ, et al.: Hypofractionation vs conventional radiation therapy for newly diagnosed diffuse intrinsic pontine glioma: a matched-cohort analysis. Int J Radiat Oncol Biol Phys 85 (2): 315-20, 2013. [PUBMED Abstract]
- Liu AK, Macy ME, Foreman NK: Bevacizumab as therapy for radiation necrosis in four children with pontine gliomas. Int J Radiat Oncol Biol Phys 75 (4): 1148-54, 2009. [PUBMED Abstract]
- Freeman CR, Krischer JP, Sanford RA, et al.: Final results of a study of escalating doses of hyperfractionated radiotherapy in brain stem tumors in children: a Pediatric Oncology Group study. Int J Radiat Oncol Biol Phys 27 (2): 197-206, 1993. [PUBMED Abstract]
- Mandell LR, Kadota R, Freeman C, et al.: There is no role for hyperfractionated radiotherapy in the management of children with newly diagnosed diffuse intrinsic brainstem tumors: results of a Pediatric Oncology Group phase III trial comparing conventional vs. hyperfractionated radiotherapy. Int J Radiat Oncol Biol Phys 43 (5): 959-64, 1999. [PUBMED Abstract]
- Allen J, Siffert J, Donahue B, et al.: A phase I/II study of carboplatin combined with hyperfractionated radiotherapy for brainstem gliomas. Cancer 86 (6): 1064-9, 1999. [PUBMED Abstract]
- Izzuddeen Y, Gupta S, Haresh KP, et al.: Hypofractionated radiotherapy with temozolomide in diffuse intrinsic pontine gliomas: a randomized controlled trial. J Neurooncol 146 (1): 91-95, 2020. [PUBMED Abstract]
- Zaghloul MS, Eldebawy E, Ahmed S, et al.: Hypofractionated conformal radiotherapy for pediatric diffuse intrinsic pontine glioma (DIPG): a randomized controlled trial. Radiother Oncol 111 (1): 35-40, 2014. [PUBMED Abstract]
- Negretti L, Bouchireb K, Levy-Piedbois C, et al.: Hypofractionated radiotherapy in the treatment of diffuse intrinsic pontine glioma in children: a single institution's experience. J Neurooncol 104 (3): 773-7, 2011. [PUBMED Abstract]
- Zaghloul MS, Nasr A, Tolba M, et al.: Hypofractionated Radiation Therapy For Diffuse Intrinsic Pontine Glioma: A Noninferiority Randomized Study Including 253 Children. Int J Radiat Oncol Biol Phys 113 (2): 360-368, 2022. [PUBMED Abstract]
- Freeman CR, Kepner J, Kun LE, et al.: A detrimental effect of a combined chemotherapy-radiotherapy approach in children with diffuse intrinsic brain stem gliomas? Int J Radiat Oncol Biol Phys 47 (3): 561-4, 2000. [PUBMED Abstract]
- Broniscer A, Leite CC, Lanchote VL, et al.: Radiation therapy and high-dose tamoxifen in the treatment of patients with diffuse brainstem gliomas: results of a Brazilian cooperative study. Brainstem Glioma Cooperative Group. J Clin Oncol 18 (6): 1246-53, 2000. [PUBMED Abstract]
- Doz F, Neuenschwander S, Bouffet E, et al.: Carboplatin before and during radiation therapy for the treatment of malignant brain stem tumours: a study by the Société Française d'Oncologie Pédiatrique. Eur J Cancer 38 (6): 815-9, 2002. [PUBMED Abstract]
- Bradley KA, Zhou T, McNall-Knapp RY, et al.: Motexafin-gadolinium and involved field radiation therapy for intrinsic pontine glioma of childhood: a children's oncology group phase 2 study. Int J Radiat Oncol Biol Phys 85 (1): e55-60, 2013. [PUBMED Abstract]
- Stupp R, Mason WP, van den Bent MJ, et al.: Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 352 (10): 987-96, 2005. [PUBMED Abstract]
- Hegi ME, Diserens AC, Gorlia T, et al.: MGMT gene silencing and benefit from temozolomide in glioblastoma. N Engl J Med 352 (10): 997-1003, 2005. [PUBMED Abstract]
- Mackay A, Burford A, Molinari V, et al.: Molecular, Pathological, Radiological, and Immune Profiling of Non-brainstem Pediatric High-Grade Glioma from the HERBY Phase II Randomized Trial. Cancer Cell 33 (5): 829-842.e5, 2018. [PUBMED Abstract]
- Frappaz D, Schell M, Thiesse P, et al.: Preradiation chemotherapy may improve survival in pediatric diffuse intrinsic brainstem gliomas: final results of BSG 98 prospective trial. Neuro Oncol 10 (4): 599-607, 2008. [PUBMED Abstract]
- Frazier JL, Lee J, Thomale UW, et al.: Treatment of diffuse intrinsic brainstem gliomas: failed approaches and future strategies. J Neurosurg Pediatr 3 (4): 259-69, 2009. [PUBMED Abstract]
- Hargrave D, Bartels U, Bouffet E: Diffuse brainstem glioma in children: critical review of clinical trials. Lancet Oncol 7 (3): 241-8, 2006. [PUBMED Abstract]
- Warren K, Bent R, Wolters PL, et al.: A phase 2 study of pegylated interferon α-2b (PEG-Intron(®)) in children with diffuse intrinsic pontine glioma. Cancer 118 (14): 3607-13, 2012. [PUBMED Abstract]
- Bouffet E, Raquin M, Doz F, et al.: Radiotherapy followed by high dose busulfan and thiotepa: a prospective assessment of high dose chemotherapy in children with diffuse pontine gliomas. Cancer 88 (3): 685-92, 2000. [PUBMED Abstract]
- Waters TW, Moore SA, Sato Y, et al.: Refractory infantile high-grade glioma containing TRK-fusion responds to larotrectinib. Pediatr Blood Cancer 68 (5): e28868, 2021. [PUBMED Abstract]
- Duffner PK, Horowitz ME, Krischer JP, et al.: Postoperative chemotherapy and delayed radiation in children less than three years of age with malignant brain tumors. N Engl J Med 328 (24): 1725-31, 1993. [PUBMED Abstract]
- Nobre L, Zapotocky M, Ramaswamy V, et al.: Outcomes of BRAF V600E Pediatric Gliomas Treated With Targeted BRAF Inhibition. JCO Precis Oncol 4: , 2020. [PUBMED Abstract]
- Ziegler DS, Wong M, Mayoh C, et al.: Brief Report: Potent clinical and radiological response to larotrectinib in TRK fusion-driven high-grade glioma. Br J Cancer 119 (6): 693-696, 2018. [PUBMED Abstract]
- Doz F, van Tilburg CM, Geoerger B, et al.: Efficacy and safety of larotrectinib in TRK fusion-positive primary central nervous system tumors. Neuro Oncol 24 (6): 997-1007, 2022. [PUBMED Abstract]
- Bouffet E, Larouche V, Campbell BB, et al.: Immune Checkpoint Inhibition for Hypermutant Glioblastoma Multiforme Resulting From Germline Biallelic Mismatch Repair Deficiency. J Clin Oncol 34 (19): 2206-11, 2016. [PUBMED Abstract]
Tratamiento de los gliomas difusos de grado alto de tipo pediátrico recidivantes
Para determinar y poner en práctica una atención óptima, el tratamiento a menudo está a cargo de un equipo multidisciplinario de especialistas con experiencia en el tratamiento de pacientes pediátricos con tumores de encéfalo.
Las opciones de tratamiento de los gliomas difusos de grado alto de tipo pediátrico recidivantes son las siguientes:
Segunda cirugía
El uso de una intervención quirúrgica se debe personalizar a partir de los siguientes aspectos:
- Tipo de tumor inicial.
- Intervalo entre el tratamiento inicial y la reaparición de la lesión expansiva.
- Localización del tumor recidivante.
- Consideraciones terapéuticas según la necesidad de tejido tumoral fresco o para administrar tratamiento en el lecho quirúrgico.
- En la mayoría de los casos de gliomas difusos de línea media centrados en la protuberancia (DIPG) (glioma pontino intrínseco difuso [GPID]) no es necesaria, ni se recomienda, la biopsia en el momento de la progresión clínica o radiológica. Es posible considerar una biopsia para confirmar la recaída cuando, durante la evaluación de diagnóstico diferencial, se identifica afectación del tronco encefálico relacionada con el tratamiento, que a veces es indistinguible clínicamente de la recaída del tumor. Otras pruebas, como la tomografía por emisión de positrones, la espectroscopia por resonancia magnética y la tomografía computarizada por emisión de fotón único, todavía no son fiables para diferenciar la necrosis de la recidiva tumoral en los pacientes con DIPG previamente irradiado.
Radioterapia
La radioterapia es apropiada para los pacientes que no la recibieron antes. Las dosis y los volúmenes de radiación son similares a los que se usan para pacientes con diagnóstico reciente. En general, esto se limita para los niños pequeños tratados al inicio con estrategias que no incluían la radioterapia.
Para los pacientes con gliomas de grado alto de tipo pediátrico que no afectan el tronco encefálico y que previamente recibieron irradiación, se ha utilizado la reirradiación, aunque los datos que demuestran algún beneficio son escasos. Es posible considerar el uso de la radiocirugía estereotáctica (RCE) o la radioterapia estereotáctica (RTE) con técnicas que emplean radioterapia hipofraccionada o tamaños de fracción estándar. Para lesiones delimitadas de volumen bajo, la RCE permite evitar la irradiación a la mayor cantidad de tejido normal. Para lesiones más infiltrantes, la radioterapia fraccionada puede preservar mejor los tejidos normales.[1]
En los pacientes con DIPG, se observó que la reirradiación prolonga la supervivencia y se considera en el momento de la progresión en los niños que tuvieron una respuesta inicial a la radioterapia.[2,3] En un estudio de fase I/II de 12 pacientes tratados con tres niveles de dosis (12 fracciones de 24 Gy, 12 fracciones de 26,5 Gy o 14 fracciones de 30,8 Gy), casi todos los pacientes mejoraron. En el análisis de utilidad clínica se mostró que el régimen preferible era el de 24 Gy,[4] mientras que en una encuesta reciente se confirmó el uso eficaz de dosis incluso más bajas (por ejemplo, 12 Gy fraccionados). Estas dosis son beneficiosas y permiten cursos adicionales de radioterapia.[5]
Terapia dirigida
Hay variantes somáticas BRAF V600E en un subgrupo pequeño de pacientes. Si bien muchos de estos tumores responden a los inhibidores de BRAF o MEK, las respuestas en el entorno recidivante, por lo general, no se mantienen a largo plazo. En una serie retrospectiva se notificó una mediana de supervivencia sin progresión de alrededor de 3 meses.[6] En un ensayo multicéntrico y sin enmascaramiento de fase II, en el que se evaluaron dabrafenib y trametinib, 15 de 45 pacientes adultos con gliomas de grado alto con variantes BRAF V600E tuvieron una respuesta objetiva. Se produjeron 3 respuestas completas y 12 respuestas parciales, con una mediana de supervivencia general de 17,6 meses.[7]
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó la combinación de dabrafenib (inhibidor de BRAF) y trametinib (inhibidor de MEK) para pacientes adultos y pediátricos de 1 año o más con tumores sólidos irresecables o metastásicos con variantes BRAF V600E que progresaron después de un tratamiento anterior y que no cuentan con alternativas de tratamiento adecuadas.[8,9] Esta aprobación incluye pacientes pediátricos de 1 año o más con gliomas de grado alto que presentan la variante BRAF V600E. La aprobación para esta población de pacientes se otorgó teniendo en cuenta los resultados que se describen a continuación:[8-10]
- La combinación de dabrafenib y trametinib se estudió en 41 pacientes pediátricos con gliomas de grado alto en recaída o progresivos.
- La mediana de edad de los pacientes inscritos fue de 13 años.
- La tasa de respuesta objetiva fue del 56 % (intervalo de confianza [IC] 95 %, 39,7–71,5 %).
- De los 23 pacientes que lograron respuestas objetivas, el 48 % tuvo una duración de la respuesta de 12 meses o más y el 22 % tuvo una duración de la respuesta de 24 meses o más.
Las fusiones génicas activadoras (ALK, NTRK1, NTRK2, NTRK3, ROS1 y MET) son características de los gliomas difusos de tipo infantil.[11,12] Los datos de informes de casos y ensayos clínicos prospectivos recientes indican que estos tumores responden bien a las terapias dirigidas.[13]
La secuenciación de la muestra tumoral se hizo en pacientes pediátricos (n = 54) y adultos jóvenes (n = 15) con gliomas de grado alto recidivantes o resistentes al tratamiento que se inscribieron en el ensayo Pediatric MATCH del Children's Oncology Group (COG) del Instituto Nacional del Cáncer (NCI). En la prueba se encontraron alteraciones genómicas que se consideraron dianas terapéuticas en grupos del estudio MATCH en 36 de 69 tumores (52,2 %).[14] Se detectaron alteraciones en los genes de la vía MAPK en 17 de 69 tumores (24,6 %), con mayor frecuencia fusiones o variantes BRAF V600E (n = 11, 15,9 %). También se identificaron variantes o fusiones de FGFR1 en 6 de 69 tumores (8,7 %).
Inmunoterapia
En numerosos estudios se investiga varias estrategias de inmunoterapia, como inhibidores de puntos de control, virus oncolíticos, células T con receptor de antígeno quimérico (CAR) y otras estrategias de modulación inmunitaria. Está en estudio la utilidad de estas estrategias en el tratamiento de pacientes con gliomas difusos de grado alto de tipo pediátrico recidivantes, con evidencia preliminar de actividad en algunos entornos.[15,16]
Opciones de tratamiento en evaluación clínica
En la actualidad se estudia la función de la inhibición de los puntos de control inmunitario en el tratamiento de los niños con astrocitoma de grado alto recidivante. Los niños con deficiencia bialélica en la reparación de errores de emparejamiento presentan una carga mutacional muy alta con expresión de neoantígenos, lo que conlleva riesgo de varios tipos de cáncer; entre ellos, neoplasias hematológicas, cánceres gastrointestinales y tumores de encéfalo. La carga de variantes alta y de neoantígenos se ha correlacionado con buena respuesta a la inhibición de los puntos de control inmunitario. En los primeros informes de casos se observaron respuestas clínicas y radiográficas en niños tratados con un inhibidor de la proteína de muerte programada-1.[17]
Los pacientes en quienes fracasa el tratamiento inicial, quizás se beneficien de tratamiento adicional, incluso de la participación en ensayos clínicos de abordajes terapéuticos nuevos.[18] Es posible que estén disponibles ensayos terapéuticos en fase temprana para pacientes seleccionados. Estos ensayos quizás estén disponibles a través del COG, el Pediatric Brain Tumor Consortium u otras entidades. La información en inglés sobre los ensayos clínicos patrocinados por el NCI se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación, se presenta un ejemplo de un ensayo clínico nacional o institucional en curso:
- APEC1621 (NCT03155620) (Pediatric MATCH: Targeted Therapy Directed by Genetic Testing in Treating Pediatric Patients with Relapsed or Refractory Advanced Solid Tumors, Non-Hodgkin Lymphomas, or Histiocytic Disorders): en el NCI-COG Pediatric Molecular Analysis for Therapeutic Choice (MATCH), que se conoce como Pediatric MATCH, se emparejarán fármacos dirigidos con cambios moleculares específicos identificados en el tumor (resistente al tratamiento o recidivante) de un paciente. Los niños y adolescentes de 1 a 21 años son aptos para participar en este ensayo.
Los pacientes que presentan tumores con variantes moleculares comprendidas en los grupos de tratamiento del Pediatric MATCH podrán inscribirse para recibir tratamiento en este ensayo. Para obtener más información en inglés, consultar el portal de Internet del NCI y el portal de Internet ClinicalTrials.gov.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Tsang DS, Oliveira C, Bouffet E, et al.: Repeat irradiation for children with supratentorial high-grade glioma. Pediatr Blood Cancer 66 (9): e27881, 2019. [PUBMED Abstract]
- Janssens GO, Gandola L, Bolle S, et al.: Survival benefit for patients with diffuse intrinsic pontine glioma (DIPG) undergoing re-irradiation at first progression: A matched-cohort analysis on behalf of the SIOP-E-HGG/DIPG working group. Eur J Cancer 73: 38-47, 2017. [PUBMED Abstract]
- Lassaletta A, Strother D, Laperriere N, et al.: Reirradiation in patients with diffuse intrinsic pontine gliomas: The Canadian experience. Pediatr Blood Cancer 65 (6): e26988, 2018. [PUBMED Abstract]
- Amsbaugh MJ, Mahajan A, Thall PF, et al.: A Phase 1/2 Trial of Reirradiation for Diffuse Intrinsic Pontine Glioma. Int J Radiat Oncol Biol Phys 104 (1): 144-148, 2019. [PUBMED Abstract]
- Cacciotti C, Liu KX, Haas-Kogan DA, et al.: Reirradiation practices for children with diffuse intrinsic pontine glioma. Neurooncol Pract 8 (1): 68-74, 2021. [PUBMED Abstract]
- Nobre L, Zapotocky M, Ramaswamy V, et al.: Outcomes of BRAF V600E Pediatric Gliomas Treated With Targeted BRAF Inhibition. JCO Precis Oncol 4: , 2020. [PUBMED Abstract]
- Wen PY, Stein A, van den Bent M, et al.: Dabrafenib plus trametinib in patients with BRAFV600E-mutant low-grade and high-grade glioma (ROAR): a multicentre, open-label, single-arm, phase 2, basket trial. Lancet Oncol 23 (1): 53-64, 2022. [PUBMED Abstract]
- Novartis Pharmaceuticals Corporation: TAFINLAR (dabrafenib): Prescribing Information. East Hanover, New Jersey: Novartis Pharmaceuticals Corporation, 2023. Available online. Last accessed February 7, 2024.
- Novartis Pharmaceuticals Corporation: MEKINIST (trametinib): Prescribing Information. East Hanover, New Jersey: Novartis Pharmaceuticals Corporation, 2023. Available online. Last accessed February 7, 2024.
- Hargrave DR, Terashima K, Hara J, et al.: Phase II Trial of Dabrafenib Plus Trametinib in Relapsed/Refractory BRAF V600-Mutant Pediatric High-Grade Glioma. J Clin Oncol 41 (33): 5174-5183, 2023. [PUBMED Abstract]
- Clarke M, Mackay A, Ismer B, et al.: Infant High-Grade Gliomas Comprise Multiple Subgroups Characterized by Novel Targetable Gene Fusions and Favorable Outcomes. Cancer Discov 10 (7): 942-963, 2020. [PUBMED Abstract]
- Guerreiro Stucklin AS, Ryall S, Fukuoka K, et al.: Alterations in ALK/ROS1/NTRK/MET drive a group of infantile hemispheric gliomas. Nat Commun 10 (1): 4343, 2019. [PUBMED Abstract]
- Desai AV, Robinson GW, Gauvain K, et al.: Entrectinib in children and young adults with solid or primary CNS tumors harboring NTRK, ROS1, or ALK aberrations (STARTRK-NG). Neuro Oncol 24 (10): 1776-1789, 2022. [PUBMED Abstract]
- Parsons DW, Janeway KA, Patton DR, et al.: Actionable Tumor Alterations and Treatment Protocol Enrollment of Pediatric and Young Adult Patients With Refractory Cancers in the National Cancer Institute-Children's Oncology Group Pediatric MATCH Trial. J Clin Oncol 40 (20): 2224-2234, 2022. [PUBMED Abstract]
- Friedman GK, Johnston JM, Bag AK, et al.: Oncolytic HSV-1 G207 Immunovirotherapy for Pediatric High-Grade Gliomas. N Engl J Med 384 (17): 1613-1622, 2021. [PUBMED Abstract]
- Majzner RG, Ramakrishna S, Yeom KW, et al.: GD2-CAR T cell therapy for H3K27M-mutated diffuse midline gliomas. Nature 603 (7903): 934-941, 2022. [PUBMED Abstract]
- Bouffet E, Larouche V, Campbell BB, et al.: Immune Checkpoint Inhibition for Hypermutant Glioblastoma Multiforme Resulting From Germline Biallelic Mismatch Repair Deficiency. J Clin Oncol 34 (19): 2206-11, 2016. [PUBMED Abstract]
- Warren KE, Gururangan S, Geyer JR, et al.: A phase II study of O6-benzylguanine and temozolomide in pediatric patients with recurrent or progressive high-grade gliomas and brainstem gliomas: a Pediatric Brain Tumor Consortium study. J Neurooncol 106 (3): 643-9, 2012. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (07/03/2024)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se añadió Das et al como referencia 21.
Se añadió texto para indicar que en los gliomas que se presentan en niños mayores y en adultos se han notificado fusiones génicas de ROS1. En un metanálisis retrospectivo en el que se incluyeron 40 niños mayores de 1 año se encontró que las fusiones génicas de ROS1 se presentaron en gliomas de diferentes tipos histológicos, incluso en gliomas difusos de grado alto y de grado bajo, así como en tumores glioneuronales. Al igual que en los casos con alteraciones de ROS1 que se presentan en lactantes, las variantes tumorales de otros genes oncoiniciadores conocidos fueron infrecuentes. Sin embargo, las alteraciones del número de copias en el genoma del tumor fueron más frecuentes en niños que en lactantes (se citó a Meredith et al. como referencia 30).
Se añadió texto para indicar que un subgrupo de tumores con alteraciones H3 K27 presentarán al mismo tiempo una variante BRAF V600E o una variante de FGFR1. Se añadió texto sobre los resultados de un estudio retrospectivo en el que se demostró una predisposición mayor por la ubicación en el tálamo (se citó a Auffret et al. como referencia 54). Además se añadió texto sobre los resultados de otro estudio retrospectivo de pacientes adultos y pediátricos que presentaban gliomas con la alteración H3 K27 en el que se encontró que las variantes BRAF V600E se presentaban en un 5,8 % y las variantes de FGFR1 en un 10,9 % de los pacientes menores de 20 años (se citó a Williams et al. como referencia 55).
Se añadió texto para indicar que la pequeña minoría de pacientes con gliomas difusos de línea media que carecen de variantes de la histona H3 a menudo exhiben sobrexpresión de EZHIP. EZHIP inhibe la actividad de PRC2, lo que produce la misma pérdida de trimetilación de H3 K27 que inducen las variantes H3 K27M (se citó a Jain et al. como referencia 56). La sobrexpresión de EZHIP se observa asimismo en los ependimomas de tipo A de fosa posterior, que también exhiben pérdida de metilación de H3 K27 (se citó a Hübner et al. como referencia 57).
Se añadió texto sobre la prevalencia, la presentación y las características genómicas de los tumores con alteraciones de IDH1 e IDH2 que se presentan en la población pediátrica.
El Consejo editorial del PDQ sobre el tratamiento pediátrico es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento de gliomas (incluso astrocitomas) y de tumores neuronales o glioneuronales infantiles. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento pediátrico, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento de gliomas (incluso astrocitomas) y de tumores neuronales o glioneuronales infantiles son:
- Kenneth J. Cohen, MD, MBA (Sidney Kimmel Comprehensive Cancer Center at Johns Hopkins Hospital)
- Louis S. Constine, MD (James P. Wilmot Cancer Center at University of Rochester Medical Center)
- Karen J. Marcus, MD, FACR (Dana-Farber Cancer Institute/Boston Children's Hospital)
- Roger J. Packer, MD (Children's National Hospital)
- D. Williams Parsons, MD, PhD (Texas Children's Hospital)
- Malcolm A. Smith, MD, PhD (National Cancer Institute)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento pediátrico emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento pediátrico. PDQ Tratamiento de gliomas (incluso astrocitomas) y de tumores neuronales o glioneuronales infantiles. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/cerebro/pro/tratamiento-gliomas-astrocitomas-infantiles-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.