Tratamiento del cáncer primario de hígado (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer primario de hígado
El cáncer de hígado incluye dos tipos principales: carcinoma hepatocelular (CHC) y cáncer de vías biliares intrahepáticas. Para obtener información sobre el cáncer de vías biliares, consultar Tratamiento del cáncer de vías biliares (colangiocarcinoma). Para obtener más información sobre las variantes menos comunes del cáncer de hígado, consultar la sección Clasificación celular del cáncer primario de hígado.
Incidencia y mortalidad
Cálculo del número estimado de casos nuevos y defunciones por cáncer de hígado y de vías biliares intrahepáticas en los Estados Unidos para 2024:[1]
- Casos nuevos: 41 630.
- Defunciones: 29 840.
El CHC es relativamente poco frecuente en los Estados Unidos, aunque su incidencia va en aumento, sobre todo en lo que concierne a la propagación de la infección por el virus de la hepatitis C.[2] El CHC es el sexto cáncer más común en todo el mundo y la tercera causa principal de muertes relacionadas con el cáncer.[3]
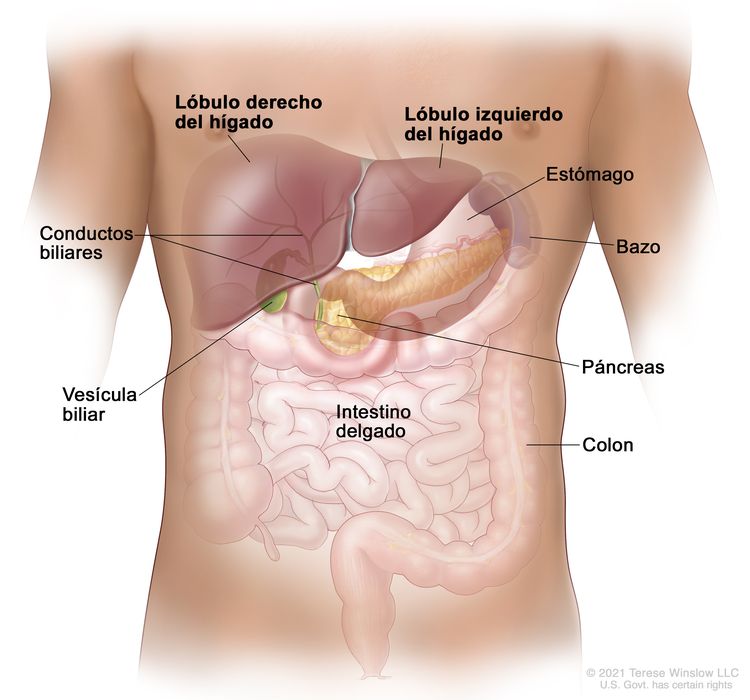
Características anatómicas
Factores de riesgo
La edad avanzada es el principal factor de riesgo para la mayoría de los cánceres. Otros factores de riesgo para el cáncer de hígado (hepatocelular) son los siguientes:
- Infección crónica o persistente por el virus de la hepatitis B o hepatitis C.[4-7]
- Cirrosis.[5,7,8]
- Consumo excesivo de bebidas alcohólicas.[6,8,9]
- Ingesta de alimentos contaminados con aflatoxina B1.[10-13]
- Esteatohepatitis no alcohólica (EHNA).[14-17]
- Consumo de tabaco.[18-20]
- Ciertas afecciones hereditarias o poco frecuentes como las siguientes:
Para obtener más información, consultar Prevención del cáncer de hígado (hepatocelular).
Exámenes de detección
Para obtener más información, consultar Exámenes de detección del cáncer de hígado (hepatocelular).
Factores diagnósticos
Las lesiones que miden menos de 1 cm que se encuentran mediante exámenes de detección en pacientes con riesgo alto de CHC no necesitan evaluación diagnóstica adicional. La mayoría de estas lesiones serán nódulos cirróticos en lugar de CHC.[24][Nivel de evidencia C1] Una estrategia común de vigilancia es un seguimiento minucioso en intervalos de 3 meses con la misma técnica que se usó para identificar por primera vez las lesiones.
Se debe considerar el diagnóstico de CHC en pacientes con lesiones hepáticas que miden más de 1 cm y que tienen riesgo de CHC. Las pruebas necesarias para diagnosticar un CHC incluyen imágenes, biopsias o ambas.
Diagnóstico por imágenes
En los pacientes con cirrosis, enfermedad hepática u otros factores de riesgo de CHC que presentan lesiones de más de 1 cm, es posible emplear estudios con contraste trifásicos (tomografía computarizada [TC] dinámica o imágenes por resonancia magnética [IRM]) para el diagnóstico de CHC.[25]
Una TC o IRM trifásicas sirven para evaluar todo el hígado en distintas fases de perfusión. Después de la administración intravenosa controlada de un material de contraste, se obtienen imágenes de las fases de perfusión arterial y venosa.
Durante la fase arterial del estudio, el CHC se destaca con más intensidad que el hígado circundante debido a que la sangre arterial en el hígado se diluye en la sangre venosa que no contiene contraste, mientras que el CHC solo contiene sangre arterial. En la fase venosa, el CHC se destaca menos que el hígado circundante (esto se conoce como lavado venoso del CHC) porque la sangre arterial que fluye a través de la lesión ya no contiene contraste; sin embargo, la sangre portal en el hígado ahora contiene contraste.
La presencia de absorción arterial seguida de lavado en un solo estudio dinámico es muy específica (95–100 %) para un CHC de 1 a 3 cm de diámetro y, prácticamente diagnóstica para un CHC.[26-28][Nivel de evidencia C1] En estos casos, es posible establecer el diagnóstico de CHC sin una segunda modalidad de imagen, incluso en ausencia de una biopsia que lo confirme.[28-30][Nivel de evidencia C1]
No obstante, si la primera modalidad de imagen, TC o IRM con contraste, no es concluyente, las imágenes secuenciales con una modalidad diferente pueden mejorar la sensibilidad para detectar un CHC (del 33 al 41 % con TC o IRM, al 76 % cuando ambos estudios se realizan en secuencia) sin una disminución de la especificidad.[27]
Pero, si pese al uso de dos modalidades de imágenes, una lesión mayor de 1 cm permanece sin caracterización en un paciente con riesgo alto de CHC (es decir, con solo uno o ningún patrón de realce clásico), se puede considerar una biopsia de hígado.[28,29]
Biopsia de hígado
Se puede realizar una biopsia de hígado cuando el diagnóstico de CHC no se establece mediante una técnica de imagen dinámica (TC o IRM trifásicas) de lesiones hepáticas de 1 cm o más en pacientes de riesgo alto.
Concentraciones de alfafetoproteína
La alfafetoproteína (AFP) no es suficientemente sensible ni específica para su uso como ensayo diagnóstico. La AFP se eleva en el colangiocarcinoma intrahepático y en algunos casos de metástasis de cáncer de colon. El hallazgo de una masa hepática en un paciente con una concentración elevada de AFP no indica automáticamente un CHC. No obstante, si la concentración de AFP es alta, se puede utilizar para vigilar la recidiva.
Pronóstico
Poco se sabe sobre la evolución natural de los tumores tempranos porque la mayoría de los pacientes de CHC reciben tratamiento. Sin embargo, en los informes más antiguos se describieron tasas de supervivencia a 3 años del 13 al 21 % en pacientes que no recibieron ningún tratamiento específico.[31,32] En la actualidad, sólo el 10 al 23 % de los pacientes con CHC son aptos para recibir un tratamiento quirúrgico con intención curativa.[33,34] La tasa de supervivencia general (SG) a 5 años para pacientes de CHC en estadio temprano que se someten a trasplante oscila entre el 44 % y el 78 %. Para los pacientes que se someten a resección de hígado la tasa de SG oscila entre el 27 % y el 70 %.[35]
El trasplante de hígado, la resección quirúrgica y la ablación ofrecen tasas altas de respuesta completa y una posibilidad de curación en pacientes de CHC en estadio temprano.[29]
Se sabe más sobre la evolución natural del CHC en estadio avanzado. Los pacientes con enfermedad avanzada sin tratamiento por lo general sobreviven menos de 6 meses.[36] En 25 ensayos clínicos aleatorizados, la tasa de supervivencia de pacientes no tratados osciló entre el 10 y el 72 % a 1 año, y del 8 al 50 % a 2 años.[37]
A diferencia de la mayoría de los pacientes con tumores sólidos, el pronóstico de los pacientes con CHC se ve afectado no solo por el estadio del tumor en el momento de su presentación sino, también, por el funcionamiento hepático subyacente. Los principales factores pronósticos que guían la selección del tratamiento son los siguientes:
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2024. American Cancer Society, 2024. Available online. Last accessed January 17, 2024.
- Altekruse SF, McGlynn KA, Reichman ME: Hepatocellular carcinoma incidence, mortality, and survival trends in the United States from 1975 to 2005. J Clin Oncol 27 (9): 1485-91, 2009. [PUBMED Abstract]
- Forner A, Llovet JM, Bruix J: Hepatocellular carcinoma. Lancet 379 (9822): 1245-55, 2012. [PUBMED Abstract]
- Bosetti C, Turati F, La Vecchia C: Hepatocellular carcinoma epidemiology. Best Pract Res Clin Gastroenterol 28 (5): 753-70, 2014. [PUBMED Abstract]
- El-Serag HB: Epidemiology of viral hepatitis and hepatocellular carcinoma. Gastroenterology 142 (6): 1264-1273.e1, 2012. [PUBMED Abstract]
- El-Serag HB, Kanwal F: Epidemiology of hepatocellular carcinoma in the United States: where are we? Where do we go? Hepatology 60 (5): 1767-75, 2014. [PUBMED Abstract]
- Lafaro KJ, Demirjian AN, Pawlik TM: Epidemiology of hepatocellular carcinoma. Surg Oncol Clin N Am 24 (1): 1-17, 2015. [PUBMED Abstract]
- Fattovich G, Stroffolini T, Zagni I, et al.: Hepatocellular carcinoma in cirrhosis: incidence and risk factors. Gastroenterology 127 (5 Suppl 1): S35-50, 2004. [PUBMED Abstract]
- Grewal P, Viswanathen VA: Liver cancer and alcohol. Clin Liver Dis 16 (4): 839-50, 2012. [PUBMED Abstract]
- London WT, McGlynn K: Liver cancer. In: Schottenfeld D, Fraumeni JF Jr, eds.: Cancer Epidemiology and Prevention. 3rd ed. Oxford University Press, 2006, pp 763-86.
- McGlynn KA, Petrick JL, London WT: Global epidemiology of hepatocellular carcinoma: an emphasis on demographic and regional variability. Clin Liver Dis 19 (2): 223-38, 2015. [PUBMED Abstract]
- Liu Y, Wu F: Global burden of aflatoxin-induced hepatocellular carcinoma: a risk assessment. Environ Health Perspect 118 (6): 818-24, 2010. [PUBMED Abstract]
- Chen JG, Egner PA, Ng D, et al.: Reduced aflatoxin exposure presages decline in liver cancer mortality in an endemic region of China. Cancer Prev Res (Phila) 6 (10): 1038-45, 2013. [PUBMED Abstract]
- Baffy G, Brunt EM, Caldwell SH: Hepatocellular carcinoma in non-alcoholic fatty liver disease: an emerging menace. J Hepatol 56 (6): 1384-91, 2012. [PUBMED Abstract]
- Diehl AM, Day C: Cause, Pathogenesis, and Treatment of Nonalcoholic Steatohepatitis. N Engl J Med 377 (21): 2063-2072, 2017. [PUBMED Abstract]
- White DL, Kanwal F, El-Serag HB: Association between nonalcoholic fatty liver disease and risk for hepatocellular cancer, based on systematic review. Clin Gastroenterol Hepatol 10 (12): 1342-1359.e2, 2012. [PUBMED Abstract]
- Ascha MS, Hanouneh IA, Lopez R, et al.: The incidence and risk factors of hepatocellular carcinoma in patients with nonalcoholic steatohepatitis. Hepatology 51 (6): 1972-8, 2010. [PUBMED Abstract]
- Chuang SC, Lee YC, Hashibe M, et al.: Interaction between cigarette smoking and hepatitis B and C virus infection on the risk of liver cancer: a meta-analysis. Cancer Epidemiol Biomarkers Prev 19 (5): 1261-8, 2010. [PUBMED Abstract]
- Lee YC, Cohet C, Yang YC, et al.: Meta-analysis of epidemiologic studies on cigarette smoking and liver cancer. Int J Epidemiol 38 (6): 1497-511, 2009. [PUBMED Abstract]
- Koh WP, Robien K, Wang R, et al.: Smoking as an independent risk factor for hepatocellular carcinoma: the Singapore Chinese Health Study. Br J Cancer 105 (9): 1430-5, 2011. [PUBMED Abstract]
- Lomas DA, Evans DL, Finch JT, et al.: The mechanism of Z alpha 1-antitrypsin accumulation in the liver. Nature 357 (6379): 605-7, 1992. [PUBMED Abstract]
- Huster D: Wilson disease. Best Pract Res Clin Gastroenterol 24 (5): 531-9, 2010. [PUBMED Abstract]
- Pfeiffenberger J, Mogler C, Gotthardt DN, et al.: Hepatobiliary malignancies in Wilson disease. Liver Int 35 (5): 1615-22, 2015. [PUBMED Abstract]
- Furuya K, Nakamura M, Yamamoto Y, et al.: Macroregenerative nodule of the liver. A clinicopathologic study of 345 autopsy cases of chronic liver disease. Cancer 61 (1): 99-105, 1988. [PUBMED Abstract]
- Brunello F, Cantamessa A, Gaia S, et al.: Radiofrequency ablation: technical and clinical long-term outcomes for single hepatocellular carcinoma up to 30 mm. Eur J Gastroenterol Hepatol 25 (7): 842-9, 2013. [PUBMED Abstract]
- Leoni S, Piscaglia F, Golfieri R, et al.: The impact of vascular and nonvascular findings on the noninvasive diagnosis of small hepatocellular carcinoma based on the EASL and AASLD criteria. Am J Gastroenterol 105 (3): 599-609, 2010. [PUBMED Abstract]
- Khalili K, Kim TK, Jang HJ, et al.: Optimization of imaging diagnosis of 1-2 cm hepatocellular carcinoma: an analysis of diagnostic performance and resource utilization. J Hepatol 54 (4): 723-8, 2011. [PUBMED Abstract]
- Sangiovanni A, Manini MA, Iavarone M, et al.: The diagnostic and economic impact of contrast imaging techniques in the diagnosis of small hepatocellular carcinoma in cirrhosis. Gut 59 (5): 638-44, 2010. [PUBMED Abstract]
- Bruix J, Sherman M; American Association for the Study of Liver Diseases: Management of hepatocellular carcinoma: an update. Hepatology 53 (3): 1020-2, 2011. [PUBMED Abstract]
- Khalili K, Kim TK, Jang HJ, et al.: Implementation of AASLD hepatocellular carcinoma practice guidelines in North America: two years of experience. [Abstract] Hepatology 48 (Suppl 1): A-128, 362A, 2008.
- Barbara L, Benzi G, Gaiani S, et al.: Natural history of small untreated hepatocellular carcinoma in cirrhosis: a multivariate analysis of prognostic factors of tumor growth rate and patient survival. Hepatology 16 (1): 132-7, 1992. [PUBMED Abstract]
- Ebara M, Ohto M, Shinagawa T, et al.: Natural history of minute hepatocellular carcinoma smaller than three centimeters complicating cirrhosis. A study in 22 patients. Gastroenterology 90 (2): 289-98, 1986. [PUBMED Abstract]
- Shah SA, Smith JK, Li Y, et al.: Underutilization of therapy for hepatocellular carcinoma in the medicare population. Cancer 117 (5): 1019-26, 2011. [PUBMED Abstract]
- Sonnenday CJ, Dimick JB, Schulick RD, et al.: Racial and geographic disparities in the utilization of surgical therapy for hepatocellular carcinoma. J Gastrointest Surg 11 (12): 1636-46; discussion 1646, 2007. [PUBMED Abstract]
- Dhir M, Lyden ER, Smith LM, et al.: Comparison of outcomes of transplantation and resection in patients with early hepatocellular carcinoma: a meta-analysis. HPB (Oxford) 14 (9): 635-45, 2012. [PUBMED Abstract]
- Okuda K, Ohtsuki T, Obata H, et al.: Natural history of hepatocellular carcinoma and prognosis in relation to treatment. Study of 850 patients. Cancer 56 (4): 918-28, 1985. [PUBMED Abstract]
- Llovet JM, Bruix J: Systematic review of randomized trials for unresectable hepatocellular carcinoma: Chemoembolization improves survival. Hepatology 37 (2): 429-42, 2003. [PUBMED Abstract]
- Llovet JM, Brú C, Bruix J: Prognosis of hepatocellular carcinoma: the BCLC staging classification. Semin Liver Dis 19 (3): 329-38, 1999. [PUBMED Abstract]
- A new prognostic system for hepatocellular carcinoma: a retrospective study of 435 patients: the Cancer of the Liver Italian Program (CLIP) investigators. Hepatology 28 (3): 751-5, 1998. [PUBMED Abstract]
Clasificación celular del cáncer primario de hígado
Los tumores malignos primarios de hígado se componen de dos tipos celulares principales: hepatocelular (90 % de los casos) y colangiocarcinoma.[1]
La clasificación histológica es la siguiente:
- Carcinoma hepatocelular (CHC; carcinoma de células hepáticas).
- Variante fibrolamelar de CHC.
Es importante distinguir la variante fibrolamelar de CHC del CHC mismo, porque hay una proporción creciente de pacientes con la variante fibrolamelar que se pueden curar si se logra resecar el tumor. Esta variante se observa con mayor frecuencia en mujeres jóvenes y, en general, también exhibe una evolución clínica más lenta que el CHC que es más común.[2]
- Colangiocarcinoma (carcinoma de vías biliares intrahepáticas).
- Colangiocarcinoma hepatocelular mixto.
- Indiferenciado.
- Hepatoblastoma. Se presenta con más frecuencia en niños que en adultos. Para obtener más información, consultar Tratamiento del cáncer de hígado infantil.
Bibliografía
- Llovet JM, Burroughs A, Bruix J: Hepatocellular carcinoma. Lancet 362 (9399): 1907-17, 2003. [PUBMED Abstract]
- Mavros MN, Mayo SC, Hyder O, et al.: A systematic review: treatment and prognosis of patients with fibrolamellar hepatocellular carcinoma. J Am Coll Surg 215 (6): 820-30, 2012. [PUBMED Abstract]
Información sobre los estadios del cáncer primario de hígado
El modelado pronóstico del carcinoma hepatocelular (CHC) es complejo por la presencia de cirrosis en hasta el 80 % de los casos. Se deben tomar en cuenta las características del tumor y los factores que se relacionan con la reserva funcional hepática. Los factores pronósticos clave se conocen solo de forma parcial y varían en los diferentes estadios de la enfermedad.
Se utilizan más de diez clasificaciones en todo el mundo, pero ningún sistema es aceptado a nivel mundial. Se han propuesto nuevas clasificaciones con el propósito de superar las dificultades de usar varios sistemas de estadificación.
En este resumen se presentan los siguientes tres sistemas de estadificación:
Sistema de estadificación del Barcelona Clinic Liver Cancer
En la actualidad, el sistema de estadificación del Barcelona Clinic Liver Cancer (BCLC) es el sistema de estadificación más aceptado para el CHC y es útil para estadificar tumores en estadio temprano. Las pruebas obtenidas en una cohorte estadounidense mostraron que la estadificación BCLC ofrece un mejor poder de estratificación pronóstica que otros sistemas de estadificación.[1]
El sistema de estadificación BCLC intenta superar las limitaciones de los sistemas de estadificación previos al incluir variables relacionadas con los siguientes aspectos:[2]
- Estadio tumoral.
- Estado funcional del hígado.
- Estado físico.
- Síntomas relacionados con el cáncer.
Se identifican cinco estadios (0 y A hasta D) a partir de las variables recién mencionadas. El sistema de estadificación BCLC vincula cada estadio del CHC con las modalidades de tratamiento apropiadas como sigue:
- Es posible que los pacientes de CHC en estadio temprano se beneficien de los tratamientos curativos (es decir, trasplante de hígado, resección quirúrgica y ablación por radiofrecuencia).
- Los pacientes con enfermedad en estadio intermedio o avanzado quizás se beneficien de los tratamientos paliativos (es decir, quimioembolización arterial transcatéter y sorafenib).
- A los pacientes con enfermedad en estadio terminal que tienen una esperanza de vida muy precaria, se les ofrecen cuidados médicos de apoyo y tratamiento paliativo.
Sistema de estadificación de Okuda
El sistema de estadificación de Okuda se utilizó mucho en el pasado e incluye variables relacionadas con la carga tumoral y el funcionamiento hepático, como la concentración de bilirrubina y albúmina, y la presencia de ascitis. Sin embargo, no incluye muchos factores pronósticos tumorales importantes que se confirmaron en series quirúrgicas y no quirúrgicas (por ejemplo, invasión vascular unifocal o multifocal, trombosis venosa portal o compromiso ganglionar locorregional).[3,4] Como resultado, la estadificación de Okuda no permite estratificar el pronóstico para los cánceres en estadio temprano y sobre todo sirve para identificar a pacientes en estadio terminal.
Sistema de estadificación del American Joint Committee on Cancer y definiciones TNM
La clasificación TNM (tumor, ganglio linfático y metástasis) propuesta por el American Joint Committee on Cancer (AJCC) no es de uso generalizado para el cáncer de hígado. La utilidad clínica de la estadificación TNM es limitada porque no considera el funcionamiento hepático. También es difícil usar este sistema para seleccionar opciones de tratamiento porque la estadificación TNM depende de un examen histopatológico detallado que solo está disponible después de la escisión tumoral. La clasificación TNM quizás sea útil para predecir el pronóstico después de la resección hepática.[5]
| Estadio | TNM | Descripción |
|---|---|---|
| Tumor = tumor primario; N = ganglios linfáticos regionales; M = metástasis a distancia. | ||
| aReproducción autorizada de AJCC: Liver. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 287–93. | ||
| IA | T1a, N0, M0 | T1a = tumor solitario que mide ≤2 cm. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| IB | T1b, N0, M0 | T1b = tumor solitario que mide >2 cm sin invasión vascular. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglios linfáticos regionales; M = metástasis a distancia. | ||
| aReproducción autorizada de AJCC: Liver. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 287–93. | ||
| II | T2, N0, M0 | T2 = tumor solitario que mide >2 cm con invasión vascular o tumores múltiples, ninguno mide >5 cm. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglios linfáticos regionales; M = metástasis a distancia. | ||
| aReproducción autorizada de AJCC: Liver. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 287–93. | ||
| IIIA | T3, N0, M0 | T3 = tumores múltiples, por lo menos uno de los tumores mide >5 cm. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| IIIB | T4, N0, M0 | T4 = tumor único o tumores múltiples de cualquier tamaño con compromiso de una rama principal de la vena porta o la vena hepática, o uno o más tumores con invasión directa de órganos adyacentes distintos de la vesícula biliar, o con perforación del peritoneo visceral. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglios linfáticos regionales; M = metástasis a distancia. | ||
| aReproducción autorizada de AJCC: Liver. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 287–93. | ||
| IVA | Cualquier T, N1, M0 | TX = tumor primario no evaluable. |
| T0 = sin indicios de tumor primario. | ||
| T1 = tumor solitario que mide ≤2 cm o >2 cm sin invasión vascular. | ||
| –T1a = tumor solitario que mide ≤2 cm. | ||
| –T1b = tumor solitario que mide >2 cm sin invasión vascular. | ||
| T2 = tumor solitario que mide >2 cm con invasión vascular o tumores múltiples, ninguno mide >5 cm. | ||
| T3 = tumores múltiples, por lo menos uno de los tumores mide >5 cm. | ||
| T4 = tumor único o tumores múltiples de cualquier tamaño con compromiso de una rama principal de la vena porta o la vena hepática, o uno o más tumores con invasión directa de órganos adyacentes distintos de la vesícula biliar, o con perforación del peritoneo visceral. | ||
| N1 = metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| IVB | Cualquier T, cualquier N, M1 | Cualquier T = consultar las descripciones de estadio IVA, cualquier T, N1, M0 en este cuadro. |
| NX = ganglios linfáticos regionales no evaluables. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| N1 = metástasis en ganglios linfáticos regionales. | ||
| M1 = metástasis a distancia. | ||
Bibliografía
- Marrero JA, Fontana RJ, Barrat A, et al.: Prognosis of hepatocellular carcinoma: comparison of 7 staging systems in an American cohort. Hepatology 41 (4): 707-16, 2005. [PUBMED Abstract]
- Llovet JM, Brú C, Bruix J: Prognosis of hepatocellular carcinoma: the BCLC staging classification. Semin Liver Dis 19 (3): 329-38, 1999. [PUBMED Abstract]
- Poon RT, Ng IO, Fan ST, et al.: Clinicopathologic features of long-term survivors and disease-free survivors after resection of hepatocellular carcinoma: a study of a prospective cohort. J Clin Oncol 19 (12): 3037-44, 2001. [PUBMED Abstract]
- Pompili M, Rapaccini GL, Covino M, et al.: Prognostic factors for survival in patients with compensated cirrhosis and small hepatocellular carcinoma after percutaneous ethanol injection therapy. Cancer 92 (1): 126-35, 2001. [PUBMED Abstract]
- Liver. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 287–93.
Aspectos generales de las opciones de tratamiento del cáncer primario de hígado
No hay un acuerdo sobre una estrategia de tratamiento única para los pacientes de carcinoma hepatocelular (CHC). La selección del tratamiento es compleja debido a varios factores, como los siguientes:
- Funcionamiento hepático subyacente.
- Extensión y localización del tumor.
- Estado general del paciente.
Varios tratamientos para el CHC se relacionan con supervivencia a largo plazo, como la resección quirúrgica, el trasplante de hígado y la ablación. No hay estudios aleatorizados grandes y de diseño sólido en los que se comparen tratamientos que se consideran eficaces para la enfermedad en estadio temprano, ni hay estudios en los que se comparen estos tratamientos con los mejores cuidados médicos de apoyo. A menudo, los pacientes de CHC son evaluados por un equipo multidisciplinario que incluye hepatólogos, radiólogos, radiólogos intervencionistas, radioncólogos, cirujanos especializados en trasplantes, cirujanos oncólogos, patólogos y médicos oncólogos.
Las mejores supervivencias se logran cuando se puede extirpar el CHC mediante resección quirúrgica o trasplante de hígado. La resección quirúrgica se realiza por lo general en pacientes con CHC localizado y suficiente reserva funcional hepática.
Para los pacientes con cirrosis descompensada y una lesión solitaria (<5 cm), o enfermedad multifocal temprana (≤ 3 lesiones, ≤ 3 de diámetro), la mejor opción es el trasplante de hígado,[1] pero la disponibilidad limitada de donantes de hígado restringe el uso de este abordaje.
La quimioembolización transarterial, los inhibidores multicinasa y la inmunoterapia son tratamientos no curativos del CHC que mejoran la supervivencia.[2-4]
En el Cuadro 5 se presentan las opciones de tratamiento estándar del CHC.
| Estadio | Opciones de tratamiento |
|---|---|
| Localizado | Resección quirúrgica |
| Trasplante de hígado | |
| Ablación | |
| Radioterapia | |
| Localmente avanzado o metastásico | Embolización transarterial y quimioembolización arterial transcatéter en pacientes con enfermedad no metastásica |
| Terapia sistémica de primera línea | |
| Terapia sistémica de segunda línea | |
| Radioterapia | |
| Recidivante (enfermedad limitada al hígado sin compromiso vascular) | Trasplante de hígado |
| Resección quirúrgica | |
| Ablación | |
| Recidivante (enfermedad extrahepática o compromiso vascular) | Terapia paliativa |
Bibliografía
- Bruix J, Sherman M; American Association for the Study of Liver Diseases: Management of hepatocellular carcinoma: an update. Hepatology 53 (3): 1020-2, 2011. [PUBMED Abstract]
- Llovet JM, Ricci S, Mazzaferro V, et al.: Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 359 (4): 378-90, 2008. [PUBMED Abstract]
- Llovet JM, Bruix J: Systematic review of randomized trials for unresectable hepatocellular carcinoma: Chemoembolization improves survival. Hepatology 37 (2): 429-42, 2003. [PUBMED Abstract]
- Cammà C, Schepis F, Orlando A, et al.: Transarterial chemoembolization for unresectable hepatocellular carcinoma: meta-analysis of randomized controlled trials. Radiology 224 (1): 47-54, 2002. [PUBMED Abstract]
Tratamiento del cáncer primario de hígado localizado
Alrededor del 30 % de los casos de carcinoma hepatocelular (CHC) se presentan como enfermedad localizada con una masa solitaria en una parte del hígado o como un número limitado de tumores (≤ 3 lesiones, ≤ 3 de diámetro) sin invasión vascular importante.
Opciones de tratamiento para el cáncer de hígado localizado
Las opciones de tratamiento para el cáncer primario de hígado localizado son las siguientes:
Los mejores desenlaces se logran con la resección y el trasplante en pacientes aptos bien seleccionados y, por lo general, se consideran la primera opción con intención curativa.
Resección quirúrgica
La cirugía es el tratamiento de base para el CHC.
La evaluación preoperatoria incluye tomografía computarizada helicoidal trifásica, imágenes por resonancia magnética o ambas para determinar la presencia de diseminación del tumor a través de planos interlobulares y el posible compromiso del hilio hepático, las venas hepáticas y la vena cava inferior. Los tumores solo son resecables si se puede conservar una cantidad suficiente de parénquima hepático con un flujo adecuado de entrada y salida vascular y biliar. En general, los pacientes con cirrosis compensada toleran la resección de hasta el 50 % del parénquima hepático.
Es posible considerar la resección quirúrgica para pacientes que cumplan con los siguientes criterios:
- Masa solitaria.
- Buen estado funcional.
- Pruebas de funcionamiento hepático normales o solo un poco anormales.
- Sin indicios de hipertensión portal.
- Sin indicios de cirrosis más allá de la clase A de Child-Pugh.
Después de considerar la localización y el número de tumores, y el funcionamiento hepático del paciente, solo del 5 al 10 % de los pacientes de cáncer de hígado tendrán una enfermedad localizada susceptible de resección.[1-5]
Los principios de la resección quirúrgica suponen obtener un margen libre alrededor del tumor, lo que a veces exige el uso de cualquiera de los siguientes procedimientos:
- Resección segmentaria.
- Lobectomía hormonal y linfática.
- Lobectomía ampliada.
Las tasas de supervivencia general (SG) a 5 años después de la resección curativa oscilan entre el 27 y el 70 %, y dependen del estadio del tumor y el funcionamiento hepático subyacente.[1-5]
En pacientes con enfermedad multifocal limitada la resección hepática es objeto de controversia.
Trasplante de hígado
El trasplante de hígado es un tratamiento potencialmente curativo del CHC y tiene el beneficio de tratar la cirrosis subyacente; pero la escasez de donantes de órganos limita la disponibilidad de este método de tratamiento.[1]
De acuerdo con los criterios de Milán, los pacientes de CHC con una única lesión que mide menos de 5 cm, o los pacientes con 2 a 3 lesiones que miden menos de 3 cm son aptos para un trasplante de hígado. La ampliación de los criterios de trasplante aceptados para el CHC no se sustenta en datos congruentes. Se considera un trasplante de hígado si la resección queda excluida como consecuencia de lesiones tumorales múltiples y pequeñas (≤3 lesiones, cada una de ≤3 cm), o si hay alteración del funcionamiento hepático (Clase B y C de Child-Pugh). En aquellos pacientes que cumplen con los requisitos, el trasplante se relaciona con una tasa de SG a 5 años de aproximadamente el 70 %.[6][Nivel de evidencia C1]
Ablación
Cuando la escisión del tumor, ya sea por trasplante o resección, no es posible o conveniente, se recurre a la ablación si es posible acceder al tumor por vía percutánea o, de ser necesario, mediante una cirugía mínimamente invasiva o cirugía abierta. La ablación es particularmente útil para los pacientes de CHC en estadio temprano con localización central en el hígado cuyo tumor es imposible de extirpar quirúrgicamente sin una afectación excesiva del parénquima funcional.
La ablación es viable de las siguientes maneras:
- Cambio en la temperatura (por ejemplo, ablación por radiofrecuencia [ARF], microondas o crioablación).
- Exposición a una sustancia química (por ejemplo, inyección percutánea de etanol [IPE]).
- Daño directo de la membrana celular (electroporación definitiva).
Con la ablación es posible considerar un margen de hígado normal alrededor del tumor. La ablación tiene una contraindicación relativa para las lesiones próximas a las vías biliares, el diafragma u otros órganos intrabdominales que se podrían lesionar durante el procedimiento. Por otra parte, cuando los tumores se localizan cerca de los vasos principales, el flujo sanguíneo en los vasos puede impedir que las técnicas de ablación térmica como la ARF alcancen la temperatura óptima. Esto se conoce como efecto de disipación del calor, que impediría una necrosis tumoral completa.
Con la ARF se obtienen los mejores resultados en pacientes con tumores que miden menos de 3 cm. En esta subpoblación, las tasas de SG a 5 años son de hasta el 59 % y las tasas de supervivencia sin recidiva no difieren de manera significativa de las obtenidas con resección hepática.[7,8] El éxito del control local disminuye de manera progresiva a medida que el tamaño del tumor supera los 3 cm.
La IPE produce buenos resultados en pacientes con cirrosis de clase A de Child-Pugh y un solo tumor de menos de 3 cm de diámetro. En esos casos, la tasa de SG a 5 años llega a ser del 40 % al 59 %.[9,10][Nivel de evidencia C2]
En los pocos ensayos controlados aleatorizados que incluyeron a pacientes con cirrosis de clase A de Child-Pugh, la ARF demostró ser superior a la IPE en términos de tasas de respuesta completa y recidivas locales; en algunos de estos estudios también se observó una mejora de la SG con la ARF. Por otra parte, se necesitan menos sesiones de tratamiento para la ARF que para la IPE a fin de lograr resultados similares.[11-14]
Cabe destacar que la ARF quizás tenga tasas de complicaciones más altas que la IPE,[12] pero ambas técnicas se relacionan con tasas más bajas de complicaciones que los procedimientos de escisión. La ARF es una técnica bien establecida para el tratamiento del CHC.
Radioterapia
La radioterapia se administra con intención curativa o paliativa en los pacientes con cáncer primario de hígado. Con la radioterapia corporal estereotáctica (RTCE), una forma de administrar radiación, los pacientes reciben un número pequeño de fracciones de radioterapia guiada por imagen con dosis biológicas equivalente altas y exactas. En numerosos estudios retrospectivos se ha observado excelente control local para los pacientes con CHC que reciben RTCE (tasas de control local que oscilan entre el 70 % y el 95 % a los 2 años para los CHC más pequeños).
Evidencia (radioterapia):
- En el estudio de fase III NRG/RTOG 1112 (NCT01730937), publicado como resumen, se evaluó el sorafenib solo o con RTCE seguido de sorafenib en pacientes con CHC. Se incluyó a pacientes con CHC nuevo o recidivante de clase A de Child-Pugh y estadio B o C de Barcelona Clinic Liver Cancer. Además, los pacientes tenían 5 o menos lesiones, la suma de sus tumores era de 20 cm o menos y las metástasis a distancia medían 3 cm o menos. Se asignaron al azar 177 pacientes para el tratamiento (92 a sorafenib solo, 85 a RTCE seguido de sorafenib). El criterio primario de valoración fue la SG.[15][Nivel de evidencia B1]
- La mediana de SG fue de 12,3 meses para el grupo de sorafenib solo y de 15,8 meses en el grupo de RTCE con sorafenib (cociente de riesgos instantáneos, 0,77; P unilateral = 0,0554).
- Los efectos adversos de grado 3 o más alto no fueron significativamente diferentes entre los 2 grupos: un 42 % para el grupo de sorafenib solo y un 47 % para el grupo de RTCE con sorafenib (P = 0,52).
- Se presentaron 3 eventos adversos de grado 5: 1 caso de insuficiencia hepática y 1 muerte sin otra indicación en el grupo de sorafenib; además se presentó 1 caso de infección pulmonar de grado 5 en el grupo de RTCE con sorafenib.
A partir de estos resultados, la RTCE es el tratamiento estándar con intención curativa para el CHC. También puede usarse para el control local antes de un trasplante de hígado.
Evidencia (radioterapia con intención paliativa):
- El estudio de fase III HE.1 (NCT02511522) del Canadian Cancer Trials Group, publicado como resumen, se incluyó un grupo de 66 pacientes con CHC. Los pacientes se asignaron al azar a recibir el mejor cuidado médico de apoyo solo o radioterapia paliativa dirigida al hígado (8 Gy en una fracción). Los pacientes tenían enfermedad terminal y no eran aptos para recibir terapias locales, regionales o sistémicas. Además, se requería que hubieran pasado más de 4 semanas de la quimioterapia o quimioembolización arterial transcatéter, más de 2 semanas desde una terapia dirigida o inmunoterapia y que no tuvieran planeado recibir ninguna terapia sistémica. El criterio primario de valoración del estudio fue la proporción de pacientes que notificaron mejoría de, por lo menos, 2 puntos desde el inicio en el Brief Pain Inventory cuando se les pidió que valoraran la intensidad del dolor del cáncer "la peor intensidad". Un criterio secundario de valoración fue la SG a 3 meses.[16][Nivel de evidencia B3]
- Se observó una mejora significativa de la puntuación del “peor” dolor desde el inicio hasta 1 mes en el 67 % de los pacientes que recibieron radioterapia y en el 22 % de los pacientes que recibieron el mejor cuidado médico de apoyo.
- Aunque históricamente la radioterapia no se ha usado en esta población de pacientes, en este estudio no se observó reducción de la SG en los pacientes que recibieron radiación. La tasa de SG a 3 meses fue del 51 % para los pacientes que recibieron radioterapia y del 33 % para los pacientes que recibieron el mejor cuidado médico de apoyo solo (P = 0,07), a pesar de que el estudio incluyó pacientes con cirrosis de clases A, B y C de Child-Pugh.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Llovet JM, Fuster J, Bruix J: Intention-to-treat analysis of surgical treatment for early hepatocellular carcinoma: resection versus transplantation. Hepatology 30 (6): 1434-40, 1999. [PUBMED Abstract]
- Chok KS, Ng KK, Poon RT, et al.: Impact of postoperative complications on long-term outcome of curative resection for hepatocellular carcinoma. Br J Surg 96 (1): 81-7, 2009. [PUBMED Abstract]
- Kianmanesh R, Regimbeau JM, Belghiti J: Selective approach to major hepatic resection for hepatocellular carcinoma in chronic liver disease. Surg Oncol Clin N Am 12 (1): 51-63, 2003. [PUBMED Abstract]
- Poon RT, Fan ST, Lo CM, et al.: Long-term survival and pattern of recurrence after resection of small hepatocellular carcinoma in patients with preserved liver function: implications for a strategy of salvage transplantation. Ann Surg 235 (3): 373-82, 2002. [PUBMED Abstract]
- Dhir M, Lyden ER, Smith LM, et al.: Comparison of outcomes of transplantation and resection in patients with early hepatocellular carcinoma: a meta-analysis. HPB (Oxford) 14 (9): 635-45, 2012. [PUBMED Abstract]
- Hemming AW, Cattral MS, Reed AI, et al.: Liver transplantation for hepatocellular carcinoma. Ann Surg 233 (5): 652-9, 2001. [PUBMED Abstract]
- Huang J, Hernandez-Alejandro R, Croome KP, et al.: Radiofrequency ablation versus surgical resection for hepatocellular carcinoma in Childs A cirrhotics-a retrospective study of 1,061 cases. J Gastrointest Surg 15 (2): 311-20, 2011. [PUBMED Abstract]
- Zhou YM, Shao WY, Zhao YF, et al.: Meta-analysis of laparoscopic versus open resection for hepatocellular carcinoma. Dig Dis Sci 56 (7): 1937-43, 2011. [PUBMED Abstract]
- Huang GT, Lee PH, Tsang YM, et al.: Percutaneous ethanol injection versus surgical resection for the treatment of small hepatocellular carcinoma: a prospective study. Ann Surg 242 (1): 36-42, 2005. [PUBMED Abstract]
- Yamamoto J, Okada S, Shimada K, et al.: Treatment strategy for small hepatocellular carcinoma: comparison of long-term results after percutaneous ethanol injection therapy and surgical resection. Hepatology 34 (4 Pt 1): 707-13, 2001. [PUBMED Abstract]
- Lencioni RA, Allgaier HP, Cioni D, et al.: Small hepatocellular carcinoma in cirrhosis: randomized comparison of radio-frequency thermal ablation versus percutaneous ethanol injection. Radiology 228 (1): 235-40, 2003. [PUBMED Abstract]
- Lin SM, Lin CJ, Lin CC, et al.: Randomised controlled trial comparing percutaneous radiofrequency thermal ablation, percutaneous ethanol injection, and percutaneous acetic acid injection to treat hepatocellular carcinoma of 3 cm or less. Gut 54 (8): 1151-6, 2005. [PUBMED Abstract]
- Brunello F, Veltri A, Carucci P, et al.: Radiofrequency ablation versus ethanol injection for early hepatocellular carcinoma: A randomized controlled trial. Scand J Gastroenterol 43 (6): 727-35, 2008. [PUBMED Abstract]
- Shiina S, Teratani T, Obi S, et al.: A randomized controlled trial of radiofrequency ablation with ethanol injection for small hepatocellular carcinoma. Gastroenterology 129 (1): 122-30, 2005. [PUBMED Abstract]
- Dawson LA, Winter KA, Knox JJ, et al.: NRG/RTOG 1112: Randomized phase III study of sorafenib vs. stereotactic body radiation therapy (SBRT) followed by sorafenib in hepatocellular carcinoma (HCC). [Abstract] J Clin Oncol 41 (Suppl 4): A-489, 2023.
- Dawson LA, Fairchild AM, Dennis K, et al.: Canadian Cancer Trials Group HE.1: A phase III study of palliative radiotherapy for symptomatic hepatocellular carcinoma and liver metastases. [Abstract] J Clin Oncol 41 (Suppl 4): A-LBA492, 2023.
Tratamiento del cáncer primario de hígado localmente avanzado o metastásico
Opciones de tratamiento para el cáncer primario de hígado localmente avanzado o metastásico
Las opciones de tratamiento para el cáncer primario de hígado localmente avanzado o metastásico que no es susceptible a intervención quirúrgica o locorregional son las siguientes:
Embolización transarterial y quimioembolización arterial transcatéter en pacientes con enfermedad no metastásica
La ETA es el tratamiento primario de mayor uso para el carcinoma hepatocelular (CHC) cuando este no es susceptible de tratamiento curativo por escisión o ablación. La mayor parte del suministro de sangre al parénquima normal del hígado proviene de la vena porta, mientras que el flujo de sangre al tumor proviene principalmente de la arteria hepática. Por otra parte, los tumores del CHC por lo general están hipervascularizados en comparación con el parénquima normal que los rodea. La obstrucción de una o varias de las ramas arteriales que alimentan el tumor quizás reduzca el flujo de sangre al tumor y produzca isquemia y necrosis tumoral.
Las sustancias de embolización, en microesferas y partículas, también se pueden administrar junto con dosis concentradas de fármacos quimioterapéuticos (por lo general doxorrubicina o cisplatino) mezcladas con lipidol u otros emulsionantes durante la quimioembolización, la quimioembolización arterial (a menudo por acceso percutáneo) y la QETA. Se considera ETA-QETA para pacientes de CHC en quienes no se indica la cirugía y que tampoco son aptos para una ablación percutánea, en ausencia de enfermedad extrahepática.
En los pacientes con cirrosis, es posible que cualquier interferencia con el suministro de sangre arterial se relacione con una morbilidad significativa y hay una contraindicación relativa cuando hay hipertensión portal, trombosis de la vena porta o ictericia clínica. En pacientes con descompensación hepática, el uso de ETA-QETA podría aumentar el riesgo de insuficiencia hepática.
En varios ensayos aleatorizados controlados se compararon ETA y QETA con la atención de apoyo.[1] Esos ensayos fueron heterogéneos en términos de las características demográficas iniciales y del tratamiento de los pacientes. En dos ensayos se demostró una ventaja de supervivencia de la ETA-QETA comparada con los cuidados médicos de apoyo.[2,3] No se ha determinado un abordaje estándar para la ETA (por ejemplo, embolizantes, fármacos quimioterapéuticos y dosis, y un esquema de tratamiento). Sin embargo, en un metanálisis se observó que la ETA-QETA mejora la supervivencia más que un tratamiento de apoyo.[1]
Es posible que el uso de microesferas farmacoactivas para la QETA reduzca los efectos secundarios sistémicos de la quimioterapia y aumente la respuesta objetiva del tumor.[4-7] En un solo estudio se indicó que las microesferas con QETA podrían ofrecer una ventaja para la supervivencia general (SG).[8]
Terapia sistémica de primera línea
Tradicionalmente, el sorafenib (inhibidor multicinasa) ha sido el tratamiento de referencia para los pacientes con CHC en estadio avanzado y funcionamiento hepático intacto (clase A de Child-Pugh) que no eran aptos para recibir terapia locorregional. Esta pauta se basaba en los resultados del ensayo SHARP, en el que se observó mejora de la SG en los pacientes que recibieron sorafenib en lugar de un placebo (10,7 vs. 7,9 meses; cociente de riesgos instantáneos [CRI], 0,69; P < 0,001). Sin embargo, es posible que los efectos adversos relacionados con el tratamiento dificulten el cumplimiento de los regímenes de sorafenib, en especial en una población con enfermedad hepática simultánea. Desde 2018, otros fármacos y combinaciones, como el atezolizumab-bevacizumab y el durvalumab-tremelimumab, han mejorado la SG, en comparación con el sorafenib, lo que ha dado lugar a su aprobación por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Otros regímenes han demostrado no ser inferiores al sorafenib, como el lenvatinib (un inhibidor multicinasa) y la inmunoterapia en monoterapia. Al elegir la terapia de primera línea, deben tenerse en cuenta los datos de supervivencia, las tasas de respuesta, el riesgo de hemorragia (es decir, varices activas) y la probabilidad de tolerar los tratamientos individuales.
Combinación de inmunoterapia y terapia dirigida
La combinación de atezolizumab (inhibidor anti-PD-L1) y bevacizumab (inhibidor del factor de crecimiento endotelial vascular [VEGF]) ha mejorado la SG, en comparación con el sorafenib. La FDA aprobó esta combinación para pacientes con CHC en estadio avanzado y funcionamiento hepático de clase A de Child-Pugh. Están en evaluación otras terapias combinadas.
Atezolizumab y bevacizumab
Evidencia (atezolizumab y bevacizumab):
- En el ensayo internacional, sin anonimato, de fase III Imbrave150 (NCT03434379), 501 pacientes con CHC irresecable que no habían recibido tratamiento sistémico previo se asignaron al azar en una proporción de 2:1 para recibir atezolizumab (1200 mg por vía intravenosa [IV]) y bevacizumab (15 mg/kg IV) cada 3 semanas (n = 336) o sorafenib (400 mg VO dos veces al día) (n = 165). Los criterios de elegibilidad incluían un funcionamiento hepático intacto (clase A de Child-Pugh) y se excluía a los pacientes con varices esofágicas o gástricas no tratadas o tratadas de forma incompleta.[9]
- La SG fue de 19,2 meses (intervalo de confianza [IC] 95 %, 17,0–23,7) en el grupo de atezolizumab-bevacizumab y de 13,4 meses (IC 95 %, 11,4–16,9) en el grupo de sorafenib (CRI, 0,66; IC 95 %, 0,52–0,85; P < 0,001).[9][Nivel de evidencia A1]
- Las tasas de respuesta objetiva fueron del 30 % (IC 95 %: 25–35 %) en el grupo de atezolizumab-bevacizumab y del 11 % (IC 95 %: 7–17 %) en el grupo de sorafenib.
- En los análisis de subgrupos, el beneficio para la SG fue en general consistente, pero con menor efecto en aquellos con CHC de origen diferente al vírico.
- Se produjeron efectos adversos relacionados con el tratamiento de grado 3 o superior en el 63 % de los pacientes del grupo de atezolizumab-bevacizumab y en el 57 % de los pacientes del grupo de sorafenib.[10]
Atezolizumab y cabozantinib
Evidencia (atezolizumab y cabozantinib):
- En el ensayo internacional, sin enmascaramiento, de fase III COSMIC-312 (NCT03755791), 837 pacientes con CHC irresecable que no habían recibido tratamiento sistémico previo se asignaron al azar en una proporción de 2:1:1 para recibir cabozantinib (40 mg VO al día) con atezolizumab (1200 mg IV cada 3 semanas), sorafenib (400 mg VO 2 veces al día) o cabozantinib (60 mg al día). Los criterios de elegibilidad incluían un funcionamiento hepático intacto (clase A de Child-Pugh) y excluían a los pacientes con varices gástricas o esofágicas con hemorragia activa en los 6 meses anteriores a la inscripción.[11]
- Mediante el primer criterio principal de valoración se exploró la mediana de la supervivencia sin progresión (SSP) en los primeros 372 pacientes que se asignaron al azar a recibir el tratamiento combinado o sorafenib. Entre esos pacientes, la mediana de la SSP fue de 6,8 meses (IC 99 %, 5,6–8,3) en el grupo de cabozantinib-atezolizumab y de 4,2 meses (IC 95 %, 2,8–7,0) en el grupo de sorafenib (CRI, 0,63; IC 99 %, 0,44–0,91; P = 0,0012).[11][Nivel de evidencia B1]
- Sin embargo, en el análisis intermedio, la SG fue similar: 15,4 meses (IC 96 %, 13,7–17,7) en los pacientes del grupo de la combinación cabozantinib-atezolizumab (n = 432) y 15,5 meses (12,1–no estimable) en los pacientes del grupo de sorafenib (n = 217) (CRI, 0,90; IC 96 %, 0,69–1,18; P = 0,44).
- En el análisis intermedio, la SSP fue de 5,8 meses (IC 99 %, 5,4–8,2) en el grupo de cabozantinib y de 4,3 meses (IC 99 %, 2,9–6,1) en el grupo de sorafenib (CRI, 0,71; IC 99 %, 0,51–1,01; P = 0,011).
- Las tasas de respuesta objetiva fueron del 11 % (8,1–14,2 %) en el grupo de cabozantinib-atezolizumab, del 4 % (1,6–7,1 %) en el grupo de sorafenib y del 6 % (3,3–10,9 %) en el grupo de cabozantinib.
- Se produjeron efectos adversos relacionados con el tratamiento de grado 3 o superior en el 76 % de los pacientes del grupo de cabozantinib-atezolizumab, en el 57 % de los pacientes del grupo de sorafenib y en el 76 % de los pacientes del grupo de cabozantinib.
Combinación de inmunoterapia sola
Mientras que los inhibidores de los puntos de control inmunitarios en monoterapia no han demostrado ninguna mejora de la supervivencia con respecto a los inhibidores de tirosina–cinasas (ITC), los inhibidores duales de los puntos de control inmunitarios han mostrado una mejora de las tasas de respuesta objetiva y de la SG, pero con un aumento de los efectos secundarios autoinmunitarios. Está en evaluación la dosificación óptima de las terapias combinadas. En 2022, a partir de los datos que siguen a continuación, la FDA aprobó la combinación de una dosis única de preparación terapéutica de tremelimumab con durvalumab cada 4 semanas.
Inhibidores de puntos de control inmunitarios en biterapia
Evidencia (inhibidores de puntos de control inmunitarios en biterapia):
- En el ensayo internacional, sin enmascaramiento, de fase III HIMALAYA (NCT03298451) se incluyó a 1171 pacientes con CHC irresecable y enfermedad hepática de clase A de Child-Pugh que no habían recibido tratamiento sistémico previo. Los pacientes se asignaron al azar en una proporción de 1:1:1 para recibir STRIDE (una dosis única de tremelimumab 300 mg IV) con durvalumab (1500 mg IV) cada 4 semanas, durvalumab en monoterapia (1500 mg IV cada 4 semanas) o sorafenib (500 mg VO 2 veces al día).[12]
- La mediana de SG fue de 16,43 meses (IC 95 %, 14,16–19,58) en el grupo de la combinación tremelimumab-durvalumab y de 13,77 meses (IC 95 %, 12,25–16,13) en el grupo de sorafenib (CRI, 0,78; IC 96,02 %, 0,65–0,93; P = 0,0035).[12][Nivel de evidencia A1]
- La tasa de respuesta objetiva fue del 20,1 % en los pacientes que recibieron STRIDE y del 5,1 % en los pacientes que recibieron sorafenib.
- Se produjeron efectos adversos relacionados con el tratamiento de grado 3 o superior en el 50,5 % de los pacientes que recibieron la combinación de tremelimumab y durvalumab y en el 52,4 % de los pacientes que recibieron sorafenib.
Inhibidores de puntos de control inmunitarios en monoterapia
Evidencia (inhibidores de puntos de control inmunitarios en monoterapia):
- En el ensayo HIMALAYA comentado más arriba se analizaron los criterios de valoración de los pacientes asignados al azar al grupo de monoterapia con durvalumab (n = 389) o al grupo de monoterapia con sorafenib (n = 389).[12]
- La mediana de SG de los pacientes que recibieron durvalumab en monoterapia (16,56 meses; IC 95%, 14,06–19,12) no fue inferior a la mediana de SG de los pacientes que recibieron sorafenib en monoterapia (13,77 meses; IC 95 %, 12,25–16,13) (CRI, 0,86; IC 95,67 %, 0,73–1,03; margen de ausencia de inferioridad, 1,08).[12][Nivel de evidencia B3]
- La tasa de respuesta objetiva fue del 8,2 % en el grupo de durvalumab y del 4,9 % en el grupo de sorafenib.
- Se produjeron efectos adversos relacionados con el tratamiento de grado 3 o superior en el 37,1 % de los pacientes que recibieron durvalumab.
- En el ensayo aleatorizado, sin enmascaramiento y de fase III CheckMate 459 (NCT02576509) participaron 743 pacientes con enfermedad hepática de clase A de Child-Pugh y CHC irresecable que no habían recibido tratamiento sistémico. Los pacientes se asignaron al azar en una proporción de 1:1 para recibir nivolumab (n = 371) o sorafenib (n = 372).[13]
- La mediana de SG fue de 16,4 meses (IC 95 %, 13,9–18,4) en el grupo de nivolumab y de 14,7 meses (IC 95%, 11,9–17,2) en el grupo de sorafenib (CRI, 0,85; IC 95 %, 0,72–1,02; P = 0,075).[13][Nivel de evidencia B3]
- La tasa de respuesta objetiva fue del 15 % (IC 95%, 12–19 %) en el grupo de nivolumab y del 7 % (IC 95 %, 5–10 %) en el grupo de sorafenib.
- Se produjeron efectos adversos relacionados con el tratamiento de grado 3 o superior en el 23 % de los pacientes que recibieron nivolumab y en el 49 % de los pacientes que recibieron sorafenib.
Terapia dirigida (inhibidores multicinasa)
La FDA aprobó dos inhibidores multicinasa orales, sorafenib y lenvatinib, como tratamiento de primera línea en pacientes con CHC en estadio avanzado cuyo funcionamiento hepático está bien compensado y que no son aptos para recibir terapias locales.
Hay pocos datos sobre las opciones de tratamiento para pacientes con funcionamiento hepático descompensado.
Lenvatinib
Evidencia (lenvatinib):
- En un ensayo internacional, sin enmascaramiento, de fase III y ausencia de inferioridad (E7080-G000-304 [NCT01761266]) en el que se incluyó a pacientes de 20 países de Asia, Europa y Norteamérica, 954 pacientes con CHC en estadio avanzado y enfermedad de clase A de Child-Pugh se asignaron al azar en una proporción de 1:1 a recibir lenvatinib (12 mg cada día para pacientes con peso corporal >60 kg o 8 mg para pacientes con peso corporal <60 kg) o sorafenib (400 mg 2 veces al día en ciclos de 28 días).[14] Se excluyeron los pacientes con compromiso hepático superior al 50 % e invasión de la vena porta.
- La mediana de SG fue de 13,6 meses, que alcanzó la ausencia de inferioridad, en los pacientes que recibieron lenvatinib y de 12,3 meses en los pacientes que recibieron sorafenib (CRI, 0,92; IC 95 %, 0,79–1,06).[14][Nivel de evidencia B1]
- La mediana de SSP fue de 7,4 meses en los pacientes que recibieron lenvatinib y de 3,7 meses en los pacientes que recibieron sorafenib (CRI, 0,66; IC 95 %, 0,57–0,77).
- Los efectos adversos del tratamiento fueron similares en el grupo de lenvatinib y el grupo de sorafenib.
- En el grupo de lenvatinib, los efectos secundarios más frecuentes fueron hipertensión (de cualquier grado, 42 %), diarrea (39 %), disminución del apetito (34 %) y pérdida de peso (31 %); 11 muertes se relacionaron con el tratamiento (insuficiencia hepática, hemorragia e insuficiencia respiratoria).
- En el grupo de sorafenib, los efectos secundarios más comunes fueron eritrodisestesia palmoplantar (de cualquier grado, 52 %), diarrea (46 %), hipertensión (30 %) y disminución del apetito (27 %); 4 muertes se relacionaron con el tratamiento (hemorragia, accidente cerebrovascular, insuficiencia respiratoria y muerte súbita).
Sorafenib
Evidencia (sorafenib):
- En el ensayo SHARP (NCT00105443) se asignó al azar a 602 pacientes con CHC en estadio avanzado para recibir sorafenib 400 mg 2 veces al día o un placebo. Excepto 20 pacientes, todos los demás tenían un puntaje de Childs-Pugh de clase A para la enfermedad hepática; el 13 % eran mujeres.[15]
- El estudio se interrumpió en el segundo análisis intermedio previsto, tras 321 muertes. La mediana de supervivencia fue significativamente más prolongada en el grupo de sorafenib que en el de placebo (10,7 meses vs. 7,9 meses; el CRI favoreció al grupo de sorafenib, 0,69; IC 95 %, 0,55–0,87; P < 0,001).
- En un ensayo posterior similar, realizado en 23 centros de China, Corea del Sur y Taiwán, se incluyó a 226 pacientes (97 % con funcionamiento hepático de clase A de Child-Pugh), y el doble de pacientes se asignaron al azar a recibir sorafenib o un placebo.[16]
- La mediana de SG fue de 6,5 meses en el grupo de sorafenib versus 4,2 meses en el grupo de placebo (CRI, 0,68; IC 95 %, 0,50–0,93; P = 0,014).
Los efectos adversos atribuidos al sorafenib en ambos ensayos incluyeron erupción palmoplantar y diarrea.[15,16]
También hay estudios en curso para evaluar la función del sorafenib después de QETA, con quimioterapia o en presencia de una enfermedad hepática más avanzada.
Terapia sistémica de segunda línea
Los ITC (regorafenib y cabozantinib) y los inhibidores del punto de control inmunitario (pembrolizumab y combinación de nivolumab con ipilimumab) están aprobados para el tratamiento de segunda línea de pacientes con CHC en estadio avanzado que progresó durante el tratamiento con sorafenib. Sin embargo, no se ha determinado cuál es el tratamiento de segunda línea más eficaz tras la combinación de primera línea de atezolizumab y bevacizumab. Los médicos pueden considerar otros tratamientos aprobados en primera línea (por ejemplo, lenvatinib después de atezolizumab y bevacizumab o inhibidores de puntos de control inmunitarios).
Terapia dirigida (inhibidores multicinasa)
Regorafenib
Evidencia (regorafenib):
- En un ensayo internacional, con enmascaramiento doble y controlado con placebo de fase III (RESORCE [NCT01774344]) participaron pacientes de 21 países de Asia, Europa, Norteamérica, Sudamérica y Australia. Se incluyeron 573 pacientes de CHC en estadio avanzado y enfermedad de clase A de Child-Pugh que habían tolerado sorafenib, pero presentaban progresión de la enfermedad. Los pacientes se asignaron al azar en una proporción de 2:1 a recibir regorafenib (160 mg/día los días 1–21 de un ciclo de 28 días) o placebo.[17]
- La mediana de SG fue de 10,6 meses en los pacientes que recibieron regorafenib y de 7,8 meses en los pacientes que recibieron placebo (CRI, 0,63; IC 95 %, 0,50–0,79).[17][Nivel de evidencia A1]
- La mediana de SSP fue de 3,1 meses en los pacientes a los que se administró regorafenib y de 1,5 meses en los pacientes que recibieron placebo.
- Los efectos secundarios más comunes de grado 3 y 4 relacionados con el regorafenib fueron hipertensión (15 %), eritrodisestesia palmoplantar (13 %), fatiga (9 %) y diarrea (3 %).
Cabozantinib
Evidencia (cabozantinib):
- En un ensayo internacional, con enmascaramiento doble y controlado con placebo, de fase III (CELESTIAL [NCT01908426]) en el que se inscribieron pacientes de 19 países de Asia, Europa, Norteamérica, Australia y Nueva Zelanda, se asignó de manera aleatoria a 707 pacientes con CHC en estadio avanzado y enfermedad de clase A de Child-Pugh que ya habían recibido sorafenib y cuya enfermedad progresó con, al menos, un tratamiento sistémico anterior, en una proporción de 2:1 para recibir cabozantinib (60 mg/día) o un placebo. El criterio principal de valoración fue la mediana de SG.[18]
- La mediana de SG fue de 10,2 meses en los pacientes que recibieron cabozantinib y de 8,0 meses en los pacientes que recibieron placebo (CRI, 0,76; IC 95 %, 0,63–0,92, P = 0,005).[18][Nivel de evidencia A1]
- La mediana de SSP fue de 1,9 meses en los pacientes que recibieron placebo y de 5,2 meses en los pacientes que recibieron cabozantinib (CRI, 0,44; IC 95 %, 0,36–0,52, P < 0,001).
- Se presentaron efectos adversos de grado 3 o 4 en el 68 % de los pacientes que recibieron cabozantinib en comparación con el 37 % de los que recibieron placebo. Los efectos adversos de grado 3 o 4 más comunes del cabozantinib fueron eritrodisestesia palmoplantar (17 %), hipertensión (16 %), concentraciones anormales de aspartato–aminotransferasa (12 %), diarrea (11 %) y cansancio (10 %).
Si bien estos hallazgos son estadísticamente significativos para la SG y la SSP, la mejora absoluta de la SG fue pequeña y la toxicidad elevada, además, no se cuenta con datos sobre calidad de vida que ayuden a guiar la selección del régimen y a decidir quién debe recibir tratamiento. Estos factores se deben considerar y evaluar de manera individual para cada paciente.
Combinación de inmunoterapia e inmunoterapia sola
Pembrolizumab
Evidencia (pembrolizumab):
- En un estudio internacional de fase II, sin enmascaramiento, de un solo grupo (KEYNOTE-224 [NCT02702414]), se incluyeron 104 pacientes de toda Europa, Norteamérica y Japón, con enfermedad en estadio B o C según el sistema de estadificación Barcelona Clinic Liver Cancer (BCLC). Los pacientes presentaban CHC en estadio avanzado resistente al tratamiento con sorafenib o intolerancia a este fármaco, y recibieron pembrolizumab (200 mg IV cada 3 semanas).[19]
- En el estudio de fase III KEYNOTE-394 (NCT03062358) se incluyó a 453 pacientes de Asia con CHC en estadio avanzado que recibieron con anterioridad tratamiento con sorafenib o quimioterapia a base de oxaliplatino. Los pacientes se asignaron al azar en una proporción de 2:1 para recibir pembrolizumab (200 mg IV) o placebo cada 3 semanas durante un máximo de 35 ciclos.[21]
- La SG fue de 14,6 meses (IC 95 %, 12,6–18,0) en el grupo de pembrolizumab y de 13,0 meses (IC 95%, 10,5–15,1) en el grupo de placebo (CRI, 0,79; IC 95 %, 0,63–0,99; P = 0,0180). En particular, la tasa de SG a 24 meses fue del 34,3 % en el grupo de pembrolizumab y del 24,9 % en el grupo de placebo.[21][Nivel de evidencia A1]
- Se produjeron efectos adversos relacionados con el tratamiento de grado 3 o superior en el 14,4 % de los pacientes del grupo de pembrolizumab y en el 5,9 % de los pacientes del grupo de placebo.
A partir de estos datos, la FDA otorgó la aprobación acelerada del pembrolizumab para pacientes con CHC en estadio avanzado que ya se trataron con sorafenib.
Nivolumab e ipilimumab
Evidencia (nivolumab e ipilimumab):
- En la cohorte 4 del CheckMate 040 (NCT01658878), un estudio multicéntrico, sin enmascaramiento, de fase I/II, participaron 148 pacientes con CHC en estadio avanzado y funcionamiento hepático Child-Pugh de clase A que ya se habían tratado con sorafenib. Los pacientes se asignaron al azar en una proporción de 1:1:1 a una de las 3 dosis siguientes:[22]
- Grupo A: 1 mg/kg de nivolumab con 3 mg/kg de ipilimumab cada 3 semanas durante 4 dosis, seguido de 240 mg de nivolumab de mantenimiento cada 2 semanas.
- Grupo B: 3 mg/kg de nivolumab con 1 mg/kg de ipilimumab cada 3 semanas durante 4 dosis, seguido de 240 mg de nivolumab de mantenimiento cada 2 semanas.
- Grupo C: 3 mg/kg de nivolumab cada 2 semanas con 1 mg/kg de ipilimumab cada 6 semanas.
- La mediana de SG fue de 22,8 meses (IC 95 %, 9,4–no alcanzada) en el grupo A, de 12,5 meses (IC 95 %, 7,6–16,4) en el grupo B y de 12,7 meses (IC 95 %, 7,4–33,0) en el grupo C.[22][Nivel de evidencia A1]
- Las tasas de respuesta objetiva fueron del 32 % (IC 95 %, 20–47 %) en el grupo A, del 27 % (IC 95 %, 15–41 %) en el grupo B y del 29 % (IC 95 %, 17–43 %) en el grupo C.
- Se produjeron efectos adversos relacionados con el tratamiento de grado 3 o superior en el 76 % de los pacientes del grupo A, el 65 % de los pacientes del grupo B y el 69 % de los pacientes del grupo C.
A partir de estos datos, la FDA otorgó la aprobación acelerada de nivolumab (1 mg/kg IV) con ipilimumab (3 mg/kg IV cada 3 semanas durante 4 dosis), seguido de nivolumab (240 mg IV cada 2 semanas) para pacientes con CHC en estadio avanzado que ya se trataron con sorafenib.[23]
Ramucirumab
El ramucirumab se usa únicamente para pacientes con concentraciones de alfa fetoproteína (AFP) de 400 ng/ml o superiores.
Evidencia (ramucirumab):
- En el ensayo REACH (NCT01140347) se asignaron al azar 565 pacientes con CHC avanzado para recibir ramucirumab o placebo después de un tratamiento de primera línea con sorafenib. El criterio principal de valoración fue la SG.[24][Nivel de evidencia A1]
- El beneficio de SG no fue estadísticamente significativo (9,2 meses [IC 95 %, 8,0–10,6] en el grupo de ramucirumab y 7,6 meses [IC 95 %, 6,0–9,3] en el grupo de placebo).
- En un análisis de subgrupo no planificado se observó que los pacientes con respuesta de la AFP presentaban una supervivencia superior que los pacientes sin dicha respuesta.
- En el ensayo REACH-2 (NCT02435433) se incluyeron 292 pacientes con un estado funcional del Eastern Cooperative Oncology Group de 0 a 1, una concentración de AFP de al menos 400 ng/ml y enfermedad hepática de clase A de Child-Pugh que habían recibido tratamiento con sorafenib. Los pacientes se asignaron al azar para recibir ramucirumab o placebo.[25,26][Nivel de evidencia A1]
- La SG y la SSP mejoraron en los pacientes que recibieron ramucirumab. La mediana de SG fue de 8,5 meses (IC 95 %, 7,0–10,6) en los pacientes que recibieron ramucirumab y de 7,3 meses (IC 95 %, 5,4–9,1) en los pacientes que recibieron placebo (CRI, 0,710; IC 95 %, 0,531–0,949; P = 0,0199).
- En un análisis conjunto de los pacientes de REACH con AFP superior a 400 ng/ml y de pacientes de REACH-2 se observó una mejora con independencia del estadio BCLC.[27][Nivel de evidencia C1]
- Entre los pacientes con enfermedad en estadio B del BCLC, la mediana de SG fue de 13,7 meses en el grupo de ramucirumab y de 8,2 meses en el grupo de placebo (CRI, 0,43; IC 95 %, 0,23–0,83). Entre los pacientes con enfermedad en estadio C del BCLC, la mediana de SG fue de 7,7 meses en el grupo de ramucirumab y de 4,8 meses en el grupo de placebo (CRI, 0,72; IC 95 %, 0,59–0,89).
Nivolumab
Evidencia (nivolumab):
- En un ensayo sin enmascaramiento de fase I/II con un solo grupo se estudió el aumento gradual y la ampliación de la dosis (CheckMate 040 [NCT01658878]) en 262 pacientes con CHC avanzado y funcionamiento hepático bien compensado. De esos pacientes, 48 estaban inscritos en la fase de aumento de la dosis y 214 en la fase de ampliación de la dosis con 3 mg/kg de nivolumab. Los pacientes recibieron tratamiento con nivolumab cada 2 semanas.[28] Las cohortes incluyeron a pacientes con infección activa por el virus de la hepatitis B (VHB) o el virus de la hepatitis C (VHC), pacientes sin infección con enfermedad no tratada con sorafenib y pacientes sin infección con enfermedad resistente al tratamiento con sorafenib.
- La tasa total de respuesta objetiva global en la fase de ampliación de la dosis fue del 20 % (IC 95 %, 15–26 %) y se presentaron 3 respuestas completas. Los resultados fueron similares en pacientes no tratados, que no respondieron al tratamiento e infectados por el VHB o el VHC.[28][Nivel de evidencia B4]
No obstante, en función de los requisitos de postcomercialización que mostraban la falta de beneficios confirmatorios, la indicación de nivolumab en monoterapia en el contexto de segunda línea se retiró en 2021.
Radioterapia
En varios estudios de fase II se indicó un beneficio de la radioterapia en el control local y la SG en comparación con los controles históricos para pacientes de CHC localmente avanzado que no son aptos para las terapias locorregionales estándar.[29,30][Nivel de evidencia C2]
La radioterapia corporal estereotáctica (RTCE) con intención curativa mejoró la SG en un grupo de pacientes con CHC del estudio NRG/RTOG 1112 (NCT01730937), publicado como resumen. En la mayoría de los estudios se incluyeron pacientes con cirrosis de clase A de Child-Pugh. Los pacientes con cirrosis de clases B o C de Child-Pugh también pueden recibir radiación hepática, aunque con un riesgo más alto de toxicidad.[31][Nivel de evidencia B1]
En muchos centros se administra RTCE de fotones, mientras que otros también ofrecen radiación de protones (o de otro ion pesado) para el hígado. De acuerdo con datos retrospectivos, la radioterapia de protones permite reducir la dosis dirigida al hígado normal y aumentar de manera regulada la dosis dirigida al tumor hepático.[32,33] En ensayos clínicos, como NRG-GI003 (NCT03186898), se está evaluando si la terapia de fotones o protones es superior para los pacientes con CHC.
La radioterapia paliativa mejoró la respuesta al dolor en un ensayo aleatorizado publicado como resumen. Las dosis más usadas fueron de 30 Gy en 10 fracciones y de 8 Gy en 1 fracción. Para obtener más informacion, consultar la sección Radioterapia en Tratamiento del cáncer de hígado localizado.[34][Nivel de evidencia B3]
Quimioterapia sistémica
Por el momento, no hay evidencia que sustente algún beneficio para la supervivencia de pacientes con CHC avanzado que reciben quimioterapia sistémica citotóxica en comparación con la ausencia de tratamiento o los mejores cuidados médicos de apoyo.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Llovet JM, Bruix J: Systematic review of randomized trials for unresectable hepatocellular carcinoma: Chemoembolization improves survival. Hepatology 37 (2): 429-42, 2003. [PUBMED Abstract]
- Llovet JM, Real MI, Montaña X, et al.: Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomised controlled trial. Lancet 359 (9319): 1734-9, 2002. [PUBMED Abstract]
- Lo CM, Ngan H, Tso WK, et al.: Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology 35 (5): 1164-71, 2002. [PUBMED Abstract]
- Malagari K, Pomoni M, Kelekis A, et al.: Prospective randomized comparison of chemoembolization with doxorubicin-eluting beads and bland embolization with BeadBlock for hepatocellular carcinoma. Cardiovasc Intervent Radiol 33 (3): 541-51, 2010. [PUBMED Abstract]
- Varela M, Real MI, Burrel M, et al.: Chemoembolization of hepatocellular carcinoma with drug eluting beads: efficacy and doxorubicin pharmacokinetics. J Hepatol 46 (3): 474-81, 2007. [PUBMED Abstract]
- Poon RT, Tso WK, Pang RW, et al.: A phase I/II trial of chemoembolization for hepatocellular carcinoma using a novel intra-arterial drug-eluting bead. Clin Gastroenterol Hepatol 5 (9): 1100-8, 2007. [PUBMED Abstract]
- Lammer J, Malagari K, Vogl T, et al.: Prospective randomized study of doxorubicin-eluting-bead embolization in the treatment of hepatocellular carcinoma: results of the PRECISION V study. Cardiovasc Intervent Radiol 33 (1): 41-52, 2010. [PUBMED Abstract]
- Dhanasekaran R, Kooby DA, Staley CA, et al.: Comparison of conventional transarterial chemoembolization (TACE) and chemoembolization with doxorubicin drug eluting beads (DEB) for unresectable hepatocelluar carcinoma (HCC). J Surg Oncol 101 (6): 476-80, 2010. [PUBMED Abstract]
- Finn RS, Qin S, Ikeda M, et al.: Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med 382 (20): 1894-1905, 2020. [PUBMED Abstract]
- Cheng AL, Qin S, Ikeda M, et al.: Updated efficacy and safety data from IMbrave150: Atezolizumab plus bevacizumab vs. sorafenib for unresectable hepatocellular carcinoma. J Hepatol 76 (4): 862-873, 2022. [PUBMED Abstract]
- Kelley RK, Rimassa L, Cheng AL, et al.: Cabozantinib plus atezolizumab versus sorafenib for advanced hepatocellular carcinoma (COSMIC-312): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 23 (8): 995-1008, 2022. [PUBMED Abstract]
- Abou-Alfa GK, Lau G, Kudo M, et al.: Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. NEJM Evid 1 (8): 2022. Available online. Last accessed March 15, 2024.
- Yau T, Park JW, Finn RS, et al.: Nivolumab versus sorafenib in advanced hepatocellular carcinoma (CheckMate 459): a randomised, multicentre, open-label, phase 3 trial. Lancet Oncol 23 (1): 77-90, 2022. [PUBMED Abstract]
- Kudo M, Finn RS, Qin S, et al.: Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. Lancet 391 (10126): 1163-1173, 2018. [PUBMED Abstract]
- Llovet JM, Ricci S, Mazzaferro V, et al.: Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 359 (4): 378-90, 2008. [PUBMED Abstract]
- Cheng AL, Kang YK, Chen Z, et al.: Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol 10 (1): 25-34, 2009. [PUBMED Abstract]
- Bruix J, Qin S, Merle P, et al.: Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 389 (10064): 56-66, 2017. [PUBMED Abstract]
- Abou-Alfa GK, Meyer T, Cheng AL, et al.: Cabozantinib in Patients with Advanced and Progressing Hepatocellular Carcinoma. N Engl J Med 379 (1): 54-63, 2018. [PUBMED Abstract]
- Zhu AX, Finn RS, Edeline J, et al.: Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib (KEYNOTE-224): a non-randomised, open-label phase 2 trial. Lancet Oncol 19 (7): 940-952, 2018. [PUBMED Abstract]
- Kudo M, Finn RS, Edeline J, et al.: Updated efficacy and safety of KEYNOTE-224: a phase II study of pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib. Eur J Cancer 167: 1-12, 2022. [PUBMED Abstract]
- Qin S, Chen Z, Fang W, et al.: Pembrolizumab Versus Placebo as Second-Line Therapy in Patients From Asia With Advanced Hepatocellular Carcinoma: A Randomized, Double-Blind, Phase III Trial. J Clin Oncol 41 (7): 1434-1443, 2023. [PUBMED Abstract]
- Yau T, Kang YK, Kim TY, et al.: Efficacy and Safety of Nivolumab Plus Ipilimumab in Patients With Advanced Hepatocellular Carcinoma Previously Treated With Sorafenib: The CheckMate 040 Randomized Clinical Trial. JAMA Oncol 6 (11): e204564, 2020. [PUBMED Abstract]
- Saung MT, Pelosof L, Casak S, et al.: FDA Approval Summary: Nivolumab Plus Ipilimumab for the Treatment of Patients with Hepatocellular Carcinoma Previously Treated with Sorafenib. Oncologist 26 (9): 797-806, 2021. [PUBMED Abstract]
- Zhu AX, Park JO, Ryoo BY, et al.: Ramucirumab versus placebo as second-line treatment in patients with advanced hepatocellular carcinoma following first-line therapy with sorafenib (REACH): a randomised, double-blind, multicentre, phase 3 trial. Lancet Oncol 16 (7): 859-70, 2015. [PUBMED Abstract]
- Chau I, Park JO, Ryoo BY, et al.: Alpha-fetoprotein kinetics in patients with hepatocellular carcinoma receiving ramucirumab or placebo: an analysis of the phase 3 REACH study. Br J Cancer 119 (1): 19-26, 2018. [PUBMED Abstract]
- Zhu AX, Kang YK, Yen CJ, et al.: Ramucirumab after sorafenib in patients with advanced hepatocellular carcinoma and increased α-fetoprotein concentrations (REACH-2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 20 (2): 282-296, 2019. [PUBMED Abstract]
- Kudo M, Finn RS, Morimoto M, et al.: Ramucirumab for Patients with Intermediate-Stage Hepatocellular Carcinoma and Elevated Alpha-Fetoprotein: Pooled Results from Two Phase 3 Studies (REACH and REACH-2). Liver Cancer 10 (5): 451-460, 2021. [PUBMED Abstract]
- El-Khoueiry AB, Sangro B, Yau T, et al.: Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial. Lancet 389 (10088): 2492-2502, 2017. [PUBMED Abstract]
- Bujold A, Massey CA, Kim JJ, et al.: Sequential phase I and II trials of stereotactic body radiotherapy for locally advanced hepatocellular carcinoma. J Clin Oncol 31 (13): 1631-9, 2013. [PUBMED Abstract]
- Kawashima M, Furuse J, Nishio T, et al.: Phase II study of radiotherapy employing proton beam for hepatocellular carcinoma. J Clin Oncol 23 (9): 1839-46, 2005. [PUBMED Abstract]
- Dawson LA, Winter KA, Knox JJ, et al.: NRG/RTOG 1112: Randomized phase III study of sorafenib vs. stereotactic body radiation therapy (SBRT) followed by sorafenib in hepatocellular carcinoma (HCC). [Abstract] J Clin Oncol 41 (Suppl 4): A-489, 2023.
- Sugahara S, Oshiro Y, Nakayama H, et al.: Proton beam therapy for large hepatocellular carcinoma. Int J Radiat Oncol Biol Phys 76 (2): 460-6, 2010. [PUBMED Abstract]
- Hong TS, Wo JY, Yeap BY, et al.: Multi-Institutional Phase II Study of High-Dose Hypofractionated Proton Beam Therapy in Patients With Localized, Unresectable Hepatocellular Carcinoma and Intrahepatic Cholangiocarcinoma. J Clin Oncol 34 (5): 460-8, 2016. [PUBMED Abstract]
- Dawson LA, Fairchild AM, Dennis K, et al.: Canadian Cancer Trials Group HE.1: A phase III study of palliative radiotherapy for symptomatic hepatocellular carcinoma and liver metastases. [Abstract] J Clin Oncol 41 (Suppl 4): A-LBA492, 2023.
Tratamiento del cáncer primario de hígado recidivante
Opciones de tratamiento del cáncer primario de hígado recidivante
La recidiva intrahepática es el patrón más común de fracaso posterior al tratamiento curativo.[1] La recidiva intrahepática del carcinoma hepatocelular (CHC) a veces es el resultado de metástasis intrahepáticas o un tumor metacrónico de nueva aparición. En teoría, las metástasis intrahepáticas en ocasiones se relacionan con desenlaces menos favorables debido a que es más probable que sean el resultado de metástasis hematógenas simultáneas. Sin embargo, en la práctica clínica no se pueden diferenciar las dos causas de recidiva.
Las opciones de tratamiento para los pacientes con cáncer primario de hígado recidivante con enfermedad limitada al hígado sin compromiso vascular son las siguientes:
- Trasplante de hígado.
- Resección quirúrgica.
- Ablación.
Las opciones de tratamiento para los pacientes con cáncer primario de hígado recidivante con enfermedad extrahepática o compromiso vascular son las siguientes:
- Terapia paliativa (quimioembolización arterial transcatéter [QETA] y terapia sistémica).
En lo que respecta al CHC primario, la estrategia de tratamiento para el CHC intrahepático recidivante se determina por el funcionamiento del hígado y las características tumorales macroscópicas (por ejemplo, número de lesiones, sitio de recidiva e invasión de los vasos principales). Para el CHC recidivante, es posible ofrecer tratamiento curativo (es decir, trasplante hepático de rescate, resección quirúrgica y ablación) o tratamientos paliativos (por ejemplo, QETA y sorafenib) utilizando los mismos criterios de selección usados para el CHC primario.
Evidencia (trasplante hepático de rescate, resección quirúrgica y ablación):
- En un estudio retrospectivo de 183 pacientes con recidiva intrahepática, solo 87 de los pacientes se pudieron tratar con intención curativa (trasplante, resección y ablación).[2][Nivel de evidencia A2]
- La tasa de supervivencia sin tumor a 5 años fue del 57,9 % para el trasplante de hígado, del 49,3 % para la resección y del 10,6 % para la ablación por radiofrecuencia). En el análisis de subgrupos se observó que el trasplante y la resección produjeron una supervivencia comparable y que ambos tratamientos condujeron a resultados significativamente mejores que la ablación (P < 0,001); sin embargo, el sesgo de selección fue una deficiencia importante en este estudio retrospectivo.
- Aparte del uso de la ablación para el tratamiento secundario, se identificaron factores de riesgo para una supervivencia sin enfermedad más corta, como las concentraciones de alfafetoproteína en la sangre superiores a 400 ng/ml y recidiva dentro de 1 año del tratamiento (47,5 % vs. 6,7 % a 5 años; P < 0,001).
En otros estudios también se indicó que la mayoría de las recidivas que aparecen temprano durante el seguimiento son causadas por la diseminación tumoral y tienen un comportamiento biológico más maligno que los tumores primarios.[3,4]
Los ensayos clínicos son apropiados y, siempre que sea posible, se deben ofrecer a los pacientes de CHC recidivante.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Fan ST, Poon RT, Yeung C, et al.: Outcome after partial hepatectomy for hepatocellular cancer within the Milan criteria. Br J Surg 98 (9): 1292-300, 2011. [PUBMED Abstract]
- Chan AC, Chan SC, Chok KS, et al.: Treatment strategy for recurrent hepatocellular carcinoma: salvage transplantation, repeated resection, or radiofrequency ablation? Liver Transpl 19 (4): 411-9, 2013. [PUBMED Abstract]
- Minagawa M, Makuuchi M, Takayama T, et al.: Selection criteria for repeat hepatectomy in patients with recurrent hepatocellular carcinoma. Ann Surg 238 (5): 703-10, 2003. [PUBMED Abstract]
- Chen YJ, Yeh SH, Chen JT, et al.: Chromosomal changes and clonality relationship between primary and recurrent hepatocellular carcinoma. Gastroenterology 119 (2): 431-40, 2000. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (04/11/2024)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Información general sobre el cáncer primario de hígado
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2024 (se citó a la American Cancer Society como referencia 1).
Tratamiento del cáncer primario de hígado localizado
Se añadió Radioterapia como subsección nueva.
Tratamiento del cáncer primario de hígado localmente avanzado o metastásico
Se añadió Ramucirumab como subsección nueva.
La sección Radioterapia fue objeto de amplia revisión.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer primario de hígado en adultos. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El Consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer primario de hígado son:
- Russell S. Berman, MD (New York University School of Medicine)
- Amit Chowdhry, MD, PhD (University of Rochester Medical Center)
- Valerie Lee, MD (Johns Hopkins University)
- Leon Pappas, MD, PhD (Dana-Farber Cancer Institute)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El Consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer primario de hígado. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/higado/pro/tratamiento-higado-adultos-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.