Tratamiento del cáncer de colon (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer de colon
El cáncer de colon es una enfermedad muy tratable, y a menudo curable, cuando se localiza en el intestino. El tratamiento primario es la cirugía, que es curativa en cerca del 50 % de los pacientes. Sin embargo, la recidiva después de la cirugía es un problema importante que a menudo constituye la causa definitiva de muerte.
Incidencia y mortalidad
El cáncer colorrectal es la tercera forma más común de cáncer en el mundo. En 2022, se calculó que hubo 1,93 millones de nuevos casos de cáncer colorrectal y 903 859 defunciones.[1]
Número estimado de casos nuevos y defunciones por cáncer de colon y recto en los Estados Unidos en 2025:[2]
- Casos nuevos de cáncer de colon: 107 320.
- Casos nuevos de cáncer de recto: 46 950.
- Defunciones: 52 900 (casos de cáncer de colon y recto combinados).
En el colon también se forman tumores de estroma gastrointestinal. Para obtener más información, consultar Tratamiento de los tumores de estroma gastrointestinal.
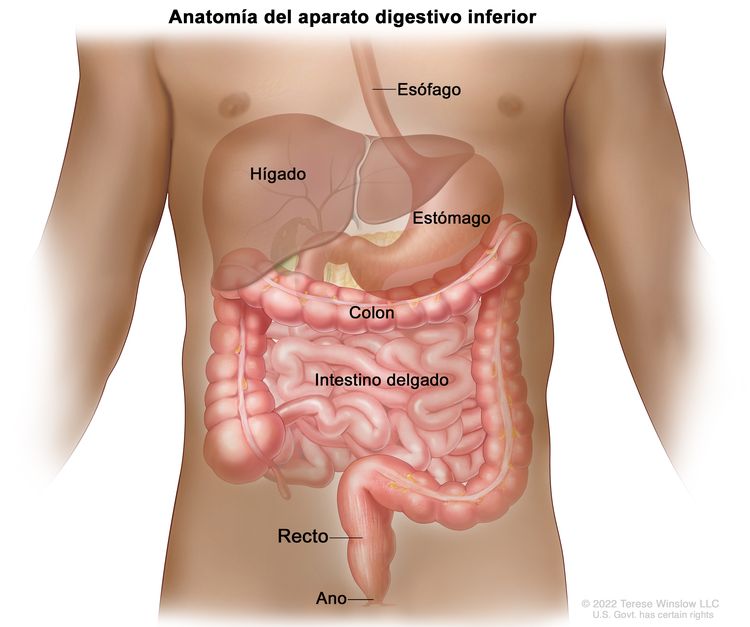
Características anatómicas
Factores de riesgo
El envejecimiento es el factor de riesgo más importante para la mayoría de cánceres. Otros factores de riesgo del cáncer colorrectal son los siguientes:
- Antecedentes familiares de cáncer colorrectal en un pariente de primer grado.[3]
- Antecedentes personales de adenomas colorrectales, cáncer colorrectal o cáncer de ovario.[4-6]
- Afecciones hereditarias, como la poliposis adenomatosa familiar (PAF) y el síndrome de Lynch (cáncer de colon sin poliposis hereditario [HNPCC]).[7]
- Antecedentes personales de colitis ulcerosa crónica o colitis de Crohn duraderas.[8]
- Consumo excesivo de alcohol.[9]
- Consumo de tabaco.[10]
- Raza u origen étnico: afroamericano.[11,12]
- Obesidad.[13]
Detección
Los exámenes de detección del cáncer de colon deben formar parte de la atención de rutina para todos los adultos de 50 años o más, en especial para aquellos que tienen familiares de primer grado con cáncer colorrectal. Esta recomendación se basa en la frecuencia de la enfermedad, la capacidad de identificar grupos de riesgo alto, el crecimiento lento de las lesiones primarias, una mejor supervivencia de los pacientes con lesiones en estadio temprano, y la relativa simplicidad y exactitud de las pruebas de detección. Para obtener más información, consultar Exámenes de detección del cáncer colorrectal.
Factores pronósticos
El pronóstico de los pacientes con cáncer de colon se relaciona de manera explícita con las siguientes características:
- El grado de penetración del tumor a través de la pared intestinal.
- La presencia o ausencia de compromiso ganglionar.
- La presencia o ausencia de metástasis a distancia.
Estas tres características son la base de todos los sistemas de estadificación de esta enfermedad.
Otros factores pronósticos del cáncer de colon son los siguientes:
Muchos otros marcadores pronósticos se han evaluado de manera retrospectiva en pacientes con cáncer de color, aunque la mayoría, como la pérdida alélica del cromosoma 18q o la expresión de la timidilato–sintasa, no se han validado de manera prospectiva.[16-25] En una serie poblacional de 607 pacientes menores de 50 años que tenían cáncer colorrectal, se estableció una relación entre la inestabilidad microsatelital, que también se vincula con el cáncer colorrectal hereditario no polipósico (HNPCC), y una mejora de la supervivencia independiente del estadio tumoral.[26] Se informó que los pacientes con HNPCC tienen mejores pronósticos en el análisis de supervivencia estratificado por estadio que los pacientes con cáncer colorrectal esporádico, pero la naturaleza retrospectiva de los estudios y la posibilidad de factores de selección dificultan la interpretación de esta observación.[27]
Las decisiones sobre el tratamiento dependen de factores como las preferencias del médico y del paciente, así como el estadio de la enfermedad, en lugar de la edad del paciente.[28-30]
Se han observado diferencias raciales en la supervivencia general (SG) después del tratamiento adyuvante, sin diferencias en la supervivencia sin enfermedad, lo que indica que las afecciones comórbidas desempeñan una función en el desenlace de supervivencia en diferentes poblaciones de pacientes.[31]
Seguimiento y supervivencia
En general, hay pocos datos, y ninguna evidencia de nivel alto, para orientar a pacientes y médicos sobre la vigilancia y el tratamiento de los pacientes después de la resección quirúrgica y el tratamiento adyuvante. La American Society of Clinical Oncology y la National Comprehensive Cancer Network recomiendan estrategias específicas de vigilancia y seguimiento.[32,33]
Después del tratamiento del cáncer de colon, es posible que las evaluaciones periódicas conduzcan a una identificación y tratamiento más tempranos de una enfermedad recidivante.[34-37] Esta vigilancia tiene poco efecto en la mortalidad general, ya que se encuentran pocas metástasis localizadas potencialmente curables en pacientes con cáncer de colon recidivante. Hasta la fecha, en ningún ensayo aleatorizado a gran escala se ha documentado ningún beneficio de la SG para los programas estándar de seguimiento posoperatorio.[38-42]
El antígeno carcinoembrionario (ACE) es una glucoproteína sérica que suele utilizarse durante la atención de pacientes con cáncer de colon. En una revisión del uso de este marcador tumoral se indica lo siguiente:[43]
- La concentración del ACE no constituye un examen de detección útil para el cáncer colorrectal por el gran número de resultados positivos y negativos falsos.
- La prueba del ACE posoperatoria se debe restringir a los pacientes que sean aptos para someterse a resección de metástasis hepáticas o pulmonares.
- No se recomienda el uso habitual solamente de las concentraciones del ACE para vigilar la respuesta al tratamiento.
El régimen óptimo y la frecuencia de los exámenes de seguimiento no están bien definidos porque el efecto en la supervivencia del paciente no es claro y la calidad de los datos es precaria.[40-42]
Factores relacionados con la recidiva
Alimentación y ejercicio
Aunque en estudios de cohortes se indicó que la dieta o el régimen de ejercicio pueden mejorar los desenlaces, no hay ensayos prospectivos aleatorizados que confirmen estos hallazgos. Los estudios de cohortes contienen múltiples oportunidades de sesgo no intencional y se debe ejercer cautela al utilizar estos datos.
Se realizaron dos estudios prospectivos de observación con pacientes inscritos en el ensayo CALGB-89803 (NCT00003835) del Cancer and Leukemia Group B, un ensayo de quimioterapia adyuvante para pacientes con cáncer de color en estadio III.[44,45] En este ensayo, los pacientes en el quintil más bajo de un patrón alimentario occidental, en comparación con los pacientes en el quintil más alto, presentaron un cociente de riesgos instantáneos (CRI) ajustado para la supervivencia sin enfermedad de 3,25 (intervalo de confianza [IC] 95 %, 2,04–5,19; P < 0,001) y una SG de 2,32 (IC 95 %, 1,36–3,96; P < 0,001). Además, también se identificó que los pacientes con cáncer de colon en estadio III en el quintil más alto de carga glucémica en la alimentación presentaron un CRI ajustado para la SG de 1,76 (IC 95 %, 1,22–2,54; P < 0,001), en comparación con los pacientes del quintil más bajo. Posteriormente, en la Cancer Prevention Study II Nutrition Cohort, entre 2315 participantes con diagnóstico de cáncer colorrectal, el grado de ingesta de carne roja y procesada antes del diagnóstico se relacionó con un riesgo más alto de muerte (riesgo relativo [RR], 1,29; IC 95 %, 1,05–1,59; P = 0,03), pero el consumo de carne roja después del diagnóstico no se relacionó con la mortalidad general.[46][Nivel de evidencia C1]
En un metanálisis de 7 estudios prospectivos de cohortes en los que se evaluó la actividad física antes y después del diagnóstico de cáncer colorrectal, se observó que los pacientes que participaron en cualquier nivel de actividad física antes del diagnóstico tenían un RR de 0,75 (IC 95 %, 0,65–0,87; P < 0,001) para la mortalidad específica del cáncer colorrectal, en comparación con los pacientes que no se ejercitaban.[47] Los pacientes que se ejercitaban mucho (vs. poco) antes del diagnóstico tuvieron un RR de 0,70 (IC 95 %, 0,56–0,87; P = 0,002). Los pacientes que participaron en alguna actividad física (comparada con ninguna actividad) después del diagnóstico tuvieron un RR de 0,74 (IC 95 %, 0,58–0,95; P = 0,02) de mortalidad específica del cáncer colorrectal. Quienes se ejercitaban mucho (vs. poco) después del diagnóstico tuvieron un RR de 0,65 (IC 95 %, 0,47–0,92; P = 0,01).[47][Nivel de evidencia C1]
Aspirina
En un estudio prospectivo de cohortes, se examinó el uso de aspirina después del diagnóstico de cáncer colorrectal.[48] Los consumidores regulares de aspirina después de un diagnóstico de cáncer colorrectal presentaron un CRIde supervivencia específica del cáncer de colon de 0,71 (IC 95 %, 0,53–0,95) y un CRIde mortalidad general de 0,79 (IC 95 %, 0,65–0,97).[48][Nivel de evidencia C1] En un estudio se evaluaron 964 pacientes con cáncer de recto o colon del Nurse’s Health Study y el Health Professionals Follow-up Study.[49] Entre los pacientes con cáncer colorrectal y variantes de PI3K, el consumo regular de aspirina se relacionó con un CRIde muerte por cualquier causade SG de 0,54 (IC 95 %, 0,31–0,94; P = 0,01)[49][Nivel de evidencia C1]
Bibliografía
- Bray F, Laversanne M, Sung H, et al.: Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 74 (3): 229-263, 2024. [PUBMED Abstract]
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Johns LE, Houlston RS: A systematic review and meta-analysis of familial colorectal cancer risk. Am J Gastroenterol 96 (10): 2992-3003, 2001. [PUBMED Abstract]
- Imperiale TF, Juluri R, Sherer EA, et al.: A risk index for advanced neoplasia on the second surveillance colonoscopy in patients with previous adenomatous polyps. Gastrointest Endosc 80 (3): 471-8, 2014. [PUBMED Abstract]
- Singh H, Nugent Z, Demers A, et al.: Risk of colorectal cancer after diagnosis of endometrial cancer: a population-based study. J Clin Oncol 31 (16): 2010-5, 2013. [PUBMED Abstract]
- Srinivasan R, Yang YX, Rubin SC, et al.: Risk of colorectal cancer in women with a prior diagnosis of gynecologic malignancy. J Clin Gastroenterol 41 (3): 291-6, 2007. [PUBMED Abstract]
- Mork ME, You YN, Ying J, et al.: High Prevalence of Hereditary Cancer Syndromes in Adolescents and Young Adults With Colorectal Cancer. J Clin Oncol 33 (31): 3544-9, 2015. [PUBMED Abstract]
- Laukoetter MG, Mennigen R, Hannig CM, et al.: Intestinal cancer risk in Crohn's disease: a meta-analysis. J Gastrointest Surg 15 (4): 576-83, 2011. [PUBMED Abstract]
- Fedirko V, Tramacere I, Bagnardi V, et al.: Alcohol drinking and colorectal cancer risk: an overall and dose-response meta-analysis of published studies. Ann Oncol 22 (9): 1958-72, 2011. [PUBMED Abstract]
- Liang PS, Chen TY, Giovannucci E: Cigarette smoking and colorectal cancer incidence and mortality: systematic review and meta-analysis. Int J Cancer 124 (10): 2406-15, 2009. [PUBMED Abstract]
- Laiyemo AO, Doubeni C, Pinsky PF, et al.: Race and colorectal cancer disparities: health-care utilization vs different cancer susceptibilities. J Natl Cancer Inst 102 (8): 538-46, 2010. [PUBMED Abstract]
- Lansdorp-Vogelaar I, Kuntz KM, Knudsen AB, et al.: Contribution of screening and survival differences to racial disparities in colorectal cancer rates. Cancer Epidemiol Biomarkers Prev 21 (5): 728-36, 2012. [PUBMED Abstract]
- Ma Y, Yang Y, Wang F, et al.: Obesity and risk of colorectal cancer: a systematic review of prospective studies. PLoS One 8 (1): e53916, 2013. [PUBMED Abstract]
- Steinberg SM, Barkin JS, Kaplan RS, et al.: Prognostic indicators of colon tumors. The Gastrointestinal Tumor Study Group experience. Cancer 57 (9): 1866-70, 1986. [PUBMED Abstract]
- Filella X, Molina R, Grau JJ, et al.: Prognostic value of CA 19.9 levels in colorectal cancer. Ann Surg 216 (1): 55-9, 1992. [PUBMED Abstract]
- McLeod HL, Murray GI: Tumour markers of prognosis in colorectal cancer. Br J Cancer 79 (2): 191-203, 1999. [PUBMED Abstract]
- Jen J, Kim H, Piantadosi S, et al.: Allelic loss of chromosome 18q and prognosis in colorectal cancer. N Engl J Med 331 (4): 213-21, 1994. [PUBMED Abstract]
- Lanza G, Matteuzzi M, Gafá R, et al.: Chromosome 18q allelic loss and prognosis in stage II and III colon cancer. Int J Cancer 79 (4): 390-5, 1998. [PUBMED Abstract]
- Griffin MR, Bergstralh EJ, Coffey RJ, et al.: Predictors of survival after curative resection of carcinoma of the colon and rectum. Cancer 60 (9): 2318-24, 1987. [PUBMED Abstract]
- Johnston PG, Fisher ER, Rockette HE, et al.: The role of thymidylate synthase expression in prognosis and outcome of adjuvant chemotherapy in patients with rectal cancer. J Clin Oncol 12 (12): 2640-7, 1994. [PUBMED Abstract]
- Shibata D, Reale MA, Lavin P, et al.: The DCC protein and prognosis in colorectal cancer. N Engl J Med 335 (23): 1727-32, 1996. [PUBMED Abstract]
- Bauer KD, Lincoln ST, Vera-Roman JM, et al.: Prognostic implications of proliferative activity and DNA aneuploidy in colonic adenocarcinomas. Lab Invest 57 (3): 329-35, 1987. [PUBMED Abstract]
- Bauer KD, Bagwell CB, Giaretti W, et al.: Consensus review of the clinical utility of DNA flow cytometry in colorectal cancer. Cytometry 14 (5): 486-91, 1993. [PUBMED Abstract]
- Sun XF, Carstensen JM, Zhang H, et al.: Prognostic significance of cytoplasmic p53 oncoprotein in colorectal adenocarcinoma. Lancet 340 (8832): 1369-73, 1992. [PUBMED Abstract]
- Roth JA: p53 prognostication: paradigm or paradox? Clin Cancer Res 5 (11): 3345, 1999. [PUBMED Abstract]
- Gryfe R, Kim H, Hsieh ET, et al.: Tumor microsatellite instability and clinical outcome in young patients with colorectal cancer. N Engl J Med 342 (2): 69-77, 2000. [PUBMED Abstract]
- Watson P, Lin KM, Rodriguez-Bigas MA, et al.: Colorectal carcinoma survival among hereditary nonpolyposis colorectal carcinoma family members. Cancer 83 (2): 259-66, 1998. [PUBMED Abstract]
- Iwashyna TJ, Lamont EB: Effectiveness of adjuvant fluorouracil in clinical practice: a population-based cohort study of elderly patients with stage III colon cancer. J Clin Oncol 20 (19): 3992-8, 2002. [PUBMED Abstract]
- Chiara S, Nobile MT, Vincenti M, et al.: Advanced colorectal cancer in the elderly: results of consecutive trials with 5-fluorouracil-based chemotherapy. Cancer Chemother Pharmacol 42 (4): 336-40, 1998. [PUBMED Abstract]
- Popescu RA, Norman A, Ross PJ, et al.: Adjuvant or palliative chemotherapy for colorectal cancer in patients 70 years or older. J Clin Oncol 17 (8): 2412-8, 1999. [PUBMED Abstract]
- Dignam JJ, Colangelo L, Tian W, et al.: Outcomes among African-Americans and Caucasians in colon cancer adjuvant therapy trials: findings from the National Surgical Adjuvant Breast and Bowel Project. J Natl Cancer Inst 91 (22): 1933-40, 1999. [PUBMED Abstract]
- Meyerhardt JA, Mangu PB, Flynn PJ, et al.: Follow-up care, surveillance protocol, and secondary prevention measures for survivors of colorectal cancer: American Society of Clinical Oncology clinical practice guideline endorsement. J Clin Oncol 31 (35): 4465-70, 2013. [PUBMED Abstract]
- Benson AB, Bekaii-Saab T, Chan E, et al.: Localized colon cancer, version 3.2013: featured updates to the NCCN Guidelines. J Natl Compr Canc Netw 11 (5): 519-28, 2013. [PUBMED Abstract]
- Martin EW, Minton JP, Carey LC: CEA-directed second-look surgery in the asymptomatic patient after primary resection of colorectal carcinoma. Ann Surg 202 (3): 310-7, 1985. [PUBMED Abstract]
- Bruinvels DJ, Stiggelbout AM, Kievit J, et al.: Follow-up of patients with colorectal cancer. A meta-analysis. Ann Surg 219 (2): 174-82, 1994. [PUBMED Abstract]
- Lautenbach E, Forde KA, Neugut AI: Benefits of colonoscopic surveillance after curative resection of colorectal cancer. Ann Surg 220 (2): 206-11, 1994. [PUBMED Abstract]
- Khoury DA, Opelka FG, Beck DE, et al.: Colon surveillance after colorectal cancer surgery. Dis Colon Rectum 39 (3): 252-6, 1996. [PUBMED Abstract]
- Safi F, Link KH, Beger HG: Is follow-up of colorectal cancer patients worthwhile? Dis Colon Rectum 36 (7): 636-43; discussion 643-4, 1993. [PUBMED Abstract]
- Moertel CG, Fleming TR, Macdonald JS, et al.: An evaluation of the carcinoembryonic antigen (CEA) test for monitoring patients with resected colon cancer. JAMA 270 (8): 943-7, 1993. [PUBMED Abstract]
- Rosen M, Chan L, Beart RW, et al.: Follow-up of colorectal cancer: a meta-analysis. Dis Colon Rectum 41 (9): 1116-26, 1998. [PUBMED Abstract]
- Desch CE, Benson AB, Smith TJ, et al.: Recommended colorectal cancer surveillance guidelines by the American Society of Clinical Oncology. J Clin Oncol 17 (4): 1312, 1999. [PUBMED Abstract]
- Benson AB, Desch CE, Flynn PJ, et al.: 2000 update of American Society of Clinical Oncology colorectal cancer surveillance guidelines. J Clin Oncol 18 (20): 3586-8, 2000. [PUBMED Abstract]
- Clinical practice guidelines for the use of tumor markers in breast and colorectal cancer. Adopted on May 17, 1996 by the American Society of Clinical Oncology. J Clin Oncol 14 (10): 2843-77, 1996. [PUBMED Abstract]
- Meyerhardt JA, Niedzwiecki D, Hollis D, et al.: Association of dietary patterns with cancer recurrence and survival in patients with stage III colon cancer. JAMA 298 (7): 754-64, 2007. [PUBMED Abstract]
- Meyerhardt JA, Sato K, Niedzwiecki D, et al.: Dietary glycemic load and cancer recurrence and survival in patients with stage III colon cancer: findings from CALGB 89803. J Natl Cancer Inst 104 (22): 1702-11, 2012. [PUBMED Abstract]
- McCullough ML, Gapstur SM, Shah R, et al.: Association between red and processed meat intake and mortality among colorectal cancer survivors. J Clin Oncol 31 (22): 2773-82, 2013. [PUBMED Abstract]
- Je Y, Jeon JY, Giovannucci EL, et al.: Association between physical activity and mortality in colorectal cancer: a meta-analysis of prospective cohort studies. Int J Cancer 133 (8): 1905-13, 2013. [PUBMED Abstract]
- Chan AT, Ogino S, Fuchs CS: Aspirin use and survival after diagnosis of colorectal cancer. JAMA 302 (6): 649-58, 2009. [PUBMED Abstract]
- Liao X, Lochhead P, Nishihara R, et al.: Aspirin use, tumor PIK3CA mutation, and colorectal-cancer survival. N Engl J Med 367 (17): 1596-606, 2012. [PUBMED Abstract]
Clasificación celular del cáncer de colon
Los tipos histológicos del cáncer de colon son los siguientes:
- Adenocarcinoma (la mayoría de los cánceres de colon).
- Adenocarcinoma mucinoso (coloide).
- Adenocarcinoma de células en anillo de sello.
- Tumores escirrosos.
- Tumores neuroendocrinos.[1] Los tumores con diferenciación neuroendocrina suelen tener un pronóstico más precario que las variantes de adenocarcinoma puro.
Bibliografía
- Saclarides TJ, Szeluga D, Staren ED: Neuroendocrine cancers of the colon and rectum. Results of a ten-year experience. Dis Colon Rectum 37 (7): 635-42, 1994. [PUBMED Abstract]
Información sobre los estadios del cáncer de colon
Las decisiones de tratamiento se pueden tomar con referencia a la clasificación TNM (tumor, ganglio linfático, metástasis) [1] en lugar de la clasificación Dukes más antigua o el esquema de clasificación Astler-Coller modificado.
El AJCC y un grupo patrocinado por el Instituto Nacional del Cáncer recomendaron que se examinaran al menos 12 ganglios linfáticos en pacientes con cáncer de colon y recto para confirmar la ausencia de compromiso ganglionar tumoral.[1-3] Esta recomendación tiene en cuenta que el número de ganglios linfáticos que se examina refleja tanto la extensión de la disección mesentérica linfovascular en el momento de la resección quirúrgica, como la identificación patológica de los ganglios en la muestra. En estudios retrospectivos se demostró que el número de ganglios linfáticos examinados en la cirugía de colon y recto se relaciona con el desenlace del paciente.[4-7]
Agrupamiento por estadios y definiciones TNM del American Joint Committee on Cancer
El AJCC designó la estadificación según la clasificación TNM para definir el cáncer de colon[1] Se usa la misma clasificación para la estadificación clínica y patológica.[1]
| Estadio | TNMb,c | Descripción | Ilustración |
|---|---|---|---|
| T = tumor primario; N = ganglios linfáticos regionales; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pp. 251–74. | |||
| Las explicaciones de los superíndices b y c están al final del Cuadro 5. | |||
| 0 | Tis, N0, M0 | Tis = carcinoma in situ, carcinoma intramucoso (compromiso de la lámina propia sin diseminación a la capa muscular de la mucosa). |
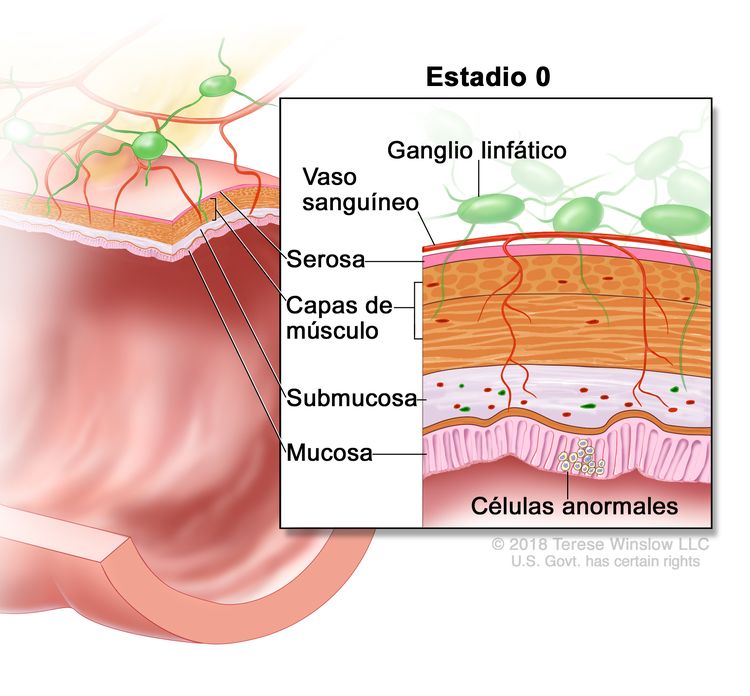 |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| Estadio | TNMb,c | Descripción | Ilustración |
|---|---|---|---|
| T = tumor primario; N = ganglios linfáticos regionales; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pp. 251–74. | |||
| Las explicaciones de los superíndices b y c están al final del Cuadro 5. | |||
| I | T1, T2, N0, M0 | T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). |
 |
| T2 = tumor con invasión de la capa muscular propia. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| Estadio | TNMb,c | Descripción | Ilustración |
|---|---|---|---|
| T = tumor primario; N = ganglios linfáticos regionales; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pp. 251–74. | |||
| Las explicaciones de los superíndices b y c están al final del Cuadro 5. | |||
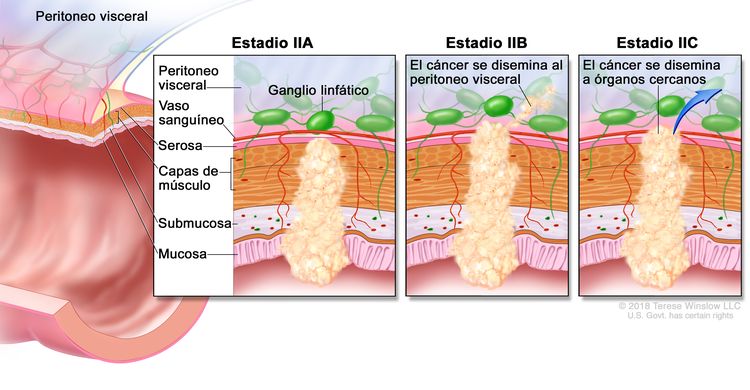
| IIA | T3, N0, M0 | T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. |
 |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| IIB | T4a, N0, M0 | T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión tumoral continua de áreas inflamatorias en la superficie del peritoneo visceral). | |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| IIC | T4b, N0, M0 | T4b = tumor con invasión directa o adherencia a órganos o estructuras adyacentes. | |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| Estadio | TNMb,c | Descripción | Ilustración |
|---|---|---|---|
| T = tumor primario; N = ganglios linfáticos regionales; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pp. 251–74. | |||
| Las explicaciones de los superíndices b y c están al final del Cuadro 5. | |||
| IIIA | T1, N2a, M0 | T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). |
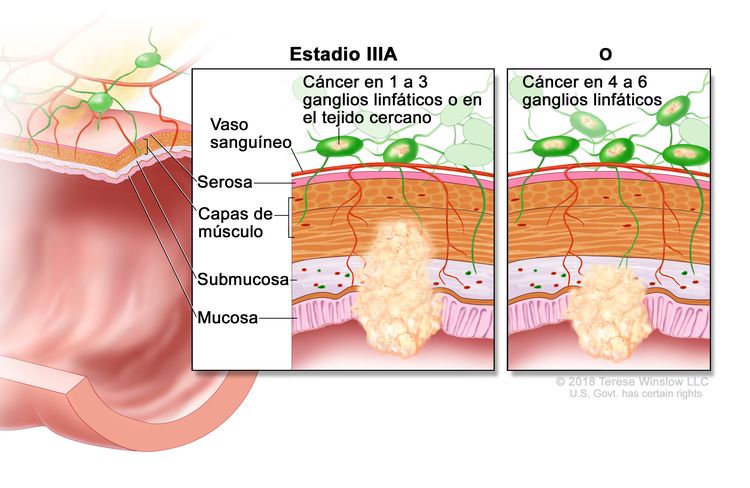 |
| N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T1–2, N1/N1c, M0 | T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). | ||
| T2 = tumor con invasión de la capa muscular propia. | |||
| N1 = compromiso de 1 a 3 ganglios linfáticos regionales (tumor en los ganglios linfáticos regionales que mide ≥0,2 mm), o cualquier cantidad de depósitos tumorales y todos los ganglios linfáticos identificables están libres de compromiso tumoral. | |||
| –N1c = sin compromiso de ganglios linfáticos regionales, pero con depósitos tumorales en la subserosa, el mesenterio, los tejidos pericólicos no peritonealizados o en los tejidos perirrectales o mesorrectales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| IIIB | T1–T2, N2b, M0 | T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). |
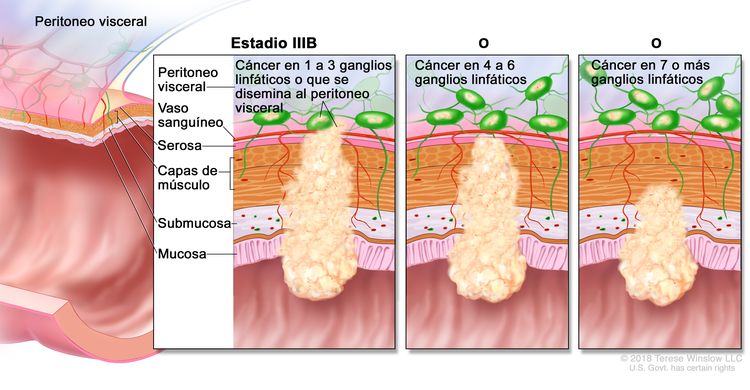 |
| T2 = tumor con invasión de la capa muscular propia. | |||
| N2b = compromiso de 7 o más ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T2–T3, N2a, M0 | T2 = tumor con invasión de la capa muscular propia. | ||
| T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. | |||
| N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T3–T4a, N1/N1c, M0 | T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. | ||
| T4 = tumor con invasión del peritoneo visceral, o con invasión y adherencia a un órgano o estructura adyacente. | |||
| –T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión tumoral continua de áreas inflamatorias en la superficie del peritoneo visceral). | |||
| N1 = compromiso de 1 a 3 ganglios linfáticos regionales (tumor en los ganglios linfáticos regionales que mide ≥0,2 mm), o cualquier cantidad de depósitos tumorales y todos los ganglios linfáticos identificables están libres de compromiso tumoral. | |||
| –N1c = sin compromiso de ganglios linfáticos regionales, pero con depósitos tumorales en la subserosa, el mesenterio, los tejidos pericólicos no peritonealizados o en los tejidos perirrectales o mesorrectales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| IIIC | T3–T4a, N2b, M0 | T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. |
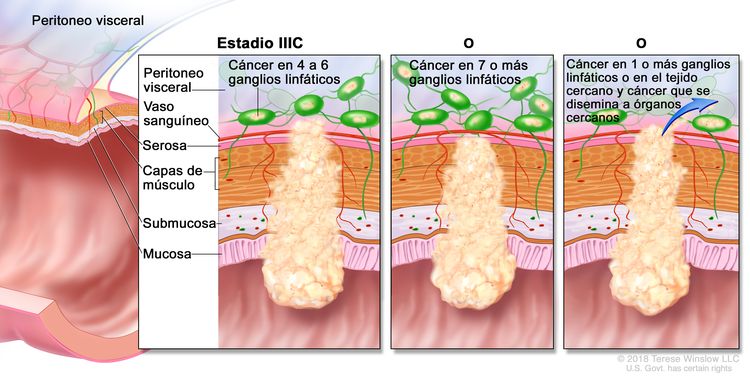 |
| T4 = tumor con invasión del peritoneo visceral, o con invasión y adherencia a un órgano o estructura adyacente. | |||
| –T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión tumoral continua de áreas inflamatorias en la superficie del peritoneo visceral). | |||
| N2b = compromiso de 7 o más ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T4a, N2a, M0 | T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión tumoral continua de áreas inflamatorias en la superficie del peritoneo visceral). | ||
| N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T4b, N1–N2, M0 | T4b = tumor con invasión directa o adherencia a órganos o estructuras adyacentes. | ||
| N1 = compromiso de 1 a 3 ganglios linfáticos regionales (tumor en los ganglios linfáticos regionales que mide ≥0,2 mm), o cualquier cantidad de depósitos tumorales y todos los ganglios linfáticos identificables están libres de compromiso tumoral. | |||
| –N1a = compromiso de un ganglio linfático regional. | |||
| –N2b = compromiso de 2 o 3 ganglios linfáticos regionales. | |||
| –N1c = sin compromiso de ganglios linfáticos regionales, pero con depósitos tumorales en la subserosa, el mesenterio, los tejidos pericólicos no peritonealizados o en los tejidos perirrectales o mesorrectales. | |||
| N2 = compromiso de 4 o más ganglios linfáticos regionales. | |||
| –N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| –N2b = compromiso de 7 o más ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| Estadio | TNMb,c | Definición | Ilustración |
|---|---|---|---|
| T = tumor primario; N = ganglios linfáticos regionales; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pp. 251–74. | |||
| bLa invasión directa en T4 incluye invasión de otros órganos o segmentos colorrectales por diseminación directa a través de la serosa. Esto se confirma mediante un examen microscópico (por ejemplo, un carcinoma de ciego que invade el colon sigmoide) o, en los cánceres retroperitoneales o subperitoneales, por la invasión directa de otros órganos o estructuras al diseminarse fuera de la capa muscular propia (es decir, un tumor en la pared posterior del colon descendente que invade el riñón izquierdo o la pared abdominal lateral; o cáncer de recto a nivel medio o distal con invasión de la próstata, las vesículas seminales, el cuello uterino o la vagina). | |||
| cUn tumor con adherencia macroscópica a otros órganos o estructuras se clasifica como cT4b. Sin embargo, si no hay tumor microscópico en la adherencia, la clasificación debe ser pT1–4a según la profundidad anatómica de la invasión en la pared. Las clasificaciones V y L se deben usar para identificar la presencia o ausencia de invasión vascular o linfática, mientras que el factor pronóstico PN se debe usar para la invasión perineural. | |||
| IVA | Cualquier T, cualquier N, M1a | TX = tumor primario no evaluable. |
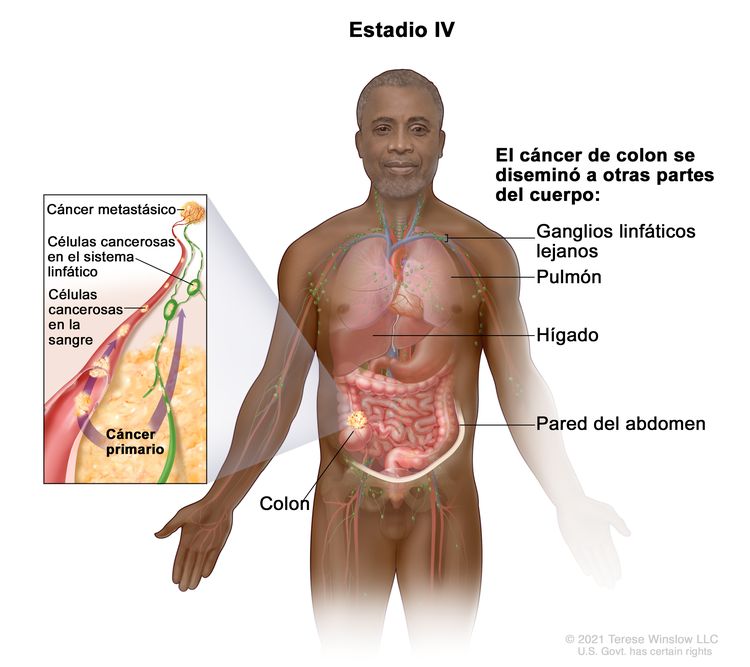 |
| T0 = sin indicios de tumor primario. | |||
| Tis = carcinoma in situ, carcinoma intramucoso (compromiso de la lámina propia sin diseminación a la capa muscular de la mucosa). | |||
| T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). | |||
| T2 = tumor con invasión de la capa muscular propia. | |||
| T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. | |||
| T4 = tumor con invasión del peritoneo visceral, o con invasión y adherencia a un órgano o estructura adyacente. | |||
| –T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión tumoral continua de áreas inflamatorias en la superficie del peritoneo visceral). | |||
| –T4b = tumor con invasión directa o adherencia a órganos o estructuras adyacentes. | |||
| NX = ganglios linfáticos regionales no evaluables. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| N1 = compromiso de 1 a 3 ganglios linfáticos regionales (tumor en los ganglios linfáticos regionales que mide ≥0,2 mm), o cualquier cantidad de depósitos tumorales y todos los ganglios linfáticos identificables están libres de compromiso tumoral. | |||
| –N1a = compromiso de un ganglio linfático regional. | |||
| –N2b = compromiso de 2 o 3 ganglios linfáticos regionales. | |||
| –N1c = sin compromiso de ganglios linfáticos regionales, pero con depósitos tumorales en la subserosa, el mesenterio, los tejidos pericólicos no peritonealizados o en los tejidos perirrectales o mesorrectales. | |||
| N2 = compromiso de 4 o más ganglios linfáticos regionales. | |||
| –N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| –N2b = compromiso de 7 o más ganglios linfáticos regionales. | |||
| M1a = se identifica metástasis en un sitio u órgano sin metástasis peritoneal. | |||
| IVB | Cualquier T, cualquier N, M1b | Cualquier T = consultar las descripciones de T en el grupo de estadio TNM cualquier T, cualquier N, M1a. | |
| Cualquier N = consultar las descripciones de N en el grupo de estadio TNM cualquier T, cualquier N1, M1a. | |||
| M1b = metástasis en 2 o más sitios u órganos sin metástasis peritoneal. | |||
| IVC | Cualquier T, cualquier N, M1c | Cualquier T = consultar las descripciones de T en el grupo de estadio TNM cualquier T, cualquier N, M1a. | |
| Cualquier N = consultar las descripciones de N en el grupo de estadio TNM cualquier T, cualquier N1, M1a. | |||
| M1c = se identifica metástasis en la superficie peritoneal, sola o acompañada de metástasis en otros sitios u órganos. | |||
Bibliografía
- Jessup J, Benson A, Chen V: Colon and Rectum. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 251–74.
- Compton CC, Greene FL: The staging of colorectal cancer: 2004 and beyond. CA Cancer J Clin 54 (6): 295-308, 2004 Nov-Dec. [PUBMED Abstract]
- Nelson H, Petrelli N, Carlin A, et al.: Guidelines 2000 for colon and rectal cancer surgery. J Natl Cancer Inst 93 (8): 583-96, 2001. [PUBMED Abstract]
- Swanson RS, Compton CC, Stewart AK, et al.: The prognosis of T3N0 colon cancer is dependent on the number of lymph nodes examined. Ann Surg Oncol 10 (1): 65-71, 2003 Jan-Feb. [PUBMED Abstract]
- Le Voyer TE, Sigurdson ER, Hanlon AL, et al.: Colon cancer survival is associated with increasing number of lymph nodes analyzed: a secondary survey of intergroup trial INT-0089. J Clin Oncol 21 (15): 2912-9, 2003. [PUBMED Abstract]
- Prandi M, Lionetto R, Bini A, et al.: Prognostic evaluation of stage B colon cancer patients is improved by an adequate lymphadenectomy: results of a secondary analysis of a large scale adjuvant trial. Ann Surg 235 (4): 458-63, 2002. [PUBMED Abstract]
- Tepper JE, O'Connell MJ, Niedzwiecki D, et al.: Impact of number of nodes retrieved on outcome in patients with rectal cancer. J Clin Oncol 19 (1): 157-63, 2001. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento del cáncer de colon
| Estadio (criterios de estadificación TNM) | Opciones de tratamiento |
|---|---|
| Cáncer de colon en estadio 0 | Cirugía |
| Cáncer de colon en estadio l | Cirugía |
| Cáncer de colon en estadio II | Cirugía |
| Quimioterapia adyuvante (en evaluación clínica) | |
| Cáncer de colon en estadio III | Cirugía |
| Ensayos clínicos | |
| Metástasis hepática | Cirugía |
| Quimioterapia neoadyuvante | |
| Ablación local | |
| Quimioterapia adyuvante | |
| Quimioterapia intraarterial | |
| Ensayos clínicos | |
| Cáncer de colon en estadio IV y recidivante | Cirugía |
| Tratamiento sistémico | |
| Inmunoterapia | |
| Ensayos clínicos |
Tratamiento quirúrgico primario
El tratamiento estándar de los pacientes con cáncer de color y enfermedad localizada es la resección quirúrgica abierta de los ganglios linfáticos primarios y regionales.
En dos estudios se examinó la función de métodos laparoscópicos [1-4] para el tratamiento del cáncer de colon.
Evidencia (métodos laparoscópicos):
- En un ensayo multicéntrico prospectivo y aleatorizado de ausencia de inferioridad (NCCTG-934653 [NCT00002575]) se comparó la colectomía laparoscópica (CLA) y la colectomía abierta en 872 pacientes.
- Después de una mediana de seguimiento de 4,4 años, la tasa de recidiva a 3 años (16 % CLA vs. 18 % colectomía abierta; cociente de riesgos instantáneos [CRI] para recidiva, 0,86; intervalo de confianza [IC] 95 %, 0,63–1,17; P = 0,32) y tasas de supervivencia general (SG) a 3 años (86 % CLA vs. 32 % colectomía abierta; CRImuerte para CLA, 0,91; IC 95 %, 0,68–1,21; P = 0,51) fueron similares en ambos grupos para todos los estadios de la enfermedad evaluados. La recidiva tumoral en las incisiones quirúrgicas fue inferior al 1 % en ambos grupos.[5][Nivel de evidencia A1]
- Se informó disminución en la estadía hospitalaria (5 días para CLA vs. 6 días para la colectomía abierta P < 0,001) y disminución del uso de analgésicos en el grupo de CLA. Se observó que la tasa de conversión de CLA a un procedimiento abierto fue del 21 %.
- En este estudio se excluyeron a los pacientes con enfermedad localmente avanzada, tumores en el colon transverso y el recto, o lesiones perforadas. Cada uno de los 66 cirujanos que participaron en el ensayo habían realizado por lo menos 20 CLA y fueron acreditados para participar después de una revisión independiente por video para asegurar el uso uniforme de principios oncológicos y quirúrgicos.[5] El componente de calidad de vida de este ensayo se publicó por separado y se notificaron beneficios mínimos a corto plazo de la calidad de vida con CLA.[6][Nivel de evidencia A3]
- En un estudio aleatorizado pequeño de una sola institución con 219 pacientes, se observó que el procedimiento de CLA se relacionó de forma independiente con una reducción de la recidiva tumoral en el análisis multivariante.[7][Nivel de evidencia A1]
La cirugía es curativa en el 25 % al 40 % de los pacientes, rigurosamente seleccionados, con metástasis hepáticas y pulmonares resecables. Los avances en los métodos quirúrgicos y las pruebas con imágenes preoperatorias permiten mejorar la selección de los pacientes para la resección.
Quimioterapia adyuvante
El posible valor de la quimioterapia adyuvante para los pacientes con cáncer de colon en estadio II es polémico. En análisis agrupados y metanálisis se indica una mejora del 2 % al 4 % en la SG para los pacientes tratados con terapia adyuvante basada en fluorouracilo (5-FU), en comparación con la observación.[8-10] Para obtener más información, consultar la sección Tratamiento del cáncer de colon en estadio II.
Antes del año 2000, el 5-FU era la única quimioterapia citotóxica útil en el entorno adyuvante para los pacientes con cáncer de color en estadio III. Desde entonces, se estableció que la capecitabina es una opción equivalente al 5-FU y la leucovorina (5-FU y LV). Se observó que añadir oxaliplatino al tratamiento con 5-FU y LV mejora la SG, en comparación con usar 5-FU y LV solos. Para obtener más información, consultar la sección Tratamiento del cáncer de colon en estadio III.
Regímenes de quimioterapia
En el Cuadro 7 se describen los regímenes de quimioterapia utilizados para tratar el cáncer de colon.
| Nombre del régimen | Combinación farmacológica | Dosis |
|---|---|---|
| 5-FU = fluorouracilo; AIO = Arbeitsgemeinschaft Internistische Onkologie; IV = intravenosa; LV = leucovorina. | ||
| AIO o AIO alemán | Ácido fólico, 5-FU e irinotecán | Irinotecán (100 mg/m2) y LV (500 mg/m2) administrados como infusiones de 2 horas el día 1, seguidos de bolo IV de 5-FU (2000 mg/m2) administrado por bomba ambulatoria semanal durante 24 horas, 4 veces por año (52 semanas). |
| CAPOX | Capecitabina y oxaliplatino | Capecitabina (1000 mg/m2) 2 veces al día los días 1–14, con oxaliplatino (70 mg/m2) los días 1 y 8, cada 3 semanas. |
| Douillard | Ácido fólico, 5-FU e irinotecán | Irinotecán (180 mg/m2) administrado como infusión de 2 horas en el día 1, LV (200 mg/m2) administrado como infusión de 2 horas los días 1 y 2, seguido de una dosis de carga de 5-FU (400 mg/m2) en bolo IV, luego 5-FU (600 mg/m2) administrado mediante bomba ambulatoria durante 22 horas cada 2 semanas los días 1 y 2. |
| FOLFIRI | LV, 5-FU e irinotecán | Irinotecán (180 mg/m2) y LV (400 mg/m2) administrados como infusiones de 2 horas el día 1, seguido de una dosis de carga de 5-FU (400 mg/m2) en bolo IV administrado el día 1, luego 5-FU (2400–3000 mg/m2) administrado mediante bomba ambulatoria durante 46 horas cada 2 semanas. |
| FOLFOX-4 | Oxaliplatino, LV y 5-FU | Oxaliplatino (85 mg/m2) administrado como infusión de 2 horas el día 1, LV (200 mg/m2) administrado como infusión de 2 horas los días 1 y 2, seguido de una dosis de carga de 5-FU (400 mg/m2) en bolo IV, luego, 5-FU (600 mg/m2) administrado mediante bomba ambulatoria durante 22 horas cada 2 semanas los días 1 y 2. |
| FOLFOX-6 | Oxaliplatino, LV y 5-FU | Oxaliplatino (85–100 mg/m2) y LV (400 mg/m2) administrados como infusiones de 2 horas el día 1, seguido de una dosis de carga de 5-FU (400 mg/m2) en bolo IV administrado el día 1, luego 5-FU (2400–3000 mg/m2) administrado mediante bomba ambulatoria durante 46 horas cada 2 semanas. |
| FOLFOXIRI | Irinotecán, oxaliplatino, LV, 5-FU | Irinotecán (165 mg/m2) administrado como infusión de 60 minutos, luego infusión simultánea de oxaliplatino (85 mg/m2) y LV (200 mg/m2) durante 120 minutos, seguida de 5-FU (3200 mg/m2) administrado como infusión continua de 48 horas. |
| FUFOX | 5-FU, LV y oxaliplatino | Oxaliplatino (50 mg/m2) con LV (500 mg/m2) y 5-FU (2000 mg/m2) administrados como infusión continua de 22 horas los días 1, 8, 22 y 29 cada 36 días. |
| FUOX | 5-FU y oxaliplatino | 5-FU (2250 mg/m2) administrado como infusión continua durante 48 horas los días 1, 8, 15, 22, 29 y 36 con oxaliplatino (85 mg/m2) los días 1, 15 y 29 cada 6 semanas. |
| IFL (o Saltz) | Irinotecán, 5-FU y LV | Irinotecán (125 mg/m2) con 5-FU (500 mg/m2) en bolo IV y LV (20 mg/m2) en bolo IV administrado semanalmente durante 4 de 6 semanas. |
| XELOX | Capecitabina y oxaliplatino | Capecitabina oral (1000 mg/m2) administrada 2 veces al día durante 14 días con oxaliplatino (130 mg/m2) el día 1 cada 3 semanas. |
Administración de capecitabina y fluorouracilo
El gen DPYD codifica la enzima que cataboliza las pirimidinas y las fluoropirimidinas, como la capecitabina y el fluorouracilo. Se estima que entre el 1 % y el 2 % de la población tiene variantes defectuosas de DPYD que reducen la función de la proteína DPD y la acumulación de pirimidinas y fluoropirimidinas en el cuerpo.[11,12] Los pacientes con la variante DPYD*2A que reciben fluoropirimidinas quizás presenten efectos tóxicos graves que ponen en riesgo la salud, y a veces son mortales. Se han identificado muchas otras variantes de DPYD, con diferentes efectos clínicos.[11-13] Es posible que se recomiende evitar la fluoropirimidina o reducir la dosis al 50 % según el genotipo DPYD del paciente y el número de alelos funcionales de DPYD.[14-16] Las pruebas genéticas para DPYD cuestan menos de $200, pero la cobertura del seguro varía debido a la falta de directrices nacionales.[17] Además, es posible que las pruebas retrasen el tratamiento por 2 semanas, lo que no sería aconsejable en casos de urgencia. Este tema es objeto de controversia y requiere evaluación adicional.[18]
Radioterapia adyuvante
Aunque el tratamiento de modalidad combinada con quimioterapia y radioterapia tiene una función importante para la atención de pacientes con cáncer de recto (por debajo de la reflexión peritoneal), la función de la radioterapia adyuvante para los pacientes con cáncer de colon (por encima de la reflexión peritoneal) no está bien definida. Los análisis de modelos de atención y las revisiones retrospectivas de una sola institución indican una función de la radioterapia en ciertos subgrupos de pacientes con cáncer de color de riesgo alto (por ejemplo, T4, ubicación del tumor en sitios inmóviles, perforación local, obstrucción y enfermedad residual después de la resección).[19-24]
Evidencia (radioterapia adyuvante):
- En un estudio aleatorizado intergrupal de fase III, se evaluó el beneficio de agregar radioterapia a la cirugía y la quimioterapia con 5-FU y levamisol en pacientes seleccionados con cáncer de colon de riesgo alto (por ejemplo, T4; o T3, N1–N2 en el colon ascendente o descendente).[25]
- Este ensayo clínico se cerró de forma temprana por insuficiente inscripción de pacientes. En un análisis de los 222 pacientes inscritos (el objetivo original era de 700 pacientes), no se demostró ningún beneficio en cuanto a la recaída o SG para el grupo que recibió radioterapia, aunque el tamaño de la muestra y la potencia estadística fueron insuficientes para excluir algún beneficio.
En la actualidad, la radioterapia adyuvante no cumple ninguna función estándar en el tratamiento de los pacientes con cáncer de colon después de una resección curativa, aunque puede desempeñar alguna función en los pacientes con enfermedad residual.
Bibliografía
- Bokey EL, Moore JW, Chapuis PH, et al.: Morbidity and mortality following laparoscopic-assisted right hemicolectomy for cancer. Dis Colon Rectum 39 (10 Suppl): S24-8, 1996. [PUBMED Abstract]
- Franklin ME, Rosenthal D, Abrego-Medina D, et al.: Prospective comparison of open vs. laparoscopic colon surgery for carcinoma. Five-year results. Dis Colon Rectum 39 (10 Suppl): S35-46, 1996. [PUBMED Abstract]
- Fleshman JW, Nelson H, Peters WR, et al.: Early results of laparoscopic surgery for colorectal cancer. Retrospective analysis of 372 patients treated by Clinical Outcomes of Surgical Therapy (COST) Study Group. Dis Colon Rectum 39 (10 Suppl): S53-8, 1996. [PUBMED Abstract]
- Schwenk W, Böhm B, Müller JM: Postoperative pain and fatigue after laparoscopic or conventional colorectal resections. A prospective randomized trial. Surg Endosc 12 (9): 1131-6, 1998. [PUBMED Abstract]
- Clinical Outcomes of Surgical Therapy Study Group: A comparison of laparoscopically assisted and open colectomy for colon cancer. N Engl J Med 350 (20): 2050-9, 2004. [PUBMED Abstract]
- Weeks JC, Nelson H, Gelber S, et al.: Short-term quality-of-life outcomes following laparoscopic-assisted colectomy vs open colectomy for colon cancer: a randomized trial. JAMA 287 (3): 321-8, 2002. [PUBMED Abstract]
- Lacy AM, García-Valdecasas JC, Delgado S, et al.: Laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomised trial. Lancet 359 (9325): 2224-9, 2002. [PUBMED Abstract]
- Efficacy of adjuvant fluorouracil and folinic acid in B2 colon cancer. International Multicentre Pooled Analysis of B2 Colon Cancer Trials (IMPACT B2) Investigators. J Clin Oncol 17 (5): 1356-63, 1999. [PUBMED Abstract]
- Gill S, Loprinzi CL, Sargent DJ, et al.: Pooled analysis of fluorouracil-based adjuvant therapy for stage II and III colon cancer: who benefits and by how much? J Clin Oncol 22 (10): 1797-806, 2004. [PUBMED Abstract]
- Mamounas E, Wieand S, Wolmark N, et al.: Comparative efficacy of adjuvant chemotherapy in patients with Dukes' B versus Dukes' C colon cancer: results from four National Surgical Adjuvant Breast and Bowel Project adjuvant studies (C-01, C-02, C-03, and C-04) J Clin Oncol 17 (5): 1349-55, 1999. [PUBMED Abstract]
- Sharma BB, Rai K, Blunt H, et al.: Pathogenic DPYD Variants and Treatment-Related Mortality in Patients Receiving Fluoropyrimidine Chemotherapy: A Systematic Review and Meta-Analysis. Oncologist 26 (12): 1008-1016, 2021. [PUBMED Abstract]
- Lam SW, Guchelaar HJ, Boven E: The role of pharmacogenetics in capecitabine efficacy and toxicity. Cancer Treat Rev 50: 9-22, 2016. [PUBMED Abstract]
- Shakeel F, Fang F, Kwon JW, et al.: Patients carrying DPYD variant alleles have increased risk of severe toxicity and related treatment modifications during fluoropyrimidine chemotherapy. Pharmacogenomics 22 (3): 145-155, 2021. [PUBMED Abstract]
- Amstutz U, Henricks LM, Offer SM, et al.: Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing: 2017 Update. Clin Pharmacol Ther 103 (2): 210-216, 2018. [PUBMED Abstract]
- Henricks LM, Lunenburg CATC, de Man FM, et al.: DPYD genotype-guided dose individualisation of fluoropyrimidine therapy in patients with cancer: a prospective safety analysis. Lancet Oncol 19 (11): 1459-1467, 2018. [PUBMED Abstract]
- Lau-Min KS, Varughese LA, Nelson MN, et al.: Preemptive pharmacogenetic testing to guide chemotherapy dosing in patients with gastrointestinal malignancies: a qualitative study of barriers to implementation. BMC Cancer 22 (1): 47, 2022. [PUBMED Abstract]
- Brooks GA, Tapp S, Daly AT, et al.: Cost-effectiveness of DPYD Genotyping Prior to Fluoropyrimidine-based Adjuvant Chemotherapy for Colon Cancer. Clin Colorectal Cancer 21 (3): e189-e195, 2022. [PUBMED Abstract]
- Baker SD, Bates SE, Brooks GA, et al.: DPYD Testing: Time to Put Patient Safety First. J Clin Oncol 41 (15): 2701-2705, 2023. [PUBMED Abstract]
- Willett C, Tepper JE, Cohen A, et al.: Local failure following curative resection of colonic adenocarcinoma. Int J Radiat Oncol Biol Phys 10 (5): 645-51, 1984. [PUBMED Abstract]
- Willett C, Tepper JE, Cohen A, et al.: Obstructive and perforative colonic carcinoma: patterns of failure. J Clin Oncol 3 (3): 379-84, 1985. [PUBMED Abstract]
- Gunderson LL, Sosin H, Levitt S: Extrapelvic colon--areas of failure in a reoperation series: implications for adjuvant therapy. Int J Radiat Oncol Biol Phys 11 (4): 731-41, 1985. [PUBMED Abstract]
- Willett CG, Fung CY, Kaufman DS, et al.: Postoperative radiation therapy for high-risk colon carcinoma. J Clin Oncol 11 (6): 1112-7, 1993. [PUBMED Abstract]
- Willett CG, Goldberg S, Shellito PC, et al.: Does postoperative irradiation play a role in the adjuvant therapy of stage T4 colon cancer? Cancer J Sci Am 5 (4): 242-7, 1999 Jul-Aug. [PUBMED Abstract]
- Schild SE, Gunderson LL, Haddock MG, et al.: The treatment of locally advanced colon cancer. Int J Radiat Oncol Biol Phys 37 (1): 51-8, 1997. [PUBMED Abstract]
- Martenson JA, Willett CG, Sargent DJ, et al.: Phase III study of adjuvant chemotherapy and radiation therapy compared with chemotherapy alone in the surgical adjuvant treatment of colon cancer: results of intergroup protocol 0130. J Clin Oncol 22 (16): 3277-83, 2004. [PUBMED Abstract]
Tratamiento del cáncer de colon en estadio 0
El cáncer de colon en estadio 0 es el tipo de lesión más superficial y se limita a la mucosa sin invasión de la lámina propia. Debido a que es superficial, el procedimiento quirúrgico puede ser limitado.
Opciones de tratamiento del cáncer de colon en estadio 0
Las opciones de tratamiento del cáncer de colon en estadio 0 son las siguientes:
Cirugía
Las opciones quirúrgicas incluyen extirpación local o polipectomía simple con márgenes limpios, o resección del colon para lesiones más grandes que no son susceptibles de extirpación local.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Tratamiento del cáncer de colon en estadio I
Debido a que es localizado, el cáncer de colon en estadio I tiene una tasa de curación alta.
Opciones de tratamiento del cáncer de colon en estadio I
Las opciones de tratamiento del cáncer de colon en estadio I son las siguientes:
- Cirugía. Resección quirúrgica amplia y anastomosis.
Cirugía
Evidencia (métodos laparoscópicos):
- La función de los métodos laparoscópicos [1-4] en el tratamiento del cáncer de colon se examinó en un ensayo multicéntrico prospectivo aleatorizado (NCCTG-934653 [NCT00002575]) donde se comparó la colectomía laparoscópica (CLA) con la colectomía abierta.
- Las tasas de recidiva a 3 años y las tasas de supervivencia general a 3 años fueron similares en ambos grupos. Para obtener más información, consultar la sección Tratamiento quirúrgico primario.
- El componente de calidad de vida de este ensayo se publicó por separado y se notificaron beneficios mínimos a corto plazo de la calidad de vida con CLA.[5][Nivel de evidencia A3]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Bokey EL, Moore JW, Chapuis PH, et al.: Morbidity and mortality following laparoscopic-assisted right hemicolectomy for cancer. Dis Colon Rectum 39 (10 Suppl): S24-8, 1996. [PUBMED Abstract]
- Franklin ME, Rosenthal D, Abrego-Medina D, et al.: Prospective comparison of open vs. laparoscopic colon surgery for carcinoma. Five-year results. Dis Colon Rectum 39 (10 Suppl): S35-46, 1996. [PUBMED Abstract]
- Fleshman JW, Nelson H, Peters WR, et al.: Early results of laparoscopic surgery for colorectal cancer. Retrospective analysis of 372 patients treated by Clinical Outcomes of Surgical Therapy (COST) Study Group. Dis Colon Rectum 39 (10 Suppl): S53-8, 1996. [PUBMED Abstract]
- Schwenk W, Böhm B, Müller JM: Postoperative pain and fatigue after laparoscopic or conventional colorectal resections. A prospective randomized trial. Surg Endosc 12 (9): 1131-6, 1998. [PUBMED Abstract]
- Weeks JC, Nelson H, Gelber S, et al.: Short-term quality-of-life outcomes following laparoscopic-assisted colectomy vs open colectomy for colon cancer: a randomized trial. JAMA 287 (3): 321-8, 2002. [PUBMED Abstract]
Tratamiento del cáncer de colon en estadio II
Opciones de tratamiento del cáncer de colon en estadio II
Las opciones de tratamiento del cáncer de colon en estadio II son las siguientes:
- Cirugía. Resección quirúrgica amplia y anastomosis.
- Quimioterapia adyuvante (en evaluación clínica).
Cirugía
Evidencia (métodos laparoscópicos):
- La función de los métodos laparoscópicos [1-4] en el tratamiento del cáncer de colon se examinó en un ensayo multicéntrico prospectivo aleatorizado (NCCTG-934653 [NCT00002575]) donde se comparó la colectomía laparoscópica (CLA) con la colectomía abierta.
- Las tasas de recidiva a 3 años y las tasas de supervivencia general (SG) a 3 años fueron similares en ambos grupos. Para obtener más información, consultar la sección Tratamiento quirúrgico primario.
- En el componente de calidad de vida de este ensayo se notificaron beneficios mínimos a corto plazo de la calidad de vida con CLA.[4][Nivel de evidencia A3]
Quimioterapia adyuvante
El posible valor de la quimioterapia adyuvante para los pacientes con cáncer de colon en estadio II es polémico. Aunque los subgrupos de pacientes con cáncer de colon en estadio II tienen un riesgo más alto de recidiva que el promedio de los pacientes (incluso aquellos con características anatómicas como adherencia tumoral a estructuras adyacentes, perforación y obstrucción completa),[5-7] la evidencia sobre la relación de la quimioterapia adyuvante basada en fluorouracilo (5-FU) y una mejora de la SG, en comparación con la cirugía sola, es contradictoria.[8]
Las características de los pacientes con cáncer de colon en estadio II que se vinculan con un aumento del riesgo de recidiva incluyen los siguientes aspectos:
- Muestra inadecuada de ganglios linfáticos.
- Enfermedad T4.
- Compromiso del peritoneo visceral.
- Tipo histológico con diferenciación precaria.
La decisión de utilizar quimioterapia adyuvante para los pacientes con cáncer de colon en estadio II es complicada y exige un análisis cuidadoso por parte de pacientes y médicos. En la mayoría de los pacientes no se indica el uso de terapia adyuvante, a menos que participen en un ensayo clínico.
Evidencia (quimioterapia adyuvante):
- En los ensayos GRECCR-03 (NCT00046995) y NCRI-QUASAR1 (NCT00005586) se evaluó el uso de quimioterapia sistémica, quimioterapia regional y terapia biológica. Después de la cirugía, los pacientes deben analizar la posibilidad de participar en un ensayo clínico controlado con cautela.
- Los investigadores del National Surgical Adyuvant Breast and Intestine Project indicaron que la reducción del riesgo de recidiva mediante la terapia adyuvante en pacientes con enfermedad en estadio II es de magnitud similar al beneficio observado en pacientes con enfermedad en estadio III tratados con terapia adyuvante, aunque no se ha establecido ninguna ventaja para la SG.[9]
- En un metanálisis de 1000 pacientes en estadio II cuya experiencia se fusionó de una serie de ensayos, se indicó una ventaja del 2 % en la supervivencia sin enfermedad a los 5 años cuando los pacientes tratados con terapia adyuvante de 5-FU y leucovorina se comparan con controles sin tratamiento.[10][Nivel de evidencia B1]; [11]
- El Cancer Care Ontario Practice Guideline Initiative Gastrointestinal Cancer Disease Site Group llevó a cabo un metanálisis de la literatura publicada en inglés sobre ensayos aleatorizados en los que se comparó la quimioterapia adyuvante y la observación para pacientes con cáncer de colon en estadio II.
- El cociente de riesgo de mortalidad fue de 0,87 (intervalo de confianza 95 %, 0,75–1,01; P = 0,07).[12]
A partir de estos datos, la American Society of Clinical Oncology publicó una guía que indica que “la evidencia directa de ensayos controlados aleatorizados no respalda el uso rutinario de quimioterapia adyuvante para pacientes con cáncer de colon en estadio II”.[13]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Bokey EL, Moore JW, Chapuis PH, et al.: Morbidity and mortality following laparoscopic-assisted right hemicolectomy for cancer. Dis Colon Rectum 39 (10 Suppl): S24-8, 1996. [PUBMED Abstract]
- Franklin ME, Rosenthal D, Abrego-Medina D, et al.: Prospective comparison of open vs. laparoscopic colon surgery for carcinoma. Five-year results. Dis Colon Rectum 39 (10 Suppl): S35-46, 1996. [PUBMED Abstract]
- Fleshman JW, Nelson H, Peters WR, et al.: Early results of laparoscopic surgery for colorectal cancer. Retrospective analysis of 372 patients treated by Clinical Outcomes of Surgical Therapy (COST) Study Group. Dis Colon Rectum 39 (10 Suppl): S53-8, 1996. [PUBMED Abstract]
- Weeks JC, Nelson H, Gelber S, et al.: Short-term quality-of-life outcomes following laparoscopic-assisted colectomy vs open colectomy for colon cancer: a randomized trial. JAMA 287 (3): 321-8, 2002. [PUBMED Abstract]
- Lanza G, Matteuzzi M, Gafá R, et al.: Chromosome 18q allelic loss and prognosis in stage II and III colon cancer. Int J Cancer 79 (4): 390-5, 1998. [PUBMED Abstract]
- Jen J, Kim H, Piantadosi S, et al.: Allelic loss of chromosome 18q and prognosis in colorectal cancer. N Engl J Med 331 (4): 213-21, 1994. [PUBMED Abstract]
- Merkel S, Wein A, Günther K, et al.: High-risk groups of patients with Stage II colon carcinoma. Cancer 92 (6): 1435-43, 2001. [PUBMED Abstract]
- Moertel CG, Fleming TR, Macdonald JS, et al.: Intergroup study of fluorouracil plus levamisole as adjuvant therapy for stage II/Dukes' B2 colon cancer. J Clin Oncol 13 (12): 2936-43, 1995. [PUBMED Abstract]
- Mamounas E, Wieand S, Wolmark N, et al.: Comparative efficacy of adjuvant chemotherapy in patients with Dukes' B versus Dukes' C colon cancer: results from four National Surgical Adjuvant Breast and Bowel Project adjuvant studies (C-01, C-02, C-03, and C-04) J Clin Oncol 17 (5): 1349-55, 1999. [PUBMED Abstract]
- Efficacy of adjuvant fluorouracil and folinic acid in B2 colon cancer. International Multicentre Pooled Analysis of B2 Colon Cancer Trials (IMPACT B2) Investigators. J Clin Oncol 17 (5): 1356-63, 1999. [PUBMED Abstract]
- Harrington DP: The tea leaves of small trials. J Clin Oncol 17 (5): 1336-8, 1999. [PUBMED Abstract]
- Figueredo A, Charette ML, Maroun J, et al.: Adjuvant therapy for stage II colon cancer: a systematic review from the Cancer Care Ontario Program in evidence-based care's gastrointestinal cancer disease site group. J Clin Oncol 22 (16): 3395-407, 2004. [PUBMED Abstract]
- Benson AB, Schrag D, Somerfield MR, et al.: American Society of Clinical Oncology recommendations on adjuvant chemotherapy for stage II colon cancer. J Clin Oncol 22 (16): 3408-19, 2004. [PUBMED Abstract]
Tratamiento del cáncer de colon en estadio III
En el cáncer de colon en estadio III hay compromiso ganglionar. En los estudios se indicó que el número de ganglios linfáticos comprometidos afecta el pronóstico; los pacientes con compromiso de 1 a 3 ganglios linfáticos tienen una supervivencia significativamente mejor que los pacientes con compromiso de 4 o más ganglios.
Opciones de tratamiento del cáncer de colon en estadio III
Las opciones de tratamiento del cáncer de colon en estadio III son las siguientes:
- Cirugía.
- Quimioterapia adyuvante.
- Ensayos clínicos. Los pacientes aptos pueden considerar la inscripción en ensayos clínicos controlados con cautela en los que se comparen varios regímenes de quimioterapia posoperatoria.[1]
Cirugía
La cirugía indicada para el cáncer de colon en estadio III es una resección quirúrgica amplia con anastomosis.
Evidencia (métodos laparoscópicos):
- La función de los métodos laparoscópicos [2-5] en el tratamiento del cáncer de colon se examinó en un ensayo multicéntrico prospectivo aleatorizado (NCCTG-934653 [NCT00002575]) donde se comparó la colectomía laparoscópica (CLA) con la colectomía abierta.
- Las tasas de recidiva a 3 años y las tasas de supervivencia general (SG) a 3 años fueron similares en ambos grupos. Para obtener más información, consultar la sección Tratamiento quirúrgico primario.
- El componente de calidad de vida de este ensayo se publicó por separado y se notificaron beneficios mínimos a corto plazo de la calidad de vida con la CLA.[6][Nivel de evidencia A3]
Quimioterapia adyuvante
Regímenes quimioterapéuticos antes del año 2000
Antes del año 2000, el fluorouracilo (5-FU) era el único fármaco de quimioterapia citotóxica útil en el entorno adyuvante para los pacientes con cáncer de colon en estadio III. En muchos de los estudios aleatorizados tempranos de 5-FU en el entorno adyuvante no se observó ninguna mejora significativa en la supervivencia de los pacientes.[7-10] En estos ensayos se usó 5-FU solo o 5-FU con semustina.
Evidencia (5-FU solo y 5-FU con semustina):
- El North Central Cancer Treatment Group llevó a cabo un ensayo aleatorizado en el que se comparó la resección quirúrgica sola con levamisol posoperatorio o levamisol y 5-FU.[11][Nivel de evidencia A1]
- Se observó una mejoría significativa en la supervivencia sin enfermedad (SSE) de los pacientes con cáncer de colon en estadio III que recibieron levamisol y 5-FU, pero el beneficio para la SG se ubicó en el límite de significación estadística.
- Se observó un beneficio absoluto para la supervivencia de alrededor del 12 % (49 vs. 37 %) en los pacientes con enfermedad en estadio III tratados con levamisol y 5-FU.
- En un ensayo intergrupal confirmatorio grande, la administración de levamisol y 5-FU prolongó la SSE y la SG en pacientes con cáncer de colon en estadio III, en comparación con los pacientes que no recibieron tratamiento después de la cirugía.[12][Nivel de evidencia A1] El levamisol solo no confirió estos beneficios.
- En estudios posteriores se probó la combinación de 5-FU y leucovorina (5-FU y LV) para el tratamiento adyuvante de los pacientes con carcinoma de colon resecado.
- Los resultados de múltiples ensayos aleatorizados con inscripción de más de 4000 pacientes, donde se comparó la quimioterapia adyuvante de 5-FU y LV con cirugía o 5-FU, semustina y vincristina, demostraron una reducción relativa de la mortalidad de entre el 22 % y el 33 % (SG a 3 años del 71–78 %, aumentó al 75–84 %).[13-15]
- En el ensayo intergrupal 0089 (INT-0089 [NCT00201331]), se asignó al azar a 3794 pacientes con cáncer de color de riesgo alto en estadios II o III a uno de los siguientes 4 grupos de tratamiento:[16]
- Administración del régimen de la Mayo Clinic durante 6 ciclos.
- Administración del régimen de Roswell Park durante 4 ciclos.
- Administración del régimen de la Mayo Clinic con levamisol durante 6 ciclos.
- Administración de un régimen de levamisol durante 1 año.
Resultados:
- La SG a 5 años osciló entre un 49 % para el régimen de la Mayo Clinic con levamisol y un 60 % para el régimen de la Mayo Clinic solo, y no hubo diferencias estadísticamente significativas entre los grupos de tratamiento.[16][Nivel de evidencia A1]
- En un informe preliminar de noviembre de 1997, se observó una ventaja estadísticamente significativa de la SG para el régimen de la Mayo Clinic con levamisol en comparación con el régimen de levamisol. Esta diferencia se tornó insignificante al prolongar el seguimiento.
- En general, se presentaron con mayor frecuencia efectos tóxicos de grado 3 o más altos durante el régimen de la Mayo Clinic y el régimen de la Mayo Clinic con levamisol. Además, el régimen de la Mayo Clinic con levamisol fue significativamente más tóxico cuando se acompañó de levamisol, en comparación con el régimen sin levamisol.
- La tasa de mortalidad para los 4 regímenes osciló entre un 0,5 % y un 1 %.
- Debido a la facilidad de uso y su perfil de toxicidad favorable, el régimen de Roswell Park se convirtió en el régimen adyuvante preferido en los Estados Unidos y se ha usado con frecuencia para el grupo de control en ensayos aleatorizados posteriores.
- Además del ensayo INT-0089, a continuación se resumen las conclusiones de varios estudios en los que se refinó el uso de 5-FU y LV para el entorno adyuvante:
- El levamisol no es necesario cuando se usa leucovorina.[16]
- El tratamiento que incluye 6 a 8 meses de 5-FU y LV equivale a 12 meses de tratamiento.[17-19]
- El tratamiento que incluye 24 semanas de 5-FU y LV adyuvante equivale a 36 semanas de tratamiento.[20]
- Las dosis altas de leucovorina son equivalentes a las dosis bajas de leucovorina.[21]
- En un metanálisis de 7 ensayos, no se observaron diferencias significativas en la eficacia o toxicidad entre los pacientes de 70 años o menos, en comparación con los pacientes mayores de 70 años.[22]
- Es más inocuo administrar un régimen de Gramont en bolo e infusión con un programa de 5-FU y LV que la administración de un programa de la Mayo Clinic modificado con bolo de 5-FU y LV.[20]
Regímenes quimioterapéuticos después del año 2000
Capecitabina
La capecitabina es una fluoropirimidina oral que pasa por una conversión enzimática de 3 pasos y se convierte en 5-FU durante el paso final en la célula tumoral. En dos estudios se demostró la equivalencia de la capecitabina, en comparación con 5-FU y LV, en pacientes con cáncer de color metastásico.[23,24]
La capecitabina proporciona desenlaces equivalentes al 5-FU y LV intravenosos en los pacientes con cáncer de colon en estadio III.
Evidencia (capecitabina):
- En un estudio europeo multicéntrico, se comparó la capecitabina (1250 mg/m2) administrada 2 veces al día los días 1 a 14 y luego, cada 21 días durante 8 ciclos con el programa de la Mayo Clinic de 5-FU y dosis bajas de LV en pacientes con cáncer de color en estadio III.[25]
- En el estudio se demostró que la SSE a 3 años es equivalente en los pacientes que recibieron capecitabina o 5-FU y LV (cociente de riesgos instantáneos [CRI], 0,87; P < 0,001).[25][Nivel de evidencia B1]
- La eritrodisestesia palmoplantar y la hiperbilirrubinemia fueron significativamente más frecuentes en los pacientes que recibieron la capecitabina, pero la diarrea, las náuseas o los vómitos, la estomatitis, la alopecia y la neutropenia fueron significativamente menos frecuentes.
- De los pacientes que recibieron la capecitabina, el 57 % necesitó modificación de la dosis.
- La capecitabina es una opción equivalente para los pacientes con cáncer de colon en estadio III en quienes se anticipa la administración de 5-FU y LV.
Oxaliplatino
El oxaliplatino tiene una actividad significativa cuando se combina con 5-FU y LV en pacientes de cáncer colorrectal metastásico.
Evidencia (oxaliplatino):
- El estudio Multicenter International Study of Oxaliplatin/Fluorouracil/Leucovorin in the Adjuvant Treatment of Colon Cancer (MOSAIC [NCT00275210]) se completó con 2246 pacientes con cáncer de color en estadios II o III sometidos a resección en quienes se encontró que los efectos tóxicos y la eficacia de FOLFOX-4 (oxaliplatino, LV y 5-FU) fueron comparables a los del mismo régimen de 5-FU y LV sin oxaliplatino administrado durante 6 meses.[26] A partir de estos resultados del ensayo MOSAIC, el régimen FOLFOX-4 neoadyuvante demostró prolongar la SG en los pacientes con cáncer de colon en estadio III, en comparación con los pacientes que recibieron 5-FU y LV sin oxaliplatino.[27]
- En los resultados preliminares del estudio al cabo de 37 meses de seguimiento se observó una mejoría significativa en la SSE a 3 años (77,8 vs. 72,9 %; P = 0,01) a favor de FOLFOX-4. Cuando se notificaron inicialmente los resultados, no hubo ninguna diferencia en la SG.[27][Nivel de evidencia B1]
- En un seguimiento posterior, al cabo de 6 años se notificó que la SG para todos los pacientes (estadios II y III) que participaron en el estudio no fue estadísticamente diferente (SG = 78,5 vs. 76,0 %; CRI = 0,84; intervalo de confianza [IC] 95 %, 0,71–1,00). En el análisis de subconjuntos, la SG a 6 años en pacientes con cáncer de colon en estadio III fue del 72,9 % en quienes recibieron FOLFOX-4 y del 68,7 % en quienes recibieron 5-FU y LV (CRI, 0,80; IC 95 %, 0,65–0,97; P = 0,023).[27][Nivel de evidencia A1]
- Los pacientes tratados con FOLFOX-4 presentaron efectos tóxicos más frecuentes, principalmente neutropenia (41 % >grado 3) y neuropatía sensorial periférica reversible (12,4 % >grado 3).
- En un estudio aleatorizado de fase III (NSABP C-07 [NCT00004931]), 2407 pacientes con cáncer de color en estadios II o III se asignaron al azar a 5-FU y LV adyuvante o fluorouracilo, leucovorina y oxaliplatino (FLOX) (5-FU y LV semanal con oxaliplatino administrado las semanas 1, 3 y 5 de cada ciclo de 6 semanas). La SSE fue el criterio principal de valoración del estudio.[28]
- La SSE fue significativamente más larga en el grupo de tratamiento que recibió FLOX, pero la SG no fue significativamente diferente. La tasa de SSE fue del 69,4 % para los pacientes que recibieron FLOX y del 64,2 % para los pacientes que recibieron 5-FU y LV (CRI, 0,82; IC 95 %, 0,72–0,93; P = 0,0034).
- La tasa de SG a 5 años fue del 80,2 % para los pacientes que recibieron FLOX y del 78,4 % para los pacientes que recibieron 5-FU y LV (CRI, 0,88; IC 95 %, 0,75–1,02; P = 0,08).[28][Nivel de evidencia B1]
- El 36,9 % de los pacientes que recibieron FLOX presentaron diarrea de grados 3 y 4, y el 16,1 % de los pacientes que recibieron FLOX presentaron deshidratación de grados 3 y 4.
La mayoría de los médicos han adoptado FOLFOX como estándar de atención debido a los problemas de toxicidad de FLOX semanal. FOLFOX se ha convertido en el estándar de referencia para la próxima generación de ensayos clínicos de pacientes con cáncer de color en estadio III.[27]
Capecitabina y oxaliplatino
La combinación de capecitabina y oxaliplatino (CAPOX) es un tratamiento estándar aceptado en pacientes con cáncer colorrectal metastásico.
Evidencia (CAPOX):
- Se evaluó CAPOX en el entorno adyuvante para pacientes con cáncer de color en estadio III resecado (capecitabina 1000 mg/m2 2 veces al día los días 1 a 14 cada 21 días y oxaliplatino 130 mg/m2 cada 21 días durante un total de 8 ciclos).[29] En un ensayo aleatorizado de fase III (NO16968 [NCT00069121]), se asignó al azar a 1886 pacientes con cáncer de colon en estadio III para recibir CAPOX o bolo de 5FU y LV (programa de Roswell Park o de la Mayo Clinic).
- La tasa de SSE a 7 años fue del 63 % para los pacientes que recibieron CAPOX y del 56 % para los pacientes que recibieron bolos de 5-FU y LV (CRI, 0,8; IC 95 %, 0,69–0,93; P = 0,004).
- La tasa de SSE a 7 años fue del 73% para los pacientes que recibieron CAPOX y del 67% para los pacientes que recibieron bolos de 5-FU y LV (CRI, 0,83; IC 95 %, 0,70–0,99; P = 0,04).[29][Nivel de evidencia A1]
A partir de este ensayo, CAPOX se ha convertido en un régimen estándar aceptable para los pacientes con cáncer de color en estadio III.
Duración del tratamiento con oxaliplatino
Dada la tasa alta de neuropatía discapacitante, la duración de la terapia adyuvante con oxaliplatino se convirtió en una pregunta abierta.
Evidencia (duración del tratamiento con oxaliplatino):
- El estudio de colaboración International Duration Evaluation of Adjuvant Therapy (IDEA) consistió en 6 ensayos aleatorizados separados donde se usaron regímenes de quimioterapia adyuvante a base de oxaliplatino de 6 meses versus 3 meses de duración. El estudio IDEA se planificó como un análisis conjunto y prospectivo de estos 6 estudios simultáneos con el fin de evaluar la ausencia de inferioridad de la terapia adyuvante con FOLFOX o CAPOX administrados durante 3 meses versus 6 meses. Se podía argumentar la ausencia de inferioridad si el límite superior del IC bilateral de 95 % del CRI no excedía 1,12.[30]
Entre 2007 y 2015, 13 025 pacientes con cáncer de color en estadio III se inscribieron en estos 6 ensayos simultáneos de fase III. De este grupo inicial, 12834 pacientes cumplieron los criterios para el análisis por intención de tratar. Al cabo de una mediana de seguimiento de 41,8 meses, no se confirmó la ausencia de inferioridad de 3 versus 6 meses en la población del análisis por intención de tratar modificada (CRI, 1,07; IC 95 %, 1,00–1,15, P = 0,11 para la ausencia de inferioridad de 3 meses).
- Las tasas de SSE a 3 años fueron del 74,6 % en el grupo de 3 meses y del 75,5 % en el grupo de 6 meses.
- La neurotoxicidad de grado 2 o superior fue más baja en el grupo de 3 meses (16,6 % para los pacientes que recibieron FOLFOX y 14,2 % para los pacientes que recibieron CAPOX) que en el grupo de 6 meses (47,7 % para los pacientes que recibieron FOLFOX y 44,9 % para los pacientes que recibieron CAPOX). Además, todos los demás efectos tóxicos fueron sustancialmente más bajos con 3 meses de tratamiento que con 6 meses.
- En un análisis de subgrupos se observó lo siguiente:
- Entre los pacientes que recibieron FOLFOX, 6 meses de tratamiento fueron superiores a 3 meses de tratamiento (CRI, 1,16; IC 95 %, 1,06–1,26; P = 0,001).
- Entre los pacientes que recibieron CAPOX, 3 meses de tratamiento fueron como 6 meses de tratamiento (CRISSE, 0,95; IC 95 %, 0,85–1,06) y alcanzaron el margen predeterminado de ausencia de inferioridad.
- Entre los pacientes con tumores N1 (compromiso de <4 ganglios), el CRI fue de 1,07 (0,97–1,17) y entre los pacientes con tumores N2 (compromiso de ≥4 ganglios), el CRI fue de 1,07 (0,96–1,19).
- Entre los pacientes con tumores T4, una duración del tratamiento de 3 meses fue inferior a una duración de 6 meses (CRI, 1,16; IC 95 %, 1,03–1,31).
- Entre los pacientes con tumores de riesgo bajo (T1–3, N1), 3 meses de tratamiento no fueron inferiores a 6 meses de tratamiento (CRI, 1,01; IC 95 %, 0,90–1,12) con una tasa de SSE a 3 años del 83,1 % para los pacientes que recibieron 3 meses de tratamiento y del 83,3 % para los pacientes que recibieron 6 meses de tratamiento.
- Entre los pacientes con tumores de riesgo alto (T4 o N2), 6 meses de tratamiento fueron superiores a 3 meses de tratamiento (CRI, 1,12; IC 95 %, 1,03–1,23; P = 0,01).
El estudio IDEA ha generado mucho debate sobre la duración óptima del tratamiento. Se recomienda que los pacientes y los médicos sopesen las ventajas y desventajas y la posible disminución de la eficacia del tratamiento durante 3 meses versus el aumento definitivo del riesgo de toxicidad, en particular la neuropatía. CAPOX es un poco más activo que FOLFOX en el entorno adyuvante.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Rougier P, Nordlinger B: Large scale trial for adjuvant treatment in high risk resected colorectal cancers. Rationale to test the combination of loco-regional and systemic chemotherapy and to compare l-leucovorin + 5-FU to levamisole + 5-FU. Ann Oncol 4 (Suppl 2): 21-8, 1993. [PUBMED Abstract]
- Bokey EL, Moore JW, Chapuis PH, et al.: Morbidity and mortality following laparoscopic-assisted right hemicolectomy for cancer. Dis Colon Rectum 39 (10 Suppl): S24-8, 1996. [PUBMED Abstract]
- Franklin ME, Rosenthal D, Abrego-Medina D, et al.: Prospective comparison of open vs. laparoscopic colon surgery for carcinoma. Five-year results. Dis Colon Rectum 39 (10 Suppl): S35-46, 1996. [PUBMED Abstract]
- Fleshman JW, Nelson H, Peters WR, et al.: Early results of laparoscopic surgery for colorectal cancer. Retrospective analysis of 372 patients treated by Clinical Outcomes of Surgical Therapy (COST) Study Group. Dis Colon Rectum 39 (10 Suppl): S53-8, 1996. [PUBMED Abstract]
- Schwenk W, Böhm B, Müller JM: Postoperative pain and fatigue after laparoscopic or conventional colorectal resections. A prospective randomized trial. Surg Endosc 12 (9): 1131-6, 1998. [PUBMED Abstract]
- Weeks JC, Nelson H, Gelber S, et al.: Short-term quality-of-life outcomes following laparoscopic-assisted colectomy vs open colectomy for colon cancer: a randomized trial. JAMA 287 (3): 321-8, 2002. [PUBMED Abstract]
- Panettiere FJ, Goodman PJ, Costanzi JJ, et al.: Adjuvant therapy in large bowel adenocarcinoma: long-term results of a Southwest Oncology Group Study. J Clin Oncol 6 (6): 947-54, 1988. [PUBMED Abstract]
- Adjuvant therapy of colon cancer--results of a prospectively randomized trial. Gastrointestinal Tumor Study Group. N Engl J Med 310 (12): 737-43, 1984. [PUBMED Abstract]
- Higgins GA, Amadeo JH, McElhinney J, et al.: Efficacy of prolonged intermittent therapy with combined 5-fluorouracil and methyl-CCNU following resection for carcinoma of the large bowel. A Veterans Administration Surgical Oncology Group report. Cancer 53 (1): 1-8, 1984. [PUBMED Abstract]
- Buyse M, Zeleniuch-Jacquotte A, Chalmers TC: Adjuvant therapy of colorectal cancer. Why we still don't know. JAMA 259 (24): 3571-8, 1988. [PUBMED Abstract]
- Laurie JA, Moertel CG, Fleming TR, et al.: Surgical adjuvant therapy of large-bowel carcinoma: an evaluation of levamisole and the combination of levamisole and fluorouracil. The North Central Cancer Treatment Group and the Mayo Clinic. J Clin Oncol 7 (10): 1447-56, 1989. [PUBMED Abstract]
- Moertel CG, Fleming TR, Macdonald JS, et al.: Levamisole and fluorouracil for adjuvant therapy of resected colon carcinoma. N Engl J Med 322 (6): 352-8, 1990. [PUBMED Abstract]
- Wolmark N, Rockette H, Fisher B, et al.: The benefit of leucovorin-modulated fluorouracil as postoperative adjuvant therapy for primary colon cancer: results from National Surgical Adjuvant Breast and Bowel Project protocol C-03. J Clin Oncol 11 (10): 1879-87, 1993. [PUBMED Abstract]
- Efficacy of adjuvant fluorouracil and folinic acid in colon cancer. International Multicentre Pooled Analysis of Colon Cancer Trials (IMPACT) investigators. Lancet 345 (8955): 939-44, 1995. [PUBMED Abstract]
- O'Connell M, Mailliard J, Macdonald J, et al.: An intergroup trial of intensive course 5FU and low dose leucovorin as surgical adjuvant therapy for high risk colon cancer. [Abstract] Proceedings of the American Society of Clinical Oncology 12: A-552, 190, 1993.
- Haller DG, Catalano PJ, Macdonald JS, et al.: Phase III study of fluorouracil, leucovorin, and levamisole in high-risk stage II and III colon cancer: final report of Intergroup 0089. J Clin Oncol 23 (34): 8671-8, 2005. [PUBMED Abstract]
- Wolmark N, Bryant J, Smith R, et al.: Adjuvant 5-fluorouracil and leucovorin with or without interferon alfa-2a in colon carcinoma: National Surgical Adjuvant Breast and Bowel Project protocol C-05. J Natl Cancer Inst 90 (23): 1810-6, 1998. [PUBMED Abstract]
- Wolmark N, Rockette H, Mamounas E, et al.: Clinical trial to assess the relative efficacy of fluorouracil and leucovorin, fluorouracil and levamisole, and fluorouracil, leucovorin, and levamisole in patients with Dukes' B and C carcinoma of the colon: results from National Surgical Adjuvant Breast and Bowel Project C-04. J Clin Oncol 17 (11): 3553-9, 1999. [PUBMED Abstract]
- Okuno SH, Woodhouse CL, Loprinzi CL, et al.: Phase III placebo-controlled clinical trial evaluation of glutamine for decreasing mucositis in patients receiving 5FU (fluorouracil)-base chemotherapy. [Abstract] Proceedings of the American Society of Clinical Oncology 17: A-256, 1998.
- Andre T, Colin P, Louvet C, et al.: Semimonthly versus monthly regimen of fluorouracil and leucovorin administered for 24 or 36 weeks as adjuvant therapy in stage II and III colon cancer: results of a randomized trial. J Clin Oncol 21 (15): 2896-903, 2003. [PUBMED Abstract]
- Comparison of flourouracil with additional levamisole, higher-dose folinic acid, or both, as adjuvant chemotherapy for colorectal cancer: a randomised trial. QUASAR Collaborative Group. Lancet 355 (9215): 1588-96, 2000. [PUBMED Abstract]
- Sargent DJ, Goldberg RM, Jacobson SD, et al.: A pooled analysis of adjuvant chemotherapy for resected colon cancer in elderly patients. N Engl J Med 345 (15): 1091-7, 2001. [PUBMED Abstract]
- Van Cutsem E, Twelves C, Cassidy J, et al.: Oral capecitabine compared with intravenous fluorouracil plus leucovorin in patients with metastatic colorectal cancer: results of a large phase III study. J Clin Oncol 19 (21): 4097-106, 2001. [PUBMED Abstract]
- Hoff PM, Ansari R, Batist G, et al.: Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer: results of a randomized phase III study. J Clin Oncol 19 (8): 2282-92, 2001. [PUBMED Abstract]
- Twelves C, Wong A, Nowacki MP, et al.: Capecitabine as adjuvant treatment for stage III colon cancer. N Engl J Med 352 (26): 2696-704, 2005. [PUBMED Abstract]
- André T, Boni C, Mounedji-Boudiaf L, et al.: Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. N Engl J Med 350 (23): 2343-51, 2004. [PUBMED Abstract]
- André T, Boni C, Navarro M, et al.: Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial. J Clin Oncol 27 (19): 3109-16, 2009. [PUBMED Abstract]
- Yothers G, O'Connell MJ, Allegra CJ, et al.: Oxaliplatin as adjuvant therapy for colon cancer: updated results of NSABP C-07 trial, including survival and subset analyses. J Clin Oncol 29 (28): 3768-74, 2011. [PUBMED Abstract]
- Schmoll HJ, Tabernero J, Maroun J, et al.: Capecitabine Plus Oxaliplatin Compared With Fluorouracil/Folinic Acid As Adjuvant Therapy for Stage III Colon Cancer: Final Results of the NO16968 Randomized Controlled Phase III Trial. J Clin Oncol 33 (32): 3733-40, 2015. [PUBMED Abstract]
- Grothey A, Sobrero AF, Shields AF, et al.: Duration of Adjuvant Chemotherapy for Stage III Colon Cancer. N Engl J Med 378 (13): 1177-1188, 2018. [PUBMED Abstract]
Tratamiento del cáncer de colon en estadio IV y recidivante
El cáncer de colon en estadio IV indica enfermedad metastásica a distancia. El tratamiento del cáncer de colon recidivante depende de que los sitios de enfermedad recidivante se verifiquen durante el examen físico o en los estudios radiográficos. Además de los procedimientos radiográficos estándares, la radioinmunocentellografía aporta información clínica que quizás afecte las decisiones sobre el tratamiento.[1] Estos abordajes no han llevado a mejoras en las medidas de desenlace a largo plazo, como la supervivencia.
Las opciones de tratamiento del cáncer de colon en estadio IV, el cáncer de colon recidivante y las metástasis hepáticas son las siguientes:
- Resección quirúrgica del cáncer recidivante local.
- Resección quirúrgica y anastomosis o derivación de una lesión primaria obstructiva o hemorrágica para determinados casos metastásicos.
- En pacientes seleccionados, ablación o resección de metástasis hepáticas (la tasa de curación a 5 años para la resección de metástasis solitarias o combinadas supera el 20 %).[2-11]
- Resección de metástasis pulmonares u ováricas aisladas en pacientes seleccionados.[12]
- Radioterapia paliativa.
- Quimioterapia paliativa.
- Terapia dirigida.
- Ensayos clínicos en los que se comparen varios fármacos nuevos, regímenes quimioterapéuticos o terapias biológicas, solos o combinados.
Opciones de tratamiento para metástasis hepáticas
Alrededor del 50 % de los pacientes con cáncer de color recibirán un diagnóstico de metástasis hepáticas, ya sea en el momento del cuadro clínico inicial o en la recidiva de la enfermedad. Si bien solo una proporción pequeña de pacientes con metástasis hepáticas son aptos para someterse a una resección quirúrgica, los avances en las técnicas de ablación tumoral y en la administración de quimioterapia regional y sistémica ofrecen varias opciones de tratamiento. Entre ellas, se encuentran las siguientes:
Cirugía
Se puede considerar que las metástasis hepáticas son resecables cuando cumplen con las siguientes características:[5,7,13-16]
- Número limitado de lesiones.
- Localización intrahepática de las lesiones.
- Ausencia de compromiso vascular importante.
- Enfermedad extrahepática ausente o limitada.
- Suficiente reserva hepática funcional.
En la mayoría de los estudios no aleatorizados, como el ensayo North Central Cancer Treatment Group (NCCTG-934653 [NCT00002575]), una resección con márgenes sin compromiso tumoral produjo tasas de supervivencia a 5 años del 25 % al 40 % en pacientes con metástasis hepáticas resecables.[5,7,13-16][Nivel de evidencia C3] La mejora de las técnicas quirúrgicas y los avances en las imágenes preoperatorias han mejorado la selección de los pacientes para la resección. Además, en múltiples estudios de quimioterapia multifarmacológica se demostró que la enfermedad metastásica aislada en el hígado, que históricamente se consideraría irresecable, a veces se puede resecar después de la administración de quimioterapia.[17]
En el caso de los pacientes con metástasis hepáticas irresecables, se han obtenido excelentes resultados con el trasplante de hígado. Todavía se está determinando la cohorte de pacientes óptima para este tratamiento, pero en general, el objetivo es lograr un buen control sistémico inicial con quimioterapia, seguida del trasplante. En un estudio de 91 pacientes, el 11 % se sometió a un trasplante de hígado de un donante vivo. Al cabo de una mediana de seguimiento de 1,5 años tras el trasplante, la tasa de supervivencia sin recidiva fue del 62 % y la tasa de supervivencia general (SG) fue del 100 %.[18][Nivel de evidencia C3]
En el estudio TRANSMET (NCT02597348), publicado en forma de resumen, se asignó al azar a 94 pacientes a recibir quimioterapia y trasplante de hígado (n = 47) o quimioterapia sola (n = 47). En un análisis por intención de tratar, la tasa de SG a 5 años fue del 57 % en el grupo de quimioterapia y trasplante de hígado y del 13 % en el grupo de quimioterapia sola. En un análisis por protocolo, la tasa de SG a 5 años fue del 73 % en el grupo de quimioterapia y trasplante de hígado y del 9 % en el grupo de quimioterapia sola.[19][Nivel de evidencia A1]
Quimioterapia neoadyuvante para metástasis hepáticas irresecables
Los pacientes con metástasis hepáticas que se consideran irresecables a veces son aptos para resección si responden bien a la quimioterapia. Estos pacientes tienen tasas de supervivencia a 5 años similares a los pacientes con enfermedad resecable inicial.[17] No hay consenso sobre el mejor régimen para convertir las metástasis hepáticas aisladas irresecables en metástasis hepáticas resecables.
Ablación local
La ablación por radiofrecuencia se ha convertido en una técnica inocua (morbilidad mayor al 2 % y tasa de mortalidad <1 %) que puede proporcionar un control tumoral a largo plazo.[20-26] La ablación por radiofrecuencia y la ablación crioquirúrgica [27-30] son opciones para los pacientes con tumores irresecables y para los pacientes que no son aptos para la resección hepática.
Otros métodos de ablación local que se han utilizado para tratar las metástasis hepáticas son la embolización y la radioterapia intersticial.[31,32] Los pacientes con metástasis pulmonares limitadas y los pacientes con metástasis pulmonares y hepáticas simultáneas también pueden considerar la resección quirúrgica, con posibilidad de supervivencia a 5 años en pacientes rigurosamente seleccionados.[12,33,34]
Quimioterapia adyuvante o neoadyuvante para metástasis hepáticas resecables
La función de la quimioterapia adyuvante después de una resección potencialmente curativa de metástasis hepáticas es incierta.
Evidencia (quimioterapia adyuvante o neoadyuvante para metástasis hepáticas resecables):
En la época anterior a FOLFOX (leucovorina cálcica [LV], fluorouracilo [5-FU] y oxaliplatino) y FOLFIRI (5-FU, leucovorina e irinotecán), en 2 ensayos se intentó asignar al azar a los pacientes para someterse a resección de metástasis hepáticas, recibir 5-FU y LV o someterse a observación; sin embargo, ambos estudios se cerraron antes de tiempo por la escasa inscripción de pacientes.
- En el ensayo FFCD-9902 (NCT00304135), se asignó al azar a 173 pacientes (se diseñó para 200 pacientes) a recibir 5-FU y LV posoperatorios, que es el régimen de la Mayo Clinic, o someterse a observación.[35]
- La tasa de supervivencia sin enfermedad (SSE) a 5 años fue del 33,5 % para los pacientes del grupo de quimioterapia y del 26,7 % para los pacientes del grupo de control (análisis multivariante de Cox: oportunidad relativa [OR] de recidiva o muerte, 0,66; intervalo de confianza [IC] 95 %, 0,46–0,96; P = 0,028). La tasa de SG a 5 años no fue significativamente diferente entre los grupos (grupo de quimioterapia, 51,1 % vs. grupo de control, 41,1 %; ORmuerte, 0,73; IC 95 %, 0,48–1,10; P = 0,13).
- En el ensayo internacional de European Organization for Research and Treatment of Cancer, el National Cancer Institute of Canada y el Gruppo Interdisciplinare Valutazione Interventi in Oncologia (EORTC/NCIC/GIVIO), se intentó una asignación al azar similar para pacientes sometidos a una resección quirúrgica de metástasis hepáticas. El estudio cerró por la escasa inscripción de pacientes y en su lugar se realizó un análisis combinado de este estudio con el estudio FFCD-9902. En el análisis combinado, se incluyó a 278 pacientes (138 tratados con quimioterapia y 14 tratados con cirugía sola).[36]
- La mediana de supervivencia sin progresión (SSP) fue de 27,9 meses en el grupo de quimioterapia y de 18,8 meses en el grupo de cirugía sola (cociente de riesgos instantáneos [CRI], 1,32; IC 95 %, 1,00–1,76; P = 0,058).
- La mediana de SG fue de 62,2 meses en el grupo de quimioterapia comparada con 47,3 meses en el grupo de cirugía sola (CRI, 1,32; IC 95 %, 0,95–1,82; P = 0,095).
En la era de la quimioterapia multifarmacológica, se evaluó en dos estudios posteriores la función de este tipo de quimioterapia en el entorno adyuvante después de la resección de metástasis hepáticas de cáncer colorrectal.
- En un estudio de fase III se asignó al azar a 306 pacientes a recibir 5-FU y LV o FOLFIRI después de la resección de metástasis hepáticas.[37]
- No hubo diferencia en la SSE (21,6 meses para 5-FU y LV vs. 24,7 meses con FOLFIRI; CRI, 0,89; P del orden logarítmico = 0,44) o en la SG (CRI, 1,09; IC 95 %, 0,72–1,64).
- En el ensayo EORTC-40983 (NCT00006479) se asignó al azar a 364 pacientes con hasta 4 metástasis hepáticas resecables a FOLFOX perioperatorio (6 ciclos prequirúrgicos y 6 ciclos posquirúrgicos) o cirugía sola.[38]
- La tasa de SSP fue del 28,1 % (IC 95,66 %, 21,3–35,5 %) en el grupo de cirugía sola y del 35,4 % (28,1–42,7 %; CRI, 0,79; 0,62–1,02; P = 0,058) en el grupo de quimioterapia perioperatoria. No hubo diferencia en la SG. En un análisis posterior se observó que la diferencia en la SSP para los pacientes realmente aptos aumentó un 8,1 % (desde el 28,1 % [21,2–36,6] hasta el 36,2 % [28,7–43,8]; CRI, 0,77 [0,60–1,00]; P = 0,041). En los pacientes que se sometieron a resección de las metástasis hepáticas, la diferencia en la SSP aumentó un 9,2 % (desde el 33,2 % [25,3–41,2] hasta el 42,4 % [34,0–50,5]; CRI, 0,73 [0,55–0,97]; P = 0,025).
- Las complicaciones posoperatorias reversibles se presentaron con más frecuencia después de la quimioterapia que la cirugía (40 [25 %] de 159 complicaciones vs. 27 [16 %] de 170 complicaciones; P = 0,04). Después de la cirugía, se presentaron dos muertes en el grupo de cirugía sola y una en el grupo de quimioterapia perioperatoria.
No hay evidencia de nivel alto que permita demostrar que la quimioterapia perioperatoria o posoperatoria mejoren la SG de pacientes sometidos a resección de metástasis hepáticas. De todos modos, a partir del análisis posterior de subconjuntos del estudio EORTC, algunos médicos consideran que el tratamiento perioperatorio o posoperatorio es razonable en este entorno.
Quimioterapia intraarterial después de resección hepática
La quimioterapia intraarterial hepática con floxuridina para las metástasis hepáticas ha producido tasas de respuesta general más altas, pero no una mejora uniforme en la supervivencia cuando se compara con la quimioterapia sistémica.[2,39-43] En un metanálisis de estudios aleatorizados, todos ellos de la época en que solo se disponía de fluoropirimidinas para el tratamiento sistémico, no se demostró ninguna ventaja de supervivencia.[44]
Evidencia (quimioterapia intraarterial después de resección hepática):
En dos ensayos se evaluó la floxuridina arterial hepática en el entorno adyuvante después de la resección hepática.
- En un ensayo de floxuridina arterial hepática y dexametasona con 5-FU y LV sistémicas, en comparación con solo 5-FU y LV sistémicas, se observaron mejores tasas de SSP a 2 años (57 vs. 42 %, P = 0,07) y tasas de SG (86 vs. 72 %, P = 0,03) en los pacientes del grupo de terapia combinada, pero no se observó ninguna diferencia estadística significativa en la mediana de supervivencia, en comparación con el tratamiento sistémico con 5-FU solo.[45][Nivel de evidencia A1]
- La mediana de supervivencia para el grupo de terapia combinada fue del 72,2 versus 59,3 meses para el grupo de monoterapia (P = 0,21).
- En un segundo ensayo preoperatorio se asignó al azar a 109 pacientes con 1 a 3 metástasis hepáticas colorrectales potencialmente resecables a no recibir tratamiento adicional o recibir floxuridina arterial hepática posoperatoria y 5-FU sistémico.[46] De los pacientes asignados al azar, el 27 % se consideraron no aptos en el momento de la cirugía, lo que dejó solo 75 pacientes evaluables para la recidiva y la supervivencia.
- Si bien disminuyó la recidiva hepática del cáncer, la mediana de supervivencia a 4 años no fue significativamente diferente entre los grupos de pacientes.
Se necesitan más estudios para evaluar este abordaje de tratamiento y determinar si una quimioterapia sistémica combinada más eficaz por sí sola proporcionaría resultados similares a la terapia intraarterial hepática combinada con tratamiento sistémico.
En varios estudios se observó un aumento de los efectos tóxicos locales por la terapia de infusión hepática, entre ellas, alteración del funcionamiento hepático y esclerosis biliar mortal.
Opciones de tratamiento del cáncer de colon en estadio IV y recidivante
El tratamiento de los pacientes con cáncer de colon recidivante o avanzado depende del sitio de la enfermedad.
Cirugía
Para los pacientes con enfermedad recidivante local, metastásica (solo en el hígado o solo en el pulmón), la resección quirúrgica, si es posible, es el único tratamiento potencialmente curativo.
Tratamiento sistémico
Los siguientes fármacos activos para pacientes con cáncer colorrectal metastásico se usan solos o combinados con otros fármacos:
- 5-fluorouracilo.
- Capecitabina.
- Irinotecán.
- Oxaliplatino.
- Bevacizumab.
- FOLFOXIRI (irinotecán, oxaliplatino, leucovorina y 5-fluorouracilo).
- Cetuximab.
- Ziv-aflibercept.
- Ramucirumab.
- Panitumumab.
- Anticuerpo contra el receptor del factor de crecimiento epidérmico versus un anticuerpo contra el factor de crecimiento endotelial vascular con quimioterapia de primera línea.
- Trifluridina y tipiracilo.
- Regorafenib.
- Fruquintinib.
- Encorafenib con cetuximab para pacientes con variantes BRAF V600E.
- Sotorasib con panitumumab para pacientes con variantes KRAS G12C.
5-fluorouracilo
Cuando el 5-fluorouracilo (5-FU) era el único fármaco quimioterapéutico activo, se realizaron ensayos en pacientes con cáncer localmente avanzado e irresecable, o con enfermedad metastásica y se observaron respuestas parciales, prolongación del tiempo transcurrido hasta la progresión (TTP) de la enfermedad,[47,48] además de mejora en la supervivencia y la calidad de vida de los pacientes que recibieron quimioterapia, en comparación con los mejores cuidados médicos de apoyo.[49-51] En varios ensayos se analizó la actividad y los efectos tóxicos de varios regímenes de 5-FU y LV utilizando diferentes dosis y programas de administración, y se observaron resultados esencialmente equivalentes con una mediana de supervivencia en el intervalo de 12 meses.[52]
Capecitabina
Antes de la llegada de la quimioterapia multifarmacológica, en dos estudios aleatorizados se demostró que la capecitabina se relacionó con una eficacia equivalente cuando se comparó con el régimen de 5-FU y LV de la Mayo Clinic.[53,54][Nivel de evidencia A1]
Irinotecán
En tres estudios aleatorizados se demostró una mejora en las tasas de respuesta, la SSP y la SG cuando se combinó irinotecán u oxaliplatino con 5-FU y LV.[55-57]
Evidencia (irinotecán):
- En un estudio intergrupal (NCCTG-N9741 [NCT00003594]) se comparó irinotecán, 5-FU y LV (IFL) con oxaliplatino, LV y 5-FU (FOLFOX4) para el tratamiento de primera línea de pacientes con cáncer colorrectal metastásico.
- Los pacientes asignados a FOLFOX-4 experimentaron una mejora de la SSP (mediana, 6,9 vs. 8,7 meses; P = 014; CRI, 0,74; IC 95 %, 0,61–0,89) y SG (15,0 vs. 19,5 meses, P = 001; CRI, 0,66; IC 95 %, 0,54–0,82) en comparación con los pacientes asignados al azar a IFL.
- Posteriormente, en dos estudios se comparó FOLFOX con FOLFIRI, y se permitió que los pacientes cruzaran al otro grupo en el momento de la progresión de la enfermedad con el tratamiento de primera línea, respectivamente.[58,59][Nivel de evidencia B1]
- La SSP y la SG fueron idénticas entre los grupos de tratamiento en ambos estudios.
- En el ensayo Bolus, Infusional, or Capecitabine with Camptosar-Celecoxib (BICC-C [NCT00094965]) se evaluaron varios regímenes diferentes a base de irinotecán en pacientes con cáncer colorrectal metastásico sin tratamiento previo, como FOLFIRI, irinotecán con bolo de 5-FU y LV (mIFL) y capecitabina e irinotecán (CAPIRI).[60][Nivel de evidencia A1]
- En el estudio se asignó al azar a 430 pacientes, pero se suspendió antes de lo previsto debido a la escasa inscripción.
- Los pacientes que recibieron FOLFIRI tuvieron una mejor SSP que los pacientes que recibieron mIFL (7,6 vs. 5,9 meses; P = 0,004) o CAPIRI (7,6 vs. 5,8 meses; P = 0,015).
- Los pacientes que recibieron CAPIRI presentaron tasas más altas de efectos de grado 3 o mayor, como náuseas, vómitos, diarrea, deshidratación o eritrodisestesia palmoplantar.
A partir de la publicación de estos estudios, el uso de FOLFOX o FOLFIRI se considera aceptable para el tratamiento de primera línea de pacientes con cáncer colorrectal metastásico.
Cuando se usa un régimen a base de irinotecán como tratamiento de primera línea del cáncer colorrectal metastásico, se prefiere FOLFIRI.[60][Nivel de evidencia B1]
Oxaliplatino
En ensayos aleatorizados de fase III se abordó la equivalencia de usar capecitabina en lugar de una infusión de 5-FU. En dos estudios de fase III, se evaluó la administración de 5-FU y oxaliplatino (FUOX) versus capecitabina y oxaliplatino (CAPOX).[61,62]
Evidencia (oxaliplatino):
- En el AIO Colorectal Study Group se asignó al azar a 474 pacientes para recibir 5-FU, LV y oxaliplatino (FUFOX) o CAPOX.
- La mediana de SSP fue de 7,1 meses para el grupo de CAPOX y de 8,0 meses para el grupo de FUFOX (CRI = 1,17; IC 95 %, 0,96–1,43; P = 0,117); el CRI se ubicó dentro del intervalo de equivalencia predeterminado.
- El Grupo de Tratamiento de los Tumores Digestivos de España asignó al azar a 348 pacientes a recibir CAPOX o FUOX.[61] [Nivel de evidencia B1]
- El TTP fue de 8,9 meses versus 9,5 meses (P = 0,153) y se ubicó dentro del intervalo de ausencia de inferioridad predeterminado.
Cuando se utiliza un régimen a base de oxaliplatino como tratamiento de primera línea para el cáncer colorrectal metastásico, el régimen CAPOX no es inferior al régimen FUOX.
Antes de la disponibilidad de cetuximab, panitumumab, bevacizumab y ziv-aflibercept como terapia de segunda línea, la quimioterapia de segunda línea con irinotecán en pacientes tratados con 5-FU y LV como terapia de primera línea demostró una mejora de la SG, en comparación con la infusión de 5-FU o los cuidados médicos de apoyo.[63-66]
Del mismo modo, en un ensayo de fase III se asignó al azar a pacientes cuya enfermedad progresó con el irinotecán combinado con 5-FU y LV para recibir un bolo y una infusión de 5-FU y LV (LV5FU2), oxaliplatino en monoterapia o FOLFOX-4. La mediana de TTP para FOLFOX-4 versus LV5FU2 fue de 4,6 versus 2,7 meses (P bilateral de la prueba del orden logarítmico estratificada < 0,001).[67][Nivel de evidencia B1]
Bevacizumab
El bevacizumab es un anticuerpo monoclonal parcialmente humanizado que se une al VEGF. Es aceptable añadir bevacizumab a FOLFIRI o FOLFOX para pacientes que reciben tratamiento de primera línea de cáncer colorrectal metastásico.
Evidencia (bevacizumab):
- Después de la aprobación del bevacizumab, se enmendó el ensayo BICC-C y se asignó al azar a otros 117 pacientes para recibir FOLFIRI con bevacizumab o mIFL con bevacizumab.
- Aunque el criterio principal de valoración de la SSP no fue significativamente diferente, los pacientes que recibieron FOLFIRI y bevacizumab tuvieron una SG significativamente mejor (no se había alcanzado al cabo de una mediana de seguimiento de 22,6 vs. 19,2 meses, P = 0,007).
- Los pacientes con cáncer colorrectal metastásico sin tratamiento previo se asignaron al azar a IFL o IFL con bevacizumab.[68][Nivel de evidencia A1]
- Los pacientes asignados al azar a IFL con bevacizumab presentaron una SSP significativamente mejor (10,6 meses en el grupo de IFL con bevacizumab, en comparación con 6,2 meses en el grupo de IFL con placebo; CRIprogresión de la enfermedad, 0,54; P < 0,001) y SG (20,3 meses en el grupo de IFL con bevacizumab, en comparación con 15,6 meses en el grupo de IFL con placebo; CRImuerte, 0,66; P < 0,001).[68]
- A pesar de la ausencia de datos directos, en la práctica habitual se añadió bevacizumab a FOLFOX como régimen estándar de primera línea a partir de los resultados del ensayo NCCTG-N9741.[69] Posteriormente, en un estudio aleatorizado de fase III, los pacientes con cáncer colorrectal en estadio IV no tratados se asignaron al azar en un diseño factorial de 2 x 2 a recibir CAPOX versus FOLFOX-4 y luego a bevacizumab versus placebo. La SSP fue el criterio principal de valoración.
- En este ensayo, se asignó al azar a 1401 pacientes y la mediana de SSP fue de 9,4 meses para los pacientes que recibieron bevacizumab y de 8,0 meses para los pacientes que recibieron placebo (CRI, 0,83; IC 97,5 %, 0,72–0,95; P = 0,0023).[70][Nivel de evidencia B1]
- La mediana de SG fue de 21,3 meses para los pacientes que recibieron bevacizumab y de 19,9 meses para los pacientes que recibieron placebo (CRI, 0,89; IC 97,5 %, 0,76–1,03; P = 0,077).
- La mediana de SSP (análisis por intención de tratar) fue de 8,0 meses en los grupos que contenían CAPOX versus 8,5 meses en los grupos que contenían FOLFOX-4 (CRI, 1,04; IC 97,5 %, 0,93–1,16), con el límite superior del IC 97,5 % por debajo del margen predefinido de ausencia inferioridad de 1,23.[70,71]
- Es probable que el efecto del bevacizumab en la SG sea menor que el observado en el estudio original de Hurwitz.[68]
- Los investigadores del Eastern Cooperative Oncology Group asignaron al azar a pacientes cuya enfermedad progresó con el uso de 5-FU, leucovorina e irinotecán, para recibir FOLFOX o FOLFOX con bevacizumab.
- Los pacientes asignados al azar a FOLFOX con bevacizumab experimentaron una mejora estadísticamente significativa en la SSP (7,43 vs. 4,7 meses, CRI, 0,61; P < 0,0001) y la SG (12,9 vs. 10,8 meses, CRI, 0,75; P = 0,0011).[72][Nivel de evidencia A1]
A partir de estos estudios, es razonable agregar bevacizumab a FOLFIRI o FOLFOX para los pacientes que se someten a tratamiento de primera línea del cáncer colorrectal metastásico. Una duda importante fue si el uso de bevacizumab se justificaba luego de usarse como componente de una terapia de primera línea. En la reunión anual de 2012 de la American Society of Clinical Oncology (ASCO), se presentaron datos de un ensayo controlado aleatorizado.[73] En el ensayo, 820 pacientes con cáncer colorrectal metastásico, después de progresar durante la quimioterapia de primera línea que incluía bevacizumab, se asignaron al azar a quimioterapia sin bevacizumab o quimioterapia con bevacizumab. Los pacientes que recibieron bevacizumab experimentaron una mejora de la SG, en comparación con los pacientes que no recibieron bevacizumab. La mediana de SG fue de 11,2 meses para los pacientes que recibieron bevacizumab o quimioterapia y de 9,8 meses para los pacientes que recibieron quimioterapia sin bevacizumab (CRI, 0,81; IC 95 %, 0,69–0,94;P de la prueba del orden logarítmico no estratificada = 0,0062). La mediana de SG fue de 5,7 meses para los pacientes que recibieron bevacizumab o quimioterapia y de 4,1 meses para los pacientes que recibieron quimioterapia sin bevacizumab (CRI, 0,68; IC 95 %, 0,59–0,78; P de la prueba del orden logarítmico no estratificada = 0,0001). [73][Nivel de evidencia A1]
FOLFOXIRI
Evidencia (FOLFOXIRI):
- La combinación de FOLFOXIRI y bevacizumab se comparó con FOLFIRI y bevacizumab en un estudio aleatorizado de fase III en 508 pacientes con cáncer colorrectal metastásico sin tratamiento.[74][Nivel de evidencia B1]
- La mediana de SSP fue de 12,1 meses en el grupo FOLFOXIRI, en comparación con 9,7 meses en el grupo FOLFIRI (CRI de progresión, 0,75; IC 95 %, 0,62–0,90; P = 0,003). La SG no fue significativamente diferente entre los grupos (31,0 vs 25,8 meses; CRImuerte, 0,79; IC 95 %, 0,63–1,00; P = 0,054).
- Los pacientes que recibieron FOLFOXIRI tuvieron significativamente más efectos tóxicos de grados 3 y 4, como neutropenia, estomatitis o neuropatía periférica.
Cetuximab
El cetuximab es un anticuerpo monoclonal parcialmente humanizado contra el EGFR. Debido a que el cetuximab afecta la señalización de tirosina–cinasa en la superficie de la membrana celular, los tumores con variantes activadoras de la vía descendiente del EGFR, como las variantes de KRAS, no son sensibles a sus efectos. Añadir el cetuximab a una quimioterapia multifarmacológica mejora la supervivencia en los pacientes con cáncer de colon que carecen de una variante de KRAS (es decir, KRAS natural). Cabe resaltar que los pacientes cuyos tumores expresan una alteración en KRAS quizás tengan desenlaces más precarios cuando el cetuximab se agrega a regímenes de quimioterapia multifarmacológica que contienen bevacizumab.
Evidencia (cetuximab):
- Se realizó un estudio aleatorizado de fase II con cetuximab o irinotecán y cetuximab en pacientes que presentaron progresión de la enfermedad mientras recibían regímenes que contenían irinotecán.[75][Nivel de evidencia C3]
- La mediana de TTP para los pacientes que recibieron cetuximab fue de 1,5 meses, en comparación con 4,2 meses para los pacientes que recibieron irinotecán y cetuximab.[75][Nivel de evidencia B1]
- A partir de este estudio, se aprobó el cetuximab para usarlo en pacientes con cáncer colorrectal metastásico resistente al 5-FU y al irinotecán.
- En el Crystal Study (EMR 62202-013 [NCT00154102]) se asignó al azar a 1198 pacientes con cáncer colorrectal en estadio IV a recibir FOLFIRI con cetuximab o sin este.[76][Nivel de evidencia B1]
- La adición de cetuximab se relacionó con una mejora de la SSP (CRI, 0,85; IC 95 %, 0,72–0,99; P de la prueba del orden logarítmico estratificada = 0,048), pero no con la SG.
- En estudios retrospectivos de pacientes con cáncer colorrectal metastásico, se indicó que la respuesta al tratamiento con anticuerpos contra el EGFR se limita a pacientes con tumores que albergan tipos naturales de KRAS (es decir, carecen de variantes activadoras en los codones 12 o 13 del gen KRAS).
- Se realizó un análisis de un subgrupo para evaluar la eficacia con relación al estado del gen KRAS en pacientes inscritos en el Crystal Study. Hubo una interacción significativa entre el estado de la variante de KRAS y la respuesta tumoral al tratamiento (P = 0,03), pero no para la SSP (P = 0,07). Entre los pacientes de tumores con KRAS natural, el CRI favoreció al grupo de FOLFIRI y cetuximab (CRI, 0,68; IC 95 %, 0,50–0,94).
- En un ensayo aleatorizado, los pacientes con cáncer colorrectal metastásico recibieron capecitabina, oxaliplatino y bevacizumab con cetuximab o sin este.[77][Nivel de evidencia B1]
- La mediana de SSP fue de 9,4 meses para el grupo que recibió cetuximab y de 10,7 meses para el grupo que no recibió cetuximab (P = 0,01).
- En un análisis de subconjuntos, los pacientes con tumores con variantes del gen KRAS que recibieron cetuximab presentaron una disminución significativa de la SSP, en comparación con los pacientes cuyos tumores tenían KRAS natural que recibieron cetuximab (8,1 vs. 10,5 meses; P = 0,04).
- En los pacientes que tenían tumores con alteraciones en KRAS, la SSP fue significativamente más corta que en aquellos que recibieron cetuximab que en los que no lo recibieron (8,1 vs. 12,5 meses; P = 0,003). La SG también fue significativamente más corta (17,2 vs. 24,9 meses, respectivamente; P = 0,03).
- En el ensayo del Medical Research Council (MRC) COIN (NCT00182715) se buscó determinar si la adición de cetuximab a la quimioterapia combinada con fluoropirimidina y oxaliplatino en el tratamiento de primera línea para pacientes con KRAS natural en sus tumores fue beneficiosa.[78,79] Además, el MRC trató de evaluar el efecto de la quimioterapia intermitente en comparación con la quimioterapia continua. Los 1630 pacientes se asignaron al azar a los siguientes tres grupos de tratamiento:
- Grupo A: fluoropirimidina y oxaliplatino.
- Grupo B: fluoropirimidina, oxaliplatino y cetuximab.
- Grupo C: fluoropirimidina y oxaliplatino intermitentes.
Las comparaciones entre los grupos A y B y los grupos A y C se analizaron y publicaron por separado.[78,79]
- En los pacientes cuyos tumores tenían KRAS natural (grupo A, n = 367; grupo B, n = 362), no hubo diferencias de la SG entre los grupos de tratamiento (mediana de supervivencia, 17,9 meses [intervalo intercuartílico (IIC), 10,3–29,2] en el grupo de control vs. 17 meses [IIC, 9,4–30,1] en el grupo de cetuximab; CRI, 1,04; IC 95 %, 0,87–1,23; P = 0,67). De manera similar, no hubo ningún efecto sobre la SSP (8,6 meses [IIC, 5,0–12,5] en el grupo de control versus 8,6 meses [IIC, 5,1–13,8] en el grupo de cetuximab; CRI, 0,96; IC 95 %, 0,82–1,12; P = 0,60).[78,79][Nivel de evidencia A1]
- Las razones de la ausencia de beneficio de la adición de cetuximab no son claras. En los análisis de subgrupos se indica que la capecitabina se relacionó con un desenlace inferior y que los pacientes tratados con cetuximab reciben terapia de segunda línea con menor frecuencia.
- No hubo ninguna diferencia entre los pacientes que recibieron tratamiento continuo (grupo A) o intermitente (grupo C). La mediana de supervivencia en la población por intención de tratar (n = 815 en ambos grupos) fue de 15,8 meses (IIC, 9,4–26,1) en el grupo A y 14,4 meses (IIC, 8,0–24,7) en el grupo C (CRI, 1,084; IC 80 %, 1,008–1,165). En la población por protocolo, que incluyó solo a los pacientes sin progresión a las 12 semanas que fueron asignados al azar a continuar el tratamiento o suspender por un tiempo la quimioterapia (grupo A, n = 467; grupo C, n = 511), la mediana de supervivencia fue de 19,6 meses (IIC, 13,0–28,1) en el grupo A y de 18,0 meses (IIC, 12,1–29,3) en el grupo C (CRI, 1,087, IC 95 %, 0,986–1,198).
- Los límites superiores para los IC de los CRI en ambos análisis superaron el límite predefinido de ausencia de inferioridad. Si bien no se logró determinar la ausencia de inferioridad para la quimioterapia intermitente, se encontraron diferencias clínicas insignificantes en los desenlaces de los pacientes.
- En el estudio OPUS se buscó evaluar el efecto de agregar cetuximab al tratamiento de primera línea con un régimen FOLFOX en un estudio aleatorizado multicéntrico de fase II sin enmascaramiento de pacientes con cáncer colorrectal metastásico que expresa EGFR.[80]
- En el ensayo, 344 pacientes se asignaron al azar para recibir FOLFOX-4 solo o FOLFOX-4 y cetuximab. No hubo diferencia estadísticamente significativa para la tasa de respuesta o la SSP.
- En un análisis de subgrupos, se analizó de manera separada a los pacientes que tenían tumores con KRAS natural. En la población con tumores que tenían KRAS natural, hubo mejora estadísticamente significativa en la tasa de respuesta (61 vs. 37 %; P = 0,011) y en la SSP (7,7 vs. 7,2 meses; P = 0,0163).
- En el análisis de subconjuntos, los pacientes con tumores que tenían alteraciones en KRAS que recibieron FOLFOX-4 y cetuximab presentaron una SSP más precaria y estadísticamente significativa que los pacientes que recibieron FOLFOX-4 solo (5,5 vs. 8,6 meses, P = 0,0192).[80][Nivel de evidencia B1]
Ziv-aflibercept
El ziv-aflibercept es una molécula anti-VEGF que se ha evaluado como componente del tratamiento de segunda línea para pacientes con cáncer colorrectal metastásico.
Evidencia (ziv-aflibercept):
- En un ensayo, 1226 pacientes se asignaron al azar para recibir ziv-aflibercept (4 mg/kg por vía intravenosa [IV]) o placebo cada 2 semanas en combinación con FOLFIRI.[81][Nivel de evidencia A2]
- Los pacientes que recibieron ziv-aflibercept y FOLFIRI presentaron una mejoría significativa de las tasas de SG, con medianas de supervivencia de 13,50 meses en comparación con los pacientes que recibieron placebo y FOLFIRI, quienes presentaron una mediana de supervivencia de 12,06 meses (CRI, 0,817; IC 95,34 %, 0,713–0,937; P = 0,0032).
- Los pacientes que recibieron ziv-aflibercept y FOLFIRI también mejoraron significativamente las tasas de SSP, la mediana de SSP fue de 6,90 meses en comparación con los pacientes que recibieron placebo y FOLFIRI, quienes presentaron una mediana de SSP de 4,67 meses (CRI, 0,758; IC 95 %, 0,661–0,869; P < 0,0001).
- A partir de estos resultados, se considera que ziv-aflibercept y FOLFIRI componen un régimen de segunda línea aceptable para pacientes tratados previamente con quimioterapia a base de FOLFOX. Hasta el momento no se ha evaluado en ningún ensayo clínico si se debe continuar bevacizumab o iniciar ziv-aflibercept para la terapia de segunda línea, y no hay datos disponibles.
Ramucirumab
El ramucirumab es un anticuerpo monoclonal completamente humanizado que se une al receptor 2 del factor de crecimiento endotelial vascular.
Evidencia (ramucirumab):
- En el estudio aleatorizado de fase III sin enmascaramiento RAISE (NCT01183780), 1072 pacientes con cáncer colorrectal en estadio IV que habían progresado con quimioterapia de primera línea se asignaron al azar a recibir FOLFIRI con ramucirumab o sin este (8 mg/kg).[82][Nivel de evidencia A1]
- Los pacientes asignados a FOLFIRI con ramucirumab presentaron una mejoría significativa de la mediana de SG (13,3 vs. 11,7 meses; CRI, 0,84; P = 0,0219) y SSP (5,7 vs. 4,5 meses; CRI, 0,793; P = 0,0005).
- Los efectos adversos de grado 3 fueron más comunes en el grupo de ramucirumab, incluso la neutropenia de grado 3.
- A partir de estos datos, se considera que FOLFIRI y ramucirumab componen un régimen de segunda línea aceptable en pacientes tratados previamente con FOLFOX y bevacizumab. No se ha evaluado en ningún ensayo clínico si se debe continuar bevacizumab o si se debe usar ramucirumab para la quimioterapia de segunda línea.
Panitumumab
El panitumumab es un anticuerpo totalmente humanizado contra el EGFR. La Administración de Alimentos y Medicamentos (FDA) aprobó el panitumumab para pacientes con cáncer colorrectal metastásico resistente a la quimioterapia.[83] En ensayos clínicos, el panitumumab demostró su eficacia como fármaco único o en terapia combinada, lo que fue compatible con los efectos del cetuximab sobre la SSP y la SG. Lo anterior indica un efecto de clase homogéneo.
Evidencia (panitumumab):
- En un ensayo de fase III, los pacientes con cáncer colorrectal resistente a la quimioterapia se asignaron al azar a recibir panitumumab o el mejor cuidado médico de apoyo.[83][Nivel de evidencia B1]
- Los pacientes que recibieron panitumumab experimentaron una mejora de la SSP (8 vs. 7,3 semanas; CRI, 0,54; IC 95 %, 0,44–0,66; P < 0,0001).
- No hubo diferencia en la SG: se cree que esto se debe a que el 76 % de los pacientes del grupo de cuidados médicos de apoyo se pasaron al grupo de panitumumab.
- En el estudio Panitumumab Randomized Trial in Combination With Chemotherapy for Metastatic Colorectal Cancer to Determine Efficacy (PRIME [NCT00364013]), se asignó al azar a 1183 pacientes a recibir FOLFOX-4 con panitumumab o sin este como terapia de primera línea para el cáncer colorrectal metastásico. El estudio se modificó para ampliar el tamaño de la muestra e incluir por separado los pacientes con tumores que tenían KRAS natural y KRAS con alteraciones.[84][Nivel de evidencia B1]
- En los pacientes con tumores que tenían KRAS natural y que recibieron panitumumab y FOLFOX-4 se observó una mejoría estadísticamente significativa en la SSP, en comparación con quienes recibieron FOLFOX-4 solo (CRI, 0,80; IC 95 %, 0,66–0,97; P de la prueba del orden logarítmico estratificada = 0,02).
- La mediana de SSP fue de 9,6 meses (IC 95 %, 9,2–11,1) para los pacientes que recibieron panitumumab con FOLFOX-4 y de 8,0 meses (IC 95 %, 7,5–9,3) para los pacientes que recibieron FOLFOX-4. La SG no fue significativamente diferente entre los grupos (CRI, 0,83; IC 95 %, 0,67–1,02; P = 0,072).
- En los pacientes que tenían tumores con alteraciones en KRAS, la SSP fue más precaria cuando se añadió panitumumab (CRI, 1,29; IC 95 %, 1,04–1,62; P de la prueba del orden logarítmico estratificada = 0,02,).
- La mediana de SSP fue de 7,3 meses (IC 95 %, 6,3–8,0) para panitumumab con FOLFOX-4 y de 8,8 meses (IC 95 %, 7,7–9,4) para FOLFOX-4 solo.
- Posteriormente, en un análisis retrospectivo, se evaluó a los pacientes con estado natural del exón 2 de KRAS para identificar si tenían otras variantes de KRAS o BRAF.[85][Nivel de evidencia C1].
- De los 620 pacientes cuyos tumores no tenían variantes del exón 2 de KRAS en la evaluación inicial, se encontró que 108 pacientes (17 %) tenían otras variantes de RAS y que 53 pacientes (8 %) tenían variantes de BRAF. En un análisis retrospectivo, los pacientes sin variantes de RAS ni BRAF tuvieron una SSP (10,8 vs. 9,2 meses; P = 0,002) y SG más prolongadas (28,3 vs. 20,9 meses; P = 0,02) cuando se asignaron al grupo que recibió FOLFOX-4 con panitumumab que los pacientes asignados al grupo de FOLFOX-4.
- De manera similar, la adición de panitumumab a un régimen FOLFOX con bevacizumab produjo una SSP y toxicidad más precarias, en comparación con un régimen FOLFOX con bevacizumab solo, en pacientes con cáncer de colon metastásico no seleccionados por presentar variantes de KRAS (11,4 vs. 10,0 meses, CRI, 1,27; IC 95 %, 1,06–1,52).[86][Nivel de evidencia B1]
- En otro estudio (NCT00339183), los pacientes con cáncer colorrectal metastásico que ya habían recibido un régimen de fluoropirimidina se asignaron al azar a FOLFIRI o FOLFIRI con panitumumab.[87][Nivel de evidencia B1]
- En un análisis posterior, los pacientes cuyos tumores tenían KRAS natural mostraron una ventaja estadísticamente significativa en la SSP (CRI, 0,73; IC 95 %, 0,59–0,90; P de la prueba del orden logarítmico estratificada = 0,004).
- La mediana de SSP fue de 5,9 meses (IC 95 %, 5,5–6,7) para panitumumab con FOLFOX-4 y de 3,9 meses (IC 95 %, 3,7–5,3) para FOLFOX-4 solo.
- La SG no fue significativamente diferente. Los pacientes con tumores que tenían alteraciones de KRAS no se beneficiaron de la adición de panitumumab.
- En un análisis posterior, los pacientes cuyos tumores tenían KRAS natural mostraron una ventaja estadísticamente significativa en la SSP (CRI, 0,73; IC 95 %, 0,59–0,90; P de la prueba del orden logarítmico estratificada = 0,004).
Anticuerpo contra el receptor del factor de crecimiento epidérmico versus anticuerpo contra el factor de crecimiento vascular con quimioterapia de primera línea
En la atención de los pacientes con cáncer colorrectal en estadio IV, es incierto si los pacientes con cáncer que expresan un KRAS natural deben recibir un anticuerpo anti-EGFR con quimioterapia o un anticuerpo anti-VEGF con quimioterapia. En dos estudios se trató de responder a esta pregunta.[88][[89]]
Evidencia (anticuerpo anti-EGFR vs. anticuerpo anti-VEGF con quimioterapia de primera línea)
- En el estudio FIRE-3 (NCT00433927), 592 pacientes, cuyos tumores tenían un exón 2 de KRAS natural, que no habían recibido tratamiento previo se asignaron al azar a recibir FOLFIRI y cetuximab (297 pacientes) o FOLFIRI y bevacizumab (295 pacientes). El criterio principal de valoración del estudio fue la tasa de respuesta objetiva.[88][Nivel de evidencia A1]
- La tasa de respuesta objetiva no difirió de forma significativa entre los grupos (tasa de respuesta objetiva, 62,0 %; IC 95 %, 56,2–67,5 vs. tasa de respuesta objetiva, 58,0 %; IC 95 %, 52,1–63,7; OR, 1,18; IC 95 %, 0,85–1,64; P = 0,18).
- La mediana de SSP fue de 10,0 meses (IC 95 %, 8,8–10,8) en el grupo de cetuximab y 10,3 meses (IC 95 %, 9,8–11,3) en el grupo de bevacizumab (CRI, 1,06; IC 95 %, 0,88–1,26; P = 0,55).
- La mediana de SG fue de 28,7 meses (IC 95 %, 24,0–36,6) en el grupo de cetuximab, comparada con 25,0 meses (22,7–27,6) en el grupo de bevacizumab (CRI, 0,77; IC 95 %, 0,62–0,96; P = 0,017).
- En un análisis posterior de pacientes con tumores que tenían RAS natural en quienes se evaluó la presencia de otras alteraciones genéticas (secuenciación de los puntos calientes mutacionales de KRAS y NRAS, que incluyó los codones 12 y 13 del exón 2; los codones 59 y 61 del exón 3; y los codones 117 y 146 del exón 4), se observó una mediana de SG de 33,1 meses (IC 95 %, 24,5–39,4) en el grupo de cetuximab, en comparación con 25,0 meses (IC 95 %, 23,0–28,1) en el grupo de bevacizumab (CRI, 0,70; IC 95 %, 0,54–0,90; P = 0,0059).[90]
- Cabe destacar que solo el 52 % de los pacientes asignados al grupo de bevacizumab recibieron cetuximab o panitumumab posteriormente.[91]
- El Cancer and Leukemia Group B presentó el estudio intergrupal 80405 [NCT00265850] en la reunión de la American Society of Clinical Oncology (ASCO) de 2014. En este estudio se asignó al azar a 2334 pacientes con cáncer que tenían KRAS natural y que no se habían tratado antes para recibir quimioterapia (FOLFOX o FOLFIRI) y bevacizumab o quimioterapia y cetuximab. El criterio principal de valoración fue la SG.[89][Nivel de evidencia B1]
- No hubo diferencia estadísticamente significativa en la SG entre los pacientes asignados a bevacizumab o cetuximab (las diferencias de SG fueron las siguientes, quimioterapia con bevacizumab: 29,04 [25,66–31,21] meses vs. quimioterapia con cetuximab 29,93 [27,56–31,21] meses; CRI, 0,92 [0,78, -1,09]; P = 0,34).
A partir de estos dos estudios, se concluyó que no hay una diferencia bien delimitada y significativa en iniciar el tratamiento con quimioterapia y bevacizumab o cetuximab para pacientes con cáncer colorrectal metastásico que tiene KRAS natural. Sin embargo, en pacientes con un cáncer que tiene KRAS natural, la administración de un anticuerpo anti-EGFR durante el tratamiento mejora la SG.
Trifluridina y tipiracilo
La combinación de trifluridina y tipiracilo (Lonsurf; también llamado TAS-102) constituye un medicamento de administración oral donde se mezcla un análogo de los ácidos nucleicos a base de timidina (trifluridina) con un inhibidor de la timidina–fosforilasa (clorhidrato de tipiracilo). La trifluridina, en su forma de trifosfato, inhibe la timidilato–sintasa; por lo tanto, esta forma de trifluridina tiene efecto antitumoral. El clorhidrato de tipiracilo es un inhibidor potente de la timidina–fosforilasa, que de manera activa degrada la trifluridina. La combinación de trifluridina y tipiracilo hace posible que se mantengan concentraciones plasmáticas suficientes de trifluridina.
Evidencia (trifluridina y tipiracilo):
- En un estudio con enmascaramiento doble de fase III (RECOURSE [NCT01607957]), se asignó al azar a 800 pacientes con cáncer colorrectal en estadio IV cuyo cáncer había sido resistente al tratamiento con dos terapias previas. Era necesario que los pacientes hubieran recibido 5-FU, oxaliplatino, irinotecán y bevacizumab; además, para los casos de cáncer que tenían KRAS natural, que hubieran recibido cetuximab o panitumumab. Se asignó al azar a los pacientes en una proporción de 2:1 para recibir el mejor cuidado médico de apoyo con trifluridina y tipiracilo (n = 534) o placebo (n = 266). La mediana de edad de los pacientes fue de 63 años y la mayoría de los pacientes (60–63 %) ya había recibido cuatro o más líneas de tratamiento. Todos los pacientes habían recibido antes fluoropirimidina, irinotecán, oxaliplatino y bevacizumab, y, además, el 52 % de los pacientes había recibido un inhibidor de EGFR. Alrededor del 20 % de los pacientes había recibido tratamiento previo con regorafenib.[92][Nivel de evidencia A1]
- Se administró trifluridina y tipiracilo en dosis de 35 mg/m2 2 veces al día con alimentos durante 5 días, con 2 días de descanso durante 2 semanas, seguido de un período de descanso de 14 días.
- El criterio principal de valoración del estudio fue la SG. La mediana de SG para los pacientes con cáncer colorrectal metastásico que recibieron trifluridina y tipiracilo fue de 7,1 meses, en comparación con 5,3 meses para quienes recibieron el placebo (CRI, 0,68; P < 0,0001).
- La mediana de SSP en el grupo de trifluridina y tipiracilo fue de 2 versus 1,7 meses en el grupo de placebo (CRI, 0,48; P < 0,0001).
- Los criterios secundarios de valoración fueron la SSP, la tasa de respuesta general y la tasa de control de la enfermedad.
- La tasa de respuesta general fue del 1,6 % con trifluridina y tipiracilo, que abarcó una respuesta completa en un paciente y respuestas parciales en otros pacientes. La tasa de respuesta general con el placebo fue de un 0,4 % (P = 0,29).
La FDA aprobó el uso de trifluridina y tipiracilo para el tratamiento de pacientes con cáncer colorrectal metastásico, según los resultados del ensayo RECOURSE.
Evidencia (combinación de trifluridina y tipiracilo con bevacizumab):
- En un ensayo internacional multiinstitucional de fase III (SUNLIGHT [NCT04737187]), se incluyó a 492 pacientes con cáncer colorrectal en estadio IV cuyo cáncer era resistente al tratamiento con hasta dos regímenes de quimioterapia previos. Se requirió que los pacientes hubieran recibido 5-FU, oxaliplatino, irinotecán, un anticuerpo monoclonal anti-VEGF o un anticuerpo monoclonal anti-EGFR (para pacientes con enfermedad con KRAS natural). Los pacientes se asignaron al azar en una proporción de 1:1 para recibir monoterapia con trifluridina y tipiracilo (n = 246) o trifluridina y tipiracilo combinados con bevacizumab (n = 246). La mediana de edad de los pacientes fue de 62 años para el grupo de combinación y de 64 años para el grupo de monoterapia; la mayoría de los pacientes (93 y 91 %) habían recibido dos líneas de tratamiento previas. Más del 98 % de los pacientes de ambos grupos habían recibido 5-FU, irinotecán y oxaliplatino, y más del 93 % de los pacientes con variantes naturales de RAS en ambos grupos habían recibido tratamiento con anticuerpos monoclonales anti-EGFR. La mediana de seguimiento fue de 14,2 meses. Se administró trifluridina y tipiracilo en dosis de 35 mg/m2 2 veces al día los días 1 a 5 y 8 a 12 de un ciclo de 28 días. Se administró bevacizumab los días 1 y 15 de cada ciclo en dosis de 5 mg/kg. El criterio principal de valoración del estudio fue la SG.[93]
- La mediana de SG fue de 10,8 meses para los pacientes que recibieron trifluridina y tipiracilo con bevacizumab y de 7,5 meses para los pacientes que recibieron monoterapia de trifluridina y tipiracilo (CRI, 0,61; IC 95 %, 0,49–0,77; P < 0,001).[93][Nivel de evidencia A1]
- La SG fue significativa en los subgrupos, incluso en los pacientes con variantes de RAS y variantes naturales, cánceres con inestabilidad microsatelital alta (MSI-H) o con estabilidad microsatelital (MSS), y en los pacientes tratados previamente con bevacizumab o no.
- La mediana de SSP fue de 5,6 meses en el grupo de combinación y de 2,4 meses en el grupo de monoterapia con trifluridina y tipiracilo (CRI, 0,44; IC 95 %, 0,36–0,54;P < 001).
- Los criterios secundarios de valoración se centraron en la SSP, la tasa de respuesta general y la inocuidad.
- La tasa de respuesta general fue del 6,1 % para el grupo de combinación y del 1,2 % para el grupo de monoterapia.
- Se observaron efectos adversos que llevaron a la interrupción del tratamiento en el 12,6 % de los pacientes de ambos grupos. Se observaron reducciones de la dosis en el 16,3 % de los pacientes del grupo de tratamiento combinado y en el 12,2 % de los pacientes del grupo de monoterapia con trifluridina y tipiracilo. El efecto adverso más común fue la neutropenia, y se observó neutropenia de grado 3 o 4 en el 43 % de los pacientes del grupo de combinación y en el 32 % de los pacientes del grupo de monoterapia.
La FDA aprobó la combinación de trifluridina y tipiracilo con bevacizumab para el tratamiento de pacientes con cáncer colorrectal metastásico previamente tratado con base en los resultados del ensayo SUNLIGHT.
Regorafenib
El regorafenib es un inhibidor de múltiples vías de tirosina–cinasa, incluso del VEGF. En 2012, la FDA (consultar el documento de aprobación en inglés) aprobó el regorafenib para pacientes cuya enfermedad había progresado durante tratamientos previos.
Evidencia (regorafenib):
- La inocuidad y eficacia del regorafenib se evaluó en un solo estudio clínico de 760 pacientes con cáncer colorrectal metastásico tratado antes. Los pacientes se asignaron al azar en una proporción de 2:1 a recibir regorafenib o un placebo, además de los mejores cuidados médicos de apoyo.[94,95]
- Los pacientes tratados con regorafenib presentaron una mejora estadísticamente significativa de la SG (6,4 meses en el grupo de regorafenib vs. 5,0 meses en el grupo de placebo; CRI, 0,77; IC 95 %, 0,64–0,94; P unilateral = 0,0052).
Con la mejora de la SG obtenida con la combinación de trifluridina y tipiracilo con bevacizumab ya mencionada, el regorafenib se considera ahora una opción de cuarta línea o posterior para el tratamiento de pacientes con cáncer colorrectal metastásico.
Fruquintinib
El fruquintinib es un inhibidor de los receptores VEGF 1, 2 y 3. En 2023, la FDA aprobó el fruquintinib para los adultos con cáncer colorrectal metastásico que recibieron antes quimioterapia a base de fluoropirimidina, oxaliplatino e irinotecán y una terapia anti-VEGF. Si los pacientes tenían enfermedad con RAS natural y eran aptos desde el punto de vista médico, también se requirió una terapia anti-EGFR.
Evidencia (fruquintinib):
- En el ensayo internacional, con enmascaramiento doble y controlado por placebo de fase III FRESCO-2 (NCT04322539) se incluyó a 691 pacientes con adenocarcinoma colorrectal metastásico que habían recibido terapias dirigidas y citotóxicas aprobadas estándar. Los pacientes tuvieron progresión de la enfermedad durante el tratamiento con trifluridina-tipiracilo, regorafenib o ambos, o presentaron intolerancia a dichos fármacos. Los pacientes habían recibido una mediana de cuatro líneas de terapia sistémica anterior. Los pacientes se asignaron al azar en una proporción 2:1 para recibir uno de los siguientes regímenes:
- Fruquintinib (5 mg por vía oral una vez al día en los días 1–21 de un ciclo de 28 días).
- Placebo (por vía oral una vez al día en los días 1–21 de un ciclo de 28 días).
Todos los pacientes recibieron cuidados de apoyo. De los pacientes, 461 recibieron fruquintinib y 230 recibieron placebo. El criterio principal de valoración fue la SG.[96] Los resultados fueron los siguientes:
- La mediana de SG fue significativamente más prolongada en el grupo de fruquintinib (7,4 meses; IC 95 %, 6,7–8,2) que en el grupo de placebo (4,8 meses; IC 95 %, 4,0–5,8) (CRI, 0,66; IC 95 %, 0,55–0,80; P < 0,0001).[96][Nivel de evidencia A1]
- La mediana de SSP fue de 3,7 meses (IC 95 %, 3,5–3,8) en el grupo de fruquintinib y 1,8 meses (IC 95 %, 1,8–1,9) en el grupo de placebo (CRI, 0,26; IC 95 %, 0,21–0,34; P < 0,001).
- En los análisis de subgrupos se demostró el beneficio del fruquintinib vs. el placebo en la mayoría de los subgrupos. De manera notable, este beneficio se observó en pacientes con variantes de RAS y enfermedad con RAS natural, pacientes con metástasis de hígado y pacientes que recibieron tratamiento previo con trifluridina-tipiracilo con regorafenib o sin este.
- La tasa de control de la enfermedad fue significativamente más prolongada en el grupo de fruquintinib (56 %) que en el grupo de placebo (16 %), con una diferencia ajustada del 39 % (IC 95 %, 32,8–46,0 %; P < 0,0001).
- Se produjeron eventos adversos de grado 3 o superior en el 65 % de los pacientes en el grupo de fruquintinib. Los eventos adversos más comunes fueron hipertensión (14 %), astenia (8 %), función hepática anormal (8 %), toxicidad dermatológica (7 %) y eritrodisestesia palmoplantar (6 %). Se produjeron eventos adversos de grado 3 o superior en el 50 % de pacientes en el grupo de placebo. Los más comunes fueron función hepática anormal (9 %), infección (6 %) y astenia (4 %).
Encorafenib y cetuximab para pacientes con variantes BRAF V600E
Las variantes BRAF V600E se presentan en cerca del 10 % de los cánceres colorrectales metastásicos y son un indicador de pronóstico precario. A diferencia del melanoma, la monoterapia con un inhibidor de BRAF no ha mostrado ningún beneficio en el cáncer colorrectal y en múltiples estudios se evaluó la administración simultánea de un tratamiento dirigido a la vía EGFR-MAPK.
Evidencia (encorafenib y cetuximab para pacientes con variantes BRAF V600E):
- Encorafenib (inhibidor de BRAF), binimetinib (inhibidor de MEK) y cetuximab (inhibidor de EGFR): En el ensayo internacional, aleatorizado y sin enmascaramiento de fase III BEACON, se inscribieron pacientes con cáncer colorrectal metastásico y variantes BRAF V600E que habían recibido uno o dos regímenes de tratamiento.[97] En el ensayo se asignó al azar a 665 pacientes en una proporción de 1:1:1 para recibir uno de los siguientes tratamientos:Los criterios principales de valoración fueron la SG y la respuesta objetiva en el grupo de tratamiento triple, en comparación con el grupo de control.
- Tratamiento triple: encorafenib (300 mg VO cada día), binimetinib (45 mg VO 2 veces al día) y cetuximab (dosis de carga IV de 400 mg/m2 seguida de 250 mg/m2 IV cada semana) (n = 224).
- Terapia doble: encorafenib y cetuximab (según la dosis de tratamiento triple) (n = 220).
- Grupo de control: FOLFIRI o irinotecán (cada 2 semanas) con cetuximab (dosis de carga de 400 mg/m2 IV seguida de 250 mg/m2 IV semanal) (n = 221).
Los datos actualizados se presentaron en forma de resumen en 2020:[98]- La SG fue de 9,0 meses en el grupo de tratamiento triple y de 5,4 meses en el grupo de control (CRI, 0,52; IC 95 %, 0,39–0,70, P < 0,0001).[97][Nivel de evidencia A1]
- Los efectos secundarios de grado 3 o más alto se presentaron en el 58 % de los pacientes del grupo de tratamiento triple; el 10 % presentó diarrea y el 11 % presentó anemia. Se produjeron efectos secundarios de grado 3 o más en el 50 % de los pacientes del grupo de tratamiento doble y en el 61 % de los pacientes del grupo de control. El 14 % de los pacientes que recibieron el régimen doble presentaron nevos melanocíticos.
- La mediana de SG fue de 9,3 meses en los grupos de tratamiento doble y triple, y de 5,9 meses en el grupo de control (CRI, 0,60 para el tratamiento triple vs. control; IC 95 %, 0,47–0,75; CRI, 0,61 para el tratamiento doble vs. control; IC 95 %, 0,48–0,77).
- La tasa de respuesta objetiva fue del 26,8 % para los pacientes que recibieron tratamiento triple (IC 95 %, 21,1–33,1 %) y del 19,5 % para los pacientes que recibieron tratamiento doble (IC 95 %, 14,5–25,4 %).
A partir de estos datos, la FDA aprobó en 2020 la combinación de encorafenib y cetuximab para pacientes con cáncer de colon metastásico y variantes BRAF V600E.
Sotorasib con panitumumab para pacientes con variantes KRAS G12C
Cerca de un 4 % de los pacientes con cáncer colorrectal presentan variantes KRAS G12C que se relacionan con un pronóstico precario.[99-102] El sotorasib y el adagrasib son 2 de los primeros inhibidores específicos de KRAS G12C que demostraron beneficio para los pacientes con cánceres que tienen alteraciones en KRAS G12C.[103,104] Dado que la reactivación de EGFR es un mecanismo de resistencia de la inhibición en KRAS G12C bien definido, se combinó el sotorasib con panitumumab, un anticuerpo anti-EGFR, para tratar a pacientes con cáncer colorrectal y variantes KRAS G12C.
- En el ensayo multicéntrico sin enmascaramiento de fase III, CodeBreaK 300 (NCT05198934), se incluyó a pacientes con cáncer colorrectal metastásico y variantes KRAS G12C que habían recibido tratamiento previo con una fluoropirimidina, oxaliplatino e irinotecán.[103] En el estudio se asignaron al azar 160 pacientes en una proporción 1:1:1 a recibir uno de los siguientes tratamientos:
- Tratamiento doble con sotorasib 960 mg una vez al día y panitumumab (6 mg/kg IV cada 2 semanas) (n = 53).
- Tratamiento doble con sotorasib 240 mg una vez al día y panitumumab (6 mg/kg IV cada 2 semanas) (n = 53).
- El tratamiento de referencia que eligiera el investigador con trifluridina-tipiracilo (35 mg/m2) o regorafenib (160 mg una vez al día) (grupo de control).
El criterio principal de valoración fue la SSP evaluada mediante una revisión central independiente con enmascaramiento de acuerdo con RECIST 1.1. Los criterios secundarios de valoración incluyeron la SG y la tasa de respuesta objetiva.
- La mediana de SSP fue de 5,6 meses (IC 95 %, 4,2–6,3) en el grupo de 960 mg de sotorasib y panitumumab, de 3,9 meses (IC 95 %, 3,7–5,8) en el grupo de 240 mg de sotorasib y panitumumab y de 2,2 meses (IC 95 %, 1,9–3,9) en el grupo de tratamiento de referencia.[103][Nivel de evidencia B1]
- El CRI de progresión de la enfermedad o muerte fue 0,49 (IC 95 %, 0,3–0,8; P = 0,006) en el grupo de 960 mg de sotorasib y panitumumab y 0,58 (IC 95 %, 0,36–0,98; P = 0,03) en el grupo de 240 mg de sotorasib y panitumumab.
- La tasa de respuesta objetiva fue del 26,4 % (IC 95 %, 15,3–40,3 %) en el grupo de 960 mg de sotorasib y panitumumab, del 5,7 % (IC 95 %, 1,2–15,7 %) en el grupo de 240 mg de sotorasib y panitumumab y del 0 % (IC 95 %, 0,0–6,6 %) en el grupo de tratamiento de referencia. Los datos para la SG todavía no están disponibles. Sin embargo, en la fecha límite de los datos los CRI fueron 0,77 (IC 95 %, 0,4–1,45) en el grupo de 960 mg de sotorasib y panitumumab y 0,91 (IC 95 %, 0,48–1,71) en el grupo de 240 mg de sotorasib y panitumumab cuando se compararon con el tratamiento de referencia.
- Se presentaron efectos secundarios de grado 3 o más en el 35,8 % de los pacientes que recibieron 960 mg de sotorasib y panitumumab, el 30,2 % de los pacientes que recibieron 240 mg de sotorasib y panitumumab y el 43,1 % de los pacientes que recibieron tratamiento de referencia. Los efectos adversos más comunes del tratamiento combinado de sotorasib con panitumumab fueron efectos tóxicos cutáneos e hipomagnesemia.
Inmunoterapia
Cerca del 4 % de los pacientes con cáncer colorrectal en estadio IV tienen tumores con deficiencia en la reparación de errores de emparejamiento (dMMR), tumores con microsatélites inestables o inestabilidad microsatelital alta (MSI-H). El fenotipo MSI-H se relaciona con alteraciones de la línea germinal en los genes MLH1, MSH2, MSH6 y PMS2, y es el fenotipo primario observado en los tumores de pacientes con cáncer colorrectal hereditario sin poliposis (HNPCC) o síndrome de Lynch. También es posible que los pacientes expresen el fenotipo MSI-H debido al silenciamiento de uno de los genes por un proceso llamado metilación del DNA. La evaluación de la inestabilidad microsatelital se realiza mediante pruebas genéticas moleculares que determinan la inestabilidad microsatelital en el tejido tumoral o mediante análisis inmunohistoquímico que detecta la ausencia de proteínas de reparación de errores de emparejamiento. Históricamente, el estado de MSI-H ha sido pronóstico de un aumento de la supervivencia en los pacientes con enfermedad en estadio más temprano y, desde 2015, también se ha encontrado que predice la respuesta tumoral a la inhibición de puntos de control.
En 2020, la FDA aprobó el pembrolizumab, en pacientes con cáncer colorrectal metastásico dMMR/MSI-H metastásico que no han recibido tratamiento. Están en curso estudios sobre el tratamiento de primera línea con inhibidores de puntos de control dobles. La FDA aprobó en 2017 el uso de los anticuerpos anti-proteína de muerte programada 1 (PD-1) pembrolizumab y nivolumab para el tratamiento de pacientes que tienen tumores con microsatélites inestables que habían recibido tratamiento con 5-FU, oxaliplatino e irinotecán. En 2018, la FDA otorgó la aprobación acelerada para la combinación de nivolumab e ipilimumab (un inhibidor de CTLA-4) para tratar los cánceres colorrectales con MSI-H que progresaron durante el tratamiento previo con 5-FU, oxaliplatino e irinotecán.
Inmunoterapia de primera línea
Pembrolizumab en monoterapia
Evidencia (pembrolizumab en monoterapia):
- En el ensayo aleatorizado internacional de fase III KEYNOTE-177 (NCT02563002), 307 pacientes con cáncer colorrectal metastásico con MSI-H o dMMR que no habían recibido tratamiento, se asignaron al azar en una proporción de 1:1 a recibir pembrolizumab (200 mg cada 3 semanas) o quimioterapia (FOLFIRI o FOLFOX-6 modificado con bevacizumab o cetuximab o sin este).[105]
- La mediana de SSP fue de 16,5 meses para los pacientes que recibieron pembrolizumab y de 8,2 meses para los pacientes que recibieron quimioterapia (CRI, 0,60; IC 95 %, 0,45–0,80; P = 0,0002).[105][Nivel de evidencia A3]
- La SSP en subgrupos predeterminados mostró CRI que favorecieron al grupo de pembrolizumab, excepto en pacientes con variantes de KRAS o NRAS.
- La tasa de respuesta objetiva fue del 43,8 % en el grupo de pembrolizumab y del 33,3 % en el grupo de quimioterapia. La mediana de duración de la respuesta no se alcanzó en el grupo de pembrolizumab (intervalo, 2,3–41,4 meses) y fue de 10,6 meses en el grupo de quimioterapia (intervalo, 2,8–37,5 meses).
- Se presentaron efectos adversos de grado 3 o más en el 56 % de los pacientes que recibieron pembrolizumab (9 % presentaron efectos adversos relacionados con la infusión de grado 3 o más), en comparación con el 78 % de los pacientes que recibieron quimioterapia.
- En una revisión final de la SG, presentada como resumen, se observó que la mediana de SG no se alcanzó en el grupo de pembrolizumab y que fue de 36,7 meses en el grupo de quimioterapia (CRI, 0,74; IC 95 %, 0,53–1,03; P = 0,0359).[106]
Nivolumab e ipilimumab
Evidencia (nivolumab e ipilimumab):
- En una cohorte de un solo grupo del estudio multicéntrico de fase II CheckMate-142 (NCT02060188), que se presentó en forma de resumen, 45 pacientes con cáncer colorrectal metastásico con MSI-H o dMMR y que no habían recibido tratamiento previo, recibieron nivolumab (3 mg/kg cada 2 semanas) con ipilimumab (1 mg/kg cada 6 semanas). El criterio principal de valoración fue la tasa de respuesta objetiva.[107]
- La tasa de respuesta objetiva fue del 69 % en todos los pacientes inscritos y del 80 % en los pacientes con variantes KRAS (n = 10).[107][Nivel de evidencia C2]
- En un seguimiento clínico de 2 años, no se alcanzó la mediana de SSP ni de SG.
- En el ensayo CheckMate 8HW (NCT04008030), publicado en forma de resumen, se asignó al azar a 303 pacientes que habían recibido varias líneas de tratamiento a recibir nivolumab e ipilimumab (n = 202) o quimioterapia sola (n = 101). Algunos pacientes también se asignaron de forma aleatoria a recibir nivolumab, pero los resultados de estos pacientes no se presentaron en el resumen. Los tratamientos se continuaron hasta la progresión de la enfermedad o efectos tóxicos inaceptables (todos los grupos), o hasta 2 años (grupo de nivolumab-ipilimumab). Se confirmó de forma centralizada que un total de 171 pacientes que recibieron nivolumab e ipilimumab, así como 84 pacientes que recibieron quimioterapia sola, presentaban cáncer colorrectal metastásico dMMR/MSI-H.[108]
- Al cabo de una mediana de seguimiento de 31,5 meses, la SSP fue superior en los pacientes que recibieron nivolumab e ipilimumab, en comparación con los que recibieron quimioterapia sola (CRI, 0,21; IC 97,91 %, 0,13–0,35; P < 0,0001). Cabe destacar que, en el grupo de quimioterapia, el 67 % de los pacientes recibió inmunoterapia posterior.
- Se produjeron 2 muertes de grado 5 en el grupo de nivolumab-ipilimumab. También tuvieron lugar eventos de grado 3 a 4 en el 23 % de los pacientes del grupo de nivolumab-ipilimumab y en el 48 % de los pacientes del grupo de quimioterapia sola.
Inmunoterapia de segunda línea
Pembrolizumab en monoterapia
Evidencia (pembrolizumab en monoterapia):
- La aprobación de la FDA de la monoterapia con pembrolizumab se basó en datos de 149 pacientes con cánceres que tenían MSI-H o dMMR inscritos en 5 ensayos clínicos no controlados, multicéntricos, de varias cohortes o de grupo único. De los pacientes, 90 tenía cáncer colorrectal y 59 tenían un diagnóstico de 1 de 14 tipos de cáncer diferentes al colorrectal. Los pacientes recibieron 200 mg de pembrolizumab cada 3 semanas o 10 mg/kg de pembrolizumab cada 2 semanas. El tratamiento se continuó hasta que se presentó algún efecto tóxico inaceptable o progresión de la enfermedad. Las medidas principales de eficacia fueron la tasa de respuesta objetiva, evaluada mediante revisión enmascarada y centralizada por radiólogos independientes, de acuerdo con los Response Evaluation Criteria in Solid Tumors (RECIST) 1.1 y la duración de la respuesta.
- La tasa de respuesta objetiva fue del 39,6 % (IC 95 %, 31,7–47,9 %).
- Las respuestas duraron 6 meses o más para el 78 % de quienes respondieron al pembrolizumab. Hubo 11 respuestas completas y 48 respuestas parciales.
- La tasa de respuesta objetiva fue similar para los pacientes con diagnóstico de cáncer colorrectal (36 %) y aquellos con diagnóstico de otro tipo de cáncer (46 % para los otros 14 tipos de cáncer).
Monoterapia con nivolumab
Evidencia (monoterapia con nivolumab):
- En el ensayo CheckMate-142 (NCT02060188), 74 pacientes con cáncer colorrectal con dMMR o MSI-H previamente tratados se inscribieron en un estudio sin enmascaramiento de fase II de un solo grupo para recibir nivolumab (3 mg/kg cada 2 semanas). El criterio principal de valoración fue la respuesta objetiva según los criterios RECIST 1.1.[109]
- La tasa de respuesta objetiva fue del 31,1 % (IC 95 %, 20,8–42,9 %).
- Se presentaron efectos adversos relacionados con el tratamiento de grado 3 a 4 en el 21 % de los pacientes.
Nivolumab e ipilimumab
Evidencia (nivolumab e ipilimumab):
- CheckMate-142 (NCT02060188) fue un ensayo multicéntrico, sin enmascaramiento, de fase II con una cohorte pacientes con cáncer colorrectal recidivante o metastásico con dMMR o MSI-H que presentaron enfermedad progresiva o intolerancia al tratamiento con, por lo menos, una línea de quimioterapia (incluso 5-FU y oxaliplatino o irinotecán), o que habían declinado el tratamiento. En el ensayo participaron 119 pacientes, que recibieron 4 dosis de nivolumab (3 mg/kg) e ipilimumab (1 mg/kg) cada 3 semanas (inducción), y luego nivolumab (3 mg/kg IV) cada 2 semanas (mantenimiento). El criterio principal de valoración fue la tasa de respuesta objetiva.[109]
- La tasa de respuesta objetiva fue del 55 % (IC 95 %, 45,2–63,8 %).
- Entre los pacientes que experimentaron alguna respuesta, el 83 % presentaron respuestas que duraron más de 6 meses.
- Se presentaron efectos adversos relacionados con el tratamiento de grado 3 a 4 en el 32 % de los pacientes.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Serafini AN, Klein JL, Wolff BG, et al.: Radioimmunoscintigraphy of recurrent, metastatic, or occult colorectal cancer with technetium 99m-labeled totally human monoclonal antibody 88BV59: results of pivotal, phase III multicenter studies. J Clin Oncol 16 (5): 1777-87, 1998. [PUBMED Abstract]
- Wagman LD, Kemeny MM, Leong L, et al.: A prospective, randomized evaluation of the treatment of colorectal cancer metastatic to the liver. J Clin Oncol 8 (11): 1885-93, 1990. [PUBMED Abstract]
- Scheele J, Stangl R, Altendorf-Hofmann A: Hepatic metastases from colorectal carcinoma: impact of surgical resection on the natural history. Br J Surg 77 (11): 1241-6, 1990. [PUBMED Abstract]
- Scheele J, Stangl R, Altendorf-Hofmann A, et al.: Indicators of prognosis after hepatic resection for colorectal secondaries. Surgery 110 (1): 13-29, 1991. [PUBMED Abstract]
- Adson MA, van Heerden JA, Adson MH, et al.: Resection of hepatic metastases from colorectal cancer. Arch Surg 119 (6): 647-51, 1984. [PUBMED Abstract]
- Coppa GF, Eng K, Ranson JH, et al.: Hepatic resection for metastatic colon and rectal cancer. An evaluation of preoperative and postoperative factors. Ann Surg 202 (2): 203-8, 1985. [PUBMED Abstract]
- Gayowski TJ, Iwatsuki S, Madariaga JR, et al.: Experience in hepatic resection for metastatic colorectal cancer: analysis of clinical and pathologic risk factors. Surgery 116 (4): 703-10; discussion 710-1, 1994. [PUBMED Abstract]
- Fernández-Trigo V, Shamsa F, Sugarbaker PH: Repeat liver resections from colorectal metastasis. Repeat Hepatic Metastases Registry. Surgery 117 (3): 296-304, 1995. [PUBMED Abstract]
- Jaeck D, Bachellier P, Guiguet M, et al.: Long-term survival following resection of colorectal hepatic metastases. Association Française de Chirurgie. Br J Surg 84 (7): 977-80, 1997. [PUBMED Abstract]
- Taylor M, Forster J, Langer B, et al.: A study of prognostic factors for hepatic resection for colorectal metastases. Am J Surg 173 (6): 467-71, 1997. [PUBMED Abstract]
- Elias D, Cavalcanti A, Sabourin JC, et al.: Resection of liver metastases from colorectal cancer: the real impact of the surgical margin. Eur J Surg Oncol 24 (3): 174-9, 1998. [PUBMED Abstract]
- Girard P, Ducreux M, Baldeyrou P, et al.: Surgery for lung metastases from colorectal cancer: analysis of prognostic factors. J Clin Oncol 14 (7): 2047-53, 1996. [PUBMED Abstract]
- Hughes KS, Simon R, Songhorabodi S, et al.: Resection of the liver for colorectal carcinoma metastases: a multi-institutional study of patterns of recurrence. Surgery 100 (2): 278-84, 1986. [PUBMED Abstract]
- Schlag P, Hohenberger P, Herfarth C: Resection of liver metastases in colorectal cancer--competitive analysis of treatment results in synchronous versus metachronous metastases. Eur J Surg Oncol 16 (4): 360-5, 1990. [PUBMED Abstract]
- Rosen CB, Nagorney DM, Taswell HF, et al.: Perioperative blood transfusion and determinants of survival after liver resection for metastatic colorectal carcinoma. Ann Surg 216 (4): 493-504; discussion 504-5, 1992. [PUBMED Abstract]
- Fong Y, Fortner J, Sun RL, et al.: Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg 230 (3): 309-18; discussion 318-21, 1999. [PUBMED Abstract]
- Leonard GD, Brenner B, Kemeny NE: Neoadjuvant chemotherapy before liver resection for patients with unresectable liver metastases from colorectal carcinoma. J Clin Oncol 23 (9): 2038-48, 2005. [PUBMED Abstract]
- Hernandez-Alejandro R, Ruffolo LI, Sasaki K, et al.: Recipient and Donor Outcomes After Living-Donor Liver Transplant for Unresectable Colorectal Liver Metastases. JAMA Surg 157 (6): 524-530, 2022. [PUBMED Abstract]
- Adam R, Piedvache C, Chiche L, et al.: Chemotherapy and liver transplantation versus chemotherapy alone in patients with definitively unresectable colorectal liver metastases: A prospective multicentric randomized trial (TRANSMET). [Abstract] J Clin Oncol 46 (Suppl 16): A-3500, 2024.
- Rossi S, Buscarini E, Garbagnati F, et al.: Percutaneous treatment of small hepatic tumors by an expandable RF needle electrode. AJR Am J Roentgenol 170 (4): 1015-22, 1998. [PUBMED Abstract]
- Solbiati L, Livraghi T, Goldberg SN, et al.: Percutaneous radio-frequency ablation of hepatic metastases from colorectal cancer: long-term results in 117 patients. Radiology 221 (1): 159-66, 2001. [PUBMED Abstract]
- Lencioni R, Goletti O, Armillotta N, et al.: Radio-frequency thermal ablation of liver metastases with a cooled-tip electrode needle: results of a pilot clinical trial. Eur Radiol 8 (7): 1205-11, 1998. [PUBMED Abstract]
- Curley SA, Izzo F, Delrio P, et al.: Radiofrequency ablation of unresectable primary and metastatic hepatic malignancies: results in 123 patients. Ann Surg 230 (1): 1-8, 1999. [PUBMED Abstract]
- Oshowo A, Gillams A, Harrison E, et al.: Comparison of resection and radiofrequency ablation for treatment of solitary colorectal liver metastases. Br J Surg 90 (10): 1240-3, 2003. [PUBMED Abstract]
- Livraghi T, Solbiati L, Meloni F, et al.: Percutaneous radiofrequency ablation of liver metastases in potential candidates for resection: the "test-of-time approach". Cancer 97 (12): 3027-35, 2003. [PUBMED Abstract]
- Pawlik TM, Izzo F, Cohen DS, et al.: Combined resection and radiofrequency ablation for advanced hepatic malignancies: results in 172 patients. Ann Surg Oncol 10 (9): 1059-69, 2003. [PUBMED Abstract]
- Jarnagin WR, Fong Y, Ky A, et al.: Liver resection for metastatic colorectal cancer: assessing the risk of occult irresectable disease. J Am Coll Surg 188 (1): 33-42, 1999. [PUBMED Abstract]
- Ravikumar TS, Kaleya R, Kishinevsky A: Surgical ablative therapy of liver tumors. Cancer: Principles and Practice of Oncology Updates 14 (3): 1-12, 2000.
- Seifert JK, Morris DL: Prognostic factors after cryotherapy for hepatic metastases from colorectal cancer. Ann Surg 228 (2): 201-8, 1998. [PUBMED Abstract]
- Bageacu S, Kaczmarek D, Lacroix M, et al.: Cryosurgery for resectable and unresectable hepatic metastases from colorectal cancer. Eur J Surg Oncol 33 (5): 590-6, 2007. [PUBMED Abstract]
- Thomas DS, Nauta RJ, Rodgers JE, et al.: Intraoperative high-dose rate interstitial irradiation of hepatic metastases from colorectal carcinoma. Results of a phase I-II trial. Cancer 71 (6): 1977-81, 1993. [PUBMED Abstract]
- Ravikumar TS: Interstitial therapies for liver tumors. Surg Oncol Clin N Am 5 (2): 365-77, 1996. [PUBMED Abstract]
- McAfee MK, Allen MS, Trastek VF, et al.: Colorectal lung metastases: results of surgical excision. Ann Thorac Surg 53 (5): 780-5; discussion 785-6, 1992. [PUBMED Abstract]
- Headrick JR, Miller DL, Nagorney DM, et al.: Surgical treatment of hepatic and pulmonary metastases from colon cancer. Ann Thorac Surg 71 (3): 975-9; discussion 979-80, 2001. [PUBMED Abstract]
- Portier G, Elias D, Bouche O, et al.: Multicenter randomized trial of adjuvant fluorouracil and folinic acid compared with surgery alone after resection of colorectal liver metastases: FFCD ACHBTH AURC 9002 trial. J Clin Oncol 24 (31): 4976-82, 2006. [PUBMED Abstract]
- Mitry E, Fields AL, Bleiberg H, et al.: Adjuvant chemotherapy after potentially curative resection of metastases from colorectal cancer: a pooled analysis of two randomized trials. J Clin Oncol 26 (30): 4906-11, 2008. [PUBMED Abstract]
- Ychou M, Hohenberger W, Thezenas S, et al.: A randomized phase III study comparing adjuvant 5-fluorouracil/folinic acid with FOLFIRI in patients following complete resection of liver metastases from colorectal cancer. Ann Oncol 20 (12): 1964-70, 2009. [PUBMED Abstract]
- Nordlinger B, Sorbye H, Glimelius B, et al.: Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial. Lancet 371 (9617): 1007-16, 2008. [PUBMED Abstract]
- Kemeny N, Daly J, Reichman B, et al.: Intrahepatic or systemic infusion of fluorodeoxyuridine in patients with liver metastases from colorectal carcinoma. A randomized trial. Ann Intern Med 107 (4): 459-65, 1987. [PUBMED Abstract]
- Chang AE, Schneider PD, Sugarbaker PH, et al.: A prospective randomized trial of regional versus systemic continuous 5-fluorodeoxyuridine chemotherapy in the treatment of colorectal liver metastases. Ann Surg 206 (6): 685-93, 1987. [PUBMED Abstract]
- Rougier P, Laplanche A, Huguier M, et al.: Hepatic arterial infusion of floxuridine in patients with liver metastases from colorectal carcinoma: long-term results of a prospective randomized trial. J Clin Oncol 10 (7): 1112-8, 1992. [PUBMED Abstract]
- Kemeny N, Cohen A, Seiter K, et al.: Randomized trial of hepatic arterial floxuridine, mitomycin, and carmustine versus floxuridine alone in previously treated patients with liver metastases from colorectal cancer. J Clin Oncol 11 (2): 330-5, 1993. [PUBMED Abstract]
- Reappraisal of hepatic arterial infusion in the treatment of nonresectable liver metastases from colorectal cancer. Meta-Analysis Group in Cancer. J Natl Cancer Inst 88 (5): 252-8, 1996. [PUBMED Abstract]
- Mocellin S, Pilati P, Lise M, et al.: Meta-analysis of hepatic arterial infusion for unresectable liver metastases from colorectal cancer: the end of an era? J Clin Oncol 25 (35): 5649-54, 2007. [PUBMED Abstract]
- Kemeny N, Huang Y, Cohen AM, et al.: Hepatic arterial infusion of chemotherapy after resection of hepatic metastases from colorectal cancer. N Engl J Med 341 (27): 2039-48, 1999. [PUBMED Abstract]
- Kemeny MM, Adak S, Gray B, et al.: Combined-modality treatment for resectable metastatic colorectal carcinoma to the liver: surgical resection of hepatic metastases in combination with continuous infusion of chemotherapy--an intergroup study. J Clin Oncol 20 (6): 1499-505, 2002. [PUBMED Abstract]
- Petrelli N, Herrera L, Rustum Y, et al.: A prospective randomized trial of 5-fluorouracil versus 5-fluorouracil and high-dose leucovorin versus 5-fluorouracil and methotrexate in previously untreated patients with advanced colorectal carcinoma. J Clin Oncol 5 (10): 1559-65, 1987. [PUBMED Abstract]
- Petrelli N, Douglass HO, Herrera L, et al.: The modulation of fluorouracil with leucovorin in metastatic colorectal carcinoma: a prospective randomized phase III trial. Gastrointestinal Tumor Study Group. J Clin Oncol 7 (10): 1419-26, 1989. [PUBMED Abstract]
- Scheithauer W, Rosen H, Kornek GV, et al.: Randomised comparison of combination chemotherapy plus supportive care with supportive care alone in patients with metastatic colorectal cancer. BMJ 306 (6880): 752-5, 1993. [PUBMED Abstract]
- Expectancy or primary chemotherapy in patients with advanced asymptomatic colorectal cancer: a randomized trial. Nordic Gastrointestinal Tumor Adjuvant Therapy Group. J Clin Oncol 10 (6): 904-11, 1992. [PUBMED Abstract]
- Buyse M, Thirion P, Carlson RW, et al.: Relation between tumour response to first-line chemotherapy and survival in advanced colorectal cancer: a meta-analysis. Meta-Analysis Group in Cancer. Lancet 356 (9227): 373-8, 2000. [PUBMED Abstract]
- Leichman CG, Fleming TR, Muggia FM, et al.: Phase II study of fluorouracil and its modulation in advanced colorectal cancer: a Southwest Oncology Group study. J Clin Oncol 13 (6): 1303-11, 1995. [PUBMED Abstract]
- Van Cutsem E, Twelves C, Cassidy J, et al.: Oral capecitabine compared with intravenous fluorouracil plus leucovorin in patients with metastatic colorectal cancer: results of a large phase III study. J Clin Oncol 19 (21): 4097-106, 2001. [PUBMED Abstract]
- Hoff PM, Ansari R, Batist G, et al.: Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer: results of a randomized phase III study. J Clin Oncol 19 (8): 2282-92, 2001. [PUBMED Abstract]
- Saltz LB, Cox JV, Blanke C, et al.: Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. Irinotecan Study Group. N Engl J Med 343 (13): 905-14, 2000. [PUBMED Abstract]
- de Gramont A, Figer A, Seymour M, et al.: Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J Clin Oncol 18 (16): 2938-47, 2000. [PUBMED Abstract]
- Douillard JY, Cunningham D, Roth AD, et al.: Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicentre randomised trial. Lancet 355 (9209): 1041-7, 2000. [PUBMED Abstract]
- Tournigand C, André T, Achille E, et al.: FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol 22 (2): 229-37, 2004. [PUBMED Abstract]
- Colucci G, Gebbia V, Paoletti G, et al.: Phase III randomized trial of FOLFIRI versus FOLFOX4 in the treatment of advanced colorectal cancer: a multicenter study of the Gruppo Oncologico Dell'Italia Meridionale. J Clin Oncol 23 (22): 4866-75, 2005. [PUBMED Abstract]
- Fuchs CS, Marshall J, Mitchell E, et al.: Randomized, controlled trial of irinotecan plus infusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: results from the BICC-C Study. J Clin Oncol 25 (30): 4779-86, 2007. [PUBMED Abstract]
- Díaz-Rubio E, Tabernero J, Gómez-España A, et al.: Phase III study of capecitabine plus oxaliplatin compared with continuous-infusion fluorouracil plus oxaliplatin as first-line therapy in metastatic colorectal cancer: final report of the Spanish Cooperative Group for the Treatment of Digestive Tumors Trial. J Clin Oncol 25 (27): 4224-30, 2007. [PUBMED Abstract]
- Porschen R, Arkenau HT, Kubicka S, et al.: Phase III study of capecitabine plus oxaliplatin compared with fluorouracil and leucovorin plus oxaliplatin in metastatic colorectal cancer: a final report of the AIO Colorectal Study Group. J Clin Oncol 25 (27): 4217-23, 2007. [PUBMED Abstract]
- Rothenberg ML, Eckardt JR, Kuhn JG, et al.: Phase II trial of irinotecan in patients with progressive or rapidly recurrent colorectal cancer. J Clin Oncol 14 (4): 1128-35, 1996. [PUBMED Abstract]
- Conti JA, Kemeny NE, Saltz LB, et al.: Irinotecan is an active agent in untreated patients with metastatic colorectal cancer. J Clin Oncol 14 (3): 709-15, 1996. [PUBMED Abstract]
- Rougier P, Van Cutsem E, Bajetta E, et al.: Randomised trial of irinotecan versus fluorouracil by continuous infusion after fluorouracil failure in patients with metastatic colorectal cancer. Lancet 352 (9138): 1407-12, 1998. [PUBMED Abstract]
- Cunningham D, Pyrhönen S, James RD, et al.: Randomised trial of irinotecan plus supportive care versus supportive care alone after fluorouracil failure for patients with metastatic colorectal cancer. Lancet 352 (9138): 1413-8, 1998. [PUBMED Abstract]
- Rothenberg ML, Oza AM, Bigelow RH, et al.: Superiority of oxaliplatin and fluorouracil-leucovorin compared with either therapy alone in patients with progressive colorectal cancer after irinotecan and fluorouracil-leucovorin: interim results of a phase III trial. J Clin Oncol 21 (11): 2059-69, 2003. [PUBMED Abstract]
- Hurwitz H, Fehrenbacher L, Novotny W, et al.: Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 350 (23): 2335-42, 2004. [PUBMED Abstract]
- Sanoff HK, Sargent DJ, Campbell ME, et al.: Five-year data and prognostic factor analysis of oxaliplatin and irinotecan combinations for advanced colorectal cancer: N9741. J Clin Oncol 26 (35): 5721-7, 2008. [PUBMED Abstract]
- Saltz LB, Clarke S, Díaz-Rubio E, et al.: Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 26 (12): 2013-9, 2008. [PUBMED Abstract]
- Cassidy J, Clarke S, Díaz-Rubio E, et al.: Randomized phase III study of capecitabine plus oxaliplatin compared with fluorouracil/folinic acid plus oxaliplatin as first-line therapy for metastatic colorectal cancer. J Clin Oncol 26 (12): 2006-12, 2008. [PUBMED Abstract]
- Giantonio BJ, Catalano PJ, Meropol NJ, et al.: High-dose bevacizumab improves survival when combined with FOLFOX4 in previously treated advanced colorectal cancer: results from the Eastern Cooperative Oncology Group (ECOG) study E3200. [Abstract] J Clin Oncol 23 (Suppl 16): A-2, 1s, 2005.
- Arnold D, Andre T, Bennouna J, et al.: Bevacizumab (BEV) plus chemotherapy (CT) continued beyond first progression in patients with metastatic colorectal cancer (mCRC) previously treated with BEV plus CT: results of a randomized phase III intergroup study (TML study). [Abstract] J Clin Oncol 30 (Suppl 15): A-CRA3503, 2012.
- Loupakis F, Cremolini C, Masi G, et al.: Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med 371 (17): 1609-18, 2014. [PUBMED Abstract]
- Cunningham D, Humblet Y, Siena S, et al.: Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med 351 (4): 337-45, 2004. [PUBMED Abstract]
- Van Cutsem E, Köhne CH, Hitre E, et al.: Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med 360 (14): 1408-17, 2009. [PUBMED Abstract]
- Tol J, Koopman M, Cats A, et al.: Chemotherapy, bevacizumab, and cetuximab in metastatic colorectal cancer. N Engl J Med 360 (6): 563-72, 2009. [PUBMED Abstract]
- Maughan TS, Adams RA, Smith CG, et al.: Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet 377 (9783): 2103-14, 2011. [PUBMED Abstract]
- Adams RA, Meade AM, Seymour MT, et al.: Intermittent versus continuous oxaliplatin and fluoropyrimidine combination chemotherapy for first-line treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet Oncol 12 (7): 642-53, 2011. [PUBMED Abstract]
- Bokemeyer C, Cutsem EV, Rougier P, et al.: Addition of cetuximab to chemotherapy as first-line treatment for KRAS wild-type metastatic colorectal cancer: pooled analysis of the CRYSTAL and OPUS randomised clinical trials. Eur J Cancer 48 (10): 1466-75, 2012. [PUBMED Abstract]
- Van Cutsem E, Tabernero J, Lakomy R, et al.: Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol 30 (28): 3499-506, 2012. [PUBMED Abstract]
- Tabernero J, Yoshino T, Cohn AL, et al.: Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol 16 (5): 499-508, 2015. [PUBMED Abstract]
- Van Cutsem E, Peeters M, Siena S, et al.: Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol 25 (13): 1658-64, 2007. [PUBMED Abstract]
- Douillard JY, Siena S, Cassidy J, et al.: Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study. J Clin Oncol 28 (31): 4697-705, 2010. [PUBMED Abstract]
- Douillard JY, Oliner KS, Siena S, et al.: Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med 369 (11): 1023-34, 2013. [PUBMED Abstract]
- Hecht JR, Mitchell E, Chidiac T, et al.: A randomized phase IIIB trial of chemotherapy, bevacizumab, and panitumumab compared with chemotherapy and bevacizumab alone for metastatic colorectal cancer. J Clin Oncol 27 (5): 672-80, 2009. [PUBMED Abstract]
- Peeters M, Price TJ, Cervantes A, et al.: Randomized phase III study of panitumumab with fluorouracil, leucovorin, and irinotecan (FOLFIRI) compared with FOLFIRI alone as second-line treatment in patients with metastatic colorectal cancer. J Clin Oncol 28 (31): 4706-13, 2010. [PUBMED Abstract]
- Heinemann V, von Weikersthal LF, Decker T, et al.: FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial. Lancet Oncol 15 (10): 1065-75, 2014. [PUBMED Abstract]
- Venook AP, Niedzwiecki D, Lenz HJ, et al.: CALGB/SWOG 80405: Phase III trial of irinotecan/5-FU/leucovorin (FOLFIRI) or oxaliplatin/5-FU/leucovorin (mFOLFOX6) with bevacizumab (BV) or cetuximab (CET) for patients (pts) with KRAS wild-type (wt) untreated metastatic adenocarcinoma of the colon or rectum (MCRC). [Abstract] J Clin Oncol 32 (Suppl 5): A-LBA3, 2014.
- Stintzing S, Modest DP, Rossius L, et al.: FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab for metastatic colorectal cancer (FIRE-3): a post-hoc analysis of tumour dynamics in the final RAS wild-type subgroup of this randomised open-label phase 3 trial. Lancet Oncol 17 (10): 1426-1434, 2016. [PUBMED Abstract]
- Modest DP, Stintzing S, von Weikersthal LF, et al.: Impact of Subsequent Therapies on Outcome of the FIRE-3/AIO KRK0306 Trial: First-Line Therapy With FOLFIRI Plus Cetuximab or Bevacizumab in Patients With KRAS Wild-Type Tumors in Metastatic Colorectal Cancer. J Clin Oncol 33 (32): 3718-26, 2015. [PUBMED Abstract]
- Mayer RJ, Van Cutsem E, Falcone A, et al.: Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med 372 (20): 1909-19, 2015. [PUBMED Abstract]
- Prager GW, Taieb J, Fakih M, et al.: Trifluridine-Tipiracil and Bevacizumab in Refractory Metastatic Colorectal Cancer. N Engl J Med 388 (18): 1657-1667, 2023. [PUBMED Abstract]
- Grothey A, Sobrero AF, Siena S, et al.: Results of a phase III randomized, double-blind, placebo-controlled, multicenter trial (CORRECT) of regorafenib plus best supportive care (BSC) versus placebo plus BSC in patients (pts) with metastatic colorectal cancer (mCRC) who have progressed after standard therapies. [Abstract] J Clin Oncol 30 (Suppl 4): A-LBA385, 2012.
- Grothey A, Van Cutsem E, Sobrero A, et al.: Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 381 (9863): 303-12, 2013. [PUBMED Abstract]
- Dasari A, Lonardi S, Garcia-Carbonero R, et al.: Fruquintinib versus placebo in patients with refractory metastatic colorectal cancer (FRESCO-2): an international, multicentre, randomised, double-blind, phase 3 study. Lancet 402 (10395): 41-53, 2023. [PUBMED Abstract]
- Kopetz S, Grothey A, Yaeger R, et al.: Encorafenib, Binimetinib, and Cetuximab in BRAF V600E-Mutated Colorectal Cancer. N Engl J Med 381 (17): 1632-1643, 2019. [PUBMED Abstract]
- Kopetz S, Grothey A, Van Cutsem E, et al.: Encorafenib plus cetuximab with or without binimetinib for BRAF V600E metastatic colorectal cancer: updated survival results from a randomized, three-arm, phase III study versus choice of either irinotecan or FOLFIRI plus cetuximab (BEACON CRC). [Abstract] J Clin Oncol 38 (15) (suppl): A-4001, 2020. Available online. Last accessed January 30, 2025.
- Fakih M, Tu H, Hsu H, et al.: Real-World Study of Characteristics and Treatment Outcomes Among Patients with KRAS p.G12C-Mutated or Other KRAS Mutated Metastatic Colorectal Cancer. Oncologist 27 (8): 663-674, 2022. [PUBMED Abstract]
- Lee JK, Sivakumar S, Schrock AB, et al.: Comprehensive pan-cancer genomic landscape of KRAS altered cancers and real-world outcomes in solid tumors. NPJ Precis Oncol 6 (1): 91, 2022. [PUBMED Abstract]
- Neumann J, Zeindl-Eberhart E, Kirchner T, et al.: Frequency and type of KRAS mutations in routine diagnostic analysis of metastatic colorectal cancer. Pathol Res Pract 205 (12): 858-62, 2009. [PUBMED Abstract]
- Henry JT, Coker O, Chowdhury S, et al.: Comprehensive Clinical and Molecular Characterization of KRAS G12C-Mutant Colorectal Cancer. JCO Precis Oncol 5: , 2021. [PUBMED Abstract]
- Fakih MG, Salvatore L, Esaki T, et al.: Sotorasib plus Panitumumab in Refractory Colorectal Cancer with Mutated KRAS G12C. N Engl J Med 389 (23): 2125-2139, 2023. [PUBMED Abstract]
- Yaeger R, Weiss J, Pelster MS, et al.: Adagrasib with or without Cetuximab in Colorectal Cancer with Mutated KRAS G12C. N Engl J Med 388 (1): 44-54, 2023. [PUBMED Abstract]
- André T, Shiu KK, Kim TW, et al.: Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med 383 (23): 2207-2218, 2020. [PUBMED Abstract]
- Andre T, Shiu K, Kim TW, et al.: Final overall survival for the phase III KN177 study: pembrolizumab versus chemotherapy in microsatellite instability-high/mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC). [Abstract] J Clin Oncol 39 (15) (suppl): A-3500, 2021. Available online. Last accessed January 30, 2025.
- Lenz H, Lonardi S, Zagonel V, et al.: Subgroup analyses of patients (pts) with microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC) treated with nivolumab (NIVO) plus low-dose ipilimumab (IPI) as first-line (1L) therapy: two-year clinical update. [Abstract] J Clin Oncol 39 (3) (suppl): A-58, 2021. Available online. Last accessed January 30, 2025.
- Lenz HJ, Lonardi S, Elez E, et al.: Nivolumab (NIVO) plus ipilimumab (IPI) vs chemotherapy (chemo) as first-line (1L) treatment for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): Expanded efficacy analysis from CheckMate 8HW. [Abstract] J Clin Oncol 42 (Suppl 16): A-3503, 2024.
- Overman MJ, McDermott R, Leach JL, et al.: Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol 18 (9): 1182-1191, 2017. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (03/21/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Información general sobre el cáncer de colon
Se añadió texto para indicar que, a nivel mundial, el cáncer colorrectal es la tercera forma más común de cáncer en el mundo. En 2022, se calculó que hubo 1,93 millones de nuevos casos de cáncer colorrectal y 903 859 defunciones (se citó a Bray et al. como referencia 1).
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2025 (se citó a la American Cancer Society como referencia 2).
Tratamiento del cáncer de colon en estadio IV y recidivante
Se añadió Fruquintinib como subsección nueva.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de colon. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de colon son:
- Amit Chowdhry, MD, PhD (University of Rochester Medical Center)
- Leon Pappas, MD, PhD (Massachusetts General Hospital)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de colon. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/colorrectal/pro/tratamiento-colorrectal-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.