Tratamiento del craneofaringioma infantil (PDQ®)–Versión para profesionales de salud
Información general sobre el craneofaringioma infantil
Los tumores de encéfalo primarios, incluidos los craneofaringiomas, son un grupo diverso de enfermedades que, en conjunto, constituyen los tumores sólidos más frecuentes en la niñez. Los tumores de encéfalo, también llamados tumores cerebrales, se clasifican de acuerdo con una evaluación integrada de las características histológicas y moleculares; la ubicación del tumor y la extensión de la diseminación son factores importantes que afectan el tratamiento y el pronóstico.
Los craneofaringiomas son tumores encefálicos infantiles infrecuentes, que se cree que tienen un origen congénito y que se forman a partir de restos ectodérmicos, la hendidura de Rathke u otro epitelio embrionario. A menudo se presentan en la región supraselar con una porción intraselar. Las imágenes por resonancia magnética (IRM) y tomografía computarizada (TC) se utilizan para el diagnóstico de los craneofaringiomas, pero se suele necesitar confirmación histológica antes del tratamiento.
El tratamiento de los pacientes con craneofaringiomas recién diagnosticados puede incluir cirugía, radioterapia, drenaje de quistes y terapias intraquísticas. El abordaje de los pacientes con craneofaringiomas recidivantes depende del tratamiento inicial. Con las estrategias de tratamiento actuales, las tasas de supervivencia a 5 y 10 años alcanzan de un 80 % a un 90 % en los niños de 0 a 14 años.[1]
Los resúmenes del PDQ sobre tratamiento de los tumores encefálicos infantiles se organizan principalmente de acuerdo con la clasificación de tumores del sistema nervioso central (SNC) de la Organización Mundial de la Salud (OMS).[2,3] Para obtener una descripción completa de la clasificación de los tumores del SNC y un enlace al resumen de tratamiento correspondiente a cada tipo de tumor encefálico, consultar Resumen de la clasificación de los tumores de encéfalo y médula espinal infantiles.
Incidencia
Los craneofaringiomas son relativamente infrecuentes y representan alrededor de un 3 % de todos los tumores intracraneales en a niñez.[1,4,5]
No se han identificado factores predisponentes.
Características anatómicas
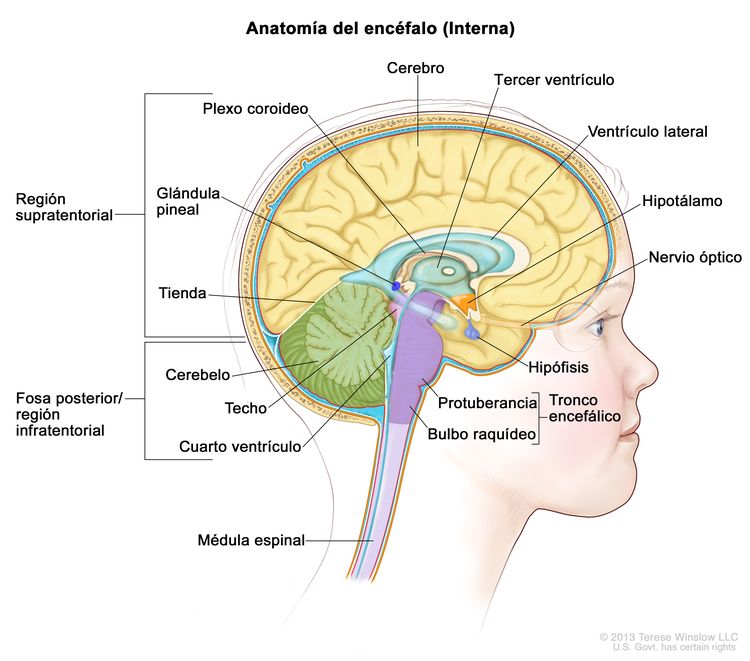
Cuadro clínico inicial
Los craneofaringiomas se presentan en la región supraselar, cerca de la hipófisis, los nervios ópticos y el quiasma óptico (consultar la Figura 2). Esta proximidad suele provocar lesiones en estas estructuras circundantes, debido al tumor y las intervenciones que se usan para tratarlo. Con mayor frecuencia afecta el funcionamiento endocrino y [6-11] algunos pacientes presentan alteraciones neuroendocrinas, como deficiencias de la hormona del crecimiento, la hormona tiroidea y el cortisol. Además, es posible que la proximidad tumoral a los nervios ópticos y el quiasma conlleve compromiso visual.[12][Nivel de evidencia C1]; [7,13-15] Algunos pacientes presentan hidrocefalia obstructiva causada por el crecimiento tumoral dentro del tercer ventrículo. En raras ocasiones, los tumores se extienden a la fosa posterior y en estos casos hay cefalea, diplopía, ataxia y hipoacusia.[16]
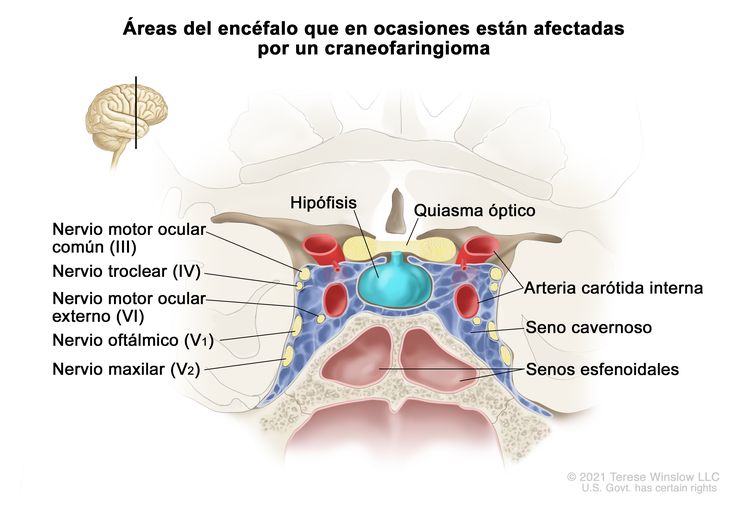
Evaluación diagnóstica
Las imágenes por TC y IRM suelen confirmar el diagnóstico de craneofaringioma infantil, en estas imágenes se observan calcificaciones intratumorales, además de componentes sólidos y quísticos en la mayoría de los tumores. No se realiza en forma rutinaria una IRM en el eje raquídeo.
Los craneofaringiomas sin calcificaciones quizás se confundan con otros tipos de tumores, como los tumores de células germinativas, los astrocitomas hipotalámicos o quiasmáticos o la histiocitosis de células de Langerhans. En estos casos se necesita una biopsia o resección para confirmar el diagnóstico.[17]
Además de las pruebas por imágenes, a menudo se hacen pruebas de funcionamiento endocrino y una exploración ocular profesional con evaluación del campo visual.
Pronóstico
Independientemente de la modalidad de tratamiento, las tasas de supervivencia general a 5 y 10 años oscilan entre el 80 % y el 90 % en niños de 0 a 14 años.[1,18-21] Las tasas de supervivencia sin complicaciones (SSC) suelen ser más variables, según el tratamiento y las características clínicas del paciente y el tumor. Las tasas de SSC oscilan entre un 23 % para los niños más pequeños y un 65 % para los niños en edad escolar.[22,23]
Bibliografía
- Ostrom QT, Cioffi G, Waite K, et al.: CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2014-2018. Neuro Oncol 23 (12 Suppl 2): iii1-iii105, 2021. [PUBMED Abstract]
- Louis DN, Perry A, Wesseling P, et al.: The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 23 (8): 1231-1251, 2021. [PUBMED Abstract]
- WHO Classification of Tumours Editorial Board, ed.: WHO Classification of Tumours: Central Nervous System Tumours. Vol. 6. 5th ed. IARC Press; 2021.
- Karavitaki N, Wass JA: Craniopharyngiomas. Endocrinol Metab Clin North Am 37 (1): 173-93, ix-x, 2008. [PUBMED Abstract]
- Garnett MR, Puget S, Grill J, et al.: Craniopharyngioma. Orphanet J Rare Dis 2: 18, 2007. [PUBMED Abstract]
- van Schaik J, Hoving EW, Müller HL, et al.: Hypothalamic-Pituitary Outcome after Treatment for Childhood Craniopharyngioma. Front Horm Res 54: 47-57, 2021. [PUBMED Abstract]
- Jimenez RB, Ahmed S, Johnson A, et al.: Proton Radiation Therapy for Pediatric Craniopharyngioma. Int J Radiat Oncol Biol Phys 110 (5): 1480-1487, 2021. [PUBMED Abstract]
- Bogusz A, Müller HL: Childhood-onset craniopharyngioma: latest insights into pathology, diagnostics, treatment, and follow-up. Expert Rev Neurother 18 (10): 793-806, 2018. [PUBMED Abstract]
- Tan TS, Patel L, Gopal-Kothandapani JS, et al.: The neuroendocrine sequelae of paediatric craniopharyngioma: a 40-year meta-data analysis of 185 cases from three UK centres. Eur J Endocrinol 176 (3): 359-369, 2017. [PUBMED Abstract]
- Cohen M, Bartels U, Branson H, et al.: Trends in treatment and outcomes of pediatric craniopharyngioma, 1975-2011. Neuro Oncol 15 (6): 767-74, 2013. [PUBMED Abstract]
- Fouda MA, Scott RM, Marcus KJ, et al.: Sixty years single institutional experience with pediatric craniopharyngioma: between the past and the future. Childs Nerv Syst 36 (2): 291-296, 2020. [PUBMED Abstract]
- Nuijts MA, Veldhuis N, Stegeman I, et al.: Visual functions in children with craniopharyngioma at diagnosis: A systematic review. PLoS One 15 (10): e0240016, 2020. [PUBMED Abstract]
- Wan MJ, Zapotocky M, Bouffet E, et al.: Long-term visual outcomes of craniopharyngioma in children. J Neurooncol 137 (3): 645-651, 2018. [PUBMED Abstract]
- Ravindra VM, Okcu MF, Ruggieri L, et al.: Comparison of multimodal surgical and radiation treatment methods for pediatric craniopharyngioma: long-term analysis of progression-free survival and morbidity. J Neurosurg Pediatr 28 (2): 152-159, 2021. [PUBMED Abstract]
- Felicetti F, Brignardello E, van Santen HM, eds.: Endocrine and Metabolic Late Effects in Cancer Survivors. Basel, Switzerland: Karger, 2021.
- Zhou L, Luo L, Xu J, et al.: Craniopharyngiomas in the posterior fossa: a rare subgroup, diagnosis, management and outcomes. J Neurol Neurosurg Psychiatry 80 (10): 1150-4, 2009. [PUBMED Abstract]
- Rossi A, Cama A, Consales A, et al.: Neuroimaging of pediatric craniopharyngiomas: a pictorial essay. J Pediatr Endocrinol Metab 19 (Suppl 1): 299-319, 2006. [PUBMED Abstract]
- Muller HL: Childhood craniopharyngioma. Recent advances in diagnosis, treatment and follow-up. Horm Res 69 (4): 193-202, 2008. [PUBMED Abstract]
- Müller HL: Childhood craniopharyngioma--current concepts in diagnosis, therapy and follow-up. Nat Rev Endocrinol 6 (11): 609-18, 2010. [PUBMED Abstract]
- Zacharia BE, Bruce SS, Goldstein H, et al.: Incidence, treatment and survival of patients with craniopharyngioma in the surveillance, epidemiology and end results program. Neuro Oncol 14 (8): 1070-8, 2012. [PUBMED Abstract]
- Ostrom QT, Cioffi G, Gittleman H, et al.: CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2012-2016. Neuro Oncol 21 (Suppl 5): v1-v100, 2019. [PUBMED Abstract]
- Beckhaus J, Friedrich C, Boekhoff S, et al.: Outcome after pediatric craniopharyngioma: the role of age at diagnosis and hypothalamic damage. Eur J Endocrinol 188 (3): , 2023. [PUBMED Abstract]
- Merchant TE, Dangda S, Hoehn ME, et al.: Pediatric Craniopharyngioma: The Effect of Visual Deficits and Hormone Deficiencies on Long-Term Cognitive Outcomes After Conformal Photon Radiation Therapy. Int J Radiat Oncol Biol Phys 115 (3): 581-591, 2023. [PUBMED Abstract]
Clasificación histopatológica del craneofaringioma infantil
Los craneofaringiomas son benignos desde el punto de vista histológico y, con frecuencia, se presentan en la región supraselar con una porción intraselar. A veces son invasivos a nivel local y, por lo general, no producen metástasis a partes alejadas del encéfalo.
Los craneofaringiomas se clasifican en la categoría de tumores de la región selar de acuerdo con las entidades que se definen a continuación. Las dos entidades se describieron antes como subtipos de craneofaringioma. Sin embargo, debido a las diferentes poblaciones que tienden a afectar y las distintas características clínicas, histológicas y moleculares que presentan, ahora se consideran entidades independientes.[1]
- Craneofaringiomas adamantinomatosos: estos tipos de craneofaringiomas se presentan con mayor frecuencia durante la niñez.[2] Los tumores casi siempre se componen de una porción sólida formada por nidos y trabéculas de células tumorales epiteliales con abundante calcificación, además de un componente quístico lleno de un líquido oscuro y aceitoso. La queratina húmeda también es característica de este tipo de tumor. Los craneofaringiomas adamantinomatosos son más malignos a nivel local que los craneofaringiomas papilares y tienen una tasa de recidiva significativamente más alta.[3] Las variantes activadoras del gen CTNNB1 se encuentran en la mayoría de los tumores adamantinomatosos.[1,4-6]
- Craneofaringiomas papilares: estos tipos de craneofaringiomas se presentan sobre todo en adultos y se observan variantes BRAF V600E en casi todos estos tumores.[1,5,6]
Bibliografía
- Louis DN, Perry A, Wesseling P, et al.: The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 23 (8): 1231-1251, 2021. [PUBMED Abstract]
- Karavitaki N, Wass JA: Craniopharyngiomas. Endocrinol Metab Clin North Am 37 (1): 173-93, ix-x, 2008. [PUBMED Abstract]
- Pekmezci M, Louie J, Gupta N, et al.: Clinicopathological characteristics of adamantinomatous and papillary craniopharyngiomas: University of California, San Francisco experience 1985-2005. Neurosurgery 67 (5): 1341-9; discussion 1349, 2010. [PUBMED Abstract]
- Sekine S, Shibata T, Kokubu A, et al.: Craniopharyngiomas of adamantinomatous type harbor beta-catenin gene mutations. Am J Pathol 161 (6): 1997-2001, 2002. [PUBMED Abstract]
- Brastianos PK, Taylor-Weiner A, Manley PE, et al.: Exome sequencing identifies BRAF mutations in papillary craniopharyngiomas. Nat Genet 46 (2): 161-5, 2014. [PUBMED Abstract]
- Goschzik T, Gessi M, Dreschmann V, et al.: Genomic Alterations of Adamantinomatous and Papillary Craniopharyngioma. J Neuropathol Exp Neurol 76 (2): 126-134, 2017. [PUBMED Abstract]
Información sobre los estadios del craneofaringioma infantil
No hay un sistema de estadificación que se use de manera generalizada para los craneofaringiomas infantiles. Para fines de tratamiento, los pacientes se clasifican según presenten una enfermedad recién diagnosticada o una enfermedad recidivante.
Aspectos generales de las opciones de tratamiento del craneofaringioma infantil
El tratamiento de los craneofaringiomas en pediatría por lo general incluye la máxima resección quirúrgica inocua posible y radioterapia dirigida al tumor residual. Además, se han utilizado terapias intraquísticas como fósforo radiactivo P 32, bleomicina e interferón α. La evidencia indica que los abordajes quirúrgicos conservadores conducen a mejores desenlaces neuroendocrinos y de calidad de vida.[1,2] Asimismo, ahora se empiezan a estudiar terapias dirigidas a medida que se identifica y comprende el comportamiento biológico de los iniciadores moleculares e inflamatorios de estos tumores.
En el Cuadro 1 se describen las opciones de tratamiento para el craneofaringioma infantil recién diagnosticado y recidivante.
| Grupo de tratamiento | Opciones de tratamiento |
|---|---|
| Craneofaringioma infantil recién diagnosticado | Resección completa, con radioterapia o sin esta |
| Resección subtotal con radioterapia | |
| Drenaje del quiste primario, con radioterapia o sin esta | |
| Terapia intraquística | |
| Craneofaringioma infantil progresivo o recidivante | Cirugía |
| Radioterapia, incluso radiocirugía | |
| Terapia intraquística (instilación intracavitaria de fósforo radiactivo P 32 o bleomicina para aquellos con recidivas quísticas, cuando estos fármacos están disponibles) | |
| Terapia sistémica y dirigida | |
| Observación |
Bibliografía
- Lohkamp LN, Kasper EM, Pousa AE, et al.: An update on multimodal management of craniopharyngioma in children. Front Oncol 13: 1149428, 2023. [PUBMED Abstract]
- Bogusz A, Müller HL: Childhood-onset craniopharyngioma: latest insights into pathology, diagnostics, treatment, and follow-up. Expert Rev Neurother 18 (10): 793-806, 2018. [PUBMED Abstract]
Tratamiento del craneofaringioma infantil recién diagnosticado
No hay consenso acerca del tratamiento óptimo para los pacientes con un craneofaringioma recién diagnosticado, en parte, debido a la falta de ensayos prospectivos aleatorizados en los que se comparen diferentes opciones de tratamiento. El tratamiento se debe personalizar de acuerdo con los siguientes factores:
- Tamaño del tumor.
- Localización del tumor.
- Extensión del tumor.
- Posible toxicidad a corto y largo plazo, en parte relacionada con las alteraciones neuroendocrinas y visuales iniciales (es posible que se opte por un abordaje quirúrgico más conservador en pacientes sin alteraciones neuroendocrinas ni visuales para controlar el riesgo de morbilidad quirúrgica).[1]
Las opciones de tratamiento establecidas para el craneofaringioma infantil recién diagnosticado son las siguientes:
Resección completa con radioterapia o sin esta
Es posible extirpar todo el tumor visible y lograr un control a largo plazo de la enfermedad.[2-4][Nivel de evidencia C1] Se notificó una tasa de supervivencia sin progresión (SSP) a 5 años de alrededor del 65 %.[5] Las tasas de recidiva notificadas oscilan entre menos de un 10 % y casi un 50 %.[6,7] La resección macroscópica total a menudo implica un gran desafío técnico debido a que el tumor está rodeado por estructuras vitales como los nervios ópticos, el quiasma óptico, la arteria carótida y sus ramificaciones, la hipófisis, el hipotálamo y el tercer par craneal. Estas estructuras restringen la posibilidad de extirpar el tumor completo. Los abordajes quirúrgicos conservadores a menudo se usan para preservar los desenlaces funcionales y de calidad de vida.[8,9][Nivel de evidencia C1]
Se han descrito muchos abordajes quirúrgicos y la elección se determina según el tamaño, la ubicación y la extensión del tumor, además de los signos y síntomas iniciales de la enfermedad del paciente. Las vías de acceso quirúrgico son las siguientes:
- Vía de acceso craneal (craneotomía): como se mencionó, la resección macroscópica total implica un mayor desafío técnico debido a que el tumor está rodeado por estructuras vitales. Con frecuencia, el cirujano tiene una visibilidad limitada de las regiones hipotalámica y selar, y después de la operación es posible que queden porciones de la masa que son la causa de algunas recidivas. Conocer las complejas variaciones del crecimiento anatómico del tumor facilita la resección macroscópica total.[10] Sin embargo, casi todos los craneofaringiomas se adhieren al infundíbulo hipofisario. De los pacientes que se someten a resección completa, casi todos necesitarán reemplazo hormonal hipofisario con múltiples medicamentos durante el resto de la vida.[3,11]
- Vía de acceso transesfenoidal: se ha comprobado que es posible un abordaje transesfenoidal en pacientes de todas las edades y para tumores de varios tamaños ubicados en la silla turca.[12]; [13][Nivel de evidencia C1] El avance de técnicas endonasales ampliadas con visualización endoscópica ha permitido un mayor uso de este abordaje, incluso para tumores de gran tamaño en niños, que es similar a la experiencia en adultos.[14] Es posible lograr una resección completa con este abordaje, aunque se relaciona con complicaciones como panhipopituitarismo y riesgo de fuga de líquido cefalorraquídeo.[15,16] Cuando es imposible utilizar una vía de acceso endonasal, se necesita una craneotomía.
Las complicaciones de la resección completa mediante cualquier abordaje quirúrgico son las siguientes:
- Obesidad, que puede poner en peligro la vida.[17]
- Necesidad de terapia de reemplazo hormonal.[18]
- Problemas graves de comportamiento.[18]
- Ceguera.
- Convulsiones.
- Fuga de líquido cefalorraquídeo.
- Pseudoaneurismas.
- Dificultad para los movimientos oculares.
- Muerte por hemorragia intraoperatoria, lesión hipotalámica o accidente cerebrovascular (infrecuente).
Si el cirujano indica que el tumor no se extirpó por completo o si las imágenes posoperatorias revelan craneofaringioma residual, a veces se recomienda radioterapia para prevenir la progresión temprana.[19][Nivel de evidencia C2] Para obtener más información, consultar la sección Resección subtotal con radioterapia.
Se realiza vigilancia periódica con imágenes por resonancia magnética durante varios años tras la resección completa debido a la posibilidad de recidiva tumoral.
Resección subtotal con radioterapia
El objetivo de una cirugía limitada puede ser establecer un diagnóstico, drenar los componentes quísticos del tumor o descomprimir las estructuras anatómicas circundantes. En las resecciones subtotales, por lo general se evita la extirpación del tumor del infundíbulo hipofisario o del hipotálamo para minimizar los efectos tardíos relacionados con la resección completa.[20]
A menudo, se hace la cirugía seguida de radioterapia, ya que la radioterapia puede disminuir el riesgo de recidiva después de una resección subtotal.[21] Con este abordaje, las tasas de SSP a 5 años son de alrededor del 70 % al 90 %,[5,22-25]; [26][Nivel de evidencia C1] y las tasas de supervivencia general (SG) a 10 años superan el 90 %, que son similares a las tasas de los pacientes sometidos a una resección macroscópica total.[27,28][Nivel de evidencia C1]; [29][Nivel de evidencia C2] En la mayoría de los casos, la radioterapia se inicia tan pronto se hace la resección subtotal. Sin embargo, en ciertos casos, como en pacientes jóvenes o en pacientes sin alteraciones neuroendocrinas o visuales, se pueden usar imágenes seriadas para retrasar o evitar la radioterapia durante el mayor tiempo posible.[7,30] El abordaje estándar de la radioterapia implica radiación de haz externo fraccionada, con una dosis recomendada de 50 Gy a 54 Gy, en fracciones de 1,8 Gy, lo que restringe la dosis dirigida al quiasma óptico a 54 Gy.[31-34] Los nuevos métodos de radiación, como la terapia de fotones de intensidad modulada y la radioterapia con haz de protones permiten reducir la dosis de radiación dirigida a partes no comprometidas del encéfalo y evitar el tejido normal.[23,34-36] Se desconoce si estos métodos reducen los efectos tardíos de la radioterapia.[26,34,36,37] Es posible que se observe un aumento transitorio del quiste durante la radioterapia, y que se necesiten imágenes seriadas durante el tratamiento para evaluar los cambios en el quiste y considerar ajustes del campo de radioterapia.[38][Nivel de evidencia C3]
Las complicaciones quirúrgicas de una resección subtotal pueden ser similares, aunque menos probables, a las de una resección completa. Si se usa radioterapia, se deben considerar otras complicaciones, como las siguientes:
En un estudio de fase II de un solo grupo, se incluyeron 94 pacientes (de 12 meses a 21 años de edad) con craneofaringiomas tratados con radioterapia con haz de protones después de una resección quirúrgica personalizada. Este grupo de pacientes se comparó con una cohorte histórica de pacientes que recibieron radioterapia con haz de fotones.[41] Los desenlaces de supervivencia fueron similares en los pacientes que recibieron terapia con protones y los que recibieron terapia con fotones. Las tasas de incidencia acumulada de necrosis, vasculopatía, cambios visuales y complicaciones graves también fueron similares entre los dos grupos de pacientes. Sin embargo, los pacientes tratados con terapia de protones en la cohorte más reciente presentaron mejores desenlaces cognitivos.
En un estudio a largo plazo de 101 niños tratados por craneofaringiomas, se evaluaron los desenlaces visuales, neurocognitivos y endocrinos después de la radioterapia con fotones. La raza y la presencia de una derivación afectaron las puntuaciones iniciales.[42] En los niños con puntuaciones más bajas de coeficiente intelectual (CI) en el momento del diagnóstico, el tratamiento a menudo produjo una reducción del puntaje de CI cerca al límite de discapacidad mental de 70 a 84. Los investigadores demostraron que la edad en el momento del tratamiento (los niños más pequeños tuvieron desenlaces más precarios), la dosis de radiación dirigida a los lóbulos temporales y el hipocampo, y el deterioro visual afectaron de manera significativa el funcionamiento neurocognitivo después de la radioterapia. En este estudio se demostró la importancia de estos factores en el tratamiento y los efectos tardíos del craneofaringioma.
En un informe del estudio prospectivo de registro KiProReg se examinó el uso de la terapia con haz de protones en 84 niños y adolescentes de menos de 18 años con craneofaringioma.[43] La tasa estimada de SG a 3 años fue del 98,2 % y la tasa de SSP fue del 94,7 %. Al cabo de una mediana de seguimiento de 4,3 años, los efectos tóxicos tardíos fueron aceptables. De los pacientes, 63 se trataron con terapia de protones con haz concentrado, lo que se considera un avance en la tecnología de protones.
Drenaje del quiste primario, con radioterapia o sin esta
Para los craneofaringiomas predominantemente quísticos, el drenaje estereotáctico del quiste, la inserción de un catéter para facilitar el drenaje o la fenestración del quiste son alternativas terapéuticas adicionales.[7,44] Estos tratamientos suelen seguirse de observación o radioterapia, según las características clínicas y tumorales. Este procedimiento también permite que el cirujano pueda emplear un abordaje que consta de las siguientes dos etapas:[45]
- Drenar el quiste para aliviar la presión y los síntomas intercurrentes.
- Resecar el tumor o administrar radioterapia más adelante.
Tratamiento intraquístico
Las terapias intraquísticas incluyen peginterferón α, fósforo radiactivo P 32 (32P) y otros compuestos,[46-48]; [49][Nivel de evidencia B4] e interferón α (que ya no está disponible comercialmente).[50]; [51][Nivel de evidencia C1]; [52][Nivel de evidencia C2] En el pasado también se utilizaba bleomicina.[53]; [54][Nivel de evidencia C2]
En una revisión sistemática de publicaciones, entre 2010 y 2021, sobre el tratamiento de los craneofaringiomas quísticos mediante braquiterapia con radioisótopos, se identificaron 66 pacientes pediátricos (N = 228).[55] Al cabo de un seguimiento mínimo de 5 años, se observaron respuestas parciales y completas en el 89 % de los niños con lesiones puramente quísticas, en comparación con el 58 % de los niños con lesiones quísticas y de otro tipo. Se logró una mejora visual en el 64 % de los pacientes con lesiones puramente quísticas y una mejora endocrina en el 20 % de estos pacientes. La tasa de progresión observada fue del 3 % para los pacientes con lesiones puramente quísticas. Se puede considerar el tratamiento con braquiterapia intraquística, con más frecuencia 32P e itrio Y 90, para pacientes con craneofaringiomas puramente quísticos.
Opciones de tratamiento en evaluación clínica
La información en inglés sobre los ensayos clínicos patrocinados por el NCI se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
En evaluaciones preclínicas contemporáneas se han identificado vías moleculares e inmunitarias activas en el craneofaringioma que podrían ser susceptibles de tratamiento dirigido con fármacos disponibles en el mercado o en investigación. En concreto, se han identificado las vías MAPK y RAF y objetivos inmunitarios e inflamatorios, como los componentes de la vía PD-1 y la IL-6.[7,56-61][Nivel de evidencia C1]
A continuación, se presenta un ejemplo de un ensayo clínico nacional o institucional en curso:
- NCT05465174 (Nivolumab and Tovorafenib [DAY101] for Treatment of Craniopharyngioma in Children and Young Adults): en este estudio se evalúa la tolerabilidad y la eficacia de la terapia combinada con inhibición de PD-1 (nivolumab) y cinasa de pan-RAF (tovorafenib) para el tratamiento de niños y adultos jóvenes con craneofaringioma.
Bibliografía
- Cohen M, Bartels U, Branson H, et al.: Trends in treatment and outcomes of pediatric craniopharyngioma, 1975-2011. Neuro Oncol 15 (6): 767-74, 2013. [PUBMED Abstract]
- Mortini P, Losa M, Pozzobon G, et al.: Neurosurgical treatment of craniopharyngioma in adults and children: early and long-term results in a large case series. J Neurosurg 114 (5): 1350-9, 2011. [PUBMED Abstract]
- Elliott RE, Hsieh K, Hochm T, et al.: Efficacy and safety of radical resection of primary and recurrent craniopharyngiomas in 86 children. J Neurosurg Pediatr 5 (1): 30-48, 2010. [PUBMED Abstract]
- Zhang YQ, Ma ZY, Wu ZB, et al.: Radical resection of 202 pediatric craniopharyngiomas with special reference to the surgical approaches and hypothalamic protection. Pediatr Neurosurg 44 (6): 435-43, 2008. [PUBMED Abstract]
- Yang I, Sughrue ME, Rutkowski MJ, et al.: Craniopharyngioma: a comparison of tumor control with various treatment strategies. Neurosurg Focus 28 (4): E5, 2010. [PUBMED Abstract]
- Müller HL, Merchant TE, Puget S, et al.: New outlook on the diagnosis, treatment and follow-up of childhood-onset craniopharyngioma. Nat Rev Endocrinol 13 (5): 299-312, 2017. [PUBMED Abstract]
- Apps JR, Muller HL, Hankinson TC, et al.: Contemporary Biological Insights and Clinical Management of Craniopharyngioma. Endocr Rev 44 (3): 518-538, 2023. [PUBMED Abstract]
- Lohkamp LN, Kasper EM, Pousa AE, et al.: An update on multimodal management of craniopharyngioma in children. Front Oncol 13: 1149428, 2023. [PUBMED Abstract]
- Bogusz A, Müller HL: Childhood-onset craniopharyngioma: latest insights into pathology, diagnostics, treatment, and follow-up. Expert Rev Neurother 18 (10): 793-806, 2018. [PUBMED Abstract]
- Morisako H, Goto T, Goto H, et al.: Aggressive surgery based on an anatomical subclassification of craniopharyngiomas. Neurosurg Focus 41 (6): E10, 2016. [PUBMED Abstract]
- Sands SA, Milner JS, Goldberg J, et al.: Quality of life and behavioral follow-up study of pediatric survivors of craniopharyngioma. J Neurosurg 103 (4 Suppl): 302-11, 2005. [PUBMED Abstract]
- Bakhsheshian J, Jin DL, Chang KE, et al.: Risk factors associated with the surgical management of craniopharyngiomas in pediatric patients: analysis of 1961 patients from a national registry database. Neurosurg Focus 41 (6): E8, 2016. [PUBMED Abstract]
- Locatelli D, Massimi L, Rigante M, et al.: Endoscopic endonasal transsphenoidal surgery for sellar tumors in children. Int J Pediatr Otorhinolaryngol 74 (11): 1298-302, 2010. [PUBMED Abstract]
- Chivukula S, Koutourousiou M, Snyderman CH, et al.: Endoscopic endonasal skull base surgery in the pediatric population. J Neurosurg Pediatr 11 (3): 227-41, 2013. [PUBMED Abstract]
- Mazzatenta D, Zoli M, Guaraldi F, et al.: Outcome of Endoscopic Endonasal Surgery in Pediatric Craniopharyngiomas. World Neurosurg 134: e277-e288, 2020. [PUBMED Abstract]
- Lee JA, Cooper RL, Nguyen SA, et al.: Endonasal Endoscopic Surgery for Pediatric Sellar and Suprasellar Lesions: A Systematic Review and Meta-analysis. Otolaryngol Head Neck Surg 163 (2): 284-292, 2020. [PUBMED Abstract]
- Müller HL, Gebhardt U, Teske C, et al.: Post-operative hypothalamic lesions and obesity in childhood craniopharyngioma: results of the multinational prospective trial KRANIOPHARYNGEOM 2000 after 3-year follow-up. Eur J Endocrinol 165 (1): 17-24, 2011. [PUBMED Abstract]
- Clark AJ, Cage TA, Aranda D, et al.: Treatment-related morbidity and the management of pediatric craniopharyngioma: a systematic review. J Neurosurg Pediatr 10 (4): 293-301, 2012. [PUBMED Abstract]
- Lin LL, El Naqa I, Leonard JR, et al.: Long-term outcome in children treated for craniopharyngioma with and without radiotherapy. J Neurosurg Pediatr 1 (2): 126-30, 2008. [PUBMED Abstract]
- Elowe-Gruau E, Beltrand J, Brauner R, et al.: Childhood craniopharyngioma: hypothalamus-sparing surgery decreases the risk of obesity. J Clin Endocrinol Metab 98 (6): 2376-82, 2013. [PUBMED Abstract]
- Müller HL: Childhood craniopharyngioma: current controversies on management in diagnostics, treatment and follow-up. Expert Rev Neurother 10 (4): 515-24, 2010. [PUBMED Abstract]
- Winkfield KM, Tsai HK, Yao X, et al.: Long-term clinical outcomes following treatment of childhood craniopharyngioma. Pediatr Blood Cancer 56 (7): 1120-6, 2011. [PUBMED Abstract]
- Jimenez RB, Ahmed S, Johnson A, et al.: Proton Radiation Therapy for Pediatric Craniopharyngioma. Int J Radiat Oncol Biol Phys 110 (5): 1480-1487, 2021. [PUBMED Abstract]
- Eveslage M, Calaminus G, Warmuth-Metz M, et al.: The Postopera tive Quality of Life in Children and Adolescents with Craniopharyngioma. Dtsch Arztebl Int 116 (18): 321-328, 2019. [PUBMED Abstract]
- Merchant TE, Hua CH, Shukla H, et al.: Proton versus photon radiotherapy for common pediatric brain tumors: comparison of models of dose characteristics and their relationship to cognitive function. Pediatr Blood Cancer 51 (1): 110-7, 2008. [PUBMED Abstract]
- Merchant TE, Kun LE, Hua CH, et al.: Disease control after reduced volume conformal and intensity modulated radiation therapy for childhood craniopharyngioma. Int J Radiat Oncol Biol Phys 85 (4): e187-92, 2013. [PUBMED Abstract]
- Schoenfeld A, Pekmezci M, Barnes MJ, et al.: The superiority of conservative resection and adjuvant radiation for craniopharyngiomas. J Neurooncol 108 (1): 133-9, 2012. [PUBMED Abstract]
- Edmonston DY, Wu S, Li Y, et al.: Limited surgery and conformal photon radiation therapy for pediatric craniopharyngioma: long-term results from the RT1 protocol. Neuro Oncol 24 (12): 2200-2209, 2022. [PUBMED Abstract]
- Clark AJ, Cage TA, Aranda D, et al.: A systematic review of the results of surgery and radiotherapy on tumor control for pediatric craniopharyngioma. Childs Nerv Syst 29 (2): 231-8, 2013. [PUBMED Abstract]
- Beckhaus J, Friedrich C, Boekhoff S, et al.: Outcome after pediatric craniopharyngioma: the role of age at diagnosis and hypothalamic damage. Eur J Endocrinol 188 (3): , 2023. [PUBMED Abstract]
- Kiehna EN, Merchant TE: Radiation therapy for pediatric craniopharyngioma. Neurosurg Focus 28 (4): E10, 2010. [PUBMED Abstract]
- Harrabi SB, Adeberg S, Welzel T, et al.: Long term results after fractionated stereotactic radiotherapy (FSRT) in patients with craniopharyngioma: maximal tumor control with minimal side effects. Radiat Oncol 9: 203, 2014. [PUBMED Abstract]
- Lo AC, Howard AF, Nichol A, et al.: Long-term outcomes and complications in patients with craniopharyngioma: the British Columbia Cancer Agency experience. Int J Radiat Oncol Biol Phys 88 (5): 1011-8, 2014. [PUBMED Abstract]
- Bishop AJ, Greenfield B, Mahajan A, et al.: Proton beam therapy versus conformal photon radiation therapy for childhood craniopharyngioma: multi-institutional analysis of outcomes, cyst dynamics, and toxicity. Int J Radiat Oncol Biol Phys 90 (2): 354-61, 2014. [PUBMED Abstract]
- Winkfield KM, Linsenmeier C, Yock TI, et al.: Surveillance of craniopharyngioma cyst growth in children treated with proton radiotherapy. Int J Radiat Oncol Biol Phys 73 (3): 716-21, 2009. [PUBMED Abstract]
- Beltran C, Roca M, Merchant TE: On the benefits and risks of proton therapy in pediatric craniopharyngioma. Int J Radiat Oncol Biol Phys 82 (2): e281-7, 2012. [PUBMED Abstract]
- Boehling NS, Grosshans DR, Bluett JB, et al.: Dosimetric comparison of three-dimensional conformal proton radiotherapy, intensity-modulated proton therapy, and intensity-modulated radiotherapy for treatment of pediatric craniopharyngiomas. Int J Radiat Oncol Biol Phys 82 (2): 643-52, 2012. [PUBMED Abstract]
- Shi Z, Esiashvili N, Janss AJ, et al.: Transient enlargement of craniopharyngioma after radiation therapy: pattern of magnetic resonance imaging response following radiation. J Neurooncol 109 (2): 349-55, 2012. [PUBMED Abstract]
- Ishida M, Hotta M, Tsukamura A, et al.: Malignant transformation in craniopharyngioma after radiation therapy: a case report and review of the literature. Clin Neuropathol 29 (1): 2-8, 2010 Jan-Feb. [PUBMED Abstract]
- Aquilina K, Merchant TE, Rodriguez-Galindo C, et al.: Malignant transformation of irradiated craniopharyngioma in children: report of 2 cases. J Neurosurg Pediatr 5 (2): 155-61, 2010. [PUBMED Abstract]
- Merchant TE, Hoehn ME, Khan RB, et al.: Proton therapy and limited surgery for paediatric and adolescent patients with craniopharyngioma (RT2CR): a single-arm, phase 2 study. Lancet Oncol 24 (5): 523-534, 2023. [PUBMED Abstract]
- Merchant TE, Dangda S, Hoehn ME, et al.: Pediatric Craniopharyngioma: The Effect of Visual Deficits and Hormone Deficiencies on Long-Term Cognitive Outcomes After Conformal Photon Radiation Therapy. Int J Radiat Oncol Biol Phys 115 (3): 581-591, 2023. [PUBMED Abstract]
- Bischoff M, Khalil DA, Frisch S, et al.: Outcome After Modern Proton Beam Therapy in Childhood Craniopharyngioma: Results of the Prospective Registry Study KiProReg. Int J Radiat Oncol Biol Phys 120 (1): 137-148, 2024. [PUBMED Abstract]
- Cinalli G, Spennato P, Cianciulli E, et al.: The role of transventricular neuroendoscopy in the management of craniopharyngiomas: three patient reports and review of the literature. J Pediatr Endocrinol Metab 19 (Suppl 1): 341-54, 2006. [PUBMED Abstract]
- Schubert T, Trippel M, Tacke U, et al.: Neurosurgical treatment strategies in childhood craniopharyngiomas: is less more? Childs Nerv Syst 25 (11): 1419-27, 2009. [PUBMED Abstract]
- Julow J, Backlund EO, Lányi F, et al.: Long-term results and late complications after intracavitary yttrium-90 colloid irradiation of recurrent cystic craniopharyngiomas. Neurosurgery 61 (2): 288-95; discussion 295-6, 2007. [PUBMED Abstract]
- Barriger RB, Chang A, Lo SS, et al.: Phosphorus-32 therapy for cystic craniopharyngiomas. Radiother Oncol 98 (2): 207-12, 2011. [PUBMED Abstract]
- Maarouf M, El Majdoub F, Fuetsch M, et al.: Stereotactic intracavitary brachytherapy with P-32 for cystic craniopharyngiomas in children. Strahlenther Onkol 192 (3): 157-65, 2016. [PUBMED Abstract]
- Kickingereder P, Maarouf M, El Majdoub F, et al.: Intracavitary brachytherapy using stereotactically applied phosphorus-32 colloid for treatment of cystic craniopharyngiomas in 53 patients. J Neurooncol 109 (2): 365-74, 2012. [PUBMED Abstract]
- Ierardi DF, Fernandes MJ, Silva IR, et al.: Apoptosis in alpha interferon (IFN-alpha) intratumoral chemotherapy for cystic craniopharyngiomas. Childs Nerv Syst 23 (9): 1041-6, 2007. [PUBMED Abstract]
- Cavalheiro S, Di Rocco C, Valenzuela S, et al.: Craniopharyngiomas: intratumoral chemotherapy with interferon-alpha: a multicenter preliminary study with 60 cases. Neurosurg Focus 28 (4): E12, 2010. [PUBMED Abstract]
- Kilday JP, Caldarelli M, Massimi L, et al.: Intracystic interferon-alpha in pediatric craniopharyngioma patients: an international multicenter assessment on behalf of SIOPE and ISPN. Neuro Oncol 19 (10): 1398-1407, 2017. [PUBMED Abstract]
- Linnert M, Gehl J: Bleomycin treatment of brain tumors: an evaluation. Anticancer Drugs 20 (3): 157-64, 2009. [PUBMED Abstract]
- Hukin J, Steinbok P, Lafay-Cousin L, et al.: Intracystic bleomycin therapy for craniopharyngioma in children: the Canadian experience. Cancer 109 (10): 2124-31, 2007. [PUBMED Abstract]
- Guimarães MM, Cardeal DD, Teixeira MJ, et al.: Brachytherapy in paediatric craniopharyngiomas: a systematic review and meta-analysis of recent literature. Childs Nerv Syst 38 (2): 253-262, 2022. [PUBMED Abstract]
- Petralia F, Tignor N, Reva B, et al.: Integrated Proteogenomic Characterization across Major Histological Types of Pediatric Brain Cancer. Cell 183 (7): 1962-1985.e31, 2020. [PUBMED Abstract]
- Apps JR, Carreno G, Gonzalez-Meljem JM, et al.: Tumour compartment transcriptomics demonstrates the activation of inflammatory and odontogenic programmes in human adamantinomatous craniopharyngioma and identifies the MAPK/ERK pathway as a novel therapeutic target. Acta Neuropathol 135 (5): 757-777, 2018. [PUBMED Abstract]
- Hengartner AC, Prince E, Vijmasi T, et al.: Adamantinomatous craniopharyngioma: moving toward targeted therapies. Neurosurg Focus 48 (1): E7, 2020. [PUBMED Abstract]
- Coy S, Rashid R, Lin JR, et al.: Multiplexed immunofluorescence reveals potential PD-1/PD-L1 pathway vulnerabilities in craniopharyngioma. Neuro Oncol 20 (8): 1101-1112, 2018. [PUBMED Abstract]
- Grob S, Mirsky DM, Donson AM, et al.: Targeting IL-6 Is a Potential Treatment for Primary Cystic Craniopharyngioma. Front Oncol 9: 791, 2019. [PUBMED Abstract]
- Donson AM, Apps J, Griesinger AM, et al.: Molecular Analyses Reveal Inflammatory Mediators in the Solid Component and Cyst Fluid of Human Adamantinomatous Craniopharyngioma. J Neuropathol Exp Neurol 76 (9): 779-788, 2017. [PUBMED Abstract]
Tratamiento del craneofaringioma infantil progresivo o recidivante
La progresión o recidiva del craneofaringioma varía según el tipo de terapia inicial, pero se notificó que oscila entre un 20 % (pacientes sometidos a resección subtotal y radioterapia) y un 90 % (pacientes sometidos a resección subtotal sin radioterapia).[1-3]
Las opciones de tratamiento para el craneofaringioma infantil recidivante son las siguientes:
Cirugía
El tratamiento inicial determina en gran parte el abordaje que se empleará para el craneofaringioma recidivante. Es difícil reintentar una resección macroscópica total y en estos casos es menos frecuente lograr el control a largo plazo de la enfermedad.[4][Nivel de evidencia C2]; [3] Además, las complicaciones son más frecuentes que cuando sea hace la cirugía inicial.[5][Nivel de evidencia C2]
Radioterapia
Si no se empleó antes, la radioterapia de haz externo sigue siendo una opción, incluso es posible considerar una radiocirugía en determinadas circunstancias.[6][Nivel de evidencia C2] La repetición de la irradiación en diferentes formas también es una opción cuando se consideran exposiciones previas a la radiación y efectos tóxicos. Se ha demostrado que la reirradiación es factible para recuperar el control tumoral y aliviar los síntomas.[7][Nivel de evidencia C3] Los tipos de radioterapia varían desde abordajes con radiación conformada estándar hasta terapia con Gamma Knife.[8][Nivel de evidencia C3]
Tratamiento intraquístico
Las recidivas quísticas se pueden tratar con la instilación intracavitaria de diversas sustancias mediante la colocación de un catéter de Ommaya.[9] Estos fármacos incluyen 32P radiactivo u otros compuestos,[10-12]; [13][Nivel de evidencia B4] bleomicina,[14]; [15][Nivel de evidencia C2] o, en el pasado, interferón α (que ya no está disponible comercialmente).[16]; [17][Nivel de evidencia C1]; [18][Nivel de evidencia C2] Estas estrategias han sido útiles en ciertos casos y se ha notificado un riesgo bajo de complicaciones. Sin embargo, ninguno de estos métodos ha demostrado ser eficaz contra las porciones sólidas del tumor.
Terapia sistémica y dirigida
Aunque no se suele usar terapia sistémica, en una serie pequeña se observó que el uso de peginterferón α-2b subcutáneo para tratar las recidivas quísticas puede producir respuestas duraderas; sin embargo, este fármaco ya no está disponible comercialmente.[19][Nivel de evidencia C2]
Observación
Es posible observar de forma segura a algunos pacientes asintomáticos con progresión tumoral mínima (<25 %). Se inicia una intervención cuando aparecen síntomas nuevos o si se identifica un crecimiento tumoral nuevo en las imágenes de seguimiento.[20]
Opciones de tratamiento en evaluación clínica
La información en inglés sobre los ensayos clínicos patrocinados por el NCI se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
En evaluaciones preclínicas contemporáneas se han identificado vías moleculares e inmunitarias activas en el craneofaringioma que podrían ser susceptibles de tratamiento dirigido con fármacos disponibles en el mercado o en investigación. En concreto, se han identificado las vías MAPK y RAF y objetivos inmunitarios e inflamatorios, como los componentes de la vía PD-1 y la IL-6.[21-27][Nivel de evidencia C1]
A continuación, se presentan ejemplos de ensayos clínicos nacionales o institucionales en curso:
- NCT05465174 (Nivolumab and Tovorafenib [DAY101] for Treatment of Craniopharyngioma in Children and Young Adults): en este estudio se evalúa la tolerabilidad y la eficacia de la terapia combinada con inhibición de PD-1 (nivolumab) y cinasa de pan-RAF (tovorafenib) para el tratamiento de niños y adultos jóvenes con craneofaringioma.
- NCT05286788 (Binimetinib [Mektovi] for the Treatment of Pediatric Adamantinomatous Craniopharyngioma): en este estudio de fase II se tratarán pacientes pediátricos con diagnóstico de craneofaringioma adamantinomatoso recidivante con binimetinib (mektovi).
- NCT05233397 (Tocilizumab [Actemra] for the Treatment of Progressive or Recurrent Pediatric Adamantinomatous Craniopharyngioma): en este estudio de fase II se tratarán pacientes pediátricos con diagnóstico de craneofaringioma adamantinomatoso recidivante con tocilizumab (actemra).
Bibliografía
- Yang I, Sughrue ME, Rutkowski MJ, et al.: Craniopharyngioma: a comparison of tumor control with various treatment strategies. Neurosurg Focus 28 (4): E5, 2010. [PUBMED Abstract]
- Bogusz A, Müller HL: Childhood-onset craniopharyngioma: latest insights into pathology, diagnostics, treatment, and follow-up. Expert Rev Neurother 18 (10): 793-806, 2018. [PUBMED Abstract]
- Liubinas SV, Munshey AS, Kaye AH: Management of recurrent craniopharyngioma. J Clin Neurosci 18 (4): 451-7, 2011. [PUBMED Abstract]
- Vinchon M, Dhellemmes P: Craniopharyngiomas in children: recurrence, reoperation and outcome. Childs Nerv Syst 24 (2): 211-7, 2008. [PUBMED Abstract]
- Jang WY, Lee KS, Son BC, et al.: Repeat operations in pediatric patients with recurrent craniopharyngiomas. Pediatr Neurosurg 45 (6): 451-5, 2009. [PUBMED Abstract]
- Xu Z, Yen CP, Schlesinger D, et al.: Outcomes of Gamma Knife surgery for craniopharyngiomas. J Neurooncol 104 (1): 305-13, 2011. [PUBMED Abstract]
- Foran SJ, Laperriere N, Edelstein K, et al.: Reirradiation for recurrent craniopharyngioma. Adv Radiat Oncol 5 (6): 1305-1310, 2020. [PUBMED Abstract]
- Kobayashi T: Long-term results of gamma knife radiosurgery for 100 consecutive cases of craniopharyngioma and a treatment strategy. Prog Neurol Surg 22: 63-76, 2009. [PUBMED Abstract]
- Steinbok P, Hukin J: Intracystic treatments for craniopharyngioma. Neurosurg Focus 28 (4): E13, 2010. [PUBMED Abstract]
- Julow J, Backlund EO, Lányi F, et al.: Long-term results and late complications after intracavitary yttrium-90 colloid irradiation of recurrent cystic craniopharyngiomas. Neurosurgery 61 (2): 288-95; discussion 295-6, 2007. [PUBMED Abstract]
- Barriger RB, Chang A, Lo SS, et al.: Phosphorus-32 therapy for cystic craniopharyngiomas. Radiother Oncol 98 (2): 207-12, 2011. [PUBMED Abstract]
- Maarouf M, El Majdoub F, Fuetsch M, et al.: Stereotactic intracavitary brachytherapy with P-32 for cystic craniopharyngiomas in children. Strahlenther Onkol 192 (3): 157-65, 2016. [PUBMED Abstract]
- Kickingereder P, Maarouf M, El Majdoub F, et al.: Intracavitary brachytherapy using stereotactically applied phosphorus-32 colloid for treatment of cystic craniopharyngiomas in 53 patients. J Neurooncol 109 (2): 365-74, 2012. [PUBMED Abstract]
- Linnert M, Gehl J: Bleomycin treatment of brain tumors: an evaluation. Anticancer Drugs 20 (3): 157-64, 2009. [PUBMED Abstract]
- Hukin J, Steinbok P, Lafay-Cousin L, et al.: Intracystic bleomycin therapy for craniopharyngioma in children: the Canadian experience. Cancer 109 (10): 2124-31, 2007. [PUBMED Abstract]
- Ierardi DF, Fernandes MJ, Silva IR, et al.: Apoptosis in alpha interferon (IFN-alpha) intratumoral chemotherapy for cystic craniopharyngiomas. Childs Nerv Syst 23 (9): 1041-6, 2007. [PUBMED Abstract]
- Cavalheiro S, Di Rocco C, Valenzuela S, et al.: Craniopharyngiomas: intratumoral chemotherapy with interferon-alpha: a multicenter preliminary study with 60 cases. Neurosurg Focus 28 (4): E12, 2010. [PUBMED Abstract]
- Kilday JP, Caldarelli M, Massimi L, et al.: Intracystic interferon-alpha in pediatric craniopharyngioma patients: an international multicenter assessment on behalf of SIOPE and ISPN. Neuro Oncol 19 (10): 1398-1407, 2017. [PUBMED Abstract]
- Yeung JT, Pollack IF, Panigrahy A, et al.: Pegylated interferon-α-2b for children with recurrent craniopharyngioma. J Neurosurg Pediatr 10 (6): 498-503, 2012. [PUBMED Abstract]
- Fouda MA, Karsten M, Staffa SJ, et al.: Management strategies for recurrent pediatric craniopharyngioma: new recommendations. J Neurosurg Pediatr 27 (5): 548-555, 2021. [PUBMED Abstract]
- Petralia F, Tignor N, Reva B, et al.: Integrated Proteogenomic Characterization across Major Histological Types of Pediatric Brain Cancer. Cell 183 (7): 1962-1985.e31, 2020. [PUBMED Abstract]
- Apps JR, Muller HL, Hankinson TC, et al.: Contemporary Biological Insights and Clinical Management of Craniopharyngioma. Endocr Rev 44 (3): 518-538, 2023. [PUBMED Abstract]
- Apps JR, Carreno G, Gonzalez-Meljem JM, et al.: Tumour compartment transcriptomics demonstrates the activation of inflammatory and odontogenic programmes in human adamantinomatous craniopharyngioma and identifies the MAPK/ERK pathway as a novel therapeutic target. Acta Neuropathol 135 (5): 757-777, 2018. [PUBMED Abstract]
- Hengartner AC, Prince E, Vijmasi T, et al.: Adamantinomatous craniopharyngioma: moving toward targeted therapies. Neurosurg Focus 48 (1): E7, 2020. [PUBMED Abstract]
- Coy S, Rashid R, Lin JR, et al.: Multiplexed immunofluorescence reveals potential PD-1/PD-L1 pathway vulnerabilities in craniopharyngioma. Neuro Oncol 20 (8): 1101-1112, 2018. [PUBMED Abstract]
- Grob S, Mirsky DM, Donson AM, et al.: Targeting IL-6 Is a Potential Treatment for Primary Cystic Craniopharyngioma. Front Oncol 9: 791, 2019. [PUBMED Abstract]
- Donson AM, Apps J, Griesinger AM, et al.: Molecular Analyses Reveal Inflammatory Mediators in the Solid Component and Cyst Fluid of Human Adamantinomatous Craniopharyngioma. J Neuropathol Exp Neurol 76 (9): 779-788, 2017. [PUBMED Abstract]
Efectos tardíos en los pacientes tratados por craneofaringioma infantil
Los aspectos de calidad de vida son importantes en los niños con craneofaringiomas y son difíciles de generalizar debido a las diversas modalidades de tratamiento. En una serie de 261 pacientes con craneofaringioma diagnosticado antes de 2000, el compromiso hipotalámico se relacionó con una supervivencia general (SG) más baja, deterioro de la calidad de vida y obesidad grave.[1][Nivel de evidencia C1] En otros estudios en los que se investigó la calidad de vida en cohortes multiinstitucionales grandes se encontró una correlación entre desenlaces de calidad de vida más precarios y variables como una edad más avanzada en el momento del diagnóstico, compromiso hipotalámico, grado de lesión hipotalámica posoperatoria y grado de resección tumoral.[2,3] Independientemente del tratamiento, la mayoría de los pacientes con craneofaringiomas presentan efectos a largo plazo a causa del tumor y su tratamiento.[2-6][Nivel de evidencia B3]
Los efectos tardíos del tratamiento para el craneofaringioma infantil son los siguientes:
- Problemas de conducta y falta de memoria. Aunque el cociente intelectual suele mantenerse, a menudo se presentan problemas de conducta y de otros dominios cognitivos como la memoria, la función ejecutiva y la atención.[4,6-8] Los efectos neurocognitivos y de la memoria se pueden mitigar mediante el uso de radioterapia con protones y planes conformados para evitar las estructuras anatómicas circundantes normales del encéfalo, como el hipotálamo y el hipocampo.[9]; [10][Nivel de evidencia B3]
- Alteraciones visuales. Se han notificado alteraciones visuales, como defectos del campo y la agudeza visual. Es posible reducir estas alteraciones con abordajes quirúrgicos menos radicales o radioterapia sola.[11][Nivel de evidencia C1]; [6,10]
- Anomalías endocrinas. Las anomalías endocrinas conllevan de manera casi universal la necesidad de reemplazo endocrino con múltiples hormonas hipofisarias durante el resto de la vida.[5,8]; [12-14][Nivel de evidencia C1] De manera similar a las alteraciones visuales, las lesiones endocrinas también se pueden mitigar con una resección quirúrgica limitada [5,6,15-17] y terapias intraquísticas que minimizan las intervenciones invasivas.[18]
- Disminución de la estatura. La terapia de reemplazo con hormona del crecimiento se usa para mejorar el crecimiento en los niños tratados por craneofaringiomas. Los niños que inician el tratamiento de reemplazo de la hormona del crecimiento en la infancia presentan aumentos de la estatura sin efecto en la SG ni en la supervivencia sin progresión cuando se comparan con los niños que no recibieron hormona del crecimiento.[19][Nivel de evidencia C1]; [20] La administración de la hormona del crecimiento a partir de 1 año del diagnóstico se relaciona con mejoras tempranas en la calidad de vida cuando se mide a los 3 años del diagnóstico.[21][Nivel de evidencia C1] Las directrices de consenso publicadas no indican aumento del riesgo de recidiva con el uso de hormonas de crecimiento. En estas directrices se recomienda considerar la administración de terapia de reemplazo de la hormona del crecimiento a partir de los 3 meses tras completar el tratamiento del cáncer en pacientes con enfermedad estable y alteración significativa del crecimiento.[22][Nivel de evidencia D]
- Obesidad. A veces se presenta obesidad potencialmente mortal y síndrome metabólico, incluso enfermedad del hígado graso no alcohólico.[23,24] Los niños que se someten a resección completa o resección subtotal a veces presentan obesidad, lo que indica que la predisposición a la obesidad quizás sea un componente de la enfermedad en sí, no el resultado de una lesión hipotalámica directa.[25][Nivel de evidencia C1] Es más probable que la obesidad grave observada en pacientes con craneofaringiomas sea el resultado de una combinación de factores como la ubicación del tumor y las características del tratamiento, con repercusiones multifacéticas posteriores.[26][Nivel de evidencia C1] En un estudio de 709 pacientes con craneofaringiomas, el compromiso del área hipotalámica posterior o la lesión operatoria de esta área fue un factor clave para el desarrollo de obesidad grave.[3]
- Vasculopatías y accidente cerebrovascular. Las vasculopatías y los accidentes cerebrovasculares subsiguientes a veces son el resultado de la irradiación local.[27,28] En estudios previos se indicó que el reemplazo a largo plazo de la hormona del crecimiento puede reducir el riesgo de accidente cerebrovascular. En los estudios también se observó que las características previas al tratamiento, como una lesión vascular previa, la ubicación de los vasos en el campo quirúrgico y las dosis más altas de radiación dirigidas a las estructuras vasculares, aumentan el riesgo de estenosis vascular a largo plazo.[28]; [29][Nivel de evidencia C1] En un estudio de 94 pacientes pediátricos con craneofaringiomas tratados con cirugía y 54 Gy de terapia de protones, el factor pronóstico más fuerte de vasculopatía postradioterapia fue una vasculopatía preexistente.[29] El efecto de la radioterapia con protones fue insignificante dentro del corredor operatorio. A pesar de la incidencia alta (n = 27, 28,7 %) de indicios de estenosis subclínica solo en las imágenes, únicamente 5 pacientes requirieron un procedimiento de revascularización. Uno de estos pacientes tenía una estenosis de grado alto antes de la radioterapia. Dos pacientes presentaron recidivas tumorales previas que requirieron resecciones múltiples antes de la radioterapia.
- Neoplasias subsiguientes. La irradiación local a veces produce neoplasias subsiguientes.[27] Las neoplasias malignas secundarias relacionadas con la radioterapia que comprometen específicamente la región hipofisaria o selar incluyen desde tumores malignos, como gliomas de grado alto, hasta meningiomas. Este riesgo aumenta en los pacientes que son más jóvenes en el momento de la radioterapia.[30]
Para obtener información sobre la incidencia, el tipo y la vigilancia de los efectos tardíos en los niños y adolescentes sobrevivientes de cáncer, consultar Efectos tardíos del tratamiento anticanceroso en la niñez.
Bibliografía
- Sterkenburg AS, Hoffmann A, Gebhardt U, et al.: Survival, hypothalamic obesity, and neuropsychological/psychosocial status after childhood-onset craniopharyngioma: newly reported long-term outcomes. Neuro Oncol 17 (7): 1029-38, 2015. [PUBMED Abstract]
- Eveslage M, Calaminus G, Warmuth-Metz M, et al.: The Postopera tive Quality of Life in Children and Adolescents with Craniopharyngioma. Dtsch Arztebl Int 116 (18): 321-328, 2019. [PUBMED Abstract]
- Beckhaus J, Friedrich C, Boekhoff S, et al.: Outcome after pediatric craniopharyngioma: the role of age at diagnosis and hypothalamic damage. Eur J Endocrinol 188 (3): , 2023. [PUBMED Abstract]
- Apps JR, Muller HL, Hankinson TC, et al.: Contemporary Biological Insights and Clinical Management of Craniopharyngioma. Endocr Rev 44 (3): 518-538, 2023. [PUBMED Abstract]
- Müller HL: Childhood craniopharyngioma: current controversies on management in diagnostics, treatment and follow-up. Expert Rev Neurother 10 (4): 515-24, 2010. [PUBMED Abstract]
- Bogusz A, Müller HL: Childhood-onset craniopharyngioma: latest insights into pathology, diagnostics, treatment, and follow-up. Expert Rev Neurother 18 (10): 793-806, 2018. [PUBMED Abstract]
- Winkfield KM, Tsai HK, Yao X, et al.: Long-term clinical outcomes following treatment of childhood craniopharyngioma. Pediatr Blood Cancer 56 (7): 1120-6, 2011. [PUBMED Abstract]
- Giese H, Haenig B, Haenig A, et al.: Neurological and neuropsychological outcome after resection of craniopharyngiomas. J Neurosurg 132 (5): 1425-1434, 2019. [PUBMED Abstract]
- Özyurt J, Thiel CM, Lorenzen A, et al.: Neuropsychological outcome in patients with childhood craniopharyngioma and hypothalamic involvement. J Pediatr 164 (4): 876-881.e4, 2014. [PUBMED Abstract]
- Merchant TE, Hoehn ME, Khan RB, et al.: Proton therapy and limited surgery for paediatric and adolescent patients with craniopharyngioma (RT2CR): a single-arm, phase 2 study. Lancet Oncol 24 (5): 523-534, 2023. [PUBMED Abstract]
- Wan MJ, Zapotocky M, Bouffet E, et al.: Long-term visual outcomes of craniopharyngioma in children. J Neurooncol 137 (3): 645-651, 2018. [PUBMED Abstract]
- Vinchon M, Weill J, Delestret I, et al.: Craniopharyngioma and hypothalamic obesity in children. Childs Nerv Syst 25 (3): 347-52, 2009. [PUBMED Abstract]
- Dolson EP, Conklin HM, Li C, et al.: Predicting behavioral problems in craniopharyngioma survivors after conformal radiation therapy. Pediatr Blood Cancer 52 (7): 860-4, 2009. [PUBMED Abstract]
- Kawamata T, Amano K, Aihara Y, et al.: Optimal treatment strategy for craniopharyngiomas based on long-term functional outcomes of recent and past treatment modalities. Neurosurg Rev 33 (1): 71-81, 2010. [PUBMED Abstract]
- Müller HL: Consequences of craniopharyngioma surgery in children. J Clin Endocrinol Metab 96 (7): 1981-91, 2011. [PUBMED Abstract]
- Marcus HJ, Rasul FT, Hussein Z, et al.: Craniopharyngioma in children: trends from a third consecutive single-center cohort study. J Neurosurg Pediatr 25 (3): 242-250, 2019. [PUBMED Abstract]
- Clark AJ, Cage TA, Aranda D, et al.: Treatment-related morbidity and the management of pediatric craniopharyngioma: a systematic review. J Neurosurg Pediatr 10 (4): 293-301, 2012. [PUBMED Abstract]
- Lohkamp LN, Kasper EM, Pousa AE, et al.: An update on multimodal management of craniopharyngioma in children. Front Oncol 13: 1149428, 2023. [PUBMED Abstract]
- Boekhoff S, Bogusz A, Sterkenburg AS, et al.: Long-term Effects of Growth Hormone Replacement Therapy in Childhood-onset Craniopharyngioma: Results of the German Craniopharyngioma Registry (HIT-Endo). Eur J Endocrinol 179 (5): 331-341, 2018. [PUBMED Abstract]
- Nguyen Quoc A, Beccaria K, González Briceño L, et al.: GH and Childhood-onset Craniopharyngioma: When to Initiate GH Replacement Therapy? J Clin Endocrinol Metab 108 (8): 1929-1936, 2023. [PUBMED Abstract]
- Heinks K, Boekhoff S, Hoffmann A, et al.: Quality of life and growth after childhood craniopharyngioma: results of the multinational trial KRANIOPHARYNGEOM 2007. Endocrine 59 (2): 364-372, 2018. [PUBMED Abstract]
- Boguszewski MCS, Boguszewski CL, Chemaitilly W, et al.: Safety of growth hormone replacement in survivors of cancer and intracranial and pituitary tumours: a consensus statement. Eur J Endocrinol 186 (6): P35-P52, 2022. [PUBMED Abstract]
- Elowe-Gruau E, Beltrand J, Brauner R, et al.: Childhood craniopharyngioma: hypothalamus-sparing surgery decreases the risk of obesity. J Clin Endocrinol Metab 98 (6): 2376-82, 2013. [PUBMED Abstract]
- Hoffmann A, Bootsveld K, Gebhardt U, et al.: Nonalcoholic fatty liver disease and fatigue in long-term survivors of childhood-onset craniopharyngioma. Eur J Endocrinol 173 (3): 389-97, 2015. [PUBMED Abstract]
- Tan TS, Patel L, Gopal-Kothandapani JS, et al.: The neuroendocrine sequelae of paediatric craniopharyngioma: a 40-year meta-data analysis of 185 cases from three UK centres. Eur J Endocrinol 176 (3): 359-369, 2017. [PUBMED Abstract]
- Otte A, Müller HL: Childhood-onset Craniopharyngioma. J Clin Endocrinol Metab 106 (10): e3820-e3836, 2021. [PUBMED Abstract]
- Kiehna EN, Merchant TE: Radiation therapy for pediatric craniopharyngioma. Neurosurg Focus 28 (4): E10, 2010. [PUBMED Abstract]
- Lo AC, Howard AF, Nichol A, et al.: A Cross-Sectional Cohort Study of Cerebrovascular Disease and Late Effects After Radiation Therapy for Craniopharyngioma. Pediatr Blood Cancer 63 (5): 786-93, 2016. [PUBMED Abstract]
- Lucas JT, Faught AM, Hsu CY, et al.: Pre- and Posttherapy Risk Factors for Vasculopathy in Pediatric Patients With Craniopharyngioma Treated With Surgery and Proton Radiation Therapy. Int J Radiat Oncol Biol Phys 113 (1): 152-160, 2022. [PUBMED Abstract]
- Burman P, van Beek AP, Biller BM, et al.: Radiotherapy, Especially at Young Age, Increases the Risk for De Novo Brain Tumors in Patients Treated for Pituitary/Sellar Lesions. J Clin Endocrinol Metab 102 (3): 1051-1058, 2017. [PUBMED Abstract]
Modificaciones a este resumen (02/20/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Tratamiento del craneofaringioma infantil recién diagnosticado
Se añadió el texto para indicar que en un informe del estudio prospectivo de registro KiProReg se examinó el uso de la terapia con haz de protones en 84 niños y adolescentes de menos de 18 años con craneofaringioma. La tasa estimada de supervivencia general a 3 años fue del 98,2 % y la tasa de supervivencia sin progresión fue del 94,7 %. Al cabo de una mediana de seguimiento de 4,3 años, los efectos tóxicos tardíos fueron aceptables. De los pacientes, 63 se trataron con terapia de protones con haz concentrado, lo que se considera un avance en la tecnología de protones (se citó a Bischoff et al. como referencia 43).
Efectos tardíos en los pacientes tratados por craneofaringioma infantil
Se añadió Nguyen Quoc et al. como referencia 20.
El Consejo editorial del PDQ sobre el tratamiento pediátrico es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del craneofaringioma infantil. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento pediátrico, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del craneofaringioma infantil son:
- Kenneth J. Cohen, MD, MBA (Sidney Kimmel Comprehensive Cancer Center at Johns Hopkins Hospital)
- Karen J. Marcus, MD, FACR (Dana-Farber of Boston Children's Cancer Center and Blood Disorders Harvard Medical School)
- Roger J. Packer, MD (Children's National Hospital)
- D. Williams Parsons, MD, PhD (Texas Children's Hospital)
- Malcolm A. Smith, MD, PhD (National Cancer Institute)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento pediátrico emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento pediátrico. PDQ Tratamiento del craneofaringioma infantil. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/cerebro/pro/tratamiento-craneo-infantil-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.