Tratamiento del melanoma (PDQ®)–Versión para profesionales de salud
Información general sobre el melanoma
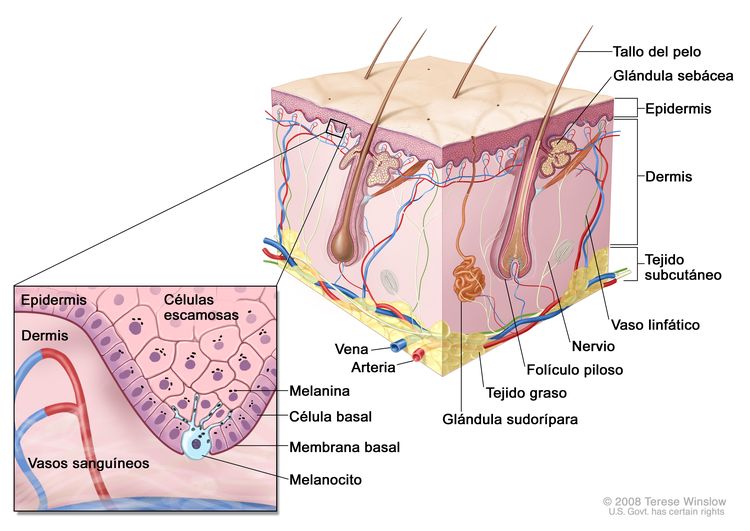
El melanoma es un tumor maligno de los melanocitos, células que producen el pigmento melanina y se derivan de la cresta neural. Aunque la mayoría de los melanomas se presentan en la piel, también surgen en las mucosas o en otros sitios a los que migran las células de la cresta neural, incluso la úvea. Los melanomas uveales son muy diferentes al melanoma cutáneo en aspectos como la incidencia, los factores pronósticos, las características moleculares y el tratamiento. Para obtener más información, consultar Tratamiento del melanoma ocular uveal.
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por melanoma en los Estados Unidos en 2024:[1]
- Casos nuevos: 100 640.
- Defunciones: 8290.
El cáncer de piel es la neoplasia maligna que se diagnostica con mayor frecuencia en los Estados Unidos. El melanoma invasivo representa cerca del 1 % de los cánceres de piel, pero es el que produce más muertes.[1,2] Desde principios de la década de 2000, la incidencia del melanoma disminuyó en alrededor de un 1 % por año en los hombres de menos de 50 años y se estabilizó en las mujeres del mismo grupo etario. En las personas de 50 años, y mayores de esa edad, la incidencia se estabilizó en los hombres y aumentó en cerca del 3 % por año en las mujeres.[1] Los hombres de edad avanzada tienen el riesgo más alto; sin embargo, el melanoma es el cáncer más frecuente en los adultos jóvenes de 25 a 29 años, y es el segundo cáncer más frecuente en personas de 15 a 29 años.[3] El melanoma ocular es el cáncer de ojo más frecuente; cada año, se diagnostican alrededor de 2000 casos.
Factores de riesgo
Los factores de riesgo de melanoma son intrínsecos (genéticos y fenotípicos) y extrínsecos (ambientales o de exposición):
- Exposición solar.
- Características pigmentarias.
- Nevos múltiples.
- Antecedentes familiares y personales de melanoma.
- Inmunodepresión.
- Exposiciones ambientales.
Para obtener más información sobre los factores de riesgo, consultar Prevención del cáncer de piel y Genética del cáncer de piel.
Características anatómicas
Exámenes de detección
Para obtener más información, consultar Exámenes de detección del cáncer de piel.
Características clínicas
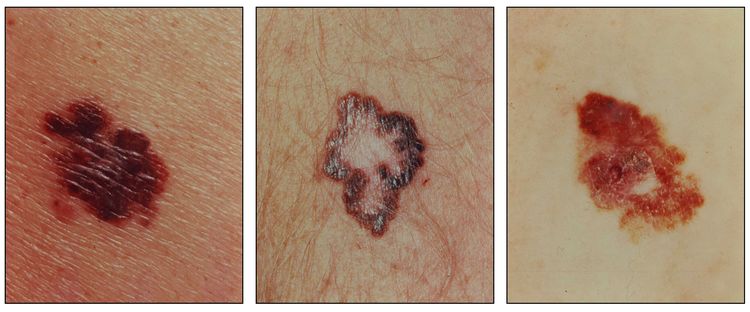
El melanoma se presenta de manera predominante en adultos, más del 50 % de los casos surgen en áreas aparentemente normales de la piel. Aunque el melanoma se presenta en cualquier sitio, incluso las mucosas y la úvea, en las mujeres es más frecuente en las extremidades y en los hombres es más frecuente en el tronco, la cabeza o el cuello.[4]
Los signos tempranos que indican una transformación maligna de un nevo son los siguientes:
- Pigmentación oscura o variable.
- Prurito.
- Aumento de tamaño o aparición de lesiones satélites.
- Ulceraciones o hemorragias (signos tardíos).
Diagnóstico
Se debe realizar una biopsia, preferiblemente por escisión local, de cualquier lesión sospechosa. Las lesiones sospechosas nunca se deben rasurar ni cauterizar. Un patólogo experto debe examinar las muestras para determinar la microestadificación.
En estudios se concluyó que es difícil diferenciar las lesiones pigmentadas benignas de los melanomas en estadio temprano. Es más, incluso dermatopatólogos expertos pueden tener opiniones diferentes. Con el fin de reducir las probabilidades de un diagnóstico incorrecto, se debe considerar una segunda evaluación por parte de un patólogo experto independiente.[5,6] En los estudios se encontró que varía mucho el grado de consenso entre los patólogos en cuanto al diagnóstico histológico de melanomas y lesiones pigmentadas benignas.[5,6]
Evidencia (desacuerdo en la evaluación histológica):
- En un estudio, se encontró que hubo desacuerdo en el diagnóstico de melanoma versus lesiones benignas en 37 de 140 casos examinados por un grupo de dermatopatólogos expertos. En la clasificación histológica del melanoma cutáneo el mayor acuerdo fue sobre el grosor de Breslow y la presencia de ulceración; pero el consenso fue precario sobre otras características histológicas, como el nivel de invasión de Clark, la presencia de regresión y la infiltración linfocítica.[5]
- En otro estudio, un grupo de patólogos expertos tuvo dos o más interpretaciones diferentes para el 38 % de los casos examinados.[6]
Factores pronósticos
Las características de los tumores primarios y metastásicos afectan el pronóstico. Los factores pronósticos más importantes que se incorporaron en la versión revisada de 2009 de la estadificación del American Joint Committee on Cancer, son los siguientes:[4,7-9]
- Grosor o nivel de invasión del melanoma.
- Índice mitótico, definido como número de mitosis por milímetro.
- Ulceraciones o hemorragia en el sitio primario.
- Número de ganglios linfáticos regionales comprometidos, con diferenciación entre macro y micrometástasis.
- Metástasis sistémicas.
- Sitio (extravisceral vs. pulmonar vs. todos los viscerales).
- Concentración sérica elevada de lactato-deshidrogenasa sérica.
Por lo general, los pacientes más jóvenes, las mujeres y aquellos con melanoma en las extremidades tienen un mejor pronóstico.[4,7-9]
Las lesiones satélites microscópicas, registradas como presentes o ausentes, en el melanoma en estadio I a veces indican un factor histológico de pronóstico precario, pero esto es polémico.[10] La presencia de linfocitos infiltrantes tumorales, clasificados como activos, inactivos o ausentes, se estudia como un posible factor pronóstico.[11]
El riesgo de recaída disminuye mucho con el tiempo, aunque no son infrecuentes las recaídas tardías.[12,13]
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2024. American Cancer Society, 2024. Available online. Last accessed December 30, 2024.
- Melanoma. Bethesda, Md: National Library of Medicine, 2012. Available online. Last accessed May 1, 2025.
- Bleyer A, O’Leary M, Barr R, et al., eds.: Cancer Epidemiology in Older Adolescents and Young Adults 15 to 29 Years of Age, Including SEER Incidence and Survival: 1975-2000. National Cancer Institute, 2006. NIH Pub. No. 06-5767. Available online. Last accessed May 1, 2025.
- Slingluff CI Jr, Flaherty K, Rosenberg SA, et al.: Cutaneous melanoma. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1643-91.
- Corona R, Mele A, Amini M, et al.: Interobserver variability on the histopathologic diagnosis of cutaneous melanoma and other pigmented skin lesions. J Clin Oncol 14 (4): 1218-23, 1996. [PUBMED Abstract]
- Farmer ER, Gonin R, Hanna MP: Discordance in the histopathologic diagnosis of melanoma and melanocytic nevi between expert pathologists. Hum Pathol 27 (6): 528-31, 1996. [PUBMED Abstract]
- Balch CM, Soong S, Ross MI, et al.: Long-term results of a multi-institutional randomized trial comparing prognostic factors and surgical results for intermediate thickness melanomas (1.0 to 4.0 mm). Intergroup Melanoma Surgical Trial. Ann Surg Oncol 7 (2): 87-97, 2000. [PUBMED Abstract]
- Manola J, Atkins M, Ibrahim J, et al.: Prognostic factors in metastatic melanoma: a pooled analysis of Eastern Cooperative Oncology Group trials. J Clin Oncol 18 (22): 3782-93, 2000. [PUBMED Abstract]
- Balch CM, Gershenwald JE, Soong SJ, et al.: Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol 27 (36): 6199-206, 2009. [PUBMED Abstract]
- León P, Daly JM, Synnestvedt M, et al.: The prognostic implications of microscopic satellites in patients with clinical stage I melanoma. Arch Surg 126 (12): 1461-8, 1991. [PUBMED Abstract]
- Mihm MC, Clemente CG, Cascinelli N: Tumor infiltrating lymphocytes in lymph node melanoma metastases: a histopathologic prognostic indicator and an expression of local immune response. Lab Invest 74 (1): 43-7, 1996. [PUBMED Abstract]
- Shen P, Guenther JM, Wanek LA, et al.: Can elective lymph node dissection decrease the frequency and mortality rate of late melanoma recurrences? Ann Surg Oncol 7 (2): 114-9, 2000. [PUBMED Abstract]
- Tsao H, Cosimi AB, Sober AJ: Ultra-late recurrence (15 years or longer) of cutaneous melanoma. Cancer 79 (12): 2361-70, 1997. [PUBMED Abstract]
Clasificación celular y molecular del melanoma
Los términos descriptivos de los subtipos celulares clinicopatológicos del melanoma maligno se deben considerar solo de interés histórico, porque no tienen importancia pronóstica o terapéutica independiente. Los subtipos celulares son los siguientes:
- Diseminación superficial.
- Nodular.
- Lentigo maligno.
- Lentiginoso acral (palmoplantar y subungueal).
- Otros tipos infrecuentes son los siguientes:
- Lentiginoso mucoso (oral y genital).
- Desmoplásico.
- Verrugoso.
Clasificación genómica
Melanoma cutáneo
La red Atlas del Genoma del Cáncer (TCGA) llevó a cabo una caracterización integradora en múltiples plataformas con 333 melanomas cutáneos de 331 pacientes.[1] Los investigadores usaron seis tipos de análisis moleculares a nivel del ADN, ARN y proteínas para identificar cuatro subtipos genómicos principales, según la presencia de las siguientes mutaciones:
- Mutación en BRAF.
- Mutación en RAS.
- Mutación en NF1.
- Triple natural.
Es posible que los subtipos genómicos indiquen objetivos de acción farmacológica, que sirvan para el diseño de ensayos clínicos, o que permitan orientar la decisión clínica para usar terapias dirigidas. Para obtener más información, consultar el Cuadro 1.
Hasta la fecha, solo las terapias dirigidas para el subtipo de melanoma con mutación en BRAF han sido eficaces y recibieron la aprobación de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). La terapia combinada con un inhibidor de BRAF y un inhibidor de MEK también producen mejorías de los desenlaces en comparación con la monoterapia; sin embargo, prácticamente todos los pacientes se vuelven resistentes al tratamiento y recaen. Para obtener más información, consultar cada una de las secciones de tratamiento. Por lo tanto, los ensayos clínicos todavía son una opción importante para los pacientes que tienen el subtipo de melanoma con mutación en BRAF o cualquiera de los otros subtipos genómicos.
Se aprobaron varias inmunoterapias para tratar el melanoma, con independencia del subtipo genético. Para obtener más información, consultar cada una de las secciones de tratamiento. El beneficio de la inmunoterapia no se ha relacionado con una mutación o subtipo molecular específico. En el análisis de la TCGA se identificaron marcadores inmunitarios (en un subgrupo de cada subtipo molecular) relacionados con mejora de la supervivencia que posiblemente tengan consecuencias para la inmunoterapia. La identificación de biomarcadores pronósticos es un área de investigación activa.
| Subtipo genómico | Porcentaje de muestras con mutación (%) | Infiltración linfocítica elevada (%) | Implicaciones clínicas para el uso de la terapia dirigidac,d | ||
|---|---|---|---|---|---|
| FDA = Administración de Alimentos y Medicamentos de los Estados Unidos. | |||||
| aMelanoma primario con muestras normales emparejadas; N = 67 (20 %). Melanoma metastásico con muestras normales emparejadas; N = 266 (80 %). Emparejada se define como una muestra del mismo paciente. | |||||
| bTriple natural se definió como un subgrupo heterogéneo sin mutaciones en BRAF, NRAS, HRAS, KRAS ni NF1. | |||||
| cEl subtipo genómico no determina ni limita las indicaciones para usar la inmunoterapia. | |||||
| dLos riesgos y beneficios de las terapias simples y combinadas se describen en la sección de este resumen sobre Aspectos generales sobre los opciones de tratamiento del melanoma. | |||||
| eLa investigación incluye estos ejemplos, pero no se limita a estos. La información en inglés sobre ensayos clínicos se publica en el portal de Internet ClinicalTrials.gov. | |||||
| fIndicado cuando la mutación se diagnostica con una prueba aprobada por la FDA. | |||||
| Tratamientos aprobados por la FDA | Tratamientos en investigacióne (monoterapia o combinación) | ||||
| Mutación en BRAF | 52 | ~ 30 | Inhibidores de BRAFf | Inhibidores de CDK, inhibidores de PI3K/Akt/mTOR, inhibidores de ERK, inhibidores de IDH1, inhibidores de EZH2, inhibidores de la cinasa Aurora, remodeladores de la cromatina ARID2 | |
| –Vemurafenib | |||||
| –Dabrafenib | |||||
| Inhibidores de MEK | |||||
| –Trametinib | |||||
| –Cobimetinib | |||||
| Combinación de inhibidores de BRAF y MEK | |||||
| –Vemurafenib y cobimetinib | |||||
| –Dabrafenib y trametinib | |||||
| Mutación en RAS (NRAS, HRAS y KRAS) | 28 | ~ 25 | Inhibidores de MEK, inhibidores de CDK, inhibidores de PI3K/Akt/mTOR, inhibidores de ERK, inhibidores de IDH1, inhibidores de EZH2, inhibidores de la cinasa Aurora, remodeladores de la cromatina ARID2 | ||
| Mutación en NF1 | 14 | ~ 25 | Inhibidores de PI3K/Akt/mTOR, inhibidores de ERK, inhibidores de IDH1, inhibidores de EZH2, remodeladores de la cromatina ARID2 | ||
| Triple naturalb | 14,5 | ~ 40 | Inhibidores de mutación en KIT/amplificación de CDK (por ejemplo, imatinib y dasatinib), inhibidores de la interacción MDM2/p53, inhibidores de PI3K/Akt/mTOR, inhibidores de IDH1, inhibidores de EZH2 | ||
Melanoma uveal
Los melanomas uveales son muy diferentes de los melanomas cutáneos. En una serie, se encontró que el 83 % de 186 melanomas uveales contenían una mutación somática constitutivamente activa en GNAQ o GNA11.[2,3] Para obtener más información, consultar Tratamiento del melanoma ocular uveal.
Bibliografía
- Cancer Genome Atlas Network: Genomic Classification of Cutaneous Melanoma. Cell 161 (7): 1681-96, 2015. [PUBMED Abstract]
- Van Raamsdonk CD, Bezrookove V, Green G, et al.: Frequent somatic mutations of GNAQ in uveal melanoma and blue naevi. Nature 457 (7229): 599-602, 2009. [PUBMED Abstract]
- Van Raamsdonk CD, Griewank KG, Crosby MB, et al.: Mutations in GNA11 in uveal melanoma. N Engl J Med 363 (23): 2191-9, 2010. [PUBMED Abstract]
Información sobre los estadios del melanoma
La estadificación clínica se basa en la presencia de diseminación a ganglios linfáticos regionales o sitios distantes. Cuando el melanoma está limitado al sitio primario según la evaluación clínica, la probabilidad de metástasis ganglionar o sistémica se eleva a medida que aumenta el grosor y la profundidad de la invasión, lo que empeora el pronóstico. El melanoma se disemina por extensión local (a través del sistema linfático) o por vía hematógena a sitios distantes. Aunque las metástasis comprometen cualquier órgano, los pulmones y el hígado son sitios frecuentes.
El microestadio del melanoma maligno se determina mediante un examen histológico en el que se mide el grosor vertical de la lesión en milímetros (clasificación de Breslow) o el nivel anatómico de la invasión local (clasificación de Clark). El grosor de Breslow es más reproducible y permite predecir con mayor exactitud el comportamiento posterior del melanoma maligno cuando el grosor de las lesiones es mayor de 1,5 mm; este grosor siempre se debe notificar.
Se requiere que un patólogo experto haga una evaluación histológica cuidadosa de la muestra completa del tumor primario para lograr una microestadificación exacta.
Clasificación de Clark (nivel de invasión)
| Nivel de invasión | Descripción |
|---|---|
| Nivel I | Lesiones con compromiso de la epidermis únicamente (melanoma in situ); sin lesiones invasivas. |
| Nivel II | Invasión de la dermis papilar; no llega a la unión entre la dermis papilar y reticular. |
| Nivel III | Invasión que se expande por la dermis papilar, pero no penetra la dermis reticular. |
| Nivel IV | Invasión de la dermis reticular, pero no penetra el tejido subcutáneo. |
| Nivel V | Invasión por toda la dermis reticular y penetra el tejido subcutáneo. |
Agrupamiento por estadios y definiciones TNM del American Joint Committee on Cancer
El American Joint Committee on Cancer (AJCC) designó los estadios mediante la clasificación TNM (tumor, ganglio linfático y metástasis) para definir el melanoma.[1]
Se usa este sistema de estadificación para el melanoma cutáneo. No se usa este sistema de estadificación para otros tipos de cáncer como los siguientes: melanoma de conjuntiva; melanoma uveal; melanoma mucoso de cabeza, cuello, uretra, vagina, recto y ano; carcinoma de células de Merkel y carcinoma de células escamosas.[1]
Grupos de estadios pronósticos y definiciones clínicas del American Joint Committee on Cancer (cTNM)
| Estadio | TNM | Categoría T (grosor y estado de ulceración) | Categoría N (número de ganglios linfáticos regionales comprometidos, presencia de metástasis en tránsito y de metástasis satélites o microsatélites) | Categoría M (sitio anatómico y concentración de LDH) |
|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínica; LDH = lactato-deshidrogenasa. | ||||
| aAdaptación de AJCC: Melanoma of the Skin. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 563–85. | ||||
| bEl grosor y el estado de ulceración no aplican en este caso. | ||||
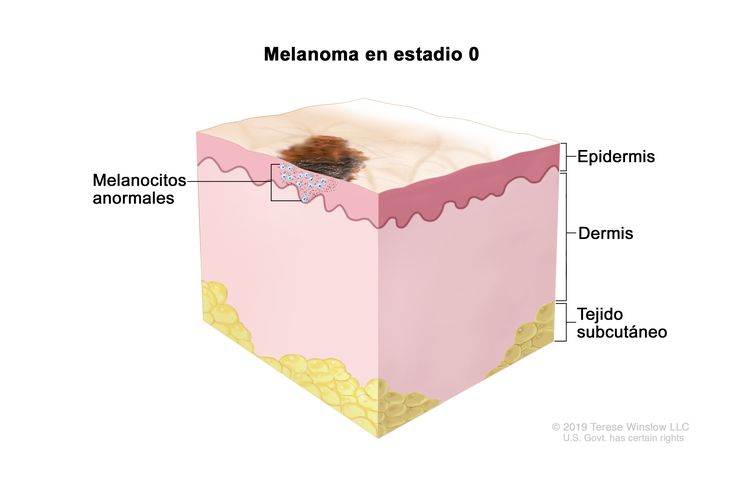
| 0 | Tis, N0, M0 | Tis = melanoma in situ.b | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. |
| Estadio | TNM | Categoría T (grosor y estado de ulceración) | Categoría N (número de ganglios linfáticos regionales comprometidos, presencia de metástasis en tránsito y de metástasis satélites o microsatélites) | Categoría M (sitio anatómico y concentración de LDH) |
|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínica; LDH = lactato-deshidrogenasa. | ||||
| aAdaptación de AJCC: Melanoma of the Skin. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 563–85. | ||||
| IA | T1a, N0, M0 | T1a = grosor de <0,8 mm, sin ulceración. | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. |
| IB | T1b, N0, M0 | T1b = grosor de <0,8 mm, con ulceración; grosor de 0,8–1,0 mm, con o sin ulceración. | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. |
| T2a, N0, M0 | T2a = grosor de >1,0–2,0 mm, sin ulceración. | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. | |
| Estadio | TNM | Categoría T (grosor y estado de ulceración) | Categoría N (número de ganglios linfáticos regionales comprometidos, presencia de metástasis en tránsito y de metástasis satélites o microsatélites) | Categoría M (sitio anatómico y concentración de LDH) |
|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínica; LDH = lactato-deshidrogenasa. | ||||
| aAdaptación de AJCC: Melanoma of the Skin. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 563–85. | ||||
| IIA | T2b, N0, M0 | T2b = grosor de >1,0–2,0 mm, con ulceración. | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. |
| T3a, N0, M0 | T3a = grosor de >2,0–4,0 mm, sin ulceración. | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. | |
| IIB | T3b, N0, M0 | T3b = grosor de >2,0–4,0 mm, con ulceración. | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. |
| T4a, N0, M0 | T4a = grosor de >4,0 mm, sin ulceración. | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. | |
| IIC | T4b, N0, M0 | T4b = grosor de >4,0 mm, con ulceración. | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. |
| Estadio | TNM | Categoría T (grosor y estado de ulceración) | Categoría N (número de ganglios linfáticos regionales comprometidos, presencia de metástasis en tránsito y de metástasis satélites o microsatélites) | Categoría M (sitio anatómico y concentración de LDH) |
|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínica; LDH = lactato-deshidrogenasa. | ||||
| aAdaptación de AJCC: Melanoma of the Skin. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 563–85. | ||||
| bPor ejemplo, melanoma diagnosticado mediante curetaje. | ||||
| cPor ejemplo, melanoma con sitio primario desconocido o regresión completa. | ||||
| dEl grosor y el estado de ulceración no aplican en este caso. | ||||
| eMelanoma detectado mediante biopsia de ganglio linfático centinela. | ||||
| III | Cualquier T, Tis, ≥N1, M0 | TX = tumor primario no evaluable.b,d | N1a = compromiso de 1 ganglio linfático oculto en la evaluación clínicae; sin metástasis en tránsito ni metástasis satélites o microsatélites. | M0 = sin metástasis a distancia. |
| T0 = sin indicios de tumor primario.c,d | ||||
| Tis = melanoma in situd | N1b = compromiso de 1 ganglio linfático detectado en la evaluación clínica, sin metástasis en tránsito ni metástasis satélites o microsatélites. | |||
| T1a = grosor de <0,8 mm, sin ulceración. | N1c = sin enfermedad ganglionar regional, con metástasis en tránsito y metástasis satélites o microsatélites. | |||
| T1b = grosor de <0,8 mm con ulceración; grosor de 0,8–1,0 mm, con ulceración o sin esta. | N2a = compromiso de 2 o 3 ganglios linfáticos ocultos en la evaluación clínicae; sin metástasis en tránsito ni metástasis satélites o microsatélites. | |||
| T2a = grosor de >1,0–2,0 mm, sin ulceración. | N2b = compromiso de 2 o 3 ganglios linfáticos (por lo menos uno detectado en la evaluación clínica), sin metástasis en tránsito ni metástasis satélites o microsatélites. | |||
| T2b = grosor de >1,0–2,0 mm, con ulceración. | N2c = compromiso de 1 ganglio linfático (oculto o detectado en la evaluación clínica) o con metástasis en tránsito y metástasis satélites o microsatélites. | |||
| T3a = grosor de >2,0–4,0 mm, sin ulceración. | N3a = compromiso de 4 o más ganglios linfáticos ocultos en la evaluación clínicae; sin metástasis en tránsito ni metástasis satélites o microsatélites. | |||
| T3b = grosor de >2,0–4,0 mm, con ulceración. | N3b = compromiso de 4 o más ganglios linfáticos (por lo menos uno detectado en la evaluación clínica), o cualquier número de ganglios apelmazados, sin metástasis en tránsito, ni metástasis satélites o microsatélites. | |||
| T4a = grosor de >4,0 mm, sin ulceración. | N3c = compromiso de 2 o más ganglios linfáticos (ocultos o detectados en la evaluación clínica), cualquier número de ganglios apelmazados o con metástasis en tránsito y metástasis satélites o microsatélites. | |||
| T4b = grosor de >4,0 mm, con ulceración. | ||||
| Estadio | TNM | Categoría T (grosor y estado de ulceración) | Categoría N (número de ganglios linfáticos regionales comprometidos, presencia de metástasis en tránsito y de metástasis satélites o microsatélites) | Categoría M (sitio anatómico y concentración de LDH) |
|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínica; LDH = lactato-deshidrogenasa: SNC = sistema nervioso central. | ||||
| aAdaptación de AJCC: Melanoma of the Skin. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 563–85. | ||||
| bPor ejemplo, no se hizo biopsia de ganglio linfático centinela o se extirparon antes los ganglios linfáticos regionales. (Excepción: la categoría N patológica no se necesita para los melanomas T1, en ese caso se usa cN). | ||||
| IV | Cualquier T, cualquier N, M1 | Cualquier T = consultar las descripciones en el Cuadro 6. | NX = ganglios linfáticos regionales no evaluables;b N0 = sin metástasis regionales; ≥N1 = consultar la descripción en el Cuadro 6. | M1 = metástasis a distancia. |
| –M1a = metástasis a distancia en la piel, el tejido blando (incluso músculo) o los ganglios linfáticos regionales [M1a(0) = LDH normal; M1a(1) = LDH alta]. | ||||
| –M1b = metástasis a distancia en el pulmón, con metástasis o sin esta en los mismos sitios descritos en M1a [M1b(0) = LDH normal; M1b(1) = LDH alta]. | ||||
| –M1c = metástasis a distancia viscerales sin compromiso del SNC, con metástasis o sin esta en los mismos sitios descritos en M1a o M1b [M1c(0) = LDH normal o M1c(1) = LDH alta]. | ||||
| –M1d = metástasis a distancia en el SNC, con metástasis o sin esta en los mismos sitios descritos en M1a, M1b o M1c [M1d(0) = LDH normal; M1d(1) = LDH alta]. | ||||
Grupos de estadios pronósticos y definiciones patológicas del American Joint Committee on Cancer (pTNM)
| Estadio | TNM | Categoría T (grosor y estado de ulceración) | Categoría N (número de ganglios linfáticos regionales comprometidos, presencia de metástasis en tránsito y de metástasis satélites o microsatélites) | Categoría M (sitio anatómico y concentración de LDH) | Imagen |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínica; LDH = lactato-deshidrogenasa. | |||||
| aAdaptación de AJCC: Melanoma of the Skin. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 563–85. | |||||
| bNo se necesita una evaluación patológica de los ganglios linfáticos para completar la estadificación patológica del estadio 0 (melanoma in situ) y del estadio T1; se usa la información de cN para asignar el estadio patológico. | |||||
| cEl grosor y el estado de ulceración no aplican en este caso. | |||||
| 0 | Tis, N0, M0 | Tis = Melanoma in situ.b,c | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. |
 |
| Estadio | TNM | Categoría T (grosor y estado de ulceración) | Categoría N (número de ganglios linfáticos regionales comprometidos, presencia de metástasis en tránsito y de metástasis satélites o microsatélites) | Categoría M (sitio anatómico y concentración de LDH) | Imagen |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; cN = N clínica; LDH = lactato-deshidrogenasa; p = patológica. | |||||
| aAdaptación de AJCC: Melanoma of the Skin. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 563–85. | |||||
| bNo se necesita una evaluación patológica de los ganglios linfáticos para completar la estadificación patológica del estadio 0 (melanoma in situ) y del estadio T1; se usa la información de cN para asignar el estadio patológico. | |||||
| IA | T1a, N0, M0 | T1a = grosor de <0,8 mm, sin ulceración. | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. |
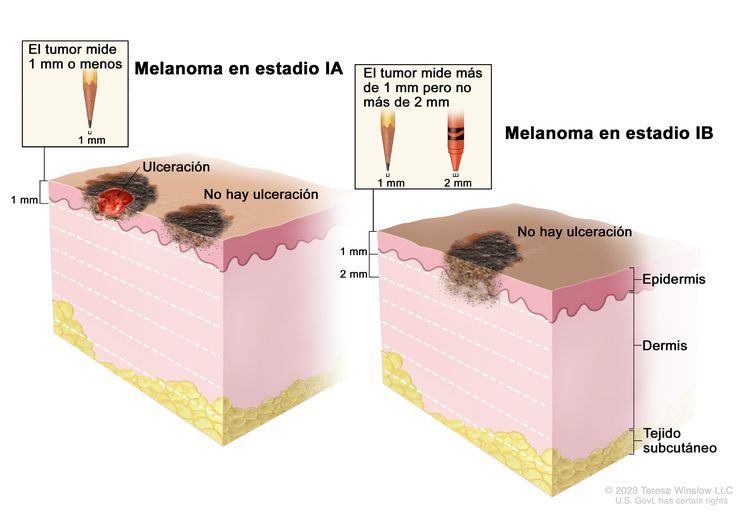 |
| T1b, N0, M0 | T1b = grosor de <0,8 mm, con ulceración; grosor de 0,8–1,0 mm, con ulceración o sin esta. | ||||
| IB | T2a, N0, M0 | T2a = grosor de >1,0–2,0 mm, sin ulceración. | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. | |
| Estadio | TNM | Categoría T (grosor y estado de ulceración) | Categoría N (número de ganglios linfáticos regionales comprometidos, presencia de metástasis en tránsito y de metástasis satélites o microsatélites) | Categoría M (sitio anatómico y concentración de LDH) | Imagen |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; LDH = lactato-deshidrogenasa; p = patológica. | |||||
| aAdaptación de AJCC: Melanoma of the Skin. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 563–85. | |||||
| IIA | T2b, N0, M0 | T2b = grosor de >1,0–2,0 mm, con ulceración. | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. |
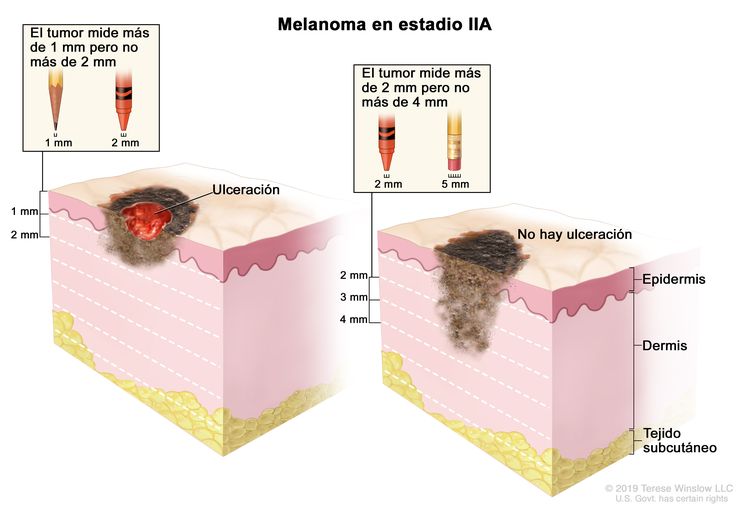 |
| T3a, N0, M0 | T3a = grosor de >2,0–4,0 mm, sin ulceración. | ||||
| IIB | T3b, N0, M0 | T3b = grosor de >2,0–4,0 mm, con ulceración. | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. |
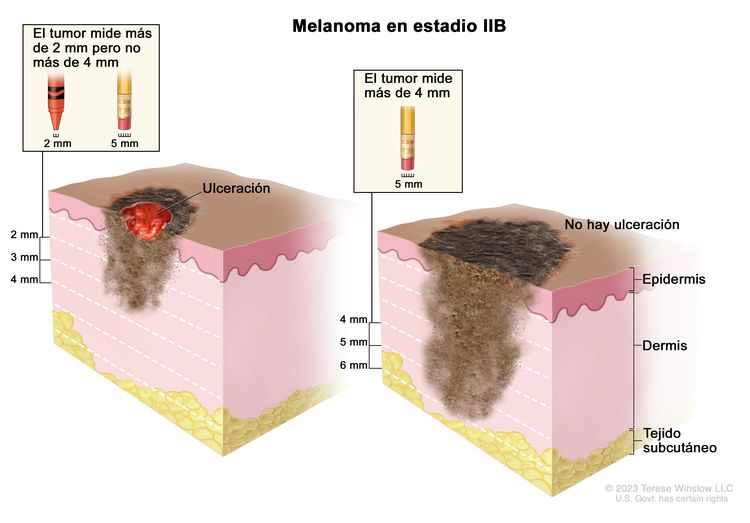 |
| T4a, N0, M0 | T4a = grosor de >4,0 mm, sin ulceración. | ||||
| IIC | T4b, N0, M0 | T4b = grosor de >4,0 mm, con ulceración. | N0 = sin metástasis regionales. | M0 = sin metástasis a distancia. |
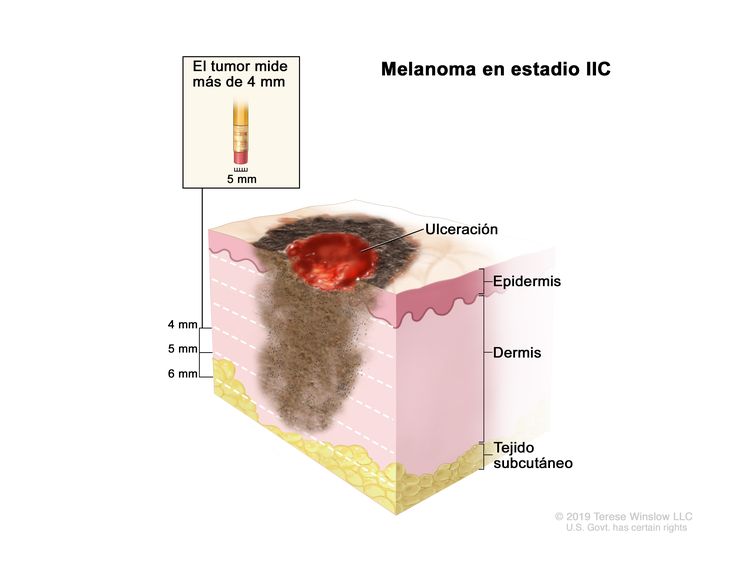 |
| Estadio | TNM | Categoría T (grosor y estado de ulceración) | Categoría N (número de ganglios linfáticos regionales comprometidos, presencia de metástasis en tránsito y de metástasis satélites o microsatélites) | Categoría M (sitio anatómico y concentración de LDH) |
|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; LDH = lactato-deshidrogenasa; p = patológica. | ||||
| aAdaptación de AJCC: Melanoma of the Skin. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 563–85. | ||||
| bMelanoma detectado mediante biopsia de ganglio linfático centinela. | ||||
| cPor ejemplo, melanoma con sitio primario desconocido o regresión completa. | ||||
| dEl grosor y el estado de ulceración no aplican en este caso. | ||||
| IIIA | T1a/b–T2a, N1a o N2a, M0 | T1a = grosor de <0,8 mm, sin ulceración; T1b = grosor de <0,8, con ulceración; grosor de 0,8–1,0 mm con ulceración o sin esta. | N1a = compromiso de 1 ganglio linfático oculto en la evaluación clínicab; sin metástasis en tránsito ni metástasis satélites o microsatélites; o N2a = compromiso de 2 o 3 ganglios linfáticos ocultos en la evaluación clínicab; sin metástasis en tránsito ni metástasis satélites o microsatélites. | M0 = sin metástasis a distancia. |
| T2a = grosor de >1,0–2,0 mm, sin ulceración. | ||||
| IIIB | T0, N1b, N1c, M0 | T0 = sin indicios de tumor primario.c,d | N1b = compromiso de 1 ganglio linfático detectado en la evaluación clínica, sin metástasis en tránsito ni metástasis satélites o microsatélites. | M0 = sin metástasis a distancia. |
| N1c = sin enfermedad ganglionar regional, con metástasis en tránsito y metástasis satélites o microsatélites. | ||||
| T1a/b–T2a, N1b/c o N2b, M0 | T1a = grosor de <0,8 mm, sin ulceración; T1b = grosor de <0,8, con ulceración; grosor de 0,8–1,0 mm con o sin ulceración. | N1b = compromiso de 1 ganglio linfático detectado en la evaluación clínica, sin metástasis en tránsito ni metástasis o microsatélites; N1c = sin enfermedad ganglionar regional, con metástasis en tránsito y metástasis satélites o microsatélites; o | M0 = sin metástasis a distancia. | |
| T2a = grosor de >1,0–2,0 mm, sin ulceración. | ||||
| N2b = compromiso de 2 o 3 ganglios linfáticos (por lo menos uno detectado en la evaluación clínica), sin metástasis en tránsito ni metástasis satélites o microsatélites. | ||||
| T2b/T3a, N1a–N2b, M0 | T2b = grosor de >1,0–2,0 mm, con ulceración; T3a = grosor de >2,0–4,0 mm, sin ulceración. | N1a = compromiso de 1 ganglio linfático oculto en la evaluación clínicab; sin metástasis en tránsito ni metástasis satélites o microsatélites. | M0 = sin metástasis a distancia. | |
| N1b = compromiso de 1 ganglio linfático detectado en la evaluación clínica, sin metástasis en tránsito ni metástasis satélites o microsatélites. | ||||
| N1c = sin enfermedad ganglionar regional, con metástasis en tránsito y metástasis satélites o microsatélites. | ||||
| N2a = compromiso de 2 o 3 ganglios linfáticos ocultos en la evaluación clínicab; sin metástasis en tránsito ni metástasis satélites o microsatélites. | ||||
| N2b = compromiso de 2 o 3 ganglios linfáticos (por lo menos 1 detectado en la evaluación clínica), sin metástasis en tránsito, satélites ni microsatélites. | ||||
| IIIC | T0, N2b, N2c, N3b, o N3c, M0 | T0 = sin indicios de tumor primario.c,d | N2b = compromiso de 2 o 3 ganglios linfáticos (por lo menos uno detectado en la evaluación clínica), sin metástasis en tránsito, satélites ni microsatélites. | M0 = sin metástasis a distancia. |
| N2c = compromiso de 1 ganglio linfático (oculto o detectado en la evaluación clínica) o con metástasis en tránsito y metástasis satélites o microsatélites. | ||||
| N3b = compromiso de 4 o más ganglios linfáticos (por lo menos 1 detectado en la evaluación clínica), o cualquier número de ganglios apelmazados, sin metástasis en tránsito, ni metástasis satélites o microsatélites; o. | ||||
| N3c = compromiso de 2 o más ganglios linfáticos (ocultos o detectados en la evaluación clínica), cualquier número de ganglios apelmazados o con metástasis en tránsito y metástasis satélites o microsatélites. | ||||
| T1a–T3a, N2c o N3a/b/c, M0 | T1a = grosor de <0,8 mm, sin ulceración; T1b = grosor de <0,8, con ulceración; grosor de 0,8–1,0 mm con ulceración o sin esta. | N2c = compromiso de 1 ganglio linfático (oculto o detectado en la evaluación clínica) o con metástasis en tránsito y metástasis satélites o microsatélites; o. | M0 = sin metástasis a distancia. | |
| T2a = grosor de >1,0–2,0 mm, sin ulceración. | ||||
| T2b = grosor de >1,0–2,0 mm, con ulceración. | ||||
| N3a = compromiso de 4 o más ganglios linfáticos ocultos en la evaluación clínicab; sin metástasis en tránsito ni metástasis satélites o microsatélites. | ||||
| N3b = compromiso de 4 o más ganglios linfáticos (por lo menos uno detectado en la evaluación clínica), o cualquier número de ganglios apelmazados, sin metástasis en tránsito, ni metástasis satélites o microsatélites. | ||||
| T3a = grosor de >2,0–4,0 mm, sin ulceración. | N3c = compromiso de 2 o más ganglios linfáticos (ocultos o detectados en la evaluación clínica), cualquier número de ganglios apelmazados o con metástasis en tránsito y metástasis satélites o microsatélites. | |||
| T3b/T4a, cualquier N ≥N1, M0 | T3b = grosor de >2,0–4,0 mm, con ulceración; T4a = grosor de >4,0 mm, sin ulceración. | N1a = compromiso de 1 ganglio linfático oculto en la evaluación clínicab; sin metástasis en tránsito ni metástasis satélites o microsatélites. | M0 = sin metástasis a distancia. | |
| N1b = compromiso de 1 ganglio linfático detectado en la evaluación clínica, sin metástasis en tránsito ni metástasis satélites o microsatélites. | ||||
| N1c = sin enfermedad ganglionar regional, con metástasis en tránsito y metástasis satélites o microsatélites. | ||||
| N2a = compromiso de 2 o 3 ganglios linfáticos ocultos en la evaluación clínicab; sin metástasis en tránsito ni metástasis satélites o microsatélites. | ||||
| N2b = compromiso de 2 o 3 ganglios linfáticos (por lo menos uno detectado en la evaluación clínica), sin metástasis en tránsito, satélites ni microsatélites. | ||||
| N2c = compromiso de 1 ganglio linfático (oculto o detectado en la evaluación clínica) o con metástasis en tránsito y metástasis satélites o microsatélites. | ||||
| N3a = compromiso de 4 o más ganglios linfáticos ocultos en la evaluación clínicab; sin metástasis en tránsito ni metástasis satélites o microsatélites. | ||||
| N3b = compromiso de 4 o más ganglios linfáticos (por lo menos uno detectado en la evaluación clínica), o cualquier número de ganglios apelmazados, sin metástasis en tránsito, ni metástasis satélites o microsatélites. | ||||
| N3c = compromiso de 2 o más ganglios linfáticos (ocultos o detectados en la evaluación clínica), cualquier número de ganglios apelmazados o con metástasis en tránsito y metástasis satélites o microsatélites. | ||||
| T4b, N1a–N2c, M0 | T4b = grosor de >4,0 mm, con ulceración. | N1a = compromiso de 1 ganglio linfático oculto en la evaluación clínicab; sin metástasis en tránsito ni metástasis satélites o microsatélites. | M0 = sin metástasis a distancia. | |
| N1b = compromiso de 1 ganglio linfático detectado en la evaluación clínica, sin metástasis en tránsito ni metástasis satélites o microsatélites. | ||||
| N1c = sin enfermedad ganglionar regional, con metástasis en tránsito y metástasis satélites o microsatélites. | ||||
| N2a = compromiso de 2 o 3 ganglios linfáticos ocultos en la evaluación clínicab; sin metástasis en tránsito ni metástasis satélites o microsatélites. | ||||
| N2b = compromiso de 2 o 3 ganglios linfáticos (por lo menos uno detectado en la evaluación clínica), sin metástasis en tránsito, satélites ni microsatélites. | ||||
| N2c = compromiso de 1 ganglio linfático (oculto o detectado en la evaluación clínica) o con metástasis en tránsito y metástasis satélites o microsatélites. | ||||
| IIID | T4b, N3a/b/c, M0 | T4b = grosor de >4,0 mm, con ulceración. | N3a = compromiso de 4 o más ganglios linfáticos ocultos en la evaluación clínicab; sin metástasis en tránsito ni metástasis satélites o microsatélites. | M0 = sin metástasis a distancia. |
| N3b = compromiso de 4 o más ganglios linfáticos (por lo menos uno detectado en la evaluación clínica), o cualquier número de ganglios apelmazados, sin metástasis en tránsito, ni metástasis satélites o microsatélites. | ||||
| N3c = compromiso de 2 o más ganglios linfáticos (ocultos o detectados en la evaluación clínica), cualquier número de ganglios apelmazados o con metástasis en tránsito y metástasis satélites o microsatélites. | ||||
| Estadio | TNM | Categoría T (grosor y estado de ulceración) | Categoría N (número de ganglios linfáticos regionales comprometidos, presencia de metástasis en tránsito y de metástasis satélites o microsatélites) | Categoría M (sitio anatómico y concentración de LDH) | Imagen |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; cN = N clínica; LDH = lactato-deshidrogenasa; p = patológica. | |||||
| aAdaptación de AJCC: Melanoma of the Skin. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 563–85. | |||||
| bPor ejemplo, no se hizo biopsia de ganglio linfático centinela o se extirparon antes los ganglios linfáticos regionales. (Excepción: la categoría N patológica no se necesita para los melanomas T1, en ese caso se usa cN). | |||||
| cNo se necesita una evaluación patológica de los ganglios linfáticos para completar la estadificación patológica del estadio 0 (melanoma in situ) y del estadio T1; se usa la información de cN para asignar el estadio patológico. | |||||
| dEl grosor y el estado de ulceración no aplican en este caso. | |||||
| IV | Cualquier T, cualquier N, M1 | Cualquier T = consultar las descripciones en el Cuadro 6 | NX = ganglios linfáticos regionales no evaluables;d N0 = sin metástasis regionales; ≥N1 = consultar la descripción en el Cuadro 6 | M1 = metástasis a distancia. |
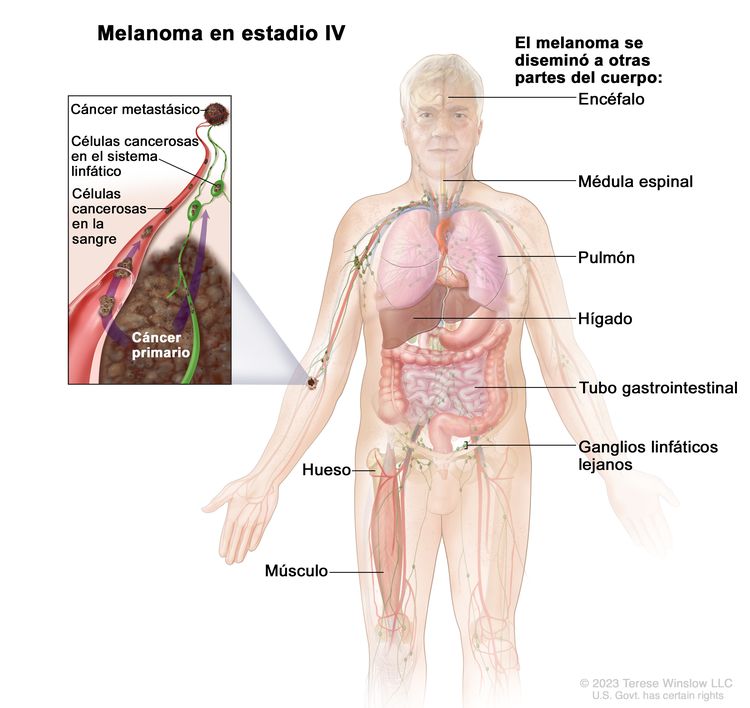 |
| Tis = melanoma in situ.b,c | –M1a = metástasis a distancia en la piel, el tejido blando (incluso músculo) o los ganglios linfáticos regionales [M1a(0) = LDH normal; M1a(1) = LDH alta]. | ||||
| –M1b = metástasis a distancia en el pulmón, con metástasis o sin esta en los mismos sitios descritos en M1a [M1b(0) = LDH normal; M1b(1) = LDH alta]. | |||||
| –M1c = metástasis a distancia viscerales sin compromiso del SNC, con o sin metástasis en los mismos sitios descritos en M1a o M1b [M1c(0) = LDH normal o M1c(1) = LDH alta]. | |||||
| –M1d = metástasis a distancia en el SNC, con metástasis o sin esta en los mismos sitios descritos en M1a, M1b o M1c [M1d(0) = LDH normal; M1d(1) = LDH alta]. | |||||
Bibliografía
- Melanoma of the Skin. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 563–85.
Aspectos generales de las opciones de tratamiento del melanoma
| Estadio (criterios de estadificación TNM) | Opciones de tratamiento estándara |
|---|---|
| aLos ensayos clínicos son una opción importante para los pacientes de melanoma en cualquier estadio porque una mejor comprensión de las vías moleculares y biológicas anómalas acelera el descubrimiento de los fármacos. Las opciones de tratamiento estándar están disponibles en muchos ensayos clínicos. Para obtener más información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI. | |
| Melanoma en estadio 0 | Escisión |
| Melanoma en estadio I | Escisión con tratamiento ganglionar o sin este |
| Melanoma en estadio II | Escisión con tratamiento ganglionar o sin este |
| Melanoma en estadio III resecable | Escisión con tratamiento ganglionar o sin este |
| Melanoma en estadio III irresecable, en estadio IV y recidivante | Terapia intralesional |
| Inmunoterapia | |
| Inhibidores de la transducción de señales | |
| Quimioterapia | |
| Terapia paliativa local | |
Escisión
La escisión quirúrgica continúa siendo la principal modalidad de tratamiento del melanoma. Los melanomas cutáneos sin diseminación fuera del sitio primario tienen probabilidades altas de curación. El tratamiento del melanoma localizado es la escisión quirúrgica con márgenes proporcionales al microestadio de la lesión primaria.
Tratamiento ganglionar
Biopsia de ganglio linfático centinela
El mapeo linfático y la biopsia de ganglio linfático centinela (BGLC) sirven para detectar metástasis ocultas en los ganglios linfáticos regionales de pacientes con tumores primarios que miden más de 1 a 4 mm; es posible que estos procedimientos permitan identificar a pacientes que pueden evitar las complicaciones relacionadas con la disección de ganglios linfáticos regionales y que quizás se beneficien de la terapia adyuvante.[1-6]
El mapeo linfático y la extracción del ganglio linfático centinela (GLC) se deben llevar a cabo antes de la extirpación amplia del melanoma primario a fin de asegurar la identificación exacta del ganglio linfático centinela.
En múltiples estudios, se demostró la exactitud diagnóstica de la BGLC, con tasas de resultados negativos falsos del 0 % al 2 %.[1,6-11] Si se detecta melanoma metastásico, es posible hacer una linfadenectomía regional completa durante un procedimiento posterior.
Disección ganglionar completa
Los pacientes que tienen compromiso micro o macroscópico de uno o más ganglios linfáticos centinelas son aptos para someterse a disección ganglionar completa para lograr control regional, o para presentarse en el estudio Multicenter Selective Lymphadenectomy Trial II (NCT00297895), en el que se determinará si la disección ganglionar completa afecta la supervivencia. La BGLC debe preceder a la extirpación amplia del melanoma primario para asegurar la exactitud del mapeo linfático.
Terapia adyuvante
Cada vez son más las opciones de terapia adyuvante para pacientes en riesgo alto de recidiva después de la resección completa, estas opciones abarcan los inhibidores de puntos de control inmunitario y los inhibidores de la transducción de señales. El ipilimumab fue el primer inhibidor de puntos de control que la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó como terapia adyuvante, se demostró que este medicamento mejoró la supervivencia general (SG) en dosis de 10 mg/kg (ipi10) cuando se comparó con un placebo (EORTC 18071 [NCT00636168]).[12] Sin embargo, la dosis de ipi10 produjo una toxicidad significativa. En el North American Intergroup Trial E1609 (NCT01274338), diseñado con 3 grupos de tratamiento, se comparó la dosis de ipi10 con una dosis más baja de ipilimumab de 3 mg/kg (ipi3) (aprobada para el melanoma metastásico) y con el uso de dosis altas de interferón. La dosis de ipi3 produjo mejora significativa de la SG mientras que la dosis de ipi10 no produjo cambios.[13] Estos datos invalidan el uso de dosis altas de interferón como tratamiento adyuvante para el melanoma. A medida que surgen nuevos inhibidores de puntos de control, la función de la dosis de ipi3 queda por definirse aún más.
En ensayos aleatorizados grandes del uso de nuevos inhibidores de puntos de control (nivolumab y pembrolizumab) y de la combinación de estos con inhibidores de la transducción de señales (dabrafenib y trametinib) se demostró un efecto clínico significativo en la supervivencia sin recidiva (SSR). En el ensayo CheckMate 238 (NCT02388906) se comparó el uso de nivolumab y el uso de la dosis de ipi10, y se encontró que el nivolumab fue superior en términos de la SSR, y su perfil de inocuidad fue más tolerable.[14] El pembrolizumab fue superior al placebo en cuanto a la SSR, y los datos de la SG todavía no son definitivos en el ensayo MK-3475-054/KEYNOTE-054 (NCT02362594).[15] El uso de dabrafenib con trametinib fue superior al placebo en cuanto a la SSR, y los datos de la SG todavía no son definitivos en el ensayo COMBI-AD (NCT01682083).[16] En el ensayo BRIM8 (NCT01667419), el tratamiento con un inhibidor de BRAF y vemurafenib no mejoró la SSR cuando se comparó con un placebo.[17]
Se han observado beneficios de la inmunoterapia con ipilimumab, nivolumab y pembrolizumab con independencia de la expresión del ligando de la proteína de muerte programada 1 (PD-L1) o la presencia de mutaciones en BRAF. Otra opción para los pacientes con mutaciones en BRAF es la terapia combinada con inhibidores de la transducción de señales.
La participación en ensayos clínicos destinados a identificar tratamientos que prolonguen aún más la SSR y la SG con menos efectos tóxicos es una opción importante para todos los pacientes.
Perfusión de extremidades
En un ensayo aleatorizado, multicéntrico, de fase III (SWOG-8593), que ya se completó con pacientes que tenían melanoma primario de extremidad en estadio I de riesgo alto, no se observó beneficio para la supervivencia sin enfermedad o la SG cuando se usó la perfusión de un miembro aislado con melfalán y se comparó con cirugía sola.[5]
Tratamiento sistemático de la enfermedad en estadio III irresecable, en estadio IV y recidivante
Si bien el melanoma con diseminación a sitios distantes casi nunca es curable, hay una rápida expansión de las opciones de tratamiento. Se ha comprobado en ensayos aleatorizados que la inhibición de puntos de control y la modulación de la vía de la proteína cinasa activada por mitógenos son dos abordajes que mejoran la SG. Debido al descubrimiento rápido de nuevos fármacos y combinaciones, se promueve que pacientes y médicos consideren la participación en un ensayo clínico para el tratamiento inicial y en el momento de la progresión.
Inmunoterapia
Inhibidores de puntos de control
La FDA aprobó tres inhibidores de puntos de control: pembrolizumab, nivolumab e ipilimumab. Cada uno de estos demostró la capacidad de mejorar la SG cuando se comparan con diferentes tratamientos para la enfermedad irresecable o avanzada. Para obtener más información, consultar las secciones Pembrolizumab, Nivolumab e Ipilimumab. Están en curso múltiples ensayos de fase III para determinar la secuencia óptima de las inmunoterapias y la inmunoterapia con terapia dirigida, y para establecer si las combinaciones de inmunoterapias o de inmunoterapia con terapia dirigida son mejores para prolongar la SG.
Interleucina-2
En 1998, la FDA aprobó la interleucina-2 (IL-2) porque se encontraron tasas de respuesta completa (RC) duradera en una minoría de pacientes (6–7 %) de melanoma metastásico que recibieron tratamiento previo en 8 estudios de fase I y II. No se han realizado estudios de fase III en los que se compare el uso de dosis altas de IL-2 con otros tratamientos o se evalúe el efecto relativo en la SG.
Inhibición doble de puntos de control
La combinación de las inmunoterapias de anticuerpos contra la proteína de muerte celular programada 1 (PD-1) y contra el antígeno 4 del linfocito T citotóxico (CTLA-4) (nivolumab e ipilimumab) ha mostrado la prolongación de la supervivencia sin progresión (SSP) y la SG en comparación con el ipilimumab en monoterapia, sin embargo esta combinación se asocia con una toxicidad significativa.
Inhibidores de la transducción de señales
Hasta la fecha, en los estudios se indica que los inhibidores de BRAF y los inhibidores de MEK quizás tengan un efecto significativo en la evolución natural del melanoma, aunque no sean curativos en monoterapia. Dos regímenes combinados de inhibidores de BRAF y MEK demostraron mejorar la SSP y la SG en comparación con los inhibidores de BRAF en monoterapia.
Inhibidores de BRAF
Vemurafenib
El vemurafenib, aprobado por la FDA en 2011, demostró mejorar la SSP y la SG en pacientes con enfermedad irresecable o avanzada. El vemurafenib es un fármaco micromolecular de uso oral que causa inhibición selectiva de la cinasa BRAF, que se indica solo para los pacientes con la mutación V600E en BRAF identificada mediante una prueba aprobada por la FDA.[11]
Dabrafenib
El dabrafenib en un fármaco micromolecular de uso oral que causa inhibición selectiva de BRAF que fue aprobado por la FDA en 2013 y demostró mejorar la SSP cuando se comparó con la dacarbazina en un ensayo multicéntrico internacional (BREAK-3 [NCT01227889]).
Inhibidores de MEK
Trametinib
El trametinib es un fármaco micromolecular de uso oral que causa inhibición selectiva de MEK1 y MEK2, fue aprobado por la FDA en 2013 para pacientes con melanoma irresecable o melanoma metastásico con una mutación V600E o V600K en BRAF. El trametinib demostró mejorar la SSP cuando se comparó con la dacarbazina.
Cobimetinib
El cobimetinib es un fármaco micromolecular de uso oral que causa inhibición selectiva de MEK, fue aprobado por la FDA en 2015 para su uso en combinación con el inhibidor de BRAF, vemurafenib. Para obtener más información, consultar la sección Terapia combinada de inhibición de la transducción de señales.
Inhibidores de c-KIT
Los datos preliminares indican que los melanomas mucosos o acrales que tienen mutaciones activadoras o amplificaciones en c-KIT quizás sean sensibles a una variedad de inhibidores de c-KIT.[18-20] Se dispone de ensayos de fase II y III para pacientes con melanoma irresecable en estadio III o estadio IV que albergan una mutación en c-KIT.
Terapia combinada de inhibición de la transducción de señales
La FDA aprobó dos regímenes combinados, dabrafenib con trametinib y vemurafenib con cobimetinib, a partir de la mejora en SSP y SG cuando se compararon con un inhibidor de BRAF en monoterapia (dabrafenib o vemurafenib) en pacientes con melanomas irresecables o metastásicos que albergan una mutación V600E o V600K en BRAF identificada mediante una prueba aprobada por la FDA.
Terapia combinada con inhibidores de la transducción de señales y terapia anti-PD-L1
El régimen triple de cobimetinib (inhibidor de MEK), vemurafenib (inhibidor de la cinasa BRAF) y atezolizumab (inhibidor de PD-L1) mostró una mejora de la SSP en comparación con la combinación de cobimetinib y vemurafenib. [21]
Quimioterapia
Dacarbazina
La dacarbazina se aprobó en 1970 a partir de las tasas de respuesta general. En ensayos de fase III la tasa de respuesta general fue del 10 % al 20 % y la RC fue escasa. En ensayos aleatorizados no se ha demostrado efecto en la SG.[22-25] La dacarbazina no afectó la SG cuando se usó en el grupo de control de los ensayos recientes para el registro de ipilimumab y vemurafenib en pacientes con melanoma metastásico que no se trataron antes.
Temozolomida
En un ensayo de fase III, cuyo criterio principal de valoración fue la SG, se observaron efectos similares para la temozolomida, un alquilante oral, y la dacarbazina intravenosa; sin embargo, el ensayo se diseñó para demostrar la superioridad de la temozolomida, lo que no se logró, y el tamaño de la muestra no fue suficiente para usar las pruebas estadísticas de ausencia de inferioridad.[23]
Terapia paliativa local
Es posible que la linfadenectomía regional sirva para la paliación de un melanoma con metástasis a distancia en áreas ganglionares. En casos de metástasis aisladas en el pulmón, el tubo gastrointestinal, los huesos y, a veces, metástasis encefálicas, la resección es paliativa y en ocasiones se produce supervivencia a largo plazo.[14,26,27]
Bibliografía
- Shen P, Wanek LA, Morton DL: Is adjuvant radiotherapy necessary after positive lymph node dissection in head and neck melanomas? Ann Surg Oncol 7 (8): 554-9; discussion 560-1, 2000. [PUBMED Abstract]
- Hochwald SN, Coit DG: Role of elective lymph node dissection in melanoma. Semin Surg Oncol 14 (4): 276-82, 1998. [PUBMED Abstract]
- Wagner JD, Gordon MS, Chuang TY, et al.: Current therapy of cutaneous melanoma. Plast Reconstr Surg 105 (5): 1774-99; quiz 1800-1, 2000. [PUBMED Abstract]
- Cascinelli N, Morabito A, Santinami M, et al.: Immediate or delayed dissection of regional nodes in patients with melanoma of the trunk: a randomised trial. WHO Melanoma Programme. Lancet 351 (9105): 793-6, 1998. [PUBMED Abstract]
- Koops HS, Vaglini M, Suciu S, et al.: Prophylactic isolated limb perfusion for localized, high-risk limb melanoma: results of a multicenter randomized phase III trial. European Organization for Research and Treatment of Cancer Malignant Melanoma Cooperative Group Protocol 18832, the World Health Organization Melanoma Program Trial 15, and the North American Perfusion Group Southwest Oncology Group-8593. J Clin Oncol 16 (9): 2906-12, 1998. [PUBMED Abstract]
- Wong SL, Balch CM, Hurley P, et al.: Sentinel lymph node biopsy for melanoma: American Society of Clinical Oncology and Society of Surgical Oncology joint clinical practice guideline. J Clin Oncol 30 (23): 2912-8, 2012. [PUBMED Abstract]
- Kirkwood JM, Strawderman MH, Ernstoff MS, et al.: Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684. J Clin Oncol 14 (1): 7-17, 1996. [PUBMED Abstract]
- Kirkwood JM, Ibrahim JG, Sondak VK, et al.: High- and low-dose interferon alfa-2b in high-risk melanoma: first analysis of intergroup trial E1690/S9111/C9190. J Clin Oncol 18 (12): 2444-58, 2000. [PUBMED Abstract]
- Eggermont AM, Suciu S, Santinami M, et al.: Adjuvant therapy with pegylated interferon alfa-2b versus observation alone in resected stage III melanoma: final results of EORTC 18991, a randomised phase III trial. Lancet 372 (9633): 117-26, 2008. [PUBMED Abstract]
- Hancock BW, Wheatley K, Harris S, et al.: Adjuvant interferon in high-risk melanoma: the AIM HIGH Study--United Kingdom Coordinating Committee on Cancer Research randomized study of adjuvant low-dose extended-duration interferon Alfa-2a in high-risk resected malignant melanoma. J Clin Oncol 22 (1): 53-61, 2004. [PUBMED Abstract]
- Chapman PB, Hauschild A, Robert C, et al.: Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med 364 (26): 2507-16, 2011. [PUBMED Abstract]
- Eggermont AM, Chiarion-Sileni V, Grob JJ, et al.: Prolonged Survival in Stage III Melanoma with Ipilimumab Adjuvant Therapy. N Engl J Med 375 (19): 1845-1855, 2016. [PUBMED Abstract]
- Tarhini AA, Lee SJ, Hodi FS, et al.: Phase III Study of Adjuvant Ipilimumab (3 or 10 mg/kg) Versus High-Dose Interferon Alfa-2b for Resected High-Risk Melanoma: North American Intergroup E1609. J Clin Oncol 38 (6): 567-575, 2020. [PUBMED Abstract]
- Leo F, Cagini L, Rocmans P, et al.: Lung metastases from melanoma: when is surgical treatment warranted? Br J Cancer 83 (5): 569-72, 2000. [PUBMED Abstract]
- Eggermont AMM, Blank CU, Mandala M, et al.: Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. N Engl J Med 378 (19): 1789-1801, 2018. [PUBMED Abstract]
- Long GV, Hauschild A, Santinami M, et al.: Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma. N Engl J Med 377 (19): 1813-1823, 2017. [PUBMED Abstract]
- Maio M, Lewis K, Demidov L, et al.: Adjuvant vemurafenib in resected, BRAFV600 mutation-positive melanoma (BRIM8): a randomised, double-blind, placebo-controlled, multicentre, phase 3 trial. Lancet Oncol 19 (4): 510-520, 2018. [PUBMED Abstract]
- Hodi FS, Friedlander P, Corless CL, et al.: Major response to imatinib mesylate in KIT-mutated melanoma. J Clin Oncol 26 (12): 2046-51, 2008. [PUBMED Abstract]
- Guo J, Si L, Kong Y, et al.: Phase II, open-label, single-arm trial of imatinib mesylate in patients with metastatic melanoma harboring c-Kit mutation or amplification. J Clin Oncol 29 (21): 2904-9, 2011. [PUBMED Abstract]
- Carvajal RD, Antonescu CR, Wolchok JD, et al.: KIT as a therapeutic target in metastatic melanoma. JAMA 305 (22): 2327-34, 2011. [PUBMED Abstract]
- Gutzmer R, Stroyakovskiy D, Gogas H, et al.: Atezolizumab, vemurafenib, and cobimetinib as first-line treatment for unresectable advanced BRAFV600 mutation-positive melanoma (IMspire150): primary analysis of the randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 395 (10240): 1835-1844, 2020. [PUBMED Abstract]
- Chapman PB, Einhorn LH, Meyers ML, et al.: Phase III multicenter randomized trial of the Dartmouth regimen versus dacarbazine in patients with metastatic melanoma. J Clin Oncol 17 (9): 2745-51, 1999. [PUBMED Abstract]
- Middleton MR, Grob JJ, Aaronson N, et al.: Randomized phase III study of temozolomide versus dacarbazine in the treatment of patients with advanced metastatic malignant melanoma. J Clin Oncol 18 (1): 158-66, 2000. [PUBMED Abstract]
- Avril MF, Aamdal S, Grob JJ, et al.: Fotemustine compared with dacarbazine in patients with disseminated malignant melanoma: a phase III study. J Clin Oncol 22 (6): 1118-25, 2004. [PUBMED Abstract]
- Robert C, Thomas L, Bondarenko I, et al.: Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 364 (26): 2517-26, 2011. [PUBMED Abstract]
- Ollila DW, Hsueh EC, Stern SL, et al.: Metastasectomy for recurrent stage IV melanoma. J Surg Oncol 71 (4): 209-13, 1999. [PUBMED Abstract]
- Gutman H, Hess KR, Kokotsakis JA, et al.: Surgery for abdominal metastases of cutaneous melanoma. World J Surg 25 (6): 750-8, 2001. [PUBMED Abstract]
Tratamiento del melanoma en estadio 0
Opciones de tratamiento estándar del melanoma en estadio 0
La opción de tratamiento estándar del melanoma en estadio 0 es la siguiente:
Escisión
La escisión con márgenes mínimos, pero sin compromiso microscópico, se usa para el tratamiento de pacientes con enfermedad en estadio 0.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Tratamiento del melanoma en estadio I
Opciones de tratamiento estándar del melanoma en estadio I
Las opciones de tratamiento estándar del melanoma en estadio I son las siguientes:
- Escisión con tratamiento ganglionar o sin este.
Escisión
La evidencia indica que es posible tratar las lesiones que miden menos de 2 mm de grosor de manera conservadora con márgenes de escisión radial de 1 cm.
Según el sitio del melanoma, la extirpación ambulatoria es ahora una opción para la mayoría de los pacientes.
Evidencia (escisión):
- En un ensayo aleatorizado, se compararon márgenes estrechos (1 cm) y márgenes amplios (≥3 cm) en pacientes con melanomas con un grosor máximo de 2 mm.[1,2][Nivel de evidencia A1]
- No se observaron diferencias entre los dos grupos en la aparición de enfermedad metastásica, la supervivencia sin enfermedad (SSE) y la supervivencia general (SG).
- En otros dos ensayos aleatorizados, se compararon márgenes de 2 cm y márgenes más amplios (4 o 5 cm).[3,4][Nivel de evidencia A1]
- No se encontraron diferencias estadísticamente significativas en la recidiva local, las metástasis a distancia, ni la SG; la mediana de seguimiento fue de por lo menos 10 años en ambos ensayos.
- En el Intergroup Melanoma Surgical Trial, la reducción de los márgenes de 4 a 2 cm se relacionó con los siguientes resultados:[5][Nivel de evidencia A1]
- Reducción estadísticamente significativa de la necesidad de usar injertos de piel (del 46 % al 11 %; P < 0,001).
- Acortamiento de la estancia hospitalaria.
- En un ensayo aleatorizado multicéntrico de fase III (SWOG-8593) de pacientes con melanoma primario de extremidad en estadio I de riesgo alto, no se observó ningún beneficio en la SSE ni la SG cuando se usó la perfusión de un miembro aislado con melfalán en comparación con la cirugía sola.[6,7]
Tratamiento ganglionar
No se ha probado el beneficio de la disección de ganglios linfáticos regionales programada en los pacientes con melanoma en estadio I.[8]
Es posible identificar la enfermedad ganglionar oculta mediante mapeo linfático y biopsia de ganglio linfático centinela (BGLC) en pacientes con tumores de grosor intermedio o ulcerados. Estos pacientes a veces se benefician con la linfadenectomía regional y la terapia adyuvante.[6,9-11]
Evidencia (linfadenectomía inmediata vs. observación con linfadenectomía diferida):
- En el International Multicenter Selective Lymphadenectomy Trial (MSLT-1 [JWCI-MORD-MSLT-1193]), se incluyó a 1269 pacientes con melanomas primarios de grosor intermedio (definidos en el estudio como de 1,2 a 3,5 mm).[12][Nivel de evidencia A1]
- Al cabo de una mediana de 59,8 meses, no se observó una ventaja en la supervivencia específica por melanoma (criterio principal de valoración) de los pacientes que se asignaron al azar a someterse a escisión amplia y BGLC, seguida de linfadenectomía completa de los ganglios comprometidos versus observación ganglionar y linfadenectomía diferida para recidivas ganglionares posteriores.
- Este ensayo no se diseñó para detectar una diferencia en el efecto de la linfadenectomía en pacientes con compromiso ganglionar microscópico.
- El Sunbelt Melanoma Trial (UAB-9735 [NCT00004196]) fue un ensayo de fase III para determinar los efectos en la SSE y SG de la linfadenectomía con dosis altas de interferón α-2b adyuvante o sin este versus observación en pacientes con metástasis submicroscópica de ganglio linfático centinela (GLC) detectada únicamente mediante una prueba de reacción en cadena de la polimerasa (es decir, resultados negativos en las pruebas histológicas e inmunohistoquímicas).
- No se han notificado los datos de supervivencia de este estudio.
Opciones de tratamiento en evaluación clínica del melanoma en estadio I
Las siguientes son las opciones de tratamiento en evaluación clínica para pacientes con melanoma en estadio I:
- Participación en ensayos clínicos en los que se evalúan nuevas técnicas para detectar la metástasis submicroscópica en el GLC. Debido a la tasa más elevada de fracaso terapéutico en el subgrupo de pacientes con enfermedad ganglionar oculta en estadio clínico I, se han evaluado nuevas técnicas en los ensayos clínicos para detectar la metástasis submicroscópica en el GLC, a fin de identificar a pacientes que se pueden beneficiar de la linfadenectomía regional con terapia adyuvante o sin esta.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Veronesi U, Cascinelli N: Narrow excision (1-cm margin). A safe procedure for thin cutaneous melanoma. Arch Surg 126 (4): 438-41, 1991. [PUBMED Abstract]
- Veronesi U, Cascinelli N, Adamus J, et al.: Thin stage I primary cutaneous malignant melanoma. Comparison of excision with margins of 1 or 3 cm. N Engl J Med 318 (18): 1159-62, 1988. [PUBMED Abstract]
- Cohn-Cedermark G, Rutqvist LE, Andersson R, et al.: Long term results of a randomized study by the Swedish Melanoma Study Group on 2-cm versus 5-cm resection margins for patients with cutaneous melanoma with a tumor thickness of 0.8-2.0 mm. Cancer 89 (7): 1495-501, 2000. [PUBMED Abstract]
- Balch CM, Soong SJ, Smith T, et al.: Long-term results of a prospective surgical trial comparing 2 cm vs. 4 cm excision margins for 740 patients with 1-4 mm melanomas. Ann Surg Oncol 8 (2): 101-8, 2001. [PUBMED Abstract]
- Balch CM, Urist MM, Karakousis CP, et al.: Efficacy of 2-cm surgical margins for intermediate-thickness melanomas (1 to 4 mm). Results of a multi-institutional randomized surgical trial. Ann Surg 218 (3): 262-7; discussion 267-9, 1993. [PUBMED Abstract]
- Essner R, Conforti A, Kelley MC, et al.: Efficacy of lymphatic mapping, sentinel lymphadenectomy, and selective complete lymph node dissection as a therapeutic procedure for early-stage melanoma. Ann Surg Oncol 6 (5): 442-9, 1999 Jul-Aug. [PUBMED Abstract]
- Koops HS, Vaglini M, Suciu S, et al.: Prophylactic isolated limb perfusion for localized, high-risk limb melanoma: results of a multicenter randomized phase III trial. European Organization for Research and Treatment of Cancer Malignant Melanoma Cooperative Group Protocol 18832, the World Health Organization Melanoma Program Trial 15, and the North American Perfusion Group Southwest Oncology Group-8593. J Clin Oncol 16 (9): 2906-12, 1998. [PUBMED Abstract]
- Hochwald SN, Coit DG: Role of elective lymph node dissection in melanoma. Semin Surg Oncol 14 (4): 276-82, 1998. [PUBMED Abstract]
- Gershenwald JE, Thompson W, Mansfield PF, et al.: Multi-institutional melanoma lymphatic mapping experience: the prognostic value of sentinel lymph node status in 612 stage I or II melanoma patients. J Clin Oncol 17 (3): 976-83, 1999. [PUBMED Abstract]
- Mraz-Gernhard S, Sagebiel RW, Kashani-Sabet M, et al.: Prediction of sentinel lymph node micrometastasis by histological features in primary cutaneous malignant melanoma. Arch Dermatol 134 (8): 983-7, 1998. [PUBMED Abstract]
- Morton DL, Thompson JF, Cochran AJ, et al.: Sentinel-node biopsy or nodal observation in melanoma. N Engl J Med 355 (13): 1307-17, 2006. [PUBMED Abstract]
- Morton DL, Thompson JF, Cochran AJ, et al.: Final trial report of sentinel-node biopsy versus nodal observation in melanoma. N Engl J Med 370 (7): 599-609, 2014. [PUBMED Abstract]
Tratamiento del melanoma en estadio II
Opciones de tratamiento estándar del melanoma en estadio II
Las opciones de tratamiento estándar del melanoma en estadio II son las siguientes:
- Escisión con tratamiento ganglionar o sin este.
Escisión
Para los melanomas que miden 2 a 4 mm de grosor, los márgenes quirúrgicos deben ser de 2 a 3 cm o menos.
No se dispone de mucha información para guiar el tratamiento de pacientes con melanomas que miden más de 4 mm de grosor; sin embargo, la mayoría de las directrices recomiendan usar márgenes de 3 cm cuando las características anatómicas lo permitan.
Según el sitio del melanoma, la mayoría de los pacientes se pueden someter a escisión ambulatoria.
Evidencia (escisión):
- En el Intergroup Melanoma Surgical Trial Task 2b, se compararon márgenes de 2 versus 4 cm en pacientes con melanomas que miden 1 a 4 mm de grosor.[1]
- Al cabo de una mediana de seguimiento de más de 10 años, no se observó ninguna diferencia significativa en la recidiva local ni en la supervivencia entre ambos grupos.
- Una reducción de los márgenes de 4 a 2 cm se relacionó con los siguientes resultados:
- Reducción estadísticamente significativa de la necesidad de usar injertos de piel (del 46 % al 11 %; P < 0,001).
- Acortamiento de la estancia hospitalaria.
- En un estudio realizado en el Reino Unido, se asignó al azar a pacientes con melanomas que midieron más de 2 mm de grosor a someterse a una escisión con márgenes de 1 o 3 cm.[2]
- Los pacientes que se trataron con márgenes de escisión de 1 cm tuvieron tasas más altas de recidiva regional local (cociente de riesgos instantáneos [CRI], 1,26; intervalo de confianza [IC] 95 %, 1,00–1,59; P = 0,05).
- No se observó diferencia en la supervivencia (CRI, 1,24; IC 95 %, 0,96–1,61; P = 0,1).
- Este estudio indica que es posible que los márgenes de 1 cm no sean suficientes en los pacientes con melanomas que miden más de 2 mm de grosor.
Tratamiento ganglionar
Mapeo linfático y biopsia del ganglio linfático centinela
El mapeo linfático y la biopsia de ganglio linfático centinela (BGLC) se usan para detectar metástasis ocultas en los ganglios linfáticos regionales de los pacientes con enfermedad en estadio II; es posible que estos procedimientos permitan identificar a pacientes que pueden evitar las complicaciones relacionadas con la disección ganglionar regional y que quizás se beneficien de la terapia adyuvante.[3-7]
El mapeo linfático y la extracción del ganglio linfático centinela (GLC) se deben llevar a cabo antes de la extirpación amplia del melanoma primario a fin de asegurar la identificación exacta del ganglio linfático centinela.
Es posible identificar el primer ganglio de la cuenca linfática que drena la lesión mediante el uso de un tinte azul y un radiofármaco que se inyectan en el sitio del tumor primario; luego, el ganglio se extirpa y se examina al microscopio. En múltiples estudios, se demostró la exactitud diagnóstica de la BGLC, con tasas de resultados negativos falsos del 0 % al 2 %.[3,8-12] Si se detecta melanoma metastásico, es posible hacer una linfadenectomía regional completa durante un procedimiento posterior.
Linfadenectomía regional
No se dispone de información publicada de ensayos prospectivos sobre la importancia clínica del melanoma micrometastásico en los ganglios linfáticos regionales. Alguna evidencia indica que entre los pacientes con tumores de grosor intermedio y metástasis oculta, la supervivencia es más prolongada en aquellos que se someten de inmediato a una linfadenectomía regional en comparación con los que difieren este procedimiento hasta que la metástasis ganglionar sea evidente en la evaluación clínica.[13] Este hallazgo se debe considerar con cautela porque proviene de la información de un análisis posterior de subgrupos de un ensayo aleatorizado.
Evidencia (linfadenectomía regional):
- En el International Multicenter Selective Lymphadenectomy Trial (MSLT-1 [JWCI-MORD-MSLT-1193]), se incluyó a 1269 pacientes con melanomas primarios de grosor intermedio (definidos en el estudio como de 1,2 a 3,5 mm).[14][Nivel de evidencia A1]
- Al cabo de una mediana de 59,8 meses, no se observó una ventaja en la supervivencia específica por melanoma (criterio principal de valoración) de los pacientes que se asignaron al azar a someterse a escisión amplia y BGLC, seguida de linfadenectomía completa de los ganglios comprometidos versus observación ganglionar y linfadenectomía diferida para recidivas ganglionares posteriores.
- Este ensayo no se diseñó para detectar una diferencia en el efecto de la linfadenectomía en pacientes con compromiso ganglionar microscópico.
- En otros tres ensayos aleatorizados prospectivos, no se logró demostrar un beneficio en la supervivencia de la disección ganglionar regional profiláctica.[15-17]
Opciones de tratamiento en evaluación clínica del melanoma en estadio II
El tratamiento adyuvante sistémico posquirúrgico no se ha sometido a estudios adecuados en pacientes con enfermedad en estadio II; por lo tanto, la participación en ensayos clínicos es una opción terapéutica importante para los pacientes con riesgo alto de recidiva.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Balch CM, Urist MM, Karakousis CP, et al.: Efficacy of 2-cm surgical margins for intermediate-thickness melanomas (1 to 4 mm). Results of a multi-institutional randomized surgical trial. Ann Surg 218 (3): 262-7; discussion 267-9, 1993. [PUBMED Abstract]
- Thomas JM, Newton-Bishop J, A'Hern R, et al.: Excision margins in high-risk malignant melanoma. N Engl J Med 350 (8): 757-66, 2004. [PUBMED Abstract]
- Gershenwald JE, Thompson W, Mansfield PF, et al.: Multi-institutional melanoma lymphatic mapping experience: the prognostic value of sentinel lymph node status in 612 stage I or II melanoma patients. J Clin Oncol 17 (3): 976-83, 1999. [PUBMED Abstract]
- McMasters KM, Reintgen DS, Ross MI, et al.: Sentinel lymph node biopsy for melanoma: controversy despite widespread agreement. J Clin Oncol 19 (11): 2851-5, 2001. [PUBMED Abstract]
- Cherpelis BS, Haddad F, Messina J, et al.: Sentinel lymph node micrometastasis and other histologic factors that predict outcome in patients with thicker melanomas. J Am Acad Dermatol 44 (5): 762-6, 2001. [PUBMED Abstract]
- Essner R: The role of lymphoscintigraphy and sentinel node mapping in assessing patient risk in melanoma. Semin Oncol 24 (1 Suppl 4): S8-10, 1997. [PUBMED Abstract]
- Chan AD, Morton DL: Sentinel node detection in malignant melanoma. Recent Results Cancer Res 157: 161-77, 2000. [PUBMED Abstract]
- Morton DL, Wen DR, Wong JH, et al.: Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg 127 (4): 392-9, 1992. [PUBMED Abstract]
- Reintgen D, Cruse CW, Wells K, et al.: The orderly progression of melanoma nodal metastases. Ann Surg 220 (6): 759-67, 1994. [PUBMED Abstract]
- Thompson JF, McCarthy WH, Bosch CM, et al.: Sentinel lymph node status as an indicator of the presence of metastatic melanoma in regional lymph nodes. Melanoma Res 5 (4): 255-60, 1995. [PUBMED Abstract]
- Uren RF, Howman-Giles R, Thompson JF, et al.: Lymphoscintigraphy to identify sentinel lymph nodes in patients with melanoma. Melanoma Res 4 (6): 395-9, 1994. [PUBMED Abstract]
- Bostick P, Essner R, Glass E, et al.: Comparison of blue dye and probe-assisted intraoperative lymphatic mapping in melanoma to identify sentinel nodes in 100 lymphatic basins. Arch Surg 134 (1): 43-9, 1999. [PUBMED Abstract]
- Cascinelli N, Morabito A, Santinami M, et al.: Immediate or delayed dissection of regional nodes in patients with melanoma of the trunk: a randomised trial. WHO Melanoma Programme. Lancet 351 (9105): 793-6, 1998. [PUBMED Abstract]
- Morton DL, Thompson JF, Cochran AJ, et al.: Sentinel-node biopsy or nodal observation in melanoma. N Engl J Med 355 (13): 1307-17, 2006. [PUBMED Abstract]
- Veronesi U, Adamus J, Bandiera DC, et al.: Delayed regional lymph node dissection in stage I melanoma of the skin of the lower extremities. Cancer 49 (11): 2420-30, 1982. [PUBMED Abstract]
- Sim FH, Taylor WF, Ivins JC, et al.: A prospective randomized study of the efficacy of routine elective lymphadenectomy in management of malignant melanoma. Preliminary results. Cancer 41 (3): 948-56, 1978. [PUBMED Abstract]
- Balch CM, Soong SJ, Bartolucci AA, et al.: Efficacy of an elective regional lymph node dissection of 1 to 4 mm thick melanomas for patients 60 years of age and younger. Ann Surg 224 (3): 255-63; discussion 263-6, 1996. [PUBMED Abstract]
Tratamiento del melanoma en estadio III resecable
Opciones de tratamiento estándar del melanoma en estadio III resecable
Las opciones de tratamiento estándar del melanoma en estadio III resecable son las siguientes:
- Escisión con tratamiento ganglionar o sin este.
- Terapia adyuvante.
Escisión
Es posible tratar el tumor primario mediante escisión local amplia con márgenes de 1 a 3 cm, según el grosor y el sitio del tumor.[1-7] A veces se necesita usar un injerto de piel para cubrir el defecto resultante.
Tratamiento ganglionar
Biopsia de ganglio linfático centinela
El mapeo linfático y la biopsia de ganglio linfático centinela (BGLC) sirven para detectar metástasis ocultas en los ganglios linfáticos regionales de pacientes con tumores primarios que miden más de 1 a 4 mm; es posible que estos procedimientos permitan identificar a pacientes que pueden evitar las complicaciones relacionadas con la disección de ganglios linfáticos regionales y que quizás se beneficien de la terapia adyuvante.[3,8-12]
El mapeo linfático y la extracción del ganglio linfático centinela (GLC) deben preceder a la extirpación amplia del melanoma primario con el fin de asegurar la identificación exacta del ganglio linfático centinela.
En múltiples estudios, se demostró la exactitud diagnóstica de la BGLC, con tasas de resultados negativos falsos del 0 % al 2 %.[8,12-17] Si se detecta melanoma metastásico, es posible hacer una linfadenectomía regional completa durante un procedimiento posterior.
Disección ganglionar completa
Los pacientes que tienen compromiso micro o macroscópico de uno o más ganglios linfáticos centinelas son aptos para someterse a disección ganglionar completa para lograr control regional, o para presentarse en el estudio Multicenter Selective Lymphadenectomy Trial II (NCT00297895), en el que se determinará si la disección ganglionar completa afecta la supervivencia. La disección ganglionar completa debe preceder la extirpación amplia del melanoma primario para asegurar la exactitud del mapeo linfático.
Terapia adyuvante
Cada vez son más las opciones de terapia adyuvante para pacientes en riesgo alto de recidiva después de la resección completa, estas opciones abarcan los inhibidores de puntos de control inmunitario y los inhibidores de la transducción de señales. El ipilimumab fue el primer inhibidor de puntos de control que la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó como terapia adyuvante, se demostró que este medicamento mejoró la supervivencia general (SG) en dosis de 10 mg/kg (ipi10) cuando se comparó con un placebo (EORTC 18071 [NCT00636168]).[18] Sin embargo, la dosis de ipi10 produjo una toxicidad significativa. En el North American Intergroup Trial E1609 (NCT01274338), diseñado con 3 grupos de tratamiento, se comparó la dosis de ipi10 con una dosis más baja de ipilimumab de 3 mg/kg (ipi3) (aprobada para el melanoma metastásico) y con el uso de dosis altas de interferón. La dosis de ipi3 produjo mejora significativa de la SG mientras que la dosis de ipi10 no produjo cambios.[19] Estos datos invalidan el uso de dosis altas de interferón como tratamiento adyuvante para el melanoma. A medida que surgen nuevos inhibidores de puntos de control, la función de la dosis de ipi3 queda por definirse aún más.
En ensayos aleatorizados grandes del uso de nuevos inhibidores de puntos de control (nivolumab y pembrolizumab) y de la combinación de estos con inhibidores de la transducción de señales (dabrafenib y trametinib) se demostró un efecto clínico significativo en la supervivencia sin recidiva (SSR). En el ensayo CheckMate 238 (NCT02388906) se comparó el uso de nivolumab y el uso de la dosis de ipi10, y se encontró que el nivolumab fue superior en términos de la SSR, y su perfil de inocuidad fue más tolerable.[20] El pembrolizumab fue superior al placebo en cuanto a la SSR, y los datos de la SG todavía no son definitivos en el ensayo MK-3475-054/KEYNOTE-054 (NCT02362594).[21] El uso de dabrafenib con trametinib fue superior al placebo en cuanto a la SSR, y los datos de la SG todavía no son definitivos en el ensayo COMBI-AD (NCT01682083).[22] En el ensayo BRIM8 (NCT01667419), el tratamiento con un inhibidor de BRAF y vemurafenib no mejoró la SSR cuando se comparó con un placebo.[23]
Se han observado beneficios de la inmunoterapia con ipilimumab, nivolumab y pembrolizumab con independencia de la expresión del ligando de la proteína de muerte programada 1 (PD-L1) o la presencia de mutaciones en BRAF. Otra opción para los pacientes con mutaciones en BRAF es la terapia con inhibidores de la transducción de señales combinada con dabrafenib y trametinib.
La participación en ensayos clínicos destinados a identificar tratamientos que prolonguen aún más la SSR y la SG con menos efectos tóxicos y programas de tratamientos más cortos, es una opción importante para todos los pacientes.
Inmunoterapia
Inhibidores de puntos control
Nivolumab
Evidencia (nivolumab):
- En un ensayo aleatorizado con enmascaramiento doble multinacional (CheckMate 238 [NCT02388906]), los pacientes de melanoma en estadios IIIB, IIIC o IV sometidos a resección completa se asignaron al azar (1:1) para recibir nivolumab o ipilimumab.[20][Nivel de evidencia B1] El criterio principal de valoración fue la SSR y se definió como el tiempo transcurrido desde la aleatorización hasta la fecha de la primera recidiva, la presentación de un melanoma primario nuevo o la muerte por cualquier causa. Se excluyeron los pacientes que se sometieron a resección más de 12 semanas antes de la aleatorización, tenían una enfermedad autoinmunitaria, usaban glucocorticoides sistémicos, recibieron antes tratamiento sistémico para melanoma y que obtuvieron un puntaje superior a 1 en el estado funcional (EF) según el Eastern Cooperative Oncology Group (ECOG). El nivolumab se administró en dosis de 3 mg/kg intravenosos cada 2 semanas y el ipilimumab se administró en dosis de 10 mg/kg cada 3 semanas durante 4 dosis y, luego, cada 3 meses durante un máximo de 1 año o hasta la recidiva de la enfermedad, junto con el placebo correspondiente.
Se asignó al azar a 906 pacientes: 453 pacientes a nivolumab y 453 pacientes a ipilimumab. Se equilibraron las características iniciales. Cerca del 81 % de los pacientes tenían enfermedad en estadio III; el 32 %, un melanoma primario ulcerado; el 48 %, enfermedad ganglionar macroscópica; el 62 %, menos del 5 % de expresión de PD-L1; y el 42 % albergaban mutaciones en BRAF.
- El European Organisation for Research and Treatment of Cancer (EORTC) Independent Data Monitoring Committee interrumpió el estudio en el momento del análisis interino especificado en el protocolo, cuando se completó un seguimiento de por lo menos 18 meses para cada paciente, momento en el que se presentaron 360 episodios de SSR. Ningún grupo de tratamiento alcanzó la mediana de SSR. A los 12 meses, la tasa de SSR en los pacientes tratados con nivolumab fue del 70,5 % (intervalo de confianza [IC] 95 %, 66,1–74,0 %) versus el 60,8 % (IC 95 %, 56,0–65,2 %) en los pacientes tratados con ipilimumab. Se notificaron recidivas o muertes en el 34 % (154 de 453) de los pacientes tratados con nivolumab versus el 45,5 % (206 de 453) de los pacientes tratados con ipilimumab (cociente de riesgos instantáneos [CRI] de recidiva o muerte, 0,65; IC 97,56 %, 0,51–0,83; P < 0,001). El análisis de subgrupos favoreció al nivolumab, con independencia de la expresión de PD-L1 o de una mutación V600 en BRAF.
- En los pacientes tratados con nivolumab se presentaron menos efectos adversos (EA), incluso efectos graves de grados 3 a 4, y muertes. Se suspendió la administración de nivolumab en el 9,7 % de los pacientes y la administración de ipilimumab en el 42,6 % de los pacientes debido a EA. Se notificaron 2 muertes relacionadas con el tratamiento en los pacientes del grupo tratado con ipilimumab (aplasia medular y colitis) y no se notificaron muertes entre los pacientes tratados con nivolumab. El perfil de EA fue como el de los efectos tóxicos de los inhibidores de puntos de control observados en el entorno metastásico; los efectos inmunitarios más frecuentes se presentaron en el sistema gastrointestinal, el sistema hepático y la piel. Los EA de grados 3 o 4 se presentaron en el 14 % de los pacientes tratados con nivolumab y en el 46 % de los pacientes tratados con ipilimumab.
- En un análisis actualizado, después de un periodo de seguimiento mínimo de 4 años, se observó una SSR del 51,7 % (IC 95 %, 46,8–56,3 %) en los pacientes que recibieron nivolumab versus el 41,2 % (IC 95 %, 36,4–45,9 %) en los pacientes que recibieron ipilimumab (CRI recaída o muerte, 0,71; IC 95 %, 0,60–0,86; P = 0,0003). La mediana de SG no se alcanzó en ningún grupo.[24]
Pembrolizumab
Evidencia (pembrolizumab):
- En un ensayo aleatorizado con enmascaramiento doble multinacional (MK-3475-054/KEYNOTE-054 [NCT02362594]), los pacientes de melanoma en estadios IIIA, IIIB o IIIC sometidos a resección completa se asignaron al azar (1:1) a recibir pembrolizumab o un placebo.[21][Nivel de evidencia B1] El criterio principal de valoración fue la SSR, definida como el tiempo transcurrido desde la aleatorización hasta la fecha de la primera recidiva o la muerte por cualquier causa. Cuando se documentó una recidiva, los pacientes podían cambiar de grupo o repetir el tratamiento con pembrolizumab. El pembrolizumab se administró en una infusión intravenosa de 200 mg cada 3 semanas hasta completar 18 dosis (cerca de 1 año).
Se asignó al azar a 1019 pacientes: 514 a pembrolizumab y 505 a placebo. Se equilibraron las características iniciales. Cerca del 40 % de los pacientes tenían melanoma primario ulcerado; el 66 %, compromiso ganglionar macroscópico, el 84 %, expresaban PD-L1 (puntaje de melanoma >2 mediante un ensayo de anticuerpos 22C3); y el 44 % albergaban mutaciones en BRAF.
- El EORTC Independent Data Monitoring Committee revisó los resultados desenmascarados en un análisis interino modificado cuando se presentaron 351 episodios (recidivas o muertes). En ese momento se observaron efectos del tratamiento y el análisis interino de la SSR pasó a ser el análisis final.
- En el análisis interino modificado con una mediana de seguimiento de 15 meses, la tasa de SSR a 12 meses fue del 75,4 % (IC 95 %, 71,3–78,9 %) en el grupo de pembrolizumab versus el 61,0 % (IC 95 %, 56,5–65,1 %) en el grupo de placebo.
- En una actualización del criterio principal de valoración de la SSR con una mediana de seguimiento de 3,5 años, se observó una SSR del 59,8 % (IC 95 %, 55,3–64,1 %) en el grupo de pembrolizumab versus el 41,4 % (IC 95 %, 39,2–48,8 %) en el grupo de placebo (CRI, 0,59; IC 95 %, 0,49–0,73).[25]
- El efecto del pembrolizumab se mantuvo con independencia de la expresión positiva o negativa de PD-L1 o de la mutación en BRAF.
- Alrededor del 14 % de los pacientes suspendieron el pembrolizumab debido a un EA. Se consideró que los EA de grados 3, 4 o 5 se relacionaron con el pembrolizumab en el 15 % de los pacientes. Hubo una muerte relacionada con el tratamiento (miositis).
Ipilimumab
Evidencia (ipilimumab):
- En el ensayo sin enmascaramiento de tres grupos del North American Intergroup Trial E1609 (NCT01274338) se comparó el uso de dos dosis diferentes de ipilimumab con dosis altas de interferón como terapia adyuvante para los pacientes con melanoma de riesgo alto.[19] Un grupo de 1670 pacientes con enfermedad resecada (estadios IIIB, IIIC, M1a o M1b según las definiciones del American Joint Committee on Cancer, 7th edition) se asignaron al azar (1:1:1) a recibir ipilimumab 3 mg/kg (ipi3) o ipilimumab 10 mg/kg (ipi10) cada 3 semanas por 4 dosis (inducción), seguido por la administración de la misma dosis cada 12 semanas durante 4 dosis más (mantenimiento), o dosis altas de interferón 20 millones de unidades/m2 al día, 5 días por semana durante 4 semanas (inducción), seguida de la administración de 10 millones de unidades/m2 al día por vía subcutánea en días alternos, 3 días de cada semana durante 48 semanas (mantenimiento).[19][Nivel de evidencia A1]
El ensayo se diseñó con dos criterios de valoración coprimarios, la SSR y la SG, y un análisis jerárquico para evaluar la dosis de ipi3 versus las dosis altas de interferón seguida de la dosis de ipi10 versus dosis altas de interferón. El tiempo transcurrido hasta el primer episodio fue más largo que lo previsto y el diseño se modificó para hacer el análisis final en la fecha límite para los datos según una mediana de seguimiento de 57,4 meses (intervalo, 0,03−86,6 meses).
- La dosis de ipi3 mejoró significativamente la SG en comparación con las dosis altas de interferón (CRI, 0,78; IC repetido 95 %, 0,61−0,99; P = 0,044), pero no la SSR (CRI, 0,85; IC 95 %, 0,66−1,09; P = 0,065).
- La dosis de ipi10 no mejoró de manera significativa la SG ni la SSR en comparación con las dosis altas de interferón (CRI, 0,88; IC 95,6 %, 0,69−1,12 y CRI exploratorio, 0,84; IC 99,4 %, 0,65−1,09, respectivamente).
- Se usaron tratamientos de rescate en el 69,7 % de los pacientes después de la dosis de ipi3, en el 51,6 % de los pacientes después de la dosis de ipi10, y en el 86,2 % de los pacientes después las dosis altas de interferón.
La toxicidad con la dosis de ipi3 fue más baja que para la dosis de ipi10; sin embargo, en ambos grupos se presentaron descontinuaciones relacionadas con el tratamiento y muertes.
- Las descontinuaciones relacionadas con el tratamiento fueron del 34,9 % en el grupo de ipi3 y del 54,1 % en el grupo de ipi10.
- Se presentaron 3 muertes posiblemente relacionadas con el tratamiento en el grupo de ipi3, 5 en el grupo de ipi10 y 2 en el grupo de dosis altas de interferón.
En el estudio se concluyó que la evidencia invalida el uso de las dosis altas de interferón como tratamiento adyuvante para pacientes con melanoma de riesgo alto. Además, los datos de SG son mejores para la dosis de ipi3 en comparación con la dosis de ipi10 y las dosis altas de interferón. La función de ipilimumab como monoterapia adyuvante no está clara porque en el CheckMate 238 se demostró que nivolumab fue superior a la dosis de ipi10 para mejorar la SSR, y los datos de SG todavía no están listos.
- En un ensayo aleatorizado con enmascaramiento doble multinacional (EORTC 18071 [NCT00636168]), los pacientes de melanoma en estadio III sometidos a resección completa se asignaron al azar (1:1) a recibir ipilimumab o un placebo.[26][Nivel de evidencia B1] Se excluyeron los pacientes que tenían metástasis ganglionares de más de 1 mm o metástasis en tránsito, que se sometieron a resección más de 12 semanas antes de la aleatorización, tenían una enfermedad autoinmunitaria, recibían terapia inmunodepresora, recibieron antes tratamiento sistémico para melanoma y que obtuvieron un puntaje de EF de ECOG superior a 1. El ipilimumab se administró en dosis de 10 mg/kg cada 3 semanas durante 4 dosis y, luego, cada 3 meses durante un máximo de 3 años. El criterio principal de valoración fue la SSR, definida por la recidiva o la muerte (independientemente de la causa) evaluada por un comité de revisión independiente.
- Se inscribieron 951 pacientes (475 en el grupo de ipilimumab y 476 en el grupo de placebo). La mediana de edad fue de 51 años y el 94 % de los pacientes tenían un puntaje de EF de 0.
- En el momento de una mediana de seguimiento de 2,7 años, se registraron 528 episodios relacionados con la SSR: 234 en el grupo de ipilimumab (49 %; 220 recidivas, 14 defunciones) y 294 en el grupo de placebo (62 %; 289 recidivas, 5 defunciones). La mediana de SSR fue de 26 meses en el grupo de ipilimumab (IC 95 %, 19–39) versus 17 meses en el grupo de placebo (IC 95 %, 13–22). El CRI fue de 0,75 (IC 95 %, 0,64–0,90; P < 0,002). El efecto del ipilimumab fue uniforme entre los subgrupos.
- Se suspendió la administración de ipilimumab debido a EA en el 52 % de los pacientes. Los pacientes recibieron ipilimumab durante una mediana de 4 dosis; el 36 % de los pacientes del grupo de ipilimumab permanecieron en tratamiento durante más de 6 meses y el 26 %, durante más de 1 año. Se presentaron 5 muertes por efectos adversos farmacológicos: 3 por colitis, 1 por miocarditis y 1 por insuficiencia multiorgánica con síndrome de Guillain-Barré. Los EA más comunes fueron de naturaleza gastrointestinal, hepática, endocrina, entre ellos, exantema, fatiga y cefalea.
Al cabo de una mediana de seguimiento de 5,3 años, se realizó un análisis actualizado.[18]
- La tasa de SSR a 5 años de los pacientes tratados con ipilimumab fue del 40,8 % y de los que recibieron placebo fue de 30,3 % (CRI de recidiva o muerte 0,76; IC 95 %, 0,64–0,89; P< 0,001). La mediana de SSR de los pacientes tratados con ipilimumab fue del 27,6 % y de los que recibieron placebo fue del 17,1 %.
- La tasa de SG a 5 años , un criterio secundario de valoración, de los pacientes tratados con ipilimumab fue del 65,4 % versus el 54,4 % para los pacientes que recibieron placebo (CRI de muerte, 0,72; 95,1 % IC 0,58–0,88; P = 0,001).
Los datos de este ensayo (EORTC 18071), en los que se probó el uso de dosis altas de ipilimumab (10 mg/kg) en comparación con un placebo, sirvieron como fundamento para la aprobación del ipilimumab en el entorno adyuvante. Sin embargo, en el ensayo intergrupal posterior, E1609 (descrito antes), se observaron mejores desenlaces con el uso de dosis bajas de ipilimumab (3 mg/kg), que es la dosis aprobada para la enfermedad metastásica.
Combinación de inhibidores de la transducción de señales
Dabrafenib y trametinib
Evidencia (dabrafenib y trametinib):
- En un ensayo aleatorizado con enmascaramiento doble multicéntrico (COMBI-AD [NCT01682083]), los pacientes de melanoma en estadios IIIA, IIIB o IIIC con mutaciones V600E o V600K en BRAF sometidos a linfadenectomía completa se asignaron al azar (1:1) para recibir dabrafenib y trametinib, o dos comprimidos de placebo idénticos.[22][Nivel de evidencia B1] El criterio principal de valoración fue la SSR definida como el tiempo transcurrido desde el momento de la aleatorización hasta la fecha de la primera recidiva o la muerte por cualquier causa. Se excluyeron los pacientes que se sometieron a resección más de 12 semanas antes de la aleatorización y que tenían un puntaje de EF de ECOG superior a 1. El dabrafenib se administró en dosis de 150 mg 2 veces al día y el trametinib se administró en dosis de 2 mg 1 vez al día (terapia combinada) durante 12 meses si no se presentaba recidiva, efectos tóxicos inaceptables o muerte. Se asignó al azar a 870 pacientes (438 a la terapia combinada y 432 a placebo). Se equilibraron las características iniciales. La mayoría de los pacientes (91 %) albergaban la mutación V600E en comparación con un 9 % que albergaban la mutación V600K. La mayoría de los pacientes (92 %) tenían un puntaje de EF de ECOG de 0.
- En la fecha límite de los datos para el análisis primario, el seguimiento mínimo fue de 2,5 años (mediana, 2,8 años) y todos los pacientes habían completado el tratamiento del ensayo. Se notificó recidiva de la enfermedad en 163 de 438 pacientes (37 %) que recibieron la terapia combinada y en 247 de 432 pacientes (57 %) que recibieron el placebo (CRI de recaída o muerte, 0,47; IC 95 %, 0,39–0,58; P < 0,001). La mediana de SSR no se había alcanzado en el grupo de combinación (IC 95 %, 44,5–no alcanzada) y fue de 16,6 meses (IC 95 %, 12,7–22,1) en el grupo de placebo.
- En el grupo de terapia combinada, el 26 % de los pacientes presentaron un EA que condujo a la interrupción de la terapia; el 38 %, necesitaron reducción de la dosis; y el 66 %, necesitaron interrupción de la dosis. En el grupo de placebo, el 3 % de los pacientes presentaron un EA que condujo a la interrupción de la terapia; el 3 % necesitaron reducción de la dosis; y el 15 %, necesitaron interrupción de la dosis. Se presentaron EA graves en el 36 % de los pacientes sometidos a terapia combinada versus el 10 % de los pacientes del grupo de placebo. Se notificó una muerte por neumonía en el grupo de terapia combinada.
- En un análisis actualizado a los 5 años, después de un periodo de seguimiento mínimo de 59 meses, se observó que la SSR fue superior en los pacientes que recibieron la combinación de dabrafenib y trametinib en comparación con los pacientes que recibieron un placebo, y el 52 % (IC 95 %, 48–58 %) de los pacientes que recibieron la combinación de dabrafenib y trametinib estaban vivos sin recaída versus el 36 % (IC 95 %, 32–41 %) de los pacientes que recibieron placebo (HRde recaída o muerte, 0,51; IC 95 %, 0,42–0,61). Los datos de la SG no son definitivos.[27]
Opciones de tratamiento en evaluación clínica del melanoma en estadio III resecable
Las opciones de tratamiento en evaluación clínica para pacientes con melanoma en estadio III resecable son las siguientes:
- Participación en ensayos de inmunoterapias combinadas, incluso con vacunas.
- Participación en ensayos de terapias adyuvantes dirigidas a una mutación conocida; por ejemplo, en c-KIT.
- Terapias intralesionales.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Veronesi U, Cascinelli N: Narrow excision (1-cm margin). A safe procedure for thin cutaneous melanoma. Arch Surg 126 (4): 438-41, 1991. [PUBMED Abstract]
- Veronesi U, Cascinelli N, Adamus J, et al.: Thin stage I primary cutaneous malignant melanoma. Comparison of excision with margins of 1 or 3 cm. N Engl J Med 318 (18): 1159-62, 1988. [PUBMED Abstract]
- Wagner JD, Gordon MS, Chuang TY, et al.: Current therapy of cutaneous melanoma. Plast Reconstr Surg 105 (5): 1774-99; quiz 1800-1, 2000. [PUBMED Abstract]
- Cohn-Cedermark G, Rutqvist LE, Andersson R, et al.: Long term results of a randomized study by the Swedish Melanoma Study Group on 2-cm versus 5-cm resection margins for patients with cutaneous melanoma with a tumor thickness of 0.8-2.0 mm. Cancer 89 (7): 1495-501, 2000. [PUBMED Abstract]
- Balch CM, Soong SJ, Smith T, et al.: Long-term results of a prospective surgical trial comparing 2 cm vs. 4 cm excision margins for 740 patients with 1-4 mm melanomas. Ann Surg Oncol 8 (2): 101-8, 2001. [PUBMED Abstract]
- Heaton KM, Sussman JJ, Gershenwald JE, et al.: Surgical margins and prognostic factors in patients with thick (>4mm) primary melanoma. Ann Surg Oncol 5 (4): 322-8, 1998. [PUBMED Abstract]
- Balch CM, Urist MM, Karakousis CP, et al.: Efficacy of 2-cm surgical margins for intermediate-thickness melanomas (1 to 4 mm). Results of a multi-institutional randomized surgical trial. Ann Surg 218 (3): 262-7; discussion 267-9, 1993. [PUBMED Abstract]
- Shen P, Wanek LA, Morton DL: Is adjuvant radiotherapy necessary after positive lymph node dissection in head and neck melanomas? Ann Surg Oncol 7 (8): 554-9; discussion 560-1, 2000. [PUBMED Abstract]
- Hochwald SN, Coit DG: Role of elective lymph node dissection in melanoma. Semin Surg Oncol 14 (4): 276-82, 1998. [PUBMED Abstract]
- Cascinelli N, Morabito A, Santinami M, et al.: Immediate or delayed dissection of regional nodes in patients with melanoma of the trunk: a randomised trial. WHO Melanoma Programme. Lancet 351 (9105): 793-6, 1998. [PUBMED Abstract]
- Koops HS, Vaglini M, Suciu S, et al.: Prophylactic isolated limb perfusion for localized, high-risk limb melanoma: results of a multicenter randomized phase III trial. European Organization for Research and Treatment of Cancer Malignant Melanoma Cooperative Group Protocol 18832, the World Health Organization Melanoma Program Trial 15, and the North American Perfusion Group Southwest Oncology Group-8593. J Clin Oncol 16 (9): 2906-12, 1998. [PUBMED Abstract]
- Wong SL, Balch CM, Hurley P, et al.: Sentinel lymph node biopsy for melanoma: American Society of Clinical Oncology and Society of Surgical Oncology joint clinical practice guideline. J Clin Oncol 30 (23): 2912-8, 2012. [PUBMED Abstract]
- Kirkwood JM, Strawderman MH, Ernstoff MS, et al.: Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684. J Clin Oncol 14 (1): 7-17, 1996. [PUBMED Abstract]
- Kirkwood JM, Ibrahim JG, Sondak VK, et al.: High- and low-dose interferon alfa-2b in high-risk melanoma: first analysis of intergroup trial E1690/S9111/C9190. J Clin Oncol 18 (12): 2444-58, 2000. [PUBMED Abstract]
- Eggermont AM, Suciu S, Santinami M, et al.: Adjuvant therapy with pegylated interferon alfa-2b versus observation alone in resected stage III melanoma: final results of EORTC 18991, a randomised phase III trial. Lancet 372 (9633): 117-26, 2008. [PUBMED Abstract]
- Hancock BW, Wheatley K, Harris S, et al.: Adjuvant interferon in high-risk melanoma: the AIM HIGH Study--United Kingdom Coordinating Committee on Cancer Research randomized study of adjuvant low-dose extended-duration interferon Alfa-2a in high-risk resected malignant melanoma. J Clin Oncol 22 (1): 53-61, 2004. [PUBMED Abstract]
- Chapman PB, Hauschild A, Robert C, et al.: Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med 364 (26): 2507-16, 2011. [PUBMED Abstract]
- Eggermont AM, Chiarion-Sileni V, Grob JJ, et al.: Prolonged Survival in Stage III Melanoma with Ipilimumab Adjuvant Therapy. N Engl J Med 375 (19): 1845-1855, 2016. [PUBMED Abstract]
- Tarhini AA, Lee SJ, Hodi FS, et al.: Phase III Study of Adjuvant Ipilimumab (3 or 10 mg/kg) Versus High-Dose Interferon Alfa-2b for Resected High-Risk Melanoma: North American Intergroup E1609. J Clin Oncol 38 (6): 567-575, 2020. [PUBMED Abstract]
- Weber J, Mandala M, Del Vecchio M, et al.: Adjuvant Nivolumab versus Ipilimumab in Resected Stage III or IV Melanoma. N Engl J Med 377 (19): 1824-1835, 2017. [PUBMED Abstract]
- Eggermont AMM, Blank CU, Mandala M, et al.: Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. N Engl J Med 378 (19): 1789-1801, 2018. [PUBMED Abstract]
- Long GV, Hauschild A, Santinami M, et al.: Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma. N Engl J Med 377 (19): 1813-1823, 2017. [PUBMED Abstract]
- Maio M, Lewis K, Demidov L, et al.: Adjuvant vemurafenib in resected, BRAFV600 mutation-positive melanoma (BRIM8): a randomised, double-blind, placebo-controlled, multicentre, phase 3 trial. Lancet Oncol 19 (4): 510-520, 2018. [PUBMED Abstract]
- Ascierto PA, Del Vecchio M, Mandalá M, et al.: Adjuvant nivolumab versus ipilimumab in resected stage IIIB-C and stage IV melanoma (CheckMate 238): 4-year results from a multicentre, double-blind, randomised, controlled, phase 3 trial. Lancet Oncol 21 (11): 1465-1477, 2020. [PUBMED Abstract]
- Eggermont AMM, Blank CU, Mandalà M, et al.: Adjuvant pembrolizumab versus placebo in resected stage III melanoma (EORTC 1325-MG/KEYNOTE-054): distant metastasis-free survival results from a double-blind, randomised, controlled, phase 3 trial. Lancet Oncol 22 (5): 643-654, 2021. [PUBMED Abstract]
- Eggermont AM, Chiarion-Sileni V, Grob JJ, et al.: Adjuvant ipilimumab versus placebo after complete resection of high-risk stage III melanoma (EORTC 18071): a randomised, double-blind, phase 3 trial. Lancet Oncol 16 (5): 522-30, 2015. [PUBMED Abstract]
- Dummer R, Hauschild A, Santinami M, et al.: Five-Year Analysis of Adjuvant Dabrafenib plus Trametinib in Stage III Melanoma. N Engl J Med 383 (12): 1139-1148, 2020. [PUBMED Abstract]
Tratamiento del melanoma en estadio III irresecable, en estadio IV y recidivante
Opciones de tratamiento del melanoma en estadio III irresecable, en estadio IV y recidivante
Las opciones de tratamiento del melanoma en estadio III irresecable, en estadio IV y recidivante son las siguientes:
Hay dos abordajes (inhibición de puntos de control y modulación de la vía de la proteína cinasa activada por mitógenos, MAPK) que han demostrado mejorar la supervivencia sin progresión (SSP) y la supervivencia general (SG) en ensayos aleatorizados. La monoterapia de anticuerpos contra PD-1 (pembrolizumab o nivolumab) demostró mejores resultados de eficacia y mejores perfiles de inocuidad cuando se comparó con el tratamiento en monoterapia de un anticuerpo contra CTLA-4 (ipilimumab) o una quimioterapia elegida por el investigador. La combinación inmunoterapéutica de anticuerpos contra PD-1 y CTLA-4 (nivolumab e ipilimumab) también prolonga la SSP y la SG en comparación con el ipilimumab; sin embargo, la combinación produce efectos tóxicos graves. La eficacia observada con la inmunoterapia es independiente del estado de mutación en BRAF.
Las combinaciones de los inhibidores de BRAF y MEK han mostrado en forma congruente una eficacia superior en comparación con los inhibidores de BRAF en monoterapia. Se observó una mejora de la SSP cuando se añadió un inhibidor de PD-L1 (atezolizumab) a la combinación de los inhibidores de BRAF y MEK (vemurafenib y cobimetinib), sin embargo, los datos de la SG son preliminares. Aún quedan por resolver algunas cuestiones relacionadas con la terapia triple, como la manera en que se compara con la inhibición de puntos de control en monoterapia y si la administración simultánea es superior a la terapia secuencial (NCT02224781).
Se alienta a los pacientes y sus médicos a considerar la participación en un ensayo clínico para el tratamiento inicial y en el momento de la progresión por la rápida formulación de nuevos fármacos o combinaciones terapéuticas y porque hay preguntas pendientes por resolver. Los ensayos clínicos abordan los siguientes aspectos:
- Importancia de la secuenciación de terapias, como inmunoterapia y terapia dirigida.
- Dosis óptimas de inmunoterapia combinada para disminuir los efectos tóxicos y conservar la eficacia.
- Métodos para seleccionar a los pacientes que se beneficiarán con la inmunoterapia combinada versus la monoterapia.
- Función de la expresión de PD-L1 como biomarcador de eficacia.
- Función de la terapia de mantenimiento.
Terapia intralesional
Talimogén laherparepvec
El talimogén laherparepvec (T-VEC) es un virus de herpes simple de tipo 1 (VHS-1) modificado genéticamente para su uso en terapia oncolítica, se aprobó como inyección intralesional local en pacientes con lesiones cutáneas, subcutáneas y ganglionares irresecables en el caso de un melanoma recidivante después de la cirugía inicial. El T-VEC se diseñó para que se replique dentro de los tumores, cause lisis y produzca el factor estimulante de colonias de granulocitos y macrófagos (GM-CSF). La liberación de antígenos junto con el GM-CSF derivado del virus tal vez induzca una respuesta inmunitaria antitumoral; sin embargo, no se conoce el mecanismo de acción exacto.
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el T-VEC a partir de datos que demostraron reducción del tamaño de las lesiones; no obstante, no se observó mejora de la SG, efecto en las metástasis viscerales ni mejora de la calidad de vida.
Evidencia (T-VEC):
- En un ensayo aleatorizado sin anonimato multicéntrico (NCT00769704), 436 pacientes se asignaron al azar en una proporción 2:1 a recibir T-VEC intralesional o GM-CSF subcutáneo durante por lo menos 6 meses o hasta que desaparecieran las lesiones que se podían inyectar.[1][Nivel de evidencia B3] Los pacientes aptos para participar tenían melanomas en estadios IIIB, IIIC y IV con lesiones irresecables que se podían medir en dos dimensiones. El criterio principal de valoración fue la tasa de respuesta duradera (TRD) (respuesta completa [RC] o respuesta parcial [RP] de >6 meses) según la evaluación de una revisión independiente. El estudio se estratificó según el sitio de la primera recidiva, la presencia de metástasis hepáticas, el estadio de la enfermedad y el tratamiento sistémico no adyuvante previo.
- La mediana de edad de los pacientes fue de 63 años (intervalo 22–94 años); el 70 % de los pacientes tenían un puntaje inicial de 0 para el estado funcional (EF) del Eastern Cooperative Oncology Group (ECOG), el 30 % tenían una enfermedad en estadio III y el 70 % una enfermedad en estadio IV (27 % M1a, 21 % M1b y 22 % M1c). De los pacientes, el 53 % habían recibido tratamiento anterior para el melanoma.
- Solo la primera dosis se administró con 106 unidades formadoras de placas (ufp)/ml hasta un máximo de 4 ml para todas las lesiones combinadas. Las dosis posteriores se administraron con 8 ufp/ml hasta 4,0 ml para todas las lesiones inyectadas combinadas, y se determinó el volumen inyectado según el tamaño de cada lesión. No se permitieron inyecciones en lesiones viscerales.
- De los pacientes tratados con T-VEC, el 16 % (intervalo de confianza [IC] 95 %, 12,0–20,5 %) tuvieron una TRD versus el 2 % (IC 95 %, 0–4,5 %) de los pacientes tratados con GM-CSF. El análisis de subgrupos indica que las diferencias en las TRD entre T-VEC y GM-CSF son más altas para los pacientes con enfermedad en estadio temprano y enfermedad sin tratamiento previo. Las TRD de los pacientes del grupo de T-VEC en comparación con los pacientes del grupo de GM-CSF, según el estadio de la enfermedad fueron las siguientes; el 33 % versus el 0 %, para la enfermedad en estadios IIIB y IIIC; el 16 % versus el 2 %, para la enfermedad en estadio IV M1a; el 3 % versus el 4 %, para la enfermedad en estadio IV M1b; y el 8 % versus el 3 %, para la enfermedad en estadio IV M1c. Los pacientes tratados con T-VEC o GM-CSF como terapia de primera línea tuvieron una TRD del 24 % versus el 0 %; sin embargo, los pacientes que recibieron el tratamiento como terapia de segunda línea o posterior tuvieron una TRD del 10 % versus el 4 %.
- La mediana de duración de la exposición a T-VEC fue de 23 semanas (5,3 meses); 26 pacientes estuvieron expuestos durante más de 1 año. Los efectos adversos (EA) más comunes en el grupo de T-VEC fueron fatiga (50 %), escalofríos (49 %), pirexia (43 %), náuseas (36 %), enfermedad parecida a la gripe (30 %) y dolor en el sitio de la inyección. La tasa de interrupción del tratamiento debida a los efectos tóxicos de T-VEC fue del 4 % versus el 2 % en el grupo de GM-CSF. De las 10 muertes de pacientes tratados con T-VEC, 8 se consideraron debidas a PD-1, salmonelosis o infarto de miocardio; ninguna se consideró relacionada con el tratamiento según los hallazgos del investigador.
Precauciones: el T-VEC es un VHS vivo atenuado que puede causar una infección herpética diseminada potencialmente mortal. Es de uso contraindicado para pacientes con inmunodeficiencia o embarazadas. Los proveedores de atención de la salud y las personas en contacto cercano deben evitar el contacto directo con las lesiones inyectadas. En la ficha técnica se proporcionan las precauciones de riesgo biológico que se deben tomar para la preparación, administración y manejo de este producto.
En la ficha técnica de la FDA en inglés se brinda información detallada para la prescripción por ciclo de tratamiento y tamaño de la lesión.
Inmunoterapia
Inhibidores de puntos control
Anticuerpos contra la proteína de muerte celular programada 1 y el ligando de la proteína de muerte programada 1
La vía PD-1 es una vía inmunoinhibitoria clave del agotamiento de células T. La inhibición de esta vía produce activación y expansión de células T y aumenta sus funciones efectoras. La PD-1 tiene dos ligandos: PD-L1 y PD-L2. La FDA aprobó dos anticuerpos contra PD-1, pembrolizumab y nivolumab, a partir de mejoras en la SG observadas en ensayos aleatorizados.
Pembrolizumab
Evidencia (pembrolizumab):
- Pacientes con tratamiento previo. En un estudio se asignó al azar a 173 pacientes (de melanoma irresecable o metastásico con progresión de la enfermedad durante las 24 semanas posteriores a la última dosis de ipilimumab, que expresaban una mutación V600 en BRAF, y había recibido tratamiento previo con un inhibidor de BRAF) para recibir una de dos dosis de pembrolizumab (2 o 10 mg/kg) cada 3 semanas. Se excluyeron los pacientes con enfermedad autoinmunitaria, afecciones que necesitaran tratamiento inmunodepresor o antecedentes de efectos adversos inmunitarios graves debidos al tratamiento con ipilimumab.
- La mediana de edad fue de 61 años; el 60 % eran hombres, el 67 % tenía un puntaje del EF de ECOG de 0 y el 33 % tenía un puntaje de EF de ECOG de 1. De los pacientes, el 18 % tenían tumores con una mutación V600 en BRAF, el 39 % tenían concentraciones elevadas de lactato deshidrogenasa (LDH), el 64 % presentaban enfermedad M1c, el 9 % tenían metástasis encefálicas y el 72 % se habían sometido a dos o más tratamientos para una enfermedad avanzada. El criterio principal de valoración fue la tasa de respuesta general (TRG), según los criterios Response Evaluation Criteria In Solid Tumors (RECIST, versión 1.1), evaluados mediante una revisión central independiente con enmascaramiento.[2][Nivel de evidencia B3]
- La TRG determinada por una revisión central independiente fue del 26 % (IC 95 %, -14–13; P = 0,96) en el grupo de 2 mg/kg: 1 RC y 20 RP en 81 pacientes. La mediana de seguimiento fue de 8 meses y todos los pacientes se siguieron por lo menos durante 6 meses. De los 21 pacientes con una respuesta objetiva, 18 presentaron respuestas duraderas de 1,4+ a 8,5+ meses.
- La tasa de respuesta en el grupo de 10 mg/kg fue similar (26 %): 20 respuestas en 76 pacientes. Se observaron respuestas en pacientes con mutaciones V600 en BRAF y sin estas.
- La dosis aprobada fue de 2 mg/kg, administrada por infusión intravenosa durante 30 minutos cada 3 semanas.
El pembrolizumab se suspendió por EA en el 7 % de los pacientes tratados con 2 mg/kg; los investigadores consideraron que 3 % de los EA se relacionaban con el fármaco. Los EA más frecuentes en los grupos de 2 versus 10 mg/kg fueron los siguientes:
- Fatiga (33 vs. 37 %).
- Prurito (23 vs. 19 %).
- Exantema (18 vs. 18 %).
Otros EA frecuentes fueron tos, náuseas, disminución del apetito, estreñimiento, artralgia y diarrea. Los EA graves más frecuentes que se presentaron en más del 2 % de 411 pacientes tratados con pembrolizumab fueron insuficiencia renal, disnea, neumonía y celulitis. Asimismo, los EA inmunitarios graves y de importancia clínica fueron neumonitis, colitis, hipofisitis, hipertiroidismo, hipotiroidismo, nefritis y hepatitis.
En la ficha técnica de la FDA en inglés, se brindan recomendaciones para cuando se sospechan EA inmunitarios graves, incluso interrumpir la administración del fármaco y administrar corticoesteroides.
- Pacientes sin tratamiento previo y con tratamiento previo. En un ensayo multicéntrico internacional (KEYNOTE 006 [NCT01866319]) 834 pacientes con melanoma metastásico se asignaron al azar en una proporción de 1:1:1 a recibir pembrolizumab (10 mg/kg intravenosos cada 2 o 3 semanas) o 4 ciclos de ipilimumab (3 mg/kg cada 3 semanas).[3] Los pacientes se estratificaron según el EF de ECOG (0 vs. 1), el tipo de terapia (primera línea vs. segunda línea) y la expresión de PD-L1 (presente vs. ausente). Los criterios principales de valoración fueron la SSP y la SG.[3][Nivel de evidencia A1]
Cerca del 66 % de los pacientes no habían recibido antes terapia sistémica para melanoma en estadio avanzado. Se encontraron mutaciones V600 en BRAF en el 36 % de los pacientes y, de ellos, casi el 50 % habían recibido tratamiento con un inhibidor de BRAF. En este estudio, no se inscribieron pacientes con mutaciones V600 en BRAF con concentraciones altas de LDH ni enfermedad sintomática o de progresión rápida que no habían recibido terapia anti-BRAF (que podría proporcionar un beneficio clínico rápido). Se observó PD-L1 en las muestras de tejido de casi el 80 % de los pacientes.
- El análisis por protocolo de la SG definitivo se llevó a cabo en el momento de una mediana de seguimiento de 23 meses. No se alcanzó la mediana de SG en ninguno de los grupos de pembrolizumab; sin embargo, la SG fue de 16,0 meses en el grupo de ipilimumab (cociente de riesgos instantáneos [CRI], 0,68; IC 95 %, 0,53−0,87 para pembrolizumab cada 2 semanas vs. ipilimumab; P = 0,0009 y 0,68; IC 95 %, 0,53−0,86 para pembrolizumab cada 3 semanas vs. ipilimumab; P = 0,0008). La tasa de supervivencia a los 24 meses fue del 55 % en los grupos que recibieron pembrolizumab cada 2 semanas y cada 3 semanas en comparación con el 43 % en el grupo de ipilimumab.[4]
- Se observó un beneficio en todos los subgrupos, excepto en los pacientes con tumores que no tenían PD-L1. Sin embargo, debido a que este subgrupo fue pequeño (18 % de los pacientes) y el IC fue amplio, no es posible extraer conclusiones definitivas de este estudio.
Nivolumab
Evidencia (nivolumab):
- Pacientes con tratamiento previo. La aprobación acelerada se basó en un análisis interino no comparativo planificado que se hizo con los primeros 120 pacientes que recibieron nivolumab y se habían sometido a por lo menos 6 meses de seguimiento en el marco del ensayo multicéntrico sin anonimato (CheckMate 037 [NCT01721746]) en el que los pacientes se asignaron al azar (2:1) a nivolumab (3 mg/kg cada 2 semanas) o una quimioterapia elegida por el investigador (dacarbazina 1000 mg/m2 intravenosa cada 3 semanas o la combinación de carboplatino [área bajo la curva de 6] cada 3 semanas y paclitaxel 175 mg/m2 cada 3 semanas).[Ficha técnica de la FDA, en inglés][Nivel de evidencia C3] Para participar los pacientes debían tener un melanoma irresecable o metastásico que progresó después del tratamiento con ipilimumab o con un inhibidor de BRAF (si presentaban una mutación V600 en BRAF). Se excluyeron los pacientes con enfermedad autoinmunitaria, afecciones que necesitaran tratamiento inmunodepresor o antecedentes de EA inmunitarios graves debidos al tratamiento con ipilimumab.
- La mediana de edad de los pacientes fue de 58 años; el 65 % de los pacientes eran hombres y el 58 % de los pacientes tenía un puntaje de EF de ECOG de 0. Asimismo, el 22 % de los pacientes presentaban una mutación V600 en BRAF; el 76 % presentaban enfermedad M1c; el 56 % tenían una concentración elevada de LDH; el 18 % tenían antecedentes de metástasis encefálicas y el 68 % se habían sometido a dos o más terapias sistémicas por enfermedad metastásica.
- La TRG y la SG fueron los criterios principales de valoración. La TRG fue del 32 % (IC 95 %, 23–41 %) con 4 RC y 34 RP evaluadas con los criterios RECIST 1.1 en una revisión central independiente. De los 38 pacientes que presentaron respuestas, 33 (87 %) tenían respuestas duraderas de 2,6+ a 10,0+ meses.
- Se observaron respuestas en pacientes con mutaciones V600 en BRAF y sin estas.
- El análisis de inocuidad se hizo con 268 pacientes. Se suspendió la administración de nivolumab debido a EA en el 9 % de los pacientes. Se produjeron EA graves en el 41 % de los pacientes y se presentaron EA de grados 3 y 4 en el 42 % de los pacientes. Los efectos adversos más comunes fueron exantema, tos, infección en las vías respiratorias superiores y edema periférico. Otros efectos adversos importantes incluyeron arritmia ventricular, iridociclitis, aumento de la amilasa y la lipasa, mareos y neuropatía.
En la ficha técnica de la FDA se brindan recomendaciones para cuando se sospechan EA inmunitarios graves, incluso interrumpir la administración del fármaco y administrar corticoesteroides.
- Pacientes sin tratamiento previo. En un ensayo multicéntrico con enmascaramiento doble (CheckMate 066 [NCT01721772]) con 418 pacientes de melanoma irresecable en estadio III o estadio IV, sin mutación en BRAF, se asignaron al azar (1:1) a recibir nivolumab (3 mg/kg cada 2 semanas) y un placebo idéntico a dacarbazina (cada 3 semanas) o dacarbazina (1000 mg/m2 cada 3 semanas con un placebo idéntico a nivolumab cada 2 semanas). El criterio principal de valoración fue la SG.[5][Nivel de evidencia A1] El ensayo se llevó a cabo en 80 centros de Europa, Israel, Australia, Canadá y América del Sur, en países en los que la dacarbazina ha sido el tratamiento estándar de primera línea para pacientes sin una mutación en BRAF.
- Durante la evaluación de inocuidad, el Consejo de Vigilancia de Datos y Seguridad (DMSB) indicó una posible diferencia en la SG. El 10 de junio de 2014, se revisó un informe abreviado de un bloqueo provisional no planificado de la base de datos en el que se observó una diferencia significativa de la SG en favor de nivolumab. El DMSB recomendó que se desenmascarara la asignación del estudio y que se permitiera la administración de nivolumab a los pacientes que recibían dacarbazina. El tamaño de la muestra previsto era de alrededor de 410 pacientes; se alcanzaron a inscribir 418 pacientes.
- En los resultados de la parte del estudio que se hizo con enmascaramiento doble antes de la modificación que permitió el cambio de tratamiento, se observó que no se alcanzó la mediana de SG en el grupo nivolumab y que la SG fue de 10,8 meses (IC 95 %, 9,3–12,1) en el grupo de dacarbazina. La tasa de SG a 1 año fue del 72,9 % (IC 95 %, 65,5–78,9 %) en el grupo nivolumab y del 42,1 % (IC 95 %, 33,0–50,9 %) en el grupo de dacarbazina. El CRIde muerte fue de 0,42; IC 99,79 %, 0,25-0,73; P < 0,001).
- Los EA más comunes en el grupo de nivolumab fueron fatiga (19,9 %), prurito (17 %), náuseas (16,5 %) y diarrea (16 %). En el grupo nivolumab, el 6,8 % de los pacientes interrumpieron el tratamiento del estudio debido a EA, en comparación con un 11,7 % de los pacientes en el grupo de dacarbazina. Los EA con un posible origen inmunitario fueron de tipo gastrointestinal, hepático, pulmonar, renal, endocrino y dermatológico; sin embargo, la mayoría de estos se resolvieron al retrasar el tratamiento del estudio, administrar glucocorticoides o ambas estrategias, según las directrices de administración del nivolumab. No se notificaron muertes por EA farmacológicos en ninguno de los grupos.
-
Cambio en el régimen de dosificación de nivolumab para el melanoma metastásico.
- En un análisis poblacional de repuesta farmacocinética y de respuesta en función de la dosis de exposición, una dosis fija de 240 mg de nivolumab cada 2 semanas se consideró equivalente al régimen de dosis de 3 mg/kg desde el punto de vista farmacocinético. La inocuidad y eficacia clínica de las dos dosis fueron similares para diferentes pesos corporales y tipos de tumor (melanoma, cáncer de pulmón de células no pequeñas y carcinoma de células renales).[6]
- El régimen de dosificación aprobado por la FDA para la monoterapia cambió de 3 mg/kg a 240 mg intravenosos cada 2 semanas hasta la progresión de la enfermedad o cuando se presenten efectos tóxicos intolerables. El régimen de dosificación de 1 mg/kg intravenosos de nivolumab combinado con ipilimumab no cambia hasta que se completa la terapia con ipilimumab; en ese momento, el régimen cambia a una dosis de 240 mg cada 2 semanas hasta la progresión de la enfermedad o hasta que se presenten efectos tóxicos intolerables.
Anticuerpo contra el antígeno 4 del linfocito T citotóxico
Ipilimumab
El ipilimumab es un anticuerpo monoclonal humano que se fija a CTLA-4, limitando así su capacidad de inhibir la activación, la proliferación y la función efectora de las células T.
Se demostró el beneficio clínico del ipilimumab para prolongar la SG en ensayos aleatorizados, y la FDA lo aprobó en 2011. Los resultados de dos ensayos aleatorizados prospectivos internacionales en los que participaron pacientes con tratamiento previo o sin este, también respaldan la administración de ipilimumab.[7,8]
Evidencia (ipilimumab):
- Pacientes con tratamiento previo. En un ensayo aleatorizado multinacional con enmascaramiento doble de 3 grupos (3:1:1) y doble placebo, participaron 676 pacientes ya tratados que tenían una enfermedad irresecable en estadios III o IV que expresaba HLA-A*0201. Se asignó al azar a 403 pacientes para recibir ipilimumab (3 mg/kg cada 3 semanas por 4 dosis) con una vacuna peptídica de glicoproteína 100 (gp100). De los participantes, 137 pacientes recibieron ipilimumab (3 mg/kg cada 3 semanas por 4 dosis) y 136 pacientes recibieron la vacuna de gp100. Los pacientes se estratificaron según el estado de metástasis al inicio y el antecedente de tratamiento con IL-2. Al inicio, 82 pacientes tenían metástasis encefálicas.[8][Nivel de evidencia A1]
- La mediana de SG fue de 10 meses en los pacientes que recibieron ipilimumab solo, de 10,1 meses en los pacientes que recibieron ipilimumab con la vacuna de gp100 y de 6,4 meses en los pacientes que recibieron la vacuna sola (CRI de ipilimumab solo vs. gp100 sola, 0,66; P <0,003; CRI de ipilimumab con la vacuna vs. gp100 sola, 0,68; P < 0,001).
- Después de 1 año, se observó en un análisis que seguían vivos el 25 % de los pacientes que solo recibieron la vacuna, en comparación con un 44 % de los pacientes que recibieron ipilimumab en monoterapia y un 45 % de los que recibieron ipilimumab con la vacuna.
- Se presentaron EA inmunitarios graves de grados 3 o 4 en el 10 % al 15 % de los pacientes tratados con ipilimumab. Los EA inmunitarios graves más frecuentes fueron diarrea o colitis, y complicaciones relacionadas con el sistema endocrino (por ejemplo, inflamación hipofisaria). Estos efectos exigieron la interrupción de la terapia y la administración de antiinflamatorios, como corticoesteroides o, en cuatro casos, infliximab (un anticuerpo contra el factor de necrosis tumoral α).
- Se notificaron 14 muertes relacionadas con el fármaco (2,1 %) y 7 muertes relacionadas con EA inmunitarios graves.
- Pacientes sin tratamiento previo. En un ensayo internacional multicéntrico, 502 pacientes no tratados antes para la enfermedad metastásica (se permitió el tratamiento adyuvante) se asignaron al azar en una proporción de 1:1 a recibir ipilimumab (10 mg/kg) con dacarbazina (850 mg/m2) o placebo con dacarbazina (850 mg/m2) en las semanas 1, 4, 7 y 10, seguidos de dacarbazina sola cada 3 semanas hasta la semana 22. Los pacientes con enfermedad estable o respuesta objetiva y sin efectos tóxicos limitantes de la dosis recibieron ipilimumab o placebo cada 12 semanas, a partir de entonces, como terapia de mantenimiento. El criterio principal de valoración fue la supervivencia. Los pacientes se estratificaron según el EF de ECOG y el estadio metastásico. Alrededor del 70 % de los pacientes tenía un puntaje de EF de ECOG de 0 y el resto, de 1. Cerca del 55 % de los pacientes presentaba enfermedad en estadio M1c.[7][Nivel de evidencia A1]
- La mediana de SG fue de 11,2 meses (IC 95 %, 9,4–13,6) para el grupo de ipilimumab y dacarbazina versus 9,1 meses (IC 95 % 7,8–10,5) para el grupo de placebo y dacarbazina. Las tasas de supervivencia en el grupo de ipilimumab y dacarbazina fueron del 47,3 % a 1 año, el 28,5 % a 2 años, y el 20,8 % a 3 años (CRIde muerte, 0,72; P < 0,001); y en el grupo de placebo y dacarbazina, las tasas fueron del 36,3 % a 1 año, el 17,9 % a 2 años, y el 12,2 % a 3 años.
- En este estudio, los EA farmacológicos más frecuentes fueron de tipo inmunitario. Se observaron EA inmunitarios graves de grado 3 o 4 en un 38,1 % de los pacientes tratados con ipilimumab y dacarbazina versus un 4,4 % de los pacientes tratados con placebo y dacarbazina; los efectos más frecuentes fueron hepatitis y enterocolitis.
- No se notificaron muertes relacionadas con los fármacos.
Médicos y pacientes deben tener en cuenta que las reacciones inmunitarias adversas pueden ser graves o mortales. Son necesarios la identificación y el tratamiento tempranos, incluso con posible administración de glucocorticoides sistémicos u otros inmunodepresores, según la guía del fabricante para el tratamiento de las reacciones inmunitarias adversas.[9]
Dosis altas de interleucina-2
La FDA aprobó la interleucina-2 (IL-2) en 1998 porque se encontraron RC duraderas en 8 estudios de fase I y II. No se han realizado estudios de fase III en los que se comparen dosis altas de IL-2 con otros tipos de tratamientos repetidos, o en los que se evalúe el efecto relativo en la SG.
Evidencia (dosis altas de IL-2):
- Las siguientes conclusiones se obtuvieron a partir de un análisis conjunto de 270 pacientes en 8 ensayos mono o multiinstitucionales realizados entre 1985 y 1993 en 22 instituciones:
Las estrategias para mejorar esta terapia constituyen un área de investigación activa.
Inhibición doble de puntos de control
Las células T expresan al mismo tiempo varios receptores que inhiben su función. Los datos preclínicos y los datos clínicos preliminares indican que el bloqueo simultáneo de dos receptores inhibitorios, CTLA-4 y PD-1, quizá es más eficaz que el bloqueo de un solo receptor.[12] Esto condujo a un ensayo de fase III (NCT01844505) en el que se comparó la administración en monoterapia de cada fármaco con la administración combinada.
Inhibidor del antígeno 4 del linfocito T citotóxico e inhibidor de la proteína de muerte celular programada 1
Evidencia (ipilimumab y nivolumab):
- Pacientes sin tratamiento previo. En un ensayo aleatorizado con enmascaramiento doble internacional (CheckMate 067), 945 pacientes de melanoma irresecable en estadio III o IV no tratado antes se asignaron al azar en una proporción 1:1:1 a los siguientes tratamientos:
- Grupo 1: nivolumab 3 mg/kg cada 2 semanas y placebo.
- Grupo 2: nivolumab 1 mg/kg cada 3 semanas con ipilimumab 3 mg/kg cada 3 semanas por 4 dosis, luego, nivolumab 3 mg cada 2 semanas.
- Grupo 3: ipilimumab 3 mg/kg cada 3 semanas por 4 dosis y placebo.
La SSP y SG fueron los criterios principales de valoración. El estudio se potenció para comparar la combinación de nivolumab con ipilimumab y la monoterapia de ipilimumab o para comparar ambas monoterapias; el estudio no se potenció para comparar la combinación de ipilimumab con nivolumab y la monoterapia de nivolumab.
Los pacientes se estratificaron según la expresión tumoral de PD-L1 evaluada en un laboratorio central mediante pruebas inmunohistoquímicas (resultado positivo vs. negativo o indeterminado), el estado de mutación en BRAF (mutación V600 vs. tipo natural) y el estadio del American Joint Committee on Cancer.[13][Nivel de evidencia A1]
- Al inicio del estudio el 74 % de los pacientes tenía una puntuación de EF de ECOG de 0; el 36 % tenía una concentración alta de LDH; el 31,5 % presentaba una mutación en BRAF y el 58 % tenía una enfermedad en estadio M1c. Una minoría de los pacientes (23,6 %) tenía un tumor con expresión de PD-L1.
- El análisis prospectivo del criterio principal de valoración de SSP se realizó después de por lo menos 9 meses de seguimiento. El tratamiento con nivolumab solo o en combinación con ipilimumab produjo una SSP significativamente más prolongada que el tratamiento con ipilimumab solo. Los resultados fueron uniformes entre los factores de estratificación predefinidos. La mediana de la SSP fue de 6,9 meses (IC 95 %, 4,3–9,5) con nivolumab; de 11,5 meses (IC 95 %, 8,9–16,7) con nivolumab e ipilimumab; y de 2,9 meses (IC 95 %, 2,8–3,4) con ipilimumab.
- El análisis prospectivo del criterio principal de valoración de SG se realizó después de 28 meses. Después de que se notificaron 467 defunciones la tasa de SG fue del 59 % en el grupo de nivolumab, del 64 % en el grupo de tratamiento combinado y del 45 % en el grupo de ipilimumab (CRIde muerte para la combinación vs. ipilimumab, 0,55 [IC 98 %, 0,42–0,72; P< 0,001]; CRIde muerte para nivolumab vs. ipilimumab, 0,63 [IC 98 %, 0,48-0,81; P< 0,001]).[14]
- En un análisis descriptivo realizado después de un seguimiento mínimo de 36 meses, se encontraron los siguientes datos:
- Las tasas de SG fueron del 52 % en el grupo de nivolumab, del 58 % en el grupo de tratamiento combinado y del 34 % en el grupo de ipilimumab.
- En el grupo de tratamiento combinado no se alcanzó la mediana de SG (IC 95 %, 38,2 meses–no alcanzada). La mediana de SG en los grupos de monoterapia con nivolumab o ipilimumab fue de 37,6 meses (IC 95 %, 29,1–no alcanzada) y 19,9 meses (IC 95 %, 16,9–24,6), respectivamente.
- El CRIde muerte para la combinación versus ipilimumab fue de 0,55 (IC 99,5 %, 0,45–0,69; P < 0,001); para nivolumab versus ipilimumab, el CRI fue de 0,65 (IC 99,5 %, 0,53–0,80; P < 0,001).
- El grupo de tratamiento combinado presentó el mayor número de EA y necesitó someterse a una vigilancia rigurosa. Los EA de grados 3 a 4 relacionados con el tratamiento se presentaron en el 16,3 % de los pacientes del grupo de nivolumab, el 27,3 % de los pacientes del grupo de ipilimumab y el 55 % de los pacientes del grupo tratamiento combinado. La razón más común para la interrupción del tratamiento fue la progresión de la enfermedad en los dos grupos de monoterapia: el 49 % con nivolumab y el 65 % con ipilimumab. La razón más frecuente para la interrupción del tratamiento en el grupo de tratamiento combinado fueron los efectos tóxicos (38 %).
- Se notificaron 4 defunciones relacionadas con el tratamiento debidas a las siguientes causas: neutropenia (grupo de nivolumab), perforación del colon (grupo de ipilimumab), necrosis hepática y miocarditis autoinmunitaria (combinación de ipilimumab y nivolumab).
- El análisis de la relación entre la expresión de PD-L1 y la SG a 3 años indicó que el grado de expresión solo es un biomarcador muy deficiente para predecir la SG.
- Melanoma metastásico en el encéfalo. Los pacientes que tenían por lo menos una metástasis encefálica medible no irradiada fueron aptos para recibir un tratamiento sistémico con inmunoterapia dual en un ensayo multicéntrico sin anonimato de fase II (CheckMate 204 [NCT02320058]).[15][Nivel de evidencia C3] Tampoco debían tener necesidad de intervención inmediata, signos o síntomas neurológicos, ni antecedentes de tratamiento con glucocorticoides durante los 14 días previos al inicio del tratamiento en estudio. Se permitió la participación de pacientes sometidos antes a radiocirugía estereotáctica o escisión de hasta 3 metástasis encefálicas. No se exigió que se confirmara la expresión de PD-L1.
El tratamiento fue nivolumab (1 mg/kg) e ipilimumab (3 mg/kg) cada 3 semanas hasta 4 dosis, seguido de nivolumab (3 mg/kg) cada 2 semanas hasta que se presentara progresión o toxicidad inaceptable.
El criterio principal de valoración fue la tasa de beneficio intracraneal desde el punto de vista clínico según la evaluación del investigador mediante los criterios RECIST, que se definió como el porcentaje de pacientes con RC, RP o enfermedad estable durante por lo menos 6 meses. En 28 sitios de los Estados Unidos, se inscribieron 101 pacientes, 94 de los cuales se siguieron durante un mínimo de 6 meses. Los datos de esta población se presentan a continuación.
- Se observó beneficio clínico (en el encéfalo) en un 57 % de los pacientes (IC 95 %, 47–68); 24 pacientes (26 %) presentaron una RC, 28 pacientes (30 %) una RP, y 2 pacientes (2 %) una enfermedad estable que duró 6 meses o más. Se encontraron tasas de respuesta objetiva parecidas (50 %) en pacientes con lesiones extracraneales, aunque menos pacientes presentaron una RC (7 %).
- En un análisis de subgrupos se indicó que se presentaron respuestas en pacientes con expresión de PD-L1 y sin expresión de esta molécula (se desconocía el estado al inicio del estudio en 20 de 94 pacientes).
- La mediana de seguimiento de 94 pacientes fue de 14 meses. La mediana de tiempo hasta obtener la respuesta intracraneal fue de 2,3 meses (intervalo, 1,1−10,8), y el tiempo hasta obtener la respuesta extracraneal fue de 2,1 meses (intervalo, 1,1−15,0).
- El efecto adverso relacionado con el tratamiento más común y de cualquier grado en el sistema nervioso central fue cefalea (21 pacientes [22 %]), con presentación de cefalea de grado 3 o 4 en 3 pacientes (3 %). Otros efectos adversos neurológicos relacionados con el tratamiento de grado 3 o 4 fueron edema cerebral (2 pacientes [27%]), hemorragia intracraneal (1 paciente [1 %]), neuropatía motora periférica (1 paciente [1 %]) y síncope (1 paciente [1 %]). Cada uno de estos efectos adversos llevó a la interrupción del tratamiento; en un caso se notificó neuropatía motora periférica irreversible. Un investigador determinó que una muerte se relacionó con el tratamiento del estudio (miocarditis inmunitaria de grado 5).
- Se documentó progresión en 33 pacientes (35 %); progresión intracraneal sola en 17 pacientes (18 %), progresión extracraneal sola en 4 pacientes (4 %), y progresión en sitios intra y extracraneales en 12 pacientes (13 %).
Inhibidores de la transducción de señales
Hasta la fecha los estudios indican que los inhibidores de BRAF y MEK (cinasa activadora de ERK [cinasa regulada por señales extracelulares] activada por mitógenos), en monoterapia o tratamiento combinado quizás tengan un efecto considerable en la evolución natural del melanoma, aunque no lo curen.
Inhibidores de BRAF
No se aconseja el tratamiento con inhibidores de BRAF para el melanoma con BRAF de tipo natural porque los datos de modelos preclínicos demostraron que los inhibidores de BRAF a veces estimulan, en lugar de inhibir, la vía de la proteína cinasa activada por mitógenos (MAPK) en células tumorales con BRAF de tipo natural o que tienen mutaciones ubicadas secuencia arriba en el gen RAS.[16-19]
Vemurafenib
El vemurafenib es un fármaco micromolecular de uso oral que causa la inhibición selectiva de la cinasa BRAF y fue aprobado por la FDA en 2011 para usarlo en pacientes con melanoma irresecable o metastásico que expresan la mutación V600E en BRAF.
Evidencia (vemurafenib):
- Pacientes sin tratamiento previo. La aprobación del vemurafenib se respaldó con los resultados de un ensayo multicéntrico internacional (BRIM-3 [NCT01006980]) en el que 2107 pacientes con melanoma en estadios IIIC o IV sin tratamiento previo se sometieron a la prueba Cobas 4800 BRAF V600 Mutation Test y se detectó la mutación V600 en BRAF en 675 pacientes.[20] Los pacientes se asignaron al azar a recibir vemurafenib (960 mg por vía oral 2 veces al día) o dacarbazina (1000 mg/m2 por vía intravenosa cada 3 semanas). Los criterios principales de valoración fueron las tasas de SG y de SSP. En el análisis interino programado, el DMSB determinó que ambos criterios de valoración (SG y SSP) cumplieron con los requisitos predefinidos para la significación estadística a favor del vemurafenib y recomendó que se permitiera el cambio de tratamiento para que los pacientes asignados a dacarbazina recibieran vemurafenib.[20][Niveles de evidencia A1 y B1]
- Se evaluó la SG de 675 pacientes y se concluyó que la SG del grupo de vemurafenib fue claramente superior a la del grupo de dacarbazina aunque no se había alcanzado la mediana de supervivencia para el vemurafenib y los datos eran preliminares por lo que no permitían trazar las curvas de supervivencia de Kaplan-Meier.
- El CRIde muerte en el grupo de vemurafenib fue de 0,37 (IC 95 %, 0,26–0,55; P < 0,001). Se observó un beneficio en la supervivencia del grupo de vemurafenib y en cada subgrupo predefinido por características específicas, por ejemplo, edad, sexo, EF de ECOG, estadio tumoral, LDH y región geográfica.
- El CRI de progresión tumoral en el grupo de vemurafenib fue de 0,26 (IC 95 %, 0,20–0,33; P < 0,001). El cálculo de la mediana de SSP fue de 5,3 meses en el grupo de vemurafenib versus 1,6 meses en el grupo de dacarbazina.
- De todos los pacientes, 20 presentaban mutaciones diferentes a V600E en BRAF: 19, V600K en BRAF y 1, V600D en BRAF. De los pacientes que tenían la mutación V600K en BRAF, 4 respondieron al vemurafenib.
- Los EA exigieron la modificación o la interrupción de la dosis en el 38 % de los pacientes que recibieron vemurafenib y en el 16 % de los que recibieron dacarbazina. Los EA más frecuentes con el vemurafenib fueron complicaciones cutáneas, artralgia y fatiga. En el 18 % de los pacientes se presentaron casos de carcinoma de células escamosas (CCE) cutáneo, queratoacantoma o ambos, que se trataron con resección simple. Los EA más comunes con la dacarbazina fueron fatiga, náuseas, vómitos y neutropenia. Para obtener más información, consultar Fatiga y Náuseas y vómitos relacionados con el tratamiento del cáncer.
- Pacientes con tratamiento previo. En un ensayo multicéntrico de fase II, se inscribió a 132 pacientes con mutaciones V600E en BRAF o V600K en BRAF para que recibieran 960 mg de vemurafenib por vía oral 2 veces al día. De los pacientes inscritos, el 61 % presentó enfermedad en estadio M1c y el 49 % tenía una concentración elevada de LDH. Todos los pacientes habían recibido uno o más tratamientos previos para la enfermedad avanzada. La mediana de seguimiento fue de 12,9 meses.[21][Nivel de evidencia C3]
- Un comité de revisión independiente notificó una tasa de respuesta del 53 % (IC 95 %, 44–62 %); 8 pacientes (6 %) alcanzaron una RC.
- Según la evaluación del comité de revisión independiente, la duración media de la respuesta fue de 6,7 meses (IC 95 %, 5,6–8,6). La mayoría de las respuestas fueron evidentes en la primera evaluación radiológica a las 6 semanas; sin embargo, algunos pacientes no respondieron hasta después de recibir 6 meses de tratamiento.
Dabrafenib
El dabrafenib es un fármaco micromolecular de uso oral que causa inhibición selectiva de la cinasa BRAF; la FDA lo aprobó en 2013 para su uso en pacientes con melanoma irresecable o metastásico que tienen una mutación V600E en BRAF detectada mediante una prueba aprobada por la FDA. El dabrafenib y otros inhibidores de BRAF no se recomiendan para el tratamiento de los melanomas con BRAF de tipo natural porque los experimentos in vitro indican que a veces se presenta una estimulación paradójica en la señalización de MAPK que causa promoción tumoral.
Evidencia (dabrafenib):
- En un ensayo multicéntrico internacional (BREAK-3 [NCT01227889]), se comparó el dabrafenib con la dacarbazina. Un grupo de 250 pacientes con melanoma irresecable en estadio III o IV y mutaciones V600E en BRAF se asignó al azar en una proporción de 3:1 (150 mg de dabrafenib por vía oral una vez al día o 1000 mg/m2 por vía intravenosa cada 3 semanas). Se permitió la participación de pacientes con el antecedente de tratamiento con IL-2 para la enfermedad en estadio avanzado. El criterio principal de valoración fue la SSP; un comité de revisión enmascarada independiente permitió el cruce de la asignación para los pacientes con progresión de la enfermedad.[22][Nivel de evidencia B1]
- En el análisis con 126 episodios, el CRI de la SSP fue de 0,30 (IC 95 %, 0,18–0,51; P < 0,0001). La mediana de SSP fue de 5,1 meses para el dabrafenib versus 2,7 meses para la dacarbazina. La mediana de duración del seguimiento y el diseño cruzado limitan los datos de SG. La tasa de RP fue del 47 % y la tasa de RC fue del 3 % en los pacientes que recibieron dabrafenib versus una tasa de RP del 5 % y una tasa de RC del 2 % en los que recibieron dacarbazina.
- Los EA más frecuentes en los pacientes tratados con dabrafenib fueron las complicaciones cutáneas (es decir, hiperqueratosis, papilomas y eritrodisestesia palmoplantar), pirexia, fatiga, cefalea y artralgia. Se presentaron casos de CCE cutáneo o queratoacantoma en 12 pacientes, carcinoma de células basales en 4 pacientes, micosis fungoide en 1 paciente y casos nuevos de melanoma en 2 pacientes.
Inhibidores de MEK
Trametinib
El trametinib es un fármaco micromolecular de uso oral que causa inhibición selectiva de MEK1 y MEK2. BRAF activa las proteínas MEK1 y MEK2, que a su vez, activan la MAPK. En los datos preclínicos se indica que los inhibidores de MEK pueden impedir la proliferación e inducir la destrucción celular de algunos tumores de melanoma humano con mutaciones en BRAF.
En 2013, la FDA aprobó el trametinib para pacientes con melanoma irresecable o metastásico que tienen mutaciones V600E o V600K en BRAF, detectadas mediante una prueba aprobada por la FDA.
Evidencia (trametinib):
- En un estudio un grupo de 1022 pacientes se sometió a detección de mutaciones en BRAF y se identificaron 322 pacientes aptos para participar (281 con una mutación V600E en BRAF, 40 con una mutación V600K en BRAF y 1 con ambas mutaciones).[23] Se permitió el antecedente de un tratamiento previo (biológico o quimioterapéutico); aunque no se permitió el antecedente de tratamiento con inhibidores de BRAF o MEK. Los pacientes se asignaron al azar en una proporción de 2:1 a recibir trametinib (2 mg una vez al día) o quimioterapia por vía intravenosa (dacarbazina 1000 mg/m2 cada 3 semanas o paclitaxel 175 mg/m2 cada 3 semanas). Se permitió que los pacientes asignados al azar a quimioterapia cambiaran al otro tratamiento; por lo tanto, el criterio principal de valoración fue la SSP.
- La SSP evaluada por los investigadores fue de 4,8 meses en el grupo de trametinib versus 1,5 meses en el grupo de quimioterapia (CRI de SSP o muerte, 0,45; IC 95 %, 0,33–0,63; P < 0,001). Se obtuvieron resultados similares en una revisión radiológica con enmascaramiento del grupo de tratamiento. No se ha alcanzado la mediana de SG.
- Se presentaron EA que condujeron a la interrupción de la dosis en el 35 % de los pacientes del grupo de trametinib y en el 22 % de los pacientes del grupo de quimioterapia. Se presentaron EA que condujeron a la reducción de la dosis en el 27 % de los pacientes del grupo de trametinib y en el 10 % de los pacientes del grupo de quimioterapia.
- Los EA más frecuentes fueron exantema, diarrea, náuseas, vómitos, fatiga, edema periférico, alopecia, hipertensión y estreñimiento. Se presentaron EA graves, aunque poco frecuentes, relacionados con el trametinib como cardiomiopatía (7 %), enfermedad pulmonar intersticial (2,4 %), retinopatía serosa central (<1 %) y oclusión venosa retiniana (<1 %). Durante el estudio no se observaron CCE cutáneos. Para obtener más información, consultar Fatiga y Náuseas y vómitos relacionados con el tratamiento del cáncer.
Cobimetinib
El cobimetinib es un fármaco micromolecular de uso oral que causa inhibición selectiva de MEK1, fue aprobado por la FDA en 2015 para usarlo en combinación con el inhibidor de BRAF, vemurafenib. Para obtener más información, consultar la sección Terapia combinada con inhibidores de la transducción de señales.
Inhibidores de KIT
Los datos preliminares indican que los melanomas mucosos o acrales que tienen mutaciones activadoras o amplificaciones en c-KIT quizás sean sensibles a una variedad de inhibidores de c-KIT.[24-26] Se dispone de ensayos de fase II y III para pacientes con melanoma irresecable en estadio III o estadio IV que albergan una mutación en c-KIT.
Terapia combinada con inhibidores de la transducción de señales
En ensayos aleatorizados de fase III, se comparó la eficacia de tres combinaciones de inhibidores de BRAF-MEK con los inhibidores de BRAF en monoterapia y se demostró de manera uniforme que la terapia combinada tiene una eficacia superior.
La resistencia secundaria a la monoterapia con un inhibidor de BRAF en pacientes con mutaciones V600 en BRAF a veces se relaciona con la reactivación de la vía MAPK. En consecuencia, las combinaciones de inhibidores de la transducción de señales que bloquean varios sitios de la misma vía o vías múltiples constituyen un área de investigación activa.
Inhibidor de BRAF con inhibidor de MEK
Dabrafenib y trametinib
Evidencia (dabrafenib y trametinib):
- Pacientes sin tratamiento previo. En un ensayo internacional de fase III con enmascaramiento doble sin entrecruzamiento (COMBI-d [NCT01584648]) , 423 pacientes de melanoma irresecable en estadio IIIC o estadio IV no tratados antes con mutaciones V600E o V600K en BRAF se asignaron al azar a recibir la combinación de dabrafenib (150 mg oral 2 veces al día) y trametinib (2 mg oral una vez al día), o de dabrafenib con placebo. El criterio principal de valoración fue la SSP evaluada por el investigador. El protocolo incluyó un análisis interino predefinido de la SG en el momento del análisis del criterio principal de valoración. Los pacientes se estratificaron de acuerdo con la concentración inicial de LDH y el genotipo de BRAF.[27][Nivel de evidencia B1]
- La mediana de SSP fue de 9,3 meses para la combinación versus 8,8 meses para dabrafenib y placebo. El de muerte o progresión fue de 0,75 (IC 95 %, 0,57–0,99; P = 0,03). En los datos actualizados en el momento del análisis final de la SG se encontró una mediana de SSP de 11,0 meses para la combinación versus 8,8 meses para dabrafenib y placebo. El CRI de SSP o muerte fue de 0,67 (IC 95 %, 0,53–0,84; P = 0,0004; no ajustado para cada prueba).[28]
- Se llevó a cabo el análisis predefinido final de la SG cuando se presentaron el 70 % de los episodios. La mediana de la SG fue de 25,1 meses en el grupo de dabrafenib y trametinib (66 % de los episodios) comparada con 18,7 meses en el grupo de dabrafenib y placebo (76 % de los episodios). El CRI fue de 0,71 (IC 95 %, 0,55–0,92; P = 0,01).
- Se notificó la interrupción permanente de los fármacos del estudio en un 9 % de los pacientes del grupo de la combinación y en un 5 % de los pacientes que recibieron dabrafenib solo.
- La incidencia de EA de grados 3 a 4 fue similar en ambos grupos: del 35 % para la combinación y del 37 % para el dabrafenib solo. Se presentó pirexia, que fue más frecuente en el grupo de combinación y se trató de inmediato con un cese temporal del fármaco en cualquiera de los grupos; es posible que el uso de glucocorticoides profilácticos prevenga los episodios recidivantes de esta complicación. Los episodios cutáneos hiperproliferativos, como el CCE cutáneo, que se piensa están relacionados con la activación paradójica de la vía MAPK, fueron menos frecuentes cuando se añadió el inhibidor de MEK. Los EA poco frecuentes, pero graves, fueron disminución de la fracción de eyección y coriorretinopatía.
- Pacientes sin tratamiento previo. En un ensayo internacional sin enmascaramiento de fase III (COMBI-v [NCT01597908]), 704 pacientes de melanoma metastásico no tratados antes que tenían una mutación V600 en BRAF se asignaron al azar a recibir las dosis estándar de la combinación de dabrafenib y trametinib, o vemurafenib solo como terapia de primera línea. El criterio principal de valoración fue la SG.[29][Nivel de evidencia A1]
- Se planificó un análisis interino de la SG cuando se presentaran 202 de los 288 episodios finales. Según el protocolo, el DMSB utilizó los límites de eficacia ajustados para los episodios reales (222) (P bilateral < 0,0214 para la eficacia y P > 0,2210 para la inutilidad del tratamiento). El DMSB recomendó la interrupción del estudio para la evaluación de eficacia, y el análisis interino se convirtió en el análisis final de la SG. Se redactó una enmienda del protocolo para permitir el cambio de los pacientes al grupo de tratamiento combinado.
- Se notificaron 100 defunciones (28 %) en el grupo de combinación y 122 defunciones (35 %) en el grupo de vemurafenib (CRI, 0,69; IC 95 %, 0,53–0,89; P = 0,005). La mediana de SG de los pacientes tratados con vemurafenib fue de 17,2 meses; la mediana no se alcanzó en el grupo de tratamiento combinado.
- Pacientes sin tratamiento previo. En un análisis conjunto de 563 pacientes asignados al azar a recibir dabrafenib y trametinib en los ensayos (descritos arriba) COMBI-d (con enmascaramiento doble) y COMBI-v (sin anonimato) , se obtuvieron resultados de cerca de 5 años.[30] Después del estudio, el 53 % de los pacientes recibió tratamiento subsecuente, de estos pacientes dos tercios recibió inmunoterapia.
- Al cabo de una mediana de seguimiento de 22 meses (intervalo, 0−76 meses), el 63 % de los pacientes había fallecido (64 % del ensayo COMBI-d y 61 % del COMBI-v).
- La tasa de SG a 5 años calculada fue del 34 % (IC 95 %, 30−38 %) y la tasa SSP evaluada por el investigador fue del 19 % (IC 95 %, 15−22 %).
- La RC, que se presentó en 109 pacientes (19 %) se asoció con una tasa de SG a 5 años del 71 % (IC 95 %, 62−79 %).
Vemurafenib y cobimetinib
Evidencia (vemurafenib y cobimetinib):
- Pacientes sin tratamiento previo. En un ensayo internacional de fase III, 495 pacientes de melanoma irresecable en estadio IIIC o estadio IV no tratados antes que tenían la mutación V600 en BRAF se asignaron al azar a recibir la combinación de vemurafenib (960 mg por vía oral una vez al día) y cobimetinib (60 mg por vía oral una vez al día durante 21 días, seguido de 7 días de descanso) o vemurafenib con placebo. El criterio principal de valoración fue la SSP evaluada por el investigador. No se permitió el cambio de tratamiento en el momento del análisis de SSP. Los pacientes se estratificaron según el estadio y la región geográfica. Se predefinieron dos análisis interinos de la SG, el primero en el momento del análisis del criterio principal de valoración.[31][Nivel de evidencia B1]
- La mediana de SSP fue de 9,9 meses para la combinación versus 6,2 meses para los pacientes tratados con vemurafenib y placebo. El CRIde progresión o muerte fue de 0,51 (IC 95 %, 0,39–0,68; P = 001).
- El primer análisis interino de la SG fue preliminar por los pocos episodios en ambos grupos; por lo tanto, no se alcanzó la mediana de supervivencia en ninguno de los grupos de estudio.
- La tasa de retirada del tratamiento por efectos adversos fue similar en los grupos: tasa del 13 % en el grupo de combinación y tasa del 12 % en el grupo de vemurafenib solo. Se notificaron 6 muertes por EA en el grupo de combinación y 3 muertes por EA en el grupo de vemurafenib solo.
- La incidencia de EA de grados 3 a 4 fue similar en los grupos: tasa del 62 % en el grupo de combinación y tasa del 58 % en el grupo de vemurafenib solo. Los EA poco frecuentes, pero graves, fueron coriorretinopatía, desprendimiento de retina, disminución de la fracción de eyección y prolongación del intervalo QT. Los episodios cutáneos hiperproliferativos, como el CCE cutáneo, que se piensa están relacionados con la activación paradójica de la vía MAPK, fueron menos frecuentes cuando se añadió el inhibidor de MEK.
Encorafenib y binimetinib
El encorafenib es un fármaco micromolecular inhibidor de BRAF que se aprobó para usarlo en combinación con binimetinib, un fármaco micromolecular inhibidor de MEK, para el tratamiento del melanoma irresecable o metastásico con una mutación V600E o V600K en BRAF, identificada mediante una prueba aprobada por la FDA. La combinación demostró mejorar la SSP y la SG en comparación con el vemurafenib; sin embargo, ninguno se aprobó para el uso en monoterapia.
Evidencia (encorafenib y binimetinib):
- Pacientes sin tratamiento previo ni progresión después de la inmunoterapia de primera línea. En un ensayo internacional sin anonimato de fase III (COLUMBUS [NCT01909453]), 577 pacientes de melanoma en estadios IIIB, IIIC o IV con una mutación V600 en BRAF se asignaron en una proporción de 1:1:1 a recibir encorafenib (450 mg al día) y binimetinib (45 mg 2 veces al día) o encorafenib en monoterapia (300 mg al día) o vemurafenib en monoterapia (960 mg 2 veces al día).[32,33] El criterio principal de valoración fue la SSP en el grupo de combinación versus el grupo de monoterapia de vemurafenib, según la evaluación enmascarada del comité de revisión independiente; la SG fue un criterio de valoración secundario.
- Pocos pacientes (cerca del 5 %) habían recibido terapia con inhibidores de puntos de control.
- Al cabo de una mediana de seguimiento de 16,6 meses, la mediana de SSP fue de 14,9 meses (IC 95 %, 11,0–18,5) con la combinación versus 7,3 meses (IC 95 %, 5,6–8,2) con vemurafenib. El CRIde progresión o muerte fue de 0,54 (IC 95 %, 0,41–0,71; P bilateral < 0,0001).
- Al cabo de una mediana de seguimiento de 36,8 meses para el criterio secundario de valoración de SG, se encontró que los pacientes del grupo de la combinación tuvieron una mediana de SG de 33,6 meses (IC 95 %, 24,4–39,2) versus 16,9 meses (IC 95 %, 14,0–24,5) para los pacientes tratados con vemurafenib (CRI, 0,61; IC 95 %, 0,47–0,79; P < 0,0001). Se administraron otros tratamientos posteriores después de la interrupción del medicamento del estudio al 42 % de los pacientes del grupo de combinación y al 62 % de los pacientes del grupo de vemurafenib.[32,33][Nivel de evidencia A1]
- La incidencia de EA de grado 3 y 4 fue del 58 % en el grupo de terapia combinada y del 63 % en el grupo de vemurafenib. Se presentaron EA graves en el 34 % del grupo de combinación y en un 37 % del grupo de vemurafenib. Los EA más comunes en el grupo de combinación fueron síntomas gastrointestinales, elevación de la γ-glutamil transferasa (GGT), elevación de la creatina-fosfocinasa (CPK), disfunción del ventrículo izquierdo (8 %) y retinopatía grave (20 %), la mayoría de estos efectos fueron de grado 1 o 2 (en la ficha técnica del medicamento se indican directrices para la vigilancia). Los pacientes que recibieron vemurafenib presentaron más pirexia y efectos tóxicos cutáneos. La administración del fármaco en estudio se interrumpió debido a EA en el 15 % del grupo de combinación y el 17 % del grupo de vemurafenib. No se presentaron muertes relacionadas con el tratamiento; no obstante, un participante del grupo de combinación se suicidó.
Terapia combinada de inhibición de la transducción de señales con inhibidor de PD-L1
Cobimetinib y vemurafenib con atezolizumab
Evidencia (cobimetinib y vemurafenib con atezolizumab):
- En un ensayo multicéntrico con enmascaramiento doble y controlado con placebo (IMspire150 [NCT02908672]) se asignaron al azar (en una proporción 1:1) a 514 pacientes de melanoma metastásico o irresecable en estadio IIIC que albergaban una mutación V600 en BRAF a recibir terapia de primera línea con cobimetinib y vemurafenib con atezolizumab o placebo.[34] Los criterios de selección fueron tener puntajes de 0 a 1 en el estado funcional (EF) según el ECOG, padecer enfermedad cuantificable y no haber recibido tratamiento sistémico previo para el melanoma metastásico. Se excluyeron a los pacientes con metástasis encefálica progresiva o sin tratar y quienes tenían antecedentes de enfermedades autoinmunitarias graves. Se permitió la participación de los pacientes que recibieron terapia adyuvante previa (14 % de los pacientes).
Después de que los pacientes en ambos grupos recibieron un ciclo de cobimetinib y vemurafenib por 28 días, se les administró atezolizumab (840 mg por vía intravenosa cada 2 semanas) o placebo en adición a la terapia combinada de inhibidores de BRAF-MEK. El criterio principal de valoración de eficacia fue la tasa de SSP evaluada por el investigador según los criterios RECIST 1.1.
- Al cabo de una mediana de seguimiento de 19 meses, la mediana de tasa de SSP evaluada por el investigador principal fue de 15 meses (IC 95 %, 11,4−18,4) en el grupo de atezolizumab y de 11 meses (IC 95 %, 9,3−12,7) en el grupo de placebo (CRI, 0,78; IC 95 %, 0,63−0,97; P = 0,0249).
- Un comité de revisión independiente de la terapia triple encontró una SSP de 16 meses (IC 95 %, 11,3−18,5) en comparación con 12 meses en el grupo de control (IC 95 %, 10,8−14,7) (CRI, 0,85; IC 95 %, 0,67−1,07).
- Las tasas de respuesta objetiva y las RC de los dos grupos fueron similares.
- Los datos de la SG son preliminares.
- Los EA graves y las interrupciones al tratamiento debido a la toxicidad fueron similares en ambos grupos. Se presentaron EA de grado 5 en 7 pacientes de cada grupo. Se consideró que la disfunción hepática de 2 pacientes en el grupo de atezolizumab y la hemorragia pulmonar de 1 paciente en el grupo de control estuvieron relacionados con el tratamiento.
Se desconoce el efecto de la terapia triple en la SG, tampoco se conoce su efecto en comparación con la monoterapia de inhibidores de puntos de control ni en comparación con la terapia secuencial en combinación con la terapia de inhibidores BRAF-MEK, precedida de la inhibición de puntos de control o seguida de esta (ensayo en curso NCT02224781).
Quimioterapia
La dacarbazina se aprobó en 1970 a partir de las TRG. En ensayos de fase III se indicó una TRG del 10 % al 20 % y se observaron escasas RC. En ensayos aleatorizados no se ha demostrado efecto en la SG.[7,20,35-37] La dacarbazina tuvo un efecto inferior para la SG cuando se usó en el grupo de control de los ensayos recientes para el registro de ipilimumab y vemurafenib en pacientes con melanoma metastásico no tratado antes.
La temozolomida, un alquilante oral que hidroliza la misma porción activa que la dacarbazina, tuvo un efecto similar a la dacarbazina (por vía intravenosa) en un ensayo aleatorizado de fase III, cuyo criterio principal de valoración fue la SG; sin embargo, el ensayo se diseñó para mostrar superioridad y el tamaño de la muestra no fue suficiente para probar la equivalencia.[36]
La tasa de respuesta objetiva a la dacarbazina y las nitrosoureas carmustina y lomustina es del 10 % al 20 %.[35,38-40] Con frecuencia, las respuestas son transitorias y duran de 3 a 6 meses, aunque a veces se presentan remisiones a largo plazo en un número limitado de pacientes que obtienen una RC.[38,40]
En un ensayo aleatorizado se comparó dacarbazina por vía intravenosa con temozolomida oral; la SG fue de 6,4 meses para la dacarbazina versus 7,7 meses para la temozolomida (CRI, 1,18; IC 95 %, 0,92–1,52). Si bien estos datos indicaron similaridad entre la dacarbazina y la temozolomida, no se observó beneficio en la supervivencia con ninguno de los fármacos; por lo tanto, esta similaridad no llevó a que la FDA aprobara la temozolomida.[36][Nivel de evidencia A1]
En el ensayo multicéntrico EORTC-18032 (NCT00101218) de la European Organisation for Research and Treatment of Cancer (EORTC), 859 pacientes se asignaron al azar para comparar la temozolomida en programación prolongada y dosis gradual con la dacarbazina. No se observaron mejoras en la SG ni la SSP en el grupo de temozolomida y esta programación y dosis causaron más efectos tóxicos que la dosis estándar de dacarbazina en monoterapia.[41][Nivel de evidencia A1]
En dos ensayos aleatorizados de fase III con pacientes de melanoma metastásico no tratado (que llevaron a que la FDA aprobara el vemurafenib [20] y el ipilimumab [7]) se usó la dacarbazina para el grupo de tratamiento estándar. En dos ensayos independientes, se demostró una SG superior para el vemurafenib (en el melanoma con mutación V600 en BRAF) y el ipilimumab, en comparación con la dacarbazina.
Otros fármacos que producen un efecto modesto cuando se usan en monoterapia son los alcaloides de vinca, los compuestos de platino y los taxanos.[38,39]
Se probaron regímenes combinados que incorporan quimioterapia (por ejemplo, quimioterapia multifarmacológica,[42,43] combinaciones de quimioterapia y tamoxifeno,[44-46] y combinaciones de quimioterapia e inmunoterapia) [10,11,42,47-50] pero no demuestran mejoras en la SG.
Tampoco se notificó un efecto en la SG en los datos publicados de un metanálisis con 18 ensayos aleatorizados (15 con información de supervivencia) de comparación de quimioterapia y bioquimioterapia (es decir, la misma quimioterapia con interferón solo o con IL-2).[51][Nivel de evidencia A1]
Terapia paliativa local
Es posible que la linfadenectomía regional sirva para la paliación de un melanoma con metástasis a distancia en áreas ganglionares. En casos de metástasis aisladas en el pulmón, el tubo gastrointestinal, los huesos y, a veces, metástasis encefálicas, la resección es paliativa y en ocasiones se produce supervivencia a largo plazo.[48-50]
A pesar de que el melanoma es un tumor relativamente resistente a la radiación, la radioterapia paliativa en ocasiones alivia los síntomas. En estudios retrospectivos, se observó que la radioterapia sirve para aliviar los síntomas y reducir, en algún grado, el tamaño del tumor en pacientes con las siguientes afecciones:[52,53]
- Metástasis encefálicas múltiples.
- Metástasis óseas.
- Compresión de la médula espinal.
No es claro el programa de fraccionamiento de dosis más eficaz para la paliación del melanoma con metástasis óseas o medulares, pero los programas con dosis altas por fracción a veces se usan para contrarrestar la resistencia tumoral. Para obtener más información, consultar El dolor y el cáncer.
Opciones de tratamiento en evaluación clínica del melanoma en estadio III irresecable, en estadio IV y recidivante
- Inmunoterapia en monoterapia o inmunomodulación combinada.
- Terapia dirigida en monoterapia o combinada.
- Inhibidores de la transducción de señales, como inhibidores de PI3K (fosfoinositida-3 cinasa) y Akt (proteína cinasa B), inhibidores de CDK (cinasa dependiente de ciclina) e inhibidores de BRAF y MEK.
- Antiangiogénicos. Los datos preclínicos indican que el aumento de la producción del factor de crecimiento endotelial vascular parece vincularse con la resistencia a los inhibidores de BRAF.[54]
- Terapia dirigida para ciertas poblaciones de pacientes con melanoma.
- En subgrupos más pequeños de pacientes con melanoma, se encuentran mutaciones activadoras en NRAS (15–20 %), en c-KIT (28–39 % de los melanomas de la piel con lesión solar crónica o melanomas acrales y mucosos) y en CDK4 (<5 %); por el contrario, a menudo se encuentra una mutación en GNAQ en los melanomas uveales. Se estudian en ensayos clínicos el uso de fármacos dirigidos a las vías activadas por estas mutaciones.
- Combinaciones de inmunoterapia y terapia dirigida.
- Inyecciones intralesionales (por ejemplo, virus oncolíticos).
- Resección quirúrgica completa de toda enfermedad identificable versus el tratamiento médico más eficaz.
- Perfusión de un miembro aislado para el melanoma irresecable en las extremidades.
- Terapia sistémica para la enfermedad irresecable.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Andtbacka RH, Kaufman HL, Collichio F, et al.: Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma. J Clin Oncol 33 (25): 2780-8, 2015. [PUBMED Abstract]
- Robert C, Ribas A, Wolchok JD, et al.: Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet 384 (9948): 1109-17, 2014. [PUBMED Abstract]
- Robert C, Schachter J, Long GV, et al.: Pembrolizumab versus Ipilimumab in Advanced Melanoma. N Engl J Med 372 (26): 2521-32, 2015. [PUBMED Abstract]
- Schachter J, Ribas A, Long GV, et al.: Pembrolizumab versus ipilimumab for advanced melanoma: final overall survival results of a multicentre, randomised, open-label phase 3 study (KEYNOTE-006). Lancet 390 (10105): 1853-1862, 2017. [PUBMED Abstract]
- Robert C, Long GV, Brady B, et al.: Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 372 (4): 320-30, 2015. [PUBMED Abstract]
- Zhao X, Suryawanshi S, Hruska M, et al.: Assessment of nivolumab benefit-risk profile of a 240-mg flat dose relative to a 3-mg/kg dosing regimen in patients with advanced tumors. Ann Oncol 28 (8): 2002-2008, 2017. [PUBMED Abstract]
- Robert C, Thomas L, Bondarenko I, et al.: Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 364 (26): 2517-26, 2011. [PUBMED Abstract]
- Hodi FS, O'Day SJ, McDermott DF, et al.: Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 363 (8): 711-23, 2010. [PUBMED Abstract]
- Yervoy (Ipilimumab): Immune-Mediated Adverse Reaction Management Guide. Princeton, NJ: Bristol-Myers Squibb, 2011. Available online. Last accessed May 1, 2025.
- Atkins MB, Lotze MT, Dutcher JP, et al.: High-dose recombinant interleukin 2 therapy for patients with metastatic melanoma: analysis of 270 patients treated between 1985 and 1993. J Clin Oncol 17 (7): 2105-16, 1999. [PUBMED Abstract]
- Atkins MB, Kunkel L, Sznol M, et al.: High-dose recombinant interleukin-2 therapy in patients with metastatic melanoma: long-term survival update. Cancer J Sci Am 6 (Suppl 1): S11-4, 2000. [PUBMED Abstract]
- Postow MA, Chesney J, Pavlick AC, et al.: Nivolumab and ipilimumab versus ipilimumab in untreated melanoma. N Engl J Med 372 (21): 2006-17, 2015. [PUBMED Abstract]
- Larkin J, Chiarion-Sileni V, Gonzalez R, et al.: Combined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma. N Engl J Med 373 (1): 23-34, 2015. [PUBMED Abstract]
- Wolchok JD, Chiarion-Sileni V, Gonzalez R, et al.: Overall Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med 377 (14): 1345-1356, 2017. [PUBMED Abstract]
- Tawbi HA, Forsyth PA, Algazi A, et al.: Combined Nivolumab and Ipilimumab in Melanoma Metastatic to the Brain. N Engl J Med 379 (8): 722-730, 2018. [PUBMED Abstract]
- Heidorn SJ, Milagre C, Whittaker S, et al.: Kinase-dead BRAF and oncogenic RAS cooperate to drive tumor progression through CRAF. Cell 140 (2): 209-21, 2010. [PUBMED Abstract]
- Hatzivassiliou G, Song K, Yen I, et al.: RAF inhibitors prime wild-type RAF to activate the MAPK pathway and enhance growth. Nature 464 (7287): 431-5, 2010. [PUBMED Abstract]
- Poulikakos PI, Zhang C, Bollag G, et al.: RAF inhibitors transactivate RAF dimers and ERK signalling in cells with wild-type BRAF. Nature 464 (7287): 427-30, 2010. [PUBMED Abstract]
- Su F, Viros A, Milagre C, et al.: RAS mutations in cutaneous squamous-cell carcinomas in patients treated with BRAF inhibitors. N Engl J Med 366 (3): 207-15, 2012. [PUBMED Abstract]
- Chapman PB, Hauschild A, Robert C, et al.: Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med 364 (26): 2507-16, 2011. [PUBMED Abstract]
- Sosman JA, Kim KB, Schuchter L, et al.: Survival in BRAF V600-mutant advanced melanoma treated with vemurafenib. N Engl J Med 366 (8): 707-14, 2012. [PUBMED Abstract]
- Hauschild A, Grob JJ, Demidov LV, et al.: Dabrafenib in BRAF-mutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial. Lancet 380 (9839): 358-65, 2012. [PUBMED Abstract]
- Flaherty KT, Robert C, Hersey P, et al.: Improved survival with MEK inhibition in BRAF-mutated melanoma. N Engl J Med 367 (2): 107-14, 2012. [PUBMED Abstract]
- Hodi FS, Friedlander P, Corless CL, et al.: Major response to imatinib mesylate in KIT-mutated melanoma. J Clin Oncol 26 (12): 2046-51, 2008. [PUBMED Abstract]
- Guo J, Si L, Kong Y, et al.: Phase II, open-label, single-arm trial of imatinib mesylate in patients with metastatic melanoma harboring c-Kit mutation or amplification. J Clin Oncol 29 (21): 2904-9, 2011. [PUBMED Abstract]
- Carvajal RD, Antonescu CR, Wolchok JD, et al.: KIT as a therapeutic target in metastatic melanoma. JAMA 305 (22): 2327-34, 2011. [PUBMED Abstract]
- Long GV, Stroyakovskiy D, Gogas H, et al.: Combined BRAF and MEK inhibition versus BRAF inhibition alone in melanoma. N Engl J Med 371 (20): 1877-88, 2014. [PUBMED Abstract]
- Long GV, Stroyakovskiy D, Gogas H, et al.: Dabrafenib and trametinib versus dabrafenib and placebo for Val600 BRAF-mutant melanoma: a multicentre, double-blind, phase 3 randomised controlled trial. Lancet 386 (9992): 444-51, 2015. [PUBMED Abstract]
- Robert C, Karaszewska B, Schachter J, et al.: Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med 372 (1): 30-9, 2015. [PUBMED Abstract]
- Robert C, Grob JJ, Stroyakovskiy D, et al.: Five-Year Outcomes with Dabrafenib plus Trametinib in Metastatic Melanoma. N Engl J Med 381 (7): 626-636, 2019. [PUBMED Abstract]
- Larkin J, Ascierto PA, Dréno B, et al.: Combined vemurafenib and cobimetinib in BRAF-mutated melanoma. N Engl J Med 371 (20): 1867-76, 2014. [PUBMED Abstract]
- Dummer R, Ascierto PA, Gogas HJ, et al.: Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 19 (5): 603-615, 2018. [PUBMED Abstract]
- Dummer R, Ascierto PA, Gogas HJ, et al.: Overall survival in patients with BRAF-mutant melanoma receiving encorafenib plus binimetinib versus vemurafenib or encorafenib (COLUMBUS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 19 (10): 1315-1327, 2018. [PUBMED Abstract]
- Gutzmer R, Stroyakovskiy D, Gogas H, et al.: Atezolizumab, vemurafenib, and cobimetinib as first-line treatment for unresectable advanced BRAFV600 mutation-positive melanoma (IMspire150): primary analysis of the randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 395 (10240): 1835-1844, 2020. [PUBMED Abstract]
- Chapman PB, Einhorn LH, Meyers ML, et al.: Phase III multicenter randomized trial of the Dartmouth regimen versus dacarbazine in patients with metastatic melanoma. J Clin Oncol 17 (9): 2745-51, 1999. [PUBMED Abstract]
- Middleton MR, Grob JJ, Aaronson N, et al.: Randomized phase III study of temozolomide versus dacarbazine in the treatment of patients with advanced metastatic malignant melanoma. J Clin Oncol 18 (1): 158-66, 2000. [PUBMED Abstract]
- Avril MF, Aamdal S, Grob JJ, et al.: Fotemustine compared with dacarbazine in patients with disseminated malignant melanoma: a phase III study. J Clin Oncol 22 (6): 1118-25, 2004. [PUBMED Abstract]
- Anderson CM, Buzaid AC, Legha SS: Systemic treatments for advanced cutaneous melanoma. Oncology (Huntingt) 9 (11): 1149-58; discussion 1163-4, 1167-8, 1995. [PUBMED Abstract]
- Wagner JD, Gordon MS, Chuang TY, et al.: Current therapy of cutaneous melanoma. Plast Reconstr Surg 105 (5): 1774-99; quiz 1800-1, 2000. [PUBMED Abstract]
- Mays SR, Nelson BR: Current therapy of cutaneous melanoma. Cutis 63 (5): 293-8, 1999. [PUBMED Abstract]
- Patel PM, Suciu S, Mortier L, et al.: Extended schedule, escalated dose temozolomide versus dacarbazine in stage IV melanoma: final results of a randomised phase III study (EORTC 18032). Eur J Cancer 47 (10): 1476-83, 2011. [PUBMED Abstract]
- Kirkwood JM, Strawderman MH, Ernstoff MS, et al.: Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684. J Clin Oncol 14 (1): 7-17, 1996. [PUBMED Abstract]
- Kirkwood JM, Ibrahim JG, Sondak VK, et al.: High- and low-dose interferon alfa-2b in high-risk melanoma: first analysis of intergroup trial E1690/S9111/C9190. J Clin Oncol 18 (12): 2444-58, 2000. [PUBMED Abstract]
- Kirkwood JM, Ibrahim J, Lawson DH, et al.: High-dose interferon alfa-2b does not diminish antibody response to GM2 vaccination in patients with resected melanoma: results of the Multicenter Eastern Cooperative Oncology Group Phase II Trial E2696. J Clin Oncol 19 (5): 1430-6, 2001. [PUBMED Abstract]
- Hancock BW, Wheatley K, Harris S, et al.: Adjuvant interferon in high-risk melanoma: the AIM HIGH Study--United Kingdom Coordinating Committee on Cancer Research randomized study of adjuvant low-dose extended-duration interferon Alfa-2a in high-risk resected malignant melanoma. J Clin Oncol 22 (1): 53-61, 2004. [PUBMED Abstract]
- Koops HS, Vaglini M, Suciu S, et al.: Prophylactic isolated limb perfusion for localized, high-risk limb melanoma: results of a multicenter randomized phase III trial. European Organization for Research and Treatment of Cancer Malignant Melanoma Cooperative Group Protocol 18832, the World Health Organization Melanoma Program Trial 15, and the North American Perfusion Group Southwest Oncology Group-8593. J Clin Oncol 16 (9): 2906-12, 1998. [PUBMED Abstract]
- Lee ML, Tomsu K, Von Eschen KB: Duration of survival for disseminated malignant melanoma: results of a meta-analysis. Melanoma Res 10 (1): 81-92, 2000. [PUBMED Abstract]
- Leo F, Cagini L, Rocmans P, et al.: Lung metastases from melanoma: when is surgical treatment warranted? Br J Cancer 83 (5): 569-72, 2000. [PUBMED Abstract]
- Ollila DW, Hsueh EC, Stern SL, et al.: Metastasectomy for recurrent stage IV melanoma. J Surg Oncol 71 (4): 209-13, 1999. [PUBMED Abstract]
- Gutman H, Hess KR, Kokotsakis JA, et al.: Surgery for abdominal metastases of cutaneous melanoma. World J Surg 25 (6): 750-8, 2001. [PUBMED Abstract]
- Ives NJ, Stowe RL, Lorigan P, et al.: Chemotherapy compared with biochemotherapy for the treatment of metastatic melanoma: a meta-analysis of 18 trials involving 2,621 patients. J Clin Oncol 25 (34): 5426-34, 2007. [PUBMED Abstract]
- Rate WR, Solin LJ, Turrisi AT: Palliative radiotherapy for metastatic malignant melanoma: brain metastases, bone metastases, and spinal cord compression. Int J Radiat Oncol Biol Phys 15 (4): 859-64, 1988. [PUBMED Abstract]
- Herbert SH, Solin LJ, Rate WR, et al.: The effect of palliative radiation therapy on epidural compression due to metastatic malignant melanoma. Cancer 67 (10): 2472-6, 1991. [PUBMED Abstract]
- Martin MJ, Hayward R, Viros A, et al.: Metformin accelerates the growth of BRAF V600E-driven melanoma by upregulating VEGF-A. Cancer Discov 2 (4): 344-55, 2012. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (04/26/2024)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes incorporados a este resumen a partir de la fecha arriba indicada.
Información general sobre el melanoma
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2024 (se citó a la American Cancer Society como referencia 1).
Se revisó texto para indicar que desde principios de la década de 2000, la incidencia de melanoma en las personas de 50 años, y mayores de esa edad, se estabilizó en los hombres y aumentó en cerca del 3 % por año en las mujeres.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del melanoma. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
El revisor principal del sumario sobre Tratamiento del melanoma es:
- Shaheer A. Khan, DO (Columbia University Irving Medical Center)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del melanoma. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/piel/pro/tratamiento-melanoma-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.