Tratamiento del cáncer de seno (mama) (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer de mama
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por cáncer de mama (solo en mujeres) en los Estados Unidos en 2025:[1]
- Casos nuevos: 316 950.
- Defunciones: 42 170.
El cáncer de mama es el cáncer extracutáneo más frecuente en las mujeres de los Estados Unidos; se calcula que en 2025 se presentarán 59 080 casos de carcinoma ductal de mama in situ (CDIS) y 316 950 casos de enfermedad invasiva.[1] Alrededor de 42 170 mujeres con diagnóstico de cáncer de mama (menos de 1 de cada 8) morirán por la enfermedad. En comparación, cerca de 60 540 mujeres morirán por cáncer de pulmón en los Estados Unidos en 2025.[1] Los hombres representan el 1 % de los casos de cáncer de mama y de las muertes por este tipo de cáncer. Para obtener más información, consultar la sección Poblaciones especiales en Exámenes de detección del cáncer de mama.
La adopción generalizada de exámenes de detección aumenta la incidencia del cáncer de mama en una población determinada y cambia las características de los cánceres que se detectan, de manera que aumenta la incidencia de cánceres de riesgo más bajo, lesiones premalignas y CDIS. Para obtener más información, consultar la sección Carcinoma ductal in situ en Exámenes de detección del cáncer de mama. En estudios poblacionales de los Estados Unidos[2] y el Reino Unido [3] se observó un aumento de la incidencia de CDIS y cáncer de mama invasivo desde la década de 1970, que se atribuye a la adopción generalizada de la terapia hormonal en la posmenopausia y de la mamografía como examen de detección. En la última década, las mujeres se han abstenido de usar hormonas durante la posmenopausia y la incidencia de cáncer de mama ha disminuido, pero no hasta los niveles observados antes del uso generalizado de mamografías de detección.[4]
Características anatómicas

Factores de riesgo
El envejecimiento es el factor de riesgo más importante para la mayoría de cánceres. Otros factores de riesgo del cáncer de mama son los siguientes:
- Antecedentes médicos familiares.[5]
- Susceptibilidad hereditaria importante.[6,7]
- Consumo de bebidas alcohólicas.
- Densidad del tejido mamario (mamográfica).[10]
- Estrógeno (endógeno).[11-13]
- Antecedentes de terapia hormonal.
- Terapia de reemplazo hormonal combinada de estrógeno y progestina.
- Obesidad (después de la menopausia).[16]
- Antecedentes personales de cáncer de mama.[17]
- Antecedentes personales de enfermedad proliferativa benigna de la mama.[18-20]
- Exposición a radiación dirigida a la mama o el tórax.[21]
Se dispone de cálculos de riesgo específicos por edad útiles para diseñar estrategias de detección orientadas a mujeres con antecedentes familiares de cáncer de mama y sin estos. Las herramientas más utilizadas son el modelo de Gail y la versión 8 del modelo IBIS Breast Cancer Risk Evaluation Tool de Tyrer-Cuzick (que incorpora los antecedentes familiares en mayor medida que el modelo de Gail, así como la densidad mamaria).[22]
Entre el 5 % y el 10 % de todas las mujeres con cáncer de mama tienen una variante patogénica germinal en los genes BRCA1 y BRCA2.[23] Las variantes específicas en los genes BRCA1 y BRCA2 son más frecuentes en mujeres de ascendencia judía.[24] El riesgo estimado de por vida de cáncer de mama para las mujeres con variantes de los genes BRCA1 y BRCA2 es del 40 % al 85 %. Las portadoras de variantes de BRCA1 y BRCA2 que además presentan antecedentes de cáncer de mama tienen un aumento del riesgo (hasta del 5 % por año) de enfermedad contralateral.[25] Los hombres portadores de variantes patogénicas de los genes BRCA1 y BRCA2 también tienen aumento del riesgo de cáncer de mama.[26]
Las variantes patogénicas de los genes BRCA1 o BRCA2 también confieren un aumento del riesgo de cáncer de ovario [26,27] y otros cánceres primarios.[26,27] Cuando se identifica una variante de los genes BRCA1 o BRCA2, es posible derivar a otros miembros de la familia a consejería y análisis genéticos.[28-31]
Para obtener más información, consultar Prevención del cáncer de mama, Exámenes de detección del cáncer de mama, además de la información en inglés Genetics of Breast and Gynecologic Cancers.
Factores de protección
Los siguientes factores de protección e intervenciones reducen el riesgo de cáncer de mama en las mujeres:
- Uso de estrógeno (después de una histerectomía).[32-34]
- Ejercicio físico.[35-37]
- Embarazo temprano.[38-40]
- Lactancia materna.[41]
- Moduladores selectivos del receptor de estrógeno (MSRE).[42]
- Inhibidores o inactivadores de la aromatasa.[43,44]
- Mastectomía para reducir el riesgo (preventiva).[45]
- Ooforectomía o ablación ovárica para reducir el riesgo (preventiva).[46-49]
Para obtener más información sobre los factores que reducen el riesgo del cáncer de mama, consultar Prevención del cáncer de mama.
Detección
En ensayos clínicos se estableció que la detección mediante mamografía (con o sin examen clínico de la mama) en mujeres asintomáticas disminuye la mortalidad por cáncer de mama. Para obtener más información, consultar Exámenes de detección del cáncer de mama.
Diagnóstico
Evaluación de la paciente
Cuando se presume que hay cáncer de mama, el abordaje de la paciente suele incluir los siguientes pasos:
- Confirmación del diagnóstico.
- Evaluación del estadio de la enfermedad.
- Selección del tratamiento.
Para diagnosticar el cáncer de mama, se utilizan las siguientes pruebas y procedimientos:
- Mamografía.
- Ecografía.
- Imágenes por resonancia magnética (IRM) de la mama según la indicación clínica.
- Biopsia.
Enfermedad contralateral
Desde el punto de vista anatomopatológico, el cáncer de mama puede ser una enfermedad multicéntrica y bilateral. La enfermedad bilateral sincrónica es, hasta cierto punto, más común en pacientes con carcinoma lobulillar infiltrante. A los 10 años del diagnóstico, el riesgo de cáncer primario en la mama contralateral oscila entre el 3 % y el 5 %, aunque la terapia endocrina disminuye ese riesgo.[50-53] La aparición de un cáncer de mama contralateral se relaciona con mayor riesgo de recidiva a distancia.[54] Cuando las pacientes con variantes patogénicas de los genes BRCA1 o BRCA2 reciben el diagnóstico antes de los 40 años, el riesgo de cáncer de mama contralateral se acerca al 50 % durante los siguientes 25 años.[55,56]
Las pacientes con cáncer de mama se someterán a mamografía bilateral en el momento del diagnóstico para descartar una enfermedad sincrónica. Luego, las pacientes continuarán el seguimiento con examen físico mamario y mamografías regulares para detectar una recidiva en la mama ipsilateral de las pacientes sometidas a cirugía de conservación de la mama o para detectar un segundo cáncer primario en la mama contralateral.
La función de la IRM para la detección en la mama contralateral y para el seguimiento de las mujeres que reciben terapia de conservación de la mama continúa en evolución. Debido a que las IRM aumentan la tasa de detección de enfermedad oculta en la mamografía, cada vez se usan más las IRM como examen de detección adicional, a pesar de la ausencia de datos aleatorizados y controlados. Solo el 25 % de los hallazgos anormales en las IRM indican neoplasia maligna, por lo tanto se recomienda confirmación patológica antes de iniciar tratamiento. Se desconoce si este aumento de la tasa de detección se traducirá en mejores desenlaces del tratamiento.[57-59]
Factores pronósticos y predictivos
Por lo general, el cáncer de mama se trata con diferentes combinaciones de cirugía, radioterapia, quimioterapia y terapia hormonal. El pronóstico y la elección del tratamiento dependen de las siguientes características clínicas y patológicas (a partir de pruebas de histología convencional e inmunohistoquímica):[60]
- Estado menopáusico de la paciente.
- Estadio de la enfermedad.
- Grado del tumor primario.
- Estado de los receptores de estrógeno (ER) y progesterona (PR) en el tumor.
- Sobreexpresión o amplificación del receptor 2 del factor de crecimiento epidérmico humano (HER2).
- Tipo histológico. El cáncer de mama se clasifica en varios tipos histológicos, algunos de importancia pronóstica. Los tipos histológicos favorables son los carcinomas mucinosos, medulares y tubulares.[61-63] El tipo histológico puede afectar el abordaje de tratamiento, incluso la toma de decisiones sobre el manejo locorregional. Para obtener más información sobre el carcinoma lobulillar, consulte la sección Clasificación histopatológica del cáncer de mama.
El perfil molecular del cáncer de mama incluye los siguientes aspectos:[64]
- Prueba del estado de los receptores ER y PR.
- Prueba del estado del receptor HER2.
- Prueba de perfil génico mediante ensayo de micromatrices o reacción en cadena de la polimerasa con retrotranscripción (por ejemplo, MammaPrint, Oncotype DX, Breast Cancer Index [BCI]).
A partir de los resultados de las pruebas de ER, PR y HER2, el cáncer de mama se clasifica en uno de los siguientes subtipos:
- Cáncer de mama positivo para receptores hormonales.
- Cáncer de mama positivo para HER2.
- Cáncer de mama triple negativo (sin expresión anormal de ER, PR ni HER2).
El estado de los receptores ER, PR y HER2 es importante para determinar el pronóstico y predecir la respuesta a la terapia endocrina y la terapia dirigida a HER2. Se publicaron las directrices elaboradas por el grupo de consenso de la American Society of Clinical Oncology y el College of American Pathologists para estandarizar la ejecución, interpretación y notificación de los resultados de los ensayos utilizados para evaluar el estado de ER y PR mediante pruebas inmunohistoquímicas, y para evaluar el estado de HER2 mediante pruebas inmunohistoquímicas y de hibridación in situ.[65,66]
Las pruebas para determinar el perfil génico son las siguientes:
- MammaPrint. La primera prueba de perfil génico que aprobó la Administración de Alimentos y Medicamentos de los Estados Unidos fue la firma génica MammaPrint. El análisis de 70 genes de esta prueba permite clasificar los tumores en categorías pronósticas de riesgo alto y riego bajo.[67-71] El objetivo del ensayo MINDACT (NCT00433589) (ver más abajo) fue determinar la utilidad clínica y el beneficio para las pacientes de la quimioterapia adyuvante.
- Oncotype DX. El análisis de 21 genes Oncotype DX es la prueba de perfil génico con la validación clínica más amplia hasta el momento, y se usa para el cáncer de mama positivo para receptores hormonales y negativo para HER2. A partir del grado de expresión de cada uno de los 21 genes se calcula una puntuación de recidiva que proporciona información sobre el pronóstico y orienta la toma de decisiones sobre el tratamiento.
En la población sin compromiso ganglionar (ganglios linfáticos negativos), los grupos de riesgo designados son los siguientes:
- Grupo de riesgo bajo: puntuación de recidiva ≤11. La quimioterapia no está indicada en este grupo.
- Grupo de riesgo intermedio: puntuación de recidiva entre 11 y 25. En este grupo de pacientes la toma de decisiones sobre la quimioterapia es compleja y personalizada, entre otros factores, se tiene en cuenta la edad (≤50 vs. >50 años), las características clinicopatológicas y las preferencias personales.
- Grupo de riesgo alto: puntaje de recidiva >25. La quimioterapia está indicada en este grupo.
En la población posmenopáusica con compromiso ganglionar (ganglios linfáticos positivos), los grupos de riesgo designados son los siguientes:
- Grupo de riesgo bajo: puntuación de recidiva ≤25. La quimioterapia no está indicada en este grupo.
- Grupo de riesgo alto: puntaje de recidiva >25. La quimioterapia está indicada en este grupo.
- BCI. El BCI es una combinación de dos perfiles, el cociente de expresión de HOXB13/IL17BR (cociente H/I) y el índice de grado molecular, que ha demostrado utilidad pronóstica y predictiva en pacientes con cáncer de mama positivo para receptores hormonales.
En los siguientes ensayos se describe el valor pronóstico y predictivo de los análisis multigénicos para el cáncer de mama en estadio temprano:
- La capacidad pronóstica del análisis de 21 genes Oncotype DX se evaluó en dos ensayos aleatorizados.
- En el ensayo National Surgical Adjuvant Breast and Bowel Project (NSABP B-14), las pacientes se asignaron al azar para recibir tamoxifeno o un placebo; los resultados que favorecieron el tamoxifeno modificaron la práctica clínica a finales de la década de 1980.[72] Se dispuso de tejido fijado con formol e incluido en parafina de 668 pacientes. El riesgo de recidiva a distancia a 10 años en las pacientes tratadas con tamoxifeno fue del 7 % en aquellas con una puntuación de recidiva baja (definida en este ensayo como <18), del 14 % en aquellas con una puntuación de recidiva intermedia (definida en este ensayo como 18–30) y del 31 % en aquellas con una puntuación de recidiva alta (definida en este ensayo como ≥31) (P < 0,001).[73]
- En un estudio comunitario de casos y controles, se examinó la capacidad pronóstica de la puntuación de recidiva para predecir las muertes por cáncer de mama después de 10 años en un grupo de pacientes tratadas con tamoxifeno y se observó un patrón pronóstico similar al observado en las pacientes del ensayo NSABP B-14.[74]
- En el ensayo NSABP B-20, se evaluó por primera vez de forma prospectiva y retrospectiva el uso de Oncotype DX para predecir el beneficio de la quimioterapia en pacientes con cáncer de mama positivo para ER sin compromiso ganglionar asignadas a un grupo de tratamiento con tamoxifeno solo (n = 227) o a uno de los grupos de tratamiento combinado (n = 424).[72]Las pacientes del ensayo NSABP B-20 se asignaron al azar para recibir tamoxifeno solo, tamoxifeno con metotrexato y fluorouracilo (MF) o ciclofosfamida con MF.[75]
- La supervivencia sin enfermedad (SSE) a distancia a 10 años mejoró del 60 % al 88 % al agregar quimioterapia al tamoxifeno en el grupo de riesgo alto (definido en este ensayo por una puntuación ≥31), mientras que no se observó beneficio en el grupo con puntuación de recidiva baja.[76]
- Se notificaron hallazgos similares en la evaluación prospectiva y retrospectiva del ensayo SWOG-8814 (NCT00929591) en pacientes posmenopáusicas positivas para receptores hormonales y con compromiso ganglionar, que recibieron tamoxifeno con ciclofosfamida, doxorrubicina y fluorouracilo, o sin estos.[77] Sin embargo, el tamaño de la muestra en este análisis fue pequeño, el seguimiento fue de solo 5 años y se debe tener en cuenta el efecto pronóstico del compromiso ganglionar.
- Cabe indicar que la potencia estadística de ambos análisis (NSABP B-20 y S8814) fue insuficiente para un análisis predictivo concluyente en pacientes con una puntuación de recidiva intermedia.
- Los resultados del ensayo prospectivo aleatorizado TAILORx (NCT00310180) indican que es poco probable que la quimioterapia proporcione un beneficio importante a las pacientes mayores de 50 años con enfermedad positiva para ER-PR, sin compromiso ganglionar y una puntuación de recidiva de 11 a 25.[78] En este estudio, se definió una puntuación de riesgo bajo como menor de 11, una puntuación de riesgo intermedio de 11 a 25 y una puntuación de riesgo alto como mayor de 25. Estos valores de corte son diferentes a los descritos antes.
Se encontró que las pacientes de este estudio con una puntuación de riesgo bajo tenían tasas de recidiva a 5 años muy bajas con la terapia endocrina.[79]
- La tasa de SSE invasiva (SSEI) fue del 93 % a los 5 años y del 84 % a los 9 años.
- La tasa de cáncer de mama sin recidiva a distancia fue del 99,3 % a los 5 años y del 96,8 % a los 9 años.
- La tasa de cáncer de mama sin recidiva a distancia ni recidiva regional local fue del 98,7 % a los 5 años y del 95,0 % a los 9 años.
- La tasa de supervivencia general (SG) fue del 98,0 % a los 5 años y del 93,7 % a los 9 años.
En el grupo de riesgo intermedio del estudio TAILORx (puntuación de recidiva, 11–25), 6907 mujeres se asignaron al azar para recibir terapia endocrina sola o terapia endocrina con quimioterapia.[78] De estas, 3399 mujeres en el grupo de terapia endocrina sola y 3312 mujeres en el grupo de terapia endocrina y quimioterapia contaban con datos disponibles para un análisis, según la asignación aleatorizada al tratamiento. Al cabo de una mediana de seguimiento de 90 meses, la diferencia en la tasa de SSEI, criterio principal de valoración del estudio, cumplió con el criterio de ausencia de inferioridad predeterminado (P > 0,10 para la prueba de ausencia de diferencia después de 835 episodios), lo que indica la ausencia de inferioridad de la terapia endocrina en comparación con la terapia endocrina y quimioterapia.
- En esta población, la tasa de SSEI a 9 años fue del 83,3 % en el grupo de terapia endocrina sola y del 84,3 % en el grupo de terapia endocrina y quimioterapia (cociente de riesgos instantáneos [CRI], 1,08; intervalo de confianza [IC] 95 %, 0,94–1,24; P = 0,26).[78][Nivel de evidencia B1]
- En el grupo de terapia endocrina sola, 185 pacientes recibieron quimioterapia; en el grupo de terapia endocrina y quimioterapia, 608 pacientes no recibieron la quimioterapia asignada. En un análisis basado en el tratamiento real que se administró, el CRI de la SSEI fue de 1,14 (IC 95 %, 0,99–1,31; P = 0,06).
- Los resultados de los otros criterios de valoración examinados (ausencia de recidiva a distancia de cáncer de mama, ausencia de recidiva local o a distancia, y SG) fueron similares en los 2 grupos de tratamiento y ninguno fue significativo (P < 10).
- Hubo interacción significativa entre la asignación del tratamiento y la edad (P = 0,03) con respecto a la SSEI, lo que indica que la quimioterapia quizás sea beneficiosa para las mujeres menores de 50 años con puntuaciones de recidiva de 11 a 25.
- En un análisis secundario de TAILORx se demostró que la integración del riesgo clínico (evaluado según el tamaño y el grado tumoral) aporta información pronóstica a la puntuación de recidiva de las mujeres con puntuaciones de al menos 11; sin embargo, el riesgo clínico no fue un indicador predictivo del beneficio de la quimioterapia.[80] En este análisis secundario se evaluó la interacción entre la edad y el beneficio de la quimioterapia. Entre las mujeres de 50 años o menos, las tasas de recidiva a distancia fueron más bajas en las pacientes con puntuaciones de recidiva de 16 a 20 y riesgo clínico alto que recibieron quimioterapia. Las tasas también fueron más bajas en las pacientes con puntuaciones de recidiva de 21 a 25, independientemente del riesgo clínico.
- La mayoría de las mujeres recibieron tamoxifeno como terapia endocrina. No está claro si la supresión del funcionamiento ovárico produjo alguno de los beneficios observados con la quimioterapia ni si es posible lograr dichos beneficios mediante terapia endocrina.
- En el ensayo MINDACT (NCT00433589) se analizó la posibilidad de incluir la evaluación del riesgo genómico obtenida con la prueba MammaPrint, a la clasificación de riesgo clínico (modificada de Adjuvant! Online) para orientar la elección de opciones más adecuadas de quimioterapia en las mujeres con cáncer de mama sin compromiso ganglionar o con compromiso de 1 a 3 ganglios.[81][Nivel de evidencia C2] A diferencia del estudio TAILORx, en el que solo participaron pacientes cuyo cáncer era positivo para receptores hormonales, en este ensayo participaron pacientes con cáncer negativo para receptores hormonales. En este estudio prospectivo, las mujeres con clasificación genómica y clínica de riesgo alto recibieron quimioterapia, mientras que las mujeres con clasificación genómica y clínica de riesgo bajo no recibieron quimioterapia. Las participantes con resultados contradictorios en las clasificaciones (riesgo clínico alto y riesgo genómico bajo o riesgo clínico bajo y riesgo genómico alto) se asignaron al azar para recibir quimioterapia o no recibirla. De esta manera, se asignaron al azar a 1550 mujeres de riesgo clínico alto y riesgo genómico bajo y 592 mujeres de riesgo clínico bajo y riesgo genómico alto. El objetivo principal del estudio fue determinar si las pacientes de riesgo clínico alto, pero riesgo genómico bajo, que no recibieron quimioterapia lograban una tasa de supervivencia a 5 años sin metástasis a distancia (criterio principal de valoración del estudio) del 92 % o inferior (diseño de ausencia de inferioridad).
- Este criterio de valoración se cumplió porque la tasa que se observó en el grupo fue del 94,7 % (IC 95 %, 92,5–96,2 %). Sin embargo, entre las pacientes de riesgo clínico alto y riesgo genómico bajo, la tasa de supervivencia a 5 años sin metástasis a distancia fue un 1,5 % más alta en el grupo que recibió quimioterapia que en el grupo que no recibió quimioterapia, aunque el estudio no tuvo una potencia estadística suficiente para detectar una diferencia entre estos grupos (CRI con quimioterapia vs. sin quimioterapia, 0,78; IC 95 %, 0,50–1,21; P = 0,27).
- El resultado fue mejor para las pacientes del grupo de riesgo clínico bajo y riesgo genómico alto, aunque se encontraron pocos indicios de beneficio de la quimioterapia en este grupo (supervivencia a 5 años sin metástasis a distancia, 95,8 % con quimioterapia vs. 95,0 % sin quimioterapia; CRI, 1,17; IC 95 %, 0,59–2,28; P = 0,66).
- En el ensayo RxPONDER (NCT01272037) participaron 3350 mujeres posmenopáusicas y 1665 premenopáusicas con cáncer de mama positivo para receptores hormonales y negativo para HER2 con una puntuación de recidiva de 25 o inferior. Las pacientes se asignaron al azar para recibir terapia endocrina sola o terapia endocrina y quimioterapia. Los resultados se notificaron como resumen; el criterio principal de valoración del estudio fue la SSEI. Debido a que los resultados de la prueba preespecificada para la interacción entre la asignación al tratamiento y el estado menopáusico fueron significativos P = 0,004), los grupos de mujeres premenopáusicas y posmenopáusicas se analizaron por separado.[82]
- En las pacientes posmenopáusicas, no hubo indicios de beneficio al añadir la quimioterapia (CRI para la terapia endocrina y quimioterapia vs. terapia endocrina, 0,97; IC 95 %, 0,78–1,22; tasa de SSEI a 5 años, 91,6 vs. 91,9 %; P = 0,82).[82][Nivel de evidencia B1]
- Sin embargo, en las pacientes premenopáusicas hubo indicios de beneficio al usar la quimioterapia con la terapia endocrina (CRI, 0,54, IC 95 %, 0,38–0,76; tasa de SSEI a 5 años, 94,2 vs. 89,0 %; P = 0,0004). La SG también mejoró significativamente en las pacientes que recibieron terapia endocrina y quimioterapia (CRI, 0,47; IC 95 %, 0,24–0,94; P = 0,032).[Nivel de evidencia A1]
- En el ensayo del West German Study Group, Plan B (NCT01049425) se comparó 2 regímenes quimioterapéuticos en pacientes con enfermedad con compromiso ganglionar (pN1) o enfermedad de riesgo alto sin compromiso ganglionar. La quimioterapia no se ofreció a las pacientes con puntuaciones de recidiva inferiores a 12, pero se les hizo el seguimiento. Para obtener una descripción completa de los regímenes quimioterapéuticos, consultar Terapia sistémica posoperatoria para el cáncer de mama positivo para receptores hormonales y negativo para HER2.
- Las tasas de SSE a 5 años fueron muy altas en las 348 pacientes que no recibieron quimioterapia y no hubo diferencia entre las pacientes sin compromiso ganglionar (94,5 %) y las pacientes con enfermedad pN1 (94,9 %).[83][Nivel de evidencia C1]
- La capacidad pronóstica del BCI se ha descrito en múltiples ensayos.[84-86]
- Se ha demostrado que el cociente de expresión H/I predice la SSE en pacientes con cáncer de mama positivo para receptores hormonales y sin compromiso ganglionar tratado con tamoxifeno.[84]
- La capacidad pronóstica del cociente H/I con respecto a la recidiva tardía y el beneficio del tratamiento se evaluó en el ensayo MA.17. Un cociente H/I elevado se relacionó de forma estadísticamente significativa con una disminución de la recidiva tardía en las pacientes que recibieron terapia prolongada con letrozol, en comparación con aquellas que no la recibieron (oportunidad relativa, 0,35; IC 95 %, 0,16–0,75; P = 0,007).[85]
- En un análisis secundario del ensayo ATAC, el BCI fue pronóstico en pacientes con cáncer de mama sin compromiso ganglionar para la recidiva a distancia temprana (años 0–5) y tardía (años 5–10). En las pacientes con tumores positivos para receptores hormonales y negativos para HER2 en estadio I, un cociente H/I elevado predijo tasas significativas de recidiva tardía a distancia.[86]
- También se evaluó la capacidad predictiva del BCI.[87]
- El cociente H/I del BCI se evaluó para determinar su capacidad de predecir el beneficio de la terapia endocrina prolongada en pacientes que participaron en el ensayo aTTom (NCT00003678). Una designación del cociente H/I del BCI alta predijo la respuesta endocrina. Un subgrupo de pacientes con enfermedad positiva para receptores hormonales y compromiso ganglionar obtuvo un beneficio significativo con 10 años de terapia con tamoxifeno (versus 5 años). Las pacientes con designación del cociente H/I del BCI baja no mostraron ningún beneficio significativo con la terapia endocrina prolongada.[87]
- El cociente H/I del BCI se evaluó como un biomarcador predictivo del beneficio de la terapia endocrina prolongada en las pacientes del ensayo IDEAL. Las muestras tumorales de 908 pacientes asignadas al azar para recibir letrozol prolongado durante 2,5 años versus 5 años se evaluaron mediante el BCI. Una designación del cociente H/I del BCI alta predijo de manera significativa el beneficio de la terapia prolongada con inhibidores de la aromatasa, mientras que las pacientes con una designación del cociente H/I del BCI baja no obtuvieron un beneficio significativo.[88]
Muchas otras pruebas génicas pueden orientar las decisiones de tratamiento en pacientes con cáncer de mama en estadio temprano (por ejemplo, Predictor Analysis of Microarray 50 [PAM50], puntuación de riesgo de recidiva, EndoPredict).
Si bien ciertas variantes hereditarias poco frecuentes (como las que afectan los genes BRCA1 y BRCA2) predisponen a las mujeres al cáncer de mama, la información pronóstica de las portadoras de BRCA1 o BRCA2 que presentan cáncer de mama es contradictoria. Estas mujeres tienen mayor riesgo de cáncer de mama contralateral. Para obtener más información en inglés, consultar la sección Female Breast Cancer Risks en BRCA1 and BRCA2: Cancer Risks and Management.
Consideraciones posteriores al tratamiento
Terapia de reemplazo hormonal
A partir de una evaluación minuciosa, algunas pacientes con síntomas graves se pueden tratar con terapia de reemplazo hormonal. Para obtener más información, consultar Prevención del cáncer de mama y la sección Terapia de reemplazo hormonal en Sofocos y sudores nocturnos.
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Altekruse SF, Kosary CL, Krapcho M, et al.: SEER Cancer Statistics Review, 1975-2007. National Cancer Institute, 2010. Also available online. Last accessed April 24, 2025.
- Johnson A, Shekhdar J: Breast cancer incidence: what do the figures mean? J Eval Clin Pract 11 (1): 27-31, 2005. [PUBMED Abstract]
- Haas JS, Kaplan CP, Gerstenberger EP, et al.: Changes in the use of postmenopausal hormone therapy after the publication of clinical trial results. Ann Intern Med 140 (3): 184-8, 2004. [PUBMED Abstract]
- Colditz GA, Kaphingst KA, Hankinson SE, et al.: Family history and risk of breast cancer: nurses' health study. Breast Cancer Res Treat 133 (3): 1097-104, 2012. [PUBMED Abstract]
- Malone KE, Daling JR, Doody DR, et al.: Family history of breast cancer in relation to tumor characteristics and mortality in a population-based study of young women with invasive breast cancer. Cancer Epidemiol Biomarkers Prev 20 (12): 2560-71, 2011. [PUBMED Abstract]
- Cybulski C, Wokołorczyk D, Jakubowska A, et al.: Risk of breast cancer in women with a CHEK2 mutation with and without a family history of breast cancer. J Clin Oncol 29 (28): 3747-52, 2011. [PUBMED Abstract]
- Goodwin PJ, Phillips KA, West DW, et al.: Breast cancer prognosis in BRCA1 and BRCA2 mutation carriers: an International Prospective Breast Cancer Family Registry population-based cohort study. J Clin Oncol 30 (1): 19-26, 2012. [PUBMED Abstract]
- Mavaddat N, Barrowdale D, Andrulis IL, et al.: Pathology of breast and ovarian cancers among BRCA1 and BRCA2 mutation carriers: results from the Consortium of Investigators of Modifiers of BRCA1/2 (CIMBA). Cancer Epidemiol Biomarkers Prev 21 (1): 134-47, 2012. [PUBMED Abstract]
- Razzaghi H, Troester MA, Gierach GL, et al.: Mammographic density and breast cancer risk in White and African American Women. Breast Cancer Res Treat 135 (2): 571-80, 2012. [PUBMED Abstract]
- Key TJ, Appleby PN, Reeves GK, et al.: Circulating sex hormones and breast cancer risk factors in postmenopausal women: reanalysis of 13 studies. Br J Cancer 105 (5): 709-22, 2011. [PUBMED Abstract]
- Kaaks R, Rinaldi S, Key TJ, et al.: Postmenopausal serum androgens, oestrogens and breast cancer risk: the European prospective investigation into cancer and nutrition. Endocr Relat Cancer 12 (4): 1071-82, 2005. [PUBMED Abstract]
- Kaaks R, Berrino F, Key T, et al.: Serum sex steroids in premenopausal women and breast cancer risk within the European Prospective Investigation into Cancer and Nutrition (EPIC). J Natl Cancer Inst 97 (10): 755-65, 2005. [PUBMED Abstract]
- Collaborative Group on Hormonal Factors in Breast Cancer: Menarche, menopause, and breast cancer risk: individual participant meta-analysis, including 118 964 women with breast cancer from 117 epidemiological studies. Lancet Oncol 13 (11): 1141-51, 2012. [PUBMED Abstract]
- Ritte R, Lukanova A, Tjønneland A, et al.: Height, age at menarche and risk of hormone receptor-positive and -negative breast cancer: a cohort study. Int J Cancer 132 (11): 2619-29, 2013. [PUBMED Abstract]
- Wolin KY, Carson K, Colditz GA: Obesity and cancer. Oncologist 15 (6): 556-65, 2010. [PUBMED Abstract]
- Kotsopoulos J, Chen WY, Gates MA, et al.: Risk factors for ductal and lobular breast cancer: results from the nurses' health study. Breast Cancer Res 12 (6): R106, 2010. [PUBMED Abstract]
- Goldacre MJ, Abisgold JD, Yeates DG, et al.: Benign breast disease and subsequent breast cancer: English record linkage studies. J Public Health (Oxf) 32 (4): 565-71, 2010. [PUBMED Abstract]
- Kabat GC, Jones JG, Olson N, et al.: A multi-center prospective cohort study of benign breast disease and risk of subsequent breast cancer. Cancer Causes Control 21 (6): 821-8, 2010. [PUBMED Abstract]
- Worsham MJ, Raju U, Lu M, et al.: Risk factors for breast cancer from benign breast disease in a diverse population. Breast Cancer Res Treat 118 (1): 1-7, 2009. [PUBMED Abstract]
- Travis LB, Hill DA, Dores GM, et al.: Breast cancer following radiotherapy and chemotherapy among young women with Hodgkin disease. JAMA 290 (4): 465-75, 2003. [PUBMED Abstract]
- Tyrer J, Duffy SW, Cuzick J: A breast cancer prediction model incorporating familial and personal risk factors. Stat Med 23 (7): 1111-30, 2004. [PUBMED Abstract]
- Blackwood MA, Weber BL: BRCA1 and BRCA2: from molecular genetics to clinical medicine. J Clin Oncol 16 (5): 1969-77, 1998. [PUBMED Abstract]
- Offit K, Gilewski T, McGuire P, et al.: Germline BRCA1 185delAG mutations in Jewish women with breast cancer. Lancet 347 (9016): 1643-5, 1996. [PUBMED Abstract]
- Frank TS, Manley SA, Olopade OI, et al.: Sequence analysis of BRCA1 and BRCA2: correlation of mutations with family history and ovarian cancer risk. J Clin Oncol 16 (7): 2417-25, 1998. [PUBMED Abstract]
- Cancer risks in BRCA2 mutation carriers. The Breast Cancer Linkage Consortium. J Natl Cancer Inst 91 (15): 1310-6, 1999. [PUBMED Abstract]
- Ford D, Easton DF, Bishop DT, et al.: Risks of cancer in BRCA1-mutation carriers. Breast Cancer Linkage Consortium. Lancet 343 (8899): 692-5, 1994. [PUBMED Abstract]
- Biesecker BB, Boehnke M, Calzone K, et al.: Genetic counseling for families with inherited susceptibility to breast and ovarian cancer. JAMA 269 (15): 1970-4, 1993. [PUBMED Abstract]
- Berry DA, Parmigiani G, Sanchez J, et al.: Probability of carrying a mutation of breast-ovarian cancer gene BRCA1 based on family history. J Natl Cancer Inst 89 (3): 227-38, 1997. [PUBMED Abstract]
- Hoskins KF, Stopfer JE, Calzone KA, et al.: Assessment and counseling for women with a family history of breast cancer. A guide for clinicians. JAMA 273 (7): 577-85, 1995. [PUBMED Abstract]
- Statement of the American Society of Clinical Oncology: genetic testing for cancer susceptibility, Adopted on February 20, 1996. J Clin Oncol 14 (5): 1730-6; discussion 1737-40, 1996. [PUBMED Abstract]
- Anderson GL, Limacher M, Assaf AR, et al.: Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women's Health Initiative randomized controlled trial. JAMA 291 (14): 1701-12, 2004. [PUBMED Abstract]
- LaCroix AZ, Chlebowski RT, Manson JE, et al.: Health outcomes after stopping conjugated equine estrogens among postmenopausal women with prior hysterectomy: a randomized controlled trial. JAMA 305 (13): 1305-14, 2011. [PUBMED Abstract]
- Anderson GL, Chlebowski RT, Aragaki AK, et al.: Conjugated equine oestrogen and breast cancer incidence and mortality in postmenopausal women with hysterectomy: extended follow-up of the Women's Health Initiative randomised placebo-controlled trial. Lancet Oncol 13 (5): 476-86, 2012. [PUBMED Abstract]
- Bernstein L, Henderson BE, Hanisch R, et al.: Physical exercise and reduced risk of breast cancer in young women. J Natl Cancer Inst 86 (18): 1403-8, 1994. [PUBMED Abstract]
- Thune I, Brenn T, Lund E, et al.: Physical activity and the risk of breast cancer. N Engl J Med 336 (18): 1269-75, 1997. [PUBMED Abstract]
- Adams-Campbell LL, Rosenberg L, Rao RS, et al.: Strenuous physical activity and breast cancer risk in African-American women. J Natl Med Assoc 93 (7-8): 267-75, 2001 Jul-Aug. [PUBMED Abstract]
- Kampert JB, Whittemore AS, Paffenbarger RS: Combined effect of childbearing, menstrual events, and body size on age-specific breast cancer risk. Am J Epidemiol 128 (5): 962-79, 1988. [PUBMED Abstract]
- Pike MC, Krailo MD, Henderson BE, et al.: 'Hormonal' risk factors, 'breast tissue age' and the age-incidence of breast cancer. Nature 303 (5920): 767-70, 1983. [PUBMED Abstract]
- Lambe M, Hsieh C, Trichopoulos D, et al.: Transient increase in the risk of breast cancer after giving birth. N Engl J Med 331 (1): 5-9, 1994. [PUBMED Abstract]
- Col: Breast cancer and breastfeeding: collaborative reanalysis of individual data from 47 epidemiological studies in 30 countries, including 50302 women with breast cancer and 96973 women without the disease. Lancet 360 (9328): 187-95, 2002. [PUBMED Abstract]
- Cuzick J, Sestak I, Bonanni B, et al.: Selective oestrogen receptor modulators in prevention of breast cancer: an updated meta-analysis of individual participant data. Lancet 381 (9880): 1827-34, 2013. [PUBMED Abstract]
- Goss PE, Ingle JN, Alés-Martínez JE, et al.: Exemestane for breast-cancer prevention in postmenopausal women. N Engl J Med 364 (25): 2381-91, 2011. [PUBMED Abstract]
- Cuzick J, Sestak I, Forbes JF, et al.: Anastrozole for prevention of breast cancer in high-risk postmenopausal women (IBIS-II): an international, double-blind, randomised placebo-controlled trial. Lancet 383 (9922): 1041-8, 2014. [PUBMED Abstract]
- Hartmann LC, Schaid DJ, Woods JE, et al.: Efficacy of bilateral prophylactic mastectomy in women with a family history of breast cancer. N Engl J Med 340 (2): 77-84, 1999. [PUBMED Abstract]
- Rebbeck TR, Levin AM, Eisen A, et al.: Breast cancer risk after bilateral prophylactic oophorectomy in BRCA1 mutation carriers. J Natl Cancer Inst 91 (17): 1475-9, 1999. [PUBMED Abstract]
- Kauff ND, Satagopan JM, Robson ME, et al.: Risk-reducing salpingo-oophorectomy in women with a BRCA1 or BRCA2 mutation. N Engl J Med 346 (21): 1609-15, 2002. [PUBMED Abstract]
- Rebbeck TR, Lynch HT, Neuhausen SL, et al.: Prophylactic oophorectomy in carriers of BRCA1 or BRCA2 mutations. N Engl J Med 346 (21): 1616-22, 2002. [PUBMED Abstract]
- Kauff ND, Domchek SM, Friebel TM, et al.: Risk-reducing salpingo-oophorectomy for the prevention of BRCA1- and BRCA2-associated breast and gynecologic cancer: a multicenter, prospective study. J Clin Oncol 26 (8): 1331-7, 2008. [PUBMED Abstract]
- Rosen PP, Groshen S, Kinne DW, et al.: Factors influencing prognosis in node-negative breast carcinoma: analysis of 767 T1N0M0/T2N0M0 patients with long-term follow-up. J Clin Oncol 11 (11): 2090-100, 1993. [PUBMED Abstract]
- Abbott A, Rueth N, Pappas-Varco S, et al.: Perceptions of contralateral breast cancer: an overestimation of risk. Ann Surg Oncol 18 (11): 3129-36, 2011. [PUBMED Abstract]
- Nichols HB, Berrington de González A, Lacey JV, et al.: Declining incidence of contralateral breast cancer in the United States from 1975 to 2006. J Clin Oncol 29 (12): 1564-9, 2011. [PUBMED Abstract]
- Giannakeas V, Lim DW, Narod SA: The risk of contralateral breast cancer: a SEER-based analysis. Br J Cancer 125 (4): 601-610, 2021. [PUBMED Abstract]
- Heron DE, Komarnicky LT, Hyslop T, et al.: Bilateral breast carcinoma: risk factors and outcomes for patients with synchronous and metachronous disease. Cancer 88 (12): 2739-50, 2000. [PUBMED Abstract]
- Graeser MK, Engel C, Rhiem K, et al.: Contralateral breast cancer risk in BRCA1 and BRCA2 mutation carriers. J Clin Oncol 27 (35): 5887-92, 2009. [PUBMED Abstract]
- Garber JE, Golshan M: Contralateral breast cancer in BRCA1/BRCA2 mutation carriers: the story of the other side. J Clin Oncol 27 (35): 5862-4, 2009. [PUBMED Abstract]
- Lehman CD, Gatsonis C, Kuhl CK, et al.: MRI evaluation of the contralateral breast in women with recently diagnosed breast cancer. N Engl J Med 356 (13): 1295-303, 2007. [PUBMED Abstract]
- Solin LJ, Orel SG, Hwang WT, et al.: Relationship of breast magnetic resonance imaging to outcome after breast-conservation treatment with radiation for women with early-stage invasive breast carcinoma or ductal carcinoma in situ. J Clin Oncol 26 (3): 386-91, 2008. [PUBMED Abstract]
- Morrow M: Magnetic resonance imaging in the breast cancer patient: curb your enthusiasm. J Clin Oncol 26 (3): 352-3, 2008. [PUBMED Abstract]
- Simpson JF, Gray R, Dressler LG, et al.: Prognostic value of histologic grade and proliferative activity in axillary node-positive breast cancer: results from the Eastern Cooperative Oncology Group Companion Study, EST 4189. J Clin Oncol 18 (10): 2059-69, 2000. [PUBMED Abstract]
- Rosen PP, Groshen S, Kinne DW: Prognosis in T2N0M0 stage I breast carcinoma: a 20-year follow-up study. J Clin Oncol 9 (9): 1650-61, 1991. [PUBMED Abstract]
- Diab SG, Clark GM, Osborne CK, et al.: Tumor characteristics and clinical outcome of tubular and mucinous breast carcinomas. J Clin Oncol 17 (5): 1442-8, 1999. [PUBMED Abstract]
- Rakha EA, Lee AH, Evans AJ, et al.: Tubular carcinoma of the breast: further evidence to support its excellent prognosis. J Clin Oncol 28 (1): 99-104, 2010. [PUBMED Abstract]
- Sørlie T, Perou CM, Tibshirani R, et al.: Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci U S A 98 (19): 10869-74, 2001. [PUBMED Abstract]
- Wolff AC, Somerfield MR, Dowsett M, et al.: Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: ASCO-College of American Pathologists Guideline Update. J Clin Oncol 41 (22): 3867-3872, 2023. [PUBMED Abstract]
- Allison KH, Hammond MEH, Dowsett M, et al.: Estrogen and Progesterone Receptor Testing in Breast Cancer: ASCO/CAP Guideline Update. J Clin Oncol 38 (12): 1346-1366, 2020. [PUBMED Abstract]
- Buyse M, Loi S, van't Veer L, et al.: Validation and clinical utility of a 70-gene prognostic signature for women with node-negative breast cancer. J Natl Cancer Inst 98 (17): 1183-92, 2006. [PUBMED Abstract]
- Wittner BS, Sgroi DC, Ryan PD, et al.: Analysis of the MammaPrint breast cancer assay in a predominantly postmenopausal cohort. Clin Cancer Res 14 (10): 2988-93, 2008. [PUBMED Abstract]
- Mook S, Knauer M, Bueno-de-Mesquita JM, et al.: Metastatic potential of T1 breast cancer can be predicted by the 70-gene MammaPrint signature. Ann Surg Oncol 17 (5): 1406-13, 2010. [PUBMED Abstract]
- Ishitobi M, Goranova TE, Komoike Y, et al.: Clinical utility of the 70-gene MammaPrint profile in a Japanese population. Jpn J Clin Oncol 40 (6): 508-12, 2010. [PUBMED Abstract]
- Knauer M, Mook S, Rutgers EJ, et al.: The predictive value of the 70-gene signature for adjuvant chemotherapy in early breast cancer. Breast Cancer Res Treat 120 (3): 655-61, 2010. [PUBMED Abstract]
- Fisher B, Jeong JH, Bryant J, et al.: Treatment of lymph-node-negative, oestrogen-receptor-positive breast cancer: long-term findings from National Surgical Adjuvant Breast and Bowel Project randomised clinical trials. Lancet 364 (9437): 858-68, 2004. [PUBMED Abstract]
- Paik S, Shak S, Tang G, et al.: A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer. N Engl J Med 351 (27): 2817-26, 2004. [PUBMED Abstract]
- Habel LA, Shak S, Jacobs MK, et al.: A population-based study of tumor gene expression and risk of breast cancer death among lymph node-negative patients. Breast Cancer Res 8 (3): R25, 2006. [PUBMED Abstract]
- Mamounas EP, Tang G, Fisher B, et al.: Association between the 21-gene recurrence score assay and risk of locoregional recurrence in node-negative, estrogen receptor-positive breast cancer: results from NSABP B-14 and NSABP B-20. J Clin Oncol 28 (10): 1677-83, 2010. [PUBMED Abstract]
- Paik S, Tang G, Shak S, et al.: Gene expression and benefit of chemotherapy in women with node-negative, estrogen receptor-positive breast cancer. J Clin Oncol 24 (23): 3726-34, 2006. [PUBMED Abstract]
- Albain KS, Barlow WE, Shak S, et al.: Prognostic and predictive value of the 21-gene recurrence score assay in postmenopausal women with node-positive, oestrogen-receptor-positive breast cancer on chemotherapy: a retrospective analysis of a randomised trial. Lancet Oncol 11 (1): 55-65, 2010. [PUBMED Abstract]
- Sparano JA, Gray RJ, Makower DF, et al.: Adjuvant Chemotherapy Guided by a 21-Gene Expression Assay in Breast Cancer. N Engl J Med 379 (2): 111-121, 2018. [PUBMED Abstract]
- Sparano JA, Gray RJ, Makower DF, et al.: Prospective Validation of a 21-Gene Expression Assay in Breast Cancer. N Engl J Med 373 (21): 2005-14, 2015. [PUBMED Abstract]
- Sparano JA, Gray RJ, Ravdin PM, et al.: Clinical and Genomic Risk to Guide the Use of Adjuvant Therapy for Breast Cancer. N Engl J Med 380 (25): 2395-2405, 2019. [PUBMED Abstract]
- Cardoso F, van't Veer LJ, Bogaerts J, et al.: 70-Gene Signature as an Aid to Treatment Decisions in Early-Stage Breast Cancer. N Engl J Med 375 (8): 717-29, 2016. [PUBMED Abstract]
- Kalinsky K, Barlow WE, Meric-Bernstam F, et al.: Abstract GS3-00: first results from a phase III randomized clinical trial of standard adjuvant endocrine therapy (ET) +/- chemotherapy (CT) in patients (pts) with 1-3 positive nodes, hormone receptor-positive (HR+) and HER2-negative (HER2-) breast cancer (BC) with recurrence score (RS) < 25: SWOG S1007 (RxPonder). [Abstract] Cancer Res 81 (4): A-GS3-00, 2021. Also available online. Last accessed April 24, 2025.
- Nitz U, Gluz O, Clemens M, et al.: West German Study PlanB Trial: Adjuvant Four Cycles of Epirubicin and Cyclophosphamide Plus Docetaxel Versus Six Cycles of Docetaxel and Cyclophosphamide in HER2-Negative Early Breast Cancer. J Clin Oncol 37 (10): 799-808, 2019. [PUBMED Abstract]
- Ma XJ, Wang Z, Ryan PD, et al.: A two-gene expression ratio predicts clinical outcome in breast cancer patients treated with tamoxifen. Cancer Cell 5 (6): 607-16, 2004. [PUBMED Abstract]
- Sgroi DC, Carney E, Zarrella E, et al.: Prediction of late disease recurrence and extended adjuvant letrozole benefit by the HOXB13/IL17BR biomarker. J Natl Cancer Inst 105 (14): 1036-42, 2013. [PUBMED Abstract]
- Sgroi DC, Sestak I, Cuzick J, et al.: Prediction of late distant recurrence in patients with oestrogen-receptor-positive breast cancer: a prospective comparison of the breast-cancer index (BCI) assay, 21-gene recurrence score, and IHC4 in the TransATAC study population. Lancet Oncol 14 (11): 1067-1076, 2013. [PUBMED Abstract]
- Bartlett JMS, Sgroi DC, Treuner K, et al.: Breast Cancer Index and prediction of benefit from extended endocrine therapy in breast cancer patients treated in the Adjuvant Tamoxifen-To Offer More? (aTTom) trial. Ann Oncol 30 (11): 1776-1783, 2019. [PUBMED Abstract]
- Noordhoek I, Treuner K, Putter H, et al.: Breast Cancer Index Predicts Extended Endocrine Benefit to Individualize Selection of Patients with HR+ Early-stage Breast Cancer for 10 Years of Endocrine Therapy. Clin Cancer Res 27 (1): 311-319, 2021. [PUBMED Abstract]
Clasificación histopatológica del cáncer de mama
En el Cuadro 1 se describe la clasificación histológica del cáncer de mama a partir de la localización del tumor.[1] El cáncer ductal infiltrante o invasivo es el tipo histológico de cáncer de mama más frecuente y representa del 70 % al 80 % de todos los casos.
| Localización del tumor | Subtipo histológico |
|---|---|
| SAI = sin otra indicación. | |
| Carcinoma, SAI | |
| Ductal | Intraductal (in situ) |
| Invasivo con componente predominante | |
| Invasivo, SAI | |
| Comedónico o tipo comedo | |
| Inflamatorio | |
| Medular con infiltrado linfocítico | |
| Mucinoso (coloide) | |
| Papilar | |
| Escirroso | |
| Tubular | |
| Otro | |
| Lobulillar | Invasivo con componente predominante in situ |
| Invasivo [2,3] | |
| Pezón | Enfermedad de Paget, SAI |
| Enfermedad de Paget con carcinoma intraductal | |
| Enfermedad de Paget con carcinoma ductal invasivo | |
| Otro | Carcinoma indiferenciado |
| Metaplásico | |
El carcinoma lobulillar es el segundo tipo histológico de cáncer de mama más frecuente y representa del 10 % al 15 % de todos los casos. El carcinoma lobulillar tiene características que definen una evolución natural distinta de la del carcinoma ductal (ver Figura 2).
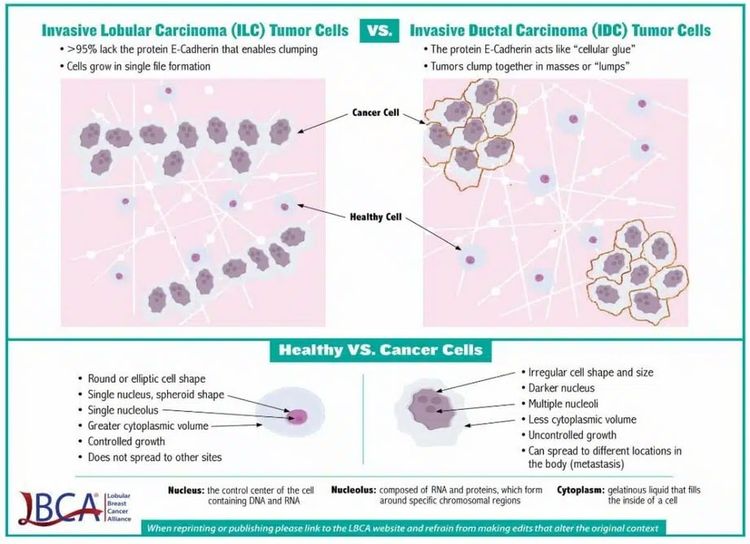
Esta distinción celular conduce a variaciones en la utilidad de la modalidad de estudios con imágenes, los criterios de diagnóstico patológico, el patrón de diseminación metastásica, el momento de presentación metastásica y la sensibilidad a los tratamientos antineoplásicos. El carcinoma lobulillar presenta las siguientes características, entre otras:[3]
- Ausencia de expresión de cadherina E, lo que quizás conduzca a un patrón de crecimiento más lineal, en lugar de uno con formación de masa. Este patrón puede hacer que la mamografía sea menos sensible y aumentar la utilidad de las imágenes por resonancia magnética para evaluar la extensión de la enfermedad en la mama.
- Patrones menos habituales de diseminación metastásica, que incluyen, entre otros, compromiso metastásico pleural, gastrointestinal, genitourinario y peritoneal.
- Probabilidad más alta de expresión del receptor de estrógeno.
- Sensibilidad más baja de la tomografía por emisión de positrones (TEP) para la detección de la enfermedad. En comparación con el carcinoma ductal, el carcinoma lobulillar tiene un nivel más bajo de absorción de 18F-fludesoxiglucosa (18F-FDG) en la TEP y se detecta con una sensibilidad mucho más baja.[4-6]
- En una serie se demostró un valor medio estándar máximo de captación de 18F-FDG en el carcinoma lobulillar invasivo (1,99 ± 1,72) que fue significativamente más bajo en comparación con el carcinoma ductal invasivo (3,91 ± 3,99) (P = 0,032).[4,5]
- En otra serie, el riesgo relativo de detección de metástasis a distancia no sospechadas con TEP y tomografía computarizada en pacientes con carcinoma ductal invasivo en estadio III fue 1,98 veces (intervalo de confianza 95 %, 0,98–3,98) el de las pacientes con carcinoma lobulillar invasivo en estadio III (P = 0,049).[6]
- Frecuencia más alta de diagnóstico en estadios más avanzados y una mayor probabilidad de compromiso ganglionar.
Los siguientes subtipos de tumores se presentan en la mama, pero no se consideran cánceres de mama típicos:
Bibliografía
- Breast. In: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual. 7th ed. Springer, 2010, pp 347-76.
- Yeatman TJ, Cantor AB, Smith TJ, et al.: Tumor biology of infiltrating lobular carcinoma. Implications for management. Ann Surg 222 (4): 549-59; discussion 559-61, 1995. [PUBMED Abstract]
- Oesterreich S, Nasrazadani A, Zou J, et al.: Clinicopathological Features and Outcomes Comparing Patients With Invasive Ductal and Lobular Breast Cancer. J Natl Cancer Inst 114 (11): 1511-1522, 2022. [PUBMED Abstract]
- Fujii T, Yajima R, Kurozumi S, et al.: Clinical Significance of 18F-FDG-PET in Invasive Lobular Carcinoma. Anticancer Res 36 (10): 5481-5485, 2016. [PUBMED Abstract]
- Jung NY, Kim SH, Choi BB, et al.: Associations between the standardized uptake value of (18)F-FDG PET/CT and the prognostic factors of invasive lobular carcinoma: in comparison with invasive ductal carcinoma. World J Surg Oncol 13: 113, 2015. [PUBMED Abstract]
- Hogan MP, Goldman DA, Dashevsky B, et al.: Comparison of 18F-FDG PET/CT for Systemic Staging of Newly Diagnosed Invasive Lobular Carcinoma Versus Invasive Ductal Carcinoma. J Nucl Med 56 (11): 1674-80, 2015. [PUBMED Abstract]
- Chaney AW, Pollack A, McNeese MD, et al.: Primary treatment of cystosarcoma phyllodes of the breast. Cancer 89 (7): 1502-11, 2000. [PUBMED Abstract]
- Carter BA, Page DL: Phyllodes tumor of the breast: local recurrence versus metastatic capacity. Hum Pathol 35 (9): 1051-2, 2004. [PUBMED Abstract]
Información sobre los estadios del cáncer de mama
El sistema de estadificación del American Joint Committee on Cancer (AJCC) proporciona una estrategia para agrupar a las pacientes según el pronóstico. Las decisiones terapéuticas se formulan, en parte, de acuerdo con las categorías de estadificación, pero también se fundamentan en otros factores clínicos (algunos se tienen en cuenta para determinar el estadio), como los siguientes:
- Tamaño del tumor.
- Estado ganglionar.
- Concentración de receptores de estrógeno y progesterona en el tejido tumoral.
- Estado del receptor 2 del factor de crecimiento epidérmico humano (HER2) en el tumor.
- Grado del tumor.
- Estado menopáusico.
- Estado general de salud de la paciente.
Los criterios estándar para definir el estado de los biomarcadores se describen a continuación:
- Expresión del receptor de estrógeno (ER): la expresión de ER se mide de manera primaria mediante pruebas inmunohistoquímicas (IHC). La tinción del 1 % o más de las células se considera un resultado positivo para la expresión de ER.[1]
- Expresión del receptor de progesterona (PR): la expresión de PR se mide de manera primaria mediante pruebas inmunohistoquímicas. La tinción del 1 % o más de las células se considera un resultado positivo para la expresión de PR.
- Expresión del receptor 2 del factor de crecimiento epidérmico humano (HER2): la expresión de HER2 se mide de manera primaria mediante pruebas inmunohistoquímicas para calcular la expresión de la proteína HER2 o mediante hibridación in situ (HIS) para calcular el número de copias del gen. Se publicaron las directrices elaboradas por el grupo de consenso de la American Society of Clinical Oncology y el College of American Pathologists para casos con resultados equívocos en las pruebas de IHC o HIS.[2]
Prueba IHC
- Resultado negativo: tinción de 0 o 1+
- Resultado equívoco: tinción 2+
- Resultado positivo: tinción 3+
Prueba HIS (sonda doble)
- Posibles resultados negativos:
- Relación HER2/sonda de enumeración cromosómica 17 (CEP17) <2,0 Y número de copias de HER2 <4
- Posibles resultados equívocos: (indica necesidad de otra prueba de HIS para confirmar el resultado equívoco o realizar una prueba IHC si no se hizo antes)
- relación HER2/CEP17 <2,0 Y número de copias de HER2 ≥4 pero <6
- Posibles resultados positivos:
- relación HER2/CEP17 ≥2,0 en la prueba HIS
- número de copias de HER2 ≥6, sin importar la relación según prueba HIS
Prueba HIS (sonda única):
- Resultado negativo: número de copias de HER2 <4
- Resultado equívoco: ≥4 pero <6 copias de HER2
- Resultado positivo: número de copias de HER2 ≥6
Definiciones TNM
El American Joint Committee on Cancer (AJCC) designó los estadios mediante la clasificación TNM (tumor, ganglio linfático y metástasis) para definir el cáncer de mama.[3] El grado del tumor se determina a partir de sus características morfológicas, como formación de túbulos, pleomorfismo nuclear y recuento mitótico.
| Categoría T | Criterios T |
|---|---|
| CDIS = carcinoma ductal in situ. | |
| aReproducción autorizada de AJCC: Breast, revised version. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pag. 4–96. | |
| bEl carcinoma lobulillar in situ es una entidad benigna que se eliminó de la estadificación TNM en la 8.ª edición del AJCC Cancer Staging Manual. | |
| cReglas para la clasificación - El sistema TNM anatómico es un método para codificar la extensión de la enfermedad. Se asigna una categoría de extensión de la enfermedad para el tumor (T), los ganglios linfáticos regionales (N) y las metástasis a distancia (M). Las asignaciones de T, N y M se establecen mediante métodos clínicos puesto que se combinan los hallazgos quirúrgicos con la información patológica y clínica. Se documentó que la extensión de la enfermedad después de la terapia neoadyuvante y la respuesta al tratamiento tiene repercusión pronóstica, lo que exige definiciones claras para el uso del prefijo yp y de la respuesta al tratamiento. El uso de terapia neoadyuvante no cambia el estadio clínico (pretratamiento). Según las reglas del sistema TNM, el componente anatómico del estadio clínico se identifica con el prefijo c (por ejemplo, cT). Además, durante la estadificación clínica se pueden usar la biopsia por aspiración con aguja fina (AAF) o aguja gruesa, y la biopsia de ganglio linfático centinela antes de la terapia neoadyuvante. Estas se registran con las anotaciones f y sn, respectivamente. Las metástasis ganglionares confirmadas mediante biopsia AAF o con aguja gruesa se clasifican en macrometástasis (cN1), sin importar el tamaño del tumor en la pieza patológica definitiva. Por ejemplo, se asigna la categoría cN1 (f) para la estadificación clínica (pretratamiento) y el estadio IIA a una paciente que tiene un tumor primario de 1 cm (antes de recibir terapia sistémica neoadyuvante) y compromiso ganglionar axilar detectado mediante biopsia por AFF guiada por ecografía, aunque la paciente no tenga adenopatías palpables durante la evaluación clínica. De la misma forma, se asigna la categoría cN1 (sn) y el estadio IIA si la paciente tiene compromiso de un ganglio centinela axilar que se identifica antes de la terapia sistémica neoadyuvante. Según las reglas del sistema TNM, si no se ha hecho una evaluación patológica T (extirpación del tumor primario), que se identifica con el prefijo p (por ejemplo, pT), se usa la clasificación clínica (cN) cuando antes de la terapia neoadyuvante se hace una evaluación microscópica de los ganglios, incluso cuando la extirpación ganglionar es completa como la de la biopsia de ganglio linfático centinela. | |
| TX | Tumor primario no evaluable. |
| T0 | Sin indicios de tumor primario. |
| Tisb | CDIS. |
| Tis (Paget) | Enfermedad de Paget del pezón que NO se relaciona con un carcinoma invasivo o un CDIS del parénquima mamario subyacente. Los carcinomas del parénquima mamario que se relacionan con una enfermedad de Paget se clasifican según el tamaño y las características de la enfermedad parenquimatosa, aunque también se debe registrar la presencia de la enfermedad de Paget. |
| T1 | Tumor ≤20 mm en su mayor dimensión. |
| –T1mi | Tumor ≤1 mm en su mayor dimensión. |
| –T1a | Tumor >1 mm, pero ≤5 mm en su mayor dimensión (las mediciones de >1,0–1,9 mm se redondean a 2 mm). |
| –T1b | Tumor >5 mm, pero ≤10 mm en su mayor dimensión. |
| –T1c | Tumor >10 mm, pero ≤20 mm en su mayor dimensión. |
| T2 | Tumor >20 mm, pero ≤50 mm en su mayor dimensión. |
| T3 | Tumor >50 mm en su mayor dimensión. |
| T4 | Tumor de cualquier tamaño con diseminación directa a la pared torácica o a la piel (ulceración o nódulos macroscópicos). La invasión de la dermis sola no se considera T4. |
| –T4a | Tumor con diseminación a la pared torácica. La invasión o adherencia al músculo pectoral sin invasión de otras estructuras de la pared torácica no se considera T4. |
| –T4b | Ulceración, nódulos satélites macroscópicos ipsilaterales o edema (incluso piel de naranja) en la piel que no cumple los criterios para carcinoma inflamatorio. |
| –T4c | Se encuentra T4a y T4b al mismo tiempo. |
| –T4d | Carcinoma inflamatorio (consultar Reglas para la clasificaciónc). |
| Categoría cN | Criterios cN |
|---|---|
| aReproducción autorizada de AJCC: Breast, revised version. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pag. 4–96. | |
| bSe deben añadir sufijos a la categoría N para registrar el método de confirmación de las metástasis: (sn) para la biopsia de ganglio centinela y (f) para la biopsia por aspiración con aguja fina o gruesa. | |
| cLa categoría cNX se usa con moderación para casos con antecedentes de extirpación quirúrgica de ganglios linfáticos regionales o cuando no se registró el examen físico axilar. | |
| dcN1mi se usa muy poco, pero quizás sea adecuada cuando se hace una biopsia de ganglio centinela antes de la resección tumoral, que es más probable en los casos que reciben terapia neoadyuvante. | |
| cNXc | Ganglios linfáticos regionales no evaluables (por ejemplo, extirpados antes). |
| cN0 | Sin metástasis en ganglios linfáticos regionales (según imágenes o evaluación clínica). |
| cN1 | Metástasis en uno o más ganglios linfáticos axilares móviles ipsilaterales de nivel I o II. |
| –cN1mid | Micrometástasis (alrededor de 200 células; >0,2 mm pero ≤2,0 mm). |
| cN2 | Metástasis en ganglios linfáticos axilares ipsilaterales de nivel I o II que están fijos o apelmazados en la evaluación clínica; |
| o metástasis en ganglios mamarios internos ipsilaterales sin metástasis en ganglios linfáticos axilares. | |
| –cN2a | Metástasis en ganglios linfáticos mamarios axilares ipsilaterales de nivel I o II que están adheridos entre sí (apelmazados) o adheridos a otras estructuras. |
| –cN2b | Metástasis solo en ganglios mamarios internos ipsilaterales sin metástasis en ganglios linfáticos axilares. |
| cN3 | Metástasis en uno o más ganglios linfáticos infraclaviculares ipsilaterales (nivel III axilar) con o sin compromiso ganglionar axilar de nivel I o II; o metástasis en uno o más ganglios linfáticos mamarios internos ipsilaterales con metástasis en ganglios linfáticos axilares de nivel l o II; o metástasis en uno o más ganglios linfáticos supraclaviculares ipsilaterales con o sin compromiso ganglionar axilar o mamario interno. |
| –cN3a | Metástasis en uno o más ganglios linfáticos infraclaviculares ipsilaterales. |
| –cN3b | Metástasis en uno o más ganglios linfáticos mamarios internos ipsilaterales y en uno o más ganglios axilares ipsilaterales. |
| –cN3c | Metástasis en uno o más ganglios linfáticos supraclaviculares ipsilaterales. |
| Categoría pN | Criterios pN |
|---|---|
| ITC = células tumorales aisladas; PCR-RT = reacción en cadena de la polimerasa con retrotranscriptasa. | |
| aReproducción autorizada de AJCC: Breast, revised version. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pag. 4–96. | |
| bSe deben añadir sufijos a la categoría N para registrar el método de confirmación de las metástasis: (sn) para la biopsia de ganglio centinela y (f) para la biopsia por aspiración con aguja fina o gruesa, SIN más resecciones ganglionares. | |
| pNX | Ganglios linfáticos regionales no evaluables (por ejemplo, no se extirparon para estudio patológico o se extirparon antes). |
| pN0 | Sin metástasis en ganglios linfáticos regionales, o solo se identificaron ITC. |
| –pN0(I+) | Solo se identificaron ITC (grupos de células malignas ≤0,2 mm) en uno o más ganglios linfáticos regionales. |
| –pN0(mol+) | Resultados positivos (anormales) en la prueba molecular de PCR-RT; no se detectaron ITC. |
| pN1 | Micrometástasis o metástasis en 1–3 ganglios linfáticos axilares, acompañadas o no de micro o macrometástasis en ganglios linfáticos mamarios internos detectadas mediante biopsia de ganglio linfático centinela, pero que no se encontraron en la evaluación clínica. |
| –pN1mi | Micrometástasis (~200 células; >0,2 mm pero ≤2,0 mm). |
| –pN1a | Metástasis en 1–3 ganglios linfáticos axilares, por lo menos una metástasis >2,0 mm. |
| –pN1b | Metástasis en ganglios linfáticos sentinelas mamarios internos ipsilaterales; se excluye las ITC. |
| –pN1c | Combinación de pN1a y pN1b. |
| pN2 | Metástasis en 4–9 ganglios linfáticos axilares, o metástasis en ganglios linfáticos mamarios internos ipsilaterales detectadas mediante imágenes, sin metástasis en ganglios linfáticos axilares. |
| –pN2a | Metástasis en 4–9 ganglios linfáticos axilares (por lo menos un depósito tumoral >2,0 mm). |
| –pN2b | Metástasis en ganglios linfáticos mamarios internos detectadas en la evaluación clínica con confirmación microscópica o sin esta. Sin compromiso patológico de ganglios linfáticos axilares. |
| pN3 | Metástasis en ≥10 ganglios linfáticos axilares; o metástasis en ganglios linfáticos infraclaviculares (nivel III axilar); o metástasis en ganglios linfáticos mamarios internos ipsilaterales detectadas mediante imágenes y metástasis en 1 o más ganglios linfáticos axilares de nivel l o II; o metástasis en >3 ganglios linfáticos axilares y micro o macrometástasis en ganglios linfáticos mamarios internos ipsilaterales detectadas mediante biopsia de ganglio linfático centinela pero que no se encontraron en la evaluación clínica; o metástasis en ganglios linfáticos supraclaviculares ipsilaterales. |
| –pN3a | Metástasis en ≥10 ganglios linfáticos axilares (por lo menos un depósito tumoral >2,0 mm) o metástasis en ganglios infraclaviculares (nivel III axilar). |
| –pN3b | pN1a o pN2a acompañados de cN2b (compromiso de ganglios mamarios internos detectado en imágenes); |
| o pN2a ante la presencia de pN1b. | |
| –pN3c | Metástasis en ganglios linfáticos supraclaviculares ipsilaterales. |
| Categoría M | Criterios M |
|---|---|
| aReproducción autorizada de AJCC: Breast, revised version. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pag. 4–96. | |
| bNo se necesitan estudios de imágenes para asignar la categoría cM0. | |
| M0 | Sin indicios clínicos ni radiológicos de metástasis a distancia.b |
| cM0(I+) | Sin indicios clínicos ni radiológicos de metástasis a distancia, pero en la evaluación microscópica o molecular se detectan células tumorales o depósitos de células ≤0,2 mm en la sangre, la médula ósea o en otros tejidos ganglionares no regionales en pacientes que no tienen signos ni síntomas de metástasis. |
| cM1 | Metástasis a distancia detectadas por métodos clínicos o radiológicos. |
| pM1 | Cualquier metástasis en órganos distantes comprobada mediante pruebas histológicas; o cualquier metástasis >0,2 mm en ganglios no regionales. |
| G | Definición G |
|---|---|
| SBR = sistema de clasificación Scarff-Bloom-Richardson, modificación de Nottingham. | |
| aReproducción autorizada de AJCC: Breast, revised version. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pag. 4–96. | |
| GX | Grado no evaluable. |
| G1 | Grado histológico combinado bajo (favorable), puntaje SBR de 3–5 puntos. |
| G2 | Grado histológico combinado intermedio (moderadamente favorable), puntaje SBR de 6–7 puntos. |
| G3 | Grado histológico combinado alto (desfavorable), puntaje SBR de 8–9 puntos. |
| G | Definición G |
|---|---|
| aReproducción autorizada de AJCC: Breast, revised version. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pag. 4–96. | |
| GX | Grado no evaluable. |
| G1 | Grado nuclear bajo. |
| G2 | Grado nuclear intermedio. |
| G3 | Grado nuclear alto. |
Grupos de estadios pronósticos y anatómicos del AJCC
Hay tres cuadros de grupos de estadios para el cáncer invasivo:[3]
- Grupos de estadio anatómico. El cuadro de los grupos de estadio anatómico se usa en las regiones del mundo donde la clasificación de grado tumoral o las pruebas de biomarcadores para ER, PR y HER2 no están disponibles de manera habitual. (Consultar el Cuadro8).
- Grupos de estadio clínico pronóstico. El cuadro de los grupos de estadio clínico pronóstico se usa para todas las pacientes en los Estados Unidos. Se debe determinar el estadio clínico pronóstico de las pacientes que reciben terapia neoadyuvante al inicio del tratamiento y luego se registra la intensidad de la respuesta al tratamiento, pero a estas pacientes no se les asigna un estadio patológico pronóstico. (Consultar el Cuadro9).
- Grupos de estadio patológico pronóstico. El cuadro de grupos de estadio patológico pronóstico se usa para todas las pacientes en los Estados Unidos que se someten a cirugía al inicio del tratamiento y cuya información patológica de T y N se notificó. (Consultar el Cuadro10).
Los registros de cáncer y los profesionales clínicos deben usar los cuadros de grupos de estadios pronósticos (clínicos y patológicos) para la notificación de los casos en los Estados Unidos. Se anticipa que para todos los casos de cáncer invasivo se hagan pruebas para definir el grado y el estadio de HER2, ER y PR, y que se notifiquen los resultados en los Estados Unidos.
Grupos de estadio anatómico del AJCC
| Estadio | TNM |
|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |
| aAdaptación autorizada de AJCC: Breast, revised version. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pag. 4–96. | |
| Notas: | |
| 1. T1 incluye T1mi. | |
| 2. Para los tumores T0 y T1 con micrometástasis ganglionares (N1mi) se usa el estadio lB. | |
| 3. Para los tumores T2, T3 y T4 con micrometástasis ganglionares (N1mi) se usa la categoría N1 para la estadificación. | |
| 4. M0 incluye M0(I+). | |
| 5. La designación pM0 no es válida; cualquier M0 corresponde a una definición clínica. | |
| 6. Si una paciente tiene una enfermedad M1 antes de la terapia sistémica neoadyuvante, se clasifica en estadio IV y luego se continúa usando el estadio IV independientemente de la respuesta a la terapia neoadyuvante. | |
| 7. La designación del estadio a veces se cambia si en las imágenes posquirúrgicas se detectan metástasis a distancia, siempre y cuando estas pruebas se realicen dentro de los 4 meses siguientes al diagnóstico, la enfermedad no haya progresado y la paciente no haya recibido terapia neoadyuvante. | |
| 8. La estadificación que se determina después de la terapia neoadyuvante se registra añadiendo los prefijos yc o ypn a la clasificación T y N. No se asigna ningún grupo de estadio anatómico si hay una respuesta patológica completa (RPC) a la terapia neoadyuvante; por ejemplo, ypT0, ypN0, cM0. | |
| 0 | Tis, N0, M0 |
| IA | T1, N0, M0 |
| IB | T0, N1mi, M0 |
| T1, N1mi, M0 | |
| IIA | T0, N1, M0 |
| T1, N1, M0 | |
| T2, N0, M0 | |
| IIB | T2, N1, M0 |
| T3, N0, M0 | |
| IIIA | T0, N2, M0 |
| T1, N2, M0 | |
| T2, N2, M0 | |
| T3, N1, M0 | |
| T3, N2, M0 | |
| IIIB | T4, N0, M0 |
| T4, N1, M0 | |
| T4, N2, M0 | |
| IIIC | Cualquier T (Tis, T1, T0, T2, T3, T4), N3, M0 |
| IV | Cualquier T (Tis, T1, T0, T2, T3, T4), cualquier N (N0, N1mi, N1, N2, N3), M1 |
Grupos de estadio pronóstico del AJCC
El estadio clínico pronóstico se usa para la clasificación y estadificación clínica de las pacientes con cáncer de mama invasivo en los Estados Unidos. Para determinar el estadio se usa información de la clasificación TNM a partir de los antecedentes de la paciente, el examen físico y los resultados de las imágenes (que no se exigen para la estadificación clínica) y las biopsias.
| TNM | Grado | Estado de HER2 | Estado de ER | Estado de PR | Grupo de estadio |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||||
| aAdaptación autorizada de AJCC: Breast, revised version. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pag. 4–96. | |||||
| bT1 incluye T1mi. | |||||
| cN1 no incluye N1mi. Para la estadificación pronóstica, los cánceres T1, N1mi, M0 y T0, N1mi, M0 se agrupan con los cánceres T1, N0, M0 que tengan el mismo estado del factor pronóstico. | |||||
| dN1 incluye N1mi. Para la estadificación pronóstica, los cánceres T2, T3 y T4, y los cánceres N1mi se agrupan con los cánceres T2, N1; T3, N1; y T4, N1, respectivamente. | |||||
| Notas: | |||||
| 1. La categoría N1mi solo se puede usar para la estadificación clínica pronóstica cuando la estadificación clínica se basa en una resección ganglionar sin resección del cáncer primario (por ejemplo, cuando se hace la biopsia de ganglio linfático centinela antes de la quimioterapia neoadyuvante o la terapia endocrina) porque para determinar la categoría N1mi se necesita la evaluación del ganglio entero y no se puede asignar a partir de una biopsia por aspiración con aguja fina o gruesa. | |||||
| 2. Para asignar el grupo de estadio de casos con compromiso ganglionar sin indicios de tumor primario (por ejemplo, T0, N1, etc.) o carcinoma ductal in situ de mama (por ejemplo, Tis, N1, etc.), se debe usar la información del grado tumoral y el estado de los receptores (receptor 2 del factor de crecimiento epidérmico humano [HER2], receptor de estrógeno y receptor de progesterona) obtenida de la evaluación del tumor en el ganglio linfático. | |||||
| 3. Para la estadificación según el Cuadro de grupos de estadio patológico pronóstico se debe usar la categoría negativo para HER2 en los casos con un resultado equívoco para HER2 en las pruebas de hibridación in situ (hibridación fluorescente in situ o hibridación cromogénica in situ) según las directrices para las pruebas de HER2 del American Society of Clinical Oncologists y el College of American Pathologists de 2013.[4,5] | |||||
| 4. La utilidad pronóstica de los grupos de estadio pronóstico se basa en poblaciones de personas con cáncer de mama a quienes se les ofreció tratamiento con terapia endocrina o quimioterapia sistémica adecuadas (incluso terapia anti-HER2), y quienes en su mayoría recibieron el tratamiento. | |||||
| Tis, N0, M0 | Cualquiera (consultar el Cuadro 6 y el Cuadro 7) | Cualquiera | Cualquiera | Cualquiera | 0 |
| T1b, N0, M0 | G1 | Positivo | Positivo | Positivo | IA |
| Negativo | IA | ||||
| T0, N1mi, M0 | Negativo | Positivo | IA | ||
| Negativo | IA | ||||
| T1b, N1mi, M0 | Negativo | Positivo | Positivo | IA | |
| Negativo | IA | ||||
| Negativo | Positivo | IA | |||
| Negativo | IB | ||||
| G2 | Positivo | Positivo | Positivo | IA | |
| Negativo | IA | ||||
| Negativo | Positivo | IA | |||
| Negativo | IA | ||||
| Negativo | Positivo | Positivo | IA | ||
| Negativo | IA | ||||
| Negativo | Positivo | IA | |||
| Negativo | IB | ||||
| G3 | Positivo | Positivo | Positivo | IA | |
| Negativo | IA | ||||
| Negativo | Positivo | IA | |||
| Negativo | IA | ||||
| Negativo | Positivo | Positivo | IA | ||
| Negativo | IB | ||||
| Negativo | Positivo | IB | |||
| Negativo | IB | ||||
| T0, N1c, M0; T1b, N1c, M0; T2, N0, M0 | G1 | Positivo | Positivo | Positivo | IB |
| Negativo | IIA | ||||
| Negativo | Positivo | IIA | |||
| Negativo | IIA | ||||
| Negativo | Positivo | Positivo | IB | ||
| Negativo | IIA | ||||
| Negativo | Positivo | IIA | |||
| Negativo | IIA | ||||
| G2 | Positivo | Positivo | Positivo | IB | |
| Negativo | IIA | ||||
| Negativo | Positivo | IIA | |||
| Negativo | IIA | ||||
| Negativo | Positivo | Positivo | IB | ||
| Negativo | IIA | ||||
| Negativo | Positivo | IIA | |||
| Negativo | IIB | ||||
| G3 | Positivo | Positivo | Positivo | IB | |
| Negativo | IIA | ||||
| Negativo | Positivo | IIA | |||
| Negativo | IIA | ||||
| Negativo | Positivo | Positivo | IIA | ||
| Negativo | IIB | ||||
| Negativo | Positivo | IIB | |||
| Negativo | IIB | ||||
| T2, N1d, M0; T3, N0, M0 | G1 | Positivo | Positivo | Positivo | IB |
| Negativo | IIA | ||||
| Negativo | Positivo | IIA | |||
| Negativo | IIB | ||||
| Negativo | Positivo | Positivo | IIA | ||
| Negativo | IIB | ||||
| Negativo | Positivo | IIB | |||
| Negativo | IIB | ||||
| G2 | Positivo | Positivo | Positivo | IB | |
| Negativo | IIA | ||||
| Negativo | Positivo | IIA | |||
| Negativo | IIB | ||||
| Negativo | Positivo | Positivo | IIA | ||
| Negativo | IIB | ||||
| Negativo | Positivo | IIB | |||
| Negativo | IIIB | ||||
| G3 | Positivo | Positivo | Positivo | IB | |
| Negativo | IIB | ||||
| Negativo | Positivo | IIB | |||
| Negativo | IIB | ||||
| Negativo | Positivo | Positivo | IIB | ||
| Negativo | IIIA | ||||
| Negativo | Positivo | IIIA | |||
| Negativo | IIIB | ||||
| T0, N2, M0; T1b, N2, M0; T2, N2, M0; T3, N1d, M0; T3, N2, M0 | G1 | Positivo | Positivo | Positivo | IIA |
| Negativo | IIIA | ||||
| Negativo | Positivo | IIIA | |||
| Negativo | IIIA | ||||
| Negativo | Positivo | Positivo | IIA | ||
| Negativo | IIIA | ||||
| Negativo | Positivo | IIIA | |||
| Negativo | IIIB | ||||
| G2 | Positivo | Positivo | Positivo | IIA | |
| Negativo | IIIA | ||||
| Negativo | Positivo | IIIA | |||
| Negativo | IIIA | ||||
| Negativo | Positivo | Positivo | IIA | ||
| Negativo | IIIA | ||||
| Negativo | Positivo | IIIA | |||
| Negativo | IIIB | ||||
| G3 | Positivo | Positivo | Positivo | IIB | |
| Negativo | IIIA | ||||
| Negativo | Positivo | IIIA | |||
| Negativo | IIIA | ||||
| Negativo | Positivo | Positivo | IIIA | ||
| Negativo | IIIB | ||||
| Negativo | Positivo | IIIB | |||
| Negativo | IIIC | ||||
| T4, N0, M0; T4, N1d, M0; T4, N2, M0; CUALQUIER T, N3, M0 | G1 | Positivo | Positivo | Positivo | IIIA |
| Negativo | IIIB | ||||
| Negativo | Positivo | IIIB | |||
| Negativo | IIIB | ||||
| Negativo | Positivo | Positivo | IIIB | ||
| Negativo | IIIB | ||||
| Negativo | Positivo | IIIB | |||
| Negativo | IIIC | ||||
| G2 | Positivo | Positivo | Positivo | IIIA | |
| Negativo | IIIB | ||||
| Negativo | Positivo | IIIB | |||
| Negativo | IIIB | ||||
| Negativo | Positivo | Positivo | IIIB | ||
| Negativo | IIIB | ||||
| Negativo | Positivo | IIIB | |||
| Negativo | IIIC | ||||
| G3 | Positivo | Positivo | Positivo | IIIB | |
| Negativo | IIIB | ||||
| Negativo | Positivo | IIIB | |||
| Negativo | IIIB | ||||
| Negativo | Positivo | Positivo | IIIB | ||
| Negativo | IIIC | ||||
| Negativo | Positivo | IIIC | |||
| Negativo | IIIC | ||||
| Cualquier T, cualquier N, M1 | Cualquiera (consultar el Cuadro 6 y el Cuadro 7) | Cualquiera | Cualquiera | Cualquiera | IV |
Grupos de estadio patológico pronóstico del AJCC
El estadio patológico pronóstico se usa para pacientes con cáncer de mama invasivo que se tratan al inicio con cirugía. Incluye toda la información que se usó para la estadificación clínica, además de los hallazgos quirúrgicos y patológicos posteriores a la cirugía para extirpar el tumor. El estadio patológico pronóstico no se usa en pacientes que reciben terapia neoadyuvante antes de la cirugía para extirpar el tumor.[3]
| TNM | Grado | Estado de HER2 | Estado de ER | Estado de PR | Grupo de estadio |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||||
| aAdaptación autorizada de AJCC: Breast, revised version. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pag. 4–96. | |||||
| bT1 incluye T1mi. | |||||
| cN1 no incluye N1mi. Para la estadificación pronóstica, los cánceres T1, N1mi, M0 y T0, N1mi, M0 se agrupan con los cánceres T1, N0, M0 que tengan el mismo estado del factor pronóstico. | |||||
| dN1 incluye N1mi. Para la estadificación pronóstica, los cánceres T2, T3 y T4, y los cánceres N1mi se agrupan con los cánceres T2, N1; T3, N1; y T4, N1, respectivamente. | |||||
| Notas: | |||||
| 1. Para asignar el grupo de estadio de casos con compromiso ganglionar sin indicios de tumor primario (por ejemplo, T0, N1, etc.) o carcinoma ductal in situ de mama (por ejemplo, Tis, N1, etc.), se debe usar la información del grado tumoral y el estado de los receptores (receptor 2 del factor de crecimiento epidérmico humano [HER2], receptor de estrógeno y receptor de progesterona) obtenida de la evaluación del tumor en el ganglio linfático. | |||||
| 2. Para la estadificación según el Cuadro de grupos de estadio patológico pronóstico se debe usar la categoría negativo para HER2 en los casos con un resultado equívoco para HER2 en las pruebas de hibridación in situ (hibridación fluorescente in situ o hibridación cromogénica in situ) según las directrices para las pruebas de HER2 del American Society of Clinical Oncologists y el College of American Pathologists de 2013.[4,5] | |||||
| 3. La utilidad pronóstica de los grupos de estadio pronóstico se basa en poblaciones de personas con cáncer de mama a quienes se les ofreció la opción de recibir terapia endocrina o quimioterapia sistémica adecuadas (incluso terapia anti-HER2), y que en su mayoría recibieron el tratamiento. | |||||
| Tis, N0, M0 | Cualquiera (consultar el Cuadro 6 y el Cuadro 7) | Cualquiera | Cualquiera | Cualquiera | 0 |
| T1b, N0, M0; T0, N1mi, M0; T1b, N1mi, M0 | G1 | Positivo | Positivo | Positivo | IA |
| Negativo | IA | ||||
| Negativo | Positivo | IA | |||
| Negativo | IA | ||||
| Negativo | Positivo | Positivo | IA | ||
| Negativo | IA | ||||
| Negativo | Positivo | IA | |||
| Negativo | IA | ||||
| G2 | Positivo | Positivo | Positivo | IA | |
| Negativo | IA | ||||
| Negativo | Positivo | IA | |||
| Negativo | IA | ||||
| Negativo | Positivo | Positivo | IA | ||
| Negativo | IA | ||||
| Negativo | Positivo | IA | |||
| Negativo | IB | ||||
| G3 | Positivo | Positivo | Positivo | IA | |
| Negativo | IA | ||||
| Negativo | Positivo | IA | |||
| Negativo | IA | ||||
| Negativo | Positivo | Positivo | IA | ||
| Negativo | IA | ||||
| Negativo | Positivo | IA | |||
| Negativo | IB | ||||
| T0, N1c, M0; T1b, N1c, M0; T2, N0, M0 | G1 | Positivo | Positivo | Positivo | IA |
| Negativo | IB | ||||
| Negativo | Positivo | IB | |||
| Negativo | IIA | ||||
| Negativo | Positivo | Positivo | IA | ||
| Negativo | IB | ||||
| Negativo | Positivo | IB | |||
| Negativo | IIA | ||||
| G2 | Positivo | Positivo | Positivo | IA | |
| Negativo | IB | ||||
| Negativo | Positivo | IB | |||
| Negativo | IIA | ||||
| Negativo | Positivo | Positivo | IA | ||
| Negativo | IIA | ||||
| Negativo | Positivo | IIA | |||
| Negativo | IIA | ||||
| G3 | Positivo | Positivo | Positivo | IA | |
| Negativo | IIA | ||||
| Negativo | Positivo | IIA | |||
| Negativo | IIA | ||||
| Negativo | Positivo | Positivo | IB | ||
| Negativo | IIA | ||||
| Negativo | Positivo | IIA | |||
| Negativo | IIA | ||||
| T2, N1c, M0; T3, N0, M0 | G1 | Positivo | Positivo | Positivo | IA |
| Negativo | IIB | ||||
| Negativo | Positivo | IIB | |||
| Negativo | IIB | ||||
| Negativo | Positivo | Positivo | IA | ||
| Negativo | IIB | ||||
| Negativo | Positivo | IIB | |||
| Negativo | IIB | ||||
| G2 | Positivo | Positivo | Positivo | IB | |
| Negativo | IIB | ||||
| Negativo | Positivo | IIB | |||
| Negativo | IIB | ||||
| Negativo | Positivo | Positivo | IB | ||
| Negativo | IIB | ||||
| Negativo | Positivo | IIB | |||
| Negativo | IIB | ||||
| G3 | Positivo | Positivo | Positivo | IB | |
| Negativo | IIB | ||||
| Negativo | Positivo | IIB | |||
| Negativo | IIB | ||||
| Negativo | Positivo | Positivo | IIA | ||
| Negativo | IIB | ||||
| Negativo | Positivo | IIB | |||
| Negativo | IIIA | ||||
| T0, N2, M0; T1b, N2, M0; T2, N2, M0, T3, N1d, M0; T3, N2, M0 | G1 | Positivo | Positivo | Positivo | IB |
| Negativo | IIIA | ||||
| Negativo | Positivo | IIIA | |||
| Negativo | IIIA | ||||
| Negativo | Positivo | Positivo | IB | ||
| Negativo | IIIA | ||||
| Negativo | Positivo | IIIA | |||
| Negativo | IIIA | ||||
| G2 | Positivo | Positivo | Positivo | IB | |
| Negativo | IIIA | ||||
| Negativo | Positivo | IIIA | |||
| Negativo | IIIA | ||||
| Negativo | Positivo | Positivo | IB | ||
| Negativo | IIIA | ||||
| Negativo | Positivo | IIIA | |||
| Negativo | IIIB | ||||
| G3 | Positivo | Positivo | Positivo | IIA | |
| Negativo | IIIA | ||||
| Negativo | Positivo | IIIA | |||
| Negativo | IIIA | ||||
| Negativo | Positivo | Positivo | IIB | ||
| Negativo | IIIA | ||||
| Negativo | Positivo | IIIA | |||
| Negativo | IIIC | ||||
| T4, N0, M0; T4, N1d, M0; T4, N2, M0; CUALQUIER T, N3, M0 | G1 | Positivo | Positivo | Positivo | IIIA |
| Negativo | IIIB | ||||
| Negativo | Positivo | IIIB | |||
| Negativo | IIIB | ||||
| Negativo | Positivo | Positivo | IIIA | ||
| Negativo | IIIB | ||||
| Negativo | Positivo | IIIB | |||
| Negativo | IIIB | ||||
| G2 | Positivo | Positivo | Positivo | IIIA | |
| Negativo | IIIB | ||||
| Negativo | Positivo | IIIB | |||
| Negativo | IIIB | ||||
| Negativo | Positivo | Positivo | IIIA | ||
| Negativo | IIIB | ||||
| Negativo | Positivo | IIIB | |||
| Negativo | IIIC | ||||
| G3 | Positivo | Positivo | Positivo | IIIB | |
| Negativo | IIIB | ||||
| Negativo | Positivo | IIIB | |||
| Negativo | IIIB | ||||
| Negativo | Positivo | Positivo | IIIB | ||
| Negativo | IIIC | ||||
| Negativo | Positivo | IIIC | |||
| Negativo | IIIC | ||||
| Cualquier T, cualquier N, M1 | Cualquiera (consultar el Cuadro 6 y el Cuadro 7) | Cualquiera | Cualquiera | Cualquiera | IV |
Bibliografía
- Barnes DM, Harris WH, Smith P, et al.: Immunohistochemical determination of oestrogen receptor: comparison of different methods of assessment of staining and correlation with clinical outcome of breast cancer patients. Br J Cancer 74 (9): 1445-51, 1996. [PUBMED Abstract]
- Wolff AC, Somerfield MR, Dowsett M, et al.: Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: ASCO-College of American Pathologists Guideline Update. J Clin Oncol 41 (22): 3867-3872, 2023. [PUBMED Abstract]
- Breast. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 589–628.
- Wolff AC, Hammond ME, Hicks DG, et al.: Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update. J Clin Oncol 31 (31): 3997-4013, 2013. [PUBMED Abstract]
- Wolff AC, Hammond ME, Hicks DG, et al.: Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update. Arch Pathol Lab Med 138 (2): 241-56, 2014. [PUBMED Abstract]
Tratamiento quirúrgico del cáncer de mama
El cáncer de mama operable requiere un abordaje de tratamiento multimodal. Después de confirmar mediante biopsia la presencia de una neoplasia maligna, se analizan con la paciente las siguientes opciones de tratamiento quirúrgico antes de elegir el procedimiento terapéutico:
- Cirugía de conservación de la mama.
- Mastectomía radical modificada (extirpación de toda la mama y disección axilar en los niveles I y II) con reconstrucción de la mama o sin esta.
Para orientar la selección de la terapia adyuvante, se consideran muchos factores como el estadio, el grado y el estado molecular del tumor (por ejemplo, estado del receptor de estrógeno [ER], receptor de progesterona [PR], receptor 2 del factor de crecimiento epidérmico humano [HER2] o el estado triple negativo).[1-5]
Estadificación quirúrgica del tumor primario
La selección de un abordaje terapéutico local depende de los siguientes factores:[6]
- Localización y tamaño de la lesión.
- Análisis de mamografías, imágenes por resonancia magnética u otras pruebas por imágenes.
- Tamaño de la mama.
- Deseo de la paciente de conservar la mama.
Las opciones de tratamiento quirúrgico del tumor primario son las siguientes:
- Cirugía de conservación de la mama (considerando el uso de radioterapia). Todos los tipos histológicos de cáncer de mama invasivo se pueden tratar con cirugía de conservación de la mama y radioterapia.[7] Sin embargo, la presencia de cáncer de mama inflamatorio, sin importar el subtipo histológico, contraindica el uso de la terapia de conservación de la mama. La enfermedad multifocal en la mama y los antecedentes de colagenopatía vascular son contraindicaciones relativas de la terapia de conservación de la mama. En el pasado, el uso de radioterapia dirigida a la mama se consideraba una contraindicación para la cirugía de conservación de la mama. Sin embargo, las investigaciones han demostrado cada vez más que la repetición de la radioterapia es posible e inocua en poblaciones seleccionadas de pacientes.[8]
- Mastectomía con reconstrucción de la mama o sin esta.
La supervivencia es equivalente con cualquiera de estas opciones, como se documentó en el ensayo EORTC-10801 [9] y en otros ensayos prospectivos aleatorizados.[10-16] Además, en un estudio retrospectivo de 753 pacientes que se dividieron en tres grupos según el estado de los receptores hormonales (positivo para ER o positivo para PR; negativo para ER y PR, pero positivo para HER2 y triple negativo), no se encontraron diferencias en el control de la enfermedad en la mama de las pacientes tratadas con cirugía estándar de conservación de la mama; sin embargo, aún no hay suficientes datos que respalden este hallazgo.[17]
La tasa de recidiva local en la mama después del tratamiento conservador es baja y varía un poco según la técnica quirúrgica utilizada (por ejemplo, tumorectomía, cuadrantectomía, mastectomía segmentaria y otras). Se ha debatido si se necesitan márgenes de resección microscópicamente limpios (borde sin compromiso tumoral).[18-20] No obstante, un grupo multidisciplinario de consenso hace poco utilizó el ancho del margen y la recidiva del tumor de mama ipsilateral de un metanálisis de 33 estudios (n = 28 162 pacientes) como fundamento científico principal para actualizar el consenso sobre los márgenes de las pacientes con cáncer de mama en estadios I y II tratadas con cirugía de conservación de la mama y radioterapia. Los resultados del metanálisis son los siguientes:[21]
- La presencia de márgenes positivos (compromiso tumoral identificado en el borde marcado con tinta de un carcinoma invasivo o carcinoma ductal in situ) se relaciona con duplicación del riesgo de recidiva ipsilateral de un tumor de mama en comparación con la presencia de márgenes negativos.
- La presencia de márgenes limpios mucho más anchos no disminuye de manera significativa la tasa de recidiva ipsilateral de un tumor de mama en comparación con la ausencia de compromiso tumoral en el borde marcado con tinta. Por lo tanto, se recomendó que se use la ausencia de compromiso tumoral en el borde marcado con tinta como el nuevo estándar para definir márgenes adecuados en un cáncer invasivo.
- No se encontró evidencia de que la presencia de unos márgenes limpios más amplios reduzcan la recidiva ipsilateral de un tumor de mama en pacientes jóvenes o en quienes tienen tumores con características biológicas desfavorables, cánceres lobulillares y cánceres con un componente intraductal extenso.
En las pacientes sometidas a mastectomía parcial, los márgenes a veces son positivos después de la cirugía primaria y, a menudo, esto lleva a una nueva extirpación. En un ensayo clínico se asignó al azar a 235 pacientes con cáncer de mama en estadios 0 a III sometidas a mastectomía parcial con o sin resección de márgenes seleccionados, para someterse a una nueva resección de los márgenes de la cavidad mediante rasurado (grupo de rasurado) o no someterse a esta (grupo sin rasurado).[22] Las pacientes del grupo de rasurado presentaron una tasa significativamente más baja de márgenes positivos que las del grupo sin rasurado (19 vs. 34 %, P = 0,01) y una tasa más baja de segunda cirugía para asegurar la presencia de márgenes limpios (10 vs. 21 %, P = 0,02).[22][Nivel de evidencia B3]
Tratamiento ganglionar axilar
El estado de los ganglios axilares sigue siendo el factor más importante para la predicción del desenlace en las pacientes con cáncer de mama. Los ganglios linfáticos axilares se estadifican para ayudar a determinar el pronóstico y el tratamiento.
La biopsia de ganglio linfático centinela (GLC) es el procedimiento de estadificación axilar inicial estándar para mujeres con cáncer de mama invasivo. El GLC se define como cualquier ganglio que recibe drenaje directo desde el tumor primario, por lo que es posible que haya más de un GLC (esto ocurre a menudo). En los estudios se observó que la inyección de azufre coloidal marcado con tecnecio Tc 99m, colorante vital azul, o ambos alrededor del tumor o la cavidad de la biopsia, así como en el área subareolar, y el drenaje posterior de estos compuestos a la axila permite identificar el GLC en el 92 % al 98 % de las pacientes.[23,24] Estos informes indican una concordancia del 97,5 % al 100 % entre la biopsia de GLC y la disección de ganglios linfáticos axilares (DGLA) completa. La biopsia de GLC sola se relaciona con menos morbilidad que la linfadenectomía axilar.[25-28]
Evidencia (biopsia de ganglio linfático centinela):
- En el estudio ALMANAC, un ensayo aleatorizado de 1031 mujeres, la DGLA se comparó con la biopsia de GLC seguida de DGLA en caso de compromiso de GLC.[29][Nivel de evidencia A3]
- La calidad de vida a 1 año (evaluada por la frecuencia de deterioro clínico importante según la escala del Trial Outcome Index of the Functional Assessment of Cancer Therapy-Breast) fue superior en el grupo de biopsia de GLC (23 % de deterioro en el grupo de biopsia de GLC vs. 35 % en el grupo de DGLA; P = 0,001). El funcionamiento del brazo también fue mejor en el grupo de biopsia de GLC.
- En el ensayo multicéntrico de fase III del National Surgical Adjuvant Breast and Bowel Project (NSABP-B-32 [NCT00003830]), se asignó al azar a las mujeres (n = 5611) para someterse a una biopsia de GLC con DGLA, o una resección de GLC sola. La DGLA se hizo solo en el caso de compromiso de GLC.[30][Nivel de evidencia A1]
- En el estudio no se observaron diferencias detectables en la supervivencia general (SG), la supervivencia sin enfermedad (SSE) ni el control regional. La tasa de SG fue del 91,8 % para la biopsia de GLC con DGLA versus el 90,3 % para la resección de GLC sola (P = 0,12).
De acuerdo con los resultados del ensayo que se describen a continuación, no es necesario realizar una DGLA después de un resultado positivo en una biopsia de GLC en pacientes con cáncer de mama con compromiso limitado de GLC tratadas mediante cirugía de conservación de la mama o mastectomía, radioterapia y terapia sistémica.
Evidencia (disección de ganglios linfáticos axilares después de un resultado positivo en una biopsia de ganglio linfático centinela en pacientes con cáncer de mama con compromiso limitado de ganglio linfático centinela):
- En el estudio ACOSOG Z0011 (Alliance, NCT00003855), un ensayo clínico de fase III, de ausencia de inferioridad, aleatorizado y multicéntrico, se evaluó si se requiere una DGLA después de una biopsia que indica compromiso del GLC. Las mujeres se asignaron de manera aleatoria a someterse a una DGLA o no recibir tratamiento axilar adicional. Las pacientes tenían cáncer de mama invasivo clínico T1 o T2 sin adenopatía palpable y de 1 a 2 GLC con metástasis identificada mediante sección congelada. Todas las pacientes se sometieron a tumorectomía, radioterapia tangencial dirigida a toda la mama y terapia sistémica adecuada. La SG fue el criterio principal de valoración y la SSE fue el criterio secundario de valoración. Debido a los desafíos para lograr la inscripción del total esperado de inscripción de 1900 mujeres, solo 891 se asignaron al azar a 1 de los 2 grupos de tratamiento.[Nivel de evidencia A1]
- Al cabo de una mediana de seguimiento de 6,3 años, la tasa de SG a 5 años fue del 91,8 % (intervalo de confianza [IC] 95 %, 89,1–94,5 %) con DGLA y del 92,5 % (IC 95 %, 90,0–95,1 %) con biopsia de GLC sola.
- En un análisis detallado del diseño del campo de radiación, se encontró que el 15 % de las pacientes también recibieron tratamiento en la región supraclavicular (además del dirigido a los campos tangenciales estándar). De aquellas con registros detallados de radiación disponibles para revisión, 43 pacientes (18,9 %) recibieron radioterapia ganglionar regional.[31]
- La tasa de SSE a 5 años fue del 82,2 % (IC 95 %, 78,3–86,3 %) con DGLA y del 83,9 % (IC 95 %, 80,2–87,9 %) con biopsia de GLC sola.
- En un ensayo con diseño similar (IBCSG 23-01), se asignó al azar a 929 mujeres con tumores mamarios de menos de 5 cm y compromiso de GLC menor de 2 mm para someterse a una DGLA o no someterse a esta.[32][Nivel de evidencia A1]
- Las pacientes que no se sometieron a disección axilar presentaron una SSE más baja (cociente de riesgos instantáneos [CRI], 0,78; IC 95 %, 0,55–1,11).
- No se observaron diferencias en la SG.
- En el ensayo AMAROS (NCT00014612) se estudió la DGLA y la radioterapia axilar después de identificar un GLC positivo.[33][Nivel de evidencia A1]
- La DGLA y la radioterapia axilar proporcionaron un control axilar excelente y comparable en pacientes con cáncer de mama primario T1 o T2 sin linfadenopatía palpable sometidas a terapia de conservación de la mama o mastectomía.
- La administración de radioterapia axilar se relacionó con una morbilidad significativamente menor.
Para las pacientes que necesitan una DGLA, la evaluación estándar por lo general incluye solo una disección en los niveles I y II, en la que se extirpan suficientes ganglios para evaluación (es decir, por lo menos 6–10) y, al mismo tiempo, se reduce la morbilidad a causa del procedimiento.
A pesar que la biopsia de GLC ha sido el procedimiento estándar para la estadificación axilar de las pacientes con cáncer de mama invasivo y axila sin compromiso clínico, en 2 ensayos controlados aleatorizados se identificaron poblaciones en las que la biopsia de GLC se podría omitir.
Evidencia (omisión de la biopsia de ganglio linfático centinela):
- En el ensayo SOUND (NCT02167490), aleatorizado, multicéntrico, de ausencia de inferioridad, se evaluó omitir la la biopsia de GLC en las mujeres con cáncer de mama invasivo. Eran pacientes de cualquier edad con tumores de menos de 2 cm que contaban con una ecografía axilar negativa preoperatoria y planeaban someterse a una cirugía con conservación de la mama y radioterapia adyuvante. Un total de 1493 mujeres se asignaron al azar para someterse a biopsia de GLC o no someterse a cirugía . La mediana de seguimiento fue de 5,7 años.[34][Nivel de evidencia A1]
- La tasa de SSE a distancia a 5 años fue del 97,7 % en el grupo de biopsia de GLC y del 98,0 % en el grupo sin cirugía (P de la prueba del orden logarítmico = 0,67; CRI, 0,84; 90 % IC, 0,45–1,54; P para la no inferioridad = 0,02).
- En el grupo de biopsia de GLC se observó un total de 12 recaídas locorregionales (1,7 %), 13 metástasis a distancia (1,8 %) y 21 muertes (3,0 %), en comparación con 11 recaídas locorregionales (1,6 %), 14 metástasis a distancia (2,0 %) y 18 muertes (2,6 %) del grupo sin cirugía.
- En el ensayo aleatorizado, multicéntrico, de ausencia de inferioridad INSEMA (NCT02466737), se evaluó omitir la biopsia de GLC en 5502 mujeres con cáncer de mama invasivo sin compromiso ganglionar clínico. Los tumores debían medir menos de 5 cm y la mayoría de las pacientes tenían enfermedad T1 y tumores positivos para ER. Las pacientes tenían programada la cirugía con conservación de la mama y radioterapia de toda la mama. Se asignaron al azar en una proporción 1:4 para no someterse a cirugía o someterse a biopsia de GLC. La mediana de seguimiento fue de 6 años.[35][Nivel de evidencia A1]
- La tasa de SSE invasiva a 5 años fue del 91,9 % en el grupo sin cirugía y del 91,7 % en el grupo de biopsia de GLC (CRI, 0,91; IC 95 %, 0,73–1,14), por debajo del margen preespecificado de ausencia de inferioridad.
- Las pacientes del grupo sin cirugía tuvieron una menor incidencia de linfedema, mayor movilidad del brazo y menos dolor al mover el brazo o el hombro que las pacientes que se sometieron a biopsia de GLC.
Reconstrucción mamaria
En las pacientes que optan por una mastectomía total, se puede realizar cirugía reconstructiva en el momento de la mastectomía (reconstrucción inmediata) o después (reconstrucción diferida).[36-39] El contorno de la mama se reconstruye mediante uno de los siguientes procedimientos:
- Mastopexia.
- Inserción submuscular de un implante artificial de silicona o solución salina. Si técnicamente es imposible poner un implante de manera inmediata, se introduce un expansor tisular debajo del músculo pectoral. Se inyecta solución salina en el expansor para estirar los tejidos durante un período de semanas o meses hasta obtener el volumen deseado. El expansor de tejido se reemplaza luego con un implante permanente. Para obtener más información en inglés sobre los implantes mamarios, consultar U.S. Food and Drug Administration.
- Colgajo del músculo recto u otro colgajo. Los colgajos musculares exigen un procedimiento operatorio mucho más complejo y prolongado, y es posible que se necesiten transfusiones de sangre.
Después de la reconstrucción de la mama, se puede administrar radioterapia dirigida a la pared torácica y a los ganglios regionales si fuera necesario, en el entorno de tratamiento adyuvante o tratamiento de una recidiva local. La radioterapia después de la reconstrucción con una prótesis mamaria o un colgajo de tejido puede afectar el resultado cosmético y la simetría. También es posible que aumente la incidencia de fibrosis capsular, dolor o que haya que retirar el implante.[40]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Fisher B, Fisher ER, Redmond C, et al.: Tumor nuclear grade, estrogen receptor, and progesterone receptor: their value alone or in combination as indicators of outcome following adjuvant therapy for breast cancer. Breast Cancer Res Treat 7 (3): 147-60, 1986. [PUBMED Abstract]
- Thor AD, Berry DA, Budman DR, et al.: erbB-2, p53, and efficacy of adjuvant therapy in lymph node-positive breast cancer. J Natl Cancer Inst 90 (18): 1346-60, 1998. [PUBMED Abstract]
- Paik S, Bryant J, Park C, et al.: erbB-2 and response to doxorubicin in patients with axillary lymph node-positive, hormone receptor-negative breast cancer. J Natl Cancer Inst 90 (18): 1361-70, 1998. [PUBMED Abstract]
- Simpson JF, Gray R, Dressler LG, et al.: Prognostic value of histologic grade and proliferative activity in axillary node-positive breast cancer: results from the Eastern Cooperative Oncology Group Companion Study, EST 4189. J Clin Oncol 18 (10): 2059-69, 2000. [PUBMED Abstract]
- Hutchins LF, Green SJ, Ravdin PM, et al.: Randomized, controlled trial of cyclophosphamide, methotrexate, and fluorouracil versus cyclophosphamide, doxorubicin, and fluorouracil with and without tamoxifen for high-risk, node-negative breast cancer: treatment results of Intergroup Protocol INT-0102. J Clin Oncol 23 (33): 8313-21, 2005. [PUBMED Abstract]
- Abrams JS, Phillips PH, Friedman MA: Meeting highlights: a reappraisal of research results for the local treatment of early stage breast cancer. J Natl Cancer Inst 87 (24): 1837-45, 1995. [PUBMED Abstract]
- Weiss MC, Fowble BL, Solin LJ, et al.: Outcome of conservative therapy for invasive breast cancer by histologic subtype. Int J Radiat Oncol Biol Phys 23 (5): 941-7, 1992. [PUBMED Abstract]
- Arthur DW, Winter KA, Kuerer HM, et al.: Effectiveness of Breast-Conserving Surgery and 3-Dimensional Conformal Partial Breast Reirradiation for Recurrence of Breast Cancer in the Ipsilateral Breast: The NRG Oncology/RTOG 1014 Phase 2 Clinical Trial. JAMA Oncol 6 (1): 75-82, 2020. [PUBMED Abstract]
- van Dongen JA, Voogd AC, Fentiman IS, et al.: Long-term results of a randomized trial comparing breast-conserving therapy with mastectomy: European Organization for Research and Treatment of Cancer 10801 trial. J Natl Cancer Inst 92 (14): 1143-50, 2000. [PUBMED Abstract]
- Fisher B, Anderson S, Bryant J, et al.: Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med 347 (16): 1233-41, 2002. [PUBMED Abstract]
- Blichert-Toft M, Rose C, Andersen JA, et al.: Danish randomized trial comparing breast conservation therapy with mastectomy: six years of life-table analysis. Danish Breast Cancer Cooperative Group. J Natl Cancer Inst Monogr (11): 19-25, 1992. [PUBMED Abstract]
- van Dongen JA, Bartelink H, Fentiman IS, et al.: Randomized clinical trial to assess the value of breast-conserving therapy in stage I and II breast cancer, EORTC 10801 trial. J Natl Cancer Inst Monogr (11): 15-8, 1992. [PUBMED Abstract]
- Sarrazin D, Lê MG, Arriagada R, et al.: Ten-year results of a randomized trial comparing a conservative treatment to mastectomy in early breast cancer. Radiother Oncol 14 (3): 177-84, 1989. [PUBMED Abstract]
- Jacobson JA, Danforth DN, Cowan KH, et al.: Ten-year results of a comparison of conservation with mastectomy in the treatment of stage I and II breast cancer. N Engl J Med 332 (14): 907-11, 1995. [PUBMED Abstract]
- Veronesi U, Cascinelli N, Mariani L, et al.: Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer. N Engl J Med 347 (16): 1227-32, 2002. [PUBMED Abstract]
- Veronesi U, Salvadori B, Luini A, et al.: Breast conservation is a safe method in patients with small cancer of the breast. Long-term results of three randomised trials on 1,973 patients. Eur J Cancer 31A (10): 1574-9, 1995. [PUBMED Abstract]
- Freedman GM, Anderson PR, Li T, et al.: Locoregional recurrence of triple-negative breast cancer after breast-conserving surgery and radiation. Cancer 115 (5): 946-51, 2009. [PUBMED Abstract]
- Schmidt-Ullrich R, Wazer DE, Tercilla O, et al.: Tumor margin assessment as a guide to optimal conservation surgery and irradiation in early stage breast carcinoma. Int J Radiat Oncol Biol Phys 17 (4): 733-8, 1989. [PUBMED Abstract]
- Solin LJ, Fowble BL, Schultz DJ, et al.: The significance of the pathology margins of the tumor excision on the outcome of patients treated with definitive irradiation for early stage breast cancer. Int J Radiat Oncol Biol Phys 21 (2): 279-87, 1991. [PUBMED Abstract]
- Wazer DE, Schmidt-Ullrich RK, Schmid CH, et al.: The value of breast lumpectomy margin assessment as a predictor of residual tumor burden. Int J Radiat Oncol Biol Phys 38 (2): 291-9, 1997. [PUBMED Abstract]
- Moran MS, Schnitt SJ, Giuliano AE, et al.: Society of Surgical Oncology-American Society for Radiation Oncology consensus guideline on margins for breast-conserving surgery with whole-breast irradiation in stages I and II invasive breast cancer. J Clin Oncol 32 (14): 1507-15, 2014. [PUBMED Abstract]
- Chagpar AB, Killelea BK, Tsangaris TN, et al.: A Randomized, Controlled Trial of Cavity Shave Margins in Breast Cancer. N Engl J Med 373 (6): 503-10, 2015. [PUBMED Abstract]
- Kern KA: Sentinel lymph node mapping in breast cancer using subareolar injection of blue dye. J Am Coll Surg 189 (6): 539-45, 1999. [PUBMED Abstract]
- Rubio IT, Korourian S, Cowan C, et al.: Sentinel lymph node biopsy for staging breast cancer. Am J Surg 176 (6): 532-7, 1998. [PUBMED Abstract]
- Veronesi U, Paganelli G, Galimberti V, et al.: Sentinel-node biopsy to avoid axillary dissection in breast cancer with clinically negative lymph-nodes. Lancet 349 (9069): 1864-7, 1997. [PUBMED Abstract]
- Albertini JJ, Lyman GH, Cox C, et al.: Lymphatic mapping and sentinel node biopsy in the patient with breast cancer. JAMA 276 (22): 1818-22, 1996. [PUBMED Abstract]
- Krag D, Weaver D, Ashikaga T, et al.: The sentinel node in breast cancer--a multicenter validation study. N Engl J Med 339 (14): 941-6, 1998. [PUBMED Abstract]
- Veronesi U, Paganelli G, Viale G, et al.: Sentinel lymph node biopsy and axillary dissection in breast cancer: results in a large series. J Natl Cancer Inst 91 (4): 368-73, 1999. [PUBMED Abstract]
- Mansel RE, Fallowfield L, Kissin M, et al.: Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC Trial. J Natl Cancer Inst 98 (9): 599-609, 2006. [PUBMED Abstract]
- Krag DN, Anderson SJ, Julian TB, et al.: Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial. Lancet Oncol 11 (10): 927-33, 2010. [PUBMED Abstract]
- Jagsi R, Chadha M, Moni J, et al.: Radiation field design in the ACOSOG Z0011 (Alliance) Trial. J Clin Oncol 32 (32): 3600-6, 2014. [PUBMED Abstract]
- Galimberti V, Cole BF, Zurrida S, et al.: Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases (IBCSG 23-01): a phase 3 randomised controlled trial. Lancet Oncol 14 (4): 297-305, 2013. [PUBMED Abstract]
- Donker M, van Tienhoven G, Straver ME, et al.: Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial. Lancet Oncol 15 (12): 1303-10, 2014. [PUBMED Abstract]
- Gentilini OD, Botteri E, Sangalli C, et al.: Sentinel Lymph Node Biopsy vs No Axillary Surgery in Patients With Small Breast Cancer and Negative Results on Ultrasonography of Axillary Lymph Nodes: The SOUND Randomized Clinical Trial. JAMA Oncol 9 (11): 1557-1564, 2023. [PUBMED Abstract]
- Reimer T, Stachs A, Veselinovic K, et al.: Axillary Surgery in Breast Cancer - Primary Results of the INSEMA Trial. N Engl J Med 392 (11): 1051-1064, 2025. [PUBMED Abstract]
- Cunningham BL: Breast reconstruction following mastectomy. In: Najarian JS, Delaney JP, eds.: Advances in Breast and Endocrine Surgery. Year Book Medical Publishers, 1986, pp 213-226.
- Scanlon EF: The role of reconstruction in breast cancer. Cancer 68 (5 Suppl): 1144-7, 1991. [PUBMED Abstract]
- Hang-Fu L, Snyderman RK: State-of-the-art breast reconstruction. Cancer 68 (5 Suppl): 1148-56, 1991. [PUBMED Abstract]
- Feller WF, Holt R, Spear S, et al.: Modified radical mastectomy with immediate breast reconstruction. Am Surg 52 (3): 129-33, 1986. [PUBMED Abstract]
- Kuske RR, Schuster R, Klein E, et al.: Radiotherapy and breast reconstruction: clinical results and dosimetry. Int J Radiat Oncol Biol Phys 21 (2): 339-46, 1991. [PUBMED Abstract]
Radioterapia para el cáncer de mama
La radioterapia es el tratamiento estándar después de la cirugía de conservación de la mama como parte de la terapia de conservación de la mama. La radioterapia también se considera para pacientes con riesgo alto después de la mastectomía. El objetivo principal de la radioterapia adyuvante es erradicar la enfermedad residual con el fin de disminuir la recidiva local y aumentar la supervivencia específica del cáncer de mama.[1]
Radioterapia posterior a la cirugía de conservación de la mama
En las mujeres que se someten a cirugía de conservación de la mama, pero que no reciben radioterapia, el riesgo de recidiva en la mama conservada es considerable (>20 %) aún en las mujeres en las que se confirme la ausencia de compromiso ganglionar axilar.[2] Pese a que en todos los ensayos de evaluación de la función de la radioterapia en la terapia de conservación de la mama se demostraron reducciones estadísticas muy significativas de la tasa de recidiva local, en ningún ensayo se demostró una reducción estadísticamente significativa de la mortalidad. No obstante, en un metanálisis grande se demostró una reducción significativa del riesgo de recidiva y muerte por cáncer de mama.[3] Por lo tanto, la evidencia respalda el uso de la radioterapia dirigida a toda la mama después de la cirugía de conservación de la misma.
Evidencia (cirugía de conservación de la mama seguida de radioterapia):
- En un metanálisis de 17 ensayos clínicos realizados por el Early Breast Cancer Trialists’ Collaborative Group (EBCTCG) en 2011, que incluyó a más de 10 000 mujeres con cáncer de mama en estadio temprano, se respaldó el uso de la radioterapia dirigida a toda la mama después de la cirugía de conservación de la misma.[3][Nivel de evidencia A1]
- La radioterapia dirigida a toda la mama redujo significativamente el riesgo de recidiva a 10 años en comparación con la cirugía de conservación de la mama sola (19 % con radioterapia dirigida a toda la mama vs. 35 % con cirugía de conservación de la mama sola; riesgo relativo [RR], 0,52; intervalo de confianza [IC] 95 %, 0,48–0,56) y redujo significativamente el riesgo de muerte por cáncer de mama a 15 años (21 % con radioterapia dirigida a toda la mama vs. 25 % con cirugía de conservación de la mama sola; RR, 0,82; IC 95 %, 0,75–0,90).
Con respecto al programa y dosis de radiación, se observó lo siguiente:
- Dosis de radiación dirigida a toda la mama. La radioterapia convencional dirigida a toda la mama se administra al órgano completo (con los ganglios linfáticos regionales o sin estos) en fracciones diarias de 1,8 Gy a 2 Gy durante 5 a 6,5 semanas, para una dosis total de 45 Gy a 50 Gy.
- Radiación de refuerzo. Por lo general, se administra en el lecho tumoral un refuerzo de radiación. En dos ensayos aleatorizados realizados en Europa, se observó que el uso de refuerzos de 10 Gy a 16 Gy reduce el riesgo de recidiva local del 4,6 % al 3,6 % a los 3 años (P = 0,044),[4][Nivel de evidencia B1] y del 7,3 % al 4,3 % a los 5 años (P < 0,001).[5][Nivel de evidencia B1] Los resultados fueron similares después de una mediana de seguimiento de 17,2 años.[6][Nivel de evidencia B1] Si se usa un refuerzo, se puede administrar con radioterapia de haz externo, a menudo con electrones, o mediante un implante radiactivo intersticial.[7] Sin embargo, la administración de un refuerzo de radiación quizás se relacione con desenlaces desfavorables en calidad de vida.[8]
- Programa de radiación. En algunos estudios se observa que un programa de fraccionamiento más corto de 42,5 Gy durante 3 a 4 semanas es una alternativa razonable para algunas pacientes con cáncer de mama.
- En un ensayo de ausencia de inferioridad, se analizaron las tasas de recidiva locorregional en 1234 pacientes con cáncer de mama invasivo sin compromiso ganglionar que se asignaron al azar para recibir radioterapia convencional dirigida a toda la mama versus un programa de fraccionamiento más corto.[9] La tasa de recaída locorregional a 10 años en las mujeres que recibieron un fraccionamiento más corto no fue inferior a la de quienes recibieron la radioterapia convencional dirigida a toda la mama (6,2 % con el programa de fraccionamiento más corto vs. 6,7 % con radioterapia dirigida a toda la mama con una diferencia absoluta de 0,5 puntos porcentuales; IC 95 %, -2,5 a 3,5).[9][Nivel de evidencia B1
- De manera similar, en un análisis combinado de los ensayos aleatorizados del United Kingdom Standardisation of Breast Radiotherapy Trials (START), (START-A [ISRCTN59368779]) y START-B [ISRCTN59368779]) no se observaron diferencias en la tasa de recaída locorregional a 10 años. En estos ensayos se asignó al azar de manera colectiva a 4451 mujeres con cáncer de mama invasivo en estadio temprano extirpado por completo (pT1–3a, pN0–1, M0) después de la cirugía de conservación de la mama para recibir dosis convencionales de radioterapia dirigida a toda la mama o un fraccionamiento más corto.[10][Nivel de evidencia B1]
- En un metanálisis en el que se incluyeron los 3 ensayos mencionados antes y otros 6 ensayos, se confirmó que las diferencias con respecto a la recidiva local o el resultado cosmético entre los programas de fraccionamiento más cortos y los convencionales no tuvieron significación estadística ni clínica.[11]
Se necesitan más estudios para determinar si el fraccionamiento más corto es apropiado para las mujeres con una carga de enfermedad ganglionar más alta.[10]
Omisión de la radioterapia para el cáncer de mama en estadio temprano favorable
La omisión de la radioterapia después de la cirugía de conservación de la mama se ha probado en pacientes de más edad con tumores positivos para receptores hormonales en estadio temprano (T1 y T2 pequeño) después de la cirugía primaria. En dos ensayos grandes se encontró que la radiación se puede omitir de manera segura sin que empeore la supervivencia, pero con un aumento del riesgo de recidiva local de alrededor del 8 % a los 10 años, suponiendo que se usa terapia hormonal.
- El estudio CALGB 9343 fue un ensayo aleatorizado de fase III de omisión de la radioterapia. Se inscribieron 636 mujeres; 317 recibieron tamoxifeno con radioterapia y 319 recibieron tamoxifeno solo. Las mujeres aptas para participar tenían 70 años o más y presentaban cáncer de mama en estadio clínico I positivo para el receptor de estrógeno (ER). Los criterios de selección inicial incluían cánceres de mama de hasta 4 cm con independencia del estado de ER, pero en agosto de 1996 se redujo a un máximo de 2 cm (T1) con estado de receptor positivo para ER o indeterminado. Las pacientes no podían tener compromiso ganglionar axilar.[12][Nivel de evidencia A1]
- A los 10 años, el 98 % de las pacientes del grupo de tamoxifeno y radiación (IC 95 %, 96–99 %) no presentaban recidivas locales ni regionales, en comparación con el 90 % del grupo de tamoxifeno solo (IC 95 %, 85–93 %).
- No hubo diferencias significativas entre los dos grupos en el tiempo hasta la mastectomía, el tiempo hasta la metástasis a distancia, la supervivencia específica del cáncer de mama ni la supervivencia en general. La tasa de supervivencia general (SG) a 10 años fue del 67 % (IC 95 %, 62–72 %) en el grupo de tamoxifeno y radiación, y del 66 % (IC 95 %, 61–71 %) en el grupo de tamoxifeno solo.
- El estudio PRIME-II fue un ensayo de fase III de omisión de la radioterapia. Se asignó al azar a 1326 mujeres para recibir irradiación dirigida a toda la mama (n = 658) o no recibir irradiación (n = 668). Las mujeres aptas para participar tenían 65 años o más y presentaban cáncer primario de mama T1 o T2 (con tumores ≤3 cm en la dimensión más grande) positivo para receptores hormonales, sin compromiso ganglionar. Las pacientes se habían sometido previamente a cirugía de conservación de la mama con márgenes de extirpación limpios y terapia endocrina adyuvante.[13][Nivel de evidencia A1]
- Al cabo de una mediana de seguimiento de 10 años, la incidencia acumulada de recidiva local del cáncer de mama fue del 9,5 % (IC 95 %, 6,8–12,3 %) en el grupo sin radioterapia y del 0,9 % (IC 95 %, 0,1–1,7 %) en el grupo con radioterapia. La tasa de SG a 10 años fue casi idéntica en los 2 grupos, del 80,8 % (IC 95 %, 77,2–84 ,3%) en el grupo sin radioterapia y del 80,7 % (IC 95 %, 76,9–84,3 %) en el grupo con radioterapia.
Irradiación parcial de la mama
Se han publicado directrices para abordar la identificación de las candidatas apropiadas para recibir irradiación parcial de la mama.[14]
Evidencia (irradiación parcial de la mama):
- En el ensayo RAPID (NCT00282035) se asignaron al azar a 2135 mujeres de 40 años o mayores con carcinoma intraductal in situ o cáncer de mama sin compromiso ganglionar sometidas a cirugía de conservación de la mama a recibir irradiación parcial acelerada de la mama (IPAM) con haz externo (38,5 Gy en 10 fracciones administradas 2 veces al día durante 5–8 días) o radioterapia dirigida a toda la mama (42,5 Gy en 16 fracciones administradas 1 vez al día durante 21 días, o 50 Gy en 25 fracciones una vez al día durante 35 días).[15] Se observaron 65 recidivas tumorales mamarias ipsilaterales, 37 en el grupo de IPAM y 28 en el grupo de irradiación dirigida a toda la mama.
- En las pacientes tratadas con IPAM, la tasa acumulada a 5 años de recidiva tumoral mamaria ipsilateral fue del 2,3 % (IC 95 %, 1,4–3,2 %) y la tasa acumulada a 8 años fue del 3,0 % (IC 95 %, 1,9–4,0 %).
- En las pacientes tratadas con radioterapia dirigida a toda la mama, la tasa acumulada a 5 años de recidiva tumoral mamaria ipsilateral fue del 1,7 % (intervalo, 0,9–2,5 %) y la tasa acumulada a 8 años fue del 2,8 % (intervalo, 1,8–3,9 %).
- El cociente de riesgos instantáneos (CRI) para la IPAM versus la radioterapia dirigida a toda la mama fue de 1,27 (IC 90 %, 0,84–1,91).
- Por ende, el límite superior del IC 90 % estimado no excedió el margen de ausencia de inferioridad de 2,02. El grupo de IPAM presentó menos toxicidad a corto plazo, pero más toxicidad a largo plazo.[15][Nivel de evidencia B1]
- En el ensayo NSABP B-39/RTOG 0413 (NCT00103181), se asignó al azar a 4216 mujeres a radioterapia dirigida a toda la mama o IPAM.[16] La radioterapia dirigida a toda la mama se administró en 25 fracciones diarias de 50 Gy durante 5 semanas, con refuerzos suplementarios dirigidos al lecho tumoral o sin estos, y la IPAM se administró como 34 Gy de braquiterapia o 38,5 Gy de radioterapia de haz externo en 10 fracciones, durante 5 días de tratamiento dentro de un periodo de 8 días.
- Al cabo de una mediana de seguimiento de 10,2 años (intervalo intercuartílico, 7,5–11,5), 90 de 2089 mujeres (4 %) aptas para el análisis del criterio principal de valoración en el grupo de la IPAM y 71 de 2036 mujeres (3 %) en el grupo de radioterapia dirigida a toda la mama presentaron recidiva tumoral mamaria ipsilateral (CRI, 1,22; IC 90 %, 0,94–1,58). Los resultados no alcanzaron el criterio preespecificado para la equivalencia, un CRI de 1,50 o inferior.
- No hubo diferencias considerables en los efectos tóxicos entre los grupos.[16][Nivel de evidencia B1]
- En el ensayo aleatorizado de fase III de un solo centro APBI-IMRT-Florence(NCT02104895) se evaluaron las diferencias en la recidiva tumoral de mama ipsilateral entre las pacientes que recibieron IPAM mediante radioterapia de intensidad modulada, una técnica de radiación avanzada (30 Gy en 5 fracciones una vez al día) o radioterapia dirigida a toda la mama con campos tangenciales (50 Gy en 25 fracciones con refuerzo del lecho tumoral). Las pacientes se habían sometido previamente a cirugía de conservación de la mama. Se asignó al azar a un total de 520 pacientes (radioterapia dirigida a toda la mama, n = 260; IPAM, n = 260).[17]
- La incidencia acumulada a 10 años de recidiva tumoral en la mama ipsilateral fue del 2,5 % en el grupo de radioterapia dirigida a toda la mama y del 3,7 % en el grupo de IPAM (CRI, 1,56; IC 95 %, 0,55–4,37; P = 0,40).
- La tasa de SG a 10 años fue del 91 % en ambos grupos (CRI, 0,95; IC 95 %, 0,50–1,79; P = 0,86). La supervivencia específica del cáncer de mama a 10 años fue del 96 % en el grupo de radioterapia dirigida a toda la mama y del 97 % en el grupo de IPAM (CRI, 0,65; IC 95 %, 0,21–1,99; P = 0,45).
- Hubo menos efectos tóxicos agudos y tardíos en el grupo de IPAM (P = 0,0001 para ambas comparaciones). El grupo de IPAM presentó mejores resultados cosméticos según la evaluación de médicos y pacientes (P = 0,0001 para ambas comparaciones).
Irradiación ganglionar regional
La irradiación ganglionar regional se administra de modo rutinario después de la mastectomía para pacientes con compromiso ganglionar; sin embargo, su función para pacientes sometidas a cirugía de conservación de la mama y radioterapia dirigida a toda la mama es menos clara. En un ensayo aleatorizado (NCT00005957) de 1832 mujeres, se observó que la administración de irradiación ganglionar regional después de una cirugía de conservación de la mama y de radioterapia dirigida a toda la mama redujo el riesgo de recidiva (tasa de SSE a 10 años, 82,0 vs. 77,0 %; CRI, 0,76; IC 95 %, 0,61–0,94; P = 0,01), pero no afectó la supervivencia (tasa de SG a 10 años, 82,8 vs. 81,8 %; CRI, 0,91; IC 95 %, 0,72–1,13; P = 0,38).[18][Nivel de evidencia A1]
Se notificaron hallazgos similares en el ensayo EORTC (NCT00002851). Se asignó al azar a mujeres con un tumor primario central o medial, con compromiso ganglionar axilar o sin este, o con un tumor externo con compromiso axilar, para recibir radioterapia dirigida a toda la mama o a la pared torácica con irradiación de los ganglios regionales o sin esta. Se realizó una cirugía de conservación de la mama al 76,1 % de las participantes; el resto se sometió a mastectomía. No se observó una mejora de la SG a 10 años en las pacientes que recibieron irradiación ganglionar regional, en comparación con las pacientes que no la recibieron (82,3 vs. 80,7 %, P = 0,06). La SSE a distancia mejoró en las pacientes sometidas a irradiación ganglionar regional en comparación con las pacientes que no se sometieron a esta irradiación (78 vs. 75 %, P = 0,02).[19][Nivel de evidencia A1]
En un metanálisis de datos individuales de pacientes de todos los ensayos aleatorizados de radioterapia regional dirigida a ganglios linfáticos versus ninguna radioterapia regional dirigida a ganglios linfáticos en mujeres con cáncer de mama en estadio temprano, se incluyeron 16 ensayos clínicos con 14 324 participantes. Se encontró que la radioterapia redujo de manera significativa la mortalidad por cáncer de mama (RR, 0,87; IC 95 %, 0,80–0,94; P = 0,0010), sin un efecto significativo sobre la mortalidad por causas diferentes al cáncer de mama (RR, 0,97; 0,84–1,11; P = 0,63), lo que produjo una reducción significativa de la mortalidad general (RR, 0,90; 0,84–0,96; P = 0,0022). Las reducciones absolutas estimadas en la mortalidad por cáncer de mama a 15 años fueron del 1,6 % en las mujeres sin compromiso ganglionar, del 2,7 % en aquellas con compromiso de 1 a 3 ganglios axilares y del 4,5 % en aquellas con compromiso de 4 o más ganglios axilares.[20]
Radioterapia posterior a la mastectomía
La radioterapia adyuvante posoperatoria dirigida a la pared torácica y los ganglios linfáticos regionales tradicionalmente se administra a pacientes seleccionadas por su riesgo alto de fracaso locorregional después de una mastectomía. Las pacientes con riesgo más alto de recidiva local tienen una o más de las siguientes características:[21-23]
- Compromiso de 4 o más ganglios axilares.
- Extensión ganglionar extracapsular macroscópica evidente.
- Invasión del espacio linfovascular.
- Tumores primarios grandes.
- Márgenes de resección del tumor primario positivos profundos o muy estrechos.
La radioterapia puede disminuir la recidiva locorregional en este grupo de riesgo alto, incluso en pacientes que reciben quimioterapia adyuvante.[24]
Es posible que el riesgo de recidiva local sea más bajo en las pacientes con compromiso de 1 a 3 ganglios linfáticos, pero sin ningún factor de riesgo alto; hay polémica sobre la utilidad de la administración rutinaria de radioterapia adyuvante en este entorno.
Evidencia (radioterapia posoperatoria para pacientes con compromiso de 1 a 3 ganglios linfáticos):
- En el metanálisis de 2005 del EBCTCG con 42 000 mujeres de 78 ensayos aleatorizados de comparaciones de tratamientos, se indicó que la radioterapia es beneficiosa, con independencia del número de ganglios linfáticos comprometidos.[1][Nivel de evidencia A1]
- En las mujeres con compromiso ganglionar después de una mastectomía y vaciamiento axilar (extirpación de ganglios linfáticos axilares y la grasa circundante), la radioterapia redujo el riesgo de recidiva local a 5 años del 23 % al 6 % (ganancia absoluta, 17 %; IC 95 %, 15,2–18,8 %). Esto se tradujo en una reducción significativa (P = 0,002) de la mortalidad por cáncer de mama (54,7 vs. 60,1 %), con una ganancia absoluta del 5,4 % (IC 95 %, 2,9–7,9 %).
- En los análisis de subgrupos, la tasa de recidiva local a 5 años se redujo en un 12 % (IC 95 %, 8–16 %) en mujeres con compromiso de 1 a 3 ganglios linfáticos y en un 14 % (IC 95 %, 10–18 %) en mujeres con compromiso de 4 o más ganglios linfáticos. En un metanálisis actualizado de 1314 mujeres sometidas a disección axilar y compromiso de 1 a 3 ganglios, la radioterapia redujo la recidiva locorregional (P bilateral < 0,00001), la recidiva general (RR, 0,68; IC 95 %, 0,57–0,82; P bilateral = 0,00006) y la mortalidad por cáncer de mama (RR, 0,80; IC 95 %, 0,67–0,95; P bilateral = 0,01).[25][Nivel de evidencia A1]
- En contraste, en el caso de las mujeres sin compromiso ganglionar y con riesgo bajo de recidiva local, la reducción absoluta en la recidiva local a 5 años fue de solo el 4 % (P = 0,002; IC 95 %, 1,8–6,2 %), y no hubo una reducción estadísticamente significativa de la tasa de mortalidad por cáncer de mama a 15 años (ganancia absoluta, 1,0 %; P > 0,1; IC 95 %, -0,8–2,8 %).
Además, en un análisis de los ensayos del National Surgical Adjuvant Breast and Bowel Project (NSABP) se observó que incluso en las pacientes con tumores primarios grandes (>5 cm) sin compromiso ganglionar axilar, el riesgo de recidiva locorregional aislada fue tan bajo (7,1 %) que la radioterapia locorregional de rutina no se justificaba.[26]
Programación de la radioterapia posoperatoria
Se ha estudiado la secuencia óptima de la quimioterapia y la radioterapia adyuvantes después de la cirugía de conservación de la mama. De acuerdo con los estudios, el aplazamiento de la radioterapia durante varios meses después de la cirugía de conservación de la mama hasta la finalización de la quimioterapia adyuvante no parece tener un efecto negativo en el resultado general. Además, en las pacientes con riesgo alto de diseminación a distancia, quizás sea preferible iniciar la quimioterapia inmediatamente después de la cirugía de conservación de la mama.
Evidencia (programación de la radioterapia posoperatoria):
- En un ensayo aleatorizado, las pacientes recibieron uno de los siguientes regímenes:[27][Nivel de evidencia A1]
- Primero quimioterapia (n = 122) de ciclofosfamida, metotrexato, fluorouracilo (5-FU) y prednisona con doxorrubicina repetida cada 21 días durante 4 ciclos, seguida de radiación dirigida a la mama.
- Primero radiación dirigida a la mama (n = 122), seguida de la misma quimioterapia.
Se observaron los siguientes resultados:
- Después de una mediana de seguimiento de 5 años, la SG fue del 73 % para el grupo que recibió primero radioterapia y del 81 % para el grupo que recibió primero quimioterapia (P = 0,11).
- Las tasas brutas a 5 años de la primera recidiva por sitio fueron, para la recidiva local, del 5 % en el grupo que recibió primero radioterapia y del 14 % en el grupo que recibió primero quimioterapia; y para la recidiva a distancia o regional o ambas, fueron del 32 % en el grupo que recibió primero radioterapia y del 20 % en el grupo que recibió primero quimioterapia. Esta diferencia en el patrón de recidiva estuvo en el límite de la significación estadística (P = 0,07).
- En análisis posteriores, se indicó que las diferencias en los patrones de recidiva persistieron en la mayoría de los subgrupos, excepto en los grupos que tenían márgenes tumorales negativos o que solo tenían compromiso de 1 a 3 ganglios linfáticos. En estos dos subgrupos, la secuencia de asignación afectó muy poco las tasas de recidiva local o a distancia, aunque la potencia estadística de estos análisis de subgrupos fue baja.
- Algunas explicaciones posibles del aumento en la recidiva a distancia observada en el grupo que recibió primero radioterapia, son el aplazamiento de la quimioterapia durante una mediana de 17 semanas después de la cirugía y la administración de dosis bajas de quimioterapia a este grupo debido al aumento de la mielodepresión.
- Otros dos ensayos aleatorizados aportaron información útil, aunque estos no estaban diseñados de manea específica para abordar la programación de la radioterapia y la quimioterapia adyuvante.
- En el ensayo NSABP-B-15, las pacientes sometidas a cirugía de conservación de la mama recibieron un curso de ciclofosfamida, metotrexato y 5-FU (CMF) (n = 194), seguido de radioterapia, y luego 5 ciclos adicionales de CMF, o recibieron 4 ciclos de doxorrubicina y ciclofosfamida (n = 199), seguidos de radioterapia.[28][Nivel de evidencia A1]
- No se observaron diferencias en la SSE, la SSE a distancia y la SG entre estos dos grupos.
- En los ensayos del International Breast Cancer Study Group VI y VII también se modificó la programación de la radioterapia y la quimioterapia adyuvante con CMF y se notificaron resultados similares a los de NSABP-B-15.[29]
- En el ensayo NSABP-B-15, las pacientes sometidas a cirugía de conservación de la mama recibieron un curso de ciclofosfamida, metotrexato y 5-FU (CMF) (n = 194), seguido de radioterapia, y luego 5 ciclos adicionales de CMF, o recibieron 4 ciclos de doxorrubicina y ciclofosfamida (n = 199), seguidos de radioterapia.[28][Nivel de evidencia A1]
En estos estudios se observó que el aplazamiento de 2 a 7 meses de la radioterapia después de la cirugía no afectó la tasa de recidiva local. Estos hallazgos se confirmaron en un metanálisis.[30][Nivel de evidencia A1]
En un análisis no planificado de pacientes tratadas en un ensayo de fase III para evaluar el beneficio de añadir trastuzumab al tratamiento de pacientes con cáncer de mama positivo para HER2, no se encontró aumento del riesgo de eventos adversos agudos ni aumento de la frecuencia de episodios cardíacos en las pacientes que recibieron al mismo tiempo radioterapia adyuvante y trastuzumab.[31] Por lo tanto, la administración simultánea de radioterapia y trastuzumab parece ser inocua y evita demoras adicionales en el inicio del tratamiento con radioterapia.
Efectos tóxicos agudos y tardíos de la radioterapia
Los efectos tóxicos agudos de la radioterapia incluyen dermatitis por radiación, hinchazón o prurito en la mama, tirantez en el área de la axila y fatiga. Si se administra tratamiento en ganglios regionales, las pacientes también pueden experimentar náuseas y dolor de garganta debido a la esofagitis por radiación. Por lo general, los síntomas alcanzan su máximo 1 a 2 semanas después de la radioterapia y luego disminuyen lentamente durante las siguientes 4 a 6 semanas.[32]
Los efectos tóxicos tardíos de la radioterapia son poco frecuentes y se pueden reducir con algunas técnicas de administración de radiación, y con una delimitación cuidadosa del volumen diana. Los efectos tardíos de la radiación son los siguientes:
- Neumonitis por radiación. En un análisis retrospectivo de 1624 mujeres tratadas en una sola institución con cirugía conservadora y radiación adyuvante dirigida a la mama, la incidencia general de neumonitis sintomática por radiación fue del 1,0 % al cabo de una mediana de seguimiento de 77 meses.[33] La incidencia de neumonitis aumentó al 3,0 % con el uso de un campo de radiación supraclavicular y al 8,8 % cuando se administró quimioterapia simultánea. La incidencia fue de solo el 1,3 % en las pacientes que recibieron quimioterapia secuencial.[33][Nivel de evidencia C1]
- Complicaciones cardíacas. Hay polémica sobre el aumento del riesgo de mortalidad cardíaca como resultado de la radiación adyuvante dirigida a la pared torácica izquierda o la mama izquierda, con inclusión de los ganglios linfáticos regionales o sin esta. En las mujeres tratadas con radioterapia antes de 1980, se observó un aumento de la tasa de mortalidad cardíaca después de 10 a 15 años, en comparación con las mujeres con cáncer de mama que no recibieron radiación o la recibieron solo en el lado derecho.[24,34-36] Es probable que la causa fuera la radiación que se administró en el miocardio izquierdo.
Las técnicas modernas de radioterapia introducidas en la década de 1990 han reducido la profundidad de la radiación dirigida al miocardio subyacente cuando se irradia el lado izquierdo de la pared torácica o la mama izquierda. Por consiguiente, se redujo la mortalidad cardíaca.[37,38]
En un análisis de los datos del Programa de Vigilancia, Epidemiología y Resultados Finales (SEER) del Instituto Nacional del Cáncer de 1973 a 1989, en el que se revisaron las muertes por cardiopatía isquémica en mujeres que recibieron radiación dirigida a la mama o la pared torácica, se observó que desde 1980 no se encontró aumento de la tasa de mortalidad por cardiopatía isquémica en las mujeres que recibieron radiación en la mama o la pared torácica del lado izquierdo.[39,40][Nivel de evidencia C1]
En un estudio poblacional de casos y controles se evaluaron eventos coronarios mayores (es decir, infarto de miocardio, revascularización coronaria o muerte por cardiopatía isquémica) en 2168 mujeres sometidas a radioterapia por cáncer de mama. En el estudio se encontró que la dosis media general dirigida a todo el corazón fue de 4,9 Gy (intervalo, 0,03–27,72). Las tasas de episodios coronarios graves aumentaron de manera lineal con la dosis media dirigida al corazón en un 7,4 % por Gy (IC 95 %, 2,9–14,5 %; P < 0,001), sin límite aparente.[41]
- Linfedema del brazo. El linfedema sigue siendo una preocupación importante para la calidad de vida de las pacientes con cáncer de mama. El tratamiento de modalidad única en la axila (cirugía o radiación) se relaciona con una incidencia baja de edema del brazo. La radioterapia adyuvante aumenta el riesgo de edema del brazo en las mujeres sometidas a disección axilar. Se presenta edema en el 2 % al 10 % de las pacientes sometidas a disección axilar sola en comparación con el 13 % al 18 % de las que se someten a disección axilar y radioterapia adyuvante.[42-44] Para obtener más información, consultar Linfedema.
- Plexopatía braquial. La lesión por radiación del plexo braquial después de radioterapia ganglionar adyuvante es una entidad clínica poco frecuente en pacientes con cáncer de mama. En un estudio de una sola institución sobre técnicas modernas de radiación, 449 pacientes con cáncer de mama tratadas con radioterapia posoperatoria dirigida a la mama y los ganglios linfáticos regionales se sometieron a un seguimiento durante 5,5 años para evaluar la tasa de lesiones del plexo braquial.[45] El diagnóstico de esta lesión se estableció por evaluación clínica y de tomografía computarizada con el fin de diferenciar una lesión por radiación de una recidiva tumoral. Cuando se administraron 54 Gy en 30 fracciones dirigidas a los ganglios regionales, la incidencia de lesión sintomática en el plexo braquial fue del 1,0 %, en comparación con el 5,9 % cuando el tamaño de las fracciones usadas fue más alto (45 Gy en 15 fracciones).
- Cáncer de mama contralateral. En un informe, se indicó un aumento del cáncer de mama contralateral en mujeres menores de 45 años que recibieron radioterapia dirigida a la pared torácica después de una mastectomía.[46] No aumentó el riesgo de cáncer de mama contralateral en las mujeres de 45 años o mayores que recibieron radioterapia.[47] Se utilizan técnicas que minimizan la dosis de radiación dirigida a la mama contralateral para mantener el riesgo absoluto tan bajo como sea posible.[48]
- Riesgo de segundas neoplasias malignas. La tasa de segundas neoplasias malignas después de la radioterapia adyuvante es muy baja. Los sarcomas en el campo del tratamiento son poco frecuentes, con un riesgo a largo plazo del 0,2 % a los 10 años.[49] En las pacientes que no fuman, el riesgo de cáncer de pulmón como resultado de la exposición a la radiación durante el tratamiento es mínimo cuando se usan técnicas modernas de dosimetría. Sin embargo, es posible que las fumadoras tengan un aumento pequeño del riesgo de cáncer pulmonar en el pulmón ipsilateral.[50]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Clarke M, Collins R, Darby S, et al.: Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials. Lancet 366 (9503): 2087-106, 2005. [PUBMED Abstract]
- Eifel P, Axelson JA, Costa J, et al.: National Institutes of Health Consensus Development Conference Statement: adjuvant therapy for breast cancer, November 1-3, 2000. J Natl Cancer Inst 93 (13): 979-89, 2001. [PUBMED Abstract]
- Darby S, McGale P, Correa C, et al.: Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials. Lancet 378 (9804): 1707-16, 2011. [PUBMED Abstract]
- Romestaing P, Lehingue Y, Carrie C, et al.: Role of a 10-Gy boost in the conservative treatment of early breast cancer: results of a randomized clinical trial in Lyon, France. J Clin Oncol 15 (3): 963-8, 1997. [PUBMED Abstract]
- Bartelink H, Horiot JC, Poortmans P, et al.: Recurrence rates after treatment of breast cancer with standard radiotherapy with or without additional radiation. N Engl J Med 345 (19): 1378-87, 2001. [PUBMED Abstract]
- Bartelink H, Maingon P, Poortmans P, et al.: Whole-breast irradiation with or without a boost for patients treated with breast-conserving surgery for early breast cancer: 20-year follow-up of a randomised phase 3 trial. Lancet Oncol 16 (1): 47-56, 2015. [PUBMED Abstract]
- Wazer DE, Kramer B, Schmid C, et al.: Factors determining outcome in patients treated with interstitial implantation as a radiation boost for breast conservation therapy. Int J Radiat Oncol Biol Phys 39 (2): 381-93, 1997. [PUBMED Abstract]
- King MT, Link EK, Whelan TJ, et al.: Quality of life after breast-conserving therapy and adjuvant radiotherapy for non-low-risk ductal carcinoma in situ (BIG 3-07/TROG 07.01): 2-year results of a randomised, controlled, phase 3 trial. Lancet Oncol 21 (5): 685-698, 2020. [PUBMED Abstract]
- Whelan TJ, Pignol JP, Levine MN, et al.: Long-term results of hypofractionated radiation therapy for breast cancer. N Engl J Med 362 (6): 513-20, 2010. [PUBMED Abstract]
- Haviland JS, Owen JR, Dewar JA, et al.: The UK Standardisation of Breast Radiotherapy (START) trials of radiotherapy hypofractionation for treatment of early breast cancer: 10-year follow-up results of two randomised controlled trials. Lancet Oncol 14 (11): 1086-94, 2013. [PUBMED Abstract]
- Hickey BE, James ML, Lehman M, et al.: Fraction size in radiation therapy for breast conservation in early breast cancer. Cochrane Database Syst Rev 7: CD003860, 2016. [PUBMED Abstract]
- Hughes KS, Schnaper LA, Bellon JR, et al.: Lumpectomy plus tamoxifen with or without irradiation in women age 70 years or older with early breast cancer: long-term follow-up of CALGB 9343. J Clin Oncol 31 (19): 2382-7, 2013. [PUBMED Abstract]
- Kunkler IH, Williams LJ, Jack WJL, et al.: Breast-Conserving Surgery with or without Irradiation in Early Breast Cancer. N Engl J Med 388 (7): 585-594, 2023. [PUBMED Abstract]
- Shaitelman SF, Anderson BM, Arthur DW, et al.: Partial Breast Irradiation for Patients With Early-Stage Invasive Breast Cancer or Ductal Carcinoma In Situ: An ASTRO Clinical Practice Guideline. Pract Radiat Oncol 14 (2): 112-132, 2024. [PUBMED Abstract]
- Whelan TJ, Julian JA, Berrang TS, et al.: External beam accelerated partial breast irradiation versus whole breast irradiation after breast conserving surgery in women with ductal carcinoma in situ and node-negative breast cancer (RAPID): a randomised controlled trial. Lancet 394 (10215): 2165-2172, 2019. [PUBMED Abstract]
- Vicini FA, Cecchini RS, White JR, et al.: Long-term primary results of accelerated partial breast irradiation after breast-conserving surgery for early-stage breast cancer: a randomised, phase 3, equivalence trial. Lancet 394 (10215): 2155-2164, 2019. [PUBMED Abstract]
- Meattini I, Marrazzo L, Saieva C, et al.: Accelerated Partial-Breast Irradiation Compared With Whole-Breast Irradiation for Early Breast Cancer: Long-Term Results of the Randomized Phase III APBI-IMRT-Florence Trial. J Clin Oncol 38 (35): 4175-4183, 2020. [PUBMED Abstract]
- Whelan TJ, Olivotto IA, Parulekar WR, et al.: Regional Nodal Irradiation in Early-Stage Breast Cancer. N Engl J Med 373 (4): 307-16, 2015. [PUBMED Abstract]
- Poortmans PM, Collette S, Kirkove C, et al.: Internal Mammary and Medial Supraclavicular Irradiation in Breast Cancer. N Engl J Med 373 (4): 317-27, 2015. [PUBMED Abstract]
- Early Breast Cancer Trialists' Collaborative Group (EBCTCG): Radiotherapy to regional nodes in early breast cancer: an individual patient data meta-analysis of 14 324 women in 16 trials. Lancet 402 (10416): 1991-2003, 2023. [PUBMED Abstract]
- Ragaz J, Jackson SM, Le N, et al.: Adjuvant radiotherapy and chemotherapy in node-positive premenopausal women with breast cancer. N Engl J Med 337 (14): 956-62, 1997. [PUBMED Abstract]
- Overgaard M, Hansen PS, Overgaard J, et al.: Postoperative radiotherapy in high-risk premenopausal women with breast cancer who receive adjuvant chemotherapy. Danish Breast Cancer Cooperative Group 82b Trial. N Engl J Med 337 (14): 949-55, 1997. [PUBMED Abstract]
- Fowble B, Gray R, Gilchrist K, et al.: Identification of a subgroup of patients with breast cancer and histologically positive axillary nodes receiving adjuvant chemotherapy who may benefit from postoperative radiotherapy. J Clin Oncol 6 (7): 1107-17, 1988. [PUBMED Abstract]
- Favourable and unfavourable effects on long-term survival of radiotherapy for early breast cancer: an overview of the randomised trials. Early Breast Cancer Trialists' Collaborative Group. Lancet 355 (9217): 1757-70, 2000. [PUBMED Abstract]
- McGale P, Taylor C, Correa C, et al.: Effect of radiotherapy after mastectomy and axillary surgery on 10-year recurrence and 20-year breast cancer mortality: meta-analysis of individual patient data for 8135 women in 22 randomised trials. Lancet 383 (9935): 2127-35, 2014. [PUBMED Abstract]
- Taghian AG, Jeong JH, Mamounas EP, et al.: Low locoregional recurrence rate among node-negative breast cancer patients with tumors 5 cm or larger treated by mastectomy, with or without adjuvant systemic therapy and without radiotherapy: results from five national surgical adjuvant breast and bowel project randomized clinical trials. J Clin Oncol 24 (24): 3927-32, 2006. [PUBMED Abstract]
- Recht A, Come SE, Henderson IC, et al.: The sequencing of chemotherapy and radiation therapy after conservative surgery for early-stage breast cancer. N Engl J Med 334 (21): 1356-61, 1996. [PUBMED Abstract]
- Fisher B, Brown AM, Dimitrov NV, et al.: Two months of doxorubicin-cyclophosphamide with and without interval reinduction therapy compared with 6 months of cyclophosphamide, methotrexate, and fluorouracil in positive-node breast cancer patients with tamoxifen-nonresponsive tumors: results from the National Surgical Adjuvant Breast and Bowel Project B-15. J Clin Oncol 8 (9): 1483-96, 1990. [PUBMED Abstract]
- Wallgren A, Bernier J, Gelber RD, et al.: Timing of radiotherapy and chemotherapy following breast-conserving surgery for patients with node-positive breast cancer. International Breast Cancer Study Group. Int J Radiat Oncol Biol Phys 35 (4): 649-59, 1996. [PUBMED Abstract]
- Hickey BE, Francis DP, Lehman M: Sequencing of chemotherapy and radiotherapy for early breast cancer. Cochrane Database Syst Rev 4: CD005212, 2013. [PUBMED Abstract]
- Halyard MY, Pisansky TM, Dueck AC, et al.: Radiotherapy and adjuvant trastuzumab in operable breast cancer: tolerability and adverse event data from the NCCTG Phase III Trial N9831. J Clin Oncol 27 (16): 2638-44, 2009. [PUBMED Abstract]
- Lapen K, Sabol C, Tin AL, et al.: Development and Pilot Implementation of a Remote Monitoring System for Acute Toxicity Using Electronic Patient-Reported Outcomes for Patients Undergoing Radiation Therapy for Breast Cancer. Int J Radiat Oncol Biol Phys 111 (4): 979-991, 2021. [PUBMED Abstract]
- Lingos TI, Recht A, Vicini F, et al.: Radiation pneumonitis in breast cancer patients treated with conservative surgery and radiation therapy. Int J Radiat Oncol Biol Phys 21 (2): 355-60, 1991. [PUBMED Abstract]
- Paszat LF, Mackillop WJ, Groome PA, et al.: Mortality from myocardial infarction after adjuvant radiotherapy for breast cancer in the surveillance, epidemiology, and end-results cancer registries. J Clin Oncol 16 (8): 2625-31, 1998. [PUBMED Abstract]
- Rutqvist LE, Johansson H: Mortality by laterality of the primary tumour among 55,000 breast cancer patients from the Swedish Cancer Registry. Br J Cancer 61 (6): 866-8, 1990. [PUBMED Abstract]
- Darby SC, McGale P, Taylor CW, et al.: Long-term mortality from heart disease and lung cancer after radiotherapy for early breast cancer: prospective cohort study of about 300,000 women in US SEER cancer registries. Lancet Oncol 6 (8): 557-65, 2005. [PUBMED Abstract]
- Højris I, Overgaard M, Christensen JJ, et al.: Morbidity and mortality of ischaemic heart disease in high-risk breast-cancer patients after adjuvant postmastectomy systemic treatment with or without radiotherapy: analysis of DBCG 82b and 82c randomised trials. Radiotherapy Committee of the Danish Breast Cancer Cooperative Group. Lancet 354 (9188): 1425-30, 1999. [PUBMED Abstract]
- Nixon AJ, Manola J, Gelman R, et al.: No long-term increase in cardiac-related mortality after breast-conserving surgery and radiation therapy using modern techniques. J Clin Oncol 16 (4): 1374-9, 1998. [PUBMED Abstract]
- Giordano SH, Kuo YF, Freeman JL, et al.: Risk of cardiac death after adjuvant radiotherapy for breast cancer. J Natl Cancer Inst 97 (6): 419-24, 2005. [PUBMED Abstract]
- Harris EE, Correa C, Hwang WT, et al.: Late cardiac mortality and morbidity in early-stage breast cancer patients after breast-conservation treatment. J Clin Oncol 24 (25): 4100-6, 2006. [PUBMED Abstract]
- Darby SC, Ewertz M, McGale P, et al.: Risk of ischemic heart disease in women after radiotherapy for breast cancer. N Engl J Med 368 (11): 987-98, 2013. [PUBMED Abstract]
- Meek AG: Breast radiotherapy and lymphedema. Cancer 83 (12 Suppl American): 2788-97, 1998. [PUBMED Abstract]
- Larson D, Weinstein M, Goldberg I, et al.: Edema of the arm as a function of the extent of axillary surgery in patients with stage I-II carcinoma of the breast treated with primary radiotherapy. Int J Radiat Oncol Biol Phys 12 (9): 1575-82, 1986. [PUBMED Abstract]
- Swedborg I, Wallgren A: The effect of pre- and postmastectomy radiotherapy on the degree of edema, shoulder-joint mobility, and gripping force. Cancer 47 (5): 877-81, 1981. [PUBMED Abstract]
- Powell S, Cooke J, Parsons C: Radiation-induced brachial plexus injury: follow-up of two different fractionation schedules. Radiother Oncol 18 (3): 213-20, 1990. [PUBMED Abstract]
- Boice JD, Harvey EB, Blettner M, et al.: Cancer in the contralateral breast after radiotherapy for breast cancer. N Engl J Med 326 (12): 781-5, 1992. [PUBMED Abstract]
- Storm HH, Andersson M, Boice JD, et al.: Adjuvant radiotherapy and risk of contralateral breast cancer. J Natl Cancer Inst 84 (16): 1245-50, 1992. [PUBMED Abstract]
- Fraass BA, Roberson PL, Lichter AS: Dose to the contralateral breast due to primary breast irradiation. Int J Radiat Oncol Biol Phys 11 (3): 485-97, 1985. [PUBMED Abstract]
- Taghian A, de Vathaire F, Terrier P, et al.: Long-term risk of sarcoma following radiation treatment for breast cancer. Int J Radiat Oncol Biol Phys 21 (2): 361-7, 1991. [PUBMED Abstract]
- Inskip PD, Stovall M, Flannery JT: Lung cancer risk and radiation dose among women treated for breast cancer. J Natl Cancer Inst 86 (13): 983-8, 1994. [PUBMED Abstract]
Terapia sistémica para el cáncer de mama en estadios I, II y III
La primera decisión a tomar sobre el uso de terapia sistémica en pacientes con cáncer de mama en estadios I, II y III es si se debe administrar antes o después de la cirugía. En esta sección se describen los factores a tener en cuenta al tomar esta decisión. También se incluye información sobre el tratamiento del cáncer de mama localmente avanzado o inflamatorio.
La quimioterapia preoperatoria, también conocida como quimioterapia primaria o neoadyuvante, se ha administrado tradicionalmente a pacientes con cáncer de mama localmente avanzado a fin de reducir el volumen tumoral y permitir una intervención quirúrgica definitiva. Es posible que la quimioterapia preoperatoria también permita conservar la mama en las pacientes que no cumplen con los requisitos para la conservación de la mama en el momento del cuadro clínico inicial. Es posible que la quimioterapia preoperatoria también reduzca la necesidad de una disección de ganglios linfáticos axilares (DGLA) en pacientes con enfermedad con compromiso ganglionar.
Gran parte de la evidencia que se presenta en las siguientes secciones sobre la quimioterapia preoperatoria se explica en las directrices de la American Society of Clinical Oncology que incluye varias opciones de tratamiento para estas pacientes.[1]
En un metanálisis de 2005 de múltiples ensayos clínicos aleatorizados, se demostró que la quimioterapia preoperatoria se relaciona con una supervivencia sin enfermedad (SSE) y una supervivencia general (SG) idénticas a las de la misma terapia en el entorno adyuvante.[2][Nivel de evidencia A1]
En 2019, el Early Breast Cancer Trialists’ Collaborative Group llevó a cabo un metanálisis con datos individuales de 4756 mujeres que participaron en 10 ensayos en los que se comparó la quimioterapia neoadyuvante con el mismo régimen administrado en el entorno adyuvante.[3] La terapia neoadyuvante se relacionó con un aumento de la frecuencia de conservación de la mama (65 vs. 49 %). No hubo diferencias entre la quimioterapia neoadyuvante y la terapia adyuvante en la recidiva a distancia, la mortalidad por cáncer de mama o la muerte por cualquier causa. Sin embargo, la terapia neoadyuvante se relacionó con tasas más altas de recidiva local a 15 años (21,4 vs. 15,9 %; riesgo relativo [RR], 1,37; intervalo de confianza [IC] 95 %, 1,17−1,61; P = 0,001).[3][Nivel de evidencia A1]
La respuesta patológica completa (RPC) se ha utilizado como criterio indirecto de valoración para los desenlaces a largo plazo, como la SSE, la supervivencia sin complicaciones (SSC) y la SG, en ensayos clínicos preoperatorios de cáncer de mama. En un análisis conjunto (CTNeoBC) de 11 ensayos aleatorizados preoperatorios (n = 11 955) se determinó que la RPC definida como la ausencia de cáncer invasivo residual en la mama y los ganglios axilares, con cáncer in situ o sin este (ypT0/is ypN0 o ypT0 ypN0), se relacionó con desenlaces superiores en comparación con la erradicación de un tumor invasivo solo en la mama (ypT0/is).[4] La RPC no se pudo validar en este estudio como criterio indirecto de valoración para la mejora de la SSC y la SG.[4][Nivel de evidencia C2] Debido a la estrecha relación entre la RPC y desenlaces muy superiores en pacientes individuales con subtipos más malignos de cáncer de mama, la FDA respaldó el uso de la RPC como criterio de valoración en ensayos clínicos preoperatorios de pacientes con cáncer de mama en estadio temprano y de riesgo alto.
Lamentablemente, la clasificación de las pacientes con RPC o enfermedad residual no permite distinguir entre las pacientes con diferentes cantidades de enfermedad residual. El método de carga de cáncer residual (RCB) se diseñó para abordar esta limitación y otras deficiencias pronósticas. El método RCB proporciona un estándar para evaluar y cuantificar la extensión de la enfermedad residual en la mama y los ganglios linfáticos axilares después de la quimioterapia neoadyuvante. Se notifica como una puntuación continua y la RPC se puntúa como RCB-0. Hay cuatro categorías RCB que van desde RCB-0 hasta RCB-3. La determinación de la RCB después del tratamiento neoadyuvante se validó como un factor pronóstico del cáncer de mama en estadio temprano.
Se llevó a cabo un análisis conjunto, multinacional y multiinstitucional, en el que se utilizaron los resultados de la RCB de las participantes y los datos clinicopatológicos. Se analizaron los datos de 5161 participantes para evaluar la relación entre la puntuación RCB continua y la SSC, que era el criterio principal de valoración del estudio. Al cabo de una mediana de seguimiento de 56 meses, la puntuación RCB fue pronóstica para cada subtipo de cáncer de mama, y una puntuación RCB más alta se relacionó significativamente con una SSC más precaria. La puntuación RCB fue pronóstica para la SSC en modelos multivariantes ajustados por edad, grado, categoría T (tumor) y estado ganglionar inicial. El cociente de riesgos instantáneos (CRI) ajustado relacionado con un aumento de 1 unidad en la RCB osciló entre 1,52 en el grupo de enfermedad positiva para receptores hormonales y negativa para HER2, y 2,09 en el grupo con enfermedad negativa apara receptores hormonales y positiva para HER2 (P < 0,0001 en todos los subtipos).[5]
En particular se prefiere la terapia neoadyuvante, en pacientes con enfermedad triple negativa o positiva para HER2, cuando la respuesta patológica se usa como pauta para la elección de la mejor terapia neoadyuvante después de la cirugía. Para obtener más información, consultar las secciones Cáncer de mama triple negativo en estadios I, II y III y Cáncer de mama positivo para HER2 en estadios I, II y III.
En la actualidad, se está evaluando la omisión de la radioterapia posoperatoria dirigida a los ganglios linfáticos regionales en pacientes que presentan compromiso ganglionar al inicio y que logran permanecer sin compromiso ganglionar después de la terapia neoadyuvante.
Selección de pacientes, estadificación, tratamiento y seguimiento
La atención multidisciplinaria de un equipo con experiencia en pacientes sometidas a terapia preoperatoria es esencial para optimizar los siguientes aspectos:
- Selección de pacientes.
- Elección de la terapia sistémica.
- Tratamiento y abordaje quirúrgico axilar.
- Decisión de administrar radioterapia adyuvante.
Las características histológicas del tumor, el grado y el estado de los receptores hormonales se evalúan cuidadosamente antes de iniciar la terapia preoperatoria. Es menos probable que las pacientes con tumores de tipo histológico lobulillar, de grado bajo o con expresión alta de receptores hormonales y estado negativo para HER2 respondan a la quimioterapia y deben considerar la cirugía primaria; en especial, cuando no hay compromiso clínico ganglionar. En estos casos, incluso si se administra quimioterapia adyuvante después de la cirugía, es posible evitar un régimen de tercera generación (a base de antraciclinas o taxanos).
Antes de comenzar la terapia preoperatoria, se debe evaluar la extensión de la enfermedad dentro de la mama y los ganglios linfáticos regionales. Para estadificar la enfermedad sistémica se usan los siguientes procedimientos:[6]
- Tomografía computarizada del tórax y el abdomen, y una gammagrafía ósea.
- Tomografía por emisión de positrones.
Cuando se desea usar terapia de conservación de la mama, se obtienen imágenes iniciales de la mama para identificar la ubicación del tumor y descartar la enfermedad multicéntrica. Por lo general se toma una biopsia de las anomalías sospechosas antes de comenzar el tratamiento y se coloca un marcador en el centro de cada tumor de mama. Toda vez que sea posible, se deben obtener biopsias de los ganglios axilares sospechosos antes de comenzar el tratamiento sistémico.
En las pacientes sin compromiso ganglionar que reciben quimioterapia neoadyuvante, por lo general se realiza una biopsia de ganglio linfático centinela (GLC) en el momento de la cirugía. En las pacientes con compromiso ganglionar, detectado mediante examen clínico o imágenes, es posible llevar a cabo una biopsia de GLC en aquellas que dejan de tener compromiso clínico ganglionar después de la terapia preoperatoria.[7] El mapeo dual con radiocoloide y colorante azul, así como la extirpación de al menos 3 ganglios sin compromiso, se relacionó con una tasa de falsos negativos más baja; en estas pacientes es posible omitir la DGLA.[8][Nivel de evidencia B4]; [9][Nivel de evidencia C2]; [10][Nivel de evidencia C3]
Cuando se considera administrar terapia preoperatoria, las opciones de tratamiento son las siguientes:
- Un régimen de quimioterapia a base de antraciclinas y taxanos para tumores de mama negativos para HER2.
- Quimioterapia y terapia dirigida a HER2 para la enfermedad positiva para HER2.
- En condiciones ideales, todo el régimen de tratamiento se administra antes de la cirugía.
- La quimioterapia es una opción para mujeres posmenopáusicas con cáncer de mama positivo para receptores hormonales. La terapia endocrina preoperatoria quizás sea una opción para las pacientes que no pueden recibir quimioterapia.
- Está en investigación el uso de la terapia endocrina preoperatoria para las mujeres premenopáusicas con cáncer sensible al tratamiento hormonal.
Es necesaria la evaluación clínica frecuente de la respuesta al tratamiento después de comenzar la terapia preoperatoria. También se necesita repetir la evaluación radiográfica si el objetivo quirúrgico es la conservación de la mama. Las pacientes con enfermedad progresiva durante la terapia preoperatoria pueden pasar a un régimen sin resistencia cruzada o proceder a la cirugía, si es posible.[11,12] Aunque la transición a un régimen sin resistencia cruzada produce una tasa más alta de RPC que la continuación de la misma terapia, no hay evidencia clara que indique que este abordaje mejore otros desenlaces del cáncer de mama.
Cáncer de mama positivo para receptores hormonales negativo para HER2 en estadios I, II y III
La mayoría de los estudios que respaldan el uso de quimioterapia se realizaron en pacientes ya operadas y antes del uso generalizado de la terapia preoperatoria. En general, sus resultados siguen siendo aplicables al tratamiento preoperatorio, y estos regímenes son los que se usan con más frecuencia en el espacio neoadyuvante para este subtipo. En la siguiente sección se describen los estudios en los que se examinó el uso de quimioterapia en el entorno preoperatorio.
En los ensayos iniciales se examinó si los regímenes a base de antraciclinas utilizados en el entorno adyuvante prolongan la SSE y la SG cuando se utilizan en el entorno preoperatorio. La evidencia respalda tasas más altas de terapia de conservación de la mama cuando el régimen de quimioterapia a base de antraciclinas se administra antes de la cirugía y no después, pero no se observó ninguna mejora de la supervivencia con la estrategia preoperatoria.
Se acostumbra la administración de un régimen a base de antraciclinas y taxanos si la quimioterapia se administra en el entorno neoadyuvante para las pacientes con cáncer de mama negativo para HER2.
Evidencia (régimen de quimioterapia a base de antraciclinas y taxanos):
- En un esfuerzo por mejorar los resultados observados con el régimen de doxorrubicina y ciclofosfamida (AC) solo, se llevó a cabo el ensayo NSABP B-27 (NCT00002707). Las pacientes se asignaron al azar para recibir las siguientes opciones de tratamiento: 1) 4 ciclos de AC preoperatorios seguidos de cirugía, 2) 4 ciclos de AC seguidos de 4 ciclos de docetaxel y luego cirugía o 3) 4 ciclos de AC seguidos de cirugía y luego 4 ciclos de docetaxel.[13][Nivel de evidencia B1]
- La administración del régimen AC preoperatorio seguido de docetaxel se relacionó con una tasa de respuesta clínica completa más alta en comparación con la administración de AC solo (63,6 % para AC seguido de docetaxel y 40,1 % para AC solo; P < 0,001); también se observó una tasa de RPC más alta (26,1 % para AC seguido de docetaxel y 13,7 % para el AC solo; P < 0,001).
- Los datos del NSABP B-27 y el Aberdeen Breast Group Trial sustentan el uso de regímenes a base de antraciclinas y taxanos para mujeres con respuesta inicial o con resistencia relativa a las antraciclinas.[11]
- También se evaluaron programas alternativos a base de antraciclinas y taxanos (docetaxel, doxorrubicina y ciclofosfamida simultáneos) que tienen eficacia similar al abordaje secuencial descrito antes.[14][Nivel de evidencia B3]
- En el ensayo GeparSepto de fase III (NCT01583426) se investigó el uso de un taxano distinto (nab-paclitaxel) en pacientes con un cáncer de mama primario que no habían recibido tratamiento.[15] Las pacientes (n = 1229) se asignaron al azar para recibir nab-paclitaxel o paclitaxel durante 12 semanas, seguido de 4 ciclos de epirrubicina y ciclofosfamida.
- La tasa de RPC fue más alta en el grupo de nab-paclitaxel (233 pacientes, 38 %; IC 95 %, 35–42 %) cuando se comparó con el grupo de paclitaxel (174 pacientes, 29 %; IC 95 %, 25–33 %).[15][Nivel de evidencia B3]
- Sin embargo, en el ensayo ETNA (NCT01822314) se comparó el nab-paclitaxel neoadyuvante con el paclitaxel seguido de terapia a base de antraciclinas y no se observaron diferencias significativas en la RPC; la neutropenia y la neuropatía periférica fueron más frecuentes en el grupo de nab-paclitaxel.[16]
- Una posible explicación a los hallazgos distintos en los ensayos GeparSepto y ETNA puede ser las diferencias en la dosis y los programas del taxano.
- No se ha comprobado que la incorporación de otros citotóxicos a los regímenes a base de antraciclinas o taxanos ofrezca un beneficio adicional significativo para la conservación de la mama o la tasa de RPC en poblaciones con cáncer de mama no seleccionadas.[17][Nivel de evidencia B3]
Terapia endocrina preoperatoria para el cáncer de mama positivo para receptores hormonales negativo para HER2
La terapia endocrina preoperatoria quizás sea una opción para las mujeres posmenopáusicas con cáncer de mama positivo para receptores hormonales cuando la quimioterapia no es una opción adecuada debido a enfermedades concurrentes o al estado funcional. Aunque el perfil de toxicidad de la terapia hormonal preoperatoria en el transcurso de 3 a 6 meses es favorable, las tasas de RPC obtenidas (1–8 %) son mucho más bajas que las notificadas con quimioterapia en poblaciones no seleccionadas.[18][Nivel de evidencia B3]
Es posible que se necesite prolongar la terapia preoperatoria en esta población de pacientes. El tamoxifeno preoperatorio se relacionó con una tasa de respuesta general del 33 %; en algunas pacientes, la respuesta máxima se logró hasta 12 meses después de la terapia.[19] En un estudio aleatorizado de 4, 8 o 12 meses de letrozol preoperatorio en pacientes mayores que no eran aptas para quimioterapia, se indicó que la terapia más prolongada produjo la tasa más alta de RPC (17,5 vs. 5 vs. 2,5 %, valor de P para la tendencia < 0,04).[20][Nivel de evidencia B3]
Los inhibidores de la aromatasa (IA) también se compararon con el tamoxifeno en el entorno preoperatorio. Las tasas generales de respuesta objetiva y terapia de conservación de la mama con 3 a 4 meses de terapia preoperatoria mejoraron de manera estadísticamente significativa en las mujeres tratadas con IA [18] o fueron comparables a los desenlaces relacionados con el tamoxifeno.[20]
El uso de terapia endocrina preoperatoria en mujeres premenopáusicas con cáncer de mama sensible a las hormonas sigue siendo experimental.
Terapia sistémica posoperatoria para el cáncer de mama positivo para receptores hormonales negativo para HER2
El estadio y las características moleculares determinan la necesidad de terapia sistémica adyuvante y la elección de modalidades en las pacientes que no han recibido terapia sistémica preoperatoria. Es adecuado seleccionar la terapia según el riesgo de recidiva tumoral personal teniendo en cuenta los riesgos a corto y largo plazo del tratamiento adyuvante. Este abordaje permite a los profesionales clínicos ayudar a las personas a determinar si los beneficios previstos de un tratamiento son razonables para su situación.
Quimioterapia con antraciclinas
En un metanálisis del Early Breast Cancer Trialists' Collaborative Group (EBCTCG) se incluyeron 11 ensayos que comenzaron entre 1976 y 1989, en los que se asignó al azar a las mujeres para recibir regímenes con antraciclinas (por ejemplo, doxorrubicina o epirrubicina) o el régimen CMF (ciclofosfamida, metotrexato y fluorouracilo [5-FU]). El resultado del análisis general en el que se comparó el régimen CMF y los regímenes con antraciclinas indicó una leve ventaja de estos últimos en mujeres pre y posmenopáusicas. Se desconocía el estado de HER2 de las mujeres que participaron en estos ensayos.[21]
En varios ensayos se abordaron los beneficios de la adición de taxanos (paclitaxel o docetaxel) a un régimen de quimioterapia adyuvante a base de antraciclinas.[22-26]
En un metanálisis de la literatura médica de 13 estudios, se demostró que el uso de un taxano mejoró la SSE y la SG (SSE: CRI, 0,83, IC 95 %, 0,79–0,87; P < 0,001; SG: CRI, 0,85, IC 95 %, 0,79–0,91; P < 0,001. Las diferencias absolutas de la supervivencia a 5 años fueron del 5 % para la SSE y del 3 % para la SG a favor de los regímenes que contenían taxanos.[22][Nivel de evidencia A1]
Varios estudios han abordado los programas de quimioterapia óptimos y la selección de taxanos.
En un ensayo intergrupal dirigido por el Eastern Cooperative Oncology Group (E1199 [NCT00004125]) con 4950 pacientes, se utilizó un diseño factorial para comparar 2 programas de administración (cada semana o cada 3 semanas) de los 2 fármacos (docetaxel vs. paclitaxel) después de la dosis estándar de quimioterapia AC administrada cada 3 semanas.[27][Nivel de evidencia A1] Los hallazgos del estudio son los siguientes:
- No se observaron diferencias en la comparación general de docetaxel y paclitaxel en la SSE (oportunidad relativa [OR], 1,03 IC 95 %, 0,91–1,16; P = 0,61) o entre los programas de 1 y 3 semanas (OR 1,06; IC 95 %, 0,94–1,20; P = 0,33).
- En la SSE (0,003) y la SG (0,01) hubo una relación significativa entre el fármaco administrado y el programa de administración. Por lo tanto, en comparación con el paclitaxel administrado cada 3 semanas, el paclitaxel administrado 1 vez por semana mejoró la SSE (OR 1,27; IC 95 %, 1,01–1,57; P = 0,006) y la SG (OR 1,32; IC 95 %, 1,02–1,72; P = 0,01).
- El docetaxel administrado cada 3 semanas también fue superior al paclitaxel administrado cada 3 semanas para la SSE (OR 1,23, IC 95 %, 1,00–1,52; P = 0,02), pero la diferencia no fue estadísticamente significativa en la SG (OR 1,13, IC 95 %, 0,88–1,46; P = 0,25).
- El docetaxel administrado cada semana no fue superior al paclitaxel administrado cada 3 semanas. No hubo fundamentos a priori para anticipar que la variación del programa de administración de los 2 fármacos tendría efectos opuestos.
En varios estudios se buscó determinar si la disminución del período entre los ciclos de quimioterapia podría mejorar los desenlaces clínicos. Los resultados generales de estos estudios apoyan el uso de dosis densas de quimioterapia para mujeres con cáncer de mama negativo para HER2.
Evidencia (administración de dosis densas de quimioterapia en mujeres con cáncer de mama negativo para HER2):
- En un ensayo intergrupal (CALGB-9741 [NCT00003088]) de 2005 pacientes con compromiso ganglionar llevado a cabo en los Estados Unidos, se usó un diseño factorial de 2 × 2 para comparar la administración simultánea de AC seguida de paclitaxel y la administración secuencial de doxorrubicina, paclitaxel y ciclofosfamida cada 2 semanas con filgrastim, o cada 3 semanas.[28][Nivel de evidencia A1]
- Al cabo de una mediana de seguimiento de 68 meses, el tratamiento con dosis densas mejoró la SSE, el criterio principal de valoración, en todas las poblaciones de pacientes (CRI, 0,80; P = 0,018), pero no la SG (CRI, 0,85; P = 0,12).[29][Nivel de evidencia A1]
- No hubo interacción entre la densidad y la secuencia.
- La neutropenia grave fue menos frecuente en las pacientes que recibieron regímenes de dosis densas.[30][Nivel de evidencia A1]
- En un ensayo italiano (NCT00433420) se compararon 2 dosis semanales versus 3 dosis semanales de epirrubicina y ciclofosfamida (con 5-FU o sin este) en un diseño factorial, con un resultado similar al de un ensayo intergrupal de los Estados Unidos; sin embargo, en este ensayo también se demostró una diferencia en la SG.[31]
- Para la comparación de densidad de las dosis, la tasa de SSE a 5 años fue del 81 % (IC 95 %, 79–84 %) en las pacientes tratadas cada 2 semanas y del 76 % (IC 95 %, 74–79 %) en las pacientes tratadas cada 3 semanas (CRI, 0,77; IC 95 %, 0,65–0,92; P = 0,004).
- Las tasas de SG a 5 años fueron del 94 % (IC 95 %, 93–96 %) y del 89 % (IC 95 %, 87–91 %; CRI, 0,65; 0,51–0,84; P = 0,001).[31][Nivel de evidencia A1]
- En un metanálisis de 26 ensayos aleatorizados, que incluyeron 37 298 mujeres que recibieron quimioterapia con antraciclinas y taxanos, se compararon regímenes estándar (administrados cada 3–4 semanas) con regímenes de dosis más intensas. Se aumentó la intensidad de las dosis de los regímenes al acortar el intervalo entre ciclos (es decir, terapia de dosis densas o administración de la misma dosis durante un periodo más corto) y al administrar fármacos individuales en secuencia para permitir dosis más altas (es decir, programa secuencial).[32]
- Las pacientes que recibieron regímenes de dosis más intensas tuvieron una supervivencia sin recidiva (SSR) superior (28,0 vs. 31,4 %; RR, 0,86; IC 95 %, 0,82–0,89; P < 0,0001) y SG (18,9 vs. 21,3 %; RR, 0,87; IC 95 %, 0,83–0,92; P < 0,0001) a 10 años. En los subgrupos de enfermedad positiva y enfermedad negativa para receptores hormonales hubo una diferencia estadísticamente significativa.
Regímenes sin antraciclinas
Debido a los posibles efectos tóxicos a largo plazo de las antraciclinas, se estudió la eficacia y toxicidad de los regímenes que no incluyen este tipo de fármacos. Para obtener más información, consultar la sección Efectos tóxicos de la quimioterapia adyuvante.
Los datos sobre la eficacia comparativa de los regímenes con antraciclinas y sin antraciclinas son contradictorios. Ambos tipos de regímenes son aceptables y la decisión de usarlos se debe hacer de manera personalizada teniendo en cuenta los riesgos y las otras características de cada paciente.
Evidencia (regímenes sin antraciclinas):
- Los ensayos ABS fueron 3 ensayos aleatorizados sin enmascaramiento de fase III en los que se comparó un régimen de taxano y ciclofosfamida (TC) con regímenes que contenían una antraciclina, ciclofosfamida y un taxano (TaxAC) para el tratamiento adyuvante de pacientes con cáncer de mama en estadio temprano negativo para HER2.[33] Se analizaron los 3 ensayos juntos y el criterio principal de valoración fue la supervivencia sin enfermedad invasiva (SSEI). El objetivo principal fue determinar la ausencia de inferioridad del régimen TC (grupo de tratamiento sin antraciclinas) en comparación con los grupos que recibieron TaxAC. La inferioridad para TC se predefinió como un CRI superior a 1,18 en el grupo TC versus los grupos TaxAC. Los participantes se asignaron al azar para recibir TC (n = 2125) o TaxAC (n = 2127).
- En el análisis interino de futilidad, el CRI para la SSEI fue de 1,202 (IC 95 %, 0,97–1,49) para el régimen de TC versus TaxAC, lo cual excedió el límite predeterminado para definir el régimen de TC como inferior.
- La tasa de SSEI a 4 años fue del 88,2 % en las pacientes que recibieron TC y del 90,7 % en las que recibieron TaxAC (P = 0,04).
- Aunque los hallazgos favorecieron los regímenes con una antraciclina, ciclofosfamida y un taxano, las diferencias absolutas entre TC y TaxAC fueron pequeñas. En los análisis exploratorios, se indicó que los mayores beneficios de los regímenes TaxAC se observaron en las pacientes con enfermedad triple negativa y enfermedad positiva para receptores hormonales con compromiso ganglionar axilar, lo que respalda la función de los regímenes sin antraciclinas en las pacientes con enfermedad de riesgo más bajo.
- En el ensayo de Alemania Occidental, Plan B (NCT01049425), se asignaron al azar a 2499 mujeres con compromiso ganglionar o enfermedad de riesgo alto sin compromiso ganglionar a recibir 4 ciclos de epirrubicina y ciclofosfamida con 4 ciclos de docetaxel (EC-T), o 6 ciclos de TC.[34] Después de una enmienda temprana, se excluyeron las mujeres con enfermedad positiva para receptores hormonales y una puntuación de recidiva inferior a 12.
- Al cabo de una mediana de seguimiento de 60 meses, los desenlaces a 5 años fueron similares en los grupos de EC-T y TC para la SSE (CRI, 1,004; IC 95 %, 0,776–1,299) y la SG (CRI, 0,937; IC 95 %, 0,654–1,342).[34][Nivel de evidencia B1]
- El límite superior de confianza del 90 % para la SSE no excedió el margen de ausencia de inferioridad de 1,467.
- Hubo 5 muertes relacionadas con el tratamiento entre las pacientes que recibieron TC y 1 muerte entre las que recibieron EC-T, pero las pacientes que recibieron EC-T presentaron eventos adversos sintomáticos con más frecuencia.
Programación de la quimioterapia posoperatoria
El momento óptimo para iniciar la terapia adyuvante no está claro. En los estudios se notificó lo siguiente.
- En un estudio retrospectivo observacional de una sola institución de pacientes con cáncer de mama en estadio temprano diagnosticado entre 1997 y 2011, se reveló que los retrasos en el inicio de la quimioterapia adyuvante afectaron de manera adversa los desenlaces de supervivencia.[35][Nivel de evidencia C1]
- El comienzo de la quimioterapia 61 días o más después de la cirugía se relacionó con desenlaces adversos en las pacientes con cáncer de mama en estadio II (SSR a distancia [SSRD]: CRI, 1,20; IC 95 %, 1,02–1,43) y cáncer de mama en estadio III (SG: CRI, 1,76; IC 95 %, 1,26–2,46; SSR: CRI, 1,34; IC 95 %, 1,01–1,76 y SSRD: CRI, 1,36; IC 95 %, 1,02–1,80).
- Las pacientes con cáncer de mama triple negativo (CMTN) y las pacientes con tumores positivos para HER2 que recibían trastuzumab y comenzaron la quimioterapia 61 días o más después de la cirugía tuvieron una supervivencia más precaria (CMTN: CRI, 1,54; IC 95 %, 1,09–2,18; con cáncer positivo para HER2: CRI, 3,09; IC 95%, 1,49–6,39) que las pacientes que iniciaron el tratamiento en los primeros 30 días después de la cirugía.
- Debido a las deficiencias y limitaciones de este diseño de estudio, el momento óptimo para iniciar la quimioterapia adyuvante permanece poco claro.
- En un estudio poblacional de California donde participaron 24 843 pacientes, se observó que los retrasos de 90 días o menos para iniciar la quimioterapia adyuvante no afectaron la SG, pero se encontró un efecto importante en los retrasos que excedieron los 90 días (CRI, 1,27; IC 95 %, 1,05–1,53), en especial entre las pacientes con TNBC.[36][Nivel de evidencia C1]
- En otros estudios múltiples se ha examinado el efecto de los retrasos de 90 días o menos en el tratamiento y se han notificado resultados incongruentes, con la posible excepción de las pacientes con TNBC.[36]
Terapia endocrina
Gran parte de la evidencia que se presenta en las siguientes secciones sobre el tratamiento de mujeres con cáncer de mama positivo para receptores hormonales se tomó en cuenta para el documento de pautas de la American Society of Clinical Oncology en el que se describen varias opciones de tratamiento para estas pacientes.[37] Se demostró que administrar terapia endocrina adyuvante durante 5 años disminuye de forma sustancial el riesgo de recidiva locorregional, recidiva a distancia, cáncer de mama contralateral y muerte por cáncer de mama.
La duración óptima de la terapia endocrina no está clara, si bien predomina la evidencia para su uso durante al menos 5 años. En un metanálisis de 88 ensayos clínicos de 62 923 mujeres con cáncer de mama positivo para receptores hormonales en remisión después de 5 años de terapia endocrina, se observó estabilización del riesgo de recidiva tardía 5 a 20 años después del diagnóstico.[38][Nivel de evidencia C2] El riesgo de recidiva a distancia se correlacionó con el estado inicial del tumor (T) y de los ganglios linfáticos (N), y este osciló del 10 % al 41 %.
Tamoxifeno
Se ha demostrado que el tamoxifeno es beneficioso para las mujeres con cáncer de mama positivo para receptores hormonales.
Evidencia (tamoxifeno para el cáncer de mama positivo para receptores hormonales en estadio temprano):
- El EBCTCG llevó a cabo un metanálisis sobre el tratamiento sistémico del cáncer de mama en estadio temprano mediante métodos terapéuticos hormonales, citotóxicos o biológicos, en ensayos aleatorizados que incluyeron a 144 939 mujeres con cáncer de mama en estadio I o II. En un análisis publicado en 2015 se incluyó información de 80 273 participantes de 71 ensayos de tamoxifeno adyuvante.[21][Nivel de evidencia A1]
- En este análisis, se encontró que el beneficio del tamoxifeno se limitó a las mujeres con tumores de mama positivos para receptores hormonales o con estado de receptores hormonales desconocido. En estas mujeres, el uso de tamoxifeno durante 5 años se relacionó con una reducción absoluta a 15 años del 12 % para la recidiva y del 9 % para la mortalidad.
- La asignación a un período de alrededor de 5 años de tamoxifeno adyuvante reduce la tasa anual de mortalidad por cáncer de mama en un 31 %; gran parte de la reducción es independiente del uso de quimioterapia, la edad (<50 años, 50 a 69 años, ≥70 años), el estado del receptor de progesterona (PR) y de otras características del tumor.
- En el metanálisis también se confirmó el beneficio del tamoxifeno adyuvante en mujeres premenopáusicas con resultado positivo para receptores hormonales. El beneficio de recibir tamoxifeno durante 5 años para las mujeres menores de 50 años fue similar al de las mujeres mayores. Además, la reducción proporcional de la recidiva y la mortalidad relacionadas con el uso del tamoxifeno fue semejante en las mujeres de cáncer de mama con compromiso ganglionar o sin este, aunque la mejora absoluta en la supervivencia a 10 años fue mayor en el grupo de cáncer de mama con compromiso ganglionar (5,3 vs. 12,5 % con el uso de tamoxifeno durante 5 años).
- Se encontraron resultados similares en el ensayo IBCSG-13-93.[39] De 1246 mujeres con enfermedad en estadio II, solo las mujeres con enfermedad positiva para receptores hormonales se beneficiaron del tamoxifeno.
En el metanálisis del EBCTCG y en varios ensayos aleatorizados grandes, se abordó la duración óptima del uso de tamoxifeno.[21,40-43] Se demostró que 10 años de terapia con tamoxifeno fue superior a periodos de tratamiento más cortos.
Evidencia (duración de la terapia con tamoxifeno):
- En el metanálisis del EBCTCG se demostró que 5 años de terapia con tamoxifeno fue superior a períodos de tratamiento más cortos. Se observaron los siguientes resultados:[21]
- Se observó una ventaja muy significativa de recibir tamoxifeno durante 5 años versus 1 o 2 años, con respecto al riesgo de recidiva (reducción proporcional del 15,2 %; P < 0,001), y una ventaja menos significativa con respecto a la mortalidad (reducción proporcional del 7,9 %; P = 0,01).
- En un seguimiento a largo plazo del ensayo Adjuvant Tamoxifen Longer Against Shorter (ATLAS [NCT00003016]) se demostró que la terapia con tamoxifeno durante 10 años fue superior a la de 5 años. Entre 1996 y 2005, se asignó al azar a 12 894 mujeres con cáncer de mama en estadio temprano para recibir 10 o 5 años de terapia con tamoxifeno. Se observó lo siguiente:[43][Nivel de evidencia A1]
- En los resultados del estudio se reveló que un periodo de 10 años de tamoxifeno redujo el riesgo de recidiva del cáncer de mama (617 recidivas con 10 años de tamoxifeno vs. 711 recidivas con 5 años de tamoxifeno; P = 0,002), la mortalidad por cáncer de mama (331 defunciones con 10 años de tamoxifeno vs. 397 defunciones con 5 años de tamoxifeno; P = 0,01) y la mortalidad general (639 defunciones con 10 años de tamoxifeno vs. 722 defunciones con 5 años de tamoxifeno; P = 0,01).
- Cabe destacar que desde el momento del diagnóstico inicial del cáncer de mama, los beneficios de un tratamiento durante 10 años fueron menos extremos antes del año 10 en comparación con el periodo posterior. A los 15 años del diagnóstico, la mortalidad por cáncer de mama fue del 15 % a los 10 años y del 12,2 % a los 5 años.
- La terapia con tamoxifeno durante 10 años, en comparación con 5 años, aumenta los siguientes riesgos:
- Émbolo pulmonar: RR, 1,87 (IC 95 %, 1,13–3,07; P = 0,01)
- Accidente cerebrovascular: RR, 1,06; IC 95 %, 0,83–1,36).
- Cardiopatía isquémica: RR, 0,76 (IC 95 %, 0,6–0,95; P = 0,02)
- Cáncer de endometrio: RR, 1,74 (IC 95 %, 1,30–2,34; P = 0,002) Se destaca, que el riesgo acumulado de cáncer de endometrio durante los años 5 a 14 posteriores al diagnóstico del cáncer de mama fue del 3,1 % para las mujeres que recibieron 10 años de tamoxifeno versus el 1,6 % para las mujeres que recibieron 5 años de tamoxifeno. La mortalidad durante los años 5 a 14 fue de 12,2 versus 15 para una reducción absoluta de la mortalidad del 2,8 %.
En los resultados del ensayo ATLAS se indicó que continuar el tamoxifeno durante 5 años adicionales fue beneficioso en las mujeres que todavía estaban en la premenopausia después de 5 años de recibir tamoxifeno adyuvante.[43] Las mujeres que entraron en la menopausia después de recibir tamoxifeno durante 5 años también pueden recibir uno o más IA. Para obtener más información, consultar la sección Inhibidores de la aromatasa.
Tamoxifeno y quimioterapia
Según los resultados de un análisis del EBCTCG, la administración de tamoxifeno a mujeres que recibieron quimioterapia adyuvante no atenúa el beneficio de la quimioterapia.[21] Sin embargo, el uso simultáneo de tamoxifeno y quimioterapia es menos eficaz que la administración secuencial.[44]
Ablación ovárica, tamoxifeno y quimioterapia
La evidencia indica que la ablación ovárica sola no sustituye de forma eficaz a otras terapias sistémicas.[45-49] Asimismo, no se ha observado una mejora significativa de los desenlaces cuando se añade la ablación ovárica al tratamiento con quimioterapia o tamoxifeno.[47,49-52]
Evidencia (tamoxifeno y supresión ovárica):
- En el estudio más grande (SOFT [NCT00066690]) realizado para analizar la adición de ablación ovárica al tamoxifeno con quimioterapia o sin esta, se asignó al azar a 2033 mujeres premenopáusicas (53 % habían recibido quimioterapia) a tratamiento con tamoxifeno o tamoxifeno y supresión ovárica con triptorelina, ablación con cirugía y radioterapia.[53][Nivel de evidencia B1]
- En el informe inicial, tras una mediana de seguimiento de 5,6 años, no hubo una diferencia significativa en el criterio principal de valoración de SSE, (CRI, 0,83; IC 95 %, 0,66–1,04; P = 0,10); la tasa de SSE a 5 años fue del 86 % en el grupo de tamoxifeno y supresión ovárica versus el 84,7 % en el grupo de tamoxifeno solo. Sin embargo, en los resultados actualizados al cabo de una mediana de seguimiento de 8 años, se demostró mejora de la SSE en el grupo que recibió tamoxifeno y supresión ovárica (CRI, 0,76; IC 95 %, 0,62–0,93; P = 0,009) en comparación con el tamoxifeno solo; la tasa de SSE a 8 años fue del 83,2 % en el grupo de tamoxifeno y supresión ovárica versus el 78,9 % en el grupo de tamoxifeno solo.
- Además, la SG a 8 años mejoró en el grupo que recibió tamoxifeno y supresión ovárica en comparación con el grupo de tamoxifeno solo (CRI, 0,67; IC 95 %, 0,48–0,92; P = 0,01); la tasa de SSE a 8 años fue del 93,3 % en el grupo de tamoxifeno y supresión ovárica versus el 91,5 % en el grupo de tamoxifeno solo.
A pesar de los resultados iniciales de este estudio, en general desfavorables, el análisis de subgrupos indicó un beneficio de la supresión ovárica en las mujeres que continuaban en la premenopausia después de recibir quimioterapia. No obstante, en los resultados del seguimiento a 8 años no se demostró heterogeneidad para el efecto del tratamiento según la administración de quimioterapia, aunque las recidivas fueron más frecuentes en las pacientes que recibieron quimioterapia.[54]
- En un ensayo del Korean Breast Cancer Study Group (NCT00912548), se inscribieron 1293 mujeres premenopáusicas menores de 45 años, todas ellas habían recibido quimioterapia adyuvante y todavía conservaban el funcionamiento ovárico o lo habían recuperado después de recibir tamoxifeno durante 2 años. Las pacientes se asignaron al azar para someterse a supresión del funcionamiento ovárico con goserelina y tamoxifeno o tamoxifeno solo.[55]
- En el análisis por intención de tratar de 1282 pacientes, la tasa de SSE a 5 años fue del 89,8 % en las pacientes del grupo de goserelina y tamoxifeno y del 87,3 % en las pacientes del grupo de tamoxifeno solo (CRI, 0,69; IC 95 %, 0,49–0,98; P = 0,036).
- También, se observó mejora de la SG (criterio secundario de valoración) en las pacientes del grupo de goserelina y tamoxifeno (CRI, 0,31; IC 95 %, 0,10–0,95; P = 0,039).[55][Nivel de evidencia A1]
Inhibidores de la aromatasa
Mujeres premenopáusicas
Los inhibidores de la aromatasa (IA) se compararon con el tamoxifeno en mujeres que estaban en la premenopausia y que se habían sometido a supresión o ablación del funcionamiento ovárico. Los resultados de estos estudios son contradictorios.
Evidencia (comparación de un IA y tamoxifeno en mujeres premenopáusicas):
- En un estudio (NCT00295646), 1803 mujeres que recibieron goserelina se asignaron al azar a un ensayo de diseño factorial de 2 x 2 en el que se comparó el anastrozol y el tamoxifeno, con ácido zoledrónico o sin este.[56]
- Al cabo de una mediana de seguimiento de 62 meses, no hubo diferencia en la SSE (CRI, 1,08; IC 95 %, 0,81–1,44; P = 0,59).
- La SG fue superior con el tamoxifeno (CRI, 1,75; IC 95 %, 1,08–2,83; P = 0,02).
- En 2 estudios sin enmascaramiento que se analizaron juntos (TEXT [NCT00066703] y SOFT [NCT00066690]), el exemestano también se comparó con el tamoxifeno en 4690 mujeres premenopáusicas sometidas a ablación ovárica.[57]
- El uso de exemestano produjo una diferencia significativa en la SSE. La tasa de SSE a 8 años fue del 86,8 % en el grupo de exemestano con supresión ovárica vs. el 82,8 % en el grupo de tamoxifeno con supresión ovárica (CRI, 0,77; IC 95 %, 0,67–0,90; P < 0,001).[57][Nivel de evidencia B1]
- La tasa a 8 años de ausencia de recidiva a distancia también fue más alta en el grupo de exemestano y supresión ovárica (91,8 vs. 89,7%; CRI, 0,80; IC 95 %, 0,66–0,96; P = 0,02).
- A pesar de las mejoras en la SSE y la ausencia de recidiva a distancia, no se observaron diferencias en la SG del grupo de exemestano y supresión ovárica en comparación con el grupo de tamoxifeno y supresión ovárica (93,4 vs. 93,3 %; CRI 0,98; IC 95 %, 0,79–1,22; P = 0,84).[57][Nivel de evidencia A1] Sin embargo, al cabo de una mediana de seguimiento de 12 años en el ensayo SOFT, la tasa de SG a 12 años fue del 89,4 % en el grupo de exemestano y supresión ovárica y del 86,8 % en el grupo de tamoxifeno solo (CRI, 0,80; IC 95%, 0,62–1,04).[58]
- En un informe de seguimiento sobre las diferencias en la calidad de vida (CV) entre el grupo de exemestano y supresión ovárica versus el grupo de tamoxifeno y supresión ovárica, se observaron los siguientes resultados (todas las diferencias citadas a continuación fueron significativas con un valor de P < 0,001 y se presentaron en pacientes que recibieron quimioterapia y en aquellas que no la recibieron):[59]
- Las pacientes que recibieron tamoxifeno y supresión del funcionamiento ovárico notificaron más sofocos y sudoración en el transcurso de 5 años que las que recibieron exemestano y supresión del funcionamiento ovárico, aunque con el tiempo estos síntomas mejoraron.
- Las pacientes que recibieron exemestano y supresión del funcionamiento ovárico notificaron más sequedad vaginal, mayor pérdida del interés sexual y dificultades para excitarse que las que recibieron tamoxifeno y supresión del funcionamiento ovárico. Estas diferencias se mantuvieron con el paso del tiempo.
- Las pacientes que recibieron exemestano y supresión del funcionamiento ovárico sufrieron dolores óseos y articulares más intensos, en especial, a corto plazo, que las que recibieron tamoxifeno y supresión del funcionamiento ovárico.
- El cambio desde el valor inicial de los indicadores generales de CV fue pequeño y similar entre los grupos de tratamiento durante los 5 años.[59][Nivel de evidencia A3]
Mujeres posmenopáusicas
En las mujeres posmenopáusicas, el uso de diferentes IA en secuencia seguido de tamoxifeno o como sustituto de este ha sido objeto de múltiples estudios; los resultados se resumieron en un metanálisis de datos individuales de pacientes.[60]
Tratamiento inicial
Evidencia (IA vs. tamoxifeno como tratamiento inicial para mujeres posmenopáusicas):
- En un ensayo aleatorizado grande con 9366 pacientes, se comparó el uso del IA anastrozol, la combinación de anastrozol con tamoxifeno y el tamoxifeno solo como tratamiento adyuvante para pacientes posmenopáusicas con enfermedad con compromiso ganglionar o sin este. La mayoría (84 %) de las pacientes en el estudio tenían resultado positivo para receptores hormonales. Poco más del 20 % había recibido quimioterapia.[61]; [62][Nivel de evidencia B1]
- Al cabo de una mediana de seguimiento de 33,3 meses, no se observaron beneficios para la SSE en el grupo de combinación en relación con el grupo de tamoxifeno solo.[61]
- Sin embargo, las pacientes del grupo de anastrozol tuvieron una SSE significativamente más larga (CRI, 0,83) que las del grupo de tamoxifeno. En un análisis llevado a cabo después de una mediana de seguimiento de 100 meses en las pacientes con resultado positivo para receptores hormonales, la SSE fue significativamente más larga en aquellas que recibieron anastrozol (P = 0,003) (CRI, 0,85; IC 95 %, 0,76–0,94), pero la SG no mejoró (CRI, 0,97; IC 95 %, 0,86–1,11; P = 0,7).[62]
- Las pacientes que recibieron tamoxifeno presentaron con mayor frecuencia cáncer de endometrio y accidentes cerebrovasculares, mientras que las pacientes que recibieron anastrozol tuvieron más fracturas. La frecuencia de infartos de miocardio fue similar en ambos grupos. Con excepción del aumento continuado en la frecuencia de cáncer de endometrio en el grupo de tamoxifeno, estas diferencias no se mantuvieron en el período posterior al tratamiento.[62]
- En un gran ensayo aleatorizado con enmascaramiento doble, participaron 8010 mujeres posmenopáusicas con cáncer de mama positivo para receptores hormonales. Se comparó el uso de letrozol y tamoxifeno, administrados de forma continua durante 5 años o con cambio al grupo del otro fármaco a los 2 años.[63] En un análisis actualizado del International Breast Cancer Study Group (IBCSG-1-98 [NCT00004205]), se notificaron los resultados de las 4922 mujeres que recibieron tamoxifeno o letrozol durante 5 años en una mediana de seguimiento de 51 meses.[64][Nivel de evidencia B1]
- La SSE fue significativamente superior en las pacientes tratadas con letrozol (CRI, 0,82; IC 95 %, 0,71–0,95; P = 0,007; SSE a 5 años, 84,0 vs. 81,1 %).
- La SG no fue significativamente diferente en las pacientes tratadas con letrozol (CRI, 0,91; IC 95 %, 0,75–1,11; P = 0,35).
- En un metanálisis con información de 9885 mujeres de varios ensayos, el riesgo de recidiva a 10 años fue del 19,1 % en el grupo de IA versus 22,7 % en el grupo de tamoxifeno (RR, 0,80; IC 95 %, 0,73–0,88; P < 0,001). La tasa de mortalidad general a 10 años también se redujo del 24,0 % al 21,3 %. (CRI, 0,89; IC 95 %, 0,8–0,97; P = 0,01).[60][Nivel de evidencia A2]
Tamoxifeno con un inhibidor de la aromatasa secuencial versus tamoxifeno durante 5 años
En varios ensayos y metanálisis se examinó el efecto de cambiar a anastrozol o exemestano hasta completar 5 años de tratamiento después de 2 a 3 años de tamoxifeno.[65-67] La evidencia, como se describe a continuación, indica que la administración secuencial de tamoxifeno y un IA es superior a continuar con el tamoxifeno durante 5 años.
Evidencia (administración secuencial de tamoxifeno y un IA vs. tamoxifeno durante 5 años):
- Un grupo llevó a cabo y notificó juntos 2 ensayos en secuencia, en los que participaron 828 pacientes; en un ensayo se usó el IA aminoglutetimida y en el otro se usó anastrozol.[67]
- Al cabo de una mediana de seguimiento de 78 meses, en los grupos de IA se observó una mejora en la mortalidad general (CRI, 0,61; IC 95 %, 0,42–0,88; P = 0,007).[67][Nivel de evidencia A1]
- Otros 2 ensayos se notificaron juntos.[66] Se asignó al azar a 3224 pacientes luego de 2 años de tamoxifeno para continuar con tamoxifeno durante 5 años en total o tomar anastrozol durante 3 años.[67]
- Hubo una diferencia significativa en la SSC (CRI, 0,80; IC 95 %; P = 0,0009), pero no en la SG (SG a 5 años, IC 97 % en el grupo del cruce vs. IC 96 % en el grupo de tamoxifeno solo; P = 0,16).[67][Nivel de evidencia B1]
- En un ensayo grande aleatorizado con enmascaramiento doble (EORTC-10967 [ICCG-96OEXE031-C1396-BIG9702]) (NCT00003418) grande en el que participaron 4742 pacientes, se comparó el uso continuo de tamoxifeno con el cambio a exemestano durante 5 años de terapia en las mujeres que recibieron 2 a 3 años de tamoxifeno.[68][Nivel de evidencia B1]
- Luego del segundo análisis interino planificado, cuando se alcanzó una mediana de seguimiento de las pacientes de 30,6 meses, se revelaron los resultados debido a una diferencia muy significativa (P < 0,005) en la SSE (CRI, 0,68) a favor del grupo de exemestano.[68]
- Después de una mediana de seguimiento de 55,7 meses, el CRI de la SSE fue de 0,76 (IC 95 %, 0,66–0,88; P = 0,001) a favor del exemestano.[69][Nivel de evidencia A1]
- A los 2,5 años de la asignación aleatoria, menos del 3,3 % de las pacientes del grupo de exemestano presentaron un episodio de SSE (IC 95 %, 1,6–4,9). El CRI de la SG fue de 0,85 (IC 95 %, 0,7–1,02; P = 0,08).[69]
- En un metanálisis de 6 ensayos en los que participaron 11 798 pacientes, la tasa de recidiva a 10 años se redujo del 19 % al 17 % en los grupos que recibieron IA (RR, 0,82; IC 95 %, 0,75–0,91; P = 0,0001). La tasa de mortalidad general a 10 años fue del 17,5 % en el grupo de tamoxifeno y del 14,6 % en el grupo de IA (RR, 0,82; IC 95 %, 0,73–0,91; P = 0,0002).[60][Nivel de evidencia A2]
Tamoxifeno e IA de manera secuencial durante 5 años versus un IA durante 5 años
La evidencia indica que no hay un beneficio del uso en secuencia de tamoxifeno y un IA durante 5 años en comparación con el uso de un IA durante 5 años.
Evidencia (administración de tamoxifeno y un IA de manera secuencial vs. un IA durante 5 años):
- En un ensayo aleatorizado grande en el que participaron 9779 pacientes, se comparó la SSE en mujeres posmenopáusicas con cáncer de mama positivo para receptores hormonales que recibieron un tratamiento inicial de tamoxifeno durante 2,5 a 3 años seguido de exemestano para completar 5 años en total versus exemestano solo durante 5 años. Los criterios principales de valoración fueron la SSE a los 2,75 y a los 5,0 años.[70][Nivel de evidencia B1]
- La tasa de SSE a 5 años fue del 85 % en el grupo de tratamiento secuencial y del 86 % en el grupo de exemestano solo (CRI, 0,97; IC 95 %, 0,88–1,08; P = 0,60).
- De modo similar, en el ensayo IBCSG 1-98 (NCT00004205), se compararon 2 grupos de tratamiento secuencial con el tratamiento de letrozol durante 5 años.[71][Nivel de evidencia B1]
- No hubo diferencia en la SSE cuando los 2 grupos de tratamiento secuencial se compararon con el tratamiento de letrozol durante 5 años (CRI de letrozol a tamoxifeno, 1,06; IC 95 %, 0,91–1,23; P = 0,45 y CRI de tamoxifeno a letrozol, 1,07; IC 95 %, 0,92–1,25; P = 0,36).
- En el ensayo FATA-GIM3 (NCT00541086), que no se incluyó en el metanálisis, se comparó el tratamiento con tamoxifeno durante 2 años, seguido de 3 años con uno de los tres IA y el tratamiento con un IA durante 5 años.[72]
- No hubo diferencia significativa en la tasa de SSE a 5 años entre los 2 abordajes de tratamiento (88,5 % en el grupo que cambió de tratamiento y 89,8 % en el grupo de tratamiento desde el inicio con un IA; CRI, 0,89; IC 95 %, 0,73–1,08; P = 0,23).
- En un metanálisis de los ensayos con 12 779 pacientes, la tasa de recidiva a 7 años se redujo ligeramente del 14,5 % al 13,8 % en los grupos que recibieron un IA durante 5 años (RR, 0,90; IC 95 %, 0,81–0,99; P = 0,045). La tasa de mortalidad general a 7 años fue del 9,3 % en los grupos de tamoxifeno seguido por IA y del 8,2 % en los grupos de IA solo (RR, 0,89; IC 95 %, 0,78–1,03; P = 0,11).[60][Nivel de evidencia A2]
Un inhibidor de la aromatasa versus otro durante 5 años
- La actividad androgénica leve del exemestano condujo a la realización de un ensayo aleatorizado en el que se evaluó si el exemestano podría preferirse al anastrozol en términos de eficacia (es decir, la SSC) y toxicidad, como tratamiento inicial para las mujeres posmenopáusicas con diagnóstico de cáncer de mama positivo para receptores hormonales.[73][Nivel de evidencia A1] En el ensayo MA27 (NCT00066573), 7576 mujeres posmenopáusicas se asignaron al azar para recibir anastrozol o exemestano durante 5 años.
- Después de una mediana de seguimiento de 4,1 años, no se observó diferencia en la eficacia (CRI, 1,02; IC 95 %, 0,87–1,18; P = 0,86).[73][Nivel de evidencia B1]
- Los 2 tratamientos tampoco fueron significativamente diferentes en cuanto al efecto en la densidad mineral ósea o las tasas de fractura.[74][Nivel de evidencia B1]
- En el estudio Femara versus Anastrozole Clinical Evaluation (FACE [NCT00248170]), se asignó al azar a 4136 pacientes con enfermedad positiva para receptores hormonales a recibir letrozol o anastrozol.[75]
- No hubo diferencia significativa en la SSE (CRI, 0,93; IC 95 %, 0,80–1,07; P = 0,3150) en el momento del análisis final que se llevó a cabo cuando ocurrieron 709 de los 959 episodios previstos.
- No se encontraron diferencias importantes en los eventos adversos entre los grupos.
- En el ensayo FATA-GIM3, 3697 pacientes con enfermedad positiva para receptores hormonales se asignaron al azar a recibir uno de los tres IA durante 5 años o después de 2 años de tamoxifeno.[72]
- No hubo diferencias significativas en la SSE a 5 años (90,0 % para anastrozol, 88,0 % para exemestano y 89,4 % para letrozol; P = 0,24) de los tres grupos de IA.
Cambio a un inhibidor de la aromatasa después de 5 años de tamoxifeno
La evidencia, según se describe a continuación, indica que el cambio a un IA después de 5 años de tamoxifeno es superior a suspender el tamoxifeno en ese momento.
- En un ensayo aleatorizado con enmascaramiento doble (CAN-NCIC-MA17 [NCT00003140]) grande en el que participaron 5187 pacientes, se comparó el letrozol versus un placebo en mujeres posmenopáusicas con cáncer positivo para receptores hormonales que recibieron tamoxifeno durante cerca de 5 años (intervalo, 4,5–6,0).[76][Nivel de evidencia B1]
- Después del primer análisis interino planificado, cuando se alcanzó una mediana de seguimiento de 2,4 años en las pacientes, se revelaron los resultados debido a una diferencia muy significativa (P < 0,008) en la SSE (CRI, 0,57) a favor del grupo de letrozol.[76]
- Después de 3 años de seguimiento, el 4,8 % de las mujeres del grupo de letrozol presentaron enfermedad recidivante o nuevos tumores primarios versus el 9,8 % de las mujeres del grupo de placebo (IC 95 % para la diferencia, 2,7–7,3 %). Debido a que el estudio se desenmascaró de manera temprana, no se dispondrá de datos comparativos a largo plazo sobre los riesgos y beneficios del letrozol en este entorno.[77,78]
- En un análisis actualizado en el que se incluyeron todos los episodios antes de desenmascararse el estudio, se confirmaron los resultados del análisis interino.[79] Además, se encontró una mejora estadísticamente significativa de la SSE a distancia en las pacientes que recibieron letrozol (CRI, 0,60; IC 95 %, 0,43–0,84; P = 0,002). Si bien no se encontró una diferencia estadísticamente significativa en la población total del estudio, las pacientes con compromiso ganglionar que recibieron letrozol también presentaron una mejora estadísticamente significativa de la SG, (CRI, 0,61; IC 95 %, 0,38–0,98; P = 0,04), aunque el valor de P no se corrigió para comparaciones múltiples.
- En el ensayo NSABP B-33 (NCT00016432) que se diseñó para comparar 5 años de exemestano y placebo después de 5 años de tamoxifeno se interrumpió de modo prematuro cuando se revelaron los resultados del estudio CAN-NCIC-MA17. En el momento del análisis, 560 de las 783 pacientes que se asignaron al azar para recibir exemestano seguían tomando ese medicamento y 344 de las 779 pacientes que se asignaron al azar para recibir placebo se habían cambiado al grupo de exemestano.[80][Nivel de evidencia B1]
- En un análisis por intención de tratar del criterio principal de valoración del estudio, la SSE, se demostró un beneficio no significativo del exemestano (CRI, 0,68; P = 0,07).
Duración de la terapia con inhibidores de la aromatasa
No está clara la duración óptima de la terapia con inhibidores de la aromatasa (IA); en ensayos múltiples se han evaluado cursos que exceden los 5 años.
Evidencia relacionada con la prolongación de la terapia endocrina pasados 5 años de la terapia adyuvante inicial con inhibidores de la aromatasa:
- En un ensayo aleatorizado con enmascaramiento doble de fase III, se evaluó el efecto de la administración de letrozol durante 5 años adicionales versus placebo en 1918 mujeres que habían recibido un IA por 5 años.[81] Se incluyó a pacientes que recibieron tratamiento previo con tamoxifeno. Si bien la mayoría de las mujeres del estudio (70,6 %) habían recibido tamoxifeno adyuvante durante 4,5 a 6 años, una proporción significativa de ellas (20,7 %) habían recibido un IA como tratamiento inicial. El criterio principal de valoración del estudio fue la SSE.
- Al cabo de una mediana de seguimiento de 6,3 años, la SSE mejoró de forma significativa en las pacientes asignadas al azar a recibir letrozol (CRI, 0,66; IC 95 %, 0,48–0,91; P = 0,01). La tasa de SSE a 5 años mejoró del 91 % al 95 %.[81][Nivel de evidencia B1]
- No se observaron diferencias en las tasas de SG (CRI, 0,97; IC 95 %, 0,73–1,28; P = 0,83). Se presentaron más fracturas en las pacientes que recibieron letrozol (14 %) que en las que recibieron placebo (9 %) (P = 0,001).
- Se evaluó la CV con los instrumentos Medical Outcomes Study 36-Item Short-Form Health Survey (SF-36) y Menopause-Specific QOL (MENQOL). Más del 85 % de las participantes completaron las evaluaciones anuales durante 5 años.
- No se encontraron diferencias entre los grupos en las 4 subescalas de MENQOL ni en el puntaje resumido de SF-36.
- Los puntajes de SF-36 correspondientes al componente emocional y de dolor corporal fueron significativamente más precarios (P = 0,03) entre las pacientes que recibieron letrozol, pero las diferencias observadas fueron menores que el mínimo de diferencias clínicamente importantes para el instrumento SF-36.
- En un estudio aleatorizado de fase III se evaluó el efecto de otros 2,5 años de letrozol versus 5 años de letrozol en 1824 mujeres que habían recibido un IA durante 5 años.[Nivel de evidencia B1] [82]
- Los episodios de SSE fueron similares en ambos grupos (CRI, 0,92; IC 95 %, 0,74–1,16). El intervalo sin metástasis a distancia también fue similar (CRI, 1,06; IC 95 % CI, 0,78–1,45).
- En un análisis de subgrupos no se identificaron pacientes que se beneficiaran de la terapia prolongada de 5 años.
- En este estudio no se demostró la superioridad de la terapia con un IA durante 10 años frente a la terapia con un IA durante 7,5 años.
- En el ensayo de fase III (NSABP-B42 [NCT00382070]) se asignaron al azar, con un método de enmascaramiento doble, a 3966 mujeres que habían recibido terapia adyuvante inicial durante 5 años con un IA o tamoxifeno durante 2 a 3 años seguido de un IA, para recibir 5 mg de letrozol o placebo por 5 años adicionales.[83][Nivel de evidencia B1] El análisis planificado de la SSE se llevó a cabo después de una mediana de seguimiento de 6,9 años.
- La tasa de SSE a 7 años fue del 81,3% en el grupo de placebo y del 84,7% en el grupo de letrozol (CRI, 0,85; IC 95 %, 0,73–0,999; P = 0,048). La diferencia observada no fue estadísticamente significativa cuando se tuvieron en cuenta los análisis interinos.
- No se encontraron diferencias estadísticamente significativas en los eventos adversos entre los grupos.
- En el ensayo de fase III(SOLE [NCT00553410]) realizado por el IBCSG se se incluyeron 4851 mujeres posmenopáusicas con resultado positivo para receptores hormonales que habían completado la terapia adyuvante con un IA, un modulador selectivo del receptor de estrógeno (RE) o con ambos durante 5 años. Las pacientes se asignaron al azar para recibir 2,5 mg de letrozol diario durante 5 años o para participar en un programa intermitente que incluyó un descanso por 3 meses al final de cada año durante los primeros 4, pero no en el año 5.[84]
- No se observó ventaja del programa intermitente para la SSE (CRI, 1,08; IC 95 %, 0,93–1,26; P = 0,31) ni para la frecuencia de los eventos adversos.[84][Nivel de evidencia B1]
- En un ensayo de fase III del Dutch Breast Cancer Study Group (DATA [NCT00301457]) se asignaron al azar a 1860 mujeres aptas (posmenopáusicas con enfermedad positiva para receptores hormonales que habían recibido tamoxifeno durante 2 a 3 años) para recibir 1 mg diario de anastrozol durante 3 o 6 años.[85]
- Al cabo de 3 años, 1660 de estas mujeres no presentaban enfermedad: entre ellas, se observó mejora en la SSE, pero no fue estadísticamente significativa, igual que en el grupo de terapia prolongada (CRI, 0,79; IC 95 %, 0,62–1,02).[85][Nivel de evidencia B1] Las mialgias y la osteoporosis u osteopenia fueron más frecuentes en el grupo de terapia prolongada.
- En un ensayo italiano de fase III, sin enmascaramiento (NCT01064635), se incluyeron mujeres posmenopáusicas con resultado positivo para receptores hormonales que habían recibido tamoxifeno durante 2 a 3 años. Las pacientes se asignaron al azar para recibir letrozol durante 2 o 3 años (control) o durante 5 años (terapia prolongada). El criterio principal de valoración fue la SSEI.[86]
- Al cabo de un seguimiento de 11,7 años, la tasa de SSE a 12 años fue del 62 % en el grupo de control y del 67 % en el grupo de terapia prolongada (CRI, 0,78; IC 95 %, 0,65–0,93; P = 0,0064). Estos resultados se confirmaron mediante un análisis de referencia en el que se excluyó a las pacientes que presentaron un episodio de SSE o en las que no se logró hacer el seguimiento antes de la divergencia del tratamiento (2–3 años después de la aleatorización).
- La tasa de SG a 12 años fue de 84 % en el grupo de control y de 88 % en el grupo de terapia prolongada (CRI, 0,77; IC 95 %, 0,60–0,98; P = 0,036).[86][Nivel de evidencia A1]
- Las artralgias y mialgias de grado 3 o superior fueron un poco más frecuentes en el grupo de terapia prolongada que en el grupo de control (3,0 vs. 2,2 % y 0,9 vs. 0,7 %, respectivamente).
- En el estudio de fase III, ABCSG-16, se inscribieron 3484 mujeres posmenopáusicas con cáncer de mama positivo para receptores hormonales que habían completado 5 años de terapia endocrina con tamoxifeno o un IA para recibir terapia prolongada con anastrozol durante 2 o 5 años. El criterio principal de valoración fue la SSE para las 3208 pacientes que permanecieron en el estudio después de 2 años. Los criterios secundarios de valoración fueron la SG, el tiempo transcurrido hasta el cáncer de mama contralateral, el tiempo transcurrido hasta un segundo cáncer primario, las fracturas y los efectos tóxicos.[87]
- Al cabo de 10 años de seguimiento, no se encontró diferencia para la SSE entre los 2 grupos (73,6 % para el curso de 2 años vs. 73,9 % para el curso de 5 años [CRI, 0,99; IC 95 %, 0,85–1,15; P = 0,90]). Además, no hubo diferencia entre los grupos en la SG, el tiempo transcurrido hasta el segundo cáncer primario y el tiempo hasta que se presentó cáncer de mama contralateral.[87][Nivel de evidencia B1]
- Se observó una tendencia a presentar más fracturas en el grupo de 5 años (4,7 vs. 6,3 %; CRI, 1,35; IC 95 %, 1,00–1,84).
- En un ensayo sin enmascaramiento que se hizo en Japón se incluyeron 1697 pacientes que habían recibido lo siguiente: 1) 5 años de anastrozol; o 2) 2 a 3 años de tamoxifeno, seguido de 2 a 3 años de anastrozol. Las pacientes se asignaron al azar para suspender el tratamiento con anastrozol o continuarlo durante 5 años. El criterio principal de valoración fue la SSE.[88]
- En un análisis que se hizo después de que todas las pacientes completaron el tratamiento del protocolo, la SSE fue superior en el grupo que continuó con el tratamiento (tasa de SSE a 5 años, 91 vs. 86 %; CRI, 0,62; IC 95 %, 0,46–0,83; P < 0,0010).[88][Nivel de evidencia B1]
- No hubo diferencia en la SSE a distancia ni en la SG.
Terapia endocrina y terapia con inhibidores de cinasas dependientes de ciclinas
Las cinasas CDK4 y CDK6 se vincularon con la proliferación continuada de células del cáncer de mama positivo para receptores hormonales y resistente a la terapia endocrina. La FDA aprobó el tratamiento con inhibidores de cinasas dependiente de ciclinas (CDK), combinado con terapia endocrina, como terapia de primera línea o posterior para las pacientes con cáncer de mama avanzado positivo para receptores hormonales y negativo para HER2; en la actualidad se está estudiando en el entorno adyuvante. Actualmente, el abemaciclib es el único inhibidor de CDK aprobado por la FDA en el entorno adyuvante.
Evidencia (inhibidores de cinasas dependientes de ciclinas en el entorno adyuvante):
- En el ensayo monarchE (NCT03155997) se examinó el efecto de añadir abemaciclib a la terapia endocrina estándar en mujeres con cáncer de mama positivo para receptores hormonales y negativo para HER2 con un riesgo alto de recidiva.[89] En el ensayo se inscribieron 5630 mujeres que cumplían con uno de los siguientes criterios: compromiso de 4 o más ganglios linfáticos; o compromiso de 1 a 3 ganglios linfáticos y tamaño tumoral de 5 cm o más, grado histológico 3 o Ki67 central del 20 % o superior. Las mujeres se asignaron al azar en una proporción 1:1 al tratamiento de referencia con terapia endocrina adyuvante con 150 mg de abemaciclib (sin enmascaramiento) o sin este 2 veces al día durante 2 años. El criterio principal de valoración fue la SSEI y los criterios secundarios de valoración fueron la SSRD, la SG y la inocuidad.
- Al cabo de una mediana de seguimiento de 54 meses, en un análisis se observó que la adición de abemaciclib produjo una mejora importante en la SSEI (SSEI a 5 años: 76 vs. 83 %; CRI, 0,680; IC 95 %, 0,599–0,772; P < 0,001) y SSRD (SSRD a 5 años: 79 vs. 86 %; CRI, 0,675; IC 95 %, 0,588–0,774; P < 0,001).
- Hubo 208 muertes en el grupo de abemaciclib y 234 muertes en el grupo de terapia endocrina sola. Esta diferencia no fue estadísticamente significativa.[90][Nivel de evidencia B1]
- Debido a los eventos adversos, se produjo ajuste de las dosis en 1901 pacientes (68,1 %); el 56,9 % de estas pacientes tuvieron que omitir dosis y al 41,2 % se les redujo la dosis. En el grupo de abemaciclib, 463 pacientes (16,6 %) interrumpieron el tratamiento con abemaciclib debido a efectos adversos; de ellos, 306 siguieron recibiendo terapia endocrina.[89]
- Se encontraron resultados similares en un análisis de subgrupos preespecificado de pacientes que recibieron quimioterapia neoadyuvante y presentaron enfermedad residual después de la cirugía.[91]
- En el ensayo NATALEE (NCT03701334) se evaluó la adición de ribociclib a la terapia adyuvante estándar en mujeres y hombres con cáncer de mama positivo para receptores hormonales negativo para HER2 en estadios II a III.[92] Un total de 5101 pacientes se asignaron al azar sin enmascaramiento para recibir un IA no esteroideo solo o en combinación con ribociclib dentro de los 12 meses posteriores al inicio del tratamiento con un IA no esteroideo. El criterio principal de valoración fue la SSEI.
- En el momento del segundo análisis interino planificado, cuando la mediana de duración del seguimiento fue de 28 meses, hubo una diferencia significativa en la SSEI a favor del grupo de ribociclib (SSEI a 3 años, 90 % para ribociclib con IA no esteroideo vs 87 % para el IA no esteroideo solo) (CRI, 0,75; IC 95 %, 0,62–0,91; P = 0,003). Este valor P superó el límite predeterminado de 0,0256.[92][Nivel de evidencia B1]
- Los criterios exploratorios de valoración de la SSE a distancia, SSR, SSRD y SG favorecieron al grupo de ribociclib, pero las diferencias no se probaron formalmente para determinar la significación en este análisis.
- La neutropenia (62 vs. 4,5 %) y los eventos adversos que afectaron el hígado (25,4 vs. 10,6 %) fueron más comunes en el grupo de ribociclib con el IA no esteroideo que en el grupo del IA no esteroideo solo. Un total de 477 pacientes interrumpieron el tratamiento con ribociclib y 554 pacientes tuvieron que reducir la dosis. No hubo muertes relacionadas con el tratamiento.
- En el ensayo PALLAS (NCT02513394) se estudió el efecto de añadir palbociclib a la terapia adyuvante estándar en mujeres con cáncer de mama positivo para receptores hormonales negativo para HER2 en estadios II a III.[93] En este ensayo, 5760 mujeres que habían iniciado la terapia endocrina adyuvante en los últimos 6 meses se asignaron al azar en una proporción 1:1 sin enmascaramiento a recibir palbociclib y terapia endocrina o terapia endocrina sola. El criterio principal de valoración fue la SSEI.
- En el momento del segundo análisis interino, no se encontraron diferencias significativas entre los grupos de tratamiento (CRI, 0,93; IC 95 %, 0,76–1,15; tasas de SSEI a 3 años, 88,2 vs. 88,5 %; P = 0,51).[93][Nivel de evidencia B1] En el análisis final planificado se observaron resultados similares.[94]
- El comité de vigilancia de datos de inocuidad recomendó que se interrumpiera el palbociclib en las pacientes cuando el estadígrafo de contraste para futilidad superara el umbral preespecificado.
- La neutropenia y la leucopenia fueron mucho más comunes en las pacientes del grupo de palbociclib, y la fatiga fue un poco más frecuente. No hubo muertes relacionadas con el tratamiento.
Terapia de modificación ósea para el cáncer de mama en estadios I, II y III
Se evaluaron los bisfosfonatos y el denosumab como terapias adyuvantes para el cáncer de mama en estadio temprano; sin embargo, su función no está clara. En comparación con el denosumab, la cantidad de evidencia que respalda los bisfosfonatos es mayor, y hay evidencia que respalda una reducción en la mortalidad por cáncer de mama—un criterio con más relevancia clínica. No se ha determinado la duración óptima de la terapia con bisfosfonato.
Evidencia (bisfosfonatos para el tratamiento del cáncer de mama en estadio temprano):
- En un metanálisis se incluyó información de 18 766 pacientes que participaron en 26 ensayos adyuvantes con cualquier tipo de bisfosfonato.[95] En general, el uso de bisfosfonatos se relacionó con reducciones con significación estadística limítrofe para las recidivas en general (RR, 0,94; IC 95 %, 0,87–1,01; P bilateral = 0,08), las recidivas a distancia (RR, 0,92; IC 95 %, 0,85–0,99; P bilateral = 0,03) y la mortalidad por cáncer de mama (RR, 0,91; IC 95 %, 0,83–0,99; P bilateral = 0,04), mientras que la reducción de las recidivas óseas fue más clara (RR, 0,83; IC 95 %, 0,73–0,94; P bilateral = 0,004).
- En un análisis de subgrupos preespecificado de mujeres premenopáusicas, el tratamiento no tuvo un efecto aparente en ningún resultado, pero en 11 767 mujeres posmenopáusicas produjo reducciones muy significativas en las recidivas en general (RR, 0,86; IC 95 %, 0,78–0,94; P bilateral = 0,002), las recidivas a distancia (RR, 0,82; IC 95 %, 0,74–0,92; P bilateral = 0,0003), las recidivas óseas (RR, 0,72; IC 95 %, 0,60–0,86; P bilateral = 0,0002) y la mortalidad por cáncer de mama (RR, 0,82; IC 95 %, 0,73–0,93; P bilateral = 0,002).[95]
- En el ensayo ABCSG-18 (NCT00556374) participaron 3435 mujeres posmenopáusicas con cáncer de mama positivo para receptores hormonales que estaban recibiendo un IA. Las pacientes se asignaron al azar para recibir denosumab o un placebo cada 6 meses durante la terapia con un IA.[96] Se reveló el tratamiento de las pacientes cuando se notificaron los resultados relacionados con los episodios óseos y se permitió el cambio de las pacientes del grupo de placebo al grupo del fármaco activo.
- En un análisis por intención de tratar acorde con la asignación original, la SSE, un criterio secundario de valoración, mejoró en las pacientes que recibieron denosumab (tasa de SSE a 5 años, 89 vs. 87 %; CRI, 0,82; IC 95 %, 0,69–0,98; P = 0,0260).[96][Nivel de evidencia B1]
- La frecuencia de eventos adversos fue similar en los 2 grupos.
- En el ensayo D-CARE (NCT01077154) se asignaron al azar a 4509 mujeres con cáncer de mama en estadio II o III para recibir denosumab o placebo.[97]
- El criterio principal de valoración de la supervivencia sin metástasis ósea no fue significativamente diferente entre los grupos (mediana no alcanzada en ninguno de los grupos; CRI, 0,97; IC 95 %, 0,82−1,14; P = 0,70).[97][Nivel de evidencia B1]
- En el ensayo SUCCESS (NCT02181101) participaron 3421 pacientes de cáncer de mama con compromiso ganglionar o de riesgo alto (≥pT2, grado 3, negativo para receptores hormonales, o en mujeres de 35 años de edad o menos) sin compromiso ganglionar que habían completado la quimioterapia adyuvante. Las pacientes se asignaron al azar para recibir 4 mg de zoledronato intravenoso (IV) durante 2 años (cada 3 meses) o 5 años (cada 3 meses durante 2 años y luego cada 6 meses durante 3 años). Solo las pacientes que completaron el tratamiento con zoledronato durante 2 años (1447 en el grupo de 2 años; 1729 en el grupo de 5 años) se incluyeron en el análisis final. Los criterios principales de valoración del estudio fueron la SSE y la SG.[98]
- Los desenlaces fueron similares en ambos grupos para la SSE (CRI, 0,97; IC 95 %, 0,76–1,25; P = 0,83) y la SG (CRI, 0,93; IC 95 %, 0,65–1,34; P = 0,71).[98][Nivel de evidencia A1]
- Los resultados de este estudio no establecen con certeza por cuánto tiempo deben administrarse los bisfosfonatos según se explicó en el editorial adjunto.[99]
Inhibidores de PARP adyuvantes para pacientes con variantes germinales de los genes BRCA1 y BRCA2
La función de la inhibición de la poli-(ADP-ribosa)–polimerasa (PARP) como tratamiento adyuvante se evaluó en pacientes que presentaron cáncer de mama en una edad temprana y variantes patogénicas germinales de los genes BRCA1 o BRCA2. El BRCA1 y el BRCA2 son genes supresores de tumores que codifican proteínas que participan en la reparación del DNA (vía de reparación por recombinación homóloga). La PARP cumple una función importante en la reparación del DNA.
Evidencia (olaparib):
- En el ensayo OlympiA (NCT02032823) se asignaron al azar a 1836 pacientes con cáncer de mama negativo para HER2 y variantes patogénicas germinales de los genes BRCA1 o BRCA2 para recibir olaparib adyuvante durante 1 año (300 mg 2 veces al día) o placebo. Todas las mujeres completaron el tratamiento mediante cirugía y quimioterapia o radioterapia neoadyuvante o adyuvante. El riesgo más alto de recidiva de las pacientes se determinó según el tamaño del tumor, el compromiso ganglionar o la presencia de cáncer residual después de la terapia neoadyuvante.[100]
Criterios de selección de las pacientes sometidas a cirugía inicial y tratadas con quimioterapia adyuvante
- Pacientes con cáncer de mama triple negativo (TNBC) que tenían enfermedad con compromiso ganglionar axilar (≥pN1, cualquier tamaño del tumor) O enfermedad sin compromiso ganglionar axilar y un tumor primario invasivo de tamaño superior a 2 cm (pN0, ≥pT2).
- Pacientes con resultado positivo para ER o PR y negativo para HER que tuvieran compromiso en al menos 4 ganglios linfáticos confirmados mediante pruebas anatomopatológicas.
Criterios de selección de las pacientes tratadas con quimioterapia neoadyuvante seguida de cirugía
- Pacientes con TNBC que tenían un cáncer invasivo residual en la mama o los ganglios linfáticos resecados (es decir, ausencia de RPC).
- Pacientes con resultado positivo para ER o PR y negativo para HER2 que tuvieran un cáncer invasivo residual en la mama o los ganglios linfáticos resecados CPS+EG (estadio Clínico/eStadio Patológico +estado de ER/Grado nuclear) de 3 o más.[101]
El criterio principal de valoración del estudio fue la supervivencia sin enfermedad invasiva (SSEI).[100][Nivel de evidencia B1]
- En el momento del primer (y único) análisis interino planificado, cuando se presentaron 284 episodios (es decir, enfermedad invasiva o muerte), el CRI para la SSEI favoreció mucho al grupo de olaparib y excedió el umbral de significación preespecificada para la interrupción (tasa de SSEI a 3 años, 85,9 vs 77,1 %; CRI, 0,58; IC 99,5 %, 0,41–0,82; P < 0,001).[100][Nivel de evidencia B1]
- La SSE a distancia también tuvo una mejora estadísticamente significativa en las pacientes que recibieron olaparib (CRI 0,57; IC 99,5 %, 0,39–0,83; P < 0,001).
- Asimismo, se observó una diferencia en la SG (CRI, 0,68; IC 99 %, 0,44–1,05; P = 0,02), pero no alcanzó el nivel de significación preespecificado cuando se corrigió por pruebas múltiples (P < 0,01).
- Los eventos adversos de grado 3 o superior que se presentaron en más del 1 % de las pacientes del grupo de olaparib incluyeron anemia (8,7 %), disminución del recuento de neutrófilos (4,8 %), disminución del recuento de glóbulos blancos (3,0 %), fatiga (1,8 %) y linfopenia (1,2 %). No se presentaron efectos adversos de grado 3 o superior en más del 1 % de las pacientes en el grupo de placebo.
- Los resultados informados por las pacientes se evaluaron entre los 1538 participantes que completaron un cuestionario inicial y al menos un cuestionario posterior.[102]
- Las pacientes que recibieron olaparib presentaron más fatiga que las pacientes que recibieron placebo y esta diferencia fue estadísticamente significativa, pero las diferencias no cumplieron con los criterios de significación clínica. La fatiga se resolvió con el tiempo una vez que se suspendió el tratamiento.
- Las pacientes que recibieron olaparib tuvieron aumentos pequeños pero estadísticamente y clínicamente significativos en los puntajes de náuseas, vómitos y pérdida de apetito durante el tratamiento.[102][Nivel de evidencia A3]
Cáncer de mama triple negativo en estadios I, II y III
El cáncer de mama triple negativo (TNBC) se define por la ausencia de tinción de ER, PR y HER2. El TNBC es insensible a algunas de las terapias más eficaces para pacientes con cáncer de mama, incluso la terapia dirigida a HER2 como los regímenes con trastuzumab y las terapias endocrinas como aquellas con tamoxifeno o IA.
Terapia preoperatoria para el cáncer de mama triple negativo
Las pacientes con TNBC a menudo reciben terapia sistémica preoperatoria.
Quimioterapia
Se han observado resultados prometedores con la adición de carboplatino a los regímenes de quimioterapia combinada de antraciclinas y taxanos en pacientes con TNBC.
Evidencia (adición de carboplatino a un régimen de quimioterapia a base de antraciclinas y taxanos para pacientes con TNBC):
- En el estudio GeparSixto (NCT01426880), se añadió carboplatino al tratamiento de base con antraciclinas y taxanos.[103][Nivel de evidencia B3]
- En pacientes con TNBC, se observaron tasas más altas de RPC con la adición de carboplatino al tratamiento de base con antraciclinas y taxanos en comparación con la administración del régimen de antraciclinas y taxanos solo (36,9 vs. 53,2 %; P = 0,005).
- Las pacientes con variantes de BRCA1 o BRCA2 tuvieron una tasa más alta de RPC que no aumentó con la adición de carboplatino (66,7 % en el grupo que no recibió derivados del platino vs. 65,7 % en el grupo que recibió derivados del platino).
- La tasa de SSE a 3 años fue más alta en las pacientes con TNBC asignadas al azar al grupo de carboplatino (86,1 vs. 75,8 %; CRI, 0,56; IC 95 %, 0,34−0,93), pero no hubo diferencias en la SG.[104]
- El régimen más intensivo también se relacionó con aumento de toxicidad e interrupciones del tratamiento (39 vs. 48 %).
- En el ensayo CALGB 40603 (NCT00861705) se comparó la administración del tratamiento de base con antraciclinas y taxanos solo, con el tratamiento de base con antraciclinas y taxanos combinado con carboplatino en pacientes con TNBC en estadios II y III.[105][Nivel de evidencia B3]
- La tasa de RPC en la mama y la axila fue del 54 % para el grupo que recibió el tratamiento de base con antraciclinas y taxanos combinado con carboplatino versus el 41 % para el grupo que recibió el tratamiento de base solo (P = 0,0029).
Inmunoterapia
Evidencia (adición de pembrolizumab al régimen de quimioterapia en pacientes con TNBC en estadio II o III):
- En el ensayo aleatorizado con enmascaramiento doble de fase III, KEYNOTE-522 (NCT03036488) se evaluó la adición de la inmunoterapia a la quimioterapia neoadyuvante en las pacientes con TNBC en estadios II y III.[106][Nivel de evidencia B1] Las participantes se asignaron al azar en una proporción 2:1 para recibir quimioterapia neoadyuvante (paclitaxel y carboplatino, seguida de doxorrubicina y ciclofosfamida) con pembrolizumab neoadyuvante y adyuvante o placebo neoadyuvante y adyuvante. Los criterios coprimarios de valoración fueron la tasa de RPC y la SSC. La tasa de RPC, según se reportó durante el primer análisis interino en las primeras 602 participantes (grupo de pembrolizumab, n = 401; grupo de placebo, n = 201), favoreció al grupo de pembrolizumab.
- Se observó una RPC en el 64,8 % de las pacientes del grupo de pembrolizumab y en el 51,2 % de las pacientes del grupo de placebo (diferencia del tratamiento estimada 13,6 %; IC 95 %, 5,4−21,8 %; P < 0,001). Cerca del 80 % de los tumores fueron positivos para el ligando de muerte celular programada 1 (PD-L1), pero se observaron beneficios del pembrolizumab en la RPC sin importar el estado de PD-L1.
- En el momento del cuarto análisis interino, cuando la mediana de seguimiento fue de 39 meses, se observó una mejora en la SSC de las pacientes que recibieron pembrolizumab. La tasa de SSC a 36 meses fue del 84,5 % en las pacientes que recibieron pembrolizumab y del 76,8 % en las que recibieron placebo (CRI, 0,63; IC 95 %, 0,48–0,82; P < 0,001).[107][Nivel de evidencia B1]
- Los datos de SSC son preliminares.
- Se presentaron eventos adversos de grado 3 o superior en el 76,8 % de las participantes del grupo de pembrolizumab y en el 72,2 % de las del grupo de placebo. Se presentaron eventos adversos graves relacionados con el tratamiento en el 32,5 % de las participantes del grupo de pembrolizumab y en el 19,5 % de las del grupo de placebo. En el grupo de pembrolizumab, se presentó con mayor frecuencia exantemas, reacciones a la infusión e insuficiencia suprarrenal de grado 3 o superior.
Terapia posoperatoria para el cáncer de mama triple negativo
Por lo habitual, se administra quimioterapia combinada en el entorno adyuvante a las pacientes que se someten a cirugía primero. Aunque no hay un tratamiento de referencia establecido en este entorno, en el siguiente ensayo se proporciona evidencia de que un régimen sin antraciclinas puede ser apropiado:
Evidencia (regímenes adyuvantes sin antraciclinas):
- En el ensayo PATTERN (NCT01216111) se comparó un régimen que incluía antraciclinas (ciclofosfamida, 5-FU, epirrubicina y docetaxel [CEF-T]) con uno de paclitaxel y carboplatino (PCb) en 647 mujeres de la China con TNBC sometidas a cirugía definitiva previa. El criterio principal de valoración fue la SSE.[108]
- Al cabo de una mediana de seguimiento de 62 meses, la tasa de SSE a 5 años fue del 86,5 % en las pacientes que recibieron PCb y del 80,3 % en las pacientes que recibieron CEF-T (CRI, 0,65; IC 95 %, 0,44–0,96; P = 0,03).[108][Nivel de evidencia B1]
- Entre los grupos, no hubo diferencia estadísticamente significativa en la SG (CRI, 0,71; IC 95 %, 0,42-1,22; P = 0,22).
Terapia con capecitabina
La terapia con capecitabina aumentó la SSE cuando se administró después de la terapia adyuvante convencional.
Evidencia (terapia con capecitabina para pacientes que no habían recibido terapia sistémica preoperatoria):
- En el ensayo SYSUCC-001 (NCT01112826) se incluyeron 443 mujeres (434 analizadas) con TNBC de 13 instituciones de la China. Las mujeres habían recibido quimioterapia adyuvante y se asignaron al azar a no recibir terapia adicional o a recibir capecitabina en dosis de 650 mg/m2 2 veces al día durante 1 año. El criterio principal de valoración del estudio fue la SSE.[109]
- Después de una mediana de seguimiento de 61 meses, la tasa de SSE a 5 años fue del 82,5 % en las pacientes que recibieron terapia de mantenimiento con capecitabina en comparación con el 73,0 % en las que no recibieron terapia adicional (CRI, 0,64; IC 95 %, 0,42–0,95; P = 0,03).[109][Nivel de evidencia B1]
- El 45 % de las pacientes que recibieron capecitabina presentaron eritrodisestesia palmoplantar, que en el 7,7 % de estas pacientes fue de grado 3.
- La tasa de pacientes que completaron 1 año de terapia fue del 82,8 %.
Evidencia (terapia con capecitabina para pacientes que habían recibido terapia sistémica preoperatoria):
- En un estudio realizado en Japón y Corea, 910 mujeres con cánceres de mama negativos para HER2 se asignaron al azar y sin enmascaramiento a recibir 6 a 8 ciclos de 3 semanas de capecitabina o a no recibir más quimioterapia. Las pacientes tenían enfermedad residual después de la quimioterapia preoperatoria con antraciclinas, taxanos o ambos, y el 30 % de ella también tenían enfermedad negativa para receptores hormonales. El criterio principal de valoración fue la SSE.[110] El estudio se interrumpió debido a los resultados de un análisis interino planificado y se hizo el análisis final en ese momento.
- En el análisis final, en el que participaron 887 pacientes aptas, la tasa de SSE a 5 años fue del 74 % en el grupo de capecitabina y del 67 % en el grupo que no recibió más quimioterapia (CRI, 0,70; IC 95 %, 0,53–0,92; P = 0,01).[Nivel de evidencia B1]
- La SG fue un criterio secundario de valoración. La tasa de SG a5 años fue del 89,2 % en el grupo de capecitabina y del 83,6 % en el grupo que no recibió más quimioterapia (CRI, 0,59; IC 95 %, 0,39–0,90; P = 0,01).
- En un análisis de subconjuntos, la SG se prolongó de manera significativa solo en las pacientes con enfermedad negativa para receptores hormonales. Entre estas pacientes, la tasa de SG a 5 años fue del 78,8 % en el grupo de capecitabina y del 70,3 % en el grupo que no recibió más quimioterapia (CRI, 0,52; IC 95 %, 0,30–0,90).
- En el grupo de capecitabina, el 73,4 % de las pacientes presentaron eritrodisestesia palmoplantar de distinta intensidad.
Estos abordajes se deben considerar para las pacientes con enfermedad residual después de la terapia preoperatoria. Las pacientes también pueden considerar la participación en ensayos clínicos de terapias nuevas. Los ensayos clínicos para esta población de pacientes incluyeron el EA1131 (NCT02445391), un ensayo clínico de fase III en el que se asignó al azar a pacientes con TNBC de tipo basal residual después de la terapia preoperatoria para recibir quimioterapia a base de platino o capecitabina, y el S1418/BR006 (NCT02954874), un ensayo de fase III en el que se evaluó la eficacia del pembrolizumab como terapia adyuvante para pacientes con TNBC residual (cáncer invasivo ≥1 cm o ganglios con enfermedad residual) después de la terapia preoperatoria. Para obtener más información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
Inmunoterapia
En un ensayo que ya se completó, no se observó beneficio cuando se añadió atezolizumab a la quimioterapia posoperatoria.
Evidencia (atezolizumab posoperatorio):
- En el ensayo ALEXANDRA/IMpassion030 (NCT03498716), 2199 mujeres que no recibieron terapia sistémica preoperatoria se asignaron de manera aleatoria a recibir quimioterapia con atezolizumab o sin este después de la cirugía. El régimen de quimioterapia incluyó paclitaxel y ciclofosfamida con doxorrubicina o epirrubicina. El criterio principal de valoración fue la SSEI. El comité de vigilancia de datos e inocuidad del estudio decidió suspender la inscripción de pacientes de manera prematura debido a resultados intrascendentes.[111]
- En el análisis final no se demostró un beneficio en la SSEI cuando se añadió atezolizumab (CRI, 1,11; IC 95 %, 0,87–1,42; P = 0,38)[111][Nivel de evidencia B1]
Cáncer de mama positivo para HER2 en estadios I, II y III
Las pacientes con cáncer de mama positivo para HER2 que también es positivo para receptores hormonales reciben terapia hormonal como se describe en la sección Cáncer de mama positivo para receptores hormonales negativo para HER2 en estadios I, II y III.
Terapia preoperatoria para el cáncer de mama positivo para HER2
Tras el éxito en el entorno de tratamiento adyuvante, los informes iniciales de los estudios de fase II indicaron mejoras en las tasas de RPC cuando se añadió trastuzumab (anticuerpo monoclonal que se une al dominio extracelular de HER2) a los regímenes preoperatorios con antraciclinas y taxanos.[112][Nivel de evidencia B3] Esto se confirmó en estudios de fase III.[113,114]
Trastuzumab
Evidencia (trastuzumab):
- En el estudio aleatorizado de fase III NeOAdjuvant Herceptin (NOHA), se asignó al azar a pacientes con cáncer de mama positivo para HER2, localmente avanzado o inflamatorio, a recibir quimioterapia preoperatoria y 1 año de terapia con trastuzumab o sin esta.[114][Nivel de evidencia A1]
- En los resultados del estudio se confirmó que la adición de trastuzumab a la quimioterapia preoperatoria produjo, no solo una mejora de las respuestas clínicas (87 vs. 74 %) y de las respuestas patológicas (mama y axila, 38 vs. 19 %), sino también de la SSC, el criterio principal de valoración.[114][Nivel de evidencia A1]
- Después de una mediana de seguimiento de 5,4 años, el beneficio para la SSC fue del 58 % con la adición de trastuzumab a la quimioterapia (IC 95 %, 48–66 %) y del 43 % (IC 95 %, 34–52 %) en las pacientes del grupo de quimioterapia sola. El CRI no ajustado de la SSC entre los 2 grupos aleatorizados de tratamiento para el cáncer de mama positivo para HER2 fue de 0,64 (IC 95 %, 0,44–0,93; P bilateral del orden logarítmico = 0,016). La SSC se relacionó en gran medida con la RPC en las pacientes que recibieron trastuzumab.[115]
- Se presentó insuficiencia cardíaca sintomática en 2 pacientes que recibieron doxorrubicina y trastuzumab simultáneos durante 2 ciclos. El número relativamente bajo de disminuciones de la fracción de eyección del ventrículo izquierdo (FEVI) y la presencia de solo 2 episodios cardíacos se explicaron por una vigilancia cuidadosa de la FEVI y una dosis total de doxorrubicina que no excedió los 180 mg/m2. Para obtener más información, consultar la sección Efectos cardiotóxicos del trastuzumab adyuvante.[114][Nivel de evidencia B1]
- Debido a la preocupación por la administración conjunta de trastuzumab y antraciclinas, en un ensayo de fase III (Z1041 [NCT00513292]), se asignó al azar a pacientes con cáncer de mama positivo para HER2 operable a recibir trastuzumab secuencial o simultáneo con el componente de antraciclina (5-FU, epirrubicina y ciclofosfamida [FEC]) del régimen de quimioterapia preoperatoria.[116][Nivel de evidencia B3]
- El criterio principal de valoración fue la RPC. No hubo una diferencia significativa en la tasa de RPC mamaria entre los grupos (56,5 % en el grupo secuencial, 54,2 % en el grupo simultáneo; diferencia de 2,3 %, IC 95 %, -9,3 a 13,9).
- Se identificaron disminuciones asintomáticas de la FEVI durante la quimioterapia preoperatoria en proporciones similares de pacientes en cada grupo.
- La SSE y la SG fueron los criterios secundarios de valoración. Después de una mediana de seguimiento de 5,1 años, no hubo diferencia en la SSE (CRI, 1,02; IC 95 %, 0,56−1,83; P = 0,96) ni en la SG (CRI, 1,17; IC 95 %, 0,48−2,88; P = 0,73) entre los grupos de tratamiento secuencial y simultáneo.[117]
- A partir de estos hallazgos, no se justifica la administración simultánea de trastuzumab con antraciclinas.
También se aprobó una formulación subcutánea (SC) de trastuzumab.
En el ensayo SafeHer (NCT01566721) se evaluó la inocuidad y tolerabilidad del trastuzumab SC autoadministrado versus administrado por un profesional clínico en pacientes con cáncer de mama positivo para HER2 en estadios I a III.[118] La quimioterapia se administró de forma simultánea o secuencial.
En un ensayo de fase III (Hannah [NCT00950300]) también se demostró que el comportamiento farmacocinético y la eficacia del trastuzumab SC no son inferiores a la formulación IV. En este ensayo internacional sin enmascaramiento (n = 596), se asignó al azar a mujeres con cáncer de mama localmente avanzado y operable, o cáncer de mama inflamatorio y positivo para HER2 para recibir quimioterapia preoperatoria (a base de antraciclinas y taxanos), con trastuzumab SC o IV cada 3 semanas antes de la cirugía. Las pacientes recibieron trastuzumab adyuvante hasta completar 1 año de tratamiento.[119][Nivel de evidencia B1] La diferencia entre las tasas de RPC de ambos grupos fue de un 4,7 % (IC 95 %, 4,0–13,4 %); del 40,7 % en el grupo de administración IV versus el 45,4 % en el grupo de administración SC, lo que demostró que la ausencia de inferioridad de la formulación SC. La SSC y la SG fueron criterios secundarios de valoración. La SSC a 6 años fue del 65 % en ambos grupos (CRI, 0,98; IC 95 %, 0,74–1,29). La tasa de SG a 6 años fue del 84 % en ambos grupos (CRI, 0,94; IC 95 %, 0,61−1,45).[120]
También se encuentran en investigación terapias más nuevas dirigidas a HER2 (lapatinib, pertuzumab). Al parecer, un abordaje bidirigido al receptor HER2 aumenta la tasa de RPC. Sin embargo, hasta la fecha no se ha demostrado ninguna ventaja de supervivencia con este abordaje.[121,122]
Pertuzumab
El pertuzumab es un anticuerpo monoclonal humanizado que se une a un epítopo específico en el dominio extracelular del receptor HER2 e inhibe su dimerización. El pertuzumab en combinación con trastuzumab, con quimioterapia o sin esta, se evaluó en 2 ensayos clínicos preoperatorios cuyo objetivo era mejorar las tasas de RPC observadas con trastuzumab y quimioterapia.
Evidencia (pertuzumab):
- En el ensayo aleatorizado sin enmascaramiento de fase II NeoSPHERE (NCT00545688),[121] se asignó al azar a 417 mujeres con tumores de más de 2 cm o compromiso ganglionar, que tenían cáncer de mama positivo para HER2, a 1 de 4 regímenes preoperatorios:[121][Nivel de evidencia B3]
- Docetaxel y trastuzumab.
- Docetaxel, trastuzumab y pertuzumab.
- Pertuzumab y trastuzumab.
- Docetaxel y pertuzumab.
Se observaron los siguientes resultados:
- Las tasas de RPC fueron del 29 % para docetaxel y trastuzumab, del 46 % para docetaxel, trastuzumab y pertuzumab, del 17 % para pertuzumab y trastuzumab y del 24 % para docetaxel y pertuzumab. Por lo tanto, la tasa más alta de RPC se observó en el grupo de tratamiento preoperatorio con bloqueo dual de HER2 y quimioterapia.
- La adición de pertuzumab a la combinación de docetaxel y trastuzumab no aumentó los efectos tóxicos, como el riesgo de episodios cardíacos adversos.
- Las tasas de SSP y SSE no mejoraron pese a que se observó una tasa alta de RPC con el bloqueo dual de HER2 y quimioterapia; sin embargo el ensayo NeoSPHERE no tuvo una potencia estadística suficiente como para detectar diferencias a largo plazo en los resultados de eficacia.[123]
- En el ensayo aleatorizado sin enmascaramiento de fase II TRYPHAENA (NCT00976989) se buscó evaluar la tolerabilidad y la actividad del trastuzumab y el pertuzumab.[124][Nivel de evidencia B3] Se asignó al azar a 225 mujeres con tumores de más de 2 cm o compromiso ganglionar, que tenían cáncer de mama localmente avanzado, operable o inflamatorio y positivo para HER2, a 1 de 3 regímenes preoperatorios:
- FEC, trastuzumab y pertuzumab simultáneos (×3) seguido de docetaxel, trastuzumab y pertuzumab simultáneos.
- FEC solo (×3) seguido de docetaxel, trastuzumab y pertuzumab (×3) simultáneos.
- Docetaxel y carboplatino simultáneos con trastuzumab y pertuzumab (×6).
Se observaron los siguientes resultados:
- La tasa de RPC fue equivalente en los 3 grupos de tratamiento: (62 % para FEC, trastuzumab y pertuzumab simultáneos seguido de docetaxel, trastuzumab y pertuzumab simultáneos; 57 % para FEC solo seguido de docetaxel, trastuzumab y pertuzumab simultáneos; y 66 % para docetaxel y carboplatino simultáneos con trastuzumab y pertuzumab).
- En los 3 grupos la incidencia de episodios cardíacos adversos fue baja, del 5 % o menos.
Debido a los resultados en estos estudios, la FDA otorgó una aprobación acelerada para el pertuzumab como parte del tratamiento preoperatorio de mujeres con cáncer de mama positivo para HER2 en estadio temprano que tienen tumores de más de 2 cm o compromiso ganglionar.
La aprobación inicial del pertuzumab por la FDA se convirtió más tarde en aprobación regular después de los resultados del ensayo confirmatorio APHINITY (NCT01358877), un estudio aleatorizado adyuvante de fase III para mujeres con cáncer de mama positivo para HER2. En los resultados del estudio se demostró una mejora de la SSEI con la combinación de quimioterapia y terapia dual dirigida a HER2 con pertuzumab y trastuzumab, en comparación con quimioterapia y trastuzumab solo.[125] En la actualidad, el pertuzumab está aprobado para usarse en combinación con trastuzumab y quimioterapia como terapia neoadyuvante del cáncer de mama localmente avanzado e inflamatorio o positivo para HER2 en estadio temprano, con tumores que miden más de 2 cm o compromiso ganglionar. Esta terapia hace parte de un régimen de tratamiento completo y combinado con quimioterapia y trastuzumab como tratamiento adyuvante para el cáncer de mama positivo para HER2 en estadio temprano con riesgo alto de recidiva.
En el ensayo multicéntrico aleatorizado sin enmascaramiento TRAIN-2 (NCT01996267) se evaluó la quimioterapia de base optima para usar con pertuzumab y trastuzumab neoadyuvantes en pacientes con cáncer de mama positivo para HER2 en estadios II a III (es decir, un régimen con antraciclinas o sin estas).[126,127][Nivel de evidencia B3] Un total de 438 pacientes se asignaron al azar para recibir uno de los siguientes regímenes:
- FEC cada 3 semanas durante 3 ciclos seguido de paclitaxel y carboplatino cada 3 semanas durante 6 ciclos. El paclitaxel se administró en los días 1 y 8 y el carboplatino solo en el día 1 o en los días 1 y 8. El trastuzumab y el pertuzumab se administraron cada 3 semanas a lo largo de la quimioterapia. No se administró la profilaxis principal con filgrastim durante la porción de terapia con FEC.
- El paclitaxel y el carboplatino se administraron según el mismo programa durante 9 ciclos. El trastuzumab y el pertuzumab se administraron cada 3 semanas a lo largo de la quimioterapia.
El criterio principal de valoración fue la RPC (ypT0/is, ypN0). Hay datos disponibles de los criterios secundarios de valoración de SSC, SG, toxicidad y conservación de la mama. Se observaron los siguientes resultados:
- No hubo diferencia estadísticamente significativa en la proporción de pacientes con RPC entre los grupos que recibieron antraciclinas (67 %) y que no las recibieron (68 %).
- No hubo diferencia en la proporción de pacientes sometidas a cirugía de conservación de la mama en cada grupo.
- Con independencia del estado ganglionar y de receptores hormonales, los cálculos de SSC a 3 años fueron del 92,7 % en el grupo que recibió antraciclinas y del 93,6 % en el grupo que no las recibió. Los cálculos de SG a 3 años fueron del 97,7 % en el grupo que recibió antraciclinas y del 98,2 % en el grupo que no las recibió.
- Una disminución de la FEVI del 10 % o más desde el inicio hasta menos del 50 % fue más común en las pacientes que recibieron antraciclinas que en las que no las recibieron (7,7 vs. 3,2 %; P = 0,04).
- Dos pacientes tratadas con antraciclinas presentaron leucemia aguda.
- No hubo diferencia en la proporción de pacientes con neuropatía periférica de al menos grado 2 en cada grupo : 66 pacientes (30 %) en el grupo que recibió antraciclinas versus 68 pacientes (31 %) en el grupo que no recibió antraciclinas.
- La neutropenia de grado 4 y la neutropenia febril fueron más comunes en el grupo que recibió antraciclinas (23 pacientes [10 %]) que en el grupo que no recibió antraciclinas (3 pacientes [1 %], P < 0,0001).
Terapia posoperatoria para el cáncer de mama positivo para HER2
Pacientes que no han recibido terapia sistémica preoperatoria.
El tratamiento estándar para el cáncer de mama positivo para HER2 en estadio temprano es 1 año de terapia adyuvante dirigida a HER2.
Trastuzumab
En varios ensayos clínicos de fase III se abordó la función del anticuerpo anti-HER2, trastuzumab, como terapia adyuvante para pacientes con cánceres que sobreexpresan HER2. En los resultados de los estudios se confirma el beneficio de la terapia adyuvante con trastuzumab administrada durante 1 año.
Evidencia (duración del tratamiento con trastuzumab para pacientes que no han recibido terapia sistémica preoperatoria):
- En el ensayo Herceptin Adjuvant (HERA) (BIG-01-01 [NCT00045032]), se examinó la eficacia del trastuzumab como tratamiento adyuvante para el cáncer de mama positivo para HER2 cuando se administra después de terminar el tratamiento primario. Para la mayoría de las pacientes, el tratamiento primario fue un régimen de quimioterapia con antraciclinas preoperatorio o posoperatorio, con radioterapia locorregional o sin esta. El trastuzumab se administró cada 3 semanas y se comenzó dentro de las primeras 7 semanas de completarse el tratamiento primario.[128][Nivel de evidencia A1] Las pacientes se asignaron al azar a uno de los tres grupos del estudio:
- Observación (n = 1693).
- Administración de trastuzumab durante 1 año (n = 1694).
- Administración de trastuzumab durante 2 años (n = 1694).
En el grupo de pacientes que recibió trastuzumab durante 1 año versus el grupo de observación, la mediana de edad fue de 49 años, alrededor del 33 % tenía enfermedad sin compromiso ganglionar y casi el 50 % tenía enfermedad negativa para receptores hormonales.[129]
Se observaron los siguientes resultados en las pacientes asignadas a 1 año de trastuzumab en comparación con las pacientes asignadas a observación:
- Al cabo de una mediana de seguimiento de 11 años,[129] el tratamiento con trastuzumab durante 1 año mejoró la SSE (tasa de SSE a 10 años, 72 vs. 66 %; CRI, 0,76; IC 95 %, 0,68–0,86; P < 0,0001), a pesar de que el 52 % de las pacientes en observación se cambiaron al otro grupo.
- También mejoró la SG (tasa de SG a 12 años, 79 vs. 73 %; CRI, 0,74; IC 95 %, 0,64–0,86; P < 0,0001).[129][Nivel de evidencia A1]
Se observaron los siguientes resultados en las pacientes asignados a 1 año de trastuzumab en comparación con aquellas asignadas a 2 años de trastuzumab:
- Al cabo de una mediana de seguimiento de 11 años, no se observó un beneficio sobre la SSE con la administración de trastuzumab durante 1 año más (CRI, 1,02; IC 95 %, 0,89–1,17).
Se presentaron episodios cardíacos sintomáticos en el 1 % de las pacientes que recibieron trastuzumab y en el 0,1 % de las del grupo de observación.
- En el análisis combinado del ensayo NSABP-B-31 (NCT00004067) y el ensayo intergrupal NCCTG-N9831 (NCT00005970), el trastuzumab se administró cada semana en forma simultánea o inmediatamente después del componente de paclitaxel del régimen AC con paclitaxel[130,131][Nivel de evidencia A1]
- Se confirmaron los resultados de HERA en un análisis conjunto de los 2 estudios, con una inscripción combinada de 3676 pacientes. Se observó una mejora estadísticamente significativa en la SSE (tasa de SSE a 3 años, 87 vs. 75 %; CRI, 0,48; P < 0,001), así como una mejora significativa en la SG (tasa de SG a 3 años, 94 % en el grupo de trastuzumab vs. 91 % en el grupo de control; tasa de SG a 4 años, 91 % en el grupo de trastuzumab vs. 86 % en el grupo de control; CRI, 0,67; P = 0,015).[130]
- Las pacientes tratadas con trastuzumab presentaron una SSE más prolongada, con un riesgo menor al 52 % de un episodio de SSE (CRI, 0,48; IC 95 %, 0,39–0,59; P < 0,001), que corresponde a una diferencia absoluta en la SSE del 11,8 % a los 3 años y de 18 % a los 4 años. En las pacientes que recibieron trastuzumab, el riesgo de recidiva a distancia fue un 53 % más bajo (CRI, 0,47; IC 95 %, 0,37–0,61; P < 0,001) y el riesgo de muerte fue un 33 % más bajo (CRI, 0,67; IC 95 %, 0,48–0,93; P = 0,015).[130]
- En un análisis actualizado, al cabo de una mediana de seguimiento de 8,4 años, la adición de trastuzumab a la quimioterapia condujo a una mejora relativa del 37 % en la SG (CRI, 0,63; IC 95 %, 0,54–0,73; P < 0,001) y un aumento en la tasa de SG a 10 años del 75,2 % al 84 %.[132]
- En el ensayo BCIRG-006 (NCT00021255), 3222 mujeres con cáncer de mama en estadio temprano y sobreexpresión de HER2, se asignaron al azar a recibir AC seguido de docetaxel (AC-T), AC seguido de docetaxel y trastuzumab (AC-T y trastuzumab) o docetaxel, carboplatino y trastuzumab (TCH, un régimen sin antraciclinas).[133][Nivel de evidencia A1]
- Se observó un beneficio significativo en la SSE y la SG en ambos grupos tratados con trastuzumab en comparación con el grupo de control que no recibió trastuzumab.
- En las pacientes que recibieron AC-T y trastuzumab, la tasa de SSE a 5 años fue del 84 % (CRI de la comparación con AC-T, 0,64; P < 0,001), y la tasa de SG fue del 92 % (CRI, 0,63; P < 0,001). En las pacientes que recibieron TCH, la tasa de SSE a 5 años fue del 81 % (CRI, 0,75; P = 0,04), y la tasa de SG fue del 91 % (CRI, 0,77; P = 0,04). El grupo de control tuvo una tasa de SSE del 75 % y una tasa de SG del 87 %.
- Los autores indicaron que no hubo diferencia significativa en la SSE o la SG entre los 2 regímenes que contenían trastuzumab. Sin embargo, el estudio no tuvo la potencia para detectar la equivalencia entre los 2 regímenes que contenían trastuzumab.
- Las tasas de insuficiencia cardíaca congestiva y disfunción cardíaca fueron significativamente más altas en el grupo que recibió AC-T y trastuzumab, que en el grupo que recibió TCH (P < 0,001).
- Estos hallazgos del ensayo plantean la pregunta de si se necesitan las antraciclinas como tratamiento adyuvante en el cáncer de mama con sobreexpresión de HER2. El grupo que recibió AC y trastuzumab mostró una ventaja pequeña, aunque sin significación estadística, en comparación con el grupo que recibió TCH.
- Este ensayo respalda el uso de TCH como régimen adyuvante alternativo para mujeres con cáncer de mama en estadio temprano con sobreexpresión de HER2, en especial, para quienes tienen riesgo de efectos cardiotóxicos.
- En el estudio Finland Herceptin (FINHER), se evaluó el efecto de un curso mucho más corto de trastuzumab. En este ensayo, 232 mujeres menores de 67 años que tenían cáncer de mama con compromiso ganglionar o cáncer de mama sin compromiso ganglionar con sobreexpresión de HER2 y de riesgo alto (tumor >2 cm) recibieron 9 infusiones semanales de trastuzumab de manera simultánea con docetaxel o vinorelbina seguidas de FEC.[134][Nivel de evidencia A1]
- Al cabo de una mediana de seguimiento a 3 años, el riesgo de recidiva o muerte se redujo significativamente en las pacientes que recibieron trastuzumab (tasa de SSE a 3 años, 89 vs. 78 %; CRI, 0,41; P = 0,01; IC 95 %, 0,21–0,83).
- La diferencia en la SG (CRI, 0,41) no fue estadísticamente significativa (P = 0,07; IC 95 %, 0,16–1,08).
- En varios estudios, se comparó la administración de trastuzumab por 6 meses con la administración por 12 meses.[135-137]
- En un análisis interino del ensayo PHARE (NCT00381901), la tasa de SSE a 2 años fue del 93,8 % (IC 95 %, 92,6–94,9 %) en el grupo de 12 meses y del 91,1 % (89,7–92,4 %) en el grupo de 6 meses (CRI, 1,28; IC 95 %, 1,05–1,56; ausencia de inferioridad, P = 0,29).[135][Nivel de evidencia A1]
- En el análisis final, después de que se observaran 704 episodios, el CRI ajustado fue de 1,08 (IC 95 %, 0,93–1,25) y no se excluyó el CRI de ausencia de inferioridad preespecificado de 1,15.
- Se observaron resultados similares en un estudio menos numeroso de 481 pacientes dirigido por el Hellenic Oncology Research Group.[136][Nivel de evidencia A1]
- En contraste, en el ensayo PERSEPHONE (NCT00712140), en el que se inscribieron 4088 pacientes que presentaron 512 episodios de SSE al momento del análisis, se excluyó el margen de ausencia de inferioridad preespecificado (CRI, 1,07; IC 90 %, 0,93−1,24; ausencia de inferioridad, P = 0,011).[137][Nivel de evidencia A1]
- En un análisis interino del ensayo PHARE (NCT00381901), la tasa de SSE a 2 años fue del 93,8 % (IC 95 %, 92,6–94,9 %) en el grupo de 12 meses y del 91,1 % (89,7–92,4 %) en el grupo de 6 meses (CRI, 1,28; IC 95 %, 1,05–1,56; ausencia de inferioridad, P = 0,29).[135][Nivel de evidencia A1]
- En el ensayo SOLD (NCT00593697), se comparó la administración de trastuzumab por 9 semanas con la administración por 1 año en 2174 mujeres con cáncer de mama positivo para HER2.[138]
- No fue posible demostrar la ausencia de inferioridad del tratamiento de 9 semanas para la SSE (CRI, 1,39; IC bilateral 90 %, 1,12−1,72).[138][Nivel de evidencia B1]
- En un metanálisis en el que se incluyeron estos ensayos se concluyó que, en relación con la SG, la administración durante 1 año de trastuzumab fue superior a la duración más corta del tratamiento, sin embargo, no hubo un beneficio significativo del tratamiento por 1 año en las pacientes con enfermedad de riesgo bajo.[139][Nivel de evidencia A1]
En varios estudios, se evaluó el uso de trastuzumab SC en los entornos neoadyuvante y adyuvante.
Pertuzumab
El pertuzumab es un anticuerpo monoclonal humanizado que se une a un epítopo específico en el dominio extracelular del receptor HER2 e inhibe su dimerización. En un ensayo aleatorizado, se evaluó su uso en combinación con el trastuzumab en el entorno posoperatorio.
Evidencia (pertuzumab):
- En el ensayo Breast Intergroup (BIG) participaron 4805 mujeres con cáncer positivo para HER2 en un estudio de comparación enmascarada. Las pacientes recibieron 12 meses de trastuzumab y un placebo versus 12 meses de trastuzumab y pertuzumab, administrados de manera simultánea con quimioterapia estándar y terapia hormonal. El criterio principal de valoración fue la SSEI.[125]
- En el momento del análisis definitivo, la tasa de SSEI a 3 años fue del 94,1 % en el grupo de trastuzumab con pertuzumab y del 93,2 % en el grupo de trastuzumab con placebo (CRI, 0,81; IC 95 %, 0,66–1,00; P = 0,045).
- En el primer análisis interino, no hubo diferencia estadísticamente significativa en la SG (criterio secundario de valoración). La misma observación se hizo en el tercer análisis interino.[140]
- Las pacientes que recibieron pertuzumab presentaron más diarrea de grado 3 (9,8 vs. 3,7 %) y fue más probable que presentaran insuficiencia cardíaca (0,6 vs. 0,2 %) que aquellos que recibieron placebo.
Trastuzumab emtansina
Evidencia (trastuzumab emtansina [T-DM1] para pacientes que recibieron terapia preoperatoria dirigida a HER2):
- En un ensayo de fase III (KATHERINE [NCT01772472]), 1486 mujeres con enfermedad positiva para HER2 que recibieron quimioterapia preoperatoria con taxanos (con una antraciclina o sin esta) acompañada de trastuzumab con otro fármaco dirigido a HER2 o sin este, pero que tenían enfermedad residual después de la cirugía, se asignaron al azar a recibir 14 ciclos de trastuzumab adyuvante o T-DM1. El criterio principal de valoración fue la SSEI.[141][Nivel de evidencia B1]
- En el momento del análisis interino planificado, la SSEI fue significativamente más alta en el grupo de T-DM1 que en el grupo de trastuzumab (CRIde enfermedad invasiva o muerte, 0,50; IC 95 %, 0,39–0,64; P < 0,001; SSEI a 3 años, 88,3 vs. 77 %).
- Los datos de SG son preliminares y no significativos (CRI, 0,70; IC 95 %, 0,47–1,05).
- En las pacientes que recibieron T-DM1 fue más probable la interrupción del tratamiento por un evento adverso (18 vs. 2,1 %) y fue más frecuente la neuropatía sensitiva (18,6 vs. 6,9 %); la mayoría de estos casos se habían resuelto en el momento del análisis.
- En un análisis de subgrupos, el beneficio de T-DM1 se observó en todos los subgrupos, incluso en las participantes que recibieron terapia dual dirigida a HER2 en el entorno preoperatorio.
Neratinib
El neratinib es un inhibidor irreversible de tirosina–cinasas de HER1, HER2 y HER4, que la FDA aprobó para la terapia adyuvante prolongada de pacientes con cáncer de mama positivo para HER2 en estadio temprano, y se administra después de la terapia con trastuzumab.
Evidencia (neratinib):
- En el ensayo ExteNET (NCT00878709), se investigó la inocuidad y la eficacia de la administración de neratinib adyuvante durante 12 meses a pacientes con cáncer de mama positivo para HER2 en estadio temprano (n = 2840) que terminaron la terapia neoadyuvante con trastuzumab durante los 2 años previos a la aleatorización. Las pacientes recibieron 240 mg diarios de neratinib oral o un placebo durante 1 año. El criterio principal de valoración fue la SSEI.[142][Nivel de evidencia A1]
- Después de una mediana de seguimiento de 5,2 años (intervalo intercuartílico, 2,1–5,3), las pacientes del grupo de neratinib presentaron significativamente menos episodios de SSEI en comparación con el grupo de placebo (grupo de neratinib, 116 episodios vs. grupo de placebo, 163 episodios; CRI estratificado, 0,73; IC 95 %, 0,57–0,92; P = 0,0083). La tasa de SSEI a 5 años fue del 90,2 % (IC 95 %, 88,3–91,8 %) en el grupo de neratinib y de 87,7 % (85,7–89,4 %) en el grupo de placebo.[143]
- Los datos de SG no son definitivos.
- Los efectos adversos más comunes de grado 1 o 2 fueron diarrea (neratinib, 55 % vs. placebo, 34 %), náuseas (41 vs. 21 %), fatiga (25 vs. 20 %), vómitos (23 vs. 8 %) y dolor abdominal (22 vs. 10 %). En la etiqueta aprobada por la FDA se recomienda la loperamida profiláctica durante los primeros 56 días de tratamiento, y según sea necesario después, para ayudar a controlar la diarrea.
- Los eventos adversos más comunes de grado 3 a 4 fueron diarrea (neratinib, 40 % vs. placebo 2 %). Todos los otros eventos adversos de grados 3 a 4 se presentaron en el 2 % o menos de las pacientes.
Cáncer de mama positivo para HER2, con tumores pequeños, sin compromiso ganglionar
No hay estudios en los que se comparen los diferentes regímenes para pacientes con tumores de mama positivos para HER2, pequeños, sin compromiso ganglionar. En los siguientes 2 estudios grandes de un solo grupo, se demostraron desenlaces superiores a los resultados anteriores en pacientes similares que no habían recibido terapia adyuvante.
Evidencia (regímenes combinados para los tumores positivos para HER2, pequeños, sin compromiso ganglionar):
- En el ensayo Adjuvant Paclitaxel and Trastuzumab (APT) de un solo grupo (NCT00542451), se evaluó un régimen sin antraciclinas, de paclitaxel y trastuzumab. Se inscribieron en el ensayo 410 mujeres con tumores positivos para HER2, pequeños (≤3 cm), sin compromiso ganglionar.[144]
- Después de 6,5 años de seguimiento, la tasa de SSE fue del 93 % (IC 95 %, 90,4–96,2 %).[144][Nivel de evidencia C2]
- La tasa de SSE a 10 años fue del 91,3 % (IC 95 %, 88,3–94,4 %).[145]
- En el ensayo ATEMP (NCT01853748) se comparó paclitaxel y trastuzumab con T-DM1 en pacientes con tumores positivos para HER2 sin compromiso ganglionar que medían 2 cm o menos (se aceptaron pacientes con micrometástasis en un solo ganglio linfático). Los objetivos del ensayo fueron determinar si T-DM1 producía menos efectos tóxicos clínicamente relevantes y si se relacionaba con una tasa de SSEI a 3 años aceptable. En el ensayo, 383 pacientes se asignaron al azar al grupo de T-DM1 y 114 pacientes al grupo de paclitaxel y trastuzumab.[146]
- Aunque los tipos de efectos tóxicos fueron diferentes en los 2 grupos de tratamiento, el número total de efectos tóxicos clínicamente relevantes fue casi igual (46 % en el grupo de T-DM1 vs. 47 % en el grupo de paclitaxel y trastuzumab; P = 0,83). Sin embargo, las pacientes que recibieron T-DM1 notificaron desenlaces más favorables durante el tratamiento.
- La tasa de SSEI a 3 años en las pacientes que recibieron T-DM1 fue del 97,8 % (IC 95 %, 96,3–99,3 %), que excedió la tasa del 95 % especificada en el protocolo para rechazar la hipótesis nula (P = 0,0001).[146][Nivel de evidencia C1] A los 5 años los resultados fueron similares.[147]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Korde LA, Somerfield MR, Carey LA, et al.: Neoadjuvant Chemotherapy, Endocrine Therapy, and Targeted Therapy for Breast Cancer: ASCO Guideline. J Clin Oncol 39 (13): 1485-1505, 2021. [PUBMED Abstract]
- Mauri D, Pavlidis N, Ioannidis JP: Neoadjuvant versus adjuvant systemic treatment in breast cancer: a meta-analysis. J Natl Cancer Inst 97 (3): 188-94, 2005. [PUBMED Abstract]
- Early Breast Cancer Trialists' Collaborative Group (EBCTCG): Long-term outcomes for neoadjuvant versus adjuvant chemotherapy in early breast cancer: meta-analysis of individual patient data from ten randomised trials. Lancet Oncol 19 (1): 27-39, 2018. [PUBMED Abstract]
- Cortazar P, Zhang L, Untch M, et al.: Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet 384 (9938): 164-72, 2014. [PUBMED Abstract]
- Yau C, Osdoit M, van der Noordaa M, et al.: Residual cancer burden after neoadjuvant chemotherapy and long-term survival outcomes in breast cancer: a multicentre pooled analysis of 5161 patients. Lancet Oncol 23 (1): 149-160, 2022. [PUBMED Abstract]
- Carlson RW, Allred DC, Anderson BO, et al.: Breast cancer. Clinical practice guidelines in oncology. J Natl Compr Canc Netw 7 (2): 122-92, 2009. [PUBMED Abstract]
- Lyman GH, Temin S, Edge SB, et al.: Sentinel lymph node biopsy for patients with early-stage breast cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol 32 (13): 1365-83, 2014. [PUBMED Abstract]
- Boughey JC, Suman VJ, Mittendorf EA, et al.: Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. JAMA 310 (14): 1455-61, 2013. [PUBMED Abstract]
- Kuehn T, Bauerfeind I, Fehm T, et al.: Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort study. Lancet Oncol 14 (7): 609-18, 2013. [PUBMED Abstract]
- Alvarado R, Yi M, Le-Petross H, et al.: The role for sentinel lymph node dissection after neoadjuvant chemotherapy in patients who present with node-positive breast cancer. Ann Surg Oncol 19 (10): 3177-84, 2012. [PUBMED Abstract]
- Smith IC, Heys SD, Hutcheon AW, et al.: Neoadjuvant chemotherapy in breast cancer: significantly enhanced response with docetaxel. J Clin Oncol 20 (6): 1456-66, 2002. [PUBMED Abstract]
- von Minckwitz G, Kümmel S, Vogel P, et al.: Intensified neoadjuvant chemotherapy in early-responding breast cancer: phase III randomized GeparTrio study. J Natl Cancer Inst 100 (8): 552-62, 2008. [PUBMED Abstract]
- Bear HD, Anderson S, Brown A, et al.: The effect on tumor response of adding sequential preoperative docetaxel to preoperative doxorubicin and cyclophosphamide: preliminary results from National Surgical Adjuvant Breast and Bowel Project Protocol B-27. J Clin Oncol 21 (22): 4165-74, 2003. [PUBMED Abstract]
- Vriens BE, Aarts MJ, de Vries B, et al.: Doxorubicin/cyclophosphamide with concurrent versus sequential docetaxel as neoadjuvant treatment in patients with breast cancer. Eur J Cancer 49 (15): 3102-10, 2013. [PUBMED Abstract]
- Untch M, Jackisch C, Schneeweiss A, et al.: Nab-paclitaxel versus solvent-based paclitaxel in neoadjuvant chemotherapy for early breast cancer (GeparSepto-GBG 69): a randomised, phase 3 trial. Lancet Oncol 17 (3): 345-56, 2016. [PUBMED Abstract]
- Gianni L, Mansutti M, Anton A, et al.: Comparing Neoadjuvant Nab-paclitaxel vs Paclitaxel Both Followed by Anthracycline Regimens in Women With ERBB2/HER2-Negative Breast Cancer-The Evaluating Treatment With Neoadjuvant Abraxane (ETNA) Trial: A Randomized Phase 3 Clinical Trial. JAMA Oncol 4 (3): 302-308, 2018. [PUBMED Abstract]
- von Minckwitz G, Rezai M, Loibl S, et al.: Capecitabine in addition to anthracycline- and taxane-based neoadjuvant treatment in patients with primary breast cancer: phase III GeparQuattro study. J Clin Oncol 28 (12): 2015-23, 2010. [PUBMED Abstract]
- Eiermann W, Paepke S, Appfelstaedt J, et al.: Preoperative treatment of postmenopausal breast cancer patients with letrozole: A randomized double-blind multicenter study. Ann Oncol 12 (11): 1527-32, 2001. [PUBMED Abstract]
- Preece PE, Wood RA, Mackie CR, et al.: Tamoxifen as initial sole treatment of localised breast cancer in elderly women: a pilot study. Br Med J (Clin Res Ed) 284 (6319): 869-70, 1982. [PUBMED Abstract]
- Smith IE, Dowsett M, Ebbs SR, et al.: Neoadjuvant treatment of postmenopausal breast cancer with anastrozole, tamoxifen, or both in combination: the Immediate Preoperative Anastrozole, Tamoxifen, or Combined with Tamoxifen (IMPACT) multicenter double-blind randomized trial. J Clin Oncol 23 (22): 5108-16, 2005. [PUBMED Abstract]
- Early Breast Cancer Trialists' Collaborative Group (EBCTCG): Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet 365 (9472): 1687-717, 2005. [PUBMED Abstract]
- De Laurentiis M, Cancello G, D'Agostino D, et al.: Taxane-based combinations as adjuvant chemotherapy of early breast cancer: a meta-analysis of randomized trials. J Clin Oncol 26 (1): 44-53, 2008. [PUBMED Abstract]
- Henderson IC, Berry DA, Demetri GD, et al.: Improved outcomes from adding sequential Paclitaxel but not from escalating Doxorubicin dose in an adjuvant chemotherapy regimen for patients with node-positive primary breast cancer. J Clin Oncol 21 (6): 976-83, 2003. [PUBMED Abstract]
- Mamounas EP, Bryant J, Lembersky B, et al.: Paclitaxel after doxorubicin plus cyclophosphamide as adjuvant chemotherapy for node-positive breast cancer: results from NSABP B-28. J Clin Oncol 23 (16): 3686-96, 2005. [PUBMED Abstract]
- Martin M, Pienkowski T, Mackey J, et al.: Adjuvant docetaxel for node-positive breast cancer. N Engl J Med 352 (22): 2302-13, 2005. [PUBMED Abstract]
- Perez EA: TAC--a new standard in adjuvant therapy for breast cancer? N Engl J Med 352 (22): 2346-8, 2005. [PUBMED Abstract]
- Sparano JA, Wang M, Martino S, et al.: Weekly paclitaxel in the adjuvant treatment of breast cancer. N Engl J Med 358 (16): 1663-71, 2008. [PUBMED Abstract]
- Citron ML, Berry DA, Cirrincione C, et al.: Randomized trial of dose-dense versus conventionally scheduled and sequential versus concurrent combination chemotherapy as postoperative adjuvant treatment of node-positive primary breast cancer: first report of Intergroup Trial C9741/Cancer and Leukemia Group B Trial 9741. J Clin Oncol 21 (8): 1431-9, 2003. [PUBMED Abstract]
- Hudis C, Citron M, Berry D, et al.: Five year follow-up of INT C9741: dose-dense (DD) chemotherapy (CRx) is safe and effective. [Abstract] Breast Cancer Research and Treatment 94 (Suppl 1): A-41, 2005.
- Citron ML, Berry DA, Cirrincione C, et al.: Dose-dense (DD) AC followed by paclitaxel is associated with moderate, frequent anemia compared to sequential (S) and/or less DD treatment: update by CALGB on Breast Cancer Intergroup Trial C9741 with ECOG, SWOG, & NCCTG. [Abstract] J Clin Oncol 23 (Suppl 16): A-620, 33s, 2005.
- Del Mastro L, De Placido S, Bruzzi P, et al.: Fluorouracil and dose-dense chemotherapy in adjuvant treatment of patients with early-stage breast cancer: an open-label, 2 × 2 factorial, randomised phase 3 trial. Lancet 385 (9980): 1863-72, 2015. [PUBMED Abstract]
- Early Breast Cancer Trialists' Collaborative Group (EBCTCG): Increasing the dose intensity of chemotherapy by more frequent administration or sequential scheduling: a patient-level meta-analysis of 37 298 women with early breast cancer in 26 randomised trials. Lancet 393 (10179): 1440-1452, 2019. [PUBMED Abstract]
- Blum JL, Flynn PJ, Yothers G, et al.: Anthracyclines in Early Breast Cancer: The ABC Trials-USOR 06-090, NSABP B-46-I/USOR 07132, and NSABP B-49 (NRG Oncology). J Clin Oncol 35 (23): 2647-2655, 2017. [PUBMED Abstract]
- Nitz U, Gluz O, Clemens M, et al.: West German Study PlanB Trial: Adjuvant Four Cycles of Epirubicin and Cyclophosphamide Plus Docetaxel Versus Six Cycles of Docetaxel and Cyclophosphamide in HER2-Negative Early Breast Cancer. J Clin Oncol 37 (10): 799-808, 2019. [PUBMED Abstract]
- Gagliato Dde M, Gonzalez-Angulo AM, Lei X, et al.: Clinical impact of delaying initiation of adjuvant chemotherapy in patients with breast cancer. J Clin Oncol 32 (8): 735-44, 2014. [PUBMED Abstract]
- Chavez-MacGregor M, Clarke CA, Lichtensztajn DY, et al.: Delayed Initiation of Adjuvant Chemotherapy Among Patients With Breast Cancer. JAMA Oncol 2 (3): 322-9, 2016. [PUBMED Abstract]
- Burstein HJ, Temin S, Anderson H, et al.: Adjuvant endocrine therapy for women with hormone receptor-positive breast cancer: american society of clinical oncology clinical practice guideline focused update. J Clin Oncol 32 (21): 2255-69, 2014. [PUBMED Abstract]
- Pan H, Gray R, Braybrooke J, et al.: 20-Year Risks of Breast-Cancer Recurrence after Stopping Endocrine Therapy at 5 Years. N Engl J Med 377 (19): 1836-1846, 2017. [PUBMED Abstract]
- Colleoni M, Gelber S, Goldhirsch A, et al.: Tamoxifen after adjuvant chemotherapy for premenopausal women with lymph node-positive breast cancer: International Breast Cancer Study Group Trial 13-93. J Clin Oncol 24 (9): 1332-41, 2006. [PUBMED Abstract]
- Fisher B, Dignam J, Bryant J, et al.: Five versus more than five years of tamoxifen for lymph node-negative breast cancer: updated findings from the National Surgical Adjuvant Breast and Bowel Project B-14 randomized trial. J Natl Cancer Inst 93 (9): 684-90, 2001. [PUBMED Abstract]
- Stewart HJ, Prescott RJ, Forrest AP: Scottish adjuvant tamoxifen trial: a randomized study updated to 15 years. J Natl Cancer Inst 93 (6): 456-62, 2001. [PUBMED Abstract]
- Tormey DC, Gray R, Falkson HC: Postchemotherapy adjuvant tamoxifen therapy beyond five years in patients with lymph node-positive breast cancer. Eastern Cooperative Oncology Group. J Natl Cancer Inst 88 (24): 1828-33, 1996. [PUBMED Abstract]
- Davies C, Pan H, Godwin J, et al.: Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor-positive breast cancer: ATLAS, a randomised trial. Lancet 381 (9869): 805-16, 2013. [PUBMED Abstract]
- Albain KS, Barlow WE, Ravdin PM, et al.: Adjuvant chemotherapy and timing of tamoxifen in postmenopausal patients with endocrine-responsive, node-positive breast cancer: a phase 3, open-label, randomised controlled trial. Lancet 374 (9707): 2055-63, 2009. [PUBMED Abstract]
- Eisen A, Messersmith J, Franek M, et al.: Adjuvant ovarian ablation in the treatment of premenopausal women with early stage invasive breast cancer. Ontario, Canada: Cancer Care, 2010. Evidence-based Series # 1-9: Section 1. Available online. Last accessed April 24, 2025.
- Adjuvant ovarian ablation versus CMF chemotherapy in premenopausal women with pathological stage II breast carcinoma: the Scottish trial. Scottish Cancer Trials Breast Group and ICRF Breast Unit, Guy's Hospital, London. Lancet 341 (8856): 1293-8, 1993. [PUBMED Abstract]
- Schmid P, Untch M, Kossé V, et al.: Leuprorelin acetate every-3-months depot versus cyclophosphamide, methotrexate, and fluorouracil as adjuvant treatment in premenopausal patients with node-positive breast cancer: the TABLE study. J Clin Oncol 25 (18): 2509-15, 2007. [PUBMED Abstract]
- Ejlertsen B, Mouridsen HT, Jensen MB, et al.: Similar efficacy for ovarian ablation compared with cyclophosphamide, methotrexate, and fluorouracil: from a randomized comparison of premenopausal patients with node-positive, hormone receptor-positive breast cancer. J Clin Oncol 24 (31): 4956-62, 2006. [PUBMED Abstract]
- Wolff AC, Davidson NE: Still waiting after 110 years: the optimal use of ovarian ablation as adjuvant therapy for breast cancer. J Clin Oncol 24 (31): 4949-51, 2006. [PUBMED Abstract]
- Boccardo F, Rubagotti A, Amoroso D, et al.: Cyclophosphamide, methotrexate, and fluorouracil versus tamoxifen plus ovarian suppression as adjuvant treatment of estrogen receptor-positive pre-/perimenopausal breast cancer patients: results of the Italian Breast Cancer Adjuvant Study Group 02 randomized trial. boccardo@hp380.ist.unige.it. J Clin Oncol 18 (14): 2718-27, 2000. [PUBMED Abstract]
- Winer EP, Hudis C, Burstein HJ, et al.: American Society of Clinical Oncology technology assessment on the use of aromatase inhibitors as adjuvant therapy for women with hormone receptor-positive breast cancer: status report 2002. J Clin Oncol 20 (15): 3317-27, 2002. [PUBMED Abstract]
- Tevaarwerk AJ, Wang M, Zhao F, et al.: Phase III comparison of tamoxifen versus tamoxifen plus ovarian function suppression in premenopausal women with node-negative, hormone receptor-positive breast cancer (E-3193, INT-0142): a trial of the Eastern Cooperative Oncology Group. J Clin Oncol 32 (35): 3948-58, 2014. [PUBMED Abstract]
- Francis PA, Regan MM, Fleming GF, et al.: Adjuvant ovarian suppression in premenopausal breast cancer. N Engl J Med 372 (5): 436-46, 2015. [PUBMED Abstract]
- Francis PA, Pagani O, Fleming GF, et al.: Tailoring Adjuvant Endocrine Therapy for Premenopausal Breast Cancer. N Engl J Med 379 (2): 122-137, 2018. [PUBMED Abstract]
- Kim HA, Lee JW, Nam SJ, et al.: Adding Ovarian Suppression to Tamoxifen for Premenopausal Breast Cancer: A Randomized Phase III Trial. J Clin Oncol 38 (5): 434-443, 2020. [PUBMED Abstract]
- Gnant M, Mlineritsch B, Stoeger H, et al.: Adjuvant endocrine therapy plus zoledronic acid in premenopausal women with early-stage breast cancer: 62-month follow-up from the ABCSG-12 randomised trial. Lancet Oncol 12 (7): 631-41, 2011. [PUBMED Abstract]
- Pagani O, Regan MM, Walley BA, et al.: Adjuvant exemestane with ovarian suppression in premenopausal breast cancer. N Engl J Med 371 (2): 107-18, 2014. [PUBMED Abstract]
- Francis PA, Fleming GF, Láng I, et al.: Adjuvant Endocrine Therapy in Premenopausal Breast Cancer: 12-Year Results From SOFT. J Clin Oncol 41 (7): 1370-1375, 2023. [PUBMED Abstract]
- Bernhard J, Luo W, Ribi K, et al.: Patient-reported outcomes with adjuvant exemestane versus tamoxifen in premenopausal women with early breast cancer undergoing ovarian suppression (TEXT and SOFT): a combined analysis of two phase 3 randomised trials. Lancet Oncol 16 (7): 848-58, 2015. [PUBMED Abstract]
- Dowsett M, Forbes JF, Bradley R, et al.: Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials. Lancet 386 (10001): 1341-52, 2015. [PUBMED Abstract]
- The ATAC Trialists' Group. Arimidex, tamoxifen alone or in combination: Anastrozole alone or in combination with tamoxifen versus tamoxifen alone for adjuvant treatment of postmenopausal women with early breast cancer: first results of the ATAC randomised trial. Lancet 359 (9324): 2131-9, 2002. [PUBMED Abstract]
- Howell A, Cuzick J, Baum M, et al.: Results of the ATAC (Arimidex, Tamoxifen, Alone or in Combination) trial after completion of 5 years' adjuvant treatment for breast cancer. Lancet 365 (9453): 60-2, 2005. [PUBMED Abstract]
- Thürlimann B, Keshaviah A, Coates AS, et al.: A comparison of letrozole and tamoxifen in postmenopausal women with early breast cancer. N Engl J Med 353 (26): 2747-57, 2005. [PUBMED Abstract]
- Coates AS, Keshaviah A, Thürlimann B, et al.: Five years of letrozole compared with tamoxifen as initial adjuvant therapy for postmenopausal women with endocrine-responsive early breast cancer: update of study BIG 1-98. J Clin Oncol 25 (5): 486-92, 2007. [PUBMED Abstract]
- Boccardo F, Rubagotti A, Guglielmini P, et al.: Switching to anastrozole versus continued tamoxifen treatment of early breast cancer. Updated results of the Italian tamoxifen anastrozole (ITA) trial. Ann Oncol 17 (Suppl 7): vii10-4, 2006. [PUBMED Abstract]
- Jakesz R, Jonat W, Gnant M, et al.: Switching of postmenopausal women with endocrine-responsive early breast cancer to anastrozole after 2 years' adjuvant tamoxifen: combined results of ABCSG trial 8 and ARNO 95 trial. Lancet 366 (9484): 455-62, 2005 Aug 6-12. [PUBMED Abstract]
- Boccardo F, Rubagotti A, Aldrighetti D, et al.: Switching to an aromatase inhibitor provides mortality benefit in early breast carcinoma: pooled analysis of 2 consecutive trials. Cancer 109 (6): 1060-7, 2007. [PUBMED Abstract]
- Coombes RC, Hall E, Gibson LJ, et al.: A randomized trial of exemestane after two to three years of tamoxifen therapy in postmenopausal women with primary breast cancer. N Engl J Med 350 (11): 1081-92, 2004. [PUBMED Abstract]
- Coombes RC, Kilburn LS, Snowdon CF, et al.: Survival and safety of exemestane versus tamoxifen after 2-3 years' tamoxifen treatment (Intergroup Exemestane Study): a randomised controlled trial. Lancet 369 (9561): 559-70, 2007. [PUBMED Abstract]
- van de Velde CJ, Rea D, Seynaeve C, et al.: Adjuvant tamoxifen and exemestane in early breast cancer (TEAM): a randomised phase 3 trial. Lancet 377 (9762): 321-31, 2011. [PUBMED Abstract]
- Regan MM, Neven P, Giobbie-Hurder A, et al.: Assessment of letrozole and tamoxifen alone and in sequence for postmenopausal women with steroid hormone receptor-positive breast cancer: the BIG 1-98 randomised clinical trial at 8·1 years median follow-up. Lancet Oncol 12 (12): 1101-8, 2011. [PUBMED Abstract]
- De Placido S, Gallo C, De Laurentiis M, et al.: Adjuvant anastrozole versus exemestane versus letrozole, upfront or after 2 years of tamoxifen, in endocrine-sensitive breast cancer (FATA-GIM3): a randomised, phase 3 trial. Lancet Oncol 19 (4): 474-485, 2018. [PUBMED Abstract]
- Goss PE, Ingle JN, Pritchard KI, et al.: Exemestane versus anastrozole in postmenopausal women with early breast cancer: NCIC CTG MA.27--a randomized controlled phase III trial. J Clin Oncol 31 (11): 1398-404, 2013. [PUBMED Abstract]
- Goss PE, Hershman DL, Cheung AM, et al.: Effects of adjuvant exemestane versus anastrozole on bone mineral density for women with early breast cancer (MA.27B): a companion analysis of a randomised controlled trial. Lancet Oncol 15 (4): 474-82, 2014. [PUBMED Abstract]
- Smith I, Yardley D, Burris H, et al.: Comparative Efficacy and Safety of Adjuvant Letrozole Versus Anastrozole in Postmenopausal Patients With Hormone Receptor-Positive, Node-Positive Early Breast Cancer: Final Results of the Randomized Phase III Femara Versus Anastrozole Clinical Evaluation (FACE) Trial. J Clin Oncol 35 (10): 1041-1048, 2017. [PUBMED Abstract]
- Goss PE, Ingle JN, Martino S, et al.: A randomized trial of letrozole in postmenopausal women after five years of tamoxifen therapy for early-stage breast cancer. N Engl J Med 349 (19): 1793-802, 2003. [PUBMED Abstract]
- Bryant J, Wolmark N: Letrozole after tamoxifen for breast cancer--what is the price of success? N Engl J Med 349 (19): 1855-7, 2003. [PUBMED Abstract]
- Burstein HJ: Beyond tamoxifen--extending endocrine treatment for early-stage breast cancer. N Engl J Med 349 (19): 1857-9, 2003. [PUBMED Abstract]
- Goss PE, Ingle JN, Martino S, et al.: Randomized trial of letrozole following tamoxifen as extended adjuvant therapy in receptor-positive breast cancer: updated findings from NCIC CTG MA.17. J Natl Cancer Inst 97 (17): 1262-71, 2005. [PUBMED Abstract]
- Mamounas EP, Jeong JH, Wickerham DL, et al.: Benefit from exemestane as extended adjuvant therapy after 5 years of adjuvant tamoxifen: intention-to-treat analysis of the National Surgical Adjuvant Breast And Bowel Project B-33 trial. J Clin Oncol 26 (12): 1965-71, 2008. [PUBMED Abstract]
- Goss PE, Ingle JN, Pritchard KI, et al.: Extending Aromatase-Inhibitor Adjuvant Therapy to 10 Years. N Engl J Med 375 (3): 209-19, 2016. [PUBMED Abstract]
- Blok EJ, Kroep JR, Meershoek-Klein Kranenbarg E, et al.: Optimal Duration of Extended Adjuvant Endocrine Therapy for Early Breast Cancer; Results of the IDEAL Trial (BOOG 2006-05). J Natl Cancer Inst 110 (1): , 2018. [PUBMED Abstract]
- Mamounas EP, Bandos H, Lembersky BC, et al.: Use of letrozole after aromatase inhibitor-based therapy in postmenopausal breast cancer (NRG Oncology/NSABP B-42): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 20 (1): 88-99, 2019. [PUBMED Abstract]
- Colleoni M, Luo W, Karlsson P, et al.: Extended adjuvant intermittent letrozole versus continuous letrozole in postmenopausal women with breast cancer (SOLE): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 19 (1): 127-138, 2018. [PUBMED Abstract]
- Tjan-Heijnen VCG, van Hellemond IEG, Peer PGM, et al.: Extended adjuvant aromatase inhibition after sequential endocrine therapy (DATA): a randomised, phase 3 trial. Lancet Oncol 18 (11): 1502-1511, 2017. [PUBMED Abstract]
- Del Mastro L, Mansutti M, Bisagni G, et al.: Extended therapy with letrozole as adjuvant treatment of postmenopausal patients with early-stage breast cancer: a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 22 (10): 1458-1467, 2021. [PUBMED Abstract]
- Gnant M, Fitzal F, Rinnerthaler G, et al.: Duration of Adjuvant Aromatase-Inhibitor Therapy in Postmenopausal Breast Cancer. N Engl J Med 385 (5): 395-405, 2021. [PUBMED Abstract]
- Iwase T, Saji S, Iijima K, et al.: Postoperative Adjuvant Anastrozole for 10 or 5 Years in Patients With Hormone Receptor-Positive Breast Cancer: AERAS, a Randomized Multicenter Open-Label Phase III Trial. J Clin Oncol 41 (18): 3329-3338, 2023. [PUBMED Abstract]
- Johnston SRD, Harbeck N, Hegg R, et al.: Abemaciclib Combined With Endocrine Therapy for the Adjuvant Treatment of HR+, HER2-, Node-Positive, High-Risk, Early Breast Cancer (monarchE). J Clin Oncol 38 (34): 3987-3998, 2020. [PUBMED Abstract]
- Rastogi P, O'Shaughnessy J, Martin M, et al.: Adjuvant Abemaciclib Plus Endocrine Therapy for Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative, High-Risk Early Breast Cancer: Results From a Preplanned monarchE Overall Survival Interim Analysis, Including 5-Year Efficacy Outcomes. J Clin Oncol 42 (9): 987-993, 2024. [PUBMED Abstract]
- Martin M, Hegg R, Kim SB, et al.: Treatment With Adjuvant Abemaciclib Plus Endocrine Therapy in Patients With High-risk Early Breast Cancer Who Received Neoadjuvant Chemotherapy: A Prespecified Analysis of the monarchE Randomized Clinical Trial. JAMA Oncol 8 (8): 1190-1194, 2022. [PUBMED Abstract]
- Slamon D, Lipatov O, Nowecki Z, et al.: Ribociclib plus Endocrine Therapy in Early Breast Cancer. N Engl J Med 390 (12): 1080-1091, 2024. [PUBMED Abstract]
- Mayer EL, Dueck AC, Martin M, et al.: Palbociclib with adjuvant endocrine therapy in early breast cancer (PALLAS): interim analysis of a multicentre, open-label, randomised, phase 3 study. Lancet Oncol 22 (2): 212-222, 2021. [PUBMED Abstract]
- Gnant M, Dueck AC, Frantal S, et al.: Adjuvant Palbociclib for Early Breast Cancer: The PALLAS Trial Results (ABCSG-42/AFT-05/BIG-14-03). J Clin Oncol 40 (3): 282-293, 2022. [PUBMED Abstract]
- Coleman R, Powles T, Paterson A, et al.: Adjuvant bisphosphonate treatment in early breast cancer: meta-analyses of individual patient data from randomised trials. Lancet 386 (10001): 1353-61, 2015. [PUBMED Abstract]
- Gnant M, Pfeiler G, Steger GG, et al.: Adjuvant denosumab in postmenopausal patients with hormone receptor-positive breast cancer (ABCSG-18): disease-free survival results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 20 (3): 339-351, 2019. [PUBMED Abstract]
- Coleman R, Finkelstein DM, Barrios C, et al.: Adjuvant denosumab in early breast cancer (D-CARE): an international, multicentre, randomised, controlled, phase 3 trial. Lancet Oncol 21 (1): 60-72, 2020. [PUBMED Abstract]
- Friedl TWP, Fehm T, Müller V, et al.: Prognosis of Patients With Early Breast Cancer Receiving 5 Years vs 2 Years of Adjuvant Bisphosphonate Treatment: A Phase 3 Randomized Clinical Trial. JAMA Oncol 7 (8): 1149-1157, 2021. [PUBMED Abstract]
- Desnoyers A, Amir E, Tannock IF: Adjuvant Zoledronate Therapy for Women With Breast Cancer-Effective Treatment or Fool's Gold? JAMA Oncol 7 (8): 1121-1123, 2021. [PUBMED Abstract]
- Tutt ANJ, Garber JE, Kaufman B, et al.: Adjuvant Olaparib for Patients with BRCA1- or BRCA2-Mutated Breast Cancer. N Engl J Med 384 (25): 2394-2405, 2021. [PUBMED Abstract]
- Mittendorf EA, Jeruss JS, Tucker SL, et al.: Validation of a novel staging system for disease-specific survival in patients with breast cancer treated with neoadjuvant chemotherapy. J Clin Oncol 29 (15): 1956-62, 2011. [PUBMED Abstract]
- Ganz PA, Bandos H, Španić T, et al.: Patient-Reported Outcomes in OlympiA: A Phase III, Randomized, Placebo-Controlled Trial of Adjuvant Olaparib in gBRCA1/2 Mutations and High-Risk Human Epidermal Growth Factor Receptor 2-Negative Early Breast Cancer. J Clin Oncol 42 (11): 1288-1300, 2024. [PUBMED Abstract]
- von Minckwitz G, Schneeweiss A, Loibl S, et al.: Neoadjuvant carboplatin in patients with triple-negative and HER2-positive early breast cancer (GeparSixto; GBG 66): a randomised phase 2 trial. Lancet Oncol 15 (7): 747-56, 2014. [PUBMED Abstract]
- Loibl S, Weber KE, Timms KM, et al.: Survival analysis of carboplatin added to an anthracycline/taxane-based neoadjuvant chemotherapy and HRD score as predictor of response-final results from GeparSixto. Ann Oncol 29 (12): 2341-2347, 2018. [PUBMED Abstract]
- Sikov WM, Berry DA, Perou CM, et al.: Impact of the addition of carboplatin and/or bevacizumab to neoadjuvant once-per-week paclitaxel followed by dose-dense doxorubicin and cyclophosphamide on pathologic complete response rates in stage II to III triple-negative breast cancer: CALGB 40603 (Alliance). J Clin Oncol 33 (1): 13-21, 2015. [PUBMED Abstract]
- Schmid P, Cortes J, Pusztai L, et al.: Pembrolizumab for Early Triple-Negative Breast Cancer. N Engl J Med 382 (9): 810-821, 2020. [PUBMED Abstract]
- Schmid P, Cortes J, Dent R, et al.: Event-free Survival with Pembrolizumab in Early Triple-Negative Breast Cancer. N Engl J Med 386 (6): 556-567, 2022. [PUBMED Abstract]
- Yu KD, Ye FG, He M, et al.: Effect of Adjuvant Paclitaxel and Carboplatin on Survival in Women With Triple-Negative Breast Cancer: A Phase 3 Randomized Clinical Trial. JAMA Oncol 6 (9): 1390-1396, 2020. [PUBMED Abstract]
- Wang X, Wang SS, Huang H, et al.: Effect of Capecitabine Maintenance Therapy Using Lower Dosage and Higher Frequency vs Observation on Disease-Free Survival Among Patients With Early-Stage Triple-Negative Breast Cancer Who Had Received Standard Treatment: The SYSUCC-001 Randomized Clinical Trial. JAMA 325 (1): 50-58, 2021. [PUBMED Abstract]
- Masuda N, Lee SJ, Ohtani S, et al.: Adjuvant Capecitabine for Breast Cancer after Preoperative Chemotherapy. N Engl J Med 376 (22): 2147-2159, 2017. [PUBMED Abstract]
- Ignatiadis M, Bailey A, McArthur H, et al.: Adjuvant Atezolizumab for Early Triple-Negative Breast Cancer: The ALEXANDRA/IMpassion030 Randomized Clinical Trial. JAMA 333 (13): 1150-60, 2025. [PUBMED Abstract]
- Buzdar AU, Ibrahim NK, Francis D, et al.: Significantly higher pathologic complete remission rate after neoadjuvant therapy with trastuzumab, paclitaxel, and epirubicin chemotherapy: results of a randomized trial in human epidermal growth factor receptor 2-positive operable breast cancer. J Clin Oncol 23 (16): 3676-85, 2005. [PUBMED Abstract]
- Untch M, Rezai M, Loibl S, et al.: Neoadjuvant treatment with trastuzumab in HER2-positive breast cancer: results from the GeparQuattro study. J Clin Oncol 28 (12): 2024-31, 2010. [PUBMED Abstract]
- Gianni L, Eiermann W, Semiglazov V, et al.: Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet 375 (9712): 377-84, 2010. [PUBMED Abstract]
- Gianni L, Eiermann W, Semiglazov V, et al.: Neoadjuvant and adjuvant trastuzumab in patients with HER2-positive locally advanced breast cancer (NOAH): follow-up of a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet Oncol 15 (6): 640-7, 2014. [PUBMED Abstract]
- Buzdar AU, Suman VJ, Meric-Bernstam F, et al.: Fluorouracil, epirubicin, and cyclophosphamide (FEC-75) followed by paclitaxel plus trastuzumab versus paclitaxel plus trastuzumab followed by FEC-75 plus trastuzumab as neoadjuvant treatment for patients with HER2-positive breast cancer (Z1041): a randomised, controlled, phase 3 trial. Lancet Oncol 14 (13): 1317-25, 2013. [PUBMED Abstract]
- Buzdar AU, Suman VJ, Meric-Bernstam F, et al.: Disease-Free and Overall Survival Among Patients With Operable HER2-Positive Breast Cancer Treated With Sequential vs Concurrent Chemotherapy: The ACOSOG Z1041 (Alliance) Randomized Clinical Trial. JAMA Oncol 5 (1): 45-50, 2019. [PUBMED Abstract]
- Gligorov J, Ataseven B, Verrill M, et al.: Safety and tolerability of subcutaneous trastuzumab for the adjuvant treatment of human epidermal growth factor receptor 2-positive early breast cancer: SafeHer phase III study's primary analysis of 2573 patients. Eur J Cancer 82: 237-246, 2017. [PUBMED Abstract]
- Ismael G, Hegg R, Muehlbauer S, et al.: Subcutaneous versus intravenous administration of (neo)adjuvant trastuzumab in patients with HER2-positive, clinical stage I-III breast cancer (HannaH study): a phase 3, open-label, multicentre, randomised trial. Lancet Oncol 13 (9): 869-78, 2012. [PUBMED Abstract]
- Jackisch C, Stroyakovskiy D, Pivot X, et al.: Subcutaneous vs Intravenous Trastuzumab for Patients With ERBB2-Positive Early Breast Cancer: Final Analysis of the HannaH Phase 3 Randomized Clinical Trial. JAMA Oncol 5 (5): e190339, 2019. [PUBMED Abstract]
- Gianni L, Pienkowski T, Im YH, et al.: Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol 13 (1): 25-32, 2012. [PUBMED Abstract]
- Baselga J, Bradbury I, Eidtmann H, et al.: Lapatinib with trastuzumab for HER2-positive early breast cancer (NeoALTTO): a randomised, open-label, multicentre, phase 3 trial. Lancet 379 (9816): 633-40, 2012. [PUBMED Abstract]
- Gianni L, Pienkowski T, Im YH, et al.: 5-year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced, inflammatory, or early-stage HER2-positive breast cancer (NeoSphere): a multicentre, open-label, phase 2 randomised trial. Lancet Oncol 17 (6): 791-800, 2016. [PUBMED Abstract]
- Schneeweiss A, Chia S, Hickish T, et al.: Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA). Ann Oncol 24 (9): 2278-84, 2013. [PUBMED Abstract]
- von Minckwitz G, Procter M, de Azambuja E, et al.: Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer. N Engl J Med 377 (2): 122-131, 2017. [PUBMED Abstract]
- van Ramshorst MS, van der Voort A, van Werkhoven ED, et al.: Neoadjuvant chemotherapy with or without anthracyclines in the presence of dual HER2 blockade for HER2-positive breast cancer (TRAIN-2): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 19 (12): 1630-1640, 2018. [PUBMED Abstract]
- van der Voort A, van Ramshorst MS, van Werkhoven ED, et al.: Three-Year Follow-up of Neoadjuvant Chemotherapy With or Without Anthracyclines in the Presence of Dual ERBB2 Blockade in Patients With ERBB2-Positive Breast Cancer: A Secondary Analysis of the TRAIN-2 Randomized, Phase 3 Trial. JAMA Oncol 7 (7): 978-984, 2021. [PUBMED Abstract]
- Piccart-Gebhart MJ, Procter M, Leyland-Jones B, et al.: Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 353 (16): 1659-72, 2005. [PUBMED Abstract]
- Cameron D, Piccart-Gebhart MJ, Gelber RD, et al.: 11 years' follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial. Lancet 389 (10075): 1195-1205, 2017. [PUBMED Abstract]
- Romond EH, Perez EA, Bryant J, et al.: Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 353 (16): 1673-84, 2005. [PUBMED Abstract]
- Perez E, Romond E, Suman V, et al.: Updated results of the combined analysis of NCCTG N9831 and NSABP B-31 adjuvant chemotherapy with/without trastuzumab in patiens with HER2-positive breast cancer. [Abstract] J Clin Oncol 25 (Suppl 18): 512, 6s, 2007.
- Perez EA, Romond EH, Suman VJ, et al.: Trastuzumab plus adjuvant chemotherapy for human epidermal growth factor receptor 2-positive breast cancer: planned joint analysis of overall survival from NSABP B-31 and NCCTG N9831. J Clin Oncol 32 (33): 3744-52, 2014. [PUBMED Abstract]
- Slamon D, Eiermann W, Robert N, et al.: Adjuvant trastuzumab in HER2-positive breast cancer. N Engl J Med 365 (14): 1273-83, 2011. [PUBMED Abstract]
- Joensuu H, Kellokumpu-Lehtinen PL, Bono P, et al.: Adjuvant docetaxel or vinorelbine with or without trastuzumab for breast cancer. N Engl J Med 354 (8): 809-20, 2006. [PUBMED Abstract]
- Pivot X, Romieu G, Debled M, et al.: 6 months versus 12 months of adjuvant trastuzumab in early breast cancer (PHARE): final analysis of a multicentre, open-label, phase 3 randomised trial. Lancet 393 (10191): 2591-2598, 2019. [PUBMED Abstract]
- Mavroudis D, Saloustros E, Malamos N, et al.: Six versus 12 months of adjuvant trastuzumab in combination with dose-dense chemotherapy for women with HER2-positive breast cancer: a multicenter randomized study by the Hellenic Oncology Research Group (HORG). Ann Oncol 26 (7): 1333-40, 2015. [PUBMED Abstract]
- Earl HM, Hiller L, Vallier AL, et al.: 6 versus 12 months of adjuvant trastuzumab for HER2-positive early breast cancer (PERSEPHONE): 4-year disease-free survival results of a randomised phase 3 non-inferiority trial. Lancet 393 (10191): 2599-2612, 2019. [PUBMED Abstract]
- Joensuu H, Fraser J, Wildiers H, et al.: Effect of Adjuvant Trastuzumab for a Duration of 9 Weeks vs 1 Year With Concomitant Chemotherapy for Early Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer: The SOLD Randomized Clinical Trial. JAMA Oncol 4 (9): 1199-1206, 2018. [PUBMED Abstract]
- Inno A, Barni S, Ghidini A, et al.: One year versus a shorter duration of adjuvant trastuzumab for HER2-positive early breast cancer: a systematic review and meta-analysis. Breast Cancer Res Treat 173 (2): 247-254, 2019. [PUBMED Abstract]
- Loibl S, Jassem J, Sonnenblick A, et al.: Adjuvant Pertuzumab and Trastuzumab in Early Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer in the APHINITY Trial: Third Interim Overall Survival Analysis With Efficacy Update. J Clin Oncol 42 (31): 3643-3651, 2024. [PUBMED Abstract]
- von Minckwitz G, Huang CS, Mano MS, et al.: Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med 380 (7): 617-628, 2019. [PUBMED Abstract]
- Chan A, Delaloge S, Holmes FA, et al.: Neratinib after trastuzumab-based adjuvant therapy in patients with HER2-positive breast cancer (ExteNET): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 17 (3): 367-77, 2016. [PUBMED Abstract]
- Martin M, Holmes FA, Ejlertsen B, et al.: Neratinib after trastuzumab-based adjuvant therapy in HER2-positive breast cancer (ExteNET): 5-year analysis of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 18 (12): 1688-1700, 2017. [PUBMED Abstract]
- Tolaney SM, Guo H, Pernas S, et al.: Seven-Year Follow-Up Analysis of Adjuvant Paclitaxel and Trastuzumab Trial for Node-Negative, Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer. J Clin Oncol 37 (22): 1868-1875, 2019. [PUBMED Abstract]
- Tolaney SM, Tarantino P, Graham N, et al.: Adjuvant paclitaxel and trastuzumab for node-negative, HER2-positive breast cancer: final 10-year analysis of the open-label, single-arm, phase 2 APT trial. Lancet Oncol 24 (3): 273-285, 2023. [PUBMED Abstract]
- Tolaney SM, Tayob N, Dang C, et al.: Adjuvant Trastuzumab Emtansine Versus Paclitaxel in Combination With Trastuzumab for Stage I HER2-Positive Breast Cancer (ATEMPT): A Randomized Clinical Trial. J Clin Oncol 39 (21): 2375-2385, 2021. [PUBMED Abstract]
- Tarantino P, Tayob N, Villacampa G, et al.: Adjuvant Trastuzumab Emtansine Versus Paclitaxel Plus Trastuzumab for Stage I Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer: 5-Year Results and Correlative Analyses From ATEMPT. J Clin Oncol 42 (31): 3652-3665, 2024. [PUBMED Abstract]
Efectos tóxicos de la terapia sistémica
Administración de capecitabina y fluorouracilo
El gen DPYD codifica la enzima que cataboliza las pirimidinas y las fluoropirimidinas, como la capecitabina y el fluorouracilo. Se estima que entre el 1 % y el 2 % de la población tiene variantes defectuosas de DPYD que reducen la función de la proteína DPD y la acumulación de pirimidinas y fluoropirimidinas en el cuerpo.[1,2] Los pacientes con la variante DPYD*2A que reciben fluoropirimidinas quizás presenten efectos tóxicos graves que ponen en riesgo la salud, y a veces son mortales. Se han identificado muchas otras variantes de DPYD, con diferentes efectos clínicos.[1-3] Es posible que se recomiende evitar la fluoropirimidina o reducir la dosis al 50 % según el genotipo DPYD del paciente y el número de alelos funcionales de DPYD.[4-6] Las pruebas genéticas para DPYD cuestan menos de $200, pero la cobertura del seguro varía debido a la falta de directrices nacionales.[7] Además, es posible que las pruebas retrasen el tratamiento por 2 semanas, lo que no sería aconsejable en casos de urgencia. Este tema es objeto de controversia y requiere evaluación adicional.[8]
Efectos tóxicos de la quimioterapia adyuvante
Los efectos tóxicos agudos de los fármacos de la quimioterapia adyuvante son los mismos que se observan cuando estos fármacos se usan en otros entornos terapéuticos. Aunque, debido a que muchas pacientes con cáncer de mama en estadio temprano tienen una supervivencia prolongada, los efectos adversos a largo plazo son especialmente importantes en este entorno. Los siguientes 2 efectos tóxicos son de especial interés:
- Cardiotoxicidad producida por antraciclinas.
- Neoplasia medular. En un estudio de 20 063 pacientes tratadas en los centros de la National Comprehensive Cancer Network, se encontró una incidencia de neoplasia medular de 0,46 por 1000 años-persona en las mujeres que recibieron quimioterapia con antraciclinas o ciclofosfamida. Esta tasa fue significativamente más alta que la tasa observada en las mujeres que se trataron con cirugía sola (cociente de riesgos instantáneos, 6,8; IC 95 %, 1,3–36,1).[9]
Efectos cardiotóxicos del trastuzumab adyuvante
En múltiples estudios se notificaron episodios cardíacos relacionados con el trastuzumab adyuvante. Los resultados más importantes de los estudios son los siguientes:
- En el ensayo HERA (BIG-01-01), se presentó insuficiencia cardíaca congestiva (ICC) grave (clase III–IV de la New York Heart Association) en el 0,6 % de las pacientes tratadas con trastuzumab.[10] La ICC fue sintomática en el 1,7 % de las pacientes del grupo de trastuzumab y en el 0,06 % de las del grupo de observación.
- En el ensayo NSABP B-31 (NCT00004067), 31 de 850 pacientes del grupo de trastuzumab presentaron episodios cardíacos sintomáticos confirmados, en comparación con 5 de 814 pacientes del grupo de control.[11] La incidencia acumulada a los 3 años de episodios cardíacos en las pacientes tratadas con trastuzumab fue del 4,1 %, en comparación con el 0,8 % en las pacientes del grupo de control (IC 95 %, 1,7–4,9 %).
- En el ensayo NCCTG-N9831, se notificaron 39 episodios cardíacos en los 3 grupos en el transcurso de 3 años. La incidencia acumulada a los 3 años de episodios cardíacos fue del 0,35 % en el grupo A (sin trastuzumab), del 3,5 % en el grupo B (trastuzumab después de paclitaxel), y del 2,5 % en el grupo C (trastuzumab simultáneo con paclitaxel).
- En el ensayo AVENTIS-TAX-GMA-302 (BCIRG 006) (NCT00021255), se detectaron episodios cardíacos clínicamente sintomáticos en el 0,38 % de las pacientes del grupo de doxorrubicina y ciclofosfamida (AC) y docetaxel (AC-D), el 1,87 % del grupo de AC, docetaxel y trastuzumab (AC-DH) y el 0,37 % del grupo de docetaxel, carboplatino y trastuzumab (DCbH).[12] También hubo una incidencia más alta y estadísticamente significativa de disminución asintomática continua en la fracción de eyección del ventrículo izquierdo (FEVI) en el grupo de AC-DH en comparación con el grupo de AC-D o el grupo de DCbH.
- En el ensayo FINHER, ninguna de las pacientes que recibieron trastuzumab presentaron episodios cardíacos clínicamente significativos. Se conservó la FEVI en todas las mujeres que recibieron trastuzumab, pero el número de pacientes que recibieron trastuzumab adyuvante fue muy bajo.[13]
Efectos cardiotóxicos del pertuzumab y el lapatinib
Evidencia (efectos cardiotóxicos del pertuzumab y el lapatinib):
- Se realizó un análisis conjunto de inocuidad cardíaca con datos proporcionados por Roche y Genentech de 598 pacientes con cáncer que recibieron pertuzumab.[14][Nivel de evidencia C2]
- Se observó disfunción sistólica ventricular izquierda asintomática en el 6,9 % de las pacientes que recibieron pertuzumab solo (n = 331; IC 95 %, 4,5–10,2 %), en el 3,4 % de las pacientes que recibieron pertuzumab en combinación con quimioterapia sin antraciclinas (n = 175; IC 95 %, 1,3–7,3 %) y en el 6,5 % de las pacientes que recibieron pertuzumab en combinación con trastuzumab (n = 93; IC 95 %, 2,4–13,5 %).
- Se observó insuficiencia cardíaca sintomática en 1 paciente (0,3 %) que recibió pertuzumab solo, en 2 pacientes (1,1 %) que recibieron pertuzumab en combinación con quimioterapia sin antraciclinas y en 1 paciente (1,1 %) que recibió pertuzumab en combinación con trastuzumab.
- En un metanálisis de ensayos aleatorizados (n = 6) se evaluó la administración de monoterapia anti-HER2 (trastuzumab, lapatinib o pertuzumab) versus terapia dual anti-HER2 (trastuzumab y lapatinib o trastuzumab y pertuzumab)[15][Nivel de evidencia C2]
- Se observó una disminución de la FEVI en el 3,1 % de las pacientes que recibieron monoterapia (IC 95 %, 2,2–4,4 %) y en el 2,9 % de las pacientes que recibieron terapia dual (IC 95 %, 2,1–4,1 %).
- Se observó insuficiencia cardíaca sintomática en el 0,88 % de las pacientes que recibieron monoterapia (IC 95 %, 0,47–1,64 %) y en el 1,49 % de las pacientes que recibieron terapia dual (IC 95 %, 0,98–2,23 %).
Efectos tóxicos de la terapia endocrina
Tamoxifeno
- El seguimiento a largo plazo del ensayo ATLAS (NCT00003016) incluyó datos de toxicidad. La terapia con tamoxifeno durante 10 años, en comparación con 5 años, aumenta los siguientes riesgos:[16]
- Émbolo pulmonar: riesgo relativo (RR) 1,87 (IC 95 %, 1,13–3,07; P = 0,01).
- Accidente cerebrovascular: RR, 1,06 (IC 95 %, 0,83–1,36).
- Cardiopatía isquémica: RR, 0,76 (IC 95 %, 0,6–0,95; P = 0,02)
- Cáncer de endometrio: RR, 1,74 (IC 95 %, 1,30–2,34; P = 0,002) Se destaca, que el riesgo acumulado de cáncer de endometrio durante los años 5 a 14 posteriores al diagnóstico del cáncer de mama fue del 3,1 % para las mujeres que recibieron 10 años de tamoxifeno versus el 1,6 % para las mujeres que recibieron 5 años de tamoxifeno. La tasa de mortalidad durante los años 5 a 14 fue del 12,2 % en las mujeres que recibieron tamoxifeno durante 10 años versus el 15 % en las mujeres que recibieron tamoxifeno durante 5 años, lo que representa una reducción absoluta de la mortalidad del 2,8 %.
Inhibidores de la aromatasa
Las pacientes que recibieron tamoxifeno presentaron con mayor frecuencia cáncer de endometrio y accidentes cerebrovasculares, mientras que las pacientes que recibieron anastrozol tuvieron más fracturas. La frecuencia de infartos de miocardio fue similar en ambos grupos. Con excepción del aumento continuado en la frecuencia de cáncer de endometrio en el grupo de tamoxifeno, estas diferencias no se mantuvieron en el período posterior al tratamiento.[17]
Bibliografía
- Sharma BB, Rai K, Blunt H, et al.: Pathogenic DPYD Variants and Treatment-Related Mortality in Patients Receiving Fluoropyrimidine Chemotherapy: A Systematic Review and Meta-Analysis. Oncologist 26 (12): 1008-1016, 2021. [PUBMED Abstract]
- Lam SW, Guchelaar HJ, Boven E: The role of pharmacogenetics in capecitabine efficacy and toxicity. Cancer Treat Rev 50: 9-22, 2016. [PUBMED Abstract]
- Shakeel F, Fang F, Kwon JW, et al.: Patients carrying DPYD variant alleles have increased risk of severe toxicity and related treatment modifications during fluoropyrimidine chemotherapy. Pharmacogenomics 22 (3): 145-155, 2021. [PUBMED Abstract]
- Amstutz U, Henricks LM, Offer SM, et al.: Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing: 2017 Update. Clin Pharmacol Ther 103 (2): 210-216, 2018. [PUBMED Abstract]
- Henricks LM, Lunenburg CATC, de Man FM, et al.: DPYD genotype-guided dose individualisation of fluoropyrimidine therapy in patients with cancer: a prospective safety analysis. Lancet Oncol 19 (11): 1459-1467, 2018. [PUBMED Abstract]
- Lau-Min KS, Varughese LA, Nelson MN, et al.: Preemptive pharmacogenetic testing to guide chemotherapy dosing in patients with gastrointestinal malignancies: a qualitative study of barriers to implementation. BMC Cancer 22 (1): 47, 2022. [PUBMED Abstract]
- Brooks GA, Tapp S, Daly AT, et al.: Cost-effectiveness of DPYD Genotyping Prior to Fluoropyrimidine-based Adjuvant Chemotherapy for Colon Cancer. Clin Colorectal Cancer 21 (3): e189-e195, 2022. [PUBMED Abstract]
- Baker SD, Bates SE, Brooks GA, et al.: DPYD Testing: Time to Put Patient Safety First. J Clin Oncol 41 (15): 2701-2705, 2023. [PUBMED Abstract]
- Wolff AC, Blackford AL, Visvanathan K, et al.: Risk of marrow neoplasms after adjuvant breast cancer therapy: the national comprehensive cancer network experience. J Clin Oncol 33 (4): 340-8, 2015. [PUBMED Abstract]
- Piccart-Gebhart MJ, Procter M, Leyland-Jones B, et al.: Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 353 (16): 1659-72, 2005. [PUBMED Abstract]
- Tan-Chiu E, Yothers G, Romond E, et al.: Assessment of cardiac dysfunction in a randomized trial comparing doxorubicin and cyclophosphamide followed by paclitaxel, with or without trastuzumab as adjuvant therapy in node-positive, human epidermal growth factor receptor 2-overexpressing breast cancer: NSABP B-31. J Clin Oncol 23 (31): 7811-9, 2005. [PUBMED Abstract]
- Slamon D, Eiermann W, Robert N, et al.: BCIRG 006: 2nd interim analysis phase III randomized trial comparing doxorubicin and cyclophosphamide followed by docetaxel (AC->T) with doxorubicin and cyclophosphamide followed by docetaxel and trastuzumab (AC->TH) with docetaxel, carboplatin and trastuzumab (TCH) in Her2neu positive early breast cancer patients. [Abstract] 29th Annual San Antonio Breast Cancer Symposium, December 14-17, 2006, San Antonio, Texas. A-52, 2006.
- Joensuu H, Kellokumpu-Lehtinen PL, Bono P, et al.: Adjuvant docetaxel or vinorelbine with or without trastuzumab for breast cancer. N Engl J Med 354 (8): 809-20, 2006. [PUBMED Abstract]
- Lenihan D, Suter T, Brammer M, et al.: Pooled analysis of cardiac safety in patients with cancer treated with pertuzumab. Ann Oncol 23 (3): 791-800, 2012. [PUBMED Abstract]
- Valachis A, Nearchou A, Polyzos NP, et al.: Cardiac toxicity in breast cancer patients treated with dual HER2 blockade. Int J Cancer 133 (9): 2245-52, 2013. [PUBMED Abstract]
- Davies C, Pan H, Godwin J, et al.: Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor-positive breast cancer: ATLAS, a randomised trial. Lancet 381 (9869): 805-16, 2013. [PUBMED Abstract]
- Howell A, Cuzick J, Baum M, et al.: Results of the ATAC (Arimidex, Tamoxifen, Alone or in Combination) trial after completion of 5 years' adjuvant treatment for breast cancer. Lancet 365 (9453): 60-2, 2005. [PUBMED Abstract]
Vigilancia posterior al tratamiento del cáncer de mama en estadios I, II y III
La frecuencia de las citas de seguimiento y la adecuación de los exámenes de detección después de terminar el tratamiento primario para el cáncer de mama en estadios I, II y III todavía son objeto de polémica.
La evidencia de los ensayos aleatorizados indica que el seguimiento periódico con gammagrafías óseas, ecografías hepáticas, radiografías torácicas y pruebas sanguíneas o de funcionamiento hepático no mejora la supervivencia ni la calidad de vida cuando se compara con el seguimiento mediante examen físico de rutina.[1-3] La supervivencia de la paciente no se modifica incluso cuando estas pruebas permiten la detección temprana de una enfermedad recidivante.[2] A partir de estos datos, el seguimiento apropiado para las pacientes asintomáticas que completaron el tratamiento para el cáncer de mama en estadios I a III se puede limitar a los siguientes exámenes:
- Examen físico.
- Mamografía anual.
Bibliografía
- Impact of follow-up testing on survival and health-related quality of life in breast cancer patients. A multicenter randomized controlled trial. The GIVIO Investigators. JAMA 271 (20): 1587-92, 1994. [PUBMED Abstract]
- Rosselli Del Turco M, Palli D, Cariddi A, et al.: Intensive diagnostic follow-up after treatment of primary breast cancer. A randomized trial. National Research Council Project on Breast Cancer follow-up. JAMA 271 (20): 1593-7, 1994. [PUBMED Abstract]
- Khatcheressian JL, Wolff AC, Smith TJ, et al.: American Society of Clinical Oncology 2006 update of the breast cancer follow-up and management guidelines in the adjuvant setting. J Clin Oncol 24 (31): 5091-7, 2006. [PUBMED Abstract]
Tratamiento del cáncer de mama con recidiva locorregional
El cáncer de mama recidivante a menudo responde al tratamiento, aunque en este estadio de la enfermedad este casi nunca es curativo. Las pacientes con una recidiva locorregional de cáncer de mama pueden sobrevivir a largo plazo con el tratamiento adecuado.
Las tasas de recidiva locorregional han disminuido a lo largo del tiempo; en un metanálisis se indica una tasa de recidiva menor al 3 % en pacientes tratadas con cirugía de conservación de la mama y radioterapia.[1] Las tasas son un poco más elevadas (hasta un 10 %) en quienes se someten a mastectomía.[2] De las pacientes con recidiva locorregional, entre el 9 % y el 25 % tendrán metástasis a distancia o enfermedad localmente extendida en el momento de la recidiva.[3-5]
Antes del tratamiento de la recidiva del cáncer de mama, se indica la reestadificación para evaluar la extensión de la enfermedad. De ser posible, se obtiene documentación citológica o histológica de la recidiva. Cuando se elige el tratamiento, se consideran el estado de los receptores de estrógeno (ER), progesterona (PR) y del receptor 2 del factor de crecimiento epidérmico humano (HER2) en el momento de la recidiva, así como el tratamiento previo, si se conoce.
El estado de ER puede cambiar en el momento de la recidiva. En un solo estudio pequeño del Cancer and Leukemia Group B (MDA-MBDT-8081), se encontró que el 36 % de los tumores positivos para receptores hormonales se tornaron negativos en las muestras de las biopsias obtenidas en el momento de la recidiva.[6] Las pacientes en este estudio no recibieron tratamiento de intervalo. Si se desconoce el estado de ER y PR, entonces el sitio o los sitios de recidiva, el intervalo sin enfermedad, la respuesta al tratamiento previo y el estado menopáusico son útiles para la selección de quimioterapia o terapia hormonal.[7]
En las pacientes con recidiva locorregional se debe considerar la administración de nuevos tratamientos locales (por ejemplo, mastectomía). En una serie, la tasa actuarial a 5 años de recaída en pacientes tratadas por recidiva invasiva luego del tratamiento de conservación de la mama y radioterapia fue del 52 %.[4]
Las opciones de tratamiento también dependen del sitio de la recidiva como se indica a continuación:
- Recidiva en la pared torácica. La recidiva local en la pared torácica después de una mastectomía suele ser una señal de enfermedad generalizada, pero en un subgrupo de pacientes, quizás sea el único sitio de recidiva. Para este subconjunto de pacientes, la cirugía o la radioterapia a veces son curativas.[8,9] Las pacientes con recidivas en la pared torácica que miden menos de 3 cm, recidiva en ganglios axilares y mamarios internos (que no sea supraclavicular, porque para este tipo la supervivencia es más precaria), y un intervalo sin enfermedad superior a 2 años antes de la recidiva, tienen la mejor probabilidad de supervivencia prolongada.[9] En una serie de este tipo de pacientes, la tasa de supervivencia sin enfermedad (SSE) a 5 años fue del 25 % y la tasa de SSE a 10 años fue del 15 %.[10] La tasa de control locorregional fue del 57 % a los 10 años. Se debe considerar la terapia sistémica para las pacientes con recidiva locorregional.
- Recidiva en la mama. En el ensayo Chemotherapy as Adjuvant for Locally Recurrent Breast Cancer (CALOR [NCT00074152]), se asignó al azar a pacientes con antecedentes de cirugía de conservación de la mama o mastectomía con márgenes limpios y extirpación completa de una recidiva local aislada, para recibir quimioterapia seleccionada por el médico o a no recibir quimioterapia. El estudio se cerró temprano debido a la poca inscripción de pacientes. El tamaño original de la muestra para obtener un cociente de riesgos instantáneos (CRI) de 0,74 fue de 977 pacientes (347 episodios de SSE), que después se modificó a 265 pacientes (CRI, 0,6; 124 episodios de SSE), pero solo se habían inscrito 162 pacientes al momento del cierre del estudio.[11][Nivel de evidencia B1]
- En las pacientes con resultado negativo para ER, el CRI para la SSE en el grupo de quimioterapia versus el grupo sin quimioterapia fue de 0,29 (intervalo de confianza [IC] 95 %, 0,13–0,67; SSE a 10 años, 70 vs. 34 %), mientras que en las pacientes con resultado positivo para ER, el CRI fue 1,07 (IC 95 %, 0,57–2,00; SSE a 10 años 50 vs. 59 %). La interacción entre la quimioterapia y el estado de ER con respecto a la SSE fue significativa (P = 0,013).[12]
- En este ensayo se respalda el uso de quimioterapia adyuvante después de la resección completa de una recidiva locorregional aislada del cáncer de mama en pacientes con tumores negativos para ER.
Todas las pacientes con cáncer de mama recidivante se consideran aptas para participar en ensayos clínicos en curso. Para obtener más información, consultar la sección Tratamiento del cáncer de mama metastásico.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Darby S, McGale P, Correa C, et al.: Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials. Lancet 378 (9804): 1707-16, 2011. [PUBMED Abstract]
- Buchanan CL, Dorn PL, Fey J, et al.: Locoregional recurrence after mastectomy: incidence and outcomes. J Am Coll Surg 203 (4): 469-74, 2006. [PUBMED Abstract]
- Aberizk WJ, Silver B, Henderson IC, et al.: The use of radiotherapy for treatment of isolated locoregional recurrence of breast carcinoma after mastectomy. Cancer 58 (6): 1214-8, 1986. [PUBMED Abstract]
- Abner AL, Recht A, Eberlein T, et al.: Prognosis following salvage mastectomy for recurrence in the breast after conservative surgery and radiation therapy for early-stage breast cancer. J Clin Oncol 11 (1): 44-8, 1993. [PUBMED Abstract]
- Haffty BG, Fischer D, Beinfield M, et al.: Prognosis following local recurrence in the conservatively treated breast cancer patient. Int J Radiat Oncol Biol Phys 21 (2): 293-8, 1991. [PUBMED Abstract]
- Kuukasjärvi T, Kononen J, Helin H, et al.: Loss of estrogen receptor in recurrent breast cancer is associated with poor response to endocrine therapy. J Clin Oncol 14 (9): 2584-9, 1996. [PUBMED Abstract]
- Perry MC, Kardinal CG, Korzun AH, et al.: Chemohormonal therapy in advanced carcinoma of the breast: Cancer and Leukemia Group B protocol 8081. J Clin Oncol 5 (10): 1534-45, 1987. [PUBMED Abstract]
- Schwaibold F, Fowble BL, Solin LJ, et al.: The results of radiation therapy for isolated local regional recurrence after mastectomy. Int J Radiat Oncol Biol Phys 21 (2): 299-310, 1991. [PUBMED Abstract]
- Halverson KJ, Perez CA, Kuske RR, et al.: Survival following locoregional recurrence of breast cancer: univariate and multivariate analysis. Int J Radiat Oncol Biol Phys 23 (2): 285-91, 1992. [PUBMED Abstract]
- Halverson KJ, Perez CA, Kuske RR, et al.: Isolated local-regional recurrence of breast cancer following mastectomy: radiotherapeutic management. Int J Radiat Oncol Biol Phys 19 (4): 851-8, 1990. [PUBMED Abstract]
- Aebi S, Gelber S, Anderson SJ, et al.: Chemotherapy for isolated locoregional recurrence of breast cancer (CALOR): a randomised trial. Lancet Oncol 15 (2): 156-63, 2014. [PUBMED Abstract]
- Wapnir IL, Price KN, Anderson SJ, et al.: Efficacy of Chemotherapy for ER-Negative and ER-Positive Isolated Locoregional Recurrence of Breast Cancer: Final Analysis of the CALOR Trial. J Clin Oncol 36 (11): 1073-1079, 2018. [PUBMED Abstract]
Tratamiento del cáncer de mama metastásico
El tratamiento de la enfermedad metastásica es paliativo. Los objetivos del tratamiento incluyen prolongar la vida y mejorar la calidad de vida. La tasa relativa de supervivencia a 5 años para las mujeres con cáncer de mama metastásico es del 31,9 %.[1] La mediana más prolongada de resultados favorables se observó en las pacientes con cáncer de mama metastásico positivo para receptores hormonales y positivo para el receptor 2 del factor de crecimiento epidérmico humano (HER2); y los desenlaces más desfavorables se observaron en las pacientes con cáncer de mama triple negativo (TNBC) metastásico.[2]
Aspectos generales de las opciones de tratamiento para el cáncer de mama metastásico
Las opciones de tratamiento para el cáncer de mama metastásico son las siguientes:
- Terapia hormonal (tamoxifeno, inhibidores de la aromatasa, degradadores selectivos de los receptores de estrógeno [ER]).
- Terapia dirigida a HER2.
- Inhibidores de CDK4/6.
- Inhibidores de mTOR.
- Inhibidores de PIK3CA.
- Quimioterapia.
- Inmunoterapia.
- Cirugía para pacientes con metástasis sintomáticas limitadas.
- Radioterapia para pacientes con metástasis sintomáticas limitadas.
- Terapia de modificación ósea para pacientes con metástasis óseas.
En muchos casos, estas terapias se administran en forma secuencial y en varias combinaciones.
De ser posible, en el momento de la presentación de la enfermedad metastásica se debe obtener documentación histológica de la metástasis con pruebas que determinen el estado de los receptores de estrógeno (ER), progesterona (PR) y de HER2. Si no es posible, es apropiado considerar la biopsia líquida (pruebas de células tumorales circulantes o de DNA tumoral circulante).
Todas las pacientes con cáncer de mama metastásico se consideran aptas para participar en ensayos clínicos en curso.
Cáncer de mama positivo para receptores hormonales negativo para HER2 metastásico
Terapia endocrina y terapia con inhibidores de cinasas dependientes de ciclinas
Las cinasas dependientes de ciclinas (CDK) de tipo CDK4 y CDK6 se han vinculado con la proliferación continuada de células del cáncer de mama positivo para receptores hormonales y resistente a la terapia endocrina. La Administración de Alimentos y Medicamentos (FDA) de los Estados Unidos aprobó los inhibidores de CDK en combinación con terapia endocrina para el tratamiento de primera línea o posterior de pacientes con cáncer de mama positivo para receptores hormonales y negativo para HER2 en estadio avanzado. Actualmente se comercializan 3 inhibidores de CDK4/6 de administración oral: palbociclib, ribociclib y abemaciclib.
En general, la adición de los inhibidores de CDK4/6 a la terapia endocrina mejora los desenlaces del cáncer de mama y suele mejorar la calidad de vida o mantenerla.[3-8] Este beneficio se observó en múltiples subgrupos clinicopatológicos de cáncer de mama.[9]
Palbociclib de primera línea y terapia endocrina
Evidencia (palbociclib de primera línea y terapia endocrina):
- En el ensayo PALOMA-2 (NCT01740427) se confirmaron los resultados del ensayo PALOMA-1 de fase II.[10] En este ensayo con enmascaramiento doble de fase III, se comparó la administración de placebo y letrozol con palbociclib y letrozol como terapia inicial para pacientes posmenopáusicas con enfermedad avanzada positiva para receptores ER (n = 666). El criterio principal de valoración fue la supervivencia sin progresión (SSP) evaluada por el investigador.[11]
- La mediana de SSP fue de 24,8 meses en el grupo de palbociclib y letrozol en comparación con 14,5 meses en el grupo de placebo y letrozol (cociente de riesgos instantáneos [CRI], 0,58; intervalo de confianza [IC] 95 %, 0,46–0,72; P < 0,001).[11][Nivel de evidencia B1]
- Los datos de supervivencia general (SG) todavía no son definitivos.
- Las pacientes que recibieron palbociclib presentaron citopenias más frecuentes (66,4 % de grados 3 a 4 en las pacientes tratadas con palbociclib vs.1,4 % en las tratadas con placebo). Otros eventos adversos comunes fueron náuseas, artralgias, fatiga y alopecia. Los eventos adversos de grados 3 a 4 más comunes, además de la neutropenia, fueron leucopenia (24,8 vs. 0 %), anemia (5,4 vs. 1,8 %) y fatiga (1,8 vs. 0,5 %).
Ribociclib de primera línea y terapia endocrina
El ribociclib, otro inhibidor de CDK4/6, también se probó en el entorno de primera línea para pacientes posmenopáusicas y pacientes premenopáusicas con cáncer de mama recidivante o metastásico positivo para receptores hormonales y negativo para HER2.
Evidencia (ribociclib de primera línea y terapia endocrina):
- En el ensayo controlado con placebo de fase III MONALEESA-2 (NCT01958021) se asignó al azar a 668 pacientes para recibir ribociclib de primera línea y letrozol o placebo y letrozol.[12,13]
- Se cumplió el criterio principal de valoración (SSP evaluada por el investigador). Se realizó un análisis interino planificado con anterioridad después de que 243 pacientes presentaron progresión de la enfermedad o murieron; la mediana de duración del seguimiento fue de 15,3 meses. Después de 18 meses, la tasa de SSP fue del 63,0 % (IC 95 %, 54,6–70,3 %) en el grupo de ribociclib y del 42,2 % (IC 95 %, 34,8–49,5 %) en el grupo de placebo.[12]
- La SG fue un criterio secundario de valoración. Se publicó un análisis final especificado en el protocolo, de la SG después de 400 muertes y una mediana de seguimiento de 6,6 años. Las pacientes que recibieron ribociclib y letrozol tuvieron un beneficio significativo en la SG en comparación con las pacientes que recibieron placebo y letrozol. La mediana de SG fue de 63,9 meses en el grupo de ribociclib y de 51,4 meses en el grupo de placebo (CRIde muerte, 0,76; IC 95 %, 0,63–0,93; P bilateral = 0,008).[14][Nivel de evidencia A1]
- Se presentó neutropenia de grados 3 a 4 en el 63,8 % de las pacientes del grupo de ribociclib y en el 1,2 % de las del grupo de placebo. También se observaron náuseas, infecciones, fatiga y diarrea de grado 1 a 2. Se presentaron efectos tóxicos hepatobiliares de grado 3 a 4 en el 14,4 % de las pacientes que recibieron ribociclib y en el 4,8 % de las pacientes que recibieron placebo. Se observó una prolongación del intervalo QTcF en el 4,5 % de las pacientes del grupo de ribociclib y en el 2,1 % de las pacientes del grupo de placebo.
- El ribociclib también se probó en combinación con fulvestrant en mujeres posmenopáusicas con cáncer de mama recidivante o metastásico positivo para receptores hormonales y negativo para HER2. En el ensayo MONALEESA-3 (NCT02422615) se incluyó a pacientes que recibían tratamiento de primera o segunda línea. En este ensayo controlado con placebo de fase III, se asignó al azar a 726 pacientes en una proporción 2:1 para recibir ribociclib y fulvestrant o placebo y fulvestrant.[15]
- Se cumplió el criterio principal de valoración (SSP evaluada por el investigador). En el momento del análisis final de SSP, la mediana de SSP en el grupo de ribociclib fue de 20,5 versus 12,8 meses en el grupo de placebo (CRI, 0,593; IC 95 %, 0,480–0,732; P < 0,001).[15][Nivel de evidencia B1]
- La SG fue superior en el grupo de ribociclib (CRI, 0,724; IC 95 %, 0,568–0,924; P = 0,004). Los resultados cruzaron el umbral preespecificado de interrupción (P = 0,011) para la superioridad de la eficacia. Los resultados fueron similares en todos los subgrupos.[16][Nivel de evidencia A1]
- Los efectos adversos fueron similares a los que se presentaron en otros estudios sobre inhibidores de CDK4/6.
- Se presentó neutropenia de grados 3 a 4 en el 53,4 % de las pacientes del grupo de ribociclib y en el 0,0 % de las pacientes del grupo de placebo.
- La tasa de neutropenia febril fue del 1,0 % en el grupo de ribociclib y del 0 % en el grupo de placebo.
- Se observó una prolongación del intervalo QTcF de más de 60 ms desde el inicio en el 6,5 % de las pacientes del grupo de ribociclib en comparación con el 0,4 % de las del grupo de placebo.
- El ribociclib también se evaluó en el entorno de primera línea en un estudio que se llevó a cabo solo con mujeres premenopáusicas o perimenopáusicas que recibieron tamoxifeno o un inhibidor de la aromatasa (IA) no esteroideo con goserelina.[17]En el estudio MONALEESA-7 (NCT02278120), 672 pacientes premenopáusicas con cáncer de mama recidivante o metastásico positivo para receptores hormonales y negativo para HER2 que no habían recibido antes terapia endocrina para enfermedad avanzada, se asignaron al azar en una proporción 1:1 para recibir ribociclib o placebo.
- Se cumplió el criterio principal de valoración (SSP evaluada por el investigador). En el momento del análisis final de la SSP, la mediana de SSP en el grupo de ribociclib fue de 23,8 versus 13,0 meses en el grupo de placebo (CRI, 0,55; IC 95 %, 0,44–0,69; P < 0,0001).[17][Nivel de evidencia A3]
- La SG fue un criterio secundario de valoración. La combinación de ribociclib y terapia endocrina se relacionó con una SG más larga que la terapia endocrina sola (SG a 42 meses, 70,2 vs. 46 %; CRIde muerte, 0,71; IC 95 %, 0,54−0,95; P = 0,01).[18][Nivel de evidencia A1] El beneficio para la supervivencia se observó en el grupo de pacientes que recibió IA con goserelina, y en el que recibió tamoxifeno, pero este beneficio no fue estadísticamente significativo en el grupo de tamoxifeno, que era mucho menos numeroso.
- Los eventos adversos fueron similares a los que se presentaron en otros estudios sobre inhibidores de CDK4/6.
- Se presentó neutropenia de grados 3 a 4 en el 61 % de las pacientes del grupo de ribociclib y en el 4 % de las del grupo de placebo.
- La tasa de neutropenia febril fue del 2,0 % en el grupo de ribociclib y del 1,0 % en el de placebo.
- Se observó una prolongación del intervalo QTcF de más de 60 ms desde el inicio en el 10,0 % de las pacientes del grupo de ribociclib en comparación con el 2,0 % de las del grupo de placebo. La prolongación de 60 ms fue más común en las pacientes que recibieron tamoxifeno (16 % con ribociclib y 7 % con placebo).
Abemaciclib de primera línea y terapia endocrina
El abemaciclib, otro inhibidor de CDK4/6, también se probó en el entorno de primera línea para pacientes posmenopáusicas con cáncer de mama recidivante o metastásico positivo para receptores hormonales y negativo para HER2.
Evidencia (abemaciclib de primera línea y terapia endocrina):
- En el ensayo aleatorizado con enmascaramiento doble de fase III MONARCH 3 (NCT02246621) se evaluó la terapia de primera línea con abemaciclib o placebo y un IA no esteroideo en 493 mujeres posmenopáusicas con cáncer de mama avanzado positivo para receptores hormonales y negativo para HER2.[19]
- Se cumplió el criterio principal de valoración, que era la SSP evaluada por el investigador. Después de una mediana de seguimiento de 17,8 meses, la mediana de SSP no se alcanzó en el grupo de abemaciclib y se logró a los 14,7 meses en el grupo de placebo (CRI, 0,54; IC 95 %, 0,41–0,72; P = 0,000021).
- En el análisis final de la SG, se obserbó una diferencia no significativa en la mediana de supervivencia (mediana de SG, 66,8 meses [grupo de abemaciclib] vs. 53,7 meses [grupo de placebo]; CRI, 0,804; IC 95 %, 0,637–1,015; P = 0,066).[20][Nivel de evidencia B1]
- El perfil de efectos secundarios del abemaciclib es diferente de otros inhibidores de CDK4/6. La diarrea fue el evento adverso más frecuente en el grupo de abemaciclib, aunque en su mayoría fue de grado 1.
- La neutropenia fue más común en el grupo de abemaciclib; sin embargo, solo el 21,1 % de las participantes presentó neutropenia de grados 3 a 4.
Palbociclib de segunda línea y terapia endocrina
Evidencia (palbociclib de segunda línea y terapia endocrina):
- En el ensayo con enmascaramiento doble de fase III PALOMA-3 (NCT01942135) participaron 521 pacientes con cáncer de mama avanzado, positivo para receptores hormonales y negativo para HER2 que habían presentado una recidiva o progresión durante la terapia endocrina anterior. Estas pacientes se asignaron al azar a recibir fulvestrant con placebo o fulvestrant con palbociclib. Las pacientes pre y posmenopáusicas fueron aptas para participar. Las pacientes premenopáusicas recibieron goserelina.[5][Nivel de evidencia A3]
- En el análisis final de SSP, se observó una mediana de SSP de 9,5 meses en el grupo de palbociclib y fulvestrant versus 4,6 meses en el grupo de placebo y fulvestrant (CRI 0,46; IC 95 %, 0,36–0,59; P < 0,0001).[21][Nivel de evidencia A3]
- Las citopenias, en particular la neutropenia, fueron mucho más frecuentes en el grupo de palbociclib, aunque la neutropenia febril fue muy infrecuente (1 %) en ambos grupos. Las pacientes que recibieron palbociclib presentaron fatiga, náuseas y cefalea con más frecuencia.
- Se hizo un análisis preespecificado de la SG después de la muerte de 310 pacientes. Se encontró una diferencia de 6,9 meses en la mediana de SG a favor del grupo de palbociclib y fulvestrant (34,9 vs. 28,0 meses), que no alcanzó significación estadística (CRI, 0,81; IC 95 %, 0,64–1,03; P = 0,09).[22]
- En un análisis de subgrupos planificado con anterioridad, se observó mejora de la SG en pacientes con sensibilidad a la terapia hormonal (CRI, 0,72; IC 95 %, 0,55−0,94), mientras que en las pacientes sin esta sensibilidad, la SG no mejoró en el grupo de palbociclib (CRI, 1,14; IC 95 %, 0,71−1,84; P = 0,12 para la interacción).
Ribociclib de segunda línea y terapia endocrina
En el ensayo MONALEESA-3 se incluyó a pacientes que recibían terapia de segunda línea. Para obtener más información, consultar la evidencia sobre ribociclib de primera línea y terapia endocrina que se encuentran más arriba.
Abemaciclib de segunda línea y terapia endocrina
Evidencia:
- En el estudio controlado con placebo de fase III MONARCH 2 (NCT02107703) se probó el abemaciclib (inhibidor de CDK4/6) en 669 pacientes con cáncer de mama avanzado positivo para receptores hormonales y negativo para HER2 (con progresión previa durante la terapia endocrina) que se asignaron al azar para recibir abemaciclib y fulvestrant o placebo y fulvestrant.[23]
- Se alcanzó el criterio principal de valoración (SSP evaluada por el investigador); la mediana de duración del seguimiento fue de 19,5 meses. La mediana de SSP fue de 16,4 meses para el grupo de abemaciclib y fulvestrant versus 9,3 meses para el grupo de placebo y fulvestrant (CRI, 0,55; IC 95 %, 0,45–0,68; P < 0,001).[23][Nivel de evidencia B1]
- Los datos de la SG son definitivos y demuestran una mejora en la SG de las pacientes que recibieron abemaciclib; se observó una mediana de SG de 46,7 meses para abemaciclib y fulvestrant versus 37,3 meses para el placebo (CRI, 0,757; IC 95 %, 0,606–0,945; P = 0,01).[24][Nivel de evidencia A1]
- Los eventos adversos fueron diarrea en el grupo de abemaciclib (86,4 %) y en el grupo de placebo (24,7 %), neutropenia (46 % y 4 %), náuseas (45,1 % y 22,9 %), fatiga (39,9 % y 26,9 %), y dolor abdominal (35,4 % y 15,7 %).
- Estos fueron en su mayoría de grados 1 a 2. La diarrea de grados 1 a 2 se presentó en el 73 % de las pacientes del grupo de abemaciclib y en el 24,2 % del grupo de placebo. De acuerdo con el informe del estudio, los antidiarreicos controlaron de manera eficaz este síntoma en la mayoría de los casos.
- La diarrea de grado 3 se presentó en el 13,4 % de las pacientes del grupo de abemaciclib y en el 0,4 % de las del grupo de placebo. No se notificó diarrea de grado 4.
- Se presentó neutropenia de grados 3 a 4 en el 25,5 % de las pacientes del grupo de abemaciclib y en el 1,7 % de las del grupo de placebo. La neutropenia febril se notificó en 6 pacientes del grupo de abemaciclib.
Terapia con inhibidor de cinasas dependientes de ciclinas después de progresión de la enfermedad que se trató con un inhibidor de cinasas dependientes de ciclinas
Evidencia (terapia con inhibidor de cinasas dependientes de ciclinas [CDK] después de progresión de la enfermedad que se trató con un inhibidor de CDK):
- En el ensayo de doble enmascaramiento, controlado con placebo que se hizo a nivel mundial postMONARCH (NCT05169567), y que se notificó a modo de resumen, se incluyeron 368 pacientes con cáncer de mama avanzado positivo para receptor de estrógeno y negativo para HER2. Las pacientes se asignaron al azar en una proporción 1:1 para recibir abemaciclib y fulvestrant o fulvestrant solo. Las pacientes aptas tenían las siguientes características: 1) progresión de la enfermedad con el tratamiento inicial para el cáncer de mama metastásico, que incluyó un inhibidor de CDK4/6 y un inhibidor de la aromatasa (99 % de las pacientes), o 2) enfermedad en recaída durante o después de la terapia adyuvante para cáncer de mama que se presentó en edad temprana con un inhibidor de CDK4/6 y terapia endocrina. El inhibidor de CDK fue palbociclib en el 59 % de las pacientes, ribociclib en el 33 % y abemaciclib en el 8 %. No se permitió ningún otro tratamiento anterior para la enfermedad metastásica. El criterio principal de valoración fue la SSP evaluada por el investigador.[25]
- La tasa de SSP a 6 meses fue del 50 % en el grupo de abemaciclib con fulvestrant y del 37 % en el grupo de fulvestrant solo (CRI, 0,73; IC 95 %, 0,57–0,95).[25][Nivel de evidencia B1]
- La tasa de respuesta general, un criterio secundario de valoración, fue del 17 % en el grupo de abemaciclib con fulvestrant y del 7 % en el grupo de fulvestrant solo.
Terapia con inhibidor de las cinasas dependientes de ciclinas en monoterapia
Evidencia (terapia con inhibidor de la cinasas dependientes de ciclinas [CDK] en monoterapia):
- La FDA aprobó el uso de abemaciclib en monoterapia para el cáncer de mama positivo para receptores hormonales y negativo para HER2 que progresa durante o después de la terapia endocrina y quimioterapia, a partir de los resultados del ensayo MONARCH 1 (NCT02102490).[26] El abemaciclib es el único inhibidor de CDK4/6 aprobado para usar en monoterapia. En el estudio de un solo grupo de fase II sobre el abemaciclib en monoterapia, MONARCH 1, se incluyó 132 mujeres con cáncer de mama avanzado positivo para receptores hormonales y negativo para HER2 que progresó durante el tratamiento con por lo menos 1 terapia endocrina previa y por lo menos 2 líneas de quimioterapia anteriores. La población del estudio se había sometido antes a tratamiento muy intenso y la mayoría de las participantes tenía enfermedad visceral. Se excluyó a las pacientes que habían recibido inhibidores de CDK. El criterio principal de valoración fue la tasa de respuesta objetiva evaluada por el investigador.
- La tasa de respuesta objetiva evaluada por el investigador fue del 19,7 % a los 12 meses (IC 95 %, 13,3–27,5 %).
- La tasa de beneficio clínico fue del 42,4 %.
- La mediana de SSP fue de 6,0 meses (IC 95 %, 4,2–7,5).
- El evento adverso más común fue diarrea, que se presentó en el 90,2 % de las participantes. No obstante, la mayoría fue de grados 1 a 2 y solo el 19,7 % de las participantes presentaron diarrea de grado 3. No se notificaron casos de diarrea de grado 4.
- Se presentó neutropenia en el 97,7 % de las participantes; sin embargo, la mayoría fue de grados 1 a 2 y solo el 26,9 % de las participantes presentó neutropenia de grados 3 a 4.
Terapia con inhibidores del blanco de la rapamicina en los mamíferos y terapia endocrina
En los modelos preclínicos y en los estudios clínicos se indica que los inhibidores del blanco de la rapamicina en mamíferos (mTOR) quizás sean una estrategia para superar la resistencia a las terapias endocrinas.
Evidencia (terapia con inhibidores de mTOR):
- En el ensayo aleatorizado controlado con placebo de fase III Breast Cancer Trial of Oral Everolimus (BOLERO-2 [NCT00863655]) se asignó al azar a pacientes con cáncer de mama metastásico positivo para receptores hormonales y resistente a los inhibidores de la aromatasa no esteroideos para recibir el inhibidor de mTOR everólimus con exemestano o placebo con exemestano.[27][Nivel de evidencia B1]
- En el análisis interino, la mediana de SSP fue de 6,9 meses para el everólimus con exemestano y de 2,8 meses para el placebo con exemestano (CRI, 0,43; IC 95 %, 0,35–0,54; P < 0,001).
- La adición de everólimus al exemestano fue más tóxica que la combinación de placebo y exemestano; los eventos adversos más comunes de grado 3 o 4 fueron estomatitis (8 vs. 1 %), anemia (6 vs. <1 %), disnea (4 vs. 1 %), hiperglucemia (4 vs. <1 %), fatiga (4 vs. 1 %) y neumonitis (3 vs. 0 %).
- Las diferencias en la SG no fueron significativas después del seguimiento posterior.[28]
- En el ensayo TAMRAD (NCT01298713) sin enmascaramiento, aleatorizado y de fase II, se comparó el tamoxifeno solo y el tamoxifeno con everólimus en mujeres posmenopáusicas cuya enfermedad progresó después de recibir un IA en el entorno adyuvante o metastásico. En el ensayo se asignó al azar a 57 mujeres para recibir tamoxifeno y a 54 mujeres para recibir la terapia combinada.[29]
- La mediana de tiempo hasta la progresión fue de 8,6 meses en el grupo de combinación y de 4,5 meses en el grupo de tamoxifeno (CRI, 0,54; IC 95 %, 0,56−0,81; P = 0,002).
- Los efectos tóxicos fueron más graves en el grupo de everólimus y similares a los del ensayo BOLERO2.
- En un análisis exploratorio, la SG fue de 32,9 meses en el grupo de tamoxifeno y no se alcanzó en el grupo de combinación (CRI, 0,45; IC 95 %, 0,24−0,81; P = 0,007).[29][Nivel de evidencia A1]
- En el ensayo aleatorizado con enmascaramiento doble de fase II PrE0102 (NCT01797120) se comparó el fulvestrant solo y el fulvestrant con everólimus en mujeres posmenopáusicas cuya enfermedad progresó después de recibir un IA en el entorno adyuvante o metastásico. Se asignó al azar a 66 mujeres al grupo de combinación y 65 mujeres al grupo de fulvestrant solo.[30]
- La mediana de SSP fue de 10,3 meses en el grupo de combinación y de 5,1 meses en el grupo de fulvestrant solo (CRI, 0,61; IC 95 %, 0,40–0,92; P = 0,02).[30][Nivel de evidencia A1]
- Los efectos tóxicos fueron similares a los de estudios previos.
- No se observaron diferencias en la SG entre los grupos.
- En el ensayo de un solo grupo SWISH (NCT02069093) se evaluó la eficacia de una solución oral de dexametasona (0,5 mg por 5 ml) para prevenir la estomatitis en mujeres que recibieron exemestano y everólimus.[31] La incidencia de estomatitis de grado 2 o más grave fue del 2 % en 85 pacientes evaluables en este estudio en comparación con el 33 % del ensayo BOLERO-2.
Terapia con inhibidores de AKT
Se encuentran variantes activadoras del gen AKT1 en el 5 % al 10 % de los cánceres de mama avanzados. El gen AKT se encuentra secuencia abajo de los genes PIK3CA y PTEN en la vía PIK3CA/AKT/ PTEN.
Capivasertib
La sobreactivación de la vía de señalización PIK3CA/AKT/PTEN ocurre en cerca de la mitad de los cánceres de mama positivos para receptores hormonales y negativos para HER2. La activación de las variantes de PIK3CA y AKT1, así como la inactivación de las alteraciones de PTEN pueden causar esta sobreactivación. El capivasertib es un inhibidor de molécula pequeña oral de las 3 isoformas de AKT (AKT1, AKT2 y AKT3).
Evidencia (capivasertib):
- En el ensayo de fase III, aleatorizado, de doble enmascaramiento CAPITELLO-291 (NCT04305496) se incluyeron mujeres y hombres con cáncer de mama avanzado positivo para ER y negativo para HER2. Los pacientes habían presentado recaída de la enfermedad o progresión durante o después del tratamiento con un inhibidor de la aromatasa, con o sin terapia previa con inhibidor de CDK4/6. En el ensayo se incluyeron 708 pacientes: 289 pacientes (40,8 %) tenían alteraciones en la vía PIK3CA/AKT/PTEN y 489 (69,1 %) habían recibido antes un inhibidor de CDK4/6 para el cáncer de mama avanzado. Los pacientes se asignaron al azar en una proporción 1:1 para recibir capivasertib con fulvestrant o placebo con fulvestrant. El criterio principal de valoración dual fue la SSP evaluada por el investigador, que se midió tanto en la población general como en pacientes con tumores con alteración de la vía PIK3CA/AKT/PTEN.[32]
- En la población general, la mediana de SSP fue de 7,2 meses en el grupo de capivasertib con fulvestrant versus 3,6 meses en el grupo de placebo con fulvestrant. (CRI, 0,60; IC 95 %, 0,51–0,71; P < 0,001).[32][Nivel de evidencia B1]
- En la población con alteración de la vía PIK3CA/AKT/PTEN, la mediana de SSP fue de 7,3 meses en el grupo de capivasertib con fulvestrant y de 3,1 meses en el grupo de placebo con fulvestrant (CRI, 0,50; IC 95 %, 0,38–0,65; P < 0,001).
- En los pacientes que recibieron capivasertib con fulvestrant, los eventos adversos de grado 3 o superior más frecuentes fueron exantema (12,1 %) y diarrea (9,3 %). El 0,3 % de los pacientes que recibieron placebo con fulvestrant presentaron exantema y diarrea de grado 3 o superior. En ocasiones, los eventos adversos llevaron a la interrupción del tratamiento. Esto ocurrió en el 13,0 % del grupo de capivasertib con fulvestrant y en el 2,3 % del grupo de placebo con fulvestrant.
A partir de este ensayo, la FDA aprobó el capivasertib in 2023.
Alpelisib y terapia endocrina
Se identifican variantes activadoras de PIK3CA en cerca del 40 % de los cánceres de mama positivos para receptores hormonales y negativos para HER2. El alpelisib es un inhibidor alfa específico de PIK3CA.
Evidencia (alpelisib y terapia endocrina):
- En el ensayo aleatorizado de fase III SOLAR-1 (NCT02437318) se comparó alpelisib y fulvestrant con placebo y fulvestrant. Se incluyeron 572 mujeres posmenopáusicas con cáncer de mama avanzado positivo para receptores hormonales y negativo para HER2 que habían recibido terapia endocrina previa.[33][Nivel de evidencia B1]
Se confirmaron variantes del gen PIK3CA en 341 participantes. El criterio principal de valoración fue la SSP en la cohorte de pacientes con variantes del gen PIK3CA.
- En esta cohorte, la mediana de SSP fue de 11 meses en el grupo de alpelisib y fulvestrant en comparación con 5,7 meses en el grupo de placebo y fulvestrant (CRIde progresión o CRIde muerte, 0,65; IC 95 %, 0,50−0,85; P < 0,001).
- La SSP no difirió entre los grupos de la cohorte de participantes sin variantes del gen PIK3CA (mediana de SSP, 7,4 meses en el grupo de alpelisib y fulvestrant vs. 5,6 meses en el grupo de placebo y fulvestrant).
- La SG en la cohorte con variantes del gen PIK3CA fue un criterio secundario de valoración. Los datos de SG todavía no son definitivos.
- Muy pocas participantes del estudio habían recibido antes terapia con un inhibidor de CDK4/6.
- Los efectos tóxicos comunes relacionados con alpelisib incluyeron hiperglucemia, diarrea, náuseas, anorexia y exantema. El control y tratamiento minuciosos de la hiperglucemia son necesarios durante la administración de alpelisib.
La FDA aprobó el alpelisib para usar en combinación con fulvestrant en mujeres con cáncer de mama avanzado positivo para receptores hormonales y negativo para HER2 con mutación en el gen PIK3CA que recibieron una terapia endocrina antes.
Elacestrant
El elacestrant es un degradador selectivo de ER (SERD) oral. Este fármaco degrada el receptor de estrógeno alfa (ER α) de manera dependiente de la dosis e inhibe la transcripción génica dirigida por ER y dependiente del estradiol así como el crecimiento tumoral, incluso en células con variantes del gen ESR1. Las variantes del gen ESR1 producen la activación de ER independiente de los estrógenos y, en consecuencia, producen resistencia a los IA, pero no necesariamente a los SERD ni a los moduladores selectivos de ER.
Evidencia (elacestrant):
- En un ensayo aleatorizado sin enmascaramiento de fase III (EMERALD [NCT03778931]), se inscribieron pacientes con cáncer de mama metastásico positivo para ER y negativo para HER2. Las pacientes aptas habían recibido previamente 1 o 2 líneas de terapia endocrina, un inhibidor de CDK4/6 y no más de una línea de quimioterapia. Se asignó al azar a un total de 477 pacientes en una proporción 1:1 para recibir 400 mg de elacestrant por vía oral una vez al día o monoterapia endocrina estándar. El criterio principal de valoración fue la SSP evaluada mediante revisión central independiente con enmascaramiento en todas las pacientes y en pacientes con variantes detectables del gen ESR1. Se detectó una variante del gen ESR1 en el 47,8 % de las pacientes, y el 43,4 % de las pacientes habían recibido 2 terapias endocrinas previas. El 29 % de las pacientes del grupo de elacestrant y el 31 % de las pacientes del grupo de atención estándar habían recibido tratamiento previo con fulvestrant. Menos de 5 % de las pacientes de todos los grupos habían recibido tratamiento previo con inhibidores de mTOR.[34]
- La SSP se prolongó en el grupo de elacestrant en todas las pacientes (CRI, 0,70; IC 95 %, 0,55–0,88; P = 0,002) y en las pacientes tratadas con elacestrant con variantes del gen ESR1 (CRI, 0,55; IC 95 %, 0,39–0,77; P = 0,0005). Entre todas las pacientes, las tasas de SSP a 6 meses fueron del 34,3 % en el grupo de elacestrant y del 20,4 % en el grupo de tratamiento estándar. En las pacientes con variantes del gen ESR1, las tasas de SSP a 6 meses fueron del 40,8 % en las pacientes del grupo de elacestrant y del 19,1 % en las pacientes del grupo de tratamiento estándar. De manera similar, para todas las pacientes, las tasas de SSP a 12 meses fueron del 22,3 % en el grupo de elacestrant y del 9,4 % en el grupo de tratamiento estándar. Entre las pacientes con variantes del gen ESR1, las tasas de SSP a 12 meses fueron del 26,8 % en el grupo de elacestrant y del 8,2 % en el grupo de tratamiento estándar.[34][Nivel de evidencia B1]
- Los efectos adversos más comunes observados con elacestrant versus el tratamiento estándar fueron náuseas (35,0 vs. 18,8 %), fatiga (19,0 vs. 18,8 %), vómitos (19,0 vs. 8,3 %), disminución del apetito (14,8 vs. 9,2 %) y artralgias (14,3 vs. 16,2 %). Se presentaron efectos adversos de grado 3 o 4 en 64 pacientes (27,0 %) que recibieron elacestrant y 47 pacientes (20,5 %) que recibieron tratamiento estándar. Los efectos adversos de grado 3 o 4 más comunes en el grupo de elacestrant fueron náuseas (6 pacientes, 2,5 %), dolor de espalda (6 pacientes, 2,5 %) y aumento de la alanina–aminotransferasa (5 pacientes, 2,1 %). Los efectos adversos de grado 3 o 4 más comunes en el grupo de tratamiento estándar fueron náuseas, fatiga, diarrea y aumento de la aspartato–aminotransferasa (cada uno se presentó en 2 pacientes, 0,9 %). Debido a los efectos adversos, se interrumpió el tratamiento en 15 pacientes (6,3 %) del grupo de elacestrant y en 10 pacientes (4,4 %) del grupo de tratamiento estándar.
Terapia con inhibidores de la HDAC
La modificación epigenética modifica la expresión génica. Esto puede provocar resistencia al tratamiento endocrino, que a veces es posible revertir mediante modificadores epigenéticos como los inhibidores de la histona–desacetilasa (HDAC). El entinostat, un inhibidor de la HDAC de administración oral, induce una disminución de la regulación de las vías de señalización de factores de crecimiento independientes del estrógeno y la normalización de las concentraciones de los receptores de estrógeno. El entinostat se evaluó en un ensayo de fase III y no se observó beneficio.[35,36]
Terapia endocrina sola
La terapia endocrina en monoterapia cada vez se usa menos, en especial en el entorno de primera línea, debido a las ventajas para la SSP y la SG relacionadas con la terapia combinada de fármacos dirigidos con terapia endocrina, según se describió antes. Sin embargo, todavía resulta apropiado utilizar este tipo de terapia en el entorno de primera línea en casos seleccionados y como terapia posterior después de la progresión durante el tratamiento con terapias dirigidas, y antes de usar quimioterapia en casos en los que se cree que todavía hay enfermedad con sensibilidad endocrina.
Los fármacos de terapia endocrina de uso más frecuente incluyen el tamoxifeno, los IA no esteroideos (letrozol, anastrozol), el IA esteroideo exemestano, y fulvestrant. En general, las mujeres premenopáusicas con cáncer de mama metastásico se someten a supresión o ablación ovárica y se tratan de la misma manera que las mujeres posmenopáusicas.
Tamoxifeno y terapia con inhibidores de la aromatasa
Si bien se ha utilizado el tamoxifeno durante muchos años en el tratamiento de mujeres posmenopáusicas con diagnóstico reciente de enfermedad metastásica positiva para ER y para PR o con estado desconocido para estos receptores, en varios ensayos aleatorizados se indican tasas de respuesta y SSP equivalentes o superiores con fármacos IA cuando se comparan con el tamoxifeno.[37-39][Nivel de evidencia B1]
Evidencia (tamoxifeno y terapia con IA):
- En un metanálisis se evaluó a pacientes con enfermedad metastásica asignadas al azar a recibir un IA como primera o segunda terapia hormonal, o terapia estándar (tamoxifeno o un progestágeno).[40][Nivel de evidencia A1]
- Las pacientes que recibieron un AI como primera o segunda terapia hormonal para la enfermedad metastásica y se asignaron al azar para recibir un fármaco de tercera generación (anastrozol, letrozol, exemestano o vorozol) vivieron más tiempo (CRIde muerte, 0,87; IC 95 %, 0,82–0,93) que aquellas que recibieron el tratamiento estándar (tamoxifeno o un progestágeno).
Fulvestrant
El fulvestrant es un degradador selectivo del receptor de estrógeno que se ha estudiado en el entorno de tratamiento de primera y segunda línea en mujeres con cáncer de mama avanzado o metastásico.
Fulvestrant de primera línea
Evidencia (fulvestrant de primera línea):
- En el ensayo aleatorizado con enmascaramiento doble de fase III FALCON (NCT01602380) se comparó el fulvestrant (500 mg) con el anastrozol (1 mg) en pacientes con cáncer de mama avanzado o metastásico positivo para receptores hormonales que no habían recibido terapia endocrina previa.[41] En el ensayo se asignó al azar a 230 pacientes para recibir fulvestrant y 232 pacientes para recibir anastrozol.
- La mediana de SSP fue de 16,6 meses en el grupo de fulvestrant y de 13,8 meses en el grupo de anastrozol (CRI, 0,797; IC 95 %, 0,637−0,999; P = 0,049).[41][Nivel de evidencia A1]
- La frecuencia de los eventos adversos fue similar en los 2 grupos, y no se presentaron diferencias en la calidad de vida.
- No se notificaron resultados de SG.
Fulvestrant de segunda línea
Evidencia (fulvestrant de segunda línea):
- En 2 ensayos aleatorizados en los que participaron 400 y 451 pacientes cuya enfermedad progresó después de recibir tamoxifeno, se demostró que el fulvestrant produjo resultados similares al anastrozol en cuanto a su efecto en la SSP.[42,43] Se desconoce la secuencia adecuada para estas terapias.[44,45]
- En el ensayo aleatorizado con enmascaramiento doble de fase III EFECT (NCT00065325), se comparó el fulvestrant administrado en un régimen de dosis de carga (500 mg en el día 0, 250 mg en los días 14 y 28, y 250 mg cada 28 días de ahí en adelante) con el exemestano (25 mg) en mujeres que presentaron enfermedad progresiva después de la terapia con un IA no esteroideo (anastrozol o letrozol).[46] En el ensayo se asignó al azar a 351 mujeres para recibir fulvestrant y a 342 mujeres para recibir exemestano.
- La mediana de tiempo hasta la progresión fue de 3,7 meses en ambos grupos (CRI, 0,93; IC 95 %, 0,819−1,133; P = 0,65).[46][Nivel de evidencia B1]
- La frecuencia de efectos adversos fue similar en ambos grupos, y no hubo diferencias en la calidad de vida.
- No se notificaron resultados de SG.
- En el ensayo con enmascaramiento doble de fase III CONFIRM (NCT00099437) se compararon 2 dosis de fulvestrant (500 vs. 250 mg, cada una administrada en un programa de dosis de carga) en 736 mujeres cuya enfermedad había progresado con una terapia endocrina previa.[47]
- La SSP fue significativamente mejor en el grupo de dosis más altas (CRI, 0,80; IC 95 %, 0,68–0,94; P = 0,006).[47][Nivel de evidencia B1]
- Los efectos adversos y la calidad de vida fueron similares en los 2 grupos.
Terapia endocrina combinada con inhibidores de la aromatasa y fulvestrant
Se encontraron resultados contradictorios en 2 ensayos en los que se comparó la combinación del antiestrógeno fulvestrant con anastrozol, y anastrozol solo para el tratamiento de primera línea de pacientes posmenopáusicas con enfermedad metastásica o recidivante positiva para receptores hormonales. Para obtener más información, consultar la sección Fulvestrant.[48,49] En ambos estudios, se administró fulvestrant en una dosis de carga de 500 mg en el día 1, luego 250 mg en los días 15 y 29, y en adelante, cada mes; además se administró 1 mg de anastrozol diario. En el ensayo Southwest Oncology Group (SWOG) participaron más pacientes con un cuadro clínico inicial de enfermedad metastásica; en el ensayo Fulvestrant and Anastrozole Combination Therapy (FACT [NCT00256698]) participaron más pacientes que en el pasado habían recibido tamoxifeno.[48,49]
Evidencia (terapia endocrina combinada con un IA y fulvestrant):
- En el ensayo SWOG-0226 [NCT00075764]), en el que se inscribieron 707 pacientes, se demostró una diferencia estadísticamente significativa en la SSP (CRI, 0,80; IC 95 %, 0,68–0,94; P = 0,007) y en la SG (CRI, 0,81; IC 95 %, 0,65–1,00; P = 0,05).[48][Nivel de evidencia A1]
- En un análisis realizado después de 5 años adicionales de seguimiento, los beneficios observados de la terapia combinada aún estaban presentes y el nivel de significación con respecto a la SG fue mayor (CRI, 0,82; IC 95 %, 0,69–0,98; P = 0,03).[50][Nivel de evidencia A1]
- Por el contrario, en el ensayo FACT, en el que participaron 514 pacientes, no se encontraron diferencias en la supervivencia sin enfermedad (SSE) (CRI, 0,99; IC 95 %, 0,81–1,20; P = 0,91) ni en la SG (CRI, 1,0; IC 95 %, 0,76–1,32; P = 1,00).[49][Nivel de evidencia A1]
Terapia secuencial para el cáncer de mama metastásico positivo para receptores hormonales
Se desconoce la secuenciación óptima de las terapias para el cáncer de mama metastásico positivo para receptores hormonales. En general, en ausencia de crisis visceral, la mayoría de las pacientes reciben regímenes endocrinos secuenciales antes de la transición a la quimioterapia. Teniendo en cuenta las mejoras de la SSP y la SG mencionadas antes, la combinación de un inhibidor CDK4/6 y terapia endocrina como tratamiento de primera línea es una opción adecuada.
Terapia con inhibidores de la poli-(ADP-ribosa)–polimerasa
Las pacientes con cáncer de mama metastásico positivo para receptores hormonales y una variante germinal del gen BRCA son aptas para recibir terapia con inhibidores de la poli-(ADP-ribosa)–polimerasa (PARP). Para obtener más información, consultar la sección Cáncer de mama metastásico con mutación germinal en el gen BRCA.
Sacituzumab govitecán
El sacituzumab govitecán es un conjugado anticuerpo-fármaco que combina un anticuerpo contra el antígeno 2 de superficie de células trofoblásticas (TROP2) con un metabolito activo de irinotecán (SN-38). El TROP2 es un transductor transmembranario de señales de calcio con expresión alta en el cáncer de mama positivo para ER y negativo para HER2. La incorporación del sacituzumab govitecán unido a TROP2 introduce el SN-38 en la célula tumoral mediante la hidrólisis del enlace.[51]
Evidencia (sacituzumab govitecán):
- En el ensayo mundial de fase III Tropics-02 (NCT03901339), se asignó al azar a 543 pacientes para recibir sacituzumab govitecán o la quimioterapia elegida por el médico (eribulina, vinorelbina, capecitabina o gemcitabina). Las pacientes presentaban cáncer de mama metastásico o recidivante local inoperable, resistente a la terapia endocrina, tratado con quimioterapia, positivo para receptores hormonales y negativo para HER2. Las pacientes habían recibido en promedio 3 líneas de quimioterapia para la enfermedad avanzada y el 99 % había recibido previamente un inhibidor CDK4/6. El criterio principal de valoración fue la SSP evaluada por revisión central independiente con enmascaramiento.[52][Nivel de evidencia B1]
- En un análisis se observó una reducción del 34 % en el riesgo de progresión o muerte (CRI, 0,66; IC 95 %, 0,53–0,83; P = 0,0003). La mediana de SSP fue de 5,5 meses en el grupo de sacituzumab govitecán y de 4,0 meses en el grupo de quimioterapia. La SSP a los 6 y 12 meses fue del 46 % y del 21 % en las pacientes que recibieron sacituzumab govitecán y del 30 % y el 7 % en las pacientes que recibieron quimioterapia.
- Los datos de la mediana de SG no son definitivos.
- Los efectos adversos importantes de grado 3 o superiores relacionados con el tratamiento fueron la neutropenia (que se presentó en el 51 % de las pacientes que recibieron sacituzumab govitecán y en el 38 % de las pacientes que recibieron quimioterapia) y la diarrea (que se presentó en el 9 % de las pacientes que recibieron sacituzumab govitecán y en el 1 % de las pacientes que recibieron quimioterapia). Una paciente del grupo de sacituzumab govitecán murió por un evento adverso relacionado con el tratamiento (choque séptico relacionado con colitis neutropénica).
- La tasa de respuesta objetiva evaluada por revisión central independiente con enmascaramiento fue del 21 % en el grupo de sacituzumab govitecán y del 14 % en el grupo de quimioterapia. La tasa de beneficio clínico fue más elevada con sacituzumab govitecán que con quimioterapia (34 vs. 22 %).
La FDA aprobó el uso del sacituzumab govitecán en pacientes con cáncer de mama irresecable metastásico, incluso para pacientes con TNBC que recibieron al menos 2 terapias sistémicas, y por lo menos 1 de ellas fue para cáncer metastásico. También se aprobó para pacientes con cáncer de mama positivo para receptores hormonales y negativo para HER2 que recibieron terapia hormonal y al menos 2 terapias sistémicas para cáncer metastásico.
Quimioterapia
Es posible que la quimioterapia sea apropiada para pacientes con cáncer de mama positivo para receptores hormonales y negativo para HER2. Para obtener más información, consultar la sección Quimioterapia para el cáncer de mama metastásico.
Cáncer de mama metastásico con HER2 bajo
El 60 % de los cánceres de mama metastásicos negativos para HER2 expresan pocas concentraciones de HER2, definidas por una puntuación de 1+ en el análisis inmunohistoquímico (IHC) o una puntuación IHC de 2+ y resultados negativos en la hibridación in situ. A estos se les llama tumores con HER2 bajo. Históricamente, las terapias dirigidas a HER2 no habían mejorado los desenlaces en estas pacientes. En los ensayos de fase inicial de trastuzumab deruxtecán, se notificó una posible eficacia en este subgrupo.[53] En un ensayo aleatorizado de fase III subsecuente, se observó un beneficio para la SG en este subgrupo.[54] El trastuzumab deruxtecán es un conjugado anticuerpo-fármaco conformado por un anticuerpo monoclonal humanizado anti-HER2 unido mediante un enlace escindible a la carga activa, un inhibidor de la topoisomerasa-I. Este fármaco tiene un efecto espectador o adyacente en las células con HER2 bajo gracias a que se incorpora en las células con sobreexpresión de HER2 donde ocurre la escisión intracelular de la carga activa que se libera hacia el tumor circundante.
Evidencia (trastuzumab deruxtecán para tumores positivos para receptores hormonales y negativos para receptores hormonales con HER2 bajo):
- En el ensayo DESTINY-Breast04 (NCT03734029) se asignó al azar a 557 mujeres en una proporción 2:1 para recibir trastuzumab deruxtecán o la quimioterapia elegida por el médico (capecitabina, eribulina, gemcitabina, paclitaxel, o nab-paclitaxel). Las pacientes habían recibido 1 o 2 líneas de quimioterapia previas. El criterio principal de valoración fue la SSP en el grupo con resultado positivo para receptores hormonales (88,7 % de pacientes). Los criterios secundarios de valoración fueron la SSP en la población total, la SG en la población total y la SG en el grupo con resultado positivo para receptores hormonales.[54][Nivel de evidencia A1]
- En la cohorte con resultado positivo para receptores hormonales, la mediana de SSP fue de 10,1 meses en las pacientes que recibieron trastuzumab deruxtecán y de 5,4 meses en las pacientes que recibieron la quimioterapia elegida por el médico (CRIde progresión de la enfermedad o muerte, 0,51; P < 0,001). La SG fue de 23,9 meses en las pacientes que recibieron trastuzumab deruxtecán y de 17,5 meses en las pacientes que recibieron la quimioterapia elegida por el médico (CRIde muerte, 0,64; P = 0,003).
- Entre todas las pacientes, la mediana de SSP fue de 9,9 meses en el grupo de trastuzumab deruxtecán y de 5,1 meses en el grupo de quimioterapia elegida por el médico (CRIde progresión de la enfermedad o muerte, 0,50; P < 0,001). La SG fue de 23,4 meses en el grupo de trastuzumab deruxtecán y de 16,8 meses en el grupo de quimioterapia elegida por el médico (CRIde muerte, 0,64; P = 0,001).
- Se presentó enfermedad pulmonar intersticial o neumonitis relacionada con el fármaco en el 12,1 % de las pacientes que recibieron trastuzumab deruxtecán; el 0,8 % de los episodios fueron de grado 5.
- En el ensayo de fase III, aleatorizado y sin enmascaramiento DESTINY-Breast06 (NCT04494425) se incluyeron pacientes con cáncer de mama metastásico positivo para RE con baja expresión de HER2 (con una puntuación de 1+ o 2+ en el análisis IHC y resultados negativos en la hibridación in situ) o expresión muy baja de HER2 (con una puntuación de 0 en el análisis IHC con tinción de membrana). Estas pacientes habían recibido una o más líneas de terapia hormonal y no habían recibido quimioterapia previa para el cáncer de mama metastásico. En el ensayo se asignó de manera aleatoria a 866 pacientes en una proporción 1:1 para recibir trastuzumab deruxtecán o la quimioterapia elegida por el médico. Un total de 713 pacientes presentaron enfermedad con expresión baja de HER2 y 153 pacientes presentaron expresión muy baja de HER2. El criterio de valoración principal fue la SSP.[55]
- En las pacientes con enfermedad que presentaba expresión baja de HER2, la mediana de SSP fue de 13,2 meses (IC 95 %, 11,4–15,2) en el grupo trastuzumab deruxtecán y 8,1 meses (IC 95 %, 7,0–9,0) en el grupo de quimioterapia (CRI, 0,62; IC 95 %, 0,51–0,74; P < 0,001).[55][Nivel de evidencia B1]
- Se presentaron eventos adversos de grado 3 o superior en el 52,8 % de las pacientes en el grupo de trastuzumab deruxtecán y en el 44,4 % de las pacientes en el grupo de quimioterapia. Se presentó enfermedad pulmonar intersticial en 49 pacientes (11,3 %; 3 eventos fueron de grado 5) y 1 paciente presentó una neumonitis (0,2 %; grado 2).
La selección de este medicamento requiere un examen cuidadoso y la discusión entre el médico y la paciente acerca de los siguientes aspectos: 1) las características biológicas de la enfermedad, 2) la toxicidad del medicamento y los riesgos para el paciente en comparación con otros medicamentos estándar disponibles, 3) el costo del medicamento y la cobertura por parte del seguro de salud.
Cáncer de mama triple negativo metastásico
Quimioterapia e inmunoterapia
El tratamiento estándar de primera línea es la quimioterapia con pembrolizumab para el cáncer de mama triple negativo (TNBC) metastásico con una puntuación positiva combinada (CPS) para el ligando de muerte celular programada 1 (PD-L1) de 10. Esto se evaluó en el ensayo KEYNOTE-355.[56,57]
Pembrolizumab
En el ensayo multinacional aleatorizado controlado con placebo y con enmascaramiento doble de fase III KEYNOTE-355 (NCT02819518) se evaluó la adición de pembrolizumab a la quimioterapia de primera línea en las pacientes con TNBC metastásico. A partir de los resultados de este ensayo, se aprobó esta combinación para el tratamiento en esta población de pacientes.[56,57]
Evidencia (pembrolizumab):
- Las pacientes se asignaron al azar en una proporción 2:1 para recibir pembrolizumab (200 mg cada 3 semanas) y quimioterapia (nab-paclitaxel, paclitaxel o gemcitabina con carboplatino) o placebo y quimioterapia. Se estratificó la aleatorización según el tipo de quimioterapia en estudio (un taxano o gemcitabina con carboplatino), la expresión de PD-L1 al inicio (CPS ≥1 o <1) y el tratamiento previo con la misma clase de quimioterapia en el entorno adyuvante o neoadyuvante (sí o no). Los criterios principales de valoración de eficacia dual fueron la SSP y la SG evaluadas en las poblaciones con CPS de PD-L1 de 10 o más, CPS de PD-L1 de 1 o más y en la población por intención de tratar. De las 847 pacientes asignadas al tratamiento, 566 recibieron pembrolizumab con quimioterapia y 281 recibieron placebo con quimioterapia.[56,57]
- En el segundo análisis interino, la mediana de seguimiento fue de 25,9 meses en el grupo de pembrolizumab con quimioterapia y de 26,3 meses en el grupo de placebo con quimioterapia. Entre las pacientes con CPS de 10 o más, la mediana de SSP fue de 9,7 meses con pembrolizumab y quimioterapia y de 5,6 meses con placebo y quimioterapia (CRIde progresión de la enfermedad o muerte, 0,65; IC 95 %, 0,49–0,86; P unilateral = 0,0012 [se alcanzó el objetivo primario]). Entre las pacientes con CPS de 1 o más, la mediana de SSP fue de 7,6 meses con pembrolizumab y quimioterapia y de 5,6 meses con placebo y quimioterapia (CRI, 0,74; 0,61–0,90; P unilateral = 0,0014 [no significativa]). En la población por intención de tratar, la mediana de SSP fue de 7,5 meses y de 5,6 meses (CRI, 0,82; 0,69–0,97 [no se probó]). El efecto del tratamiento con pembrolizumab aumentó con la concentración de PD-L1.
- A partir de los datos de SSP, la FDA aprobó el uso de pembrolizumab con quimioterapia para el tratamiento de pacientes con TNBC metastásico o recidivante local irresecable cuyos tumores expresan PD-L1 (CPS ≥10).
- En el momento del análisis final, la mediana de seguimiento fue de 44,1 meses. En el grupo con una CPS de al menos 10, la mediana de SG fue de 23 meses en el grupo de pembrolizumab y quimioterapia y de 16,1 meses en el grupo de placebo y quimioterapia (CRI, 0,73; IC 95 %, 0,55–0,95; P bilateral = 0,0185 [significativa]). En el grupo con una CPS de al menos 1, la mediana de supervivencia no se modificó de manera significativa (17,6 vs. 16 meses; P = 0,1125).
- Se presentaron efectos adversos relacionados con el tratamiento de grado 3 a 5 en el 68,1 % de las pacientes del grupo de pembrolizumab y en el 66,9 % de las pacientes del grupo de placebo. Se produjeron 2 muertes en el grupo de pembrolizumab (lesión renal aguda y neumonía). No hubo muertes en el grupo de placebo. En el 5,3 % de las pacientes del grupo de pembrolizumab se presentaron efectos adversos inmunitarios de grado 3 a 4, ninguno de los cuales causó la muerte.
Atezolizumab
La adición de atezolizumab, un anticuerpo contra PD-L1, a la quimioterapia de primera línea para pacientes con cáncer de mama avanzado negativo para receptores hormonales y negativo para HER2 se evaluó en el ensayo aleatorizado controlado con placebo de fase III IMpassion130 (NCT02425891).[58,59] Las participantes (n = 902) se asignaron al azar en una proporción 1:1 para recibir atezolizumab y paclitaxel unido nanopartículas de albúmina (nab-paclitaxel) o placebo y nab-paclitaxel. Las pacientes se estratificaron de acuerdo con la presencia de metástasis hepáticas (sí o no), el tratamiento previo con taxanos (sí o no) y el estado de PD-L1 (positivo o negativo). La expresión de PD-L1 del 1 % o más se consideró como positiva. Los criterios coprimarios de valoración fueron la SSP y la SG, ambos evaluados en la población por intención de tratar y en la población con resultado positivo para PD-L1 (n = 369).
A partir de la publicación inicial de los datos sobre la SSP del ensayo IMPassion130, la FDA otorgó la aprobación acelerada para el uso del atezolizumab en combinación con paclitaxel fijado a una proteína para las pacientes con TNBC metastásico o localmente avanzado irresecable cuyos tumores expresan PD-L1. Sin embargo, en un análisis final de 2021, no se observó ningún beneficio para la SG en la población por intención de tratar.[58,59]
En el ensayo aleatorizado controlado con placebo con enmascaramiento doble de fase III, IMpassion131 (NCT03125902), se estudió el paclitaxel con atezolizumab o sin este como tratamiento de primera línea para pacientes con TNBC metastásico o localmente avanzado irresecable. Se incluyó 651 pacientes, el 45 % presentaban TNBC positivo para PD-L1. En este ensayo tampoco se observó beneficio de la adición del atezolizumab al régimen con paclitaxel en esta población.[60] En consecuencia, el patrocinador retiró de forma voluntaria esta aprobación.
- En el IMpassion130 se notificaron datos de SSP con una mediana de seguimiento de 12,9 meses.[58]
- En la población por intención de tratar, la SSP mejoró con la adición de atezolizumab (mediana de SSP, 7,2 vs. 5,5 meses; CRI, 0,80; IC 95 %, 0,69–0,92; P = 0,0025).
- En la población con resultado positivo para PD-L1, la SSP mejoró con la adición de atezolizumab (mediana de SSP, 7,5 vs. 5 meses; CRI, 0,62; IC 95 %, 0,49–0,78; P < 0,001).
- Se presentaron eventos adversos según lo esperado. Los eventos adversos potencialmente inmunitarios fueron más frecuentes en el grupo de atezolizumab.
- En el análisis primario de la SSP para el ensayo IMpassion131, se reveló que añadir atezolizumab al régimen con paclitaxel no mejoró la SSP evaluada por el investigador en la población con resultado positivo para PD-L1. La mediana de SSP fue de 6,0 meses para las pacientes que recibieron atezolizumab y paclitaxel en comparación con 5,7 meses para las pacientes que recibieron placebo y paclitaxel (CRI, 0,82; IC 95 %, 0,60–1,12; P = 0,20).[60]
- En los resultados finales para la SG no se observó diferencia entre los grupos de tratamiento. La mediana de SG fue de 22,1 meses para las pacientes que recibieron atezolizumab y paclitaxel en comparación con 28,3 meses para las pacientes que recibieron placebo y paclitaxel en la población con resultado positivo para PD-L1 (CRI, 1,11; IC 95 %, 0,76–1,64).
- Los resultados de la población por intención de tratar fueron congruentes con los de la población con resultado positivo para PD-L1. El perfil de inocuidad fue congruente con los efectos conocidos para cada fármaco en estudio.
Sacituzumab govitecán
El Sacituzumab govitecán es un conjugado anticuerpo-fármaco que combina un anticuerpo contra TROP2 con un metabolito activo del irinotecán (SN-38). TROP2 es un transductor transmembranario de señales de calcio con expresión alta en el TNBC. La incorporación del sacituzumab govitecán unido a TROP2 introduce el SN-38 en la célula tumoral mediante la hidrólisis del enlace.[51]
Evidencia (sacituzumab govitecán):
- En un ensayo de fase I/II, 108 mujeres con TNBC que habían recibido por lo menos 2 regímenes de quimioterapia (mediana, 3) se trataron con sacituzumab govitecán en dosis intravenosas de 10 mg/kg los días 1 y 8 de un ciclo de 21 días.[61][Nivel de evidencia C3]
- Se observó una tasa de respuesta del 33,3 % (IC 95 %, 24,6–43,1 %).
- La mediana de duración de la respuesta fue de 7,7 meses (IC 95 %, 4,9–10,8).
- El efecto tóxico principal fue neutropenia y se presentaron 4 muertes durante el tratamiento.[61][Nivel de evidencia C3]
- La FDA otorgó la aprobación acelerada para el uso del sacituzumab govitecán en pacientes con TNBC metastásico después de recibir por lo menos de 2 líneas previas de tratamiento.
- En un ensayo aleatorizado de fase III (ASCENT [NCT02574455]) se confirmó la eficacia del sacituzumab govitecán en pacientes con TNBC metastásico en recaída o resistente al tratamiento después de recibir 2 o más regímenes de quimioterapia previos. Se asignaron al azar a 468 mujeres sin metástasis encefálicas para recibir sacituzumab govitecán o la monoquimioterapia elegida por el médico (eribulina, vinorelbina, capecitabina o gemcitabina). El criterio principal de valoración fue la SSP. Todas las pacientes habían recibido taxanos en el pasado. Las pacientes recibieron sacituzumab govitecán en una dosis de 10 mg/kg intravenosa los días 1 y 8 de cada ciclo de 21 días.[62]
- En el grupo de quimioterapia, el 54 % de las pacientes recibieron eribulina, el 20 % vinorelbina, el 13 % capecitabina y el 12 % gemcitabina.
- La mediana de SSP fue de 5,6 meses (IC 95 %, 4,3–6,3; 166 episodios) en el grupo de sacituzumab govitecán y de 1,7 meses (IC 95 %, 1,5–2,6; 150 episodios) en el grupo de quimioterapia (CRIde progresión de la enfermedad o muerte, 0,41; IC 95 %, 0,32–0,52; P < 0,001).[62][Nivel de evidencia A1]
- La mediana de SG fue de 12,1 meses (IC 95 %, 10,7–14,0) en el grupo de sacituzumab govitecán y de 6,7 meses (IC 95 %, 5,8–7,7) en el grupo de quimioterapia (CRIde muerte, 0,48; IC 95 %, 0,38–0,59; P < 0,001).
- La tasa de respuesta general fue del 35 % en el grupo de sacituzumab govitecán y del 5 % en el grupo de quimioterapia.
- Los eventos adversos importantes relacionados con el tratamiento de grado 3 o superior se presentaron con mayor frecuencia en las pacientes que recibieron sacituzumab govitecán que en las que recibieron quimioterapia: neutropenia (51 vs. 33 %), leucopenia (10 vs. 5 %), diarrea (10 vs. <1 %), anemia (8 vs. 5 %) y neutropenia febril (6 vs. 2 %).
Terapia con inhibidores de la poli-(ADP-ribosa)–polimerasa
Las pacientes con TNBC y una variante patogénica germinal del gen BRCA son aptas para recibir terapia con inhibidores de la poli-(ADP-ribosa)–polimerasa (PARP). Para obtener más información, consultar la sección Cáncer de mama metastásico con mutación germinal en el gen BRCA.
Quimioterapia
La quimioterapia a veces es apropiada para las pacientes con TNBC. Para obtener más información, consultar la sección Quimioterapia para el cáncer de mama metastásico.
Inmunoterapia en monoterapia
Hasta la fecha, la inmunoterapia en monoterapia no ha demostrado beneficio en la SG de pacientes con TNBC metastásico.
Evidencia (pembrolizumab):
- En el ensayo internacional multicéntrico aleatorizado sin enmascaramiento de fase III, KEYNOTE-119 (NCT02555657), participaron pacientes con TNBC metastásico. Las pacientes habían recibido 1 o 2 tratamientos sistémicos previos para la enfermedad metastásica además de una antraciclina o un taxano. Se asignaron al azar a 622 pacientes para recibir 200 mg de pembrolizumab intravenoso una vez cada 3 semanas por 35 ciclos (grupo de pembrolizumab), o la monoquimioterapia elegida por el investigador (capecitabina, eribulina, gemcitabina o vinorelbina). El criterio principal de valoración fue la SG según se evaluó en cada uno de los siguientes grupos: pacientes con una CPS de PD-L1 de 10 o más, pacientes con una CPS de 1 o más y todas las pacientes.[63]
- En las pacientes con una CPS de PD-L1 de 10 o más, la mediana de SG fue de 12,7 meses (IC 95 %, 9,9–16,3) en el grupo de pembrolizumab y de 11,6 meses (IC 95 %, 8,3-13,7) en el grupo de quimioterapia (CRI, 0,78; IC 95 %, 0,57–1,06; P del orden logarítmico = 0,057).[63][Nivel de evidencia A1]
- En las pacientes con CPS de 1 o más, la mediana de SG fue de 10,7 meses (IC 95 %, 9,3–12,5) en el grupo de pembrolizumab y de 10,2 meses (IC 95 %, 7,9–12,6) en el grupo de quimioterapia (CRI, 0,86; IC 95 %, 0,69–1,06; P del orden logarítmico = 0,073).
- Entre todas las pacientes, la mediana de SG fue de 9,9 meses (IC 95 %, 8,3–11,4) en el grupo de pembrolizumab y de 10,8 meses (IC 95 %, 9,1–12,6) en el grupo de quimioterapia (CRI, 0,97; IC 95 %, 0,82–1,15).
Cáncer de mama positivo para HER2 metastásico
Desde la década de 1990 se utiliza la terapia con anticuerpos dirigidos a la vía HER2 que ha revolucionado el tratamiento del cáncer de mama metastásico positivo para HER2. Se han aprobado varios fármacos dirigidos a HER2 (por ejemplo, trastuzumab, pertuzumab, trastuzumab emtansina y lapatinib) para tratar esta enfermedad.
Terapia con anticuerpos monoclonales
Trastuzumab
Alrededor del 20 % al 25 % de las pacientes con cáncer de mama tienen tumores que sobreexpresan HER2.[64] El trastuzumab es un anticuerpo monoclonal humanizado que se une al receptor HER2.[64] En las pacientes tratadas antes con quimioterapia citotóxica cuyos tumores sobreexpresaban HER2, la administración de trastuzumab en monoterapia produjo una tasa de respuesta del 21 %.[65][Nivel de evidencia C3]
Evidencia (trastuzumab):
- En un ensayo de fase III, se asignaron al azar pacientes con enfermedad metastásica para recibir quimioterapia sola (doxorrubicina y ciclofosfamida o paclitaxel) o la misma quimioterapia y trastuzumab.[66][Nivel de evidencia A1]
- Las pacientes tratadas con quimioterapia y trastuzumab tuvieron una ventaja en la SG en comparación con los que recibieron quimioterapia sola (25,1 vs. 20,3 meses, P = 0,05).[66][Nivel de evidencia A1]
Cabe destacar, que cuando el trastuzumab se combina con la doxorrubicina produce toxicidad cardíaca significativa.[67]
En los ensayos clínicos en los que se comparó una quimioterapia multifarmacológica con trastuzumab y una monoquimioterapia, se obtuvieron resultados contradictorios.
- En un estudio aleatorizado de pacientes con cáncer de mama metastásico tratadas con trastuzumab, paclitaxel y carboplatino, las pacientes toleraron bien la combinación y se demoraron más en presentar una progresión de la enfermedad en comparación con las que recibieron trastuzumab o paclitaxel en monoterapia.[68][Nivel de evidencia B1]
- Sin embargo, no se observaron diferencias en la SG, el tiempo transcurrido hasta la progresión o la tasa de respuesta en el ensayo de fase III del Breast Cancer International Research Group (BCIRG-007 [NCT00047255]) en el que se comparó carboplatino, docetaxel y trastuzumab con docetaxel y trastuzumab como quimioterapia de primera línea para el cáncer de mama metastásico con sobreexpresión de HER2.[69][Nivel de evidencia A1]
Fuera del entorno de un ensayo clínico, el tratamiento estándar de primera línea para el cáncer de mama metastásico con sobreexpresión de HER2 es la monoquimioterapia y trastuzumab.
Pertuzumab
El pertuzumab es un anticuerpo monoclonal humanizado que se une a un epítopo del dominio extracelular de HER2 diferente al epítopo al que se une el trastuzumab. La unión del pertuzumab a HER2 previene la dimerización de este con otros receptores HER activados por ligandos, sobre todo con HER3.
Evidencia (pertuzumab):
- En el estudio de fase III CLEOPATRA (NCT00567190), se evaluó la eficacia e inocuidad de pertuzumab, trastuzumab y docetaxel versus placebo, trastuzumab y docetaxel en el entorno de tratamiento de primera línea de un cáncer metastásico positivo para HER2[70,71][Nivel de evidencia A1]
- Al cabo de una mediana de seguimiento de 50 meses, la mediana de SG fue de 40,8 meses en el grupo de control versus 56,5 meses en el grupo de pertuzumab (CRI a favor del grupo de pertuzumab, 0,68; IC 95 %, 0,56–0,84; P < 0,001). La mediana de SSP según la evaluación del investigador mejoró en 6,3 meses con la adición de pertuzumab (CRI, 0,68; IC 95 %, 0,58–0,80).
- La mediana de SG fue de 56,5 meses en el grupo de pertuzumab comparada con 40,8 meses en el grupo de placebo (CRI, 0,68; IC 95 %, 0,57–0,84; P < 0,001).[71] Las tasas de SG de referencia a 8 años fueron del 37 % con la adición de pertuzumab, en comparación con el 23 % del grupo de placebo.[72]
- El perfil de toxicidad fue similar en ambos grupos de tratamiento, sin aumento de los efectos cardiotóxicos en el grupo de combinación con pertuzumab.
Trastuzumab emtansina
El trastuzumab emtansina (T-DM1) es un conjugado anticuerpo-fármaco que incorpora las propiedades antitumorales dirigidas a HER2 del trastuzumab con la actividad citotóxica del inhibidor de microtúbulos DM1. T-DM1 permite el transporte de fármacos intracelulares específicos a las células que sobreexpresan HER2, lo que quizás mejore el índice terapéutico y disminuya la exposición del tejido normal.
Evidencia ( trastuzumab emtansina):
- En el estudio aleatorizado sin enmascaramiento de fase III EMILIA o TDM4370g (NCT00829166) participaron 991 pacientes con cáncer de mama irresecable, localmente avanzado o metastásico y con sobreexpresión de HER2, que habían recibido tratamiento previo con trastuzumab y un taxano.[73][Nivel de evidencia A1] Las pacientes se asignaron al azar para recibir T-DM1 o lapatinib y capecitabina.
- La mediana de SSP fue de 9,6 meses con T-DM1 versus 6,4 meses con lapatinib y capecitabina (CRI, 0,65; IC 95 %, 0,55–0,77; P < 0,001).
- La mediana de SG fue más larga con T-DM1 versus lapatinib y capecitabina (29,9 vs. 25,9 meses; CRI, 0,75 [IC 95 %, 0,64–0,88]).[74]
- La incidencia de trombocitopenia y el aumento de las concentraciones séricas de aminotransferasa fueron más altas en las pacientes que recibieron T-DM1, mientras que la incidencia de diarrea, náuseas, vómitos y eritrodisestesia palmoplantar fue más alta en las pacientes que recibieron lapatinib y capecitabina.
- Se obtuvo evidencia adicional de la actividad de T-DM1 en el cáncer de mama metastásico con sobreexpresión de HER2 en un estudio aleatorizado de fase II de tratamiento con T-DM1 versus trastuzumab y docetaxel.[75][Nivel de evidencia B1] En este ensayo del entorno de tratamiento de primera línea para la enfermedad metastásica, se asignaron al azar 137 mujeres de cáncer de mama con sobreexpresión de HER2.
- Al cabo de una mediana de seguimiento de 14 meses, la mediana de SSP fue de 9,2 meses en el grupo de trastuzumab y docetaxel y de 14,2 meses en el grupo de T-DM1 (CRI, 0,59; IC 95 %, 0,36–0,97).
- Los resultados preliminares de SG fueron similares en los grupos de tratamiento.
- El T-DM1 exhibió un perfil de inocuidad más favorable que la combinación de trastuzumab y docetaxel, con menos eventos adversos de grado 3 (46,4 vs. 90,9 %), menos eventos adversos que condujeran a la interrupción del tratamiento (7,2 vs. 40,9 %) y menos eventos adversos graves (20,3 vs. 25,8 %).
- También se mostró evidencia de la actividad de T-DM1 en pacientes que recibieron tratamiento intensivo previo para el cáncer de mama metastásico con sobreexpresión de HER2 tratadas con trastuzumab y lapatinib, en el estudio aleatorizado de fase III, TH3RESA (NCT01419197) de T-DM1 versus el tratamiento elegido por el médico.[76][Nivel de evidencia A1] En este ensayo se asignó al azar a 602 pacientes en una proporción 2:1 (404 pacientes a T-DM1 y 198 pacientes al tratamiento elegido por el médico) y se permitió el cambio a T-DM1.
- Al cabo de una mediana de seguimiento de 7,2 meses en el grupo de T-DM1 y de 6,5 meses en el grupo de tratamiento elegido por el médico, la mediana de SSP fue de 6,2 meses en el grupo de T-DM1 y de 3,3 meses en el grupo de tratamiento elegido por el médico (CRI, 0,528; IC 95 %, 0,422–0,661; P < 0,0001).
- La SG fue significativamente más prolongada con trastuzumab emtansina versus el tratamiento elegido por el médico (mediana de SG, 22,7 vs. 15,8 meses; CRI, 0,68; IC 95 %, 0,54–0,85; P = 0,0007).[77]
- La función de T-DM1 como tratamiento de primera línea para el cáncer de mama metastásico con sobreexpresión de HER2 se evaluó en el ensayo de fase III MARIANNE (NCT01120184).[78][Nivel de evidencia B1] En este estudio se asignó al azar a 1095 pacientes para recibir trastuzumab y un taxano, T-DM1 y placebo, o T-DM1 y pertuzumab.
- La mediana de SSP para estos grupos de tratamiento fue de 13,7 meses en el grupo de trastuzumab y un taxano, de 14,1 meses en el grupo de T-DM1 y placebo, y de 15,2 meses en el grupo de T-DM1 y pertuzumab.
- No hubo diferencia significativa de la SSP en el grupo de T-DM1 y placebo en comparación con el grupo de trastuzumab y un taxano (CRI, 0,91; IC 97,5 %, 0,73–1,13), ni en el grupo de T-DM1 y pertuzumab en comparación con el grupo de trastuzumab y un taxano (CRI, 0,87; IC 97,5 %, 0,69–1,08).
- Por lo tanto, ni el tratamiento con T-DM1 y placebo ni el de T-DM1 y pertuzumab mostraron superioridad para la SSP sobre el tratamiento con trastuzumab y un taxano.
Trastuzumab deruxtecán
El trastuzumab deruxtecán es un conjugado anticuerpo-fármaco que combina el trastuzumab con un inhibidor de la topoisomerasa. Se ha demostrado la actividad antitumoral de este medicamento en pacientes con cáncer de mama positivo para HER2 en estadio avanzado.
Evidencia (trastuzumab deruxtecán):
- En un ensayo aleatorizado multicéntrico de fase III, sin enmascaramiento (DESTINY-Breast03 [NCT03529110]), se comparó la eficacia y la inocuidad del trastuzumab deruxtecán con el trastuzumab emtansina. En el estudio participaron 524 pacientes con cáncer de mama metastásico positivo para HER2 que se trataron previamente con un taxano y trastuzumab. La SSP fue el criterio principal de valoración.[79]
- A los 12 meses, el 75,8 % de las pacientes que recibieron trastuzumab deruxtecán estaban vivas sin progresión de la enfermedad, en comparación con el 34,1 % de las pacientes que recibieron trastuzumab emtansina (CRI, 0,28; IC 95 %, 0,22–0,37; P < 0,001).
- Los criterios secundarios de valoración fueron la SG, la tasa de respuesta general y la inocuidad. El 94,1 % de las pacientes que recibieron trastuzumab deruxtecán estaban vivas a los 12 meses, en comparación con el 85,9 % de las pacientes que recibieron trastuzumab emtansina (CRIde muerte, 0,55; IC 95 %, 0,36–0,86). La tasa de respuesta general favoreció al trastuzumab deruxtecán y fue del 79,7 % versus el 34,2 %. Se presentaron efectos adversos relacionados con el fármaco de grado 3 a 4 en el 45,1 % de las pacientes que recibieron trastuzumab deruxtecán y en el 38,9 % de las pacientes que recibieron trastuzumab emtansina. La enfermedad pulmonar intersticial y la neumonitis se presentaron en el 10,5 % de las pacientes que recibieron trastuzumab deruxtecán y en el 1,9 % de las pacientes que recibieron trastuzumab emtansina; ninguno de estos eventos fue de grado 4 a 5.
En este ensayo se produjo un cambio en el tratamiento estándar de las pacientes con cáncer de mama metastásico positivo para HER2, de tal forma que las pacientes con tratamiento previo con un taxano y trastuzumab recibieron trastuzumab deruxtecán, en lugar de trastuzumab emtansina, como tratamiento de segunda línea.
Margetuximab
El margetuximab es un anticuerpo monoclonal inmunoglobulina G anti-HER2 modificado en la región Fc que se dirige al mismo epítopo que el trastuzumab, con efectos antiproliferativos similares. En comparación con el trastuzumab, el margetuximab se diseñó para aumentar la afinidad de unión (in vitro) para el receptor Fcγ activador y disminuir la afinidad de unión para el receptor Fcγ inhibidor.
Evidencia (margetuximab):
- El análisis primario de la SSP del estudio SOPHIA de fase III (NCT02492711) llevó a que la FDA aprobara el uso de margetuximab con quimioterapia en pacientes con cáncer de mama metastásico positivo para HER2 que recibieron al menos 2 regímenes anti-HER2 previos, uno de ellos para la enfermedad metastásica. En el ensayo sin enmascaramiento SOPHIA se asignó al azar a 536 pacientes de la población por intención de tratar para recibir margetuximab o trastuzumab. Ambos grupos recibieron la quimioterapia elegida por el investigador (capecitabina, eribulina, gemcitabina o vinorelbina). Las pacientes aptas habían presentado progresión de la enfermedad después de 2 o más tratamientos anti-HER2 previos y de 1 a 3 líneas de tratamiento para la enfermedad metastásica. Todas las pacientes habían recibido trastuzumab, todas menos 1 habían recibido pertuzumab y el 91,2 % había recibido ado-trastuzumab emtansina. Los criterios principales de valoración secuenciales fueron la SSP evaluada mediante revisión central, seguida de la SG.[80,81][Nivel de evidencia B1]
- El margetuximab mejoró la SSP primaria en comparación con el trastuzumab con una reducción del riesgo relativo del 24 % (CRI, 0,76; IC 95 %, 0,59–0,98; P= 0,03) (mediana de SSP, 5,8 vs. 4,9 meses, que favoreció al margetuximab).
- La mediana de seguimiento fue de 20,2 meses. La mediana de SG en la población por intención de tratar no fue estadísticamente diferente entre los 2 grupos de tratamiento: de 21,6 meses en el grupo de margetuximab y de 21,9 meses en el grupo de trastuzumab (CRI, 0,95; IC 95 %, 0,77–1,17; P = 0,620).
- Los efectos adversos de grado 3 o superior que se presentaron en al menos el 5 % de las pacientes incluyeron disminución del recuento de neutrófilos y anemia en ambos grupos, fatiga en el grupo de margetuximab y neutropenia febril en el grupo de trastuzumab.
Terapia con inhibidor de tirosina–cinasas
La FDA aprobó varios inhibidores de tirosina–cinasas (ITC) para el cáncer de mama metastásico positivo para HER2.
Tucatinib
El tucatinib es un ITC de administración oral que es muy selectivo para el dominio cinasa de HER2 e inhibe muy poco el receptor del factor de crecimiento epidérmico. En un ensayo de fase Ib con pacientes que habían recibido tratamiento previo se demostró actividad cuando el tucatinib se combinó con trastuzumab y capecitabina.
Evidencia (tucatinib):
- En el ensayo HER2CLIMB (NCT02614794) se comparó trastuzumab, capecitabina y tucatinib con trastuzumab, capecitabina y placebo en 632 pacientes que habían recibido tratamiento con trastuzumab, pertuzumab y trastuzumab emtansina. Las pacientes tenían un estado funcional de 0 a 1 del Eastern Cooperative Oncology Group (ECOG). Se incluyó a pacientes con metástasis encefálicas y sin estas. El criterio principal de valoración fue la SSP.[82][Nivel de evidencia A1]
- La mediana de SSP de 7,8 meses en el grupo de combinación de tucatinib y de 5,6 meses en el grupo de combinación con placebo (CRI, 0,54; IC 95 %, 0,42–0,71; P < 0,001).
- En un análisis interino que se llevo a cabo al mismo tiempo que el análisis de la SSP, la mediana de SG fue de 21,9 meses en el grupo de combinación de tucatinib y de 17,4 meses en el grupo de combinación con placebo (CRI, 0,66; IC 95 %, 0,50–0,88; P = 0,005).
- Las pacientes con metástasis encefálicas y sin estas se beneficiaron de la combinación de tucatinib.
- Los eventos adversos de grado 3 incluyeron diarrea, síndrome de eritrodisestesia palmoplantar y concentraciones altas de aminotransferasa, y fueron más comunes en el grupo de combinación de tucatinib, pero se presentaron en menos del 15 % de las pacientes.
Neratinib
El neratinib es un ITC irreversible pan-HER (HER1, HER2, y HER4), aprobado para usarse en combinación con capecitabina en pacientes con cáncer de mama avanzado o metastásico positivo para HER2 después de recibir 2 o más regímenes previos a base de un anti-HER2 en el entorno metastásico.
Evidencia (neratinib):
- En el ensayo de fase III NALA (NCT01808573), se comparó neratinib y capecitabina con lapatinib y capecitabina en 621 pacientes con cáncer de mama metastásico positivo para HER2 que recibieron 2 o más regímenes dirigidos a HER2 en el entorno metastásico. Los criterios coprimarios de valoración fueron la SSP y la SG. Los criterios secundarios de valoración fueron el tiempo hasta la intervención por enfermedad metastásica en el sistema nervioso central (SNC) y la duración de la respuesta. Se incluyeron pacientes con enfermedad en el SNC estable o asintomática.[83][Nivel de evidencia B1]
- Las pacientes que recibieron neratinib y capecitabina tuvieron una mejora significativa de la SSP (CRI, 0,76; IC 95 %, 0,63–0,93). La SG no difirió entre los 2 grupos.
- La incidencia acumulada de intervención por enfermedad en el SNC fue del 22,8 % (IC 95 %, 15,5–30,9 %) para las pacientes que recibieron neratinib versus el 29,2 % (IC 95 %, 22,5–36,1 %) para las pacientes que recibieron lapatinib.
- La duración de la respuesta fue de 8,5 meses para las pacientes que recibieron neratinib versus 5,6 meses para las que recibieron lapatinib.
- Los eventos adversos más frecuentes fueron diarrea, náuseas, eritrodisestesia palmoplantar y vómitos; la diarrea de grado 3 se presentó en el 24,4 % de las pacientes que recibieron neratinib. La administración de medicamentos antidiarreicos fue necesaria en el grupo de neratinib; el 98,3 % de las pacientes los usaron.
- Los puntajes de calidad de vida fueron similares en ambos grupos.
Lapatinib
El lapatinib es un ITC de HER2 y del receptor del factor de crecimiento epidérmico que se administra por vía oral. La combinación de lapatinib y capecitabina demostró actividad en pacientes con cáncer de mama metastásico positivo para HER2 que progresó después del tratamiento con trastuzumab.
Evidencia (lapatinib):
- En un ensayo aleatorizado sin enmascaramiento (GSK-EGF100151 [NCT00078572]), se comparó la combinación de capecitabina y lapatinib con capecitabina sola en 324 pacientes con enfermedad localmente avanzada o metastásica que progresó después de tratamientos que incluyeron antraciclinas, taxanos y trastuzumab.[84][Nivel de evidencia A1]
- La mediana del tiempo transcurrido hasta la progresión en el grupo de lapatinib y capecitabina fue de 8,4 meses en comparación con 4,4 meses en el grupo de capecitabina sola (CRI, 0,49; IC 95 %, 0,34–0,71; P < 0,001).
- No hubo diferencia en la SG (CRI, 0,92; IC 95 %, 0,58–1,46; P = 0,72).[84][Nivel de evidencia A1]
- Fue más probable que las pacientes que recibieron terapia combinada presentaran diarrea, exantemas y dispepsia. Para obtener más información, consultar la sección Diarrea en Complicaciones gastrointestinales.
- No se dispone de datos sobre la calidad de vida o el tratamiento después de la progresión de la enfermedad.
Inhibición del blanco de la rapamicina en los mamíferos
En el ensayo con enmascaramiento doble y controlado con placebo de fase III, BOLERO-3 (NCT01007942) se obtuvo evidencia de la actividad de la inhibición del blanco de la rapamicina en los mamíferos (mTOR) en el cáncer de mama positivo para HER2.[85]
- En este ensayo, 569 pacientes con cáncer de mama positivo para HER2 resistente al trastuzumab que antes habían recibido terapia con un taxano, se asignaron al azar para recibir everólimus, trastuzumab y vinorelbina, o placebo, trastuzumab y vinorelbina.[85][Nivel de evidencia B1]
- Al cabo de una mediana de seguimiento de 20,2 meses, la mediana de SSP fue de 7,0 meses en el grupo de everólimus versus 5,78 meses en el grupo de placebo (CRI, 0,78; IC 95 %, 0,65–0,95; P = 0,0067).
- Se notificaron eventos adversos graves en 117 pacientes (42 %) del grupo de everólimus y en 55 pacientes (20 %) del grupo de placebo.
- Los resultados finales de la SG de este ensayo todavía no se han notificado.
Cáncer de mama metastásico con mutación germinal en el gen BRCA
En las pacientes con cáncer de mama metastásico portadoras de variantes patogénicas germinales de los genes BRCA1 o BRCA2, se observó actividad de los inhibidores de PARP administrados por vía oral. El BRCA1 y el BRCA2 son genes supresores de tumores que codifican proteínas que participan en la reparación del DNA (mediante la vía de reparación por recombinación homóloga). La PARP cumple una función clave en la reparación del DNA y se ha estudiado como tratamiento para pacientes con cáncer de mama que albergan variantes germinales de los genes BRCA1 o BRCA2.
Olaparib
Evidencia (olaparib):
- En el ensayo aleatorizado sin enmascaramiento de fase III OlympiAD (NCT02000622), se asignó al azar a 302 pacientes, en una proporción 2:1, para recibir olaparib (300 mg 2 veces al día) o terapia estándar (con capecitabina, eribulina o vinorelbina en monoterapia).[86] Todas las pacientes habían recibido antraciclinas y taxanos antes en el entorno adyuvante o metastásico, y aquellas con enfermedad positiva para receptores hormonales también se habían tratado con terapia endocrina previa.
- La mediana de SSP fue significativamente más prolongada en el grupo de olaparib que en el grupo de terapia estándar (7,0 vs. 4,2 meses. CRIde progresión de la enfermedad o muerte, 0,58; IC 95 %, 0,43–0,80; P < 0,001).[86][Nivel de evidencia A1]
- La SG no difirió entre los 2 grupos de tratamiento según la mediana de tiempo transcurrido hasta la muerte (CRIde muerte, 0,90; IC 95 %, 0,63–1,29; P = 0,57).
- El olaparib fue menos tóxico que la terapia estándar, la tasa de eventos adversos de grado 3 o superior fue del 36,6 % en el grupo de olaparib y del 50,5 % en el grupo de terapia estándar; el grupo de olaparib presentó con mayor frecuencia anemia, náuseas, vómitos, fatiga, cefalea y tos; el grupo de quimioterapia presentó con mayor frecuencia neutropenia, eritrodisestesia palmoplantar y anomalías en las pruebas de funcionamiento hepático.
- Se destaca que, en el análisis de subgrupos, se indicó que la mejora de la SSP con el olaparib fue mayor en el subgrupo de TNBC (CRI, 0,43; IC 95 %, 0,29–0,63) que en el subgrupo de cáncer de mama positivo para receptores hormonales (CRI, 0,82; IC 95 %, 0,55–1,26).
Talazoparib
Evidencia (talazoparib):
- En el ensayo aleatorizado sin enmascaramiento de fase IIIEMBRACA (NCT01945775) se asignó a 431 pacientes con cáncer de mama localmente avanzado o metastásico y variantes patogénicas germinales de los genes BRCA1 o BRCA2 en una proporción 2:1 para recibir talazoparib (1 mg VO cada día) o la monoquimioterapia estándar elegida por el médico (eribulina, capecitabina, gemcitabina o vinorelbina).[87] Todas las pacientes habían recibido tratamiento previo con una antraciclina, un taxano o ambos. Las pacientes habían recibido 3 o menos líneas de quimioterapia citotóxica para el cáncer de mama avanzado. Se permitió la participación de pacientes que se habían tratado antes con terapia a base de derivados del platino para un cáncer de mama en estadio temprano si esta terapia se había completado por lo menos 6 meses antes de la progresión de la enfermedad, o si no se identificaba de manera objetiva progresión de la enfermedad durante el tratamiento con derivados del platino para una enfermedad avanzada. Participaron pacientes con cáncer de mama positivo o negativo para receptores hormonales.
- La mediana de SSP fue significativamente más prolongada en el grupo de talazoparib que en el grupo de terapia estándar (8,6 vs. 5,6 meses; CRIde progresión de la enfermedad o muerte, 0,54; IC 95 %, 0,41–0,71; P < 0,001).
- Se observaron beneficios en todos los subgrupos, aunque los IC fueron amplios en el subgrupo de pacientes que había recibido antes terapia con derivados del platino.
- La mediana de SG no difirió entre los 2 grupos (22,3 vs. 19,5 meses, CRIde muerte, 0,76; IC 95 %, 0,55–1,06; P = 0,11), aunque los datos de supervivencia no son definitivos.
- El principal efecto tóxico observado con talazoparib fue mielodepresión, en especial, anemia.
- En los datos de desenlaces notificados por las pacientes se observaron más efectos favorables en las mediciones de calidad de vida con el talazoparib que con la quimioterapia estándar.[88]
Para obtener más información en inglés, consultar Genetics of Breast and Gynecologic Cancers.
Cáncer de mama con carga mutacional del tumor alta
Un biomarcador establecido para la inmunoterapia con inhibidores de puntos de control es la carga mutacional del tumor (TMB) somática alta. La TMB es el número de mutaciones en la región codificante del genoma tumoral y se notifica como mutaciones por megabase (Mut/Mb). La TMB es alta (≥10) en aproximadamente el 5 % de los cánceres de mama.[89] La mediana más alta de TMB se observa en los tumores triple negativos y la mediana más baja de TMB se observa en las pacientes con tumores positivos para ER y negativos para HER2.
Pembrolizumab
Evidencia (pembrolizumab):
- A partir del ensayo KEYNOTE-158, la FDA aprobó el pembrolizumab para el tratamiento de tumores sólidos metastásicos con una TMB de al menos 10 Mut/Mb.[90]
- El KEYNOTE-158 (NCT02628067) fue un estudio multinacional multicohorte no aleatorizado y sin enmascaramiento de fase II. Las pacientes presentaban neoplasias malignas sólidas metastásicas, para las que habían recibido al menos una línea de tratamiento anterior. Las participantes recibieron 200 mg de pembrolizumab intravenoso cada 3 semanas durante un máximo de 35 ciclos. La TMB se evaluó en muestras tumorales fijadas en formol e incluidas en parafina mediante la prueba FoundationOne CDX. Un total de 105 de 805 pacientes evaluables presentaron una TMB alta (≥10 Mut/Mb).
- El criterio principal de valoración fue la tasa de respuesta objetiva. Se observaron respuestas objetivas en 30 de 102 pacientes (29 %) en el grupo de TMB alta y en 43 de 688 pacientes (6 %) en el grupo que no tenía una TMB alta. Se presentaron efectos adversos relacionados con el tratamiento de grado 3 a 5 en 16 pacientes. Una paciente murió por neumonía, y el investigador consideró que estaba relacionada con el tratamiento.
- El estudio TAPUR (NCT02693535) fue un ensayo en cesta de fase II que se hizo para identificar la eficacia de los fármacos dirigidos disponibles comercialmente en pacientes con cánceres avanzados y alteraciones genómicas conocidas por ser dianas farmacológicas. Se notificaron resultados del ensayo TAPUR de pacientes con cáncer de mama metastásico y TMB alta. El criterio principal de valoración fue el control de la enfermedad (respuesta objetiva o enfermedad estable durante ≥16 semanas).[91][Nivel de evidencia C3]
- En el estudio participaron 28 pacientes con cáncer de mama metastásico y TMB alta. La TMB osciló entre 9 y 37 Mut/Mb.
- El control de la enfermedad se observó en el 37 % de las pacientes, y la respuesta objetiva se observó en el 21 % de las pacientes.
- La mediana de SSP fue de 10,6 meses y la mediana de SG fue de 30,6 meses.
Quimioterapia para el cáncer de mama metastásico
Las pacientes que estén recibiendo terapia hormonal y presenten progresión tumoral son aptas para recibir quimioterapia citotóxica. No se dispone de datos que indiquen que la terapia combinada produzca un beneficio para la SG en comparación con un régimen de monoterapia. Las pacientes con tumores negativos para receptores hormonales y aquellas con metástasis viscerales o enfermedad sintomática también son aptas para recibir citotóxicos.[92]
Los fármacos que han demostrado actividad en monoterapia para el cáncer de mama metastásico son los siguientes:
- Antraciclinas.
- Taxanos.
- Alquilantes.
- Ciclofosfamida.
- Fluoropirimidinas.
- Antimetabolitos.
- Metotrexato.
- Alcaloides de vinca.
- Vinorelbina.[104]
- Vinblastina.
- Vincristina.
- Derivados del platino.
- Carboplatino.
- Cisplatino.
- Otros fármacos.
Los regímenes combinados que han demostrado actividad para el cáncer de mama metastásico son los siguientes:
- AC: doxorrubicina y ciclofosfamida.[109]
- EC: epirrubicina y ciclofosfamida.[110]
- Docetaxel y doxorrubicina.[111]
- CAF: ciclofosfamida, doxorrubicina y 5-FU.[112]
- CMF: ciclofosfamida, metotrexato y 5-FU.[113]
- Doxorrubicina y paclitaxel.[114,115]
- Docetaxel y capecitabina.[116]
- Vinorelbina y epirrubicina.[117]
- Capecitabina e ixabepilona.[118]
- Carboplatino y gemcitabina.[119]
- Gemcitabina y paclitaxel.[120]
No se dispone de datos que indiquen que la terapia combinada produzca un beneficio para la SG en comparación con la monoterapia. En un ensayo intergrupal del ECOG (E-1193) se asignó al azar a pacientes para recibir paclitaxel y doxorrubicina, administradas en combinación o en secuencia.[121] Aunque la tasa de respuesta y el tiempo transcurrido hasta la progresión fueron mejores para el grupo de combinación, la supervivencia fue igual en ambos grupos.[121][Nivel de evidencia A1]; [122,123]
Los siguientes factores afectan la selección del tratamiento de cada paciente:
- Tasa de progresión de la enfermedad.
- Presencia o ausencia de enfermedades concurrentes.
- Preferencia del médico o de la paciente.
Se puede utilizar monoterapias secuenciales o combinaciones para las pacientes que recaen con enfermedad metastásica. A menudo se administra quimioterapia combinada si hay indicios de enfermedad rápidamente progresiva o crisis viscerales. No se observó ventaja con las combinaciones de quimioterapia y terapia hormonal en la SG en comparación con la administración secuencial de estos fármacos.[124,125] En una revisión sistemática de 17 ensayos aleatorizados, se encontró que la adición de uno o más fármacos quimioterapéuticos a un régimen quimioterapéutico para intentar intensificar el tratamiento mejoró la respuesta tumoral, pero no tuvo efecto en la SG.[126][Nivel de evidencia A1]
Los siguientes factores se pueden tener en cuenta para tomar decisiones relacionadas con la duración de la quimioterapia:
- Preferencias de la paciente y objetivos del tratamiento.
- Efectos tóxicos de tratamientos previos.
- Disponibilidad de otras opciones de tratamiento.
Varios grupos estudiaron la duración óptima del tratamiento para pacientes con enfermedad que responde al tratamiento o que se mantiene estable. En 2 ensayos aleatorizados se observó que para las pacientes que obtuvieron una respuesta completa al tratamiento inicial, la SSE se prolonga cuando en el momento de la recaída se inicia de inmediato tratamiento con un régimen de quimioterapia diferente en comparación con mantenerse en observación.[127,128][Nivel de evidencia A1] Sin embargo, en ninguno de estos 2 estudios se observó una mejora de la SG en las pacientes que recibieron tratamiento de inmediato; en uno de estos estudios,[128] la supervivencia fue de hecho más precaria en el grupo que recibió tratamiento inmediato. De manera similar, no se observaron diferencias en la supervivencia cuando las pacientes con respuesta parcial o enfermedad estable después del tratamiento inicial se asignaron al azar para recibir una quimioterapia diferente versus mantenerse en observación, [129] o un régimen de quimioterapia diferente administrado en dosis altas versus dosis bajas.[130][Nivel de evidencia A1] Sin embargo, 324 pacientes que lograron el control de la enfermedad se asignaron al azar a quimioterapia de mantenimiento u observación. Las pacientes que recibieron quimioterapia de mantenimiento (paclitaxel y gemcitabina) presentaron una mejor SSP a 6 meses y una mejor SG. Esto se relacionó con un aumento de la tasa de efectos adversos.[131][Nivel de evidencia A1] Debido a que no hay un abordaje estándar para el tratamiento de la enfermedad metastásica, las pacientes que necesitan regímenes de segunda línea son aptas para participar en ensayos clínicos.
Administración de capecitabina y fluorouracilo
El gen DPYD codifica la enzima que cataboliza las pirimidinas y las fluoropirimidinas, como la capecitabina y el fluorouracilo. Se estima que entre el 1 % y el 2 % de la población tiene variantes defectuosas de DPYD que reducen la función de la proteína DPD y la acumulación de pirimidinas y fluoropirimidinas en el cuerpo.[132,133] Los pacientes con la variante DPYD*2A que reciben fluoropirimidinas quizás presenten efectos tóxicos graves que ponen en riesgo la salud, y a veces son mortales. Se han identificado muchas otras variantes de DPYD, con diferentes efectos clínicos.[132-134] Es posible que se recomiende evitar la fluoropirimidina o reducir la dosis al 50 % según el genotipo DPYD del paciente y el número de alelos funcionales de DPYD.[135-137] Las pruebas genéticas para DPYD cuestan menos de $200, pero la cobertura del seguro varía debido a la falta de directrices nacionales.[138] Además, es posible que las pruebas retrasen el tratamiento por 2 semanas, lo que no sería aconsejable en casos de urgencia. Este tema es objeto de controversia y requiere evaluación adicional.[139]
Efectos cardiotóxicos de las antraciclinas
Se debe tomar en cuenta el potencial de efectos cardiotóxicos inducidos por las antraciclinas cuando se selecciona el régimen de quimioterapia en pacientes seleccionadas. Los factores de riesgo de toxicidad cardíaca identificados son los siguientes:
- Edad avanzada.
- Antecedentes de radioterapia dirigida a la pared torácica.
- Antecedentes de exposición a antraciclinas.
- Hipertensión y enfermedad cardíaca subyacente conocida.
- Diabetes.
El cardioprotector dexrazoxano disminuyó el riesgo de toxicidad cardíaca inducida por la doxorrubicina en pacientes de estudios controlados. El uso de este fármaco permitió la administración de dosis acumuladas de doxorrubicina más altas y la administración de doxorrubicina a pacientes con factores de riesgo cardíaco.[140-143] El riesgo de toxicidad cardíaca también se puede reducir al administrar doxorrubicina mediante una infusión intravenosa continua.[144] En las directrices de la American Society of Clinical Oncology se indica el uso de dexrazoxano para las pacientes con cáncer metastásico que recibieron una dosis acumulada de doxorrubicina de 300 mg/m2 o más, cuando se considera que puede ser beneficiosa la administración de otro tratamiento con una antraciclina.[145] El dexrazoxano tiene un efecto protector similar en las pacientes que reciben epirrubicina.[146]
Tratamiento quirúrgico del cáncer de mama metastásico
En el ensayo ECOG 2108 (NCT01242800) se evaluó el beneficio potencial de las intervenciones locorregionales en pacientes con cáncer de mama metastásico. Las mujeres con cáncer de mama metastásico y un tumor primario intacto recibieron terapia sistémica durante 4 a 8 meses. Si no tenían progresión de la enfermedad, las pacientes se asignaron al azar a recibir tratamiento locorregional para el sitio primario (cirugía y radioterapia, según los estándares para la enfermedad metastásica) o continuar con la terapia sistémica. De las 256 pacientes asignadas, 125 recibieron tratamiento locorregional. El criterio principal de valoración fue la SG.[147]
- La SG a 3 años fue del 67,9 % en el grupo de terapia sistémica y del 68,4 % en el grupo de tratamiento locorregional (CRI, 1,11; IC 90 %, 0,82–1,52; P = 0,57). La mediana de SG fue de 53,1 meses (IC 95 %, 47,9–no estimable) en el grupo de terapia sistémica y de 54,9 meses (IC 95 %, 46,7–no estimable) en el grupo de tratamiento locorregional.
- La progresión de la enfermedad locorregional fue menos frecuente en las pacientes que recibieron tratamiento locorregional (tasa de progresión locorregional a 3 años, 16,3 vs. 39,8 %; P < 0,001).
La cirugía a veces está indicada para pacientes seleccionadas. Por ejemplo, es posible que sea necesario hacer una cirugía en pacientes con las siguientes características:
- Lesiones fungoides o dolorosas en la mama (mastectomía).
- Metástasis en el parénquima encefálico o metástasis vertebrales con compresión de la médula espinal.
- Fracturas patológicas o inminentes.
- Derrames pleurales o pericárdicos.
Para obtener más información sobre derrames pleurales y pericárdicos, consultar Síndromes cardiopulmonares.
Radioterapia para el cáncer de mama metastásico
La radioterapia cumple una función importante para el tratamiento paliativo de las metástasis localizadas sintomáticas.[148] Las indicaciones para la radioterapia de haz externo son las siguientes:
- Metástasis óseas dolorosas.
- Metástasis irresecables en el sistema nervioso central (es decir, encéfalo, meninges y médula espinal).
- Obstrucción bronquial.
- Lesiones fungoides o dolorosas en la mama o la pared torácica.
- Después de la cirugía de descompresión de metástasis intracraneales o de la médula espinal.
- Después de la fijación de fracturas patológicas.
El cloruro de estroncio Sr 89, un radionúclido de administración sistémica, a veces se usa para la paliación de metástasis óseas difusas.[149,150]
Terapia de modificación ósea para el cáncer de mama metastásico
En pacientes con metástasis óseas se debe considerar el uso de terapia de modificación ósea para reducir la morbilidad esquelética.[151] En los resultados de ensayos aleatorizados de pamidronato y clodronato en pacientes con metástasis óseas se observó disminución de la morbilidad esquelética.[152-154][Nivel de evidencia A3] El zoledronato fue al menos tan eficaz como el pamidronato.[155]
El esquema de dosificación óptimo del zoledronato se estudió en CALGB-70604 (Alliance; NCT00869206), en el que se asignó al azar a 1822 pacientes, 855 de las cuales tenían cáncer de mama metastásico, a recibir ácido zoledrónico cada 4 semanas o cada 12 semanas.[156] Los episodios esqueléticos fueron similares en ambos grupos, 260 pacientes (29,5 %) en el grupo de dosificación de zoledronato cada 4 semanas y 253 pacientes (28,6 %) en el grupo de dosificación de zoledronato cada 12 semanas experimentaron por lo menos 1 episodio esquelético (diferencia de riesgo de -0,3 % [IC unilateral 95 %, -4 % hasta infinito]; P < 0,001 para la ausencia de inferioridad).[156][Nivel de evidencia B1] Este estudio indica que el intervalo de dosificación más largo, cada 12 semanas, es una opción de tratamiento razonable para el tratamiento con zoledronato.
El anticuerpo monoclonal denosumab inhibe el ligando del receptor activador del factor nuclear κ β (RANKL). En un metanálisis de 3 ensayos de fase III (NCT00321464, NCT00321620y NCT00330759) en los que se comparó el zoledronato versus el denosumab para el tratamiento de las metástasis óseas, se indica que el denosumab es similar al zoledronato para reducir el riesgo de un primer episodio esquelético.[157]
Para obtener más información sobre los bisfosfonatos, consultar El dolor y el cáncer.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- National Cancer Institute: SEER Cancer Stat Facts: Female Breast Cancer. Bethesda, Md: National Cancer Institute. Available online. Last accessed April 9, 2025.
- Seidman AD, Bordeleau L, Fehrenbacher L, et al.: National Cancer Institute Breast Cancer Steering Committee Working Group Report on Meaningful and Appropriate End Points for Clinical Trials in Metastatic Breast Cancer. J Clin Oncol 36 (32): 3259-3268, 2018. [PUBMED Abstract]
- Rugo HS, Diéras V, Gelmon KA, et al.: Impact of palbociclib plus letrozole on patient-reported health-related quality of life: results from the PALOMA-2 trial. Ann Oncol 29 (4): 888-894, 2018. [PUBMED Abstract]
- Rugo HS, Finn RS, Diéras V, et al.: Palbociclib plus letrozole as first-line therapy in estrogen receptor-positive/human epidermal growth factor receptor 2-negative advanced breast cancer with extended follow-up. Breast Cancer Res Treat 174 (3): 719-729, 2019. [PUBMED Abstract]
- Turner NC, Ro J, André F, et al.: Palbociclib in Hormone-Receptor-Positive Advanced Breast Cancer. N Engl J Med 373 (3): 209-19, 2015. [PUBMED Abstract]
- Verma S, O'Shaughnessy J, Burris HA, et al.: Health-related quality of life of postmenopausal women with hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer treated with ribociclib + letrozole: results from MONALEESA-2. Breast Cancer Res Treat 170 (3): 535-545, 2018. [PUBMED Abstract]
- Janni W, Alba E, Bachelot T, et al.: First-line ribociclib plus letrozole in postmenopausal women with HR+ , HER2- advanced breast cancer: Tumor response and pain reduction in the phase 3 MONALEESA-2 trial. Breast Cancer Res Treat 169 (3): 469-479, 2018. [PUBMED Abstract]
- Kaufman PA, Toi M, Neven P, et al.: Health-Related Quality of Life in MONARCH 2: Abemaciclib plus Fulvestrant in Hormone Receptor-Positive, HER2-Negative Advanced Breast Cancer After Endocrine Therapy. Oncologist 25 (2): e243-e251, 2020. [PUBMED Abstract]
- Gao JJ, Cheng J, Bloomquist E, et al.: CDK4/6 inhibitor treatment for patients with hormone receptor-positive, HER2-negative, advanced or metastatic breast cancer: a US Food and Drug Administration pooled analysis. Lancet Oncol 21 (2): 250-260, 2020. [PUBMED Abstract]
- Finn RS, Crown JP, Lang I, et al.: The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomised phase 2 study. Lancet Oncol 16 (1): 25-35, 2015. [PUBMED Abstract]
- Finn RS, Martin M, Rugo HS, et al.: Palbociclib and Letrozole in Advanced Breast Cancer. N Engl J Med 375 (20): 1925-1936, 2016. [PUBMED Abstract]
- Hortobagyi GN, Stemmer SM, Burris HA, et al.: Ribociclib as First-Line Therapy for HR-Positive, Advanced Breast Cancer. N Engl J Med 375 (18): 1738-1748, 2016. [PUBMED Abstract]
- Huober J, Barrios CH, Niikura N, et al.: Atezolizumab With Neoadjuvant Anti-Human Epidermal Growth Factor Receptor 2 Therapy and Chemotherapy in Human Epidermal Growth Factor Receptor 2-Positive Early Breast Cancer: Primary Results of the Randomized Phase III IMpassion050 Trial. J Clin Oncol 40 (25): 2946-2956, 2022. [PUBMED Abstract]
- Hortobagyi GN, Stemmer SM, Burris HA, et al.: Overall Survival with Ribociclib plus Letrozole in Advanced Breast Cancer. N Engl J Med 386 (10): 942-950, 2022. [PUBMED Abstract]
- Slamon DJ, Neven P, Chia S, et al.: Phase III Randomized Study of Ribociclib and Fulvestrant in Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: MONALEESA-3. J Clin Oncol 36 (24): 2465-2472, 2018. [PUBMED Abstract]
- Slamon DJ, Neven P, Chia S, et al.: Overall Survival with Ribociclib plus Fulvestrant in Advanced Breast Cancer. N Engl J Med 382 (6): 514-524, 2020. [PUBMED Abstract]
- Tripathy D, Im SA, Colleoni M, et al.: Ribociclib plus endocrine therapy for premenopausal women with hormone-receptor-positive, advanced breast cancer (MONALEESA-7): a randomised phase 3 trial. Lancet Oncol 19 (7): 904-915, 2018. [PUBMED Abstract]
- Im SA, Lu YS, Bardia A, et al.: Overall Survival with Ribociclib plus Endocrine Therapy in Breast Cancer. N Engl J Med 381 (4): 307-316, 2019. [PUBMED Abstract]
- Goetz MP, Toi M, Campone M, et al.: MONARCH 3: Abemaciclib As Initial Therapy for Advanced Breast Cancer. J Clin Oncol 35 (32): 3638-3646, 2017. [PUBMED Abstract]
- Goetz MP, Toi M, Huober J, et al.: Abemaciclib plus a nonsteroidal aromatase inhibitor as initial therapy for HR+, HER2- advanced breast cancer: final overall survival results of MONARCH 3. Ann Oncol 35 (8): 718-727, 2024. [PUBMED Abstract]
- Cristofanilli M, Turner NC, Bondarenko I, et al.: Fulvestrant plus palbociclib versus fulvestrant plus placebo for treatment of hormone-receptor-positive, HER2-negative metastatic breast cancer that progressed on previous endocrine therapy (PALOMA-3): final analysis of the multicentre, double-blind, phase 3 randomised controlled trial. Lancet Oncol 17 (4): 425-39, 2016. [PUBMED Abstract]
- Turner NC, Slamon DJ, Ro J, et al.: Overall Survival with Palbociclib and Fulvestrant in Advanced Breast Cancer. N Engl J Med 379 (20): 1926-1936, 2018. [PUBMED Abstract]
- Sledge GW, Toi M, Neven P, et al.: MONARCH 2: Abemaciclib in Combination With Fulvestrant in Women With HR+/HER2- Advanced Breast Cancer Who Had Progressed While Receiving Endocrine Therapy. J Clin Oncol 35 (25): 2875-2884, 2017. [PUBMED Abstract]
- Sledge GW, Toi M, Neven P, et al.: The Effect of Abemaciclib Plus Fulvestrant on Overall Survival in Hormone Receptor-Positive, ERBB2-Negative Breast Cancer That Progressed on Endocrine Therapy-MONARCH 2: A Randomized Clinical Trial. JAMA Oncol 6 (1): 116-124, 2020. [PUBMED Abstract]
- Kalinsky K, Bianchini G, Hamilton E, et al.: Abemaciclib plus fulvestrant vs fulvestrant alone for HR+, HER2- advanced breast cancer following progression on a prior CDK4/6 inhibitor plus endocrine therapy: primary outcome of the phase 3 postMONARCH trial. [Abstract] J Clin Oncol 42 (Suppl 17): A-LBA1001, 2024.
- Dickler MN, Tolaney SM, Rugo HS, et al.: MONARCH 1, A Phase II Study of Abemaciclib, a CDK4 and CDK6 Inhibitor, as a Single Agent, in Patients with Refractory HR+/HER2- Metastatic Breast Cancer. Clin Cancer Res 23 (17): 5218-5224, 2017. [PUBMED Abstract]
- Baselga J, Campone M, Piccart M, et al.: Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. N Engl J Med 366 (6): 520-9, 2012. [PUBMED Abstract]
- Piccart M, Hortobagyi GN, Campone M, et al.: Everolimus plus exemestane for hormone-receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer: overall survival results from BOLERO-2†. Ann Oncol 25 (12): 2357-62, 2014. [PUBMED Abstract]
- Bachelot T, Bourgier C, Cropet C, et al.: Randomized phase II trial of everolimus in combination with tamoxifen in patients with hormone receptor-positive, human epidermal growth factor receptor 2-negative metastatic breast cancer with prior exposure to aromatase inhibitors: a GINECO study. J Clin Oncol 30 (22): 2718-24, 2012. [PUBMED Abstract]
- Kornblum N, Zhao F, Manola J, et al.: Randomized Phase II Trial of Fulvestrant Plus Everolimus or Placebo in Postmenopausal Women With Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Metastatic Breast Cancer Resistant to Aromatase Inhibitor Therapy: Results of PrE0102. J Clin Oncol 36 (16): 1556-1563, 2018. [PUBMED Abstract]
- Rugo HS, Seneviratne L, Beck JT, et al.: Prevention of everolimus-related stomatitis in women with hormone receptor-positive, HER2-negative metastatic breast cancer using dexamethasone mouthwash (SWISH): a single-arm, phase 2 trial. Lancet Oncol 18 (5): 654-662, 2017. [PUBMED Abstract]
- Turner NC, Oliveira M, Howell SJ, et al.: Capivasertib in Hormone Receptor-Positive Advanced Breast Cancer. N Engl J Med 388 (22): 2058-2070, 2023. [PUBMED Abstract]
- André F, Ciruelos E, Rubovszky G, et al.: Alpelisib for PIK3CA-Mutated, Hormone Receptor-Positive Advanced Breast Cancer. N Engl J Med 380 (20): 1929-1940, 2019. [PUBMED Abstract]
- Bidard FC, Kaklamani VG, Neven P, et al.: Elacestrant (oral selective estrogen receptor degrader) Versus Standard Endocrine Therapy for Estrogen Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: Results From the Randomized Phase III EMERALD Trial. J Clin Oncol 40 (28): 3246-3256, 2022. [PUBMED Abstract]
- Yardley DA, Ismail-Khan RR, Melichar B, et al.: Randomized phase II, double-blind, placebo-controlled study of exemestane with or without entinostat in postmenopausal women with locally recurrent or metastatic estrogen receptor-positive breast cancer progressing on treatment with a nonsteroidal aromatase inhibitor. J Clin Oncol 31 (17): 2128-35, 2013. [PUBMED Abstract]
- Connolly RM, Zhao F, Miller KD, et al.: E2112: Randomized Phase III Trial of Endocrine Therapy Plus Entinostat or Placebo in Hormone Receptor-Positive Advanced Breast Cancer. A Trial of the ECOG-ACRIN Cancer Research Group. J Clin Oncol 39 (28): 3171-3181, 2021. [PUBMED Abstract]
- Bonneterre J, Thürlimann B, Robertson JF, et al.: Anastrozole versus tamoxifen as first-line therapy for advanced breast cancer in 668 postmenopausal women: results of the Tamoxifen or Arimidex Randomized Group Efficacy and Tolerability study. J Clin Oncol 18 (22): 3748-57, 2000. [PUBMED Abstract]
- Nabholtz JM, Buzdar A, Pollak M, et al.: Anastrozole is superior to tamoxifen as first-line therapy for advanced breast cancer in postmenopausal women: results of a North American multicenter randomized trial. Arimidex Study Group. J Clin Oncol 18 (22): 3758-67, 2000. [PUBMED Abstract]
- Mouridsen H, Gershanovich M, Sun Y, et al.: Phase III study of letrozole versus tamoxifen as first-line therapy of advanced breast cancer in postmenopausal women: analysis of survival and update of efficacy from the International Letrozole Breast Cancer Group. J Clin Oncol 21 (11): 2101-9, 2003. [PUBMED Abstract]
- Mauri D, Pavlidis N, Polyzos NP, et al.: Survival with aromatase inhibitors and inactivators versus standard hormonal therapy in advanced breast cancer: meta-analysis. J Natl Cancer Inst 98 (18): 1285-91, 2006. [PUBMED Abstract]
- Robertson JFR, Bondarenko IM, Trishkina E, et al.: Fulvestrant 500 mg versus anastrozole 1 mg for hormone receptor-positive advanced breast cancer (FALCON): an international, randomised, double-blind, phase 3 trial. Lancet 388 (10063): 2997-3005, 2016. [PUBMED Abstract]
- Osborne CK, Pippen J, Jones SE, et al.: Double-blind, randomized trial comparing the efficacy and tolerability of fulvestrant versus anastrozole in postmenopausal women with advanced breast cancer progressing on prior endocrine therapy: results of a North American trial. J Clin Oncol 20 (16): 3386-95, 2002. [PUBMED Abstract]
- Howell A, Robertson JF, Quaresma Albano J, et al.: Fulvestrant, formerly ICI 182,780, is as effective as anastrozole in postmenopausal women with advanced breast cancer progressing after prior endocrine treatment. J Clin Oncol 20 (16): 3396-403, 2002. [PUBMED Abstract]
- Henderson IC: A rose is no longer a rose. J Clin Oncol 20 (16): 3365-8, 2002. [PUBMED Abstract]
- Flemming J, Madarnas Y, Franek JA: Fulvestrant for systemic therapy of locally advanced or metastatic breast cancer in postmenopausal women: a systematic review. Breast Cancer Res Treat 115 (2): 255-68, 2009. [PUBMED Abstract]
- Chia S, Gradishar W, Mauriac L, et al.: Double-blind, randomized placebo controlled trial of fulvestrant compared with exemestane after prior nonsteroidal aromatase inhibitor therapy in postmenopausal women with hormone receptor-positive, advanced breast cancer: results from EFECT. J Clin Oncol 26 (10): 1664-70, 2008. [PUBMED Abstract]
- Di Leo A, Jerusalem G, Petruzelka L, et al.: Results of the CONFIRM phase III trial comparing fulvestrant 250 mg with fulvestrant 500 mg in postmenopausal women with estrogen receptor-positive advanced breast cancer. J Clin Oncol 28 (30): 4594-600, 2010. [PUBMED Abstract]
- Mehta RS, Barlow WE, Albain KS, et al.: Combination anastrozole and fulvestrant in metastatic breast cancer. N Engl J Med 367 (5): 435-44, 2012. [PUBMED Abstract]
- Bergh J, Jönsson PE, Lidbrink EK, et al.: FACT: an open-label randomized phase III study of fulvestrant and anastrozole in combination compared with anastrozole alone as first-line therapy for patients with receptor-positive postmenopausal breast cancer. J Clin Oncol 30 (16): 1919-25, 2012. [PUBMED Abstract]
- Mehta RS, Barlow WE, Albain KS, et al.: Overall Survival with Fulvestrant plus Anastrozole in Metastatic Breast Cancer. N Engl J Med 380 (13): 1226-1234, 2019. [PUBMED Abstract]
- Vidula N, Yau C, Rugo HS: Trop2 gene expression (Trop2e) in primary breast cancer (BC): Correlations with clinical and tumor characteristics. [Abstract] J Clin Oncol 35 (15 Suppl): A-1075, 2017.
- Rugo HS, Bardia A, Marmé F, et al.: Sacituzumab Govitecan in Hormone Receptor-Positive/Human Epidermal Growth Factor Receptor 2-Negative Metastatic Breast Cancer. J Clin Oncol 40 (29): 3365-3376, 2022. [PUBMED Abstract]
- Modi S, Park H, Murthy RK, et al.: Antitumor Activity and Safety of Trastuzumab Deruxtecan in Patients With HER2-Low-Expressing Advanced Breast Cancer: Results From a Phase Ib Study. J Clin Oncol 38 (17): 1887-1896, 2020. [PUBMED Abstract]
- Modi S, Jacot W, Yamashita T, et al.: Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med 387 (1): 9-20, 2022. [PUBMED Abstract]
- Bardia A, Hu X, Dent R, et al.: Trastuzumab Deruxtecan after Endocrine Therapy in Metastatic Breast Cancer. N Engl J Med 391 (22): 2110-2122, 2024. [PUBMED Abstract]
- Cortes J, Cescon DW, Rugo HS, et al.: Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet 396 (10265): 1817-1828, 2020. [PUBMED Abstract]
- Cortes J, Rugo HS, Cescon DW, et al.: Pembrolizumab plus Chemotherapy in Advanced Triple-Negative Breast Cancer. N Engl J Med 387 (3): 217-226, 2022. [PUBMED Abstract]
- Schmid P, Adams S, Rugo HS, et al.: Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. N Engl J Med 379 (22): 2108-2121, 2018. [PUBMED Abstract]
- Emens LA, Adams S, Barrios CH, et al.: First-line atezolizumab plus nab-paclitaxel for unresectable, locally advanced, or metastatic triple-negative breast cancer: IMpassion130 final overall survival analysis. Ann Oncol 32 (8): 983-993, 2021. [PUBMED Abstract]
- Miles D, Gligorov J, André F, et al.: Primary results from IMpassion131, a double-blind, placebo-controlled, randomised phase III trial of first-line paclitaxel with or without atezolizumab for unresectable locally advanced/metastatic triple-negative breast cancer. Ann Oncol 32 (8): 994-1004, 2021. [PUBMED Abstract]
- Bardia A, Mayer IA, Vahdat LT, et al.: Sacituzumab Govitecan-hziy in Refractory Metastatic Triple-Negative Breast Cancer. N Engl J Med 380 (8): 741-751, 2019. [PUBMED Abstract]
- Bardia A, Hurvitz SA, Tolaney SM, et al.: Sacituzumab Govitecan in Metastatic Triple-Negative Breast Cancer. N Engl J Med 384 (16): 1529-1541, 2021. [PUBMED Abstract]
- Winer EP, Lipatov O, Im SA, et al.: Pembrolizumab versus investigator-choice chemotherapy for metastatic triple-negative breast cancer (KEYNOTE-119): a randomised, open-label, phase 3 trial. Lancet Oncol 22 (4): 499-511, 2021. [PUBMED Abstract]
- Pegram MD, Pauletti G, Slamon DJ: HER-2/neu as a predictive marker of response to breast cancer therapy. Breast Cancer Res Treat 52 (1-3): 65-77, 1998. [PUBMED Abstract]
- Cobleigh MA, Vogel CL, Tripathy D, et al.: Multinational study of the efficacy and safety of humanized anti-HER2 monoclonal antibody in women who have HER2-overexpressing metastatic breast cancer that has progressed after chemotherapy for metastatic disease. J Clin Oncol 17 (9): 2639-48, 1999. [PUBMED Abstract]
- Slamon DJ, Leyland-Jones B, Shak S, et al.: Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 344 (11): 783-92, 2001. [PUBMED Abstract]
- Seidman A, Hudis C, Pierri MK, et al.: Cardiac dysfunction in the trastuzumab clinical trials experience. J Clin Oncol 20 (5): 1215-21, 2002. [PUBMED Abstract]
- Robert N, Leyland-Jones B, Asmar L, et al.: Randomized phase III study of trastuzumab, paclitaxel, and carboplatin compared with trastuzumab and paclitaxel in women with HER-2-overexpressing metastatic breast cancer. J Clin Oncol 24 (18): 2786-92, 2006. [PUBMED Abstract]
- Valero V, Forbes J, Pegram MD, et al.: Multicenter phase III randomized trial comparing docetaxel and trastuzumab with docetaxel, carboplatin, and trastuzumab as first-line chemotherapy for patients with HER2-gene-amplified metastatic breast cancer (BCIRG 007 study): two highly active therapeutic regimens. J Clin Oncol 29 (2): 149-56, 2011. [PUBMED Abstract]
- Baselga J, Cortés J, Kim SB, et al.: Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. N Engl J Med 366 (2): 109-19, 2012. [PUBMED Abstract]
- Swain SM, Baselga J, Kim SB, et al.: Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. N Engl J Med 372 (8): 724-34, 2015. [PUBMED Abstract]
- Swain SM, Miles D, Kim SB, et al.: Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a double-blind, randomised, placebo-controlled, phase 3 study. Lancet Oncol 21 (4): 519-530, 2020. [PUBMED Abstract]
- Verma S, Miles D, Gianni L, et al.: Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 367 (19): 1783-91, 2012. [PUBMED Abstract]
- Diéras V, Miles D, Verma S, et al.: Trastuzumab emtansine versus capecitabine plus lapatinib in patients with previously treated HER2-positive advanced breast cancer (EMILIA): a descriptive analysis of final overall survival results from a randomised, open-label, phase 3 trial. Lancet Oncol 18 (6): 732-742, 2017. [PUBMED Abstract]
- Hurvitz SA, Dirix L, Kocsis J, et al.: Phase II randomized study of trastuzumab emtansine versus trastuzumab plus docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer. J Clin Oncol 31 (9): 1157-63, 2013. [PUBMED Abstract]
- Krop IE, Kim SB, González-Martín A, et al.: Trastuzumab emtansine versus treatment of physician's choice for pretreated HER2-positive advanced breast cancer (TH3RESA): a randomised, open-label, phase 3 trial. Lancet Oncol 15 (7): 689-99, 2014. [PUBMED Abstract]
- Krop IE, Kim SB, Martin AG, et al.: Trastuzumab emtansine versus treatment of physician's choice in patients with previously treated HER2-positive metastatic breast cancer (TH3RESA): final overall survival results from a randomised open-label phase 3 trial. Lancet Oncol 18 (6): 743-754, 2017. [PUBMED Abstract]
- Perez EA, Barrios C, Eiermann W, et al.: Trastuzumab Emtansine With or Without Pertuzumab Versus Trastuzumab Plus Taxane for Human Epidermal Growth Factor Receptor 2-Positive, Advanced Breast Cancer: Primary Results From the Phase III MARIANNE Study. J Clin Oncol 35 (2): 141-148, 2017. [PUBMED Abstract]
- Cortés J, Kim SB, Chung WP, et al.: Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer. N Engl J Med 386 (12): 1143-1154, 2022. [PUBMED Abstract]
- Rugo HS, Im SA, Cardoso F, et al.: Margetuximab Versus Trastuzumab in Patients With Previously Treated HER2-Positive Advanced Breast Cancer (SOPHIA): Final Overall Survival Results From a Randomized Phase 3 Trial. J Clin Oncol 41 (2): 198-205, 2023. [PUBMED Abstract]
- Rugo HS, Im SA, Cardoso F, et al.: Efficacy of Margetuximab vs Trastuzumab in Patients With Pretreated ERBB2-Positive Advanced Breast Cancer: A Phase 3 Randomized Clinical Trial. JAMA Oncol 7 (4): 573-584, 2021. [PUBMED Abstract]
- Murthy RK, Loi S, Okines A, et al.: Tucatinib, Trastuzumab, and Capecitabine for HER2-Positive Metastatic Breast Cancer. N Engl J Med 382 (7): 597-609, 2020. [PUBMED Abstract]
- Saura C, Oliveira M, Feng YH, et al.: Neratinib Plus Capecitabine Versus Lapatinib Plus Capecitabine in HER2-Positive Metastatic Breast Cancer Previously Treated With ≥ 2 HER2-Directed Regimens: Phase III NALA Trial. J Clin Oncol 38 (27): 3138-3149, 2020. [PUBMED Abstract]
- Geyer CE, Forster J, Lindquist D, et al.: Lapatinib plus capecitabine for HER2-positive advanced breast cancer. N Engl J Med 355 (26): 2733-43, 2006. [PUBMED Abstract]
- André F, O'Regan R, Ozguroglu M, et al.: Everolimus for women with trastuzumab-resistant, HER2-positive, advanced breast cancer (BOLERO-3): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet Oncol 15 (6): 580-91, 2014. [PUBMED Abstract]
- Robson M, Im SA, Senkus E, et al.: Olaparib for Metastatic Breast Cancer in Patients with a Germline BRCA Mutation. N Engl J Med 377 (6): 523-533, 2017. [PUBMED Abstract]
- Litton JK, Rugo HS, Ettl J, et al.: Talazoparib in Patients with Advanced Breast Cancer and a Germline BRCA Mutation. N Engl J Med 379 (8): 753-763, 2018. [PUBMED Abstract]
- Ettl J, Quek RGW, Lee KH, et al.: Quality of life with talazoparib versus physician's choice of chemotherapy in patients with advanced breast cancer and germline BRCA1/2 mutation: patient-reported outcomes from the EMBRACA phase III trial. Ann Oncol 29 (9): 1939-1947, 2018. [PUBMED Abstract]
- Barroso-Sousa R, Jain E, Cohen O, et al.: Prevalence and mutational determinants of high tumor mutation burden in breast cancer. Ann Oncol 31 (3): 387-394, 2020. [PUBMED Abstract]
- Marabelle A, Fakih M, Lopez J, et al.: Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 KEYNOTE-158 study. Lancet Oncol 21 (10): 1353-1365, 2020. [PUBMED Abstract]
- Alva AS, Mangat PK, Garrett-Mayer E, et al.: Pembrolizumab in Patients With Metastatic Breast Cancer With High Tumor Mutational Burden: Results From the Targeted Agent and Profiling Utilization Registry (TAPUR) Study. J Clin Oncol 39 (22): 2443-2451, 2021. [PUBMED Abstract]
- Wilcken N, Dear R: Chemotherapy in metastatic breast cancer: A summary of all randomised trials reported 2000-2007. Eur J Cancer 44 (15): 2218-25, 2008. [PUBMED Abstract]
- Ranson MR, Carmichael J, O'Byrne K, et al.: Treatment of advanced breast cancer with sterically stabilized liposomal doxorubicin: results of a multicenter phase II trial. J Clin Oncol 15 (10): 3185-91, 1997. [PUBMED Abstract]
- Harris L, Batist G, Belt R, et al.: Liposome-encapsulated doxorubicin compared with conventional doxorubicin in a randomized multicenter trial as first-line therapy of metastatic breast carcinoma. Cancer 94 (1): 25-36, 2002. [PUBMED Abstract]
- Keller AM, Mennel RG, Georgoulias VA, et al.: Randomized phase III trial of pegylated liposomal doxorubicin versus vinorelbine or mitomycin C plus vinblastine in women with taxane-refractory advanced breast cancer. J Clin Oncol 22 (19): 3893-901, 2004. [PUBMED Abstract]
- Sparano JA, Makhson AN, Semiglazov VF, et al.: Pegylated liposomal doxorubicin plus docetaxel significantly improves time to progression without additive cardiotoxicity compared with docetaxel monotherapy in patients with advanced breast cancer previously treated with neoadjuvant-adjuvant anthracycline therapy: results from a randomized phase III study. J Clin Oncol 27 (27): 4522-9, 2009. [PUBMED Abstract]
- Seidman AD, Berry D, Cirrincione C, et al.: Randomized phase III trial of weekly compared with every-3-weeks paclitaxel for metastatic breast cancer, with trastuzumab for all HER-2 overexpressors and random assignment to trastuzumab or not in HER-2 nonoverexpressors: final results of Cancer and Leukemia Group B protocol 9840. J Clin Oncol 26 (10): 1642-9, 2008. [PUBMED Abstract]
- Gonzalez-Angulo AM, Hortobagyi GN: Optimal schedule of paclitaxel: weekly is better. J Clin Oncol 26 (10): 1585-7, 2008. [PUBMED Abstract]
- Gradishar WJ, Tjulandin S, Davidson N, et al.: Phase III trial of nanoparticle albumin-bound paclitaxel compared with polyethylated castor oil-based paclitaxel in women with breast cancer. J Clin Oncol 23 (31): 7794-803, 2005. [PUBMED Abstract]
- Ibrahim NK, Samuels B, Page R, et al.: Multicenter phase II trial of ABI-007, an albumin-bound paclitaxel, in women with metastatic breast cancer. J Clin Oncol 23 (25): 6019-26, 2005. [PUBMED Abstract]
- Blum JL, Jones SE, Buzdar AU, et al.: Multicenter phase II study of capecitabine in paclitaxel-refractory metastatic breast cancer. J Clin Oncol 17 (2): 485-93, 1999. [PUBMED Abstract]
- Blum JL, Dieras V, Lo Russo PM, et al.: Multicenter, Phase II study of capecitabine in taxane-pretreated metastatic breast carcinoma patients. Cancer 92 (7): 1759-68, 2001. [PUBMED Abstract]
- Venturini M, Paridaens R, Rossner D, et al.: An open-label, multicenter study of outpatient capecitabine monotherapy in 631 patients with pretreated advanced breast cancer. Oncology 72 (1-2): 51-7, 2007. [PUBMED Abstract]
- Degardin M, Bonneterre J, Hecquet B, et al.: Vinorelbine (navelbine) as a salvage treatment for advanced breast cancer. Ann Oncol 5 (5): 423-6, 1994. [PUBMED Abstract]
- Carmichael J, Walling J: Advanced breast cancer: investigational role of gemcitabine. Eur J Cancer 33 (Suppl 1): S27-30, 1997. [PUBMED Abstract]
- Vahdat LT, Pruitt B, Fabian CJ, et al.: Phase II study of eribulin mesylate, a halichondrin B analog, in patients with metastatic breast cancer previously treated with an anthracycline and a taxane. J Clin Oncol 27 (18): 2954-61, 2009. [PUBMED Abstract]
- Cortes J, O'Shaughnessy J, Loesch D, et al.: Eribulin monotherapy versus treatment of physician's choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open-label randomised study. Lancet 377 (9769): 914-23, 2011. [PUBMED Abstract]
- Smith JW, Vukelja S, Rabe A, et al.: Phase II randomized trial of weekly and every-3-week ixabepilone in metastatic breast cancer patients. Breast Cancer Res Treat 142 (2): 381-8, 2013. [PUBMED Abstract]
- Tranum BL, McDonald B, Thigpen T, et al.: Adriamycin combinations in advanced breast cancer. A Southwest Oncology Group Study. Cancer 49 (5): 835-9, 1982. [PUBMED Abstract]
- Langley RE, Carmichael J, Jones AL, et al.: Phase III trial of epirubicin plus paclitaxel compared with epirubicin plus cyclophosphamide as first-line chemotherapy for metastatic breast cancer: United Kingdom National Cancer Research Institute trial AB01. J Clin Oncol 23 (33): 8322-30, 2005. [PUBMED Abstract]
- Misset JL, Dieras V, Gruia G, et al.: Dose-finding study of docetaxel and doxorubicin in first-line treatment of patients with metastatic breast cancer. Ann Oncol 10 (5): 553-60, 1999. [PUBMED Abstract]
- Buzdar AU, Kau SW, Smith TL, et al.: Ten-year results of FAC adjuvant chemotherapy trial in breast cancer. Am J Clin Oncol 12 (2): 123-8, 1989. [PUBMED Abstract]
- Tormey DC, Gelman R, Band PR, et al.: Comparison of induction chemotherapies for metastatic breast cancer. An Eastern Cooperative Oncology Group Trial. Cancer 50 (7): 1235-44, 1982. [PUBMED Abstract]
- Jassem J, Pieńkowski T, Płuzańska A, et al.: Doxorubicin and paclitaxel versus fluorouracil, doxorubicin, and cyclophosphamide as first-line therapy for women with metastatic breast cancer: final results of a randomized phase III multicenter trial. J Clin Oncol 19 (6): 1707-15, 2001. [PUBMED Abstract]
- Biganzoli L, Cufer T, Bruning P, et al.: Doxorubicin and paclitaxel versus doxorubicin and cyclophosphamide as first-line chemotherapy in metastatic breast cancer: The European Organization for Research and Treatment of Cancer 10961 Multicenter Phase III Trial. J Clin Oncol 20 (14): 3114-21, 2002. [PUBMED Abstract]
- O'Shaughnessy J, Miles D, Vukelja S, et al.: Superior survival with capecitabine plus docetaxel combination therapy in anthracycline-pretreated patients with advanced breast cancer: phase III trial results. J Clin Oncol 20 (12): 2812-23, 2002. [PUBMED Abstract]
- Serin D, Verrill M, Jones A, et al.: Vinorelbine alternating oral and intravenous plus epirubicin in first-line therapy of metastatic breast cancer: results of a multicentre phase II study. Br J Cancer 92 (11): 1989-96, 2005. [PUBMED Abstract]
- Thomas ES, Gomez HL, Li RK, et al.: Ixabepilone plus capecitabine for metastatic breast cancer progressing after anthracycline and taxane treatment. J Clin Oncol 25 (33): 5210-7, 2007. [PUBMED Abstract]
- O'Shaughnessy J, Schwartzberg L, Danso MA, et al.: Phase III study of iniparib plus gemcitabine and carboplatin versus gemcitabine and carboplatin in patients with metastatic triple-negative breast cancer. J Clin Oncol 32 (34): 3840-7, 2014. [PUBMED Abstract]
- Albain KS, Nag SM, Calderillo-Ruiz G, et al.: Gemcitabine plus Paclitaxel versus Paclitaxel monotherapy in patients with metastatic breast cancer and prior anthracycline treatment. J Clin Oncol 26 (24): 3950-7, 2008. [PUBMED Abstract]
- Sledge GW, Neuberg D, Bernardo P, et al.: Phase III trial of doxorubicin, paclitaxel, and the combination of doxorubicin and paclitaxel as front-line chemotherapy for metastatic breast cancer: an intergroup trial (E1193). J Clin Oncol 21 (4): 588-92, 2003. [PUBMED Abstract]
- Seidman AD: Sequential single-agent chemotherapy for metastatic breast cancer: therapeutic nihilism or realism? J Clin Oncol 21 (4): 577-9, 2003. [PUBMED Abstract]
- Overmoyer B: Combination chemotherapy for metastatic breast cancer: reaching for the cure. J Clin Oncol 21 (4): 580-2, 2003. [PUBMED Abstract]
- Honig SF: Hormonal therapy and chemotherapy. In: Harris JR, Morrow M, Lippman ME, et al., eds.: Diseases of the Breast. Lippincott-Raven Publishers. 1996, pp 669-734.
- Perez EA: Current management of metastatic breast cancer. Semin Oncol 26 (4 Suppl 12): 1-10, 1999. [PUBMED Abstract]
- Jones D, Ghersi D, Wilcken N: Addition of drug/s to a chemotherapy regimen for metastatic breast cancer. Cochrane Database Syst Rev 3: CD003368, 2006. [PUBMED Abstract]
- Falkson G, Gelman RS, Pandya KJ, et al.: Eastern Cooperative Oncology Group randomized trials of observation versus maintenance therapy for patients with metastatic breast cancer in complete remission following induction treatment. J Clin Oncol 16 (5): 1669-76, 1998. [PUBMED Abstract]
- Peters WP, Jones RB, Vrendenburgh J, et al.: A large, prospective, randomized trial of high-dose combination alkylating agents (CPB) with autologous cellular support (ABMS) as consolidation for patients with metastatic breast cancer achieving complete remission after intensive doxorubicin-based induction therapy (AFM). [Abstract] Proceedings of the American Society of Clinical Oncology 15: A-149, 121, 1996.
- Muss HB, Case LD, Richards F, et al.: Interrupted versus continuous chemotherapy in patients with metastatic breast cancer. The Piedmont Oncology Association. N Engl J Med 325 (19): 1342-8, 1991. [PUBMED Abstract]
- Falkson G, Gelman RS, Glick J, et al.: Metastatic breast cancer: higher versus low dose maintenance treatment when only a partial response or a no change status is obtained following doxorubicin induction treatment. An Eastern Cooperative Oncology Group study. Ann Oncol 3 (9): 768-70, 1992. [PUBMED Abstract]
- Park YH, Jung KH, Im SA, et al.: Phase III, multicenter, randomized trial of maintenance chemotherapy versus observation in patients with metastatic breast cancer after achieving disease control with six cycles of gemcitabine plus paclitaxel as first-line chemotherapy: KCSG-BR07-02. J Clin Oncol 31 (14): 1732-9, 2013. [PUBMED Abstract]
- Sharma BB, Rai K, Blunt H, et al.: Pathogenic DPYD Variants and Treatment-Related Mortality in Patients Receiving Fluoropyrimidine Chemotherapy: A Systematic Review and Meta-Analysis. Oncologist 26 (12): 1008-1016, 2021. [PUBMED Abstract]
- Lam SW, Guchelaar HJ, Boven E: The role of pharmacogenetics in capecitabine efficacy and toxicity. Cancer Treat Rev 50: 9-22, 2016. [PUBMED Abstract]
- Shakeel F, Fang F, Kwon JW, et al.: Patients carrying DPYD variant alleles have increased risk of severe toxicity and related treatment modifications during fluoropyrimidine chemotherapy. Pharmacogenomics 22 (3): 145-155, 2021. [PUBMED Abstract]
- Amstutz U, Henricks LM, Offer SM, et al.: Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing: 2017 Update. Clin Pharmacol Ther 103 (2): 210-216, 2018. [PUBMED Abstract]
- Henricks LM, Lunenburg CATC, de Man FM, et al.: DPYD genotype-guided dose individualisation of fluoropyrimidine therapy in patients with cancer: a prospective safety analysis. Lancet Oncol 19 (11): 1459-1467, 2018. [PUBMED Abstract]
- Lau-Min KS, Varughese LA, Nelson MN, et al.: Preemptive pharmacogenetic testing to guide chemotherapy dosing in patients with gastrointestinal malignancies: a qualitative study of barriers to implementation. BMC Cancer 22 (1): 47, 2022. [PUBMED Abstract]
- Brooks GA, Tapp S, Daly AT, et al.: Cost-effectiveness of DPYD Genotyping Prior to Fluoropyrimidine-based Adjuvant Chemotherapy for Colon Cancer. Clin Colorectal Cancer 21 (3): e189-e195, 2022. [PUBMED Abstract]
- Baker SD, Bates SE, Brooks GA, et al.: DPYD Testing: Time to Put Patient Safety First. J Clin Oncol 41 (15): 2701-2705, 2023. [PUBMED Abstract]
- Swain SM, Whaley FS, Gerber MC, et al.: Delayed administration of dexrazoxane provides cardioprotection for patients with advanced breast cancer treated with doxorubicin-containing therapy. J Clin Oncol 15 (4): 1333-40, 1997. [PUBMED Abstract]
- Swain SM, Whaley FS, Gerber MC, et al.: Cardioprotection with dexrazoxane for doxorubicin-containing therapy in advanced breast cancer. J Clin Oncol 15 (4): 1318-32, 1997. [PUBMED Abstract]
- Hensley ML, Schuchter LM, Lindley C, et al.: American Society of Clinical Oncology clinical practice guidelines for the use of chemotherapy and radiotherapy protectants. J Clin Oncol 17 (10): 3333-55, 1999. [PUBMED Abstract]
- Marty M, Espié M, Llombart A, et al.: Multicenter randomized phase III study of the cardioprotective effect of dexrazoxane (Cardioxane) in advanced/metastatic breast cancer patients treated with anthracycline-based chemotherapy. Ann Oncol 17 (4): 614-22, 2006. [PUBMED Abstract]
- Hortobagyi GN, Frye D, Buzdar AU, et al.: Decreased cardiac toxicity of doxorubicin administered by continuous intravenous infusion in combination chemotherapy for metastatic breast carcinoma. Cancer 63 (1): 37-45, 1989. [PUBMED Abstract]
- Hensley ML, Hagerty KL, Kewalramani T, et al.: American Society of Clinical Oncology 2008 clinical practice guideline update: use of chemotherapy and radiation therapy protectants. J Clin Oncol 27 (1): 127-45, 2009. [PUBMED Abstract]
- Venturini M, Michelotti A, Del Mastro L, et al.: Multicenter randomized controlled clinical trial to evaluate cardioprotection of dexrazoxane versus no cardioprotection in women receiving epirubicin chemotherapy for advanced breast cancer. J Clin Oncol 14 (12): 3112-20, 1996. [PUBMED Abstract]
- Khan SA, Zhao F, Goldstein LJ, et al.: Early Local Therapy for the Primary Site in De Novo Stage IV Breast Cancer: Results of a Randomized Clinical Trial (EA2108). J Clin Oncol 40 (9): 978-987, 2022. [PUBMED Abstract]
- Hartsell WF, Scott CB, Bruner DW, et al.: Randomized trial of short- versus long-course radiotherapy for palliation of painful bone metastases. J Natl Cancer Inst 97 (11): 798-804, 2005. [PUBMED Abstract]
- Porter AT, McEwan AJ, Powe JE, et al.: Results of a randomized phase-III trial to evaluate the efficacy of strontium-89 adjuvant to local field external beam irradiation in the management of endocrine resistant metastatic prostate cancer. Int J Radiat Oncol Biol Phys 25 (5): 805-13, 1993. [PUBMED Abstract]
- Quilty PM, Kirk D, Bolger JJ, et al.: A comparison of the palliative effects of strontium-89 and external beam radiotherapy in metastatic prostate cancer. Radiother Oncol 31 (1): 33-40, 1994. [PUBMED Abstract]
- Hillner BE, Ingle JN, Chlebowski RT, et al.: American Society of Clinical Oncology 2003 update on the role of bisphosphonates and bone health issues in women with breast cancer. J Clin Oncol 21 (21): 4042-57, 2003. [PUBMED Abstract]
- Paterson AH, Powles TJ, Kanis JA, et al.: Double-blind controlled trial of oral clodronate in patients with bone metastases from breast cancer. J Clin Oncol 11 (1): 59-65, 1993. [PUBMED Abstract]
- Hortobagyi GN, Theriault RL, Lipton A, et al.: Long-term prevention of skeletal complications of metastatic breast cancer with pamidronate. Protocol 19 Aredia Breast Cancer Study Group. J Clin Oncol 16 (6): 2038-44, 1998. [PUBMED Abstract]
- Powles T, Paterson A, McCloskey E, et al.: Reduction in bone relapse and improved survival with oral clodronate for adjuvant treatment of operable breast cancer [ISRCTN83688026]. Breast Cancer Res 8 (2): R13, 2006. [PUBMED Abstract]
- Rosen LS, Gordon D, Kaminski M, et al.: Long-term efficacy and safety of zoledronic acid compared with pamidronate disodium in the treatment of skeletal complications in patients with advanced multiple myeloma or breast carcinoma: a randomized, double-blind, multicenter, comparative trial. Cancer 98 (8): 1735-44, 2003. [PUBMED Abstract]
- Himelstein AL, Foster JC, Khatcheressian JL, et al.: Effect of Longer-Interval vs Standard Dosing of Zoledronic Acid on Skeletal Events in Patients With Bone Metastases: A Randomized Clinical Trial. JAMA 317 (1): 48-58, 2017. [PUBMED Abstract]
- Lipton A, Fizazi K, Stopeck AT, et al.: Superiority of denosumab to zoledronic acid for prevention of skeletal-related events: a combined analysis of 3 pivotal, randomised, phase 3 trials. Eur J Cancer 48 (16): 3082-92, 2012. [PUBMED Abstract]
Tratamiento del carcinoma ductal in situ
Introducción
El carcinoma ductal in situ (CDIS) es una afección no invasiva. El CDIS puede progresar hasta convertirse en cáncer invasivo, pero los cálculos de la probabilidad de que esto ocurra varían mucho. Algunos informes incluyen el CDIS en las estadísticas sobre el cáncer de mama. En 2025, se anticipa que el CDIS represente cerca del 16 % de todos los tumores de mama invasivos y no invasivos de diagnóstico reciente en los Estados Unidos.[1] Por otro lado, el CDIS representa cerca del 25 % de todos los casos de tumores invasivos y no invasivos identificados mediante exámenes de detección.
La frecuencia de diagnóstico de CDIS ha aumentado mucho en los Estados Unidos a partir del uso generalizado de la mamografía de detección. Muy pocos casos de CDIS se presentan como una masa palpable, y más del 90 % se diagnostican solo mediante mamografía.[2]
El CDIS abarca un grupo heterogéneo de lesiones histopatológicas que se clasifican en los siguientes subtipos, sobre todo de acuerdo con su perfil arquitectónico:
- Micropapilar.
- Papilar.
- Sólido.
- Cribiforme.
- Comedónico o tipo comedo.
El CDIS de tipo comedo se compone de células con características citológicas de malignidad, con núcleos de grado alto, pleomorfismo y abundante necrosis luminal central. El CDIS de tipo comedo es más maligno, con una probabilidad más alta de relacionarse con un carcinoma ductal invasivo.[3]
Opciones de tratamiento para el carcinoma ductal in situ
Las opciones de tratamiento para el carcinoma ductal in situ (CDIS) son las siguientes:
- Cirugía de conservación de la mama, o mastectomía y radioterapia, con tamoxifeno o sin este.
- Mastectomía total con tamoxifeno o sin este.
En el pasado, el tratamiento habitual del CDIS era la mastectomía.[4] La justificación para la mastectomía incluía una incidencia del 30 % de enfermedad multicéntrica, una prevalencia del 40 % de tumor residual en la mastectomía después de una extirpación amplia sola, y una incidencia del 25 % al 50 % de recidiva en la mama después de una cirugía limitada para tumor palpable; el 50 % de estas recidivas eran carcinomas invasivos.[4,5] La tasa combinada de recidiva local y a distancia después de la mastectomía es del 1 % al 2 %. No hay comparaciones aleatorizadas de mastectomía versus cirugía de conservación de la mama y radioterapia dirigida a la mama.
Debido a que la cirugía de conservación de la mama combinada con radioterapia dirigida a la mama es eficaz para el carcinoma invasivo, este abordaje conservador se extendió al CDIS. Para determinar si el uso de la cirugía de conservación de la mama y la radioterapia eran un abordaje razonable para el tratamiento del CDIS, el National Surgical Adjuvant Breast and Bowel Project (NSABP) y la European Organisation for Research and Treatment of Cancer (EORTC) llevaron a cabo por separado ensayos prospectivos aleatorizados de mujeres con CDIS localizado, con márgenes quirúrgicos negativos después de una biopsia por excisión, que se asignaron al azar a recibir radioterapia dirigida a la mama (50 Gy) o a no recibir tratamiento adicional.[6-9] Hasta la fecha, en ningún ensayo controlado aleatorizado se encontró un beneficio para la supervivencia del CDIS tratado con radioterapia adyuvante o terapia hormonal adyuvante, aunque se encontró que ambas terapias reducen el riesgo de recidiva.
Evidencia (cirugía de conservación de la mama y radioterapia dirigida a la mama):
- De las 818 mujeres inscritas en el ensayo NSABP-B-17, en el 80 % el diagnóstico se estableció mediante mamografía, y el 70 % de las lesiones medían 1 cm o menos. Los resultados se notificaron en el intervalo de seguimiento actuarial de 12 años.[7]; [9][Nivel de evidencia B1]
- La tasa general de recidiva tumoral en la mama se redujo del 31,7 % al 15,7 % cuando se administró radioterapia (P < 0,005).
- La radioterapia redujo el cáncer invasivo del 16,8 % al 7,7 % (P = 0,001) y el CDIS recidivante del 14,6 % al 8,0 % (P = 0,001).
- Se evaluaron 9 características patológicas por su capacidad de predecir la recidiva en la mama, pero solo la comedonecrosis fue un factor significativo de predicción de recidiva.
- De manera semejante, de 1010 pacientes inscritas en el ensayo EORTC-10853, en el 71 % de las mujeres las lesiones se detectaron mediante mamografía. Los resultados se notificaron en una mediana de seguimiento de 10,5 años.[9][Nivel de evidencia B1]
- La tasa general de recidiva tumoral en la mama se redujo del 26 % al 15 % (P < 0,001) con una disminución efectiva similar de las tasas de recidiva invasiva (13 % a 8 %, P = 0,065) y tasas de recidiva no invasiva (14 % a 7 %, P = 0,001).
- En este análisis, los parámetros relacionados con un aumento de riesgo de recidiva en la mama fueron edad de 40 años o menos, enfermedad palpable, CDIS de diferenciación intermedia o poco diferenciado, modelo de crecimiento cribiforme o sólido, y márgenes indeterminados. En otros informes, los márgenes de menos de 1 mm se relacionaron con una tasa de recidiva local inaceptable, incluso con radioterapia.[10]
En ambos estudios, el efecto de la radioterapia fue uniforme para todos los factores de riesgo evaluados.
- En una revisión sistemática de 4 ensayos aleatorizados, se confirmó el beneficio de la administración de radioterapia (cociente de riesgos instantáneos [CRI], 0,49; intervalo de confianza [IC], 95 %, 0,41–0,58; P < 0,00001). En este estudio, se tuvo que tratar con radioterapia a 9 mujeres para prevenir 1 recidiva en la mama ipsilateral.[11]
- En un gran ensayo clínico nacional del Radiation Therapy Oncology Group (RTOG-9804 [NCT00003857]) se comparó la cirugía de conservación de la mama y el uso de tamoxifeno con radioterapia o sin esta, pero se cerró de manera prematura por inscripción insuficiente (636 de una proyección de inscripción de 1790 pacientes). Se inscribió a pacientes con CDIS de riesgo bajo (definido como CDIS de grado bajo o intermedio detectado mediante mamografía que midiera <2,5 cm con márgenes ≥3 mm).[12]
- La incidencia acumulada a 15 años de recidiva en la mama fue del 7,1 % (IC 95 %, 4,0–11,5 %) con radioterapia versus el 15,1 % (IC 95 %, 10,8–20,2 %) con observación (CRI, 0,36; IC 95 %, 0,20–0,66; P = 0,0007). En el análisis multivariante, solo la radioterapia (CRI, 0,34; IC 95 %, 0,19–0,64; P = 0,0007) y el uso de tamoxifeno (CRI, 0,45; IC 95 %, 0,25–0,78; P = 0,0047) se relacionaron con una reducción de la recidiva en la mama.[13]
Los resultados de los ensayos NSABP-B-17 y EORTC-10853, y de otros 2 ensayos, se incluyeron en un metanálisis en el que se demostró una reducción en todos los episodios en la mama ipsilateral (CRI, 0,49; IC 95 %, 0,41–0,58; P < 0,00001), recidiva invasiva ipsilateral (CRI, 0,50; IC 95 %, 0,32–0,76; P = 0,001), y recidiva ipsilateral del CDIS (CRI, 0,61; IC 95 %, 0,39–0,95; P = 0,03).[14][Nivel de evidencia B1] Sin embargo, después de 10 años de seguimiento, no hubo un efecto significativo en la mortalidad por cáncer de mama, la mortalidad por causas diferentes al cáncer de mama o la mortalidad general.[11]
Para identificar a un grupo de pacientes con pronóstico favorable en quienes se puede omitir la radioterapia posoperatoria, se formularon y pusieron a prueba de manera retrospectiva varios sistemas de estadificación patológica, pero no se ha logrado un consenso en cuanto a las recomendaciones.[15-18]
El Van Nuys Prognostic Index es un sistema de estadificación patológica que combina 3 factores predictivos de recidiva local (tamaño del tumor, ancho del margen y clasificación patológica). Se usó para un análisis retrospectivo de 333 pacientes tratadas con extirpación sola, o con extirpación y radioterapia.[18] Cuando se usó este índice pronóstico, se encontró que las pacientes con lesiones de pronóstico favorable que se someten a extirpación quirúrgica sola tuvieron una tasa de recidiva baja (es decir, 2 % al cabo de una mediana de seguimiento de 79 meses). Se realizó otro análisis posterior con estos datos para determinar la influencia del ancho del margen sobre el control local.[19] Las pacientes con lesiones extirpadas que tenían márgenes que miden 10 mm o más en todas las direcciones tuvieron una probabilidad muy baja de presentar recidiva local con cirugía sola (4 % con una mediana de seguimiento de 8 años).
Ambas revisiones son retrospectivas, no controladas y sujetas a un importante sesgo de selección. Por el contrario, en el ensayo prospectivo del NSABP no se identificó ningún subconjunto de pacientes que no se beneficiara de la adición de radioterapia a la cirugía de conservación de la mama en el tratamiento de un CDIS.[3,6,14,20]
Para determinar si el tamoxifeno aumenta la eficacia del tratamiento local del CDIS, el NSABP realizó un ensayo prospectivo con enmascaramiento doble (NSABP-B-24).
Evidencia (terapia endocrina adyuvante):
- En el ensayo NSABP-B-24, se asignaron al azar 1804 mujeres a cirugía de conservación de la mama, radioterapia (50 Gy) y placebo, o cirugía de conservación de la mama, radioterapia y tamoxifeno (20 mg cada día durante 5 años).[21] En el 23 % de las pacientes se encontraron márgenes quirúrgicos positivos o de estado desconocido. Alrededor del 80 % de las lesiones medían 1 cm o menos, y más del 80 % se detectaron mediante mamografía. Los episodios de cáncer de mama se definieron por la presencia de enfermedad ipsilateral nueva, enfermedad contralateral nueva o metástasis nuevas.
- Las mujeres del grupo de tamoxifeno presentaron menos episodios de cáncer de mama a los 5 años que las mujeres tratadas con un placebo (8,2 vs. 13,4 %; P = 0,009).[21][Nivel de evidencia B1]
- En el grupo de tamoxifeno se redujo el cáncer de mama invasivo ipsilateral del 4,2 % al 2,1 % a los 5 años (P = 0,03).
- En el grupo de tamoxifeno también se redujo la incidencia de neoplasias de la mama contralateral (invasivas y no invasivas) del 0,8 % al 0,4 % al año (P = 0,01).
- El beneficio del tamoxifeno se extendió a las pacientes con márgenes positivos o márgenes dudosos.[22] Para obtener más información, consultar Prevención del cáncer de mama.
- No se comprobó ninguna ventaja para la supervivencia con el uso de tamoxifeno.
- En el estudio con enmascaramiento doble NSABP-B35, 3104 mujeres posmenopáusicas con CDIS sometidas a cirugía de conservación de la mama, se asignaron al azar para recibir tamoxifeno o anastrozol adyuvantes, además de la radioterapia adyuvante.
- El uso de anastrozol se relacionó con una incidencia significativamente menor de episodios de cáncer de mama (CRI, 0,73; P = 0,023), pero no mejoró la supervivencia.[23][Nivel de evidencia B1]
- En el ensayo Second International Breast Cancer Intervention Study (IBIS II DCIS [NCT00078832]), se inscribieron 2980 mujeres posmenopáusicas en una comparación con enmascaramiento doble de tamoxifeno y anastrozol como terapia adyuvante. Todas las mujeres se habían sometido a cirugía de conservación de la mama, y el 71 % de ellas habían recibido radioterapia.[24]
- No se encontró diferencia en la tasa de recidiva del cáncer de mama a favor del anastrozol (CRI, 0,89; IC 95 %, 0,64–1,23; P = 0,49) ni hubo diferencia en la supervivencia.
La decisión de recetar terapia endocrina después de un diagnóstico de CDIS a menudo conlleva a una conversación con la paciente sobre los posibles beneficios y efectos secundarios de cada fármaco.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Siegel R, Ward E, Brawley O, et al.: Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths. CA Cancer J Clin 61 (4): 212-36, 2011 Jul-Aug. [PUBMED Abstract]
- Fisher ER, Dignam J, Tan-Chiu E, et al.: Pathologic findings from the National Surgical Adjuvant Breast Project (NSABP) eight-year update of Protocol B-17: intraductal carcinoma. Cancer 86 (3): 429-38, 1999. [PUBMED Abstract]
- Fonseca R, Hartmann LC, Petersen IA, et al.: Ductal carcinoma in situ of the breast. Ann Intern Med 127 (11): 1013-22, 1997. [PUBMED Abstract]
- Lagios MD, Westdahl PR, Margolin FR, et al.: Duct carcinoma in situ. Relationship of extent of noninvasive disease to the frequency of occult invasion, multicentricity, lymph node metastases, and short-term treatment failures. Cancer 50 (7): 1309-14, 1982. [PUBMED Abstract]
- Fisher B, Dignam J, Wolmark N, et al.: Lumpectomy and radiation therapy for the treatment of intraductal breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-17. J Clin Oncol 16 (2): 441-52, 1998. [PUBMED Abstract]
- Fisher B, Land S, Mamounas E, et al.: Prevention of invasive breast cancer in women with ductal carcinoma in situ: an update of the national surgical adjuvant breast and bowel project experience. Semin Oncol 28 (4): 400-18, 2001. [PUBMED Abstract]
- Julien JP, Bijker N, Fentiman IS, et al.: Radiotherapy in breast-conserving treatment for ductal carcinoma in situ: first results of the EORTC randomised phase III trial 10853. EORTC Breast Cancer Cooperative Group and EORTC Radiotherapy Group. Lancet 355 (9203): 528-33, 2000. [PUBMED Abstract]
- Bijker N, Meijnen P, Peterse JL, et al.: Breast-conserving treatment with or without radiotherapy in ductal carcinoma-in-situ: ten-year results of European Organisation for Research and Treatment of Cancer randomized phase III trial 10853--a study by the EORTC Breast Cancer Cooperative Group and EORTC Radiotherapy Group. J Clin Oncol 24 (21): 3381-7, 2006. [PUBMED Abstract]
- Chan KC, Knox WF, Sinha G, et al.: Extent of excision margin width required in breast conserving surgery for ductal carcinoma in situ. Cancer 91 (1): 9-16, 2001. [PUBMED Abstract]
- Correa C, McGale P, Taylor C, et al.: Overview of the randomized trials of radiotherapy in ductal carcinoma in situ of the breast. J Natl Cancer Inst Monogr 2010 (41): 162-77, 2010. [PUBMED Abstract]
- McCormick B, Winter K, Hudis C, et al.: RTOG 9804: a prospective randomized trial for good-risk ductal carcinoma in situ comparing radiotherapy with observation. J Clin Oncol 33 (7): 709-15, 2015. [PUBMED Abstract]
- McCormick B, Winter KA, Woodward W, et al.: Randomized Phase III Trial Evaluating Radiation Following Surgical Excision for Good-Risk Ductal Carcinoma In Situ: Long-Term Report From NRG Oncology/RTOG 9804. J Clin Oncol 39 (32): 3574-3582, 2021. [PUBMED Abstract]
- Goodwin A, Parker S, Ghersi D, et al.: Post-operative radiotherapy for ductal carcinoma in situ of the breast. Cochrane Database Syst Rev 11: CD000563, 2013. [PUBMED Abstract]
- Page DL, Lagios MD: Pathologic analysis of the National Surgical Adjuvant Breast Project (NSABP) B-17 Trial. Unanswered questions remaining unanswered considering current concepts of ductal carcinoma in situ. Cancer 75 (6): 1219-22; discussion 1223-7, 1995. [PUBMED Abstract]
- Fisher ER, Costantino J, Fisher B, et al.: Response - blunting the counterpoint. Cancer 75 (6): 1223-1227, 1995.
- Holland R, Peterse JL, Millis RR, et al.: Ductal carcinoma in situ: a proposal for a new classification. Semin Diagn Pathol 11 (3): 167-80, 1994. [PUBMED Abstract]
- Silverstein MJ, Lagios MD, Craig PH, et al.: A prognostic index for ductal carcinoma in situ of the breast. Cancer 77 (11): 2267-74, 1996. [PUBMED Abstract]
- Silverstein MJ, Lagios MD, Groshen S, et al.: The influence of margin width on local control of ductal carcinoma in situ of the breast. N Engl J Med 340 (19): 1455-61, 1999. [PUBMED Abstract]
- Goodwin A, Parker S, Ghersi D, et al.: Post-operative radiotherapy for ductal carcinoma in situ of the breast--a systematic review of the randomised trials. Breast 18 (3): 143-9, 2009. [PUBMED Abstract]
- Fisher B, Dignam J, Wolmark N, et al.: Tamoxifen in treatment of intraductal breast cancer: National Surgical Adjuvant Breast and Bowel Project B-24 randomised controlled trial. Lancet 353 (9169): 1993-2000, 1999. [PUBMED Abstract]
- Houghton J, George WD, Cuzick J, et al.: Radiotherapy and tamoxifen in women with completely excised ductal carcinoma in situ of the breast in the UK, Australia, and New Zealand: randomised controlled trial. Lancet 362 (9378): 95-102, 2003. [PUBMED Abstract]
- Margolese RG, Cecchini RS, Julian TB, et al.: Anastrozole versus tamoxifen in postmenopausal women with ductal carcinoma in situ undergoing lumpectomy plus radiotherapy (NSABP B-35): a randomised, double-blind, phase 3 clinical trial. Lancet 387 (10021): 849-56, 2016. [PUBMED Abstract]
- Forbes JF, Sestak I, Howell A, et al.: Anastrozole versus tamoxifen for the prevention of locoregional and contralateral breast cancer in postmenopausal women with locally excised ductal carcinoma in situ (IBIS-II DCIS): a double-blind, randomised controlled trial. Lancet 387 (10021): 866-73, 2016. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (05/08/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Tratamiento quirúrgico del cáncer de mama
Se añadió texto para indicar que, a pesar que la biopsia de ganglio linfático centinela (GLC) ha sido el procedimiento estándar para la estadificación axilar de las pacientes con cáncer de mama invasivo y axila sin compromiso clínico, en 2 ensayos controlados aleatorizados se identificaron poblaciones en las que la biopsia de GLC se podría omitir. En el ensayo SOUND, se asignaron al azar a 1493 mujeres con cáncer de mama invasivo para someterse a biopsia de GLC o no someterse a cirugía. Eran pacientes de cualquier edad con tumores de menos de 2 cm que contaban con una ecografía axilar negativa preoperatoria y planeaban someterse a una cirugía con conservación de la mama y radioterapia adyuvante (se citó a Gentilini et al. como referencia 34 y un nivel de evidencia A1). En el ensayo INSEMA, se asignó al azar a 5502 mujeres con cáncer de mama invasivo sin compromiso ganglionar clínico a no someterse a cirugía o someterse a biopsia de GLC. Los tumores debían medir menos de 5 cm y la mayoría de las pacientes tenían enfermedad T1 y tumores positivos para ER. Las pacientes tenían programada la cirugía con conservación de la mama y radioterapia de toda la mama (se citó a Reimer et al. como referencia 35 y un nivel de evidencia A1).
Terapia sistémica para el cáncer de mama en estadios I, II y III
Se añadió texto sobre un ensayo sin enmascaramiento que se hizo en Japón en el que se incluyeron 1697 pacientes que habían recibido lo siguiente: 1) 5 años de anastrozol; o 2) 2 a 3 años de tamoxifeno, seguido de 2 a 3 años de anastrozol. Las pacientes se asignaron al azar para suspender el tratamiento con anastrozol o continuarlo durante 5 años (se citó a Iwase et al. como referencia 88 y un nivel de evidencia B1).
Se revisó el texto sobre un ensayo en el que se examinó el efecto de añadir abemaciclib a la terapia endocrina estándar en mujeres con cáncer de mama positivo para receptores hormonales y negativo para HER2 con un riesgo alto de recidiva. Se encontraron resultados similares en un análisis de subgrupos preespecificado de pacientes que recibieron quimioterapia neoadyuvante y presentaron enfermedad residual después de la cirugía (se citó a Martin et al. como referencia 91).
Se añadió Inmunoterapia como subsección nueva bajo la sección Terapia posoperatoria para el cáncer de mama triple negativo.
Se revisó el texto sobre los resultados de un ensayo de un solo grupo en el que el uso de paclitaxel y trastuzumab en 410 mujeres con tumores positivos para HER2, pequeños, sin compromiso ganglionar (se citó a Tolaney et al. como referencia 145).
Tratamiento del cáncer de mama metastásico
Se revisó el texto sobre los resultados de un ensayo aleatorizado con enmascaramiento doble de fase III en el que se evaluó la terapia de primera línea con abemaciclib o placebo y un inhibidor de la aromatasa no esteroideo en 493 mujeres posmenopáusicas con cáncer de mama avanzado positivo para receptores hormonales y negativo para HER2 (se citó a Goetz et al. como referencia 20 y un nivel de evidencia B1).
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de seno (mama) en adultas. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de seno (mama) son:
- Fumiko Chino, MD (MD Anderson Cancer Center)
- Tarek Hijal, MD (McGill University Health Centre)
- Joseph L. Pater, MD (NCIC-Clinical Trials Group)
- Carol Tweed, MD (Maryland Oncology Hematology)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de seno (mama). Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/seno/pro/tratamiento-seno-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.