Tratamiento de la leucemia mieloide aguda (PDQ®)–Versión para profesionales de salud
Información general sobre la leucemia mieloide aguda
La leucemia mieloide aguda (LMA) también se conoce como leucemia mielógena aguda y leucemia no linfocítica aguda.
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por LMA en los Estados Unidos para 2025:[1]
- Casos nuevos: 22 010.
- Defunciones: 11 090.
A partir de datos del Surveillance, Epidemiology, and End Results (SEER) Program, de 2014 a 2020, el 31,9 % de los pacientes con LMA seguían vivos 5 años después del diagnóstico.[2]
Características anatómicas
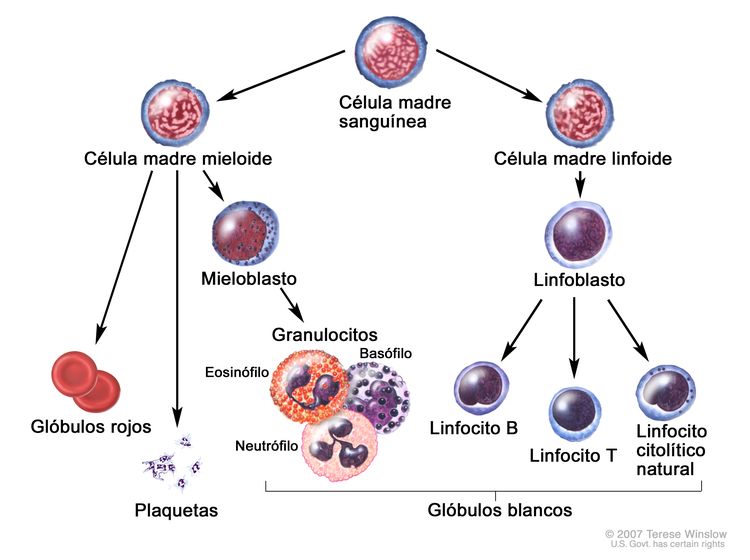
La LMA es un grupo heterogéneo de neoplasias hemáticas que son resultado de la expansión clonal de precursores hematopoyéticos mieloides en la médula ósea. No solo se observa la circulación de células leucémicas (también llamadas blastocitos) en la sangre periférica, sino que también son comunes la granulocitopenia, la anemia y la trombocitopenia porque la proliferación de células leucémicas interfiere con la hematopoyesis normal.[3]
Cuadro clínico inicial
El diagnóstico de LMA es infrecuente antes de los 45 años de edad; la mediana de edad en el momento del diagnóstico es de 69 años.[2] Los pacientes quizás exhiban los siguientes síntomas durante el cuadro clínico inicial:
- Debilidad.
- Fiebre.
- Infección.
- Palidez.
- Hemorragia.
La disminución en la producción de glóbulos sanguíneos normales debido a la infiltración leucémica de la médula ósea también da lugar a otros síntomas y complicaciones. Con menos frecuencia, los pacientes presentan signos o síntomas relacionados con la acumulación de células leucémicas en ciertas ubicaciones anatómicas, como el compromiso del sistema nervioso central (SNC), el compromiso testicular, o la presencia de un sarcoma mieloide (también llamado cloroma). Los síntomas de la leucemia aguda suelen surgir en un periodo de 4 a 6 semanas antes del diagnóstico.[3]
Evaluación diagnóstica
La diferenciación de la LMA de otras formas de leucemia, en particular la leucemia mieloide crónica y la leucemia linfocítica aguda, tiene implicaciones terapéuticas fundamentales. La herramienta principal para determinar el diagnóstico es la citometría de flujo con el fin de evaluar los antígenos de superficie en las células leucémicas. Un simple estudio morfológico no es adecuado para determinar el linaje y, como mínimo, se necesitan tinciones histoquímicas especiales. Si bien es posible establecer el diagnóstico mediante la evaluación de la sangre periférica, se emplea una biopsia de la médula ósea para evaluar las características morfológicas y los marcadores de superficie celular, y también permite obtener material para el análisis citogenético y molecular. Se necesita un recuento de blastocitos en la sangre periférica o la médula ósea del 20 % o más para establecer el diagnóstico, excepto en los casos con ciertas anomalías cromosómicas (es decir, t(15;17), t(8;21), inv(16) o t(16;16)).[4]
Pronóstico y factores pronósticos
Si bien las tasas de casos nuevos de LMA no han cambiado de manera significativa durante los últimos 10 años, las muertes ajustadas por edad han disminuido.[2] La intensidad del tratamiento deberá ser suficiente para lograr una respuesta completa (RC), puesto que la remisión parcial no ofrece beneficios importantes de supervivencia. Se anticipa que alrededor del 60 % al 70 % de los adultos con LMA logren un estado de RC después de la terapia de inducción apropiada. Se proyecta que más del 25 % de los adultos con LMA (cerca del 45 % de los que logran una RC) sobrevivirán 3 años o más, y es posible que se curen.
Cerca de la mitad de los pacientes con LMA albergan anomalías cromosómicas; por ello, el análisis citogenético convencional sigue siendo obligatorio durante la evaluación de una presunta LMA.[5,6] El uso sistemático de las pruebas diagnósticas moleculares, la identificación de variantes patogénicas de NPM1, FLT3, CEPBA y RUNX1, y otros genes, se ha vuelto una parte rutinaria para determinar el pronóstico. Los análisis citogenéticos y moleculares proporcionan la información más sólida para el pronóstico, lo que permite anticipar el desenlace después de la inducción a la remisión y la terapia de consolidación.[7] Se ha combinado la información citogenética y molecular para formar grupos pronósticos específicos.
Otros factores de pronóstico adverso de la LMA son los siguientes:
- Edad en el momento del diagnóstico. Las tasas de remisión de la LMA en adultos exhiben una relación inversa con la edad, se anticipa una tasa de remisión superior al 65 % en pacientes menores de 60 años. Hay datos que indican que la duración de la remisión quizás es inferior en los pacientes de edad más avanzada. El aumento de la morbilidad y mortalidad durante la inducción guarda relación directa con la edad.
- Compromiso leucémico en el sistema nervioso central.
- Infección sistémica en el momento del diagnóstico.
- Leucocitosis (>100 000/mm3) en el momento del diagnóstico.
- Neoplasias mieloides relacionadas con el tratamiento a base de alquilantes y radioterapia.
- Antecedentes de síndrome mielodisplásico u otro trastorno hemático previo.
Efectos a largo plazo del tratamiento del cáncer
El riesgo de cualquier efecto a largo plazo depende del tipo y la dosis del tratamiento, y de la edad a la que el paciente recibió tratamiento.
En un estudio de 30 pacientes con LMA en remisión durante por lo menos 10 años, se observó una incidencia del 13 % de neoplasias malignas secundarias.[8] De 31 mujeres sobrevivientes a largo plazo de LMA o leucemia linfoblástica aguda (LLA) diagnosticadas antes de los 40 años, 26 mujeres recuperaron la menstruación normal después del tratamiento. Entre 36 hijos nacidos con vida de sobrevivientes de leucemia, 2 presentaron problemas congénitos.[8]
La mayoría de los pacientes con LMA que se someten a tratamiento intensivo reciben una antraciclina. Las antraciclinas se han vinculado con un mayor riesgo de insuficiencia cardíaca congestiva (ICC).[9] La cardiotoxicidad de las antraciclinas depende de la dosis. En un estudio, la ICC relacionada con la doxorrubicina fue del 5 % con una dosis acumulada de por vida de 400 mg/m2, hasta alcanzar el 26 % con una dosis acumulada de 550 mg/m2.[10] En muchos casos, la insuficiencia cardíaca se manifiesta como un efecto tardío.[11] En un análisis de niños que recibieron tratamiento por una leucemia aguda, la incidencia acumulada de ICC a 10 años fue del 1,7 % en los casos de LLA y del 7,5 % en los casos de LMA.[12]
Los pacientes que reciben un trasplante alogénico de células madre hematopoyéticas a veces presentan múltiples efectos secundarios a largo plazo o efectos tardíos a causa de la quimioterapia y la radiación de dosis altas y como un efecto de la enfermedad de injerto contra huésped crónica y la inmunodepresión. Estos efectos secundarios quizás incluyan fatiga crónica, disfunción tiroidea y gonadal, infertilidad, infección crónica, enfermedad coronaria acelerada, osteopenia, cataratas, sobrecarga de hierro, resultados psicológicos adversos, además de segundos cánceres.[13-15]
En el Bone Marrow Transplant Survivor Study, los sobrevivientes de trasplante de células hematopoyéticas presentaron envejecimiento acelerado y una probabilidad 8,4 veces mayor de fragilidad en comparación con sus hermanos (intervalo de confianza [IC] 95 %, 2,0−34,5; (P = 0,003). En un análisis multivariante, la fragilidad se vinculó con un aumento de 2,76 veces del riesgo de muerte en comparación con un estado sin fragilidad (IC 95 %, 1,7−4,4; P < 0,001).[16]
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Surveillance, Epidemiology, and End Results Program: Cancer Stat Facts: Leukemia — Acute Myeloid Leukemia (AML). Bethesda, Md: National Cancer Institute, DCCPS, Surveillance Research Program, 2020. Available online. Last accessed January 24, 2025.
- Sekeres MA, Gerds AT: Mitigating Fear and Loathing in Managing Acute Myeloid Leukemia. Semin Hematol 52 (3): 249-55, 2015. [PUBMED Abstract]
- Swerdlow SH, Campo E, Harris NL, et al., eds.: WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th rev. ed. International Agency for Research on Cancer, 2017.
- Slovak ML, Kopecky KJ, Cassileth PA, et al.: Karyotypic analysis predicts outcome of preremission and postremission therapy in adult acute myeloid leukemia: a Southwest Oncology Group/Eastern Cooperative Oncology Group Study. Blood 96 (13): 4075-83, 2000. [PUBMED Abstract]
- Grimwade D, Walker H, Harrison G, et al.: The predictive value of hierarchical cytogenetic classification in older adults with acute myeloid leukemia (AML): analysis of 1065 patients entered into the United Kingdom Medical Research Council AML11 trial. Blood 98 (5): 1312-20, 2001. [PUBMED Abstract]
- Döhner H, Estey E, Grimwade D, et al.: Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood 129 (4): 424-447, 2017. [PUBMED Abstract]
- Micallef IN, Rohatiner AZ, Carter M, et al.: Long-term outcome of patients surviving for more than ten years following treatment for acute leukaemia. Br J Haematol 113 (2): 443-5, 2001. [PUBMED Abstract]
- Steinherz LJ, Steinherz PG, Tan CT, et al.: Cardiac toxicity 4 to 20 years after completing anthracycline therapy. JAMA 266 (12): 1672-7, 1991. [PUBMED Abstract]
- Swain SM, Whaley FS, Ewer MS: Congestive heart failure in patients treated with doxorubicin: a retrospective analysis of three trials. Cancer 97 (11): 2869-79, 2003. [PUBMED Abstract]
- Hequet O, Le QH, Moullet I, et al.: Subclinical late cardiomyopathy after doxorubicin therapy for lymphoma in adults. J Clin Oncol 22 (10): 1864-71, 2004. [PUBMED Abstract]
- Chellapandian D, Pole JD, Nathan PC, et al.: Congestive heart failure among children with acute leukemia: a population-based matched cohort study. Leuk Lymphoma 60 (2): 385-394, 2019. [PUBMED Abstract]
- Inamoto Y, Lee SJ: Late effects of blood and marrow transplantation. Haematologica 102 (4): 614-625, 2017. [PUBMED Abstract]
- Sun CL, Francisco L, Baker KS, et al.: Adverse psychological outcomes in long-term survivors of hematopoietic cell transplantation: a report from the Bone Marrow Transplant Survivor Study (BMTSS). Blood 118 (17): 4723-31, 2011. [PUBMED Abstract]
- Armenian SH, Sun CL, Kawashima T, et al.: Long-term health-related outcomes in survivors of childhood cancer treated with HSCT versus conventional therapy: a report from the Bone Marrow Transplant Survivor Study (BMTSS) and Childhood Cancer Survivor Study (CCSS). Blood 118 (5): 1413-20, 2011. [PUBMED Abstract]
- Arora M, Sun CL, Ness KK, et al.: Physiologic Frailty in Nonelderly Hematopoietic Cell Transplantation Patients: Results From the Bone Marrow Transplant Survivor Study. JAMA Oncol 2 (10): 1277-1286, 2016. [PUBMED Abstract]
Clasificación de la leucemia mieloide aguda
Clasificación de la Organización Mundial de la Salud
Un grupo de patólogos y de médicos, patrocinados por la Organización Mundial de la Salud (OMS), revisó la clasificación de la leucemia mieloide aguda (LMA).[1] Si bien se conservaron elementos de la clasificación del grupo cooperativo French-American-British (FAB) (es decir, características morfológicas, inmunofenotípicas, citogenéticas y clínicas),[2,3] la clasificación de la OMS incorpora las características morfológicas, citogenéticas y genético-moleculares, además de los marcadores inmunológicos, y los interrelaciona, lo que conforma una clasificación de aplicación universal, con repercusiones pronósticas y terapéuticas.[1,3,4] Cada criterio repercute sobre el pronóstico y el tratamiento pero, para fines prácticos, el tratamiento antileucémico inicial es similar para todos los subtipos.
En 2001, la OMS propuso un sistema de clasificación nuevo en el que incorporó información citogenética útil para el diagnóstico, que se correlaciona de forma más confiable con el desenlace. En este sistema de clasificación, también se disminuyó de un 30 % a un 20 % el porcentaje de blastocitos leucémicos en la médula ósea exigido para el diagnóstico de la LMA. Además, se introdujo una aclaración de manera que los pacientes con anomalías citogenéticas recurrentes no necesitan cumplir el requisito de blastocitos para determinar el diagnóstico de LMA.[5-7]
En 2008, la OMS aumentó el número de anomalías citogenéticas vinculadas con la clasificación de LMA y, por primera vez, incluyó variantes patogénicas específicas (CEBPA y NPM) en su sistema de clasificación.[5,8] Con el agregado de estas variantes génicas, la subclasificación FAB ya no suministraba información pronóstica para los pacientes con diagnóstico de LMA, sin otra indicación (SAI).[9]
En 2016, se revisó la clasificación de la OMS para incluir más información sobre los biomarcadores de leucemia relevantes para el diagnóstico, pronóstico y tratamiento de la leucemia.[10] A medida que surjan nuevas tecnologías que apunten a la clasificación genética, epigenética, proteómica e inmunofenotípica, la clasificación de la LMA seguirá evolucionando, y proporcionará pautas esclarecedoras del pronóstico y las características biológicas a médicos e investigadores.
Clasificación de la Organización Mundial de la Salud de 2016 para la leucemia mieloide aguda y las neoplasias relacionadas
- Leucemia mieloide aguda con anomalías genéticas recurrentes:
- Leucemia mieloide aguda con t(8;21)(q22;q22), RUNX1::RUNX1T1.
- Leucemia mieloide aguda con inv(16)(p13.1;q22) o t(16;16)(p13.1;q22), CBFB::MYH11.
- Leucemia promielocítica aguda con PML::RARA.
- Leucemia mieloide aguda con t(9;11)(p21.3;q23.3), MLLT3::KMT2A.
- Leucemia mieloide aguda con t(6;9)(p23;q34.1), DEK::NUP214.
- Leucemia mieloide aguda con inv(3)(q21.3;q26.2) o t(3;3)(q21.3;q26.2), GATA2, MECOM.
- Leucemia mieloide aguda (megacarioblástica) con t(1;22)(p13.3;q13.3), RBM15::MKL1.
- Leucemia mieloide aguda con BCR::ABL1 (entidad provisional).
- Leucemia mieloide aguda con variantes patogénicas de NPM1.
- Leucemia mieloide aguda con variantes patogénicas de CEBPA.
- Leucemia mieloide aguda con variantes patogénicas de RUNX1 (entidad provisional).
- Leucemia mieloide aguda con características relacionadas con mielodisplasia.
- Neoplasias mieloides relacionadas con el tratamiento.
- Leucemia mieloide aguda, sin otra indicación:
- Leucemia mieloide aguda con diferenciación mínima (clasificación FAB M0).
- Leucemia mieloide aguda sin maduración (clasificación FAB M1).
- Leucemia mieloide aguda con maduración (clasificación FAB M2).
- Leucemia mielomonocítica aguda (clasificación FAB M4).
- Leucemia monoblástica aguda y leucemia monocítica aguda (clasificaciones FAB M5a y M5b).
- Leucemia eritroide pura (clasificación FAB M6a y M6b).
- Leucemia megacarioblástica aguda (clasificación FAB M7)
- Leucemia basofílica aguda.
- Panmielosis aguda con mielofibrosis.
- Sarcoma mieloide.
- Proliferaciones mieloides relacionadas con el síndrome de Down:
- Mielopoyesis anormal transitoria.
- Leucemia mieloide relacionada con el síndrome de Down.
Leucemia mieloide aguda con anomalías genéticas recurrentes
La leucemia mieloide aguda (LMA) con anomalías genéticas bien definidas se caracteriza por anomalías genéticas recurrentes.[10] Las anomalías cromosómicas identificadas con mayor frecuencia son las translocaciones recíprocas t(8;21), inv(16) o t(16:16), t(15;17), y las translocaciones que afectan el sitio de ruptura 11q23. Estos reordenamientos cromosómicos estructurales producen genes de fusión que codifican proteínas quiméricas, que en ocasiones contribuyen al inicio o progresión de la leucemogénesis. Muchas de estas translocaciones se detectan por reacción en cadena de la polimerasa con retrotranscripción (RT–PCR) o hibridación fluorescente in situ (FISH), cuya sensibilidad es superior a la de los análisis citogenéticos en metafase. Otras anomalías citogenéticas recurrentes son menos comunes.
Las plataformas de diagnóstico molecular como la secuenciación de última generación, junto con la RT–PCR, se usan para identificar anomalías moleculares recurrentes en la LMA, lo que ayuda a refinar más las categorías diagnósticas en el sistema de clasificación de la OMS de 2016.[10]
Leucemia mieloide aguda con t(8;21)(q22;q22), RUNX1-RUNX1T1
La translocación t(8;21)(q22;q22) es una de las anomalías cromosómicas más comunes en la LMA, y se presenta en el 5 % al 12 % de los casos.[11] Es posible que ocurran sarcomas mieloides (cloromas) y quizás se relacionen con un porcentaje de blastocitos en la médula ósea inferior al 20 %.
Las características morfológicas comunes son las siguientes:
- Blastocitos grandes con citoplasma basofílico abundante, a menudo con numerosos gránulos azurófilos.
- En ciertos casos, algunos blastocitos exhiben gránulos muy grandes (gránulos tipo pseudosíndrome de Chediak-Higashi).
- Cuerpos de Auer, detectables en los neutrófilos maduros.
- Blastocitos más pequeños, sobre todo en la sangre periférica.
- Promielocitos, mielocitos y neutrófilos maduros con displasia variable en la médula ósea.
- Segmentación nuclear anormal (núcleos con pseudoanomalía de Pelger-Huët) o anomalías en la tinción citoplasmática.
- Aumento de los precursores eosinófilos.
- Reducción o ausencia de monocitos.
- Eritroblastos y megacariocitos normales.
En pocas ocasiones, la LMA con esta translocación se manifiesta con un porcentaje de blastocitos en la médula ósea inferior al 20 %.[5] La LMA con t(8;21), además de inv(16)(p13;q22) o t(16;16)(p13;q22), conforma una categoría conocida como LMA con factor de unión nuclear. Esta categoría de LMA se vincula con supervivencia a largo plazo cuando se administran dosis altas de citarabina.[12-15]
La translocación t(8;21)(q22;q22) afecta el gen RUNX1, que codifica CBFα, y el gen RUNX1T1 (8;21).[5,16] El transcrito de fusión RUNX1::RUNX1T1 se detecta en forma constante en pacientes de LMA con t(8;21). Esta translocación se suele relacionar con una buena respuesta a la quimioterapia, una tasa alta de remisión completa (RC) y supervivencia a largo plazo cuando se administran dosis altas de citarabina en la fase de consolidación, como se demostró en los ensayos Cancer and Leukemia Group B (CLB-9022 y CLB-8525).[12-15] A menudo hay otras anomalías cromosómicas; por ejemplo, pérdida de un cromosoma sexual y del(9)(q22). La leucocitosis (es decir, recuento de glóbulos blancos >25 x 109/l) se vincula con un desenlace precario,[17] así como la presencia de una variante patogénica de KIT.[18]
Leucemia mieloide aguda con inv(16)(p13.1;q22) o t(16;16)(p13.1;q22), CBFB::MYH11
La anomalía inv(16)(p13;q22) o la translocación t(16;16)(p13;q22) se encuentran en el 10 % al 12 % de todos los casos de LMA, sobre todo en los pacientes más jóvenes.[5,19] A veces, se observan sarcomas mieloides en el momento del diagnóstico inicial o de la recaída.
Las características morfológicas comunes son las siguientes:
- Diferenciación monocítica y granulocítica.
- Un componente típico de eosinófilos anormales con gránulos de color violáceo púrpura propios de los eosinófilos inmaduros, que cuando es abundante oculta el aspecto morfológico de las células.
- Cuerpos de Auer en los mieloblastos.
- Disminución de los neutrófilos en la médula ósea.
De la misma manera como se observa en casos infrecuentes de LMA con t(8;21), el porcentaje de blastocitos en la médula ósea en este tipo de LMA a veces es inferior al 20 %.
Tanto la inv(16)(p13;q22) como la t(16;16)(p13;q22) producen la fusión del gen CBFB en 16q22 con el gen del músculo liso MYH11 en 16p13, lo que forma el gen de fusión CBFB::MYH11.[11] Algunas veces, es necesario el uso de los métodos de FISH y RT–PCR para documentar este gen de fusión porque su presencia no siempre se registra con las técnicas citogenéticas de bandeo tradicionales.[20] De manera similar a la LMA con t(8;21), los pacientes con el gen de fusión CBFB::MYH11 alcanzan tasas más altas de RC y una supervivencia a largo plazo cuando se administran dosis altas de citarabina en el entorno de consolidación.[12,13,15] A diferencia de la LMA con t(8;21), la pertinencia para el pronóstico de las variantes patogénicas de KIT no es clara.[21]
Leucemia promielocítica aguda con PML::RARA
La leucemia promielocítica aguda (LPA) se define por la presencia de la proteína de fusión PML::RARA, por lo general, como resultado de t(15;17)(q22;q12), pero en ocasiones es críptica o se origina a partir de reordenamientos citogenéticos complejos diferentes a t(15;17)(q22;q12). Además, se trata de una LMA en la que los promielocitos son el tipo de célula leucémica dominante. Hay dos subtipos de LPA: LPA hipergranular o típica y LPA microgranular o hipogranular. La LPA comprende el 5 % al 8 % de los casos de LMA y predomina en adultos de mediana edad.[5] Es común que la LPA típica y la microgranular produzcan coagulación intravascular diseminada (CID).[22,23] En la LPA microgranular, a diferencia de la LPA típica, el recuento leucocitario es muy alto y el tiempo de duplicación es rápido.[5]
Las características morfológicas comunes de la LPA típica son las siguientes:
- Núcleos en forma de riñón o bilobulados.
- Citoplasma lleno de gránulos grandes (rosa vivo, rojo, o púrpura en las tinciones de Romanowsky).
- Haces de cuerpos de Auer dentro del citoplasma (células en haces, faggot).
- Cuerpos de Auer más grandes que en otros tipos de LMA.
- Reacción positiva intensa a la mieloperoxidasa (MPO) en todos los promielocitos leucémicos.
- Presencia ocasional de promielocitos leucémicos en sangre.
Las características morfológicas comunes de la LPA microgranular son las siguientes:
- Núcleos bilobulados.
- Gránulos escasos o ausentes (gránulos azurófilos submicroscópicos).
- Número bajo de promielocitos anómalos con gránulos visibles o haces de cuerpos de Auer (células en haces, faggot).
- Recuento elevado de leucocitos en la sangre periférica.
- Reacción positiva intensa a la MPO en todos los promielocitos leucémicos.
En la LPA, el gen RARA en 17q12 se fusiona con un factor de regulación nuclear en 15q22 (gen PML) que produce un transcrito de fusión génica PML::RARA.[24-26] En casos excepcionales de t(15;17) críptica o enmascarada, están ausentes los hallazgos citogenéticos típicos y se observan variantes de translocaciones complejas, o una inserción submicroscópica del gen RARA en el gen PML que conduce a la expresión del transcrito de fusión PML::RARA.[5] Los métodos de FISH o RT–PCR tal vez sean necesarios para descubrir estos reordenamientos genéticos crípticos.[27,28] En cerca del 1 % de los pacientes con LPA, se detectan variantes de anomalías cromosómicas caracterizadas por la fusión del gen RARA con otros genes.[29] Las variantes de translocaciones que afectan el gen RARA incluyen t(11;17)(q23;q21), t(5;17)(q32;q12) y t(11;17)(q13;q21).[5]
La LPA exhibe una sensibilidad específica al tratamiento con ácido holo-trans-retinoico (ATRA, ácido retinoico o tretinoína), que actúa como diferenciador.[30-32] Es posible obtener tasas altas de RC y supervivencia sin enfermedad a largo plazo en pacientes con LPA cuando se usa una combinación de tratamiento con ATRA y quimioterapia,[33] o cuando se usa un régimen de trióxido de arsénico sin quimioterapia.[34]
Leucemia mieloide aguda con t(9;11)(p21.3;q23.3), MLLT3::KMT2A
La LMA con anomalías en 11q23 representa el 5 % al 6 % de los casos de LMA, y por lo general exhibe características monocíticas. Este tipo de LMA es más común en los niños. Dos subgrupos clínicos que tienen una frecuencia alta de LMA con anomalías en 11q23 son los lactantes con LMA y los pacientes con LMA relacionada con el tratamiento, por lo general después de recibir inhibidores de la topoisomerasa del DNA. A veces, los pacientes presentan CID y sarcomas monocíticos extramedulares o infiltración tisular (encías o piel).[5]
Las características morfológicas comunes son las siguientes:
- Monoblastos y promonocitos predominantes en la médula ósea.
- Monoblastos y promonocitos con reacciones positivas intensas a esterasas inespecíficas.
El gen MLLT3 en 11q23, un regulador epigenético que participa en translocaciones y se ha identificado en cerca de 135 reordenamientos diferentes hasta el momento.[35] En ocasiones, otros genes además de MLLT3 están involucrados en anomalías de 11q23.[36] Tal vez se requiera el uso de FISH para detectar anomalías genéticas que afecten al gen KMT2A (también conocido como MLL).[36-38] En general, las categorías de riesgo y el pronóstico para cada una de las translocaciones de 11q23 son difíciles de determinar debido a la falta de estudios con una cantidad significativa de pacientes; no obstante, se ha notificado que los pacientes con t(11;19)(q23;p13.1) tienen desenlaces precarios.[13]
Leucemia mieloide aguda con t(6;9)(p23;q34.1), DEK::NUP214
La translocación t(6;9) conduce a la formación de una proteína de fusión DEK::NUP214 que se relaciona con leucemia y está presente en cerca del 1 % de los casos de LMA.[39-41] NUP214 es un componente del complejo de poros nucleares. Este subgrupo de LMA se ha vinculado con un pronóstico precario.[39,42,43]
Leucemia mieloide aguda con inv(3)(q21.3;q26.2) o t(3;3)(q21.3;q26.2), GATA2, MECOM
La anomalía inv(3) o la translocación t(3;3) son infrecuentes y representan alrededor del 1 % de todos los casos de LMA.[41] El gen MECOM del cromosoma 3q26 codifica dos proteínas reguladoras de la transcripción: EVI1 y MDS1-EVI1. Las anomalías inv(3) y t(3;3) no conducen a un gen de fusión, más bien reubican el potenciador distal de GATA2, lo que produce una sobreexpresión de EVI1, y al mismo tiempo confieren haploinsuficiencia de GATA2.[44,45] Estas anomalías acarrean un pronóstico precario.[15,46,47] Las anomalías que afectan MECOM se detectan en algunos casos de LMA que presentan otras anomalías en 3q y que también se relacionaron con un pronóstico precario.
Leucemia mieloide aguda (megacarioblástica) con t(1;22)(p13.3;q13.3), RBM15::MKL1
La translocación t(1;22)(p13;q13) que produce el gen de fusión RBM15::MKL1 es un oncoiniciadora poco frecuente de LMA infantil (<1 % de las LMA infantiles) y se limita a la leucemia megacariocítica aguda. Para obtener más información, consultar Tratamiento de la leucemia mieloide aguda infantil.
Leucemia mieloblástica aguda con BCR::ABL1 (entidad provisional)
La OMS agregó esta entidad provisional en 2016 como iniciativa para reconocer que los pacientes que producen la proteína de fusión BCR::ABL1 deben recibir tratamiento con inhibidores de tirosina–cinasas.[10] Sin embargo, esta entidad es muy difícil de diferenciar de la leucemia mieloide crónica (LMC) en fase blástica (LMC-FB). La pérdida de IKZF1 o CDKN2A ayuda a diferenciar entre casos verdaderos de LMA con BCR::ABL1 y la LMC-FB.[48] Para obtener más información, consultar Tratamiento de la leucemia mieloide crónica.
Leucemia mieloide aguda con variantes patogénicas de NPM1
La NPM1 es una proteína vinculada con el ensamblaje y trasporte proteico en los ribosomas; además es una chaperona molecular que participa en la prevención de la agregación proteica en el nucléolo. Los métodos inmunohistoquímicos sirven para identificar con exactitud a los pacientes con variantes patogénicas de NPM1 porque se demuestra la localización citoplasmática de NPM.[49] La proteína NPM1 anormal está disminuida en su localización nuclear y conducen a una diferenciación hematopoyética defectuosa. Por lo general, estas variantes se vinculan con un cariotipo normal (50 %) y, con menor frecuencia, se observan junto con un cariotipo anormal (<10 %) o un cariotipo complejo (<3 %).[50-52] La presencia de una variante patogénica de NPM1 confiere un mejor pronóstico en ausencia de variantes por duplicación interna en tándem (ITD) en FLT3.[50,53,54]
Leucemia mieloide aguda con variantes patogénicas de CEBPA
En los adultos menores de 60 años, el 10 % al 15 % de los casos de LMA con características citogenéticas normales tienen variantes patogénicas de CEBPA.[53,55] El gen CEBPA está ubicado en el cromosoma 19 y codifica un factor de transcripción que coordina la diferenciación mieloide y la interrupción de la proliferación celular.[56]
El desenlace de los pacientes con LMA que presentan variantes patogénicas de CEBPA es relativamente favorable, y es similar al de los pacientes que tienen leucemias con factor de unión nuclear.[53,57] En estudios se observó un pronóstico favorable para la LMA con variantes bialélicas de CEBPA, pero no para la LMA con variantes monoalélicas de CEBPA.[55,58-60] Estos hallazgos llevaron a la revisión de la OMS en 2016 donde se incluyó la presencia de variantes bialélicas en la definición de este subtipo.[10]
Leucemia mieloide aguda con variantes patogénicas de RUNX1 (entidad provisional)
La LMA con variantes patogénicas de RUNX1, que es una entidad provisional en la clasificación de la OMS de 2016 para la LMA y las neoplasias relacionadas, designa una población diferenciada de LMA de nueva aparición que no exhibe características relacionadas con el síndrome mielodisplásico (SMD).[61] Las variantes de RUNX1 acarrean un riesgo alto de fracaso terapéutico.[62-64]
Leucemia mieloide aguda con características relacionadas con mielodisplasia
La LMA con características relacionadas con mielodisplasia se caracteriza por un 20 % o más de blastocitos en sangre o médula ósea, y displasia en dos o más líneas celulares mieloides, que en general incluye los megacariocitos.[5] Para el diagnóstico, se debe encontrar displasia en el 50 % o más de las células de por lo menos dos linajes, y en una muestra de médula ósea antes del tratamiento, o se debe encontrar una anomalía citogenética relacionada con el SMD.[5] La LMA con características relacionadas con mielodisplasia puede aparecer de novo, después de un SMD o superpuesta a una neoplasia mielodisplásica o mieloproliferativa. Siempre que el SMD preceda a la LMA se debe usar la terminología diagnóstica de LMA con características relacionadas con mielodisplasia que surge de un síndrome mielodisplásico.[5] Cuando hay variantes de NPM1 o variantes bialélicas de CEBPA, la displasia multilinaje por sí sola no permite que un caso se clasifique como LMA con cambios relacionados con mielodisplasia.[5] Para obtener más información, consultar Tratamiento de los síndromes mielodisplásicos y Tratamiento de las neoplasias mielodisplásicas o mieloproliferativas.
La LMA con características relacionadas con mielodisplasia se presenta sobre todo en pacientes de edad más avanzada.[5] Los pacientes de LMA con características relacionadas con mielodisplasia a menudo presentan pancitopenia grave.
Las características morfológicas comunes son las siguientes:
- Displasia multilinaje en la sangre o la médula ósea.
- Displasia en el 50 % o más de las células de 2 o más líneas celulares.
- Disgranulopoyesis (neutrófilos con citoplasma hipogranular, núcleos hiposegmentados o núcleos con segmentación atípica).
- Diseritropoyesis (núcleos megaloblásticos, cariorrexis o multinucleación de precursores eritroides y sideroblastos en anillo).
- Dismegacariopoyesis (micromegacariocitos y megacariocitos de tamaño normal o grande, con núcleos monolobulados o múltiples núcleos delimitados).
Las anomalías cromosómicas observadas en la LMA con características relacionadas con mielodisplasia son similares a las observadas en los SMD y, con frecuencia, incluyen ganancia o pérdida de segmentos grandes de ciertos cromosomas, entre los que predominan los cromosomas 5 y 7. Se notificó que el diagnóstico de LMA con características relacionadas con mielodisplasia afecta de manera adversa la probabilidad de lograr una RC.[65-67]
Neoplasias mieloides relacionadas con el tratamiento
Las neoplasias mieloides relacionadas con el tratamiento (NM-t) comprenden la LMA (LMA-t) y los SMD (SMD-t) secundarios a la quimioterapia citotóxica o la radioterapia.[5] Los SMD relacionados con el tratamiento (o secundarios) se incluyen debido a sus estrechos vínculos clinicopatológicos con la LMA relacionada con el tratamiento. Si bien estos trastornos relacionados con el tratamiento se distinguen por los mutágenos específicos involucrados, en un estudio reciente se indica la dificultad de establecer esta diferenciación debido al frecuente uso superpuesto de múltiples mutágenos durante el tratamiento del cáncer.[68] La anomalía citogenética relacionada, no el mutágeno, determina el pronóstico y el tratamiento, por lo tanto, la anomalía se debe indicar en el diagnóstico.[10]
Desde que se estableció un vínculo de las NM-t con variantes patogénicas germinales de los genes de susceptibilidad al cáncer, se justifica el empleo de pruebas genéticas germinales o asesoramiento genético en personas con antecedentes familiares de cáncer sólidos.[69]
Neoplasias mieloides relacionadas con alquilantes
Las leucemias agudas y los síndromes mielodisplásicos relacionados con alquilantes o radiación suelen presentarse 5 y 6 años después de la exposición al mutágeno, con un intervalo notificado de entre 10 y 192 meses.[70,71] El riesgo de su aparición depende de la dosis acumulada total del alquilante y de la edad del paciente.
Se han observado anomalías citogenéticas en más del 90 % de los casos de NM-t, en su mayoría en los cromosomas 5 o 7.[70,72,73] Las anomalías cromosómicas complejas (≥3 anomalías diferentes) constituyen el hallazgo más común.[68,72-74]
Neoplasias mieloides relacionadas con inhibidores de la topoisomerasa II
Este tipo de neoplasia mieloide se presenta en pacientes tratados con inhibidores de la topoisomerasa II. Estos fármacos abarcan las epipodofilotoxinas, etopósido y tenipósido, además de las antraciclinas, doxorrubicina y 4-epi-doxorrubicina.[70] El período medio de latencia desde el inicio del tratamiento causal hasta que aparece la NM-t es de cerca de 2 años.[75]
Al igual que en las NM-t relacionadas con alquilantes o radiación, las anomalías citogenéticas suelen ser complejas.[68,72-74] El hallazgo citogenético predominante son las anormalidades del cromosoma 11q23 y las variantes patogénicas del gen KMT2A.[68,76]
Leucemia mieloide aguda, sin otra indicación
La categoría de leucemia mieloide aguda (LMA), sin otra indicación (SAI) abarca los casos de LMA que no satisfacen los criterios para la LMA con anomalías genéticas recurrentes, la LMA con características relacionadas con mielodisplasia o una neoplasia mieloide relacionada con mielodisplasia (NM-t).[10] Conforme se mencionó antes, las subcategorías de LMA, SAI carecen de importancia pronóstica cuando no está claro si hay variantes patogénicas de NPM1 y CEBPA.[9] La clasificación en este subconjunto de LMA se basa en las características morfológicas, citoquímicas y de maduración de las células leucémicas (es decir, el sistema de clasificación FAB) e incluye los siguientes tipos:[5]
- Leucemia mieloide aguda con diferenciación mínima.
- Leucemia mieloide aguda sin maduración.
- Leucemia mieloide aguda con maduración.
- Leucemia mielomonocítica aguda.
- Leucemia monoblástica aguda o leucemia monocítica aguda.
- Leucemia eritroide pura.
- Leucemia megacarioblástica aguda.
- Leucemia basofílica aguda.
- Panmielosis aguda con mielofibrosis.
Sarcoma mieloide
El sarcoma mieloide (conocido también como tumor mieloide extramedular, sarcoma granulocítico y cloroma) es una masa tumoral que contiene mieloblastos o células mieloides inmaduras en un sitio extramedular.[5] Se ha notificado sarcoma mieloide en el 2 % al 8 % de los pacientes con LMA.[77] Las características clínicas incluyen su manifestación habitual en las estructuras óseas subperiósticas del cráneo, los senos paranasales, el esternón, las costillas, las vértebras y la pelvis; compromiso ganglionar, cutáneo, mediastínico, del intestino delgado y el espacio epidural; así como presentación de novo o concomitante con la LMA o un trastorno mieloproliferativo.[10,77,78]
Las características morfológicas y citoquímicas son las siguientes:
- Sarcoma granulocítico compuesto por mieloblastos, neutrófilos y precursores de neutrófilos con tres subtipos según su grado de maduración (es decir, blástico, inmaduro y diferenciado).
- Sarcoma monoblástico que precede a una leucemia monoblástica aguda o se presenta de manera simultánea.
- Tumores con hematopoyesis trilinaje y transformación de trastornos mieloproliferativos crónicos.
- Mieloblastos y neutrófilos positivos para la mieloperoxidasa (MPO).
- Neutrófilos positivos para la naftol-ASD-cloroacetato–esterasa.
La determinación del inmunofenotipo con anticuerpos para la MPO, la lisozima y el cloroacetato es esencial para el diagnóstico de estas lesiones.[5] Los mieloblastos en los sarcomas granulocíticos expresan antígenos mieloides (CD13, CD33, CD117 y MPO). Los monoblastos en los sarcomas monoblásticos expresan antígenos propios de la leucemia monoblástica aguda (CD14, CD116 y CD11c) y, por lo general, reaccionan con anticuerpos a la lisozima y al CD68. El diagnóstico diferencial principal abarca el linfoma no Hodgkin de tipo linfoblástico, el linfoma de Burkitt, el linfoma de células grandes y los tumores de células redondas pequeñas, en especial, en la niñez (por ejemplo, neuroblastoma, rabdomiosarcoma, tumores de Ewing o neuroectodérmicos primitivos y meduloblastoma). Cuando sea posible, se debe obtener un estudio FISH para identificar anomalías cromosómicas comunes, así como estudios moleculares para corroborar el diagnóstico y facilitar la determinación del pronóstico.
No hay anomalías cromosómicas exclusivas que se relacionen con el sarcoma mieloide.[77,79] La presencia de un sarcoma mieloide en los pacientes con LMA con t(8;21), que por lo demás tienen un pronóstico favorable, a veces se relaciona con una tasa de RC más baja y una remisión más corta.[80] El sarcoma mieloide que ocurre en pacientes con SMD o trastorno mieloproliferativo equivale a una transformación blástica (progresión a LMA). En el caso de la LMA, el pronóstico corresponde al de la leucemia subyacente.[10] Si bien el cuadro clínico inicial del sarcoma mieloide quizás indique que es un sarcoma aislado, de hecho es una manifestación parcial de una enfermedad sistémica y se debe tratar con quimioterapia intensiva.[77,78,81,82]
Proliferaciones mieloides relacionadas con el síndrome de Down
Para obtener más información sobre la mielopoyesis anormal transitoria (MAT) y la leucemia mieloide relacionada con el síndrome de Down, consultar Tratamiento de las proliferaciones mieloides del síndrome de Down en la niñez.
Leucemias agudas de linaje ambiguo
Las leucemias agudas de linaje ambiguo son tipos raros de leucemia aguda en los que las características morfológicas, citoquímicas e inmunofenotípicas de la población de blastocitos no permiten clasificarlas en las categorías mieloide o linfoide, o son tipos que presentan características morfológicas o inmunofenotípicas de células mieloides y linfoides o de los linajes B y T (es decir, leucemia bilineal aguda y leucemia bifenotípica aguda).[10,83,84]
Estas leucemias comprenden las siguientes subcategorías:[5]
- Leucemia aguda indiferenciada.
- Leucemia aguda de fenotipo mixto con t(9;22)(q34.1;q11.2) y BCR::ABL1.
- Leucemia aguda de fenotipo mixto con t(v;11q23.3) y reordenamiento de KMT2A.
- Leucemia aguda de fenotipo mixto, B/mieloide, sin otra indicación.
- Leucemia aguda de fenotipo mixto, T/mieloide, sin otra indicación.
Se diagnostica una leucemia aguda de fenotipo mixto (LAFM) si hay expresión de antígenos de más de un linaje:[5]
| Diagnóstico | Criterios |
|---|---|
| MPO = mieloperoxidasa. | |
| Linaje mieloide | MPO (citometría de flujo, prueba inmunohistoquímica o citoquímica) o diferenciación monocítica (≥ 2 de los siguientes aspectos: prueba citoquímica de esterasa inespecífica, CD11c, CD14, CD64 o lisozima). |
| Linaje de células T | CD3 citoplasmático intenso (con anticuerpos contra la cadena ε de CD3); o CD3 de superficie. |
| Linaje de células B | CD19 intenso con ≥1 de los siguientes aspectos con expresión intensa: CD79a citoplasmático, cCD22 o CD10; o CD19 débil con al menos dos de los siguientes con expresión intensa: CD79a, cCD22 o CD10. |
En un porcentaje alto de leucemias agudas de linaje ambiguo se observan anomalías citogenéticas.[85-88] Alrededor del 33 % de los casos exhiben el cromosoma Filadelfia y algunos casos presentan t(4;11)(q21;q23) u otras anomalías de 11q23. En general, el pronóstico es desfavorable. Las anomalías de 11q23 o BCR::ABL1 son, en particular, indicadoras de un pronóstico desfavorable;[86,89,90] sin embargo, los resultados preliminares indican que es posible utilizar inhibidores de tirosina–cinasas en forma satisfactoria.[91,92]
Bibliografía
- Brunning RD, Matutes E, Harris NL, et al.: Acute myeloid leukaemia: introduction. In: Jaffe ES, Harris NL, Stein H, et al., eds.: Pathology and Genetics of Tumours of Haematopoietic and Lymphoid Tissues. IARC Press, 2001. World Health Organization Classification of Tumours, 3, pp 77-80.
- Bennett JM, Catovsky D, Daniel MT, et al.: Proposed revised criteria for the classification of acute myeloid leukemia. A report of the French-American-British Cooperative Group. Ann Intern Med 103 (4): 620-5, 1985. [PUBMED Abstract]
- Cheson BD, Cassileth PA, Head DR, et al.: Report of the National Cancer Institute-sponsored workshop on definitions of diagnosis and response in acute myeloid leukemia. J Clin Oncol 8 (5): 813-9, 1990. [PUBMED Abstract]
- Bennett JM, Catovsky D, Daniel MT, et al.: Proposals for the classification of the acute leukaemias. French-American-British (FAB) co-operative group. Br J Haematol 33 (4): 451-8, 1976. [PUBMED Abstract]
- Swerdlow SH, Campo E, Harris NL, et al., eds.: WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th rev. ed. International Agency for Research on Cancer, 2017.
- Jaffe ES, Harris NL, Stein H, et al., eds.: Pathology and Genetics of Tumours of Haematopoietic and Lymphoid Tissues. IARC Press, 2001. World Health Organization Classification of Tumours, 3.
- Hasle H, Niemeyer CM, Chessells JM, et al.: A pediatric approach to the WHO classification of myelodysplastic and myeloproliferative diseases. Leukemia 17 (2): 277-82, 2003. [PUBMED Abstract]
- Arber DA, Vardiman JW, Brunning RD: Acute myeloid leukaemia with recurrent genetic abnormalities. In: Swerdlow SH, Campo E, Harris NL, et al., eds.: WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th ed. International Agency for Research on Cancer, 2008, pp 110-23.
- Walter RB, Othus M, Burnett AK, et al.: Significance of FAB subclassification of "acute myeloid leukemia, NOS" in the 2008 WHO classification: analysis of 5848 newly diagnosed patients. Blood 121 (13): 2424-31, 2013. [PUBMED Abstract]
- Arber DA, Orazi A, Hasserjian R, et al.: The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 127 (20): 2391-405, 2016. [PUBMED Abstract]
- Caligiuri MA, Strout MP, Gilliland DG: Molecular biology of acute myeloid leukemia. Semin Oncol 24 (1): 32-44, 1997. [PUBMED Abstract]
- Bloomfield CD, Lawrence D, Byrd JC, et al.: Frequency of prolonged remission duration after high-dose cytarabine intensification in acute myeloid leukemia varies by cytogenetic subtype. Cancer Res 58 (18): 4173-9, 1998. [PUBMED Abstract]
- Byrd JC, Mrózek K, Dodge RK, et al.: Pretreatment cytogenetic abnormalities are predictive of induction success, cumulative incidence of relapse, and overall survival in adult patients with de novo acute myeloid leukemia: results from Cancer and Leukemia Group B (CALGB 8461). Blood 100 (13): 4325-36, 2002. [PUBMED Abstract]
- Palmieri S, Sebastio L, Mele G, et al.: High-dose cytarabine as consolidation treatment for patients with acute myeloid leukemia with t(8;21). Leuk Res 26 (6): 539-43, 2002. [PUBMED Abstract]
- Grimwade D, Walker H, Oliver F, et al.: The importance of diagnostic cytogenetics on outcome in AML: analysis of 1,612 patients entered into the MRC AML 10 trial. The Medical Research Council Adult and Children's Leukaemia Working Parties. Blood 92 (7): 2322-33, 1998. [PUBMED Abstract]
- Downing JR: The AML1-ETO chimaeric transcription factor in acute myeloid leukaemia: biology and clinical significance. Br J Haematol 106 (2): 296-308, 1999. [PUBMED Abstract]
- Schlenk RF, Benner A, Krauter J, et al.: Individual patient data-based meta-analysis of patients aged 16 to 60 years with core binding factor acute myeloid leukemia: a survey of the German Acute Myeloid Leukemia Intergroup. J Clin Oncol 22 (18): 3741-50, 2004. [PUBMED Abstract]
- Duployez N, Marceau-Renaut A, Boissel N, et al.: Comprehensive mutational profiling of core binding factor acute myeloid leukemia. Blood 127 (20): 2451-9, 2016. [PUBMED Abstract]
- Marlton P, Keating M, Kantarjian H, et al.: Cytogenetic and clinical correlates in AML patients with abnormalities of chromosome 16. Leukemia 9 (6): 965-71, 1995. [PUBMED Abstract]
- Poirel H, Radford-Weiss I, Rack K, et al.: Detection of the chromosome 16 CBF beta-MYH11 fusion transcript in myelomonocytic leukemias. Blood 85 (5): 1313-22, 1995. [PUBMED Abstract]
- Döhner K, Paschka P: Intermediate-risk acute myeloid leukemia therapy: current and future. Hematology Am Soc Hematol Educ Program 2014 (1): 34-43, 2014. [PUBMED Abstract]
- Kwaan HC, Wang J, Boggio LN: Abnormalities in hemostasis in acute promyelocytic leukemia. Hematol Oncol 20 (1): 33-41, 2002. [PUBMED Abstract]
- Barbui T, Falanga A: Disseminated intravascular coagulation in acute leukemia. Semin Thromb Hemost 27 (6): 593-604, 2001. [PUBMED Abstract]
- de Thé H, Chomienne C, Lanotte M, et al.: The t(15;17) translocation of acute promyelocytic leukaemia fuses the retinoic acid receptor alpha gene to a novel transcribed locus. Nature 347 (6293): 558-61, 1990. [PUBMED Abstract]
- Melnick A, Licht JD: Deconstructing a disease: RARalpha, its fusion partners, and their roles in the pathogenesis of acute promyelocytic leukemia. Blood 93 (10): 3167-215, 1999. [PUBMED Abstract]
- Kayser S, Schlenk RF, Platzbecker U: Management of patients with acute promyelocytic leukemia. Leukemia 32 (6): 1277-1294, 2018. [PUBMED Abstract]
- Lo Coco F, Diverio D, Falini B, et al.: Genetic diagnosis and molecular monitoring in the management of acute promyelocytic leukemia. Blood 94 (1): 12-22, 1999. [PUBMED Abstract]
- Zaccaria A, Valenti A, Toschi M, et al.: Cryptic translocation of PML/RARA on 17q. A rare event in acute promyelocytic leukemia. Cancer Genet Cytogenet 138 (2): 169-73, 2002. [PUBMED Abstract]
- Jansen JH, Löwenberg B: Acute promyelocytic leukemia with a PLZF-RARalpha fusion protein. Semin Hematol 38 (1): 37-41, 2001. [PUBMED Abstract]
- Castaigne S, Chomienne C, Daniel MT, et al.: All-trans retinoic acid as a differentiation therapy for acute promyelocytic leukemia. I. Clinical results. Blood 76 (9): 1704-9, 1990. [PUBMED Abstract]
- Tallman MS, Andersen JW, Schiffer CA, et al.: All-trans-retinoic acid in acute promyelocytic leukemia. N Engl J Med 337 (15): 1021-8, 1997. [PUBMED Abstract]
- Tallman MS, Andersen JW, Schiffer CA, et al.: All-trans retinoic acid in acute promyelocytic leukemia: long-term outcome and prognostic factor analysis from the North American Intergroup protocol. Blood 100 (13): 4298-302, 2002. [PUBMED Abstract]
- Fenaux P, Chastang C, Chevret S, et al.: A randomized comparison of all transretinoic acid (ATRA) followed by chemotherapy and ATRA plus chemotherapy and the role of maintenance therapy in newly diagnosed acute promyelocytic leukemia. The European APL Group. Blood 94 (4): 1192-200, 1999. [PUBMED Abstract]
- Lo-Coco F, Avvisati G, Vignetti M, et al.: Retinoic acid and arsenic trioxide for acute promyelocytic leukemia. N Engl J Med 369 (2): 111-21, 2013. [PUBMED Abstract]
- Meyer C, Burmeister T, Gröger D, et al.: The MLL recombinome of acute leukemias in 2017. Leukemia 32 (2): 273-284, 2018. [PUBMED Abstract]
- Giugliano E, Rege-Cambrin G, Scaravaglio P, et al.: Two new translocations involving the 11q23 region map outside the MLL locus in myeloid leukemias. Haematologica 87 (10): 1014-20, 2002. [PUBMED Abstract]
- König M, Reichel M, Marschalek R, et al.: A highly specific and sensitive fluorescence in situ hybridization assay for the detection of t(4;11)(q21;q23) and concurrent submicroscopic deletions in acute leukaemias. Br J Haematol 116 (4): 758-64, 2002. [PUBMED Abstract]
- Kim HJ, Cho HI, Kim EC, et al.: A study on 289 consecutive Korean patients with acute leukaemias revealed fluorescence in situ hybridization detects the MLL translocation without cytogenetic evidence both initially and during follow-up. Br J Haematol 119 (4): 930-9, 2002. [PUBMED Abstract]
- Ageberg M, Drott K, Olofsson T, et al.: Identification of a novel and myeloid specific role of the leukemia-associated fusion protein DEK-NUP214 leading to increased protein synthesis. Genes Chromosomes Cancer 47 (4): 276-87, 2008. [PUBMED Abstract]
- Shiba N, Ichikawa H, Taki T, et al.: NUP98-NSD1 gene fusion and its related gene expression signature are strongly associated with a poor prognosis in pediatric acute myeloid leukemia. Genes Chromosomes Cancer 52 (7): 683-93, 2013. [PUBMED Abstract]
- Döhner H, Estey E, Grimwade D, et al.: Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood 129 (4): 424-447, 2017. [PUBMED Abstract]
- Slovak ML, Gundacker H, Bloomfield CD, et al.: A retrospective study of 69 patients with t(6;9)(p23;q34) AML emphasizes the need for a prospective, multicenter initiative for rare 'poor prognosis' myeloid malignancies. Leukemia 20 (7): 1295-7, 2006. [PUBMED Abstract]
- Alsabeh R, Brynes RK, Slovak ML, et al.: Acute myeloid leukemia with t(6;9) (p23;q34): association with myelodysplasia, basophilia, and initial CD34 negative immunophenotype. Am J Clin Pathol 107 (4): 430-7, 1997. [PUBMED Abstract]
- Gröschel S, Sanders MA, Hoogenboezem R, et al.: A single oncogenic enhancer rearrangement causes concomitant EVI1 and GATA2 deregulation in leukemia. Cell 157 (2): 369-81, 2014. [PUBMED Abstract]
- Yamazaki H, Suzuki M, Otsuki A, et al.: A remote GATA2 hematopoietic enhancer drives leukemogenesis in inv(3)(q21;q26) by activating EVI1 expression. Cancer Cell 25 (4): 415-27, 2014. [PUBMED Abstract]
- Mrózek K, Heerema NA, Bloomfield CD: Cytogenetics in acute leukemia. Blood Rev 18 (2): 115-36, 2004. [PUBMED Abstract]
- Lugthart S, Gröschel S, Beverloo HB, et al.: Clinical, molecular, and prognostic significance of WHO type inv(3)(q21q26.2)/t(3;3)(q21;q26.2) and various other 3q abnormalities in acute myeloid leukemia. J Clin Oncol 28 (24): 3890-8, 2010. [PUBMED Abstract]
- Nacheva EP, Grace CD, Brazma D, et al.: Does BCR/ABL1 positive acute myeloid leukaemia exist? Br J Haematol 161 (4): 541-50, 2013. [PUBMED Abstract]
- Falini B, Martelli MP, Bolli N, et al.: Immunohistochemistry predicts nucleophosmin (NPM) mutations in acute myeloid leukemia. Blood 108 (6): 1999-2005, 2006. [PUBMED Abstract]
- Falini B, Mecucci C, Tiacci E, et al.: Cytoplasmic nucleophosmin in acute myelogenous leukemia with a normal karyotype. N Engl J Med 352 (3): 254-66, 2005. [PUBMED Abstract]
- Falini B, Nicoletti I, Martelli MF, et al.: Acute myeloid leukemia carrying cytoplasmic/mutated nucleophosmin (NPMc+ AML): biologic and clinical features. Blood 109 (3): 874-85, 2007. [PUBMED Abstract]
- Falini B, Martelli MP, Bolli N, et al.: Acute myeloid leukemia with mutated nucleophosmin (NPM1): is it a distinct entity? Blood 117 (4): 1109-20, 2011. [PUBMED Abstract]
- Schlenk RF, Döhner K, Krauter J, et al.: Mutations and treatment outcome in cytogenetically normal acute myeloid leukemia. N Engl J Med 358 (18): 1909-18, 2008. [PUBMED Abstract]
- Gale RE, Green C, Allen C, et al.: The impact of FLT3 internal tandem duplication mutant level, number, size, and interaction with NPM1 mutations in a large cohort of young adult patients with acute myeloid leukemia. Blood 111 (5): 2776-84, 2008. [PUBMED Abstract]
- Taskesen E, Bullinger L, Corbacioglu A, et al.: Prognostic impact, concurrent genetic mutations, and gene expression features of AML with CEBPA mutations in a cohort of 1182 cytogenetically normal AML patients: further evidence for CEBPA double mutant AML as a distinctive disease entity. Blood 117 (8): 2469-75, 2011. [PUBMED Abstract]
- Nerlov C: C/EBPalpha mutations in acute myeloid leukaemias. Nat Rev Cancer 4 (5): 394-400, 2004. [PUBMED Abstract]
- Marcucci G, Maharry K, Radmacher MD, et al.: Prognostic significance of, and gene and microRNA expression signatures associated with, CEBPA mutations in cytogenetically normal acute myeloid leukemia with high-risk molecular features: a Cancer and Leukemia Group B Study. J Clin Oncol 26 (31): 5078-87, 2008. [PUBMED Abstract]
- Wouters BJ, Löwenberg B, Erpelinck-Verschueren CA, et al.: Double CEBPA mutations, but not single CEBPA mutations, define a subgroup of acute myeloid leukemia with a distinctive gene expression profile that is uniquely associated with a favorable outcome. Blood 113 (13): 3088-91, 2009. [PUBMED Abstract]
- Dufour A, Schneider F, Metzeler KH, et al.: Acute myeloid leukemia with biallelic CEBPA gene mutations and normal karyotype represents a distinct genetic entity associated with a favorable clinical outcome. J Clin Oncol 28 (4): 570-7, 2010. [PUBMED Abstract]
- Fasan A, Haferlach C, Alpermann T, et al.: The role of different genetic subtypes of CEBPA mutated AML. Leukemia 28 (4): 794-803, 2014. [PUBMED Abstract]
- Schnittger S, Dicker F, Kern W, et al.: RUNX1 mutations are frequent in de novo AML with noncomplex karyotype and confer an unfavorable prognosis. Blood 117 (8): 2348-57, 2011. [PUBMED Abstract]
- Tang JL, Hou HA, Chen CY, et al.: AML1/RUNX1 mutations in 470 adult patients with de novo acute myeloid leukemia: prognostic implication and interaction with other gene alterations. Blood 114 (26): 5352-61, 2009. [PUBMED Abstract]
- Mendler JH, Maharry K, Radmacher MD, et al.: RUNX1 mutations are associated with poor outcome in younger and older patients with cytogenetically normal acute myeloid leukemia and with distinct gene and MicroRNA expression signatures. J Clin Oncol 30 (25): 3109-18, 2012. [PUBMED Abstract]
- Gaidzik VI, Bullinger L, Schlenk RF, et al.: RUNX1 mutations in acute myeloid leukemia: results from a comprehensive genetic and clinical analysis from the AML study group. J Clin Oncol 29 (10): 1364-72, 2011. [PUBMED Abstract]
- Díaz-Beyá M, Rozman M, Pratcorona M, et al.: The prognostic value of multilineage dysplasia in de novo acute myeloid leukemia patients with intermediate-risk cytogenetics is dependent on NPM1 mutational status. Blood 116 (26): 6147-8, 2010. [PUBMED Abstract]
- Rozman M, Navarro JT, Arenillas L, et al.: Multilineage dysplasia is associated with a poorer prognosis in patients with de novo acute myeloid leukemia with intermediate-risk cytogenetics and wild-type NPM1. Ann Hematol 93 (10): 1695-703, 2014. [PUBMED Abstract]
- Weinberg OK, Seetharam M, Ren L, et al.: Clinical characterization of acute myeloid leukemia with myelodysplasia-related changes as defined by the 2008 WHO classification system. Blood 113 (9): 1906-8, 2009. [PUBMED Abstract]
- Smith SM, Le Beau MM, Huo D, et al.: Clinical-cytogenetic associations in 306 patients with therapy-related myelodysplasia and myeloid leukemia: the University of Chicago series. Blood 102 (1): 43-52, 2003. [PUBMED Abstract]
- Churpek JE, Marquez R, Neistadt B, et al.: Inherited mutations in cancer susceptibility genes are common among survivors of breast cancer who develop therapy-related leukemia. Cancer 122 (2): 304-11, 2016. [PUBMED Abstract]
- Brunning RD, Matutes E, Flandrin G, et al.: Acute myeloid leukaemias and myelodysplastic syndromes, therapy related. In: Jaffe ES, Harris NL, Stein H, et al., eds.: Pathology and Genetics of Tumours of Haematopoietic and Lymphoid Tissues. IARC Press, 2001. World Health Organization Classification of Tumours, 3, pp 89-91.
- Ellis M, Ravid M, Lishner M: A comparative analysis of alkylating agent and epipodophyllotoxin-related leukemias. Leuk Lymphoma 11 (1-2): 9-13, 1993. [PUBMED Abstract]
- Olney HJ, Mitelman F, Johansson B, et al.: Unique balanced chromosome abnormalities in treatment-related myelodysplastic syndromes and acute myeloid leukemia: report from an international workshop. Genes Chromosomes Cancer 33 (4): 413-23, 2002. [PUBMED Abstract]
- Mauritzson N, Albin M, Rylander L, et al.: Pooled analysis of clinical and cytogenetic features in treatment-related and de novo adult acute myeloid leukemia and myelodysplastic syndromes based on a consecutive series of 761 patients analyzed 1976-1993 and on 5098 unselected cases reported in the literature 1974-2001. Leukemia 16 (12): 2366-78, 2002. [PUBMED Abstract]
- Pedersen-Bjergaard J, Andersen MK, Christiansen DH, et al.: Genetic pathways in therapy-related myelodysplasia and acute myeloid leukemia. Blood 99 (6): 1909-12, 2002. [PUBMED Abstract]
- Leone G, Voso MT, Sica S, et al.: Therapy related leukemias: susceptibility, prevention and treatment. Leuk Lymphoma 41 (3-4): 255-76, 2001. [PUBMED Abstract]
- Bloomfield CD, Archer KJ, Mrózek K, et al.: 11q23 balanced chromosome aberrations in treatment-related myelodysplastic syndromes and acute leukemia: report from an international workshop. Genes Chromosomes Cancer 33 (4): 362-78, 2002. [PUBMED Abstract]
- Yamauchi K, Yasuda M: Comparison in treatments of nonleukemic granulocytic sarcoma: report of two cases and a review of 72 cases in the literature. Cancer 94 (6): 1739-46, 2002. [PUBMED Abstract]
- Yilmaz AF, Saydam G, Sahin F, et al.: Granulocytic sarcoma: a systematic review. Am J Blood Res 3 (4): 265-70, 2013. [PUBMED Abstract]
- Brunning RD, Matutes E, Flandrin G, et al.: Acute myeloid leukaemia not otherwise categorised. In: Jaffe ES, Harris NL, Stein H, et al., eds.: Pathology and Genetics of Tumours of Haematopoietic and Lymphoid Tissues. IARC Press, 2001. World Health Organization Classification of Tumours, 3, pp 91-105.
- Byrd JC, Weiss RB, Arthur DC, et al.: Extramedullary leukemia adversely affects hematologic complete remission rate and overall survival in patients with t(8;21)(q22;q22): results from Cancer and Leukemia Group B 8461. J Clin Oncol 15 (2): 466-75, 1997. [PUBMED Abstract]
- Hayashi T, Kimura M, Satoh S, et al.: Early detection of AML1/MTG8 fusion mRNA by RT-PCR in the bone marrow cells from a patient with isolated granulocytic sarcoma. Leukemia 12 (9): 1501-3, 1998. [PUBMED Abstract]
- Imrie KR, Kovacs MJ, Selby D, et al.: Isolated chloroma: the effect of early antileukemic therapy. Ann Intern Med 123 (5): 351-3, 1995. [PUBMED Abstract]
- Matutes E, Pickl WF, Van't Veer M, et al.: Mixed-phenotype acute leukemia: clinical and laboratory features and outcome in 100 patients defined according to the WHO 2008 classification. Blood 117 (11): 3163-71, 2011. [PUBMED Abstract]
- van den Ancker W, Terwijn M, Westers TM, et al.: Acute leukemias of ambiguous lineage: diagnostic consequences of the WHO2008 classification. Leukemia 24 (7): 1392-6, 2010. [PUBMED Abstract]
- Hanson CA, Abaza M, Sheldon S, et al.: Acute biphenotypic leukaemia: immunophenotypic and cytogenetic analysis. Br J Haematol 84 (1): 49-60, 1993. [PUBMED Abstract]
- Legrand O, Perrot JY, Simonin G, et al.: Adult biphenotypic acute leukaemia: an entity with poor prognosis which is related to unfavourable cytogenetics and P-glycoprotein over-expression. Br J Haematol 100 (1): 147-55, 1998. [PUBMED Abstract]
- Carbonell F, Swansbury J, Min T, et al.: Cytogenetic findings in acute biphenotypic leukaemia. Leukemia 10 (8): 1283-7, 1996. [PUBMED Abstract]
- Pane F, Frigeri F, Camera A, et al.: Complete phenotypic and genotypic lineage switch in a Philadelphia chromosome-positive acute lymphoblastic leukemia. Leukemia 10 (4): 741-5, 1996. [PUBMED Abstract]
- Brunning RD, Matutes E, Borowitz M: Acute leukaemias of ambiguous lineage. In: Jaffe ES, Harris NL, Stein H, et al., eds.: Pathology and Genetics of Tumours of Haematopoietic and Lymphoid Tissues. IARC Press, 2001. World Health Organization Classification of Tumours, 3, pp 106-7.
- Killick S, Matutes E, Powles RL, et al.: Outcome of biphenotypic acute leukemia. Haematologica 84 (8): 699-706, 1999. [PUBMED Abstract]
- Kawajiri C, Tanaka H, Hashimoto S, et al.: Successful treatment of Philadelphia chromosome-positive mixed phenotype acute leukemia by appropriate alternation of second-generation tyrosine kinase inhibitors according to BCR-ABL1 mutation status. Int J Hematol 99 (4): 513-8, 2014. [PUBMED Abstract]
- Shimizu H, Yokohama A, Hatsumi N, et al.: Philadelphia chromosome-positive mixed phenotype acute leukemia in the imatinib era. Eur J Haematol 93 (4): 297-301, 2014. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento de la leucemia mieloide aguda
Fases del tratamiento
Para el tratamiento de los pacientes con leucemia mieloide aguda (LMA) se tiene en cuenta si la enfermedad se acaba de diagnosticar (que no ha sido tratada), está en remisión o es recidivante. Del mismo modo, cuando se escoge un abordaje de tratamiento, se considera la intensidad del tratamiento y el estado de salud general del paciente. El tratamiento satisfactorio de la LMA exige el control de la enfermedad sistémica y en la médula ósea, así como un tratamiento específico para la enfermedad que afecta el sistema nervioso central (SNC). La piedra angular de esta estrategia incluye quimioterapia combinada de administración sistémica. Puesto que solo el 5 % o menos de los pacientes con LMA contraen enfermedad en el SNC, no se indica el tratamiento profiláctico.[1,2]
- Diagnóstico nuevo (sin tratamiento previo). La LMA que no ha sido tratada se define como leucemia recién diagnosticada en pacientes que no se han sometido a tratamiento. El tratamiento inicial para pacientes con LMA recién diagnosticada suele ser la terapia de inducción con la que se procura inducir una remisión. En pacientes con LMA, la remisión completa (RC) se define como un hemograma normal de sangre periférica (recuento absoluto de neutrófilos >1000/mm3 y recuento de plaquetas >100 000/mm3), médula normocelular con menos del 5 % de blastocitos y ausencia de signos o síntomas de la enfermedad. Así como, ausencia de signos o síntomas evidentes de leucemia en el SNC u otra infiltración extramedular.[3]
Se han propuesto modificaciones a la definición de RC debido a que algunas respuestas son más intensas que una RC y otras tal vez no satisfagan todos los criterios para una respuesta completa. Además, hay leucemia residual en la mayoría de los pacientes con LMA que cumplen con estos criterios de RC.[3]
| Categoría de respuesta | Definición |
|---|---|
| RC = remisión completa; RCh = RC con recuperación hematológica parcial; RCi = RC con recuperación hematológica incompleta; RCERM− = RC sin enfermedad residual mensurable; RP = remisión parcial; RT–qPCR = reacción en cadena de la polimerasa cuantitativa con retrotranscripción. | |
| RCERM− | Si se estudia antes del tratamiento, RC con negatividad para un marcador genético por RT–qPCR o RC con negatividad por citometría de flujo multicolor. |
| RC | Blastocitos en la médula ósea <5 %; ausencia de blastocitos circulantes y blastocitos con cuerpos de Auer; ausencia de enfermedad extramedular; recuento absoluto de neutrófilos ≥1,0 × 109/l (1000/μl); recuento de plaquetas ≥100 × 109/l (100 000/μl). |
| RCh | Recuento absoluto de neutrófilos ≥0,5 x 109/L (500/μ) y recuento de plaquetas ≥50 x 109/l (100 000/μl); por lo demás se cumplen todos los otros criterios de RC.[4] |
| RCi | Todos los criterios para la RC excepto neutropenia residual (<1,0 × 109/l [1000/μl]) o trombocitopenia (< 100 × 109/l [100 000/μl]). |
| Estado morfológico libre de leucemia | Blastocitos en la médula ósea <5 %; ausencia de blastocitos con cuerpos de Auer; ausencia de enfermedad extramedular; no requiere recuperación hematológica. |
| RP | Todos los criterios hematológicos de una remisión completa; disminución del porcentaje de blastocitos en la médula ósea del 5 % al 25 %; y disminución de por lo menos del 50 % en el porcentaje de blastocitos en la médula ósea antes del tratamiento. |
| Ausencia de respuesta | Los pacientes evaluables para respuesta pero que no cumplen con los criterios de RC, RCh, RCi, estado morfológico libre de leucemia o RP se asignan a la categoría de ausencia de respuesta antes del referente de respuesta. Los pacientes que no logran alcanzar una respuesta según el referente designado se asignan a la categoría de enfermedad resistente al tratamiento. |
- Remisión. Cuando los pacientes están en remisión después de la quimioterapia de inducción, se administra quimioterapia de consolidación con el objetivo de profundizar la respuesta y consolidar la remisión. La terapia de mantenimiento se incluye en la mayoría de los protocolos de tratamiento y ensayos clínicos actuales. La terapia de consolidación es eficaz cuando se administra justo después de que se logra la remisión.[5]
- Enfermedad persistente o recidivante. A pesar de la quimioterapia intensiva, algunos pacientes con LMA recién diagnosticada no entrarán en remisión y padecerán una enfermedad primaria resistente al tratamiento. Además algunos pacientes que están en remisión después de la inducción y la quimioterapia de consolidación, presentan una recidiva de la enfermedad.[3] Las tasas de enfermedad primaria resistente al tratamiento y recaída varían según la edad del paciente, las variantes genómicas observadas en las células leucémicas y el tratamiento inicial.
| Categoría de respuesta | Definición | |
|---|---|---|
| RC = remisión completa; RCh = RC con recuperación hematológica completa; RCh con ERM de nivel bajo = RC con enfermedad residual mensurable detectada a un nivel bajo; CRi = RC con recuperación hematológica incompleta; CRi con ERM de nivel bajo = RC con recuperación hematológica incompleta y enfermedad residual mensurable detectada a un nivel bajo; ERM con ER- = RC con ausencia de enfermedad residual mensurable; ERM con ER de nivel bajo = RC con enfermedad residual mensurable detectada a un nivel bajo; ERM = enfermedad residual mensurable; ERM- = ausencia de enfermedad residual mensurable; ERM+ = presencia de enfermedad residual mensurable; RP = respuesta parcial; RT–qPCR = reacción en cadena de la polimerasa cuantitativa con retrotranscripción. | ||
| Enfermedad primaria resistente al tratamiento | Ausencia de RC, RCh o RCi en el referente de respuesta (por ejemplo, después de dos cursos de tratamiento de inducción intensivos) o en un referente definido (por ejemplo, 180 días después de comenzar una terapia menos intensiva). | |
| Recaída hematológica (después de Rc, RCh o RCi) | Blastocitos en la médula ósea ≥5 %; reaparición de blastocitos en la sangre en por lo menos dos muestras de sangre periférica con un intervalo entre las muestras de por lo menos 1 semana; o aparición de enfermedad extramedular. | |
| Recaída por ERM (después de Rc, RCh o RCi con ERM-) | Definida por una de las siguientes situaciones: | |
| Conversión de ERM- a ERM+, con independencia del método | ||
| Aumento del número de copias de ERM ≥1 log10 entre dos muestras con resultado positivo en pacientes de RC con ERM de nivel bajo, RCh con ERM o RCi con ERM de nivel bajo por qPCR. | ||
| Cualquier resultado se debe confirmar rápidamente en una muestra consecutiva secundaria de la misma fuente de tisular. | ||
| Enfermedad estable | Ausencia de RC con ERM-, RC, RCi, RP, estado morfológico libre de leucemia; y criterios insatisfechos para enfermedad progresiva. | |
| Enfermedad progresiva | Indicios de un aumento en el porcentaje de blastocitos en la médula ósea o aumento del recuento absoluto de blastocitos en la sangre, según una de las siguientes situaciones: | |
| Aumento >50 % de los blastocitos en la médula. | ||
| Aumento >50 % de los blastocitos periféricos en ausencia de un síndrome de diferenciación. | ||
| Enfermedad extramedular nueva. | ||
Cuidado paliativo durante el tratamiento
Puesto que la mielodepresión es una consecuencia prevista de la leucemia y de la quimioterapia, se debe vigilar de cerca a los pacientes durante el tratamiento. Es indispensable que la institución de tratamiento cuente con apoyo hematológico de múltiples componentes sanguíneos, entre ellos, transfusión de plaquetas, además de apoyo para el tratamiento de las complicaciones infecciosas relacionadas.[6]
Terapia de transfusión
El cuidado médico de apoyo durante la inducción a la remisión deberá incluir de manera rutinaria, según estén indicadas, transfusiones de glóbulos rojos y plaquetas.[7,8] La ablación rápida de la médula con la consiguiente regeneración temprana de la médula reduce la morbilidad y la mortalidad. En ensayos aleatorizados, se observaron resultados similares en pacientes que recibieron profilaxis con transfusiones de plaquetas a una concentración de 10 000/mm3 en vez de 20 000/mm3.[9] La incidencia de isoinmunización de plaquetas fue similar entre los grupos asignados al azar a recibir concentrados de mezcla de plaquetas de donantes escogidos al azar; concentrados de mezcla de plaquetas filtrados de donantes escogidos al azar; concentrados de mezcla de plaquetas irradiados con rayos ultravioleta de tipo B de donantes escogidos al azar; o plaquetas filtradas obtenidas mediante aféresis de donante único escogido al azar.[10]
No existe evidencia que respalde el uso de transfusiones de granulocitos para el tratamiento de la LMA. En un ensayo aleatorizado multicéntrico (RING [NCT00627393]), se abordó la utilidad de las transfusiones de granulocitos en pacientes con infecciones.[11] No hubo diferencia entre los grupos de granulocitos y de control para el criterio principal de valoración compuesto de supervivencia y respuesta microbiana 42 días después de la aleatorización. Sin embargo, la potencia estadística para detectar un verdadero efecto beneficioso fue baja porque la tasa de inclusión de pacientes fue la mitad de lo planeado en el diseño del estudio.
Factores de crecimiento
Se han estudiado los siguientes factores de crecimiento para el tratamiento de la LMA:
- Factores estimulantes de colonias. Se ha estudiado el uso del factor estimulante de colonias de granulocitos y el factor estimulante de colonias de granulocitos y macrófagos con el fin de reducir el período de granulocitopenia relacionada con el tratamiento de la leucemia.[12] Cuando se usan estos factores, se administran después de la quimioterapia. Si bien la administración de los factores de crecimiento reduce el tiempo de recuperación de neutrófilos de 2 a 5 días, y disminuye las tasas de neutropenia febril y la duración de la hospitalización, en los ensayos clínicos aleatorizados no se ha demostrado una repercusión de los factores de crecimiento en la supervivencia general ni se ha notificado de manera uniforme su eficacia en función del costo.[13,14] No se recomienda la administración rutinaria de factores de crecimiento durante la inducción a la remisión.
- Factores estimulantes de la eritropoyesis. El principal tratamiento de la anemia relacionada con el diagnóstico de LMA y la quimioterapia de inducción son las transfusiones de glóbulos rojos. A diferencia de los síndromes mielodisplásicos, la administración de factores estimulantes de la eritropoyesis (por ejemplo, epoetina alfa y darbepoetina) no cumple una función durante el tratamiento de la LMA.
- Miméticos de la trombopoyetina. En los ensayos clínicos se ha evaluado la administración de miméticos de la trombopoyetina durante el tratamiento de la LMA. El eltrombopag como monoterapia se evaluó en un ensayo aleatorizado, controlado con placebo, con enmascaramiento doble y multicéntrico de fase I/II en el que participaron 98 pacientes con recuento de plaquetas inferior a 30 × 109/l como resultado de LMA o SMD. No se registraron mejoras significativas en los recuentos de plaquetas. Se notificó hemorragia considerable en 10 (16 %) pacientes que recibieron eltrombopag y en 9 (26 %) pacientes que recibieron placebo. No se observó diferencia en la progresión de la enfermedad o en la supervivencia general.[15]
El eltrombopag aceleró la recuperación de plaquetas y redujo el número de transfusiones de plaquetas necesarias cuando se incorporó sin enmascaramiento a la quimioterapia de inducción en pacientes de más edad con LMA negativa para FLT3.[16] Sin embargo, en otro estudio aleatorizado con enmascaramiento doble de 148 pacientes, se agregó eltrombopag o placebo a la quimioterapia de inducción en dosis altas.[17] Los resultados de este estudio no indicaron ningún beneficio clínico del eltrombopag en relación con el placebo. En vista de la señal de eficacia mínima en este momento, el eltrombopag no se recomienda en forma sistemática para el cuidado médico de apoyo ni durante la inducción a la remisión.
Terapia antimicrobiana
La terapia antimicrobiana empírica de espectro amplio es una necesidad indiscutible en los pacientes febriles con neutropenia profunda.[18,19] La instrucción cuidadosa sobre la higiene personal de las manos, el cuidado dental y el reconocimiento de los primeros signos de infección es apropiada para todos los pacientes. No se indica el aislamiento en instalaciones complejas (que incluyen filtración del aire, alimentos estériles y esterilización de la flora intestinal).[20,21] Del mismo modo, no hay beneficio de consumir una dieta neutropénica con alimentos cocidos, conforme se demostró en ensayos aleatorizados.[22]
La profilaxis antibiótica con una fluoroquinolona y la profilaxis antifúngica con un triazol de administración oral o una equinocandina de administración parenteral son adecuados para pacientes en quienes se anticipa una neutropenia prolongada y profunda (<100 mm3 durante 2 semanas en el caso de una neutropenia profunda de >7 días de duración).[23] A diferencia del tratamiento de pacientes con linfoma linfoblástico agudo, la profilaxis contra Pneumocystis jirovecii no se emplea en forma sistemática.
La profilaxis antivírica con análogos nucleosídicos, como el aciclovir, está indicada para pacientes seropositivos para el virus del herpes simple, mientras reciben la quimioterapia de inducción.[23]
Bibliografía
- Rozovski U, Ohanian M, Ravandi F, et al.: Incidence of and risk factors for involvement of the central nervous system in acute myeloid leukemia. Leuk Lymphoma 56 (5): 1392-7, 2015. [PUBMED Abstract]
- Alakel N, Stölzel F, Mohr B, et al.: Symptomatic central nervous system involvement in adult patients with acute myeloid leukemia. Cancer Manag Res 9: 97-102, 2017. [PUBMED Abstract]
- Döhner H, Estey EH, Amadori S, et al.: Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood 115 (3): 453-74, 2010. [PUBMED Abstract]
- Döhner H, Wei AH, Appelbaum FR, et al.: Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN. Blood 140 (12): 1345-1377, 2022. [PUBMED Abstract]
- Cassileth PA, Lynch E, Hines JD, et al.: Varying intensity of postremission therapy in acute myeloid leukemia. Blood 79 (8): 1924-30, 1992. [PUBMED Abstract]
- Supportive Care. In: Wiernik PH, Canellos GP, Dutcher JP, et al., eds.: Neoplastic Diseases of the Blood. 3rd ed. Churchill Livingstone, 1996, pp 779-967.
- Slichter SJ: Controversies in platelet transfusion therapy. Annu Rev Med 31: 509-40, 1980. [PUBMED Abstract]
- Murphy MF, Metcalfe P, Thomas H, et al.: Use of leucocyte-poor blood components and HLA-matched-platelet donors to prevent HLA alloimmunization. Br J Haematol 62 (3): 529-34, 1986. [PUBMED Abstract]
- Rebulla P, Finazzi G, Marangoni F, et al.: The threshold for prophylactic platelet transfusions in adults with acute myeloid leukemia. Gruppo Italiano Malattie Ematologiche Maligne dell'Adulto. N Engl J Med 337 (26): 1870-5, 1997. [PUBMED Abstract]
- Leukocyte reduction and ultraviolet B irradiation of platelets to prevent alloimmunization and refractoriness to platelet transfusions. The Trial to Reduce Alloimmunization to Platelets Study Group. N Engl J Med 337 (26): 1861-9, 1997. [PUBMED Abstract]
- Price TH, Boeckh M, Harrison RW, et al.: Efficacy of transfusion with granulocytes from G-CSF/dexamethasone-treated donors in neutropenic patients with infection. Blood 126 (18): 2153-61, 2015. [PUBMED Abstract]
- Geller RB: Use of cytokines in the treatment of acute myelocytic leukemia: a critical review. J Clin Oncol 14 (4): 1371-82, 1996. [PUBMED Abstract]
- Rowe JM, Andersen JW, Mazza JJ, et al.: A randomized placebo-controlled phase III study of granulocyte-macrophage colony-stimulating factor in adult patients (> 55 to 70 years of age) with acute myelogenous leukemia: a study of the Eastern Cooperative Oncology Group (E1490). Blood 86 (2): 457-62, 1995. [PUBMED Abstract]
- Stone RM, Berg DT, George SL, et al.: Granulocyte-macrophage colony-stimulating factor after initial chemotherapy for elderly patients with primary acute myelogenous leukemia. Cancer and Leukemia Group B. N Engl J Med 332 (25): 1671-7, 1995. [PUBMED Abstract]
- Platzbecker U, Wong RS, Verma A, et al.: Safety and tolerability of eltrombopag versus placebo for treatment of thrombocytopenia in patients with advanced myelodysplastic syndromes or acute myeloid leukaemia: a multicentre, randomised, placebo-controlled, double-blind, phase 1/2 trial. Lancet Haematol 2 (10): e417-26, 2015. [PUBMED Abstract]
- Mukherjee S, Li H, Hobbs BP: A single arm, phase II study of eltrombopag to enhance platelet count recovery in older patients with acute myeloid leukemia (AML) undergoing remission induction therapy. [Abstract] Blood 134 (Suppl 1): 2595, 2019.
- Frey N, Jang JH, Szer J, et al.: Eltrombopag treatment during induction chemotherapy for acute myeloid leukaemia: a randomised, double-blind, phase 2 study. Lancet Haematol 6 (3): e122-e131, 2019. [PUBMED Abstract]
- Hughes WT, Armstrong D, Bodey GP, et al.: From the Infectious Diseases Society of America. Guidelines for the use of antimicrobial agents in neutropenic patients with unexplained fever. J Infect Dis 161 (3): 381-96, 1990. [PUBMED Abstract]
- Rubin M, Hathorn JW, Pizzo PA: Controversies in the management of febrile neutropenic cancer patients. Cancer Invest 6 (2): 167-84, 1988. [PUBMED Abstract]
- Armstrong D: Symposium on infectious complications of neoplastic disease (Part II). Protected environments are discomforting and expensive and do not offer meaningful protection. Am J Med 76 (4): 685-9, 1984. [PUBMED Abstract]
- Sherertz RJ, Belani A, Kramer BS, et al.: Impact of air filtration on nosocomial Aspergillus infections. Unique risk of bone marrow transplant recipients. Am J Med 83 (4): 709-18, 1987. [PUBMED Abstract]
- Gardner A, Mattiuzzi G, Faderl S, et al.: Randomized comparison of cooked and noncooked diets in patients undergoing remission induction therapy for acute myeloid leukemia. J Clin Oncol 26 (35): 5684-8, 2008. [PUBMED Abstract]
- Taplitz RA, Kennedy EB, Bow EJ, et al.: Antimicrobial Prophylaxis for Adult Patients With Cancer-Related Immunosuppression: ASCO and IDSA Clinical Practice Guideline Update. J Clin Oncol 36 (30): 3043-3054, 2018. [PUBMED Abstract]
Tratamiento de la leucemia mieloide aguda recién diagnosticada
Opciones de tratamiento de la leucemia mieloide aguda recién diagnosticada (que no ha sido tratada; tratamiento de inducción a la remisión)
La opción de tratamiento de la leucemia mieloide aguda (LMA) (que no ha sido tratada; tratamiento de inducción a la remisión) es la siguiente:
Quimioterapia
La quimioterapia para la LMA se divide en las siguientes dos categorías generales:
- Quimioterapia intensiva de inducción a la remisión.
- Quimioterapia no intensiva.
Es posible administrar uno de los siguientes regímenes de quimioterapia combinada como terapia intensiva de inducción a la remisión:
- Citarabina y daunorrubicina.[1,2]
- Citarabina e idarrubicina.[3-6]
- Citarabina y mitoxantrona.[7]
- Citarabina, antraciclina y midostaurina.[8]
- Citarabina, antraciclina y gemtuzumab ozogamicina.[9]
- Daunorrubicina y citarabina liposomales (CPX-351).[10]
- En ocasiones se administra citarabina o metotrexato intratecal para el tratamiento de la leucemia en el sistema nervioso central (SNC).
El régimen de dos fármacos con citarabina administrada como una infusión continua durante 7 días y un curso de 3 días de una antraciclina (llamada terapia de inducción 7 + 3) da lugar a una tasa de respuesta completa cercana al 65 %. En la mayoría de las instancias, no hay un beneficio clínico adicional cuando se añaden fármacos que potencialmente no presentan resistencia cruzada (como fludarabina, inhibidores de la topoisomerasa, tioguanina, mitoxantrona, inhibidores de la histona–desacetilasas o clofarabina) a un régimen 7 + 3. Cuando se agrega cladribina a la quimioterapia de inducción 7 + 3, se observó mejoría de las tasas de remisión [11] y de supervivencia [12] en dos ensayos controlados aleatorizados, pero este régimen no se ha adoptado en forma generalizada ante la falta de ensayos confirmatorios. A continuación se analiza la adición de midostaurina y gemtuzumab ozogamicina a la quimioterapia de inducción intensiva.
La elección de una antraciclina y la intensidad de la dosis de antraciclina quizás influya en la supervivencia de los pacientes con LMA. La idarrubicina es más eficaz que la daunorrubicina, sobre todo en adultos jóvenes, aunque quizás las dosis de idarrubicina y daunorrubicina no hayan sido equivalentes.[3-6] No se ha informado una diferencia significativa en la supervivencia obtenida con la daunorrubicina y la mitoxantrona.[13]
Selección de una antraciclina
En la actualidad, no hay evidencia concluyente para recomendar una antraciclina en lugar de otra.
Evidencia (antraciclinas):
- En una revisión sistemática y metanálisis de 18 ensayos controlados aleatorizados, que incluían a 6755 pacientes, se evaluó el uso de idarrubicina versus daunorrubicina como parte de la quimioterapia de inducción.[14]
- La administración de idarrubicina mejoró los resultados, entre ellos la supervivencia general (SG), en comparación con la daunorrubicina (12 estudios, 5976 pacientes; cociente de riesgos instantáneos [CRI], 0,90; intervalo de confianza [IC] 95 %, 0,84−0,96; P = 0,0008). Sin embargo, con idarrubicina aumentó el riesgo de muerte durante la inducción (14 estudios, 6349 pacientes; riesgo relativo [RR], 1,18; IC 95 %, 1,01−1,36; P = 0,03) y el riesgo de mucositis (5 estudios, 2000 pacientes; RR, 1,22; IC 95 %, 1,04−1,44; P = 0,02) en comparación con daunorrubicina. Además, el beneficio de supervivencia de la idarrubicina desapareció cuando se utilizó una dosis de daunorrubicina de al menos 180 mg/m2 (4 estudios, 2867 pacientes; CRI, 0,91; IC 95 %, 0,82−1,00; P = 0,06).
- En pacientes de 60 años y menos, los desenlaces para quienes recibieron daunorrubicina (90 mg/m2/dosis, dosis total durante la inducción de 270 mg/m2) fueron superiores a los de aquellos que recibieron dosis más tradicionales (45 mg/m2/dosis; dosis total = 135 mg/m2). La tasa de remisión completa (RC) fue del 71 % versus el 57 % (P< 0,001) y la mediana de supervivencia fue de 24 versus 16 meses (P = 0,003).[15]
- No se dispone de datos de una comparación aleatorizada entre 270 mg/m2 de daunorrubicina y 180 mg/m2de daunorrubicina, ni entre 270 mg/m2 de daunorrubicina e idarrubicina.
Adición de un inhibidor de FLT3
Las variantes en el dominio tirosina–cinasa (TKD) y las duplicaciones internas en tándem (ITD) del gen FLT3, son frecuentes en la LMA y suelen vincularse con un resultado precario.
Midostaurina
Evidencia (midostaurina):
- En un ensayo aleatorizado multicéntrico de fase III (NCT00651261), participaron pacientes de LMA con FLT3 alterado. Los pacientes recibieron midostaurina, un inhibidor multicinasa de FLT3, o placebo con quimioterapia de inducción con citarabina y daunorrubicina. La adición de midostaurina llevó a una mejora de la supervivencia (mediana, 75 vs. 26 meses; CRI de muerte, 0,78; P unilateral = 0,009).[8]
- La supervivencia sin complicaciones (definida como el tiempo transcurrido desde la aleatorización hasta la recaída, la muerte por cualquier causa o la no consecución de la RC especificada en el protocolo) mejoró en los pacientes del grupo de midostaurina (CRI de complicación o muerte, 0,78; P unilateral = 0,002) y el beneficio de supervivencia fue constante en todos los subtipos de variante de FLT3. Las tasas de RC (59 vs. 54 %) y el tiempo hasta la recuperación del recuento de neutrófilos fueron similares en los 2 grupos.[8][Nivel de evidencia A1]
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó la midostaurina en combinación con terapia de inducción para pacientes con LMA y una variante de FLT3.
Quizartinib
Evidencia (quizartinib):
- En un ensayo aleatorizado multicéntrico de fase III (NCT02668653) participaron pacientes con LMA con alteración de FLT3-ITD. Los pacientes recibieron quizartinib, inhibidor selectivo de FLT3 específico de ITD, o placebo, además de quimioterapia de inducción con citarabina y daunorrubicina. La adición de quizartinib mejoró la supervivencia (mediana, 31,9 vs. 15,1 meses; CRI de muerte, 0,78; P = 0,032).[16]
- La SSC (definida como el tiempo transcurrido desde la aleatorización hasta la ausencia de RC en un plazo de 42 días desde el inicio del último ciclo de inducción, la recaída o la muerte por cualquier causa, lo que ocurriera primero) fue similar para los pacientes de los grupos de quizartinib y placebo (CRI para evento o muerte, 0,92; IC 95%, 0,75–1,11; P = 0,24). Las tasas de RC y el tiempo hasta la recuperación del recuento de neutrófilos fueron similares en los 2 grupos.[16][Nivel de evidencia A1]
La FDA aprobó el quizartinib en combinación con terapia de inducción para pacientes con LMA y una variante de FLT3-ITD, pero no para pacientes con otras variantes de FLT3, como FLT3-TKD.
La adición de un inhibidor de FLT3 a la quimioterapia de inducción es el tratamiento estándar para pacientes con LMA con FLT3 alterado que son aptos para someterse a quimioterapia intensiva. En un estudio en curso (NCT03836209) se está evaluando qué inhibidor de FLT3 es mejor para los pacientes con LMA con FLT3-ITD que reciben quimioterapia inicial. En otros estudios están en evaluación los inhibidores de FLT3 en combinación con hipometilantes y venetoclax en pacientes que no son candidatos a recibir terapia intensiva.
Adición de gemtuzumab ozogamicina
Evidencia (gemtuzumab ozogamicina):
- En un metanálisis de más de 3000 pacientes, la adición de gemtuzumab ozogamicina (inmunotoxina dirigida a CD33), al tratamiento de citarabina y antraciclina, o de clofarabina y antraciclina generó un pequeño aumento en la tasa de SG a los 5 años (30,7 vs. 34,6 %; CRI, 0,90; IC 95 %, 0,82−0,98; P = 0,01).[9]
- La mejora en la tasa de SG a 5 años se observó en todas las edades, pero este efecto fue mayor en pacientes con características citogenéticas de pronóstico favorable (55,2 vs. 76,3 %; CRI, 0,47; IC 95 %, 0,31−0,73; P = 0,0005), y en menor grado con características citogenéticas de riesgo intermedio (34,1 vs. 39,4 %; CRI, 0,84; IC 95 %, 0,75−0,95; P = 0,007). No se observó beneficio en los pacientes con cariotipo de riesgo adverso.[9][Nivel de evidencia A1]
- En contraste, el gemtuzumab ozogamicina no mejoró la tasa de supervivencia a 1 año en pacientes de edad avanzada que recibieron dosis bajas de citarabina, pero la tasa de RC aumentó del 17 % al 30 % (oportunidad relativa [OR], 0,48; IC 95 %, 0,32–0,73); P = 0,006).[17]
La ficha técnica del gemtuzumab ozogamicina, aprobada por la FDA, incluye un recuadro con una advertencia sobre el riesgo de hepatotoxicidad, que abarca el síndrome de obstrucción sinusoidal hepático grave o letal.
Daunorrubicina y citarabina liposomales
CPX-351 es un liposoma que encapsula dos fármacos de manera que libera citarabina y daunorrubicina en un cociente molar sinérgico fijo de 5:1.
Evidencia (CPX-351):
- En un ensayo multicéntrico se investigó la administración de CPX-351 en pacientes de 60 a 75 años con LMA relacionada con el tratamiento, LMA con antecedentes de síndrome mielodisplásico (SMD) o LMA con cambios relacionados con mielodisplasia.[10]
- En comparación con una quimioterapia de inducción 7 + 3, CPX-351 produjo una tasa de remisión general superior (47,7 % vs. 33,3 %; P = 0,016), y una mediana de SG mejorada (9,56 vs. 5,95 meses; CRI, 0,69; IC 95 %, 0,52−0,90; P = 0,003).[10][Nivel de evidencia A1]
- Las tasas de mortalidad temprana y los efectos tóxicos fueron similares entre los dos grupos. Sin embargo, la mediana de tiempo hasta la recuperación de los neutrófilos y las plaquetas fue más prolongada para CPX-351 (35,0 y 36,5 días, respectivamente) en comparación con la quimioterapia de inducción 7 + 3 (29 y 29 días, respectivamente).
Adultos de edad avanzada o adultos con afecciones comórbidas importantes
Algunos pacientes tal vez rehúsen someterse al tratamiento o estén demasiado débiles para recibir quimioterapia de inducción intensiva. La administración de dosis bajas de citarabina, decitabina y azacitidina, o del mejor cuidado de apoyo son abordajes terapéuticos de eficacia equivalente para los pacientes de edad avanzada con LMA que rehúsan someterse a la quimioterapia tradicional de inducción 7 + 3. A diferencia de un curso sucinto de inducción 7 + 3, estas terapias menos intensivas se continúan de manera indefinida mientras el paciente obtiene beneficio (es decir, hasta la progresión de la enfermedad o toxicidad significativa).
A veces, se administra uno de los siguientes regímenes de quimioterapia como terapia menos intensiva:
- Hipometilantes (azacitidina y decitabina).
- Dosis bajas de citarabina.
- Venetoclax con hipometilantes, o dosis bajas de citarabina.
- Glasdegib y dosis bajas de citarabina.
- Ivosidenib con azacitidina o sin esta.
- Enasidenib.
- En ocasiones se administra citarabina o metotrexato intratecales para el tratamiento de la leucemia en el SNC.
Evidencia (quimioterapia para pacientes que rehúsan la terapia intensiva de inducción a la remisión):
- Hipometilantes. Los hipometilantes azacitidina y decitabina se suelen utilizar en esta población de pacientes mayores, en especial en los Estados Unidos. Aunque la aprobación de estos medicamentos por parte de la FDA es para la indicación de SMD, en los estudios de registro que llevaron a la aprobación se incluyeron pacientes con el 20 % al 30 % de mieloblastos, lo que ahora se considera LMA oligoblástica.[18,19]
- Azacitidina. En un ensayo internacional de fase III (NCT01074047) se asignó al azar a pacientes con LMA de 65 años de edad o mayores a recibir azacitidina o regímenes convencionales (inducción 7 + 3, dosis bajas de citarabina o el mejor cuidado de apoyo solo).[20]
- La azacitidina llevó a una mediana de SG de 10,4 meses (IC 95 %, 8,0−12,7) en comparación con 6,5 meses (IC 95 %, 5,0−8,6) con regímenes convencionales (CRI, 0,85; IC 95 %, 0,69−1,03; P = 0,1009).[20][Nivel de evidencia A1]
- Decitabina. En un ensayo de fase III, se asignó al azar a 485 pacientes con LMA, mayores de 65 años, a recibir decitabina (n = 242) o su elección preferida (n = 243) de cuidados médicos de apoyo (n = 28) o dosis bajas de citarabina (n = 215).[21]
- Aunque las tasas de RC + RCp (RC con recuperación incompleta de plaquetas) fueron más del doble en el grupo de decitabina (17,8 %) en comparación con el grupo que optó por el tratamiento (7,8 %) (P = 0,001), la mediana de SG no mejoró de modo significativo en los pacientes que recibieron decitabina (7,7 meses) en comparación con quienes se sometieron al tratamiento de elección (5,0 meses) (CRI de muerte con decitabina, 0,85; IC 95 %, 0,69–1,04; P = 0,11).
En comparación con el tratamiento durante 5 días consecutivos, el tratamiento durante 10 días consecutivos quizás genere tasas de respuesta más altas, en especial en los pacientes que presentan variantes de TP53 o características citogenéticas desfavorables.[22][Nivel de evidencia C3]
- Azacitidina. En un ensayo internacional de fase III (NCT01074047) se asignó al azar a pacientes con LMA de 65 años de edad o mayores a recibir azacitidina o regímenes convencionales (inducción 7 + 3, dosis bajas de citarabina o el mejor cuidado de apoyo solo).[20]
- Dosis bajas de citarabina. Los adultos mayores que rehúsan someterse a la terapia intensiva de inducción a la remisión o que no se consideran aptos para recibirla, quizás se beneficien al recibir dosis bajas de citarabina administradas 2 veces por día durante 10 días en ciclos repetidos cada 4 a 6 semanas.[23]
- La tasa de RC con este régimen fue del 18 % comparada con el 1 % en pacientes tratados con hidroxiurea (P = 0,006).
- La supervivencia con dosis bajas de citarabina fue mejor que la supervivencia con hidroxiurea (OR = 0,60; IC 95 %, 0,44–0,81; P = 0,009).[23][Nivel de evidencia A1]
- Venetoclax con hipometilantes, o dosis bajas de citarabina. La FDA aprobó el uso de venetoclax, un inhibidor de la proteína antiapoptótica BCL2, en combinación con dosis bajas de citarabina o un hipometilante para el tratamiento de la LMA en pacientes de 75 años de edad o mayores, y para los que no pueden someterse a quimioterapia de inducción 7 + 3 debido a afecciones comórbidas. La aprobación se concedió a partir de los resultados de 2 estudios.
- El primer estudio (NCT02203773) fue un ensayo clínico no aleatorizado sin enmascaramiento de fase Ib sobre el uso de venetoclax en combinación con azacitidina o decitabina.[24]
- En este estudio, 35 (61 %; IC 95 %, 47,6−74,0 %) de 57 pacientes obtuvieron una RC o una RC con recuperación hematológica incompleta (RCi). La mediana de duración de la respuesta para todos los pacientes (RC + RCi + remisión parcial [RP]) fue de 8,4 meses (intervalo, 4,7−11,7; n = 36).
- El segundo estudio (NCT02287233) fue un estudio de fase I/IIb de administración de venetoclax en combinación con dosis bajas de citarabina a 82 pacientes con LMA recién diagnosticada, entre ellos pacientes con exposición anterior a un hipometilante por un trastorno hematológico previo como SMD.[25]
- En los 82 pacientes inscritos en el estudio, la tasa de RC o RCi fue del 54 % (IC 95 %, 42−65 %), con una mediana de duración de la remisión de 8,1 meses (IC 95 %, 5,3−14,9 meses). La mediana de SG para todos los pacientes, con independencia de la respuesta, fue de 10,1 meses (IC 95 %, 5,7‒14,2 meses).
- Los efectos adversos más comunes con la administración de combinaciones de venetoclax son síntomas gastrointestinales y mielodepresión, que en algunos casos exige retrasar los ciclos, añadir un factor de crecimiento o reducir la duración de la administración de venetoclax por ciclo. Además, se suelen tomar medidas profilácticas adecuadas para prevenir el síndrome de lisis tumoral.[25][Nivel de evidencia C3]
- El primer estudio (NCT02203773) fue un ensayo clínico no aleatorizado sin enmascaramiento de fase Ib sobre el uso de venetoclax en combinación con azacitidina o decitabina.[24]
- Glasdegib y dosis bajas de citarabina. El glasdegib, un inhibidor oral de la vía del erizo sónico (hedgehog), en combinación con dosis bajas de citarabina se comparó con la administración de dosis bajas de citarabina sola en un estudio aleatorizado, sin enmascaramiento de fase II en el que se incluyeron 116 pacientes con LMA de 75 años o mayores o que tenían afecciones comórbidas graves (enfermedad cardíaca, deterioro renal o estado funcional del Eastern Cooperative Oncology Group de 2).[26]
- De los 78 pacientes con LMA que recibieron glasdegib y dosis bajas de citarabina, un 24 % (n = 19) de los pacientes obtuvieron una RC o RCi en comparación con un 5 % (2 de 38) de los pacientes que recibieron dosis bajas de citarabina sola. La mediana de SG en los pacientes con LMA fue de 8,3 meses (IC, 80 %; 6,6–9,5) para los pacientes que recibieron glasdegib y dosis bajas de citarabina, y de 4,3 meses (IC 80 %; 2,9-4,9) para los pacientes que recibieron dosis bajas de citarabina sola (CRI = 0,46; IC 80 %; 0,35–0,62; P = 0,0002).[26][Nivel de evidencia A1]
En forma similar al venetoclax, la FDA aprobó el uso de glasdegib en combinación con dosis bajas de citarabina para el tratamiento de la LMA en pacientes de 75 años o más, o en pacientes que no pueden recibir quimioterapia de inducción intensiva.
- Ivosidenib. En pacientes mayores o débiles de LMA con variantes de IDH1, una opción es el inhibidor de IDH1, ivosidenib. La FDA aprobó el uso de ivosidenib solo o en combinación con azacitidina para el tratamiento de la LMA que presenta una variante de IDH1 susceptible (detectada por una prueba diagnóstica aprobada por la FDA) en adultos de 75 años o más con LMA recién diagnosticada o que presentan afecciones comórbidas que impiden el uso de quimioterapia de inducción intensiva. En el contexto de un estudio de fase I, 34 pacientes con LMA recién diagnosticada y variante de IDH1 que no reunían las condiciones para recibir quimioterapia de inducción intensiva, recibieron monoterapia de ivosidenib.[27]
- En 6 pacientes se notificó síndrome de diferenciación (18 %), pero no requirió de la interrupción del tratamiento.
- La tasa de RC y RCi fue del 42,4 % (IC 95 %, 25,5−60,8 %), con una mediana de duración de la respuesta que no se logró (límite inferior del IC 95 % de 4,6 meses).
- Para los 34 pacientes en el estudio, la mediana de SG fue de 12,6 meses (IC 95 %, 4,5‒25,7).[27][Nivel de evidencia C3]
En un ensayo aleatorizado con enmascaramiento doble controlado con placebo de fase III, se evaluó la combinación de azacitidina e ivosidenib en pacientes con LMA recién diagnosticada quienes no fueron aptos para la quimioterapia de inducción intensiva. El análisis por intensión de tratar incluyó 72 pacientes que recibieron azacitidina e ivosidenib y 74 pacientes que recibieron azacitidina y placebo. Una solicitud de nuevo fármaco complementaria para el ivosidenib en combinación con azacitidina para los pacientes con LMA y IDH1 alterado sin tratar es objeto de revisión prioritaria de la FDA.[28]
- Al cabo de una mediana de seguimiento de 12,4 meses, el criterio principal de valoración para la SSC fue la mejora de los pacientes que recibieron azacitidina e ivosidenib, en comparación con los pacientes que recibieron azacitidina y placebo (CRI, 0,33; IC 95 %, 0,16–0,69).
- La mediana de la SG fue de 24 meses para los pacientes que recibieron azacitidina e ivosidenib y de 7,9 meses para los pacientes que recibieron azacitidina y placebo (CRI de muerte, 0,44; IC 95 %, 0,27–0,73).
- Se presentó síndrome de diferenciación en el 14 % de los pacientes que recibió azacitidina e ivosidenib y en el 8 % de los paciente que recibió azacitidina y placebo. La incidencia de episodios de sangrado fue del 41 % con azacitidina e ivosidenib y del 29 % con azacitidina y placebo. Se observó infección de cualquier grado en el 28 % de los pacientes de azacitidina e ivosidenib y en el 49 % de los pacientes de azacitidina y placebo. Para obtener más información sobre el síndrome de diferenciación consultar la sección Tratamiento de la leucemia promielocítica aguda recién diagnosticada.[28][Nivel de evidencia A1]
- Enasidenib. En pacientes mayores o débiles con una LMA y variantes de IDH2, una opción es el inhibidor de IDH2 enasidenib. Si bien la monoterapia con enasidenib no está aprobada en este entorno, se evaluó en un ensayo de fase I/II en pacientes con LMA recién diagnosticada, que no que no eran aptos para recibir quimioterapia estándar.[29]
- De los 39 pacientes inscritos, 7 (18 %) obtuvieron una RC, 1 (3 %) obtuvo una RCi y 2 (5 %) obtuvieron una RP.
- La mediana de SG para todos los pacientes fue de 11,3 meses (IC 95 %, 5,7‒15,1) y no se alcanzó para los pacientes que obtuvieron una respuesta.[29][Nivel de evidencia C3]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Yates J, Glidewell O, Wiernik P, et al.: Cytosine arabinoside with daunorubicin or adriamycin for therapy of acute myelocytic leukemia: a CALGB study. Blood 60 (2): 454-62, 1982. [PUBMED Abstract]
- Dillman RO, Davis RB, Green MR, et al.: A comparative study of two different doses of cytarabine for acute myeloid leukemia: a phase III trial of Cancer and Leukemia Group B. Blood 78 (10): 2520-6, 1991. [PUBMED Abstract]
- Wiernik PH, Banks PL, Case DC, et al.: Cytarabine plus idarubicin or daunorubicin as induction and consolidation therapy for previously untreated adult patients with acute myeloid leukemia. Blood 79 (2): 313-9, 1992. [PUBMED Abstract]
- Vogler WR, Velez-Garcia E, Weiner RS, et al.: A phase III trial comparing idarubicin and daunorubicin in combination with cytarabine in acute myelogenous leukemia: a Southeastern Cancer Study Group Study. J Clin Oncol 10 (7): 1103-11, 1992. [PUBMED Abstract]
- Berman E, Heller G, Santorsa J, et al.: Results of a randomized trial comparing idarubicin and cytosine arabinoside with daunorubicin and cytosine arabinoside in adult patients with newly diagnosed acute myelogenous leukemia. Blood 77 (8): 1666-74, 1991. [PUBMED Abstract]
- Mandelli F, Petti MC, Ardia A, et al.: A randomised clinical trial comparing idarubicin and cytarabine to daunorubicin and cytarabine in the treatment of acute non-lymphoid leukaemia. A multicentric study from the Italian Co-operative Group GIMEMA. Eur J Cancer 27 (6): 750-5, 1991. [PUBMED Abstract]
- Löwenberg B, Suciu S, Archimbaud E, et al.: Mitoxantrone versus daunorubicin in induction-consolidation chemotherapy--the value of low-dose cytarabine for maintenance of remission, and an assessment of prognostic factors in acute myeloid leukemia in the elderly: final report. European Organization for the Research and Treatment of Cancer and the Dutch-Belgian Hemato-Oncology Cooperative Hovon Group. J Clin Oncol 16 (3): 872-81, 1998. [PUBMED Abstract]
- Stone RM, Mandrekar SJ, Sanford BL, et al.: Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation. N Engl J Med 377 (5): 454-464, 2017. [PUBMED Abstract]
- Hills RK, Castaigne S, Appelbaum FR, et al.: Addition of gemtuzumab ozogamicin to induction chemotherapy in adult patients with acute myeloid leukaemia: a meta-analysis of individual patient data from randomised controlled trials. Lancet Oncol 15 (9): 986-96, 2014. [PUBMED Abstract]
- Lancet JE, Uy GL, Cortes JE, et al.: CPX-351 (cytarabine and daunorubicin) Liposome for Injection Versus Conventional Cytarabine Plus Daunorubicin in Older Patients With Newly Diagnosed Secondary Acute Myeloid Leukemia. J Clin Oncol 36 (26): 2684-2692, 2018. [PUBMED Abstract]
- Holowiecki J, Grosicki S, Robak T, et al.: Addition of cladribine to daunorubicin and cytarabine increases complete remission rate after a single course of induction treatment in acute myeloid leukemia. Multicenter, phase III study. Leukemia 18 (5): 989-97, 2004. [PUBMED Abstract]
- Holowiecki J, Grosicki S, Giebel S, et al.: Cladribine, but not fludarabine, added to daunorubicin and cytarabine during induction prolongs survival of patients with acute myeloid leukemia: a multicenter, randomized phase III study. J Clin Oncol 30 (20): 2441-8, 2012. [PUBMED Abstract]
- Arlin Z, Case DC, Moore J, et al.: Randomized multicenter trial of cytosine arabinoside with mitoxantrone or daunorubicin in previously untreated adult patients with acute nonlymphocytic leukemia (ANLL). Lederle Cooperative Group. Leukemia 4 (3): 177-83, 1990. [PUBMED Abstract]
- Li X, Xu S, Tan Y, et al.: The effects of idarubicin versus other anthracyclines for induction therapy of patients with newly diagnosed leukaemia. Cochrane Database Syst Rev (6): CD010432, 2015. [PUBMED Abstract]
- Fernandez HF, Sun Z, Yao X, et al.: Anthracycline dose intensification in acute myeloid leukemia. N Engl J Med 361 (13): 1249-59, 2009. [PUBMED Abstract]
- Erba HP, Montesinos P, Kim HJ, et al.: Quizartinib plus chemotherapy in newly diagnosed patients with FLT3-internal-tandem-duplication-positive acute myeloid leukaemia (QuANTUM-First): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 401 (10388): 1571-1583, 2023. [PUBMED Abstract]
- Burnett AK, Hills RK, Hunter AE, et al.: The addition of gemtuzumab ozogamicin to low-dose Ara-C improves remission rate but does not significantly prolong survival in older patients with acute myeloid leukaemia: results from the LRF AML14 and NCRI AML16 pick-a-winner comparison. Leukemia 27 (1): 75-81, 2013. [PUBMED Abstract]
- Silverman LR, Demakos EP, Peterson BL, et al.: Randomized controlled trial of azacitidine in patients with the myelodysplastic syndrome: a study of the cancer and leukemia group B. J Clin Oncol 20 (10): 2429-40, 2002. [PUBMED Abstract]
- Kantarjian H, O'brien S, Cortes J, et al.: Results of intensive chemotherapy in 998 patients age 65 years or older with acute myeloid leukemia or high-risk myelodysplastic syndrome: predictive prognostic models for outcome. Cancer 106 (5): 1090-8, 2006. [PUBMED Abstract]
- Dombret H, Seymour JF, Butrym A, et al.: International phase 3 study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with >30% blasts. Blood 126 (3): 291-9, 2015. [PUBMED Abstract]
- Kantarjian HM, Thomas XG, Dmoszynska A, et al.: Multicenter, randomized, open-label, phase III trial of decitabine versus patient choice, with physician advice, of either supportive care or low-dose cytarabine for the treatment of older patients with newly diagnosed acute myeloid leukemia. J Clin Oncol 30 (21): 2670-7, 2012. [PUBMED Abstract]
- Welch JS, Petti AA, Miller CA, et al.: TP53 and Decitabine in Acute Myeloid Leukemia and Myelodysplastic Syndromes. N Engl J Med 375 (21): 2023-2036, 2016. [PUBMED Abstract]
- Burnett AK, Milligan D, Prentice AG, et al.: A comparison of low-dose cytarabine and hydroxyurea with or without all-trans retinoic acid for acute myeloid leukemia and high-risk myelodysplastic syndrome in patients not considered fit for intensive treatment. Cancer 109 (6): 1114-24, 2007. [PUBMED Abstract]
- DiNardo CD, Pratz KW, Letai A, et al.: Safety and preliminary efficacy of venetoclax with decitabine or azacitidine in elderly patients with previously untreated acute myeloid leukaemia: a non-randomised, open-label, phase 1b study. Lancet Oncol 19 (2): 216-228, 2018. [PUBMED Abstract]
- Wei AH, Strickland SA, Hou JZ, et al.: Venetoclax Combined With Low-Dose Cytarabine for Previously Untreated Patients With Acute Myeloid Leukemia: Results From a Phase Ib/II Study. J Clin Oncol 37 (15): 1277-1284, 2019. [PUBMED Abstract]
- Cortes JE, Heidel FH, Hellmann A, et al.: Randomized comparison of low dose cytarabine with or without glasdegib in patients with newly diagnosed acute myeloid leukemia or high-risk myelodysplastic syndrome. Leukemia 33 (2): 379-389, 2019. [PUBMED Abstract]
- Roboz GJ, DiNardo CD, Stein EM, et al.: Ivosidenib induces deep durable remissions in patients with newly diagnosed IDH1-mutant acute myeloid leukemia. Blood 135 (7): 463-471, 2020. [PUBMED Abstract]
- Montesinos P, Recher C, Vives S, et al.: Ivosidenib and Azacitidine in IDH1-Mutated Acute Myeloid Leukemia. N Engl J Med 386 (16): 1519-1531, 2022. [PUBMED Abstract]
- Pollyea DA, Tallman MS, de Botton S, et al.: Enasidenib, an inhibitor of mutant IDH2 proteins, induces durable remissions in older patients with newly diagnosed acute myeloid leukemia. Leukemia 33 (11): 2575-2584, 2019. [PUBMED Abstract]
Tratamiento de la leucemia mieloide aguda en remisión
Aunque se notificó que algunos pacientes con leucemia mieloide aguda (LMA) obtienen una supervivencia sin enfermedad (SSE) a largo plazo o curación con un solo ciclo de quimioterapia,[1] la terapia de consolidación siempre se indica cuando el objetivo del tratamiento acarrea intención curativa. En un estudio aleatorizado pequeño dirigido por el Eastern Cooperative Oncology Group (ECOG), todos los pacientes que no recibieron terapia de consolidación presentaron una recaída después de una mediana corta de remisión completa (RC).[2]
Las opciones de tratamiento de la leucemia mieloide aguda en remisión (fase de consolidación) son las siguientes:
- Quimioterapia de corto plazo (3−4 ciclos), quimioterapia relativamente intensiva de regímenes a base de citarabina similar a la de ensayos clínicos de inducción estándar (quimioterapia de consolidación), y quimioterapia de consolidación con tratamiento a base de dosis más intensas de citarabina.
- La terapia de mantenimiento (dosis bajas a largo plazo) no ha demostrado beneficio en pacientes con LMA en varios estudios, pero se han obtenido beneficios con las siguientes dos estrategias:
- Midostaurina en pacientes de LMA con variante de FLT3.
- Azacitidina oral.
- Trasplante de células hematopoyéticas (médula ósea o células madre).
- Dosis altas de quimioterapia con rescate autógeno de células madre de sangre periférica.
- Terapia de ablación de la médula ósea o terapia de intensidad reducida seguida de trasplante alogénico de células hematopoyéticas.
Quimioterapia
La terapia de consolidación sin trasplante con regímenes que contienen citarabina presenta tasas de mortalidad relacionada con el tratamiento que suelen ser de menos del 10 % al 20 %; además, se notificaron tasas de SSE a largo plazo del 20 % al 50 %.[3-6] No se han determinado las dosis, los programas y la duración óptimos de la quimioterapia de consolidación.
La terapia de consolidación estándar para pacientes con LMA en remisión abarca dosis altas de citarabina; sin embargo, hay cierta controversia sobre el beneficio para todos los pacientes con LMA más jóvenes que obtienen la primera respuesta completa versus subgrupos seleccionados, como aquellos con anomalías en el factor de unión central.[7-11] La duración de la terapia de consolidación oscila entre 1 y [4,6] 4 o más ciclos.[3,5]
Evidencia (quimioterapia):
- En un ensayo aleatorizado grande en el que se compararon tres regímenes diferentes de terapia de consolidación con citarabina, se observó un beneficio claro para la supervivencia de pacientes menores de 60 años que recibieron dosis altas de citarabina.[3]
- En el ensayo del Medical Research Council (MRC-LEUK-AML11), la intensificación de la dosis de citarabina o la duración de la quimioterapia de consolidación con dosis convencionales de citarabina no mejoró la SSE ni la supervivencia general (SG) en los pacientes de 60 años o más.[12,13]
La quimioterapia a base de dosis intensivas de citarabina a veces causa complicaciones tóxicas neurológicas [14] o pulmonares graves, [15] de manera que solo médicos con experiencia en estos regímenes deben administrarla en centros equipados para resolver posibles complicaciones. En un análisis retrospectivo con 256 pacientes de una sola institución que recibieron bolos de dosis altas de citarabina, el factor pronóstico más poderoso de neurotoxicidad de la citarabina fue la insuficiencia renal. La incidencia de neurotoxicidad fue significativamente mayor en pacientes tratados con dosis de 3 g/m2/dosis 2 veces al día en comparación con aquellos tratados con 2 g/m2/dosis.
Terapia de mantenimiento
Si bien en varios estudios antiguos se usó una terapia a largo plazo en dosis bajas (mantenimiento), no hay evidencia convincente de que la terapia de mantenimiento prolonga la SSP o la SG. No obstante, la terapia de mantenimiento con midostaurina o azacitidina oral quizás mejore los desenlaces.
Midostaurina
Evidencia (midostaurina):
Las variantes del gen FLT3, en el dominio tirosina–cinasa y las duplicaciones internas en tándem, son frecuentes en la LMA y suelen vincularse con un resultado precario.
- En un ensayo aleatorizado, multicéntrico de fase III RATIFY (NCT00651261), se administró midostaurina, inhibidor de FLT3 y de cinasas múltiples, con quimioterapia de inducción de citarabina y daunorrubicina para compararlo con placebo en pacientes de LMA con alteración de FLT3.[16][Nivel de evidencia A1]
- La adición de midostaurina (inhibidor de FLT3 y de cinasas múltiples), a la quimioterapia de inducción con citarabina y daunorrubicina mejoró la supervivencia (mediana, 75 vs. 26 meses; cociente de riesgos instantáneos [CRI] de muerte, 0,78; P unilateral = 0,009).
- Los pacientes que permanecieron en remisión después de completar la terapia de consolidación pasaron a la fase de mantenimiento en la que recibieron midostaurina o placebo en dosis de 50 mg oral 2 veces al día, durante 12 ciclos de 28 días. Se administró un régimen de mantenimiento durante los 12 ciclos completos en 120 pacientes (69 en el grupo de midostaurina y 51 en el grupo de placebo).
- En un análisis de referencia específico al final de la fase de mantenimiento no se observaron diferencias en la SSP entre los dos grupos. Además, desde el inicio de la terapia de mantenimiento no se observaron diferencias en la SG entre los dos grupos.[17]
Si bien en el estudio RATIFY se toleró bien el mantenimiento, en otro estudio de fase II solo un pequeño subgrupo de pacientes toleró la midostaurina como terapia de mantenimiento después de quimioterapia o trasplante.[18]
- En un ensayo aleatorizado, multicéntrico de fase II RADIUS (NCT01883362), la adición de midostaurina al tratamiento estándar se comparó con el tratamiento estándar solo después de un trasplante alogénico de células hematopoyéticas.[19] De manera parecida al ensayo RATIFY, la midostaurina se administró en dosis de 50 mg 2 veces al día, durante 12 ciclos de 28 días. Se inscribieron 30 pacientes en cada grupo, pero solo la mitad logró completar los 12 ciclos de terapia.
- La tasa de supervivencia sin recaída (SSR) a 18 meses fue del 89 % en el grupo de midostaurina y del 76 % en el grupo de tratamiento estándar (CRI, 0,46; intervalo de confianza [IC] 95 %, 0,12−1,86; P = 0,27). La reducción relativa anticipada en el riesgo de recaída con la adición de midostaurina fue del 54 %.[19][Nivel de evidencia B1]
Azacitidina oral
Evidencia (azacitidina oral):
- El ensayo aleatorizado controlado con placebo y con enmascaramiento doble de fase III QUAZAR AML-001 (NCT01757535) proporcionó el fundamento para la aprobación reglamentaria de la azacitidina oral para la terapia de mantenimiento de la LMA.[20] En el estudio participaron 472 pacientes con LMA de 55 años o más, que estaban dentro de los 4 meses de su primera RC o RC con recuperación hematológica incompleta después de la quimioterapia de inducción con o sin tratamiento de consolidación, y que no eran aptos para recibir un trasplante alogénico de células hematopoyéticas. Se administró azacitidina oral o placebo en dosis de 300 mg al día durante 14 días cada 28 días. El tratamiento se continuó hasta que se presentó progresión de la enfermedad o efectos tóxicos intolerables.
- En los pacientes que recibieron azacitidina, la mediana de SG desde la aleatorización fue de 24,7 meses (IC 95 %, 18,7−30,5) en comparación con 14,8 meses (IC 95 %, 11,7−17,6) en los pacientes que recibieron placebo (CRI, 0,69; IC 95 %, 0,55−0,86; P = 0,0009).[20][Nivel de evidencia A1]
Trasplante de células hematopoyéticas (médula ósea o células madre)
Trasplante alogénico de células hematopoyéticas
El trasplante alogénico de células hematopoyéticas, incluso con quimioterapia de acondicionamiento mínima, conlleva la incidencia más baja de recidiva leucémica, incluso cuando se compara con el trasplante de células hematopoyéticas de un gemelo idéntico (trasplante singénico). Este hallazgo dio paso a la noción de efecto inmunológico de injerto contra leucemia, análogo a la enfermedad de injerto contra huésped. La mejora en el tiempo sin recaída gracias a un trasplante alogénico de células hematopoyéticas como terapia primaria de consolidación se contrarresta, al menos en parte, por el aumento de morbilidad y mortalidad causado por la enfermedad de injerto contra huésped, la enfermedad venoclusiva del hígado y las infecciones. Las tasas de SSE con el trasplante alogénico en el momento de la primera remisión completa oscilan entre el 45 % y el 60 %.[21-24]
La administración de un trasplante alogénico de células hematopoyéticas en adultos exige la participación de un donante fraterno con compatibilidad de HLA, un donante no emparentado con compatibilidad de HLA, un donante haploidéntico (“compatibilidad de HLA parcial”), o el uso de dos unidades de sangre de cordón umbilical con compatibilidad apropiada. Según el registro de Center for International Blood and Marrow Transplant Research, incluso en pacientes que recibieron un trasplante de células hematopoyéticas entre 2007 y 2017, la probabilidad de supervivencia a 3 años después de un trasplante de donante fraterno con compatibilidad de HLA fue del 59 % (±1 %) en pacientes con enfermedad en estadio temprano, el 53 % (±1 %) en pacientes con enfermedad en estadio intermedio, y del 29 % (±1 %) en pacientes con enfermedad en estadio avanzado.[24] La probabilidad de supervivencia después de un trasplante de un donante no emparentado fue del 53 % (±1 %) en los pacientes con enfermedad en estadio temprano, el 50 % (±1 %) en aquellos con enfermedad en estadio intermedio, y del 27 % (±1 %) en pacientes con enfermedad en estadio avanzado.[Nivel de evidencia C1]
Debido a que el trasplante de células madre cura a más del 30 % de los pacientes que experimentan recidiva después de quimioterapia, algunos investigadores indicaron que el trasplante alogénico de médula ósea se puede reservar para la primera o segunda recidiva sin que se modifique el número de pacientes que se curan.[25] La información clínica y citogenética permite definir ciertos subconjuntos de pacientes con un pronóstico mejor o peor de acuerdo con factores de riesgo bajo o alto en quienes reciben quimioterapia de consolidación.[26]
- Leucemia mieloide aguda de riesgo bajo. Los factores de riesgo bajo son t(8;21), inv(16), cariotipo normal con una variante de NPM1 (en ausencia de una variante de FLT3) y cariotipo normal con variantes dobles de la proteína α de unión a la secuencia citosina-citosina-adenosina-adenosina-timidina (CCAAT) de promotores (C/EBP). Los pacientes en el grupo de riesgo bajo tienen una probabilidad de curación razonable cuando reciben quimioterapia intensiva de consolidación, de manera que es aceptable postergar el trasplante en ese grupo hasta la primera recidiva temprana.
- Leucemia mieloide aguda de riesgo alto. Los factores de riesgo alto fueron deleción de 5q, 7q, y 17p, inversión de 3 o t(3;3), anormalidad de (17p), trisomía 8, t(6;9), t(9;22), la mayoría de las translocaciones que afectan el cromosoma 11q23, y las variantes del gen KMT2A, un cariotipo complejo o monosómico, antecedentes de mielodisplasia o trastorno hematológico, variantes de TP53, variantes de RUNX1, variantes de ASXL1 y cariotipo normal con variantes de FLT3. Es poco probable que el grupo de riesgo alto se cure con quimioterapia de consolidación, de manera que el trasplante alogénico de médula ósea en el momento de la primera RC es una opción aceptable para estos pacientes. Sin embargo, incluso si reciben un trasplante alogénico de células madre, el desenlace para los pacientes con LMA de riesgo alto es precario (tasa de SSE a 5 años del 8 % al 30 % en pacientes con leucemia relacionada con el tratamiento o mielodisplasia).[27]
- Características citogenéticas normales. Los pacientes con características citogenéticas normales se ubican en un grupo de riesgo intermedio, y se deberá individualizar el tratamiento de consolidación a partir de los marcadores moleculares, los factores comórbidos y las preferencias del paciente; lo más conveniente es el tratamiento en un ensayo clínico.
Un diseño de ensayo clínico frecuente que se usa para evaluar el beneficio del trasplante alogénico como terapia de consolidación para la LMA en el momento de la primera remisión es el llamado diseño de comparación donante-no donante. En este diseño, los pacientes con LMA recién diagnosticada que logran una RC se consideran aptos desde el punto de vista médico para un trasplante alogénico y se someten a la tipificación de HLA. Si se identifica un donante fraterno compatible o un donante no emparentado compatible, el paciente se asigna al grupo que recibirá un trasplante. El análisis del desenlace se hace por intención de tratar; es decir, los pacientes asignados al grupo con donantes que no reciben un trasplante se agrupan en el análisis con los pacientes que recibieron un trasplante. En este tipo de ensayo, el criterio de valoración habitual es la SSE. Además, es menos frecuente que se notifique la SG desde el momento del diagnóstico.
Los investigadores intentaron abordar este tema mediante un metanálisis con datos de 18 ensayos prospectivos independientes de pacientes con LMA en los que se usó el diseño donante-no donante y datos de 6 ensayos adicionales que se incluyeron para el análisis de sensibilidad.[28] En los ensayos incluidos en este metanálisis, se inscribieron pacientes de 60 años o menos desde 1982 hasta 2006. La mediana de seguimiento osciló entre 42 y 142 meses. Los regímenes preparatorios fueron similares en los diferentes ensayos. El trasplante alogénico se comparó con el trasplante autógeno (6 ensayos) o con varios regímenes quimioterapéuticos de consolidación donde la citarabina en dosis altas fue el fármaco más común.
- La mortalidad relacionada con el tratamiento osciló entre el 5 % al 42 % en los grupos con donantes, en comparación con el 3 % al 27 % en el grupo sin donantes.
- De 18 ensayos en los que se notificó la SSR en todos los grupos de riesgo según las características citogenéticas, el CRI combinado para el beneficio general de SSR con trasplante alogénico fue de 0,80, lo que indica una reducción estadísticamente significativa en la mortalidad o recaída en el momento de la primera RC.
- De los 15 ensayos en los que se notificó la SG en todos los grupos de riesgo según las características citogenéticas, el CRI combinado para la SG fue de 0,90, lo que también indica una reducción estadísticamente significativa en la mortalidad o recaída en el momento de la primera RC.
- En análisis de subgrupos por categoría de riesgo citogenético, no se identificó beneficio en la SSR o la SG con el trasplante alogénico en pacientes con LMA de riesgo bajo (SSR: CRI, 1,07, IC 95 %, 0,83–1,38; P = 0,59; SG: CRI, 1,06, IC 95 %, 0,64–1,76; P = 0,81). Sin embargo, se observó un beneficio del trasplante en los pacientes con características citogenéticas de riesgo intermedio (SSR: CRI, 0,83, IC 95 %, 0,74–0,93; P < 0,01; SG: CRI 0,84; IC 95 %, 0,71–0,99; P = 0,03) o características citogenéticas de riesgo alto (SSR: CRI, 0,73, IC 95 %, 0,59–0,90; P < 0,01; SG: CRI, 0,60, IC 95 %, 0,40–0,90; P < 0,01).[28][Nivel de evidencia B4] La conclusión de este metanálisis fue que se justifica la administración de un trasplante alogénico de un donante fraterno en el momento de la primera RC por la mejora de la SSR y la SG en los pacientes con riesgo intermedio o riesgo alto, pero no se justifica este trasplante en los pacientes con características citogenéticas de riesgo bajo.
Una salvedad importante en este análisis es que no hubo uniformidad en las estrategias de inducción y consolidación para la LMA entre los diferentes estudios del metanálisis, y tampoco hubo uniformidad en las definiciones para los grupos de riesgo según las características citogenéticas. Es posible que esto produjera tasas de supervivencia inferiores en los pacientes que se trataron solo con quimioterapia.
La mayoría de los médicos que tratan a pacientes con leucemia están de acuerdo en que se debe ofrecer un trasplante cuando los pacientes con LMA exhiben un riesgo citogenético alto en el momento de la primera RC, y que no se debe ofrecer un trasplante a quienes exhiben un riesgo citogenético bajo en el momento de la primera RC.[26] Sin embargo, para los pacientes mayores con LMA de riesgo bajo, que quizás no toleren la terapia de consolidación intensiva a base de citarabina, es posible considerar la administración de un trasplante alogénico de células hematopoyéticas como terapia de consolidación.[29]
Trasplante autógeno de células madre hematopoyéticas
La función del trasplante autógeno para los pacientes con LMA se ha reducido con el tiempo por las mejoras en la mortalidad (no relacionada con recaída) del trasplante alogénico de células hematopoyéticas, así como el advenimiento del trasplante haploidéntico y de cordón umbilical que expandió el grupo de donantes posibles de manera que prácticamente todos los pacientes consiguen un donante.[30-33] El trasplante autógeno de células hematopoyéticas produjo tasas de SSE del 35 % al 50 % en pacientes con LMA en primera remisión. El trasplante autógeno de células hematopoyéticas también ha curado una proporción más pequeña de pacientes en segunda remisión.[34-40] Las tasas de mortalidad relacionadas con el tratamiento de pacientes sometidos a trasplante autógeno de sangre periférica o de médula ósea oscilan entre un 10 % y un 20 %.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Vaughan WP, Karp JE, Burke PJ: Long chemotherapy-free remissions after single-cycle timed-sequential chemotherapy for acute myelocytic leukemia. Cancer 45 (5): 859-65, 1980. [PUBMED Abstract]
- Cassileth PA, Harrington DP, Hines JD, et al.: Maintenance chemotherapy prolongs remission duration in adult acute nonlymphocytic leukemia. J Clin Oncol 6 (4): 583-7, 1988. [PUBMED Abstract]
- Mayer RJ, Davis RB, Schiffer CA, et al.: Intensive postremission chemotherapy in adults with acute myeloid leukemia. Cancer and Leukemia Group B. N Engl J Med 331 (14): 896-903, 1994. [PUBMED Abstract]
- Champlin R, Gajewski J, Nimer S, et al.: Postremission chemotherapy for adults with acute myelogenous leukemia: improved survival with high-dose cytarabine and daunorubicin consolidation treatment. J Clin Oncol 8 (7): 1199-206, 1990. [PUBMED Abstract]
- Rohatiner AZ, Gregory WM, Bassan R, et al.: Short-term therapy for acute myelogenous leukemia. J Clin Oncol 6 (2): 218-26, 1988. [PUBMED Abstract]
- Geller RB, Burke PJ, Karp JE, et al.: A two-step timed sequential treatment for acute myelocytic leukemia. Blood 74 (5): 1499-506, 1989. [PUBMED Abstract]
- Löwenberg B: Sense and nonsense of high-dose cytarabine for acute myeloid leukemia. Blood 121 (1): 26-8, 2013. [PUBMED Abstract]
- Weick JK, Kopecky KJ, Appelbaum FR, et al.: A randomized investigation of high-dose versus standard-dose cytosine arabinoside with daunorubicin in patients with previously untreated acute myeloid leukemia: a Southwest Oncology Group study. Blood 88 (8): 2841-51, 1996. [PUBMED Abstract]
- Löwenberg B, Pabst T, Vellenga E, et al.: Cytarabine dose for acute myeloid leukemia. N Engl J Med 364 (11): 1027-36, 2011. [PUBMED Abstract]
- Schaich M, Röllig C, Soucek S, et al.: Cytarabine dose of 36 g/m² compared with 12 g/m² within first consolidation in acute myeloid leukemia: results of patients enrolled onto the prospective randomized AML96 study. J Clin Oncol 29 (19): 2696-702, 2011. [PUBMED Abstract]
- Miyawaki S, Ohtake S, Fujisawa S, et al.: A randomized comparison of 4 courses of standard-dose multiagent chemotherapy versus 3 courses of high-dose cytarabine alone in postremission therapy for acute myeloid leukemia in adults: the JALSG AML201 Study. Blood 117 (8): 2366-72, 2011. [PUBMED Abstract]
- Stone RM, Berg DT, George SL, et al.: Postremission therapy in older patients with de novo acute myeloid leukemia: a randomized trial comparing mitoxantrone and intermediate-dose cytarabine with standard-dose cytarabine. Blood 98 (3): 548-53, 2001. [PUBMED Abstract]
- Goldstone AH, Burnett AK, Wheatley K, et al.: Attempts to improve treatment outcomes in acute myeloid leukemia (AML) in older patients: the results of the United Kingdom Medical Research Council AML11 trial. Blood 98 (5): 1302-11, 2001. [PUBMED Abstract]
- Baker WJ, Royer GL, Weiss RB: Cytarabine and neurologic toxicity. J Clin Oncol 9 (4): 679-93, 1991. [PUBMED Abstract]
- Haupt HM, Hutchins GM, Moore GW: Ara-C lung: noncardiogenic pulmonary edema complicating cytosine arabinoside therapy of leukemia. Am J Med 70 (2): 256-61, 1981. [PUBMED Abstract]
- Stone RM, Mandrekar SJ, Sanford BL, et al.: Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation. N Engl J Med 377 (5): 454-464, 2017. [PUBMED Abstract]
- Larson RA, Mandrekar SJ, Sanford BL: An Analysis of Maintenance Therapy and Post-Midostaurin Outcomes in the International Prospective Randomized, Placebo-Controlled, Double-Blind Trial (CALGB 10603/RATIFY [Alliance]) for Newly Diagnosed Acute Myeloid Leukemia (AML) Patients with FLT3 Mutations. [Abstract] Blood 130 (Suppl 1):145, 2017.
- Schlenk RF, Weber D, Fiedler W, et al.: Midostaurin added to chemotherapy and continued single-agent maintenance therapy in acute myeloid leukemia with FLT3-ITD. Blood 133 (8): 840-851, 2019. [PUBMED Abstract]
- Maziarz RT, Levis M, Patnaik MM, et al.: Midostaurin after allogeneic stem cell transplant in patients with FLT3-internal tandem duplication-positive acute myeloid leukemia. Bone Marrow Transplant 56 (5): 1180-1189, 2021. [PUBMED Abstract]
- Wei AH, Döhner H, Pocock C, et al.: Oral Azacitidine Maintenance Therapy for Acute Myeloid Leukemia in First Remission. N Engl J Med 383 (26): 2526-2537, 2020. [PUBMED Abstract]
- Clift RA, Buckner CD, Thomas ED, et al.: The treatment of acute non-lymphoblastic leukemia by allogeneic marrow transplantation. Bone Marrow Transplant 2 (3): 243-58, 1987. [PUBMED Abstract]
- Reiffers J, Gaspard MH, Maraninchi D, et al.: Comparison of allogeneic or autologous bone marrow transplantation and chemotherapy in patients with acute myeloid leukaemia in first remission: a prospective controlled trial. Br J Haematol 72 (1): 57-63, 1989. [PUBMED Abstract]
- Bostrom B, Brunning RD, McGlave P, et al.: Bone marrow transplantation for acute nonlymphocytic leukemia in first remission: analysis of prognostic factors. Blood 65 (5): 1191-6, 1985. [PUBMED Abstract]
- D'Souza A, Fretham C, Lee SJ, et al.: Current Use of and Trends in Hematopoietic Cell Transplantation in the United States. Biol Blood Marrow Transplant 26 (8): e177-e182, 2020. [PUBMED Abstract]
- Schiller GJ, Nimer SD, Territo MC, et al.: Bone marrow transplantation versus high-dose cytarabine-based consolidation chemotherapy for acute myelogenous leukemia in first remission. J Clin Oncol 10 (1): 41-6, 1992. [PUBMED Abstract]
- Döhner H, Estey E, Grimwade D, et al.: Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood 129 (4): 424-447, 2017. [PUBMED Abstract]
- Witherspoon RP, Deeg HJ, Storer B, et al.: Hematopoietic stem-cell transplantation for treatment-related leukemia or myelodysplasia. J Clin Oncol 19 (8): 2134-41, 2001. [PUBMED Abstract]
- Koreth J, Schlenk R, Kopecky KJ, et al.: Allogeneic stem cell transplantation for acute myeloid leukemia in first complete remission: systematic review and meta-analysis of prospective clinical trials. JAMA 301 (22): 2349-61, 2009. [PUBMED Abstract]
- Tallman MS, Wang ES, Altman JK, et al.: Acute Myeloid Leukemia, Version 3.2019, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 17 (6): 721-749, 2019. [PUBMED Abstract]
- Gerds AT, Appelbaum FR: To transplant or not to transplant for adult acute myeloid leukemia: an ever-evolving decision. Clin Adv Hematol Oncol 10 (10): 655-62, 2012. [PUBMED Abstract]
- Gooley TA, Chien JW, Pergam SA, et al.: Reduced mortality after allogeneic hematopoietic-cell transplantation. N Engl J Med 363 (22): 2091-101, 2010. [PUBMED Abstract]
- Ciurea SO, Zhang MJ, Bacigalupo AA, et al.: Haploidentical transplant with posttransplant cyclophosphamide vs matched unrelated donor transplant for acute myeloid leukemia. Blood 126 (8): 1033-40, 2015. [PUBMED Abstract]
- Ballen KK, Lazarus H: Cord blood transplant for acute myeloid leukaemia. Br J Haematol 173 (1): 25-36, 2016. [PUBMED Abstract]
- Chao NJ, Stein AS, Long GD, et al.: Busulfan/etoposide--initial experience with a new preparatory regimen for autologous bone marrow transplantation in patients with acute nonlymphoblastic leukemia. Blood 81 (2): 319-23, 1993. [PUBMED Abstract]
- Linker CA, Ries CA, Damon LE, et al.: Autologous bone marrow transplantation for acute myeloid leukemia using busulfan plus etoposide as a preparative regimen. Blood 81 (2): 311-8, 1993. [PUBMED Abstract]
- Sanz MA, de la Rubia J, Sanz GF, et al.: Busulfan plus cyclophosphamide followed by autologous blood stem-cell transplantation for patients with acute myeloblastic leukemia in first complete remission: a report from a single institution. J Clin Oncol 11 (9): 1661-7, 1993. [PUBMED Abstract]
- Cassileth PA, Andersen J, Lazarus HM, et al.: Autologous bone marrow transplant in acute myeloid leukemia in first remission. J Clin Oncol 11 (2): 314-9, 1993. [PUBMED Abstract]
- Jones RJ, Santos GW: Autologous bone marrow transplantation with 4-hydroperoxycyclophosphamide purging. In: Gale RP, ed.: Acute Myelogenous Leukemia: Progress and Controversies: Proceedings of a Wyeth-Ayerst-UCLA Symposia Western Workshop Held at Lake Lanier, Georgia, November 28-December 1, 1989. Wiley-Liss, 1990, pp 411-419.
- Gorin NC, Aegerter P, Auvert B, et al.: Autologous bone marrow transplantation for acute myelocytic leukemia in first remission: a European survey of the role of marrow purging. Blood 75 (8): 1606-14, 1990. [PUBMED Abstract]
- Robertson MJ, Soiffer RJ, Freedman AS, et al.: Human bone marrow depleted of CD33-positive cells mediates delayed but durable reconstitution of hematopoiesis: clinical trial of MY9 monoclonal antibody-purged autografts for the treatment of acute myeloid leukemia. Blood 79 (9): 2229-36, 1992. [PUBMED Abstract]
Tratamiento de la leucemia mieloide aguda resistente al tratamiento o recidivante
No existe un régimen de tratamiento estándar para los pacientes con leucemia mieloide aguda recidivante o resistente al tratamiento.[1,2]
Las opciones de tratamiento de la leucemia mieloide aguda resistente al tratamiento o recidivante son las siguientes:
Quimioterapia
Quimioterapia de rescate intensiva
Se demostró la eficacia de varios regímenes de quimioterapia de rescate intensiva para el tratamiento de la LMA recidivante, entre ellos los siguientes:
Fludarabina, citarabina y filgrastim
Se ha observado actividad antileucémica de el régimen de fludarabina, citarabina y filgrastim (FLAG) en pacientes con LMA en recaída y resistente al tratamiento.
Evidencia (fludarabina, citarabina y filgrastim):
- En un estudio multicéntrico de fase II se incluyeron 83 pacientes con LMA en recaída o resistente al tratamiento o anemia resistente al tratamiento de novo con exceso de blastocitos en transformación. El criterio principal de valoración fue la tasa de remisión completa (RC) alcanzada después de uno o dos cursos de la quimioterapia de inducción FLAG.[3]
- En los pacientes con recaída de leucemia cuya primera remisión duró 6 meses o más, la tasa de RC fue del 81 % (17 de 21 pacientes).
- En los pacientes con LMA cuya primera remisión duró menos de 6 meses, o en los pacientes con enfermedad primaria resistente al tratamiento, la tasa de RC fue del 30 % (13 de 44 pacientes).[3][Nivel de evidencia C3]
- La mielodepresión y la mucositis fueron efectos tóxicos comunes del tratamiento.
También se ha añadido idarrubicina a este régimen (FLAG-Ida).[4]
Mitoxantrona, etopósido y citarabina
Evidencia (mitoxantrona, etopósido y citarabina):
- En un estudio se evaluó la administración de un curso de quimioterapia de mitoxantrona, etopósido y citarabina (MEC) en 74 pacientes con LMA y un pronóstico precario. La población incluyó a 30 pacientes con recaída de LMA, 28 pacientes con LMA primaria resistente al tratamiento y 16 pacientes con LMA secundaria.[5]
- El régimen MEC produjo una tasa de inducción a la RC del 55 %.[5][Nivel de evidencia C3]
- En un ensayo aleatorizado de fase III del Eastern Cooperative Oncology Group (ECOG) (E-2995), se evaluó a 129 pacientes con uno de los siguientes estados de enfermedad: LMA en recaída a menos de 6 meses de la primera RC; LMA en recaída después de trasplante alogénico o autógeno de médula ósea; LMA en segunda recaída o posteriores; fracaso de la inducción primaria; LMA secundaria; o síndromes mielodisplásicos de riesgo alto. Los pacientes se asignaron al azar a recibir MEC con valspodar, un modulador de resistencia a múltiples fármacos, o sin este.
- La tasa de respuesta completa fue de solo el 17 % al 25 % en ambos grupos.[6][Nivel de evidencia B3]
Dosis altas o estándar de citarabina y mitoxantrona
Evidencia (dosis altas o estándar de citarabina y mitoxantrona)
- En un estudio de citarabina y mitoxantrona se incluyeron 49 pacientes con LMA en recaída o resistente al tratamiento.[7]
Dosis altas de etopósido y ciclofosfamida
Evidencia (dosis altas de etopósido y ciclofosfamida):
- Los resultados notificados han sido similares a los de la combinación de citarabina y mitoxantrona.[9]
Idarrubicina y citarabina
Evidencia (idarrubicina y citarabina):
Otros regímenes intensivos
Terapia de intensidad reducida, que incluye terapia dirigida
Los pacientes que no pueden someterse a terapia intensiva o que no desean someterse a este tipo de tratamiento, pueden recibir terapias de intensidad reducida, como las siguientes:
Gilteritinib
El gilteritinib es un inhibidor de FLT3 oral con actividad en el subtipo con duplicación interna en tándem (ITD) o en el subtipo con alteración del dominio tirosina–cinasa (TKD).
Evidencia (gilteritinib):
- En un ensayo de fase III, 371 pacientes se asignaron al azar en una proporción 2:1 a recibir gilteritinib o una quimioterapia de rescate predeterminada (MEC, FLAG-Ida, azacitidina, o dosis bajas de citarabina).[16,17]
- Al cabo de una mediana de seguimiento de 37,1 meses, la mediana de supervivencia general (SG) fue de 9,3 meses en los pacientes que recibieron gilteritinib, y de 5,6 meses en los pacientes que recibieron quimioterapia (cociente de riesgos instantáneos [CRI] de muerte, 0,665; intervalo de confianza [IC] 95 %, 0,52–0,85). La tasa de SG estimada a 2 años fue del 20,6 % (IC 95 %, 15,8 %–26,0 %) en los pacientes que recibieron gilteritinib y del 14,2 % (IC 95 %, 8,3 %–21,6 %) en los pacientes que recibieron quimioterapia.[16] Entre los pacientes que se trataron con gilteritinib, la mediana de duración de la respuesta completa o respuesta completa con recuperación hematológica parcial fue de 10 meses (intervalo intercuartílico [IIC], 2,08–no evaluable), y de 23 meses (IIC, 4,9–no evaluable) solo en aquellos que alcanzaron una respuesta completa.[17]
- Las tasas de respuesta completa y respuesta completa con recuperación hematológica parcial fueron más altas en los pacientes que recibieron gilteritinib que en los pacientes que recibieron quimioterapia (34 vs.15,3 %; CRI, 18,6; IC 95 %, 9,8–27,4).
- Los efectos adversos de grado 3 o superior fueron menos comunes en los pacientes que recibieron gilteritinib cuando se ajustó por el tiempo de exposición.[16][Nivel de evidencia A1] El efecto adverso de interés más frecuente fue el aumento de las transaminasas hepáticas en los pacientes que recibieron gilteritinib. Si la concentración de transaminasas hepáticas aumenta más de 5 veces el límite superior normal (y se considera relacionado con el tratamiento), se interrumpe el tratamiento con gilteritinib. Cuando la concentración de las enzimas vuelve a ser igual o menor a 2,5 veces el límite superior normal, se reanuda el tratamiento con una dosis reducida de 80 mg una vez al día.[17][Nivel de evidencia A1]
Enasidenib
Enasidenib es un inhibidor micromolecular oral con actividad contra la enzima IDH2 alterada.
Evidencia (enasidenib):
- En un estudio de fase I/II, 214 pacientes con LMA en recaída o resistente al tratamiento recibieron enasidenib.[18]
- La tasa de respuesta general fue del 40,3 % (IC 95 %, 33,0–48,0 %), con una mediana de duración de la respuesta de 5,8 meses.
- Esto incluyó a 46 pacientes (26,1 %) que obtuvieron una RC o una RC con recuperación hematológica incompleta (RCi).
- Los efectos adversos relacionados con el tratamiento de grado 3 o 4 fueron hiperbilirrubinemia indirecta (12 %) y síndrome de diferenciación (7 %). Como resultado, la administración de Alimentos y Medicamentos (FDA) agregó un recuadro de advertencia al prospecto del enasidenib, que alerta a los médicos prescriptores de la posibilidad de aparición de un síndrome de diferenciación.[18][Nivel de evidencia C3]
Ivosidenib
El ivosidenib es un inhibidor micromolecular oral con actividad contra la enzima IDH1 alterada.
Evidencia (ivosidenib):
- En un estudio de fase I/II, 179 pacientes con LMA en recaída o resistente al tratamiento recibieron ivosidenib.[19]
- La tasa de respuesta completa fue del 39,1 % (IC 95 %, 31,9−46,7 %), con una mediana de duración de la remisión de 6,5 meses (intervalo, 4,6−9,3). Esto incluyó a 54 pacientes (30,2 %) que obtuvieron una RC o una RCi.
- Más de un tercio de los pacientes que necesitaron transfusiones al inicio del tratamiento luego ya no las necesitaron.
- Se observó una prolongación del intervalo QT, de grado 3 o superior, en 14 pacientes (7,8 %), y una diferenciación de grado 3 o superior en 7 pacientes (3,9 %). La FDA agregó un recuadro de advertencia al prospecto del ivosidenib, que alerta a los médicos prescriptores de la posibilidad de aparición de un síndrome de diferenciación.[19][Nivel de evidencia C3]
Revumenib
El revumenib es un inhibidor de la menina de administración oral que la FDA aprobó para el tratamiento de la leucemia aguda en recaída o resistente al tratamiento con una translocación de KMT2A en pacientes adultos o pediátricos de 1 año o más.
- En el estudio AUGMENT-101 (NCT04065399) de fase I/II, 104 pacientes con leucemia aguda en recaída o resistente al tratamiento con reordenamiento de KMT2A recibieron revumenib. Los pacientes tenían que tener un intervalo QT corregido (QTc) mediante la fórmula de Fridericia inferior a 450 ms al inicio.[20]
- La tasa general de RC con RCh (remisión completa con recuperación hematológica incompleta) fue del 21,2 % (IC 95 %, 13,8–30,3 %). La mediana de duración de la RC con RCh fue de 6,4 meses (IC 95 %, 2,7–no alcanzado).[20][Nivel de evidencia C3]
- De los 83 pacientes que eran dependientes de transfusiones de glóbulos rojos o plaquetas, el 14 % se volvió independiente de las transfusiones durante el periodo de 56 días posterior al inicio.
- El revumenib tiene una advertencia en el prospecto (en inglés) para el síndrome de diferenciación, que se observó en el 29 % de los pacientes. El síndrome de diferenciación de grado 3 o 4 se observó en el 13 % de los pacientes y hubo 1 defunción (0,7 %).
- Se observó prolongación del intervalo QTc de grado 3 o superior en el 12 % de los pacientes.
- Debido a que CYP3A4 metaboliza el revumenib, la dosis debe reducirse en los pacientes que reciben inhibidores potentes de CYP3A4. La dosis estándar para los pacientes que pesan más de 40 kg es de 270 mg por vía oral 2 veces al día, con reducción de la dosis hasta 160 mg oral 2 veces al día en pacientes que reciben un inhibidor potente de CYP3A4. Además, la dosis se ajusta de acuerdo al área de superficie corporal en pacientes que pesan menos de 40 kg.
Hipometilantes
Evidencia (hipometilantes):
- En un análisis retrospectivo, 655 pacientes con LMA en recaída o LMA primaria resistente al tratamiento recibieron azacitidina (57 %) o decitabina (43 %).[21]
- En general, el 16 % de los pacientes obtuvieron una RC o una RCi y la mediana de SG fue de 21 meses.[21][Nivel de evidencia C3]
Gemtuzumab ozogamicina
Se evaluó el gemtuzumab ozogamicina, un fármaco de quimioterapia dirigida a anticuerpo, en pacientes con LMA en recaída que expresaban CD33.
Evidencia (gemtuzumab ozogamicina):
- En un análisis agrupado de 3 estudios sin enmascaramiento de grupo único y de fase II, se incluyeron 277 pacientes.[22]
- La tasa de respuesta general fue del 26 %. 35 pacientes (13 %) lograron una RC y 36 pacientes (13 %) lograron una RC sin recuperación de plaquetas. No está claro si la recuperación de plaquetas inadecuada fue una consecuencia de los efectos tóxicos del gemtuzumab en los megacariocitos o correspondía a una leucemia residual subclínica.[22]
No se conocen bien los desenlaces a largo plazo de los pacientes que reciben gemtuzumab y logran una RC sin recuperación de plaquetas. El gemtuzumab induce una aplasia profunda de la médula ósea similar a la quimioterapia de inducción para el tratamiento de la leucemia, y también produce hepatotoxicidad importante, que incluye la enfermedad venoclusiva hepática.[22][Nivel de evidencia C3]
Clofarabina con citarabina o sin esta
Evidencia (clofarabina con citarabina o sin esta):
- La clofarabina, un análogo nucleosídico de purina, se estudió como monoterapia en 62 pacientes con LMA en recaída o resistente al tratamiento.[23]
- Ocho de los 19 pacientes que recibieron tratamiento para su primera recaída obtuvieron una respuesta completa.
- La clofarabina se administró en combinación con dosis intermedias de citarabina en pacientes con LMA en recaída o resistente al tratamiento.[24]
- Siete de los 29 pacientes con LMA o síndrome mielodisplásico que recibieron tratamiento para su primera recaída presentaron una RC.[24][Nivel de evidencia C3]
Trasplante alogénico de células hematopoyéticas
Cuando los pacientes con enfermedad recidivante reciben un tratamiento intensivo, es posible que obtengan una supervivencia sin enfermedad (SSE) prolongada; sin embargo, los pacientes con enfermedad recidivante solo se pueden curar con un trasplante de células hematopoyéticas.[25][Nivel de evidencia C2] El trasplante alogénico de células hematopoyéticas en el momento de la segunda RC conlleva mejores tasas de SSE que el trasplante en el momento de una recaída.[26][Nivel de evidencia C1]
Evidencia (trasplante alogénico de células hematopoyéticas):
- En la actualidad, el Center for International Blood and Marrow Transplantation Research Registry notifica los desenlaces en pacientes que reciben trasplantes. El grupo notificó los siguientes desenlaces de trasplantes realizados en los Estados Unidos entre 2008 y 2018:[27][Nivel de evidencia C2]
- La tasa de supervivencia a 3 años fue del 53 % en los pacientes con LMA en segunda RC o remisiones posteriores versus el 31 % en los pacientes con enfermedad recidivante (o que nunca han obtenido una RC) que recibieron un trasplante de donante fraterno compatible.
- La tasa de supervivencia a 3 años fue del 50 % en los pacientes con LMA en segunda RC o remisiones posteriores versus el 30 % en los pacientes con enfermedad recidivante (o que nunca han obtenido una RC) que recibieron un trasplante de donante fraterno compatible.
El trasplante alogénico de células hematopoyéticas a veces es eficaz como terapia de rescate en algunos pacientes que no obtienen una remisión con la quimioterapia intensiva (leucemia primaria resistente al tratamiento). En varios estudios retrospectivos se demostró la capacidad del trasplante alogénico de células hematopoyéticas para inducir remisión de una enfermedad primaria resistente al tratamiento.[28]
Evidencia (trasplante alogénico de células hematopoyéticas para inducir remisión):
- En un análisis retrospectivo de 168 pacientes con LMA y enfermedad primaria resistente al tratamiento que recibieron un trasplante alogénico de células hematopoyéticas, la tasa de SG a 5 años fue del 22 %.[29]
- Otro análisis se llevó a cabo con participantes de un ensayo de grupo cooperativo prospectivo, SWOG S0106 (NCT00085709).[30]
- De los 589 pacientes tratados en el ensayo de grupo cooperativo, 150 (25 %) tenía una enfermedad primaria resistente al tratamiento.
- Entre los 64 pacientes con enfermedad primaria resistente al tratamiento que recibieron un trasplante alogénico de células hematopoyéticas, la tasa de supervivencia a 4 años fue del 48 % en comparación con el 4 % en los 86 pacientes que no recibieron un trasplante.[30][Nivel de evidencia C3]
No hay ensayos aleatorizados que prueben la eficacia de este abordaje.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Döhner H, Estey E, Grimwade D, et al.: Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood 129 (4): 424-447, 2017. [PUBMED Abstract]
- Sekeres MA, Guyatt G, Abel G, et al.: American Society of Hematology 2020 guidelines for treating newly diagnosed acute myeloid leukemia in older adults. Blood Adv 4 (15): 3528-3549, 2020. [PUBMED Abstract]
- Jackson G, Taylor P, Smith GM, et al.: A multicentre, open, non-comparative phase II study of a combination of fludarabine phosphate, cytarabine and granulocyte colony-stimulating factor in relapsed and refractory acute myeloid leukaemia and de novo refractory anaemia with excess of blasts in transformation. Br J Haematol 112 (1): 127-37, 2001. [PUBMED Abstract]
- Pastore D, Specchia G, Carluccio P, et al.: FLAG-IDA in the treatment of refractory/relapsed acute myeloid leukemia: single-center experience. Ann Hematol 82 (4): 231-5, 2003. [PUBMED Abstract]
- Spadea A, Petti MC, Fazi P, et al.: Mitoxantrone, etoposide and intermediate-dose Ara-C (MEC): an effective regimen for poor risk acute myeloid leukemia. Leukemia 7 (4): 549-52, 1993. [PUBMED Abstract]
- Greenberg PL, Lee SJ, Advani R, et al.: Mitoxantrone, etoposide, and cytarabine with or without valspodar in patients with relapsed or refractory acute myeloid leukemia and high-risk myelodysplastic syndrome: a phase III trial (E2995). J Clin Oncol 22 (6): 1078-86, 2004. [PUBMED Abstract]
- Paciucci PA, Dutcher JP, Cuttner J, et al.: Mitoxantrone and ara-C in previously treated patients with acute myelogenous leukemia. Leukemia 1 (7): 565-7, 1987. [PUBMED Abstract]
- Hiddemann W, Kreutzmann H, Straif K, et al.: High-dose cytosine arabinoside and mitoxantrone: a highly effective regimen in refractory acute myeloid leukemia. Blood 69 (3): 744-9, 1987. [PUBMED Abstract]
- Brown RA, Herzig RH, Wolff SN, et al.: High-dose etoposide and cyclophosphamide without bone marrow transplantation for resistant hematologic malignancy. Blood 76 (3): 473-9, 1990. [PUBMED Abstract]
- Lambertenghi-Deliliers G, Maiolo AT, Annaloro C, et al.: Idarubicin in sequential combination with cytosine arabinoside in the treatment of relapsed and refractory patients with acute non-lymphoblastic leukemia. Eur J Cancer Clin Oncol 23 (7): 1041-5, 1987. [PUBMED Abstract]
- Harousseau JL, Reiffers J, Hurteloup P, et al.: Treatment of relapsed acute myeloid leukemia with idarubicin and intermediate-dose cytarabine. J Clin Oncol 7 (1): 45-9, 1989. [PUBMED Abstract]
- Herzig RH, Lazarus HM, Wolff SN, et al.: High-dose cytosine arabinoside therapy with and without anthracycline antibiotics for remission reinduction of acute nonlymphoblastic leukemia. J Clin Oncol 3 (7): 992-7, 1985. [PUBMED Abstract]
- Liu Yin JA, Wheatley K, Rees JK, et al.: Comparison of 'sequential' versus 'standard' chemotherapy as re-induction treatment, with or without cyclosporine, in refractory/relapsed acute myeloid leukaemia (AML): results of the UK Medical Research Council AML-R trial. Br J Haematol 113 (3): 713-26, 2001. [PUBMED Abstract]
- Becker PS, Kantarjian HM, Appelbaum FR, et al.: Clofarabine with high dose cytarabine and granulocyte colony-stimulating factor (G-CSF) priming for relapsed and refractory acute myeloid leukaemia. Br J Haematol 155 (2): 182-9, 2011. [PUBMED Abstract]
- Scappini B, Gianfaldoni G, Caracciolo F, et al.: Cytarabine and clofarabine after high-dose cytarabine in relapsed or refractory AML patients. Am J Hematol 87 (12): 1047-51, 2012. [PUBMED Abstract]
- Perl AE, Martinelli G, Cortes JE, et al.: Gilteritinib or Chemotherapy for Relapsed or Refractory FLT3-Mutated AML. N Engl J Med 381 (18): 1728-1740, 2019. [PUBMED Abstract]
- Perl AE, Larson RA, Podoltsev NA, et al.: Follow-up of patients with R/R FLT3-mutation-positive AML treated with gilteritinib in the phase 3 ADMIRAL trial. Blood 139 (23): 3366-3375, 2022. [PUBMED Abstract]
- Stein EM, DiNardo CD, Pollyea DA, et al.: Enasidenib in mutant IDH2 relapsed or refractory acute myeloid leukemia. Blood 130 (6): 722-731, 2017. [PUBMED Abstract]
- DiNardo CD, Stein EM, de Botton S, et al.: Durable Remissions with Ivosidenib in IDH1-Mutated Relapsed or Refractory AML. N Engl J Med 378 (25): 2386-2398, 2018. [PUBMED Abstract]
- Issa GC, Aldoss I, Thirman MJ, et al.: Menin Inhibition With Revumenib for KMT2A-Rearranged Relapsed or Refractory Acute Leukemia (AUGMENT-101). J Clin Oncol 43 (1): 75-84, 2025. [PUBMED Abstract]
- Stahl M, DeVeaux M, Montesinos P, et al.: Hypomethylating agents in relapsed and refractory AML: outcomes and their predictors in a large international patient cohort. Blood Adv 2 (8): 923-932, 2018. [PUBMED Abstract]
- Larson RA, Sievers EL, Stadtmauer EA, et al.: Final report of the efficacy and safety of gemtuzumab ozogamicin (Mylotarg) in patients with CD33-positive acute myeloid leukemia in first recurrence. Cancer 104 (7): 1442-52, 2005. [PUBMED Abstract]
- Kantarjian H, Gandhi V, Cortes J, et al.: Phase 2 clinical and pharmacologic study of clofarabine in patients with refractory or relapsed acute leukemia. Blood 102 (7): 2379-86, 2003. [PUBMED Abstract]
- Faderl S, Gandhi V, O'Brien S, et al.: Results of a phase 1-2 study of clofarabine in combination with cytarabine (ara-C) in relapsed and refractory acute leukemias. Blood 105 (3): 940-7, 2005. [PUBMED Abstract]
- Forman SJ, Schmidt GM, Nademanee AP, et al.: Allogeneic bone marrow transplantation as therapy for primary induction failure for patients with acute leukemia. J Clin Oncol 9 (9): 1570-4, 1991. [PUBMED Abstract]
- Clift RA, Buckner CD, Thomas ED, et al.: The treatment of acute non-lymphoblastic leukemia by allogeneic marrow transplantation. Bone Marrow Transplant 2 (3): 243-58, 1987. [PUBMED Abstract]
- Phelan R, Arora M, Chen M: The US Summary Slides - HCT Trends and Survival Data. Center for International Blood and Marrow Transplant Research, 2020. Available online. Last accessed January 24, 2025.
- Gyurkocza B, Lazarus HM, Giralt S: Allogeneic hematopoietic cell transplantation in patients with AML not achieving remission: potentially curative therapy. Bone Marrow Transplant 52 (8): 1083-1090, 2017. [PUBMED Abstract]
- Craddock C, Labopin M, Pillai S, et al.: Factors predicting outcome after unrelated donor stem cell transplantation in primary refractory acute myeloid leukaemia. Leukemia 25 (5): 808-13, 2011. [PUBMED Abstract]
- Othus M, Appelbaum FR, Petersdorf SH, et al.: Fate of patients with newly diagnosed acute myeloid leukemia who fail primary induction therapy. Biol Blood Marrow Transplant 21 (3): 559-64, 2015. [PUBMED Abstract]
Tratamiento de la leucemia promielocítica aguda
Se debe evaluar bien la terapia de inducción para la leucemia promielocítica aguda (LPA). El tratamiento se enfoca en la administración de diferentes fármacos que eliminan células leucémicas. La mortalidad temprana se vincula con hemorragia, síndrome de diferenciación o infección. Es frecuente que se obtengan tasas altas de remisión completa (RC) con todos los regímenes de tratamiento, y la enfermedad persistente o la recaída son infrecuentes.
Tratamiento de la leucemia promielocítica aguda recién diagnosticada
Las opciones de tratamiento de la LPA recién diagnosticada son las siguientes:
El ácido retinoico (ATRA) induce la diferenciación terminal de las células leucémicas después de la restauración de la hematopoyesis no clonal. La administración de ATRA conlleva la resolución rápida de la coagulopatía en la mayoría de los pacientes, y no exige la administración de heparina en los pacientes que reciben ATRA. No obstante, en ensayos aleatorizados no se ha observado reducción en la morbilidad y mortalidad durante la inducción con ATRA cuando se compara con quimioterapia. La administración de ATRA quizás produzca las siguientes afecciones:
- Síndrome de diferenciación. La administración de ATRA a veces produce un síndrome de dificultad respiratoria, conocido como síndrome de diferenciación. La identificación oportuna del síndrome y la administración intensiva de esteroides a veces previene la dificultad respiratoria.[1]
- Hiperleucocitosis. No se ha establecido el tratamiento apropiado de la hiperleucocitosis producida por el ATRA. La hiperleucocitosis de la LPA por lo general se trata con la adición de quimioterapia citotóxica. No se recomienda el uso de leucoaféresis por riesgo alto de complicaciones como episodios hemorrágicos y coagulación intravascular diseminada.
En estudios de la década de 1990, se observó que las tasas de supervivencia general (SG) mejoran en los pacientes que reciben ATRA además de quimioterapia.[2,3] El trióxido de arsénico, una sustancia que induce diferenciación y apoptosis de las células de la LPA, también se usa para el tratamiento de este tipo de leucemia. El tratamiento de inducción a la remisión en la LPA se determina a partir del riesgo de la enfermedad. La LPA de riesgo bajo a intermedio (recuento de glóbulo blancos [GB] ≤10 × 109/l) se trata sin quimioterapia (ATRA y trióxido de arsénico), mientras que la enfermedad de riesgo alto se trata con una combinación de ATRA, trióxido de arsénico y quimioterapia.
Ácido retinoico y trióxido de arsénico para la enfermedad de riesgo bajo a intermedio
Evidencia (ácido retinoico y trióxido de arsénico para la enfermedad de riesgo bajo a intermedio):
- En un ensayo aleatorizado controlado multicéntrico de fase III en pacientes con LPA clasificada como de riesgo bajo a intermedio (conteo de GB, ≤10 × 109/l) se comparó el uso de ATRA y quimioterapia con ATRA y trióxido de arsénico.[4]
- Las tasas de RC fueron igualmente altas en ambos grupos. Se presentaron RC en 77 pacientes (100 %) evaluables del grupo de ATRA y trióxido de arsénico y en 75 de 79 pacientes (95 %) del grupo de ATRA y quimioterapia (P = 0,12).
- Al cabo de una mediana de seguimiento de 34,4 meses, la tasa de SG a 2 años fue del 99 % (intervalo de confianza [IC] 95 %, 96−100 %) en el grupo que recibió ATRA y trióxido de arsénico, y del 91 % (IC 95 %, 85−97 %) en el grupo de ATRA y quimioterapia (P = 0,02).
- La incidencia acumulada de recaída a 2 años fue igual de baja en ambos grupos, del 1 % (IC 95 %, 0−4%) en el grupo que recibió ATRA y trióxido de arsénico, y del 6 % (IC 95 %, 0−11 %) en el grupo de ATRA y quimioterapia (P = 0,24).
- El criterio principal de valoración fue la supervivencia sin complicaciones (SSC) (definida como la ausencia de RC hematológica después de la terapia de inducción, la ausencia de RC molecular después de 3 cursos de consolidación, una respuesta molecular, una recaída hematológica o la muerte). La tasa de SSC a 2 años fue del 97 % en el grupo que recibió ATRA y trióxido de arsénico, y del 85 % en el grupo de ATRA y quimioterapia (P< 0,001 para la ausencia de inferioridad).
- Los resultados de este régimen sin quimioterapia para la LPA de riesgo bajo a riesgo intermedio se confirmaron en un segundo ensayo controlado aleatorizado de fase III.[5][Nivel de evidencia A1]
Ácido retinoico y quimioterapia, seguida de terapia de consolidación a base de trióxido de arsénico para la enfermedad de riesgo alto
La inducción a la remisión con una combinación de antraciclina y ATRA se usa para la inducción a la remisión en pacientes con enfermedad de riesgo alto (recuento de GB, >10 × 109/l).
Evidencia (ácido retinoico y quimioterapia, seguida de terapia de consolidación a base de trióxido de arsénico para la enfermedad de riesgo alto):
- En el estudio AIDA-2000 (NCT00180128) se utilizó una combinación de ATRA oral hasta el momento de obtener una RC o durante un máximo de 45 días, con 4 dosis intravenosas de idarrubicina (12 mg/m2) los días 2, 4, 6 y 8. La consolidación se administró según el riesgo, de manera que los pacientes con riesgo bajo a intermedio recibieron ciclos adicionales de antraciclina y ATRA, y los pacientes de riesgo alto también recibieron citarabina, etopósido, 6-tioguanina y quimioterapia CHT (6-mercaptopurina con metotrexato) como consolidación.[6]
- Después de la inducción, 420 de 445 pacientes (94,4 %) tratados según el protocolo de AIDA-2000 obtuvieron una RC. La tasa de SG a 6 años fue del 87,4 %, y la tasa de incidencia acumulada de recaída fue del 10,7 %.[6][Nivel de evidencia B4]
- En el estudio de fase II APML4, se añadió trióxido de arsénico al tratamiento de inducción a la remisión de base con ATRA e idarrubicina.[7]
- Entre los 124 pacientes evaluables, se presentaron 4 (3,2 %) muertes tempranas y 118 (95 %) RC hematológicas.
- La tasa de respuesta sin recaída a 2 años fue del 97,5 % (IC 95 %, 90,4−99,4 %), la tasa de supervivencia sin fracaso terapéutico fue del 88,1 % (IC 95 %, 80,7−92,8 %), y la tasa de SG fue del 93,2 % (IC 95 %, 85,8−96,8 %).[7][Nivel de evidencia B4]
Se formuló un régimen a base de trióxido de arsénico, que incluye gemtuzumab ozogamicina como el único fármaco citotóxico.
- En un estudio de una sola institución, los pacientes recibieron una inducción de ATRA y trióxido de arsénico. Además recibieron una dosis de gemtuzumab ozogamicina (o idarrubicina) si el recuento de GB era superior a 10 x 109/l en el momento de la presentación o subió por encima de 30 x 109/l durante la inducción.[8] En los pacientes en remisión que recibieron trióxido de arsénico y ATRA en meses alternos durante 7 ciclos de consolidación, se substituyó el gemtuzumab ozogamicina cuando el trióxido de arsénico o el ATRA se descontinuó debido a toxicidad.
- De 54 pacientes con enfermedad de riesgo alto tratados en este protocolo, 1 paciente recibió gemtuzumab ozogamicina e idarrubicina (12 mg/m2 al día durante 3 días) por una leucocitosis persistente a pesar de recibir gemtuzumab ozogamicina.
- La tasa de RC fue del 96 %, y 5 (9 %) pacientes recayeron.
- A los 5 años, la tasa de SSC fue del 81 %, la tasa de supervivencia sin enfermedad (SSE) fue del 89 % y la tasa de SG fue del 86 %, lo que indica que las respuestas son durables.
- En la población del estudio completa, la tasa de SG a 5 años fue similar entre los 45 pacientes de riesgo alto que recibieron gemtuzumab ozogamicina (84 %) en comparación con 7 pacientes que recibieron idarrubicina (100 %, P = 0,453).[8][Nivel de evidencia B4]
Se publicó el seguimiento a largo plazo de este estudio.[9]
Cabe anotar que los regímenes más recientes para el tratamiento de la LPA incluyen alguna forma de terapia de mantenimiento. En un metanálisis de ensayos aleatorizados se indicó que el mantenimiento mejora la SSE pero no la SG; sin embargo, en estos ensayos no se usaron regímenes de trióxido de arsénico.
Tratamiento de la leucemia promielocítica aguda recidivante
Las opciones de tratamiento de la leucemia promielocítica aguda recidivante son las siguientes:
Trióxido de arsénico con quimioterapia o sin esta
El trióxido de arsénico produce tasas altas de segunda remisión en pacientes con LPA recidivante.[10] Cuando se usa en monoterapia, es posible que el trióxido de arsénico produzca tasas de respuesta completa del 80 % al 90 % en pacientes con recaída hematológica, y del 70 % al 80 % en pacientes con remisión molecular.[11-14] La elección del tratamiento de rescate parte del tratamiento previo y el intervalo de tiempo transcurrido entre la primera remisión y la recaída.
- En pacientes con recaída temprana a menos de 6 meses de recibir ATRA y trióxido de arsénico, se debe considerar la administración de regímenes a base de antraciclinas y ATRA como se administran para la inducción a la remisión inicial en pacientes con enfermedad de riesgo alto.
- En los pacientes que recaen a menos de 6 meses después de recibir ATRA y regímenes a base de antraciclinas (sin exposición previa al trióxido de arsénico), se debe considerar el uso de regímenes a base de trióxido de arsénico.
- En todos los pacientes con recaída tardía (>6 meses), se debe considerar la administración de regímenes a base de trióxido de arsénico con antraciclinas, o sin estas, o con gemtuzumab ozogamicina.
En un ensayo aleatorizado pequeño, se indicó que para los pacientes que reciben tratamiento de rescate con trióxido de arsénico, la adición de ATRA no confiere beneficio en comparación con el trióxido de arsénico solo, en pacientes que recibieron ATRA antes.[14] En este estudio de 20 pacientes, la tasa de respuesta completa después de un ciclo de trióxido de arsénico con ATRA o sin este fue del 80 %.
Trasplante de células hematopoyéticas
Algunos pacientes que obtienen una segunda remisión gracias al trióxido de arsénico, experimentan SSE a largo plazo después de un trasplante autógeno de células madre,[15,16] de manera que este se puede considerar en pacientes con remisión molecular (resultado negativo de una prueba cuantitativa de reacción en cadena de la polimerasa [PCR] en una muestra de médula ósea). En los pacientes que no obtienen remisión o que presentan indicios de enfermedad residual medible en la PCR cuantitativa en una muestra de médula ósea después del tratamiento de rescate se puede considerar el uso de un trasplante alogénico de células hematopoyéticas.[17] En un estudio de registro, se notificó una tasa de SG a 3 años después del trasplante durante una segunda RC del 80 % en comparación con el 59 % en pacientes que no recibieron un trasplante (P = 0,03).[10]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Frankel SR, Eardley A, Lauwers G, et al.: The "retinoic acid syndrome" in acute promyelocytic leukemia. Ann Intern Med 117 (4): 292-6, 1992. [PUBMED Abstract]
- Adès L, Guerci A, Raffoux E, et al.: Very long-term outcome of acute promyelocytic leukemia after treatment with all-trans retinoic acid and chemotherapy: the European APL Group experience. Blood 115 (9): 1690-6, 2010. [PUBMED Abstract]
- Sanz MA, Montesinos P, Vellenga E, et al.: Risk-adapted treatment of acute promyelocytic leukemia with all-trans retinoic acid and anthracycline monochemotherapy: long-term outcome of the LPA 99 multicenter study by the PETHEMA Group. Blood 112 (8): 3130-4, 2008. [PUBMED Abstract]
- Lo-Coco F, Avvisati G, Vignetti M, et al.: Retinoic acid and arsenic trioxide for acute promyelocytic leukemia. N Engl J Med 369 (2): 111-21, 2013. [PUBMED Abstract]
- Burnett AK, Russell NH, Hills RK, et al.: Arsenic trioxide and all-trans retinoic acid treatment for acute promyelocytic leukaemia in all risk groups (AML17): results of a randomised, controlled, phase 3 trial. Lancet Oncol 16 (13): 1295-305, 2015. [PUBMED Abstract]
- Lo-Coco F, Avvisati G, Vignetti M, et al.: Front-line treatment of acute promyelocytic leukemia with AIDA induction followed by risk-adapted consolidation for adults younger than 61 years: results of the AIDA-2000 trial of the GIMEMA Group. Blood 116 (17): 3171-9, 2010. [PUBMED Abstract]
- Iland HJ, Bradstock K, Supple SG, et al.: All-trans-retinoic acid, idarubicin, and IV arsenic trioxide as initial therapy in acute promyelocytic leukemia (APML4). Blood 120 (8): 1570-80; quiz 1752, 2012. [PUBMED Abstract]
- Ravandi F, Estey E, Jones D, et al.: Effective treatment of acute promyelocytic leukemia with all-trans-retinoic acid, arsenic trioxide, and gemtuzumab ozogamicin. J Clin Oncol 27 (4): 504-10, 2009. [PUBMED Abstract]
- Abaza Y, Kantarjian H, Garcia-Manero G, et al.: Long-term outcome of acute promyelocytic leukemia treated with all-trans-retinoic acid, arsenic trioxide, and gemtuzumab. Blood 129 (10): 1275-1283, 2017. [PUBMED Abstract]
- Lengfelder E, Lo-Coco F, Ades L, et al.: Arsenic trioxide-based therapy of relapsed acute promyelocytic leukemia: registry results from the European LeukemiaNet. Leukemia 29 (5): 1084-91, 2015. [PUBMED Abstract]
- Leoni F, Gianfaldoni G, Annunziata M, et al.: Arsenic trioxide therapy for relapsed acute promyelocytic leukemia: a bridge to transplantation. Haematologica 87 (5): 485-9, 2002. [PUBMED Abstract]
- Soignet SL, Frankel SR, Douer D, et al.: United States multicenter study of arsenic trioxide in relapsed acute promyelocytic leukemia. J Clin Oncol 19 (18): 3852-60, 2001. [PUBMED Abstract]
- Thirugnanam R, George B, Chendamarai E, et al.: Comparison of clinical outcomes of patients with relapsed acute promyelocytic leukemia induced with arsenic trioxide and consolidated with either an autologous stem cell transplant or an arsenic trioxide-based regimen. Biol Blood Marrow Transplant 15 (11): 1479-84, 2009. [PUBMED Abstract]
- Raffoux E, Rousselot P, Poupon J, et al.: Combined treatment with arsenic trioxide and all-trans-retinoic acid in patients with relapsed acute promyelocytic leukemia. J Clin Oncol 21 (12): 2326-34, 2003. [PUBMED Abstract]
- Yanada M, Tsuzuki M, Fujita H, et al.: Phase 2 study of arsenic trioxide followed by autologous hematopoietic cell transplantation for relapsed acute promyelocytic leukemia. Blood 121 (16): 3095-102, 2013. [PUBMED Abstract]
- Holter Chakrabarty JL, Rubinger M, Le-Rademacher J, et al.: Autologous is superior to allogeneic hematopoietic cell transplantation for acute promyelocytic leukemia in second complete remission. Biol Blood Marrow Transplant 20 (7): 1021-5, 2014. [PUBMED Abstract]
- de Botton S, Fawaz A, Chevret S, et al.: Autologous and allogeneic stem-cell transplantation as salvage treatment of acute promyelocytic leukemia initially treated with all-trans-retinoic acid: a retrospective analysis of the European acute promyelocytic leukemia group. J Clin Oncol 23 (1): 120-6, 2005. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (04/23/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Información general sobre la leucemia mieloide aguda
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2025 (se citó a la American Cancer Society como referencia 1).
Se revisó el texto para indicar que según los resultados de los datos del programa Surveillance, Epidemiology, and End Results (SEER) de 2014 a 2020, el 31,9 % de los pacientes con LMA estaban vivos al cabo de 5 años del diagnóstico.
Se añadió texto para indicar que si bien las tasas de nuevos casos de LMA no han cambiado significativamente en los últimos 10 años, las tasas de mortalidad ajustadas por edad han disminuido.
Aspectos generales de las opciones de tratamiento de la leucemia mieloide aguda
Se revisó el Cuadro 2 Categorías de respuesta al tratamiento para la leucemia mieloide aguda recién diagnosticada.
Se revisó el Cuadro 3 Categorías de respuesta al tratamiento para la leucemia mieloide aguda persistente o recidivante.
Tratamiento de la leucemia mieloide aguda resistente al tratamiento o recidivante
Se añadió la subsección nueva Revumenib.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento de la leucemia mieloide aguda en adultos. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento de la leucemia mieloide aguda son:
- Alexander Ambinder, MD, MPH (Johns Hopkins University )
- Aaron Gerds, MD (Cleveland Clinic Taussig Cancer Institute)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento de la leucemia mieloide aguda. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/leucemia/pro/tratamiento-lma-adultos-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.