Tratamiento de la leucemia mieloide crónica (PDQ®)–Versión para profesionales de salud
Información general sobre la leucemia mieloide crónica
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por leucemia mieloide crónica (LMC) en los Estados Unidos en 2025:[1]
- Casos nuevos: 9560.
- Defunciones: 1290.
La LMC, también llamada leucemia mielógena, granulocítica o mielocítica crónica, forma parte de un grupo de enfermedades llamadas trastornos mieloproliferativos. Otras entidades relacionadas con la LMC son las siguientes:
- Policitemia vera.
- Mielofibrosis.
- Trombocitemia esencial.
Para obtener más información, consultar Tratamiento de las neoplasias mieloproliferativas crónicas.
Características genéticas y moleculares
La LMC se identifica por la presencia de demasiados mieloblastos en la sangre y la médula ósea, y la enfermedad empeora a medida que aumenta el número de mieloblastos.
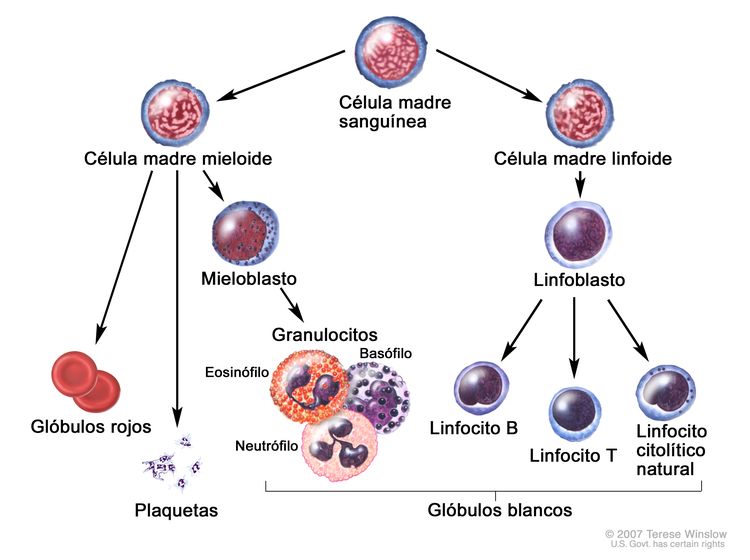
Este tipo de leucemia es un trastorno clonal de diagnóstico sencillo porque las células leucémicas de más del 95 % de los pacientes exhiben una anomalía citogenética distintiva, el cromosoma Filadelfia (Ph).[2]
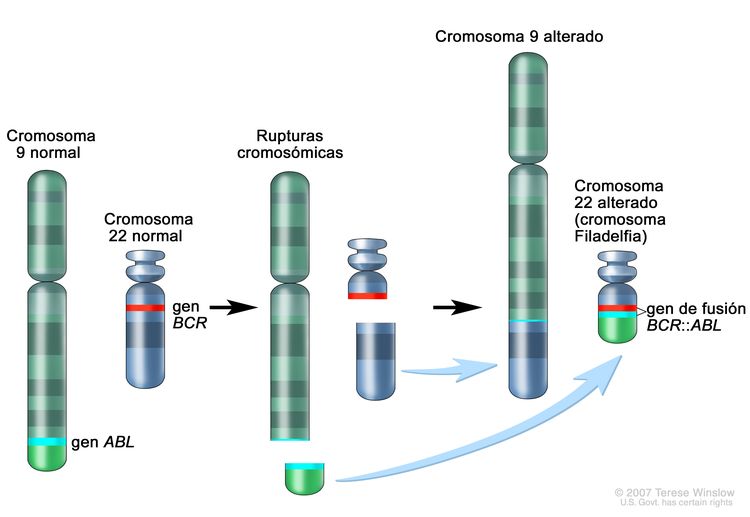
El cromosoma Filadelfia es el resultado de una translocación recíproca entre los brazos largos de los cromosomas 9 y 22, y es identificable en todos los precursores hematopoyéticos.[3] Esta translocación produce la transferencia del oncogén ABL1 en el cromosoma 9 a un área del cromosoma 22 denominada región de ruptura (dentro del gen BCR).[3] Esto, a su vez, produce un gen de fusión BCR::ABL1 a partir del que se elabora una proteína tirosina–cinasa anormal que causa la mielopoyesis desordenada propia de la LMC. La translocación 9;22 se detecta en sangre periférica mediante análisis molecular.
Cuadro clínico inicial
Aunque la LMC puede ser asintomática, la esplenomegalia es el hallazgo más frecuente durante el examen físico en el momento del diagnóstico.[4] En ocasiones, el bazo es enorme, ocupa la mayor parte del abdomen, causa dolor o sensación de saciedad y puede llegar a producir un problema clínico importante; en otras ocasiones, el bazo está solo un poco agrandado. El bazo no se puede palpar ni se observa un aumento de tamaño en la tomografía computarizada (TC) de cerca del 10 % de los pacientes.
Otros síntomas que presentan algunos pacientes son los siguientes:
- Fatiga.
- Pérdida de peso inexplicable.
- Sudores nocturnos excesivos.
- Fiebre.
La transición entre las fases crónica, acelerada y blástica a veces ocurre de manera gradual durante 1 año o más, pero otras veces es abrupta (crisis blástica). Los pacientes con LMC en fase acelerada muestran signos de progresión sin cumplir los criterios de crisis blástica (leucemia aguda). Los signos y síntomas que indican un cambio de la LMC a la fase acelerada son los siguientes:
- Esplenomegalia progresiva.
- Aumento de leucocitosis o trombocitosis.
- Anemia progresiva.
Los signos y síntomas que indican un cambio a una crisis blástica, además de los síntomas de la LMC en fase acelerada, son los siguientes:
- Trombocitopenia.
- Esplenomegalia o hepatomegalia crecientes y dolorosas.
- Fiebre.
- Dolor óseo.
- Aparición de lesiones osteolíticas.
En la fase acelerada, las células diferenciadas persisten, aunque a menudo exhiben anomalías morfológicas en aumento. El paciente presenta empeoramiento de la anemia, la trombocitopenia y la fibrosis medular.[4]
Factores de riesgo
Los factores de riesgo de la LMC son los siguientes:
- Edad avanzada.
- Exposición a dosis altas de radiación ionizante.
Evaluación diagnóstica
Además de la historia clínica y el examen físico, la evaluación diagnóstica inicial incluye los siguientes procedimientos:
- Recuento sanguíneo completo con diferencial.
- Estudios bioquímicos de la sangre.
- Aspiración de la médula ósea y biopsia. En las presentaciones clínicas típicas de la LMC, la utilidad de la aspiración de médula ósea y la biopsia para todos los pacientes con diagnóstico reciente es cuestionable fuera del contexto de un ensayo clínico. Las pruebas de médula ósea son apropiadas para pacientes con signos clínicos de fase acelerada o crisis blástica (fiebre, esplenomegalia o >20 % de blastocitos en la sangre periférica).[5]
- Análisis citogenético.
- Hibridación fluorescente in situ (FISH). La prueba de FISH para detectar la translocación BCR::ABL1 se puede realizar con aspirado de médula ósea o en una muestra de sangre periférica en pacientes con LMC.[4]
- Reacción en cadena de la polimerasa con transcripción inversa (RT-PCR). En un subgrupo pequeño de pacientes, el reordenamiento BCR::ABL1 solo es detectable mediante RT-PCR, que es la técnica más sensible disponible en la actualidad. Los pacientes que muestran en la RT-PCR el gen de fusión BCR::ABL1 presentan un cuadro clínico y pronóstico idénticos a los pacientes con un cromosoma Filadelfia clásico. Sin embargo, los pacientes que no muestran la fusión BCR::ABL1 en la RT-PCR tienen una evolución clínica más parecida a los pacientes la leucemia mielomonocítica crónica, que es una entidad clínica distinta relacionada con un síndrome mielodisplásico.[6-8]
- Tomografía computarizada (TC).
Pronóstico y supervivencia
La mediana de edad de los pacientes con LMC positiva para el cromosoma Filadelfia es de 67 años.[9] Con la llegada de los inhibidores de tirosina–cinasas (ITC) orales, se proyecta que la mediana de supervivencia se aproxime a la esperanza de vida normal para la mayoría de los pacientes.[10]
La LMC negativa para el cromosoma Filadelfia es una entidad poco definida que se distingue de manera menos clara de otros síndromes mieloproliferativos. Los pacientes con LMC negativa para el cromosoma Filadelfia por lo general tienen una respuesta más precaria al tratamiento y una supervivencia más corta que los pacientes positivos para el cromosoma Filadelfia.[11] Los pacientes negativos para el cromosoma Filadelfia, pero que tienen reordenamientos génicos BCR::ABL1 detectables mediante la técnica de Southern, presentan un pronóstico equivalente a los pacientes positivos para el cromosoma Filadelfia.[6,12]
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Jabbour E, Kantarjian H: Chronic myeloid leukemia: 2020 update on diagnosis, therapy and monitoring. Am J Hematol 95 (6): 691-709, 2020. [PUBMED Abstract]
- Deininger MW, Goldman JM, Melo JV: The molecular biology of chronic myeloid leukemia. Blood 96 (10): 3343-56, 2000. [PUBMED Abstract]
- Jabbour E, Kantarjian H: Chronic myeloid leukemia: 2012 update on diagnosis, monitoring, and management. Am J Hematol 87 (11): 1037-45, 2012. [PUBMED Abstract]
- Hidalgo-Lόpez JE, Kanagal-Shamanna R, Quesada AE, et al.: Bone marrow core biopsy in 508 consecutive patients with chronic myeloid leukemia: Assessment of potential value. Cancer 124 (19): 3849-3855, 2018. [PUBMED Abstract]
- Martiat P, Michaux JL, Rodhain J: Philadelphia-negative (Ph-) chronic myeloid leukemia (CML): comparison with Ph+ CML and chronic myelomonocytic leukemia. The Groupe Français de Cytogénétique Hématologique. Blood 78 (1): 205-11, 1991. [PUBMED Abstract]
- Oscier DG: Atypical chronic myeloid leukaemia, a distinct clinical entity related to the myelodysplastic syndrome? Br J Haematol 92 (3): 582-6, 1996. [PUBMED Abstract]
- Kurzrock R, Bueso-Ramos CE, Kantarjian H, et al.: BCR rearrangement-negative chronic myelogenous leukemia revisited. J Clin Oncol 19 (11): 2915-26, 2001. [PUBMED Abstract]
- Lee SJ, Anasetti C, Horowitz MM, et al.: Initial therapy for chronic myelogenous leukemia: playing the odds. J Clin Oncol 16 (9): 2897-903, 1998. [PUBMED Abstract]
- Bower H, Björkholm M, Dickman PW, et al.: Life Expectancy of Patients With Chronic Myeloid Leukemia Approaches the Life Expectancy of the General Population. J Clin Oncol 34 (24): 2851-7, 2016. [PUBMED Abstract]
- Onida F, Ball G, Kantarjian HM, et al.: Characteristics and outcome of patients with Philadelphia chromosome negative, bcr/abl negative chronic myelogenous leukemia. Cancer 95 (8): 1673-84, 2002. [PUBMED Abstract]
- Cortes JE, Talpaz M, Beran M, et al.: Philadelphia chromosome-negative chronic myelogenous leukemia with rearrangement of the breakpoint cluster region. Long-term follow-up results. Cancer 75 (2): 464-70, 1995. [PUBMED Abstract]
Características histopatológicas y fases de la leucemia mieloide crónica
El examen histopatológico del aspirado de médula ósea de pacientes con leucemia mieloide crónica (LMC) demuestra un cambio de la serie mieloide a formas inmaduras que aumentan en número a medida que los pacientes progresan a la fase blástica de la enfermedad. La médula es hipercelular y los recuentos diferenciales de médula ósea y sangre muestran una combinación de granulocitos maduros e inmaduros, como los que se encuentran en la médula ósea normal. A menudo aumenta el número de eosinófilos o basófilos y, a veces, se observa monocitosis. Muchas veces aumenta la cantidad de megacariocitos en la médula ósea y, a veces, hay fragmentos de núcleos megacariocíticos en la sangre, en especial cuando el recuento plaquetario es muy alto. El porcentaje de linfocitos se reduce tanto en la médula como en la sangre, en comparación con las muestras normales. La proporción mieloide:eritroide en la médula ósea suele ser muy elevada. La enzima fosfatasa alcalina leucocitaria está ausente, o se reduce de manera importante, en los neutrófilos de los pacientes con LMC.[1]
La mayoría de los pacientes no requieren examen de médula ósea. Sin embargo, se indican los análisis de la médula ósea en pacientes con fiebre, malestar general, esplenomegalia progresiva rápida y más de un 10 % de blastocitos circulantes. En los pacientes con LMC, se usan muestras de médula ósea para evaluar la celularidad, la fibrosis y las características citogenéticas. Las pruebas con reacción en cadena de la polimerasa con transcripción inversa (RT-PCR) o hibridación fluorescente in situ (FISH) en aspirados de sangre o médula ósea sirven para demostrar la presencia de la translocación 9;22.[1]
Leucemia mieloide crónica en fase crónica
La LMC en fase crónica se caracteriza por los hallazgos de la médula ósea y las características citogenéticas que se enumeran a continuación, pero con menos de un 10 % de blastocitos y promielocitos en la sangre periférica y la médula ósea.[2] Los siguientes factores predicen una fase crónica más corta después del tratamiento con inhibidores de tirosina–cinasas.
Con estas características se han formulado análisis multivariantes para usar en modelos predictivos.[5-7]
La tasa de progresión desde la fase crónica hasta la crisis blástica es de un 5 % a un 10 % en los primeros 2 años y de un 20 % en los años siguientes.[5]
Para obtener más información, consultar la sección Tratamiento de la leucemia mieloide crónica en fase crónica.
Leucemia mieloide crónica en fase acelerada
La LMC en fase acelerada se caracteriza por un 10 % a un 19 % de blastocitos en sangre periférica o médula ósea.[2]
Para obtener más información, consultar la sección Tratamiento de la leucemia mieloide crónica en fase acelerada.
Leucemia mieloide crónica en fase blástica
La LMC en fase blástica se caracteriza por un 20 % o más blastocitos en sangre periférica o médula ósea.
Cuando hay un 20 % o más de blastocitos junto con fiebre, malestar general y esplenomegalia progresiva, el paciente ha entrado en crisis blástica.[2]
Para obtener más información, consultar la sección Tratamiento de la leucemia mieloide crónica en fase blástica.
Bibliografía
- Jabbour E, Kantarjian H: Chronic myeloid leukemia: 2012 update on diagnosis, monitoring, and management. Am J Hematol 87 (11): 1037-45, 2012. [PUBMED Abstract]
- Cortes JE, Talpaz M, O'Brien S, et al.: Staging of chronic myeloid leukemia in the imatinib era: an evaluation of the World Health Organization proposal. Cancer 106 (6): 1306-15, 2006. [PUBMED Abstract]
- Lauseker M, Bachl K, Turkina A, et al.: Prognosis of patients with chronic myeloid leukemia presenting in advanced phase is defined mainly by blast count, but also by age, chromosomal aberrations and hemoglobin. Am J Hematol 94 (11): 1236-1243, 2019. [PUBMED Abstract]
- Fabarius A, Leitner A, Hochhaus A, et al.: Impact of additional cytogenetic aberrations at diagnosis on prognosis of CML: long-term observation of 1151 patients from the randomized CML Study IV. Blood 118 (26): 6760-8, 2011. [PUBMED Abstract]
- Sokal JE, Baccarani M, Russo D, et al.: Staging and prognosis in chronic myelogenous leukemia. Semin Hematol 25 (1): 49-61, 1988. [PUBMED Abstract]
- Hasford J, Pfirrmann M, Hehlmann R, et al.: A new prognostic score for survival of patients with chronic myeloid leukemia treated with interferon alfa. Writing Committee for the Collaborative CML Prognostic Factors Project Group. J Natl Cancer Inst 90 (11): 850-8, 1998. [PUBMED Abstract]
- Kvasnicka HM, Thiele J, Schmitt-Graeff A, et al.: Bone marrow features improve prognostic efficiency in multivariate risk classification of chronic-phase Ph(1+) chronic myelogenous leukemia: a multicenter trial. J Clin Oncol 19 (12): 2994-3009, 2001. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento de la leucemia mieloide crónica
El tratamiento de los pacientes con leucemia mieloide crónica (LMC) suele iniciar en el momento del diagnóstico, que se basa en la presencia de un recuento elevado de glóbulos blancos, esplenomegalia, trombocitosis e identificación de la translocación BCR::ABL1.[1]
| Fase | Opciones de tratamiento |
|---|---|
| LMC = leucemia mieloide crónica. | |
| LMC en fase crónica | Terapia dirigida con inhibidor alostérico de BCR::ABL1 en el bolsillo miristoilo de ABL1 |
| Terapia dirigida con otros inhibidores de tirosina–cinasas BCR::ABL1 | |
| Trasplante alogénico de médula ósea o células madre | |
| LMC en fase acelerada | Terapia dirigida con inhibidores de tirosina-cinasas |
| Trasplante de células madre alogénico | |
| LMC en fase blástica | Terapia dirigida con inhibidores de tirosina–cinasas |
| Trasplante alogénico de médula ósea o células madre | |
| LMC en recaída | Terapia dirigida con inhibidores de tirosina–cinasas |
Terapia dirigida con inhibidores de tirosina–cinasas
El tratamiento óptimo de primera línea para los pacientes con LMC en fase crónica incluye inhibidores específicos de la tirosina–cinasa BCR::ABL1. Aunque el mesilato de imatinib se ha estudiado ampliamente en pacientes con LMC, también se han evaluado otros inhibidores de tirosina–cinasas (ITC) de mayor potencia y selectividad para BCR::ABL1 que el imatinib.[1-4] La cirugía bariátrica impide la correcta absorción de los ITC orales, lo que produce respuestas subóptimas.[5]
Trasplante alogénico de médula ósea o células madre
El trasplante alogénico de médula ósea (TMO) o de células madre (TCM) también se han utilizado con intención curativa.[6] Se dispone de datos a largo plazo de más de 10 años de tratamiento y la mayoría de los sobrevivientes a largo plazo no muestran indicios de la translocación BCR::ABL1 en ninguna prueba disponible (por ejemplo, análisis citogenético, reacción en cadena de la polimerasa con transcripción inversa o hibridación fluorescente in situ). Sin embargo, algunos pacientes no son aptos para este abordaje debido a la edad, las condiciones comórbidas o la falta de un donante adecuado. Además, hay gran morbilidad y mortalidad derivada del TMO o TCM alogénico; se anticipa una mortalidad relacionada con el tratamiento del 5 % al 10 %, según la disponibilidad de donante emparentado y la presencia de antígenos incompatibles.[6]
Evidencia (TCM alogénico vs. tratamiento farmacológico):
- En un ensayo prospectivo de 427 pacientes aptos para trasplante que no habían recibido tratamiento, 166 pacientes se asignaron a un TCM alogénico y 261 pacientes se asignaron a tratamiento farmacológico (en su mayoría imatinib).[6][Nivel de evidencia C1]
- No se notificaron diferencias en la supervivencia general a 10 años entre los grupos de tratamiento.
Se observaron desenlaces similares en los pacientes sometidos a un TCM alogénico debido a intolerancia o incumplimiento con el ITC.[7]
Interferón α
También se dispone de datos a largo plazo para los pacientes tratados con interferón α.[8-10] Alrededor del 10 % al 20 % de estos pacientes presentan una respuesta citogenética completa sin indicios de la translocación BCR::ABL1 en las pruebas disponibles, y la mayoría de ellos están libres de enfermedad después de 10 años. Sin embargo, se requiere terapia de mantenimiento con interferón y algunos pacientes experimentan efectos secundarios que impiden continuar el tratamiento.
Hidroxiurea
La hidroxiurea es superior al busulfano en la fase crónica de la LMC, con una mediana de supervivencia significativamente más larga y menos efectos adversos graves.[11] A menudo se usa una dosis de 40 mg/kg por día al principio y, con frecuencia, se reduce rápidamente el recuento de glóbulos blancos (GB). Cuando el recuento de GB cae por debajo de 20 × 109/l, se suele reducir y ajustar la dosis de la hidroxiurea para mantener un recuento de GB entre 5 × 109/l y 20 × 109 /l.
La hidroxiurea se usa de manera primaria para estabilizar a los pacientes con hiperleucocitosis o como terapia paliativa cuando no hay respuesta a otras terapias.
Bibliografía
- Cortes J, Pavlovsky C, Saußele S: Chronic myeloid leukaemia. Lancet 398 (10314): 1914-1926, 2021. [PUBMED Abstract]
- Jabbour E, Kantarjian H: Chronic myeloid leukemia: 2020 update on diagnosis, therapy and monitoring. Am J Hematol 95 (6): 691-709, 2020. [PUBMED Abstract]
- Brümmendorf TH, Cortes JE, Milojkovic D, et al.: Bosutinib versus imatinib for newly diagnosed chronic phase chronic myeloid leukemia: final results from the BFORE trial. Leukemia 36 (7): 1825-1833, 2022. [PUBMED Abstract]
- Hochhaus A, Wang J, Kim DW, et al.: Asciminib in Newly Diagnosed Chronic Myeloid Leukemia. N Engl J Med 391 (10): 885-898, 2024. [PUBMED Abstract]
- Haddad FG, Kantarjian HM, Bidikian A, et al.: Association between bariatric surgery and outcomes in chronic myeloid leukemia. Cancer 129 (12): 1866-1872, 2023. [PUBMED Abstract]
- Gratwohl A, Pfirrmann M, Zander A, et al.: Long-term outcome of patients with newly diagnosed chronic myeloid leukemia: a randomized comparison of stem cell transplantation with drug treatment. Leukemia 30 (3): 562-9, 2016. [PUBMED Abstract]
- Wu J, Chen Y, Hageman L, et al.: Late mortality after bone marrow transplant for chronic myelogenous leukemia in the context of prior tyrosine kinase inhibitor exposure: A Blood or Marrow Transplant Survivor Study (BMTSS) report. Cancer 125 (22): 4033-4042, 2019. [PUBMED Abstract]
- Ozer H, George SL, Schiffer CA, et al.: Prolonged subcutaneous administration of recombinant alpha 2b interferon in patients with previously untreated Philadelphia chromosome-positive chronic-phase chronic myelogenous leukemia: effect on remission duration and survival: Cancer and Leukemia Group B study 8583. Blood 82 (10): 2975-84, 1993. [PUBMED Abstract]
- Kantarjian HM, Smith TL, O'Brien S, et al.: Prolonged survival in chronic myelogenous leukemia after cytogenetic response to interferon-alpha therapy. The Leukemia Service. Ann Intern Med 122 (4): 254-61, 1995. [PUBMED Abstract]
- Long-term follow-up of the Italian trial of interferon-alpha versus conventional chemotherapy in chronic myeloid leukemia. The Italian Cooperative Study Group on Chronic Myeloid Leukemia. Blood 92 (5): 1541-8, 1998. [PUBMED Abstract]
- Hehlmann R, Heimpel H, Hasford J, et al.: Randomized comparison of busulfan and hydroxyurea in chronic myelogenous leukemia: prolongation of survival by hydroxyurea. The German CML Study Group. Blood 82 (2): 398-407, 1993. [PUBMED Abstract]
Tratamiento de la leucemia mieloide crónica en fase crónica
Opciones de tratamiento de la leucemia mieloide crónica en fase crónica
Las opciones de tratamiento de la leucemia mieloide crónica (LMC) en fase crónica son las siguientes:
- Terapia dirigida con un inhibidor alostérico de BCR::ABL1 en el bolsillo miristoilo de ABL1 (asciminib).
- Terapia dirigida con otros inhibidores de tirosina–cinasas BCR::ABL1 (nilotinib, dasatinib, bosutinib o imatinib).
- Trasplante alogénico de médula ósea o células madre.
El tratamiento inicial preferido para los pacientes con LMC en fase crónica recién diagnosticada podría ser cualquiera de los inhibidores específicos de la tirosina–cinasa BCR::ABL1 (como asciminib, nilotinib, dasatinib, bosutinib o imatinib).[1] Con cualquiera de estos fármacos, las tasas a 10 años de supervivencia sin complicaciones y de supervivencia general (SG) superan el 90 %.[2-4]
Las siglas para las tasas de respuesta de la LMC utilizadas en esta sección son las siguientes:
- RMP: respuesta molecular profunda o pronunciada (antes llamada RMC [respuesta molecular completa]). Esto significa una reducción mayor de 4 en escala logarítmica (BCR::ABL1 ≤ 0,01 %); también se llama RM 4 (respuesta molecular 4). La RM 4,5 se usa para BCR::ABL1 ≤ 0,0032 % y RM 5 para BCR::ABL1 ≤ 0,001 %.
- RMT: respuesta molecular temprana. Esto significa una reducción mayor de 1 en escala logarítmica (BCR::ABL1 ≤ 10 %) a los 3 meses.
- RMM: respuesta molecular mayor. Esto significa una reducción mayor de 3 en escala logarítmica (BCR::ABL1 ≤ 0,1 %).
Una concentración de transcritos BCR::ABL1 del 10 % o inferior en pacientes después de 3 meses de tratamiento con un ITC específico (se considera RMT) se relaciona con mejor pronóstico en términos de supervivencia sin fracaso, supervivencia sin progresión (SSP) y SG.[5-10] Sin embargo, en un análisis retrospectivo, incluso los pacientes con una concentración de transcritos BCR::ABL1 superior al 10 % después de 3 meses de tratamiento tuvieron buenos resultados cuando el tiempo de reducción a la mitad fue inferior a 76 días.[11]
Es problemático exigir un cambio de terapia basado en esta concentración de transcritos del 10 % a los 3 a 6 meses porque el 75 % de los pacientes evolucionan bien, incluso con una respuesta subóptima.[12] Después de 1 año, el objetivo de respuesta ideal es obtener una RMM, que se define como una concentración de BCR::ABL1 inferior o igual al 0,1 %. El objetivo ideal es una RMP, que se define por reducción de 4 en escala logarítmica (BCR::ABL1 ≤ 0,01 %) o que la concentración se torne indetectable, lo que suele suceder cuando la concentración de BCR::ABL1 es menor o igual a 0,001 % (RM 5).[13]
Terapia dirigida con un inhibidor alostérico de BCR::ABL1 en el bolsillo miristoilo de ABL1
Evidencia (terapia dirigida con un inhibidor alostérico de BCR::ABL1 en el bolsillo miristoilo de ABL1):
- En un estudio prospectivo (NCT04971226) se incluyó a 405 pacientes con LMC recién diagnosticada. Los pacientes se asignaron al azar a recibir asciminib (n = 201) (inhibidor alostérico de BCR::ABL1 en el bolsillo miristoilo de ABL1, un sitio distinto del que usan otros ITC), mesilato de imatinib (n = 102) o nilotinib, dasatinib o bosutinib (n = 102).[14]
- Al cabo de una mediana de seguimiento de 16,3 meses, la tasa de RMP a las 48 semanas fue del 67,7 % para los pacientes que recibieron asciminib y del 49 % para los que recibieron imatinib, nilotinib, dasatinib o bosutinib (P < 0,002).[14][Nivel de evidencia B3]
- Los pacientes que recibieron asciminib tuvieron menos eventos adversos de grado 3 o superior (38 %), en comparación con el imatinib (44 %) y otros ITC (55 %). La tasa de interrupción debida a eventos adversos fue inferior en los pacientes que recibieron asciminib (5 %), en comparación con los pacientes que recibieron imatinib (11 %) u otros ITC (10 %).
- El asciminib mostró una mayor eficacia en este informe inicial del ensayo, así como una mejor tolerabilidad con base en los eventos adversos y las interrupciones. A partir de esto, la Administración de Alimentos y Medicamentos de EE. UU. aprobó el uso de asciminib como terapia de primera línea. El uso de asciminib acarrea un riesgo significativo de toxicidad financiera ($260 000 al año en 2024) versus imatinib ($500 al año en 2024). El precio de los demás ITC podría reducirse porque el dasatinib se comercializa como fármaco genérico, y se anticipa que el nilotinib, el bosutinib y el ponatinib se puedan conseguir como genéricos en 2027.
- En un análisis de subgrupos preespecificado se comparó el asciminib con ITC de segunda generación (sin inclusión de imatinib). En la semana 48, el 66,0 % de los pacientes que recibieron asciminib tenía una RMM y el 57,8 % de los pacientes que recibieron un ITC de segunda generación tenía una RMM. La diferencia del 8,2 % no fue estadísticamente significativa (intervalo de confianza [IC] 95 %, -5,1 a 21,5). En el primer año, la eficacia de asciminib es equivalente a los ITC de segunda generación. Se necesita un seguimiento más prolongado para evaluar bien los desenlaces de eficacia y toxicidad.[14]
Terapia dirigida con otros inhibidores de tirosina–cinasas BCR::ABL1
Evidencia (terapia dirigida con otros ITC BCR::ABL1):
- En un estudio prospectivo aleatorizado de 846 pacientes, se comparó el nilotinib con el imatinib.[15][Nivel de evidencia B3]
- La tasa de RMM a los 24 meses osciló entre un 71 % y un 67 % para los pacientes que recibieron programas de 2 dosis de nilotinib y de un 44 % para los pacientes que recibieron imatinib (P < 0,0001 para ambas comparaciones).
- La progresión a LMC en fase acelerada o crisis blástica se presentó en 17 pacientes que recibieron imatinib (14 %), pero solo en 2 pacientes que recibieron 300 mg de nilotinib 2 veces al día (<1 %, P = 0,0003) y en 5 pacientes que recibieron 400 mg de nilotinib 2 veces al día (1,8 %, P = 0,0089).
- En un estudio prospectivo aleatorizado de 519 pacientes, se comparó el dasatinib con el imatinib. Se notificaron los siguientes resultados:[16][Nivel de evidencia B3]
- La tasa de RMM a los 12 meses fue del 46 % para los pacientes que recibieron dasatinib y del 28 % para los pacientes que recibieron imatinib (P < 0,0001).
- La tasa de RMM a los 24 meses fue del 64 % para los pacientes que recibieron dasatinib y del 46 % para los pacientes que recibieron imatinib (P < 0,0001).
- A los 5 años, no hubo ninguna diferencia en la SSP ni en la SG.
- La progresión a LMC en fase acelerada o crisis blástica se presentó en 13 pacientes (5 %) que recibieron imatinib y en 6 pacientes (2,3 %) que recibieron dasatinib (sin significación estadística).
- En análisis comparativos retrospectivos, una dosis de dasatinib de 50 mg por día demostró la misma eficacia que la de 100 mg, pero produjo menos derrames pleurales (5 vs. 21 %).[17][Nivel de evidencia C3]
- En un estudio prospectivo aleatorizado de 536 pacientes, se comparó el bosutinib con el imatinib.[18][Nivel de evidencia B3]
- La tasa de RMM a 5 años fue del 73,9 % para los pacientes del grupo de bosutinib versus el 64,6 % para los pacientes del grupo de imatinib (cociente de riesgos instantáneos [CRI], 1,57; IC 95 %, 1,08–2,28; P = 0,0075). A los 5 años, el 47,4 % de los pacientes del grupo de bosutinib y el 36,6 % de los pacientes del grupo de imatinib obtuvieron una RMP (4,5 en escala logarítmica) (CRI, 1,57; IC 95 %, 1,11–2,22).[18]
- La progresión a LMC en fase acelerada o crisis blástica se presentó en 4 pacientes (1,6 %) que recibieron bosutinib y en 6 pacientes (2,5 %) que recibieron imatinib.
En ensayos prospectivos aleatorizados, el nilotinib, el dasatinib y el bosutinib mostraron tasas más altas de RMM más tempranas, en comparación con el imatinib. No está claro si esto se traducirá en mejores resultados a largo plazo.[8,9,18][Nivel de evidencia B3] En un estudio de fase II con varias dosis de dasatinib en pacientes mayores de 70 años, se observó una respuesta óptima y una reducción de la toxicidad a partir de 20 mg una vez al día, con aumento de la dosis de ser necesario, en comparación con la dosis estándar de 100 mg al día.[19][Nivel de evidencia C3]
¿Se pueden discontinuar los inhibidores de tirosina–cinasas?
No está claro si se puede interrumpir el tratamiento con ITC en los pacientes que obtienen una RMP. Varios informes no aleatorizados se resumen de la siguiente manera:[20-24][Nivel de evidencia C3]
- Los pacientes que reciben un ITC durante más de 3 a 5 años y logran una RMP (remisión molecular, 4,5; BCR::ABL1 ≤ 0,0032 %) son los mejores candidatos para considerar la interrupción del tratamiento.
- El 50 % de los pacientes tendrán una recaída de la enfermedad si suspenden el tratamiento con ITC. No obstante, en un análisis retrospectivo, con una mediana de seguimiento de 3 años, se encontró que los pacientes que habían logrado una RMP (4 a 4,5 en escala logarítmica) durante 5 o más años tuvieron una tasa de recaída cercana al 10 %.[25][Nivel de evidencia C3] En otro informe retrospectivo con una mediana de seguimiento de 3 años se encontraron 3 factores medibles predictivos del mantenimiento de la RMM: mayor duración del tratamiento con ITC, mayor duración de la RMP en el tratamiento con ITC y ausencia de células blásticas en sangre periférica en el momento del diagnóstico.[20]
- Casi todos los pacientes que recaen, de acuerdo con los criterios de la prueba de reacción en cadena de la polimerasa con retrotranscripción (RT-PCR) cuantitativa para BCR::ABL1, pueden reiniciar de manera exitosa el tratamiento con el ITC que recibieron antes.
No obstante, se desconoce la duración de la remisión y la profundidad de la respuesta después de la reinducción de un ITC previo. Los datos para recomendar la interrupción universal de los ITC son insuficientes, incluso en los pacientes con una RMP o RMC. Es necesario realizar un seguimiento (es decir, al menos cada 3 meses inicialmente, aunque el intervalo preciso no está bien definido) después de suspender el tratamiento porque se han observado recaídas incluso después de 2 a 3 años. Se notificó síndrome de abstinencia con mialgias y artralgias después de suspender el tratamiento con ITC.[26] Las evaluaciones de la calidad de vida indican que hay mejoras en el funcionamiento social, la diarrea y la fatiga después de suspender el tratamiento con ITC.[27][Nivel de evidencia C1]
Trasplante alogénico de médula ósea o células madre
El único tratamiento curativo de manera uniforme para los pacientes con LMC ha sido el trasplante alogénico de médula ósea (TMO) o células madre (TCM).[28-30] Los pacientes menores de 60 años con un gemelo idéntico, o con donantes fraternos compatibles según HLA, se pueden considerar para recibir un TMO temprano en la fase crónica de la enfermedad. Aunque el procedimiento se relaciona con morbilidad y mortalidad agudas considerables, de un 50 % a un 70 % de los pacientes que reciben el trasplante en la fase crónica de la enfermedad se curan. Los resultados son mejores en los pacientes más jóvenes, en especial en los menores de 20 años. Los desenlaces de los pacientes que se someten a un trasplante en las fases acelerada y blástica de la enfermedad son progresivamente peores.[31,32] La mayoría de las series de pacientes receptores de trasplantes indican una mejora de la supervivencia cuando el procedimiento se realiza en el transcurso de 1 año después del diagnóstico.[33-35][Nivel de evidencia C1] Sin embargo, los datos que respaldan el trasplante temprano no se han confirmado en ensayos controlados.
Evidencia (TCM alogénico):
- En un ensayo clínico aleatorizado, los pacientes se sometieron a un TCM alogénico después de prepararse con ciclofosfamida e irradiación corporal total (ICT) o busulfano y ciclofosfamida sin ICT. Se notificaron los siguientes resultados:[36][Nivel de evidencia A1]
- La supervivencia sin enfermedad y la SG fueron comparables entre los grupos.
- El busulfano y la ciclofosfamida sin ICT se relacionaron con reducciones en los casos de enfermedad de injerto contra huésped (EICH), los episodios de fiebre y las hospitalizaciones y días en los que se acudía al hospital.
- En una revisión retrospectiva de 2444 pacientes, que se sometieron a TCM alogénico mielosupresor, se notificaron los siguientes resultados:[37]
- Las tasas de SG a 15 años fueron del 88 % (IC 95 %, 86–90 %) para los receptores de trasplantes de donantes fraternos compatibles y del 87 % (IC 95 %, 83–90 %) para los receptores de trasplantes de donantes no emparentados.
- Las incidencias acumuladas de recaída fueron del 8 % (IC 95 %, 7–10 %) para los receptores de trasplante de donantes fraternos y del 2 % (IC 95 %, 1– 4 %) para los receptores de trasplante de donantes no emparentados.
- En un ensayo prospectivo de 354 pacientes menores de 60 años, 123 de 135 pacientes con donante emparentado compatible recibieron un TCM alogénico temprano, mientras que los otros recibieron terapia con interferón e imatinib en el momento de la recaída. Algunos pacientes también recibieron un TCM de donante no emparentado compatible en el momento de la remisión.[38][Nivel de evidencia B4]
- Al cabo de una mediana de seguimiento de 9 años, la supervivencia continuaba favoreciendo el grupo de tratamiento farmacológico (P = 0,049), pero la mayor parte del beneficio fue temprano para la mortalidad relacionada con el trasplante, con curvas de supervivencia convergentes a los 8 años.
Aunque la mayoría de las recaídas se presentan en el transcurso de los 5 años del trasplante, hay casos donde se han presentado hasta 15 años después del TMO.[39] En un análisis molecular de 243 pacientes sometidos a TMO alogénico durante un intervalo de 20 años, solo el 15 % tenían resultados de transcritos de BCR::ABL1 indetectables mediante análisis de PCR.[40] El riesgo de recaída es menor en los pacientes que recibieron un trasplante temprano y en los pacientes que presentaron EICH crónica.[32,41] En una revisión retrospectiva, los pacientes con enfermedad en recaída después de un trasplante alogénico que recibieron ITC tuvieron una tasa de SG a 3 años del 60 %.[42][Nivel de evidencia C1]
Con la introducción de la terapia con asciminib, imatinib, dasatinib, bosutinib y nilotinib, se ha cuestionado el momento oportuno y la secuencia de los trasplantes de médula ósea (TMO) o de células madre (TCM) alogénicos.[43] El TCM alogénico es la opción preferida para los pacientes que presentan enfermedad en fase blástica, los que tienen una variante del gen T315I resistente al ponatinib (un ITC oral) y aquellos pacientes con intolerancia completa a las opciones farmacológicas.[44] Se observaron desenlaces similares en los pacientes sometidos a un TCM alogénico debido a intolerancia o incumplimiento del ITC.[45]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Wei G, Rafiyath S, Liu D: First-line treatment for chronic myeloid leukemia: dasatinib, nilotinib, or imatinib. J Hematol Oncol 3: 47, 2010. [PUBMED Abstract]
- Hochhaus A, Larson RA, Guilhot F, et al.: Long-Term Outcomes of Imatinib Treatment for Chronic Myeloid Leukemia. N Engl J Med 376 (10): 917-927, 2017. [PUBMED Abstract]
- Masarova L, Cortes JE, Patel KP, et al.: Long-term results of a phase 2 trial of nilotinib 400 mg twice daily in newly diagnosed patients with chronic-phase chronic myeloid leukemia. Cancer 126 (7): 1448-1459, 2020. [PUBMED Abstract]
- Maiti A, Cortes JE, Patel KP, et al.: Long-term results of frontline dasatinib in chronic myeloid leukemia. Cancer 126 (7): 1502-1511, 2020. [PUBMED Abstract]
- Marin D, Ibrahim AR, Lucas C, et al.: Assessment of BCR-ABL1 transcript levels at 3 months is the only requirement for predicting outcome for patients with chronic myeloid leukemia treated with tyrosine kinase inhibitors. J Clin Oncol 30 (3): 232-8, 2012. [PUBMED Abstract]
- Branford S, Kim DW, Soverini S, et al.: Initial molecular response at 3 months may predict both response and event-free survival at 24 months in imatinib-resistant or -intolerant patients with Philadelphia chromosome-positive chronic myeloid leukemia in chronic phase treated with nilotinib. J Clin Oncol 30 (35): 4323-9, 2012. [PUBMED Abstract]
- Marin D, Hedgley C, Clark RE, et al.: Predictive value of early molecular response in patients with chronic myeloid leukemia treated with first-line dasatinib. Blood 120 (2): 291-4, 2012. [PUBMED Abstract]
- Jabbour E, Kantarjian HM, Saglio G, et al.: Early response with dasatinib or imatinib in chronic myeloid leukemia: 3-year follow-up from a randomized phase 3 trial (DASISION). Blood 123 (4): 494-500, 2014. [PUBMED Abstract]
- Hughes TP, Saglio G, Kantarjian HM, et al.: Early molecular response predicts outcomes in patients with chronic myeloid leukemia in chronic phase treated with frontline nilotinib or imatinib. Blood 123 (9): 1353-60, 2014. [PUBMED Abstract]
- Neelakantan P, Gerrard G, Lucas C, et al.: Combining BCR-ABL1 transcript levels at 3 and 6 months in chronic myeloid leukemia: implications for early intervention strategies. Blood 121 (14): 2739-42, 2013. [PUBMED Abstract]
- Branford S, Yeung DT, Parker WT, et al.: Prognosis for patients with CML and >10% BCR-ABL1 after 3 months of imatinib depends on the rate of BCR-ABL1 decline. Blood 124 (4): 511-8, 2014. [PUBMED Abstract]
- Baccarani M, Deininger MW, Rosti G, et al.: European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood 122 (6): 872-84, 2013. [PUBMED Abstract]
- Shanmuganathan N, Hughes TP: Molecular monitoring in CML: how deep? How often? How should it influence therapy? Blood 132 (20): 2125-2133, 2018. [PUBMED Abstract]
- Hochhaus A, Wang J, Kim DW, et al.: Asciminib in Newly Diagnosed Chronic Myeloid Leukemia. N Engl J Med 391 (10): 885-898, 2024. [PUBMED Abstract]
- Kantarjian HM, Hochhaus A, Saglio G, et al.: Nilotinib versus imatinib for the treatment of patients with newly diagnosed chronic phase, Philadelphia chromosome-positive, chronic myeloid leukaemia: 24-month minimum follow-up of the phase 3 randomised ENESTnd trial. Lancet Oncol 12 (9): 841-51, 2011. [PUBMED Abstract]
- Cortes JE, Saglio G, Kantarjian HM, et al.: Final 5-Year Study Results of DASISION: The Dasatinib Versus Imatinib Study in Treatment-Naïve Chronic Myeloid Leukemia Patients Trial. J Clin Oncol 34 (20): 2333-40, 2016. [PUBMED Abstract]
- Jabbour E, Sasaki K, Haddad FG, et al.: Low-dose dasatinib 50 mg/day versus standard-dose dasatinib 100 mg/day as frontline therapy in chronic myeloid leukemia in chronic phase: A propensity score analysis. Am J Hematol 97 (11): 1413-1418, 2022. [PUBMED Abstract]
- Brümmendorf TH, Cortes JE, Milojkovic D, et al.: Bosutinib versus imatinib for newly diagnosed chronic phase chronic myeloid leukemia: final results from the BFORE trial. Leukemia 36 (7): 1825-1833, 2022. [PUBMED Abstract]
- Murai K, Ureshino H, Kumagai T, et al.: Low-dose dasatinib in older patients with chronic myeloid leukaemia in chronic phase (DAVLEC): a single-arm, multicentre, phase 2 trial. Lancet Haematol 8 (12): e902-e911, 2021. [PUBMED Abstract]
- Mahon FX, Pfirrmann M, Dulucq S, et al.: European Stop Tyrosine Kinase Inhibitor Trial (EURO-SKI) in Chronic Myeloid Leukemia: Final Analysis and Novel Prognostic Factors for Treatment-Free Remission. J Clin Oncol 42 (16): 1875-1880, 2024. [PUBMED Abstract]
- Mahon FX, Boquimpani C, Kim DW, et al.: Treatment-Free Remission After Second-Line Nilotinib Treatment in Patients With Chronic Myeloid Leukemia in Chronic Phase: Results From a Single-Group, Phase 2, Open-Label Study. Ann Intern Med 168 (7): 461-470, 2018. [PUBMED Abstract]
- Legros L, Nicolini FE, Etienne G, et al.: Second tyrosine kinase inhibitor discontinuation attempt in patients with chronic myeloid leukemia. Cancer 123 (22): 4403-4410, 2017. [PUBMED Abstract]
- Chamoun K, Kantarjian H, Atallah R, et al.: Tyrosine kinase inhibitor discontinuation in patients with chronic myeloid leukemia: a single-institution experience. J Hematol Oncol 12 (1): 1, 2019. [PUBMED Abstract]
- Atallah E, Schiffer CA, Radich JP, et al.: Assessment of Outcomes After Stopping Tyrosine Kinase Inhibitors Among Patients With Chronic Myeloid Leukemia: A Nonrandomized Clinical Trial. JAMA Oncol 7 (1): 42-50, 2021. [PUBMED Abstract]
- Haddad FG, Sasaki K, Issa GC, et al.: Treatment-free remission in patients with chronic myeloid leukemia following the discontinuation of tyrosine kinase inhibitors. Am J Hematol 97 (7): 856-864, 2022. [PUBMED Abstract]
- Richter J, Söderlund S, Lübking A, et al.: Musculoskeletal pain in patients with chronic myeloid leukemia after discontinuation of imatinib: a tyrosine kinase inhibitor withdrawal syndrome? J Clin Oncol 32 (25): 2821-3, 2014. [PUBMED Abstract]
- Schoenbeck KL, Atallah E, Lin L, et al.: Patient-Reported Functional Outcomes in Patients With Chronic Myeloid Leukemia After Stopping Tyrosine Kinase Inhibitors. J Natl Cancer Inst 114 (1): 160-164, 2022. [PUBMED Abstract]
- Gratwohl A, Hermans J: Allogeneic bone marrow transplantation for chronic myeloid leukemia. Working Party Chronic Leukemia of the European Group for Blood and Marrow Transplantation (EBMT). Bone Marrow Transplant 17 (Suppl 3): S7-9, 1996. [PUBMED Abstract]
- Crawley C, Szydlo R, Lalancette M, et al.: Outcomes of reduced-intensity transplantation for chronic myeloid leukemia: an analysis of prognostic factors from the Chronic Leukemia Working Party of the EBMT. Blood 106 (9): 2969-76, 2005. [PUBMED Abstract]
- Bacher U, Klyuchnikov E, Zabelina T, et al.: The changing scene of allogeneic stem cell transplantation for chronic myeloid leukemia--a report from the German Registry covering the period from 1998 to 2004. Ann Hematol 88 (12): 1237-47, 2009. [PUBMED Abstract]
- Wagner JE, Zahurak M, Piantadosi S, et al.: Bone marrow transplantation of chronic myelogenous leukemia in chronic phase: evaluation of risks and benefits. J Clin Oncol 10 (5): 779-89, 1992. [PUBMED Abstract]
- Enright H, Davies SM, DeFor T, et al.: Relapse after non-T-cell-depleted allogeneic bone marrow transplantation for chronic myelogenous leukemia: early transplantation, use of an unrelated donor, and chronic graft-versus-host disease are protective. Blood 88 (2): 714-20, 1996. [PUBMED Abstract]
- Goldman JM, Szydlo R, Horowitz MM, et al.: Choice of pretransplant treatment and timing of transplants for chronic myelogenous leukemia in chronic phase. Blood 82 (7): 2235-8, 1993. [PUBMED Abstract]
- Clift RA, Appelbaum FR, Thomas ED: Treatment of chronic myeloid leukemia by marrow transplantation. Blood 82 (7): 1954-6, 1993. [PUBMED Abstract]
- Hansen JA, Gooley TA, Martin PJ, et al.: Bone marrow transplants from unrelated donors for patients with chronic myeloid leukemia. N Engl J Med 338 (14): 962-8, 1998. [PUBMED Abstract]
- Clift RA, Buckner CD, Thomas ED, et al.: Marrow transplantation for chronic myeloid leukemia: a randomized study comparing cyclophosphamide and total body irradiation with busulfan and cyclophosphamide. Blood 84 (6): 2036-43, 1994. [PUBMED Abstract]
- Goldman JM, Majhail NS, Klein JP, et al.: Relapse and late mortality in 5-year survivors of myeloablative allogeneic hematopoietic cell transplantation for chronic myeloid leukemia in first chronic phase. J Clin Oncol 28 (11): 1888-95, 2010. [PUBMED Abstract]
- Hehlmann R, Berger U, Pfirrmann M, et al.: Drug treatment is superior to allografting as first-line therapy in chronic myeloid leukemia. Blood 109 (11): 4686-92, 2007. [PUBMED Abstract]
- Maziarz R: Transplantation for CML: lifelong PCR monitoring? Blood 107 (10): 3820, 2006.
- Kaeda J, O'Shea D, Szydlo RM, et al.: Serial measurement of BCR-ABL transcripts in the peripheral blood after allogeneic stem cell transplantation for chronic myeloid leukemia: an attempt to define patients who may not require further therapy. Blood 107 (10): 4171-6, 2006. [PUBMED Abstract]
- Pichert G, Roy DC, Gonin R, et al.: Distinct patterns of minimal residual disease associated with graft-versus-host disease after allogeneic bone marrow transplantation for chronic myelogenous leukemia. J Clin Oncol 13 (7): 1704-13, 1995. [PUBMED Abstract]
- Shimazu Y, Murata M, Kondo T, et al.: The new generation tyrosine kinase inhibitor improves the survival of chronic myeloid leukemia patients after allogeneic stem cell transplantation. Hematol Oncol 40 (3): 442-456, 2022. [PUBMED Abstract]
- Saussele S, Lauseker M, Gratwohl A, et al.: Allogeneic hematopoietic stem cell transplantation (allo SCT) for chronic myeloid leukemia in the imatinib era: evaluation of its impact within a subgroup of the randomized German CML Study IV. Blood 115 (10): 1880-5, 2010. [PUBMED Abstract]
- O'Brien S, Berman E, Moore JO, et al.: NCCN Task Force report: tyrosine kinase inhibitor therapy selection in the management of patients with chronic myelogenous leukemia. J Natl Compr Canc Netw 9 (Suppl 2): S1-25, 2011. [PUBMED Abstract]
- Wu J, Chen Y, Hageman L, et al.: Late mortality after bone marrow transplant for chronic myelogenous leukemia in the context of prior tyrosine kinase inhibitor exposure: A Blood or Marrow Transplant Survivor Study (BMTSS) report. Cancer 125 (22): 4033-4042, 2019. [PUBMED Abstract]
Tratamiento de la leucemia mieloide crónica en fase acelerada
Opciones de tratamiento de la leucemia mieloide crónica en fase acelerada
Las opciones de tratamiento de la leucemia mieloide crónica (LMC) en fase acelerada son las siguientes:
Terapia dirigida con inhibidores de tirosina–cinasas
Bosutinib
La Administración de Alimentos y Medicamentos de los Estados Unidos aprobó el bosutinib como tratamiento de primera línea para los pacientes con LMC en fase acelerada. Estos pacientes se incluyeron en el ensayo inicial de fase I/II en el que se observó una mejora de la eficacia, en comparación con el imatinib, en función de las tasas de respuesta y la respuesta molecular mayor a los 5 años de seguimiento.[1][Nivel de evidencia C3]
Trasplante de células madre alogénico
La inducción de la remisión con un ITC y la consideración de un TCM alogénico para los pacientes con respuestas precarias, cuando es posible, es un abordaje estándar para los pacientes con LMC en fase acelerada.[2]
Evidencia (imatinib vs. TCM alogénico):
- En un estudio de cohortes de 132 pacientes con LMC en fase acelerada, se comparó el imatinib con un TCM alogénico como tratamiento de primera línea, con una mediana de seguimiento de 32 meses.[2][Nivel de evidencia C1]
- La tasa de supervivencia general mejoró con el TCM alogénico para los pacientes de riesgo alto según el índice de Sokal (100 vs. 17,7 %; P = 0,008).
- En los pacientes de riesgo bajo e intermedio según el índice de Sokal, no hubo diferencias de supervivencia entre los dos abordajes de primera línea.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Gambacorti-Passerini C, Cortes JE, Lipton JH, et al.: Safety and efficacy of second-line bosutinib for chronic phase chronic myeloid leukemia over a five-year period: final results of a phase I/II study. Haematologica 103 (8): 1298-1307, 2018. [PUBMED Abstract]
- Jiang Q, Xu LP, Liu DH, et al.: Imatinib mesylate versus allogeneic hematopoietic stem cell transplantation for patients with chronic myelogenous leukemia in the accelerated phase. Blood 117 (11): 3032-40, 2011. [PUBMED Abstract]
Tratamiento de la leucemia mieloide crónica en fase blástica
Opciones de tratamiento de la leucemia mieloide crónica en fase blástica
Las opciones de tratamiento de la leucemia mieloide crónica (LMC) en fase blástica son las siguientes:
Terapia dirigida con inhibidores de tirosina–cinasas
El bosutinib, el mesilato de imatinib, el dasatinib y el nilotinib demostraron actividad en pacientes con crisis blástica mieloide y crisis blástica linfoide o leucemia linfoblástica aguda (LLA) positiva para el cromosoma Filadelfia (Ph).[1-3]
Evidencia (terapia dirigida con ITC):
- En 2 ensayos de mesilato de imatinib y en 1 ensayo de dasatinib participaron 518 pacientes con LMC en fase blástica.[2,4,5][Nivel de evidencia C1]
- En los estudios se confirmó una tasa de respuesta hematológica de un 42 % a un 55 % y una tasa de respuesta citogenética importante, de un 16 % a un 25 %, pero la tasa de supervivencia estimada a 2 años fue inferior al 28 %.
- A los pacientes con LMC en fase blástica linfoide (al contrario de aquellos en fase blástica mieloide que es más común) se les administró la misma terapia que a los pacientes con LLA positiva para el cromosoma Ph. En un ensayo de fase II, 23 pacientes con LMC en fase blástica linfoide recibieron hiper-CVAD (ciclofosfamida, vincristina, doxorrubicina y dexametasona hiperfraccionadas) y dasatinib. La tasa de respuesta molecular mayor fue del 70 %, y la mayoría de los pacientes se remitieron a TCM alogénico.[6][Nivel de evidencia C3]
- En una revisión de 477 pacientes con LMC en fase blástica tratados entre 1997 y 2016 en un solo centro, se observó que el 72 % habían recibido tratamiento previo con ITC durante la fase crónica antes de la transformación.[7][Nivel de evidencia C3]
- La mediana de supervivencia general sin progresión fue de 12 meses.
- La mediana de supervivencia sin fracaso fue de 5 meses.
- Los pacientes que se sometieron a un TCM alogénico evolucionaron mejor, pero este resultado quizás se deba a un sesgo de selección.
Trasplante alogénico de médula ósea o células madre
Se debe considerar el trasplante de médula ósea (TMO) o de células madre (TCM) alogénico cuando sea posible, según la respuesta y la durabilidad de la respuesta.[8-12]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Druker BJ, Sawyers CL, Kantarjian H, et al.: Activity of a specific inhibitor of the BCR-ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute lymphoblastic leukemia with the Philadelphia chromosome. N Engl J Med 344 (14): 1038-42, 2001. [PUBMED Abstract]
- Saglio G, Hochhaus A, Goh YT, et al.: Dasatinib in imatinib-resistant or imatinib-intolerant chronic myeloid leukemia in blast phase after 2 years of follow-up in a phase 3 study: efficacy and tolerability of 140 milligrams once daily and 70 milligrams twice daily. Cancer 116 (16): 3852-61, 2010. [PUBMED Abstract]
- Gambacorti-Passerini C, Cortes JE, Lipton JH, et al.: Safety and efficacy of second-line bosutinib for chronic phase chronic myeloid leukemia over a five-year period: final results of a phase I/II study. Haematologica 103 (8): 1298-1307, 2018. [PUBMED Abstract]
- Kantarjian HM, Cortes J, O'Brien S, et al.: Imatinib mesylate (STI571) therapy for Philadelphia chromosome-positive chronic myelogenous leukemia in blast phase. Blood 99 (10): 3547-53, 2002. [PUBMED Abstract]
- Sawyers CL, Hochhaus A, Feldman E, et al.: Imatinib induces hematologic and cytogenetic responses in patients with chronic myelogenous leukemia in myeloid blast crisis: results of a phase II study. Blood 99 (10): 3530-9, 2002. [PUBMED Abstract]
- Morita K, Kantarjian HM, Sasaki K, et al.: Outcome of patients with chronic myeloid leukemia in lymphoid blastic phase and Philadelphia chromosome-positive acute lymphoblastic leukemia treated with hyper-CVAD and dasatinib. Cancer 127 (15): 2641-2647, 2021. [PUBMED Abstract]
- Jain P, Kantarjian HM, Ghorab A, et al.: Prognostic factors and survival outcomes in patients with chronic myeloid leukemia in blast phase in the tyrosine kinase inhibitor era: Cohort study of 477 patients. Cancer 123 (22): 4391-4402, 2017. [PUBMED Abstract]
- Wagner JE, Zahurak M, Piantadosi S, et al.: Bone marrow transplantation of chronic myelogenous leukemia in chronic phase: evaluation of risks and benefits. J Clin Oncol 10 (5): 779-89, 1992. [PUBMED Abstract]
- Enright H, Davies SM, DeFor T, et al.: Relapse after non-T-cell-depleted allogeneic bone marrow transplantation for chronic myelogenous leukemia: early transplantation, use of an unrelated donor, and chronic graft-versus-host disease are protective. Blood 88 (2): 714-20, 1996. [PUBMED Abstract]
- Goldman JM, Szydlo R, Horowitz MM, et al.: Choice of pretransplant treatment and timing of transplants for chronic myelogenous leukemia in chronic phase. Blood 82 (7): 2235-8, 1993. [PUBMED Abstract]
- Clift RA, Appelbaum FR, Thomas ED: Treatment of chronic myeloid leukemia by marrow transplantation. Blood 82 (7): 1954-6, 1993. [PUBMED Abstract]
- Hansen JA, Gooley TA, Martin PJ, et al.: Bone marrow transplants from unrelated donors for patients with chronic myeloid leukemia. N Engl J Med 338 (14): 962-8, 1998. [PUBMED Abstract]
Tratamiento de la leucemia mieloide crónica en recaída
Opciones de tratamiento de la leucemia mieloide crónica en recaída
Las opciones de tratamiento de la leucemia mieloide crónica (LMC) en recaída son las siguientes:
La LMC en recaída se caracteriza por cambios que indiquen progresión de la enfermedad desde un estado de remisión estable, como los siguientes:
- Aumento de células mieloides o blásticas en la sangre periférica o la médula ósea.
- Resultado positivo en la prueba citogenética cuando antes había sido negativo.
- Resultado positivo en la hibridación fluorescente in situ (FISH) para la translocación BCR::ABL1 cuando antes había sido negativo.
La detección de la translocación BCR::ABL1 mediante prueba de reacción en cadena de la polimerasa con retrotranscripción (RT-PCR) durante remisiones prolongadas no constituye una recaída por sí sola. Sin embargo, la reducción exponencial en la medida cuantitativa de la RT-PCR durante 3 a 12 meses se correlaciona con el grado de respuesta citogenética, de la misma manera que el aumento exponencial se puede relacionar con una medida cuantitativa de RT-PCR estrechamente relacionada con la recaída clínica.[1] El fracaso del tratamiento evidente se define como una pérdida de la remisión hematológica o progresión a una LMC en fase acelerada o crisis blástica. Un aumento constante de las concentraciones de BCR::ABL1 en la RT-PCR indica una recaída de la enfermedad.
Terapia dirigida con inhibidores de tirosina–cinasas
En caso de fracaso del tratamiento o respuesta subóptima, los pacientes se deben someter a un análisis de la mutación del dominio de cinasa en BCR::ABL1 para ayudar a guiar el tratamiento con los ITC más nuevos o con un trasplante alogénico.[2,3]
Las variantes del dominio de tirosina–cinasa pueden conferir resistencia al mesilato de imatinib. En este entorno se ha estudiado el uso de otros ITC, como dasatinib, nilotinib o bosutinib, dosis más altas de mesilato de imatinib y trasplante de células madre (TCM) alogénico.[4-16] En particular, la variante de T315I caracteriza la resistencia al imatinib, dasatinib, nilotinib y bosutinib.
Ponatinib
El ponatinib es un ITC oral que tiene actividad en pacientes con variantes del gen T315I o en quienes fracasó el tratamiento con otro ITC.[17-19] En múltiples estudios de fase II, se concluyó que la administración de una dosis inicial de 45 mg, con una disminución a 15 mg en el momento de la respuesta resulta en una respuesta óptima (≤ 1 % BCR::ABL1) y menor toxicidad.[20,21][Nivel de evidencia C3] El ponatinib se relaciona con un aumento de los eventos adversos cardiovasculares. Los pacientes con enfermedad cardiovascular significativa, hipertensión o diabetes mellitus se excluyeron de los ensayos clínicos.[20,21]
Evidencia (ponatinib):
- El ponatinib se ha estudiado en múltiples estudios de fase II en los que participaron 799 pacientes.[17,21][Nivel de evidencia C3]
- De los 799 pacientes con una variante de T315I o resistencia a 2 o más ITC previos, del 46 % al 68 % presentaron una respuesta óptima (≤ 1 % BCR::ABL1) al ponatinib.
- En una revisión retrospectiva de 184 pacientes con LMC crónica recidivante y variante de T315I, se notificaron los siguientes resultados:[18][Nivel de evidencia C3]
- Los pacientes que recibieron tratamiento con ponatinib tuvieron una tasa de supervivencia general (SG) a 4 años más alta que los pacientes tratados con TCM alogénico (73 vs. 56 %; cociente de riesgos instantáneos [CRI], 0,37; intervalo de confianza [IC] 95 %, 0,16−0,84; P = 0,017).
- Para los pacientes con LMC en fase acelerada, la supervivencia fue equivalente; sin embargo, para los pacientes con LMC en fase de crisis blástica, la SG fue peor para aquellos que recibieron ponatinib (CRI, 2,29; IC 95 %, 1,08−4,82; P = 0,030).
- En una revisión retrospectiva, los pacientes con una variante de T315I y LMC que no respondieron al ponatinib presentaron un pronóstico precario, con una mediana de supervivencia de 16 meses. Los desenlaces para estos pacientes fueron mejores después de un TCM alogénico, pero quizás este resultado se deba a un sesgo de selección.[22][Nivel de evidencia C3]
- Se llevó a cabo un ensayo de fase II de 282 pacientes para determinar la dosis mínima eficaz de ponatinib, porque las dosis más altas se relacionaron con episodios de obstrucción arterial.[20]
- Se encontró que la dosis óptima fue una dosis inicial de 45 mg administrada una vez al día; luego se disminuyó a 15 mg cuando se logró una respuesta (≤ 1 % BCR::ABL1).[20]
Asciminib
El asciminib es un inhibidor alostérico de BCR::ABL1 que actúa en el bolsillo miristoilo de ABL1, un sitio distinto de los que usan los ITC.
Evidencia (asciminib):
- En un ensayo clínico aleatorizado sin enmascaramiento, se comparó el asciminib con el bosutinib. Después de una mediana de seguimiento de 14,9 meses, se asignó al azar a 233 pacientes con enfermedad resistente al tratamiento a recibir asciminib o bosutinib en una proporción de 2:1.[23]
- La tasa de respuesta molecular mayor (RMM) en la semana 24 fue del 25,5 % para los pacientes que recibieron asciminib versus el 13,2 % para los pacientes que recibieron bosutinib. La diferencia en la respuesta (ajustada para la respuesta citogenética mayor al inicio) fue de un 12,2 % (IC 95 %, 2,19–22,30 %; P = 0,029).[23][Nivel de evidencia B3]
- El 50,6 % de los pacientes que recibió asciminib y el 60,5 % de los que recibieron bosutinib presentaron efectos adversos de grado 3 o 4.
- En un ensayo de fase I de asciminib se incluyeron pacientes con tratamiento previo intenso que presentaron resistencia o efectos secundarios inaceptables después de los ITC estándar. Se incluyó a pacientes con una variante de T315I y aquellos en quienes fracasó el tratamiento con ponatinib.[24][Nivel de evidencia C3]
- De 141 pacientes, el 48 % logró una RMM a los 12 meses.
- En un ensayo de fase II se incluyeron 31 pacientes que recibieron asciminib.[25][Nivel de evidencia C3]
- Se notificó una tasa de RMM del 41 % a los 12 meses.
- Se encontró que 3 de 9 pacientes cuya enfermedad no respondió al ponatinib previo respondieron al asciminib.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Martinelli G, Iacobucci I, Rosti G, et al.: Prediction of response to imatinib by prospective quantitation of BCR-ABL transcript in late chronic phase chronic myeloid leukemia patients. Ann Oncol 17 (3): 495-502, 2006. [PUBMED Abstract]
- Soverini S, Hochhaus A, Nicolini FE, et al.: BCR-ABL kinase domain mutation analysis in chronic myeloid leukemia patients treated with tyrosine kinase inhibitors: recommendations from an expert panel on behalf of European LeukemiaNet. Blood 118 (5): 1208-15, 2011. [PUBMED Abstract]
- Parker WT, Lawrence RM, Ho M, et al.: Sensitive detection of BCR-ABL1 mutations in patients with chronic myeloid leukemia after imatinib resistance is predictive of outcome during subsequent therapy. J Clin Oncol 29 (32): 4250-9, 2011. [PUBMED Abstract]
- Jabbour E, Cortes J, Kantarjian HM, et al.: Allogeneic stem cell transplantation for patients with chronic myeloid leukemia and acute lymphocytic leukemia after Bcr-Abl kinase mutation-related imatinib failure. Blood 108 (4): 1421-3, 2006. [PUBMED Abstract]
- le Coutre PD, Giles FJ, Hochhaus A, et al.: Nilotinib in patients with Ph+ chronic myeloid leukemia in accelerated phase following imatinib resistance or intolerance: 24-month follow-up results. Leukemia 26 (6): 1189-94, 2012. [PUBMED Abstract]
- Hochhaus A, Baccarani M, Deininger M, et al.: Dasatinib induces durable cytogenetic responses in patients with chronic myelogenous leukemia in chronic phase with resistance or intolerance to imatinib. Leukemia 22 (6): 1200-6, 2008. [PUBMED Abstract]
- Guilhot F, Apperley J, Kim DW, et al.: Dasatinib induces significant hematologic and cytogenetic responses in patients with imatinib-resistant or -intolerant chronic myeloid leukemia in accelerated phase. Blood 109 (10): 4143-50, 2007. [PUBMED Abstract]
- Kantarjian HM, Giles FJ, Bhalla KN, et al.: Nilotinib is effective in patients with chronic myeloid leukemia in chronic phase after imatinib resistance or intolerance: 24-month follow-up results. Blood 117 (4): 1141-5, 2011. [PUBMED Abstract]
- Kantarjian H, Cortes J, Kim DW, et al.: Phase 3 study of dasatinib 140 mg once daily versus 70 mg twice daily in patients with chronic myeloid leukemia in accelerated phase resistant or intolerant to imatinib: 15-month median follow-up. Blood 113 (25): 6322-9, 2009. [PUBMED Abstract]
- Jabbour E, Jones D, Kantarjian HM, et al.: Long-term outcome of patients with chronic myeloid leukemia treated with second-generation tyrosine kinase inhibitors after imatinib failure is predicted by the in vitro sensitivity of BCR-ABL kinase domain mutations. Blood 114 (10): 2037-43, 2009. [PUBMED Abstract]
- Apperley JF, Cortes JE, Kim DW, et al.: Dasatinib in the treatment of chronic myeloid leukemia in accelerated phase after imatinib failure: the START a trial. J Clin Oncol 27 (21): 3472-9, 2009. [PUBMED Abstract]
- Hughes T, Saglio G, Branford S, et al.: Impact of baseline BCR-ABL mutations on response to nilotinib in patients with chronic myeloid leukemia in chronic phase. J Clin Oncol 27 (25): 4204-10, 2009. [PUBMED Abstract]
- Kantarjian H, Pasquini R, Lévy V, et al.: Dasatinib or high-dose imatinib for chronic-phase chronic myeloid leukemia resistant to imatinib at a dose of 400 to 600 milligrams daily: two-year follow-up of a randomized phase 2 study (START-R). Cancer 115 (18): 4136-47, 2009. [PUBMED Abstract]
- Saglio G, Hochhaus A, Goh YT, et al.: Dasatinib in imatinib-resistant or imatinib-intolerant chronic myeloid leukemia in blast phase after 2 years of follow-up in a phase 3 study: efficacy and tolerability of 140 milligrams once daily and 70 milligrams twice daily. Cancer 116 (16): 3852-61, 2010. [PUBMED Abstract]
- Cortes JE, Kantarjian HM, Brümmendorf TH, et al.: Safety and efficacy of bosutinib (SKI-606) in chronic phase Philadelphia chromosome-positive chronic myeloid leukemia patients with resistance or intolerance to imatinib. Blood 118 (17): 4567-76, 2011. [PUBMED Abstract]
- Khoury HJ, Cortes JE, Kantarjian HM, et al.: Bosutinib is active in chronic phase chronic myeloid leukemia after imatinib and dasatinib and/or nilotinib therapy failure. Blood 119 (15): 3403-12, 2012. [PUBMED Abstract]
- Cortes JE, Kim DW, Pinilla-Ibarz J, et al.: A phase 2 trial of ponatinib in Philadelphia chromosome-positive leukemias. N Engl J Med 369 (19): 1783-96, 2013. [PUBMED Abstract]
- Nicolini FE, Basak GW, Kim DW, et al.: Overall survival with ponatinib versus allogeneic stem cell transplantation in Philadelphia chromosome-positive leukemias with the T315I mutation. Cancer 123 (15): 2875-2880, 2017. [PUBMED Abstract]
- Shacham-Abulafia A, Raanani P, Lavie D, et al.: Real-life Experience With Ponatinib in Chronic Myeloid Leukemia: A Multicenter Observational Study. Clin Lymphoma Myeloma Leuk 18 (7): e295-e301, 2018. [PUBMED Abstract]
- Cortes J, Apperley J, Lomaia E, et al.: Ponatinib dose-ranging study in chronic-phase chronic myeloid leukemia: a randomized, open-label phase 2 clinical trial. Blood 138 (21): 2042-2050, 2021. [PUBMED Abstract]
- Kantarjian HM, Jabbour E, Deininger M, et al.: Ponatinib after failure of second-generation tyrosine kinase inhibitor in resistant chronic-phase chronic myeloid leukemia. Am J Hematol 97 (11): 1419-1426, 2022. [PUBMED Abstract]
- Boddu P, Shah AR, Borthakur G, et al.: Life after ponatinib failure: outcomes of chronic and accelerated phase CML patients who discontinued ponatinib in the salvage setting. Leuk Lymphoma 59 (6): 1312-1322, 2018. [PUBMED Abstract]
- Réa D, Mauro MJ, Boquimpani C, et al.: A phase 3, open-label, randomized study of asciminib, a STAMP inhibitor, vs bosutinib in CML after 2 or more prior TKIs. Blood 138 (21): 2031-2041, 2021. [PUBMED Abstract]
- Hughes TP, Mauro MJ, Cortes JE, et al.: Asciminib in Chronic Myeloid Leukemia after ABL Kinase Inhibitor Failure. N Engl J Med 381 (24): 2315-2326, 2019. [PUBMED Abstract]
- Garcia-Gutiérrez V, Luna A, Alonso-Dominguez JM, et al.: Safety and efficacy of asciminib treatment in chronic myeloid leukemia patients in real-life clinical practice. Blood Cancer J 11 (2): 16, 2021. [PUBMED Abstract]
Referencias bibliográficas clave para la leucemia mieloide crónica
Los miembros del Consejo editorial del PDQ® sobre el tratamiento para adultos seleccionaron estas referencias bibliográficas por su importancia en el entorno del tratamiento de la leucemia mieloide crónica (LMC). Esta lista se proporciona para informar a los interesados sobre estudios importantes que han ayudado a conformar la comprensión actual sobre las opciones de tratamiento para la LMC. A continuación, se indican las secciones del resumen en las que se citaron las referencias.
- Hughes TP, Saglio G, Kantarjian HM, et al.: Early molecular response predicts outcomes in patients with chronic myeloid leukemia in chronic phase treated with frontline nilotinib or imatinib. Blood 123 (9): 1353-60, 2014. [PUBMED Abstract]
Citada en:
- Jabbour E, Kantarjian HM, Saglio G, et al.: Early response with dasatinib or imatinib in chronic myeloid leukemia: 3-year follow-up from a randomized phase 3 trial (DASISION). Blood 123 (4): 494-500, 2014. [PUBMED Abstract]
Citada en:
- Kantarjian HM, Hochhaus A, Saglio G, et al.: Nilotinib versus imatinib for the treatment of patients with newly diagnosed chronic phase, Philadelphia chromosome-positive, chronic myeloid leukaemia: 24-month minimum follow-up of the phase 3 randomised ENESTnd trial. Lancet Oncol 12 (9): 841-51, 2011. [PUBMED Abstract]
Citada en:
Actualizaciones más recientes a este resumen (04/08/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Información general sobre la leucemia mieloide crónica
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2025 (se citó a la American Cancer Society como referencia 1).
Tratamiento de la leucemia mieloide crónica en fase crónica
Se revisó texto sobre un estudio prospectivo de 405 pacientes con leucemia mieloide crónica recién diagnosticada. Los pacientes se asignaron al azar a recibir asciminib u mesilato de imatinib, nilotinib, dasatinib o bosutinib. En un análisis de subgrupos preespecificado se comparó el asciminib con ITC de segunda generación (sin inclusión de imatinib). En la semana 48, el 66,0 % de los pacientes que recibieron asciminib tenía una respuesta molecular mayor (RMM) y el 57,8 % de los pacientes que recibieron un ITC de segunda generación tenía una RMM. La diferencia del 8,2 % no fue estadísticamente significativa. En el primer año, la eficacia de asciminib es equivalente a los ITC de segunda generación. Se necesita un seguimiento más prolongado para evaluar bien los desenlaces de eficacia y toxicidad.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento de la leucemia mieloide crónica. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento de la leucemia mieloide crónica son:
- Aaron Gerds, MD (Cleveland Clinic Taussig Cancer Institute)
- Eric J. Seifter, MD (Johns Hopkins University)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento de la leucemia mieloide crónica. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/leucemia/pro/tratamiento-lmc-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.