Tratamiento del cáncer de recto (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer de recto
Incidencia y mortalidad
Resulta difícil separar los aspectos epidemiológicos del cáncer de recto de los del cáncer de colon porque es frecuente que en los estudios se analicen juntos el cáncer de colon y el cáncer de recto (es decir, cáncer colorrectal).
El cáncer colorrectal es la tercera forma más común de cáncer en el mundo. En 2022, se calculó que hubo 1,93 millones de casos nuevos de cáncer colorrectal y 903 859 defunciones.[1]
Número estimado de casos nuevos y defunciones por cáncer de recto y cáncer de colon en los Estados Unidos para 2025:[2]
- Casos nuevos de cáncer de recto: 46 950.
- Casos nuevos de cáncer de colon: 107 320.
- Defunciones: 52 990 (cáncer de recto y cáncer de colon combinados).
El cáncer colorrectal afecta casi de la misma manera a hombres y mujeres. Entre todos los grupos raciales de los Estados Unidos, las personas negras tienen las tasas más altas de incidencia esporádica y mortalidad de cáncer colorrectal.[3,4]
Características anatómicas
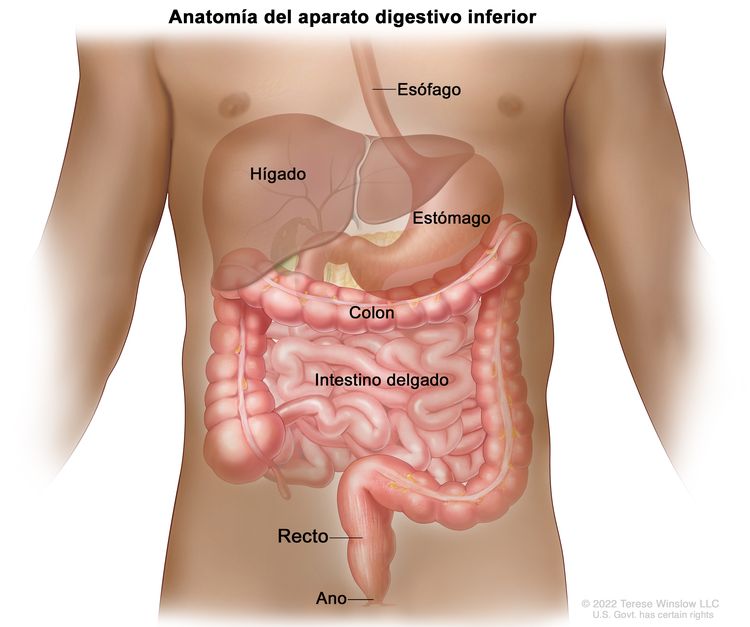
El recto está ubicado dentro de la pelvis y se extiende desde la mucosa de transición de la línea dentada anal hasta el colon sigmoide en la reflexión peritoneal. En una sigmoidoscopia rígida, el recto mide entre 10 y 15 cm desde el borde del ano.[5] La ubicación de un tumor de recto en general se indica por la distancia entre el borde del ano, la línea dentada o el anillo anorrectal, y el borde inferior del tumor, con mediciones que difieren según se use un endoscopio rígido o flexible, o un examen digital.[6]
La distancia a la que se encuentra el tumor desde la musculatura del esfínter anal afecta la capacidad de llevar a cabo una cirugía para conservar el esfínter. Las restricciones óseas de la pelvis limitan el acceso quirúrgico al recto, lo que reduce la probabilidad de obtener márgenes amplios sin compromiso tumoral y aumenta el riesgo de recidiva local.[5]
Factores de riesgo
El envejecimiento es el factor de riesgo más importante para la mayoría de cánceres. Otros factores de riesgo del cáncer colorrectal son los siguientes:
- Antecedentes familiares de cáncer colorrectal en un pariente de primer grado.[7]
- Antecedentes personales de adenomas colorrectales, cáncer colorrectal o cáncer de ovario.[8-10]
- Afecciones hereditarias, como la poliposis adenomatosa familiar (PAF) y el síndrome de Lynch (cáncer de colon sin poliposis hereditario [HNPCC]).[11]
- Antecedentes personales de colitis ulcerosa crónica o colitis de Crohn duraderas.[12]
- Consumo excesivo de alcohol.[13]
- Consumo de tabaco.[14]
- Raza u origen étnico: afroamericano.[15,16]
- Obesidad.[17]
Exámenes de detección
La evidencia científica sustenta el uso de exámenes de detección del cáncer de recto como parte de la atención de rutina para todos los adultos de 50 años o más; en especial, si tienen familiares de primer grado con cáncer colorrectal. Algunas de las razones son:
- Incidencia de la enfermedad en adultos de 50 años o más.
- Capacidad de identificar grupos de riesgo alto.
- Crecimiento lento de las lesiones primarias.
- Mejor supervivencia de los pacientes con lesiones en estadio temprano.
- Simplicidad y exactitud relativas de los exámenes de detección.
Para obtener más información, consultar Exámenes de detección del cáncer colorrectal.
Características clínicas
Los síntomas del cáncer de recto son similares a los del cáncer de colon, entre ellos, los siguientes:[18]
- Hemorragia rectal.
- Cambio del hábito intestinal.
- Dolor abdominal.
- Obstrucción intestinal.
- Cambio en el apetito.
- Pérdida de peso.
- Debilidad.
Con excepción de los síntomas de obstrucción, estos síntomas no siempre se correlacionan con el estadio de la enfermedad ni significan un diagnóstico en particular.[19]
Evaluación diagnóstica
La evaluación clínica inicial incluye los siguientes aspectos:
- Examen físico y antecedentes.
- Examen digital del recto.
- Colonoscopia.
- Biopsia.
- Prueba del antígeno carcinoembrionario (ACE).
- Pruebas inmunohistoquímicas.
- Prueba de la reparación de errores de emparejamiento del DNA y de inestabilidad microsatelital (IMS).
El examen físico puede revelar una masa palpable o rectorragia. Es posible que se encuentren adenopatías, hepatomegalia o signos pulmonares cuando hay enfermedad metastásica.[6] En los exámenes de laboratorio a veces se identifica anemia ferropénica y alteraciones de los electrólitos y el funcionamiento hepático.
Factores pronósticos
El pronóstico de los pacientes con cáncer de recto se relaciona con varios factores, como los siguientes:[6,20-28]
- Invasión o adherencia del tumor a órganos adyacentes.[20]
- Presencia o ausencia de compromiso tumoral ganglionar y número de ganglios linfáticos comprometidos.[6,21-24]
- Presencia o ausencia de metástasis a distancia.[6,20]
- Perforación u obstrucción intestinal.[6,28]
- Presencia o ausencia de características patológicas de riesgo alto, como las siguientes:[26,27,29]
- Márgenes quirúrgicos con compromiso tumoral.
- Invasión linfovascular.
- Invasión perineural.
- Tipo histológico con diferenciación precaria.
- Margen circunferencial de resección (MCR) o profundidad de la penetración tumoral de la pared intestinal.[6,25,30] El MCR se mide en milímetros y se define como el margen de retroperitoneo o tejido blando adventicio más cercano al punto de penetración más profunda del tumor.
- Presencia IMS como consecuencia de deficiencia en la reparación de errores de emparejamiento del DNA.
En estudios prospectivos multiinstitucionales, solo se validó el estadio de la enfermedad (designado como tumor [T], estado ganglionar [N] y metástasis a distancia [M]) como factor pronóstico.[20-25] Estas conclusiones se confirmaron en un importante análisis conjunto en el que se evaluó el efecto del estadio T, el estadio N y el tratamiento en la supervivencia y la recaída de pacientes con cáncer de recto que reciben terapia adyuvante.[31]
La deficiencia en la reparación de errores de emparejamiento se presenta en el 5 % al 10 % de los pacientes con adenocarcinomas de recto. Los tumores con deficiencia en la reparación de errores de emparejamiento no reaccionan bien a la quimioterapia en entornos neoadyuvante, adyuvante o metastásico.[32-34] En series poblacionales de 607 pacientes de 50 años o menores en el momento del diagnóstico, el cáncer colorrectal con IMS se relacionó con una mejora de la supervivencia que fue independiente del estadio tumoral. La IMS también se relaciona con el síndrome de Lynch.[35] Además, el perfil de expresión génica es útil para predecir la respuesta de los adenocarcinomas de recto a la quimiorradioterapia preoperatoria. También ayuda a determinar el pronóstico del cáncer de recto en estadios II y III después de la quimiorradioterapia neoadyuvante a base de fluorouracilo.[36,37]
Se observaron diferencias raciales y étnicas en la supervivencia general (SG) después de la terapia adyuvante para el cáncer de recto, con una SG más corta para los pacientes negros que para los blancos. Los factores causantes de esta disparidad incluyen la ubicación del tumor, el tipo de procedimiento quirúrgico y la presencia de afecciones comórbidas.[38]
Seguimiento posterior al tratamiento
Las metas principales de los programas de vigilancia posoperatoria para el cáncer de recto son las siguientes:[39]
- Evaluar la eficacia del tratamiento inicial.
- Detectar neoplasias malignas nuevas o metacrónicas.
- Detectar cánceres recidivantes o metastásicos que tengan la posibilidad de curarse.
Los estudios rutinarios y periódicos después del tratamiento del cáncer de recto quizás conduzcan a la identificación y el tratamiento tempranos de una enfermedad recidivante.[39-43] En dos ensayos clínicos, se demostró un beneficio estadísticamente significativo para la supervivencia de protocolos de seguimiento más intensivos. En un metanálisis en el que se combinaron estos dos ensayos con otros cuatro, se informó de una mejora estadísticamente significativa en la supervivencia de los pacientes que recibieron seguimiento intensivo.[39,44,45]
Hay variaciones en las directrices de las principales sociedades oncológicas estadounidenses y europeas en cuanto a la vigilancia para el cáncer colorrectal después del tratamiento inicial con intención curativa, por lo tanto, continúa la incertidumbre sobre las estrategias óptimas de vigilancia.[46,47] Se necesitan estudios aleatorizados prospectivos grandes, bien diseñados y multiinstitucionales con el fin de establecer un consenso fundamentado en evidencia científica para la evaluación del seguimiento.
Antígeno carcinoembrionario
La medición del antígeno carcinoembrionario (ACE), una glicoproteína sérica, se usa con frecuencia para la atención y el seguimiento de los pacientes con cáncer de recto. Una revisión sobre el uso de este marcador tumoral para el cáncer de recto indica lo siguiente:[39]
- Una prueba sérica del ACE no es un instrumento de detección valioso para el cáncer de recto debido a sensibilidad y especificidad bajas.
- La prueba del ACE posoperatoria por lo común se restringe a los pacientes que serían aptos para una intervención adicional, como los siguientes:
- Pacientes con cáncer de recto en estadio II o estadio III (cada 2 a 3 meses durante por lo menos 2 años después del diagnóstico).
- Pacientes con cáncer de recto aptos para una resección de las metástasis hepáticas.
En un estudio retrospectivo neerlandés de extirpación mesorrectal total para el tratamiento del cáncer de recto, los investigadores encontraron que la concentración sérica del ACE preoperatoria fue normal en la mayoría de los pacientes con cáncer de recto; pero en los pacientes con recidiva las concentraciones séricas del ACE aumentaron por lo menos un 50 %. Los autores concluyeron que en pacientes con cáncer de recto no se puede descartar el uso seriado de pruebas posoperatorias del ACE a partir de una concentración sérica preoperatoria normal del ACE.[48,49]
Bibliografía
- Bray F, Laversanne M, Sung H, et al.: Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 74 (3): 229-263, 2024. [PUBMED Abstract]
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Albano JD, Ward E, Jemal A, et al.: Cancer mortality in the United States by education level and race. J Natl Cancer Inst 99 (18): 1384-94, 2007. [PUBMED Abstract]
- Kauh J, Brawley OW, Berger M: Racial disparities in colorectal cancer. Curr Probl Cancer 31 (3): 123-33, 2007 May-Jun. [PUBMED Abstract]
- Wolpin BM, Meyerhardt JA, Mamon HJ, et al.: Adjuvant treatment of colorectal cancer. CA Cancer J Clin 57 (3): 168-85, 2007 May-Jun. [PUBMED Abstract]
- Libutti SK, Willett CG, Saltz LB: Cancer of the rectum. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1127-41.
- Johns LE, Houlston RS: A systematic review and meta-analysis of familial colorectal cancer risk. Am J Gastroenterol 96 (10): 2992-3003, 2001. [PUBMED Abstract]
- Imperiale TF, Juluri R, Sherer EA, et al.: A risk index for advanced neoplasia on the second surveillance colonoscopy in patients with previous adenomatous polyps. Gastrointest Endosc 80 (3): 471-8, 2014. [PUBMED Abstract]
- Singh H, Nugent Z, Demers A, et al.: Risk of colorectal cancer after diagnosis of endometrial cancer: a population-based study. J Clin Oncol 31 (16): 2010-5, 2013. [PUBMED Abstract]
- Srinivasan R, Yang YX, Rubin SC, et al.: Risk of colorectal cancer in women with a prior diagnosis of gynecologic malignancy. J Clin Gastroenterol 41 (3): 291-6, 2007. [PUBMED Abstract]
- Mork ME, You YN, Ying J, et al.: High Prevalence of Hereditary Cancer Syndromes in Adolescents and Young Adults With Colorectal Cancer. J Clin Oncol 33 (31): 3544-9, 2015. [PUBMED Abstract]
- Laukoetter MG, Mennigen R, Hannig CM, et al.: Intestinal cancer risk in Crohn's disease: a meta-analysis. J Gastrointest Surg 15 (4): 576-83, 2011. [PUBMED Abstract]
- Fedirko V, Tramacere I, Bagnardi V, et al.: Alcohol drinking and colorectal cancer risk: an overall and dose-response meta-analysis of published studies. Ann Oncol 22 (9): 1958-72, 2011. [PUBMED Abstract]
- Liang PS, Chen TY, Giovannucci E: Cigarette smoking and colorectal cancer incidence and mortality: systematic review and meta-analysis. Int J Cancer 124 (10): 2406-15, 2009. [PUBMED Abstract]
- Laiyemo AO, Doubeni C, Pinsky PF, et al.: Race and colorectal cancer disparities: health-care utilization vs different cancer susceptibilities. J Natl Cancer Inst 102 (8): 538-46, 2010. [PUBMED Abstract]
- Lansdorp-Vogelaar I, Kuntz KM, Knudsen AB, et al.: Contribution of screening and survival differences to racial disparities in colorectal cancer rates. Cancer Epidemiol Biomarkers Prev 21 (5): 728-36, 2012. [PUBMED Abstract]
- Ma Y, Yang Y, Wang F, et al.: Obesity and risk of colorectal cancer: a systematic review of prospective studies. PLoS One 8 (1): e53916, 2013. [PUBMED Abstract]
- Stein W, Farina A, Gaffney K, et al.: Characteristics of colon cancer at time of presentation. Fam Pract Res J 13 (4): 355-63, 1993. [PUBMED Abstract]
- Majumdar SR, Fletcher RH, Evans AT: How does colorectal cancer present? Symptoms, duration, and clues to location. Am J Gastroenterol 94 (10): 3039-45, 1999. [PUBMED Abstract]
- Compton CC, Greene FL: The staging of colorectal cancer: 2004 and beyond. CA Cancer J Clin 54 (6): 295-308, 2004 Nov-Dec. [PUBMED Abstract]
- Swanson RS, Compton CC, Stewart AK, et al.: The prognosis of T3N0 colon cancer is dependent on the number of lymph nodes examined. Ann Surg Oncol 10 (1): 65-71, 2003 Jan-Feb. [PUBMED Abstract]
- Le Voyer TE, Sigurdson ER, Hanlon AL, et al.: Colon cancer survival is associated with increasing number of lymph nodes analyzed: a secondary survey of intergroup trial INT-0089. J Clin Oncol 21 (15): 2912-9, 2003. [PUBMED Abstract]
- Prandi M, Lionetto R, Bini A, et al.: Prognostic evaluation of stage B colon cancer patients is improved by an adequate lymphadenectomy: results of a secondary analysis of a large scale adjuvant trial. Ann Surg 235 (4): 458-63, 2002. [PUBMED Abstract]
- Tepper JE, O'Connell MJ, Niedzwiecki D, et al.: Impact of number of nodes retrieved on outcome in patients with rectal cancer. J Clin Oncol 19 (1): 157-63, 2001. [PUBMED Abstract]
- Balch GC, De Meo A, Guillem JG: Modern management of rectal cancer: a 2006 update. World J Gastroenterol 12 (20): 3186-95, 2006. [PUBMED Abstract]
- Weiser MR, Landmann RG, Wong WD, et al.: Surgical salvage of recurrent rectal cancer after transanal excision. Dis Colon Rectum 48 (6): 1169-75, 2005. [PUBMED Abstract]
- Fujita S, Nakanisi Y, Taniguchi H, et al.: Cancer invasion to Auerbach's plexus is an important prognostic factor in patients with pT3-pT4 colorectal cancer. Dis Colon Rectum 50 (11): 1860-6, 2007. [PUBMED Abstract]
- Griffin MR, Bergstralh EJ, Coffey RJ, et al.: Predictors of survival after curative resection of carcinoma of the colon and rectum. Cancer 60 (9): 2318-24, 1987. [PUBMED Abstract]
- DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011.
- Wieder HA, Rosenberg R, Lordick F, et al.: Rectal cancer: MR imaging before neoadjuvant chemotherapy and radiation therapy for prediction of tumor-free circumferential resection margins and long-term survival. Radiology 243 (3): 744-51, 2007. [PUBMED Abstract]
- Gunderson LL, Sargent DJ, Tepper JE, et al.: Impact of T and N stage and treatment on survival and relapse in adjuvant rectal cancer: a pooled analysis. J Clin Oncol 22 (10): 1785-96, 2004. [PUBMED Abstract]
- Le DT, Uram JN, Wang H, et al.: PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med 372 (26): 2509-20, 2015. [PUBMED Abstract]
- Overman MJ, Lonardi S, Wong KYM, et al.: Durable Clinical Benefit With Nivolumab Plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer. J Clin Oncol 36 (8): 773-779, 2018. [PUBMED Abstract]
- André T, Shiu KK, Kim TW, et al.: Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med 383 (23): 2207-2218, 2020. [PUBMED Abstract]
- Gryfe R, Kim H, Hsieh ET, et al.: Tumor microsatellite instability and clinical outcome in young patients with colorectal cancer. N Engl J Med 342 (2): 69-77, 2000. [PUBMED Abstract]
- Liersch T, Langer C, Ghadimi BM, et al.: Lymph node status and TS gene expression are prognostic markers in stage II/III rectal cancer after neoadjuvant fluorouracil-based chemoradiotherapy. J Clin Oncol 24 (25): 4062-8, 2006. [PUBMED Abstract]
- Ghadimi BM, Grade M, Difilippantonio MJ, et al.: Effectiveness of gene expression profiling for response prediction of rectal adenocarcinomas to preoperative chemoradiotherapy. J Clin Oncol 23 (9): 1826-38, 2005. [PUBMED Abstract]
- Dignam JJ, Ye Y, Colangelo L, et al.: Prognosis after rectal cancer in blacks and whites participating in adjuvant therapy randomized trials. J Clin Oncol 21 (3): 413-20, 2003. [PUBMED Abstract]
- Abir F, Alva S, Longo WE, et al.: The postoperative surveillance of patients with colon cancer and rectal cancer. Am J Surg 192 (1): 100-8, 2006. [PUBMED Abstract]
- Martin EW, Minton JP, Carey LC: CEA-directed second-look surgery in the asymptomatic patient after primary resection of colorectal carcinoma. Ann Surg 202 (3): 310-7, 1985. [PUBMED Abstract]
- Bruinvels DJ, Stiggelbout AM, Kievit J, et al.: Follow-up of patients with colorectal cancer. A meta-analysis. Ann Surg 219 (2): 174-82, 1994. [PUBMED Abstract]
- Lautenbach E, Forde KA, Neugut AI: Benefits of colonoscopic surveillance after curative resection of colorectal cancer. Ann Surg 220 (2): 206-11, 1994. [PUBMED Abstract]
- Khoury DA, Opelka FG, Beck DE, et al.: Colon surveillance after colorectal cancer surgery. Dis Colon Rectum 39 (3): 252-6, 1996. [PUBMED Abstract]
- Pietra N, Sarli L, Costi R, et al.: Role of follow-up in management of local recurrences of colorectal cancer: a prospective, randomized study. Dis Colon Rectum 41 (9): 1127-33, 1998. [PUBMED Abstract]
- Secco GB, Fardelli R, Gianquinto D, et al.: Efficacy and cost of risk-adapted follow-up in patients after colorectal cancer surgery: a prospective, randomized and controlled trial. Eur J Surg Oncol 28 (4): 418-23, 2002. [PUBMED Abstract]
- Pfister DG, Benson AB, Somerfield MR: Clinical practice. Surveillance strategies after curative treatment of colorectal cancer. N Engl J Med 350 (23): 2375-82, 2004. [PUBMED Abstract]
- Li Destri G, Di Cataldo A, Puleo S: Colorectal cancer follow-up: useful or useless? Surg Oncol 15 (1): 1-12, 2006. [PUBMED Abstract]
- Kapiteijn E, Kranenbarg EK, Steup WH, et al.: Total mesorectal excision (TME) with or without preoperative radiotherapy in the treatment of primary rectal cancer. Prospective randomised trial with standard operative and histopathological techniques. Dutch ColoRectal Cancer Group. Eur J Surg 165 (5): 410-20, 1999. [PUBMED Abstract]
- Grossmann I, de Bock GH, Meershoek-Klein Kranenbarg WM, et al.: Carcinoembryonic antigen (CEA) measurement during follow-up for rectal carcinoma is useful even if normal levels exist before surgery. A retrospective study of CEA values in the TME trial. Eur J Surg Oncol 33 (2): 183-7, 2007. [PUBMED Abstract]
Clasificación celular y características patológicas del cáncer de recto
Los adenocarcinomas representan la mayoría de los tumores de recto en los Estados Unidos. Se calcula que otros tipos histológicos representan del 2 % al 5 % de los tumores colorrectales.[1]
La clasificación de la Organización Mundial de la Salud de los tumores del colon y el recto incluye las siguientes categorías:[2]
Tumores epiteliales
Adenoma
- Adenoma tubular.
- Adenoma velloso.
- Adenoma tubulovelloso.
- Adenoma serrado.
Carcinoma
- Adenocarcinoma.
- Adenocarcinoma mucinoso.
- Carcinoma de células en anillo de sello.
- Carcinoma de células pequeñas.
- Carcinoma adenoescamoso.
- Carcinoma medular.
- Carcinoma indiferenciado.
Carcinoide (neoplasia neuroendocrina bien diferenciada)
- Neoplasia de células enterocromafines secretoras de serotonina.
- Tumor de células L productoras de péptido similar al glucagón, polipéptido pancreático o péptido YY.
- Otras.
Neoplasia intraepitelial (displasia) relacionada con enfermedades inflamatorias crónicas
- Neoplasia intraepitelial glandular de grado bajo.
- Neoplasia intraepitelial glandular de grado alto.
Carcinoma-adenocarcinoma (mixto)
- Otros.
Tumores no epiteliales
- Lipoma.
- Leiomioma.
- Tumor de estroma gastrointestinal. Para obtener más información, consultar Tratamiento de los tumores de estroma gastrointestinal.
- Leiomiosarcoma.
- Angiosarcoma.
- Sarcoma de Kaposi. Para obtener más información, consultar Tratamiento del sarcoma de Kaposi.
- Melanoma. Para obtener más información, consultar Tratamiento del melanoma.
- Otros.
Linfomas malignos
- Linfoma de células B de la zona marginal, de tejido linfoide asociado a mucosa.
- Linfoma de células de manto.
- Linfoma difuso de células B grandes.
- Linfoma de Burkitt.
- Linfoma tipo Burkitt o linfoma de Burkitt atípico.
Para obtener más información, consultar Tratamiento del linfoma no Hodgkin de células B de crecimiento lento.
Bibliografía
- Kang H, O'Connell JB, Leonardi MJ, et al.: Rare tumors of the colon and rectum: a national review. Int J Colorectal Dis 22 (2): 183-9, 2007. [PUBMED Abstract]
- Hamilton SR, Aaltonen LA: Pathology and Genetics of Tumours of the Digestive System. International Agency for Research on Cancer, 2000.
Información sobre los estadios del cáncer de recto
La estadificación precisa proporciona información crucial acerca de la localización y el tamaño del tumor primario en el recto y, si estuvieran presentes, el tamaño, el número y la localización de cualquier metástasis. Una estadificación inicial precisa afecta el tratamiento porque ayuda a determinar el tipo de intervención quirúrgica y la elección de la terapia neoadyuvante para aumentar al máximo la probabilidad de una resección con márgenes limpios. Para el cáncer primario de recto, las imágenes pélvicas ayudan a determinar los siguientes factores:[1-7]
- La profundidad de la invasión tumoral.
- La distancia desde el complejo esfinteriano.
- La posibilidad de lograr márgenes circunferenciales (radiales) sin compromiso tumoral.
- El compromiso de ganglios linfáticos locorregionales u órganos adyacentes.
Evaluación para la estadificación
La evaluación clínica y los procedimientos de estadificación incluyen los siguientes aspectos:
- Examen digital del recto (EDR): este examen se usa con o sin examen rectovaginal y proctoscopia rígida para determinar si es posible una cirugía que conserve el esfínter.[1,2,5]
- Colonoscopia: la colonoscopia completa sirve para descartar cáncer en otras partes del intestino.[5]
- Tomografía computarizada (TC): la TC corporal total sirve para descartar enfermedad metastásica.[5]
- Imágenes por resonancia magnética (IRM): las IRM del abdomen y la pelvis se usan para determinar la profundidad de penetración y la posibilidad de lograr márgenes circunferenciales (radiales) sin compromiso tumoral, así como identificar metástasis ganglionares locorregionales y metástasis a distancia. En particular, las IRM quizás sean muy útiles para determinar un compromiso del sacro por recidiva local.[1]
- Ecografía endorrectal: la ecografía endorrectal con sonda rígida o endoscopio flexible para lesiones estenóticas sirve para determinar la profundidad de la penetración e identificar metástasis ganglionares locorregionales.[2,4]
- Tomografía por emisión de positrones (TEP): la TEP se usa para obtener imágenes de las metástasis a distancia.[1]
- Antígeno carcinoembrionario (ACE): la medición de la concentración sérica de ACE sirve para hacer la evaluación pronóstica y determinar la respuesta al tratamiento.[6,7]
En varios estudios se indica que la exactitud de la ecografía endorrectal para la estadificación tumoral (T) del carcinoma rectal es del 80 al 95 %, en comparación con el 65 al 75 % para la TC y el 75 a 85 % para las IRM. La exactitud de la ecografía endorrectal para determinar el compromiso ganglionar metastásico es del 70 al 75 %, en comparación con el 55 al 65 % para la TC y el 60 al 70 % para las IRM.[2] En un metanálisis de 84 estudios, ninguna de las tres técnicas de obtención de imágenes (ecografía endorrectal, TC y IRM) fue superior de manera significativa a las otras para determinar el estadio de compromiso ganglionar (N).[8] La ecografía endorrectal con sonda rígida a veces tiene la misma exactitud para los estadios T y N cuando se compara con la ecografía endorrectal con endoscopio flexible. Sin embargo, es posible que una ecografía endorrectal técnicamente difícil produzca un resultado no concluyente o incorrecto para ambos estadios T y N. En este caso, se puede considerar una evaluación adicional con IRM o una ecografía endorrectal con endoscopio flexible.[4,9]
El margen circunferencial de resección es un parámetro importante para la estadificación patológica de los pacientes con cáncer de recto. Se define como el margen, medido en milímetros, de retroperitoneo o tejido blando adventicio más cercano al punto de penetración más profunda del tumor.[10]
Agrupamiento por estadios y definiciones TNM del American Joint Committee on Cancer
El American Joint Committee on Cancer (AJCC) designó los estadios mediante la clasificación TNM (tumor, ganglio linfático y metástasis) para definir el cáncer de recto.[11] La misma clasificación se usa para la estadificación clínica y patológica.[11] Para las decisiones de tratamiento se usa más el sistema de estadificación TNM que los esquemas de clasificación antiguos de Dukes o el Modified Astler-Coller.
El sistema de estadificación se utiliza para los adenocarcinomas, los carcinomas neuroendocrinos de grado alto y los carcinomas escamosos de colon y recto. Este sistema de estadificación no se usa para los siguientes tipos histopatológicos de cáncer: carcinomas de apéndice, carcinomas de ano y tumores neuroendocrinos bien diferenciados (carcinoides).[11] Para obtener más información, consultar Tratamiento del cáncer de ano y Tratamiento de los tumores neuroendocrinos gastrointestinales.
Estado de los ganglios linfáticos
Un grupo patrocinado por el AJCC y el Instituto Nacional del Cáncer recomendó que se examinen por lo menos 10 a 14 ganglios linfáticos en las extirpaciones de colon y recto de pacientes que no reciben terapia neoadyuvante. En los casos de extirpación con fines paliativos o en los pacientes que no recibieron radioterapia preoperatoria, es posible que se encuentren menos ganglios linfáticos.[10-12] Para esta recomendación se considera que el número de ganglios linfáticos que se examina refleja tanto la extensión de la disección mesentérica linfovascular en el momento de la resección quirúrgica, como la identificación patológica de los ganglios en la muestra.
En estudios retrospectivos, como en el ensayo intergrupal INT-0089 (NCT00201331), se demostró que el número de ganglios linfáticos examinados durante la cirugía de colon y de recto quizás se relacione con el desenlace del paciente.[13-16]
Se propuso una nueva estrategia de estadificación para las metástasis tumorales del cáncer de recto con compromiso ganglionar.[17]
| Estadio | TNMb,c | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 251–74. | |||
| Las explicaciones de los superíndices b y c están al final del Cuadro 5. | |||
| 0 | Tis, N0, M0 | Tis = carcinoma in situ, carcinoma intramucoso (compromiso de la lámina propia sin diseminación a la capa muscular de la mucosa). |
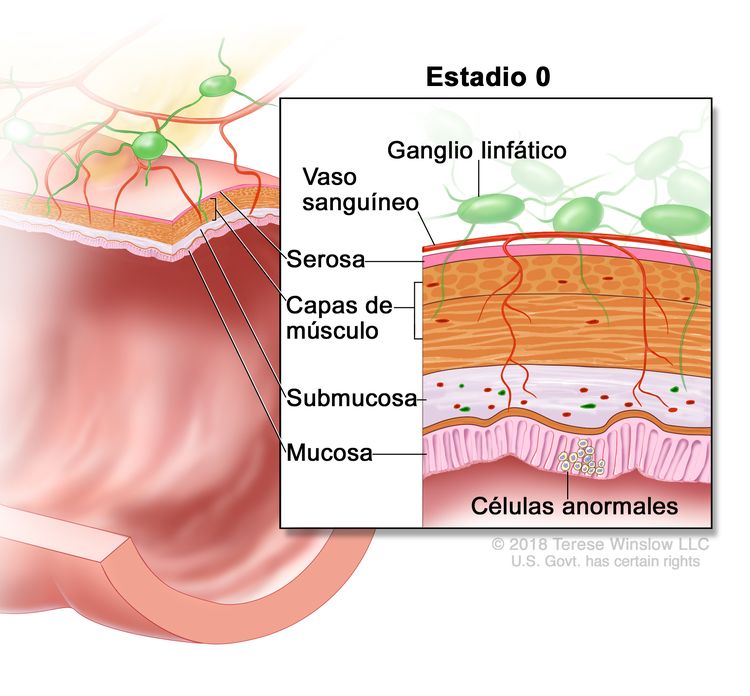 |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| Estadio | TNMb,c | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 251–74. | |||
| Las explicaciones de los superíndices b y c están al final del Cuadro 5. | |||
| I | T1–T2, N0, M0 | T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). |
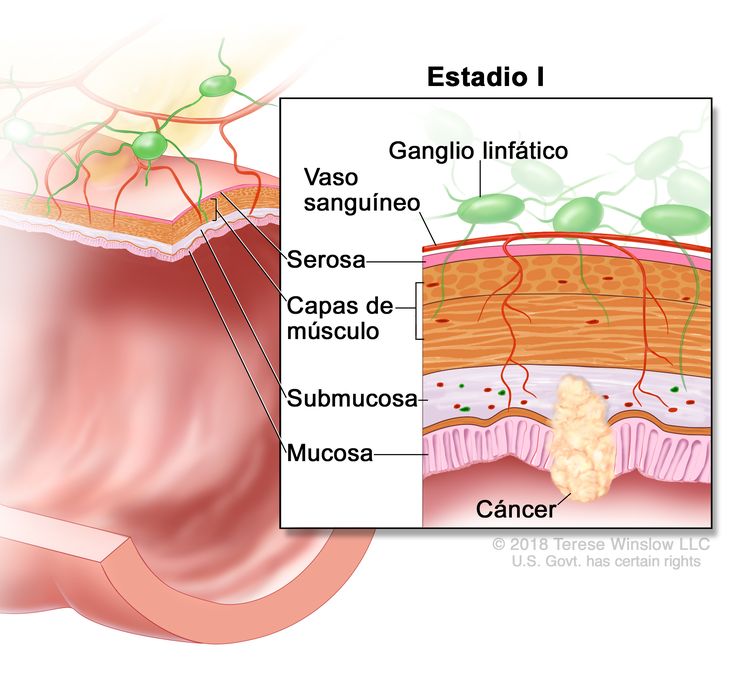 |
| T2 = tumor con invasión de la capa muscular propia. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| Estadio | TNMb,c | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 251–74. | |||
| Las explicaciones de los superíndices b y c están al final del Cuadro 5. | |||
| IIA | T3, N0, M0 | T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. |
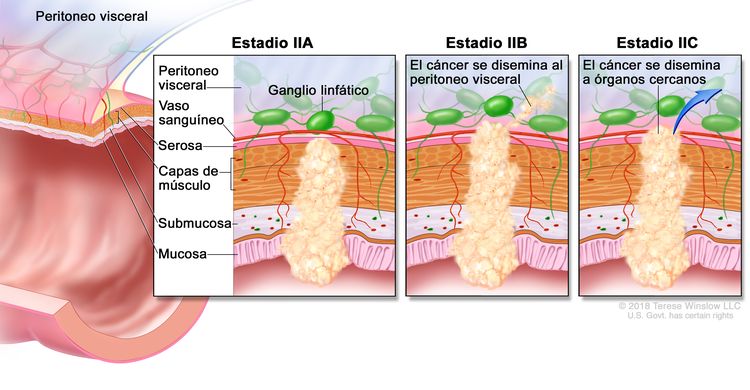 |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| IIB | T4a, N0, M0 | T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión persistente de áreas inflamatorias en la superficie del peritoneo visceral). | |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| IIC | T4b, N0, M0 | T4b = tumor con invasión directa o adherencia a órganos o estructuras adyacentes. | |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| Estadio | TNMb,c | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 251–74. | |||
| Las explicaciones de los superíndices b y c están al final del Cuadro 5. | |||
| IIIA | T1, N2a, M0 | T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). |
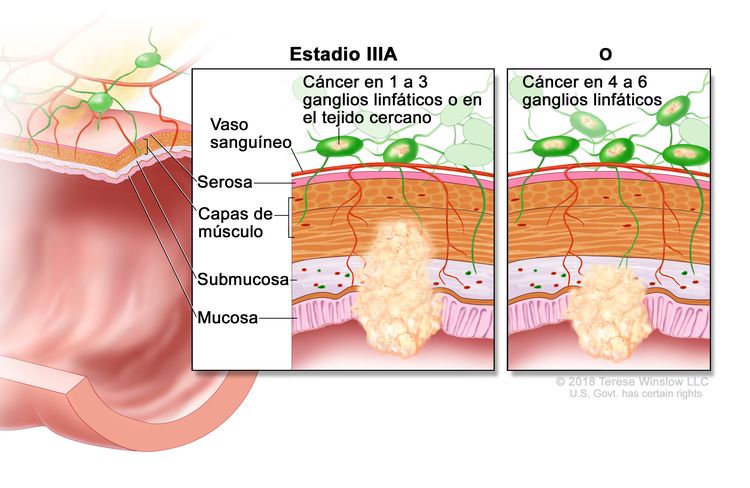 |
| N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T1–2, N1/N1c, M0 | T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). | ||
| T2 = tumor con invasión de la capa muscular propia. | |||
| N1 = compromiso de 1 a 3 ganglios linfáticos regionales (tumor en los ganglios linfáticos regionales que mide ≥0,2 mm), o cualquier cantidad de depósitos tumorales y todos los ganglios linfáticos identificables están libres de compromiso tumoral. | |||
| –N1c = sin compromiso de ganglios linfáticos regionales, pero con depósitos tumorales en la subserosa, el mesenterio, los tejidos pericólicos no peritonealizados o en los tejidos perirrectales o mesorrectales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| IIIB | T1–T2, N2b, M0 | T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). |
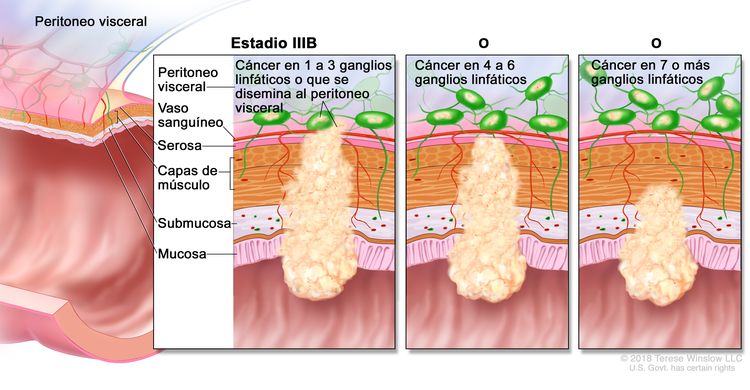 |
| T2 = tumor con invasión de la capa muscular propia. | |||
| N2b = compromiso de 7 o más ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T2–T3, N2a, M0 | T2 = tumor con invasión de la capa muscular propia. | ||
| T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. | |||
| N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T3–T4a, N1/N1c, M0 | T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. | ||
| T4 = tumor con invasión del peritoneo visceral, o con invasión y adherencia a un órgano o estructura adyacente. | |||
| –T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión persistente de áreas inflamatorias en la superficie del peritoneo visceral). | |||
| N1 = compromiso de 1 a 3 ganglios linfáticos regionales (tumor en los ganglios linfáticos regionales que mide ≥0,2 mm), o cualquier cantidad de depósitos tumorales y todos los ganglios linfáticos identificables están libres de compromiso tumoral. | |||
| –N1c = sin compromiso de ganglios linfáticos regionales, pero con depósitos tumorales en la subserosa, el mesenterio, los tejidos pericólicos no peritonealizados o en los tejidos perirrectales o mesorrectales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| IIIC | T3–T4a, N2b, M0 | T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. |
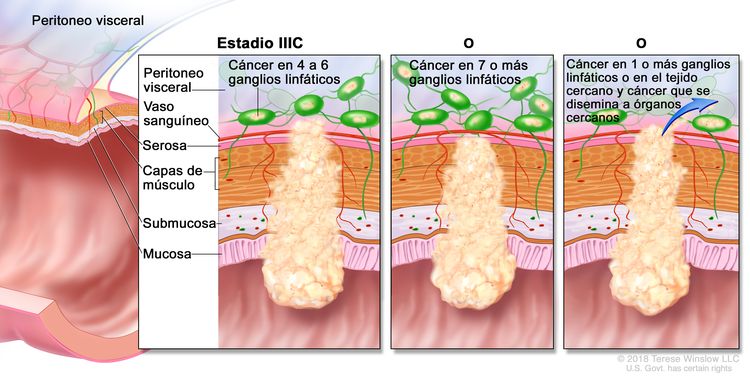 |
| T4 = tumor con invasión del peritoneo visceral, o con invasión y adherencia a un órgano o estructura adyacente. | |||
| –T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión persistente de áreas inflamatorias en la superficie del peritoneo visceral). | |||
| N2b = compromiso de 7 o más ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T4a, N2a, M0 | T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión persistente de áreas inflamatorias en la superficie del peritoneo visceral). | ||
| N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T4b, N1–N2, M0 | T4b = tumor con invasión directa o adherencia a órganos o estructuras adyacentes. | ||
| N1 = compromiso de 1 a 3 ganglios linfáticos regionales (tumor en los ganglios linfáticos regionales que mide ≥0,2 mm), o cualquier cantidad de depósitos tumorales y todos los ganglios linfáticos identificables están libres de compromiso tumoral. | |||
| –N1a = compromiso de 1 ganglio linfático regional. | |||
| –N2b = compromiso de 2 o 3 ganglios linfáticos regionales. | |||
| –N1c = sin compromiso de ganglios linfáticos regionales, pero con depósitos tumorales en la subserosa, el mesenterio, los tejidos pericólicos no peritonealizados o en los tejidos perirrectales o mesorrectales. | |||
| N2 = compromiso de 4 o más ganglios linfáticos regionales. | |||
| –N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| –N2b = compromiso de 7 o más ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| Estadio | TNMb,c | Definición | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 251–74. | |||
| bLa invasión directa en T4 incluye invasión de otros órganos o segmentos colorrectales por diseminación directa a través de la serosa. Esto se confirma mediante un examen microscópico (por ejemplo, un carcinoma de ciego que invade el colon sigmoide) o, en los cánceres retroperitoneales o subperitoneales, por la invasión directa de otros órganos o estructuras al diseminarse fuera de la capa muscular propia (es decir, un tumor en la pared posterior del colon descendente que invade el riñón izquierdo o la pared abdominal lateral; o cáncer de recto a nivel medio o distal con invasión de la próstata, las vesículas seminales, el cuello uterino o la vagina). | |||
| cUn tumor con adherencia macroscópica a otros órganos o estructuras se clasifica como cT4b. Sin embargo, si no hay tumor microscópico en la adherencia, la clasificación debe ser pT1–4a según la profundidad anatómica de la invasión en la pared. Las clasificaciones V y L se deben usar para identificar la presencia o ausencia de invasión vascular o linfática, mientras que el factor pronóstico PN se debe usar para la invasión perineural. | |||
| IVA | Cualquier T, cualquier N, M1a | TX = tumor primario no evaluable. |
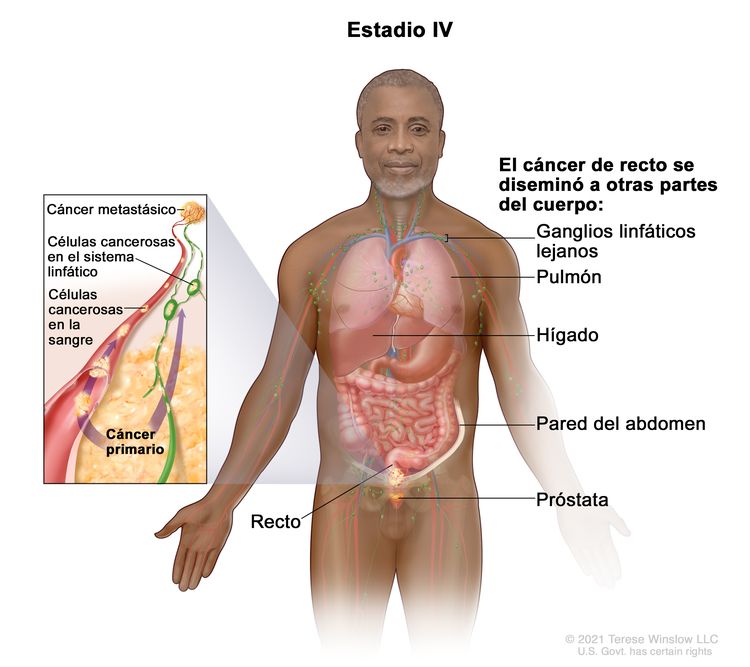 |
| T0 = sin indicios de tumor primario. | |||
| Tis = carcinoma in situ, carcinoma intramucoso (compromiso de la lámina propia sin diseminación a la capa muscular de la mucosa). | |||
| T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). | |||
| T2 = tumor con invasión de la capa muscular propia. | |||
| T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. | |||
| T4 = tumor con invasión del peritoneo visceral, o con invasión y adherencia a un órgano o estructura adyacente. | |||
| –T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión persistente de áreas inflamatorias en la superficie del peritoneo visceral). | |||
| –T4b = tumor con invasión directa o adherencia a órganos o estructuras adyacentes. | |||
| NX = ganglios linfáticos regionales no evaluables. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| N1 = compromiso de 1 a 3 ganglios linfáticos regionales (tumor en los ganglios linfáticos regionales que mide ≥0,2 mm), o cualquier cantidad de depósitos tumorales y todos los ganglios linfáticos identificables están libres de compromiso tumoral. | |||
| –N1a = compromiso de 1 ganglio linfático regional. | |||
| –N1b = compromiso de 2 o 3 ganglios linfáticos regionales. | |||
| –N1c = sin compromiso de ganglios linfáticos regionales, pero con depósitos tumorales en la subserosa, el mesenterio, los tejidos pericólicos no peritonealizados o en los tejidos perirrectales o mesorrectales. | |||
| N2 = compromiso de 4 o más ganglios linfáticos regionales. | |||
| –N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| –N2b = compromiso de 7 o más ganglios linfáticos regionales. | |||
| M1a = se identifica metástasis en un sitio u órgano sin metástasis peritoneal. | |||
| IVB | Cualquier T, cualquier N, M1b | Cualquier T = consultar las descripciones de T en el grupo de estadio TNM para cualquier T, cualquier N, M1a. | |
| Cualquier N = consultar las descripciones de N en el grupo de estadio TNM para cualquier T, cualquier N1, M1a. | |||
| M1b = metástasis en 2 o más sitios u órganos sin metástasis peritoneal. | |||
| IVC | Cualquier T, cualquier N, M1c | Cualquier T = consultar las descripciones de T en el grupo de estadio TNM para cualquier T, cualquier N, M1a. | |
| Cualquier N = consultar las descripciones de N en el grupo de estadio TNM para cualquier T, cualquier N1, M1a. | |||
| M1c = se identifica metástasis en la superficie peritoneal, sola o con metástasis en otros sitios u órganos. | |||
Bibliografía
- Schmidt CR, Gollub MJ, Weiser MR: Contemporary imaging for colorectal cancer. Surg Oncol Clin N Am 16 (2): 369-88, 2007. [PUBMED Abstract]
- Siddiqui AA, Fayiga Y, Huerta S: The role of endoscopic ultrasound in the evaluation of rectal cancer. Int Semin Surg Oncol 3: 36, 2006. [PUBMED Abstract]
- Søreide K: Molecular testing for microsatellite instability and DNA mismatch repair defects in hereditary and sporadic colorectal cancers--ready for prime time? Tumour Biol 28 (5): 290-300, 2007. [PUBMED Abstract]
- Zammit M, Jenkins JT, Urie A, et al.: A technically difficult endorectal ultrasound is more likely to be inaccurate. Colorectal Dis 7 (5): 486-91, 2005. [PUBMED Abstract]
- Libutti SK, Willett CG, Saltz LB: Cancer of the rectum. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1127-41.
- Goldstein MJ, Mitchell EP: Carcinoembryonic antigen in the staging and follow-up of patients with colorectal cancer. Cancer Invest 23 (4): 338-51, 2005. [PUBMED Abstract]
- Das P, Skibber JM, Rodriguez-Bigas MA, et al.: Predictors of tumor response and downstaging in patients who receive preoperative chemoradiation for rectal cancer. Cancer 109 (9): 1750-5, 2007. [PUBMED Abstract]
- Lahaye MJ, Engelen SM, Nelemans PJ, et al.: Imaging for predicting the risk factors--the circumferential resection margin and nodal disease--of local recurrence in rectal cancer: a meta-analysis. Semin Ultrasound CT MR 26 (4): 259-68, 2005. [PUBMED Abstract]
- Balch GC, De Meo A, Guillem JG: Modern management of rectal cancer: a 2006 update. World J Gastroenterol 12 (20): 3186-95, 2006. [PUBMED Abstract]
- Compton CC, Greene FL: The staging of colorectal cancer: 2004 and beyond. CA Cancer J Clin 54 (6): 295-308, 2004 Nov-Dec. [PUBMED Abstract]
- Jessup J, Benson A, Chen V: Colon and Rectum. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 251–74.
- Nelson H, Petrelli N, Carlin A, et al.: Guidelines 2000 for colon and rectal cancer surgery. J Natl Cancer Inst 93 (8): 583-96, 2001. [PUBMED Abstract]
- Swanson RS, Compton CC, Stewart AK, et al.: The prognosis of T3N0 colon cancer is dependent on the number of lymph nodes examined. Ann Surg Oncol 10 (1): 65-71, 2003 Jan-Feb. [PUBMED Abstract]
- Le Voyer TE, Sigurdson ER, Hanlon AL, et al.: Colon cancer survival is associated with increasing number of lymph nodes analyzed: a secondary survey of intergroup trial INT-0089. J Clin Oncol 21 (15): 2912-9, 2003. [PUBMED Abstract]
- Prandi M, Lionetto R, Bini A, et al.: Prognostic evaluation of stage B colon cancer patients is improved by an adequate lymphadenectomy: results of a secondary analysis of a large scale adjuvant trial. Ann Surg 235 (4): 458-63, 2002. [PUBMED Abstract]
- Tepper JE, O'Connell MJ, Niedzwiecki D, et al.: Impact of number of nodes retrieved on outcome in patients with rectal cancer. J Clin Oncol 19 (1): 157-63, 2001. [PUBMED Abstract]
- Greene FL, Stewart AK, Norton HJ: New tumor-node-metastasis staging strategy for node-positive (stage III) rectal cancer: an analysis. J Clin Oncol 22 (10): 1778-84, 2004. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento del cáncer de recto
El tratamiento del cáncer de recto es un poco diferente del tratamiento del cáncer de colon por el riesgo alto de recidiva local y un pronóstico general más precario. Las diferencias abarcan la técnica quirúrgica, el uso de radioterapia y el método de administración de la quimioterapia. Además de determinar la intención de la cirugía del cáncer de recto (es decir, curativa o paliativa), es importante considerar aspectos terapéuticos que permitan mantener o restaurar el funcionamiento normal del esfínter anal, el funcionamiento genitourinario y el funcionamiento sexual.[1,2]
El abordaje de tratamiento del cáncer de recto es multimodal e involucra un equipo multidisciplinario de especialistas en cáncer expertos en gastroenterología, oncología médica, oncología quirúrgica, radioncología y radiología.
Inmunoterapia
Entre los pacientes con adenocarcinomas de recto, del 5 % al 10 % de los tumores exhiben deficiencia en la reparación de errores de emparejamiento o inestabilidad microsatelital alta. Los inhibidores de puntos de control inmunitario son eficaces como terapia de primera línea para el cáncer colorrectal metastásico, con tasas de respuestas general del 30 % al 60 %.[3-5] Se ha comprobado que estas respuestas son duraderas y se ha observado una supervivencia general (SG) prolongada en este entorno.
Evidencia (inmunoterapia):
- En un estudio de fase II (NCT04165772) se estudió el dostarlimab, un anticuerpo monoclonal anti-proteína de muerte celular programada 1 (PD-1), en 12 pacientes con adenocarcinoma de recto localmente avanzado en estadio II o III con deficiencia en la reparación de errores de emparejamiento.[6]
- Los 12 pacientes exhibieron respuestas clínicas completas del 100 % (intervalo de confianza [IC] 95 %, 74 %–100 %) después de una mediana de seguimiento de 12 meses. El cáncer no recidivó en el transcurso de un periodo de seguimiento de 6 a 25 meses. En el momento del seguimiento, se había logrado evitar la quimiorradioterapia y la cirugía.[6][Nivel de evidencia C3]
- Antes de que este abordaje se convierta en un nuevo estándar terapéutico se necesita evaluar a más pacientes. Es necesario usar un periodo de seguimiento más prolongado para asegurar la duración de la respuesta y evaluar la necesidad de cirugía o quimiorradioterapia posterior.
Tratamiento quirúrgico primario
El tratamiento primario para los pacientes de cáncer de recto es la resección quirúrgica del tumor primario. El abordaje quirúrgico del tratamiento varía de acuerdo con los siguientes aspectos:
- Localización del tumor.
- Estadio de la enfermedad.
- La presencia o ausencia de características de riesgo alto (es decir, márgenes con compromiso tumoral, invasión linfovascular, invasión perineural y tipo histológico con diferenciación precaria).
Los tipos de resección quirúrgica son los siguientes:[1,2,7]
- Polipectomía para determinados tipos de cánceres T1.
- Extirpación local transanal y microcirugía endoscópica transanal para determinados tipos de cánceres de recto con estadificación clínica T1/T2 N0.
- Extirpación mesorrectal total con técnicas de conservación neuroautonómica a través de una resección anterior baja.
- Extirpación mesorrectal total a través de una resección abdominoperineal en pacientes que no son aptos para conservación del esfínter lo que implica una colostomía permanente para estos pacientes.
A veces se usa una polipectomía sola para determinados casos (T1) que tienen pólipos con cáncer invasivo que se pueden resecar por completo con márgenes limpios y cuyas características histológicas son favorables.[8,9]
La extirpación local de los tumores en estadio clínico T1 es una técnica quirúrgica aceptable para determinados pacientes seleccionados en forma apropiada. Para el resto de los tumores, la extirpación mesorrectal es el tratamiento preferido. Determinados pacientes con tumores T2 que se seleccionan de forma cuidadosa son aptos para una extirpación local. Se notificaron tasas de fracaso local que oscilan entre el 4 % y el 8 % después de una resección rectal con extirpación mesorrectal apropiada (extirpación mesorrectal total para tumores de recto bajos o medios y extirpación mesorrectal como mínimo 5 cm por debajo del tumor para tumores de recto altos).[10-14]
Para los pacientes con cánceres de recto medio o alto en estadio avanzado, el tratamiento preferido quizás sea una resección anterior baja seguida de anastomosis colorrectal. Sin embargo, en pacientes con cáncer de recto localmente avanzado para los que se indica una resección radical, se prefiere una extirpación mesorrectal total con técnicas de conservación neuroautonómica a través de una resección anterior baja.[1,2]
La incidencia baja de recaída local después de una extirpación mesorrectal meticulosa llevó a que algunos investigadores cuestionaran el uso rutinario de la radioterapia adyuvante. Debido al aumento en la tendencia de que el fracaso primario se presente solamente en sitios locorregionales, el efecto de la radioterapia perioperatoria es más alto en el cáncer de recto que en el cáncer de colon.[15]
Quimiorradioterapia
Quimiorradioterapia preoperatoria
La terapia neoadyuvante para el cáncer de recto con quimiorradioterapia preoperatoria es la opción de tratamiento preferida para los pacientes con enfermedad en estadios II y III. No obstante, la quimiorradioterapia posoperatoria para pacientes con cáncer de recto en estadio II y estadio III sigue siendo una opción aceptable.[16][Nivel de evidencia A1] La terapia neoadyuvante total (quimioterapia seguida de radiación o radiación seguida de quimioterapia) también es una opción.
De acuerdo con los resultados de los estudios enumerados a continuación, la quimiorradioterapia preoperatoria se convirtió en el estándar de atención para los pacientes con enfermedad en estadios clínicos T3–T4 o que tienen compromiso ganglionar (estadios II o III).
- Ensayo del German Rectal Cancer Study Group.[17]
- Ensayo National Surgical Adjuvant Breast and Bowel Project R-03 NSABP R-03 (NCT00410579).[18][Nivel de evidencia A1] Para obtener más información, consultar la sección Tratamiento del cáncer de recto en estadios II y III.
En múltiples estudios de fase II y fase III se examinaron los beneficios de la quimiorradioterapia preoperatoria, entre ellos, los siguientes:[16]
- Regresión tumoral y descenso del estadio del tumor.
- Mejora de la resecabilidad tumoral.
- Tasa más alta de control local.
- Mejora del perfil de toxicidad de la quimiorradioterapia.
- Tasa más alta de conservación del esfínter.
La quimiorradiación permite lograr tasas de respuesta patológica completa del 10 % al 25 %.[19-26] Sin embargo, la radioterapia preoperatoria aumenta las complicaciones en comparación con la cirugía sola. Algunos pacientes de cánceres con riesgo bajo de recidiva local se podrían tratar de modo adecuado con cirugía y quimioterapia adyuvante.[27-30] Para obtener más información sobre estos estudios, consultar la subsección Quimiorradioterapia preoperatoria en la sección Tratamiento del cáncer de recto en estadios II y III.
Quimiorradioterapia posoperatoria
La quimiorradioterapia posoperatoria es el estándar de atención vigente para el cáncer de recto en estadios II y III. No obstante, en los estudios previos a 1990 que se enumeran a continuación, se encontró que la terapia posoperatoria de modalidad combinada aumenta la supervivencia sin enfermedad (SSE) y la SG.
- Ensayo del Gastrointestinal Tumor Study Group (GITSG-7175).
- Ensayo del Mayo/North Central Cancer Treatment Group (NCCTG-794751).
- Ensayo del National Surgical Adjuvant Breast and Bowel Project (NSABP-R-01).
En estudios posteriores se intentó aumentar el beneficio de supervivencia al mejorar la sensibilidad a la radiación e identificar los quimioterapéuticos y sistemas de administración óptimos.
Fluorouracilo (5-FU): en los siguientes estudios se examinaron los métodos óptimos para la administración del 5-FU adyuvante:
- Ensayo intergrupal, protocolo 86-47-51 (MAYO-864751).[31][Nivel de evidencia A1]
- Ensayo intergrupal, protocolo 0114 (INT-0114 [CLB-9081]).[29][Nivel de evidencia A1]
- Ensayo intergrupal, protocolo 0144.[32]
Para obtener información detallada sobre los resultados de estos estudios, consultar la sección Cáncer de recto en estadios II y III.
La quimiorradioterapia posoperatoria aceptable para los pacientes con cáncer de recto en estadios II o III que no se inscriben en ensayos clínicos incluye infusión continua de 5-FU durante la radiación pélvica de 45 a 55 Gy y 4 ciclos de quimioterapia adyuvante de mantenimiento con bolo de 5-FU modulado con leucovorina (LV) o sin esta.
En los hallazgos del ensayo NSABP-R-01 se describe la comparación de la cirugía sola con la cirugía seguida de quimioterapia o radioterapia.[33] Posteriormente, en el estudio NSABP-R-02 (NCT00410579), se analizó si la adición de radioterapia posoperatoria mejoraría la ventaja de supervivencia notificada en R-01.[34][Nivel de evidencia A1]
En el estudio NSABP-R-02, la adición de radioterapia redujo de manera significativa la recidiva local a 5 años (el 8 % para quimiorradioterapia vs. el 13 % para la quimioterapia sola, P = 0,02), pero no se demostró ningún beneficio significativo en términos de supervivencia. La radioterapia mejoró la supervivencia de los pacientes menores de 60 años y los pacientes sometidos a resección abdominoperineal.
Si bien con este ensayo se inició un debate en la comunidad oncológica sobre la función adecuada de la radioterapia posoperatoria, es prematuro concluir que se debe omitir la radioterapia por las graves complicaciones que acarrea una recidiva locorregional.
Regímenes de quimioterapia
En el Cuadro 7 se describen los regímenes de quimioterapia utilizados para tratar el cáncer de recto.
| Nombre del régimen | Combinación farmacológica | Dosis |
|---|---|---|
| 5-FU = fluorouracilo; AIO = Arbeitsgemeinschaft Internistische Onkologie; IV = intravenoso; LV = leucovorina. | ||
| AIO o AIO alemán | LV, 5-FU e irinotecán | Irinotecán (100 mg/m2) y LV (500 mg/m2) administrados en una infusión de 2 horas el día 1, seguidos de 5-FU (2000 mg/m2) en bolo IV administrado cada semana por bomba ambulatoria durante 24 horas, 4 veces por año (52 semanas). |
| CAPOX | Capecitabina y oxaliplatino | Capecitabina (1000 mg/m2) 2 veces al día los días 1–14 y oxaliplatino (70 mg/m2) los días 1 y 8 cada 3 semanas. |
| Douillard | LV, 5-FU e irinotecán | Irinotecán (180 mg/m2) administrado en una infusión de 2 horas el día 1, LV (200 mg/m2) administrada en una infusión de 2 horas los días 1 y 2, seguida de una dosis de carga de 5-FU (400 mg/m2) en bolo IV, luego 5-FU (600 mg/m2) administrado por bomba ambulatoria durante 22 horas cada 2 semanas los días 1 y 2. |
| FOLFIRI | LV, 5-FU e irinotecán | Irinotecán (180 mg/m2) y LV (400 mg/m2) administrados en una infusión de 2 horas el día 1, seguidos de una dosis de carga de 5-FU (400 mg/m2) administrada en bolo IV el día 1, luego 5-FU (2400–3000 mg/m2) administrado por bomba ambulatoria durante 46 horas cada 2 semanas. |
| FOLFOX4 | Oxaliplatino, LV y 5-FU | Oxaliplatino (85 mg/m2) administrado en una infusión de 2 horas el día 1, LV (200 mg/m2) administrada en una infusión de 2 horas los días 1 y 2, seguida de una dosis de carga de 5-FU (400 mg/m2) en bolo IV, luego 5-FU (600 mg/m2) administrado por bomba ambulatoria durante 22 horas cada 2 semanas los días 1 y 2. |
| FOLFOX6 | Oxaliplatino, LV y 5-FU | Oxaliplatino (85–100 mg/m2) y LV (400 mg/m2) administrados en una infusión de 2 horas el día 1, seguidos de una dosis de carga de 5-FU (400 mg/m2) en bolo IV el día 1, luego 5-FU (2400–3000 mg/m2) administrado por bomba ambulatoria durante 46 horas cada 2 semanas. |
| FOLFOXIRI | Irinotecán, oxaliplatino, LV y 5-FU | Irinotecán (165 mg/m2) administrado en una infusión de 60 minutos, seguida de una infusión simultánea de oxaliplatino (85 mg/m2) y LV (200 mg/m2) durante 120 minutos, seguidos de 5-FU (3200 mg/m2) administrado en una infusión continua durante 48 horas. |
| FUFOX | 5-FU, LV y oxaliplatino | Oxaliplatino (50 mg/m2), LV (500 mg/m2) y 5-FU (2000 mg/m2) administrados en una infusión continua durante 22 horas los días 1, 8, 22 y 29 cada 36 días. |
| FUOX | 5-FU y oxaliplatino | 5-FU (2250 mg/m2) administrado en una infusión continua durante 48 horas los días 1, 8, 15, 22, 29 y 36 con oxaliplatino (85 mg/m2) los días 1, 15 y 29 cada 6 semanas. |
| IFL (o Saltz) | Irinotecán, 5-FU y LV | Irinotecán (125 mg/m2) y 5-FU (500 mg/m2) en bolo IV, con LV (20 mg/m2) en bolo IV administrada cada semana durante 4 de 6 semanas. |
| XELOX | Capecitabina y oxaliplatino | Capecitabina oral (1000 mg/m2) administrada 2 veces al día durante 14 días y oxaliplatino (130 mg/m2) el día 1 cada 3 semanas. |
Terapia neoadyuvante total
Los datos respaldan la administración neoadyuvante de radioterapia y quimioterapia.
En el ensayo RAPIDO (NCT01558921) se asignó al azar a 920 pacientes a recibir ciclo corto de quimiorradioterapia seguido de 6 ciclos de CAPOX (capecitabina y oxaliplatino) o 9 ciclos de FOLFOX (LV, 5-FU y oxaliplatino) seguidos de cirugía, o ciclo prolongado de quimiorradioterapia seguido de cirugía con la opción de añadir quimioterapia adyuvante. El criterio principal de valoración fue el fracaso del tratamiento relacionado con la enfermedad a los 3 años (definido como la primera aparición de fracaso locorregional, metástasis a distancia, nuevo tumor colorrectal primario o muerte relacionada con el tratamiento). La tasa de fracaso del tratamiento relacionado con la enfermedad a los 3 años fue del 23,7 % (IC 95 %, 19,8–27,6 %) en el grupo de ciclo corto de quimiorradioterapia y un 30,4 % (IC 95 %, 26,1–34,6 %) en el grupo de ciclo prolongado de quimiorradioterapia (cociente de riesgos instantáneos [CRI], 0,75; IC 95 %, 0,60–0,95; P = 0,019).[35][Nivel de evidencia B1]
En el estudio francés aleatorizado de fase III UNICANCER-PRODIGE 23 (NCT01804790) se asignó al azar a 461 pacientes a recibir 6 ciclos de FOLFIRINOX (LV, 5-FU, irinotecán y oxaliplatino) seguidos de quimiorradioterapia (grupo experimental) o quimiorradioterapia (grupo de atención estándar). Los pacientes de ambos grupos se sometieron a una extirpación mesorrectal total. No se trataba de un ensayo de terapia neoadyuvante total, ya que los dos grupos también recibieron quimioterapia adyuvante con FOLFOX modificado o capecitabina durante 3 meses (grupo experimental) o 6 meses (grupo de atención estándar). La tasa de SSE a 3 años fue del 76 % (IC 95 %, 69–81 %) en el grupo experimental y del 69 % (IC 95 %, 62–74%) en el grupo de atención estándar (CRI estratificado, 0,69; IC 95 %, 0,49–0,97; P = 0,034).[36][Nivel de evidencia B1]
El abordaje de la terapia neoadyuvante total se estudió en ensayos clínicos porque los datos mostraron que muchos pacientes no recibieron toda la quimioterapia recomendada cuando se administró después de la cirugía. Por ejemplo, en el ensayo OPRA (NCT02008656), en el que se usó un abordaje de terapia neoadyuvante total, alrededor del 85 % de los pacientes recibieron toda la quimioterapia recomendada, lo que es una mejora del cumplimiento con respecto a los ensayos en los que se usó quimioterapia adyuvante. Otro beneficio potencial de este abordaje es que permite que más pacientes reciban un tratamiento no quirúrgico (también conocido como conducta expectante), que se describe con más detalle a continuación. Este abordaje puede ser interesante para los pacientes que, de otro modo, necesitarían una resección abdominoperineal, que conlleva la necesidad de un estoma de por vida.[37,38][Nivel de evidencia B1]
Es posible omitir la radioterapia en determinados pacientes con cáncer de recto localmente avanzado si reciben quimioterapia intensiva, pero seguirán necesitando una extirpación mesorrectal total. En el ensayo PROSPECT (NCT01515787) se asignó al azar a 1194 pacientes a recibir quimioterapia FOLFOX neoadyuvante (con administración de quimiorradioterapia solo si el tumor primario disminuye de tamaño en <20 % o si FOLFOX se interrumpió debido a los efectos secundarios) o quimiorradioterapia neoadyuvante estándar. Todos los pacientes se sometieron a cirugía y tuvieron la opción de recibir FOLFOX adyuvante (4 o 6 ciclos para el grupo de quimioterapia neoadyuvante y 8 ciclos para el grupo de quimiorradioterapia neoadyuvante). La población del estudio incluyó a pacientes con enfermedad T2 con compromiso ganglionar; T3, N0; o T3 con compromiso ganglionar que cumplían los requisitos para someterse a una cirugía con conservación del esfínter (por lo tanto, se excluyó a la mayoría de los pacientes con tumores rectales bajos). Este estudio concluyó que la omisión de la radioterapia era posible en determinados pacientes sin comprometer los resultados oncológicos, con base en un diseño de estudio de no inferioridad. Cabe señalar que, en Europa, muchos pacientes con enfermedad T3, N0 no se someten a ningún tratamiento neoadyuvante antes de la resección. La omisión de la radiación es beneficiosa para los pacientes que deseen preservar la fertilidad.[39]
La terapia neoadyuvante total es, en la actualidad, el abordaje de preferencia para la mayoría de los pacientes con cáncer de recto localmente avanzado sin metástasis a distancia.
Toxicidad del tratamiento
Los efectos secundarios agudos de la radioterapia dirigida a la pelvis para el cáncer de recto se derivan casi siempre de la toxicidad gastrointestinal, son autoinvolutivos y, por lo general, se resuelven de manera espontánea 4 a 6 semanas después de terminar el tratamiento.
La mayor preocupación es la posibilidad de morbilidad tardía después del tratamiento del cáncer de recto. Los pacientes de cáncer de recto sometidos a procedimientos quirúrgicos radicales a veces presentan síntomas crónicos, en particular si hay una deficiencia del esfínter anal.[40] Los pacientes que reciben radioterapia tienen más disfunción intestinal crónica, disfunción del esfínter anorrectal (si el esfínter se conservó quirúrgicamente) y disfunción sexual que los pacientes sometidos a una resección quirúrgica sola.[28,41-46]
En un análisis de pacientes tratados con quimiorradioterapia posoperatoria se indica que estos pacientes a veces presentan más disfunción intestinal crónica que los pacientes sometidos a resección quirúrgica sola.[47] En una revisión de Cochrane, se destacan los riesgos de aumento en la morbilidad quirúrgica, así como la relación entre la radioterapia y los efectos tardíos en el funcionamiento rectal y sexual.[40]
Los avances de las técnicas y la planificación de la radiación quizás permitan reducir al mínimo estas complicaciones agudas y tardías relacionadas con el tratamiento. Estas técnicas son las siguientes:[48-52]
- Máquinas de radiación de alta energía.
- Múltiples campos de radiación en la pelvis.
- Posicionamiento de los pacientes en decúbito prono.
- Moldes hechos a la medida del paciente (inmovilizadores abdominales) para inmovilizar a los pacientes y excluir de los campos de radiación la mayor cantidad de intestino delgado posible.
- Distensión vesical durante la radioterapia para excluir de los campos de radiación la mayor cantidad de intestino delgado posible.
- Visualización del intestino delgado mediante contraste oral durante la planificación del tratamiento para que cuando sea posible se excluya el intestino delgado del campo de radiación.
- Técnicas tridimensionales u otras técnicas avanzadas de planificación de la radiación.
Ciclo largo de radioterapia versus ciclo corto de radioterapia
Se suelen usar los siguientes abordajes para la radioterapia:
- Ciclo largo de quimiorradioterapia (por lo general, a dosis de 50,4–54 Gy), comúnmente administrado con capecitabina o 5-FU/LV.
- Ciclo corto de radioterapia (25 Gy en 5 fracciones), por lo general administrado sin quimioterapia.
En Europa, es habitual administrar radioterapia preoperatoria sola en 1 semana (5 Gy × 5 tratamientos diarios) seguida de cirugía una semana después, en lugar del abordaje de ciclo prolongado de quimiorradioterapia utilizado en los Estados Unidos. Una de las razones de esta diferencia es la preocupación que existe en los Estados Unidos por el aumento de los efectos tardíos cuando se administran dosis altas de radiación por fracción.
En un estudio polaco se asignó al azar a 316 pacientes a recibir ciclos prolongados de quimiorradioterapia preoperatoria (50,4 Gy en 28 fracciones diarias con 5-FU/LV) o radioterapia de ciclo corto preoperatoria (25 Gy en 5 fracciones).[46] Aunque el criterio principal de valoración fue la conservación del esfínter, la toxicidad tardía no fue significativamente diferente desde el punto de vista estadístico entre los dos enfoques de tratamiento (7 % para el grupo de tratamiento prolongado vs. el 10 % para el grupo de tratamiento de ciclo corto). Cabe señalar que no se comunicaron datos sobre el esfínter anal ni la función sexual, y que la toxicidad fue determinada por el médico, no por el paciente.
La elección del ciclo largo de radioterapia versus el de corta duración para el cáncer de recto es un área de estudio activo, y no se sabe cuál es superior. En general, el ciclo prolongado de quimiorradioterapia permite administrar al paciente una dosis biológicamente equivalente más alta (junto con la quimiosensibilización, normalmente con capecitabina o 5-FU), lo que teóricamente mejoraría el control local. Esto está respaldado por el ensayo RAPIDO, en el que se observó una mayor tasa de recidiva local en los pacientes que recibieron ciclo corto de radioterapia en lugar de los que recibieron ciclo largo de quimiorradioterapia.[35]
Por otra parte, el ciclo corto de radioterapia requiere una interrupción más breve del tratamiento sistémico más potente. Por lo tanto, si un paciente tiene un riesgo relativamente mayor de recidiva local que de recidiva a distancia, puede preferirse el ciclo prolongado de quimiorradioterapia, pero si el paciente tiene un riesgo mayor de recidiva a distancia, quizás se prefiera la terapia de corta duración para permitir un retorno más rápido a la quimioterapia. Muchos médicos tampoco ofrecen quimiorradioterapia de corta duración cuando se utiliza un abordaje de tratamiento no quirúrgico, ya que no se ha estudiado, y también debido a que las tasas de control local son potencialmente más bajas, lo que es consecuencia de la dosis biológicamente equivalente más baja, en comparación con el ciclo prolongado de quimiorradioterapia. Todavía está en evaluación la secuencia óptima de radioterapia y quimioterapia cuando se administran como parte de una terapia neoadyuvante total. También hay algunas situaciones clínicas en las que el ciclo corto de quimiorradioterapia tal vez no sea preferible, como cuando hay un endoprótesis rectal (que puede provocar mayores efectos tóxicos rectales).
Administración de capecitabina y fluorouracilo
El gen DPYD codifica la enzima que cataboliza las pirimidinas y las fluoropirimidinas, como la capecitabina y el fluorouracilo. Se estima que entre el 1 % y el 2 % de la población tiene variantes defectuosas de DPYD que reducen la función de la proteína DPD y la acumulación de pirimidinas y fluoropirimidinas en el cuerpo.[53,54] Los pacientes con la variante DPYD*2A que reciben fluoropirimidinas quizás presenten efectos tóxicos graves que ponen en riesgo la salud, y a veces son mortales. Se han identificado muchas otras variantes de DPYD, con diferentes efectos clínicos.[53-55] Es posible que se recomiende evitar la fluoropirimidina o reducir la dosis al 50 % según el genotipo DPYD del paciente y el número de alelos funcionales de DPYD.[56-58] Las pruebas genéticas para DPYD cuestan menos de $200, pero la cobertura del seguro varía debido a la falta de directrices nacionales.[59] Además, es posible que las pruebas retrasen el tratamiento por 2 semanas, lo que no sería aconsejable en casos de urgencia. Este tema es objeto de controversia y requiere evaluación adicional.[60]
Bibliografía
- Balch GC, De Meo A, Guillem JG: Modern management of rectal cancer: a 2006 update. World J Gastroenterol 12 (20): 3186-95, 2006. [PUBMED Abstract]
- Baxter NN, Garcia-Aguilar J: Organ preservation for rectal cancer. J Clin Oncol 25 (8): 1014-20, 2007. [PUBMED Abstract]
- Le DT, Uram JN, Wang H, et al.: PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med 372 (26): 2509-20, 2015. [PUBMED Abstract]
- Overman MJ, Lonardi S, Wong KYM, et al.: Durable Clinical Benefit With Nivolumab Plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer. J Clin Oncol 36 (8): 773-779, 2018. [PUBMED Abstract]
- André T, Shiu KK, Kim TW, et al.: Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med 383 (23): 2207-2218, 2020. [PUBMED Abstract]
- Cercek A, Lumish M, Sinopoli J, et al.: PD-1 Blockade in Mismatch Repair-Deficient, Locally Advanced Rectal Cancer. N Engl J Med 386 (25): 2363-2376, 2022. [PUBMED Abstract]
- Guillem JG, Cohen AM: Current issues in colorectal cancer surgery. Semin Oncol 26 (5): 505-13, 1999. [PUBMED Abstract]
- Cooper HS, Deppisch LM, Gourley WK, et al.: Endoscopically removed malignant colorectal polyps: clinicopathologic correlations. Gastroenterology 108 (6): 1657-65, 1995. [PUBMED Abstract]
- Seitz U, Bohnacker S, Seewald S, et al.: Is endoscopic polypectomy an adequate therapy for malignant colorectal adenomas? Presentation of 114 patients and review of the literature. Dis Colon Rectum 47 (11): 1789-96; discussion 1796-7, 2004. [PUBMED Abstract]
- MacFarlane JK, Ryall RD, Heald RJ: Mesorectal excision for rectal cancer. Lancet 341 (8843): 457-60, 1993. [PUBMED Abstract]
- Enker WE, Thaler HT, Cranor ML, et al.: Total mesorectal excision in the operative treatment of carcinoma of the rectum. J Am Coll Surg 181 (4): 335-46, 1995. [PUBMED Abstract]
- Zaheer S, Pemberton JH, Farouk R, et al.: Surgical treatment of adenocarcinoma of the rectum. Ann Surg 227 (6): 800-11, 1998. [PUBMED Abstract]
- Heald RJ, Smedh RK, Kald A, et al.: Abdominoperineal excision of the rectum--an endangered operation. Norman Nigro Lectureship. Dis Colon Rectum 40 (7): 747-51, 1997. [PUBMED Abstract]
- Lopez-Kostner F, Lavery IC, Hool GR, et al.: Total mesorectal excision is not necessary for cancers of the upper rectum. Surgery 124 (4): 612-7; discussion 617-8, 1998. [PUBMED Abstract]
- Gunderson LL, Sosin H: Areas of failure found at reoperation (second or symptomatic look) following "curative surgery" for adenocarcinoma of the rectum. Clinicopathologic correlation and implications for adjuvant therapy. Cancer 34 (4): 1278-92, 1974. [PUBMED Abstract]
- Sauer R, Becker H, Hohenberger W, et al.: Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 351 (17): 1731-40, 2004. [PUBMED Abstract]
- Sauer R, Liersch T, Merkel S, et al.: Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol 30 (16): 1926-33, 2012. [PUBMED Abstract]
- Roh MS, Colangelo LH, O'Connell MJ, et al.: Preoperative multimodality therapy improves disease-free survival in patients with carcinoma of the rectum: NSABP R-03. J Clin Oncol 27 (31): 5124-30, 2009. [PUBMED Abstract]
- Janjan NA, Khoo VS, Abbruzzese J, et al.: Tumor downstaging and sphincter preservation with preoperative chemoradiation in locally advanced rectal cancer: the M. D. Anderson Cancer Center experience. Int J Radiat Oncol Biol Phys 44 (5): 1027-38, 1999. [PUBMED Abstract]
- Crane CH, Skibber JM, Birnbaum EH, et al.: The addition of continuous infusion 5-FU to preoperative radiation therapy increases tumor response, leading to increased sphincter preservation in locally advanced rectal cancer. Int J Radiat Oncol Biol Phys 57 (1): 84-9, 2003. [PUBMED Abstract]
- Grann A, Minsky BD, Cohen AM, et al.: Preliminary results of preoperative 5-fluorouracil, low-dose leucovorin, and concurrent radiation therapy for clinically resectable T3 rectal cancer. Dis Colon Rectum 40 (5): 515-22, 1997. [PUBMED Abstract]
- Rich TA, Skibber JM, Ajani JA, et al.: Preoperative infusional chemoradiation therapy for stage T3 rectal cancer. Int J Radiat Oncol Biol Phys 32 (4): 1025-9, 1995. [PUBMED Abstract]
- Chari RS, Tyler DS, Anscher MS, et al.: Preoperative radiation and chemotherapy in the treatment of adenocarcinoma of the rectum. Ann Surg 221 (6): 778-86; discussion 786-7, 1995. [PUBMED Abstract]
- Hyams DM, Mamounas EP, Petrelli N, et al.: A clinical trial to evaluate the worth of preoperative multimodality therapy in patients with operable carcinoma of the rectum: a progress report of National Surgical Breast and Bowel Project Protocol R-03. Dis Colon Rectum 40 (2): 131-9, 1997. [PUBMED Abstract]
- Bosset JF, Magnin V, Maingon P, et al.: Preoperative radiochemotherapy in rectal cancer: long-term results of a phase II trial. Int J Radiat Oncol Biol Phys 46 (2): 323-7, 2000. [PUBMED Abstract]
- Hiotis SP, Weber SM, Cohen AM, et al.: Assessing the predictive value of clinical complete response to neoadjuvant therapy for rectal cancer: an analysis of 488 patients. J Am Coll Surg 194 (2): 131-5; discussion 135-6, 2002. [PUBMED Abstract]
- Lai LL, Fuller CD, Kachnic LA, et al.: Can pelvic radiotherapy be omitted in select patients with rectal cancer? Semin Oncol 33 (6 Suppl 11): S70-4, 2006. [PUBMED Abstract]
- Peeters KC, van de Velde CJ, Leer JW, et al.: Late side effects of short-course preoperative radiotherapy combined with total mesorectal excision for rectal cancer: increased bowel dysfunction in irradiated patients--a Dutch colorectal cancer group study. J Clin Oncol 23 (25): 6199-206, 2005. [PUBMED Abstract]
- Tepper JE, O'Connell M, Niedzwiecki D, et al.: Adjuvant therapy in rectal cancer: analysis of stage, sex, and local control--final report of intergroup 0114. J Clin Oncol 20 (7): 1744-50, 2002. [PUBMED Abstract]
- Gunderson LL, Sargent DJ, Tepper JE, et al.: Impact of T and N stage and treatment on survival and relapse in adjuvant rectal cancer: a pooled analysis. J Clin Oncol 22 (10): 1785-96, 2004. [PUBMED Abstract]
- O'Connell MJ, Martenson JA, Wieand HS, et al.: Improving adjuvant therapy for rectal cancer by combining protracted-infusion fluorouracil with radiation therapy after curative surgery. N Engl J Med 331 (8): 502-7, 1994. [PUBMED Abstract]
- Smalley SR, Benedetti JK, Williamson SK, et al.: Phase III trial of fluorouracil-based chemotherapy regimens plus radiotherapy in postoperative adjuvant rectal cancer: GI INT 0144. J Clin Oncol 24 (22): 3542-7, 2006. [PUBMED Abstract]
- Fisher B, Wolmark N, Rockette H, et al.: Postoperative adjuvant chemotherapy or radiation therapy for rectal cancer: results from NSABP protocol R-01. J Natl Cancer Inst 80 (1): 21-9, 1988. [PUBMED Abstract]
- Wolmark N, Wieand HS, Hyams DM, et al.: Randomized trial of postoperative adjuvant chemotherapy with or without radiotherapy for carcinoma of the rectum: National Surgical Adjuvant Breast and Bowel Project Protocol R-02. J Natl Cancer Inst 92 (5): 388-96, 2000. [PUBMED Abstract]
- Bahadoer RR, Dijkstra EA, van Etten B, et al.: Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol 22 (1): 29-42, 2021. [PUBMED Abstract]
- Conroy T, Bosset JF, Etienne PL, et al.: Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 22 (5): 702-715, 2021. [PUBMED Abstract]
- Verheij FS, Omer DM, Williams H, et al.: Long-Term Results of Organ Preservation in Patients With Rectal Adenocarcinoma Treated With Total Neoadjuvant Therapy: The Randomized Phase II OPRA Trial. J Clin Oncol 42 (5): 500-506, 2024. [PUBMED Abstract]
- Garcia-Aguilar J, Patil S, Gollub MJ, et al.: Organ Preservation in Patients With Rectal Adenocarcinoma Treated With Total Neoadjuvant Therapy. J Clin Oncol 40 (23): 2546-2556, 2022. [PUBMED Abstract]
- Schrag D, Weiser M, Saltz L, et al.: Challenges and solutions in the design and execution of the PROSPECT Phase II/III neoadjuvant rectal cancer trial (NCCTG N1048/Alliance). Clin Trials 16 (2): 165-175, 2019. [PUBMED Abstract]
- Wong RK, Tandan V, De Silva S, et al.: Pre-operative radiotherapy and curative surgery for the management of localized rectal carcinoma. Cochrane Database Syst Rev (2): CD002102, 2007. [PUBMED Abstract]
- Randomised trial of surgery alone versus surgery followed by radiotherapy for mobile cancer of the rectum. Medical Research Council Rectal Cancer Working Party. Lancet 348 (9042): 1610-4, 1996. [PUBMED Abstract]
- Initial report from a Swedish multicentre study examining the role of preoperative irradiation in the treatment of patients with resectable rectal carcinoma. Swedish Rectal Cancer Trial. Br J Surg 80 (10): 1333-6, 1993. [PUBMED Abstract]
- Dahlberg M, Glimelius B, Graf W, et al.: Preoperative irradiation affects functional results after surgery for rectal cancer: results from a randomized study. Dis Colon Rectum 41 (5): 543-9; discussion 549-51, 1998. [PUBMED Abstract]
- Birgisson H, Påhlman L, Gunnarsson U, et al.: Adverse effects of preoperative radiation therapy for rectal cancer: long-term follow-up of the Swedish Rectal Cancer Trial. J Clin Oncol 23 (34): 8697-705, 2005. [PUBMED Abstract]
- Marijnen CA, van de Velde CJ, Putter H, et al.: Impact of short-term preoperative radiotherapy on health-related quality of life and sexual functioning in primary rectal cancer: report of a multicenter randomized trial. J Clin Oncol 23 (9): 1847-58, 2005. [PUBMED Abstract]
- Bujko K, Nowacki MP, Nasierowska-Guttmejer A, et al.: Long-term results of a randomized trial comparing preoperative short-course radiotherapy with preoperative conventionally fractionated chemoradiation for rectal cancer. Br J Surg 93 (10): 1215-23, 2006. [PUBMED Abstract]
- Kollmorgen CF, Meagher AP, Wolff BG, et al.: The long-term effect of adjuvant postoperative chemoradiotherapy for rectal carcinoma on bowel function. Ann Surg 220 (5): 676-82, 1994. [PUBMED Abstract]
- Martling A, Holm T, Johansson H, et al.: The Stockholm II trial on preoperative radiotherapy in rectal carcinoma: long-term follow-up of a population-based study. Cancer 92 (4): 896-902, 2001. [PUBMED Abstract]
- Dahlberg M, Glimelius B, Påhlman L: Improved survival and reduction in local failure rates after preoperative radiotherapy: evidence for the generalizability of the results of Swedish Rectal Cancer Trial. Ann Surg 229 (4): 493-7, 1999. [PUBMED Abstract]
- Guerrero Urbano MT, Henrys AJ, Adams EJ, et al.: Intensity-modulated radiotherapy in patients with locally advanced rectal cancer reduces volume of bowel treated to high dose levels. Int J Radiat Oncol Biol Phys 65 (3): 907-16, 2006. [PUBMED Abstract]
- Koelbl O, Richter S, Flentje M: Influence of patient positioning on dose-volume histogram and normal tissue complication probability for small bowel and bladder in patients receiving pelvic irradiation: a prospective study using a 3D planning system and a radiobiological model. Int J Radiat Oncol Biol Phys 45 (5): 1193-8, 1999. [PUBMED Abstract]
- Gunderson LL, Russell AH, Llewellyn HJ, et al.: Treatment planning for colorectal cancer: radiation and surgical techniques and value of small-bowel films. Int J Radiat Oncol Biol Phys 11 (7): 1379-93, 1985. [PUBMED Abstract]
- Sharma BB, Rai K, Blunt H, et al.: Pathogenic DPYD Variants and Treatment-Related Mortality in Patients Receiving Fluoropyrimidine Chemotherapy: A Systematic Review and Meta-Analysis. Oncologist 26 (12): 1008-1016, 2021. [PUBMED Abstract]
- Lam SW, Guchelaar HJ, Boven E: The role of pharmacogenetics in capecitabine efficacy and toxicity. Cancer Treat Rev 50: 9-22, 2016. [PUBMED Abstract]
- Shakeel F, Fang F, Kwon JW, et al.: Patients carrying DPYD variant alleles have increased risk of severe toxicity and related treatment modifications during fluoropyrimidine chemotherapy. Pharmacogenomics 22 (3): 145-155, 2021. [PUBMED Abstract]
- Amstutz U, Henricks LM, Offer SM, et al.: Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing: 2017 Update. Clin Pharmacol Ther 103 (2): 210-216, 2018. [PUBMED Abstract]
- Henricks LM, Lunenburg CATC, de Man FM, et al.: DPYD genotype-guided dose individualisation of fluoropyrimidine therapy in patients with cancer: a prospective safety analysis. Lancet Oncol 19 (11): 1459-1467, 2018. [PUBMED Abstract]
- Lau-Min KS, Varughese LA, Nelson MN, et al.: Preemptive pharmacogenetic testing to guide chemotherapy dosing in patients with gastrointestinal malignancies: a qualitative study of barriers to implementation. BMC Cancer 22 (1): 47, 2022. [PUBMED Abstract]
- Brooks GA, Tapp S, Daly AT, et al.: Cost-effectiveness of DPYD Genotyping Prior to Fluoropyrimidine-based Adjuvant Chemotherapy for Colon Cancer. Clin Colorectal Cancer 21 (3): e189-e195, 2022. [PUBMED Abstract]
- Baker SD, Bates SE, Brooks GA, et al.: DPYD Testing: Time to Put Patient Safety First. J Clin Oncol 41 (15): 2701-2705, 2023. [PUBMED Abstract]
Tratamiento del cáncer de recto en estadio 0
Opciones de tratamiento del cáncer de recto en estadio 0
El cáncer de recto en estadio 0 o carcinoma in situ es el tipo de lesión rectal más superficial y se limita a la mucosa sin invasión de la lámina propia.
La opción de tratamiento del cáncer de recto en estadio 0 es la siguiente:
Polipectomía o cirugía
Para los tumores del cáncer de recto en estadio 0, a veces se indica la extirpación local o la polipectomía simple.[1] Debido a su naturaleza localizada en el momento de la presentación inicial, el cáncer de recto en estadio 0 tiene una tasa de curación alta. Es posible hacer una resección rectal de espesor completo por vía transanal o transcoccígea para las lesiones grandes que no son susceptibles de extirpación local.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Bailey HR, Huval WV, Max E, et al.: Local excision of carcinoma of the rectum for cure. Surgery 111 (5): 555-61, 1992. [PUBMED Abstract]
Tratamiento del cáncer de recto en estadio I
Opciones de tratamiento del cáncer de recto en estadio I
Los tumores en estadio I se diseminan por debajo de la mucosa dentro de la submucosa (T1) o la pared muscular intestinal (T2), pero no atraviesan la pared. Debido a su naturaleza localizada en el momento de la presentación inicial, el cáncer de recto en estadio I tiene una tasa de curación alta.
La opción de tratamiento del cáncer de recto en estadio I es la siguiente:
Cirugía con quimiorradioterapia o sin esta
Hay 3 opciones posibles para la resección quirúrgica del cáncer de recto en estadio I:
- Extirpación local. La extirpación local se limita a tumores confinados a la pared rectal y que no comprometen el espesor total del recto (es decir, no son tumores T3) según evaluación por ecografía rectal o imágenes por resonancia magnética. El paciente ideal para una extirpación local tiene un tumor T1 con diferenciación de buena a moderada que ocupa menos de un tercio de la circunferencia de la pared intestinal. La extirpación local se relaciona con un riesgo más alto de fracaso local y sistémico y solo se debe realizar en pacientes con tumores T2 seleccionados de manera cuidadosa. A veces se indica una resección local transanal o de otro tipo [1,2] con o sin radioterapia de haz de externo (RHE) perioperatoria y fluorouracilo (5-FU).
- Resección anterior baja. La resección quirúrgica amplia y la anastomosis son opciones cuando se puede realizar una resección anterior baja adecuada con suficiente recto distal como para permitir una anastomosis convencional o una anastomosis coloanal.
- Resección abdominoperineal. La resección quirúrgica amplia con resección abdominoperineal se utiliza para lesiones que son demasiado distales como para permitir una resección anterior baja.
A veces los pacientes con tumores que son patológicamente T1 no necesitan terapia posoperatoria. Los pacientes con tumores T2 o superiores tienen compromiso ganglionar casi el 20 % de las veces. Los pacientes pueden sopesar tratamiento adicional, como radioterapia y quimioterapia o resección quirúrgica amplia del recto.[3] En ocasiones, los pacientes con características histológicas precarias o márgenes con compromiso tumoral después de la extirpación local deben considerar una resección anterior baja o una resección abdominoperineal y tratamiento posoperatorio, según lo dicte la estadificación quirúrgica completa.
Para los pacientes con tumores T1 y T2, no hay ensayos aleatorizados disponibles en los que se comparen la extirpación local con quimiorradioterapia posoperatoria o sin esta y la resección quirúrgica amplia (resección anterior baja y resección abdominoperineal).
Evidencia (cirugía):
- Los investigadores del Cancer and Leukemia Group B inscribieron en el ensayo prospectivo CLB-8984 a pacientes con adenocarcinomas de recto T1 y T2 ubicados a menos de 10 cm de la línea dentada, con diámetro de no más de 4 cm y compromiso de no más del 40 % de la circunferencia rectal. Los pacientes con tumores T1 solo se sometieron a cirugía sin tratamiento adicional, mientras que los pacientes con tumores T2 se trataron con RHE (54 Gy en 30 fracciones, 5 días por semana) y 5-FU (500 mg/m2 los días 1 a 2, y los días 29 a 31 de la radioterapia).[4]
- En el momento de una mediana de seguimiento de 48 meses, la tasa de supervivencia sin fracaso (SSF) a los 6 años de los pacientes con tumores T1 fue del 83 % y la tasa de supervivencia general (SG) fue del 87 %.
- Para los pacientes con tumores T2, la tasa de SSF a los 6 años fue del 71 % y la tasa de SG fue del 85 %.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Bailey HR, Huval WV, Max E, et al.: Local excision of carcinoma of the rectum for cure. Surgery 111 (5): 555-61, 1992. [PUBMED Abstract]
- Benson R, Wong CS, Cummings BJ, et al.: Local excision and postoperative radiotherapy for distal rectal cancer. Int J Radiat Oncol Biol Phys 50 (5): 1309-16, 2001. [PUBMED Abstract]
- Sitzler PJ, Seow-Choen F, Ho YH, et al.: Lymph node involvement and tumor depth in rectal cancers: an analysis of 805 patients. Dis Colon Rectum 40 (12): 1472-6, 1997. [PUBMED Abstract]
- Steele GD, Herndon JE, Bleday R, et al.: Sphincter-sparing treatment for distal rectal adenocarcinoma. Ann Surg Oncol 6 (5): 433-41, 1999 Jul-Aug. [PUBMED Abstract]
Tratamiento del cáncer de recto en estadios II y III
Opciones de tratamiento del cáncer de recto en estadios II y III
Las opciones de tratamiento del cáncer de recto en estadios II y III son las siguientes:
- Quimiorradioterapia preoperatoria.
- Quimioterapia neoadyuvante con FOLFOX sin quimiorradioterapia preoperatoria (para determinados pacientes con enfermedad de riesgo más bajo).
- Ciclo corto de radioterapia preoperatoria seguido de cirugía y quimioterapia.
- Quimiorradioterapia posoperatoria.
- Cirugía.
- Quimiorradioterapia primaria seguida de vigilancia intensiva para pacientes con respuesta clínica completa.
- Inmunoterapia (para pacientes con deficiencia en la reparación de errores de emparejamiento o inestabilidad microsatelital [IMS] alta).
Quimiorradioterapia preoperatoria
De acuerdo con los resultados de varios estudios, la quimiorradioterapia preoperatoria se convirtió en el estándar de atención para los pacientes con enfermedad en estadios clínicos T3–T4 o que tienen compromiso ganglionar. Los resultados de un estudio afirman que el FOLFOX neoadyuvante (leucovorina [LV], fluorouracilo [5-FU] y oxaliplatino) es una alternativa a la quimiorradioterapia para determinados pacientes con enfermedad de riesgo bajo.[1]
Evidencia (quimiorradioterapia preoperatoria):
- En el German Rectal Cancer Study Group (CAO/ARO/AIO-94 [Working Group of Surgical Oncology/Working Group of Radiation Oncology/Working Group of Medical Oncology of the Germany Cancer Society]), se asignó al azar a 823 pacientes con cáncer de recto en estadios T3/T4 o con compromiso ganglionar, estadificados mediante ecografía, a recibir quimiorradioterapia preoperatoria o quimiorradioterapia posoperatoria (50,4 Gy en 28 fracciones diarias dirigidas al tumor y los ganglios linfáticos pélvicos junto con 5-FU en infusión de 1000 mg/m2 al día por 5 días durante la primera y quinta semanas de radioterapia).[2][Nivel de evidencia A1] Todos los pacientes se sometieron a extirpación mesorrectal total y recibieron 4 ciclos adicionales de quimioterapia a base de 5-FU.
- Las tasas de supervivencia general (SG) a 5 años fueron del 76 % para la quimiorradioterapia preoperatoria y del 74 % para la quimiorradioterapia posoperatoria (P = 0,80). La incidencia acumulada a 5 años de recaída local fue del 6 % en los pacientes asignados a quimiorradioterapia preoperatoria y del 13 % en el grupo de quimiorradioterapia posoperatoria (P = 0,006).
- Se presentaron efectos tóxicos agudos de grados 3 o 4 en el 27 % de los pacientes en el grupo de tratamiento preoperatorio y en el 40 % de los pacientes en el grupo de tratamiento posoperatorio (P = 0,001). Las tasas correspondientes de efectos tóxicos a largo plazo fueron del 14 y 24 %, respectivamente (P = 0,01).
- La misma cantidad de pacientes se sometió a resección abdominoperineal en cada grupo. Sin embargo, entre los 194 pacientes con tumores que el cirujano consideró que necesitaban una extirpación abdominoperineal antes de la aleatorización, se logró un aumento estadísticamente significativo de la conservación del esfínter en quienes recibieron quimiorradioterapia preoperatoria (P = 0,004). Estos resultados se actualizaron al cabo de una mediana de seguimiento de 11 años.[3]
- La SG a 10 años fue equivalente en ambos grupos (el 59,6 % en el grupo preoperatorio vs. el 59,9 % en el grupo posoperatorio; P = 0,85). Sin embargo, persiste un beneficio de control local en los pacientes tratados con quimiorradioterapia preoperatoria en comparación con quimiorradioterapia posoperatoria (incidencia acumulada a 10 años de recaída local: el 7,1 % en el grupo preoperatorio vs. el 10,1 % en el grupo posoperatorio; P = 0,048). No se detectaron diferencias significativas en la incidencia acumulada a 10 años de metástasis a distancia o en la supervivencia sin enfermedad (SSE).[3]
- Entre los pacientes asignados al grupo de quimiorradioterapia posoperatoria, el 18 % tenían en realidad una enfermedad en estadio I según la evaluación patológica, y antes se habían sobrevalorado como T3, T4 o N1 según una ecografía endorrectal. Es posible que un número similar de pacientes en el grupo de tratamiento preoperatorio se sobretrataran.
- De manera similar, en el ensayo NSABP R-03 (NCT00410579), se comparó la quimiorradioterapia preoperatoria y posoperatoria en pacientes con cáncer de recto en estadios clínicos T3, T4 o con compromiso ganglionar. La quimioterapia consistió en 5-FU y LV con 45 Gy en 25 fracciones con un refuerzo de 5,4 Gy. Aunque el tamaño de la muestra previsto fue de 900 pacientes, el estudio se cerró de manera anticipada con 267 pacientes por inscripción insuficiente.[4][Nivel de evidencia A1]
- Al cabo de una mediana de seguimiento de 8,4 años, se encontró que la quimiorradioterapia preoperatoria produjo una mejora significativa en la SSE a 5 años (el 64,7 % vs. el 53,4 % para pacientes en posoperatorio; P = 0,011).
- De forma similar al German Rectal Cancer Study, no se observó diferencia significativa en la SG entre los grupos de tratamiento (el 74,5 % para la quimiorradioterapia preoperatoria vs. el 65,6 % para la quimiorradioterapia posoperatoria; P = 0, 065).
Quimioterapia neoadyuvante con FOLFOX sin quimiorradioterapia preoperatoria (para determinados pacientes con enfermedad de riesgo más bajo)
Evidencia (quimioterapia neoadyuvante con FOLFOX sin quimiorradioterapia preoperatoria [para determinados pacientes con enfermedad de riesgo más bajo]):
- En el ensayo PROSPECT (NCT01515787) participaron 1194 pacientes con cáncer de recto en estadio clínico T2 con compromiso ganglionar; T3, N0; o T3 con compromiso ganglionar que eran candidatos para la cirugía con conservación del esfínter. Se asignaron al azar 1128 pacientes para recibir FOLFOX neoadyuvante FOLFOX (6 ciclos) o quimiorradioterapia.[1][Nivel de evidencia B1]
- Los pacientes del grupo de FOLFOX neoadyuvante que tuvieron una respuesta clínica inferior al 20 % tras la reestadificación o que no pudieron tolerar, al menos, 5 ciclos de FOLFOX fueron seleccionados para recibir quimiorradioterapia. El FOLFOX neoadyuvante con el uso selectivo de quimiorradioterapia pélvica sola no fue inferior a la quimiorradioterapia pélvica neoadyuvante inicial para la supervivencia sin enfermedad (SSE) (cociente de riesgos instantáneos [CRI]recidiva de la enfermedad o muerte, 0,92; intervalo de confianza [IC] 90,2 %, 0,74–1,14; P = 0,005 para la ausencia de inferioridad).[1]
Estos resultados demuestran que el uso de 6 ciclos de FOLFOX, en lugar de quimiorradioterapia neoadyuvante, es una opción aceptable para esta población de pacientes, que se considera que representa potencialmente más de la mitad de todos los pacientes con cáncer de recto localmente avanzado en los Estados Unidos. Prescindir de la quimiorradioterapia podría evitar a los pacientes efectos secundarios a largo plazo, como el deterioro de las funciones intestinales, vesicales y sexuales, el aumento del riesgo de fracturas pélvicas y neoplasias secundarias, la disminución de la reserva de médula ósea y los efectos sobre la fertilidad.
Ciclo corto de radioterapia preoperatoria seguido de cirugía y quimioterapia
El uso de un ciclo corto de radioterapia antes de la cirugía ha sido el abordaje tradicional en partes de Europa y Australia.
Evidencia (ciclo corto de radioterapia preoperatoria):
- El uso de un ciclo corto de radioterapia se evaluó en el estudio aleatorizado Swedish Rectal Cancer Trial (NCT00337545).[5][Nivel de evidencia A1] En el ensayo, 1168 pacientes menores de 80 años con adenocarcinoma de recto resecable en estadios l a III se asignaron al azar para recibir radioterapia preoperatoria (25 Gy en 5 fracciones) o someterse a cirugía de inmediato. Los pacientes no recibieron quimioterapia adyuvante.
- La tasa de SG a 5 años fue del 58 % en el grupo de radioterapia y del 48 % en el grupo de cirugía (P = 0,005).
- La tasa de control local fue del 11 % en el grupo de radioterapia y del 27 % en el grupo de cirugía (P <0,001).
Después, en el Polish Rectal Trial y el Trans-Tasman Radiation Oncology Group (TROG) se comparó un ciclo corto de radioterapia preoperatoria y el ciclo prolongado estándar de quimiorradioterapia administrada con 5-FU.
- En el Polish Rectal Trial, se asignó al azar a 312 pacientes con cáncer de recto en estadio clínico T3 o T4 a recibir radioterapia preoperatoria (25 Gy en 5 fracciones) seguida de extirpación mesorrectal total en un lapso de 7 días; 6 meses de 5-FU y LV adyuvantes o quimiorradioterapia preoperatoria (50,4 Gy en 28 fracciones con un bolo simultáneo de 5-FU y LV); extirpación mesorrectal total al cabo de 4 a 6 semanas de completar la radioterapia y 4 meses de 5-FU y LV adyuvantes.[6] El criterio principal de valoración del estudio fue detectar una diferencia de al menos el 15 % en la conservación del esfínter con una potencia del 80 %.
- Las tasas de conservación del esfínter fueron del 61,2 % en el grupo de ciclo corto y del 58 % en el grupo de quimiorradioterapia (P = 0,570).
- La tasa actuarial de supervivencia a 4 años fue del 67,2 % en el grupo de ciclo corto y del 66,2 % en el grupo de quimiorradioterapia (CRI, 1,01; IC 95 %, 0,69–1,48; P = 0,960).
- El CRI de recidiva local en el grupo de ciclo corto comparado con el grupo de quimiorradioterapia fue de 0,65 (IC 95 %, 0,32–1,28; P = 0,210).
- No hubo diferencias en la toxicidad tardía entre el grupo de ciclo corto y el grupo de quimiorradioterapia.
- En el ensayo TROG (TROG 01.04 [NCT00145769]), a 326 pacientes de adenocarcinoma de recto en estadios T3, N0 a N2, M0 mediante ecografía o imágenes por resonancia magnética (IRM) y ubicados a menos de 12 cm del borde anal, se asignaron al azar para recibir un ciclo corto de radioterapia (25 Gy en 5 fracciones) seguido de cirugía 3 a 7 días después o un ciclo prolongado de quimiorradioterapia (50,4 Gy en 28 fracciones con infusión simultánea continua de 5-FU) seguido de cirugía al cabo de 4 a 6 semanas. Todos los pacientes recibieron quimioterapia adyuvante (5-FU y LV) después de la cirugía. El ensayo se diseñó con una potencia del 80 % para identificar una diferencia del 10 % en la recidiva local a 3 años mediante una prueba bilateral con un nivel de significación del 5 %.[7]
- La incidencia acumulada de recidiva local a 3 años fue del 7,5 % para el grupo de ciclo corto y del 4,4 % para el grupo de ciclo prolongado (P = 0,24).
- La tasa de SG a 5 años fue del 74 % para el grupo de ciclo corto y del 70 % para el grupo de ciclo prolongado (CRI, 1,12; IC 95 %, 0,76–1,67; P = 0,62).
- El Medical Research Council of the United Kingdom y el National Cancer Institute of Canada partieron de la experiencia con el ciclo corto para dirigir un estudio aleatorizado (MRC CR07 y NCIC-CTG C016 [NCT00003422]) en el que se comparó un ciclo corto de radioterapia preoperatoria y quimiorradioterapia posoperatoria selectiva.[8] En el ensayo, en 80 centros se asignaron al azar a 1350 pacientes con adenocarcinomas de recto resecables situados a menos de 15 cm del borde anal externo. No fue obligatorio el uso de IRM o ecografías pélvicas. Los pacientes asignados al azar a un ciclo corto de radioterapia recibieron 25 Gy en 5 fracciones seguidas de extirpación mesorrectal total y quimioterapia adyuvante de acuerdo con la política de cada centro sobre el compromiso de ganglios y márgenes. Los pacientes asignados al azar a quimiorradioterapia posoperatoria selectiva se sometieron a una cirugía inmediata seguida de quimiorradiación posoperatoria (45 Gy en 25 fracciones y 5-FU simultáneo) si el margen circunferencial de la resección era de 1 mm o menos. Se volvió a administrar quimioterapia adyuvante para el grupo que recibió quimiorradioterapia selectiva según las normas locales sobre el compromiso de ganglios y márgenes.[8]
- El riesgo de recidiva local a 3 años fue del 4,4 % en el grupo de ciclo corto preoperatorio y del 10,6 % en el grupo de quimiorradioterapia selectiva (CRI, 0,39; IC 95 %, 0,27–0,58; P < 0,0001).
- La SG no difirió entre los grupos.
En conjunto, en estos estudios se demuestra que un ciclo corto de radioterapia preoperatoria y un ciclo prolongado de quimiorradioterapia preoperatoria son estrategias de tratamiento razonables para pacientes con adenocarcinoma de recto en estadios II o III.
Quimiorradioterapia posoperatoria
El avance en la formulación de regímenes de tratamiento posoperatorio se relaciona con la integración de la quimioterapia sistémica con la radioterapia, así como con la redefinición de las técnicas de ambas modalidades. La eficacia de la radioterapia posoperatoria y la quimioterapia a base de 5-FU para el cáncer de recto en estadios II y III, se estableció por medio de una serie de ensayos clínicos prospectivos aleatorizados como los que se enumeran a continuación:[9-11][Nivel de evidencia A1]
- Gastrointestinal Tumor Study Group (GITSG-7175).
- Mayo/North Central Cancer Treatment Group (NCCTG-794751).
- National Surgical Adjuvant Breast and Bowel Project (NSABP-R-01).
En estos estudios se demostró un aumento del intervalo de SSE y SG cuando se combinó radioterapia con quimioterapia después de una resección quirúrgica. Después de la publicación de los resultados de estos ensayos en 1990, los expertos de la Consensus Development Conference, patrocinada por el Instituto Nacional del Cáncer, recomendaron el tratamiento posoperatorio de modalidad combinada para los pacientes con carcinoma de recto en estadios II y III.[12] Desde entonces, la quimiorradioterapia preoperatoria se convirtió en el estándar de atención, aunque la quimiorradioterapia posoperatoria sigue siendo una alternativa aceptable. Para obtener más información, consultar la sección Quimiorradioterapia preoperatoria.
Evidencia adicional (quimiorradioterapia posoperatoria):
- En el protocolo intergrupal 86-47-51 (MAYO-864751) se comparó la infusión continua de 5-FU (225 mg/m2/día durante todo el ciclo de radioterapia) con un bolo de 5-FU (500 mg/m2/día por 3 días consecutivos durante la primera y quinta semanas de radioterapia).[13][Nivel de evidencia A1]
- Se observó una mejora del 10 % en la SG con el uso de una infusión continua de 5-FU.
- En un ensayo aleatorizado de tres grupos se determinó si la infusión continua de 5-FU durante los 6 ciclos de quimioterapia adyuvante estándar era más eficaz que la infusión continua de 5-FU administrada sola durante la radiación pélvica. La mediana de seguimiento fue de 5,7 años.[14]
- El grupo 1 recibió un bolo de 5-FU en 2 ciclos de 5 días antes (500 mg/m2/día) y después (450 mg/m2/día) de la radioterapia, con una infusión venosa prolongada de 5-FU (225 mg/m2/día) durante la radioterapia.
- El grupo 2 recibió una infusión continua de 5-FU antes (300 mg/m2/día durante 42 días), después (300 mg/m2/día durante 56 días) y durante (225 mg/m2/día) la radioterapia.
- El grupo 3 recibió un bolo de 5-FU con LV en 2 ciclos de 5 días antes (5-FU 425 mg2/día; LV 20 mg/m2/día) y después (5-FU 380 mg/m2/día; LV 20 mg/m2/día) de la radioterapia, y un bolo de 5-FU con LV (5-FU de 400 mg/m2/día; LV 20 mg/m2/día los días 1 a 4, cada 28 días) durante la radioterapia. Se administró levamisol (150 mg/día) en ciclos de 3 días cada 14 días, antes y después de la radioterapia.
- No se detectaron diferencias en la SSE, la SG ni el fracaso locorregional (en todos los grupos: tasa de SSE a 3 años, 67–69 %, tasa de SG a 3 años de 81–83 %, tasa de fracaso locorregional, 4,6–8 %).
- La toxicidad mortal fue de menos del 1 %, se presentaron efectos tóxicos hematológicos de grado 3 a 4 en el 55 % de los pacientes del grupo 1 y en el 49 % de los pacientes del grupo 3 versus el 4 % de los pacientes del grupo de infusión continua.[14][Nivel de evidencia A1]
- En los resultados finales del ensayo intergrupal 0114 (INT-0114), al cabo de una mediana de 7,4 años, no se observaron beneficios de supervivencia o control local cuando se añadió LV, levamisol o ambos al tratamiento posoperatorio con 5-FU para los pacientes con cáncer de recto en estadios II y III.[15][Nivel de evidencia A1]
- En un análisis conjunto de 3791 pacientes inscritos en ensayos clínicos, se demostró que para los pacientes con enfermedad T3, N0 la tasa de SG a 5 años con cirugía y quimioterapia (SG, 84 %) se comparó favorablemente con las tasas de supervivencia de los pacientes tratados con cirugía, radioterapia y quimioterapia en bolo (tasa de SG, 76 %), o cirugía, radioterapia y quimioterapia en infusión prolongada (tasa de SG, 80 %).[16]
Cirugía
Por lo general, para el cáncer de recto en estadios II y III se realiza una extirpación mesorrectal total, ya sea con resección anterior baja o resección abdominoperineal, antes o después de la quimiorradioterapia.
En estudios retrospectivos se demostró que algunos pacientes con enfermedad patológica T3, N0 sometidos a cirugía sin tratamiento adicional tienen un riesgo muy bajo de recidiva local y sistémica.[17]
Quimiorradioterapia primaria seguida de vigilancia intensiva para pacientes con respuesta clínica completa
Desde el surgimiento de la quimiorradioterapia preoperatoria para el cáncer de recto, el abordaje estándar ha sido recomendar la resección quirúrgica definitiva mediante resección abdominoperineal o resección asistida por laparoscopia. En la mayoría de las series, después de un ciclo prolongado de quimiorradioterapia, entre el 10 % y el 20 % de los pacientes presentará una respuesta clínica completa sin signos de cáncer persistente en las imágenes, el examen rectal o la visualización directa durante una sigmoidoscopia. Antes se pensaba que la mayoría de los pacientes que no se sometían a cirugía por razones personales o médicas presentarían una recidiva local o sistémica. Sin embargo, quedó claro que los pacientes con una respuesta patológica completa a la quimiorradioterapia preoperatoria seguida de una cirugía definitiva tuvieron una mejor SSE que los pacientes que no tenían una respuesta patológica clínica.[18]
En varios estudios de una sola institución se ha cuestionado este estándar de atención al demostrar que la mayoría de los pacientes con respuesta clínica completa se curarán del cáncer de recto sin cirugía y que muchos pacientes que tienen una recidiva local se pueden tratar con resección quirúrgica (resección abdominoperineal o resección asistida por laparoscopia) en el momento de una recidiva.[19-22] Estas series institucionales se vieron perjudicadas por su tamaño pequeño y un sesgo de selección inherente.
Evidencia (quimiorradioterapia primaria seguida de vigilancia intensiva para quienes presentan una respuesta clínica completa):
- Investigadores en Inglaterra llevaron a cabo el ensayo Oncological Outcomes after Clinical Complete Response in Patients with Rectal Cancer.[23] Este fue un ensayo de cohortes con emparejamiento por índice de propensión. En un centro médico de atención especializada de tercer nivel en Manchester, se conformó un grupo combinado de 228 pacientes que eligieron someterse a una espera cautelosa entre 2011 y 2013 después de una respuesta clínica completa a la quimiorradioterapia y 98 pacientes de un registro de 3 centros médicos vecinos que también eligieron la espera cautelosa luego de la quimiorradioterapia desde 2005. Se consideró que había respuesta clínica completa cuando no se encontraban ulceración residual, estenosis ni masa rectal mediante examen digital del recto y endoscopia al cabo de 8 semanas o más de terminar la quimiorradioterapia simultánea. Los únicos hallazgos compatibles con una respuesta clínica completa observados el examen clínico o endoscópico fueron el blanqueamiento de la mucosa y telangiectasia. Se necesitaron imágenes radiográficas normales del mesorrecto y la pelvis para la clasificación de respuesta clínica completa. Los pacientes con respuesta clínica completa (n = 129) se compararon con una cohorte de pacientes tratados de modo similar sometidos a cirugía para lograr una resección completa (n = 228). En comparación con todos los pacientes sometidos a cirugía, los que eligieron la espera cautelosa tenían tumores en estadio T y N más tempranos, y era menos probable que tuvieran diferenciación precaria.
- Luego de una mediana de seguimiento de 33 meses, 44 (34 %) de los 129 pacientes que eligieron la espera cautelosa presentaron recidiva local y 36 pacientes se sometieron a resección de rescate.
- En un análisis de cohortes emparejadas, la tasa de SSE a 3 años sin masas nuevas en todos los pacientes fue del 83 % (IC 95 %, 76–88 %): 88 % (IC 95 %, 75–94 %) para el grupo de espera cautelosa y del 78 % (IC 95 %, 63–87 %) para el grupo de resección quirúrgica ( P del orden logarítmico = 0,022).
- La tasa de SG a 3 años fue del 96 % (IC 95 %, 88–98 %) para el grupo de espera cautelosa versus el 87 % (IC 95 %, 77–93 %) para el grupo de resección quirúrgica ( P del orden logarítmico = 0,015).
- La tasa de supervivencia sin colostomía a 3 años fue del 74 % (IC 95 %, 64–82 %) para el grupo de espera cautelosa y del 47 % (IC 95 %, 37–57 %; P del orden logarítmico < 0,0001) para el grupo de cirugía.
Los pacientes sometidos a espera cautelosa se sometieron a un protocolo de seguimiento más intensivo que incluyó un examen digital rectal ambulatorio; IRM (cada 4–6 meses durante los primeros 2 años); examen con anestesia o endoscopia; tomografía computarizada del tórax, el abdomen y la pelvis, y por lo menos 2 mediciones del antígeno carcinoembrionario durante los 2 primeros años. No se ha determinado el seguimiento óptimo.
Para los pacientes que presentan una respuesta clínica completa a la terapia, es razonable considerar el abordaje de espera cautelosa con vigilancia intensiva en lugar de la resección quirúrgica inmediata.
- En el estudio OPRA (NCT02008656) se asignó al azar a 324 pacientes con cáncer de recto en estadio II/III a recibir quimioterapia de inducción seguida de quimiorradioterapia, o quimiorradioterapia seguida de quimioterapia de consolidación. Los pacientes tenían la posibilidad de omitir la cirugía en función de la evaluación de la respuesta.[24,25]
- La tasa de SSE a 5 años fue del 71 % (IC 95 %, 64–79 %) y la tasa de supervivencia sin extirpación mesorrectal total fue del 39 % (IC 95 %, 32–48%) en los pacientes que recibieron quimioterapia de inducción seguida de quimiorradioterapia. La tasa de SSE a 5 años fue del 69 % (IC 95 %, 62–77 %) y la tasa de supervivencia sin extirpación mesorrectal total fue del 54 % (IC 95 %, 46–62 %) en los pacientes que recibieron quimiorradioterapia seguida de quimioterapia de consolidación.[24][Nivel de evidencia B1]
Aunque el régimen de vigilancia óptimo para los pacientes que se someten a tratamiento no quirúrgico sigue en estudio activo, el régimen del ensayo OPRA incluyó vigilancia periódica con tacto rectal, sigmoidoscopia e IRM. El tacto rectal y la sigmoidoscopia flexible se realizaron cada 4 meses durante los 2 primeros años desde el momento de la evaluación de la respuesta, y cada 6 meses durante los 3 años siguientes. La IRM rectal se realizó cada 6 meses durante los 2 primeros años y anualmente durante los 3 años siguientes. Los pacientes podían someterse a evaluaciones adicionales si estaba clínicamente indicado.
No se ha determinado el seguimiento óptimo de estos pacientes. Para los pacientes que tienen una respuesta clínica completa al tratamiento, el tratamiento no quirúrgico con vigilancia intensiva en lugar de la resección quirúrgica inmediata es un abordaje de atención estándar.
Inmunoterapia
Entre los pacientes con adenocarcinomas de recto, del 5 % al 10 % de los tumores exhiben deficiencia en la reparación de errores de emparejamiento o IMS alta. Los inhibidores de puntos de control inmunitario son eficaces como terapia de primera línea para el cáncer colorrectal metastásico, con tasas de respuestas general del 30 % al 60 %.[26-28] Se ha comprobado que estas respuestas son duraderas y se ha observado una SG prolongada en este entorno.
Evidencia (inmunoterapia):
- En un estudio de fase II (NCT04165772) se estudió el dostarlimab, un anticuerpo monoclonal anti-proteína de muerte celular programada 1 (PD-1) en 12 pacientes con adenocarcinoma de recto localmente avanzado en estadio II o III con deficiencia en la reparación de errores de emparejamiento.[29]
- Los 12 pacientes exhibieron respuestas clínicas completas del 100 % (IC 95 %, 74 %–100 %) después de una mediana de seguimiento de hasta 12 meses. El cáncer no recidivó en el transcurso de un periodo de seguimiento de 6 a 25 meses. En el momento del seguimiento, se había logrado evitar la quimiorradioterapia y la cirugía.[29][Nivel de evidencia C3]
- Antes de que este abordaje se convierta en un nuevo estándar terapéutico se necesita evaluar a más pacientes. Es necesario usar un periodo de seguimiento más prolongado para asegurar la duración de la respuesta y evaluar la necesidad de cirugía o quimiorradioterapia posterior.
Regímenes quimioterapéuticos
Muchos oncólogos académicos recomiendan que se use el régimen FOLFOX como la quimioterapia adyuvante para el cáncer de recto. Sin embargo, no hay datos sobre el cáncer de recto que sustenten este abordaje. FOLFOX se usó en el grupo estándar del último estudio intergrupal en el que se evaluó la quimioterapia adyuvante para el cáncer de recto. En un ensayo del Eastern Cooperative Oncology Group (ECOG-E5202 [NCT00217737]), se asignó al azar a pacientes de cáncer de recto en estadios II o III que recibieron quimiorradioterapia preoperatoria o posoperatoria a recibir 6 meses de FOLFOX, con bevacizumab o sin este, pero este ensayo se cerró por inscripción insuficiente. No hay datos de eficacia.
Oxaliplatino preoperatorio con quimiorradioterapia
También se observaron propiedades radiosensibilizadoras del oxaliplatino en modelos preclínicos.[30] En estudios de fase II de combinación de oxaliplatino y quimiorradioterapia a base de fluoropirimidinas, se notificaron tasas de respuesta patológica completa que oscilaron entre el 14 % y el 30 %.[31-35] Los datos de múltiples estudios permitieron demostrar una correlación entre las tasas de respuesta patológica completa y los criterios de valoración, como la supervivencia sin metástasis a distancia, la SSE y la SG.[36-38]
Actualmente no se justifica el uso simultáneo, fuera de un ensayo clínico, de oxaliplatino y radioterapia para el tratamiento de pacientes con cáncer de recto.
Evidencia (oxaliplatino preoperatorio con quimiorradioterapia):
- En el ensayo ACCORD 12/0405-Prodige 2 (NCT00227747) se asignó al azar a 598 pacientes con cáncer de recto en estadio clínico T2 o T3, o resecable T4 palpable mediante examen digital del recto, a recibir radioterapia preoperatoria (45 Gy en 25 fracciones durante 5 semanas) y capecitabina (800 mg/m2 2 veces al día, 5 de cada 7 días) o a una dosis más alta de radiación (50 Gy en 25 fracciones durante 5 semanas) con la misma dosis de capecitabina y oxaliplatino (50 mg/m2 cada semana). En el 98 % de los pacientes de ambos grupos se realizó una extirpación mesorrectal total al cabo de una mediana de 6 semanas de intervalo después de completar la quimiorradioterapia.[39]
- La respuesta patológica completa fue el criterio principal de valoración (aunque nunca se validó como un verdadero criterio de valoración indirecto de la SG). En el grupo tratado con oxaliplatino un porcentaje más alto de pacientes logró una respuesta patológica completa (19,2 vs. 13,9 %). Sin embargo, la diferencia no alcanzó significación estadística (P = 0,09).
- La tasa de efectos tóxicos de grado 3 o 4 fue significativamente más alta en el grupo tratado con oxaliplatino (25 vs. 11 %, P <0,001), y no hubo diferencia en la tasa de cirugía para conservar el esfínter (75 vs. 78 %).
- De modo similar, en el ensayo STAR-01 se investigó la función de la quimiorradioterapia combinada de oxaliplatino y 5-FU para el cáncer de recto localmente avanzado.[40][Nivel de evidencia A1] En este estudio italiano se asignó al azar a 747 pacientes con adenocarcinoma localmente avanzado en estadio clínico T3 o T4 y N1 a N2 ubicado en el recto medio o inferior, a recibir infusión continua de 5-FU junto con radioterapia o el mismo régimen en combinación con oxaliplatino (60 mg/m2). Aunque el criterio principal de valoración fue la SG, en un análisis previsto en el protocolo se notificó de manera preliminar la respuesta a la terapia preoperatoria.
- La tasa de respuesta patológica completa fue equivalente al 16 % en ambos grupos (oportunidad relativa, 0,98; IC 95 %, 0,66–1,44; P = 0,904).
- No se observó diferencia en la tasa compromiso ganglionar patológico, infiltración tumoral más allá de la capa muscular propia o la tasa de compromiso tumoral del margen circunferencial.
- Se observó un aumento de efectos tóxicos agudos de grado 3 a 4 relacionados con el tratamiento cuando se agregó el oxaliplatino (24 vs. 8 %; P <0,001). No se han notificado los resultados a largo plazo como la SG.
- En el ensayo NSABP-R-04 (NCT00058474) de diseño factorial 2 x 2, se asignó al azar a 1608 pacientes con adenocarcinoma en estadio clínico T3, T4 o compromiso ganglionar clínico ubicado a menos de 12 cm del borde anal externo, a uno de los siguientes 4 grupos de tratamiento:
- Infusión intravenosa (IV) continua de 5-FU con radioterapia.
- Capecitabina con radioterapia.
- Infusión IV continua de 5-FU y oxaliplatino semanal con radioterapia.
- Capecitabina y oxaliplatino semanal con radioterapia.
El objetivo principal de este estudio es el control de la enfermedad locorregional.[41][Nivel de evidencia B1] En la reunión anual de la American Society of Clinical Oncology de 2011, se presentó el resumen de los resultados preliminares en los que se demostraron los siguientes resultados:
- No hubo diferencia significativa en las tasas de respuesta patológica completa, cirugía para conservar el esfínter o descenso del estadio quirúrgico entre los regímenes de 5-FU y capecitabina, o entre los regímenes con oxaliplatino o sin este.
- Los pacientes tratados con oxaliplatino presentaron tasas significativamente más altas de efectos tóxicos agudos de grados 3 y 4 (15,4 vs. 6,6 %; P < 0,001).
- En el ensayo alemán CAO/ARO/AIO-04, se asignó al azar a 1236 pacientes con adenocarcinoma en estadio clínico T3 a T4 o con compromiso ganglionar clínico ubicados a menos de 12 cm del borde anal externo, a recibir quimiorradioterapia simultánea con 5-FU (semanas 1 y 5) o quimiorradioterapia simultánea con 5-FU diario (250 mg/m2y oxaliplatino (50 mg/m2).[42][Nivel de evidencia B1]
- En contraste con los estudios previos, los pacientes que recibieron oxaliplatino lograron una tasa significativamente más alta de respuesta patológica completa (17 vs. 13 %; P= 0,038).
- No hubo una diferencia significativa en las tasas generales de efectos tóxicos de grado 3 y 4; sin embargo, la diarrea, las náuseas y los vómitos fueron más comunes en quienes recibieron oxaliplatino.
- En este estudio, los programas de administración de 5-FU fueron diferentes entre los dos grupos, lo que quizás contribuyó con la diferencia en los resultados. Será necesario un seguimiento más prolongado para determinar el efecto en el criterio principal de valoración del estudio, la SSE.
Regímenes posoperatorios con oxaliplatino
De acuerdo con los resultados de varios estudios, el oxaliplatino como radiosensibilizador no parece añadir ningún beneficio en la respuesta del tumor primario, pero se relacionó con un aumento de la toxicidad aguda del tratamiento. Todavía se debate si el oxaliplatino se debe añadir a la terapia adyuvante de 5-FU y LV para el tratamiento posoperatorio del cáncer de recto en estadios II y III. No hay estudios aleatorizados de fase III que permitan apoyar el uso de oxaliplatino para el tratamiento adyuvante del cáncer de recto. Sin embargo, en la actualidad la adición de oxaliplatino a la terapia adyuvante con 5-FU y LV se considera el estándar de atención para el cáncer de colon.
Evidencia (oxaliplatino posoperatorio):
- En el estudio aleatorizado Multicenter International Study of Oxaliplatin/5-FU/LV in the Adjuvant Treatment of Colon Cancer (MOSAIC), se compararon los efectos tóxicos y la eficacia de FOLFOX4 (infusión de 2 horas de 200 de mg/m2 de LV, seguida de un bolo de 400 mg/m2 de 5-FU y, luego, 12 ciclos de infusión de 22 horas de 600 mg/m2 de 5-FU durante 2 días consecutivos cada 14 días y una infusión de 2 horas de 85 mg/m2 de oxaliplatino el día 1, administrado simultáneamente con LV), con el mismo régimen de 5-FU y LV sin oxaliplatino administrado durante 6 meses. Cada grupo del ensayo incluyó a 1123 pacientes.[43]
- Los resultados preliminares del estudio después de 37 meses de seguimiento demostraron una mejora significativa de la SSE a 3 años a favor de FOLFOX4 (77,8 vs. 72,9 %; P = 0,01). En el informe inicial no se habían notificado diferencias en la SG.[44][Nivel de evidencia B1]
- En un seguimiento más prolongado de 6 años se observó que la SG para todos los pacientes (estadio II y III) del estudio no fue significativamente diferente (tasa de SG = 78,5 % para FOLFOX4 vs. 76,0 % para 5-FU y LV; CRI, 0,84; IC 95 %, 0,71–1,00).
- En un análisis de subconjuntos, la tasa de SG a 6 años de los pacientes con cáncer de colon en estadio III fue del 72,9 % en los que recibieron FOLFOX4 y del 68,9% en los que recibieron 5-FU y LV (CRI = 0,80; IC 95 %, 0,65–0,97; P = 0,023).[44][Nivel de evidencia A1]
- Los pacientes tratados con FOLFOX4 presentaron más efectos tóxicos, entre ellos, los más comunes fueron neutropenia (41% > grado 3) y neuropatía sensorial periférica reversible (12,4% > grado 3).
- Los resultados del estudio NSABP-C-07, ya completado, confirman y amplían los resultados del ensayo MOSAIC.[45] En el NSABP C-07, se asignó al azar a 2492 pacientes con cáncer de colon en estadios II o III a recibir FLOX (infusión IV de 2 horas de 85 mg/m2 de oxaliplatino los días 1, 15 y 29 de cada ciclo de tratamiento de 8 semanas, seguida de una infusión intravenosa de 2 horas de 500 mg/m2 de LV y un bolo de 500 mg/m2 de 5-FU 1 hora después de comenzar la infusión de LV los días 1, 8, 15, 22, 29 y 36, seguido de un período de descanso de 2 semanas durante 3 ciclos [24 semanas]) o a la misma quimioterapia sin oxaliplatino (régimen de Roswell Park).
- Las tasas de SSE a 3 y 4 años fueron del 71,8 % y del 67 % para el régimen de Roswell Park y del 76,1 % y 73,2 % para FLOX, respectivamente.
- El CRI fue de 0,80 (IC 95 %, 0,69–0,93), y hubo una reducción de riesgo del 20 % en favor de FLOX (P < 0,004).
No está claro si los resultados de estos ensayos de cáncer de colon se pueden aplicar al tratamiento de los pacientes de cáncer de recto. No hay estudios aleatorizados de fase III que permitan apoyar la práctica habitual de administrar FOLFOX como tratamiento adyuvante para pacientes con cáncer de recto.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Schrag D, Shi Q, Weiser MR, et al.: Preoperative Treatment of Locally Advanced Rectal Cancer. N Engl J Med 389 (4): 322-334, 2023. [PUBMED Abstract]
- Sauer R, Becker H, Hohenberger W, et al.: Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 351 (17): 1731-40, 2004. [PUBMED Abstract]
- Sauer R, Liersch T, Merkel S, et al.: Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol 30 (16): 1926-33, 2012. [PUBMED Abstract]
- Roh MS, Colangelo LH, O'Connell MJ, et al.: Preoperative multimodality therapy improves disease-free survival in patients with carcinoma of the rectum: NSABP R-03. J Clin Oncol 27 (31): 5124-30, 2009. [PUBMED Abstract]
- Improved survival with preoperative radiotherapy in resectable rectal cancer. Swedish Rectal Cancer Trial. N Engl J Med 336 (14): 980-7, 1997. [PUBMED Abstract]
- Bujko K, Nowacki MP, Nasierowska-Guttmejer A, et al.: Long-term results of a randomized trial comparing preoperative short-course radiotherapy with preoperative conventionally fractionated chemoradiation for rectal cancer. Br J Surg 93 (10): 1215-23, 2006. [PUBMED Abstract]
- Ngan SY, Burmeister B, Fisher RJ, et al.: Randomized trial of short-course radiotherapy versus long-course chemoradiation comparing rates of local recurrence in patients with T3 rectal cancer: Trans-Tasman Radiation Oncology Group trial 01.04. J Clin Oncol 30 (31): 3827-33, 2012. [PUBMED Abstract]
- Sebag-Montefiore D, Stephens RJ, Steele R, et al.: Preoperative radiotherapy versus selective postoperative chemoradiotherapy in patients with rectal cancer (MRC CR07 and NCIC-CTG C016): a multicentre, randomised trial. Lancet 373 (9666): 811-20, 2009. [PUBMED Abstract]
- Thomas PR, Lindblad AS: Adjuvant postoperative radiotherapy and chemotherapy in rectal carcinoma: a review of the Gastrointestinal Tumor Study Group experience. Radiother Oncol 13 (4): 245-52, 1988. [PUBMED Abstract]
- Krook JE, Moertel CG, Gunderson LL, et al.: Effective surgical adjuvant therapy for high-risk rectal carcinoma. N Engl J Med 324 (11): 709-15, 1991. [PUBMED Abstract]
- Fisher B, Wolmark N, Rockette H, et al.: Postoperative adjuvant chemotherapy or radiation therapy for rectal cancer: results from NSABP protocol R-01. J Natl Cancer Inst 80 (1): 21-9, 1988. [PUBMED Abstract]
- NIH consensus conference. Adjuvant therapy for patients with colon and rectal cancer. JAMA 264 (11): 1444-50, 1990. [PUBMED Abstract]
- O'Connell MJ, Martenson JA, Wieand HS, et al.: Improving adjuvant therapy for rectal cancer by combining protracted-infusion fluorouracil with radiation therapy after curative surgery. N Engl J Med 331 (8): 502-7, 1994. [PUBMED Abstract]
- Smalley SR, Benedetti JK, Williamson SK, et al.: Phase III trial of fluorouracil-based chemotherapy regimens plus radiotherapy in postoperative adjuvant rectal cancer: GI INT 0144. J Clin Oncol 24 (22): 3542-7, 2006. [PUBMED Abstract]
- Tepper JE, O'Connell M, Niedzwiecki D, et al.: Adjuvant therapy in rectal cancer: analysis of stage, sex, and local control--final report of intergroup 0114. J Clin Oncol 20 (7): 1744-50, 2002. [PUBMED Abstract]
- Gunderson LL, Sargent DJ, Tepper JE, et al.: Impact of T and N stage and treatment on survival and relapse in adjuvant rectal cancer: a pooled analysis. J Clin Oncol 22 (10): 1785-96, 2004. [PUBMED Abstract]
- Willett CG, Badizadegan K, Ancukiewicz M, et al.: Prognostic factors in stage T3N0 rectal cancer: do all patients require postoperative pelvic irradiation and chemotherapy? Dis Colon Rectum 42 (2): 167-73, 1999. [PUBMED Abstract]
- Maas M, Nelemans PJ, Valentini V, et al.: Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: a pooled analysis of individual patient data. Lancet Oncol 11 (9): 835-44, 2010. [PUBMED Abstract]
- Maas M, Beets-Tan RG, Lambregts DM, et al.: Wait-and-see policy for clinical complete responders after chemoradiation for rectal cancer. J Clin Oncol 29 (35): 4633-40, 2011. [PUBMED Abstract]
- Lambregts DM, Maas M, Bakers FC, et al.: Long-term follow-up features on rectal MRI during a wait-and-see approach after a clinical complete response in patients with rectal cancer treated with chemoradiotherapy. Dis Colon Rectum 54 (12): 1521-8, 2011. [PUBMED Abstract]
- Smith JD, Ruby JA, Goodman KA, et al.: Nonoperative management of rectal cancer with complete clinical response after neoadjuvant therapy. Ann Surg 256 (6): 965-72, 2012. [PUBMED Abstract]
- Dalton RS, Velineni R, Osborne ME, et al.: A single-centre experience of chemoradiotherapy for rectal cancer: is there potential for nonoperative management? Colorectal Dis 14 (5): 567-71, 2012. [PUBMED Abstract]
- Renehan AG, Malcomson L, Emsley R, et al.: Watch-and-wait approach versus surgical resection after chemoradiotherapy for patients with rectal cancer (the OnCoRe project): a propensity-score matched cohort analysis. Lancet Oncol 17 (2): 174-83, 2016. [PUBMED Abstract]
- Verheij FS, Omer DM, Williams H, et al.: Long-Term Results of Organ Preservation in Patients With Rectal Adenocarcinoma Treated With Total Neoadjuvant Therapy: The Randomized Phase II OPRA Trial. J Clin Oncol 42 (5): 500-506, 2024. [PUBMED Abstract]
- Garcia-Aguilar J, Patil S, Gollub MJ, et al.: Organ Preservation in Patients With Rectal Adenocarcinoma Treated With Total Neoadjuvant Therapy. J Clin Oncol 40 (23): 2546-2556, 2022. [PUBMED Abstract]
- Le DT, Uram JN, Wang H, et al.: PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med 372 (26): 2509-20, 2015. [PUBMED Abstract]
- Overman MJ, Lonardi S, Wong KYM, et al.: Durable Clinical Benefit With Nivolumab Plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer. J Clin Oncol 36 (8): 773-779, 2018. [PUBMED Abstract]
- André T, Shiu KK, Kim TW, et al.: Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med 383 (23): 2207-2218, 2020. [PUBMED Abstract]
- Cercek A, Lumish M, Sinopoli J, et al.: PD-1 Blockade in Mismatch Repair-Deficient, Locally Advanced Rectal Cancer. N Engl J Med 386 (25): 2363-2376, 2022. [PUBMED Abstract]
- Cividalli A, Ceciarelli F, Livdi E, et al.: Radiosensitization by oxaliplatin in a mouse adenocarcinoma: influence of treatment schedule. Int J Radiat Oncol Biol Phys 52 (4): 1092-8, 2002. [PUBMED Abstract]
- Gérard JP, Chapet O, Nemoz C, et al.: Preoperative concurrent chemoradiotherapy in locally advanced rectal cancer with high-dose radiation and oxaliplatin-containing regimen: the Lyon R0-04 phase II trial. J Clin Oncol 21 (6): 1119-24, 2003. [PUBMED Abstract]
- Machiels JP, Duck L, Honhon B, et al.: Phase II study of preoperative oxaliplatin, capecitabine and external beam radiotherapy in patients with rectal cancer: the RadiOxCape study. Ann Oncol 16 (12): 1898-905, 2005. [PUBMED Abstract]
- Rödel C, Liersch T, Hermann RM, et al.: Multicenter phase II trial of chemoradiation with oxaliplatin for rectal cancer. J Clin Oncol 25 (1): 110-7, 2007. [PUBMED Abstract]
- Ryan DP, Niedzwiecki D, Hollis D, et al.: Phase I/II study of preoperative oxaliplatin, fluorouracil, and external-beam radiation therapy in patients with locally advanced rectal cancer: Cancer and Leukemia Group B 89901. J Clin Oncol 24 (16): 2557-62, 2006. [PUBMED Abstract]
- Valentini V, Coco C, Minsky BD, et al.: Randomized, multicenter, phase IIb study of preoperative chemoradiotherapy in T3 mid-distal rectal cancer: raltitrexed + oxaliplatin + radiotherapy versus cisplatin + 5-fluorouracil + radiotherapy. Int J Radiat Oncol Biol Phys 70 (2): 403-12, 2008. [PUBMED Abstract]
- García-Aguilar J, Hernandez de Anda E, Sirivongs P, et al.: A pathologic complete response to preoperative chemoradiation is associated with lower local recurrence and improved survival in rectal cancer patients treated by mesorectal excision. Dis Colon Rectum 46 (3): 298-304, 2003. [PUBMED Abstract]
- Guillem JG, Chessin DB, Cohen AM, et al.: Long-term oncologic outcome following preoperative combined modality therapy and total mesorectal excision of locally advanced rectal cancer. Ann Surg 241 (5): 829-36; discussion 836-8, 2005. [PUBMED Abstract]
- Rödel C, Martus P, Papadoupolos T, et al.: Prognostic significance of tumor regression after preoperative chemoradiotherapy for rectal cancer. J Clin Oncol 23 (34): 8688-96, 2005. [PUBMED Abstract]
- Gérard JP, Azria D, Gourgou-Bourgade S, et al.: Comparison of two neoadjuvant chemoradiotherapy regimens for locally advanced rectal cancer: results of the phase III trial ACCORD 12/0405-Prodige 2. J Clin Oncol 28 (10): 1638-44, 2010. [PUBMED Abstract]
- Aschele C, Cionini L, Lonardi S, et al.: Primary tumor response to preoperative chemoradiation with or without oxaliplatin in locally advanced rectal cancer: pathologic results of the STAR-01 randomized phase III trial. J Clin Oncol 29 (20): 2773-80, 2011. [PUBMED Abstract]
- Roh MS, Yothers GA, O'Connell MJ, et al.: The impact of capecitabine and oxaliplatin in the preoperative multimodality treatment in patients with carcinoma of the rectum: NSABP R-04. [Abstract] J Clin Oncol 29 (Suppl 15): A-3503, 2011.
- Rödel C, Liersch T, Becker H, et al.: Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer: initial results of the German CAO/ARO/AIO-04 randomised phase 3 trial. Lancet Oncol 13 (7): 679-87, 2012. [PUBMED Abstract]
- André T, Boni C, Mounedji-Boudiaf L, et al.: Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. N Engl J Med 350 (23): 2343-51, 2004. [PUBMED Abstract]
- André T, Boni C, Navarro M, et al.: Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial. J Clin Oncol 27 (19): 3109-16, 2009. [PUBMED Abstract]
- de Gramont A, Boni C, Navarro M, et al.: Oxaliplatin/5FU/LV in the adjuvant treatment of stage II and stage III colon cancer: efficacy results with a median follow-up of 4 years. [Abstract] J Clin Oncol 23 (Suppl 16): A-3501, 246s, 2005.
Tratamiento del cáncer de recto en estadio IV y recidivante
El tratamiento de los pacientes de cáncer de recto en estadio avanzado o recidivante depende de la localización de la enfermedad.
Opciones de tratamiento del cáncer de recto en estadio IV y recidivante
Las opciones de tratamiento del cáncer de recto en estadio IV y recidivante son las siguientes:
Cirugía con quimioterapia o radioterapia, o sin estas
Para los pacientes con enfermedad recidivante local o que tienen metástasis solo en el hígado o solo en el pulmón, la resección quirúrgica, cuando se puede hacer, es el único tratamiento potencialmente curativo.[1] También se puede considerar una resección quirúrgica para los pacientes con metástasis pulmonar limitada y aquellos con metástasis pulmonares y hepáticas; es posible obtener una supervivencia a 5 años en pacientes muy seleccionados.[2-5] La presencia de hidronefrosis relacionada con la recidiva es una contraindicación para la cirugía con intención curativa.[6]
El cáncer de recto que recidiva localmente a veces es resecable; en particular, si antes se hizo una operación inadecuada. En los pacientes que tienen una recidiva local sola después de una resección inicial con intención curativa se puede lograr una supervivencia sin enfermedad a largo plazo cuando se usa un tratamiento local intensivo y se repite la resección anterior baja con anastomosis coloanal, o se hace una resección abdominoperineal o una exenteración pélvica posterior o total.[7,8]
Es posible que la quimiorradioterapia de inducción para pacientes no irradiados antes que tienen recidivas pélvicas localizadas en estado avanzado (compromiso de la pared pélvica lateral, el sacro o los órganos adyacentes) aumente la resecabilidad y permita la conservación del esfínter.[9,10] En pacientes con enfermedad recidivante local que recibieron previamente radiación de haz externo, la radioterapia intraoperatoria quizás mejore el control local, con una morbilidad aceptable.[11]
Terapia sistémica
Los siguientes son fármacos que se usan, solos o combinados con otros medicamentos, para pacientes de cáncer colorrectal metastásico:
- Fluorouracilo (5-FU).
- Irinotecán.
- Oxaliplatino.
- Capecitabina.
- Bevacizumab.
- FOLFOXIRI (irinotecán, oxaliplatino, leucovorina [LV] y 5-FU).
- Cetuximab.
- Ziv-aflibercept.
- Ramucirumab.
- Panitumumab.
- Anticuerpo contra el receptor del factor de crecimiento epidérmico (EGFR) versus un anticuerpo contra el factor de crecimiento endotelial vascular (VEGF) con quimioterapia de primera línea.
- Regorafenib.
- Fruquintinib.
- Trifluridina y tipiracilo.
- Encorafenib con cetuximab para pacientes con variantes V600E en BRAF.
- Sotorasib con panitumumab para pacientes con variantes G12C en KRAS.
Fluorouracilo
Cuando el fluorouracilo (5-FU) era el único fármaco quimioterapéutico activo, en los ensayos clínicos de pacientes con enfermedad local avanzada, irresecable o metastásica se encontraron respuestas parciales, prolongación del tiempo transcurrido hasta la progresión (TTP) de la enfermedad [12,13] y mejora de la supervivencia y calidad de vida para los pacientes que recibieron quimioterapia versus el mejor cuidado médico de apoyo.[14-16] En varios ensayos se analizaron la actividad y los efectos tóxicos de diversos regímenes de 5-FU y LV con diferentes dosis y esquemas de administración; en esencia, se observaron resultados equivalentes con una mediana de supervivencia de cerca de 12 meses.[17]
Irinotecán y oxaliplatino
En tres estudios aleatorizados de pacientes de cáncer colorrectal metastásico se demostraron mejores tasas de respuesta, supervivencia sin progresión (SSP) y supervivencia general (SG) cuando irinotecán o oxaliplatino se combinaron con 5-FU y LV.[18-20]
Evidencia (irinotecán vs. oxaliplatino):
- En un estudio intergrupal (NCCTG-N9741 [NCT00003594]) se comparó irinotecán, 5-FU y LV (IFL) con oxaliplatino, LV y 5-FU (FOLFOX4) para el tratamiento de primera línea de pacientes con cáncer colorrectal metastásico.[21][Nivel de evidencia A1]
- Los pacientes asignados a FOLFOX4 en comparación con los pacientes asignados al azar a IFL, mejoraron la SSP (mediana, 8,7 vs. 6,9 meses; P = 0,014; cociente de riesgos instantáneos [CRI] = 0,74; intervalo de confianza [IC] 95 %, 0,61–0,89) y la SG (19,5 vs. 15 meses, P = 0,001; CRI = 0,66; IC 95 %, 0,54–0,82).
- Con posterioridad, en dos estudios se compararon los regímenes FOLFOX y LV, 5-FU con irinotecán (FOLFIRI), y se permitió que los pacientes cambiaran de grupo después de la progresión de la enfermedad durante la terapia de primera línea.[22,23][Nivel de evidencia B1]
- La SSP y la SG fueron idénticas entre los grupos de tratamiento en ambos estudios.
- En el ensayo Bolus, Infusional, or Capecitabine with Camptosar-Celecoxib (BICC-C [NCT00094965]) se evaluaron varios regímenes diferentes a base de irinotecán para pacientes de cáncer colorrectal metastásico sin tratamiento previo, entre ellos: FOLFIRI, irinotecán con bolo de 5-FU combinado con LV (mIFL) y capecitabina con irinotecán (CAPIRI).[24] En el estudio se asignó al azar a 430 pacientes, pero se suspendió antes de lo previsto debido a escasa inscripción.
- Los pacientes que recibieron FOLFIRI tuvieron una mejor SSP que los pacientes que recibieron mIFL (7,6 vs. 5,9 meses, P = 0,004) o CAPIRI (7,6 vs. 5,8 meses, P = 0,015).
- Los pacientes que recibieron CAPIRI presentaron las tasas más altas, de grado 3 o mayor, de náuseas, vómitos, diarrea, deshidratación y eritrodisestesia palmoplantar.
A partir de la publicación de estos estudios, el uso de FOLFOX o FOLFIRI se considera aceptable para el tratamiento de primera línea de pacientes con cáncer colorrectal metastásico. Sin embargo, se prefiere usar FOLFIRI cuando se emplea un régimen a base de irinotecán como tratamiento de primera línea del cáncer colorrectal metastásico.[24][Nivel de evidencia B1]
Capecitabina
Antes del advenimiento de la quimioterapia multifarmacológica, en dos estudios aleatorizados se demostró que la capecitabina se vinculó con una eficacia equivalente en comparación a la del régimen de la Mayo Clinic de 5-FU y LV.[25,26][Nivel de evidencia A1]
En ensayos aleatorizados de fase III se abordó la equivalencia de usar capecitabina en lugar de una infusión de 5-FU. En dos estudios de fase III se evaluó el uso de capecitabina y oxaliplatino (CAPOX) versus 5-FU y oxaliplatino (FUOX o FUFOX).[27,28]
Evidencia (oxaliplatino vs. capecitabina):
- El Arbeitsgemeinschaft Internische Onkologie (AIO) Colorectal Study Group asignó al azar a 474 pacientes para recibir CAPOX o FUFOX.
- La mediana de SSP fue de 7,1 meses en el grupo de CAPOX y de 8,0 meses en el grupo de FUFOX (CRI = 1,17; IC 95 %, 0,96–1,43; P = 0,117), y el CRI se ubicó dentro del intervalo de equivalencia predeterminado.[28]
- Un grupo cooperativo español asignó al azar a 348 pacientes a recibir CAPOX o FUOX.[27][Nivel de evidencia B1]
- El TTP fue de 8,9 meses para CAPOX versus 9,5 meses para FUOX (P = 0,153) y se ubicó dentro del intervalo de ausencia de inferioridad predeterminado.
Cuando se utiliza un régimen a base de oxaliplatino como tratamiento de primera línea para el cáncer colorrectal metastásico, el régimen de CAPOX no es inferior al régimen de 5-FU y oxaliplatino.
Bevacizumab
Es aceptable añadir bevacizumab a FOLFIRI o FOLFOX para pacientes que reciben tratamiento de primera línea de cáncer colorrectal metastásico. En la actualidad no hay estudios aleatorizados controlados completos que evalúen si el uso continuo de bevacizumab para el tratamiento de segunda o tercera línea después de progresión con el tratamiento de primera línea con bevacizumab prolonga la supervivencia.
Evidencia (bevacizumab):
- Después de la aprobación del bevacizumab, se enmendó el ensayo BICC-C y se asignó al azar a otros 117 pacientes para recibir el régimen FOLFIRI con bevacizumab o mIFL con bevacizumab.[24]
- Aunque no se encontró diferencia estadísticamente significativa para el criterio principal de valoración de la SSP, los pacientes que recibieron FOLFIRI con bevacizumab presentaron una mejora significativa de la SG (28,0 meses vs. 19,2 meses; P = 0,037; CRI para la muerte = 1,79; IC 95 %, 1,12–2,88).
- En el estudio Hurwitz, se asignó al azar a pacientes de cáncer colorrectal metastásico no tratados para recibir IFL o IFL con bevacizumab.[29]
- Los pacientes asignados al azar al grupo de IFL con bevacizumab tuvieron una mejora significativa de la SSP (10,6 meses en el grupo de IFL y bevacizumab en comparación con 6,2 meses en el grupo de IFL y placebo; CRI de progresión de la enfermedad, 0,54; P < 0,001) y SG (20,3 meses en el grupo de IFL y bevacizumab en comparación con 15,6 meses en el grupo de IFL y placebo; esto corresponde a un CRIde muerte 0,66, P = 0,001).[29]
- A pesar de la ausencia de datos directos, en la práctica habitual se añadió bevacizumab a FOLFOX como régimen estándar de primera línea a partir de los resultados del ensayo NCCTG-N9741.[21] Después, en un estudio aleatorizado de fase III, con diseño factorial de 2 × 2, se asignó al azar a pacientes de cáncer colorrectal no tratado en estadio IV a recibir CAPOX versus FOLFOX4 y, luego, bevacizumab versus placebo. La SSP fue el criterio principal de valoración.[30][Nivel de evidencia B1]
- La mediana de SSP fue de 9,4 meses para los pacientes que recibieron bevacizumab y 8,0 meses para los pacientes que recibieron placebo (CRI, 0,83; IC 97,5 %, 0,72–0,95; P = 0,0023).
- La mediana de SG fue de 21,3 meses para los pacientes que recibieron bevacizumab y 19,9 meses para los pacientes que recibieron placebo (CRI, 0,89; IC 97,5 %, 0,76–1,03; P = 0,077).
- La mediana de SSP (análisis por intención de tratar) fue de 8,0 meses en el análisis combinado de todos los grupos que recibieron CAPOX versus 8,5 meses para todos los grupos que recibieron FOLFOX4 (CRI, 1,04; IC 97,5 %, 0,93–1,16); el límite superior del IC 97,5 % notificado se ubicó por debajo del margen predefinido de ausencia de inferioridad de 1,23.[30,31]
- Es probable que el efecto del bevacizumab en la SG sea menor de lo que se observó en el estudio original de Hurwitz.
- Los investigadores del Eastern Cooperative Oncology Group asignaron al azar a pacientes cuya enfermedad progresó con el uso de 5-FU, leucovorina e irinotecán, para recibir FOLFOX o FOLFOX con bevacizumab.
- Los pacientes asignados al azar a FOLFOX con bevacizumab presentaron una mejoría estadísticamente significativa de la SSP (7,43 vs. 4,7 meses, CRI, 0,61; P < 0,0001) y la SG (12,9 vs. 10,8 meses; CRI, 0,75; P = 0,0011).[32][Nivel de evidencia A1]
FOLFOXIRI
Evidencia (FOLFOXIRI):
- En un estudio aleatorizado de fase III con 508 pacientes de cáncer colorrectal metastásico sin tratamiento previo, se comparó la combinación de FOLFOXIRI y bevacizumab con la combinación de FOLFIRI y bevacizumab.[33]
- La mediana de SSP fue de 12,1 meses en el grupo de FOLFOXIRI en comparación con 9,7 meses en el grupo de FOLFIRI (CRI de progresión, 0,75; IC 95 %, 0,62–0,90; P = 0,003). La SG no fue significativamente diferente entre los grupos (31,0 vs. 25,8 meses; CRIde muerte, 0,79; IC 95 %, 0,63-1,00; P = 0,054).[33][Nivel de evidencia B1]
- Los pacientes que recibieron FOLFOXIRI tuvieron, de manera significativa, más efectos tóxicos de grados 3 y 4, como neutropenia, estomatitis y neuropatía periférica.
Cetuximab
El cetuximab es un anticuerpo monoclonal parcialmente humanizado contra el EGFR. Cabe resaltar que los pacientes cuyos tumores expresan alteraciones en KRAS quizás tengan desenlaces más precarios cuando el cetuximab se agrega a regímenes de quimioterapia multifarmacológica que contienen bevacizumab.
Evidencia (cetuximab):
- Se llevó a cabo un estudio aleatorizado de fase II sobre el uso de cetuximab solo o irinotecán combinado con cetuximab, para los pacientes cuya enfermedad progresó mientras recibían regímenes que contenían irinotecán.[34][Nivel de evidencia C3]
- La mediana de TTP en los pacientes que recibieron cetuximab fue de 1,5 meses comparada con una mediana de TTP de 4,2 meses en los pacientes que recibieron irinotecán y cetuximab. A partir de este estudio, se aprobó el cetuximab para usarlo en pacientes de cáncer colorrectal metastásico resistente al 5-FU y al irinotecán.
- En el Crystal Study (EMR 62202-013 [NCT00154102]) se asignó al azar a 1198 pacientes de cáncer colorrectal en estadio IV para recibir FOLFIRI, con cetuximab o sin este.[35][Nivel de evidencia B1]
- La adición de cetuximab se relacionó con una mejora de la SSP (CRI, 0,85; IC 95 %, 0,72–0,99; P del orden logarítmico estratificado = 0,048), pero no de la SG.
- En estudios retrospectivos de pacientes de cáncer colorrectal metastásico, se indicó que las respuestas a la terapia con anticuerpos contra el EGFR se limitan a pacientes con tumores que albergan tipos naturales de KRAS (es decir, carecen de variantes activadoras en los codones 12 o 13 del gen KRAS).
- Se realizó un análisis de un subgrupo para evaluar la eficacia en relación con el estado del gen KRAS en pacientes inscritos en el Crystal Study. Hubo una interacción significativa entre el estado de la variante de KRAS y la respuesta tumoral al tratamiento (P = 0,03), pero no para la SSP (P = 0,07). Entre los pacientes de tumores con KRAS natural, el CRI favoreció al grupo de FOLFIRI y cetuximab (CRI, 0,68; IC 95 %, 0,50–0,94).
- En un estudio aleatorizado, los pacientes de cáncer colorrectal metastásico recibieron capecitabina, oxaliplatino y bevacizumab con cetuximab o sin este.[36][Nivel de evidencia B1]
- La mediana de SSP fue de 9,4 meses para el grupo que recibió cetuximab y de 10,7 meses para el grupo que no recibió cetuximab (P = 0,01).
- En un análisis de subconjuntos, los pacientes con tumores con alteraciones en el gen KRAS que recibieron cetuximab presentaron una disminución significativa de la SSP, en comparación con los pacientes cuyos tumores tenían un KRAS natural que recibieron cetuximab (8,1 vs. 10,5 meses; P = 0,04).
- En los pacientes que tenían tumores con alteraciones en KRAS, la SSP fue significativamente más corta en aquellos que recibieron cetuximab que en los que no lo recibieron (8,1 vs. 12,5 meses; P = 0,003). La SG fue también bastante más corta (17,2 vs. 24,9 meses, respectivamente; P = 0,03).
- En el ensayo del Medical Research Council (MRC) COIN (NCT00182715) se buscó determinar si era beneficioso agregar cetuximab a la quimioterapia combinada de una fluoropirimidina y oxaliplatino para el tratamiento de primera línea de pacientes cuyos tumores expresan KRAS natural.[37,38] Además, el MRC trató de evaluar el efecto de la quimioterapia intermitente en comparación con la quimioterapia continua. Los 1630 pacientes se asignaron al azar a los siguientes tres grupos de tratamiento:
- Grupo A: fluoropirimidina y oxaliplatino.
- Grupo B: fluoropirimidina, oxaliplatino y cetuximab.
- Grupo C: fluoropirimidina y oxaliplatino intermitentes.
Las comparaciones entre los grupos A y B, y los grupos A y C se analizaron y publicaron por separado.[37,38]
- En los pacientes cuyos tumores expresaban KRAS natural (grupo A, n = 367; grupo B, n = 362), no hubo diferencias de la SG entre los grupos de tratamiento (mediana de supervivencia, 17,9 meses [intervalo intercuartílico (IIC), 10,3–29,2] en el grupo de control vs. 17,0 meses [IIC, 9,4–30,1] en el grupo de cetuximab; CRI, 1,04; IC 95 %, 0,87–1,23; P = 0,67). Tampoco hubo efecto en la SSP (8,6 meses [IIC, 5,0–12,5] en el grupo de control vs. 8,6 meses [IIC, 5,1–13,8] en el grupo de cetuximab; CRI, 0,96; IC 95 %; 0,82–1,12; P = 0,60).[37,38][Nivel de evidencia A1]
- Las razones de la ausencia de beneficio de la adición de cetuximab no son claras. En los análisis de subgrupos se indica que la capecitabina se relacionó con un desenlace inferior y que los pacientes tratados con cetuximab reciben terapia de segunda línea con menor frecuencia.
- No hubo diferencia entre los pacientes que recibieron tratamiento continuo (grupo A) e intermitente (grupo C).
- La mediana de supervivencia en la población de intención de tratar (n = 815 en ambos grupos) fue de 15,8 meses (IIC, 9,4–26,1) en el grupo A y 14,4 meses (IIC, 8,0–24,7) en el grupo C (CRI, 1,084; IC 80 %, 1,008–1,165).
- En la población por protocolo, que incluyó solo a los pacientes sin progresión a las 12 semanas que fueron asignados al azar a continuar el tratamiento o suspender por un tiempo la quimioterapia (grupo A, n = 467; grupo C, n = 511), la mediana de supervivencia fue de 19,6 meses (IIC, 13,0–28,1) en el grupo A y de 18,0 meses (IIC, 12,1–29,3) en el grupo C (CRI, 1,087; IC 95 %, 0,986–1,198).
- Los límites superiores para los IC de los CRI en ambos análisis fueron superiores al límite predefinido de ausencia de inferioridad. Si bien no se logró determinar la ausencia de inferioridad para la quimioterapia intermitente, se encontraron diferencias clínicas insignificantes en los desenlaces de los pacientes.
Ziv-aflibercept
El ziv-aflibercept es una molécula anti-VEGF que se evalúa como componente de la terapia de segunda línea para pacientes de cáncer colorrectal metastásico.
Evidencia (ziv-aflibercept):
- En un ensayo, se asignó al azar a 1226 pacientes para recibir ziv-aflibercept (4 mg/kg IV) o placebo cada 2 semanas en combinación con FOLFIRI.[39][Nivel de evidencia A2]
- Los pacientes que recibieron ziv-aflibercept y FOLFIRI presentaron una mejoría significativa de las tasas de SG, con medianas de supervivencia de 13,50 meses en comparación con los pacientes que recibieron placebo y FOLFIRI, quienes presentaron una mediana de supervivencia de 12,06 meses (CRI, 0,817; IC 95,34 %, 0,713–0,937; P = 0,0032).
- Los pacientes que recibieron ziv-aflibercept y FOLFIRI también mejoraron de manera significativa las tasas de SSP, y la mediana de SSP fue de 6,90 meses en comparación con los pacientes que recibieron placebo y FOLFIRI, quienes presentaron una mediana de SSP de 4,67 meses (CRI, 0,758; IC 95 %, 0,661–0,869; P < 0,0001).
- A partir de estos resultados, se considera que ziv-aflibercept y FOLFIRI es un régimen de segunda línea aceptable para pacientes tratados previamente con quimioterapia a base de FOLFOX. Hasta el momento no se ha evaluado en ningún ensayo clínico si se debe continuar bevacizumab o iniciar ziv-aflibercept para la terapia de segunda línea, y no hay datos disponibles.
Ramucirumab
El ramucirumab es un anticuerpo monoclonal humanizado por completo que se une al receptor 2 del factor de crecimiento endotelial vascular (VEGFR-2).
Evidencia (ramucirumab):
- En un estudio aleatorizado sin enmascaramiento de fase III RAISE (NCT01183780), se aleatorizó a 1072 pacientes con cáncer colorrectal en estadio IV que progresó durante la quimioterapia de primera línea para recibir FOLFIRI con ramucirumab (8 mg/kg) o sin este.[40][Nivel de evidencia A1]
- Los pacientes asignados a FOLFIRI con ramucirumab presentaron una mejoría significativa de la mediana de SG (13,3 vs. 11,7 meses; CRI, 0,84; P = 0,0219) y SSP (5,7 vs. 4,5 meses; CRI, 0,793; P = 0,0005).
- Los efectos adversos de grado 3 fueron más comunes en el grupo de ramucirumab, incluso la neutropenia de grado 3.
- A partir de estos datos se considera que FOLFIRI y ramucirumab es un régimen de segunda línea aceptable en pacientes tratados previamente con FOLFOX y bevacizumab. No se ha evaluado en ningún ensayo clínico si se debe continuar bevacizumab o si se debe usar ramucirumab para la quimioterapia de segunda línea.
Panitumumab
El panitumumab es un anticuerpo contra el EGFR humanizado por completo. La Administración de Alimentos y Medicamentos (FDA) aprobó el panitumumab para su uso en pacientes de cáncer colorrectal metastásico resistente a la quimioterapia.[41] En ensayos clínicos, se demostró la eficacia de panitumumab como fármaco único o de terapia combinada, lo que fue congruente con los efectos de cetuximab en la SSP y la SG. Parece que hay un efecto de clase homogéneo.
Evidencia (panitumumab):
- En un ensayo de fase III, se asignó al azar a pacientes de cáncer colorrectal resistente a la quimioterapia a recibir panitumumab o el mejor cuidado médico de apoyo.[41][Nivel de evidencia B1]
- Los pacientes que recibieron panitumumab experimentaron una mejora de la SSP (8 vs. 7,3 semanas; CRI, 0,54; IC 95 %, 0,44–0,66; P < 0,0001).
- No hubo diferencia en la SG, lo que quizás se deba a que el 76 % de los pacientes del grupo de cuidados médicos de apoyo se pasaron al grupo de panitumumab.
- En el estudio Panitumumab Randomized Trial in Combination With Chemotherapy for Metastatic Colorectal Cancer to Determine Efficacy (PRIME [NCT00364013]), se asignó al azar a 1183 pacientes a FOLFOX4 con panitumumab o sin este como terapia de primera línea para el cáncer colorrectal metastásico. El estudio se modificó para aumentar el tamaño de la muestra y tratar por separado a los pacientes con tumores que expresaban KRAS natural y a aquellos con tumores que expresaban alteraciones en KRAS.[42][Nivel de evidencia B1]
- En los pacientes cuyos tumores expresaban KRAS natural y que recibieron panitumumab y FOLFOX4 se observó una mejoría estadísticamente significativa en la SSP en comparación con quienes recibieron FOLFOX4 solo (CRI, 0,80; IC 95 %, 0,66–0,97; P del orden logarítmico estratificado = 0,02).
- La mediana de SSP fue de 9,6 meses (IC 95 %, 9,2–11,1 meses) en los pacientes que recibieron panitumumab y FOLFOX4 y de 8,0 meses (IC 95 %, 7,5–9,3 meses) en los pacientes que recibieron FOLFOX4. La SG no fue significativamente diferente entre los grupos (CRI, 0,83; IC 95 %, 0,67–1,02; P = 0,072).
- Para los pacientes que tenían tumores con alteraciones en KRAS, la SSP fue más precaria cuando se añadió panitumumab (CRI, 1,29; IC 95 %, 1,04–1,62; P del orden logarítmico estratificado = 0,02).
- La mediana de SSP fue 7,3 meses (IC 95 %, 6,3–8,0 meses) con panitumumab y FOLFOX4 y de 8,8 meses (IC 95 %, 7,7–9,4 meses) con FOLFOX4 solo.
- Posteriormente, en un análisis retrospectivo se evaluó a los pacientes con un estado de exón 2 en KRAS natural con el fin de identificar otras variantes de KRAS y BRAF.[43][Nivel de evidencia C1]
- De los 620 pacientes identificados al inicio cuyos tumores no expresaban una variante del exón 2 de KRAS, se encontró que 108 pacientes (17 %) tenían otras variantes de RAS y que 53 pacientes (8 %) presentaban variantes de BRAF. En un análisis retrospectivo, los pacientes sin variantes de RAS o BRAF tuvieron una SSP (10,8 vs. 9,2 meses; P = 0,002) y SG más prolongadas (28,3 vs. 20,9 meses; P = 0,02) cuando se asignaron al grupo que recibió FOLFOX4 y panitumumab que los pacientes asignados al grupo de FOLFOX4.
- Igualmente, la adición de panitumumab a un régimen FOLFOX y bevacizumab resultó en una SSP más precaria y una peor toxicidad en comparación con un régimen FOLFOX y bevacizumab solo en pacientes con cáncer de colon metastásico no seleccionados según la variante de KRAS (11,4 vs. 10,0 meses; CRI, 1,27; IC 95 %, 1,06–1,52).[44][Nivel de evidencia B1]
- En otro estudio (NCT00339183), los pacientes de cáncer colorrectal metastásico que habían recibido un régimen con fluoropirimidina se asignaron al azar a FOLFIRI o FOLFIRI y panitumumab.[45][Nivel de evidencia B1]
- En un análisis posterior, los pacientes cuyos tumores tenían KRAS natural mostraron una ventaja estadísticamente significativa en la SSP (CRI, 0,73; IC 95 %, 0,59–0,90; P del orden logarítmico estratificado = 0,004).
- La mediana de SSP fue de 5,9 meses (IC 95 %, 5,5–6,7 meses) para el grupo que recibió FOLFIRI y panitumumab, y de 3,9 meses (IC 95 %, 3,7–5,3 meses) para el grupo que recibió FOLFIRI solo.
- La SG no fue significativamente diferente. La mediana de SG fue de 14,5 meses para el grupo que recibió FOLFIRI y panitumumab versus 12,5 meses para el grupo que recibió FOLFIRI solo.
- Los pacientes con tumores que expresaban alteraciones en KRAS no se beneficiaron de la adición de panitumumab.
- En un análisis posterior, los pacientes cuyos tumores tenían KRAS natural mostraron una ventaja estadísticamente significativa en la SSP (CRI, 0,73; IC 95 %, 0,59–0,90; P del orden logarítmico estratificado = 0,004).
Anticuerpo contra el receptor del factor de crecimiento epidérmico versus anticuerpo contra el factor de crecimiento vascular con quimioterapia de primera línea
En la atención de los pacientes con cáncer colorrectal en estadio IV, es incierto si los pacientes de cáncer que expresan KRAS natural deben recibir un anticuerpo anti-EGFR con quimioterapia o un anticuerpo anti-VEGF con quimioterapia. En dos estudios se intentó responder esta duda.[46,47]
Evidencia (anticuerpo anti-EGFR vs. anticuerpo anti-VEGF con quimioterapia de primera línea):
- En el estudio FIRE-3 (NCT00433927), 592 pacientes cuyos tumores expresaban un exón 2 de KRAS natural y no se habían tratado antes se asignaron al azar a recibir FOLFIRI y cetuximab (297 pacientes) o FOLFIRI y bevacizumab (295 pacientes). El criterio principal de valoración del estudio fue la tasa de respuesta objetiva.[46][Nivel de evidencia A1]
- La tasa de respuesta objetiva no difirió de forma significativa entre los grupos (tasa de respuesta objetiva, 62,0 %; IC 95 %, 56,2–67,5 vs. tasa de respuesta objetiva, 58,0 %; IC 95 %, 52,1–63,7; OR, 1,18; IC 95 %, 0,85–1,64; P = 0,18).
- La mediana de SSP fue de 10,0 meses (IC 95 %, 8,8–10,8) en el grupo de cetuximab y 10,3 meses (IC 95 %, 9,8–11,3) en el grupo de bevacizumab (CRI, 1,06; IC 95 %, 0,88–1,26; P = 0,55).
- La mediana de SG fue de 28,7 meses (IC 95 %, 24,0–36,6) en el grupo de cetuximab comparada con 25,0 meses (22,7–27,6) en el grupo de bevacizumab (CRI, 0,77; IC 95 %, 0,62–0,96; P = 0,017).
- En un análisis posterior de pacientes cuyos tumores se sometieron a un análisis ampliado de la expresión de RAS natural (con secuenciación de puntos de hipermutabilidad dentro de los genes KRAS y NRAS, incluso los codones 12 y 13 del exón 2; los codones 59 y 61 del exón 3; y los codones 117 y 146 del exón 4), la mediana de SG fue de 33,1 meses (IC 95 %, 24,5–39,4) en el grupo de cetuximab en comparación con 25,0 meses (IC 95 %, 23,0–28,1) en el grupo de bevacizumab (CRI, 0,70; IC 95 %, 0,54–0,90; P = 0,0059).[48]
- Cabe destacar que, solo el 52 % de los pacientes asignados al grupo de bevacizumab recibieron después cetuximab o panitumumab.[49]
- El Cancer and Leukemia Group B presentó el estudio intergrupal 80405 (NCT00265850) en la reunión de la American Society of Clinical Oncology de 2014. En este estudio se asignó al azar a 2334 pacientes de cáncer con KRAS natural que no se habían tratado antes para recibir quimioterapia (FOLFOX o FOLFIRI) y bevacizumab, o quimioterapia y cetuximab. La SG fue el criterio principal de valoración.[47][Nivel de evidencia B1]
- No hubo diferencia estadísticamente significativa en la SG entre los pacientes asignados a bevacizumab o cetuximab (las diferencias de SG según la quimioterapia fueron las siguientes: 29,04 [25,66–31,21] meses para el bevacizumab vs. 29,93 [27,56–31,21] meses para el bevacizumab; CRI, 0,92 [0,78–1,09]; P = 0,34).
A partir de estos dos estudios se concluyó que no hay una diferencia bien delimitada y significativa en iniciar el tratamiento con quimioterapia y bevacizumab o cetuximab para pacientes de cáncer colorrectal metastásico que expresan KRAS natural. No obstante, en los pacientes de cáncer con KRAS natural, la administración de un anticuerpo anti-EGFR en algún momento durante el tratamiento mejora la SG.
Regorafenib
El regorafenib es un inhibidor de múltiples vías de tirosina–cinasas, como la vía del VEGF. En 2012, la FDA aprobó (ver documento en inglés) el uso de regorafenib en pacientes cuya enfermedad había progresado durante tratamientos previos.
Evidencia (regorafenib):
- La inocuidad y eficacia del regorafenib se evaluó en un solo estudio clínico de 760 pacientes de cáncer colorrectal metastásico sometidos a tratamiento previo. Se asignó al azar a los pacientes en una proporción 2:1 para recibir regorafenib o un placebo además del mejor cuidado de apoyo.[50,51]
- Los pacientes tratados con regorafenib presentaron una mejora estadísticamente significativa de la SG (6,4 meses en el grupo de regorafenib vs. 5,0 meses en el grupo de placebo; CRI, 0,77; IC 95 %, 0,64–0,94; P unilateral = 0,0052).
Fruquintinib
El fruquintinib es un inhibidor de los receptores VEGF 1, 2 y 3. En 2023, la FDA aprobó el fruquintinib para los adultos con cáncer colorrectal metastásico que recibieron antes quimioterapia a base de fluoropirimidina, oxaliplatino e irinotecán y una terapia anti-VEGF. Si los pacientes tenían enfermedad con RAS natural y eran aptos desde el punto de vista médico, también se requirió una terapia anti-EGFR.
Evidencia (fruquintinib):
- En el ensayo internacional, con enmascaramiento doble y controlado por placebo de fase III FRESCO-2 (NCT04322539) se incluyó a 691 pacientes con adenocarcinoma colorrectal metastásico que habían recibido terapias dirigidas y citotóxicas aprobadas estándar. Los pacientes tuvieron progresión de la enfermedad durante el tratamiento con trifluridina-tipiracilo, regorafenib o ambos, o presentaron intolerancia a dichos fármacos. Los pacientes habían recibido una mediana de cuatro líneas de terapia sistémica anterior. Los pacientes se asignaron al azar en una proporción 2:1 para recibir uno de los siguientes regímenes:
- Fruquintinib (5 mg por vía oral una vez al día en los días 1–21 de un ciclo de 28-días).
- Placebo (por vía oral una vez al día en los días 1–21 de un ciclo de 28-días).
Todos los pacientes recibieron cuidados de apoyo. De los pacientes, 461 recibieron fruquintinib y 230 recibieron placebo. El criterio principal de valoración fue la SG.[52] Los resultados fueron los siguientes:
- La mediana de SB fue significativamente más prolongada en el grupo de fruquintinib (7,4 meses; IC 95 %, 6,7–8,2) que en el grupo de placebo (4,8 meses; IC 95 %, 4,0–5,8) (CRI, 0,66; IC 95 %, 0,55–0,80; P < 0,0001).[52][Nivel de evidencia A1]
- La mediana de SSP fue de 3,7 meses (IC 95 %, 3,5–3,8) en el grupo de fruquintinib y 1,8 meses (IC 95 %, 1,8–1,9) en el grupo de placebo (CRI, 0,26; IC 95 %, 0,21–0,34; P < 0,001).
- En los análisis de subgrupos se demostró el beneficio del fruquintinib vs. el placebo en la mayoría de los subgrupos. De manera notable, este beneficio se observó en pacientes con variantes de RAS y enfermedad con RAS natural, pacientes con metástasis de hígado y pacientes que recibieron tratamiento previo con trifluridina-tipiracilo con regorafenib o sin este.
- La tasa de control de la enfermedad fue significativamente más prolongada en el grupo de fruquintinib (56 %) que en el grupo de placebo (16 %), con una diferencia ajustada del 39 % (IC 95 %, 32,8–46,0 %; P < 0,0001).
- Se produjeron eventos adversos de grado 3 o superior en el 65 % de los pacientes en el grupo de fruquintinib. Los eventos adversos más comunes fueron hipertensión (14 %), astenia (8 %), función hepática anormal (8 %), toxicidad dermatológica (7 %) y eritrodisestesia palmoplantar (6 %). Se produjeron eventos adversos de grado 3 o superior en el 50 % de pacientes en el grupo de placebo. Los más comunes fueron función hepática anormal (9 %), infección (6 %) y astenia (4 %).
Trifluridina y tipiracilo
La combinación de trifluridina y tipiracilo (Lonsurf; también llamado TAS-102) constituye un medicamento de administración oral de trifluridina (un análogo del nucleósido timidina) y clorhidrato de tipiracilo (un inhibidor de la timidina fosforilasa). La trifluridina, en su forma de trifosfato inhibe la timidilato sintasa; por lo tanto, esta forma de trifluridina tiene efecto antitumoral. El clorhidrato de tipiracilo es un inhibidor potente de la timidina fosforilasa, que degrada la trifluridina de manera activa. La combinación de trifluridina y tipiracilo hace posible que se mantengan suficientes concentraciones plasmáticas de trifluridina.
Evidencia (trifluridina y tipiracilo):
- En un estudio con enmascaramiento doble de fase III (RECOURSE [NCT01607957]), se asignó al azar a 800 pacientes con cáncer colorrectal en estadio IV cuyo cáncer fue resistente al tratamiento con dos terapias previas. Era necesario que los pacientes hubieran recibido 5-FU, oxaliplatino, irinotecán y bevacizumab; además, para los casos de cánceres que expresaban KRAS natural, era necesario que hubieran recibido cetuximab o panitumumab. Se asignó al azar a los pacientes en una proporción de 2:1 para recibir el mejor cuidado médico de apoyo con trifluridina y tipiracilo (n = 534) o placebo (n = 266). La mediana de edad de los pacientes fue de 63 años y la mayoría de los pacientes (60–63 %) recibieron tratamiento de cuarta línea o adicional. Todos los pacientes recibieron antes una fluoropirimidina, irinotecán, oxaliplatino y bevacizumab; además, el 52 % de los pacientes recibió un inhibidor de EGFR. Aproximadamente el 20 % de los pacientes había recibido tratamiento con regorafenib.[53][Nivel de evidencia A1]
- Se administró trifluridina y tipiracilo combinado con los alimentos en dosis de 35 mg/m2 2 veces al día por 5 días, con 2 días de descanso semanales durante 2 semanas, seguidos de 14 días de descanso farmacológico.
- El criterio principal de valoración del estudio fue la SG. La mediana de SG para los pacientes de cáncer colorrectal metastásico que recibieron trifluridina y tipiracilo fue de 7,1 meses en comparación con 5,3 meses para quienes recibieron un placebo (CRI, 0,68; P < 0,0001).
- La mediana de SSP en el grupo de trifluridina y tipiracilo fue de 2 versus 1,7 meses en el grupo de placebo (CRI, 0,48; P < 0,0001).
- Los criterios secundarios de valoración fueron la SSP, la tasa de respuesta general y la tasa de control de la enfermedad.
- La tasa de respuesta general fue del 1,6 % con trifluridina y tipiracilo, que abarcó una respuesta completa en un paciente y respuestas parciales en otros pacientes. La tasa de respuesta general con el placebo fue del 0,4 % (P = 0,29).
La FDA aprobó trifluridina y tipiracilo para el tratamiento de los pacientes con cáncer colorrectal metastásico con fundamento en los resultados del ensayo RECOURSE.
Evidencia (combinación de trifluridina y tipiracilo con bevacizumab):
- En un ensayo internacional multiinstitucional de fase III (SUNLIGHT [NCT04737187]) se incluyó a 492 pacientes con cáncer colorrectal en estadio IV cuyo cáncer era resistente al tratamiento con hasta dos regímenes de quimioterapia previos. Se requirió que los pacientes hubieran recibido 5-FU, oxaliplatino, irinotecán, un anticuerpo monoclonal anti-VEGF o un anticuerpo monoclonal anti-EGFR (para pacientes con enfermedad con KRAS natural). Los pacientes se asignaron al azar en una proporción de 1:1 para recibir monoterapia con trifluridina y tipiracilo (n = 246) o trifluridina y tipiracilo combinados con bevacizumab (n = 246). La mediana de edad de los pacientes fue de 62 años para el grupo de combinación y de 64 años para el grupo de monoterapia; la mayoría de los pacientes (93 y 91 %) habían recibido dos líneas de tratamiento previas. En ambos grupos, más del 98 % de los pacientes habían recibido 5-FU, irinotecán y oxaliplatino, y más del 93 % de los pacientes con variantes naturales de RAS habían recibido tratamiento con anticuerpos monoclonales anti-EGFR. La mediana de seguimiento fue de 14,2 meses. Se administró trifluridina y tipiracilo en dosis de 35 mg/m2 2 veces al día los días 1 a 5 y 8 a 12 de un ciclo de 28 días. Se administró bevacizumab los días 1 y 15 de cada ciclo en dosis de 5 mg/kg. El criterio principal de valoración del estudio fue la SG.[54]
- La mediana de SG fue de 10,8 meses para los pacientes que recibieron trifluridina y tipiracilo con bevacizumab y de 7,5 meses para los pacientes que recibieron monoterapia de trifluridina y tipiracilo (CRI, 0,61; IC 95 %, 0,49–0,77; P < 0,001).[54][Nivel de evidencia A1]
- La SG fue significativa en los subgrupos, incluso en los pacientes con variantes de RAS y variantes naturales, cánceres con inestabilidad microsatelital alta (IMS-A) o con estabilidad microsatelital, así como en los pacientes que recibieron tratamiento previo con bevacizumab o que no lo recibieron.
- La mediana de SSP fue de 5,6 meses en el grupo de combinación y de 2,4 meses en el grupo de monoterapia con trifluridina y tipiracilo (CRI, 0,44; IC 95 %, 0,36–0,54;P < 0,001).
- Los criterios secundarios de valoración se centraron en la SSP, la tasa de respuesta general y la inocuidad.
- La tasa de respuesta general fue del 6,1 % para el grupo de combinación y del 1,2 % para el grupo de monoterapia.
- Se observaron efectos adversos que llevaron a la interrupción del tratamiento en el 12,6 % de los pacientes de los dos grupos. Se observaron reducciones de la dosis en el 16,3 % de los pacientes del grupo de tratamiento combinado y en el 12,2 % de los pacientes del grupo de monoterapia con trifluridina y tipiracilo. El efecto adverso más común fue la neutropenia, y se observó neutropenia de grado 3 o 4 en el 43 % de los pacientes del grupo de combinación y en el 32 % de los pacientes del grupo de monoterapia.
La FDA aprobó la combinación de trifluridina y tipiracilo con bevacizumab para el tratamiento de pacientes con cáncer colorrectal metastásico previamente tratado con base en los resultados del ensayo SUNLIGHT.
Encorafenib con cetuximab para pacientes con variantes V600E en BRAF
Las variantes V600E en BRAF se producen en alrededor del 10 % de los cánceres colorrectales metastásicos y son un indicador de un pronóstico precario. A diferencia del melanoma, la monoterapia con un inhibidor de BRAF no ha demostrado ser beneficiosa para el cáncer colorrectal, y varios estudios han evaluado el tratamiento simultáneo dirigido a la vía EGFR-MAPK.
Evidencia (encorafenib con cetuximab para pacientes con variantes V600E en BRAF):
- Encorafenib (inhibidor de BRAF), binimetinib (inhibidor de MEK) y cetuximab (inhibidor de EGFR):
en el ensayo international, abierto y aleatorizado de fase III BEACON, se inscribieron pacientes con cáncer colorrectal metastásico y variantes V600E en BRAF que recibieron antes uno o dos regímenes de tratamiento.[55] En el ensayo se asignaron al azar 665 pacientes en una proporción 1:1:1 para recibir uno de los siguientes regímenes:
- Tratamiento triple: encorafenib (300 mg al día por VO), binimetinib (45 mg 2 veces al día por VO) y cetuximab (dosis de carga de 400 mg/m2 IV seguida de 250 mg/m2 IV cada semana) (n = 224).
- Tratamiento doble: encorafenib y cetuximab (según la dosis del tratamiento triple) (n = 220).
- Grupo de control: FOLFIRI o irinotecán (cada 2 semanas) con cetuximab (dosis de carga de 400 mg/m2 IV seguida de 250 mg/m2 IV cada semana) (n = 221).
Los criterios principales de valoración fueron la SG y la respuesta objetiva en el grupo del tratamiento triple en comparación con el grupo de control.
- La SG fue de 9,0 meses en el grupo de tratamiento triple y de 5,4 meses en el grupo de control (CRI, 0,52; IC 95 %, 0,39–0,70, P < 0,0001).[55][Nivel de evidencia A1]
- En el 58 % de los pacientes en el grupo de tratamiento triple, se presentaron efectos secundarios de grado 3 o más alto; el 10 % de los pacientes presentó diarrea y el 11 % anemia. En el 50 % de los pacientes en el grupo de tratamiento doble y en el 61 % del grupo de control, se presentaron efectos secundarios de grado 3 o más alto. El 14 % de los pacientes que recibieron el régimen doble presentaron nevos melanocíticos.
En 2020, se presentaron datos actualizados en forma de resumen:[56]
- La mediana de SG para los grupos de tratamiento triple y doble fue de 9,3 meses y para el grupo de control fue de 5,9 meses (CRI, 0,60 para el grupo de tratamiento triple vs. grupo de control; IC 95 %, 0,47–0,75; CRI, 0,61 para el grupo de tratamiento doble vs. grupo de control; IC 95 %, 0,48–0,77).
- La tasa de respuesta objetiva para los pacientes que recibieron el tratamiento triple fue del 26,8 % (IC 95 %, 21,1–33,1 %) y 19,5 % para los pacientes que recibieron el tratamiento doble (IC 95 %, 14,5–25,4 %).
De acuerdo con estos datos, la FDA aprobó la combinación de encorafenib con cetuximab para los pacientes que recibieron tratamiento previo para el cáncer colorrectal metastásico y variantes V600E en BRAF.
Sotorasib con panitumumab para pacientes con variantes G12C en KRAS
Cerca de un 4 % de los pacientes con cáncer colorrectal presentan variantes G12C en KRAS, que se relacionan con un pronóstico precario.[57-60] El sotorasib y el adagrasib son 2 de los primeros inhibidores específicos de G12C en KRAS que demostraron beneficio para los pacientes con cánceres que tienen la mutación G12C en KRAS.[61,62] Dado que la reactivación de EGFR es un mecanismo de resistencia de la inhibición de G12C en KRAS bien definido, se combinó el sotorasib con panitumumab, un anticuerpo anti-EGFR, para tratar a pacientes con cáncer colorrectal y variantes G12C en KRAS.
- En el ensayo multicéntrico sin enmascaramiento de fase III, CodeBreaK 300 (NCT05198934), se incluyó a pacientes con cáncer colorrectal metastásico y variantes G12C en KRAS que habían recibido tratamiento previo con una fluoropirimidina, oxaliplatino e irinotecán.[61] En el estudio se asignaron al azar 160 pacientes en una proporción 1:1:1 a recibir uno de los siguientes regímenes:
- Tratamiento doble con sotorasib 960 mg una vez al día y panitumumab (6 mg/kg IV cada 2 semanas) (n = 53).
- Tratamiento doble con sotorasib 240 mg una vez al día y panitumumab (6 mg/kg IV cada 2 semanas) (n = 53).
- El tratamiento de referencia que eligiera el investigador con trifluridina-tipiracilo (35 mg/m2) o regorafenib (160 mg una vez al día) (grupo de control).
El criterio principal de valoración fue la SSP evaluada mediante una revisión central independiente con enmascaramiento de acuerdo con RECIST 1.1. Los criterios secundarios de valoración incluyeron la SG y la tasa de respuesta objetiva.
- La mediana de SSP fue de 5,6 meses (IC 95 %, 4,2–6,3) en el grupo de 960 mg de sotorasib y panitumumab, de 3,9 meses (IC 95 %, 3,7–5,8) en el grupo de 240 mg de sotorasib y panitumumab y de 2,2 meses (IC 95 %, 1,9–3,9) en el grupo de tratamiento de referencia.[61][Nivel de evidencia B1]
- El CRI de progresión de la enfermedad o muerte fue 0,49 (IC 95 %, 0,3–0,8; P = 0,006) en el grupo de 960 mg de sotorasib y panitumumab y 0,58 (IC 95 %, 0,36–0,98; P = 0,03) en el grupo de 240 mg de sotorasib y panitumumab.
- La tasa de respuesta objetiva fue del 26,4 % (IC 95 %, 15,3–40,3 %) en el grupo de 960 mg de sotorasib y panitumumab, del 5,7 % (IC 95 %, 1,2–15,7 %) en el grupo de 240 mg de sotorasib y panitumumab y del 0 % (IC 95 %, 0,0–6,6 %) en el grupo de tratamiento de referencia. Los datos para la SG todavía no están disponibles. Sin embargo, en la fecha límite de los datos los CRI fueron 0,77 (IC 95 %, 0,4–1,45) en el grupo de 960 mg de sotorasib y panitumumab y 0,91 (IC 95 %, 0,48–1,71) en el grupo de 240 mg de sotorasib y panitumumab cuando se compararon con el tratamiento de referencia.
- Se presentaron efectos secundarios de grado 3 o más en el 35,8 % de los pacientes que recibieron 960 mg de sotorasib y panitumumab, el 30,2 % de los pacientes que recibieron 240 mg de sotorasib y panitumumab y el 43,1 % de los pacientes que recibieron tratamiento de referencia. Los efectos adversos más comunes del tratamiento combinado de sotorasib con panitumumab fueron efectos tóxicos cutáneos e hipomagnesemia.
Quimioterapia de segunda línea
La quimioterapia de segunda línea con irinotecán en pacientes tratados con 5-FU y LV como terapia de primera línea demostró una mejora de la SG en comparación con la infusión de 5-FU o el uso de cuidados médicos de apoyo.[63-66]
Del mismo modo, en un ensayo de fase III se asignó al azar a pacientes cuya enfermedad progresó con el irinotecán combinado con 5-FU y LV para recibir un bolo e infusión de 5-FU y LV (LV5FU2), oxaliplatino en monoterapia o FOLFOX4. La mediana del TTP para FOLFOX4 versus LV5FU2 fue de 4,6 versus 2,7 meses (prueba del orden logarítmico estratificada P bilateral < 0,001).[67][Nivel de evidencia B1]
Inmunoterapia
Alrededor del 4 % de los pacientes con cáncer colorrectal en estadio IV tienen tumores con deficiencia en la reparación de errores de emparejamiento (dMMR) o con microsatélites inestables, lo que también se conoce como IMS-A. El fenotipo IMS-A se relaciona con defectos en la línea germinal de los genes MLH1, MSH2, MSH6 y PMS2 y es el fenotipo principal que se observa en tumores de pacientes con cáncer colorrectal sin poliposis hereditario (HNPCC) o síndrome de Lynch. También es posible que los pacientes presenten el fenotipo IMS-A debido al silenciamiento de uno de los genes por un proceso llamado metilación del ADN. La evaluación de la inestabilidad microsatelital se realiza mediante pruebas genéticas moleculares que determinan la inestabilidad microsatelital en el tejido tumoral o mediante análisis inmunohistoquímico que detecta la ausencia de proteínas de reparación de errores de emparejamiento. El estado de IMS-A ha tenido históricamente un pronóstico de mayor supervivencia para los pacientes con enfermedad en etapas tempranas y, desde 2015, también se ha encontrado que predice la respuesta del tumor a la inhibición de puntos de control.
En 2020, la FDA aprobó el uso de pembrolizumab en pacientes con cáncer colorrectal metastásico con dMMR o IMS-A sin tratamiento previo. Se encuentran en curso estudios sobre el tratamiento de primera línea con inhibidores duales de puntos de control. En 2017, la FDA aprobó el uso de pembrolizumab, un anticuerpo de la proteína de muerte celular programada 1 (PD-1), y en 2017 aprobó el uso de nivolumab para el tratamiento de pacientes con tumores con inestabilidad microsatelital que recibieron tratamiento a base de 5-FU, oxaliplatino e irinotecán. En 2018, la FDA concedió la aprobación acelerada para la combinación de nivolumab con ipilimumab (inhibidor de CTLA-4) para tratar el cáncer colorrectal con IMS-A que progresa después de tratamientos previos a base de 5-FU, oxaliplatino e irinotecán.
Inmunoterapia de primera línea
Pembrolizumab en monoterapia
Evidencia (pembrolizumab en monoterapia):
- En el ensayo internacional de fase III, sin anonimato, aleatorizado KEYNOTE-177 (NCT02563002), se asignaron al azar 307 pacientes con cáncer colorrectal metastásico con IMS-A o dMMR sin tratamiento previo en una proporción 1:1 para recibir pembrolizumab (200 mg cada 3 semanas) o quimioterapia (FOLFIRI o FOLFOX-6 modificada, con bevacizumab o cetuximab o sin estos).[68]
- La mediana de SSP fue de 16,5 meses para los pacientes que recibieron pembrolizumab y de 8,2 meses para los pacientes que recibieron quimioterapia (CRI, 0,60; IC 95 %, 0,45–0,80; P = 0,0002).[68][Nivel de evidencia A3]
- La SSP en los subgrupos predeterminados demostró un CRI que favoreció al grupo del pembrolizumab, excepto en pacientes con variantes de KRAS o NRAS.
- La tasa de respuesta objetiva fue del 43,8 % en el grupo de pembrolizumab y del 33,3 % en el grupo de quimioterapia. La mediana de la duración de la respuesta no se alcanzó en el grupo de pembrolizumab (intervalo, 2,3–41,4 meses) y fue de 10,6 meses en el grupo de quimioterapia (intervalo, 2,8–37,5 meses).
- En el 56 % de los pacientes que recibieron pembrolizumab se presentaron efectos adversos de grado 3 o más alto (un 9 % presentó efectos adversos de grado 3 o más alto relacionados con la infusión), en comparación con el 78 % de los pacientes que recibieron quimioterapia.
- Una revisión final de la SG, presentada en forma de resumen, mostró que no se alcanzó la mediana de SG en el grupo de pembrolizumab y fue de 36,7 meses en el grupo de quimioterapia (CRI, 0,74; IC 95 %, 0,53–1,03; P = 0,0359).[69]
Nivolumab e ipilimumab
Evidencia (nivolumab e ipilimumab):
- En una cohorte de grupo único del estudio multicéntrico de fase II CheckMate-142 (NCT02060188) presentado en forma de resumen, se administró nivolumab (3 mg/kg cada 2 semanas) con ipilimumab (1 mg/kg cada 6 semanas) a 45 pacientes de cáncer colorrectal metastásico con IMS-A o dMMR sin tratamiento previo. El criterio principal de valoración fue la tasa de respuesta objetiva.[70]
- La tasa de respuesta objetiva fue del 69 % entre los pacientes inscritos y del 80 % para los pacientes con variantes de KRAS (n = 10).[70][Nivel de evidencia C2]
- En un seguimiento médico a los 2 años, no se alcanzó la mediana de SSP ni de SG.
- En el ensayo CheckMate 8HW (NCT04008030), que se publicó en forma de resumen, se asignó al azar a 303 pacientes, que habían recibido varias líneas de tratamiento, a recibir nivolumab e ipilimumab (n = 202) o quimioterapia sola (n = 101). A algunos de los pacientes también se los asignó al azar a recibir nivolumab, pero los resultados de estos pacientes no se presentaron en el resumen. Los tratamientos se continuaron hasta la progresión o los efectos tóxicos inaceptables (todos los grupos), o hasta 2 años (grupo de nivolumab-ipilimumab). A un total de 171 pacientes que recibieron nivolumab e ipilimumab y de 84 pacientes que recibieron quimioterapia sola se les confirmó de forma central que presentaban cáncer colorrectal metastásico con dMMR/MSI-H.[71]
- Al cabo de una mediana de seguimiento de 31,5 meses, la SSP fue superior en los pacientes que recibieron nivolumab e ipilimumab, en comparación con aquellos que recibieron quimioterapia sola (CRI, 0,21; IC 97,91 %, 0,13–0,35; P < 0,0001). Hay que destacar que, en el grupo de quimioterapia, el 67 % de los pacientes recibieron inmunoterapia posterior.
- Se produjeron 5 muertes de grado 2 en el grupo de nivolumab-ipilimumab y tuvieron lugar eventos de grado 3 a 4 en el 23 % de los pacientes en el grupo de nivolumab-ipilimumab, así como en el 48 % de los pacientes en el grupo de quimioterapia sola.
Inmunoterapia de segunda línea
Pembrolizumab en monoterapia
Evidencia (pembrolizumab en monoterapia):
- La aprobación de la FDA para el pembrolizumab en monoterapia se sustentó en datos de 149 pacientes con IMS-A o cánceres con dMMR inscritos en 5 ensayos clínicos de un solo grupo, multicéntricos, multicohortes y no controlados. De los pacientes, 90 tenían cáncer colorrectal y 59 tenían un diagnóstico de 1 de 14 tipos de cáncer. Los pacientes recibieron 200 mg de pembrolizumab cada 3 semanas o 10 mg/kg de pembrolizumab cada 2 semanas. El tratamiento continuó hasta que se presentó una concentración tóxica inaceptable o progresión de la enfermedad. Las medidas principales de los resultados de eficacia fueron la tasa de respuesta objetiva (evaluada mediante revisión central independiente y enmascarada hecha por radiólogos según los Response Evaluation Criteria in Solid Tumors [RECIST] 1.1) y la duración de la respuesta.
- La tasa de respuesta objetiva fue del 39,6 % (IC 95 %, 31,7–47,9 %).
- Las respuestas duraron 6 meses o más para el 78 % de los pacientes que respondieron al pembrolizumab. Hubo 11 respuestas completas y 48 respuestas parciales.
- La tasa de respuesta objetiva fue similar para los pacientes con diagnóstico de cáncer colorrectal (36 %) y aquellos con otros cánceres (46 % para los otros 14 tipos de cáncer).
Nivolumab en monoterapia
Evidencia (nivolumab en monoterapia):
- En el ensayo CheckMate-142 (NCT02060188), se inscribieron 74 pacientes con cáncer colorrectal con dMMR o IMS-A y tratamiento previo en un estudio sin enmascaramiento de grupo único y de fase II para recibir nivolumab (3 mg/kg cada 2 semanas). El criterio principal de valoración fue la respuesta objetiva según RECIST 1.1.[72]
- La tasa de respuesta objetiva fue del 31,1 % (IC 95 %, 20,8–42,9 %).
- Se presentaron efectos adversos de grado 3 a 4 relacionados con el tratamiento en el 21 % de los pacientes.
Nivolumab e ipilimumab
Evidencia (nivolumab e ipilimumab):
- El ensayo multicéntrico sin anonimato de fase II CheckMate-142 (NCT02060188), se realizó con una cohorte de pacientes con cáncer colorrectal recurrente o metastásico con dMMR o IMS-A que progresaron, eran intolerantes, o declinaron al menos una línea de quimioterapia (incluso 5-FU y oxaliplatino o irinotecán). En el ensayo se inscribieron 119 pacientes que recibieron 4 dosis de nivolumab (3 mg/kg) e ipilimumab (1 mg/kg) cada 3 semanas (inducción), y luego nivolumab (3 mg/kg IV) cada 2 semanas (mantenimiento). El criterio principal de valoración fue la tasa de respuesta objetiva.[72]
- La tasa de respuesta objetiva fue del 55 % (IC 95 %, 45,2–63,8 %).
- Entre los pacientes que presentaron una respuesta, el 83 % tuvieron respuestas que duraron más de 6 meses.
- Se presentaron efectos adversos de grado 3 a 4 relacionados con el tratamiento en el 32 % de los pacientes.
Terapia paliativa
Se pueden indicar radioterapia paliativa,[11,66] quimioterapia,[13,73-78] y quimiorradioterapia.[79,80] Para aliviar la obstrucción, se pueden utilizar derivaciones paliativas colocadas mediante endoscopia.[81]
Tratamiento de las metástasis hepáticas
Alrededor del 15 % al 25 % de los pacientes con cáncer colorrectal presentarán metástasis hepáticas en el momento del diagnóstico y del 25 % al 50 % presentará una metástasis hepática metacrónica después de la resección del tumor primario.[82-84] Si bien solo una proporción pequeña de pacientes con metástasis hepáticas son aptos para someterse a una resección quirúrgica, los avances en las técnicas de ablación tumoral y en la administración de quimioterapia regional y sistémica ofrecen varias opciones de tratamiento. Estas incluyen las siguientes:
Cirugía
Las metástasis hepáticas se pueden considerar resecables de acuerdo con los siguientes aspectos:[65,85-97]
- Número limitado de lesiones.
- Localización intrahepática de las lesiones.
- Ausencia de compromiso vascular importante.
- Enfermedad extrahepática ausente o limitada.
- Reserva funcional hepática suficiente.
En la mayoría de los estudios no aleatorizados, como el ensayo North Central Cancer Treatment Group NCCTG-934653 (NCT00002575), una resección en la que se obtienen márgenes sin compromiso tumoral se relacionó con tasas de supervivencia a 5 años del 25 % al 40 % para los pacientes con una metástasis hepática resecable.[98-102][Nivel de evidencia C3] El perfeccionamiento de las técnicas quirúrgicas y los avances en las pruebas con imágenes preoperatorias han permitido mejorar la selección de pacientes para la resección. Además, en múltiples estudios de quimioterapia multifarmacológica se demostró que la administración de quimioterapia puede transformar una metástasis que tradicionalmente se consideraría irresecable en una metástasis resecable en pacientes que tienen una enfermedad metastásica aislada en el hígado.[103]
En el caso de los pacientes con metástasis hepáticas irresecables, se han obtenido excelentes resultados con el trasplante de hígado. Todavía se está determinando la cohorte de pacientes óptima para este tratamiento, pero en general el objetivo es lograr un buen control sistémico inicial con quimioterapia, seguida de trasplante. En un estudio de 91 pacientes, el 11 % se sometieron a un trasplante hepático de donante vivo. Al cabo de una mediana de seguimiento de 1,5 años después del trasplante, la tasa de supervivencia sin recidiva fue del 62 %, y la tasa de SG fue del 100 %.[104][Nivel de evidencia C3]
En el estudio TRANSMET (NCT02597348), publicado en forma de resumen, se asignó al azar a 94 pacientes para recibir quimioterapia y trasplante de hígado (n = 47) o quimioterapia sola (n = 47). En un análisis por intención de tratar, la tasa de SG a 5 años fue del 57 % en el grupo de quimioterapia y trasplante de hígado y del 13 % en el grupo de quimioterapia sola. En un análisis por protocolo, la tasa de SG a 5 años fue del 73 % en el grupo de quimioterapia y trasplante hepático y del 9 % en el grupo de quimioterapia sola.[105][Nivel de evidencia A1]
Quimioterapia neoadyuvante para las metástasis hepáticas irresecables
Los pacientes con metástasis hepáticas que se consideran irresecables a veces son aptos para resección si responden bien a la quimioterapia. Estos pacientes tienen tasas de supervivencia a 5 años similares a las de los pacientes con enfermedad resecable desde el principio.[103]
Ablación local para las metástasis hepáticas irresecables
La ablación por radiofrecuencia ha surgido como una técnica inocua (morbilidad grave del 2 % y tasa de mortalidad de <1 %) que a veces proporciona control tumoral a largo plazo.[106-112] La ablación por radiofrecuencia y la ablación crioquirúrgica aún son opciones para los pacientes con tumores irresecables y para quienes no son aptos para una resección hepática.
Quimioterapia adyuvante
La función de la quimioterapia adyuvante después de una resección potencialmente curativa de metástasis hepáticas es incierta.
Evidencia (quimioterapia adyuvante):
- En un ensayo en el que se comparó la floxuridina arterial hepática y la dexametasona con 5-FU y LV solas, se encontró mejora de la SSP a 2 años (57 vs. 42 %; P = 0,07) y la SG (86 vs. 72 %; P = 0,03) en los pacientes del grupo de terapia combinada, pero no se observó una diferencia estadísticamente significativa en la mediana de supervivencia en comparación con el tratamiento con 5-FU sistémico solo.[113][Nivel de evidencia A1]
- La mediana de supervivencia para el grupo de terapia combinada fue de 72,2 versus 59,3 meses para el grupo de monoterapia (P = 0,21).
- En un segundo ensayo preoperatorio se asignó al azar a pacientes con 1 a 3 metástasis hepáticas colorrectales potencialmente resecables a no recibir tratamiento adicional o a recibir floxuridina arterial hepática posoperatoria y 5-FU sistémico.[114] De los pacientes asignados al azar, el 27 % no se consideraron aptos en el momento de la cirugía, lo que dejó solo a 75 pacientes evaluables en cuanto a recidiva y supervivencia.
- Si bien disminuyó la recidiva hepática del cáncer, la mediana de supervivencia a 4 años no fue diferente de manera significativa entre los grupos de pacientes.
Se necesitan más estudios para evaluar este abordaje de tratamiento y determinar si una quimioterapia sistémica combinada más eficaz por sí sola proporcionaría resultados similares a la terapia intraarterial hepática combinada con tratamiento sistémico.
Quimioterapia intraarterial después de resección hepática
La quimioterapia intraarterial hepática con floxuridina para las metástasis hepáticas produce tasas de respuestas generales más altas, pero no mejoras uniformes para la supervivencia en comparación con la quimioterapia sistémica.[93,115-119] La polémica sobre la eficacia de la quimioterapia regional fue la base de un gran ensayo multicéntrico de fase III (Leuk-9481[NCT00002716]) de infusión arterial hepática versus quimioterapia sistémica. Se está evaluando el uso de una combinación de quimioterapia intraarterial con radioterapia hepática, en especial, cuando se emplea radiación focal para las lesiones metastásicas.[120]
En varios estudios se observó un aumento de los efectos tóxicos locales después de la terapia de infusión hepática, como anomalías en el funcionamiento hepático y esclerosis biliar mortal.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Wanebo HJ, Koness RJ, Vezeridis MP, et al.: Pelvic resection of recurrent rectal cancer. Ann Surg 220 (4): 586-95; discussion 595-7, 1994. [PUBMED Abstract]
- Girard P, Ducreux M, Baldeyrou P, et al.: Surgery for lung metastases from colorectal cancer: analysis of prognostic factors. J Clin Oncol 14 (7): 2047-53, 1996. [PUBMED Abstract]
- McAfee MK, Allen MS, Trastek VF, et al.: Colorectal lung metastases: results of surgical excision. Ann Thorac Surg 53 (5): 780-5; discussion 785-6, 1992. [PUBMED Abstract]
- Headrick JR, Miller DL, Nagorney DM, et al.: Surgical treatment of hepatic and pulmonary metastases from colon cancer. Ann Thorac Surg 71 (3): 975-9; discussion 979-80, 2001. [PUBMED Abstract]
- Tepper JE, O'Connell M, Donna H, et al.: Analysis of surgical salvage after failure of primary therapy in rectal cancer: results from INT 0114. [Abstract] Proceedings of the American Society of Clinical Oncology 21: A-507, 2002.
- Rodriguez-Bigas MA, Herrera L, Petrelli NJ: Surgery for recurrent rectal adenocarcinoma in the presence of hydronephrosis. Am J Surg 164 (1): 18-21, 1992. [PUBMED Abstract]
- Ogunbiyi OA, McKenna K, Birnbaum EH, et al.: Aggressive surgical management of recurrent rectal cancer--is it worthwhile? Dis Colon Rectum 40 (2): 150-5, 1997. [PUBMED Abstract]
- Vermaas M, Ferenschild FT, Verhoef C, et al.: Total pelvic exenteration for primary locally advanced and locally recurrent rectal cancer. Eur J Surg Oncol 33 (4): 452-8, 2007. [PUBMED Abstract]
- Lowy AM, Rich TA, Skibber JM, et al.: Preoperative infusional chemoradiation, selective intraoperative radiation, and resection for locally advanced pelvic recurrence of colorectal adenocarcinoma. Ann Surg 223 (2): 177-85, 1996. [PUBMED Abstract]
- Valentini V, Morganti AG, De Franco A, et al.: Chemoradiation with or without intraoperative radiation therapy in patients with locally recurrent rectal carcinoma: prognostic factors and long term outcome. Cancer 86 (12): 2612-24, 1999. [PUBMED Abstract]
- Haddock MG, Gunderson LL, Nelson H, et al.: Intraoperative irradiation for locally recurrent colorectal cancer in previously irradiated patients. Int J Radiat Oncol Biol Phys 49 (5): 1267-74, 2001. [PUBMED Abstract]
- Petrelli N, Herrera L, Rustum Y, et al.: A prospective randomized trial of 5-fluorouracil versus 5-fluorouracil and high-dose leucovorin versus 5-fluorouracil and methotrexate in previously untreated patients with advanced colorectal carcinoma. J Clin Oncol 5 (10): 1559-65, 1987. [PUBMED Abstract]
- Petrelli N, Douglass HO, Herrera L, et al.: The modulation of fluorouracil with leucovorin in metastatic colorectal carcinoma: a prospective randomized phase III trial. Gastrointestinal Tumor Study Group. J Clin Oncol 7 (10): 1419-26, 1989. [PUBMED Abstract]
- Scheithauer W, Rosen H, Kornek GV, et al.: Randomised comparison of combination chemotherapy plus supportive care with supportive care alone in patients with metastatic colorectal cancer. BMJ 306 (6880): 752-5, 1993. [PUBMED Abstract]
- Expectancy or primary chemotherapy in patients with advanced asymptomatic colorectal cancer: a randomized trial. Nordic Gastrointestinal Tumor Adjuvant Therapy Group. J Clin Oncol 10 (6): 904-11, 1992. [PUBMED Abstract]
- Buyse M, Thirion P, Carlson RW, et al.: Relation between tumour response to first-line chemotherapy and survival in advanced colorectal cancer: a meta-analysis. Meta-Analysis Group in Cancer. Lancet 356 (9227): 373-8, 2000. [PUBMED Abstract]
- Leichman CG, Fleming TR, Muggia FM, et al.: Phase II study of fluorouracil and its modulation in advanced colorectal cancer: a Southwest Oncology Group study. J Clin Oncol 13 (6): 1303-11, 1995. [PUBMED Abstract]
- Saltz LB, Cox JV, Blanke C, et al.: Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. Irinotecan Study Group. N Engl J Med 343 (13): 905-14, 2000. [PUBMED Abstract]
- de Gramont A, Figer A, Seymour M, et al.: Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J Clin Oncol 18 (16): 2938-47, 2000. [PUBMED Abstract]
- Douillard JY, Cunningham D, Roth AD, et al.: Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicentre randomised trial. Lancet 355 (9209): 1041-7, 2000. [PUBMED Abstract]
- Sanoff HK, Sargent DJ, Campbell ME, et al.: Five-year data and prognostic factor analysis of oxaliplatin and irinotecan combinations for advanced colorectal cancer: N9741. J Clin Oncol 26 (35): 5721-7, 2008. [PUBMED Abstract]
- Tournigand C, André T, Achille E, et al.: FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol 22 (2): 229-37, 2004. [PUBMED Abstract]
- Colucci G, Gebbia V, Paoletti G, et al.: Phase III randomized trial of FOLFIRI versus FOLFOX4 in the treatment of advanced colorectal cancer: a multicenter study of the Gruppo Oncologico Dell'Italia Meridionale. J Clin Oncol 23 (22): 4866-75, 2005. [PUBMED Abstract]
- Fuchs CS, Marshall J, Mitchell E, et al.: Randomized, controlled trial of irinotecan plus infusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: results from the BICC-C Study. J Clin Oncol 25 (30): 4779-86, 2007. [PUBMED Abstract]
- Van Cutsem E, Twelves C, Cassidy J, et al.: Oral capecitabine compared with intravenous fluorouracil plus leucovorin in patients with metastatic colorectal cancer: results of a large phase III study. J Clin Oncol 19 (21): 4097-106, 2001. [PUBMED Abstract]
- Hoff PM, Ansari R, Batist G, et al.: Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer: results of a randomized phase III study. J Clin Oncol 19 (8): 2282-92, 2001. [PUBMED Abstract]
- Díaz-Rubio E, Tabernero J, Gómez-España A, et al.: Phase III study of capecitabine plus oxaliplatin compared with continuous-infusion fluorouracil plus oxaliplatin as first-line therapy in metastatic colorectal cancer: final report of the Spanish Cooperative Group for the Treatment of Digestive Tumors Trial. J Clin Oncol 25 (27): 4224-30, 2007. [PUBMED Abstract]
- Porschen R, Arkenau HT, Kubicka S, et al.: Phase III study of capecitabine plus oxaliplatin compared with fluorouracil and leucovorin plus oxaliplatin in metastatic colorectal cancer: a final report of the AIO Colorectal Study Group. J Clin Oncol 25 (27): 4217-23, 2007. [PUBMED Abstract]
- Hurwitz H, Fehrenbacher L, Novotny W, et al.: Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 350 (23): 2335-42, 2004. [PUBMED Abstract]
- Saltz LB, Clarke S, Díaz-Rubio E, et al.: Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 26 (12): 2013-9, 2008. [PUBMED Abstract]
- Cassidy J, Clarke S, Díaz-Rubio E, et al.: Randomized phase III study of capecitabine plus oxaliplatin compared with fluorouracil/folinic acid plus oxaliplatin as first-line therapy for metastatic colorectal cancer. J Clin Oncol 26 (12): 2006-12, 2008. [PUBMED Abstract]
- Giantonio BJ, Catalano PJ, Meropol NJ, et al.: High-dose bevacizumab improves survival when combined with FOLFOX4 in previously treated advanced colorectal cancer: results from the Eastern Cooperative Oncology Group (ECOG) study E3200. [Abstract] J Clin Oncol 23 (Suppl 16): A-2, 1s, 2005.
- Loupakis F, Cremolini C, Masi G, et al.: Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med 371 (17): 1609-18, 2014. [PUBMED Abstract]
- Cunningham D, Humblet Y, Siena S, et al.: Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med 351 (4): 337-45, 2004. [PUBMED Abstract]
- Van Cutsem E, Köhne CH, Hitre E, et al.: Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med 360 (14): 1408-17, 2009. [PUBMED Abstract]
- Tol J, Koopman M, Cats A, et al.: Chemotherapy, bevacizumab, and cetuximab in metastatic colorectal cancer. N Engl J Med 360 (6): 563-72, 2009. [PUBMED Abstract]
- Maughan TS, Adams RA, Smith CG, et al.: Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet 377 (9783): 2103-14, 2011. [PUBMED Abstract]
- Adams RA, Meade AM, Seymour MT, et al.: Intermittent versus continuous oxaliplatin and fluoropyrimidine combination chemotherapy for first-line treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet Oncol 12 (7): 642-53, 2011. [PUBMED Abstract]
- Van Cutsem E, Tabernero J, Lakomy R, et al.: Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol 30 (28): 3499-506, 2012. [PUBMED Abstract]
- Tabernero J, Yoshino T, Cohn AL, et al.: Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol 16 (5): 499-508, 2015. [PUBMED Abstract]
- Van Cutsem E, Peeters M, Siena S, et al.: Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol 25 (13): 1658-64, 2007. [PUBMED Abstract]
- Douillard JY, Siena S, Cassidy J, et al.: Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study. J Clin Oncol 28 (31): 4697-705, 2010. [PUBMED Abstract]
- Douillard JY, Oliner KS, Siena S, et al.: Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med 369 (11): 1023-34, 2013. [PUBMED Abstract]
- Hecht JR, Mitchell E, Chidiac T, et al.: A randomized phase IIIB trial of chemotherapy, bevacizumab, and panitumumab compared with chemotherapy and bevacizumab alone for metastatic colorectal cancer. J Clin Oncol 27 (5): 672-80, 2009. [PUBMED Abstract]
- Peeters M, Price TJ, Cervantes A, et al.: Randomized phase III study of panitumumab with fluorouracil, leucovorin, and irinotecan (FOLFIRI) compared with FOLFIRI alone as second-line treatment in patients with metastatic colorectal cancer. J Clin Oncol 28 (31): 4706-13, 2010. [PUBMED Abstract]
- Heinemann V, von Weikersthal LF, Decker T, et al.: FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial. Lancet Oncol 15 (10): 1065-75, 2014. [PUBMED Abstract]
- Venook AP, Niedzwiecki D, Lenz HJ, et al.: CALGB/SWOG 80405: Phase III trial of irinotecan/5-FU/leucovorin (FOLFIRI) or oxaliplatin/5-FU/leucovorin (mFOLFOX6) with bevacizumab (BV) or cetuximab (CET) for patients (pts) with KRAS wild-type (wt) untreated metastatic adenocarcinoma of the colon or rectum (MCRC). [Abstract] J Clin Oncol 32 (Suppl 5): A-LBA3, 2014.
- Stintzing S, Modest DP, Rossius L, et al.: FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab for metastatic colorectal cancer (FIRE-3): a post-hoc analysis of tumour dynamics in the final RAS wild-type subgroup of this randomised open-label phase 3 trial. Lancet Oncol 17 (10): 1426-1434, 2016. [PUBMED Abstract]
- Modest DP, Stintzing S, von Weikersthal LF, et al.: Impact of Subsequent Therapies on Outcome of the FIRE-3/AIO KRK0306 Trial: First-Line Therapy With FOLFIRI Plus Cetuximab or Bevacizumab in Patients With KRAS Wild-Type Tumors in Metastatic Colorectal Cancer. J Clin Oncol 33 (32): 3718-26, 2015. [PUBMED Abstract]
- Grothey A, Sobrero AF, Siena S, et al.: Results of a phase III randomized, double-blind, placebo-controlled, multicenter trial (CORRECT) of regorafenib plus best supportive care (BSC) versus placebo plus BSC in patients (pts) with metastatic colorectal cancer (mCRC) who have progressed after standard therapies. [Abstract] J Clin Oncol 30 (Suppl 4): A-LBA385, 2012.
- Grothey A, Van Cutsem E, Sobrero A, et al.: Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 381 (9863): 303-12, 2013. [PUBMED Abstract]
- Dasari A, Lonardi S, Garcia-Carbonero R, et al.: Fruquintinib versus placebo in patients with refractory metastatic colorectal cancer (FRESCO-2): an international, multicentre, randomised, double-blind, phase 3 study. Lancet 402 (10395): 41-53, 2023. [PUBMED Abstract]
- Mayer RJ, Van Cutsem E, Falcone A, et al.: Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med 372 (20): 1909-19, 2015. [PUBMED Abstract]
- Prager GW, Taieb J, Fakih M, et al.: Trifluridine-Tipiracil and Bevacizumab in Refractory Metastatic Colorectal Cancer. N Engl J Med 388 (18): 1657-1667, 2023. [PUBMED Abstract]
- Kopetz S, Grothey A, Yaeger R, et al.: Encorafenib, Binimetinib, and Cetuximab in BRAF V600E-Mutated Colorectal Cancer. N Engl J Med 381 (17): 1632-1643, 2019. [PUBMED Abstract]
- Kopetz S, Grothey A, Van Cutsem E, et al.: Encorafenib plus cetuximab with or without binimetinib for BRAF V600E metastatic colorectal cancer: updated survival results from a randomized, three-arm, phase III study versus choice of either irinotecan or FOLFIRI plus cetuximab (BEACON CRC). [Abstract] J Clin Oncol 38 (15) (suppl): A-4001, 2020. Available online. Last accessed January 30, 2025.
- Fakih M, Tu H, Hsu H, et al.: Real-World Study of Characteristics and Treatment Outcomes Among Patients with KRAS p.G12C-Mutated or Other KRAS Mutated Metastatic Colorectal Cancer. Oncologist 27 (8): 663-674, 2022. [PUBMED Abstract]
- Lee JK, Sivakumar S, Schrock AB, et al.: Comprehensive pan-cancer genomic landscape of KRAS altered cancers and real-world outcomes in solid tumors. NPJ Precis Oncol 6 (1): 91, 2022. [PUBMED Abstract]
- Neumann J, Zeindl-Eberhart E, Kirchner T, et al.: Frequency and type of KRAS mutations in routine diagnostic analysis of metastatic colorectal cancer. Pathol Res Pract 205 (12): 858-62, 2009. [PUBMED Abstract]
- Henry JT, Coker O, Chowdhury S, et al.: Comprehensive Clinical and Molecular Characterization of KRAS G12C-Mutant Colorectal Cancer. JCO Precis Oncol 5: , 2021. [PUBMED Abstract]
- Fakih MG, Salvatore L, Esaki T, et al.: Sotorasib plus Panitumumab in Refractory Colorectal Cancer with Mutated KRAS G12C. N Engl J Med 389 (23): 2125-2139, 2023. [PUBMED Abstract]
- Yaeger R, Weiss J, Pelster MS, et al.: Adagrasib with or without Cetuximab in Colorectal Cancer with Mutated KRAS G12C. N Engl J Med 388 (1): 44-54, 2023. [PUBMED Abstract]
- Rothenberg ML, Eckardt JR, Kuhn JG, et al.: Phase II trial of irinotecan in patients with progressive or rapidly recurrent colorectal cancer. J Clin Oncol 14 (4): 1128-35, 1996. [PUBMED Abstract]
- Conti JA, Kemeny NE, Saltz LB, et al.: Irinotecan is an active agent in untreated patients with metastatic colorectal cancer. J Clin Oncol 14 (3): 709-15, 1996. [PUBMED Abstract]
- Rougier P, Van Cutsem E, Bajetta E, et al.: Randomised trial of irinotecan versus fluorouracil by continuous infusion after fluorouracil failure in patients with metastatic colorectal cancer. Lancet 352 (9138): 1407-12, 1998. [PUBMED Abstract]
- Cunningham D, Pyrhönen S, James RD, et al.: Randomised trial of irinotecan plus supportive care versus supportive care alone after fluorouracil failure for patients with metastatic colorectal cancer. Lancet 352 (9138): 1413-8, 1998. [PUBMED Abstract]
- Rothenberg ML, Oza AM, Bigelow RH, et al.: Superiority of oxaliplatin and fluorouracil-leucovorin compared with either therapy alone in patients with progressive colorectal cancer after irinotecan and fluorouracil-leucovorin: interim results of a phase III trial. J Clin Oncol 21 (11): 2059-69, 2003. [PUBMED Abstract]
- André T, Shiu KK, Kim TW, et al.: Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med 383 (23): 2207-2218, 2020. [PUBMED Abstract]
- Andre T, Shiu K, Kim TW, et al.: Final overall survival for the phase III KN177 study: pembrolizumab versus chemotherapy in microsatellite instability-high/mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC). [Abstract] J Clin Oncol 39 (15) (suppl): A-3500, 2021. Available online. Last accessed January 30, 2025.
- Lenz H, Lonardi S, Zagonel V, et al.: Subgroup analyses of patients (pts) with microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC) treated with nivolumab (NIVO) plus low-dose ipilimumab (IPI) as first-line (1L) therapy: two-year clinical update. [Abstract] J Clin Oncol 39 (3) (suppl): A-58, 2021. Available online. Last accessed January 30, 2025.
- Lenz HJ, Lonardi S, Elez E, et al.: Nivolumab (NIVO) plus ipilimumab (IPI) vs chemotherapy (chemo) as first-line (1L) treatment for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): Expanded efficacy analysis from CheckMate 8HW. [Abstract] J Clin Oncol 42 (Suppl 16): A-3503, 2024.
- Overman MJ, McDermott R, Leach JL, et al.: Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol 18 (9): 1182-1191, 2017. [PUBMED Abstract]
- Valone FH, Friedman MA, Wittlinger PS, et al.: Treatment of patients with advanced colorectal carcinomas with fluorouracil alone, high-dose leucovorin plus fluorouracil, or sequential methotrexate, fluorouracil, and leucovorin: a randomized trial of the Northern California Oncology Group. J Clin Oncol 7 (10): 1427-36, 1989. [PUBMED Abstract]
- Erlichman C, Fine S, Wong A, et al.: A randomized trial of fluorouracil and folinic acid in patients with metastatic colorectal carcinoma. J Clin Oncol 6 (3): 469-75, 1988. [PUBMED Abstract]
- Doroshow JH, Multhauf P, Leong L, et al.: Prospective randomized comparison of fluorouracil versus fluorouracil and high-dose continuous infusion leucovorin calcium for the treatment of advanced measurable colorectal cancer in patients previously unexposed to chemotherapy. J Clin Oncol 8 (3): 491-501, 1990. [PUBMED Abstract]
- Poon MA, O'Connell MJ, Wieand HS, et al.: Biochemical modulation of fluorouracil with leucovorin: confirmatory evidence of improved therapeutic efficacy in advanced colorectal cancer. J Clin Oncol 9 (11): 1967-72, 1991. [PUBMED Abstract]
- Wadler S, Lembersky B, Atkins M, et al.: Phase II trial of fluorouracil and recombinant interferon alfa-2a in patients with advanced colorectal carcinoma: an Eastern Cooperative Oncology Group study. J Clin Oncol 9 (10): 1806-10, 1991. [PUBMED Abstract]
- Grem JL, Jordan E, Robson ME, et al.: Phase II study of fluorouracil, leucovorin, and interferon alfa-2a in metastatic colorectal carcinoma. J Clin Oncol 11 (9): 1737-45, 1993. [PUBMED Abstract]
- Wong CS, Cummings BJ, Brierley JD, et al.: Treatment of locally recurrent rectal carcinoma--results and prognostic factors. Int J Radiat Oncol Biol Phys 40 (2): 427-35, 1998. [PUBMED Abstract]
- Crane CH, Janjan NA, Abbruzzese JL, et al.: Effective pelvic symptom control using initial chemoradiation without colostomy in metastatic rectal cancer. Int J Radiat Oncol Biol Phys 49 (1): 107-16, 2001. [PUBMED Abstract]
- Baron TH: Expandable metal stents for the treatment of cancerous obstruction of the gastrointestinal tract. N Engl J Med 344 (22): 1681-7, 2001. [PUBMED Abstract]
- Power DG, Healey-Bird BR, Kemeny NE: Regional chemotherapy for liver-limited metastatic colorectal cancer. Clin Colorectal Cancer 7 (4): 247-59, 2008. [PUBMED Abstract]
- Khatri VP, Chee KG, Petrelli NJ: Modern multimodality approach to hepatic colorectal metastases: solutions and controversies. Surg Oncol 16 (1): 71-83, 2007. [PUBMED Abstract]
- Pawlik TM, Choti MA: Surgical therapy for colorectal metastases to the liver. J Gastrointest Surg 11 (8): 1057-77, 2007. [PUBMED Abstract]
- Adson MA, van Heerden JA, Adson MH, et al.: Resection of hepatic metastases from colorectal cancer. Arch Surg 119 (6): 647-51, 1984. [PUBMED Abstract]
- Gayowski TJ, Iwatsuki S, Madariaga JR, et al.: Experience in hepatic resection for metastatic colorectal cancer: analysis of clinical and pathologic risk factors. Surgery 116 (4): 703-10; discussion 710-1, 1994. [PUBMED Abstract]
- Hughes KS, Simon R, Songhorabodi S, et al.: Resection of the liver for colorectal carcinoma metastases: a multi-institutional study of patterns of recurrence. Surgery 100 (2): 278-84, 1986. [PUBMED Abstract]
- Schlag P, Hohenberger P, Herfarth C: Resection of liver metastases in colorectal cancer--competitive analysis of treatment results in synchronous versus metachronous metastases. Eur J Surg Oncol 16 (4): 360-5, 1990. [PUBMED Abstract]
- Rosen CB, Nagorney DM, Taswell HF, et al.: Perioperative blood transfusion and determinants of survival after liver resection for metastatic colorectal carcinoma. Ann Surg 216 (4): 493-504; discussion 504-5, 1992. [PUBMED Abstract]
- Fong Y, Fortner J, Sun RL, et al.: Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg 230 (3): 309-18; discussion 318-21, 1999. [PUBMED Abstract]
- Scheele J, Stangl R, Altendorf-Hofmann A: Hepatic metastases from colorectal carcinoma: impact of surgical resection on the natural history. Br J Surg 77 (11): 1241-6, 1990. [PUBMED Abstract]
- Scheele J, Stangl R, Altendorf-Hofmann A, et al.: Indicators of prognosis after hepatic resection for colorectal secondaries. Surgery 110 (1): 13-29, 1991. [PUBMED Abstract]
- Wagman LD, Kemeny MM, Leong L, et al.: A prospective, randomized evaluation of the treatment of colorectal cancer metastatic to the liver. J Clin Oncol 8 (11): 1885-93, 1990. [PUBMED Abstract]
- Coppa GF, Eng K, Ranson JH, et al.: Hepatic resection for metastatic colon and rectal cancer. An evaluation of preoperative and postoperative factors. Ann Surg 202 (2): 203-8, 1985. [PUBMED Abstract]
- Taylor M, Forster J, Langer B, et al.: A study of prognostic factors for hepatic resection for colorectal metastases. Am J Surg 173 (6): 467-71, 1997. [PUBMED Abstract]
- Jaeck D, Bachellier P, Guiguet M, et al.: Long-term survival following resection of colorectal hepatic metastases. Association Française de Chirurgie. Br J Surg 84 (7): 977-80, 1997. [PUBMED Abstract]
- Fernández-Trigo V, Shamsa F, Sugarbaker PH: Repeat liver resections from colorectal metastasis. Repeat Hepatic Metastases Registry. Surgery 117 (3): 296-304, 1995. [PUBMED Abstract]
- Weeks JC, Nelson H, Gelber S, et al.: Short-term quality-of-life outcomes following laparoscopic-assisted colectomy vs open colectomy for colon cancer: a randomized trial. JAMA 287 (3): 321-8, 2002. [PUBMED Abstract]
- Higgins GA, Amadeo JH, McElhinney J, et al.: Efficacy of prolonged intermittent therapy with combined 5-fluorouracil and methyl-CCNU following resection for carcinoma of the large bowel. A Veterans Administration Surgical Oncology Group report. Cancer 53 (1): 1-8, 1984. [PUBMED Abstract]
- Buyse M, Zeleniuch-Jacquotte A, Chalmers TC: Adjuvant therapy of colorectal cancer. Why we still don't know. JAMA 259 (24): 3571-8, 1988. [PUBMED Abstract]
- Laurie JA, Moertel CG, Fleming TR, et al.: Surgical adjuvant therapy of large-bowel carcinoma: an evaluation of levamisole and the combination of levamisole and fluorouracil. The North Central Cancer Treatment Group and the Mayo Clinic. J Clin Oncol 7 (10): 1447-56, 1989. [PUBMED Abstract]
- Moertel CG, Fleming TR, Macdonald JS, et al.: Levamisole and fluorouracil for adjuvant therapy of resected colon carcinoma. N Engl J Med 322 (6): 352-8, 1990. [PUBMED Abstract]
- Leonard GD, Brenner B, Kemeny NE: Neoadjuvant chemotherapy before liver resection for patients with unresectable liver metastases from colorectal carcinoma. J Clin Oncol 23 (9): 2038-48, 2005. [PUBMED Abstract]
- Hernandez-Alejandro R, Ruffolo LI, Sasaki K, et al.: Recipient and Donor Outcomes After Living-Donor Liver Transplant for Unresectable Colorectal Liver Metastases. JAMA Surg 157 (6): 524-530, 2022. [PUBMED Abstract]
- Adam R, Piedvache C, Chiche L, et al.: Chemotherapy and liver transplantation versus chemotherapy alone in patients with definitively unresectable colorectal liver metastases: A prospective multicentric randomized trial (TRANSMET). [Abstract] J Clin Oncol 46 (Suppl 16): A-3500, 2024.
- Rossi S, Buscarini E, Garbagnati F, et al.: Percutaneous treatment of small hepatic tumors by an expandable RF needle electrode. AJR Am J Roentgenol 170 (4): 1015-22, 1998. [PUBMED Abstract]
- Solbiati L, Livraghi T, Goldberg SN, et al.: Percutaneous radio-frequency ablation of hepatic metastases from colorectal cancer: long-term results in 117 patients. Radiology 221 (1): 159-66, 2001. [PUBMED Abstract]
- Lencioni R, Goletti O, Armillotta N, et al.: Radio-frequency thermal ablation of liver metastases with a cooled-tip electrode needle: results of a pilot clinical trial. Eur Radiol 8 (7): 1205-11, 1998. [PUBMED Abstract]
- Curley SA, Izzo F, Delrio P, et al.: Radiofrequency ablation of unresectable primary and metastatic hepatic malignancies: results in 123 patients. Ann Surg 230 (1): 1-8, 1999. [PUBMED Abstract]
- Oshowo A, Gillams A, Harrison E, et al.: Comparison of resection and radiofrequency ablation for treatment of solitary colorectal liver metastases. Br J Surg 90 (10): 1240-3, 2003. [PUBMED Abstract]
- Livraghi T, Solbiati L, Meloni F, et al.: Percutaneous radiofrequency ablation of liver metastases in potential candidates for resection: the "test-of-time approach". Cancer 97 (12): 3027-35, 2003. [PUBMED Abstract]
- Pawlik TM, Izzo F, Cohen DS, et al.: Combined resection and radiofrequency ablation for advanced hepatic malignancies: results in 172 patients. Ann Surg Oncol 10 (9): 1059-69, 2003. [PUBMED Abstract]
- Kemeny N, Huang Y, Cohen AM, et al.: Hepatic arterial infusion of chemotherapy after resection of hepatic metastases from colorectal cancer. N Engl J Med 341 (27): 2039-48, 1999. [PUBMED Abstract]
- Kemeny MM, Adak S, Gray B, et al.: Combined-modality treatment for resectable metastatic colorectal carcinoma to the liver: surgical resection of hepatic metastases in combination with continuous infusion of chemotherapy--an intergroup study. J Clin Oncol 20 (6): 1499-505, 2002. [PUBMED Abstract]
- Kemeny N, Daly J, Reichman B, et al.: Intrahepatic or systemic infusion of fluorodeoxyuridine in patients with liver metastases from colorectal carcinoma. A randomized trial. Ann Intern Med 107 (4): 459-65, 1987. [PUBMED Abstract]
- Chang AE, Schneider PD, Sugarbaker PH, et al.: A prospective randomized trial of regional versus systemic continuous 5-fluorodeoxyuridine chemotherapy in the treatment of colorectal liver metastases. Ann Surg 206 (6): 685-93, 1987. [PUBMED Abstract]
- Rougier P, Laplanche A, Huguier M, et al.: Hepatic arterial infusion of floxuridine in patients with liver metastases from colorectal carcinoma: long-term results of a prospective randomized trial. J Clin Oncol 10 (7): 1112-8, 1992. [PUBMED Abstract]
- Kemeny N, Cohen A, Seiter K, et al.: Randomized trial of hepatic arterial floxuridine, mitomycin, and carmustine versus floxuridine alone in previously treated patients with liver metastases from colorectal cancer. J Clin Oncol 11 (2): 330-5, 1993. [PUBMED Abstract]
- Reappraisal of hepatic arterial infusion in the treatment of nonresectable liver metastases from colorectal cancer. Meta-Analysis Group in Cancer. J Natl Cancer Inst 88 (5): 252-8, 1996. [PUBMED Abstract]
- McGinn CJ, Lawrence TS: Clinical Results of the Combination of Radiation and Fluoropyrimidines in the Treatment of Intrahepatic Cancer. Semin Radiat Oncol 7 (4): 313-323, 1997. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (04/30/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes hechos a este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este resumen.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de recto. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de recto son:
- Amit Chowdhry, MD, PhD (University of Rochester Medical Center)
- Leon Pappas, MD, PhD (Massachusetts General Hospital)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de recto. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/colorrectal/pro/tratamiento-rectal-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.