Tratamiento del sarcoma de tejido blando infantil (PDQ®)–Versión para profesionales de salud
Información general sobre el sarcoma de tejido blando infantil
Se han logrado mejoras notables en la supervivencia de niños y adolescentes con cáncer. Entre 1975 y 2020, la mortalidad por cáncer infantil disminuyó en más de un 50 %.[1-3] Los niños y adolescentes sobrevivientes de cáncer necesitan un seguimiento minucioso, ya que es posible que los efectos secundarios del tratamiento del cáncer persistan o se presenten meses o años después de este. Para obtener información sobre la incidencia, el tipo y la vigilancia de los efectos tardíos en los niños y adolescentes sobrevivientes de cáncer, consultar Efectos tardíos del tratamiento anticanceroso en la niñez.
Los sarcomas de tejido blando en niños son un grupo heterogéneo de tumores malignos que surgen en el tejido mesenquimatoso primitivo y representan el 6 % de todos los tumores infantiles (rabdomiosarcomas, 3 %; otros sarcomas de tejido blando, 3 %).[2] Para obtener más información, consultar la sección Clasificación histopatológica del sarcoma de tejido blando infantil.
El rabdomiosarcoma, un tumor de músculo estriado, es el sarcoma de tejido blando más común en los niños. Representa el 50 % de los sarcomas de tejido blando en niños de 0 a 14 años.[2] Para obtener más información, consultar Tratamiento del rabdomiosarcoma infantil.
En el ámbito de la pediatría, los otros tipos de sarcoma de tejido blando se llaman en conjunto sarcomas de tejido blando no rabdomiosarcomatosos y representan alrededor del 3,5 % de todos los tumores en los niños.[2,4] En este resumen se describe el tratamiento de los sarcomas de tejido blando no rabdomiosarcomatosos.
Los sarcomas de tejido blando no rabdomiosarcomatosos a menudo se clasifican según el tipo de tejido sano del cual se originan. Estos tejidos abarcan, entre otros, varios tipos de tejido conjuntivo, tejido del sistema nervioso periférico, tejido muscular liso y tejido vascular. La clasificación también incluye los tumores indiferenciados que no se vinculan con un tipo de tejido establecido con claridad. Para obtener más información sobre los tumores vasculares en los niños, consultar Tratamiento de los tumores vasculares infantiles.
Incidencia del sarcoma de tejido blando según la edad y el tipo histológico
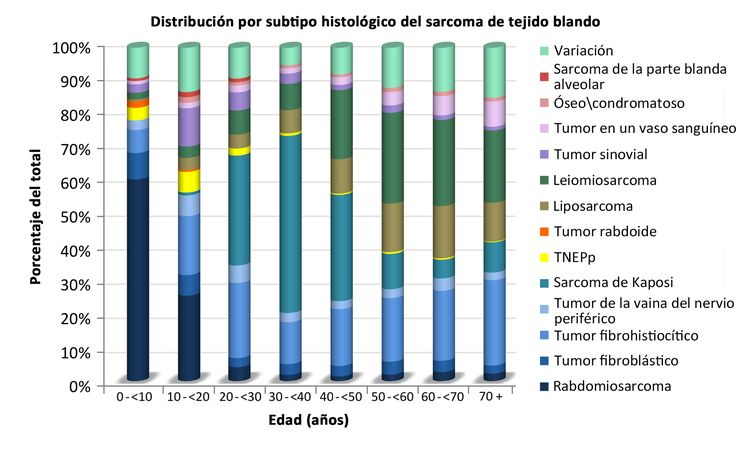
En el Cuadro 1 se presenta la distribución de los sarcomas de tejido blando de acuerdo con el tipo histológico y la edad, según la información del 2000 al 2015 del Surveillance, Epidemiology, and End Results (SEER) Program. En la Figura 2 también se muestra la distribución de los subtipos histológicos por edad.
| Edad <5 años | Edad 5–9 años | Edad 10–14 años | Edad 15–19 años | Edad <20 años | Todas las edades (incluso adultos) | |||
|---|---|---|---|---|---|---|---|---|
| TNEPp = tumores neuroectodérmicos primitivos periféricos; SEER = Surveillance, Epidemiology, and End Results. | ||||||||
| aFuente: Base de datos SEER.[5] | ||||||||
| Todos los sarcomas de tejido blando y otros sarcomas extraóseos | 1124 | 773 | 1201 | 1558 | 4656 | 80 269 | ||
| Rabdomiosarcomas | 668 | 417 | 382 | 327 | 1794 | 3284 | ||
| Fibrosarcomas, neoplasias de nervio periférico y otras neoplasias fibrosas | 137 | 64 | 112 | 181 | 494 | 6645 | ||
| Tumores fibroblásticos y miofibroblásticos | 114 | 33 | 41 | 77 | 265 | 4228 | ||
| Tumores de vaina nerviosa | 23 | 31 | 70 | 102 | 226 | 2303 | ||
| Otras neoplasias fibromatosas | 0 | 0 | 1 | 2 | 3 | 114 | ||
| Sarcoma de Kaposi | 2 | 1 | 2 | 10 | 15 | 7722 | ||
| Otros sarcomas de tejido blando específicos | 237 | 238 | 559 | 865 | 1899 | 49 004 | ||
| Tumor de Ewing y tumor de Askin de tejido blando | 37 | 36 | 72 | 113 | 258 | 596 | ||
| TNEPp de tejido blando | 24 | 23 | 42 | 56 | 145 | 402 | ||
| Tumor rabdoide extrarrenal | 75 | 8 | 9 | 4 | 96 | 205 | ||
| Liposarcomas | 4 | 6 | 37 | 79 | 126 | 10 749 | ||
| Tumores fibrohistiocíticos | 43 | 73 | 142 | 223 | 481 | 13 531 | ||
| Leiomiosarcomas | 11 | 14 | 19 | 41 | 85 | 14 107 | ||
| Sarcomas sinoviales | 12 | 39 | 141 | 210 | 402 | 2608 | ||
| Tumores de vasos sanguíneos | 12 | 9 | 11 | 32 | 64 | 4238 | ||
| Neoplasias óseas y condromatosas de tejido blando | 1 | 6 | 16 | 14 | 37 | 1018 | ||
| Sarcoma alveolar de partes blandas | 4 | 5 | 22 | 33 | 64 | 211 | ||
| Sarcomas de tejido blando de diversos tipos | 14 | 19 | 48 | 60 | 141 | 1339 | ||
| Sarcomas de tejido blando sin especificación | 80 | 53 | 146 | 175 | 454 | 13 614 | ||
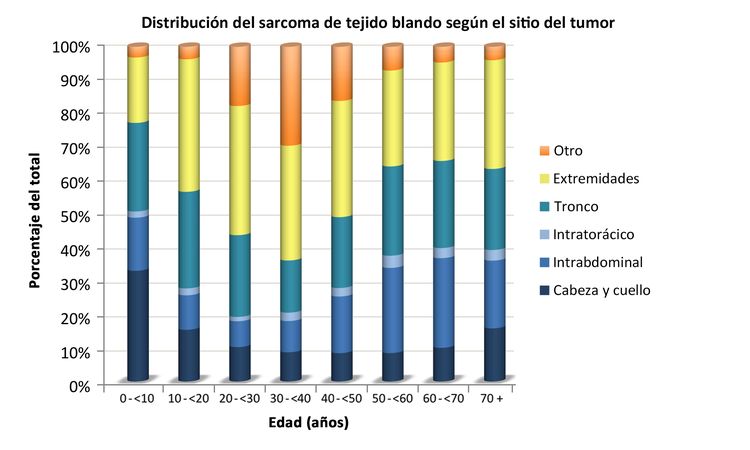
Los sarcomas de tejido blando no rabdomiosarcomatosos son más frecuentes en adolescentes y adultos,[6] La mayor parte de la información sobre el tratamiento y la evolución de la enfermedad en pacientes más jóvenes se ha obtenido de estudios en pacientes adultos. La distribución de estos tumores por edad de acuerdo con el estadio (Figura 1), subtipo histológico (Figura 2) y sitio tumoral (Figura 3) se muestran más adelante.[7]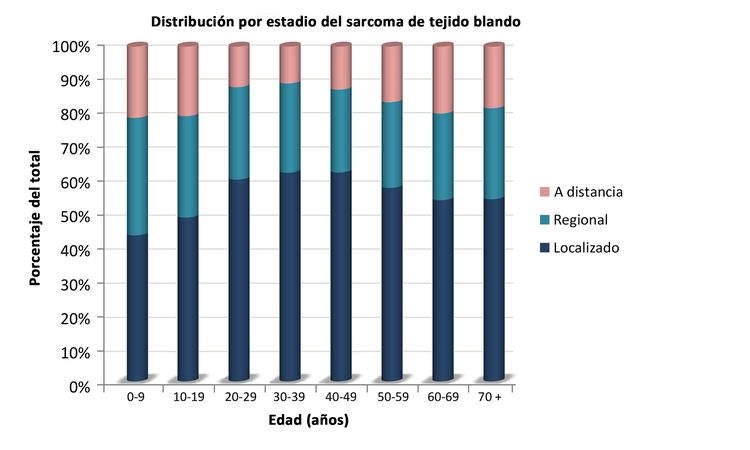
Factores de riesgo
A continuación se enumeran algunos factores genéticos y exposiciones externas asociadas con la formación de sarcomas de tejido blando no rabdomiosarcomatosos:
-
Factores genéticos.
- Síndrome de Li-Fraumeni: los pacientes con síndrome de Li-Fraumeni (suele originarse por cambios hereditarios oncógenos en el gen supresor de tumores TP53) tienen un aumento en el riesgo de presentar tumores de tejido blando (en especial, sarcoma de tejido blando no rabdomiosarcomatoso), sarcomas óseos, cáncer de mama, tumores de encéfalo y leucemia aguda.[8,9]
- Poliposis adenomatosa familiar: los pacientes con poliposis adenomatosa familiar tienen un aumento en el riesgo de presentar fibromatosis tipo desmoide.[10]
- Gen RB1: las variantes germinales del gen RB1 se han relacionado con un aumento en el riesgo de presentar sarcomas de tejido blando; en especial, leiomiosarcoma; el riesgo es mayor en los niños menores de 1 año que recibieron alquilantes.[11,12]
- Gen SMARCB1: las variantes germinales o deleciones del gen SMARCB1 (INI1) se asocian con un aumento en el riesgo de presentar tumores rabdoides extrarrenales.[13]
- Neurofibromatosis de tipo 1: alrededor del 4 % de los pacientes con neurofibromatosis de tipo 1 presentan tumores malignos de vaina de nervio periférico, que suelen aparecer tras una latencia prolongada; algunos pacientes presentan múltiples lesiones.[14-16]
- Síndrome de Werner: este síndrome se caracteriza por inestabilidad cromosómica espontánea que produce aumento de la susceptibilidad al cáncer y envejecimiento prematuro. Se ha notificado un exceso de sarcomas de tejido blando en pacientes con síndrome de Werner.[17]
- Complejo de esclerosis tuberosa: este complejo se asocia con diversos tumores que exhiben diferenciación perivascular de células epitelioides (PEComas), incluso linfangioleiomiomatosis y angiomiolipomas hepáticos y renales.[18-20]
- Inmunodeficiencia combinada grave por deficiencia de adenosina–desaminasa: se notificó que los pacientes con inmunodeficiencia combinada grave por déficit de adenosina–desaminasa tienen un aumento del riesgo de presentar dermatofibrosarcoma protuberante multicéntrico que, por lo general, aparece a una edad promedio de 8,9 años.[21]
-
Exposición a riesgos externos:
- Radiación: algunos sarcomas de tejido blando no rabdomiosarcomatosos (en especial, el histiocitoma fibroso maligno) se presentan dentro de los límites de un sitio que se irradió antes.[22-26]
- Infección por el virus de Epstein-Barr (VEB) en pacientes con síndrome de inmunodeficiencia adquirida: algunos sarcomas de tejido blando no rabdomiosarcomatosos (por ejemplo, el leiomiosarcoma) se han relacionado con la infección por el VEB en pacientes con SIDA.[22,27]
Cuadro clínico inicial
Los sarcomas de tejido blando no rabdomiosarcomatoso pueden surgir en cualquier parte del cuerpo, pero suelen formarse en el tronco y las extremidades.[28-30] Aunque es poco frecuentes, es posible que estos tumores surjan en el tejido encefálico; el tratamiento dependerá del tipo histológico.[31]
Los sarcomas de tejido blando no rabdomiosarcomatoso a veces se manifiestan como una masa sólida asintomática y en otros casos producen síntomas por invasión local en estructuras anatómicas adyacentes. Los síntomas sistémicos (por ejemplo, fiebre, pérdida de peso y sudoración nocturna) son poco frecuentes. Se han notificado casos de hipoglucemia y raquitismo hipofosfatémico en pacientes con hemangiopericitoma (ahora identificado como tumor fibroso solitario según el sistema de clasificación revisado de la Organización Mundial de la Salud), y casos de hiperglucemia en pacientes con fibrosarcoma de pulmón.[32]
Evaluación para el diagnóstico y la estadificación
Cuando se identifica una lesión sospechosa, es fundamental llevar a cabo una evaluación diagnóstica completa, seguida de una biopsia adecuada. Se usan los siguientes procedimientos para obtener imágenes de la lesión antes de iniciar cualquier intervención:
- Radiografías simples. Las radiografías simples sirven para descartar el compromiso óseo y detectar las calcificaciones que a veces se observan en tumores de tejido blando como el osteosarcoma extraesquelético o el sarcoma sinovial.
- Tomografía computarizada (TC). La TC de tórax es esencial para evaluar la presencia de metástasis. Es posible usar TC de abdomen para obtener imágenes de los tumores intraabdominales, como el liposarcoma. Los pacientes con sarcomas de tejido blando no rabdomiosarcomatosos que se trataron en 11 centros que formaban parte del European paediatric Soft Tissue Sarcoma Study Group (EpSSG) se analizaron de manera retrospectiva para evaluar el efecto de nódulos pulmonares indeterminados identificados en TC de tórax.[33] De los 206 pacientes analizados, 109 (52,9 %) no tenían nódulos, 78 (38 %) tenían al menos un nódulo indeterminado y 19 (9,2 %) tenían nódulos que cumplían con los criterios de metástasis. La tasa de supervivencia sin complicaciones (SSC) a 5 años fue del 78,5 % (intervalo de confianza [IC] 95 %, 69,4–85,1 %) en los pacientes sin nódulos y del 69,6 % (IC 95%, 57,9–78,7 %) en los pacientes con nódulos indeterminados (P = 0,135). La tasa de supervivencia general (SG) a 5 años fue del 87,4 % (IC 95 %, 79,3–92,5 %) en los pacientes sin nódulos y del 79,0 % (IC 95 %, 67,5–86,8 %) en los pacientes con nódulos indeterminados (P = 0,086).
- Imágenes por resonancia magnética (IRM). La IRM se usa para obtener imágenes de tumores intraabdominales, como el liposarcoma, y es imprescindible para las lesiones en las extremidades.
- Tomografía por emisión de positrones (TEP) y gammagrafía ósea. En un estudio retrospectivo, se completaron 46 TEP en 25 pacientes pediátricos con sarcoma de tejido blando.[34] El valor predictivo positivo de encontrar enfermedad metastásica fue del 89 % y el valor predictivo negativo fue del 67 %. En un estudio pequeño de 9 pacientes con sarcoma de tejido blando no rabdomiosarcomatoso, se indicó que la TEP-TC era más exacta y eficiente para identificar las metástasis a distancia que cualquiera de las modalidades solas.[35] El uso de esta modalidad en los sarcomas de tejido blando no rabdomiosarcomatosos pediátricos no se ha estudiado de manera prospectiva.
Las características de las imágenes de algunos tumores son sumamente orientadoras del diagnóstico. Por ejemplo, se describieron las características de las imágenes del sarcoma fibromixoide infantil de grado bajo y del sarcoma alveolar de partes blandas que sirven para ayudar a diagnosticar estas neoplasias raras.[36]
Estrategias para la toma de biopsias
Aunque desde el punto de vista patológico los tumores del tejido blando no rabdomiosarcomatosos se distinguen del rabdomiosarcoma y del sarcoma de Ewing, la clasificación de este tipo de sarcoma a menudo es difícil. Para el diagnóstico del sarcoma de tejido blando no rabdomiosarcomatoso, se puede usar biopsia con aguja gruesa, biopsia por incisión o biopsia por escisión. En la medida de lo posible, el cirujano que realizará la resección definitiva debe participar en la decisión sobre el tipo de biopsia. La ubicación inadecuada de las incisiones o de las agujas de biopsia puede afectar la capacidad para obtener márgenes negativos.
Las técnicas de biopsia con aguja deben garantizar un muestreo tisular adecuado. Dada la importancia diagnóstica de las translocaciones y otros cambios moleculares, es esencial una biopsia con aguja gruesa o una biopsia por incisión pequeña que permita obtener suficiente tejido tumoral para el análisis histológico convencional e inmunocitoquímico, al igual que otros estudios, como microscopia óptica y electrónica, citogenética, hibridación fluorescente in situ y patología molecular.[37,38]
En ocasiones, es necesario obtener múltiples muestras de tejido. De 530 casos de presuntas masas de tejido blando de pacientes (en su mayoría adultos) que se sometieron a biopsia con aguja gruesa, se demostró que 426 (80 %) eran tumores de tejido blando, de los cuales 225 (52,8 %) eran malignos. La biopsia con aguja gruesa permitió diferenciar el sarcoma de tejido blando de las lesiones benignas con una sensibilidad del 96,3 % y una especificidad del 99,4 %. El subtipo del tumor se designó de manera correcta en el 89,5 % de las lesiones benignas y en el 88 % de los sarcomas de tejido blando. La tasa de complicaciones de la biopsia fue del 0,4 %.[39]
Los aspectos a tener en cuenta durante el procedimiento de una biopsia son los siguientes:
- La biopsia con aguja gruesa de un tumor ubicado en tejido profundo puede causar un hematoma, que luego repercute en la resección o la administración de radiación porque el volumen irradiado debe abarcar el hematoma.
- Por lo general no se recomienda la biopsia con aguja fina porque es difícil determinar el diagnóstico histológico exacto y el grado tumoral de este grupo heterogéneo de tumores.
- Es posible que la biopsia se guíe con ecografía, TC o IRM con el fin de garantizar que sea representativa.[40] La guía por imagen es muy útil; en especial para lesiones profundas y con el fin de evitar cambios quísticos o tumores necróticos.[41]
- Las biopsias por incisión no deben comprometer la posibilidad de hacer una resección local amplia posterior.
- Se desaconsejan las biopsias por escisión de la lesión, ya que solo son apropiadas para lesiones superficiales pequeñas (<3 cm).[42,43] Si se contempla el uso de una biopsia por escisión, se recomienda obtener una IRM para definir el área de compromiso ya que quizás sea necesario someter al paciente a una cirugía o radioterapia posterior.
- En distintas series institucionales, se demostró la viabilidad y eficacia de la biopsia de ganglio centinela como procedimiento de estadificación en pacientes pediátricos con sarcomas de tejido blando.[44-49] En la actualidad, la utilidad de la biopsia de ganglio centinela se limita al sarcoma epitelioide, el sarcoma de células claras y el rabdomiosarcoma de tronco y extremidades.[50]
En un estudio prospectivo de pacientes pediátricos con sarcoma que se sometieron a biopsia de ganglio linfático centinela, se examinaron 28 pacientes. Los resultados de la biopsia de ganglio linfático centinela fueron positivos para compromiso tumoral en 7 de 28 pacientes, entre ellos 3 pacientes (43 %) cuyas TEP-TC fueron negativas para compromiso tumoral. La TEP-TC sobrestimó el compromiso ganglionar en 14 pacientes más que el número confirmado mediante biopsia de ganglio linfático centinela. Los hallazgos de las biopsias de ganglio linfático centinela condujeron a un cambio en el tratamiento de los 7 pacientes que se determinó que tenían enfermedad metastásica. Como se indicó en informes anteriores, los 2 tipos de sarcoma de tejido blando no rabdomiosarcomatoso incluidos en este estudio fueron el sarcoma epitelioide y el sarcoma de células claras.[50]
- En el estudio ARST0332 (NCT00346164) los pacientes con sarcoma epitelioide, sarcoma de células claras, o que presentaban ganglios agrandados en las imágenes radiográficas, se sometieron a muestreo de ganglios regionales. Se identificaron metástasis ganglionares en 20 pacientes (3,8 %), y todos, excepto uno, presentaron evidencia radiográfica de compromiso ganglionar. Los tipos histológicos más comunes fueron el sarcoma epitelioide (18 %), el angiosarcoma (17 %) y el sarcoma de células claras (14 %). Los pacientes con metástasis ganglionares aisladas tuvieron un desenlace similar al de aquellos que no tenían metástasis a distancia (tasas de SG a 5 años, 85 vs. 87 %). En este estudio se recomendaron las biopsias de ganglio linfático centinela, aunque no fueron un requisito. En la mayoría de los pacientes no se hizo biopsia de ganglio linfático centinela porque presentaban evidencia clínica de ganglios agrandados. Cabe destacar que 3 pacientes sin evidencia clínica de metástasis ganglionar en el momento del ingreso al estudio presentaron insuficiencia de cuencas ganglionares. A uno de estos pacientes se le tomaron muestras de 3 ganglios linfáticos en 2 cuencas diferentes mediante biopsia de ganglio linfático centinela y fueron negativas en el análisis patológico.[51]
Se evitan las incisiones transversales en las extremidades para disminuir la pérdida de piel durante una resección posterior y porque estas exigen que se abarque un volumen transversal de tejido mayor en el campo de radiación. También se evitan otros procedimientos quirúrgicos radicales antes del diagnóstico definitivo.
Por estas razones, se recomienda mucho la biopsia abierta o varias biopsias con aguja gruesa para obtener suficiente tejido tumoral para los estudios cruciales y, para evitar restringir las opciones de tratamiento en el futuro.
Resección no planificada
En los niños sometidos a una resección no planificada de un sarcoma de tejido blando no rabdomiosarcomatoso, es frecuente que se recomiende una resección posterior debido a que muchos pacientes presentarán compromiso tumoral de la pieza extirpada.[52,53] En un análisis de una sola institución con adolescentes y adultos, se comparó un grupo de pacientes sometidos a resección no planificada de un sarcoma de tejido blando y un grupo de control de pacientes emparejados según el estadio. En este análisis retrospectivo, la resección inicial no planificada de un sarcoma de tejido blando aumentó el riesgo de recidiva local, metástasis y muerte. Este incremento fue mayor en los tumores de grado alto.[54][Nivel de evidencia C1] En este caso, se espera una segunda resección.
Anomalías cromosómicas
Muchos sarcomas de tejido blando no rabdomiosarcomatoso se caracterizan por presentar anomalías cromosómicas. Algunas de estas translocaciones cromosómicas producen la fusión de 2 genes dispares. El transcrito de fusión resultante se puede detectar con facilidad mediante técnicas de reacción en cadena de la polimerasa; esto facilita el diagnóstico de estas neoplasias con translocaciones.
Algunas de las anomalías más frecuentes de los tumores de tejido blando no rabdomiosarcomatosos se describen en el Cuadro 2.
| Características histológicas | Anomalías cromosómicas | Genes comprometidos |
|---|---|---|
| aAdaptación de Sandberg,[55] Slater et al.,[56] Mertens et al.,[57] Romeo[58] y Schaefer et al[59] | ||
| Sarcoma alveolar de partes blandas | t(x;17)(p11.2;q25) | ASPSCR1::TFE3 [60-62] |
| Histiocitoma fibroso angiomatoide | t(12;16)(q13;p11), t(2;22)(q33;q12) y t(12;22)(q13;q12) | FUS::ATF1, EWSR1::CREB1,[63] EWSR1::ATF1 |
| Sarcomas con reordenamiento de BCOR | inv(X)(p11.4;p11.2) | BCOR::CCNB3 |
| Sarcomas con reordenamiento de CIC | t(4;19)(q35;q13) y t(10;19)(q26;q13) | CIC::DUX4 |
| Sarcoma de células claras | t(12;22)(q13;q12) y t(2;22)(q33;q12) | EWSR::ATF1, EWSR1::CREB1 [64] |
| Fibrosarcoma congénito (infantil) o nefroma mesoblástico | t(12;15)(p13;q25) | ETV6::NTRK3 |
| Dermatofibrosarcoma protuberante | t(17;22)(q22;q13) | COL1A1::PDGFB |
| Fibromatosis desmoide | Trisomía 8 o 20, pérdida de 5q21 | Variantes de CTNNB1 o APC |
| Tumores desmoplásicos de células redondas pequeñas | t(11;22)(p13;q12) | EWSR1::WT1[65,66] |
| Hemangioendotelioma epitelioide | t(1;3)(p36;q25) [67] | WWTR1::CAMTA1 |
| Sarcoma epitelioide | Inactivación de SMARCB1 | SMARCB1 |
| Condrosarcoma mixoide extraesquelético | t(9;22)(q22;q12), t(9;17)(q22;q11), t(9;15)(q22;q21) y t(3;9)(q11;q22) | EWSR1::NR4A3, TAF2N::NR4A3, TCF12::NR4A3, TFG::NR4A3 |
| Hemangiopericitoma | t(12;19)(q13;q13.3) y t(13;22)(q22;q13.3) | LMNA::NTRK1 [68] |
| Fibrosarcoma infantil | t(12;15)(p13;q25) | ETV6::NTRK3 |
| Tumor miofibroblástico inflamatorio | t(1;2)(q23;q13), t(2;19)(q23;2), t(q23;17)(q23;2), t(2;q13)(p23;q23), t(2;11)(p23;p15) [69] | TPM3::ALK, TPM4::ALK, CLTC::ALK, RANBP2::ALK, CARS1::ALK, RAS |
| Miofibromatosis infantil | Variantes de ganancia de función | PDGFRB [70] |
| Sarcoma fibromixoide de grado bajo | t(7;16)(q33;p11) y t(11;16)(p11;p11) | FUS::CREB3L2, FUS::CREB3L1 |
| Tumor maligno de vaina de nervio periférico | 17q11.2, pérdida o reordenamiento de 10p, 11q, 17q y 22q | NF1 |
| Condrosarcoma mesenquimatoso | del(8)(q13.3q21.1) | HEY1::NCOA2 |
| Mioepitelioma | t(19;22)(q13;q12), t(1;22)(q23;q12) y t(6;22)(p21;q12) | EWSR1::ZNF44, EWSR1::PBX1, EWSR1::POU5F1 |
| Liposarcoma mixoide o de células redondas | t(12;16)(q13;p11) y t(12;22)(q13;q12) | FUS::DDIT3, EWSR1::DDIT3 |
| Tumor mesenquimatoso mixoide primitivo de la infancia | Duplicación interna en tándem | BCOR |
| Tumor rabdoide | Inactivación de SMARCB1 | SMARCB1 |
| Fibrosarcoma epitelioide esclerosante | T(11;22)(p11;q12) y t(19;22)(p13;q12) | EWSR1::CREB3L1, EWSR1::CREB3L3 |
| Tumor fibroso solitario | inv(12)(q13q13) | NAB2::STAT6 |
| Sarcoma sinovial | t(x;18)(p11.2;q11.2) | SS18::SSX |
| Tumor tenosinovial de células gigantes | t(1;2)(p13;q35) | COL6A3::CSF1 |
Pronóstico y factores pronósticos
El pronóstico del sarcoma de tejido blando no rabdomiosarcomatoso varía en gran medida según los siguientes factores:[71-73]
- Sitio del tumor primario.
- Tamaño del tumor.
- Grado del tumor. Para obtener más información, consultar la sección Sistema de clasificación por grados tumorales patológicos del sarcoma de tejido blando.
- Tipo histológico del tumor.
- Profundidad de la invasión tumoral.
- Presencia de metástasis y sitio del tumor metastásico.
- Resecabilidad del tumor.
- Uso de radioterapia.
En una revisión de una serie grande de adultos con sarcoma de tejido blando no rabdomiosarcomatoso, se encontró que los pacientes con sarcomas superficiales de extremidades tuvieron un pronóstico mejor que aquellos con tumores profundos. Por lo tanto, además del grado y el tamaño, se debe considerar la profundidad de la invasión tumoral.[74]
En varias series de adultos y niños, se observó que los pacientes con tumores grandes o invasores tienen un pronóstico significativamente más precario que el de aquellos con tumores pequeños no invasores. En una revisión retrospectiva de sarcomas de tejido blando en niños y adolescentes, se indica que el límite de 5 cm para los adultos con sarcoma de tejido blando quizás no sea apropiado en niños pequeños, sobre todo, en los lactantes. En la revisión se identificó una interacción entre el diámetro del tumor y el área de superficie corporal.[75] Se ha cuestionado esta relación y se necesitan más estudios para determinar las consecuencias terapéuticas de dicha observación.[76]
Algunos sarcomas de tejido blando no rabdomiosarcomatoso en niños tienen mejores desenlaces. Por ejemplo, los pacientes con fibrosarcoma infantil que se presenta a los 4 años o menos tienen un pronóstico excelente. Estos desenlaces se deben a que la cirugía sola logra curar a una cantidad significativa de estos pacientes, y a que el tumor es muy quimiosensible. Este tumor también responde bien al larotrectinib, un inhibidor específico de la cinasa del receptor de tropomiosina.[22,77]
Pronóstico de acuerdo al ensayo ARST0332 del Children's Oncology Group
A menudo, los sarcomas de tejido blando en niños mayores y adolescentes tienen un comportamiento semejante a los de pacientes adultos.[22,78] En un estudio de gran tamaño prospectivo multinacional del Children's Oncology Group (COG) (ARST0332 [NCT00346164]), se inscribieron pacientes menores de 30 años recién diagnosticados. Los pacientes se asignaron al tratamiento según el grupo de riesgo. Los grupos de riesgo se definieron por la presencia de metástasis, la resecabilidad y los márgenes tumorales, así como por el tamaño y el grado del tumor. Para obtener más información, consultar la Figura 4.[79][Nivel de evidencia B4]
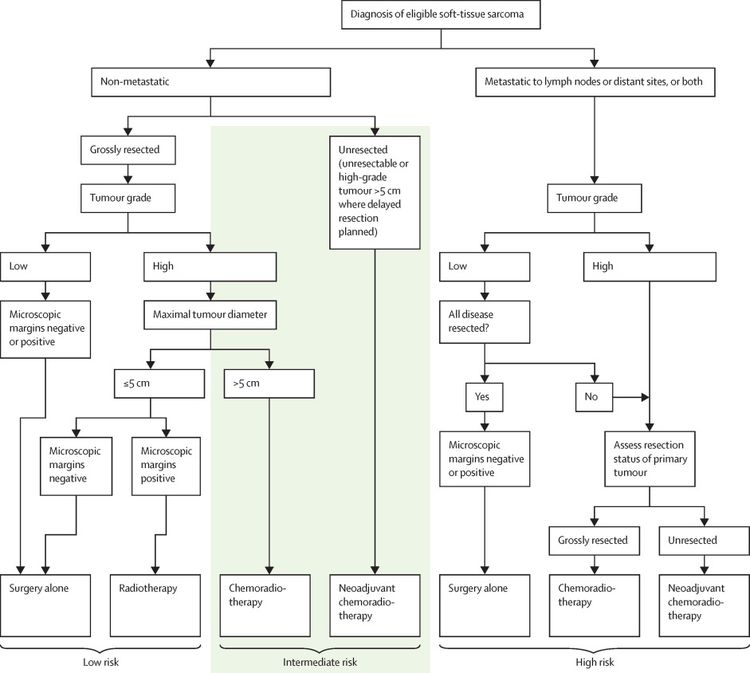
Cada paciente se asignó a 1 de 3 grupos de riesgo y a 1 de 4 grupos de tratamiento. Los grupos de riesgo fueron los siguientes:[79]
- Riesgo bajo: tumor de grado bajo no metastásico con resección R0 (resección completa con márgenes negativos al microscópico) o R1 (márgenes positivos al microscopio) o tumor de grado alto ≤5 cm con resección R1.
- Riesgo intermedio: tumor de grado alto no metastásico con resección R0 o tumor de grado alto >5 cm con resección R1 o tumor no resecado de cualquier tamaño o grado.
- Riesgo alto: tumor metastásico.
Los grupos de tratamiento fueron los siguientes:
- Cirugía sola (n = 205).
- Radioterapia (55,8 Gy) (n = 17).
- Quimiorradioterapia (quimioterapia y radioterapia de 55,8 Gy) (n = 111).
- Quimiorradioterapia neoadyuvante (quimioterapia y 45 Gy de radioterapia; luego, cirugía y refuerzo de radioterapia según los márgenes, y quimioterapia continuada) (n = 196).
La quimioterapia incluyó 6 ciclos de ifosfamida (3 g/m2 por dosis) administrada por vía intravenosa los días 1 a 3 y 5 ciclos de doxorrubicina (37,5 mg/m2 por dosis) administrada por vía intravenosa los días 1 a 2 cada 3 semanas, con ajuste de la secuencia de acuerdo con el momento de la cirugía o la radioterapia.
De los 550 pacientes inscritos, se incluyeron 529 pacientes evaluables en el análisis; al cabo de una mediana de seguimiento de 6,5 años (intervalo intercuartílico [RIC], 4,9–7,9), se obtuvieron los resultados de supervivencia que se muestran en el Cuadro 3.
| Supervivencia sin complicaciones a 5 años | Supervivencia general a 5 años | |||
|---|---|---|---|---|
| Grupo de riesgo | Episodios/pacientes | Estimación, % (IC 95 %) | Episodios/pacientes | Estimación, % (IC 95 %) |
| IC = intervalo de confianza; R0 = extirpado por completo con márgenes microscópicos negativos; R1 = extirpado de forma macroscópica pero con márgenes microscópicos positivos; R2 = escisión macroscópica incompleta. | ||||
| Bajo | 26/222 | 88,9 (84,0–93,8) | 10/222 | 96,2 (93,2–99,2) |
| Intermedio | 84/227 | 65,0 (58,2–71,8) | 55/227 | 79,2 (73,4–85,0) |
| Alto | 63/80 | 21,2 (11,4–31,1) | 52/80 | 35,5 (23,6–47,4) |
| Margen quirúrgico | ||||
| R0 | 44/252 | 83,6 (78,3–89,0) | 22/252 | 92,8 (89,1–96,5) |
| R1 | 29/81 | 66,2 (54,8–77,5) | 17/81 | 79,7 (70,0–89,5) |
| R2 | 100/196 | 49,2 (41,4–57,0) | 78/196 | 62,7 (55,2–70,3) |
Los pacientes pediátricos con sarcoma de tejido blando no rabdomiosarcomatoso localizado no resecado tienen un pronóstico precario. Solo alrededor de un tercio de los pacientes tratados con terapia multimodal permanecen sin enfermedad.[71,80]; [81,82][Nivel de evidencia C1] En una revisión italiana de 30 pacientes con sarcoma de tejido blando no rabdomiosarcomatoso en sitios viscerales, solo 10 pacientes sobrevivieron a los 5 años. Los factores pronósticos desfavorables fueron la incapacidad de lograr una resección completa, el tumor de gran tamaño, la invasión tumoral, el subtipo histológico y los sitios de pleuropulmonares.[83][Nivel de evidencia C1]
Pronóstico de acuerdo al estudio NRSTS 2005 del European Pediatric Soft Tissue Sarcoma Study Group
El European Pediatric Soft Tissue Sarcoma Study Group (EpSSG) llevó a cabo un ensayo prospectivo para pacientes menores de 21 años con sarcoma de tejido blando no rabdomiosarcomatoso. El grupo analizó a 206 pacientes con sarcoma sinovial y 363 pacientes con sarcoma de tejido blando no rabdomiosarcomatoso de tipo adulto. Los pacientes se trataron según los grupos de riesgo asignados. Para obtener más información en inglés, consultar la Figura 5.[84] Al cabo de una mediana de seguimiento de 80 meses (intervalo intercuartílico, 54,3–111,3) en los 467 pacientes sobrevivientes, la tasa de supervivencia sin complicaciones (SSC) a 5 años fue del 73,7 % (IC 95 %, 69,7–77,2 %) y la tasa de SG fue del 83,8 % (IC 95 %, 80,3–86,7 %). La supervivencia por grupos de tratamiento se muestra en el Cuadro 4.[84]
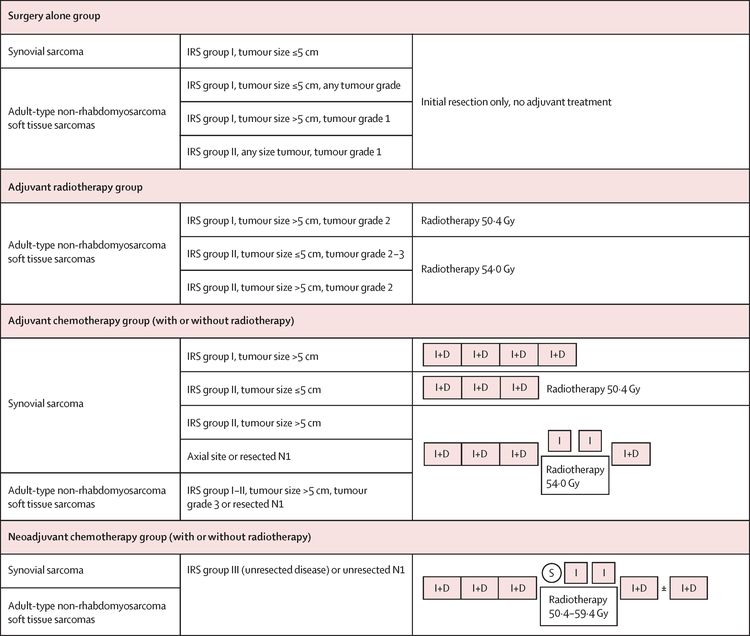
| Grupo de tratamiento | Tasa de supervivencia sin complicaciones a 5 años (IC 95 %) | Tasa de supervivencia general a 5 años (IC 95 %) | Tasa de recidiva local |
|---|---|---|---|
| IC = intervalo de confianza; EpSSG = European Pediatric Soft Tissue Sarcoma Study Group; NRSTS = sarcoma de tejido blando no rabdomiosarcomatoso. | |||
| Cirugía sola | 91,4 % (87,0–94,4 %) | 98,1 % (95,0–99,3 %) | |
| Radioterapia adyuvante sola | 75,5 % (46,9–90,1 %) | 88,2 % (60,6–96,9 %) | 6,7 % (1/15) |
| Quimioterapia adyuvante con radioterapia o sin esta | 65,6 % (54,8–74,5 %) | 75,8 % (65,3–83,5 %) | 10,8 % (7/65) |
| Quimioterapia neoadyuvante con radioterapia o sin esta | 56,4 % (49,3–63,0 %) | 70,4 % (63,3–76,4 %) | 14,2 % (16/113) |
En general, el control local después de la radioterapia fue el siguiente: R0, 106 de 109 pacientes (97 %); R1, 51 de 60 pacientes (85 %); y R2 o irresecable, 2 de 6 pacientes (33 %). Los factores de predicción de recidiva local fueron el grado de la resección diferida (P < 0,001), las imágenes de la respuesta antes de la cirugía diferida (P < 0,001), el subtipo histológico (P < 0,001) y la ausencia de radioterapia (P = 0,046). La SSC a 5 años fue significativamente más baja en los pacientes que no pudieron someterse a resección R0 o R1 (P = 0,0003).[85]
Los autores concluyeron que la terapia adyuvante podría omitirse sin repercusión desfavorable en el grupo de pacientes asignados a cirugía sola. También determinaron que la mejora del desenlace en los pacientes con sarcoma de tejido blando no rabdomiosarcomatoso de tipo adulto de riesgo alto, que se someten a resección inicial y aquellos que no se someten a resección inicial, sigue presentando una dificultad clínica importante.[84]
En un análisis agrupado realizado por centros pediátricos de los Estados Unidos y Europa, el desenlace fue mejor en aquellos pacientes cuya resección tumoral se consideró completa que para los pacientes cuya resección fue incompleta. El desenlace fue mejor en los pacientes que recibieron radioterapia que en los pacientes que no la recibieron.[81][Nivel de evidencia C1]
El tratamiento ideal para cada paciente se debe determinar de modo cuidadoso e individual usando estos factores pronósticos antes de iniciar el tratamiento, porque la morbilidad a largo plazo se debe reducir al mínimo mientras la supervivencia sin enfermedad se aumenta al máximo.[29,86-90]
Bibliografía
- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014. [PUBMED Abstract]
- National Cancer Institute: NCCR*Explorer: An interactive website for NCCR cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed February 25, 2025.
- Surveillance Research Program, National Cancer Institute: SEER*Explorer: An interactive website for SEER cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed December 30, 2024.
- Hawkins DS, Black JO, Orbach D, et al.: Nonrhabdomyosarcoma soft-tissue sarcomas. In: Blaney SM, Helman LJ, Adamson PC, eds.: Pizzo and Poplack's Pediatric Oncology. 8th ed. Wolters Kluwer, 2020, pp 721-46.
- Surveillance, Epidemiology, and End Results (SEER) Program: SEER*Stat Database: Incidence - SEER 18 Regs Research Data + Hurricane Katrina Impacted Louisiana Cases, Nov 2017 Sub (1973-2015 varying) - Linked To County Attributes - Total U.S., 1969-2016 Counties [Database]. National Cancer Institute, DCCPS, Surveillance Research Program, released April 2018, based on the November 2017 submission. Available online. Last accessed October 12, 2022.
- Weiss SW, Goldblum JR: General considerations. In: Weiss SW, Goldblum JR: Enzinger and Weiss's Soft Tissue Tumors. 5th ed. Mosby, 2008, pp 1-14.
- Ferrari A, Sultan I, Huang TT, et al.: Soft tissue sarcoma across the age spectrum: a population-based study from the Surveillance Epidemiology and End Results database. Pediatr Blood Cancer 57 (6): 943-9, 2011. [PUBMED Abstract]
- Chang F, Syrjänen S, Syrjänen K: Implications of the p53 tumor-suppressor gene in clinical oncology. J Clin Oncol 13 (4): 1009-22, 1995. [PUBMED Abstract]
- Plon SE, Malkin D: Childhood cancer and hereditary. In: Pizzo PA, Poplack DG, eds.: Principles and Practice of Pediatric Oncology. 7th ed. Lippincott Williams and Wilkins, 2015, pp 13-31.
- Groen EJ, Roos A, Muntinghe FL, et al.: Extra-intestinal manifestations of familial adenomatous polyposis. Ann Surg Oncol 15 (9): 2439-50, 2008. [PUBMED Abstract]
- Kleinerman RA, Tucker MA, Abramson DH, et al.: Risk of soft tissue sarcomas by individual subtype in survivors of hereditary retinoblastoma. J Natl Cancer Inst 99 (1): 24-31, 2007. [PUBMED Abstract]
- Wong JR, Morton LM, Tucker MA, et al.: Risk of subsequent malignant neoplasms in long-term hereditary retinoblastoma survivors after chemotherapy and radiotherapy. J Clin Oncol 32 (29): 3284-90, 2014. [PUBMED Abstract]
- Eaton KW, Tooke LS, Wainwright LM, et al.: Spectrum of SMARCB1/INI1 mutations in familial and sporadic rhabdoid tumors. Pediatr Blood Cancer 56 (1): 7-15, 2011. [PUBMED Abstract]
- Weiss SW, Goldblum JR: Benign tumors of peripheral nerves. In: Weiss SW, Goldblum JR: Enzinger and Weiss's Soft Tissue Tumors. 5th ed. Mosby, 2008, pp 825-901.
- deCou JM, Rao BN, Parham DM, et al.: Malignant peripheral nerve sheath tumors: the St. Jude Children's Research Hospital experience. Ann Surg Oncol 2 (6): 524-9, 1995. [PUBMED Abstract]
- Stark AM, Buhl R, Hugo HH, et al.: Malignant peripheral nerve sheath tumours--report of 8 cases and review of the literature. Acta Neurochir (Wien) 143 (4): 357-63; discussion 363-4, 2001. [PUBMED Abstract]
- Goto M, Miller RW, Ishikawa Y, et al.: Excess of rare cancers in Werner syndrome (adult progeria). Cancer Epidemiol Biomarkers Prev 5 (4): 239-46, 1996. [PUBMED Abstract]
- Fricke BL, Donnelly LF, Casper KA, et al.: Frequency and imaging appearance of hepatic angiomyolipomas in pediatric and adult patients with tuberous sclerosis. AJR Am J Roentgenol 182 (4): 1027-30, 2004. [PUBMED Abstract]
- Adriaensen ME, Schaefer-Prokop CM, Duyndam DA, et al.: Radiological evidence of lymphangioleiomyomatosis in female and male patients with tuberous sclerosis complex. Clin Radiol 66 (7): 625-8, 2011. [PUBMED Abstract]
- Hornick JL, Fletcher CD: PEComa: what do we know so far? Histopathology 48 (1): 75-82, 2006. [PUBMED Abstract]
- Kesserwan C, Sokolic R, Cowen EW, et al.: Multicentric dermatofibrosarcoma protuberans in patients with adenosine deaminase-deficient severe combined immune deficiency. J Allergy Clin Immunol 129 (3): 762-769.e1, 2012. [PUBMED Abstract]
- Spunt SL, Million L, Coffin C: The nonrhabdomyosarcoma soft tissue sarcoma. In: Pizzo PA, Poplack DG, eds.: Principles and Practice of Pediatric Oncology. 7th ed. Lippincott Williams and Wilkins, 2015, pp 827-54.
- Weiss SW, Goldblum JR: Malignant fibrous histiocytoma (pleomorphic undifferentiated sarcoma). In: Weiss SW, Goldblum JR: Enzinger and Weiss's Soft Tissue Tumors. 5th ed. Mosby, 2008, pp 403-27.
- Tukenova M, Guibout C, Hawkins M, et al.: Radiation therapy and late mortality from second sarcoma, carcinoma, and hematological malignancies after a solid cancer in childhood. Int J Radiat Oncol Biol Phys 80 (2): 339-46, 2011. [PUBMED Abstract]
- Bartkowiak D, Humble N, Suhr P, et al.: Second cancer after radiotherapy, 1981-2007. Radiother Oncol 105 (1): 122-6, 2012. [PUBMED Abstract]
- Casey DL, Friedman DN, Moskowitz CS, et al.: Second cancer risk in childhood cancer survivors treated with intensity-modulated radiation therapy (IMRT). Pediatr Blood Cancer 62 (2): 311-316, 2015. [PUBMED Abstract]
- McClain KL, Leach CT, Jenson HB, et al.: Association of Epstein-Barr virus with leiomyosarcomas in children with AIDS. N Engl J Med 332 (1): 12-8, 1995. [PUBMED Abstract]
- Dillon P, Maurer H, Jenkins J, et al.: A prospective study of nonrhabdomyosarcoma soft tissue sarcomas in the pediatric age group. J Pediatr Surg 27 (2): 241-4; discussion 244-5, 1992. [PUBMED Abstract]
- Rao BN: Nonrhabdomyosarcoma in children: prognostic factors influencing survival. Semin Surg Oncol 9 (6): 524-31, 1993 Nov-Dec. [PUBMED Abstract]
- Zeytoonjian T, Mankin HJ, Gebhardt MC, et al.: Distal lower extremity sarcomas: frequency of occurrence and patient survival rate. Foot Ankle Int 25 (5): 325-30, 2004. [PUBMED Abstract]
- Benesch M, von Bueren AO, Dantonello T, et al.: Primary intracranial soft tissue sarcoma in children and adolescents: a cooperative analysis of the European CWS and HIT study groups. J Neurooncol 111 (3): 337-45, 2013. [PUBMED Abstract]
- Weiss SW, Goldblum JR: Miscellaneous tumors of intermediate malignancy. In: Weiss SW, Goldblum JR: Enzinger and Weiss's Soft Tissue Tumors. 5th ed. Mosby, 2008, pp 1093-1160.
- Giraudo C, Schoot R, Cardoen L, et al.: Indeterminate pulmonary nodules in non-rhabdomyosarcoma soft tissue sarcoma: A study of the European paediatric Soft Tissue Sarcoma Study Group. Cancer 130 (4): 597-608, 2024. [PUBMED Abstract]
- Mody RJ, Bui C, Hutchinson RJ, et al.: FDG PET imaging of childhood sarcomas. Pediatr Blood Cancer 54 (2): 222-7, 2010. [PUBMED Abstract]
- Tateishi U, Hosono A, Makimoto A, et al.: Accuracy of 18F fluorodeoxyglucose positron emission tomography/computed tomography in staging of pediatric sarcomas. J Pediatr Hematol Oncol 29 (9): 608-12, 2007. [PUBMED Abstract]
- Sargar K, Kao SC, Spunt SL, et al.: MRI and CT of Low-Grade Fibromyxoid Sarcoma in Children: A Report From Children's Oncology Group Study ARST0332. AJR Am J Roentgenol 205 (2): 414-20, 2015. [PUBMED Abstract]
- Weiss SW, Goldblum JR: Enzinger and Weiss's Soft Tissue Tumors. 5th ed. Mosby, 2008.
- Recommendations for the reporting of soft tissue sarcomas. Association of Directors of Anatomic and Surgical Pathology. Mod Pathol 11 (12): 1257-61, 1998. [PUBMED Abstract]
- Strauss DC, Qureshi YA, Hayes AJ, et al.: The role of core needle biopsy in the diagnosis of suspected soft tissue tumours. J Surg Oncol 102 (5): 523-9, 2010. [PUBMED Abstract]
- Chowdhury T, Barnacle A, Haque S, et al.: Ultrasound-guided core needle biopsy for the diagnosis of rhabdomyosarcoma in childhood. Pediatr Blood Cancer 53 (3): 356-60, 2009. [PUBMED Abstract]
- Tuttle R, Kane JM: Biopsy techniques for soft tissue and bowel sarcomas. J Surg Oncol 111 (5): 504-12, 2015. [PUBMED Abstract]
- Coffin CM, Dehner LP, O'Shea PA: Pediatric Soft Tissue Tumors: A Clinical, Pathological, and Therapeutic Approach. Williams and Wilkins, 1997.
- Smith LM, Watterson J, Scott SM: Medical and surgical management of pediatric soft tissue tumors. In: Coffin CM, Dehner LP, O'Shea PA: Pediatric Soft Tissue Tumors: A Clinical, Pathological, and Therapeutic Approach. Williams and Wilkins, 1997, pp 360-71.
- Neville HL, Andrassy RJ, Lally KP, et al.: Lymphatic mapping with sentinel node biopsy in pediatric patients. J Pediatr Surg 35 (6): 961-4, 2000. [PUBMED Abstract]
- Neville HL, Raney RB, Andrassy RJ, et al.: Multidisciplinary management of pediatric soft-tissue sarcoma. Oncology (Huntingt) 14 (10): 1471-81; discussion 1482-6, 1489-90, 2000. [PUBMED Abstract]
- Kayton ML, Delgado R, Busam K, et al.: Experience with 31 sentinel lymph node biopsies for sarcomas and carcinomas in pediatric patients. Cancer 112 (9): 2052-9, 2008. [PUBMED Abstract]
- Dall'Igna P, De Corti F, Alaggio R, et al.: Sentinel node biopsy in pediatric patients: the experience in a single institution. Eur J Pediatr Surg 24 (6): 482-7, 2014. [PUBMED Abstract]
- Parida L, Morrisson GT, Shammas A, et al.: Role of lymphoscintigraphy and sentinel lymph node biopsy in the management of pediatric melanoma and sarcoma. Pediatr Surg Int 28 (6): 571-8, 2012. [PUBMED Abstract]
- Alcorn KM, Deans KJ, Congeni A, et al.: Sentinel lymph node biopsy in pediatric soft tissue sarcoma patients: utility and concordance with imaging. J Pediatr Surg 48 (9): 1903-6, 2013. [PUBMED Abstract]
- Wagner LM, Kremer N, Gelfand MJ, et al.: Detection of lymph node metastases in pediatric and adolescent/young adult sarcoma: Sentinel lymph node biopsy versus fludeoxyglucose positron emission tomography imaging-A prospective trial. Cancer 123 (1): 155-160, 2017. [PUBMED Abstract]
- Alvarez E, He J, Spunt SL, et al.: Lymph node metastases in paediatric and young adult patients with non-rhabdomyosarcoma soft tissue sarcoma (NRSTS): Findings from Children's Oncology Group (COG) study ARST0332. Eur J Cancer 180: 89-98, 2023. [PUBMED Abstract]
- Chui CH, Spunt SL, Liu T, et al.: Is reexcision in pediatric nonrhabdomyosarcoma soft tissue sarcoma necessary after an initial unplanned resection? J Pediatr Surg 37 (10): 1424-9, 2002. [PUBMED Abstract]
- Cecchetto G, Guglielmi M, Inserra A, et al.: Primary re-excision: the Italian experience in patients with localized soft-tissue sarcomas. Pediatr Surg Int 17 (7): 532-4, 2001. [PUBMED Abstract]
- Qureshi YA, Huddy JR, Miller JD, et al.: Unplanned excision of soft tissue sarcoma results in increased rates of local recurrence despite full further oncological treatment. Ann Surg Oncol 19 (3): 871-7, 2012. [PUBMED Abstract]
- Sandberg AA: Translocations in malignant tumors. Am J Pathol 159 (6): 1979-80, 2001. [PUBMED Abstract]
- Slater O, Shipley J: Clinical relevance of molecular genetics to paediatric sarcomas. J Clin Pathol 60 (11): 1187-94, 2007. [PUBMED Abstract]
- Mertens F, Antonescu CR, Hohenberger P, et al.: Translocation-related sarcomas. Semin Oncol 36 (4): 312-23, 2009. [PUBMED Abstract]
- Romeo S, Dei Tos AP: Clinical application of molecular pathology in sarcomas. Curr Opin Oncol 23 (4): 379-84, 2011. [PUBMED Abstract]
- Schaefer IM, Cote GM, Hornick JL: Contemporary Sarcoma Diagnosis, Genetics, and Genomics. J Clin Oncol 36 (2): 101-110, 2018. [PUBMED Abstract]
- Ladanyi M, Lui MY, Antonescu CR, et al.: The der(17)t(X;17)(p11;q25) of human alveolar soft part sarcoma fuses the TFE3 transcription factor gene to ASPL, a novel gene at 17q25. Oncogene 20 (1): 48-57, 2001. [PUBMED Abstract]
- Ladanyi M: The emerging molecular genetics of sarcoma translocations. Diagn Mol Pathol 4 (3): 162-73, 1995. [PUBMED Abstract]
- Williams A, Bartle G, Sumathi VP, et al.: Detection of ASPL/TFE3 fusion transcripts and the TFE3 antigen in formalin-fixed, paraffin-embedded tissue in a series of 18 cases of alveolar soft part sarcoma: useful diagnostic tools in cases with unusual histological features. Virchows Arch 458 (3): 291-300, 2011. [PUBMED Abstract]
- Antonescu CR, Dal Cin P, Nafa K, et al.: EWSR1-CREB1 is the predominant gene fusion in angiomatoid fibrous histiocytoma. Genes Chromosomes Cancer 46 (12): 1051-60, 2007. [PUBMED Abstract]
- Hisaoka M, Ishida T, Kuo TT, et al.: Clear cell sarcoma of soft tissue: a clinicopathologic, immunohistochemical, and molecular analysis of 33 cases. Am J Surg Pathol 32 (3): 452-60, 2008. [PUBMED Abstract]
- Barnoud R, Sabourin JC, Pasquier D, et al.: Immunohistochemical expression of WT1 by desmoplastic small round cell tumor: a comparative study with other small round cell tumors. Am J Surg Pathol 24 (6): 830-6, 2000. [PUBMED Abstract]
- Wang LL, Perlman EJ, Vujanic GM, et al.: Desmoplastic small round cell tumor of the kidney in childhood. Am J Surg Pathol 31 (4): 576-84, 2007. [PUBMED Abstract]
- Errani C, Zhang L, Sung YS, et al.: A novel WWTR1-CAMTA1 gene fusion is a consistent abnormality in epithelioid hemangioendothelioma of different anatomic sites. Genes Chromosomes Cancer 50 (8): 644-53, 2011. [PUBMED Abstract]
- Haller F, Knopf J, Ackermann A, et al.: Paediatric and adult soft tissue sarcomas with NTRK1 gene fusions: a subset of spindle cell sarcomas unified by a prominent myopericytic/haemangiopericytic pattern. J Pathol 238 (5): 700-10, 2016. [PUBMED Abstract]
- Jain S, Xu R, Prieto VG, et al.: Molecular classification of soft tissue sarcomas and its clinical applications. Int J Clin Exp Pathol 3 (4): 416-28, 2010. [PUBMED Abstract]
- Agaimy A, Bieg M, Michal M, et al.: Recurrent Somatic PDGFRB Mutations in Sporadic Infantile/Solitary Adult Myofibromas But Not in Angioleiomyomas and Myopericytomas. Am J Surg Pathol 41 (2): 195-203, 2017. [PUBMED Abstract]
- Spunt SL, Hill DA, Motosue AM, et al.: Clinical features and outcome of initially unresected nonmetastatic pediatric nonrhabdomyosarcoma soft tissue sarcoma. J Clin Oncol 20 (15): 3225-35, 2002. [PUBMED Abstract]
- Spunt SL, Poquette CA, Hurt YS, et al.: Prognostic factors for children and adolescents with surgically resected nonrhabdomyosarcoma soft tissue sarcoma: an analysis of 121 patients treated at St Jude Children's Research Hospital. J Clin Oncol 17 (12): 3697-705, 1999. [PUBMED Abstract]
- Ferrari A, Casanova M, Collini P, et al.: Adult-type soft tissue sarcomas in pediatric-age patients: experience at the Istituto Nazionale Tumori in Milan. J Clin Oncol 23 (18): 4021-30, 2005. [PUBMED Abstract]
- Brooks AD, Heslin MJ, Leung DH, et al.: Superficial extremity soft tissue sarcoma: an analysis of prognostic factors. Ann Surg Oncol 5 (1): 41-7, 1998 Jan-Feb. [PUBMED Abstract]
- Ferrari A, Miceli R, Meazza C, et al.: Soft tissue sarcomas of childhood and adolescence: the prognostic role of tumor size in relation to patient body size. J Clin Oncol 27 (3): 371-6, 2009. [PUBMED Abstract]
- Rodeberg DA, Stoner JA, Garcia-Henriquez N, et al.: Tumor volume and patient weight as predictors of outcome in children with intermediate risk rhabdomyosarcoma: a report from the Children's Oncology Group. Cancer 117 (11): 2541-50, 2011. [PUBMED Abstract]
- Hong DS, DuBois SG, Kummar S, et al.: Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol 21 (4): 531-540, 2020. [PUBMED Abstract]
- Weiss SW, Goldblum JR: Enzinger and Weiss's Soft Tissue Tumors. 4th ed. Mosby, 2001.
- Spunt SL, Million L, Chi YY, et al.: A risk-based treatment strategy for non-rhabdomyosarcoma soft-tissue sarcomas in patients younger than 30 years (ARST0332): a Children's Oncology Group prospective study. Lancet Oncol 21 (1): 145-161, 2020. [PUBMED Abstract]
- O'Sullivan B, Davis AM, Turcotte R, et al.: Preoperative versus postoperative radiotherapy in soft-tissue sarcoma of the limbs: a randomised trial. Lancet 359 (9325): 2235-41, 2002. [PUBMED Abstract]
- Ferrari A, Miceli R, Rey A, et al.: Non-metastatic unresected paediatric non-rhabdomyosarcoma soft tissue sarcomas: results of a pooled analysis from United States and European groups. Eur J Cancer 47 (5): 724-31, 2011. [PUBMED Abstract]
- Smith KB, Indelicato DJ, Knapik JA, et al.: Definitive radiotherapy for unresectable pediatric and young adult nonrhabdomyosarcoma soft tissue sarcoma. Pediatr Blood Cancer 57 (2): 247-51, 2011. [PUBMED Abstract]
- Ferrari A, Magni C, Bergamaschi L, et al.: Pediatric nonrhabdomyosarcoma soft tissue sarcomas arising at visceral sites. Pediatr Blood Cancer 64 (9): , 2017. [PUBMED Abstract]
- Ferrari A, van Noesel MM, Brennan B, et al.: Paediatric non-rhabdomyosarcoma soft tissue sarcomas: the prospective NRSTS 2005 study by the European Pediatric Soft Tissue Sarcoma Study Group (EpSSG). Lancet Child Adolesc Health 5 (8): 546-558, 2021. [PUBMED Abstract]
- Million L, Hayes-Jordan A, Chi YY, et al.: Local Control For High-Grade Nonrhabdomyosarcoma Soft Tissue Sarcoma Assigned to Radiation Therapy on ARST0332: A Report From the Childrens Oncology Group. Int J Radiat Oncol Biol Phys 110 (3): 821-830, 2021. [PUBMED Abstract]
- Dillon PW, Whalen TV, Azizkhan RG, et al.: Neonatal soft tissue sarcomas: the influence of pathology on treatment and survival. Children's Cancer Group Surgical Committee. J Pediatr Surg 30 (7): 1038-41, 1995. [PUBMED Abstract]
- Pappo AS, Fontanesi J, Luo X, et al.: Synovial sarcoma in children and adolescents: the St Jude Children's Research Hospital experience. J Clin Oncol 12 (11): 2360-6, 1994. [PUBMED Abstract]
- Marcus KC, Grier HE, Shamberger RC, et al.: Childhood soft tissue sarcoma: a 20-year experience. J Pediatr 131 (4): 603-7, 1997. [PUBMED Abstract]
- Pratt CB, Pappo AS, Gieser P, et al.: Role of adjuvant chemotherapy in the treatment of surgically resected pediatric nonrhabdomyosarcomatous soft tissue sarcomas: A Pediatric Oncology Group Study. J Clin Oncol 17 (4): 1219, 1999. [PUBMED Abstract]
- Pratt CB, Maurer HM, Gieser P, et al.: Treatment of unresectable or metastatic pediatric soft tissue sarcomas with surgery, irradiation, and chemotherapy: a Pediatric Oncology Group study. Med Pediatr Oncol 30 (4): 201-9, 1998. [PUBMED Abstract]
Clasificación histopatológica del sarcoma de tejido blando infantil
Clasificación de los sarcomas de tejido blando de la Organización Mundial de la Salud
El sistema de clasificación de la Organización Mundial de la Salud (OMS) para el cáncer representa la nomenclatura común para el cáncer en todo el mundo. En los Estados Unidos, el American Joint Committee on Cancer (AJCC) adoptó este sistema para la estadificación del sarcoma y el College of American Pathologists (CAP) lo usa en los protocolos oncológicos de sarcomas de hueso y tejido blando. En 2020, la OMS publicó una revisión de la clasificación de tumores de tejido blando y hueso. Esta incluyó varias actualizaciones a los esquemas de clasificación, nomenclatura, asignación de grados y estratificación del riesgo existentes. La clasificación revisada incluye entidades descritas recientemente y tiene en cuenta las alteraciones moleculares.[1]
La clasificación por grados para los tumores de tejido blando es un tema polémico. La clasificación de la OMS del año 2020 representa el consenso de varios patólogos expertos en tejidos blandos y genetistas, así como de oncólogos, radiólogos y cirujanos. Esta edición, además, incorpora aspectos morfológicos e información genética en la clasificación. Por ejemplo, se incluyó una categoría de tumores nuevos llamada neoplasias de células fusiformes con reordenamiento de NTRK, mientras que el fibrosarcoma infantil se excluyó de este grupo. El sarcoma de Ewing se eliminó de la sección de tumores óseos y se incluyó en la sección de sarcomas indiferenciados de células pequeñas de hueso y tejido blando. Esta clasificación refleja los sitios de presentación variable y la variedad de translocaciones observadas en el sarcoma de Ewing. Esta clasificación también separó el sarcoma de Ewing de entidades como los sarcomas con reordenamiento de CIC, los sarcomas con reordenamiento de BCOR y las neoplasias con fusiones del gen EWSR1 que comprometen genes compañeros diferentes a ETS.[1]
- Tumores adipocíticos.
- Tumores adipocíticos benignos.
- Lipoma, sin otra indicación (SAI).
- Lipomatosis.
- Lipomatosis neural.
- Lipoblastomatosis.
- Angiolipoma, SAI.
- Miolipoma.
- Lipoma condroide.
- Lipoma de células fusiformes.
- Tumor lipomatoso de células fusiformes atípicas o pleomórfico.
- Hibernoma.
- Tumores adipocíticos intermedios (localmente invasores).
- Tumores adipocíticos malignos.
- Tumores adipocíticos benignos.
- Tumores osteocondrales.
- Tumores osteocondrales benignos.
- Condroma, SAI.
- Tumores osteocondrales malignos.
- Tumores osteocondrales benignos.
-
Tumores fibroblásticos y miofibroblásticos
- Tumores fibroblásticos y miofibroblásticos benignos.
- Fascitis nodular.
- Fascitis proliferativa.
- Miositis proliferativa.
- Miositis osificante y pseudotumor fibroóseo de los dedos.
- Fascitis isquémica.
- Elastofibroma.
- Hamartoma fibroso de la infancia.
- Fibromatosis colli.
- Fibromatosis hialina juvenil.
- Fibromatosis con cuerpos de inclusión.
- Fibroma de vaina tendinosa.
- Fibroblastoma desmoplásico.
- Miofibroblastoma.
- Fibroma aponeurótico calcificante.
- Tumor fibroblástico positivo para EWSR1::SMAD3 (nuevo).
- Angiomiofibroblastoma.
- Angiofibroma celular.
- Angiofibroma, SAI.
- Fibroma nucal.
- Fibromixoma acral.
- Fibroma de Gardner.
- Tumores fibroblásticos y miofibroblásticos intermedios (localmente invasores).
- Tumor fibroso solitario benigno.
- Fibromatosis de tipo palmoplantar.
- Fibromatosis tipo desmoide (denominada anteriormente tumor desmoide o fibromatosis agresiva).
- Lipofibromatosis.
- Fibroblastoma de células gigantes.
- Tumores fibroblásticos y miofibroblásticos intermedios (metastatizan con poca frecuencia).
- Dermatofibrosarcoma protuberante, sin otra indicación.
- Dermatofibrosarcoma protuberante pigmentado.
- Dermatofibrosarcoma protuberante fibrosarcomatoso.
- Dermatofibrosarcoma protuberante mixoide.
- Dermatofibrosarcoma protuberante en forma de placa.
- Tumor fibroso solitario, SAI.
- Tumor miofibroblástico inflamatorio.
- Sarcoma miofibroblástico inflamatorio epitelioide.
- Sarcoma miofibroblástico.
- Tumor fibroblástico superficial positivo para CD34.
- Sarcoma fibroblástico mixoinflamatorio.
- Fibrosarcoma infantil.[2]
- Dermatofibrosarcoma protuberante, sin otra indicación.
- Tumores fibroblásticos y miofibroblásticos malignos.
- Tumor fibroso solitario maligno.
- Fibrosarcoma, sin otra indicación.
- Mixofibrosarcoma.
- Sarcoma fibromixoide de grado bajo.[3]
- Fibrosarcoma epitelioide esclerosante.
- Tumores fibroblásticos y miofibroblásticos benignos.
- Tumores de músculo esquelético.
- Tumores de músculo esquelético benignos.
- Rabdomioma, SAI.
- Tumores de músculo esquelético malignos.
- Rabdomiosarcoma (embrionario, de células fusiformes o esclerosante, alveolar y pleomórfico). Para obtener más información, consultar Tratamiento del rabdomiosarcoma infantil.
- Ectomesenquimoma.
- Tumores de músculo esquelético benignos.
- Tumores de músculo liso.
- Tumores de músculo liso benignos e intermedios.
- Leiomioma, SAI.
- Tumor de músculo liso de potencial maligno incierto.
- Tumores de músculo liso malignos.
El angioleiomioma se reclasificó bajo los tumores perivasculares.
- Tumores de músculo liso benignos e intermedios.
- Tumores denominados fibrohistiocíticos.
- Tumores denominados fibrohistiocíticos benignos.
- Tumores tenosinoviales de células gigantes, SAI.
- Tumores tenosinoviales de células gigantes de tipo difuso.
- Histiocitoma fibroso benigno profundo.
- Tumores tenosinoviales de células gigantes, SAI.
- Tumores denominados fibrohistiocíticos intermedios (metastatizan con poca frecuencia).
- Tumor fibrohistiocítico plexiforme.
- Tumor de partes blandas de células gigantes, SAI.
- Tumores denominados fibrohistiocíticos malignos.
- Tumor tenosinovial de células gigantes maligno.
- Tumores denominados fibrohistiocíticos benignos.
- Tumores de vaina de nervio periférico.
- Tumores de vaina de nervio periférico benignos.
- Schwannoma, SAI (incluye las variantes).
- Neurofibroma, SAI (incluye las variantes).
- Neurofibroma plexiforme.
- Perineurioma, SAI.
- Tumor de células granulosas, SAI.
- Mixoma de vaina de nervio.
- Neuroma circunscrito solitario.
- Meningioma, SAI.
- Tumor tritón benigno o coristoma neuromuscular.
- Tumor híbrido de vaina nerviosa.
- Tumores de vaina de nervio periférico malignos.
- Tumor maligno de vaina de nervio periférico, sin otra indicación.
- Tumor maligno de vaina de nervio periférico epitelioide.
- Tumor maligno de vaina de nervio periférico melánico.
- Tumor de células granulosas maligno.
- Perineurioma maligno.
- Tumor maligno de vaina de nervio periférico, sin otra indicación.
- Tumores de vaina de nervio periférico benignos.
- Tumores pericíticos (perivasculares).
- Tumores pericíticos (perivasculares) benignos e intermedios.
- Tumor glómico, SAI (incluye las variantes).
- Glomangiomatosis.
- Miopericitoma.
- Miofibromatosis.
- Miofibroma (la clasificación de la OMS más reciente incluye el hemangiopericitoma).
- Miofibromatosis infantil.
- Angioleiomioma.
- Tumor glómico, SAI (incluye las variantes).
- Tumores pericíticos (perivasculares) malignos.
- Tumor glómico maligno.
- Tumores pericíticos (perivasculares) benignos e intermedios.
- Tumores de diferenciación incierta.
- Tumores de diferenciación incierta benignos.
- Mixoma, sin otra indicación.
- Angiomixoma de gran malignidad.
- Tumor angiectásico hialinizante pleomórfico.
- Tumor mesenquimal fosfatúrico, SAI.
- Tumor epitelioide perivascular benigno.
- Angiomiolipoma.
- Tumores de diferenciación incierta intermedios (localmente invasores).
- Tumor fibrolipomatoso hemosiderótico.
- Angiomiolipoma epitelioide.
- Tumores de diferenciación incierta intermedios (metastatizan con poca frecuencia).
- Fibroxantoma atípico.
- Histiocitoma fibroso angiomatoide.
- Tumor fibromixoide osificante, SAI.
- Tumores mixtos, SAI.
- Tumores mixtos malignos, SAI.
- Mioepitelioma, SAI.
- Tumores de diferenciación incierta malignos.
- Tumor mesenquimal fosfatúrico maligno.
- Neoplasia de células fusiformes con reordenamiento de NTRK (nuevo).
- Sarcoma sinovial, sin otra indicación.
- Sarcoma sinovial de células fusiformes.
- Sarcoma sinovial bifásico.
- Sarcoma sinovial poco diferenciado.
- Sarcoma epitelioide.
- Sarcoma alveolar de partes blandas.
- Sarcoma de células claras, sin otra indicación.
- Condrosarcoma mixoide extraesquelético.
- Tumor desmoplásico de células redondas pequeñas.
- Tumor rabdoide, sin otra indicación (extrarrenal).
- Tumor epitelioide perivascular maligno.
- Sarcoma de la íntima.
- Tumor fibromixoide osificante maligno.
- Carcinoma mioepitelial.
- Sarcoma indiferenciado.
- Sarcoma de células fusiformes indiferenciado.
- Sarcoma pleomórfico indiferenciado.
- Sarcoma de células redondas indiferenciado.
- Tumores de diferenciación incierta benignos.
- Tumores vasculares.
- Tumores vasculares benignos.
- Hemangioma, SAI. Para obtener más información, consultar Tratamiento de los tumores vasculares infantiles.
- Hemangioma intramuscular.
- Hemangioma arteriovenoso.
- Hemangioma venoso.
- Hemangioma epitelioide.
- Linfangioma, SAI.
- Linfangioma quístico.
- Hemangioma en penacho adquirido.
- Tumores vasculares intermedios (localmente invasores).
- Tumores vasculares intermedios (metastatizan con poca frecuencia).
- Hemangioendotelioma retiforme.
- Angioendotelioma papilar intralinfático.
- Hemangioendotelioma compuesto.
- Sarcoma de Kaposi.
- Sarcoma de Kaposi de crecimiento lento clásico.
- Sarcoma de Kaposi endémico de África.
- Sarcoma de Kaposi relacionado con el SIDA.
- Sarcoma de Kaposi iatrogénico.
- Hemangioendotelioma pseudomiogénico (similar al sarcoma epitelioide).
- Tumores vasculares malignos.
- Hemangioendotelioma epitelioide, sin otra indicación.
- Hemangioendotelioma epitelioide con fusión WWTR1::CAMTA1.
- Hemangioendotelioma epitelioide con fusión YAP1::TFE3.
- Angiosarcoma.
- Hemangioendotelioma epitelioide, sin otra indicación.
- Tumores vasculares benignos.
Con el aumento del uso de técnicas de secuenciación de última generación y un mayor conocimiento de los inhibidores de tirosina–cinasas aprobados de forma reciente que se dirigen a NTRK y a otros genes, se han identificado nuevos subgrupos de lesiones de tejido blando infantiles que se caracterizan por fusiones de cinasas y presentan características morfológicas similares. Es importante identificar estas entidades raras porque algunas de ellas podrían ser susceptibles al tratamiento con nuevos fármacos. A continuación se describen algunos ejemplos de estas lesiones.[4]
- Los tumores neurales similares a la lipofibromatosis son tumores superficiales que suelen afectar a los niños y las células son inmunorreactivas para S100. Estos tumores por lo general tienen fusiones en NTRK1, pero es infrecuente que alberguen fusiones en RET o en ALK.
- Los tumores de células fusiformes positivos para S100 y CD34 que se asemejan a los tumores malignos de vaina de nervio periférico de grado intermedio predominan en niños y adultos jóvenes, y es posible que afecten los huesos y los tejidos blandos. Presentan fusiones en diferentes genes, como RAF1, BRAF, NTRK1 y NTRK2.
- Las lesiones similares al fibrosarcoma infantil tienen características morfológicas similares a las del fibrosarcoma infantil y afectan con mayor frecuencia a pacientes menores de 2 años. Se forman sobre todo en los sitios intrabdominales. A menudo presentan fusiones que involucran otros genes, como BRAF, NTRK1 o MET.
- Los sarcomas de células fusiformes con características hemangiopericíticas y miopericíticas a veces afectan a los niños y tienen fusiones en NTRK1.
- Los sarcomas de células fusiformes positivos para la fusión en RAF1 se observan en niños y adultos y, a menudo, surgen en el tronco. Casi nunca son de gran malignidad.
- Los tumores de tejidos blandos positivos para la fusión en BRAF se han relacionado con variantes similares al fibrosarcoma infantil o a los sarcomas de células fusiformes que se asemejan a tumores malignos de vaina de nervio periférico. Estos tumores se han notificado en niños y a menudo afectan la cavidad abdominal.
- Los tumores positivos para la fusión en RET afectan sobre todo a niños y tienen un fenotipo similar a los de los tumores positivos para la fusión en NTRK. Es posible que exhiban diferenciación fibroblástica y de tipo neural. Estos tumores son sensibles al selpercatinib, un inhibidor muy selectivo de RET de moléculas pequeña.[5]
Bibliografía
- WHO Classification of Tumours Editorial Board: WHO Classification of Tumours. Volume 3: Soft Tissue and Bone Tumours. 5th ed., IARC Press, 2020.
- Steelman C, Katzenstein H, Parham D, et al.: Unusual presentation of congenital infantile fibrosarcoma in seven infants with molecular-genetic analysis. Fetal Pediatr Pathol 30 (5): 329-37, 2011. [PUBMED Abstract]
- Evans HL: Low-grade fibromyxoid sarcoma: a clinicopathologic study of 33 cases with long-term follow-up. Am J Surg Pathol 35 (10): 1450-62, 2011. [PUBMED Abstract]
- Antonescu CR: Emerging soft tissue tumors with kinase fusions: An overview of the recent literature with an emphasis on diagnostic criteria. Genes Chromosomes Cancer 59 (8): 437-444, 2020. [PUBMED Abstract]
- Ortiz MV, Gerdemann U, Raju SG, et al.: Activity of the Highly Specific RET Inhibitor Selpercatinib (LOXO-292) in Pediatric Patients With Tumors Harboring RET Gene Alterations. JCO Precis Oncol 4: , 2020. [PUBMED Abstract]
Sistemas de estadificación y clasificación por grados para el sarcoma de tejido blando infantil
La estadificación clínica tiene una función importante para pronosticar el desenlace clínico y determinar el tratamiento más eficaz del sarcoma de tejido blando infantil. Por ahora, no hay un sistema de estadificación bien aceptado que sea válido para todos los sarcomas infantiles. El sistema del American Joint Committee on Cancer (AJCC) que se usa en adultos no se ha validado en estudios pediátricos.
Aunque no se dispone de un sistema de estadificación estandarizado para los sarcomas de tejido blando no rabdomiosarcomatosos en pediatría, en la actualidad se usan dos sistemas para estadificar este tipo de sarcomas en niños:[1]
- Sistema de estadificación quirúrgico-patológico: el sistema de estadificación quirúrgico-patológico que se emplea en el Intergroup Rhabdomyosarcoma Study se basa en la cantidad o el grado de tumor que queda después de la cirugía inicial y en la presencia de metástasis. Este sistema de estadificación se usó en los primeros ensayos del ámbito pediátrico.[2] Para obtener más información, consultar la sección Sistema de estadificación del Intergroup Rhabdomiosarcoma Study.
- Sistema de estadificación TNM: el sistema de estadificación TNM (tumor, ganglio linfático y metástasis) es una iniciativa conjunta del AJCC (Estados Unidos) y la International Union Against Cancer (mundial). La estadificación se basa en la extensión del tumor (T), el alcance de la diseminación a los ganglios linfáticos (N), la presencia de metástasis (M) y el grado del tumor. Para la estadificación del sarcoma de tejido blando de la 8ª edición del AJCC Cancer Staging Manual, consultar los Cuadros 5, 6 7 y 8.[3-7] En el último ensayo del Children's Oncology Group (COG), se usó la 6ª edición del AJCC Cancer Staging Manual para el sarcoma de tejido blando (con revisión central de patología).[1] Se llevó a cabo una revisión de niños con sarcomas de tejido blando no rabdomiosarcomatoso con datos del Surveillance, Epidemiology, and End Results (SEER) Program y se identificaron 941 pacientes entre 1988 y 2007.[8] La estratificación del riesgo del COG se validó en esta cohorte.
Sistema de estadificación del Intergroup Rhabdomyosarcoma Study
Enfermedad no metastásica
- Grupo I: tumor localizado que se resecó por completo y márgenes negativos en el análisis histológico.
- Grupo II: tumor sometido a resección macroscópica y residuos microscópicos tumorales en uno o más márgenes, o diseminación a ganglios linfáticos regionales.
- Grupo IIA: tumor localizado sometido a resección macroscópica y enfermedad microscópica residual.
- Grupo IIB: enfermedad regional con compromiso ganglionar que se resecó por completo sin enfermedad microscópica. Se debe obtener un resultado negativo para compromiso del ganglio linfático regional más proximal al paciente y más distal en relación con el tumor.
- Grupo IIC: enfermedad regional con compromiso ganglionar sometida a resección macroscópica, pero con indicios de enfermedad microscópica residual en el sitio primario o compromiso histológico del ganglio linfático regional más proximal al sitio de disección.
- Grupo III: tumor localizado que no se resecó por completo o que solo se sometió a biopsia, o tumor macroscópico residual.
Enfermedad metastásica
- Grupo IV: cualquier tumor localizado o regional con metástasis a distancia en el momento del diagnóstico. Esto incluye la presencia de células cancerosas en los derrames (pleural o peritoneal) o en el líquido cefalorraquídeo (infrecuente).
Enfermedad recidivante y progresiva
- Cualquier sarcoma de tejido blando que recidiva después del tratamiento inicial o que progresa después de la radioterapia, la quimioterapia o la cirugía inicial.
Sistema de estadificación TNM
En la 8ª edición del AJCC Cancer Staging Manual se designó la estadificación según los cuatro criterios de tamaño tumoral, estado ganglionar, grado histológico y metástasis, así como por el sitio anatómico del tumor primario (cabeza y cuello; tronco y extremidades; abdomen y órganos viscerales torácicos; retroperitoneo; y características histológicas y sitios poco comunes) (consultar los Cuadros 5, 6 7 y 8).[3-7] Para obtener información sobre las características histológicas y los sitios poco comunes, consultar el AJCC Cancer Staging Manual.[7]
| Categoría T | Sarcoma de tejido blando de tronco, extremidades y retroperitoneo | Sarcoma de tejido blando de cabeza y cuello | Sarcoma de tejido blando de vísceras abdominales o torácicas |
|---|---|---|---|
| aAdaptación de O'Sullivan et al.,[3] Yoon et al.,[4] Raut et al.,[5] y Pollock et al.[6] | |||
| TX | Tumor primario no evaluable. | Tumor primario no evaluable. | Tumor primario no evaluable. |
| T0 | Sin indicios de tumor primario. | ||
| T1 | Tumor ≤5 cm en su mayor dimensión. | Tumor ≤2 cm. | Tumor limitado al órgano. |
| T2 | Tumor >5 cm y ≤10 cm en su mayor dimensión. | Tumor >2 cm y ≤4 cm. | Diseminación del tumor a tejido fuera del órgano. |
| T2a | Invasión de la serosa o el peritoneo visceral. | ||
| T2b | Diseminación fuera de la serosa (mesenterio). | ||
| T3 | Tumor >10 cm y ≤15 cm en su mayor dimensión. | Tumor >4 cm. | Invasión de otro órgano. |
| T4 | Tumor >15 cm en su mayor dimensión. | Tumor con invasión de estructuras adyacentes. | Compromiso multifocal. |
| T4a | Tumor con invasión orbitaria, invasión a la base del cráneo o la duramadre, invasión del compartimiento visceral central, compromiso de los huesos de la cara o invasión de los músculos pterigoideos. | Multifocal (2 sitios). | |
| T4b | Tumor con invasión del parénquima encefálico, atrapamiento de la arteria carótida, invasión muscular prevertebral o compromiso del sistema nervioso central por diseminación perineural. | Multifocal (3–5 sitios). | |
| T4c | Multifocal (>5 sitios). | ||
| aAdaptación de O'Sullivan et al.,[3] Yoon et al.,[4] Raut et al.,[5] y Pollock et al.[6] | |
| bPara el sarcoma de tejido blando de vísceras abdominales o torácicas, N0 = no hay compromiso ganglionar o no se conoce el estado ganglionar; N1 = compromiso ganglionar. | |
| N0 | Sin metástasis ganglionares regionales o no se conoce el estado de los ganglios linfáticos.b |
| N1 | Metástasis en ganglios linfáticos regionales.b |
| aAdaptación de O'Sullivan et al.,[3] Yoon et al.,[4] Raut et al.,[5] y Pollock et al.[6] | |
| bPara el sarcoma de tejido blando de vísceras abdominales o torácicas, M0 = no hay metástasis; M1 = presencia de metástasis. | |
| M0 | Sin metástasis a distancia.b |
| M1 | Metástasis a distancia.b |
| Estadio | T | N | M | Grado |
|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||||
| aAdaptación de Yoon et al. [4] y Pollock et al.[6] | ||||
| bEstadio IIIB del sarcoma de tejido blando de retroperitoneo; estadio IV del sarcoma de tejido blando de tronco y extremidades. | ||||
| IA | T1 | N0 | M0 | G1, GX |
| IB | T2, T3, T4 | N0 | M0 | G1, GX |
| II | T1 | N0 | M0 | G2, G3 |
| IIIA | T2 | N0 | M0 | G2, G3 |
| IIIB | T3, T4 | N0 | M0 | G2, G3 |
| IIIB/IVb | Cualquier T | N1 | M0 | Cualquier G |
| IV | Cualquier T | Cualquier N | M1 | Cualquier G |
Sistema de clasificación por grados tumorales patológicos del sarcoma de tejido blando
En la mayoría de los casos de sarcomas de tejido blando, la clasificación histopatológica exacta del sarcoma de tejido blando por sí sola no proporciona información óptima sobre su comportamiento clínico. Por lo tanto, se usan varios parámetros histológicos para el proceso de asignación del grado; entre ellos, los siguientes:
- Grado de celularidad.
- Pleomorfismo celular.
- Actividad mitótica.
- Grado de necrosis.
- Crecimiento invasor.
Este proceso se utiliza para mejorar la correlación entre los hallazgos histológicos y el desenlace clínico.[9] En los niños, la clasificación por grados para el sarcoma de tejido blando se complica debido a ciertos factores como el pronóstico, la edad del paciente, el alcance de la resección quirúrgica y la capacidad del tumor de metastatizar. Por ejemplo, los niños menores de 4 años con fibrosarcoma infantil y hemangiopericitoma tienen un pronóstico favorable, mientras que es posible que el histiocitoma fibroso angiomatoide y el dermatofibrosarcoma protuberante recidiven a nivel local cuando no se resecan por completo, pero no suelen metastatizar.
Es difícil evaluar la validez de un sistema de clasificación por grados en la población pediátrica debido a que estas neoplasias son muy raras. En marzo de 1986, el Pediatric Oncology Group (POG) llevó a cabo un estudio prospectivo sobre los sarcomas de tejido blando infantil no rabdomiosarcomatosos pediátricos y creó el sistema de clasificación por grados del Pediatric Oncology Group. En el análisis del desenlace de los pacientes con sarcomas de tejido blando no rabdomiosarcomatosos localizado, se demostró que los pacientes con tumores de grado 3 tuvieron desenlaces significativamente más precarios que aquellos con lesiones de grado 1 o 2. Este hallazgo indica que el sistema puede predecir con precisión el comportamiento clínico de los sarcomas de tejido blando no rabdomiosarcomatosos.[9-11]
Se ha demostrado que los sistemas de clasificación por grados del POG y la Fédération Nationale des Centres de Lutte Contre Le Cancer (FNCLCC) son de valor pronóstico para los sarcomas de tejido blando no rabdomiosarcomatosos en la población pediátrica y en adultos.[12-16] El COG utiliza el FNCLCC desde el punto de vista clínico. En un estudio de 130 tumores de niños y adolescentes con sarcomas de tejido blando no rabdomiosarcomatosos inscritos en 3 ensayos clínicos prospectivos, se encontró una correlación entre los grados POG y FNCLCC asignados. No obstante, la clasificación por grados no se correlacionó en todos los casos; 44 pacientes cuyos tumores recibieron grados dispares (grado POG 3, grado FNCLCC 1 o 2) presentaron desenlaces intermedios entre los asignados al mismo tiempo al grado 3 y los grados 1 y 2. Se determinó que un índice mitótico de 10 o mayor era un factor pronóstico importante.[17]
En el ensayo ARST0332 (NCT00346164) del COG se compararon los sistemas de clasificación patológica por grados POG y FNCLCC como parte de una estrategia prospectiva basada en el riesgo. En el estudio se encontró que, además de la profundidad del tumor y del grado de invasión, el grado FNCLCC se asoció de manera directa con la supervivencia sin complicaciones y la supervivencia general.[18] En el ensayo ARST1321 (NCT02180867) del COG que ya se cerró se utilizó el sistema FNCLCC para asignar el grado histológico.
El FNCLCC Sarcoma Group se describe a continuación. El sistema de asignación de grados del POG ya no se usa.
Sistema de clasificación por grados de la Fédération Nationale des Centres de Lutte Contre Le Cancer
El sistema de clasificación por grados histológicos de la Fédération Nationale des Centres de Lutte Contre Le Cancer (FNCLCC) se formuló para adultos con sarcoma de tejido blando. El propósito del sistema de clasificación por grados es predecir qué pacientes presentarán metástasis y determinar si se beneficiarían de la quimioterapia posoperatoria.[19,20] Para obtener información sobre el sistema de clasificación por grados histológicos de la FNCLCC para adultos, consultar la sección Grado histológico de la Fédération Nationale des Centres de Lutte Contre Le Cancer en Tratamiento del sarcoma de tejido blando.
Bibliografía
- American Joint Committee on Cancer: AJCC Cancer Staging Manual. 6th ed. Springer, 2002.
- Maurer HM, Beltangady M, Gehan EA, et al.: The Intergroup Rhabdomyosarcoma Study-I. A final report. Cancer 61 (2): 209-20, 1988. [PUBMED Abstract]
- O'Sullivan B, Maki RG, Agulnik M, et al.: Soft tissue sarcoma of the head and neck. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 499-505.
- Yoon SS, Maki RG, Asare EA, et al.: Soft tissue sarcoma of the trunk and extremities. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 507-15.
- Raut CP, Maki RG, Baldini EH, et al.: Soft tissue sarcoma of the abdomen and thoracic visceral organs. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 517-21.
- Pollock RE, Maki RG, Baldini EH, et al.: Soft tissue sarcoma of the retroperitoneum. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 531-7.
- Maki RG, Folpe AL, Guadagnolo BA, et al.: Soft tissue sarcoma - unusual histologies and sites. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 539-45.
- Waxweiler TV, Rusthoven CG, Proper MS, et al.: Non-Rhabdomyosarcoma Soft Tissue Sarcomas in Children: A Surveillance, Epidemiology, and End Results Analysis Validating COG Risk Stratifications. Int J Radiat Oncol Biol Phys 92 (2): 339-48, 2015. [PUBMED Abstract]
- Parham DM, Webber BL, Jenkins JJ, et al.: Nonrhabdomyosarcomatous soft tissue sarcomas of childhood: formulation of a simplified system for grading. Mod Pathol 8 (7): 705-10, 1995. [PUBMED Abstract]
- Recommendations for the reporting of soft tissue sarcomas. Association of Directors of Anatomic and Surgical Pathology. Mod Pathol 11 (12): 1257-61, 1998. [PUBMED Abstract]
- Skytting B, Meis-Kindblom JM, Larsson O, et al.: Synovial sarcoma--identification of favorable and unfavorable histologic types: a Scandinavian sarcoma group study of 104 cases. Acta Orthop Scand 70 (6): 543-54, 1999. [PUBMED Abstract]
- Rao BN: Nonrhabdomyosarcoma in children: prognostic factors influencing survival. Semin Surg Oncol 9 (6): 524-31, 1993 Nov-Dec. [PUBMED Abstract]
- Pisters PW, Leung DH, Woodruff J, et al.: Analysis of prognostic factors in 1,041 patients with localized soft tissue sarcomas of the extremities. J Clin Oncol 14 (5): 1679-89, 1996. [PUBMED Abstract]
- Coindre JM, Terrier P, Bui NB, et al.: Prognostic factors in adult patients with locally controlled soft tissue sarcoma. A study of 546 patients from the French Federation of Cancer Centers Sarcoma Group. J Clin Oncol 14 (3): 869-77, 1996. [PUBMED Abstract]
- Pappo AS, Fontanesi J, Luo X, et al.: Synovial sarcoma in children and adolescents: the St Jude Children's Research Hospital experience. J Clin Oncol 12 (11): 2360-6, 1994. [PUBMED Abstract]
- Pratt CB, Maurer HM, Gieser P, et al.: Treatment of unresectable or metastatic pediatric soft tissue sarcomas with surgery, irradiation, and chemotherapy: a Pediatric Oncology Group study. Med Pediatr Oncol 30 (4): 201-9, 1998. [PUBMED Abstract]
- Khoury JD, Coffin CM, Spunt SL, et al.: Grading of nonrhabdomyosarcoma soft tissue sarcoma in children and adolescents: a comparison of parameters used for the Fédération Nationale des Centers de Lutte Contre le Cancer and Pediatric Oncology Group Systems. Cancer 116 (9): 2266-74, 2010. [PUBMED Abstract]
- Spunt SL, Million L, Chi YY, et al.: A risk-based treatment strategy for non-rhabdomyosarcoma soft-tissue sarcomas in patients younger than 30 years (ARST0332): a Children's Oncology Group prospective study. Lancet Oncol 21 (1): 145-161, 2020. [PUBMED Abstract]
- Coindre JM, Terrier P, Guillou L, et al.: Predictive value of grade for metastasis development in the main histologic types of adult soft tissue sarcomas: a study of 1240 patients from the French Federation of Cancer Centers Sarcoma Group. Cancer 91 (10): 1914-26, 2001. [PUBMED Abstract]
- Guillou L, Coindre JM, Bonichon F, et al.: Comparative study of the National Cancer Institute and French Federation of Cancer Centers Sarcoma Group grading systems in a population of 410 adult patients with soft tissue sarcoma. J Clin Oncol 15 (1): 350-62, 1997. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento del sarcoma de tejido blando infantil
Debido a que el sarcoma de tejido blando no rabdomiosarcomatoso infantil es raro, el tratamiento lo debe coordinar un equipo multidisciplinario que incluya oncólogos (pediatra o médico), patólogos, cirujanos y radioncólogos para todos los niños, adolescentes y adultos jóvenes con estos tumores. Además, con el fin de definir mejor la evolución natural del tumor y la respuesta al tratamiento, se deberá considerar la participación de los niños con estas neoplasias raras en protocolos de tratamiento nacionales o institucionales. Para obtener más información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
El Children's Oncology Group (COG) dirigió un ensayo prospectivo no aleatorizado (ARST0332 [NCT00346164]) para pacientes con sarcomas de tejido blando.[1]
La resección quirúrgica de los tumores primarios se clasificó como sigue:
- R0 cuando se hizo una resección completa y los márgenes fueron negativos al microscopio.
- R1 cuando los márgenes fueron positivos al microscopio.
- R2 cuando quedó tumor residual macroscópico después de la resección.
Los pacientes se asignaron a 1 de los 3 grupos de riesgo siguientes:
- Riesgo bajo: tumor de grado bajo no metastásico con resección R0 o R1 o tumor de grado alto ≤5 cm con resección R1.
- Riesgo intermedio: tumor de grado alto no metastásico con resección R0 o tumor de grado alto >5 cm con resección R1, o tumor no resecado de cualquier tamaño o grado.
- Riesgo alto: tumor metastásico.
Los grupos de tratamiento fueron los siguientes:
- Cirugía sola.
- Radioterapia (55,8 Gy).
- Quimiorradioterapia (quimioterapia y 55,8 Gy de radioterapia).
- Quimiorradioterapia neoadyuvante (quimioterapia y 45 Gy de radioterapia; luego, cirugía y refuerzo de radioterapia según los márgenes, y quimioterapia continuada).
La quimioterapia incluyó 6 ciclos de ifosfamida intravenosa (IV) (3 g/m2 por dosis) los días 1 a 3 y 5 ciclos de doxorrubicina IV (37,5 mg/m2 por dosis) los días 1 a 2 cada 3 semanas, con ajuste de la secuencia de acuerdo con el momento de la cirugía o la radioterapia.
El análisis incluyó a 529 pacientes evaluables: riesgo bajo (n = 222), riesgo intermedio (n = 227) y riesgo alto (n = 80). Los pacientes sometidos a cirugía sola (n = 205), radioterapia (n = 17), quimiorradioterapia (n = 111) y quimiorradioterapia neoadyuvante (n = 196).
En el momento de una mediana de seguimiento de 6,5 años (intervalo intercuartílico [IIQ], 4,9–7,9), la tasa de supervivencia sin complicaciones (SSC) a 5 años y la tasa de supervivencia general (SG), por grupo de riesgo, fueron las siguientes:
- Grupo de riesgo bajo: tasa de SSC, 88,9 % (intervalo de confianza [IC] 95 %, 84,0–93,8 %) y la tasa de SG, 96,2 % (IC 95 %, 93,2–99,2 %).
- Grupo de riesgo intermedio: tasa de SSC, 65,0 % (IC 95 %, 58,2–71,8 %) y la tasa de SG, 79,2 % (IC 95 %, 73,4–85,0 %).
- Grupo de riesgo alto: tasa de SSC, 21,2 % (IC 95 %, 11,4–31,1 %) y la tasa de SG, 35,5 % (IC 95 %, 23,6–47,4 %).
Los autores concluyeron que las características clínicas previas al tratamiento son útiles para definir el riesgo de fracaso del tratamiento y estratificar a los pacientes jóvenes de sarcoma de tejido blando no rabdomiosarcomatoso para asignarlos a un tratamiento adaptado al riesgo. La mayoría de los pacientes de riesgo bajo se pueden curar sin terapia adyuvante, de manera que evitan las conocidas complicaciones a largo plazo. La supervivencia sigue siendo mejorable para los pacientes de riesgo intermedio y riesgo alto; estos pacientes necesitan tratamientos novedosos.
Cirugía
La resección quirúrgica del tumor primario es el tratamiento principal de la mayoría de los sarcomas de tejido blando no rabdomiosarcomatosos. En el estudio del COG ARST0332 (NCT00346164), alrededor del 37 % de los pacientes menores de 30 años se trataron con cirugía sola.[1] Otro 36 % de los pacientes se sometió a resección quirúrgica después de la quimiorradioterapia neoadyuvante. Es muy recomendable la participación de un cirujano experto en la resección de sarcomas de tejido blando.
Después de obtener una biopsia adecuada y establecer el diagnóstico patológico, se deben hacer todos los intentos por resecar el tumor primario. La exhaustividad de la resección predice el desenlace. En el estudio COG ARST0332, las resecciones completas con márgenes negativos al microscopio (R0) produjeron los mejores desenlaces.[1]
- Las tasas de SSC a 5 años en los pacientes tratados con cirugía y otras modalidades fueron las siguientes:
- Del 84 % en los pacientes que tuvieron resecciones R0.
- Del 66 % en los pacientes que tuvieron resecciones R1.
- Del 49 % en los pacientes que tuvieron resecciones R2.
- Las tasas de SG a 5 años en los pacientes tratados con cirugía y otras modalidades fueron las siguientes:
- Del 93% en los pacientes que tuvieron resecciones R0.
- Del 80% en los pacientes que tuvieron resecciones R1.
- Del 63% en los pacientes que tuvieron resecciones R2.
- Las tasas de SSC a 5 años en los pacientes tratados solo con cirugía fueron las siguientes:
- Del 96 % en los pacientes con tumores de grado bajo que tuvieron resecciones R0.
- Del 81 % en los pacientes con tumores de grado bajo que tuvieron resecciones R1.
- Del 84 % en los pacientes con tumores de grado alto de menos de 5 cm y con resecciones R0.
El COG comunicó los resultados del subconjunto de pacientes con NRSTS de grado bajo incluidos en el estudio ARST0332.[2] Los pacientes de riesgo bajo recibieron tratamiento con cirugía sola, mientras que los pacientes de riesgo intermedio y alto recibieron ifosfamida o doxorrubicina y radioterapia, con resección definitiva antes o después de 12 semanas de quimioterapia y radioterapia.
| Grupo de riesgo | Tasa de supervivencia sin complicaciones a 5 años | Tasa de supervivencia general a 5 años |
|---|---|---|
| Riesgo bajo | 90 % | 100 % |
| Riesgo intermedio | 55 % | 78 % |
| Riesgo alto | 25 % | 25 % |
- En los pacientes de riesgo bajo se observaron recidivas solo locales en el 10 % de los pacientes. Ningún paciente con márgenes de resección superiores a 1 mm presentó recidivas locales.
- De los 17 pacientes de riesgo intermedio y alto que completaron la quimioterapia neoadyuvante y la radioterapia, 16 se sometieron a una resección tumoral macroscópica total y el 80 % tenían márgenes negativos.
- En el grupo de riesgo intermedio y alto los eventos incluyeron 1 recidiva local y 7 recidivas metastásicas.
El momento de la cirugía depende de la evaluación de la factibilidad y morbilidad de esta. En el estudio COG ARST0332, los desenlaces fueron casi idénticos para los pacientes de riesgo intermedio que lograron una resección R0 o R1 tras una cirugía inicial o que se hizo después de la quimiorradioterapia neoadyuvante (70 vs. 71 %, respectivamente). Fue más probable que se lograra una resección R0 después de la terapia neoadyuvante.[1] Estas observaciones son ciertas incluso para los tumores de grado alto, en los que la capacidad de lograr la resección R0 o R1 fue el predictor más importante de la SSC. El tratamiento con quimiorradioterapia neoadyuvante se relacionó con el uso de dosis de radioterapia más bajas y tasas más altas de resección R0.[3] Se debe determinar la resecabilidad en el momento del diagnóstico, con énfasis en obtener márgenes negativos sin pérdida de forma o función.
Si con la cirugía inicial no se logran obtener márgenes tisulares negativos en el estudio patológico o si la cirugía inicial se llevó a cabo cuando no se sabía que había un cáncer, el paciente se somete a una nueva resección del área afectada para obtener márgenes limpios, aunque no necesariamente amplios.[4-7] Este principio quirúrgico es correcto, aunque no se haya detectado una masa en las imágenes por resonancia magnética tras la cirugía inicial.[8]; [9][Nivel de evidencia C1]
Las metástasis ganglionares regionales en el momento del diagnóstico son inusuales y se observan con más frecuencia en pacientes con sarcomas epitelioides y de células claras.[10,11] El uso de la biopsia de ganglio linfático centinela como procedimiento de estadificación para el sarcoma de tejido blando es objeto de controversia. Sin embargo, es posible que ayude a tratar determinados casos de adultos con sarcoma de células claras y sarcoma epitelioide. No hay datos suficientes para respaldar el uso de la biopsia de ganglio linfático centinela en el tratamiento de pacientes pediátricos con otros sarcomas de tejido blando no rabdomiosarcomatosos.[12-17]
Radioterapia
Los factores a tomar en cuenta para administrar la radioterapia se basan en la posibilidad de que una cirugía, con quimioterapia o sin esta, permita obtener control local sin pérdida de órganos vitales ni funciones importantes, o sin que cause trastornos cosméticos o psicológicos importantes. Esto variará de acuerdo con los siguientes aspectos:
- Características del paciente (por ejemplo, edad y sexo).
- Características del tumor (por ejemplo, características histopatológicas, sitio, tamaño y grado).
- Uso de tratamiento quirúrgico y el estado de los márgenes.
- Expectativas con respecto a la morbilidad causada por la radiación (por ejemplo, alteración en el desarrollo óseo o muscular, lesión orgánica o neoplasia subsiguiente).
Es posible administrar la radioterapia de manera preoperatoria o posoperatoria. También se utiliza como terapia definitiva en situaciones poco comunes cuando no se lleva a cabo una resección quirúrgica.[18] Tanto el tamaño del campo de radiación como la dosis se basarán en las características del paciente y el tumor, y en el procedimiento quirúrgico.[19] La radioterapia, preoperatoria o posoperatoria, se relacionó con una mejora de la SG, en comparación con la cirugía sola.[20]
En determinadas situaciones, es posible aplicar braquiterapia y radiación intraoperatoria.[21-23]; [24][Nivel de evidencia C2]
Radioterapia preoperatoria
La radioterapia preoperatoria se relacionó con excelentes tasas de control local.[25-27] Este abordaje tiene ventajas, como dirigirse a volúmenes más pequeños de tejido porque no se necesita tratar el lecho posquirúrgico y reducir un poco la dosis de radiación porque no se presenta la hipoxia relativa propia de la perturbación quirúrgica de la vasculatura, y no hay cicatrización. La radioterapia preoperatoria se relacionó con un aumento de la tasa de complicaciones de las heridas en los adultos, sobre todo en tumores de la extremidad inferior, sin embargo la gravedad de estas complicaciones es cuestionable.[28] Por otro lado, la radioterapia preoperatoria a veces produce menos fibrosis que los abordajes posoperatorios, quizás por el volumen y la dosis más bajas.[29] La técnica de radiación puede afectar la conservación del tejido sano. En comparación con la radioterapia conformada tridimensional, la radioterapia de intensidad modulada tiene la capacidad de disminuir la dosis de radiación que se dirige a la piel y la epífisis cuando se irradia un sarcoma de extremidad.[30]
Radioterapia posoperatoria
También es posible administrar la radioterapia de manera posoperatoria. En general, se indica el uso de radiación en pacientes con márgenes quirúrgicos inadecuados y tumores voluminosos de grado alto.[31,32] Esto es importante, sobre todo en los tumores de grado alto con márgenes tumorales de menos de 1 cm.[33,34]; [35][Nivel de evidencia C3] Con la combinación de una resección R0 (margen negativo) y radioterapia, es posible lograr el control local del tumor primario en el 90 % de los pacientes con sarcomas de extremidades, del 70 % al 75 % de los pacientes con sarcomas retroperitoneales y el 80 % de los pacientes en general.[21,36-39]
Los sarcomas retroperitoneales son particulares porque la radiosensibilidad del intestino a las lesiones hace menos aconsejable la radioterapia posoperatoria.[40,41] Las adherencias posoperatorias y la inmovilidad del intestino aumentan el riesgo de lesión causada por cualquier dosis de radiación. Esto se contrapone con el abordaje preoperatorio en el que el tumor a menudo desplaza el intestino fuera del campo de radiación y cualquier parte expuesta del intestino es más móvil, lo que disminuye la exposición de segmentos intestinales específicos.
Dosis y volumen
El volumen y la dosis de radiación dependen de las características tumorales, quirúrgicas y del paciente descritas antes, así como de los siguientes aspectos:
- Edad del paciente y potencial de crecimiento.
- Capacidad de evitar órganos vitales, láminas epifisarias y vasos linfáticos (pero no los haces neurovasculares que son relativamente tolerantes a la radiación).
- Resultados funcionales y cosméticos.
Las dosis acostumbradas de radiación preoperatoria son de 45 Gy a 50 Gy, y se considera la aplicación de un refuerzo posoperatorio de 10 Gy a 20 Gy si los márgenes de resección son positivos para compromiso macroscópico o microscópico, o cuando se piensa usar braquiterapia cuando se anticipa una resección subtotal. Además, incluso en el entorno preoperatorio, se puede considerar la administración de un refuerzo adicional de radiación a una dosis de 60 Gy en las áreas del tumor que se prevé que tengan riesgo de enfermedad residual microscópica (por ejemplo, áreas del tumor adyacentes a tejidos normales importantes) que no es posible extirpar con márgenes adecuados. Esto se logra con una dosis de refuerzo integrada de forma simultánea (es decir, un área de dosis más alta dentro del volumen de una dosis más baja) o que se administra en un pequeño campo de radiación después de tratar el volumen inicial con una dosis de 45 Gy a 50 Gy. Sin embargo, faltan datos que documenten la eficacia de un refuerzo posoperatorio en áreas con márgenes positivos al microscopio.[42] La dosis de radiación posoperatoria es de 55 Gy a 60 Gy para las resecciones R0, hasta 65 Gy para las resecciones R1 (márgenes positivos al microscopio) y más alta cuando hay enfermedad macroscópica residual irresecable en función de las metas generales de tratamiento (por ejemplo, control definitivo local vs. paliación).
El Children's Oncology Group analizó la recidiva local (RL) de los sarcomas de tejido blando no rabdomiosarcomatosos después de la radioterapia en pacientes tratados en el ensayo ARST0332.[3] Los pacientes menores de 30 años con sarcomas de tejido blando no rabdomiosarcomatosos de grado alto recibieron radioterapia (55,8 Gy) para tumores R1 de 5 cm o menos (grupo B); radioterapia (55,8 Gy) con quimioterapia para tumores R0 o R1 de más de 5 cm (grupo C); o radioterapia neoadyuvante (45 Gy) con quimioterapia y cirugía diferida, quimioterapia y refuerzo posoperatorio a 10,8 Gy para tumores R0, tumores con márgenes inferiores a 5 mm o tumores R1, así como 19,8 Gy para tumores R2 o tumores sin resección (grupo D).
- De 193 pacientes aptos, 24 presentaron recidivas locales (grupo B: 1 de 15 [6,7 %], grupo C: 7 de 65 [10,8 %], grupo D: 16 de 113 [14,2 %]) con una mediana de tiempo hasta la recidiva local de 1,1 años (intervalo, 0,11–5,27).
- De 95 pacientes aptos para cirugía diferida después de la terapia neoadyuvante, en 89 (93,7 %) se obtuvieron márgenes R0 o R1.
- El control local general después de la radioterapia fue el siguiente: R0, 106 de 109 (97 %); R1, 51 de 60 (85 %); y R2 o irresecable, 2 de 6 (33 %).
- Los autores concluyeron que el tratamiento basado en el riesgo para los pacientes jóvenes con sarcomas de tejido blando no rabdomiosarcomatoso de grado alto tratados en el ARST0332 produjo un control local muy alto, en particular después de la resección R0 (97 %), a pesar de que se usaron dosis de radioterapia inferiores a las estándar.
Los márgenes de radiación suelen ser de 2 cm a 4 cm en el plano longitudinal y abarcan los planos transversales de las fascias.[43,44]
Quimioterapia
La función de la quimioterapia posoperatoria sigue siendo poco clara.[45]
Evidencia (falta de claridad en relación con la quimioterapia posoperatoria):
- En un metanálisis de datos de todos los ensayos aleatorizados de adultos con sarcoma de tejido blando, se observó lo siguiente:[46]
- la supervivencia sin recidiva fue mejor en los pacientes con tumores de grado alto de más de 5 cm sometidos a quimioterapia posoperatoria.
- En un ensayo europeo, los adultos con sarcoma de tejido blando completamente resecado se asignaron al azar a observación o quimioterapia posoperatoria con ifosfamida y doxorrubicina.[47][Nivel de evidencia A1]
- La quimioterapia posoperatoria no se relacionó con una mejora de la SSC o la SG.
- Es difícil extrapolar este ensayo a pacientes pediátricos porque el ensayo tuvo las siguientes características: 1) una amplia variedad de características histológicas; 2) una dosis relativamente baja de ifosfamida; 3) se aplazó la radioterapia definitiva para los pacientes asignados a quimioterapia hasta que esta finalizara; 4) casi la mitad de los pacientes en el ensayo tenían tumores de grado intermedio.
- En la discusión, los autores integraron sus pacientes con los de las series publicadas antes, incluso los del metanálisis europeo, y concluyeron que los resultados indicaban un beneficio de la quimioterapia posoperatoria.
- En el ensayo pediátrico prospectivo más numerosos no se demostró ningún beneficio con la vincristina, la dactinomicina, la ciclofosfamida y la doxorrubicina posoperatorias.[36]
- La doxorrubicina y la ifosfamida se usaron en el ensayo fundamentado en el riesgo del COG, ARST0332 (NCT00346164).[1][Nivel de evidencia C1]
- Aunque este no fue un estudio aleatorizado, en los resultados al cabo de 2,6 años se observó que los pacientes con tumores no metastásicos y de riesgo alto (>5 cm y grado alto) sometidos a resección macroscópica, radioterapia y doxorrubicina con ifosfamida posoperatorias tuvieron una tasa de SSC a 5 años del 67,2 % y una tasa de SG del 78 %.
- En aquellos pacientes con enfermedad metastásica tratados con quimioterapia y radioterapia preoperatorias, se calculó una tasa de SSC a 5 años del 21,2 %; la tasa de SG fue del 35,5 %.
Terapia dirigida
Se ha contemplado el uso de inhibidores de la angiogénesis y del blanco de la rapamicina en los mamíferos (mTOR) para el tratamiento de sarcomas de tejido blando en adultos, pero no en niños.
Evidencia (terapia dirigida para adultos con sarcoma de tejido blando):
- En un ensayo de 711 pacientes adultos que lograron una respuesta o enfermedad estable después de la quimioterapia, los pacientes se asignaron al azar para recibir ridaforólimus o placebo.[48]
- La administración de ridaforólimus se relacionó con una mejora de 3 semanas en la supervivencia sin progresión (SSP), en comparación con el placebo.
- En otro ensayo de 371 pacientes adultos asignados al azar con sarcoma de tejido blando metastásico que progresó después de la quimioterapia, se comparó el pazopanib con un placebo.[49]
- La mediana de SSP en el grupo de pazopanib fue de 4,6 meses comparada con 1,6 meses en el grupo de placebo. No se presentaron diferencias en la SG entre los 2 grupos.
- En un estudio de 182 pacientes adultos con liposarcoma recidivante, leiomiosarcoma, sarcoma sinovial y otros sarcomas para los que ya habían recibido tratamiento, los pacientes se asignaron al azar para recibir regorafenib o placebo.[50]
- Los pacientes con tumores no adipocíticos tratados con regorafenib presentaron mejoras significativas en la SSP cuando se compararon con los pacientes que recibieron placebo.
El consorcio de cáncer de COG y NRG Oncology dirigió un ensayo aleatorizado de pazopanib añadido a quimioterapia neoadyuvante (doxorrubicina e ifosfamida) y radioterapia preoperatoria en niños y adultos con sarcoma de tejido blando no rabdomiosarcomatoso. Los pacientes con tumores mayores a 5 cm y enfermedad de grado intermedio o alto eran aptos para participar. El criterio de valoración del ensayo fue la respuesta tumoral patológica después de la terapia adyuvante. La inscripción al estudio se cerró de manera anticipada porque en el análisis interino planificado se observó que se cruzó el límite para una respuesta patológica. Se inscribieron 81 pacientes, pero solo se obtuvieron datos de respuesta para 42 (52 %) (17 pacientes de cada grupo interrumpieron el tratamiento por progresión, toxicidad intolerable, decisión propia o del médico)[51]
- En el grupo de control, 4 de 18 pacientes (22 %) exhibían más de un 90 % de necrosis en el momento de la resección, en comparación con 14 de 24 pacientes (58 %) en el grupo tratado con pazopanib, lo que dio cumplimiento con los criterios para interrupción anticipada del estudio.
- La toxicidad fue más alta en el grupo de pazopanib, sobre todo por el aumento de la mielodepresión. Las complicaciones de la herida también fueron más frecuentes en el grupo de pazopanib.
- Mediante seguimientos más prolongados, los investigadores pudieron evaluar los objetivos secundarios de SG y SSC.[52] Al cabo de una mediana de seguimiento de 3,3 años (intervalo, 0,1–5,8 años), la tasa de SSC a 3 años para todos los pacientes del análisis por intención de tratar fue del 52,5 % en los pacientes que recibieron pazopanib y del 50,6 % en aquellos que no lo recibieron (P del orden logarítmico = 0,8677). La tasa de SG a 3 años fue del 75,7 % en los pacientes que recibieron pazopanib y del 65,4 % en el grupo de control (P del orden logarítmico = 0,1919).
Bibliografía
- Spunt SL, Million L, Chi YY, et al.: A risk-based treatment strategy for non-rhabdomyosarcoma soft-tissue sarcomas in patients younger than 30 years (ARST0332): a Children's Oncology Group prospective study. Lancet Oncol 21 (1): 145-161, 2020. [PUBMED Abstract]
- Douglass DP, Coffin CM, Randall RL, et al.: Clinical features and outcomes of young patients with low-grade non-rhabdomyosarcoma soft tissue sarcomas treated with a risk-based strategy: A report from Children's Oncology Group study ARST0332. Pediatr Blood Cancer 71 (8): e31062, 2024. [PUBMED Abstract]
- Million L, Hayes-Jordan A, Chi YY, et al.: Local Control For High-Grade Nonrhabdomyosarcoma Soft Tissue Sarcoma Assigned to Radiation Therapy on ARST0332: A Report From the Childrens Oncology Group. Int J Radiat Oncol Biol Phys 110 (3): 821-830, 2021. [PUBMED Abstract]
- Sugiura H, Takahashi M, Katagiri H, et al.: Additional wide resection of malignant soft tissue tumors. Clin Orthop (394): 201-10, 2002. [PUBMED Abstract]
- Cecchetto G, Guglielmi M, Inserra A, et al.: Primary re-excision: the Italian experience in patients with localized soft-tissue sarcomas. Pediatr Surg Int 17 (7): 532-4, 2001. [PUBMED Abstract]
- Chui CH, Spunt SL, Liu T, et al.: Is reexcision in pediatric nonrhabdomyosarcoma soft tissue sarcoma necessary after an initial unplanned resection? J Pediatr Surg 37 (10): 1424-9, 2002. [PUBMED Abstract]
- Paulino AC, Ritchie J, Wen BC: The value of postoperative radiotherapy in childhood nonrhabdomyosarcoma soft tissue sarcoma. Pediatr Blood Cancer 43 (5): 587-93, 2004. [PUBMED Abstract]
- Kaste SC, Hill A, Conley L, et al.: Magnetic resonance imaging after incomplete resection of soft tissue sarcoma. Clin Orthop (397): 204-11, 2002. [PUBMED Abstract]
- Chandrasekar CR, Wafa H, Grimer RJ, et al.: The effect of an unplanned excision of a soft-tissue sarcoma on prognosis. J Bone Joint Surg Br 90 (2): 203-8, 2008. [PUBMED Abstract]
- Daigeler A, Kuhnen C, Moritz R, et al.: Lymph node metastases in soft tissue sarcomas: a single center analysis of 1,597 patients. Langenbecks Arch Surg 394 (2): 321-9, 2009. [PUBMED Abstract]
- Mazeron JJ, Suit HD: Lymph nodes as sites of metastases from sarcomas of soft tissue. Cancer 60 (8): 1800-8, 1987. [PUBMED Abstract]
- Neville HL, Andrassy RJ, Lally KP, et al.: Lymphatic mapping with sentinel node biopsy in pediatric patients. J Pediatr Surg 35 (6): 961-4, 2000. [PUBMED Abstract]
- Neville HL, Raney RB, Andrassy RJ, et al.: Multidisciplinary management of pediatric soft-tissue sarcoma. Oncology (Huntingt) 14 (10): 1471-81; discussion 1482-6, 1489-90, 2000. [PUBMED Abstract]
- Kayton ML, Delgado R, Busam K, et al.: Experience with 31 sentinel lymph node biopsies for sarcomas and carcinomas in pediatric patients. Cancer 112 (9): 2052-9, 2008. [PUBMED Abstract]
- Dall'Igna P, De Corti F, Alaggio R, et al.: Sentinel node biopsy in pediatric patients: the experience in a single institution. Eur J Pediatr Surg 24 (6): 482-7, 2014. [PUBMED Abstract]
- Parida L, Morrisson GT, Shammas A, et al.: Role of lymphoscintigraphy and sentinel lymph node biopsy in the management of pediatric melanoma and sarcoma. Pediatr Surg Int 28 (6): 571-8, 2012. [PUBMED Abstract]
- Alcorn KM, Deans KJ, Congeni A, et al.: Sentinel lymph node biopsy in pediatric soft tissue sarcoma patients: utility and concordance with imaging. J Pediatr Surg 48 (9): 1903-6, 2013. [PUBMED Abstract]
- Haas RL, Gronchi A, van de Sande MAJ, et al.: Perioperative Management of Extremity Soft Tissue Sarcomas. J Clin Oncol 36 (2): 118-124, 2018. [PUBMED Abstract]
- Crompton JG, Ogura K, Bernthal NM, et al.: Local Control of Soft Tissue and Bone Sarcomas. J Clin Oncol 36 (2): 111-117, 2018. [PUBMED Abstract]
- Nussbaum DP, Rushing CN, Lane WO, et al.: Preoperative or postoperative radiotherapy versus surgery alone for retroperitoneal sarcoma: a case-control, propensity score-matched analysis of a nationwide clinical oncology database. Lancet Oncol 17 (7): 966-975, 2016. [PUBMED Abstract]
- Merchant TE, Parsh N, del Valle PL, et al.: Brachytherapy for pediatric soft-tissue sarcoma. Int J Radiat Oncol Biol Phys 46 (2): 427-32, 2000. [PUBMED Abstract]
- Schomberg PJ, Gunderson LL, Moir CR, et al.: Intraoperative electron irradiation in the management of pediatric malignancies. Cancer 79 (11): 2251-6, 1997. [PUBMED Abstract]
- Nag S, Shasha D, Janjan N, et al.: The American Brachytherapy Society recommendations for brachytherapy of soft tissue sarcomas. Int J Radiat Oncol Biol Phys 49 (4): 1033-43, 2001. [PUBMED Abstract]
- Viani GA, Novaes PE, Jacinto AA, et al.: High-dose-rate brachytherapy for soft tissue sarcoma in children: a single institution experience. Radiat Oncol 3: 9, 2008. [PUBMED Abstract]
- Virkus WW, Mollabashy A, Reith JD, et al.: Preoperative radiotherapy in the treatment of soft tissue sarcomas. Clin Orthop (397): 177-89, 2002. [PUBMED Abstract]
- Zagars GK, Ballo MT, Pisters PW, et al.: Preoperative vs. postoperative radiation therapy for soft tissue sarcoma: a retrospective comparative evaluation of disease outcome. Int J Radiat Oncol Biol Phys 56 (2): 482-8, 2003. [PUBMED Abstract]
- Dickie C, Parent A, Griffin AM, et al.: The value of adaptive preoperative radiotherapy in management of soft tissue sarcoma. Radiother Oncol 122 (3): 458-463, 2017. [PUBMED Abstract]
- O'Sullivan B, Davis AM, Turcotte R, et al.: Preoperative versus postoperative radiotherapy in soft-tissue sarcoma of the limbs: a randomised trial. Lancet 359 (9325): 2235-41, 2002. [PUBMED Abstract]
- Davis AM, O'Sullivan B, Turcotte R, et al.: Late radiation morbidity following randomization to preoperative versus postoperative radiotherapy in extremity soft tissue sarcoma. Radiother Oncol 75 (1): 48-53, 2005. [PUBMED Abstract]
- Rao AD, Chen Q, Million L, et al.: Preoperative Intensity Modulated Radiation Therapy Compared to Three-Dimensional Conformal Radiation Therapy for High-Grade Extremity Sarcomas in Children: Analysis of the Children's Oncology Group Study ARST0332. Int J Radiat Oncol Biol Phys 103 (1): 38-44, 2019. [PUBMED Abstract]
- Marcus KC, Grier HE, Shamberger RC, et al.: Childhood soft tissue sarcoma: a 20-year experience. J Pediatr 131 (4): 603-7, 1997. [PUBMED Abstract]
- Delaney TF, Kepka L, Goldberg SI, et al.: Radiation therapy for control of soft-tissue sarcomas resected with positive margins. Int J Radiat Oncol Biol Phys 67 (5): 1460-9, 2007. [PUBMED Abstract]
- Blakely ML, Spurbeck WW, Pappo AS, et al.: The impact of margin of resection on outcome in pediatric nonrhabdomyosarcoma soft tissue sarcoma. J Pediatr Surg 34 (5): 672-5, 1999. [PUBMED Abstract]
- Skytting B: Synovial sarcoma. A Scandinavian Sarcoma Group project. Acta Orthop Scand Suppl 291: 1-28, 2000. [PUBMED Abstract]
- Hua C, Gray JM, Merchant TE, et al.: Treatment planning and delivery of external beam radiotherapy for pediatric sarcoma: the St. Jude Children's Research Hospital experience. Int J Radiat Oncol Biol Phys 70 (5): 1598-606, 2008. [PUBMED Abstract]
- Pratt CB, Pappo AS, Gieser P, et al.: Role of adjuvant chemotherapy in the treatment of surgically resected pediatric nonrhabdomyosarcomatous soft tissue sarcomas: A Pediatric Oncology Group Study. J Clin Oncol 17 (4): 1219, 1999. [PUBMED Abstract]
- Karakousis CP, Driscoll DL: Treatment and local control of primary extremity soft tissue sarcomas. J Surg Oncol 71 (3): 155-61, 1999. [PUBMED Abstract]
- Zagars GK, Ballo MT, Pisters PW, et al.: Prognostic factors for disease-specific survival after first relapse of soft-tissue sarcoma: analysis of 402 patients with disease relapse after initial conservative surgery and radiotherapy. Int J Radiat Oncol Biol Phys 57 (3): 739-47, 2003. [PUBMED Abstract]
- Raut CP, Miceli R, Strauss DC, et al.: External validation of a multi-institutional retroperitoneal sarcoma nomogram. Cancer 122 (9): 1417-24, 2016. [PUBMED Abstract]
- Baldini EH, Wang D, Haas RL, et al.: Treatment Guidelines for Preoperative Radiation Therapy for Retroperitoneal Sarcoma: Preliminary Consensus of an International Expert Panel. Int J Radiat Oncol Biol Phys 92 (3): 602-12, 2015. [PUBMED Abstract]
- Bishop AJ, Zagars GK, Torres KE, et al.: Combined Modality Management of Retroperitoneal Sarcomas: A Single-Institution Series of 121 Patients. Int J Radiat Oncol Biol Phys 93 (1): 158-65, 2015. [PUBMED Abstract]
- Al Yami A, Griffin AM, Ferguson PC, et al.: Positive surgical margins in soft tissue sarcoma treated with preoperative radiation: is a postoperative boost necessary? Int J Radiat Oncol Biol Phys 77 (4): 1191-7, 2010. [PUBMED Abstract]
- Wang D, Bosch W, Kirsch DG, et al.: Variation in the gross tumor volume and clinical target volume for preoperative radiotherapy of primary large high-grade soft tissue sarcoma of the extremity among RTOG sarcoma radiation oncologists. Int J Radiat Oncol Biol Phys 81 (5): e775-80, 2011. [PUBMED Abstract]
- Bahig H, Roberge D, Bosch W, et al.: Agreement among RTOG sarcoma radiation oncologists in contouring suspicious peritumoral edema for preoperative radiation therapy of soft tissue sarcoma of the extremity. Int J Radiat Oncol Biol Phys 86 (2): 298-303, 2013. [PUBMED Abstract]
- Ferrari A: Role of chemotherapy in pediatric nonrhabdomyosarcoma soft-tissue sarcomas. Expert Rev Anticancer Ther 8 (6): 929-38, 2008. [PUBMED Abstract]
- Adjuvant chemotherapy for localised resectable soft-tissue sarcoma of adults: meta-analysis of individual data. Sarcoma Meta-analysis Collaboration. Lancet 350 (9092): 1647-54, 1997. [PUBMED Abstract]
- Woll PJ, Reichardt P, Le Cesne A, et al.: Adjuvant chemotherapy with doxorubicin, ifosfamide, and lenograstim for resected soft-tissue sarcoma (EORTC 62931): a multicentre randomised controlled trial. Lancet Oncol 13 (10): 1045-54, 2012. [PUBMED Abstract]
- Demetri GD, Chawla SP, Ray-Coquard I, et al.: Results of an international randomized phase III trial of the mammalian target of rapamycin inhibitor ridaforolimus versus placebo to control metastatic sarcomas in patients after benefit from prior chemotherapy. J Clin Oncol 31 (19): 2485-92, 2013. [PUBMED Abstract]
- van der Graaf WT, Blay JY, Chawla SP, et al.: Pazopanib for metastatic soft-tissue sarcoma (PALETTE): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet 379 (9829): 1879-86, 2012. [PUBMED Abstract]
- Mir O, Brodowicz T, Italiano A, et al.: Safety and efficacy of regorafenib in patients with advanced soft tissue sarcoma (REGOSARC): a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet Oncol 17 (12): 1732-1742, 2016. [PUBMED Abstract]
- Weiss AR, Chen YL, Scharschmidt TJ, et al.: Pathological response in children and adults with large unresected intermediate-grade or high-grade soft tissue sarcoma receiving preoperative chemoradiotherapy with or without pazopanib (ARST1321): a multicentre, randomised, open-label, phase 2 trial. Lancet Oncol 21 (8): 1110-1122, 2020. [PUBMED Abstract]
- Weiss AR, Chen YL, Scharschmidt TJ, et al.: Outcomes After Preoperative Chemoradiation With or Without Pazopanib in Non-Rhabdomyosarcoma Soft Tissue Sarcoma: A Report From Children's Oncology Group and NRG Oncology. J Clin Oncol 41 (31): 4842-4848, 2023. [PUBMED Abstract]
Consideraciones especiales para el tratamiento de niños con sarcoma de tejido blando
El cáncer en niños y adolescentes es infrecuente, aunque desde 1975 se ha observado un aumento gradual de la incidencia general.[1] Los niños y adolescentes con cáncer se deben derivar a centros médicos que cuenten con equipos multidisciplinarios de especialistas en oncología con experiencia en el tratamiento de los cánceres que se presentan en la niñez y la adolescencia. Este equipo multidisciplinario incorpora la pericia de los siguientes especialistas en pediatría y otros para asegurar que los niños reciban el tratamiento, los cuidados médicos de apoyo y la rehabilitación que les permitan lograr una supervivencia y calidad de vida óptimas:
- Médicos de atención primaria.
- Cirujanos pediátricos.
- Patólogos.
- Radioncólogos pediatras.
- Oncólogos y hematólogos pediatras.
- Especialistas en rehabilitación.
- Enfermeros oncólogos especializados en pediatría.
- Trabajadores sociales.
- Profesionales de la vida infantil.
- Psicólogos.
- Asesores nutricionales.
Para obtener información específica sobre los cuidados médicos de apoyo para niños y adolescentes con cáncer, consultar los resúmenes de Cuidados médicos de apoyo y cuidados paliativos.
La American Academy of Pediatrics estableció pautas para los centros de oncología pediátrica y su función en el tratamiento de los niños y adolescentes con cáncer.[2] En estos centros de oncología pediátrica, se dispone de ensayos clínicos para la mayoría de los tipos de cáncer que se presentan en niños y adolescentes, y se ofrece la oportunidad de participar a la mayoría de los pacientes y familiares. Es de vital importancia la evaluación multidisciplinaria en centros de oncología pediátrica que cuenten con experiencia quirúrgica y radioterapéutica, con el fin de asegurar el mejor desenlace clínico en estos pacientes. Aunque una proporción significativa de los pacientes se cura con una cirugía, con radioterapia o sin esta, la adición de quimioterapia quizás sea beneficiosa en subgrupos de niños con esta enfermedad y, por lo tanto, se recomienda su participación en ensayos clínicos. Por lo general, los ensayos clínicos para los niños y adolescentes con cáncer se diseñan a fin de comparar un tratamiento que parece mejor con el tratamiento estándar actual. En otros tipos de ensayos clínicos se prueban tratamientos cuando no hay un tratamiento estándar para el cáncer que se ha diagnosticado. La mayoría de los avances en la identificación de tratamientos curativos para los cánceres infantiles se lograron mediante ensayos clínicos. Para obtener más información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
Muchas de las estrategias terapéuticas para niños y adolescentes con tumores de tejido blando son similares a las de pacientes adultos, aunque hay diferencias importantes. Por ejemplo, las características biológicas de la neoplasia en pacientes pediátricos a veces difieren mucho de las lesiones en adultos. Además, los procedimientos para conservar un miembro son más difíciles de llevar a cabo en pacientes pediátricos. La morbilidad relacionada con la radioterapia, en particular en lactantes y niños pequeños, puede ser mucho mayor que la observada en adultos.[3]
En los últimos 20 años, la mejora en los desenlaces a partir de los tratamientos multimodales en adultos y niños con sarcomas de tejido blando ha hecho que aumente la preocupación sobre el potencial de efectos secundarios a largo plazo causados por este tratamiento en niños. Se debe individualizar el tratamiento de los niños y adolescentes con sarcoma de tejido blando no rabdomiosarcomatoso con el fin de aumentar al máximo el control tumoral y reducir la morbilidad a largo plazo. Estos pacientes se deben inscribir en estudios prospectivos en los que se evalúe con precisión cualquier posible complicación.[4]
Bibliografía
- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014. [PUBMED Abstract]
- American Academy of Pediatrics: Standards for pediatric cancer centers. Pediatrics 134 (2): 410-4, 2014. Also available online. Last accessed February 25, 2025.
- Suit H, Spiro I: Radiation as a therapeutic modality in sarcomas of the soft tissue. Hematol Oncol Clin North Am 9 (4): 733-46, 1995. [PUBMED Abstract]
- Hawkins DS, Black JO, Orbach D, et al.: Nonrhabdomyosarcoma soft-tissue sarcomas. In: Blaney SM, Helman LJ, Adamson PC, eds.: Pizzo and Poplack's Pediatric Oncology. 8th ed. Wolters Kluwer, 2020, pp 721-46.
Tratamiento de los tumores adipocíticos
Los tumores adipocíticos representan menos del 10 % de las lesiones de tejido blando en pacientes menores de 20 años. Los tumores adipocíticos más comunes en los niños son los lipomas y los lipoblastomas.
En el Cuadro 10 se resumen las neoplasias adipocíticas que se observan en pacientes pediátricos y se incluye información sobre las características clínicopatológicas y moleculares correspondientes.[1]
| Tumores adipocíticos | Frecuencia [2,3] | Características epidemiológicas | Sitio preferido | Características histológicas | Alteraciones citogenéticas y moleculares |
|---|---|---|---|---|---|
| M = masculino; F = femenino; HGMA2 = «high-mobility group AT-hook 2»; PLAG1 = «pleomorphic adenoma gene 1»; MDM2 = «mouse double minute 2 homolog»; FUS = «fused in sarcoma»; DDIT3 = «DNA damage inducible transcript 3». | |||||
| aReproducción autorizada de Seminars in Diagnostic Pathology, volumen 36, número 2, Putra J, Al-Ibraheemi A, Adipocytic tumors in Children: A contemporary review, páginas 95–104, derechos de autor 2019, con autorización de Elsevier.[1] | |||||
| Benignas | |||||
| Lipoma | 64–70 % (incluye las variantes) | • Solitario: M = F | Tronco. | Capas monótonas de adipocitos maduros. | Cromosomas 12q (HMGA2), 13q y 6p. |
| • Múltiple: M > F | |||||
| • Infrecuente en los primeros 20 años de vida. | |||||
| • Más frecuente entre los 40–60 años. | |||||
| Angiolipoma | 4–28 % | • M > F | Tronco y extremidades. | • Proliferación de adipocitos maduros. | — |
| • Más común al final de la adolescencia y alrededor de los 20 años. | • Proliferación vascular (proliferación capilar con trombos de fibrina). | ||||
| Lipoblastoma | 18–30 % | • M > F | Tronco y extremidades. | • Arquitectura lobulillar. | Reordenamiento del cromosoma 8q (PLAG1). |
| • Zonas de maduración. | |||||
| • <3 años (90 %) | • Células estrelladas primitivas. | ||||
| • Lipoblastos multivacuolados. | |||||
| • Área mixoide con vasos plexiformes prominentes. | |||||
| Hibernoma | 2 % | • M = F | Región dorsal (área escapular), de la pared torácica, axilar e inguinal. | • Arquitectura lobulillar. | Reordenamiento del cromosoma 11q13-21. |
| • Infrecuente en los primeros 20 años de vida (5 %). | • Diferentes tipos de células: células grasas pardas, lipoblastos multivacuolados y células grasas maduras. | ||||
| • El 60 % se presenta entre los 20 y 40 años. | • Red de capilares prominente (menos pronunciada que el lipoblastoma y el liposarcoma mixoide). | ||||
| Intermedio | |||||
| Tumor lipomatoso atípico y liposarcoma bien diferenciado. | Raro | • M = F | Extremidades, cabeza y cuello, tronco. | • Proliferación de adipocitos maduros. | Anillo supernumerario y cromosoma marcador gigante 12q14-15 (MDM2). |
| • Es sumamente infrecuente en niños (asociado con el síndrome de Li-Fraumeni). | • Variación significativa de tamaño. | ||||
| • Incidencia máxima entre los 60 y 70 años. | • Núcleos hipercromáticos con atipia. | ||||
| Maligno | |||||
| Liposarcoma mixoide | 4 % | • F > M | Extremidades, tronco, región de la cabeza y el cuello, y región abdominal. | • Arquitectura nodular. | t(12;16)(q13;p11) recurrente que produce la fusión génica FUS::DDIT3. |
| • Mezcla de células no lipogénicas redondas o fusiformes, además de lipoblastos. | |||||
| • El liposarcoma más común en niños (10 a 20 años), pero el menos frecuente en los adultos. | • Estroma mixoide prominente con vasculatura en alambrada. | ||||
| • Variantes en niños: subtipos pleomórfico y de células fusiformes. | |||||
| • Incidencia máxima entre los 40 y 60 años. | • La progresión al tipo morfológico de células redondas es infrecuente en niños. | ||||
| Liposarcoma desdiferenciado. | Raro | • Se notificó en un niño de 8 años con un liposarcoma bien diferenciado.[4] | • Extremidad inferior en un solo informe de caso de paciente pediátrico.[4] | • Transición de un liposarcoma bien diferenciado a un sarcoma no lipogénico de grado alto. | Anillo supernumerario y cromosoma marcador gigante 12q14-15 (MDM2). |
| • La desdiferenciación se presenta hasta en el 10 % de los liposarcomas bien diferenciados en adultos. | • Retroperitoneo (adultos). | • Diferenciación heterogénea (5–10 %). | |||
| • Incidencia máxima entre los 60 y 70 años. | |||||
| Liposarcoma pleomórfico | Infrecuente o no notificado | • La incidencia máxima del liposarcoma pleomórfico ocurre entre los 70 y 80 años. | • Extremidades (adultos). | • Lipoblastos pleomórficos. | — |
| • El subtipo se notificó en los entornos de los síndromes de Li-Fraumeni [5] y Muir-Torre.[6] | • Fondo de sarcoma pleomórfico de grado alto (no lipogénico). | ||||
Liposarcoma bien diferenciado, sin otra indicación
El liposarcoma es poco frecuente en la población pediátrica y representa el 3 % de los sarcomas de tejido blando en pacientes menores de 20 años (consultar el Cuadro 1).
En una revisión de 182 pacientes pediátricos con sarcomas de tipo adulto, solo 14 recibieron un diagnóstico de liposarcoma.[7] En un estudio retrospectivo se identificaron 34 pacientes menores de 22 años entre 1960 y 2011.[8] Hubo casi el mismo número de pacientes varones y mujeres, y la mediana de edad fue de 18 años. En una revisión clinicopatológica internacional, se describieron las características de 82 casos de liposarcoma infantil.[9] La mediana de edad fue de 15,5 años y las mujeres se vieron afectadas con mayor frecuencia. En ambos informes, la mayoría de los pacientes tenían liposarcoma mixoide.[8,9]
En una revisión bibliográfica de 275 casos de liposarcoma infantil, se observó que:[10]
- El liposarcoma mixoide fue el tipo histológico más frecuente (68 %), seguido del liposarcoma bien diferenciado (10,5 %).
- De los pacientes, el 12 % murió por la enfermedad; la mayoría fueron casos de los subtipos pleomórfico y mixoide pleomórfico.
- Cerca del 70 % de los pacientes con liposarcoma mixoide y bien diferenciado se trataron solo con una cirugía. Los desenlaces clínicos generales en estos grupos de pacientes fueron excelentes, sin indicios de enfermedad en 114 de 127 pacientes.
- Por el contrario, más del 50 % de los pacientes de liposarcoma pleomórfico se sometió a radioterapia y quimioterapia además de la cirugía, y el desenlace clínico fue subóptimo, sin indicios de enfermedad, en solo 5 de 10 pacientes.
- Se encontraron variantes germinales de TP53 en 2 pacientes con liposarcoma pleomórfico mixoide y en 2 pacientes con liposarcoma bien diferenciado que tenían una historia familiar compatible con el síndrome de Li-Fraumeni.
Cuadro clínico inicial
La mayoría de los liposarcomas en niños y adolescentes son de grado bajo y se localizan a nivel subcutáneo. Las metástasis ganglionares son infrecuentes y la mayoría de las metástasis son pulmonares. Es más probable que los tumores que surgen en la periferia sean de grado bajo y mixoides. Los tumores que surgen a nivel central tienen más probabilidades de ser de grado alto, pleomórficos y de manifestarse inicialmente con metástasis, o recidivar con metástasis.
Clasificación histopatológica
La clasificación de la Organización Mundial de la Salud (OMS) para el liposarcoma es la siguiente:[11]
- Liposarcomas intermedios (localmente invasores).
- Tumor lipomatoso atípico. Estos tumores no metastatizan, a menos que experimenten una desdiferenciación.
- Liposarcomas malignos.
- Liposarcoma desdiferenciado.
- Liposarcoma mixoide. Los liposarcomas mixoides puros se caracterizan por la translocación t(12;16)(q13;p11) y, aunque metastatizan, suelen presentar un desenlace excelente en ausencia de un componente de células redondas.[12] El liposarcoma mixoide es el subtipo de liposarcoma más común en la población pediátrica.[8,9]
- Liposarcoma pleomórfico. Es un tipo de liposarcoma infrecuente que de manera primaria surge en adultos mayores.
- Liposarcoma pleomórfico mixoide. Esta entidad rara se presenta de manera primaria en niños, adolescentes y adultos jóvenes. Se presenta con frecuencia en el mediastino y es muy maligno desde el punto de vista clínico.
- Liposarcoma bien diferenciado, SAI.
Alteraciones genómicas
- Tumor lipomatoso atípico. Esta entidad se caracteriza por un anillo supernumerario y cromosomas marcadores gigantes que contienen la región cromosómica 12q14-q15, que abarca MDM2. La amplificación de MDM2 se detecta en casi todos los casos de tumor lipomatoso atípico o liposarcoma bien diferenciado, y es frecuente que se presenten coamplificaciones de MDM2 con genes cercanos como CDK4 y FRS2.[13]
- Liposarcoma desdiferenciado. Esta entidad, igual que el tumor lipomatoso atípico, se caracteriza por amplificación de MDM2, anillo supernumerario y cromosomas marcadores gigantes que contienen la región cromosómica 12q14-q15. El liposarcoma desdiferenciado contiene un número alto de alteraciones segmentarias en el número de copias, pero pocas variantes génicas.[14]
- Liposarcoma mixoide. Esta entidad se caracteriza por la translocación t(12;16)(q13;p11) que produce el gen de fusión FUS::DDIT3.[14] En un pequeño porcentaje de casos, EWSR1 sustituye a FUS, produciendo la fusión génica EWSR1::DDIT3 (t(12;22)(q13;Q12)). El gen DDIT3 (llamado antes CHOP y GADD153) se activa por estrés y tiene un efecto inhibitorio en la adipogénesis.[15] El liposarcoma mixoide es el subtipo de liposarcoma más común en la población pediátrica. La mayoría de los casos pediátricos exhiben la fusión génica FUS::DDIT3.[8,9,16]
- Liposarcoma pleomórfico. Esta entidad es de manera primaria una afección de adultos mayores que no exhibe los reordenamientos génicos de DDIT3 ni la amplificación de MDM2. Los casos de liposarcoma pleomórfico suelen presentar numerosos desequilibrios cromosómicos, incluso, en algunos casos, variantes de TP53 y NF1.[17]
- Liposarcoma pleomórfico mixoide. Esta entidad se presenta con mayor frecuencia en la población de adolescentes y adultos jóvenes y carece del reordenamiento del gen DDIT3 del liposarcoma mixoide y la amplificación de MDM2 propia del tumor lipomatoso atípico y el liposarcoma desdiferenciado.[9,16,18] En cambio, el liposarcoma pleomórfico mixoide se presenta con ganancias y pérdidas cromosómicas múltiples. La pérdida de expresión de Rb se observa a menudo, y en ocasiones se relaciona con la pérdida del cromosoma 13q14 donde se encuentra RB1.[18,19] Aunque la mayoría de los casos de liposarcoma pleomórfico mixoide carecen de variantes de TP53, una minoría tiene variantes de TP53 que, en algunos casos, se relacionan con el síndrome de Li-Fraumeni.[20-22]
Pronóstico
Los tumores centrales o de grado más alto se relacionan con un riesgo de muerte significativamente más alto. En una revisión retrospectiva internacional, la tasa de supervivencia a 5 años fue del 42 % en pacientes con tumores centrales. De 10 pacientes con liposarcoma mixoide pleomórfico, 7 murieron por la enfermedad.[9] En un estudio retrospectivo de 14 pacientes, la tasa de supervivencia a 5 años fue del 78 %. El grado del tumor, el subtipo histológico y la ubicación primaria se correlacionaron con la supervivencia.[8]
Tratamiento del liposarcoma
Las opciones de tratamiento del liposarcoma son las siguientes:
- Cirugía. Si el tumor no se extirpa por completo o se produce recidiva local, se puede realizar una segunda cirugía.[23-25]
- Quimioterapia seguida de cirugía.
- Cirugía y radioterapia (de acuerdo con la evidencia de estudios en adultos).[26,27]
- Terapia dirigida (de acuerdo con la evidencia de estudios en adultos).[28]
Cirugía
La cirugía es el tratamiento más importante para el liposarcoma. Después de una resección quirúrgica completa de un liposarcoma bien diferenciado o mixoide, las tasas de supervivencia sin complicaciones (SSC) y de supervivencia general (SG) son aproximadamente del 90 %.[29] Si la cirugía inicial está incompleta, se debe realizar una nueva escisión para lograr un margen amplio de resección.[23-25] Se observaron recidivas locales que se controlaron con otra resección del tumor, en particular para el liposarcoma de grado bajo.
Quimioterapia
La quimioterapia se ha utilizado para disminuir el tamaño del liposarcoma antes de la cirugía a fin de facilitar la resección completa, en particular, en los tumores centrales.[30,31] La función de la quimioterapia posoperatoria para un liposarcoma no está bien definida. No se necesita tratamiento posoperatorio para los liposarcomas mixoides que se resecaron por completo. La supervivencia de los pacientes con liposarcomas pleomórficos sigue siendo precaria, aunque se administre quimioterapia posoperatoria.[32]
Hay muy pocos datos que respalden el uso de la trabectedina en pacientes pediátricos.[33] La trabectedina ha producido respuestas alentadoras en adultos con liposarcoma mixoide avanzado.[34] En un estudio, los pacientes adultos con liposarcoma y leiomiosarcoma recidivantes se asignaron al azar para recibir tratamiento con trabectedina o dacarbazina. Los pacientes tratados con trabectedina presentaron una reducción del 45 % en la progresión de la enfermedad.[35][Nivel de evidencia B1]
El tratamiento con eribulina, un inhibidor de la dinámica de los microtúbulos que no pertenece al grupo de los taxanos, mejoró de manera significativa la supervivencia en pacientes adultos con liposarcoma recidivante, en comparación con la dacarbazina. La mediana de SG fue de 15,6 meses en los pacientes que recibieron eribulina versus 8,4 meses en los pacientes que recibieron dacarbazina. Las diferencias en la supervivencia fueron aún mayores en pacientes con liposarcoma pleomórfico y desdiferenciado. La eribulina fue eficaz para prolongar la supervivencia de los pacientes con tumores de grado alto o intermedio.[36][Nivel de evidencia A1] En un ensayo pediátrico de fase I de eribulina no se incluyeron pacientes con liposarcoma.[37]
Cirugía y radioterapia
La radioterapia pre o posoperatoria también se toma en consideración, en función de las consecuencias estéticas o funcionales del tratamiento adicional con cirugía y radioterapia.[38,39]
Terapia dirigida
En un estudio multicéntrico de un solo grupo de fase II, 41 pacientes adultos con liposarcoma de grado alto o intermedio irresecable o metastásico se trataron con pazopanib en una dosis diaria de 800 mg.[28][Nivel de evidencia B4]
- La tasa de supervivencia sin progresión (SSP) a las 12 semanas fue de un 68,3 %, significativamente más alto que el valor de la hipótesis nula de un 40 %.
- Se obtuvo control tumoral en el 44 % de los pacientes. Un paciente tuvo una respuesta parcial y 17 enfermedad estable.
- A las 24 semanas, el 39 % de los pacientes continuaba sin progresión. La mediana de SSP fue de 4,4 meses y la mediana de SG fue de 12,6 meses.
Bibliografía
- Putra J, Al-Ibraheemi A: Adipocytic tumors in Children: A contemporary review. Semin Diagn Pathol 36 (2): 95-104, 2019. [PUBMED Abstract]
- Coffin CM, Alaggio R: Adipose and myxoid tumors of childhood and adolescence. Pediatr Dev Pathol 15 (1 Suppl): 239-54, 2012. [PUBMED Abstract]
- Dehner LP, Gru AA: Nonepithelial Tumors and Tumor-like Lesions of the Skin and Subcutis in Children. Pediatr Dev Pathol 21 (2): 150-207, 2018 Mar-Apr. [PUBMED Abstract]
- Yozu M, Symmans P, Dray M, et al.: Muir-Torre syndrome-associated pleomorphic liposarcoma arising in a previous radiation field. Virchows Arch 462 (3): 355-60, 2013. [PUBMED Abstract]
- Palit A, Inamadar AC: Circumferential skin folds in a child: a case of Michelin tire baby syndrome. Indian J Dermatol Venereol Leprol 73 (1): 49-51, 2007 Jan-Feb. [PUBMED Abstract]
- Goucha S, Khaled A, Zéglaoui F, et al.: Nevus lipomatosus cutaneous superficialis: Report of eight cases. Dermatol Ther (Heidelb) 1 (2): 25-30, 2011. [PUBMED Abstract]
- Ferrari A, Casanova M, Collini P, et al.: Adult-type soft tissue sarcomas in pediatric-age patients: experience at the Istituto Nazionale Tumori in Milan. J Clin Oncol 23 (18): 4021-30, 2005. [PUBMED Abstract]
- Stanelle EJ, Christison-Lagay ER, Sidebotham EL, et al.: Prognostic factors and survival in pediatric and adolescent liposarcoma. Sarcoma 2012: 870910, 2012. [PUBMED Abstract]
- Alaggio R, Coffin CM, Weiss SW, et al.: Liposarcomas in young patients: a study of 82 cases occurring in patients younger than 22 years of age. Am J Surg Pathol 33 (5): 645-58, 2009. [PUBMED Abstract]
- Baday YI, Navai SA, Hicks MJ, et al.: Pediatric liposarcoma: A case series and literature review. Pediatr Blood Cancer 68 (12): e29327, 2021. [PUBMED Abstract]
- Fletcher CDM, Bridge JA, Hogendoorn P, et al., eds.: WHO Classification of Tumours of Soft Tissue and Bone. 4th ed. IARC Press, 2013.
- Sreekantaiah C, Karakousis CP, Leong SP, et al.: Cytogenetic findings in liposarcoma correlate with histopathologic subtypes. Cancer 69 (10): 2484-95, 1992. [PUBMED Abstract]
- Kanojia D, Nagata Y, Garg M, et al.: Genomic landscape of liposarcoma. Oncotarget 6 (40): 42429-44, 2015. [PUBMED Abstract]
- Powers MP, Wang WL, Hernandez VS, et al.: Detection of myxoid liposarcoma-associated FUS-DDIT3 rearrangement variants including a newly identified breakpoint using an optimized RT-PCR assay. Mod Pathol 23 (10): 1307-15, 2010. [PUBMED Abstract]
- Han J, Murthy R, Wood B, et al.: ER stress signalling through eIF2α and CHOP, but not IRE1α, attenuates adipogenesis in mice. Diabetologia 56 (4): 911-24, 2013. [PUBMED Abstract]
- Peng R, Li N, Lan T, et al.: Liposarcoma in children and young adults: a clinicopathologic and molecular study of 23 cases in one of the largest institutions of China. Virchows Arch 479 (3): 537-549, 2021. [PUBMED Abstract]
- Barretina J, Taylor BS, Banerji S, et al.: Subtype-specific genomic alterations define new targets for soft-tissue sarcoma therapy. Nat Genet 42 (8): 715-21, 2010. [PUBMED Abstract]
- Creytens D, Folpe AL, Koelsche C, et al.: Myxoid pleomorphic liposarcoma-a clinicopathologic, immunohistochemical, molecular genetic and epigenetic study of 12 cases, suggesting a possible relationship with conventional pleomorphic liposarcoma. Mod Pathol 34 (11): 2043-2049, 2021. [PUBMED Abstract]
- Hofvander J, Jo VY, Ghanei I, et al.: Comprehensive genetic analysis of a paediatric pleomorphic myxoid liposarcoma reveals near-haploidization and loss of the RB1 gene. Histopathology 69 (1): 141-147, 2016. [PUBMED Abstract]
- Sinclair TJ, Thorson CM, Alvarez E, et al.: Pleomorphic myxoid liposarcoma in an adolescent with Li-Fraumeni syndrome. Pediatr Surg Int 33 (5): 631-635, 2017. [PUBMED Abstract]
- Francom CR, Leoniak SM, Lovell MA, et al.: Head and neck pleomorphic myxoid liposarcoma in a child with Li-Fraumeni syndrome. Int J Pediatr Otorhinolaryngol 123: 191-194, 2019. [PUBMED Abstract]
- Zare SY, Leivo M, Fadare O: Recurrent Pleomorphic Myxoid Liposarcoma in a Patient With Li-Fraumeni Syndrome. Int J Surg Pathol 28 (2): 225-228, 2020. [PUBMED Abstract]
- Sugiura H, Takahashi M, Katagiri H, et al.: Additional wide resection of malignant soft tissue tumors. Clin Orthop (394): 201-10, 2002. [PUBMED Abstract]
- Cecchetto G, Guglielmi M, Inserra A, et al.: Primary re-excision: the Italian experience in patients with localized soft-tissue sarcomas. Pediatr Surg Int 17 (7): 532-4, 2001. [PUBMED Abstract]
- Chui CH, Spunt SL, Liu T, et al.: Is reexcision in pediatric nonrhabdomyosarcoma soft tissue sarcoma necessary after an initial unplanned resection? J Pediatr Surg 37 (10): 1424-9, 2002. [PUBMED Abstract]
- Bahig H, Roberge D, Bosch W, et al.: Agreement among RTOG sarcoma radiation oncologists in contouring suspicious peritumoral edema for preoperative radiation therapy of soft tissue sarcoma of the extremity. Int J Radiat Oncol Biol Phys 86 (2): 298-303, 2013. [PUBMED Abstract]
- Baldini EH, Wang D, Haas RL, et al.: Treatment Guidelines for Preoperative Radiation Therapy for Retroperitoneal Sarcoma: Preliminary Consensus of an International Expert Panel. Int J Radiat Oncol Biol Phys 92 (3): 602-12, 2015. [PUBMED Abstract]
- Samuels BL, Chawla SP, Somaiah N, et al.: Results of a prospective phase 2 study of pazopanib in patients with advanced intermediate-grade or high-grade liposarcoma. Cancer 123 (23): 4640-4647, 2017. [PUBMED Abstract]
- La Quaglia MP, Spiro SA, Ghavimi F, et al.: Liposarcoma in patients younger than or equal to 22 years of age. Cancer 72 (10): 3114-9, 1993. [PUBMED Abstract]
- Ferrari A, Casanova M, Spreafico F, et al.: Childhood liposarcoma: a single-institutional twenty-year experience. Pediatr Hematol Oncol 16 (5): 415-21, 1999 Sep-Oct. [PUBMED Abstract]
- Cecchetto G, Alaggio R, Dall'Igna P, et al.: Localized unresectable non-rhabdo soft tissue sarcomas of the extremities in pediatric age: results from the Italian studies. Cancer 104 (9): 2006-12, 2005. [PUBMED Abstract]
- Huh WW, Yuen C, Munsell M, et al.: Liposarcoma in children and young adults: a multi-institutional experience. Pediatr Blood Cancer 57 (7): 1142-6, 2011. [PUBMED Abstract]
- Baruchel S, Pappo A, Krailo M, et al.: A phase 2 trial of trabectedin in children with recurrent rhabdomyosarcoma, Ewing sarcoma and non-rhabdomyosarcoma soft tissue sarcomas: a report from the Children's Oncology Group. Eur J Cancer 48 (4): 579-85, 2012. [PUBMED Abstract]
- Gronchi A, Bui BN, Bonvalot S, et al.: Phase II clinical trial of neoadjuvant trabectedin in patients with advanced localized myxoid liposarcoma. Ann Oncol 23 (3): 771-6, 2012. [PUBMED Abstract]
- Demetri GD, von Mehren M, Jones RL, et al.: Efficacy and Safety of Trabectedin or Dacarbazine for Metastatic Liposarcoma or Leiomyosarcoma After Failure of Conventional Chemotherapy: Results of a Phase III Randomized Multicenter Clinical Trial. J Clin Oncol 34 (8): 786-93, 2016. [PUBMED Abstract]
- Demetri GD, Schöffski P, Grignani G, et al.: Activity of Eribulin in Patients With Advanced Liposarcoma Demonstrated in a Subgroup Analysis From a Randomized Phase III Study of Eribulin Versus Dacarbazine. J Clin Oncol 35 (30): 3433-3439, 2017. [PUBMED Abstract]
- Schafer ES, Rau RE, Berg S, et al.: A phase 1 study of eribulin mesylate (E7389), a novel microtubule-targeting chemotherapeutic agent, in children with refractory or recurrent solid tumors: A Children's Oncology Group Phase 1 Consortium study (ADVL1314). Pediatr Blood Cancer 65 (8): e27066, 2018. [PUBMED Abstract]
- Lee ATJ, Thway K, Huang PH, et al.: Clinical and Molecular Spectrum of Liposarcoma. J Clin Oncol 36 (2): 151-159, 2018. [PUBMED Abstract]
- Beane JD, Yang JC, White D, et al.: Efficacy of adjuvant radiation therapy in the treatment of soft tissue sarcoma of the extremity: 20-year follow-up of a randomized prospective trial. Ann Surg Oncol 21 (8): 2484-9, 2014. [PUBMED Abstract]
Tratamiento de los tumores osteocondrales
Hay varios subtipos de tumores osteocondrales, entre ellos los siguientes:
Condrosarcoma mesenquimatoso extraesquelético
Las neoplasias óseas y condromatosas representan el 0,8 % de los sarcomas de tejido blando en los pacientes menores de 20 años (consultar el Cuadro 1). El condrosarcoma mesenquimatoso se presenta con más frecuencia en la región de la cabeza y el cuello.
Características histopatológicas y alteraciones genómicas
El condrosarcoma mesenquimatoso es un tumor raro que se caracteriza por células redondas pequeñas y cartílago hialino que suele afectar a adultos jóvenes.
Se ha establecido una relación entre el condrosarcoma mesenquimatoso y el reordenamiento cromosómico constante. En un análisis retrospectivo de casos de condrosarcoma mesenquimatoso, se identificó una fusión génica HEY1::NCOA2 en 10 de 15 muestras analizadas.[1] Esta fusión génica no se relacionó con cambios cromosómicos que se pudieron detectar mediante cariotipificación. En un caso de condrosarcoma mesenquimatoso, se identificó la translocación t(1;5)(Q42;q32) y se observó que se relacionaba con una nueva fusión génica IRF2BP::CDX1.[2]
En un estudio retrospectivo se analizaron 13 pacientes con condrosarcoma mesenquimatoso; todos ellos con fusiones génicas HEY1::NCOA2 confirmadas.[3]
- La mediana de edad de presentación fue de 19 años.
- De los pacientes con condrosarcomas mesenquimatosos, 5 (39 %) tenían una presentación intraósea (cráneo, maxilar, paladar y mandíbula), mientras que los 8 casos restantes se presentaron en el encéfalo, las meninges, la órbita y la cavidad nasal.
- Desde el punto de vista microscópico, los condrosarcomas mesenquimatosos de cabeza y cuello se caracterizaron por células redondas primitivas dispuestas en una arquitectura anidada distintiva y una vasculatura abundante y muy ramificada.
- El 69 % de los casos presentaba un componente cartilaginoso de islas de cartílago hialino o condrocitos únicos.
- Por lo general, se observó un inmunoperfil combinado de CD99(+)/SATB2(+)/CD34(-)/STAT6(-).
Factores pronósticos y pronóstico
En una encuesta retrospectiva llevada a cabo en instituciones europeas, se identificó a 113 niños y adultos con condrosarcoma mesenquimatoso. Los factores relacionados con un mejor desenlace fueron los siguientes:[4][Nivel de evidencia C1]
- Ausencia de enfermedad metastásica en el cuadro clínico inicial.
- Márgenes de resección limpios.
- Administración de quimioterapia posoperatoria después de la resección en pacientes cuya enfermedad estaba inicialmente localizada.
En un análisis retrospectivo con datos del Surveillance, Epidemiology, and End Results (SEER) Program desde 1973 hasta 2011, se identificó a 205 pacientes con condrosarcoma mesenquimatoso; 82 pacientes tenían tumores primarios esqueléticos y 123 pacientes tenían tumores extraesqueléticos.[5] Los desenlaces de los pacientes con tumores primarios esqueléticos y extraesqueléticos fueron los mismos. Los factores relacionados con los desenlaces fueron los siguientes:
- Sitio primario. Se observó una tasa de supervivencia general (SG) a 5 años del 50 % en pacientes con tumores de apéndice, del 37 % en pacientes con tumores axiales y del 74 % en pacientes con tumores craneales.
- Metástasis y tamaño del tumor. La presencia de enfermedad metastásica y un tamaño tumoral más grande, se vincularon de manera independiente con un mayor riesgo de muerte.
En una revisión retrospectiva de una sola institución se identificaron 43 casos de condrosarcoma mesenquimatoso desde 1979 hasta 2010.[6] Se evaluaron 30 pacientes con enfermedad localizada. La media de edad en el momento del diagnóstico fue de 33 años (intervalo, 11–65 años).
- La tasa de SG a 5 años fue del 51 % y la tasa de SG a 10 años fue del 37 %.
- La edad más joven (<30 años de edad) y el sexo masculino se relacionaron con una SG y una supervivencia sin enfermedad (SSE) más precarias.
- Los pacientes que no recibieron radioterapia adyuvante fueron más propensos a presentar una recidiva local.
Tratamiento del condrosarcoma mesenquimatoso extraesquelético
Las opciones de tratamiento del condrosarcoma mesenquimatoso extraesquelético son las siguientes:
En una revisión de 15 pacientes menores de 26 años incluidos en los protocolos del German Cooperative Soft Tissue Sarcoma Study Group (11 con lesiones de tejido blando) y del German-Austrian-Swiss Cooperative Osteosarcoma Study Group (4 con lesiones óseas primarias), se indicó que es necesaria una resección quirúrgica completa o una resección incompleta seguida de radioterapia, para el control local.[9][Nivel de evidencia C1]
En una revisión retrospectiva de una sola institución, se identificó a 12 pacientes pediátricos con condrosarcoma mesenquimatoso.[10] De estos pacientes, 11 tenían enfermedad localizada y 1 tenía nódulos pulmonares. Recibieron quimioterapia preoperatoria 6 pacientes, y todos recibieron quimioterapia posoperatoria (con mayor frecuencia ifosfamida y doxorrubicina), con radioterapia (mediana de dosis, 59,4 Gy) o sin esta.
- En los tumores de estos pacientes se documentó el reordenamiento de NCOA2.
- En el estudio se confirmó que la resección quirúrgica es necesaria para la curación.
- En el momento de una mediana de seguimiento de 4,8 meses, la tasa de SSE a 5 años fue del 68,2 % (intervalo de confianza [IC] 95 %, 39,8–96,6 %), y la tasa de SG fue del 88,9 % (IC 95 %, 66,9–100 %).
En un estudio japonés de pacientes con condrosarcoma mixoide extraesquelético y condrosarcoma mesenquimatoso, los pacientes se asignaron al azar a un tratamiento con trabectedina o al mejor cuidado médico de apoyo.[11] La mediana de edad de los pacientes fue de 38 años (intervalo, 21–77 años).
- La SG fue más alta en los pacientes asignados a recibir trabectedina que en los pacientes asignados a recibir el mejor cuidado médico de apoyo.
Osteosarcoma extraesquelético
El osteosarcoma extraesquelético es sumamente infrecuente en niños y adolescentes. Las neoplasias óseas y condromatosas representan el 0,8 % de los sarcomas de tejido blando en los pacientes menores de 20 años (consultar el Cuadro 1).
Alteraciones genómicas
En una revisión de 32 pacientes adultos con osteosarcoma extraesquelético se observaron varias alteraciones uniformes.[12] Las alteraciones genómicas frecuentes incluyeron pérdidas de número de copias en CDKN2A (70 %), TP53 (56 %) y RB1 (49 %). Se identificaron variantes que afectaron la metilación y la desmetilación (40 %), la reestructuración de cromatina (27 %) y las vías WNT/SHH (27 %). Los casos con pérdidas en el número de copias bialélicas simultáneas de TP53 y RB1 se relacionaron con SSE y SG más precarias.
Factores pronósticos y pronóstico
El osteosarcoma extraesquelético se relaciona con un riesgo alto de recidiva local y metástasis pulmonar.[13]
En una revisión retrospectiva de una sola institución se identificó a 43 pacientes con osteosarcoma extraesquelético: 37 pacientes tenían enfermedad localizada y 6 pacientes presentaban enfermedad metastásica. La mediana de edad fue de 55 años (intervalo de edad, 7–81 años). El 75 % de los pacientes recibieron quimioterapia.[14]
- La mediana de supervivencia sin progresión (SSP) fue de 21 meses.
- La mediana de SG fue de 50 meses.
- Hubo una tendencia hacia una mejor supervivencia para los pacientes que recibieron quimioterapia y una mejora estadísticamente significativa en la supervivencia de los pacientes que recibieron quimioterapia con cisplatino.
En una revisión de 274 pacientes con osteosarcoma extraesquelético, la mediana de edad en el momento del diagnóstico fue de 57 años (intervalo, 12–91 años).[15][Nivel de evidencia C1]
- Las tasas de SSE y SG a 5 años fueron significativamente mejores para quienes recibieron quimioterapia.
- El uso de un régimen de tipo osteosarcoma se relacionó con mejoras en las tasas de respuesta.
La European Musculoskeletal Oncology Society realizó un análisis retrospectivo de 266 pacientes con osteosarcoma extraesquelético aptos y tratados entre 1981 y 2014. Cincuenta pacientes (19 %) presentaron enfermedad metastásica.[15]
- En un análisis de los 211 pacientes que lograron la remisión completa luego de la resección quirúrgica del tumor primario, se observó una tasa de SG a 5 años del 51 % y una tasa de SSE del 43 %.
- Hubo una tendencia favorable a la supervivencia entre los pacientes que se trataron con la quimioterapia que se suele usar para los pacientes con osteosarcoma óseo.
- En un análisis multivariante, los factores que se relacionaron con un pronóstico más favorable incluyeron una edad menor (<40 años), tumores más pequeños y el uso de quimioterapia.
En un análisis de datos del SEER Program, desde 1973 hasta 2009, se identificaron 256 pacientes (6 %) con osteosarcoma extraesquelético entre 4173 pacientes con osteosarcoma de grado alto.[16]
- En comparación con los pacientes que tenían un osteosarcoma esquelético, fue más probable que los pacientes con osteosarcoma extraesquelético fueran mayores, mujeres, presentaran un tumor primario axial y compromiso de ganglio linfático regional.
- Las características de pronóstico adverso incluyeron la presencia de enfermedad metastásica, mayor tamaño del tumor, edad avanzada y sitio axial del tumor primario.
Tratamiento del osteosarcoma extraesquelético
Las opciones de tratamiento del osteosarcoma extraesquelético son las siguientes:
Los regímenes quimioterapéuticos típicos que se usan para el osteosarcoma incluyen una combinación de cisplatino, doxorrubicina, dosis altas de metotrexato e ifosfamida.[13-15]
Para obtener más información sobre el tratamiento del osteosarcoma extraóseo, incluso las opciones de quimioterapia, consultar Tratamiento del osteosarcoma y el sarcoma pleomórfico indiferenciado óseo.
Bibliografía
- Wang L, Motoi T, Khanin R, et al.: Identification of a novel, recurrent HEY1-NCOA2 fusion in mesenchymal chondrosarcoma based on a genome-wide screen of exon-level expression data. Genes Chromosomes Cancer 51 (2): 127-39, 2012. [PUBMED Abstract]
- Nyquist KB, Panagopoulos I, Thorsen J, et al.: Whole-transcriptome sequencing identifies novel IRF2BP2-CDX1 fusion gene brought about by translocation t(1;5)(q42;q32) in mesenchymal chondrosarcoma. PLoS One 7 (11): e49705, 2012. [PUBMED Abstract]
- Xu B, Rooper LM, Dermawan JK, et al.: Mesenchymal chondrosarcoma of the head and neck with HEY1::NCOA2 fusion: A clinicopathologic and molecular study of 13 cases with emphasis on diagnostic pitfalls. Genes Chromosomes Cancer 61 (11): 670-677, 2022. [PUBMED Abstract]
- Frezza AM, Cesari M, Baumhoer D, et al.: Mesenchymal chondrosarcoma: prognostic factors and outcome in 113 patients. A European Musculoskeletal Oncology Society study. Eur J Cancer 51 (3): 374-81, 2015. [PUBMED Abstract]
- Schneiderman BA, Kliethermes SA, Nystrom LM: Survival in Mesenchymal Chondrosarcoma Varies Based on Age and Tumor Location: A Survival Analysis of the SEER Database. Clin Orthop Relat Res 475 (3): 799-805, 2017. [PUBMED Abstract]
- Kawaguchi S, Weiss I, Lin PP, et al.: Radiation therapy is associated with fewer recurrences in mesenchymal chondrosarcoma. Clin Orthop Relat Res 472 (3): 856-64, 2014. [PUBMED Abstract]
- Bahig H, Roberge D, Bosch W, et al.: Agreement among RTOG sarcoma radiation oncologists in contouring suspicious peritumoral edema for preoperative radiation therapy of soft tissue sarcoma of the extremity. Int J Radiat Oncol Biol Phys 86 (2): 298-303, 2013. [PUBMED Abstract]
- Baldini EH, Wang D, Haas RL, et al.: Treatment Guidelines for Preoperative Radiation Therapy for Retroperitoneal Sarcoma: Preliminary Consensus of an International Expert Panel. Int J Radiat Oncol Biol Phys 92 (3): 602-12, 2015. [PUBMED Abstract]
- Dantonello TM, Int-Veen C, Leuschner I, et al.: Mesenchymal chondrosarcoma of soft tissues and bone in children, adolescents, and young adults: experiences of the CWS and COSS study groups. Cancer 112 (11): 2424-31, 2008. [PUBMED Abstract]
- Bishop MW, Somerville JM, Bahrami A, et al.: Mesenchymal Chondrosarcoma in Children and Young Adults: A Single Institution Retrospective Review. Sarcoma 2015: 608279, 2015. [PUBMED Abstract]
- Morioka H, Takahashi S, Araki N, et al.: Results of sub-analysis of a phase 2 study on trabectedin treatment for extraskeletal myxoid chondrosarcoma and mesenchymal chondrosarcoma. BMC Cancer 16: 479, 2016. [PUBMED Abstract]
- Jour G, Wang L, Middha S, et al.: The molecular landscape of extraskeletal osteosarcoma: A clinicopathological and molecular biomarker study. J Pathol Clin Res 2 (1): 9-20, 2016. [PUBMED Abstract]
- Sordillo PP, Hajdu SI, Magill GB, et al.: Extraosseous osteogenic sarcoma. A review of 48 patients. Cancer 51 (4): 727-34, 1983. [PUBMED Abstract]
- Paludo J, Fritchie K, Haddox CL, et al.: Extraskeletal Osteosarcoma: Outcomes and the Role of Chemotherapy. Am J Clin Oncol 41 (9): 832-837, 2018. [PUBMED Abstract]
- Longhi A, Bielack SS, Grimer R, et al.: Extraskeletal osteosarcoma: A European Musculoskeletal Oncology Society study on 266 patients. Eur J Cancer 74: 9-16, 2017. [PUBMED Abstract]
- Thampi S, Matthay KK, Boscardin WJ, et al.: Clinical Features and Outcomes Differ between Skeletal and Extraskeletal Osteosarcoma. Sarcoma 2014: 902620, 2014. [PUBMED Abstract]
Tratamiento de los tumores fibroblásticos y miofibroblásticos
Hay varios subtipos de tumores fibroblásticos y miofibroblásticos, entre ellos los siguientes:
- Tumores fibroblásticos y miofibroblásticos intermedios (localmente invasores).
- Fibromatosis tipo desmoide (denominada anteriormente tumor desmoide o fibromatosis agresiva).
- Tumores fibroblásticos y miofibroblásticos intermedios (metastatizan con poca frecuencia).
- Dermatofibrosarcoma protuberante, sin otra indicación.
- Tumor miofibroblástico inflamatorio.
- Sarcoma miofibroblástico inflamatorio epitelioide.
- Fibrosarcoma infantil.
- Tumores fibroblásticos y miofibroblásticos malignos.
Fibromatosis tipo desmoide
La fibromatosis tipo desmoide antes se llamaba tumor desmoide o fibromatosis agresiva.
La fibromatosis tipo desmoide tiene un potencial muy bajo de producir metástasis. Los tumores infiltran a nivel local y lograr el control quirúrgico es difícil por la necesidad de conservar las estructuras normales.
La fibromatosis tipo desmoide tiene un potencial alto de recidiva local. Estos tumores tienen una evolución natural muy variable, incluso hay ejemplos bien documentados de regresión espontánea.[1]
Alteraciones genómicas
La mayoría de tumores desmoides son esporádicos, pero una proporción baja se asocia con una variante del gen APC (vinculado con pólipos intestinales e incidencia alta de cáncer de colon). En un estudio de 519 pacientes mayores de 10 años con diagnóstico de fibromatosis tipo desmoide, se encontró que 39 pacientes (7,5 %, por una posible subestimación) tenían poliposis adenomatosa familiar (PAF).[2] Los pacientes con PAF y fibromatosis tipo desmoide eran más jóvenes, con mayor frecuencia varones, y tenían más tumores de pared abdominal o mesentéricos que los pacientes con fibromatosis tipo desmoide sin PAF.
Se han observado variantes del exón 3 del gen CTNNB1 en más del 80 % de los casos de fibromatosis tipo desmoide. La variante 45F en el exón 3 del gen CTNNB1 se ha vinculado con aumento del riesgo de recidiva de la enfermedad.[3] La resección quirúrgica repetida a veces permite controlar las lesiones recidivantes.[4]
En la actualidad, no se cuenta con recomendaciones generales sobre pruebas genéticas en niños con fibromatosis tipo desmoide. Las características moleculares y patológicas del tumor solo orientan la detección.
Si se encuentran antecedentes familiares de cáncer de colon, hay hiperplasia congénita del epitelio pigmentario de la retina [5,6] o si la fibromatosis tipo desmoide se presenta en el abdomen o la pared abdominal,[2] se debe derivar de inmediato a un asesor genético. Si el tumor exhibe una variante somática en CTNNB1, no son necesarios los exámenes de detección porque no se ha descrito ninguna variante del gen APC en este entorno. Si no se identifica alguna variante de CTNNB1, es posible que se justifiquen los análisis para detectar la variante de APC.[7,8]
Los tumores desmoides pediátricos a veces albergan otras variantes de los genes AKT, TP53 y RET, así como la variante BRAF V600E.[9] Para obtener más información en inglés, consultar la sección Familial Adenomatous Polyposis (FAP) en Genetics of Colorectal Cancer (Genética del cáncer colorrectal).
Tratamiento de la fibromatosis tipo desmoide
Es muy difícil evaluar el beneficio de las intervenciones terapéuticas para la fibromatosis tipo desmoide, porque esta enfermedad tiene una evolución natural muy variable, y se observan regresiones parciales hasta en el 20 % de los pacientes.[10] En series grandes de adultos y en series pediátricas más pequeñas, se encontraron periodos prolongados de estabilización de la enfermedad, incluso regresión sin tratamiento sistémico.[4,11]; [12][Nivel de evidencia C2] Por ejemplo, en un ensayo grande controlado con placebo de sorafenib en pacientes adultos con tumor desmoide, los pacientes que no recibieron tratamiento (observación o placebo) mostraron una tasa de regresión parcial del 20 %, y el 46 % de los pacientes del grupo de placebo no presentaron progresión al cabo de 1 año.[10]
Las opciones de tratamiento de la fibromatosis tipo desmoide son las siguientes:
Observación
Debido a la evolución natural variable de los tumores desmoides, como se describió antes, la observación a veces es una opción viable. Este es, sobre todo, el caso de las lesiones asintomáticas, las lesiones que no representan un peligro para los órganos vitales y los tumores que se resecan de forma incompleta.[4,13-19]
Se organizó una reunión mundial de consenso de expertos en sarcoma con experiencia en tumores desmoides pediátricos y de adultos con el fin de definir el tratamiento correcto. El Desmoid Tumor Working Group indicó que un abordaje de vigilancia activa inicial no afectaba la eficacia de tratamientos posteriores. Se indicó que el tratamiento activo solo debía considerarse en casos de progresión persistente. La vigilancia activa incluye el control continuo con imágenes por resonancia magnética (IRM) iniciales 1 a 2 meses después del diagnóstico e imágenes posteriores a intervalos de 3 a 6 meses. Se deben tomar decisiones encaminadas a iniciar un tratamiento activo cuando la enfermedad afecta estructuras vitales, como el mesenterio o la región de la cabeza y el cuello, que puedan causar morbilidad significativa.[20]
Evidencia (observación vs. cirugía inicial):
- En un estudio prospectivo de 771 pacientes con fibromatosis tipo desmoide, se comparó la cirugía inicial con la observación inicial.[21][Nivel de evidencia C2]
- No hubo diferencia en las tasas de supervivencia sin complicaciones (SSC) entre los 2 grupos (53 vs. 58 %; P = 0,415).
- Entre los pacientes con localización tumoral favorable, es decir, pared abdominal, intraabdominal, mama, vísceras digestivas y extremidades inferiores, la tasa de SSC a 2 años fue similar en los pacientes sometidos a una cirugía (70 %) u observación (63 %; P = 0,41).
- Entre los pacientes con tumores en una localización desfavorable, es decir, pared torácica, cabeza y cuello y extremidad superior, la tasa de SSC a 2 años fue significativamente superior en quienes recibieron tratamiento no quirúrgico (52 %), en comparación con quienes se sometieron a una cirugía inicial (25 %; P = 0,001).
- Hubo 173 pacientes con fibromatosis tipo desmoide que se trataron en estudios pediátricos europeos del Soft Tissue Sarcoma Study Group (EpSSG) desde 2005. De esos pacientes, 13 (8 %) solo se sometieron a biopsias (sin tratamiento adicional), 65 pacientes (42 %) recibieron solo quimioterapia, 31 pacientes (20 %) se sometieron a cirugía sola, 36 pacientes (23 %) se sometieron a quimioterapia y cirugía, y 9 pacientes (6 %) recibieron radioterapia además de otras terapias.[22][Nivel de evidencia C2]
- Todos los pacientes estaban vivos en el momento del análisis.
- Los autores concluyeron que el abordaje conservador no quirúrgico no afectó los desenlaces en pacientes pediátricos.
Se ha cuestionado la falta de intervención quirúrgica o de otro tipo. En el Toronto Hospital for Sick Children se evaluó la repercusión emocional en los pacientes con tumores desmoides al regresar para visitas regulares a un centro oncológico con el fin de someterse a tomografía computarizada (TC) o IRM y consultas de seguimiento. Las personas con tumores desmoides presentaban grados más altos de ansiedad, incluso cuando se los comparaba con pacientes de sarcoma; esto no disminuyó con el tratamiento y continuó durante todo el seguimiento.[23][Nivel de evidencia C1]
Quimioterapia para tumores recidivantes o irresecables
Los siguientes regímenes de quimioterapia se han empleado para tratar la fibromatosis tipo desmoide:
- Metotrexato y vinblastina: esta combinación produjo respuestas objetivas en cerca de un tercio de los pacientes con fibromatosis tipo desmoide irresecable o recidivante.[24]
- Doxorrubicina y dacarbazina: en una serie compuesta en su mayoría por pacientes adultos con PAF y fibromatosis tipo desmoide irresecable que no respondió bien a la terapia hormonal, se observó que la doxorrubicina con dacarbazina seguida de meloxicam (un AINE) es un tratamiento inocuo que puede provocar respuestas.[25]
- Doxorrubicina liposomal pegilada: en un estudio de 11 pacientes, 4 pacientes lograron una respuesta objetiva y 7 pacientes presentaron enfermedad estable.[26] En una serie de 5 pacientes, se notificó una mediana de intervalo sin progresión de 29 meses.[27]
- Hidroxiurea: en un ensayo retrospectivo, se notificaron los desenlaces de 16 niños que habían recibido antes tratamiento para tumores desmoides con hidroxiurea. Antes de la administración de la hidroxiurea, 7 pacientes exhibieron progresión del tumor, 2 pacientes notificaron aumento del dolor y 7 pacientes presentaron ambos. Se redujo el tamaño del tumor en el 37,5 % de los pacientes (18,7 % de remisiones parciales) y mejoraron los síntomas en el 68,7 % de los pacientes.[28]
- Vinorelbina: en una revisión retrospectiva, 24 pacientes con fibromatosis de tipo desmoide (mediana de edad, 13,9 años; intervalo, 1–23 años) recibieron vinorelbina oral en 8 centros de la Société Française des Cancers de l'Enfant entre 2005 y 2020. De los 23 pacientes evaluables, el 13 % presentaron respuestas parciales, el 78 % estabilización de la enfermedad y el 9 % progresión de la enfermedad. La tasa de supervivencia sin progresión (SSP) fue del 89,3 % a los 24 meses.[29]
Inhibidores de tirosina–cinasas
La terapia dirigida se ha utilizado para el tratamiento de niños y adultos con fibromatosis tipo desmoide.
Evidencia (sorafenib):
- Se condujo un estudio internacional prospectivo de fase III con enmascaramiento doble a través de la National Clinical Trials Network para evaluar la eficacia del sorafenib en pacientes con tumores desmoides irresecables progresivos o sintomáticos. Se inscribieron 87 pacientes (entre 18 y 72 años de edad). Los pacientes se asignaron al azar en una proporción 2:1 (sorafenib: placebo); se permitió el cambio al grupo de sorafenib después de la progresión de la enfermedad.[10][Nivel de evidencia B1]
- La tasa de respuesta objetiva fue del 33 % (intervalo de confianza [IC], 95 %, 20–48 %) en el grupo de sorafenib y del 20 % (IC 95 %, 8–38 %) en el grupo de placebo.
- La mediana de tiempo hasta la respuesta objetiva fue de 9,5 meses para los pacientes tratados con sorafenib y de 13,3 meses para los pacientes que recibieron el placebo.
- La tasa de SSP a 2 años fue del 81 % en los pacientes tratados con sorafenib, en comparación con el 36 % en los pacientes que recibieron el placebo.
Evidencia (pazopanib):
- En una serie pequeña se incluyeron 6 pacientes (de 3 a 21 años) con fibromatosis tipo desmoide que recibieron pazopanib.[30]
- Se notificó mejora de los síntomas y enfermedad estable en todos los pacientes.
- En un estudio aleatorizado no comparativo, se incluyeron pacientes adultos con tumores desmoides tratados con pazopanib, o metotrexato y vinblastina.[31]
- Cerca del 84 % de los pacientes que recibieron pazopanib no presentaban progresión a los 6 meses.
Inhibidores de la vía NOTCH o de la gamma-secretasa
La vía NOTCH se ha relacionado con la formación de tumores desmoides.[32] Se evaluó el nirogacestat, un inhibidor de la vía NOTCH o de la gamma-secretasa, en pacientes adultos y pediátricos.
Evidencia (nirogacestat):
- En un estudio se incluyeron 17 pacientes adultos con tumores desmoides, de lo cuales 15 tenían variantes de los genes APC o CTNNB1.[33][Nivel de evidencia C3]
- De los pacientes, 5 (29 %) lograron una respuesta parcial confirmada con el nirogacestat.
- Entre las pacientes adultas, 4 presentaron menstruación irregular de grado 1.
- En un ensayo clínico (NCT03785964), el 75 % de las mujeres en edad fértil notificaron complicaciones relacionadas con disfunción ovárica.[34]
- En una serie pequeña se incluyeron 4 pacientes menores de 20 años que recibieron nirogacestat en el marco de un uso compasivo.[35][Nivel de evidencia C3]
- De los pacientes, 3 presentaron un beneficio duradero, definido como respuesta completa (n = 1), respuesta parcial (n = 1) o enfermedad estable (n = 1).
- Ningún paciente presentó efectos adversos de grado 3 o 4.
- La FDA aprobó el nirogacestat para el tratamiento de pacientes de 18 años o más con tumores desmoides progresivos que requieren terapia sistémica. La aprobación se hizo sobre la base de un ensayo prospectivo, aleatorizado y controlado con placebo que llevó adelante un consorcio.[34]
- En 142 pacientes, el nirogacestat presentó un beneficio significativo para la SSP, en comparación con el placebo (cociente de riesgos instantáneos para la progresión de la enfermedad o la muerte, 0,29; IC 95 %, 0,15–0,55; P < 0,001).
- La probabilidad de no presentar complicaciones a los 2 años fue del 76 % con el nirogacestat y del 44 % con un placebo.
- El nirogacestat se relacionó con beneficios significativos relacionados con la SSP, la respuesta objetiva, el dolor, la carga de los síntomas, el funcionamiento físico, el desempeño en las actividades cotidianas y la calidad de vida relacionada con la salud en adultos con tumores desmoides en progresión.
- El nirogacestat se relacionó con un riesgo significativo de insuficiencia ovárica.
Antiinflamatorios no esteroideos
Los antiinflamatorios no esteroideos (AINE), como el sulindac, se han utilizado en casos aislados de fibromatosis tipo desmoide; las respuestas observadas fueron por lo general de estabilización de la enfermedad.[36]
Tratamiento antiestrogénico
El tratamiento antiestrogénico, por lo general con tamoxifeno y sulindac, también produjo estabilización de la enfermedad.[37] En un ensayo prospectivo de la combinación de tamoxifeno y sulindac, se notificaron pocos efectos secundarios, pero fueron comunes los quistes de ovario asintomáticos en las niñas. La combinación fue relativamente poco activa, según se evaluó mediante las tasas de respuesta y de SSP.[38][Nivel de evidencia B4]
Cirugía
La resección quirúrgica se debe usar con cautela en los pacientes con tumores desmoides porque hay regresión espontánea en hasta el 20 % de los casos. Se recomienda la resección quirúrgica cuando el crecimiento del tumor amenaza la integridad de las vías respiratorias o cuando hay síntomas persistentes, como el dolor. En caso contrario se prefiere una estrategia de conducta expectante.
Si se opta por la cirugía, la intención es lograr márgenes limpios. No obstante, en una revisión retrospectiva de niños sometidos a cirugía por fibromatosis tipo desmoide en el St. Jude Children’s Research Hospital (SJCRH) no se notificó ninguna correlación entre los márgenes quirúrgicos y el riesgo de recidiva.[19] En este estudio, 10 de 39 pacientes presentaron recidiva después de la cirugía, con una mediana de intervalo de tiempo de 2,5 años.
Radioterapia
Se ha utilizado radiación para la fibromatosis tipo desmoide irresecable y sintomática o en el ámbito posoperatorio después de una resección tumoral inadecuada cuando la progresión hubiese causado consecuencias patológicas. Las posibles complicaciones a largo plazo de la radioterapia, en especial las neoplasias subsiguientes, hacen que esta modalidad sea menos atractiva para los pacientes más jóvenes.[39]
Se puede considerar la radioterapia posoperatoria cuando la recidiva o la progresión implicaría una cirugía adicional que podría causar compromiso funcional o cosmético, siempre y cuando la radiación se considere aceptable en términos de morbilidad.
Opciones de tratamiento en evaluación clínica
La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
Dermatofibrosarcoma protuberante, sin otra indicación
El dermatofibrosarcoma es un tumor raro que se presenta en todos los grupos de edad, pero muchos de los casos se notifican en niños.[40-42] En una revisión de 451 casos en personas menores de 20 años de la base de datos SEER Program se encontró que la incidencia fue de 1 caso por millón. La incidencia fue más alta en pacientes negros de 15 a 19 años. Los sitios más comunes fueron el tronco y las extremidades, semejante a lo que se encuentra en adultos.
El 95 % de los pacientes se sometió a cirugía. La tasa de supervivencia general (SG) fue del 100 % a los 5 años, del 98 % a los 15 años y del 97 % a los 30 años. La supervivencia de los hombres fue más baja, en comparación con la de las mujeres (P < 0,05).[43][Nivel de evidencia C1]
Alteraciones genómicas
El tumor tiene una translocación cromosómica t(17;22)(q22;q13) constante en la que se yuxtapone el gen COL1A1 con el gen PDGFRB.
Tratamiento del dermatofibrosarcoma protuberante
Se publicaron directrices para la evaluación diagnóstica y el tratamiento del dermatofibrosarcoma protuberante.[44]
Las opciones de tratamiento del dermatofibrosarcoma protuberante son las siguientes:
Cirugía con radioterapia o sin esta
La mayoría de los pacientes con tumores de dermatofibrosarcoma pueden curarse con una resección quirúrgica completa. Una resección amplia con márgenes negativos, una operación de Mohs o una operación de Mohs modificada prevendrán la recidiva de la mayoría de los tumores.[45] A pesar del comportamiento localmente agresivo del tumor, rara vez se presentan metástasis ganglionares o viscerales.
Evidencia (cirugía):
- En el ensayo prospectivo NRSTS 2005 (NCT00334854) del EpSSG se identificaron 46 pacientes con dermatofibrosarcoma protuberante.[46] La mediana de edad en el momento del diagnóstico fue de 6,9 años (intervalo, 0,4–17,5 años). Todos los pacientes presentaban enfermedad localizada, el 93 % de los pacientes tenían tumores pequeños (<5 cm) y el 76 % de los pacientes tenía tumores del grupo I del Intergroup Rhabdomyosarcoma Study (IRS).
- Todos los pacientes se sometieron al inicio a una cirugía y 32 pacientes necesitaron 2 procedimientos.
- Hubo 11 pacientes con tumores del grupo II del IRS; 2 de ellos presentaron una recidiva local.
- Al cabo de una mediana de seguimiento de 49 meses (intervalo, 4,2–130,9 meses), en el momento de este informe todos los pacientes estaban vivos.
- La tasa de SSC a 5 años fue del 92,6 % (IC 95 %, 78,8–97,6 %), y la tasa de SG fue del 100 %.
En revisiones retrospectivas, la radioterapia posoperatoria después de la resección incompleta quizás fue el factor que disminuyó la probabilidad de recidiva.[47,48] La probabilidad de enfermedad metastásica es mayor después de recidivas múltiples, y se debe considerar el uso de radiación u otras terapias adyuvantes para los pacientes con recidivas que no se pueden tratar con cirugía.[41,43]
Terapia dirigida (imatinib)
Cuando no es posible la resección quirúrgica o el tumor es recidivante, el tratamiento con imatinib ha sido eficaz en adultos.[49-51]
Evidencia (imatinib):
- En una revisión sistemática de 9 estudios se evaluó a 152 pacientes con dermatofibrosarcoma protuberante, comprobado mediante análisis histológico, que habían recibido imatinib.[52]
- En el estudio se demostró una tasa de respuesta completa del 5,2 %, una tasa de respuesta parcial del 55,2 % y una tasa de enfermedad estable del 27,6 %.
- No se presentaron diferencias en las tasas de respuesta al imatinib en dosis de 400 mg u 800 mg por día.
Tumor miofibroblástico inflamatorio y sarcoma miofibroblástico inflamatorio epitelioide
El tumor miofibroblástico inflamatorio es un tumor mesenquimatoso raro que se presenta sobre todo en niños y adolescentes.[53-55]
Cuadro clínico inicial
Los tumores miofibroblásticos inflamatorios son tumores raros que afectan los tejidos blandos y las vísceras de niños y adultos jóvenes.[56] Rara vez hacen metástasis, pero suelen ser localmente invasivos. Los sitios anatómicos comunes de la enfermedad son los tejidos blandos, los pulmones, el bazo, el colon y las mamas.[53] En 2015 se publicó una revisión de 42 casos pediátricos de tumor miofibroblástico inflamatorio de vejiga.[57]
El sarcoma miofibroblástico inflamatorio epitelioide es un subtipo poco común de tumores miofibroblásticos inflamatorios que exhibe predominio masculino y que se puede presentar desde la lactancia hasta la edad adulta.[58-60] Este subtipo exhibe características morfológicas epitelioides y una configuración membranosa perinuclear o nuclear de inmunotinción de ALK.[58] El sitio de presentación más común es el abdomen, aunque se han notificado otros sitios primarios.[58-60]
Alteraciones genómicas
Cerca de la mitad de los tumores miofibroblásticos inflamatorios exhiben una variante clonal que activa el gen ALK (codificador de un receptor tirosina–cinasa) en el cromosoma 2p23.[61]
La mayoría de los casos de sarcoma miofibroblástico inflamatorio epitelioide tienen fusiones génicas RANBP2::ALK. También se notificaron fusiones génicas RRBP1::ALK.[58-60] Debido a que RANBP2 se ubica en el poro nuclear, quizás esto explique la configuración de tinción de membrana perinuclear o nuclear ALK del sarcoma miofibroblástico inflamatorio epitelioide.
Se identificaron las fusiones de cinasas ROS1 y PDGFRB en 8 de 11 pacientes (73 %) con pruebas inmunohistoquímicas negativas para ALK.[62][Nivel de evidencia C3]
Pronóstico
Los tumores miofibroblásticos inflamatorios recidivan con frecuencia, pero rara vez son metastásicos.[53-55] En los estudios de niños con tumor miofibroblástico inflamatorio, se observaron tasas de supervivencia a 5 años superiores al 80 %.[63]
El sarcoma miofibroblástico inflamatorio epitelioide es un tumor agresivo que, por lo general, se trata con cirugía. Antes de que el inhibidor de ALK estuviera disponible, era frecuente la progresión de la enfermedad y las tasas de mortalidad eran elevadas.[58,59,64] El sarcoma miofibroblástico inflamatorio epitelioide suele responder a los inhibidores de ALK, pero se ha observado progresión durante el tratamiento, lo que es compatible con el comportamiento clínico agresivo del tumor.[60]
Tratamiento del tumor miofibroblástico inflamatorio
Las opciones de tratamiento del tumor miofibroblástico inflamatorio son las siguientes:
Cirugía y quimioterapia
La extirpación quirúrgica completa, cuando es posible, es el tratamiento de elección.[65]
Evidencia (cirugía con quimioterapia o sin esta):
- En una serie de 9 pacientes, se observó lo siguiente:[66][Nivel de evidencia C1]
- Cuatro lograron remisión sostenida después de una resección completa.
- Tres pacientes con enfermedad residual recayeron, pero luego lograron una remisión sostenida.
- Un paciente con enfermedad metastásica respondió a la quimioterapia multifarmacológica.
- En otro estudio de 31 pacientes sometidos a resección quirúrgica completa, 4 pacientes presentaron recidivas locales.[63]
- De los 4 pacientes con recidivas locales, todos estaban vivos después de una segunda resección quirúrgica (3 pacientes) o después de someterse a quimioterapia adyuvante y resección (1 paciente).
- En una revisión de estudios alemanes, se identificaron 37 pacientes menores de 21 años con tumores miofibroblásticos inflamatorios.[67][Nivel de evidencia C1]
- De 20 pacientes, 17 tuvieron resecciones completas sin recidivas. Las resecciones quirúrgicas se pueden restringir a aquellos procedimientos que permiten conservar la forma y la función.
- El resto de los pacientes se trataron con una combinación de cirugía y varios regímenes de quimioterapia.
- La tasa de SSC general a 5 años fue del 75 %, y la tasa de SG fue del 91 %.
- En una serie de 32 pacientes de 18 años o menos, se encontró que la resección completa fue el tratamiento de elección, aunque algunos pacientes recibieron corticoesteroides o quimioterapia citotóxica.[68][Nivel de evidencia C1]
- La tasa de SG fue del 94 %.
- Recayeron 3 pacientes y, de estos, 2 murieron por la enfermedad.
- Cuando se realizó una resección completa, con la administración de otros tratamientos, como los corticoesteroides, o sin esta, la tasa de supervivencia fue más alta para estos pacientes.
El beneficio de la quimioterapia se ha notificado en informes de casos.[69] En un registro prospectivo del European Soft Tissue Sarcoma Group (2005–2016) de niños con tumor miofibroblástico inflamatorio se encontró una tasa de SSC del 82,9 % y una tasa de SG del 98,1 % a los 5 años en todos los pacientes. La tasa de respuesta para los pacientes que recibieron tratamiento sistémico (quimioterapia o terapia con inhibidor de ALK) fue del 63 % cuando se usó como tratamiento de primera línea y del 66 % cuando se usó como tratamiento de segunda línea. Se notificó respuesta al tratamiento en 8 de los 10 pacientes que recibieron vinblastina y dosis bajas de metotrexato y en los 5 pacientes que recibieron inhibidores de ALK (todos exhibían tumores positivos para ALK)[63]
Terapia con corticoesteroides o terapia con antiinflamatorios no esteroideos
Hay informes de casos de respuesta a los corticoesteroides o a los antiinflamatorios no esteroideos (AINE).[63,70,71]
Terapia dirigida (inhibidores de ALK)
Los tumores miofibroblásticos inflamatorios respondieron al tratamiento con inhibidores de ALK, de la siguiente manera:
Crizotinib
Evidencia (crizotinib):
- En pacientes pediátricos con enfermedad cuantificable, el uso de crizotinib produjo respuestas tumorales parciales en 3 de 6 pacientes que tenían tumores miofibroblásticos inflamatorios con translocaciones en ALK.[72]
- En un informe de caso de un paciente de 16 años con tumor miofibroblástico inflamatorio metastásico o multifocal positivo para ALK se describió una respuesta completa y un intervalo sin enfermedad de 3 años con el crizotinib.[73]
- En un estudio se incluyeron 14 pacientes con tumores miofibroblásticos inflamatorios tratados con crizotinib.[74][Nivel de evidencia C3]
- De estos pacientes, 5 presentaron una respuesta completa, 7 respuesta parcial y los otros 2, enfermedad estable.
- Ningún paciente había recaído en el momento de la publicación del artículo.
- Dos adultos que tenían tumores miofibroblásticos inflamatorios con reordenamientos de ALK obtuvieron una respuesta parcial al crizotinib.[75][Nivel de evidencia C3]
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el crizotinib para pacientes de 1 año o más con tumores miofibroblásticos inflamatorios irresecables, recidivantes o resistentes al tratamiento con ALK.
Ceritinib
Evidencia (ceritinib):
- Se observó respuesta al tratamiento con ceritinib en 2 pacientes pediátricos que participaron en un ensayo clínico.[76]
- Uno de los pacientes tuvo una respuesta completa que duró varios años con la continuación del tratamiento.
- El otro paciente tuvo una respuesta parcial después de interrumpir la administración del fármaco por toxicidad hepática y renal grave.
- En un estudio multicéntrico de fase I de ceritinib, 7 de 10 pacientes con tumor miofibroblástico inflamatorio tuvieron respuestas objetivas al ceritinib.[77]
- En un ensayo de fase I de ceritinib para pacientes adultos tratados previamente con inhibidores de ALK, 1 paciente con tumor miofibroblástico inflamatorio presentó una respuesta parcial.[78]
Alectinib
En un informe de caso se describió el tratamiento exitoso de un paciente con un tumor miofibroblástico inflamatorio y una fusión génica FN1::ALK al recibir alectinib, un inhibidor de ALK de segunda generación.[79]
Para obtener información sobre el tratamiento de este tumor en los pulmones, consultar Tratamiento de los tumores miofibroblásticos inflamatorios pulmonares en la niñez.
Fibrosarcoma infantil
Hay dos tipos distintos de fibrosarcoma en niños y adolescentes:
- El fibrosarcoma infantil es un tumor fibroblástico maligno que por lo general se caracteriza por las fusiones génicas ETV6::NTRK3.
- El fibrosarcoma de tipo adulto se compone de células tumorales fibroblásticas monomórficas. Algunas de las características genómicas del fibrosarcoma de tipo adulto se han descrito recientemente.[80]
Estos tipos de fibrosarcoma corresponden a 2 diagnósticos patológicos diferenciados y exigen diferente tratamiento.
Cuadro clínico inicial
El fibrosarcoma infantil suele presentarse en niños menores de 1 año. Por lo general, este tumor surge como una masa de crecimiento rápido que, a menudo, se observa en el momento del nacimiento o incluso en la ecografía prenatal. Es frecuente que estos tumores sean muy voluminosos en el cuadro clínico inicial.[81] Se ha notificado hipercalcemia secundaria a concentraciones elevadas de la proteína relacionada con la hormona paratiroidea como una característica de presentación inicial de esta enfermedad en los recién nacidos.[82]
La incidencia de metástasis en el momento del diagnóstico de estos tumores es baja.
Alteraciones genómicas
El tumor por lo general tiene una translocación citogenética t(12;15)(p13;q25) característica que da lugar a la fusión génica ETV6::NTRK3. El fibrosarcoma infantil comparte esta translocación y tiene un aspecto histológico prácticamente idéntico al nefroma mesoblástico.
En ocasiones, el fibrosarcoma infantil se presenta en niños de hasta 4 años. Se identificó un tumor con características morfológicas similares en niños más grandes; en estos niños, los tumores no exhiben la fusión ETV6::NRTK3, que es característica de los pacientes más jóvenes.[83] Se han descrito deleciones intragénicas en BRAF en casos de fibrosarcoma infantil, y aparecen junto con fusiones de NTRK3.[84] En un estudio se describieron los casos de 4 niños pequeños con tumores que se clasificaron, según sus características histológicas, como fibrosarcomas infantiles y que tenían reordenamientos en ALK.[85]
La Associazione Italiana Ematologia Oncologia Pediatrica analizó una cohorte de 44 pacientes pediátricos con tumores clasificados como fibrosarcomas infantiles o nefromas mesoblásticos congénitos. Con el fin de identificar nuevos eventos iniciadores, se analizaron mediante secuenciación de RNA 8 tumores mesenquimatosos infantiles similares a fibrosarcomas que obtuvieron un resultado negativo para el gen de fusión ETV6::NTRK3. Se identificaron 3 genes de fusión que involucraban a RAF1: GOLGA4::RAF1, LRRFIP2::RAF1 y CLIP1::RAF1. Las 3 proteínas de fusión conservaron todo el dominio catalítico de la cinasa RAF1.[86]
Tratamiento del fibrosarcoma infantil
Las opciones de tratamiento del fibrosarcoma infantil son las siguientes:
Cirugía, observación o quimioterapia
La resección completa es curativa en la mayoría de los pacientes con fibrosarcoma infantil. No obstante, el gran tamaño de la lesión hace que con frecuencia sea imposible llevar a cabo una resección sin consecuencias funcionales importantes. Por ejemplo, a menudo se necesita una amputación para los tumores de las extremidades con el fin de lograr una resección completa.
Un grupo pediátrico europeo notificó que la observación también es una opción para pacientes con enfermedad de grado II después de una cirugía.[87] Entre los pacientes con enfermedad del grupo II, 12 no recibieron tratamiento adicional y 2 recayeron. Después de la quimioterapia se observó remisión completa en 1 paciente. Se administró quimioterapia posoperatoria a los pacientes con enfermedad en los grupos más altos y para aquellos cuya enfermedad progresó. En un estudio posterior, solo se presentó progresión de la enfermedad en 1 de 7 pacientes del grupo II; dicho paciente logró una remisión completa con quimioterapia.[88][Nivel de evidencia C1]
Se notificó un caso poco frecuente de regresión espontánea sin tratamiento.[89][Nivel de evidencia C3]
La quimioterapia preoperatoria ha hecho posible un abordaje quirúrgico más conservador. Los fármacos activos en este entorno incluyen vincristina, dactinomicina, ciclofosfamida e ifosfamida.[90,91]; [88,92,93][Nivel de evidencia C1] En 3 estudios anteriores de pacientes con fibrosarcoma infantil se indicó que un régimen sin alquilantes fue eficaz y se usó como primera opción de tratamiento en pacientes con enfermedad macroscópica.[87,88,94] Sin embargo, en los resultados más recientes de estudios en los que se usaron inhibidores de NTRK se indicó que los inhibidores de cinasas son un tratamiento inicial apropiado.
Terapia dirigida
Crizotinib
Evidencia (crizotinib):
Larotrectinib
El larotrectinib es un inhibidor oral competitivo del ATP de las TRK A, B y C.
Evidencia (larotrectinib):
- Se completó un ensayo de fase I/II de larotrectinib en pacientes con fibrosarcoma infantil recidivante que albergaban una fusión del gen NTRK.[97]
- Se observaron respuestas objetivas duraderas en los 8 pacientes y las respuestas se presentaron en una mediana de 1,7 meses.
- La mayoría de los efectos tóxicos fueron de grados 1 y 2, lo que incluyó transaminitis, leucopenia, neutropenia y vómitos. No se presentaron efectos de grados 4 o 5 atribuidos al larotrectinib.
- En otro estudio, 3 de 5 pacientes que lograron una respuesta parcial después de recibir larotrectinib neoadyuvante se sometieron a una resección quirúrgica completa con márgenes negativos.[98,99]; [100][Nivel de evidencia C2]
- Estos 3 pacientes obtuvieron una respuesta patológica excelente (efecto del tratamiento >98 %) y permanecieron sin enfermedad 7 a 15 meses después de la cirugía.
- En un informe de seguimiento, 159 pacientes con tumores positivos para fusiones de TRK se inscribieron en ensayos de fase I/II. Hubo 28 pacientes con fibrosarcoma infantil que se trataron con larotrectinib en monoterapia.[101][Nivel de evidencia C2]
- La tasa de respuesta fue del 96 %.
Otros inhibidores de TRK
- LOXO-195: en un ensayo clínico, 1 de 8 pacientes pediátricos con un fibrosarcoma infantil con el reordenamiento ETV6::NTRK3 presentó enfermedad progresiva después de 8 meses de terapia con larotrectinib y se encontró que tenía una resistencia adquirida por variante de G623R. El paciente se trató con LOXO-195, un inhibidor selectivo de TRK diseñado para remediar la resistencia adquirida por variantes recurrentes del dominio cinasa, y experimentó una respuesta parcial transitoria.[102]
- Pazopanib: un paciente de 2 meses con fibrosarcoma infantil se trató primero con quimioterapia. En el momento de la progresión de la enfermedad, se observó una respuesta al tratamiento con pazopanib.[103]
Opciones de tratamiento en evaluación clínica
La información en inglés sobre los ensayos clínicos patrocinados por el NCI se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
Fibrosarcoma, sin otra indicación
Estos tumores carecen de la translocación que se observa en los fibrosarcomas infantiles. Se manifiestan como la mayoría de tumores no rabdomiosarcomatosos y el abordaje de tratamiento es similar.
Mixofibrosarcoma
El mixofibrosarcoma es una lesión rara, en especial en niños. Por lo general, se trata con resección quirúrgica completa.
Sarcoma fibromixoide de grado bajo
El sarcoma fibromixoide de grado bajo es una neoplasia de tejidos blandos engañosa en el análisis histológico, que afecta en su mayoría a adultos jóvenes y de mediana edad. Por lo general, se encuentra de manera profunda en las extremidades.[104-106]
En un ensayo del Children's Oncology Group (COG) (ARST0332 [NCT00346164]) se inscribió a 11 pacientes con este tipo de tumor. La mediana de edad en el momento del diagnóstico fue de 13 años y los varones fueron los más afectados. Los sitios tumorales más frecuentes fueron las extremidades superiores e inferiores (n = 9). Ninguno de los pacientes presentó recidiva de la enfermedad local ni a distancia al cabo de una mediana de seguimiento de hasta 2,7 años.[107]
Alteraciones genómicas
El sarcoma fibromixoide de grado bajo se caracteriza por una translocación génica FUS::CREB3L2 y, en raras ocasiones, translocaciones génicas alternativas como FUS::CREB3L1 y EWSR1::CREB3L1.[108,109]
Pronóstico
En una revisión de 33 pacientes (3 menores de 18 años) con sarcoma fibromixoide de grado bajo, 21 pacientes presentaron una recidiva local después de intervalos de hasta 15 años (mediana, 3,5 años). Se observaron metástasis hasta 45 años (mediana, 5 años) después del diagnóstico en 15 pacientes, los órganos de metástasis más frecuentes fueron los pulmones y la pleura. Este hallazgo acentúa la necesidad de seguimiento continuado para estos pacientes.[104] Incluso después de que se presenta metástasis, la evolución de la enfermedad puede ser lenta.[110]
En otro informe, 14 de 73 pacientes eran menores de 18 años. En esta serie de seguimiento relativamente corto (mediana de 24 meses), solo 8 de 54 pacientes sometidos a un seguimiento adecuado presentaron recidiva local (9 %) o a distancia (6 %). Este informe indicó que el comportamiento de este tumor podría ser mucho mejor de lo que se notificó antes.[111] Sin embargo, debido a que a veces se presentan metástasis tardías, se justifica un seguimiento cuidadoso de estos pacientes.
Tratamiento del sarcoma fibromixoide de grado bajo
Las opciones de tratamiento del sarcoma fibromixoide de grado bajo son las siguientes:
- Cirugía.
El sarcoma fibromixoide de grado bajo no es muy quimiosensible, y la poca información disponible indica que el tratamiento de elección es quirúrgico.[110]
Evidencia (cirugía):
- El German Cooperative Weichteilsarkom Studiengruppe (CWS) notificó los resultados de un estudio de 31 pacientes menores de 21 años con sarcoma fibromixoide de grado bajo.[105][Nivel de evidencia C2]
- La tasa de SSC a 5 años fue del 71 % (IC 95 %, ±18,6 %), la tasa de supervivencia sin recaída local a 5 años fue del 76 % (IC 95 %, ± 17,6 %) y la tasa de SG a 5 años fue del 100 %.
- De 24 pacientes que tuvieron resecciones R0 (resección completa con márgenes microscópicos negativos), 5 pacientes (21 %) presentaron recaídas (3 locales, 1 metastásica y 1 combinada).
- De 7 pacientes que tuvieron resecciones R1 (márgenes positivos al microscopio), 3 pacientes (43 %) presentaron recaídas locales.
Hay pocos datos sobre el uso de quimioterapia o radioterapia para esta enfermedad. En un informe se indica que la trabectedina puede ser eficaz para el tratamiento del sarcoma fibromixoide de grado bajo.[112]
Fibrosarcoma epitelioide esclerosante
El fibrosarcoma epitelioide esclerosante es un sarcoma maligno raro que suele albergar fusiones en el gen EWSR1 y tiene una evolución clínica muy maligna. El tumor responde de manera precaria a la quimioterapia.[113,114]
Características genómicas
El fibrosarcoma epitelioide esclerosante por lo general alberga la fusión génica EWSR1::CREB3L1. Sin embargo, EWSR1 quizás se una a otros compañeros de fusión, como CREB3L2 y CREB3L3.[115,116] Las fusiones de genes que comprometen a FUS (incluso la fusión FUS::CREB3L2 relacionada con el sarcoma fibromixoide de grado bajo) y PAX5 (por ejemplo, PAX5::CREB3L1) son infrecuentes, pero en ocasiones se presentan.[116,117] Los casos de fibrosarcoma epitelioide esclerosante que carecen de la expresión de MUC4, por lo general no tienen fusiones génicas de EWSR1, mientras que se suele observar una fusión génica que compromete a YAP1 y KMT2A.[113,115,118,119] El fibrosarcoma epitelioide esclerosante presenta más alteraciones estructurales y cromosómicas segmentarias que el fibrosarcoma fibromixoide de grado bajo.[115]
Tratamiento del fibrosarcoma epitelioide esclerosante
Las opciones de tratamiento del fibrosarcoma epitelioide esclerosante son las siguientes:
- Cirugía.
El tumor responde de manera precaria a la quimioterapia.[120] Es por eso que, por lo general, se trata con resección quirúrgica completa. Se recomienda un seguimiento a largo plazo debido a que se pueden presentar recidivas locales o metástasis tardías
Bibliografía
- Lewis JJ, Boland PJ, Leung DH, et al.: The enigma of desmoid tumors. Ann Surg 229 (6): 866-72; discussion 872-3, 1999. [PUBMED Abstract]
- Nieuwenhuis MH, Casparie M, Mathus-Vliegen LM, et al.: A nation-wide study comparing sporadic and familial adenomatous polyposis-related desmoid-type fibromatoses. Int J Cancer 129 (1): 256-61, 2011. [PUBMED Abstract]
- Lazar AJ, Tuvin D, Hajibashi S, et al.: Specific mutations in the beta-catenin gene (CTNNB1) correlate with local recurrence in sporadic desmoid tumors. Am J Pathol 173 (5): 1518-27, 2008. [PUBMED Abstract]
- Faulkner LB, Hajdu SI, Kher U, et al.: Pediatric desmoid tumor: retrospective analysis of 63 cases. J Clin Oncol 13 (11): 2813-8, 1995. [PUBMED Abstract]
- Rossato M, Rigotti M, Grazia M, et al.: Congenital hypertrophy of the retinal pigment epithelium (CHRPE) and familial adenomatous polyposis (FAP). Acta Ophthalmol Scand 74 (4): 338-42, 1996. [PUBMED Abstract]
- Baker RH, Heinemann MH, Miller HH, et al.: Hyperpigmented lesions of the retinal pigment epithelium in familial adenomatous polyposis. Am J Med Genet 31 (2): 427-35, 1988. [PUBMED Abstract]
- Kattentidt Mouravieva AA, Geurts-Giele IR, de Krijger RR, et al.: Identification of Familial Adenomatous Polyposis carriers among children with desmoid tumours. Eur J Cancer 48 (12): 1867-74, 2012. [PUBMED Abstract]
- Wang WL, Nero C, Pappo A, et al.: CTNNB1 genotyping and APC screening in pediatric desmoid tumors: a proposed algorithm. Pediatr Dev Pathol 15 (5): 361-7, 2012 Sep-Oct. [PUBMED Abstract]
- Baday YI, Navai SA, Hicks MJ, et al.: Pediatric liposarcoma: A case series and literature review. Pediatr Blood Cancer 68 (12): e29327, 2021. [PUBMED Abstract]
- Gounder MM, Mahoney MR, Van Tine BA, et al.: Sorafenib for Advanced and Refractory Desmoid Tumors. N Engl J Med 379 (25): 2417-2428, 2018. [PUBMED Abstract]
- Merchant NB, Lewis JJ, Woodruff JM, et al.: Extremity and trunk desmoid tumors: a multifactorial analysis of outcome. Cancer 86 (10): 2045-52, 1999. [PUBMED Abstract]
- Honeyman JN, Theilen TM, Knowles MA, et al.: Desmoid fibromatosis in children and adolescents: a conservative approach to management. J Pediatr Surg 48 (1): 62-6, 2013. [PUBMED Abstract]
- Bonvalot S, Ternès N, Fiore M, et al.: Spontaneous regression of primary abdominal wall desmoid tumors: more common than previously thought. Ann Surg Oncol 20 (13): 4096-102, 2013. [PUBMED Abstract]
- Bonvalot S, Eldweny H, Haddad V, et al.: Extra-abdominal primary fibromatosis: Aggressive management could be avoided in a subgroup of patients. Eur J Surg Oncol 34 (4): 462-8, 2008. [PUBMED Abstract]
- Merchant TE, Nguyen D, Walter AW, et al.: Long-term results with radiation therapy for pediatric desmoid tumors. Int J Radiat Oncol Biol Phys 47 (5): 1267-71, 2000. [PUBMED Abstract]
- Zelefsky MJ, Harrison LB, Shiu MH, et al.: Combined surgical resection and iridium 192 implantation for locally advanced and recurrent desmoid tumors. Cancer 67 (2): 380-4, 1991. [PUBMED Abstract]
- Weiss AJ, Lackman RD: Low-dose chemotherapy of desmoid tumors. Cancer 64 (6): 1192-4, 1989. [PUBMED Abstract]
- Klein WA, Miller HH, Anderson M, et al.: The use of indomethacin, sulindac, and tamoxifen for the treatment of desmoid tumors associated with familial polyposis. Cancer 60 (12): 2863-8, 1987. [PUBMED Abstract]
- Soto-Miranda MA, Sandoval JA, Rao B, et al.: Surgical treatment of pediatric desmoid tumors. A 12-year, single-center experience. Ann Surg Oncol 20 (11): 3384-90, 2013. [PUBMED Abstract]
- Desmoid Tumor Working Group: The management of desmoid tumours: A joint global consensus-based guideline approach for adult and paediatric patients. Eur J Cancer 127: 96-107, 2020. [PUBMED Abstract]
- Penel N, Le Cesne A, Bonvalot S, et al.: Surgical versus non-surgical approach in primary desmoid-type fibromatosis patients: A nationwide prospective cohort from the French Sarcoma Group. Eur J Cancer 83: 125-131, 2017. [PUBMED Abstract]
- Orbach D, Brennan B, Bisogno G, et al.: The EpSSG NRSTS 2005 treatment protocol for desmoid-type fibromatosis in children: an international prospective case series. Lancet Child Adolesc Health 1 (4): 284-292, 2017. [PUBMED Abstract]
- Gladdy RA, Gupta AA: If Active Surveillance is the Standard of Care for Desmoid Patients, When Should Intervention be Considered? Ann Surg Oncol 26 (13): 4185-4187, 2019. [PUBMED Abstract]
- Skapek SX, Ferguson WS, Granowetter L, et al.: Vinblastine and methotrexate for desmoid fibromatosis in children: results of a Pediatric Oncology Group Phase II Trial. J Clin Oncol 25 (5): 501-6, 2007. [PUBMED Abstract]
- Gega M, Yanagi H, Yoshikawa R, et al.: Successful chemotherapeutic modality of doxorubicin plus dacarbazine for the treatment of desmoid tumors in association with familial adenomatous polyposis. J Clin Oncol 24 (1): 102-5, 2006. [PUBMED Abstract]
- Constantinidou A, Jones RL, Scurr M, et al.: Pegylated liposomal doxorubicin, an effective, well-tolerated treatment for refractory aggressive fibromatosis. Eur J Cancer 45 (17): 2930-4, 2009. [PUBMED Abstract]
- Ananth P, Werger A, Voss S, et al.: Liposomal doxorubicin: Effective treatment for pediatric desmoid fibromatosis. Pediatr Blood Cancer 64 (7): , 2017. [PUBMED Abstract]
- Ferrari A, Orbach D, Affinita MC, et al.: Evidence of hydroxyurea activity in children with pretreated desmoid-type fibromatosis: A new option in the armamentarium of systemic therapies. Pediatr Blood Cancer 66 (1): e27472, 2019. [PUBMED Abstract]
- Kornreich L, Orbach D, Nicolas N, et al.: Oral vinorelbine in young patients with desmoid-type fibromatosis. Tumori 109 (5): 511-518, 2023. [PUBMED Abstract]
- Agresta L, Kim H, Turpin BK, et al.: Pazopanib therapy for desmoid tumors in adolescent and young adult patients. Pediatr Blood Cancer 65 (6): e26968, 2018. [PUBMED Abstract]
- Toulmonde M, Pulido M, Ray-Coquard I, et al.: Pazopanib or methotrexate-vinblastine combination chemotherapy in adult patients with progressive desmoid tumours (DESMOPAZ): a non-comparative, randomised, open-label, multicentre, phase 2 study. Lancet Oncol 20 (9): 1263-1272, 2019. [PUBMED Abstract]
- Shang H, Braggio D, Lee YJ, et al.: Targeting the Notch pathway: A potential therapeutic approach for desmoid tumors. Cancer 121 (22): 4088-96, 2015. [PUBMED Abstract]
- Kummar S, O'Sullivan Coyne G, Do KT, et al.: Clinical Activity of the γ-Secretase Inhibitor PF-03084014 in Adults With Desmoid Tumors (Aggressive Fibromatosis). J Clin Oncol 35 (14): 1561-1569, 2017. [PUBMED Abstract]
- Gounder M, Ratan R, Alcindor T, et al.: Nirogacestat, a γ-Secretase Inhibitor for Desmoid Tumors. N Engl J Med 388 (10): 898-912, 2023. [PUBMED Abstract]
- Takahashi T, Prensner JR, Robson CD, et al.: Safety and efficacy of gamma-secretase inhibitor nirogacestat (PF-03084014) in desmoid tumor: Report of four pediatric/young adult cases. Pediatr Blood Cancer 67 (10): e28636, 2020. [PUBMED Abstract]
- Meazza C, Bisogno G, Gronchi A, et al.: Aggressive fibromatosis in children and adolescents: the Italian experience. Cancer 116 (1): 233-40, 2010. [PUBMED Abstract]
- Hansmann A, Adolph C, Vogel T, et al.: High-dose tamoxifen and sulindac as first-line treatment for desmoid tumors. Cancer 100 (3): 612-20, 2004. [PUBMED Abstract]
- Skapek SX, Anderson JR, Hill DA, et al.: Safety and efficacy of high-dose tamoxifen and sulindac for desmoid tumor in children: results of a Children's Oncology Group (COG) phase II study. Pediatr Blood Cancer 60 (7): 1108-12, 2013. [PUBMED Abstract]
- Rutenberg MS, Indelicato DJ, Knapik JA, et al.: External-beam radiotherapy for pediatric and young adult desmoid tumors. Pediatr Blood Cancer 57 (3): 435-42, 2011. [PUBMED Abstract]
- Buckley PG, Mantripragada KK, Benetkiewicz M, et al.: A full-coverage, high-resolution human chromosome 22 genomic microarray for clinical and research applications. Hum Mol Genet 11 (25): 3221-9, 2002. [PUBMED Abstract]
- Valdivielso-Ramos M, Torrelo A, Campos M, et al.: Pediatric dermatofibrosarcoma protuberans in Madrid, Spain: multi-institutional outcomes. Pediatr Dermatol 31 (6): 676-82, 2014 Nov-Dec. [PUBMED Abstract]
- Gooskens SL, Oranje AP, van Adrichem LN, et al.: Imatinib mesylate for children with dermatofibrosarcoma protuberans (DFSP). Pediatr Blood Cancer 55 (2): 369-73, 2010. [PUBMED Abstract]
- Rubio GA, Alvarado A, Gerth DJ, et al.: Incidence and Outcomes of Dermatofibrosarcoma Protuberans in the US Pediatric Population. J Craniofac Surg 28 (1): 182-184, 2017. [PUBMED Abstract]
- Miller SJ, Alam M, Andersen JS, et al.: Dermatofibrosarcoma protuberans. J Natl Compr Canc Netw 10 (3): 312-8, 2012. [PUBMED Abstract]
- Meguerditchian AN, Wang J, Lema B, et al.: Wide excision or Mohs micrographic surgery for the treatment of primary dermatofibrosarcoma protuberans. Am J Clin Oncol 33 (3): 300-3, 2010. [PUBMED Abstract]
- Brennan B, Zanetti I, De Salvo GL, et al.: Dermatofibrosarcoma protuberans in children and adolescents: The European Paediatric Soft Tissue Sarcoma Study Group prospective trial (EpSSG NRSTS 2005). Pediatr Blood Cancer 67 (10): e28351, 2020. [PUBMED Abstract]
- Dagan R, Morris CG, Zlotecki RA, et al.: Radiotherapy in the treatment of dermatofibrosarcoma protuberans. Am J Clin Oncol 28 (6): 537-9, 2005. [PUBMED Abstract]
- Sun LM, Wang CJ, Huang CC, et al.: Dermatofibrosarcoma protuberans: treatment results of 35 cases. Radiother Oncol 57 (2): 175-81, 2000. [PUBMED Abstract]
- Price VE, Fletcher JA, Zielenska M, et al.: Imatinib mesylate: an attractive alternative in young children with large, surgically challenging dermatofibrosarcoma protuberans. Pediatr Blood Cancer 44 (5): 511-5, 2005. [PUBMED Abstract]
- McArthur GA, Demetri GD, van Oosterom A, et al.: Molecular and clinical analysis of locally advanced dermatofibrosarcoma protuberans treated with imatinib: Imatinib Target Exploration Consortium Study B2225. J Clin Oncol 23 (4): 866-73, 2005. [PUBMED Abstract]
- Rutkowski P, Van Glabbeke M, Rankin CJ, et al.: Imatinib mesylate in advanced dermatofibrosarcoma protuberans: pooled analysis of two phase II clinical trials. J Clin Oncol 28 (10): 1772-9, 2010. [PUBMED Abstract]
- Navarrete-Dechent C, Mori S, Barker CA, et al.: Imatinib Treatment for Locally Advanced or Metastatic Dermatofibrosarcoma Protuberans: A Systematic Review. JAMA Dermatol 155 (3): 361-369, 2019. [PUBMED Abstract]
- Kovach SJ, Fischer AC, Katzman PJ, et al.: Inflammatory myofibroblastic tumors. J Surg Oncol 94 (5): 385-91, 2006. [PUBMED Abstract]
- Brodlie M, Barwick SC, Wood KM, et al.: Inflammatory myofibroblastic tumours of the respiratory tract: paediatric case series with varying clinical presentations. J Laryngol Otol 125 (8): 865-8, 2011. [PUBMED Abstract]
- Xiao Y, Zhou S, Ma C, et al.: Radiological and histopathological features of hepatic inflammatory myofibroblastic tumour: analysis of 10 cases. Clin Radiol 68 (11): 1114-20, 2013. [PUBMED Abstract]
- Karnak I, Senocak ME, Ciftci AO, et al.: Inflammatory myofibroblastic tumor in children: diagnosis and treatment. J Pediatr Surg 36 (6): 908-12, 2001. [PUBMED Abstract]
- Collin M, Charles A, Barker A, et al.: Inflammatory myofibroblastic tumour of the bladder in children: a review. J Pediatr Urol 11 (5): 239-45, 2015. [PUBMED Abstract]
- Mariño-Enríquez A, Wang WL, Roy A, et al.: Epithelioid inflammatory myofibroblastic sarcoma: An aggressive intra-abdominal variant of inflammatory myofibroblastic tumor with nuclear membrane or perinuclear ALK. Am J Surg Pathol 35 (1): 135-44, 2011. [PUBMED Abstract]
- Lee JC, Li CF, Huang HY, et al.: ALK oncoproteins in atypical inflammatory myofibroblastic tumours: novel RRBP1-ALK fusions in epithelioid inflammatory myofibroblastic sarcoma. J Pathol 241 (3): 316-323, 2017. [PUBMED Abstract]
- Trahair T, Gifford AJ, Fordham A, et al.: Crizotinib and Surgery for Long-Term Disease Control in Children and Adolescents With ALK-Positive Inflammatory Myofibroblastic Tumors. JCO Precis Oncol 3: , 2019. [PUBMED Abstract]
- Coffin CM, Hornick JL, Fletcher CD: Inflammatory myofibroblastic tumor: comparison of clinicopathologic, histologic, and immunohistochemical features including ALK expression in atypical and aggressive cases. Am J Surg Pathol 31 (4): 509-20, 2007. [PUBMED Abstract]
- Lovly CM, Gupta A, Lipson D, et al.: Inflammatory myofibroblastic tumors harbor multiple potentially actionable kinase fusions. Cancer Discov 4 (8): 889-95, 2014. [PUBMED Abstract]
- Casanova M, Brennan B, Alaggio R, et al.: Inflammatory myofibroblastic tumor: The experience of the European pediatric Soft Tissue Sarcoma Study Group (EpSSG). Eur J Cancer 127: 123-129, 2020. [PUBMED Abstract]
- Yu L, Liu J, Lao IW, et al.: Epithelioid inflammatory myofibroblastic sarcoma: a clinicopathological, immunohistochemical and molecular cytogenetic analysis of five additional cases and review of the literature. Diagn Pathol 11 (1): 67, 2016. [PUBMED Abstract]
- Devaney KO, Lafeir DJ, Triantafyllou A, et al.: Inflammatory myofibroblastic tumors of the head and neck: evaluation of clinicopathologic and prognostic features. Eur Arch Otorhinolaryngol 269 (12): 2461-5, 2012. [PUBMED Abstract]
- Mehta B, Mascarenhas L, Zhou S, et al.: Inflammatory myofibroblastic tumors in childhood. Pediatr Hematol Oncol 30 (7): 640-5, 2013. [PUBMED Abstract]
- Kube S, Vokuhl C, Dantonello T, et al.: Inflammatory myofibroblastic tumors-A retrospective analysis of the Cooperative Weichteilsarkom Studiengruppe. Pediatr Blood Cancer 65 (6): e27012, 2018. [PUBMED Abstract]
- Dalton BG, Thomas PG, Sharp NE, et al.: Inflammatory myofibroblastic tumors in children. J Pediatr Surg 51 (4): 541-4, 2016. [PUBMED Abstract]
- Favini F, Resti AG, Collini P, et al.: Inflammatory myofibroblastic tumor of the conjunctiva: response to chemotherapy with low-dose methotrexate and vinorelbine. Pediatr Blood Cancer 54 (3): 483-5, 2010. [PUBMED Abstract]
- Doski JJ, Priebe CJ, Driessnack M, et al.: Corticosteroids in the management of unresected plasma cell granuloma (inflammatory pseudotumor) of the lung. J Pediatr Surg 26 (9): 1064-6, 1991. [PUBMED Abstract]
- Diop B, Konate I, Ka S, et al.: Mesenteric myofibroblastic tumor: NSAID therapy after incomplete resection. J Visc Surg 148 (4): e311-4, 2011. [PUBMED Abstract]
- Mossé YP, Lim MS, Voss SD, et al.: Safety and activity of crizotinib for paediatric patients with refractory solid tumours or anaplastic large-cell lymphoma: a Children's Oncology Group phase 1 consortium study. Lancet Oncol 14 (6): 472-80, 2013. [PUBMED Abstract]
- Gaudichon J, Jeanne-Pasquier C, Deparis M, et al.: Complete and Repeated Response of a Metastatic ALK-rearranged Inflammatory Myofibroblastic Tumor to Crizotinib in a Teenage Girl. J Pediatr Hematol Oncol 38 (4): 308-11, 2016. [PUBMED Abstract]
- Mossé YP, Voss SD, Lim MS, et al.: Targeting ALK With Crizotinib in Pediatric Anaplastic Large Cell Lymphoma and Inflammatory Myofibroblastic Tumor: A Children's Oncology Group Study. J Clin Oncol 35 (28): 3215-3221, 2017. [PUBMED Abstract]
- Butrynski JE, D'Adamo DR, Hornick JL, et al.: Crizotinib in ALK-rearranged inflammatory myofibroblastic tumor. N Engl J Med 363 (18): 1727-33, 2010. [PUBMED Abstract]
- Brivio E, Zwaan CM: ALK inhibition in two emblematic cases of pediatric inflammatory myofibroblastic tumor: Efficacy and side effects. Pediatr Blood Cancer 66 (5): e27645, 2019. [PUBMED Abstract]
- Fischer M, Moreno L, Ziegler DS, et al.: Ceritinib in paediatric patients with anaplastic lymphoma kinase-positive malignancies: an open-label, multicentre, phase 1, dose-escalation and dose-expansion study. Lancet Oncol 22 (12): 1764-1776, 2021. [PUBMED Abstract]
- Nishio M, Murakami H, Horiike A, et al.: Phase I Study of Ceritinib (LDK378) in Japanese Patients with Advanced, Anaplastic Lymphoma Kinase-Rearranged Non-Small-Cell Lung Cancer or Other Tumors. J Thorac Oncol 10 (7): 1058-66, 2015. [PUBMED Abstract]
- Fujiki T, Sakai Y, Ikawa Y, et al.: Pediatric inflammatory myofibroblastic tumor of the bladder with ALK-FN1 fusion successfully treated by alectinib. Pediatr Blood Cancer 70 (4): e30172, 2023. [PUBMED Abstract]
- Gounder MM, Agaram NP, Trabucco SE, et al.: Clinical genomic profiling in the management of patients with soft tissue and bone sarcoma. Nat Commun 13 (1): 3406, 2022. [PUBMED Abstract]
- Sulkowski JP, Raval MV, Browne M: Margin status and multimodal therapy in infantile fibrosarcoma. Pediatr Surg Int 29 (8): 771-6, 2013. [PUBMED Abstract]
- Hirschfeld R, Welch JJG, Harrison DJ, et al.: Two cases of humoral hypercalcemia of malignancy complicating infantile fibrosarcoma. Pediatr Blood Cancer 64 (10): , 2017. [PUBMED Abstract]
- Kao YC, Fletcher CDM, Alaggio R, et al.: Recurrent BRAF Gene Fusions in a Subset of Pediatric Spindle Cell Sarcomas: Expanding the Genetic Spectrum of Tumors With Overlapping Features With Infantile Fibrosarcoma. Am J Surg Pathol 42 (1): 28-38, 2018. [PUBMED Abstract]
- Wegert J, Vokuhl C, Collord G, et al.: Recurrent intragenic rearrangements of EGFR and BRAF in soft tissue tumors of infants. Nat Commun 9 (1): 2378, 2018. [PUBMED Abstract]
- Tan SY, Al-Ibraheemi A, Ahrens WA, et al.: ALK rearrangements in infantile fibrosarcoma-like spindle cell tumours of soft tissue and kidney. Histopathology 80 (4): 698-707, 2022. [PUBMED Abstract]
- Motta M, Barresi S, Pizzi S, et al.: RAF1 gene fusions are recurrent driver events in infantile fibrosarcoma-like mesenchymal tumors. J Pathol 263 (2): 166-177, 2024. [PUBMED Abstract]
- Orbach D, Rey A, Cecchetto G, et al.: Infantile fibrosarcoma: management based on the European experience. J Clin Oncol 28 (2): 318-23, 2010. [PUBMED Abstract]
- Orbach D, Brennan B, De Paoli A, et al.: Conservative strategy in infantile fibrosarcoma is possible: The European paediatric Soft tissue sarcoma Study Group experience. Eur J Cancer 57: 1-9, 2016. [PUBMED Abstract]
- Madden NP, Spicer RD, Allibone EB, et al.: Spontaneous regression of neonatal fibrosarcoma. Br J Cancer Suppl 18: S72-5, 1992. [PUBMED Abstract]
- Hawkins DS, Black JO, Orbach D, et al.: Nonrhabdomyosarcoma soft-tissue sarcomas. In: Blaney SM, Helman LJ, Adamson PC, eds.: Pizzo and Poplack's Pediatric Oncology. 8th ed. Wolters Kluwer, 2020, pp 721-46.
- Loh ML, Ahn P, Perez-Atayde AR, et al.: Treatment of infantile fibrosarcoma with chemotherapy and surgery: results from the Dana-Farber Cancer Institute and Children's Hospital, Boston. J Pediatr Hematol Oncol 24 (9): 722-6, 2002. [PUBMED Abstract]
- Akyüz C, Küpeli S, Varan A, et al.: Infantile fibrosarcoma: retrospective analysis of eleven patients. Tumori 97 (2): 166-9, 2011 Mar-Apr. [PUBMED Abstract]
- Gallego S, Pericas N, Barber I, et al.: Infantile fibrosarcoma of the retroperitoneum: a site of unfavorable prognosis? Pediatr Hematol Oncol 28 (5): 451-3, 2011. [PUBMED Abstract]
- Parida L, Fernandez-Pineda I, Uffman JK, et al.: Clinical management of infantile fibrosarcoma: a retrospective single-institution review. Pediatr Surg Int 29 (7): 703-8, 2013. [PUBMED Abstract]
- Mody RJ, Wu YM, Lonigro RJ, et al.: Integrative Clinical Sequencing in the Management of Refractory or Relapsed Cancer in Youth. JAMA 314 (9): 913-25, 2015. [PUBMED Abstract]
- Wong V, Pavlick D, Brennan T, et al.: Evaluation of a Congenital Infantile Fibrosarcoma by Comprehensive Genomic Profiling Reveals an LMNA-NTRK1 Gene Fusion Responsive to Crizotinib. J Natl Cancer Inst 108 (1): , 2016. [PUBMED Abstract]
- Laetsch TW, DuBois SG, Mascarenhas L, et al.: Larotrectinib for paediatric solid tumours harbouring NTRK gene fusions: phase 1 results from a multicentre, open-label, phase 1/2 study. Lancet Oncol 19 (5): 705-714, 2018. [PUBMED Abstract]
- Kummar S, Lassen UN: TRK Inhibition: A New Tumor-Agnostic Treatment Strategy. Target Oncol 13 (5): 545-556, 2018. [PUBMED Abstract]
- Drilon A, Laetsch TW, Kummar S, et al.: Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children. N Engl J Med 378 (8): 731-739, 2018. [PUBMED Abstract]
- DuBois SG, Laetsch TW, Federman N, et al.: The use of neoadjuvant larotrectinib in the management of children with locally advanced TRK fusion sarcomas. Cancer 124 (21): 4241-4247, 2018. [PUBMED Abstract]
- Hong DS, DuBois SG, Kummar S, et al.: Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol 21 (4): 531-540, 2020. [PUBMED Abstract]
- Drilon A, Nagasubramanian R, Blake JF, et al.: A Next-Generation TRK Kinase Inhibitor Overcomes Acquired Resistance to Prior TRK Kinase Inhibition in Patients with TRK Fusion-Positive Solid Tumors. Cancer Discov 7 (9): 963-972, 2017. [PUBMED Abstract]
- Yanagisawa R, Noguchi M, Fujita K, et al.: Preoperative Treatment With Pazopanib in a Case of Chemotherapy-Resistant Infantile Fibrosarcoma. Pediatr Blood Cancer 63 (2): 348-51, 2016. [PUBMED Abstract]
- Evans HL: Low-grade fibromyxoid sarcoma: a clinicopathologic study of 33 cases with long-term follow-up. Am J Surg Pathol 35 (10): 1450-62, 2011. [PUBMED Abstract]
- Scheer M, Vokuhl C, Veit-Friedrich I, et al.: Low-grade fibromyxoid sarcoma: A report of the Cooperative Weichteilsarkom Studiengruppe (CWS). Pediatr Blood Cancer 67 (2): e28009, 2020. [PUBMED Abstract]
- Fletcher CDM, Bridge JA, Hogendoorn P, et al., eds.: WHO Classification of Tumours of Soft Tissue and Bone. 4th ed. IARC Press, 2013.
- Sargar K, Kao SC, Spunt SL, et al.: MRI and CT of Low-Grade Fibromyxoid Sarcoma in Children: A Report From Children's Oncology Group Study ARST0332. AJR Am J Roentgenol 205 (2): 414-20, 2015. [PUBMED Abstract]
- Guillou L, Benhattar J, Gengler C, et al.: Translocation-positive low-grade fibromyxoid sarcoma: clinicopathologic and molecular analysis of a series expanding the morphologic spectrum and suggesting potential relationship to sclerosing epithelioid fibrosarcoma: a study from the French Sarcoma Group. Am J Surg Pathol 31 (9): 1387-402, 2007. [PUBMED Abstract]
- Mohamed M, Fisher C, Thway K: Low-grade fibromyxoid sarcoma: Clinical, morphologic and genetic features. Ann Diagn Pathol 28: 60-67, 2017. [PUBMED Abstract]
- O'Sullivan MJ, Sirgi KE, Dehner LP: Low-grade fibrosarcoma (hyalinizing spindle cell tumor with giant rosettes) with pulmonary metastases at presentation: case report and review of the literature. Int J Surg Pathol 10 (3): 211-6, 2002. [PUBMED Abstract]
- Folpe AL, Lane KL, Paull G, et al.: Low-grade fibromyxoid sarcoma and hyalinizing spindle cell tumor with giant rosettes: a clinicopathologic study of 73 cases supporting their identity and assessing the impact of high-grade areas. Am J Surg Pathol 24 (10): 1353-60, 2000. [PUBMED Abstract]
- Maretty-Nielsen K, Baerentzen S, Keller J, et al.: Low-Grade Fibromyxoid Sarcoma: Incidence, Treatment Strategy of Metastases, and Clinical Significance of the FUS Gene. Sarcoma 2013: 256280, 2013. [PUBMED Abstract]
- Prieto-Granada C, Zhang L, Chen HW, et al.: A genetic dichotomy between pure sclerosing epithelioid fibrosarcoma (SEF) and hybrid SEF/low-grade fibromyxoid sarcoma: a pathologic and molecular study of 18 cases. Genes Chromosomes Cancer 54 (1): 28-38, 2015. [PUBMED Abstract]
- Arbajian E, Puls F, Antonescu CR, et al.: In-depth Genetic Analysis of Sclerosing Epithelioid Fibrosarcoma Reveals Recurrent Genomic Alterations and Potential Treatment Targets. Clin Cancer Res 23 (23): 7426-7434, 2017. [PUBMED Abstract]
- Arbajian E, Puls F, Magnusson L, et al.: Recurrent EWSR1-CREB3L1 gene fusions in sclerosing epithelioid fibrosarcoma. Am J Surg Pathol 38 (6): 801-8, 2014. [PUBMED Abstract]
- Dewaele B, Libbrecht L, Levy G, et al.: A novel EWS-CREB3L3 gene fusion in a mesenteric sclerosing epithelioid fibrosarcoma. Genes Chromosomes Cancer 56 (9): 695-699, 2017. [PUBMED Abstract]
- Porteus C, Gan Q, Gong Y, et al.: Sclerosing epithelioid fibrosarcoma: cytologic characterization with histologic, immunohistologic, molecular, and clinical correlation of 8 cases. J Am Soc Cytopathol 9 (6): 513-519, 2020 Nov - Dec. [PUBMED Abstract]
- Puls F, Agaimy A, Flucke U, et al.: Recurrent Fusions Between YAP1 and KMT2A in Morphologically Distinct Neoplasms Within the Spectrum of Low-grade Fibromyxoid Sarcoma and Sclerosing Epithelioid Fibrosarcoma. Am J Surg Pathol 44 (5): 594-606, 2020. [PUBMED Abstract]
- Warmke LM, Meis JM: Sclerosing Epithelioid Fibrosarcoma: A Distinct Sarcoma With Aggressive Features. Am J Surg Pathol 45 (3): 317-328, 2021. [PUBMED Abstract]
- Chew W, Benson C, Thway K, et al.: Clinical Characteristics and efficacy of chemotherapy in sclerosing epithelioid fibrosarcoma. Med Oncol 35 (11): 138, 2018. [PUBMED Abstract]
Tratamiento de los tumores de músculo esquelético
Hay varios subtipos de tumores de músculo esquelético, entre ellos los siguientes:
Rabdomiosarcoma
Para obtener más información, consultar Tratamiento del rabdomiosarcoma infantil.
Ectomesenquimoma
El ectomesenquimoma es un tumor de músculo esquelético raro que casi siempre ocurre en la niñez. Se trata de un sarcoma de tejido blando bifenotípico con componentes mesenquimatosos y ectodérmicos.
En una revisión retrospectiva de una sola institución se identificaron 7 casos de ectomesenquimoma maligno.[1] Los 7 pacientes eran hombres, con una media de edad de 7,5 meses (intervalo, 0,6–17,0 meses). De los 7 pacientes en esta serie, 5 estaban sanos, sin enfermedad en el momento del informe.
Características histológicas y alteraciones genómicas
En una revisión retrospectiva de una sola institución con 6 pacientes de ectomesenquimoma maligno, se identificó el rabdomiosarcoma como el elemento mesenquimatoso en 5 de los 6 tumores.[2] Los tumores con características morfológicas de rabdomiosarcoma alveolar exhibieron la translocación característica. No se identificaron anomalías moleculares unificadoras.
En una revisión retrospectiva de una sola institución se identificaron 7 casos de ectomesenquimoma maligno.[1] En la mayoría de los pacientes se observaron elementos de rabdomiosarcoma embrionario. Los elementos neuroectodérmicos mixtos se componían de células ganglionares difusas, ganglioneuroma o ganglioneuroblastoma. De los 7 casos, 6 presentaron variantes de HRAS. En todos los casos se mantuvo la trimetilación en la lisina 27 de la histona H3 (H3K27me3), que suele perderse en los tumores malignos de vaina nerviosa de nervio periférico.
Tratamiento del ectomesenquimoma
Las opciones de tratamiento del ectomesenquimoma son las siguientes:
- Cirugía.
- Quimioterapia.
- Radioterapia.
El Cooperative Weichteilsarkom Studiengruppe (CWS) informó sobre 6 pacientes (edades de 0,2 a 13,5 años) registrados en el transcurso de 14 años.[3][Nivel de evidencia C1] Los tumores se localizaron en varios sitios, como las extremidades, el abdomen y la órbita. Los 6 pacientes se trataron con cirugía y quimioterapia dirigida al rabdomiosarcoma. Dos pacientes recibieron radioterapia. Tres pacientes presentaron recidivas tumorales con características de rabdomiosarcoma. Aunque los datos son escasos, parece que el tumor responde a la quimioterapia.[3]
El European Pediatric Soft Tissue Sarcoma Study Group (EpSSG) identificó a 10 pacientes con ectomesenquimoma en una base de datos prospectiva.[4] De los 10 casos, 7 tenían un diagnóstico local inicial de rabdomiosarcoma. Todos los pacientes recibieron quimioterapia de acuerdo con la estrategia para rabdomiosarcomas y 4 pacientes recibieron radioterapia. En total, 6 pacientes estaban vivos en primera remisión, 2 presentaban una segunda remisión y 1 paciente había recibido tratamiento por un segundo cáncer primario. Solo el paciente con un tumor metastásico en el momento del diagnóstico murió por la enfermedad.
Bibliografía
- Huang SC, Alaggio R, Sung YS, et al.: Frequent HRAS Mutations in Malignant Ectomesenchymoma: Overlapping Genetic Abnormalities With Embryonal Rhabdomyosarcoma. Am J Surg Pathol 40 (7): 876-85, 2016. [PUBMED Abstract]
- Griffin BB, Chou PM, George D, et al.: Malignant Ectomesenchymoma: Series Analysis of a Histologically and Genetically Heterogeneous Tumor. Int J Surg Pathol 26 (3): 200-212, 2018. [PUBMED Abstract]
- Dantonello TM, Leuschner I, Vokuhl C, et al.: Malignant ectomesenchymoma in children and adolescents: report from the Cooperative Weichteilsarkom Studiengruppe (CWS). Pediatr Blood Cancer 60 (2): 224-9, 2013. [PUBMED Abstract]
- Milano GM, Orbach D, Casanova M, et al.: Malignant ectomesenchymoma in children: The European pediatric Soft tissue sarcoma Study Group experience. Pediatr Blood Cancer 70 (2): e30116, 2023. [PUBMED Abstract]
Tratamiento de los tumores de músculo liso
Leiomiosarcoma, sin otra indicación
El leiomiosarcoma representa el 2 % de los sarcomas de tejido blando en pacientes menores de 20 años (consultar el Cuadro 1).
Factores de riesgo
De 43 niños con VIH/SIDA que presentaron tumores, 8 tenían un leiomiosarcoma relacionado con el virus de Epstein-Barr.[1] Los sobrevivientes de retinoblastoma hereditario tienen un aumento estadísticamente significativo del riesgo de presentar leiomiosarcoma y el 78 % de estos pacientes reciben el diagnóstico 30 años después del diagnóstico inicial del retinoblastoma, o más tarde.[2]
Tratamiento del leiomiosarcoma
No hay opciones de tratamiento estándar para el leiomiosarcoma en pacientes pediátricos.
La trabectedina se ha estudiado en adultos con leiomiosarcoma. No hay estudios en los que se use trabectedina para tratar el leiomiosarcoma en pacientes pediátricos.
Los resultados de los estudios en adultos son los siguientes:
- En un estudio sin anonimato de trabectedina en adultos con sarcomas recidivantes, la mejor tasa de respuesta general (remisión completa y remisión parcial) se observó en los pacientes con leiomiosarcoma (7,5 %).[3] La tasa de beneficio clínico (que incluye la enfermedad estable) fue del 54 % en pacientes con leiomiosarcoma.
- En otro estudio de adultos, se asignó al azar a pacientes con liposarcoma recidivante y leiomiosarcoma para recibir tratamiento con trabectedina o dacarbazina. Los pacientes tratados con trabectedina tuvieron una reducción del 45 % en la progresión de la enfermedad.[4]
Bibliografía
- Pollock BH, Jenson HB, Leach CT, et al.: Risk factors for pediatric human immunodeficiency virus-related malignancy. JAMA 289 (18): 2393-9, 2003. [PUBMED Abstract]
- Kleinerman RA, Tucker MA, Abramson DH, et al.: Risk of soft tissue sarcomas by individual subtype in survivors of hereditary retinoblastoma. J Natl Cancer Inst 99 (1): 24-31, 2007. [PUBMED Abstract]
- Samuels BL, Chawla S, Patel S, et al.: Clinical outcomes and safety with trabectedin therapy in patients with advanced soft tissue sarcomas following failure of prior chemotherapy: results of a worldwide expanded access program study. Ann Oncol 24 (6): 1703-9, 2013. [PUBMED Abstract]
- Demetri GD, von Mehren M, Jones RL, et al.: Efficacy and Safety of Trabectedin or Dacarbazine for Metastatic Liposarcoma or Leiomyosarcoma After Failure of Conventional Chemotherapy: Results of a Phase III Randomized Multicenter Clinical Trial. J Clin Oncol 34 (8): 786-93, 2016. [PUBMED Abstract]
Tratamiento de los tumores denominados fibrohistiocíticos
Tumor fibrohistiocítico plexiforme
El tumor fibrohistiocítico plexiforme es un tumor raro de grado bajo a intermedio que afecta, con mayor frecuencia, a niños y adultos jóvenes. La mediana de edad en el momento de la presentación oscila entre 8 y 14,5 años; sin embargo, el tumor se describió en pacientes de tan solo 3 meses.[1,2]
Cuadro clínico inicial
Por lo general, el tumor se presenta como una masa indolora en la piel o el tejido subcutáneo y, con mayor frecuencia, afecta las extremidades superiores, como los dedos, la mano o la muñeca.[3-5] El tumor fibrohistiocítico plexiforme es de grado intermedio y casi nunca produce metástasis. Sin embargo, hay escasos informes de diseminación del tumor a los ganglios linfáticos regionales o los pulmones.[1,5,6]
Alteraciones genómicas
No se detectaron anomalías cromosómicas consistentes, pero se notificó una translocación t(4;15)(q21;q15).[7]
Tratamiento del tumor fibrohistiocítico plexiforme
Las opciones de tratamiento del tumor fibrohistiocítico plexiforme son las siguientes:
- Cirugía.
La cirugía es el tratamiento de elección, pero se notificó recidiva local en un 12 % a un 50 % de los casos.[8]
Bibliografía
- Enzinger FM, Zhang RY: Plexiform fibrohistiocytic tumor presenting in children and young adults. An analysis of 65 cases. Am J Surg Pathol 12 (11): 818-26, 1988. [PUBMED Abstract]
- Black J, Coffin CM, Dehner LP: Fibrohistiocytic tumors and related neoplasms in children and adolescents. Pediatr Dev Pathol 15 (1 Suppl): 181-210, 2012. [PUBMED Abstract]
- Moosavi C, Jha P, Fanburg-Smith JC: An update on plexiform fibrohistiocytic tumor and addition of 66 new cases from the Armed Forces Institute of Pathology, in honor of Franz M. Enzinger, MD. Ann Diagn Pathol 11 (5): 313-9, 2007. [PUBMED Abstract]
- Billings SD, Folpe AL: Cutaneous and subcutaneous fibrohistiocytic tumors of intermediate malignancy: an update. Am J Dermatopathol 26 (2): 141-55, 2004. [PUBMED Abstract]
- Remstein ED, Arndt CA, Nascimento AG: Plexiform fibrohistiocytic tumor: clinicopathologic analysis of 22 cases. Am J Surg Pathol 23 (6): 662-70, 1999. [PUBMED Abstract]
- Salomao DR, Nascimento AG: Plexiform fibrohistiocytic tumor with systemic metastases: a case report. Am J Surg Pathol 21 (4): 469-76, 1997. [PUBMED Abstract]
- Redlich GC, Montgomery KD, Allgood GA, et al.: Plexiform fibrohistiocytic tumor with a clonal cytogenetic anomaly. Cancer Genet Cytogenet 108 (2): 141-3, 1999. [PUBMED Abstract]
- Luzar B, Calonje E: Cutaneous fibrohistiocytic tumours - an update. Histopathology 56 (1): 148-65, 2010. [PUBMED Abstract]
Tratamiento de los tumores de vaina de nervio periférico
Hay varios subtipos de tumores de vaina de nervio periférico, como los siguientes:
Tumor maligno de vaina de nervio periférico, sin otra indicación
Los tumores malignos de vaina de nervio periférico representan el 5 % de los sarcomas de tejido blando en pacientes menores de 20 años (consultar el Cuadro 1).
Factores de riesgo
El tumor maligno de vaina de nervio periférico en ocasiones aparece de manera esporádica en niños con neurofibromatosis de tipo 1 (NF1).[1] Entre los pacientes con NF1, los antecedentes familiares de tumor maligno de vaina de nervio periférico se relacionan con un aumento del riesgo de presentar tumor maligno de vaina de nervio periférico de inicio temprano.[2]
Se notificó un caso raro de un niño con neurofibromatosis de tipo 2 (NF2) confirmada y 1 neurofibroma benigno que presentó 5 recidivas. Durante ese periodo, las lesiones progresivamente perdieron marcadores (como S-100) y adquirieron signos definitivos de transformación a un tumor maligno de vaina de nervio periférico, documentado por múltiples marcadores, incluso el primer ejemplo de NOTCH2 en esta enfermedad.[3]
Características histológicas, evaluación diagnóstica y alteraciones genómicas
La patogénesis molecular de los tumores malignos de vaina de nervio periférico en adultos manifiesta variantes inactivadoras de al menos 3 vías, como en la de NF1, CDKN2A, CDKN2B, y en componentes centrales del complejo PRC2. Se notificaron alteraciones similares en tumores pediátricos.[4]
- Se han descrito variantes inactivadoras de SUZ12 en estos tumores y están ausentes en los neurofibromas.[5]
- Se usó una matriz de metilación de DNA para una caracterización del perfil cromosómico basado en el metiloma de 171 tumores de vaina de nervio periférico.[6] No fue posible distinguir los neurofibromas atípicos y los tumores malignos de vaina de nervio periférico de grado bajo, con un perfil de metilación común y pérdida de CDKN2A. En el análisis epigenómico se identificaron 2 grupos de tumores malignos de vaina de nervio periférico de grado alto convencionales que compartían la pérdida frecuente de neurofibromina. El grupo más grande presentaba una pérdida adicional de la trimetilación de H3K27me3. El grupo más pequeño de pacientes con sitios primarios en su mayoría raquídeos presentó retención de H3K27me3.
- Se realizó el perfil genómico en 201 tumores malignos de vaina de nervio periférico.[7] Se observaron alteraciones de BRAF en 13 de los 201 tumores.
En el Memorial Sloan Kettering Cancer Center se estudió la documentación de archivo y consulta de 64 pacientes pediátricos y adultos jóvenes (20 años o menos).[4] El 58 % de los pacientes tenían antecedentes de NF1. Todos menos 1 presentaban tumores malignos de vaina de nervio periférico de grado alto. En total, el 89 % de los pacientes se clasificaron como portadores de tumores malignos de vaina de nervio periférico de grado alto y el 94 % de los pacientes presentaban características histológicas convencionales. Había 16 tumores de grado alto disponibles para la caracterización molecular mediante el ensayo MSK-IMPACT. Estos tumores de niños y adolescentes presentaban eventos iniciadores genómicos similares a los de los tumores en adultos. En el estudio se encontraron alteraciones genómicas en componentes de PRC2 (SUZ12 o EED; 9 casos), variantes de NF1 (8 casos), así como deleciones de CDKN2A y CDKN2B (8 casos). La pérdida de la expresión de HDK27me3 se observó en el 82 % de los tumores malignos de vaina de nervio periférico de grado alto convencionales. Este hallazgo es un marcador diagnóstico inmunohistoquímico potencialmente importante para los tumores malignos de vaina de nervio periférico pediátricos.
Factores pronósticos y pronóstico
Los factores relacionados con un pronóstico favorable son los siguientes:[1,8-10]
- Tamaño más pequeño del tumor. En un análisis multivariante, se encontró que solo el tamaño del tumor y la expresión nuclear de p53 fueron factores de predicción independientes de la supervivencia específica de la enfermedad.[9]
- Sexo masculino.[11]
- Raza blanca que no es hispana.[11]
- Estadio más bajo.
- Grado histológico más bajo.
- Extremidad como sitio primario.
Los factores relacionados con un pronóstico desfavorable son los siguientes:[12]
- Grado alto.
- Localización profunda del tumor.
- Estadio localmente avanzado en el momento del diagnóstico.
- Presencia de metástasis en el momento del diagnóstico. En una revisión retrospectiva de 140 pacientes con tumor maligno de vaina de nervio periférico del MD Anderson Cancer Center, se incluyó a niños y adolescentes. La supervivencia específica de la enfermedad a 10 años fue del 32 %. En esta serie, la presencia de enfermedad metastásica se relacionó con un pronóstico mucho más precario.[9]
- Resección macroscópica incompleta (R2).
- Inactivación de p53, ya sea por una variante o amplificación de MDM2.[13]
- Expresión alta de p53 y ciclina D1. Estos marcadores se identificaron como factores de pronóstico adverso mediante la tinción inmunohistoquímica del tejido de la biopsia diagnóstica.[14][Nivel de evidencia C2]
La presencia de NF1 parece estar relacionada con un pronóstico desfavorable, pero los datos son contradictorios.[4,15]
En los pacientes con enfermedad localizada del estudio del MD Anderson Cancer Center, no se observó una diferencia significativa en el desenlace entre los pacientes con NF1 y aquellos sin NF1.[9] En otros estudios, no se definió bien si la ausencia de NF1 es un factor de pronóstico favorable puesto que se ha relacionado con desenlaces favorables [8] y desfavorables.[1,8,10]
En el estudio del French Sarcoma Group, se relacionó la NF1 con otras características de pronóstico precario, pero no fue un factor de predicción independiente de un desenlace precario.[12] En un análisis retrospectivo de los datos del registro de cáncer de los Países Bajos, se identificaron 784 pacientes con tumor maligno de vaina de nervio periférico; 70 de los pacientes tenían 18 años o menos.[16][Nivel de evidencia C1] En los niños con NF1, el tamaño tumoral grande fue más común (>5 cm, 92,3 vs. 59,1 %). En general, la tasa estimada de supervivencia a 5 años fue del 52,4 % (error estándar [EE], 10,1 %) en los pacientes con tumor maligno de vaina de nervio periférico que presentaban NF1, en comparación con el 75,8 % (EE, 7,1 %) en los pacientes sin NF1.
El Cooperative Weichteilsarkom Studiengruppe (CWS) notificó una revisión retrospectiva de pacientes con tumor maligno de vaina de nervio periférico tratados en 5 ensayos consecutivos del CWS.[17] Se analizó a un total de 159 pacientes. Se notificó NF1 en 38 pacientes (24 %). En el momento del diagnóstico, se documentó compromiso ganglionar en 15 pacientes (9 %) y se observaron metástasis a distancia en 15 pacientes (9 %). En general, la tasa de supervivencia sin complicaciones (SSC) fue del 40,5 % a los 5 años y del 36,3 % a los 10 años. La tasa de supervivencia general (SG) fue del 54,6% a los 5 años y del 47,1% a los 10 años. En el análisis univariante, los factores de pronóstico adverso de la SSC o la SG fueron la edad más avanzada, el estado de positividad para NF1, el sitio del tumor primario diferente a una extremidad, el tamaño tumoral más grande, el grupo Intergroup Rhabdomyosarcoma Study (IRS) más alto, la presencia de enfermedad metastásica y el fracaso en lograr la primera remisión completa.
Tratamiento del tumor maligno de vaina de nervio periférico
Las opciones de tratamiento del tumor maligno de vaina de nervio periférico son las siguientes:
- Cirugía antes de la radioterapia o después de esta.[18,19]
- Quimioterapia, para tumores irresecables.
Cirugía antes de la radioterapia o después de esta
La resección quirúrgica completa del tumor, cuando es posible, es el tratamiento de elección.
La función de la radioterapia es difícil de evaluar, pero no se puede asegurar un control local duradero de un residuo tumoral microscópico posoperatorio identificado después de la radioterapia.
Quimioterapia
La quimioterapia ha producido respuestas objetivas en niños con tumor maligno de vaina de nervio periférico.
Evidencia (quimioterapia):
- En un análisis retrospectivo numeroso sobre la experiencia con este tumor en Alemania e Italia, se notificaron los siguientes resultados:[1]
- El 65 % por ciento de los tumores medibles presentaron respuestas objetivas a los regímenes de quimioterapia con ifosfamida.
- En el análisis no se demostró de manera concluyente una mejora de la supervivencia con quimioterapia.
- En este análisis retrospectivo, también se observó una tendencia a la mejora del desenlace con radioterapia posoperatoria.
- En una serie de 37 pacientes jóvenes con tumor maligno de vaina de nervio periférico y NF1, se observó que la mayoría de los pacientes tenían tumores invasivos grandes que no respondían bien a la quimioterapia.[20]
- La tasa de supervivencia sin progresión (SSP) fue del 19 % y la tasa de SG a 5 años fue del 28 %.
- El European Pediatric Soft Tissue Sarcoma Study Group (EpSSG) realizó un estudio prospectivo en pacientes de 21 años o menos con tumor maligno de vaina de nervio periférico.[21] La resección quirúrgica de los tumores primarios se clasificó como R0, si la resección se completó con márgenes microscópicos negativos; R1, si los márgenes fueron positivos al microscopio; y R2, si después de la resección quedó tumor macroscópico residual. Los pacientes se asignaron sin aleatorización a uno de los siguientes 4 grupos de riesgo:
- Cohorte 1: pacientes que tenían tumores con resección completa (R0) sometidos a cirugía sola (n = 13); la tasa de SSC a 5 años fue del 92 %.
- Cohorte 2: pacientes que tenían tumores con resección incompleta (R1 o R2) que recibieron radioterapia adyuvante (n = 4); la tasa de SSC a 5 años fue del 33 %.
- Cohorte 3: pacientes que tenían tumores con resección incompleta (R1 o R2) que recibieron quimioterapia adyuvante (n = 7); la tasa de SSC a 5 años fue del 29 %.
- Cohorte 4: pacientes que recibieron quimioterapia antes de la resección quirúrgica o que exhibían compromiso ganglionar (n = 27); la tasa de SSC a 5 años fue del 52 %.
Para los pacientes que recibieron quimioterapia, el tratamiento incluyó 4 cursos de ifosfamida con doxorrubicina y 2 cursos de ifosfamida simultáneos con radioterapia (50,4–54 Gy).
- La tasa de respuesta a la quimioterapia (respuesta parcial y respuesta completa) en los pacientes con enfermedad cuantificable fue del 46 %.
- La presencia de NF1 (51 % de los pacientes) fue un factor independiente de pronóstico precario para la SG y la SSC.
- En un estudio de niños y adultos con tumores malignos de vaina de nervio periférico esporádicos (n = 14) o vinculados con NF1 que no habían recibido quimioterapia (n = 34), se trató a los pacientes con 2 ciclos de ifosfamida y doxorrubicina además de 2 ciclos de ifosfamida y etopósido.[22]
- Las tasas de respuesta fueron más bajas en los pacientes con tumores relacionados con NF1 que en los pacientes con tumores esporádicos (17,9 vs. 44,4 %). No obstante, debido al cierre prematuro del estudio no se contó con una potencia estadística suficiente para detectar diferencias significativas en las respuestas objetivas entre los 2 grupos.
- Las tasas de enfermedad estable fueron similares en ambos grupos.
Tumor maligno de vaina de nervio periférico recidivante
En un análisis de 120 pacientes inscritos en protocolos pediátricos italianos entre 1979 y 2004, se identificó a 73 pacientes menores de 21 años con tumor maligno de vaina de nervio periférico recidivante. Las opciones de tratamiento incluyeron cirugía, radioterapia y quimioterapia.[23]
- El momento de la recaída desde el diagnóstico inicial varió desde 1 hasta 204 meses, con una mediana de tiempo hasta la recaída de 7 meses.
- La mediana de SG desde la primer recaída fue de 11 meses, con una tasa de SG del 39 % al cabo de 1 año y del 16 % a los 5 años.
- Los factores relacionados con una mayor probabilidad de supervivencia luego de una recaída fueron menor grado de invasión en el cuadro clínico inicial, mayor tiempo transcurrido hasta la recaída y resección quirúrgica completa del tumor en la recaída.
En un estudio retrospectivo se evaluaron 9 pacientes con tumor maligno de vaina de nervio periférico irresecable o metastásico (7 pacientes tratados antes) tratados con selinexor con doxorrubicina o sin esta. De los pacientes, 3 exhibieron una respuesta parcial que duró de 3 a más de 8 meses, y 4 pacientes presentaron enfermedad estable.[24]
Opciones de tratamiento en evaluación clínica
La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación, se presenta un ejemplo de un ensayo clínico nacional o institucional en curso:
- NCT04465643 (Neoadjuvant Nivolumab Plus Ipilimumab for Newly Diagnosed Malignant Peripheral Nerve Sheath Tumor): el objetivo de este estudio es evaluar la inocuidad y la viabilidad del nivolumab neoadyuvante con ipilimumab antes del tratamiento estándar (cirugía, quimioterapia o radioterapia) en pacientes con NF1 que reciben un diagnóstico nuevo de tumores malignos o premalignos de vaina de nervio periférico, en quienes se indica la cirugía de resección del tumor.
Tumor tritón maligno
En la actualidad, los tumores tritón malignos se clasifican como una variante de los tumores malignos de vaina de nervio periférico. Se presentan con mayor frecuencia en pacientes con NF1 y constan de componentes neurogénicos y rabdomioblásticos.[25]
Bibliografía
- Carli M, Ferrari A, Mattke A, et al.: Pediatric malignant peripheral nerve sheath tumor: the Italian and German soft tissue sarcoma cooperative group. J Clin Oncol 23 (33): 8422-30, 2005. [PUBMED Abstract]
- Malbari F, Spira M, B Knight P, et al.: Malignant Peripheral Nerve Sheath Tumors in Neurofibromatosis: Impact of Family History. J Pediatr Hematol Oncol 40 (6): e359-e363, 2018. [PUBMED Abstract]
- Agresta L, Salloum R, Hummel TR, et al.: Malignant peripheral nerve sheath tumor: Transformation in a patient with neurofibromatosis type 2. Pediatr Blood Cancer 66 (2): e27520, 2019. [PUBMED Abstract]
- Agaram NP, Wexler LH, Chi P, et al.: Malignant peripheral nerve sheath tumor in children: A clinicopathologic and molecular study with parallels to the adult counterpart. Genes Chromosomes Cancer 62 (3): 131-138, 2023. [PUBMED Abstract]
- Zhang M, Wang Y, Jones S, et al.: Somatic mutations of SUZ12 in malignant peripheral nerve sheath tumors. Nat Genet 46 (11): 1170-2, 2014. [PUBMED Abstract]
- Röhrich M, Koelsche C, Schrimpf D, et al.: Methylation-based classification of benign and malignant peripheral nerve sheath tumors. Acta Neuropathol 131 (6): 877-87, 2016. [PUBMED Abstract]
- Kaplan HG, Rostad S, Ross JS, et al.: Genomic Profiling in Patients With Malignant Peripheral Nerve Sheath Tumors Reveals Multiple Pathways With Targetable Mutations. J Natl Compr Canc Netw 16 (8): 967-974, 2018. [PUBMED Abstract]
- Hagel C, Zils U, Peiper M, et al.: Histopathology and clinical outcome of NF1-associated vs. sporadic malignant peripheral nerve sheath tumors. J Neurooncol 82 (2): 187-92, 2007. [PUBMED Abstract]
- Zou C, Smith KD, Liu J, et al.: Clinical, pathological, and molecular variables predictive of malignant peripheral nerve sheath tumor outcome. Ann Surg 249 (6): 1014-22, 2009. [PUBMED Abstract]
- Okada K, Hasegawa T, Tajino T, et al.: Clinical relevance of pathological grades of malignant peripheral nerve sheath tumor: a multi-institution TMTS study of 56 cases in Northern Japan. Ann Surg Oncol 14 (2): 597-604, 2007. [PUBMED Abstract]
- Amirian ES, Goodman JC, New P, et al.: Pediatric and adult malignant peripheral nerve sheath tumors: an analysis of data from the surveillance, epidemiology, and end results program. J Neurooncol 116 (3): 609-16, 2014. [PUBMED Abstract]
- Valentin T, Le Cesne A, Ray-Coquard I, et al.: Management and prognosis of malignant peripheral nerve sheath tumors: The experience of the French Sarcoma Group (GSF-GETO). Eur J Cancer 56: 77-84, 2016. [PUBMED Abstract]
- Høland M, Kolberg M, Danielsen SA, et al.: Inferior survival for patients with malignant peripheral nerve sheath tumors defined by aberrant TP53. Mod Pathol 31 (11): 1694-1707, 2018. [PUBMED Abstract]
- Krawczyk MA, Karpinsky G, Izycka-Swieszewska E, et al.: Immunohistochemical assessment of cyclin D1 and p53 is associated with survival in childhood malignant peripheral nerve sheath tumor. Cancer Biomark 24 (3): 351-361, 2019. [PUBMED Abstract]
- Akshintala S, Mallory NC, Lu Y, et al.: Outcome of Patients With Malignant Peripheral Nerve Sheath Tumors Enrolled on Sarcoma Alliance for Research Through Collaboration (SARC) Phase II Trials. Oncologist 28 (5): 453-459, 2023. [PUBMED Abstract]
- Martin E, Coert JH, Flucke UE, et al.: Neurofibromatosis-associated malignant peripheral nerve sheath tumors in children have a worse prognosis: A nationwide cohort study. Pediatr Blood Cancer 67 (4): e28138, 2020. [PUBMED Abstract]
- Meister MT, Scheer M, Hallmen E, et al.: Malignant peripheral nerve sheath tumors in children, adolescents, and young adults: Treatment results of five Cooperative Weichteilsarkom Studiengruppe (CWS) trials and one registry. J Surg Oncol 122 (7): 1337-1347, 2020. [PUBMED Abstract]
- Bahig H, Roberge D, Bosch W, et al.: Agreement among RTOG sarcoma radiation oncologists in contouring suspicious peritumoral edema for preoperative radiation therapy of soft tissue sarcoma of the extremity. Int J Radiat Oncol Biol Phys 86 (2): 298-303, 2013. [PUBMED Abstract]
- Baldini EH, Wang D, Haas RL, et al.: Treatment Guidelines for Preoperative Radiation Therapy for Retroperitoneal Sarcoma: Preliminary Consensus of an International Expert Panel. Int J Radiat Oncol Biol Phys 92 (3): 602-12, 2015. [PUBMED Abstract]
- Ferrari A, Bisogno G, Macaluso A, et al.: Soft-tissue sarcomas in children and adolescents with neurofibromatosis type 1. Cancer 109 (7): 1406-12, 2007. [PUBMED Abstract]
- van Noesel MM, Orbach D, Brennan B, et al.: Outcome and prognostic factors in pediatric malignant peripheral nerve sheath tumors: An analysis of the European Pediatric Soft Tissue Sarcoma Group (EpSSG) NRSTS-2005 prospective study. Pediatr Blood Cancer 66 (10): e27833, 2019. [PUBMED Abstract]
- Higham CS, Steinberg SM, Dombi E, et al.: SARC006: Phase II Trial of Chemotherapy in Sporadic and Neurofibromatosis Type 1 Associated Chemotherapy-Naive Malignant Peripheral Nerve Sheath Tumors. Sarcoma 2017: 8685638, 2017. [PUBMED Abstract]
- Bergamaschi L, Bisogno G, Manzitti C, et al.: Salvage rates and prognostic factors after relapse in children and adolescents with malignant peripheral nerve sheath tumors. Pediatr Blood Cancer 65 (2): , 2018. [PUBMED Abstract]
- Al-Ezzi E, Gounder M, Watson G, et al.: Selinexor, a First in Class, Nuclear Export Inhibitor for the Treatment of Advanced Malignant Peripheral Nerve Sheath Tumor. Oncologist 26 (4): e710-e714, 2021. [PUBMED Abstract]
- WHO Classification of Tumours Editorial Board: WHO Classification of Tumours. Volume 3: Soft Tissue and Bone Tumours. 5th ed., IARC Press, 2020.
Tratamiento de los tumores pericíticos (perivasculares)
Hay varios subtipos de tumores pericíticos (perivasculares), entre ellos los siguientes:
Miopericitoma
El hemangiopericitoma infantil, un subtipo de miopericitoma, es un tumor muy vascularizado de origen incierto.
Entre los niños con hemangiopericitomas, los menores de 1 año tienen un pronóstico más favorable que los mayores de 1 año.[1-3]
Características histológicas
En el análisis histológico, los hemangiopericitomas contienen células redondas o fusiformes empaquetadas alrededor de una vasculatura compleja con muchas ramificaciones. Con frecuencia hay hialinización. Los hemangiopericitomas infantiles tienen características histológicas similares, pero muchos son multilobulares con vasculatura por fuera de la masa tumoral.[4]
Tratamiento y desenlace del hemangiopericitoma infantil
Las opciones de tratamiento del hemangiopericitoma infantil son las siguientes:
- Quimioterapia.
Evidencia (quimioterapia):
- En una serie de 17 niños, se demostraron con claridad las diferencias entre el potencial metastásico y la reacción al tratamiento del hemangiopericitoma infantil y de adultos. Once niños eran mayores de 1 año. Varios de estos pacientes tenían enfermedad en los ganglios linfáticos o los pulmones.[5]
- Sobrevivieron 3 pacientes con enfermedad en estadio I, aunque uno de ellos presentó recidiva pulmonar.
- De los pacientes, 8 tenían enfermedad en estadio II o estadio III; 2 de estos pacientes sobrevivieron y 6 presentaron progresión de la enfermedad y fallecieron.
- Entre los pacientes, 6 tenían hemangiopericitoma infantil, 5 de ellos en estadio superior al I. Los 6 pacientes sobrevivieron y 3 de ellos presentaron una respuesta favorable a vincristina, actinomicina y ciclofosfamida.
En varios estudios se notificaron sarcomas de tejido blando en niños más parecidos a la miofibromatosis infantil o el hemangiopericitoma.[6,7] En lugar de la proteína de fusión ETV6::NTRK3 observada en el fibrosarcoma infantil congénito, se identificó una proteína de fusión LMNA::NTRK1.[8] Un paciente portador de esta fusión respondió al crizotinib. Para obtener más información sobre la miofibromatosis infantil, consultar la sección Miofibromatosis infantil.
Miofibromatosis infantil
La miofibromatosis infantil es un tumor fibroso de la lactancia y la niñez que aparece con más frecuencia en los primeros 2 años de vida.[9]
La lesión se puede presentar como un solo nódulo subcutáneo (miofibroma) que compromete con mayor frecuencia la región de la cabeza y el cuello, o las lesiones pueden afectar múltiples áreas de la piel, los músculos y los huesos (miofibromatosis).[10-13]
Alteraciones genómicas y pruebas genéticas
Se han identificado variantes somáticas de ganancia de función en PDGFRB en casos esporádicos de miofibromatosis infantil, entre ellas, variantes puntuales activadoras, indels en el marco de lectura y duplicaciones.[14,15] Se han observado variantes de PDGFRB en la mayoría de los casos de nódulos multicéntricos, pero son menos comunes en los casos de miofibroma solitario.[15,16] Algunas variantes de PDGFRB que causan miofibromatosis infantil son sensibles a inhibidores de tirosina–cinasas como el imatinib.[15,16]
Se ha descrito una forma autosómica dominante hereditaria de la miofibromatosis infantil. Se asocia con variantes germinales del gen PDGFRB, la variante R561C es la más frecuente.[17-19] La variante R561C produce una activación relativamente débil de PDGFRB, lo que quizás explique la presencia de otras variantes de PDGFRB que exhiben más actividad en algunos casos de miofibromatosis infantil familiar.[16,17]
El Host Genome Working Group de la European Society for Paediatric Oncology formuló pautas de asesoramiento y pruebas germinales para estos grupos de pacientes. Este grupo recomienda el análisis de la línea germinal en los niños con miofibromatosis infantil que cumplen, por lo menos, uno de los siguientes criterios:[20]
- Enfermedad multicéntrica.
- Miofibromatosis infantil en familiares de primer y segundo grado o que presentan nódulos de tejidos blandos durante la niñez.
- Presencia de una variante germinal de PDGFR en la familia.
- Sospecha de variantes germinales en mosaico de PDGFRB.
Tratamiento y desenlace de la miofibromatosis infantil
Los pacientes con estos tumores por lo general tienen un pronóstico excelente y puede que los tumores remitan de manera espontánea. Sin embargo, cerca de un tercio de los casos con compromiso multicéntrico también tendrán compromiso visceral, y el pronóstico para estos pacientes es precario.[12,13,21]
Las opciones de tratamiento de la miofibromatosis infantil son las siguientes:
- Observación.
- Quimioterapia.
- Inhibidores de tirosina–cinasas eficaces contra PDGFRB.
Entre 1981 y 2016, se inscribieron de manera prospectiva 95 pacientes en 5 ensayos del Cooperative Weichteilsarkom Studiengruppe (CWS) y en un ensayo de registro.[22] Se diagnosticó enfermedad localizada en 71 pacientes. Entre ellos, 42 (59 %) eran lactantes menores de 12 meses. El tratamiento principal (aplicado a 55 niños) fue la conducta expectante después de la biopsia o la resección inicial. La terapia sistémica solo se recomendó en casos de enfermedad progresiva potencialmente mortal o en casos de compresión de estructuras vitales o disfunción orgánica en el entorno de enfermedad progresiva. Teniendo en cuenta esto, se administró quimioterapia a 16 de 71 pacientes como una decisión individual del centro de tratamiento: De los pacientes, 8 recibieron metotrexato y vinblastina, 5 recibieron vincristina, dactinomicina y ciclofosfamida (VAC) y 3 recibieron otros tratamientos.
- Se evaluó la respuesta de 9 pacientes que habían recibido quimioterapia. Entre estos pacientes, 2 presentaron remisión completa (RC) o remisión parcial (RP) (tasa de respuesta objetiva, 22 %).
- En total, 77 pacientes estaban vivos en RC y 10 pacientes en RP. Otros 3 pacientes murieron por enfermedad progresiva.
- La tasa de supervivencia sin complicaciones (SSC) a 5 años fue del 73 % en los pacientes con enfermedad localizada y del 51 % en los pacientes con enfermedad multifocal.
- La tasa de supervivencia general (SG) a 5 años fue del 95 % en los pacientes con enfermedad localizada o multifocal.
La administración de quimioterapia combinada de vincristina con dactinomicina y vinblastina con metotrexato probó ser eficaz en casos de enfermedad multicéntrica con compromiso visceral y en casos potencialmente mortales por progresión de la enfermedad (por ejemplo, obstrucción de las vías respiratorias superiores).[12,13,23]
En informes de casos, se notificó una regresión tumoral rápida en pacientes con miofibromatosis infantil que exhiben variantes de PDGFRB cuando se tratan con inhibidores de tirosina–cinasas como imatinib y sunitinib, que inhiben la ganancia de función del gen PDGFRB con la variante en el tumor.[24-27]
Bibliografía
- Rodriguez-Galindo C, Ramsey K, Jenkins JJ, et al.: Hemangiopericytoma in children and infants. Cancer 88 (1): 198-204, 2000. [PUBMED Abstract]
- Ferrari A, Casanova M, Bisogno G, et al.: Hemangiopericytoma in pediatric ages: a report from the Italian and German Soft Tissue Sarcoma Cooperative Group. Cancer 92 (10): 2692-8, 2001. [PUBMED Abstract]
- Bien E, Stachowicz-Stencel T, Godzinski J, et al.: Retrospective multi-institutional study on hemangiopericytoma in Polish children. Pediatr Int 51 (1): 19-24, 2009. [PUBMED Abstract]
- Weiss SW, Goldblum JR: Enzinger and Weiss's Soft Tissue Tumors. 5th ed. Mosby, 2008.
- Fernandez-Pineda I, Parida L, Jenkins JJ, et al.: Childhood hemangiopericytoma: review of St Jude Children's Research Hospital. J Pediatr Hematol Oncol 33 (5): 356-9, 2011. [PUBMED Abstract]
- Haller F, Knopf J, Ackermann A, et al.: Paediatric and adult soft tissue sarcomas with NTRK1 gene fusions: a subset of spindle cell sarcomas unified by a prominent myopericytic/haemangiopericytic pattern. J Pathol 238 (5): 700-10, 2016. [PUBMED Abstract]
- Wong V, Pavlick D, Brennan T, et al.: Evaluation of a Congenital Infantile Fibrosarcoma by Comprehensive Genomic Profiling Reveals an LMNA-NTRK1 Gene Fusion Responsive to Crizotinib. J Natl Cancer Inst 108 (1): , 2016. [PUBMED Abstract]
- Doebele RC, Davis LE, Vaishnavi A, et al.: An Oncogenic NTRK Fusion in a Patient with Soft-Tissue Sarcoma with Response to the Tropomyosin-Related Kinase Inhibitor LOXO-101. Cancer Discov 5 (10): 1049-57, 2015. [PUBMED Abstract]
- Wiswell TE, Davis J, Cunningham BE, et al.: Infantile myofibromatosis: the most common fibrous tumor of infancy. J Pediatr Surg 23 (4): 315-8, 1988. [PUBMED Abstract]
- Chung EB, Enzinger FM: Infantile myofibromatosis. Cancer 48 (8): 1807-18, 1981. [PUBMED Abstract]
- Modi N: Congenital generalised fibromatosis. Arch Dis Child 57 (11): 881-2, 1982. [PUBMED Abstract]
- Levine E, Fréneaux P, Schleiermacher G, et al.: Risk-adapted therapy for infantile myofibromatosis in children. Pediatr Blood Cancer 59 (1): 115-20, 2012. [PUBMED Abstract]
- Larralde M, Hoffner MV, Boggio P, et al.: Infantile myofibromatosis: report of nine patients. Pediatr Dermatol 27 (1): 29-33, 2010 Jan-Feb. [PUBMED Abstract]
- Agaimy A, Bieg M, Michal M, et al.: Recurrent Somatic PDGFRB Mutations in Sporadic Infantile/Solitary Adult Myofibromas But Not in Angioleiomyomas and Myopericytomas. Am J Surg Pathol 41 (2): 195-203, 2017. [PUBMED Abstract]
- Arts FA, Sciot R, Brichard B, et al.: PDGFRB gain-of-function mutations in sporadic infantile myofibromatosis. Hum Mol Genet 26 (10): 1801-1810, 2017. [PUBMED Abstract]
- Dachy G, de Krijger RR, Fraitag S, et al.: Association of PDGFRB Mutations With Pediatric Myofibroma and Myofibromatosis. JAMA Dermatol 155 (8): 946-950, 2019. [PUBMED Abstract]
- Cheung YH, Gayden T, Campeau PM, et al.: A recurrent PDGFRB mutation causes familial infantile myofibromatosis. Am J Hum Genet 92 (6): 996-1000, 2013. [PUBMED Abstract]
- Martignetti JA, Tian L, Li D, et al.: Mutations in PDGFRB cause autosomal-dominant infantile myofibromatosis. Am J Hum Genet 92 (6): 1001-7, 2013. [PUBMED Abstract]
- Murray N, Hanna B, Graf N, et al.: The spectrum of infantile myofibromatosis includes both non-penetrance and adult recurrence. Eur J Med Genet 60 (7): 353-358, 2017. [PUBMED Abstract]
- Hettmer S, Dachy G, Seitz G, et al.: Genetic testing and surveillance in infantile myofibromatosis: a report from the SIOPE Host Genome Working Group. Fam Cancer 20 (4): 327-336, 2021. [PUBMED Abstract]
- Gopal M, Chahal G, Al-Rifai Z, et al.: Infantile myofibromatosis. Pediatr Surg Int 24 (3): 287-91, 2008. [PUBMED Abstract]
- Sparber-Sauer M, Vokuhl C, Seitz G, et al.: Infantile myofibromatosis: Excellent prognosis but also rare fatal progressive disease. Treatment results of five Cooperative Weichteilsarkom Studiengruppe (CWS) trials and one registry. Pediatr Blood Cancer 69 (3): e29403, 2022. [PUBMED Abstract]
- Weaver MS, Navid F, Huppmann A, et al.: Vincristine and Dactinomycin in Infantile Myofibromatosis With a Review of Treatment Options. J Pediatr Hematol Oncol 37 (3): 237-41, 2015. [PUBMED Abstract]
- Weller JM, Keil VC, Gielen GH, et al.: PDGRFB mutation-associated myofibromatosis: Response to targeted therapy with imatinib. Am J Med Genet A 179 (9): 1895-1897, 2019. [PUBMED Abstract]
- Wenger TL, Bly RA, Wu N, et al.: Activating variants in PDGFRB result in a spectrum of disorders responsive to imatinib monotherapy. Am J Med Genet A 182 (7): 1576-1591, 2020. [PUBMED Abstract]
- Mudry P, Slaby O, Neradil J, et al.: Case report: rapid and durable response to PDGFR targeted therapy in a child with refractory multiple infantile myofibromatosis and a heterozygous germline mutation of the PDGFRB gene. BMC Cancer 17 (1): 119, 2017. [PUBMED Abstract]
- Pond D, Arts FA, Mendelsohn NJ, et al.: A patient with germ-line gain-of-function PDGFRB p.N666H mutation and marked clinical response to imatinib. Genet Med 20 (1): 142-150, 2018. [PUBMED Abstract]
Tratamiento de tumores de diferenciación incierta
Hay muchos subtipos de tumores de diferenciación incierta, entre ellos los siguientes:
- Mixoma, sin otra indicación (benigno).
- Sarcoma sinovial, sin otra indicación (poco diferenciado, de células fusiformes y variedades bifásicas).
- Sarcoma epitelioide.
- Sarcoma alveolar de partes blandas.
- Sarcoma de células claras, sin otra indicación.
- Condrosarcoma mixoide extraesquelético.
- Tumor desmoplásico de células redondas pequeñas.
- Tumor rabdoide, sin otra indicación (extrarrenal).
- Tumor epitelioide perivascular (PEComa), maligno.
- Sarcoma indiferenciado.
- Sarcoma pleomórfico indiferenciado.
- Sarcoma de células redondas indiferenciado.
Mixoma, sin otra indicación
Complejo de Carney
El complejo de Carney es un síndrome autosómico dominante causado por variantes del gen PRKAR1A, localizado en el cromosoma 17.[1] El síndrome se caracteriza por mixomas cardíacos y cutáneos, lentigos de color marrón pálido a marrón, nevos azules, enfermedad adrenocortical nodular pigmentada primaria que causa el síndrome de Cushing y una variedad de tumores endocrinos y no endocrinos, incluso adenomas de hipófisis, tumores tiroideos y tumor testicular de células de Sertoli calcificante de células grandes.[1-3] Se publicaron directrices de vigilancia para pacientes con complejo de Carney que incluyen ecografías cardíacas, testiculares y tiroideas.
Para los pacientes con complejo de Carney, el pronóstico depende de la frecuencia de las recidivas de los mixomas cardíacos y cutáneos, y otros tumores.
Para obtener más información sobre los tratamientos de las afecciones relacionadas con el complejo de Carney, consultar los siguientes resúmenes:
Sarcoma sinovial, sin otra indicación (poco diferenciado, de células fusiformes y variedades bifásicas)
El sarcoma sinovial representa el 9 % de los sarcomas de tejido blando en pacientes menores de 20 años (consultar el Cuadro 1).
El sarcoma sinovial es uno de los sarcomas de tejido blando no rabdomiosarcomatosos más frecuentes en niños y adolescentes. En una revisión de la base de datos del Surveillance, Epidemiology, and End Results (SEER) Program de 1973 a 2005, se identificaron 1268 pacientes con sarcoma sinovial. Alrededor del 17 % de estos pacientes eran niños y adolescentes, y la mediana de edad en el momento del diagnóstico fue de 34 años.[4] Además, en el protocolo ARST0332 (NCT00346164) del Children's Oncology Group (COG) y el protocolo European Pediatric Soft Tissue Sarcoma Study Group (EpSSG) 2005, el sarcoma sinovial fue el subtipo histológico más común.[5]
Cuadro clínico inicial
Las localizaciones más frecuentes son las extremidades, seguidas del tronco, la cabeza y el cuello.[4] Rara vez, el sarcoma sinovial surge en el corazón o el pericardio y presenta manifestaciones pleuropulmonares.[6-9]
El sitio más común de metástasis es el pulmón.[10,11] El riesgo de metástasis está más condicionado por el tamaño del tumor. Los pacientes con tumores de más de 5 cm tienen un riesgo estimado 32 veces más alto de presentar metástasis, en comparación con otros pacientes.
El Cooperative Weichteilsarkom Studiengruppe (CWS) notificó 432 pacientes menores de 21 años con diagnóstico de sarcoma sinovial entre 1981 y 2018.[12]En el estudio, se compararon 3 grupos de edad de pacientes: niños (0–12 años; n = 176), adolescentes (13–16 años; n = 178) y adultos jóvenes (17–21 años; n = 78).
- La proporción de tumores invasivos fue significativamente más alta en los pacientes de más edad (niños, 33 %; adolescentes, 39 % y adultos jóvenes, 54 %; P = 0,009).
- La proporción de tumores de más de 10 cm (niños; 13 %; adolescentes, 21 %; adultos jóvenes, 31 %; P = 0,006) y la presencia de metástasis en el diagnóstico inicial también fueron más elevadas en los pacientes de más edad (niños, 6 %; adolescentes, 10 %; adultos jóvenes, 21 %; P = 0,001).
Características histológicas, evaluación diagnóstica y alteraciones genómicas
El sarcoma sinovial se subclasifica en los siguientes tipos:
- Sarcoma sinovial de células fusiformes.
- Sarcoma sinovial bifásico.
- Sarcoma sinovial poco diferenciado.
El diagnóstico del sarcoma sinovial se hace mediante análisis inmunohistoquímico, hallazgos ultraestructurales y comprobación de una translocación cromosómica específica: t(x;18)(p11.2;q11.2). Esta anomalía es específica del sarcoma sinovial y se encuentra en todos los subtipos morfológicos. El sarcoma sinovial se produce como consecuencia de un reordenamiento del gen SS18 en el cromosoma 18 con uno de los subtipos (1, 2 o 4) del gen SSX en el cromosoma X.[13,14] Se cree que el transcrito de fusión SS18::SSX promueve el silenciamiento epigenético de los principales genes supresores de tumores.[15]
En un informe, se observó una reducción de la reactividad nuclear de SMARCB1 en la tinción inmunohistoquímica en 49 casos de sarcoma sinovial, lo que indica que este patrón puede ayudar a distinguir el sarcoma sinovial de otras tipos histológicos.[16]
Factores pronósticos
Factores pronósticos favorables
Los pacientes menores de 10 años tienen desenlaces y características clínicas más favorables que los pacientes de más edad.
Las características clínicas favorables son las siguientes:[4,17-19]
- Tumores primarios en las extremidades.
- Tumores más pequeños.
- Enfermedad localizada
- La respuesta a la quimioterapia se correlacionó con una mejora de la supervivencia en un metanálisis.
Factores pronósticos desfavorables
En los siguientes estudios se notificaron múltiples factores relacionados con desenlaces precarios:
- En un análisis retrospectivo de sarcoma sinovial en niños y adolescentes tratados en Alemania e Italia, el tamaño del tumor (>5 cm o ≤5 cm en su mayor dimensión) fue un factor pronóstico importante de la supervivencia sin complicaciones [SSC]).[20] En este análisis, el grado de invasión local confirió una menor probabilidad de SSC, pero el desenlace clínico no se relacionó con los márgenes quirúrgicos.
- En un análisis retrospectivo de una sola institución de 111 pacientes con sarcoma sinovial menores de 22 años en el momento del diagnóstico, se encontró que un tamaño tumoral más grande, una mayor profundidad en el tejido, un mayor grado de invasión local y una ubicación más proximal del tumor se relacionaban con una supervivencia general (SG) más precaria.[21][Nivel de evidencia C1]
- En un análisis multicéntrico de 219 niños de diversos centros de tratamiento, incluso de Alemania, el St. Jude Children's Research Hospital (SJCRH), el Instituto Tumori y el MD Anderson Cancer Center, se notificó una tasa estimada de SG a 5 años del 80 % y una tasa de SSC del 72 %.[19] En este análisis, se observó una interacción entre el tamaño del tumor y la capacidad invasiva. En análisis multivariantes, los pacientes con tumores grandes o invasivos, o con enfermedad del del grupo III (localizada, con resección incompleta o de la que solo se obtuvo una biopsia) y grupo IV (metástasis en el momento del diagnóstico) del Intergroup Rhabdomyosarcoma Study presentaron una SG más precaria. El tratamiento con radioterapia se relacionó con mejora de la SG (cocientes de riesgos instantáneos (CRI), 0,4; intervalo de confianza (IC) 95 %, 0,2–0,7). En los pacientes del grupo III del IRS, la respuesta objetiva a la quimioterapia (18 de 30 [60 %]) se correlacionó con una mejora de la supervivencia.
- Se ha estudiado el uso de firmas pronósticas de expresión e índice genómico del sarcoma sinovial. Los perfiles genómicos complejos, con mayor reordenamiento del genoma, son más comunes en adultos que en pacientes más jóvenes con sarcoma sinovial y se relacionan con un riesgo más alto de metástasis.[22]
- En una revisión de 84 pacientes con sarcoma sinovial localizado, donde se contaba con información sobre el estado de la fusión (SS18::SSX) y la clasificación histológica, no se encontró ninguna diferencia en la SG. Sin embargo, en cuanto al tamaño del tumor en el momento del diagnóstico, se halló que los pacientes con tumores de entre 5 cm y 10 cm presentaron un pronóstico más precario que aquellos con tumores más pequeños (P = 0,02). Los pacientes con tumores de más de 10 cm tuvieron una SG aún más precaria (P = 0,0003).[23][Nivel de evidencia C1]
- El grupo alemán CWS analizó a 27 pacientes evaluables menores de 21 años con metástasis pulmonares entre 296 pacientes con sarcoma sinovial. Todos los pacientes tenían metástasis en los pulmones. La tasa de SSC a 5 años fue del 26 % y la tasa de SG fue del 30 %. El factor pronóstico más importante en el momento de la presentación fue que las metástasis se limitaran a una lesión en un solo pulmón o una lesión en ambos pulmones (grupo que llamaron oligometastásico). Los elementos del tratamiento vinculados con una supervivencia superior fueron la terapia local adecuada del tumor primario y, cuando fue posible, de las metástasis. El uso de irradiación dirigida a todo el pulmón no se correlacionó con mejores desenlaces.[24][Nivel de evidencia C1]
- El EpSSG diseñó un índice genómico para el sarcoma sinovial.[25][Nivel de evidencia C2] El índice genómico se definió como A2/C, donde A es el número total de alteraciones (ganancias y pérdidas segmentarias) y C es el número de cromosomas afectados en los resultados de la matriz de hibridación genómica comparativa. En un análisis multivariante de 61 pacientes pediátricos, adolescentes y adultos jóvenes (edad <25 años), el índice genómico alto fue un factor de predicción independiente de SSC y SG inferiores.
- En adultos, el pronóstico más precario se relacionó con factores como el estadio III y estadio IVA del International Union Against Cancer/American Joint Committee on Cancer, una escasa necrosis tumoral, la localización en el tronco, un índice mitótico alto, mayor edad y un grado histológico más elevado.[26-28]
Tratamiento del sarcoma sinovial
Las opciones de tratamiento del sarcoma sinovial son las siguientes:
Cirugía sola
Evidencia (cirugía sola):
- El COG y el EpSSG informaron sobre un análisis combinado de 60 pacientes menores de 21 años con sarcoma sinovial localizado que se asignaron de manera prospectiva a cirugía sin radioterapia ni quimioterapia adyuvante.[31] La inscripción se limitó a los pacientes con resección completa inicial con márgenes limpios en el análisis histológico y un tumor de grado 2 de cualquier tamaño o un tumor de grado 3 de 5 cm o menos.
- La tasa de SSC a 3 años fue del 90 % (mediana de seguimiento, 5,2 años; intervalo, 1,9–9,1).
- Se presentaron 8 casos de recidiva tumoral; no se observó ningún caso de recidiva metastásica.
- Todos los pacientes con enfermedad recidivante se trataron de manera eficaz con terapia de segunda línea, que produjo una tasa de SG del 100 %.
- Por lo tanto, los autores concluyeron que un abordaje solo quirúrgico fue óptimo para los pacientes que lograron una resección R0 (resección completa con márgenes microscópicos negativos) y tenían tumores de menos de 5 cm, con independencia del grado.
Cirugía y quimioterapia, con radioterapia o sin esta
El sarcoma sinovial es más sensible a la quimioterapia que muchos otros tipos de sarcomas de tejido blando. Los niños con sarcoma sinovial tienen mejor pronóstico que los adultos con este tipo sarcoma.[11,28,32-37]
Los regímenes más utilizados para el tratamiento del sarcoma sinovial incorporan ifosfamida y doxorrubicina.[19,35,38] Las tasas de respuesta al régimen de ifosfamida y doxorrubicina son más altas que en otros sarcomas de tejido blando no rabdomiosarcomatoso.[39]
Evidencia (cirugía y quimioterapia con radioterapia o sin esta):
- Varios centros de tratamiento promueven la quimioterapia después de la resección y la radioterapia para niños y adultos jóvenes con sarcoma sinovial.[19,20,40-42]
- En los estudios de la International Society of Pediatric Oncology-Malignant Mesenchymal Tumors, se observó que determinados pacientes con sarcoma sinovial no metastásico (edad temprana, tumores resecados de <5 cm) a veces presentan desenlaces excelentes sin radioterapia. Sin embargo, aún no está claro si ese abordaje elimina la ventaja de la radiación para el control local o regional.[41]
- En un ensayo alemán, se indicó un beneficio de la quimioterapia posoperatoria en niños con sarcoma sinovial.[42]
- En un metanálisis también se indicó que la quimioterapia puede proporcionar beneficios.[19]
- El COG notificó un análisis del subgrupo de pacientes con sarcoma sinovial tratados en el ensayo ARST0332 (NCT00346164). Este fue un ensayo prospectivo de asignación de tratamiento para pacientes menores de 30 años con sarcomas de tejido blando no rabdomiosarcomatoso.[43] Se analizaron los desenlaces de 138 pacientes aptos.
- En general, se logró resección R0 o resección R1 (márgenes positivos al microscopio) del tumor primario en 129 pacientes (93,5 %): 69 pacientes (53,5 %) al comienzo del estudio y 60 pacientes (46,5 %) después de la quimioterapia neoadyuvante. De estos pacientes, 104 (80,6 %) presentaron una resección R0: 55 pacientes (53 %) al comienzo del estudio y 49 pacientes (47 %) después de la quimioterapia neoadyuvante.
- La respuesta fue evaluable en 55 pacientes de los 60 que recibieron quimioterapia neoadyuvante. De ellos, 2 pacientes (3,6 %) presentaron respuesta completa, 9 pacientes (16,4 %) presentaron respuesta parcial, 41 pacientes (74,6 %) presentaron enfermedad estable y 3 pacientes (5,5 %) presentaron enfermedad progresiva. El tejido de 57 tumores fue sometido a revisión central después de la resección definitiva. Se encontró que 41 tumores (72 %) exhibían menos del 90 % de necrosis, y 16 tumores (28 %) exhibían el 90 % o más de necrosis.
- En los 46 pacientes del grupo de riesgo bajo, la tasa de SSC a 5 años fue del 81,9 % (IC 95 %, 69–94,8 %) y la tasa de SG fue del 97,7 % (IC 95 %, 92,7–100 %).
- En los 23 pacientes del grupo de riesgo intermedio (grupo de tratamiento C), la tasa de SSC a 5 años fue del 64 % (IC 95 %, 42,4–85,8%) y la tasa de SG fue del 89,5 % (IC 95 %, 75,3–100 %).
- En los 49 pacientes del grupo de riesgo intermedio (grupo de tratamiento D), la tasa de SSC a 5 años fue del 71,2 % (IC 95 %, 56,5–85,9 %) y la tasa de SG fue del 86,5 % (IC 95 %, 75,6–97,3 %).
- En los 21 pacientes del grupo de riesgo alto, la tasa de SSC a 5 años fue del 7,6 % (IC 95 %, 0–22%) y la tasa de SG fue del 12,5 % (IC 95 %, 0–28,7 %).
- El EpSSG realizó un estudio prospectivo de pacientes menores de 21 años con sarcoma sinovial (CCLG-EPSSG-NRSTS-2005 [NCT00334854]).[44][Nivel de evidencia C1] Los pacientes se estratificaron en los siguientes 3 grupos de riesgo y se asignaron de forma no aleatoria al tratamiento según el grupo de riesgo:
- Los pacientes de riesgo bajo tenían tumores del grupo I del IRS que medían menos de 5 cm y tumores primarios no axiales.
- Los pacientes de riesgo intermedio no tenían tumores primarios axiales; tenían tumores del grupo I del IRS que medían más de 5 cm o tumores del grupo II del IRS.
- Los pacientes de riesgo alto fueron todos los pacientes con tumores en sitios axiales primarios (cabeza y cuello, pulmones y pleura, tronco, retroperitoneo), tumores del grupo III del IRS o tumores N1.
Los desenlaces de los pacientes tratados en el ensayo CCLG-EPSSG-NRSTS-2005 se describen en el Cuadro 11.
Cuadro 11. Supervivencia sin complicaciones y supervivencia general de pacientes con sarcoma sinovial de riesgo bajo, intermedio y alto tratados en el ensayo CCLG-EPSSG-NRSTS-2005 Grupo de riesgo Tratamiento SSC a 3 años (%) SG a 3 años (%) IRS = Intergroup Rhabdomyosarcoma Study; RT = radioterapia. aQuimioterapia de ifosfamida y doxorrubicina, sin doxorrubicina durante la radioterapia. b59,4 Gy en casos sin opción de una resección secundaria; 50,4 Gy como radioterapia preoperatoria; 50,4 Gy, 54 Gy y 59,4 Gy como radioterapia posoperatoria, en el caso de resecciones R0, R1 y R2, respectivamente (sin radioterapia adicional en el caso de resecciones completas secundarias con márgenes limpios en niños menores de 6 años). Bajo Cirugía sola 92 100 Intermedio Cirugía, 3–6 ciclos de quimioterapiaa, ± RTb 91 100 Alto (grupo III del IRS) 3 ciclos de quimioterapiaa, cirugía, 3 ciclos adicionales de quimioterapia, ± RTb 77 94 Alto (sitios primarios axiales) Cirugía, 6 ciclos de quimioterapiaa, RTb 78 100 - El CWS notificó los resultados de un ensayo prospectivo para el tratamiento de pacientes con sarcoma sinovial. La selección de pacientes se restringió a aquellos con tumores localizados con enfermedad residual macroscópica después de la primera cirugía, antes del inicio de la terapia sistémica (IRS III) y sin enfermedad metastásica detectable desde el punto de vista clínico. En el estudio participaron 145 pacientes con una mediana de edad de 14,5 años (intervalo, 0,2–33,2 años). En los protocolos se recomendó, pero no fue un requisito, que se administrara radioterapia antes de la resección definitiva del tumor. Se administró radioterapia a 115 pacientes (79 %) y 23 de ellos no recibieron radioterapia (no se documentó información sobre 7 pacientes). De los 115 pacientes irradiados, 57 se irradiaron antes de la escisión del tumor y 52 después de la escisión del tumor.[45]
- En esta comparación no aleatorizada, la secuenciación de la radioterapia antes de la resección definitiva se relacionó con una mejora estadísticamente significativa en las tasas de supervivencia sin recidiva local, en comparación con la cirugía definitiva antes de la radioterapia.
- La omisión de la radioterapia se relacionó con un desenlace inferior.
- Los desenlaces de los pacientes se describen en el Cuadro 12.
Cuadro 12. Efectos de la programación de la radioterapia en los desenlaces de pacientes con sarcoma sinovial Radioterapia Número de pacientes Tasa de SSC a 5 años Tasa de SG a 5 años Tasa de supervivencia sin recidiva local a 5 años SSC = supervivencia sin complicaciones; SG = supervivencia general. Sin radioterapia 23 44 % 57 % 76 % Radioterapia antes de la cirugía 57 70 % 83 % 98 % Radioterapia después de la cirugía. 52 73 % 82 % 86 %
Sarcoma sinovial recidivante, sin otra indicación
Para los pacientes con sarcoma sinovial recidivante, la tasa de supervivencia después de la recaída es precaria (30–40 % a los 5 años). Los factores relacionados con el desenlace después de la recaída incluyen la duración de la primera remisión (> o ≤ 18 meses) y la ausencia de una segunda remisión.[46,47]
En un estudio alemán, la resección quirúrgica de la enfermedad metastásica fue el método más frecuente para lograr una remisión completa.[47] La quimioterapia de mantenimiento por vía oral con trofosfamida, idarrubicina y etopósido o con ciclofosfamida oral y vinblastina intravenosa se administró de forma individual.
Un consorcio de 6 centros de referencia europeos informó sobre una revisión retrospectiva de pacientes menores de 21 años con sarcoma sinovial recidivante. En 41 pacientes, las primeras recidivas se produjeron entre 3 y 132 meses (mediana, 18 meses) después del primer diagnóstico. Las recaídas fueron locales en el 34 % de los pacientes, metastásicas en el 54 %, y locales y metastásicas en el 12 %. Los tratamientos en la primera recaída incluyeron cirugía en el 56 % de los pacientes, radioterapia en el 34 % y terapia sistémica en el 88 %. En total, 36 pacientes recibieron tratamiento médico de segunda línea, que incluyó quimioterapia en 32 pacientes (con 10 regímenes diferentes) y terapia dirigida en 4 pacientes. No se incluyó ningún paciente en ensayos clínicos de fase inicial como terapia de segunda línea. La tasa de respuesta general fue del 42 %. La mediana de SSC fue de 12 meses, y la tasa de SSC a 5 años tras la recaída fue del 15,8 %. La mediana de SG fue de 30 meses, y la tasa de SG a 5 años tras la recaída fue del 22,2 %. En un análisis de regresión multivariantee de Cox, la SG se relacionó de forma significativa con el tiempo y el tipo de recaída.[48]
La radioterapia (radioterapia corporal estereotáctica) se puede utilizar para tratar metástasis pulmonares específicas. Por lo general, se considera su uso después de, por lo menos, una resección para confirmar la presencia de enfermedad metastásica. En particular, la radioterapia es apropiada para pacientes con lesiones que comprometan el intercambio gaseoso por su localización adyacente a los bronquios o que causen dolor al invadir la pared torácica.[49]
Del 70 % al 80 % de los sarcomas sinoviales expresan NY-ESO-1, un antígeno testicular inmunógeno de cáncer.[50] Es posible usar transferencia adoptiva de células T modificadas para que expresen NY-ESO-1c259, un receptor de célula T (TCR) con alta afinidad para NY-ESO-1/LAGE1a, dirigida a NY-ESO-1.[51] El procedimiento para fabricar las células T genomanipuladas restringe su reactividad a un solo tipo de HLA. Todos los ensayos clínicos de este tipo de tecnología han usado HLA-A*02 como diana inicial y han restringido la inscripción a los pacientes cuyos tumores expresaban NY-ESO-1 y que tenían HLA-A*02. En un ensayo multinstitucional, se confirmó la presencia de respuestas antitumorales en el 50 % de los pacientes (6 de 12) caracterizadas por achicamiento del tumor en el transcurso de varios meses. Se encontraron células NY-ESO-1c259T circulantes después de la infusión en todos los pacientes y las células perduraron por lo menos 6 meses en todos los pacientes que respondieron a la infusión.[52]
Opciones de tratamiento en evaluación clínica
La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
Sarcoma epitelioide
El sarcoma epitelioide es un tumor mesenquimatoso raro con histogénesis incierta que exhibe diferenciación multilinaje.[53]
Cuadro clínico inicial
El sarcoma epitelioide suele presentarse como un nódulo firme de crecimiento lento en el tejido blando profundo. El tipo proximal afecta de manera predominante a adultos y compromete el esqueleto axial y sitios proximales. El tumor es muy maligno y tiene una predisposición a metástasis ganglionares.
Alteraciones genómicas
El sarcoma epitelioide se caracteriza por la inactivación del gen SMARCB1, presente en los tipos convencional y proximal de este sarcoma.[54] Esta anomalía conduce a una mayor dependencia de EZH2 y a la formación de tumores.[55]
Tratamiento del sarcoma epitelioide
Las opciones de tratamiento del sarcoma epitelioide son las siguientes:
Cirugía con quimioterapia o radioterapia, o sin estas
El tratamiento más eficaz es la extirpación quirúrgica de los tumores primarios y recidivantes.[56][Nivel de evidencia C1] Debido a que esta enfermedad tiene predisposición a presentar metástasis ganglionar oculta, se recomienda la biopsia de ganglio linfático centinela para el sarcoma epitelioide de extremidades o glúteos en ausencia de comprobación clínica (por imágenes o por examen físico) de ganglios linfáticos agrandados.[57]
Evidencia (cirugía con quimioterapia o radioterapia o sin esta):
- En un análisis retrospectivo del grupo alemán CWS de 67 niños, adolescentes y adultos jóvenes (mediana de edad 14 años) con sarcoma epitelioide, 53 pacientes tenían enfermedad localizada y 14 pacientes tenían enfermedad metastásica.[58][Nivel de evidencia C1] De 67 pacientes, se trató a 58 con resecciones primarias. De acuerdo con el examen microscópico, las resecciones se consideraron completas en 35 pacientes e incompletas en 12 pacientes; en el examen macroscópico las resecciones fueron incompletas en 20 pacientes. Se trató con quimioterapia a 49 pacientes y con radioterapia a 33 pacientes.
- Se logró la remisión completa en 45 de 53 pacientes (85 %) con enfermedad localizada.
- Se observaron recidivas en 27 pacientes después de una mediana de tiempo de 0,9 años (intervalo, 0,1–2,3 años).
- Los pacientes con enfermedad localizada tuvieron una tasa de SSC a 5 años del 35 % (IC 95 %, ±12 %) y una tasa de SG del 48 % (IC 95 % ±14 %).
- Los pacientes con enfermedad metastásica tuvieron una tasa de SSC a 5 años del 7 % (IC 95 %, ±14 %) y una tasa de SG del 9 % (IC 95 %, ±16 %).
- Los factores que se correlacionaron con un pronóstico favorable en los pacientes con enfermedad localizada fueron un tamaño tumoral pequeño, un grupo del IRS más bajo, menor grado de invasión tumoral, un estado negativo para el compromiso ganglionar y una resección completa según el análisis microscópico.
- En un análisis retrospectivo se revisaron los ensayos clínicos prospectivos del COG y el EpSSG en los que participaron pacientes menores de 30 años con sarcoma epitelioide.[59][Nivel de evidencia B4] En el análisis se identificaron 63 pacientes tratados entre julio de 2005 y noviembre de 2015. Los pacientes se estratificaron en 3 grupos de riesgo mediante una combinación de características clínicas y tratamientos recibidos. Los pacientes de riesgo bajo (n = 34) se sometieron a cirugía con radioterapia o sin esta. Este grupo incluyó de modo predominante a pacientes con tumores no metastásicos con resección amplia o marginal que medían 5 cm o menos. El grupo de riesgo intermedio incluyó a pacientes (n = 16) con tumores no metastásicos de grado alto y tumores que medían más de 5 cm o irresecables. Los pacientes de riesgo alto (n = 13) tenían enfermedad ganglionar o metástasis a distancia, sin importar el grado o el tamaño del tumor.
- Se observaron respuestas parciales en 11 de 22 pacientes (50 %) que recibieron terapia neoadyuvante.
- Se presentaron casos de recidiva local (n = 10) y recidiva a distancia (n = 15).
- Las tasas estimadas de SG a 5 años fueron del 86,4 % en los pacientes de riesgo bajo, del 63,5 % en los pacientes de riesgo intermedio y del 0 % en los pacientes de riesgo alto.
- Los factores de predicción de una SSC más precaria en los pacientes sin metástasis fueron un compromiso ganglionar locorregional, un tumor invasor, un grado alto y un menor alcance de la resección.
- En una revisión de 30 pacientes pediátricos con sarcoma epitelioide (mediana de edad en el momento de la presentación, 12 años), se notificaron los siguientes resultados:[60]
- Se observaron respuestas a la quimioterapia en el 40 % de los pacientes que recibieron regímenes de tratamiento propios del sarcoma.
- El 60 % de los pacientes estaban vivos al cabo de 5 años del diagnóstico inicial.
- En una revisión retrospectiva de una sola institución de 20 pacientes, que incluyó niños y adultos (mediana de edad, 27,3 años), se notificó lo siguiente:[56]
- No hubo diferencia en la probabilidad de recidiva entre los pacientes que recibieron quimioterapia y los que no la recibieron.
- Los autores indicaron que la radioterapia quizás sea útil.
Terapia dirigida
Evidencia (tazemetostat):
- En un ensayo de fase II de 62 adultos con sarcoma epitelioide en quienes se documentó por análisis inmunohistioquímico la pérdida de INI1 o las alteraciones bialélicas en SMARCB1 (gen codificador de INI1), el tazemetostat demostró actividad clínica.[61]
- Se presentaron 9 de 62 respuestas parciales confirmadas, la tasa de respuesta objetiva fue del 15 % y la tasa de control de la enfermedad fue del 26 %.
En enero de 2020, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) otorgó la aprobación acelerada al uso del tazemetostat en pacientes adultos y jóvenes de 16 años o más con sarcoma epitelioide metastásico, o localmente avanzado, que no cumplían los requisitos para una resección completa.
Opciones de tratamiento en evaluación clínica para el sarcoma epitelioide
La información en inglés sobre los ensayos clínicos patrocinados por el NCI se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación, se presenta un ejemplo de un ensayo clínico nacional o institucional en curso:
- PEPN2121 (NCT05286801) (Tiragolumab and Atezolizumab for the Treatment of Relapsed or Refractory SMARCB1- or SMARCA4-Deficient Tumors): en este estudio se evalúa la combinación de un anticuerpo dirigido a PD-L1 (atezolizumab) con un anticuerpo dirigido a TIGIT (tiragolumab) en pacientes que tienen tumores con deficiencia de SMARCB1 o SMARCA4. Es posible que los pacientes con sarcoma epitelioide sean aptos para este estudio.
Sarcoma alveolar de partes blandas
Los sarcomas alveolares de partes blandas representan el 1,4 % de los sarcomas de tejido blando en pacientes menores de 20 años (consultar el Cuadro 1
Cuadro clínico inicial
La mediana de edad de presentación es de 25 años en pacientes con sarcoma alveolar de partes blandas. Este tumor surge de manera más frecuente en las extremidades, pero también puede aparecer en la región oral y maxilofacial.[62-64] El sarcoma alveolar de partes blandas en niños a veces se manifiesta con indicios de enfermedad metastásica.[65] Son infrecuentes las metástasis encefálicas y pulmonares tardías.[62]
En una serie de 61 pacientes con sarcoma alveolar de partes blandas que se trataron en 4 ensayos consecutivos del CWS y del Soft Tissue Sarcoma Registry (SoTiSaR), 46 pacientes presentaron enfermedad localizada y 15 pacientes presentaron indicios de metástasis en el momento del diagnóstico.[66]
Entre 1980 y 2014, se trataron 69 pacientes menores de 30 años con sarcoma alveolar de partes blandas en cuatro instituciones importantes. La mediana de edad en el momento del diagnóstico fue de 17 años y el 64 % de los pacientes eran mujeres. El sitio más común de la enfermedad fue la extremidad inferior y 26 pacientes tenían una translocación génica ASPSCR1::TFE3.[67]
Alteraciones genómicas
Este tumor de histogénesis incierta se caracteriza por una translocación cromosómica constante t(X;17)(p11,2;q25) en la que se fusiona el gen ASPSCR1 con el gen TFE3.[68,69]
Pronóstico
En los pacientes con sarcoma alveolar de partes blandas, las metástasis son frecuentes y, a menudo, tienen una evolución poco activa y prolongada.
El sarcoma alveolar de partes blandas en niños a veces también presenta una evolución poco activa.[65] Es posible que los pacientes con sarcoma alveolar de partes blandas presenten una recidiva muchos años después de un largo periodo de remisión aparente.[66,70]
- En un estudio se notificó que en una serie de 19 pacientes con sarcoma alveolar de partes blandas que recibieron tratamiento la tasa de SG a 5 años fue del 80 %. La tasa de SG fue del 91 % en los pacientes con enfermedad localizada, del 100 % en los pacientes con tumores que medían 5 cm o menos y del 31 % en los pacientes con tumores que medían más de 5 cm.[71]
- En otra serie de 33 pacientes, la tasa de SG fue del 68 % a los 5 años del diagnóstico y del 53 % a los 10 años del diagnóstico. La supervivencia fue mejor en los pacientes con tumores más pequeños (≤5 cm) y tumores que se resecaron por completo.[72][Nivel de evidencia C1]
- En una revisión retrospectiva de niños y adultos jóvenes menores de 30 años (mediana de edad, 17 años; intervalo, 1,5–30 años) de 4 instituciones, se identificó a 69 pacientes tratados de manera primaria con cirugía entre 1980 y 2014.[67][Nivel de evidencia C1] Se encontró una translocación ASPSCR1::TFE3 en los 26 pacientes analizados. Hubo 19 pacientes con tumores del grupo I del IRS (28 %), 7 pacientes con tumores del grupo II del IRS (10 %), 5 pacientes con tumores del grupo III del IRS (7 %) y 38 pacientes con tumores del grupo IV del IRS (55 %). En los 31 pacientes con tumores localizados (grupos posquirúrgicos I, II y III del IRS), la tasa de SSC a 5 años fue del 80 % y la tasa de SG fue del 87 %. En los 38 pacientes con tumores metastásicos (grupo IV del IRS), la tasa de SSC a 5 años fue del 7 % y la tasa de SG fue del 61 %.
- En una serie de pacientes tratados en estudios consecutivos de Alemania, 15 de 61 pacientes (25 %) presentaron metástasis, por lo general de índole miliar. A pesar de la falta de respuesta a la quimioterapia, la tasa de SG a 5 años fue del 61 %, con una tasa de SSC del 20 %.[66]
Tratamiento del sarcoma alveolar de partes blandas
Las opciones de tratamiento del sarcoma alveolar de partes blandas son las siguientes:
- Cirugía con radioterapia y quimioterapia o sin estas.[29,30]
- Terapia dirigida (inhibidores de tirosina–cinasas e inhibidores de puntos de control).[73]
Cirugía con radioterapia y quimioterapia o sin estas
El abordaje estándar de tratamiento es la resección completa de la lesión primaria.[71] Si la escisión completa no es posible, se administra radioterapia.
Evidencia (cirugía con quimioterapia o sin esta):
- En un estudio realizado en China, se notificó sobre 18 pacientes con sarcoma alveolar de partes blandas en la región oral y maxilofacial. Entre ellos, 15 pacientes eran menores de 30 años. El tratamiento primario fue la resección quirúrgica con márgenes negativos.[64][Nivel de evidencia C2]
- Todos los pacientes sobrevivieron y solo 1 paciente presentó recidiva de enfermedad metastásica.
- En una serie de pacientes tratados en estudios consecutivos en Alemania, se notificó lo siguiente:[66]
- La supervivencia sin progresión (SSP) de los pacientes sin metástasis en el momento de la presentación mejoró con la resección completa del tumor primario.
- La tasa de SSC a 5 años fue del 100 % en los pacientes con tumores que se resecaron por completo, en comparación con el 50 % en los pacientes con enfermedad residual microscópica o macroscópica.
- En una serie de 51 pacientes pediátricos de 0 a 21 años con sarcoma alveolar de partes blandas, se notificó lo siguiente:[62][Nivel de evidencia C1]
- La tasa de SG fue del 78 % a los 10 años y la tasa de SSC fue de alrededor del 63 %.
- En los pacientes con enfermedad localizada (n = 37) la tasa de SG a 10 años fue del 87 %.
- Los 14 pacientes con metástasis en el momento del diagnóstico presentaron una tasa de SG a 10 años del 44 %, en parte debido a la resección quirúrgica del tumor primario y a las metástasis pulmonares en algunos pacientes.
- Solo 3 de 18 pacientes (17 %) con enfermedad cuantificable presentaron una reacción favorable a la quimioterapia antisarcoma convencional, pero 2 de 4 pacientes tratados con sunitinib presentaron una respuesta parcial.
Terapia dirigida
Se han realizado estudios de terapia dirigida (inhibidores de tirosina–cinasas e inhibidores de puntos de control).
Sunitinib
Evidencia (sunitinib):
- En un estudio retrospectivo pequeño con 9 pacientes adultos con sarcoma alveolar de partes blandas metastásico que recibieron sunitinib, se notificaron respuestas parciales en 5 pacientes y enfermedad estable en 2 pacientes.[74][Nivel de evidencia C3]
- En otro estudio, 15 pacientes adultos con sarcoma alveolar de partes blandas se trataron con sunitinib. De los pacientes, 5 se trataron con sunitinib durante más de 2 años.[75][Nivel de evidencia C1]
- Presentaron respuestas parciales 6 pacientes.
- La mediana de SSP fue de 19 meses y la mediana de SG fue de 56 meses.
- La tasa de SG a 5 años fue del 49 %.
Cediranib
El cediranib es un inhibidor de los 3 receptores del factor de crecimiento epidérmico vascular que se conocen.
Evidencia (cediranib):
- En un ensayo pediátrico de fase II de cediranib en el que se usó el 70 % de la dosis máxima tolerada en adultos para el tratamiento de pacientes menores de 16 años, se notificó lo siguiente:[76][Nivel de evidencia B4]
- De 7 pacientes, 5 presentaron enfermedad estable durante 14 meses o más.
- Un grupo internacional realizó un ensayo aleatorizado controlado con placebo con enmascaramiento doble de fase II sobre cediranib en pacientes adolescentes y adultos con sarcoma alveolar de partes blandas.[77][Nivel de evidencia A1]
- La mediana del cambio porcentual en la suma de los diámetros de la lesión objetivo en la población evaluable fue de un -8,3 % (intervalo intercuartílico [IIC], -26,5 a 5,9) en los pacientes que recibieron cediranib, en comparación con un 13,4 % (IIC, 1,1–21,3) en los pacientes que recibieron el placebo (P unilateral = 0,0010).
- Los autores concluyeron que el cediranib es un fármaco activo en pacientes con sarcoma alveolar de partes blandas.
- En un ensayo de fase II de cediranib, 15 de 43 pacientes adultos (35 %) con sarcoma alveolar de partes blandas metastásico presentaron respuestas parciales.[78][Nivel de evidencia C3]
Pazopanib
Evidencia (pazopanib):
- En un ensayo sin enmascaramiento en el que se evaluó la eficacia del pazopanib en 6 pacientes adultos, 1 paciente logró una respuesta parcial y 5 pacientes presentaron enfermedad estable.[79]
- En otro ensayo se incluyeron 30 pacientes adultos que se trataron con pazopanib.[80]
- Se presentó 1 caso de respuesta completa, 7 pacientes tuvieron respuestas parciales y 17 pacientes, enfermedad estable.
- La mediana de SSP fue de 13,6 meses.
Axitinib y pembrolizumab
El axitinib es un inhibidor de la tirosina–cinasa del receptor del factor de crecimiento endotelial vascular. El pembrolizumab es un inhibidor del punto de control inmunitario de la proteína 1 de muerte celular programada.
Evidencia (axitinib y pembrolizumab):
- En un ensayo, pacientes adultos con sarcomas avanzados se trataron con una combinación de axitinib y pembrolizumab.[73]
- La tasa de SSP a 3 meses en 12 pacientes con sarcoma alveolar de partes blandas fue del 73 %.
- De 11 pacientes con enfermedad evaluable, 6 exhibieron respuestas parciales con axitinib.
Otras terapias
Hay informes esporádicos de respuestas objetivas al tratamiento con interferón α y bevacizumab.[62,81,82]
Debido a que estos son tumores raros, se debe considerar la inscripción en ensayos clínicos prospectivos de todos los niños con sarcoma alveolar de partes blandas. Para obtener más información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
Opciones de tratamiento en evaluación clínica para el sarcoma alveolar de partes blandas
La información en inglés sobre los ensayos clínicos patrocinados por el NCI se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
Sarcoma de células claras, sin otra indicación
El sarcoma de células claras (antes llamado melanoma maligno de partes blandas) es un sarcoma de tejido blando raro que suele afectar los tejidos blandos profundos de las extremidades. También se llama sarcoma de células claras de tendones y aponeurosis. El tumor suele afectar a adolescentes y adultos jóvenes.
Cuadro clínico inicial
El tumor afecta con mayor frecuencia la extremidad inferior, en particular el pie, el talón y el tobillo.[83,84] Tiene una predisposición alta a la diseminación ganglionar, en especial las metástasis en los ganglios linfáticos regionales (12–43 %).[84,85]
Es común que el tumor tenga una evolución clínica poco activa. Los pacientes con tumores pequeños localizados con índice mitótico bajo y un grado histológico intermedio presentan los mejores desenlaces.[86]
Alteraciones genómicas
El sarcoma de células claras de tejido blando se caracteriza por las fusiones génicas EWSR1::ATF1 o EWSR1::CREB1.[87,88]
Tratamiento del sarcoma de células claras de tejido blando
Las opciones de tratamiento del sarcoma de células claras de tejido blando son las siguientes:
Cirugía con radioterapia o sin esta
La cirugía, con radioterapia o sin esta, es el tratamiento de elección y ofrece la mejor probabilidad de curación.
Evidencia (cirugía con radioterapia o sin esta):
- En una serie de 28 pacientes pediátricos de los Soft Tissue Cooperative Studies en Italia y Alemania, la mediana de edad en el momento del diagnóstico fue de 14 años y la extremidad inferior fue el sitio primario más común (50 %).[89]; [90][Nivel de evidencia C2]
- En esta serie, se curaron 12 de 13 pacientes con tumores resecados por completo.
- En los pacientes con estadio más avanzado de la enfermedad, el desenlace es precario y la quimioterapia casi nunca es eficaz.
Terapia dirigida
Evidencia (terapia dirigida):
- En un estudio de la European Organization for Research and Treatment of Cancer, se trató con crizotinib a 26 pacientes de sarcoma de células claras con enfermedad metastásica y reordenamientos de EWSR1 documentados.[91]
- Uno de los pacientes tuvo una respuesta parcial y 17 tuvieron enfermedad estable.
Condrosarcoma mixoide extraesquelético
El condrosarcoma mixoide extraesquelético es un tipo relativamente infrecuente de sarcoma de tejido blando, y representa solo el 2,3 % de todos los sarcomas de tejido blando.[92] Se ha notificado en niños y adolescentes.[93]
Este tumor se ha considerado tradicionalmente de bajo potencial maligno.[94] Sin embargo, en informes de instituciones grandes se observó que el condrosarcoma mixoide extraesquelético exhibe un potencial maligno importante, en especial si a los pacientes se los somete a seguimiento prolongado.[95,96] Los pacientes suelen presentar una evolución lenta prolongada. Se ha descrito bien el compromiso ganglionar. Además, se ha notificado recidiva local (57 %) y diseminación metastásica a los pulmones (26 %).[96]
Alteraciones genómicas
El condrosarcoma mixoide extraesquelético es una neoplasia multinodular. Las células redondeadas se organizan en cordones y cadenas sobre un fondo mixoide de sulfato de condroitina. Se identificaron varias anomalías citogenéticas (consultar el Cuadro 2); la más frecuente es la fusión génica EWSR1::NR4A3.[97]
Tratamiento del condrosarcoma mixoide extraesquelético
Las opciones de tratamiento del condrosarcoma mixoide extraesquelético son las siguientes:
- Cirugía.
- Radioterapia.
El control local intensivo y la resección de las metástasis produjo tasas de SG del 87 % a los 5 años y del 63 % a los 10 años. Los tumores fueron relativamente resistentes a la radioterapia.[95] No se ha establecido el beneficio terapéutico de la quimioterapia.
Hay posibles dianas genéticas para la acción de moléculas pequeñas, pero se tienen que estudiar en un ensayo clínico. En un estudio de adultos, 6 de 10 pacientes que recibieron sunitinib lograron respuestas parciales.[98]
Sarcoma de Ewing extraesquelético
Casi una quinta parte de los pacientes con sarcoma de Ewing presentarán sitios primarios no óseos (extraóseos). El tratamiento de este tumor es el mismo que el de los tumores primarios óseos.[99] Para obtener más información, consultar Tratamiento del sarcoma de Ewing y los sarcomas indiferenciados de células redondas pequeñas de hueso y tejido blando.
Tumor desmoplásico de células redondas pequeñas
El tumor desmoplásico de células redondas pequeñas es un sarcoma primitivo raro.
Cuadro clínico inicial
El tumor desmoplásico de células redondas pequeñas afecta con mayor frecuencia el peritoneo abdominal, la pelvis o el peritoneo del escroto, pero es posible que se presente en el riñón u otros órganos sólidos.[100-104] Con frecuencia se encuentran de docenas a cientos de implantes intraperitoneales. Se presentan sobre todo en hombres (85 %) y en ocasiones se diseminan a los pulmones y a otros sitios.[104,105]
Evaluación diagnóstica
En una serie grande de 65 pacientes en una sola institución, se compararon las tomografías computadas (TC) (n = 54) y las TC combinadas con tomografías por emisión de positrones (TEP)-TC (n = 11). Las TEP-TC arrojaron muy pocos resultados negativos falsos y permitieron la detección de sitios metastásicos que no se encontraron en las TC convencionales.[105]
Alteraciones genómicas
En estudios citogenéticos de estos tumores, se observó una translocación recurrente t(11;22)(p13;q12), que se ha caracterizado como una fusión de los genes WT1 y EWSR1.[103,106] La fusión EWSR1::WT1 confirma el diagnóstico de tumor desmoplásico de células redondas pequeñas. La carga de variantes del tumor es en promedio baja para el tumor desmoplásico de células redondas pequeñas (<1 variante por megabase), y es infrecuente la presencia de alteraciones génicas recurrentes diferentes a la fusión EWSR1::WT1.[107] Un porcentaje pequeño de los casos (aproximadamente el 3 %) tiene variantes activadoras de FGFR4, y con igual frecuencia se observó la amplificación de FGFR4.[107,108] Se han observado variantes inactivadoras de TP53 y ARID1A en un porcentaje pequeño de los casos de tumores desmoplásicos de células redondas pequeñas.[107,108]
Pronóstico
El pronóstico general de los pacientes con tumor desmoplásico de células redondas pequeñas continúa siendo muy precario y la tasa de mortalidad notificada es del 90 %. Una resección de más del 90 % del tumor, en el momento de la presentación inicial o después de la quimioterapia preoperatoria, a veces es un factor de pronóstico favorable para la SG.[109,110]; [111][Nivel de evidencia C1] La respuesta a la quimioterapia neoadyuvante y la resección completa (cercana al 100 %) se relaciona con un mejor desenlace.[104,112]
Tratamiento del tumor desmoplásico de células redondas pequeñas
No hay un abordaje estándar para el tratamiento del tumor desmoplásico de células redondas pequeñas.
Las opciones de tratamiento del tumor desmoplásico de células redondas pequeñas son las siguientes:
- Terapia multimodal (quimioterapia, cirugía y radioterapia).
- Cirugía con quimioterapia hipertérmica intraperitoneal.
- Otras opciones de tratamiento.
Terapia multimodal
Las resecciones quirúrgicas completas son infrecuentes y a menudo se realizan en centros muy especializados, pero son decisivas para mejorar la supervivencia. Las modalidades de tratamiento exitosas incluyen quimioterapia neoadyuvante de tipo Ewing, seguida de resección quirúrgica completa de los tumores intraabdominales extensos, seguida de radioterapia abdominal total. Con este abordaje multimodal, se puede lograr la supervivencia a los 5 años en el 30 % al 40 % de los pacientes.[100,101,109,113-116]
Cirugía con quimioterapia hipertérmica intraperitoneal
La quimioterapia hipertérmica intraperitoneal (HIPEC) es un método de tratamiento local que, en ocasiones, proporciona más control de la enfermedad intraabdominal microscópica. La teoría es que la quimioterapia caliente que se introduce en la cavidad abdominal después de la resección quirúrgica (en el momento de la cirugía) produce citotoxicidad sinérgica en las células microscópicas que quedan en el abdomen.[117]
La adición de HIPEC para completar la resección quirúrgica (cirugía citorreductora) es una técnica nueva que se utilizó por primera vez en niños durante un ensayo clínico de fase I realizado en 2006. La cirugía citorreductora y la HIPEC para el tratamiento de tumores desmoplásicos de células redondas pequeñas forman parte de un abordaje multidisciplinario y solo se administran en centros muy especializados. Las cirugías pueden durar más de 12 horas y se deben considerar los aspectos técnicos de esta resección tumoral particular.[117]
Evidencia (cirugía con HIPEC):
- En un estudio de fase II de una sola institución, se observó que la HIPEC es una adición prometedora de la resección quirúrgica completa. En el estudio se inscribieron 14 pacientes con tumor desmoplásico de células redondas pequeñas y 5 pacientes con otros sarcomas. Estos pacientes muy seleccionados tenían tumores confinados a la cavidad abdominal. Estos pacientes exhibieron una respuesta parcial a la quimioterapia neoadyuvante de tipo Ewing, se sometieron a resecciones quirúrgicas completas y recibieron HIPEC con cisplatino. También recibieron radioterapia abdominal total adyuvante seguida de quimioterapia adyuvante.[117]
- Con este abordaje estandarizado, los pacientes con tumores desmoplásicos de células redondas pequeñas tuvieron una tasa de SG del 80 % a los 30 meses y del 40 % a los 50 meses.
- Los pacientes con tumores desmoplásico de células redondas pequeñas sin metástasis hepáticas no presentaron recidivas intraabdominales; sin embargo, el 87 % de los pacientes con metástasis hepáticas o enfermedad portal presentaron recidivas.
- En un estudio retrospectivo en varias instituciones de Francia, se trató a los pacientes con cirugía citorreductora e HIPEC. Se seleccionó a 22 pacientes con una mediana de edad en el momento del diagnóstico de 14,8 años (intervalo, 4,2–17,6 años). Entre estos, 7 pacientes tenían mesoteliomas peritoneales, 7 tenían tumores desmoplásicos de células redondas pequeñas y 8 pacientes exhibían tumores con otros tipos histológicos. Se logró una resección macroscópica completa (CC-0, donde CC indica integridad de la citorreducción) en 16 casos (73 %). De los 7 pacientes con tumores desmoplásicos de células redondas pequeñas, 4 tuvieron resecciones completas.[118][Nivel de evidencia C1]
- Se observó recaída en 16 pacientes (72 %) luego de una mediana de tiempo de 9,6 meses (intervalo, 1,4–86,4 años).
- Al cabo de una mediana de tiempo de 5,3 meses (intervalo, 0,1–36,1 meses), 9 pacientes (41 %) murieron por enfermedad recidivante.
- En otro estudio realizado en Francia, se analizó el uso de cirugía citorreductora con HIPEC para el tratamiento de pacientes con tumores desmoplásicos de células redondas pequeñas con enfermedad limitada al abdomen. De los 107 pacientes con tumores desmoplásicos de células redondas pequeñas, 48, que no tenían metástasis extraperitoneales, se sometieron a cirugía citorreductora. De 48 pacientes (media de edad, 22 años), 38 (79 %) recibieron quimioterapia preoperatoria o posoperatoria y 23 (48 %) recibieron radioterapia abdominopélvica completa posoperatoria. Se administró quimioterapia intraperitoneal a 11 pacientes (23 %); 2 pacientes recibieron quimioterapia intraperitoneal posoperatoria temprana (EPIC) y 9 pacientes recibieron HIPEC.[119]
- Después de una mediana de seguimiento de 30 meses, la mediana de SG de toda la cohorte fue de 42 meses.
- La tasa de SG a 2 años fue del 72 % y la tasa de SG a 5 años fue del 19 %.
- La tasa de supervivencia sin enfermedad (SSE) a 2 años fue del 30 % y la tasa de SSE a 5 años fue del 12 %.
- La radioterapia dirigida a toda la cavidad abdominopélvica fue la única variable relacionada con supervivencia sin recidiva peritoneal y SSE después de la cirugía citorreductora.
- Se utilizaron 6 regímenes diferentes de quimioterapia en los 11 pacientes que recibieron quimioterapia intraperitoneal (HIPEC o EPIC). En el estudio, no se indica la supervivencia o el desenlace para este grupo.
- La repercusión de HIPEC o EPIC sobre la SG y la SSE no fue estadísticamente significativa pero, como no se utilizaron regímenes estandarizados en todos los pacientes, resulta difícil evaluar los resultados.
- En un estudio retrospectivo de una sola institución, se informó sobre 9 pacientes (mediana de edad, 19 años) con tumor desmoplásico de células redondas pequeñas. La mayoría de los pacientes tenían enfermedad generalizada; entre ellos, 4 pacientes con enfermedad extraabdominal y 5 pacientes con compromiso hepático. Estos 9 pacientes se sometieron a 10 tratamientos citorreductores con HIPEC. Además, 7 pacientes también recibieron radioterapia y 3 pacientes se sometieron a trasplante de células madre.[120]
- La tasa de supervivencia sin recaída a 3 años fue del 13 %, y la tasa de SG fue del 55 %.
- El tratamiento a menudo se vinculó con hospitalizaciones prolongadas.
- Fue necesario administrar nutrición parenteral a largo plazo a 8 pacientes durante una mediana de 261 días.
- Otras complicaciones a largo plazo fueron gastroparesia (n = 1), obstrucción del intestino delgado (n = 3) y cistitis hemorrágica (n = 2).
Otras opciones de tratamiento
El Center for International Blood and Marrow Transplant Research analizó a pacientes con tumor desmoplásico de células redondas pequeñas de su registro que recibieron consolidación con dosis altas de quimioterapia y reconstitución de células madre autógenas.[121] Si bien en este análisis retrospectivo del registro se indicó algún beneficio de este abordaje, otros investigadores han dejado de usarlo debido al exceso de efectos tóxicos y la ausencia de eficacia.[109]
En un estudio de una sola institución, se notificó que 5 de 5 pacientes con tumor desmoplásico de células redondas pequeñas recidivante presentaron respuestas parciales al tratamiento con la combinación de vinorelbina, ciclofosfamida y temsirólimus.[122]
Tumor rabdoide, sin otra indicación (extrarrenal)
Los tumores rabdoides malignos en niños con tumores renales se describieron por primera vez en 1981. Después, estos tumores se identificaron en varios sitios extrarrenales. Estos tumores son infrecuentes y muy malignos, en especial en niños menores de 2 años. Para obtener más información, consultar la sección Tumores rabdoides de riñón en Tratamiento del tumor de Wilms y otros tumores renales infantiles.
Los tumores rabdoides extrarrenales (extracraneales) representan el 2 % de los sarcomas de tejido blando en pacientes menores de 20 años (consultar el Cuadro 1).
Alteraciones genéticas y genómicas
La primera serie de tamaño considerable de niños con tumor rabdoide maligno extrarrenal y extracraneal de tejidos blandos se creó a partir de 26 pacientes inscritos en los estudios IRS I a III durante una revisión de material de patología. Solo 5 pacientes (19 %) estaban vivos y sin enfermedad después de 2 años.[123]
Durante la investigación de niños que presentaban tumores teratoides rabdoides atípicos en el encéfalo, así como otros con tumores rabdoides renales y extrarrenales, se encontraron variantes germinales y adquiridas del gen SMARCB1 en 29 tumores analizados.[124] Los tumores rabdoides a veces se relacionan con variantes germinales del gen SMARCB1 y se pueden heredar de un progenitor en apariencia no afectado.[125] Esta observación se extendió a 32 tumores rabdoides malignos en todos los sitios en pacientes cuya mediana de edad en el momento del diagnóstico fue de 12 meses.[126]
Pruebas genéticas y vigilancia
Se debe considerar el análisis de la línea germinal para personas de todas las edades con tumores rabdoides. Se recomienda el asesoramiento genético como parte del plan de tratamiento debido al riesgo bajo, pero real, de que se presenten más casos dentro de una familia. Cuando hay variantes, se deberán considerar los exámenes de detección en los progenitores, aunque estos exámenes de portadores tienen una probabilidad baja de positividad. Es posible realizar un diagnóstico prenatal en situaciones en las que se ha documentado una variante o deleción específica de SMARCB1 en la familia.[125]
Hasta la fecha, hay escasa evidencia sobre la eficacia de la vigilancia de pacientes con un síndrome de predisposición a tumores rabdoides de tipo 1 causado por variantes germinales de pérdida de función en SMARCB1. Sin embargo, se han formulado recomendaciones por consenso, debido a la naturaleza maligna de los tumores, la mortalidad significativa, y el comienzo a una edad temprana en portadores de variantes interruptoras de SMARCB1. Un grupo de expertos en las características genéticas del cáncer infantil (conformado por oncólogos, radiólogos y genetistas) formularon estas recomendaciones. No se ha hecho un estudio oficial para corroborar el beneficio de la vigilancia de los pacientes con variantes germinales de SMARCB1. Se ha postulado que la detección temprana quizás mejore la supervivencia general (SG) por el posible beneficio para la supervivencia al identificar una enfermedad resecable.[127-129]
La vigilancia de los pacientes con variantes germinales de SMARCB1 incluye los siguientes aspectos:
- Imágenes por resonancia magnética (IRM) del encéfalo cada 3 meses desde el nacimiento (o el diagnóstico) hasta los 5 años de edad.
- Se recomienda una ecografía abdominal con énfasis en los riñones cada 3 meses.
Pronóstico y cuadro clínico inicial
La edad temprana y la enfermedad metastásica en el momento de la presentación se relacionan con desenlace precario en niños con tumores rabdoides extracraneales.
En un estudio en el que se usaron datos de la National Cancer Database, se identificaron 202 pacientes (menores de 18 años) con tumores rabdoides malignos fuera del sistema nervioso central (SNC). El sitio primario del tumor rabdoide maligno fue el tejido blando (46 %), los riñones (45 %) y el hígado (9 %).[130]
- La tasa de SG a 1 año fue del 48,8 % y la tasa de SG a 5 años fue del 35,9 %.
- En el análisis multivariante se demostró que la edad inferior a 1 año y la presencia de metástasis fueron indicadores de pronóstico precario (P = 0,058).
- En la cohorte de pacientes quirúrgicos (n = 143), se observó cierta relación clínicamente significativa entre la presencia de enfermedad residual y un desenlace más precario (CRI, 1,54; IC 95 %, 0,88–2,69; P = 0,13).
En un estudio del SEER, se examinó a 229 pacientes con tumor rabdoide maligno de riñón, del SNC y extrarrenal. Los factores que tuvieron una repercusión favorable fueron la edad de 2 a 18 años de los pacientes, tumores de extensión limitada y la administración de radioterapia, en comparación con otros pacientes (P < 0,002 para cada comparación). El sitio del tumor primario no tuvo importancia pronóstica. La tasa de SG fue del 33 % a los 5 años.[131]
En un registro europeo de tumores rabdoides extracraneales, se identificaron 100 pacientes de 14 países entre 2009 y 2018.[132] La mitad de los pacientes tenían menos de 1 año en el momento del diagnóstico. En 30 pacientes (30 %), el tumor se ubicó en los riñones. Se encontró un tumor rabdoide maligno extracraneal y extrarrenal en el 70 % de los pacientes (70 de 100), y los sitios más frecuentes fueron la región cervical, la región torácica y el hígado. En 9 pacientes se encontraron tumores sincrónicos. Se presentaron metástasis a distancia en el momento del diagnóstico en el 35 % de los pacientes (35 de 100). Se detectaron variantes germinales de SMARCB1 en un 21 % de los pacientes (17 de 81 pacientes evaluables). La tasa de SG a 5 años fue del 45,8 % (± 5,4 %) y la tasa de SSC fue del 35,2 % (± 5,1 %). En un modelo multivariante ajustado, los factores de predicción más significativos para un desenlace negativo fueron la presencia de una variante germinal, metástasis y la ausencia de resección macroscópica total.
Tratamiento del tumor rabdoide extrarrenal (extracraneal)
Las opciones de tratamiento del tumor rabdoide extrarrenal (extracraneal) son las siguientes:[133-135][Nivel de evidencia C1]
- Resección quirúrgica siempre que sea posible.
- Régimen de quimioterapia que se usa para los sarcomas de tejido blando (aunque no haya un régimen único que se acepte como el mejor en la actualidad).
- Radioterapia.
Se documentaron respuestas favorables al alisertib en 4 pacientes con tumores teratoides rabdoides atípicos del SNC.[136] Para obtener más información sobre los tumores teratoides rabdoides atípicos del SNC, consultar Tratamiento del tumor teratoide rabdoide atípico del sistema nervioso central infantil.
Opciones de tratamiento en evaluación clínica
La información en inglés sobre los ensayos clínicos patrocinados por el NCI se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación, se presenta un ejemplo de un ensayo clínico nacional o institucional en curso:
- PEPN2121 (NCT05286801) (Tiragolumab and Atezolizumab for the Treatment of Relapsed or Refractory SMARCB1- or SMARCA4-Deficient Tumors): en este estudio se evalúa la combinación de un anticuerpo dirigido a PD-L1 (atezolizumab) con un anticuerpo dirigido a TIGIT (tiragolumab) en pacientes que tienen tumores con deficiencia de SMARCB1 o SMARCA4. Es posible que los pacientes con tumores rabdoides extrarrenales (extracraneales) sean aptos para participar en este estudio.
Tumor epitelioide perivascular (PEcoma) maligno
Cuadro clínico inicial
Los PEComas se presentan en varios sitios infrecuentes: gastrointestinales, pulmonares, ginecológicos y genitourinarios. Los PEComas de tejido blando, visceral y ginecológico se observan con mayor frecuencia en mujeres de mediana edad y, por lo general, no se relacionan con el complejo de la esclerosis tuberosa.[137] La evolución de la enfermedad puede ser lenta.
Factores de riesgo y características moleculares
Los PEComas benignos son frecuentes en los pacientes con esclerosis tuberosa, un síndrome autosómico dominante que también predispone al cáncer de células renales y los tumores de encéfalo. La causa de la esclerosis tuberosa es la inactivación germinal de TSC1 (9q34) o TSC2 (16p13.3); en los PEComas esporádicos se encuentra inactivación somática de los mismos genes supresores de tumores.[138] La inactivación de cualquiera de estos genes produce una estimulación de la vía de mTOR, lo que fundamenta el tratamiento de los tumores curables no quirúrgicos que tienen una inactivación genética similar (linfangioleiomiomatosis y angiomiolipoma) con inhibidores de mTOR.[139,140] Una proporción baja de los PEComas tiene reordenamientos de TFE3 con fusiones que comprometen varios genes; entre ellos, SFPQ y RAD51B.[141]
Pronóstico
La mayoría de los PEComas tiene un curso clínico benigno, pero se ha informado de comportamiento maligno predecible a partir del tamaño tumoral, el índice mitótico y la presencia de necrosis.[142]
Tratamiento del PEComa
No hay opciones de tratamiento estándar. El tratamiento incluye cirugía y observación seguida de cirugía cuando el tumor es voluminoso.[143]
En tumores con indicios de activación de mTORC1 y pérdida de TSC1 o TSC2, como la linfangioleiomiomatosis y el angiomiolipoma,[139] se ha documentado bien la actividad clínica de los inhibidores de mTOR, como el sirólimus. En una serie de casos pequeña, 3 pacientes adultos con PEComas respondieron al sirólimus.[144]
En un ensayo de fase II, 34 pacientes con PEComas malignos metastásicos o localmente avanzados recibieron tratamiento con partículas de sirólimus unidas a proteínas para suspensión inyectable (unidas a albúmina) (nab-sirólimus). De los 31 pacientes aptos para el análisis de eficacia, 12 (39 %) tuvieron respuesta (1 respuesta completa y 11 respuestas parciales), 16 (52 %) presentaron enfermedad estable y 3 (10 %) enfermedad progresiva. Las respuestas fueron rápidas y duraderas. La mediana de duración de la respuesta no se logró después de una mediana de seguimiento de 2,5 años. De 12 pacientes que respondieron al tratamiento, 7 aún continuaban con el tratamiento (intervalo, de 5,6 meses a más de 47,2 meses). Se realizó el perfil de variantes del tumor en 25 muestras. De 9 pacientes con variantes de TSC2, 8 respondieron al tratamiento, mientras que, de 16 pacientes sin variantes de TSC2, solo 2 respondieron. Además, se observaron respuestas en 10 de 17 pacientes con expresión de fosfo-S6 (pS6). No se observó ninguna respuesta en 8 pacientes sin expresión de pS6. La ausencia de expresión de pS6 refleja la falta de activación de mTORC1.[145][Nivel de evidencia C1] En 2021, la FDA aprobó el nab-sirólimus para pacientes adultos con PEComas.
Sarcoma indiferenciado
Desde 1972 hasta 2006, los pacientes con sarcoma indiferenciado de tejido blando fueron aptos para participar en los ensayos de rabdomiosarcoma coordinados por el grupo IRS y el COG. La justificación fue que los pacientes con sarcoma indiferenciado de tejido blando y los pacientes con rabdomiosarcoma alveolar tienen sitios de enfermedad y desenlaces similares. En los ensayos terapéuticos de adultos con sarcoma de tejido blando, se incluyen a pacientes con sarcoma indiferenciado de tejido blando y otros tipos histológicos, quienes reciben tratamientos semejantes, con ifosfamida y doxorrubicina y, en ocasiones, con otros fármacos quimioterapéuticos, cirugía y radioterapia.
En el ensayo ARST0332 (NCT00346164) del COG, los pacientes con sarcoma indiferenciado de grado alto se trataron con un régimen a base de ifosfamida y doxorrubicina. En el ensayo se notificaron los resultados de los pacientes con sarcoma indiferenciado de grado alto y de los pacientes con todos los sarcomas de tejido blando de grado alto. La tasa estimada de SSC a 5 años fue del 64 % y la tasa de SG fue de 77 % para los sarcomas clasificados como de grado alto por la Fédération Nationale des Centres de Lutte Contre Le Cancer (FNCLC).[5][Nivel de evidencia C1]
En un informe de 32 pacientes con sarcomas indiferenciados de tejido blando inscritos en el ensayo ARST0332 (NCT00346164), la mediana de edad en el momento de la inscripción fue de 13,6 años y 2 tercios de los pacientes eran hombres. Los sitios primarios más frecuentes fueron la región paravertebral y las extremidades. Cinco pacientes presentaron enfermedad metastásica.[146]
- La tasa de SSC a 5 años fue del 71 %, y la tasa de SG fue del 83 %.
- De los 9 niños con enfermedad de riesgo bajo (enfermedad localizada de grado bajo resecada o enfermedad localizada de grado alto <5 cm resecada con márgenes negativos) que se trataron solo con cirugía o radioterapia, la tasa de SSC a 5 años fue del 65 % y la tasa de SG fue del 100 %, lo que indica que los pacientes con enfermedad de riesgo bajo se pueden rescatar si la enfermedad recidiva.
- Los 23 pacientes restantes que tenían enfermedad de riesgo intermedio (tumor de grado alto >5 cm resecado, tumor de grado alto >5 cm sin resecar) o enfermedad de riesgo alto (metástasis a ganglios linfáticos o sitios lejanos) se trataron con quimiorradioterapia y se retrasó la cirugía cuando fue posible. La tasa de SSC a 5 años fue del 73 % y la SG estimada fue del 77 %.
- Las alteraciones en el número de copias fueron frecuentes, por lo general con pérdida de 1p (25 %), ganancia de 1q (25 %), ganancia del cromosoma 8 (25 %) y ganancia del cromosoma 2 (16 %). Estas anomalías se observaron en su mayoría en pacientes con tumores de riesgo intermedio o riesgo alto, y hubo una relación clara entre la pérdida del cromosoma 1p o la ganancia del cromosoma 1q y desenlaces clínicos más precarios. La presencia simultánea de la ganancia de 1q y la pérdida de 1p se relacionó con un desenlace clínico muy desfavorable (tasas de SSC a 5 años y SG del 20 %). Con secuenciación de última generación se identificaron fusiones oncogénicas en 8 de 10 muestras que incluyeron reordenamientos de BCOR y CIC, así como fusiones génicas COL1A1::PDGFB, KIAA1549::BRAF y SAMD5::SASH1.
Sarcoma pleomórfico indiferenciado (histiocitoma fibroso maligno)
En un momento determinado, el histiocitoma fibroso maligno fue el tipo histológico más común en los adultos con sarcomas de tejido blando. Sin embargo, desde que se identificó en los primeros años de la década de 1960, ha persistido la controversia sobre el histiocitoma fibroso maligno en términos de su histogénesis y validez como entidad clinicopatológica. La clasificación de la Organización Mundial de la Salud (OMS) ya no incluye el histiocitoma fibroso maligno como una categoría diagnóstica diferenciada, sino como un subtipo de sarcoma pleomórfico indiferenciado.[147,148]
Esta entidad representa del 2 % al 6 % de todos los sarcomas de tejido blando en los niños.[149]
Cuadro clínico inicial
Estos tumores suelen presentarse entre los 10 y 20 años. En una serie de10 pacientes, la mediana de edad fue de 10 años y, por lo general, el tumor se encontraba en las extremidades. En esta serie, todos los tumores eran localizados y 5 de 9 pacientes (a quienes se les dio seguimiento) estaban vivos y en primera remisión.[149]
En otra serie de 17 pacientes pediátricos con histiocitoma fibroso maligno, la mediana de edad en el momento del diagnóstico fue de 5 años y se presentó compromiso de las extremidades en 8 casos.[150] Todos los pacientes con enfermedad metastásica murieron y 2 pacientes exhibieron una respuesta clínica al régimen de doxorrubicina.
Para obtener más información sobre el tratamiento del histiocitoma fibroso maligno óseo, consultar Tratamiento del osteosarcoma y el sarcoma pleomórfico indiferenciado óseo.
Factores de riesgo
Estos tumores pueden surgir en sitios previamente irradiados o como una neoplasia secundaria en pacientes con retinoblastoma.[151]
Características moleculares
En un análisis de 70 pacientes diagnosticados con histiocitosis fibrosa maligna sin tipo específico, histiocitoma fibroso maligno estoriforme o pleomórfico, sarcoma pleomórfico o sarcoma pleomórfico indiferenciado se observó un cariotipo muy complejo sin anomalías recurrentes específicas.[152]
Los sarcomas indiferenciados con la amplificación 12q13–15, como MDM2 y CDK4, se clasifican mejor como liposarcomas desdiferenciados.[152] No ha se ha definido bien la relación entre este tumor y la familia de tumores indiferenciados o sin clasificar con características morfológicas de células fusiformes.
Tratamiento del sarcoma pleomórfico recién diagnosticado
Para obtener información sobre el tratamiento del sarcoma pleomórfico indiferenciado óseo, consultar Tratamiento del osteosarcoma y el sarcoma pleomórfico indiferenciado óseo.
Tratamiento del sarcoma pleomórfico recidivante o resistente al tratamiento
Las opciones de tratamiento del sarcoma pleomórfico recidivante o resistente al tratamiento son las siguientes:
- Pembrolizumab.
La Sarcoma Alliance for Research through Collaboration dirigió un ensayo de fase II sobre el inhibidor de puntos de control pembrolizumab en pacientes de 18 años o más con sarcoma de tejido blando recidivante.[153][Nivel de evidencia C3]
- De 40 pacientes con sarcoma de tejido blando, 7 (18 %) presentaron una respuesta objetiva.
- De 10 pacientes con sarcoma pleomórfico indiferenciado, 4 (40 %) presentaron una respuesta objetiva, al igual que 2 (20 %) de 10 pacientes con liposarcoma y 1 (10 %) de 10 pacientes con sarcoma sinovial.
- Ninguno de los pacientes con leiomiosarcoma (n = 10) exhibió una respuesta objetiva.
Sarcoma de células redondas indiferenciado
Sarcomas indiferenciados de células redondas pequeñas con alteraciones genéticas en BCOR
Consultar las secciones Sarcomas indiferenciados de células redondas pequeñas con alteraciones genéticas en BCOR y Características genómicas del sarcoma de Ewing en Tratamiento del sarcoma de Ewing y los sarcomas indiferenciados de células redondas pequeñas de hueso y tejido blando.
Sarcomas indiferenciados de células redondas pequeñas con alteraciones genéticas en CIC
Consultar las secciones Sarcomas indiferenciados de células redondas pequeñas con alteraciones genéticas en CIC y Características genómicas del sarcoma de Ewing en Tratamiento del sarcoma de Ewing y los sarcomas indiferenciados de células redondas pequeñas de hueso y tejido blando.
Sarcomas indiferenciados de células redondas pequeñas con fusiones de EWSR1 y genes diferentes a ETS
Consultar la sección Sarcomas indiferenciados de células redondas pequeñas con fusiones de EWSR1 y genes diferentes a ETS en Tratamiento del sarcoma de Ewing y los sarcomas indiferenciados de células redondas pequeñas de hueso y tejido blando.
Bibliografía
- Wilkes D, Charitakis K, Basson CT: Inherited disposition to cardiac myxoma development. Nat Rev Cancer 6 (2): 157-65, 2006. [PUBMED Abstract]
- Carney JA, Young WF: Primary pigmented nodular adrenocortical disease and its associated conditions. Endocrinologist 2: 6-21, 1992.
- Ryan MW, Cunningham S, Xiao SY: Maxillary sinus melanoma as the presenting feature of Carney complex. Int J Pediatr Otorhinolaryngol 72 (3): 405-8, 2008. [PUBMED Abstract]
- Sultan I, Rodriguez-Galindo C, Saab R, et al.: Comparing children and adults with synovial sarcoma in the Surveillance, Epidemiology, and End Results program, 1983 to 2005: an analysis of 1268 patients. Cancer 115 (15): 3537-47, 2009. [PUBMED Abstract]
- Spunt SL, Million L, Chi YY, et al.: A risk-based treatment strategy for non-rhabdomyosarcoma soft-tissue sarcomas in patients younger than 30 years (ARST0332): a Children's Oncology Group prospective study. Lancet Oncol 21 (1): 145-161, 2020. [PUBMED Abstract]
- Wang JG, Li NN: Primary cardiac synovial sarcoma. Ann Thorac Surg 95 (6): 2202-9, 2013. [PUBMED Abstract]
- Chirmade PC, Parikh S, Anand A, et al.: Primary pleuropulmonary synovial sarcoma with brain metastases in a paediatric patient: an unusual presentation. Adv Respir Med 85 (4): 206-210, 2017. [PUBMED Abstract]
- Frazier AA, Franks TJ, Pugatch RD, et al.: From the archives of the AFIP: Pleuropulmonary synovial sarcoma. Radiographics 26 (3): 923-40, 2006 May-Jun. [PUBMED Abstract]
- Essary LR, Vargas SO, Fletcher CD: Primary pleuropulmonary synovial sarcoma: reappraisal of a recently described anatomic subset. Cancer 94 (2): 459-69, 2002. [PUBMED Abstract]
- Pappo AS, Fontanesi J, Luo X, et al.: Synovial sarcoma in children and adolescents: the St Jude Children's Research Hospital experience. J Clin Oncol 12 (11): 2360-6, 1994. [PUBMED Abstract]
- Ferrari A, De Salvo GL, Oberlin O, et al.: Synovial sarcoma in children and adolescents: a critical reappraisal of staging investigations in relation to the rate of metastatic involvement at diagnosis. Eur J Cancer 48 (9): 1370-5, 2012. [PUBMED Abstract]
- Scheer M, Blank B, Bauer S, et al.: Synovial sarcoma disease characteristics and primary tumor sites differ between patient age groups: a report of the Cooperative Weichteilsarkom Studiengruppe (CWS). J Cancer Res Clin Oncol 146 (4): 953-960, 2020. [PUBMED Abstract]
- van de Rijn M, Barr FG, Collins MH, et al.: Absence of SYT-SSX fusion products in soft tissue tumors other than synovial sarcoma. Am J Clin Pathol 112 (1): 43-9, 1999. [PUBMED Abstract]
- Krsková L, Sumerauer D, Stejskalová E, et al.: A novel variant of SYT-SSX1 fusion gene in a case of spindle cell synovial sarcoma. Diagn Mol Pathol 16 (3): 179-83, 2007. [PUBMED Abstract]
- Su L, Sampaio AV, Jones KB, et al.: Deconstruction of the SS18-SSX fusion oncoprotein complex: insights into disease etiology and therapeutics. Cancer Cell 21 (3): 333-47, 2012. [PUBMED Abstract]
- Arnold MA, Arnold CA, Li G, et al.: A unique pattern of INI1 immunohistochemistry distinguishes synovial sarcoma from its histologic mimics. Hum Pathol 44 (5): 881-7, 2013. [PUBMED Abstract]
- Vlenterie M, Ho VK, Kaal SE, et al.: Age as an independent prognostic factor for survival of localised synovial sarcoma patients. Br J Cancer 113 (11): 1602-6, 2015. [PUBMED Abstract]
- Smolle MA, Parry M, Jeys L, et al.: Synovial sarcoma: Do children do better? Eur J Surg Oncol 45 (2): 254-260, 2019. [PUBMED Abstract]
- Okcu MF, Munsell M, Treuner J, et al.: Synovial sarcoma of childhood and adolescence: a multicenter, multivariate analysis of outcome. J Clin Oncol 21 (8): 1602-11, 2003. [PUBMED Abstract]
- Brecht IB, Ferrari A, Int-Veen C, et al.: Grossly-resected synovial sarcoma treated by the German and Italian Pediatric Soft Tissue Sarcoma Cooperative Groups: discussion on the role of adjuvant therapies. Pediatr Blood Cancer 46 (1): 11-7, 2006. [PUBMED Abstract]
- Stanelle EJ, Christison-Lagay ER, Healey JH, et al.: Pediatric and adolescent synovial sarcoma: multivariate analysis of prognostic factors and survival outcomes. Ann Surg Oncol 20 (1): 73-9, 2013. [PUBMED Abstract]
- Lagarde P, Przybyl J, Brulard C, et al.: Chromosome instability accounts for reverse metastatic outcomes of pediatric and adult synovial sarcomas. J Clin Oncol 31 (5): 608-15, 2013. [PUBMED Abstract]
- Stegmaier S, Leuschner I, Poremba C, et al.: The prognostic impact of SYT-SSX fusion type and histological grade in pediatric patients with synovial sarcoma treated according to the CWS (Cooperative Weichteilsarkom Studie) trials. Pediatr Blood Cancer 64 (1): 89-95, 2017. [PUBMED Abstract]
- Scheer M, Dantonello T, Hallmen E, et al.: Primary Metastatic Synovial Sarcoma: Experience of the CWS Study Group. Pediatr Blood Cancer 63 (7): 1198-206, 2016. [PUBMED Abstract]
- Orbach D, Mosseri V, Pissaloux D, et al.: Genomic complexity in pediatric synovial sarcomas (Synobio study): the European pediatric soft tissue sarcoma group (EpSSG) experience. Cancer Med 7 (4): 1384-1393, 2018. [PUBMED Abstract]
- Trassard M, Le Doussal V, Hacène K, et al.: Prognostic factors in localized primary synovial sarcoma: a multicenter study of 128 adult patients. J Clin Oncol 19 (2): 525-34, 2001. [PUBMED Abstract]
- Guillou L, Benhattar J, Bonichon F, et al.: Histologic grade, but not SYT-SSX fusion type, is an important prognostic factor in patients with synovial sarcoma: a multicenter, retrospective analysis. J Clin Oncol 22 (20): 4040-50, 2004. [PUBMED Abstract]
- Ferrari A, Gronchi A, Casanova M, et al.: Synovial sarcoma: a retrospective analysis of 271 patients of all ages treated at a single institution. Cancer 101 (3): 627-34, 2004. [PUBMED Abstract]
- Bahig H, Roberge D, Bosch W, et al.: Agreement among RTOG sarcoma radiation oncologists in contouring suspicious peritumoral edema for preoperative radiation therapy of soft tissue sarcoma of the extremity. Int J Radiat Oncol Biol Phys 86 (2): 298-303, 2013. [PUBMED Abstract]
- Baldini EH, Wang D, Haas RL, et al.: Treatment Guidelines for Preoperative Radiation Therapy for Retroperitoneal Sarcoma: Preliminary Consensus of an International Expert Panel. Int J Radiat Oncol Biol Phys 92 (3): 602-12, 2015. [PUBMED Abstract]
- Ferrari A, Chi YY, De Salvo GL, et al.: Surgery alone is sufficient therapy for children and adolescents with low-risk synovial sarcoma: A joint analysis from the European paediatric soft tissue sarcoma Study Group and the Children's Oncology Group. Eur J Cancer 78: 1-6, 2017. [PUBMED Abstract]
- McGrory JE, Pritchard DJ, Arndt CA, et al.: Nonrhabdomyosarcoma soft tissue sarcomas in children. The Mayo Clinic experience. Clin Orthop (374): 247-58, 2000. [PUBMED Abstract]
- Van Glabbeke M, van Oosterom AT, Oosterhuis JW, et al.: Prognostic factors for the outcome of chemotherapy in advanced soft tissue sarcoma: an analysis of 2,185 patients treated with anthracycline-containing first-line regimens--a European Organization for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group Study. J Clin Oncol 17 (1): 150-7, 1999. [PUBMED Abstract]
- Koscielniak E, Harms D, Henze G, et al.: Results of treatment for soft tissue sarcoma in childhood and adolescence: a final report of the German Cooperative Soft Tissue Sarcoma Study CWS-86. J Clin Oncol 17 (12): 3706-19, 1999. [PUBMED Abstract]
- Pappo AS, Devidas M, Jenkins J, et al.: Phase II trial of neoadjuvant vincristine, ifosfamide, and doxorubicin with granulocyte colony-stimulating factor support in children and adolescents with advanced-stage nonrhabdomyosarcomatous soft tissue sarcomas: a Pediatric Oncology Group Study. J Clin Oncol 23 (18): 4031-8, 2005. [PUBMED Abstract]
- Cecchetto G, Alaggio R, Dall'Igna P, et al.: Localized unresectable non-rhabdo soft tissue sarcomas of the extremities in pediatric age: results from the Italian studies. Cancer 104 (9): 2006-12, 2005. [PUBMED Abstract]
- Pappo AS, Rao BN, Jenkins JJ, et al.: Metastatic nonrhabdomyosarcomatous soft-tissue sarcomas in children and adolescents: the St. Jude Children's Research Hospital experience. Med Pediatr Oncol 33 (2): 76-82, 1999. [PUBMED Abstract]
- Brennan B, Stevens M, Kelsey A, et al.: Synovial sarcoma in childhood and adolescence: a retrospective series of 77 patients registered by the Children's Cancer and Leukaemia Group between 1991 and 2006. Pediatr Blood Cancer 55 (1): 85-90, 2010. [PUBMED Abstract]
- Ferrari A, Miceli R, Rey A, et al.: Non-metastatic unresected paediatric non-rhabdomyosarcoma soft tissue sarcomas: results of a pooled analysis from United States and European groups. Eur J Cancer 47 (5): 724-31, 2011. [PUBMED Abstract]
- Raney RB: Synovial sarcoma in young people: background, prognostic factors, and therapeutic questions. J Pediatr Hematol Oncol 27 (4): 207-11, 2005. [PUBMED Abstract]
- Orbach D, Mc Dowell H, Rey A, et al.: Sparing strategy does not compromise prognosis in pediatric localized synovial sarcoma: experience of the International Society of Pediatric Oncology, Malignant Mesenchymal Tumors (SIOP-MMT) Working Group. Pediatr Blood Cancer 57 (7): 1130-6, 2011. [PUBMED Abstract]
- Ladenstein R, Treuner J, Koscielniak E, et al.: Synovial sarcoma of childhood and adolescence. Report of the German CWS-81 study. Cancer 71 (11): 3647-55, 1993. [PUBMED Abstract]
- Venkatramani R, Xue W, Randall RL, et al.: Synovial Sarcoma in Children, Adolescents, and Young Adults: A Report From the Children's Oncology Group ARST0332 Study. J Clin Oncol 39 (35): 3927-3937, 2021. [PUBMED Abstract]
- Ferrari A, De Salvo GL, Brennan B, et al.: Synovial sarcoma in children and adolescents: the European Pediatric Soft Tissue Sarcoma Study Group prospective trial (EpSSG NRSTS 2005). Ann Oncol 26 (3): 567-72, 2015. [PUBMED Abstract]
- Scheer M, Hallmen E, Vokuhl C, et al.: Pre-operative radiotherapy is associated with superior local relapse-free survival in advanced synovial sarcoma. J Cancer Res Clin Oncol 149 (5): 1717-1731, 2023. [PUBMED Abstract]
- Ferrari A, De Salvo GL, Dall'Igna P, et al.: Salvage rates and prognostic factors after relapse in children and adolescents with initially localised synovial sarcoma. Eur J Cancer 48 (18): 3448-55, 2012. [PUBMED Abstract]
- Scheer M, Dantonello T, Hallmen E, et al.: Synovial Sarcoma Recurrence in Children and Young Adults. Ann Surg Oncol 23 (Suppl 5): 618-626, 2016. [PUBMED Abstract]
- Ferrari A, Orbach D, Bergamaschi L, et al.: Treatment at relapse for synovial sarcoma of children and adolescents: A multi-institutional European retrospective analysis. Pediatr Blood Cancer 71 (7): e31038, 2024. [PUBMED Abstract]
- Dhakal S, Corbin KS, Milano MT, et al.: Stereotactic body radiotherapy for pulmonary metastases from soft-tissue sarcomas: excellent local lesion control and improved patient survival. Int J Radiat Oncol Biol Phys 82 (2): 940-5, 2012. [PUBMED Abstract]
- Lai JP, Robbins PF, Raffeld M, et al.: NY-ESO-1 expression in synovial sarcoma and other mesenchymal tumors: significance for NY-ESO-1-based targeted therapy and differential diagnosis. Mod Pathol 25 (6): 854-8, 2012. [PUBMED Abstract]
- Robbins PF, Kassim SH, Tran TL, et al.: A pilot trial using lymphocytes genetically engineered with an NY-ESO-1-reactive T-cell receptor: long-term follow-up and correlates with response. Clin Cancer Res 21 (5): 1019-27, 2015. [PUBMED Abstract]
- D'Angelo SP, Melchiori L, Merchant MS, et al.: Antitumor Activity Associated with Prolonged Persistence of Adoptively Transferred NY-ESO-1 c259T Cells in Synovial Sarcoma. Cancer Discov 8 (8): 944-957, 2018. [PUBMED Abstract]
- Chbani L, Guillou L, Terrier P, et al.: Epithelioid sarcoma: a clinicopathologic and immunohistochemical analysis of 106 cases from the French sarcoma group. Am J Clin Pathol 131 (2): 222-7, 2009. [PUBMED Abstract]
- Hornick JL, Dal Cin P, Fletcher CD: Loss of INI1 expression is characteristic of both conventional and proximal-type epithelioid sarcoma. Am J Surg Pathol 33 (4): 542-50, 2009. [PUBMED Abstract]
- Knutson SK, Warholic NM, Wigle TJ, et al.: Durable tumor regression in genetically altered malignant rhabdoid tumors by inhibition of methyltransferase EZH2. Proc Natl Acad Sci U S A 110 (19): 7922-7, 2013. [PUBMED Abstract]
- Guzzetta AA, Montgomery EA, Lyu H, et al.: Epithelioid sarcoma: one institution's experience with a rare sarcoma. J Surg Res 177 (1): 116-22, 2012. [PUBMED Abstract]
- Hawkins DS, Spunt SL, Skapek SX, et al.: Children's Oncology Group's 2013 blueprint for research: Soft tissue sarcomas. Pediatr Blood Cancer 60 (6): 1001-8, 2013. [PUBMED Abstract]
- Sparber-Sauer M, Koscielniak E, Vokuhl C, et al.: Epithelioid sarcoma in children, adolescents, and young adults: Localized, primary metastatic and relapsed disease. Treatment results of five Cooperative Weichteilsarkom Studiengruppe (CWS) trials and one registry. Pediatr Blood Cancer 66 (9): e27879, 2019. [PUBMED Abstract]
- Spunt SL, Francotte N, De Salvo GL, et al.: Clinical features and outcomes of young patients with epithelioid sarcoma: an analysis from the Children's Oncology Group and the European paediatric soft tissue Sarcoma Study Group prospective clinical trials. Eur J Cancer 112: 98-106, 2019. [PUBMED Abstract]
- Casanova M, Ferrari A, Collini P, et al.: Epithelioid sarcoma in children and adolescents: a report from the Italian Soft Tissue Sarcoma Committee. Cancer 106 (3): 708-17, 2006. [PUBMED Abstract]
- Gounder M, Schöffski P, Jones RL, et al.: Tazemetostat in advanced epithelioid sarcoma with loss of INI1/SMARCB1: an international, open-label, phase 2 basket study. Lancet Oncol 21 (11): 1423-1432, 2020. [PUBMED Abstract]
- Orbach D, Brennan B, Casanova M, et al.: Paediatric and adolescent alveolar soft part sarcoma: A joint series from European cooperative groups. Pediatr Blood Cancer 60 (11): 1826-32, 2013. [PUBMED Abstract]
- Ferrari A, Sultan I, Huang TT, et al.: Soft tissue sarcoma across the age spectrum: a population-based study from the Surveillance Epidemiology and End Results database. Pediatr Blood Cancer 57 (6): 943-9, 2011. [PUBMED Abstract]
- Wang HW, Qin XJ, Yang WJ, et al.: Alveolar soft part sarcoma of the oral and maxillofacial region: clinical analysis in a series of 18 patients. Oral Surg Oral Med Oral Pathol Oral Radiol 119 (4): 396-401, 2015. [PUBMED Abstract]
- Kayton ML, Meyers P, Wexler LH, et al.: Clinical presentation, treatment, and outcome of alveolar soft part sarcoma in children, adolescents, and young adults. J Pediatr Surg 41 (1): 187-93, 2006. [PUBMED Abstract]
- Sparber-Sauer M, Seitz G, von Kalle T, et al.: Alveolar soft-part sarcoma: Primary metastatic disease and metastatic relapse occurring during long-term follow-up: Treatment results of four Cooperative Weichteilsarkom Studiengruppe (CWS) trials and one registry. Pediatr Blood Cancer 65 (12): e27405, 2018. [PUBMED Abstract]
- Flores RJ, Harrison DJ, Federman NC, et al.: Alveolar soft part sarcoma in children and young adults: A report of 69 cases. Pediatr Blood Cancer 65 (5): e26953, 2018. [PUBMED Abstract]
- Ladanyi M, Lui MY, Antonescu CR, et al.: The der(17)t(X;17)(p11;q25) of human alveolar soft part sarcoma fuses the TFE3 transcription factor gene to ASPL, a novel gene at 17q25. Oncogene 20 (1): 48-57, 2001. [PUBMED Abstract]
- Williams A, Bartle G, Sumathi VP, et al.: Detection of ASPL/TFE3 fusion transcripts and the TFE3 antigen in formalin-fixed, paraffin-embedded tissue in a series of 18 cases of alveolar soft part sarcoma: useful diagnostic tools in cases with unusual histological features. Virchows Arch 458 (3): 291-300, 2011. [PUBMED Abstract]
- Lieberman PH, Brennan MF, Kimmel M, et al.: Alveolar soft-part sarcoma. A clinico-pathologic study of half a century. Cancer 63 (1): 1-13, 1989. [PUBMED Abstract]
- Casanova M, Ferrari A, Bisogno G, et al.: Alveolar soft part sarcoma in children and adolescents: A report from the Soft-Tissue Sarcoma Italian Cooperative Group. Ann Oncol 11 (11): 1445-9, 2000. [PUBMED Abstract]
- Pennacchioli E, Fiore M, Collini P, et al.: Alveolar soft part sarcoma: clinical presentation, treatment, and outcome in a series of 33 patients at a single institution. Ann Surg Oncol 17 (12): 3229-33, 2010. [PUBMED Abstract]
- Wilky BA, Trucco MM, Subhawong TK, et al.: Axitinib plus pembrolizumab in patients with advanced sarcomas including alveolar soft-part sarcoma: a single-centre, single-arm, phase 2 trial. Lancet Oncol 20 (6): 837-848, 2019. [PUBMED Abstract]
- Stacchiotti S, Negri T, Zaffaroni N, et al.: Sunitinib in advanced alveolar soft part sarcoma: evidence of a direct antitumor effect. Ann Oncol 22 (7): 1682-90, 2011. [PUBMED Abstract]
- Jagodzińska-Mucha P, Świtaj T, Kozak K, et al.: Long-term results of therapy with sunitinib in metastatic alveolar soft part sarcoma. Tumori 103 (3): 231-235, 2017. [PUBMED Abstract]
- Cohen JW, Widemann BC, Derdak J, et al.: Cediranib phase-II study in children with metastatic alveolar soft-part sarcoma (ASPS). Pediatr Blood Cancer 66 (12): e27987, 2019. [PUBMED Abstract]
- Judson I, Morden JP, Kilburn L, et al.: Cediranib in patients with alveolar soft-part sarcoma (CASPS): a double-blind, placebo-controlled, randomised, phase 2 trial. Lancet Oncol 20 (7): 1023-1034, 2019. [PUBMED Abstract]
- Kummar S, Allen D, Monks A, et al.: Cediranib for metastatic alveolar soft part sarcoma. J Clin Oncol 31 (18): 2296-302, 2013. [PUBMED Abstract]
- Kim M, Kim TM, Keam B, et al.: A Phase II Trial of Pazopanib in Patients with Metastatic Alveolar Soft Part Sarcoma. Oncologist 24 (1): 20-e29, 2019. [PUBMED Abstract]
- Stacchiotti S, Mir O, Le Cesne A, et al.: Activity of Pazopanib and Trabectedin in Advanced Alveolar Soft Part Sarcoma. Oncologist 23 (1): 62-70, 2018. [PUBMED Abstract]
- Roozendaal KJ, de Valk B, ten Velden JJ, et al.: Alveolar soft-part sarcoma responding to interferon alpha-2b. Br J Cancer 89 (2): 243-5, 2003. [PUBMED Abstract]
- Conde N, Cruz O, Albert A, et al.: Antiangiogenic treatment as a pre-operative management of alveolar soft-part sarcoma. Pediatr Blood Cancer 57 (6): 1071-3, 2011. [PUBMED Abstract]
- Meis-Kindblom JM: Clear cell sarcoma of tendons and aponeuroses: a historical perspective and tribute to the man behind the entity. Adv Anat Pathol 13 (6): 286-92, 2006. [PUBMED Abstract]
- Dim DC, Cooley LD, Miranda RN: Clear cell sarcoma of tendons and aponeuroses: a review. Arch Pathol Lab Med 131 (1): 152-6, 2007. [PUBMED Abstract]
- Blazer DG, Lazar AJ, Xing Y, et al.: Clinical outcomes of molecularly confirmed clear cell sarcoma from a single institution and in comparison with data from the Surveillance, Epidemiology, and End Results registry. Cancer 115 (13): 2971-9, 2009. [PUBMED Abstract]
- Coindre JM, Hostein I, Terrier P, et al.: Diagnosis of clear cell sarcoma by real-time reverse transcriptase-polymerase chain reaction analysis of paraffin embedded tissues: clinicopathologic and molecular analysis of 44 patients from the French sarcoma group. Cancer 107 (5): 1055-64, 2006. [PUBMED Abstract]
- Fujimura Y, Siddique H, Lee L, et al.: EWS-ATF-1 chimeric protein in soft tissue clear cell sarcoma associates with CREB-binding protein and interferes with p53-mediated trans-activation function. Oncogene 20 (46): 6653-9, 2001. [PUBMED Abstract]
- Hisaoka M, Ishida T, Kuo TT, et al.: Clear cell sarcoma of soft tissue: a clinicopathologic, immunohistochemical, and molecular analysis of 33 cases. Am J Surg Pathol 32 (3): 452-60, 2008. [PUBMED Abstract]
- Ferrari A, Casanova M, Bisogno G, et al.: Clear cell sarcoma of tendons and aponeuroses in pediatric patients: a report from the Italian and German Soft Tissue Sarcoma Cooperative Group. Cancer 94 (12): 3269-76, 2002. [PUBMED Abstract]
- Karita M, Tsuchiya H, Yamamoto N, et al.: Caffeine-potentiated chemotherapy for clear cell sarcoma: a report of five cases. Int J Clin Oncol 18 (1): 33-7, 2013. [PUBMED Abstract]
- Schöffski P, Wozniak A, Stacchiotti S, et al.: Activity and safety of crizotinib in patients with advanced clear-cell sarcoma with MET alterations: European Organization for Research and Treatment of Cancer phase II trial 90101 'CREATE'. Ann Oncol 28 (12): 3000-3008, 2017. [PUBMED Abstract]
- Tsuneyoshi M, Enjoji M, Iwasaki H, et al.: Extraskeletal myxoid chondrosarcoma--a clinicopathologic and electron microscopic study. Acta Pathol Jpn 31 (3): 439-47, 1981. [PUBMED Abstract]
- Hachitanda Y, Tsuneyoshi M, Daimaru Y, et al.: Extraskeletal myxoid chondrosarcoma in young children. Cancer 61 (12): 2521-6, 1988. [PUBMED Abstract]
- Enzinger FM, Shiraki M: Extraskeletal myxoid chondrosarcoma. An analysis of 34 cases. Hum Pathol 3 (3): 421-35, 1972. [PUBMED Abstract]
- McGrory JE, Rock MG, Nascimento AG, et al.: Extraskeletal myxoid chondrosarcoma. Clin Orthop Relat Res (382): 185-90, 2001. [PUBMED Abstract]
- Drilon AD, Popat S, Bhuchar G, et al.: Extraskeletal myxoid chondrosarcoma: a retrospective review from 2 referral centers emphasizing long-term outcomes with surgery and chemotherapy. Cancer 113 (12): 3364-71, 2008. [PUBMED Abstract]
- Hisaoka M, Ishida T, Imamura T, et al.: TFG is a novel fusion partner of NOR1 in extraskeletal myxoid chondrosarcoma. Genes Chromosomes Cancer 40 (4): 325-8, 2004. [PUBMED Abstract]
- Stacchiotti S, Pantaleo MA, Astolfi A, et al.: Activity of sunitinib in extraskeletal myxoid chondrosarcoma. Eur J Cancer 50 (9): 1657-64, 2014. [PUBMED Abstract]
- Leavey PJ, Laack NN, Krailo MD, et al.: Phase III Trial Adding Vincristine-Topotecan-Cyclophosphamide to the Initial Treatment of Patients With Nonmetastatic Ewing Sarcoma: A Children's Oncology Group Report. J Clin Oncol 39 (36): 4029-4038, 2021. [PUBMED Abstract]
- Leuschner I, Radig K, Harms D: Desmoplastic small round cell tumor. Semin Diagn Pathol 13 (3): 204-12, 1996. [PUBMED Abstract]
- Kushner BH, LaQuaglia MP, Wollner N, et al.: Desmoplastic small round-cell tumor: prolonged progression-free survival with aggressive multimodality therapy. J Clin Oncol 14 (5): 1526-31, 1996. [PUBMED Abstract]
- Saab R, Khoury JD, Krasin M, et al.: Desmoplastic small round cell tumor in childhood: the St. Jude Children's Research Hospital experience. Pediatr Blood Cancer 49 (3): 274-9, 2007. [PUBMED Abstract]
- Wang LL, Perlman EJ, Vujanic GM, et al.: Desmoplastic small round cell tumor of the kidney in childhood. Am J Surg Pathol 31 (4): 576-84, 2007. [PUBMED Abstract]
- Hayes-Jordan A, LaQuaglia MP, Modak S: Management of desmoplastic small round cell tumor. Semin Pediatr Surg 25 (5): 299-304, 2016. [PUBMED Abstract]
- Arora VC, Price AP, Fleming S, et al.: Characteristic imaging features of desmoplastic small round cell tumour. Pediatr Radiol 43 (1): 93-102, 2013. [PUBMED Abstract]
- Gerald WL, Ladanyi M, de Alava E, et al.: Clinical, pathologic, and molecular spectrum of tumors associated with t(11;22)(p13;q12): desmoplastic small round-cell tumor and its variants. J Clin Oncol 16 (9): 3028-36, 1998. [PUBMED Abstract]
- Slotkin EK, Bowman AS, Levine MF, et al.: Comprehensive Molecular Profiling of Desmoplastic Small Round Cell Tumor. Mol Cancer Res 19 (7): 1146-1155, 2021. [PUBMED Abstract]
- Chow WA, Yee JK, Tsark W, et al.: Recurrent secondary genomic alterations in desmoplastic small round cell tumors. BMC Med Genet 21 (1): 101, 2020. [PUBMED Abstract]
- Lal DR, Su WT, Wolden SL, et al.: Results of multimodal treatment for desmoplastic small round cell tumors. J Pediatr Surg 40 (1): 251-5, 2005. [PUBMED Abstract]
- Philippe-Chomette P, Kabbara N, Andre N, et al.: Desmoplastic small round cell tumors with EWS-WT1 fusion transcript in children and young adults. Pediatr Blood Cancer 58 (6): 891-7, 2012. [PUBMED Abstract]
- Sedig L, Geiger J, Mody R, et al.: Paratesticular desmoplastic small round cell tumors: A case report and review of the literature. Pediatr Blood Cancer 64 (12): , 2017. [PUBMED Abstract]
- Subbiah V, Lamhamedi-Cherradi SE, Cuglievan B, et al.: Multimodality Treatment of Desmoplastic Small Round Cell Tumor: Chemotherapy and Complete Cytoreductive Surgery Improve Patient Survival. Clin Cancer Res 24 (19): 4865-4873, 2018. [PUBMED Abstract]
- Schwarz RE, Gerald WL, Kushner BH, et al.: Desmoplastic small round cell tumors: prognostic indicators and results of surgical management. Ann Surg Oncol 5 (5): 416-22, 1998 Jul-Aug. [PUBMED Abstract]
- Goodman KA, Wolden SL, La Quaglia MP, et al.: Whole abdominopelvic radiotherapy for desmoplastic small round-cell tumor. Int J Radiat Oncol Biol Phys 54 (1): 170-6, 2002. [PUBMED Abstract]
- Osborne EM, Briere TM, Hayes-Jordan A, et al.: Survival and toxicity following sequential multimodality treatment including whole abdominopelvic radiotherapy for patients with desmoplastic small round cell tumor. Radiother Oncol 119 (1): 40-4, 2016. [PUBMED Abstract]
- Atallah V, Honore C, Orbach D, et al.: Role of Adjuvant Radiation Therapy After Surgery for Abdominal Desmoplastic Small Round Cell Tumors. Int J Radiat Oncol Biol Phys 95 (4): 1244-53, 2016. [PUBMED Abstract]
- Hayes-Jordan AA, Coakley BA, Green HL, et al.: Desmoplastic Small Round Cell Tumor Treated with Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy: Results of a Phase 2 Trial. Ann Surg Oncol 25 (4): 872-877, 2018. [PUBMED Abstract]
- Scalabre A, Philippe-Chomette P, Passot G, et al.: Cytoreductive surgery and hyperthermic intraperitoneal perfusion with chemotherapy in children with peritoneal tumor spread: A French nationwide study over 14 years. Pediatr Blood Cancer 65 (4): , 2018. [PUBMED Abstract]
- Honoré C, Atallah V, Mir O, et al.: Abdominal desmoplastic small round cell tumor without extraperitoneal metastases: Is there a benefit for HIPEC after macroscopically complete cytoreductive surgery? PLoS One 12 (2): e0171639, 2017. [PUBMED Abstract]
- Stiles ZE, Murphy AJ, Anghelescu DL, et al.: Desmoplastic Small Round Cell Tumor: Long-Term Complications After Cytoreduction and Hyperthermic Intraperitoneal Chemotherapy. Ann Surg Oncol 27 (1): 171-178, 2020. [PUBMED Abstract]
- Cook RJ, Wang Z, Arora M, et al.: Clinical outcomes of patients with desmoplastic small round cell tumor of the peritoneum undergoing autologous HCT: a CIBMTR retrospective analysis. Bone Marrow Transplant 47 (11): 1455-8, 2012. [PUBMED Abstract]
- Tarek N, Hayes-Jordan A, Salvador L, et al.: Recurrent desmoplastic small round cell tumor responding to an mTOR inhibitor containing regimen. Pediatr Blood Cancer 65 (1): , 2018. [PUBMED Abstract]
- Kodet R, Newton WA, Sachs N, et al.: Rhabdoid tumors of soft tissues: a clinicopathologic study of 26 cases enrolled on the Intergroup Rhabdomyosarcoma Study. Hum Pathol 22 (7): 674-84, 1991. [PUBMED Abstract]
- Biegel JA, Zhou JY, Rorke LB, et al.: Germ-line and acquired mutations of INI1 in atypical teratoid and rhabdoid tumors. Cancer Res 59 (1): 74-9, 1999. [PUBMED Abstract]
- Eaton KW, Tooke LS, Wainwright LM, et al.: Spectrum of SMARCB1/INI1 mutations in familial and sporadic rhabdoid tumors. Pediatr Blood Cancer 56 (1): 7-15, 2011. [PUBMED Abstract]
- Lee RS, Stewart C, Carter SL, et al.: A remarkably simple genome underlies highly malignant pediatric rhabdoid cancers. J Clin Invest 122 (8): 2983-8, 2012. [PUBMED Abstract]
- Teplick A, Kowalski M, Biegel JA, et al.: Educational paper: screening in cancer predisposition syndromes: guidelines for the general pediatrician. Eur J Pediatr 170 (3): 285-94, 2011. [PUBMED Abstract]
- Mitchell SG, Pencheva B, Porter CC: Germline Genetics and Childhood Cancer: Emerging Cancer Predisposition Syndromes and Psychosocial Impacts. Curr Oncol Rep 21 (10): 85, 2019. [PUBMED Abstract]
- Foulkes WD, Kamihara J, Evans DGR, et al.: Cancer Surveillance in Gorlin Syndrome and Rhabdoid Tumor Predisposition Syndrome. Clin Cancer Res 23 (12): e62-e67, 2017. [PUBMED Abstract]
- Morgan KM, Siow VS, Strotmeyer S, et al.: Characteristics and Outcomes in Pediatric Non-Central Nervous System Malignant Rhabdoid Tumors: A Report from the National Cancer Database. Ann Surg Oncol 29 (1): 671-678, 2022. [PUBMED Abstract]
- Sultan I, Qaddoumi I, Rodríguez-Galindo C, et al.: Age, stage, and radiotherapy, but not primary tumor site, affects the outcome of patients with malignant rhabdoid tumors. Pediatr Blood Cancer 54 (1): 35-40, 2010. [PUBMED Abstract]
- Nemes K, Bens S, Kachanov D, et al.: Clinical and genetic risk factors define two risk groups of extracranial malignant rhabdoid tumours (eMRT/RTK). Eur J Cancer 142: 112-122, 2021. [PUBMED Abstract]
- Puri DR, Meyers PA, Kraus DH, et al.: Radiotherapy in the multimodal treatment of extrarenal extracranial malignant rhabdoid tumors. Pediatr Blood Cancer 50 (1): 167-9, 2008. [PUBMED Abstract]
- Madigan CE, Armenian SH, Malogolowkin MH, et al.: Extracranial malignant rhabdoid tumors in childhood: the Childrens Hospital Los Angeles experience. Cancer 110 (9): 2061-6, 2007. [PUBMED Abstract]
- Bourdeaut F, Fréneaux P, Thuille B, et al.: Extra-renal non-cerebral rhabdoid tumours. Pediatr Blood Cancer 51 (3): 363-8, 2008. [PUBMED Abstract]
- Wetmore C, Boyett J, Li S, et al.: Alisertib is active as single agent in recurrent atypical teratoid rhabdoid tumors in 4 children. Neuro Oncol 17 (6): 882-8, 2015. [PUBMED Abstract]
- Folpe A, Inwards C, eds.: Bone and Soft Tissue Pathology: A Volume in the Foundations in Diagnostic Pathology. WB Saunders Co, 2010.
- Martignoni G, Pea M, Reghellin D, et al.: Molecular pathology of lymphangioleiomyomatosis and other perivascular epithelioid cell tumors. Arch Pathol Lab Med 134 (1): 33-40, 2010. [PUBMED Abstract]
- Bissler JJ, McCormack FX, Young LR, et al.: Sirolimus for angiomyolipoma in tuberous sclerosis complex or lymphangioleiomyomatosis. N Engl J Med 358 (2): 140-51, 2008. [PUBMED Abstract]
- Davies DM, Johnson SR, Tattersfield AE, et al.: Sirolimus therapy in tuberous sclerosis or sporadic lymphangioleiomyomatosis. N Engl J Med 358 (2): 200-3, 2008. [PUBMED Abstract]
- Agaram NP, Sung YS, Zhang L, et al.: Dichotomy of Genetic Abnormalities in PEComas With Therapeutic Implications. Am J Surg Pathol 39 (6): 813-25, 2015. [PUBMED Abstract]
- Armah HB, Parwani AV: Perivascular epithelioid cell tumor. Arch Pathol Lab Med 133 (4): 648-54, 2009. [PUBMED Abstract]
- Alaggio R, Cecchetto G, Martignoni G, et al.: Malignant perivascular epithelioid cell tumor in children: description of a case and review of the literature. J Pediatr Surg 47 (6): e31-40, 2012. [PUBMED Abstract]
- Wagner AJ, Malinowska-Kolodziej I, Morgan JA, et al.: Clinical activity of mTOR inhibition with sirolimus in malignant perivascular epithelioid cell tumors: targeting the pathogenic activation of mTORC1 in tumors. J Clin Oncol 28 (5): 835-40, 2010. [PUBMED Abstract]
- Wagner AJ, Ravi V, Riedel RF, et al.: nab-Sirolimus for Patients With Malignant Perivascular Epithelioid Cell Tumors. J Clin Oncol 39 (33): 3660-3670, 2021. [PUBMED Abstract]
- Laetsch TW, Roy A, Xu L, et al.: Undifferentiated Sarcomas in Children Harbor Clinically Relevant Oncogenic Fusions and Gene Copy-Number Alterations: A Report from the Children's Oncology Group. Clin Cancer Res 24 (16): 3888-3897, 2018. [PUBMED Abstract]
- Randall RL, Albritton KH, Ferney BJ, et al.: Malignant fibrous histiocytoma of soft tissue: an abandoned diagnosis. Am J Orthop 33 (12): 602-8, 2004. [PUBMED Abstract]
- Fletcher CDM, Bridge JA, Hogendoorn P, et al., eds.: WHO Classification of Tumours of Soft Tissue and Bone. 4th ed. IARC Press, 2013.
- Alaggio R, Collini P, Randall RL, et al.: Undifferentiated high-grade pleomorphic sarcomas in children: a clinicopathologic study of 10 cases and review of literature. Pediatr Dev Pathol 13 (3): 209-17, 2010 May-Jun. [PUBMED Abstract]
- Daw NC, Billups CA, Pappo AS, et al.: Malignant fibrous histiocytoma and other fibrohistiocytic tumors in pediatric patients: the St. Jude Children's Research Hospital experience. Cancer 97 (11): 2839-47, 2003. [PUBMED Abstract]
- Bjerkehagen B, Smeland S, Walberg L, et al.: Radiation-induced sarcoma: 25-year experience from the Norwegian Radium Hospital. Acta Oncol 47 (8): 1475-82, 2008. [PUBMED Abstract]
- Le Guellec S, Chibon F, Ouali M, et al.: Are peripheral purely undifferentiated pleomorphic sarcomas with MDM2 amplification dedifferentiated liposarcomas? Am J Surg Pathol 38 (3): 293-304, 2014. [PUBMED Abstract]
- Tawbi HA, Burgess M, Bolejack V, et al.: Pembrolizumab in advanced soft-tissue sarcoma and bone sarcoma (SARC028): a multicentre, two-cohort, single-arm, open-label, phase 2 trial. Lancet Oncol 18 (11): 1493-1501, 2017. [PUBMED Abstract]
Tratamiento de los tumores vasculares
Los tumores vasculares abarcan desde los hemangiomas, que siempre se consideran benignos, hasta los angiosarcomas, que son muy malignos.[1] Los tumores vasculares malignos incluyen los siguientes subtipos:
Hemangioendotelioma epitelioide, sin otra indicación
Incidencia y desenlace
En 1982, Weiss y Enzinger describieron por primera vez el hemangioendotelioma epitelioide en el tejido blando. Estos tumores a veces se presentan en pacientes más jóvenes, pero la incidencia máxima se ubica en la cuarta y quinta década de vida. El número de pacientes pediátricos que se mencionan en la bibliografía es reducido.
Los hemangioendoteliomas epitelioides pueden tener una evolución poco activa o de gran malignidad; la tasa de supervivencia general a 5 años es del 73 %. Hay informes de casos de pacientes con lesiones múltiples que no recibieron tratamiento y que presentaron una evolución muy benigna. Sin embargo, otros pacientes presentan una evolución muy maligna. Algunos patólogos han tratado de estratificar a los pacientes para evaluar los riesgos y ajustar el tratamiento, pero se necesita llevar a cabo más investigación sobre este tema.[2-8]
En una serie de casos multiinstitucional se informó de 24 pacientes en edades de 2 a 26 años con hemangioendoteliomas epitelioides.[9][Nivel de evidencia C2] La mayoría de los pacientes presentaba enfermedad multiorgánica. Se observó progresión en el 63 % de los pacientes, con un tiempo medio transcurrido hasta la progresión de 18,4 meses (intervalo, 0–72 meses).
La presencia de efusiones, un tamaño tumoral mayor de 3 cm y un índice mitótico alto (>3 mitosis/50 campos de gran aumento) se han relacionado con desenlaces desfavorables.[4]
Cuadro clínico inicial y evaluación diagnóstica
Los sitios comunes de compromiso son los siguientes: solo el hígado (21 %), el hígado y los pulmones (18 %), solo pulmones (12 %) y solo los huesos (14 %).[4,10,11] El cuadro clínico inicial depende del sitio comprometido, como sigue:
- Hígado: los nódulos hepáticos exhiben vascularización central en la ecografía, lesiones contrastadas en la tomografía computarizada, además de señal T1 baja y señal T2 moderada en las imágenes por resonancia magnética. Estos quizás sean hallazgos fortuitos en pacientes asintomáticos, pero la mayoría de los pacientes por lo general presentan signos y síntomas de colestasis, como prurito, ictericia o ictericia escleral.
- Pulmón: el hemangioendotelioma epitelioide pulmonar a veces es un hallazgo asintomático en una radiografía de tórax o se relaciona con dolor pleural, hemoptisis, anemia y fibrosis.
- Huesos: las metástasis óseas a veces se relacionan con una fractura patológica. En las radiografías, hay lesiones osteolíticas bien definidas, múltiples o solitarias.
- Tejido blando: el 30 % de los casos con compromiso de tejido blando se vinculan con metástasis. Cuando se presenta, la enfermedad metastásica puede ser de gran malignidad y tener escasa respuesta a la quimioterapia.
- Piel: las lesiones cutáneas se presentan en forma sobresaliente y nodular, o en placas calientes de color marrón rojizo.
Alteraciones genómicas y características histopatológicas
En la mayoría de los pacientes se encontraron las fusiones génicas WWTR1::CAMTA1. Con menos frecuencia, se notificaron las fusiones génicas YAP1::TFE3.[2] No es posible dirigir el efecto de los medicamentos actuales de forma específica a estas fusiones. Se ha descrito monoclonalidad en las lesiones hepáticas múltiples, lo que indicaría un proceso metastásico.
Desde el punto de vista histológico, estas lesiones se caracterizan como lesiones epitelioides dispuestas en nidos, hebras y trabéculas, con pocos espacios vasculares. Las características que quizá se relacionen con un comportamiento clínico muy maligno incluyen atipia celular, una o más mitosis por 10 campos de gran aumento, un incremento en la proporción de células fusiformes, necrosis focal y formación ósea metaplásica.[4]
Tratamiento del hemangioendotelioma epitelioide
Las opciones de tratamiento del hemangioendotelioma epitelioide son las siguientes:
- Observación.
- Cirugía.
- Inmunoterapia.
- Terapia dirigida.
- Quimioterapia.
- Radioterapia.
Para los casos de poca malignidad, se justifica la observación. La cirugía se realiza siempre que la resección sea posible. El trasplante de hígado se ha utilizado para lesiones hepáticas muy malignas, con metástasis o sin estas.[4,12-14]
Para los casos de gran malignidad se han usado una variedad de fármacos, como interferón, talidomida, sorafenib, pazopanib y sirólimus.[12,15,16] Los casos de una malignidad aún mayor se tratan con quimioterapia del tipo que se usa para el angiosarcoma.
En una serie de casos multiinstitucional, se informó de 24 pacientes en edades de 2 a 26 años con hemangioendotelioma epitelioide.[9][Nivel de evidencia C2]
- De los pacientes que se trataron con sirólimus, 3 presentaron una enfermedad estable o respuestas parciales por más de 2,5 años.
Un informe de 2020 sobre el tratamiento con sirólimus en niños tuvo como objetivo aportar información a la experiencia previa con sirólimus en adultos. En una revisión retrospectiva, se identificaron 6 pacientes pediátricos con hemangioendotelioma epitelioide diseminado tratados con sirólimus.[17]
- En 4 de los 6 pacientes, se observaron respuestas parciales o estabilización de la enfermedad.
En un informe del European paediatric Soft Tissue Sarcoma Study Group se analizaron 10 pacientes con enfermedad localizada y 1 paciente con enfermedad metastásica de dos estudios.[18] La mediana de edad fue de 14,3 años (intervalo, 9,0–18,8 años). El tratamiento local fue la cirugía primaria inicial en 7 de los pacientes y los otros 5 recibieron terapia sistémica. Ninguno recibió radioterapia.
- Al cabo de una mediana de seguimiento de 50 meses (intervalo, 6–176 meses), 9 pacientes permanecían con vida y sin tratamiento y 2 habían muerto.
- La tasa de supervivencia sin progresión a 5 años fue del 77,1 % (intervalo de confianza del 95 % [IC], 34,5–93,9 %).
- La tasa de supervivencia general fue del 74,1 % (IC 95 %, 28,1–93,0 %).
Los pacientes o familiares que deseen explorar otras terapias para la enfermedad deben contemplar la participación en ensayos con abordajes terapéuticos nuevos porque no hay fármacos estándar que hayan demostrado actividad clínica significativa.
Independientemente de si se decide continuar con una terapia dirigida a la enfermedad en el momento de la progresión, el objetivo principal del tratamiento sigue siendo el cuidado paliativo. Esto garantiza que se aumenta al máximo la calidad de vida mientras se intenta reducir el estrés de la enfermedad terminal.
Opciones de tratamiento en evaluación clínica para el hemangioendotelioma epitelioide
La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Angiosarcoma
Incidencia y cuadro clínico inicial
Los angiosarcomas son tumores vasculares raros (representan el 2 % de los sarcomas) y de gran malignidad que se presentan en cualquier parte del cuerpo, pero son más comunes en los tejidos blandos. Se estima que la incidencia del angiosarcoma es de 2 casos por millón de personas. En los Estados Unidos, cada año afecta a alrededor de 600 personas que suelen tener entre 60 y 70 años.[19]
Los angiosarcomas son muy infrecuentes en los niños. No está claro si las características fisiopatológicas de los angiosarcomas en niños difieren de la de los angiosarcomas en adultos. Se notificaron casos en recién nacidos y lactantes mayores que presentaron al inicio lesiones cutáneas y hepáticas múltiples, algunas de las cuales expresan GLUT1.[20-23] La mayoría de los angiosarcomas comprometen la piel y el tejido blando superficial, aunque también afectan el hígado, el bazo y el pulmón; con poca frecuencia afectan el hueso.
La nomenclatura de estas lesiones hepáticas ha sido difícil y confusa debido al uso de la terminología obsoleta propuesta en 1971 (por ejemplo, hemangioendotelioma tipo 1: hemangioma infantil; hemangioendotelioma tipo II: angiosarcoma de grado bajo; hemangioendotelioma de tipo III: angiosarcoma de grado alto).[21] En un informe de 8 casos de angiosarcomas hepáticos en niños, se resaltó el uso indebido del término hemangioendotelioma así como la importancia del diagnóstico y tratamiento tempranos de estos tumores.[24]
Factores de riesgo
Los factores de riesgo establecidos incluyen los siguientes:[25]
- Exposición al cloruro de vinilo.
- Exposición a la radiación.
- Linfedema crónico por cualquier causa, incluso el síndrome de Stewart-Treves.
Alteraciones genómicas y características histopatológicas
Los angiosarcomas son tumores en su mayoría aneuploides. Los escasos casos de angiosarcoma que surgen de lesiones benignas, como los hemangiomas, siguen una vía distintiva que requiere investigación. En el angiosarcoma inducido por radiación se observa amplificación de MYC. Se observaron variantes de KDR y amplificaciones de FLT4 con una frecuencia inferior al 50 %.[25]
Es posible que el diagnóstico histopatológico sea muy difícil porque a veces hay áreas de atipia variada. Una característica común del angiosarcoma es una red irregular de canales en un modelo de disección a lo largo de haces de colágeno dérmico. Hay variación de forma y tamaño celular, mitosis, múltiples capas de endotelio y formación papilar. También puede haber células epitelioides. La necrosis y la hemorragia son comunes. Los tumores se tiñen para analizar el factor VIII, el CD31 y el CD34. Algunas lesiones hepáticas se parecen a los hemangiomas infantiles y tienen expresión focal de GLUT1.[21]
Tratamiento del angiosarcoma
Las opciones de tratamiento del angiosarcoma son las siguientes:
Cirugía
Es posible curar la enfermedad localizada mediante cirugía radical. La resección quirúrgica completa es fundamental para la supervivencia a largo plazo de pacientes con angiosarcomas y linfangiosarcomas, pese a la evidencia de que el tumor se encoge en algunos pacientes tratados con terapia local o sistémica.[22,26-28] Hay poca información sobre el uso del trasplante de hígado para los angiosarcomas localizados.[29][Nivel de evidencia C1]
Evidencia (cirugía):
- En una revisión de 222 pacientes (mediana de edad, 62 años; intervalo, 15–90 años), se notificó lo siguiente:[28]
- Una tasa general de supervivencia específica de la enfermedad (SEE) del 38 % a los 5 años.
- La tasa de SEE a 5 años fue del 44 % en 138 pacientes con tumores localizados resecados, pero solo del 16 % en 43 pacientes con metástasis en el momento del diagnóstico.
- En un informe de caso se indicó que el trasplante de hígado tal vez contribuya a prolongar la supervivencia sin enfermedad.[30][Nivel de evidencia C2]
Radioterapia
La enfermedad localizada, en especial los angiosarcomas cutáneos, se pueden tratar con radioterapia o quimioterapia combinada (por ejemplo, paclitaxel) y radioterapia.[31] La mayoría de estos casos notificados son en adultos.[32] Cuando se usa radiación, las dosis son altas (50–70 Gy), los volúmenes cutáneos son extensos debido a la naturaleza infiltrante de la enfermedad y, a menudo, se incluyen ganglios regionales (drenantes), incluso si son negativos desde el punto de vista clínico.[33,34] Debido a estos factores, la radioterapia se usa muy poco para el tratamiento de los niños.
Cirugía, quimioterapia y radioterapia
El tratamiento multimodal con cirugía, quimioterapia sistémica y radioterapia se usa para la enfermedad metastásica, aunque rara vez es curativo.[34,35] El objetivo del tratamiento en pacientes con angiosarcomas metastásicos es el control de la enfermedad. La supervivencia sin progresión publicada es de entre 3 y 7 meses,[36] y la mediana de supervivencia general (SG) es de 14 a 18 meses.[37] En adultos y niños, las tasas de SG a 5 años son del 20 % al 35 %.[22,23,38]
Un niño con diagnóstico de angiosarcoma secundario a una transformación maligna de un hemangioma infantil, respondió al tratamiento con bevacizumab (anticuerpo monoclonal contra el factor de crecimiento endotelial vascular) combinado con quimioterapia sistémica.[20,35]
Los inhibidores biológicos de la angiogénesis han mostrado actividad en adultos con angiosarcomas.[21,38]
Hay un informe de caso de un paciente pediátrico con angiosarcoma cardiaco metastásico que recibió tratamiento exitoso con quimioterapia convencional, radiación, cirugía y terapias dirigidas, que incluyeron el pazopanib.[39]
Cuidados paliativos
Independientemente de si se decide continuar con una terapia dirigida a la enfermedad en el momento de la progresión, el objetivo principal del tratamiento siguen siendo los cuidados paliativos. Esto garantiza que se aumenta al máximo la calidad de vida mientras se intenta reducir el estrés de la enfermedad terminal.
Opciones de tratamiento en evaluación clínica para el angiosarcoma
Los pacientes o familiares que deseen explorar otras terapias para la enfermedad deben contemplar la participación en ensayos con abordajes terapéuticos nuevos porque no hay fármacos estándar que hayan demostrado actividad clínica significativa.
La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Coffin CM, Dehner LP: Vascular tumors in children and adolescents: a clinicopathologic study of 228 tumors in 222 patients. Pathol Annu 28 Pt 1: 97-120, 1993. [PUBMED Abstract]
- Mehrabi A, Kashfi A, Fonouni H, et al.: Primary malignant hepatic epithelioid hemangioendothelioma: a comprehensive review of the literature with emphasis on the surgical therapy. Cancer 107 (9): 2108-21, 2006. [PUBMED Abstract]
- Haro A, Saitoh G, Tamiya S, et al.: Four-year natural clinical course of pulmonary epithelioid hemangioendothelioma without therapy. Thorac Cancer 6 (4): 544-7, 2015. [PUBMED Abstract]
- Sardaro A, Bardoscia L, Petruzzelli MF, et al.: Epithelioid hemangioendothelioma: an overview and update on a rare vascular tumor. Oncol Rev 8 (2): 259, 2014. [PUBMED Abstract]
- Dong K, Wang XX, Feng JL, et al.: Pathological characteristics of liver biopsies in eight patients with hepatic epithelioid hemangioendothelioma. Int J Clin Exp Pathol 8 (9): 11015-23, 2015. [PUBMED Abstract]
- Adams DM, Hammill A: Other vascular tumors. Semin Pediatr Surg 23 (4): 173-7, 2014. [PUBMED Abstract]
- Xiao Y, Wang C, Song Y, et al.: Primary epithelioid hemangioendothelioma of the kidney: the first case report in a child and literature review. Urology 82 (4): 925-7, 2013. [PUBMED Abstract]
- Reich S, Ringe H, Uhlenberg B, et al.: Epithelioid hemangioendothelioma of the lung presenting with pneumonia and heart rhythm disturbances in a teenage girl. J Pediatr Hematol Oncol 32 (4): 274-6, 2010. [PUBMED Abstract]
- Cournoyer E, Al-Ibraheemi A, Engel E, et al.: Clinical characterization and long-term outcomes in pediatric epithelioid hemangioendothelioma. Pediatr Blood Cancer 67 (2): e28045, 2020. [PUBMED Abstract]
- Daller JA, Bueno J, Gutierrez J, et al.: Hepatic hemangioendothelioma: clinical experience and management strategy. J Pediatr Surg 34 (1): 98-105; discussion 105-6, 1999. [PUBMED Abstract]
- Ackermann O, Fabre M, Franchi S, et al.: Widening spectrum of liver angiosarcoma in children. J Pediatr Gastroenterol Nutr 53 (6): 615-9, 2011. [PUBMED Abstract]
- Raheja A, Suri A, Singh S, et al.: Multimodality management of a giant skull base hemangioendothelioma of the sphenopetroclival region. J Clin Neurosci 22 (9): 1495-8, 2015. [PUBMED Abstract]
- Ahmad N, Adams DM, Wang J, et al.: Hepatic epithelioid hemangioendothelioma in a patient with hemochromatosis. J Natl Compr Canc Netw 12 (9): 1203-7, 2014. [PUBMED Abstract]
- Otte JB, Zimmerman A: The role of liver transplantation for pediatric epithelioid hemangioendothelioma. Pediatr Transplant 14 (3): 295-7, 2010. [PUBMED Abstract]
- Stacchiotti S, Provenzano S, Dagrada G, et al.: Sirolimus in Advanced Epithelioid Hemangioendothelioma: A Retrospective Case-Series Analysis from the Italian Rare Cancer Network Database. Ann Surg Oncol 23 (9): 2735-44, 2016. [PUBMED Abstract]
- Semenisty V, Naroditsky I, Keidar Z, et al.: Pazopanib for metastatic pulmonary epithelioid hemangioendothelioma-a suitable treatment option: case report and review of anti-angiogenic treatment options. BMC Cancer 15: 402, 2015. [PUBMED Abstract]
- Engel ER, Cournoyer E, Adams DM, et al.: A Retrospective Review of the Use of Sirolimus for Pediatric Patients With Epithelioid Hemangioendothelioma. J Pediatr Hematol Oncol 42 (8): e826-e829, 2020. [PUBMED Abstract]
- Orbach D, Van Noesel MM, Brennan B, et al.: Epithelioid hemangioendothelioma in children: The European Pediatric Soft Tissue Sarcoma Study Group experience. Pediatr Blood Cancer 69 (10): e29882, 2022. [PUBMED Abstract]
- Cioffi A, Reichert S, Antonescu CR, et al.: Angiosarcomas and other sarcomas of endothelial origin. Hematol Oncol Clin North Am 27 (5): 975-88, 2013. [PUBMED Abstract]
- Jeng MR, Fuh B, Blatt J, et al.: Malignant transformation of infantile hemangioma to angiosarcoma: response to chemotherapy with bevacizumab. Pediatr Blood Cancer 61 (11): 2115-7, 2014. [PUBMED Abstract]
- Dehner LP, Ishak KG: Vascular tumors of the liver in infants and children. A study of 30 cases and review of the literature. Arch Pathol 92 (2): 101-11, 1971. [PUBMED Abstract]
- Ferrari A, Casanova M, Bisogno G, et al.: Malignant vascular tumors in children and adolescents: a report from the Italian and German Soft Tissue Sarcoma Cooperative Group. Med Pediatr Oncol 39 (2): 109-14, 2002. [PUBMED Abstract]
- Deyrup AT, Miettinen M, North PE, et al.: Pediatric cutaneous angiosarcomas: a clinicopathologic study of 10 cases. Am J Surg Pathol 35 (1): 70-5, 2011. [PUBMED Abstract]
- Grassia KL, Peterman CM, Iacobas I, et al.: Clinical case series of pediatric hepatic angiosarcoma. Pediatr Blood Cancer 64 (11): , 2017. [PUBMED Abstract]
- Elliott P, Kleinschmidt I: Angiosarcoma of the liver in Great Britain in proximity to vinyl chloride sites. Occup Environ Med 54 (1): 14-8, 1997. [PUBMED Abstract]
- Lezama-del Valle P, Gerald WL, Tsai J, et al.: Malignant vascular tumors in young patients. Cancer 83 (8): 1634-9, 1998. [PUBMED Abstract]
- Fata F, O'Reilly E, Ilson D, et al.: Paclitaxel in the treatment of patients with angiosarcoma of the scalp or face. Cancer 86 (10): 2034-7, 1999. [PUBMED Abstract]
- Lahat G, Dhuka AR, Hallevi H, et al.: Angiosarcoma: clinical and molecular insights. Ann Surg 251 (6): 1098-106, 2010. [PUBMED Abstract]
- Orlando G, Adam R, Mirza D, et al.: Hepatic hemangiosarcoma: an absolute contraindication to liver transplantation--the European Liver Transplant Registry experience. Transplantation 95 (6): 872-7, 2013. [PUBMED Abstract]
- Aldén J, Baecklund F, Psaros Einberg A, et al.: Is primary hepatic angiosarcoma in children an indication for liver transplantation?-A single-centre experience and review of the literature. Pediatr Transplant 25 (8): e14095, 2021. [PUBMED Abstract]
- Roy A, Gabani P, Davis EJ, et al.: Concurrent paclitaxel and radiation therapy for the treatment of cutaneous angiosarcoma. Clin Transl Radiat Oncol 27: 114-120, 2021. [PUBMED Abstract]
- Sanada T, Nakayama H, Irisawa R, et al.: Clinical outcome and dose volume evaluation in patients who undergo brachytherapy for angiosarcoma of the scalp and face. Mol Clin Oncol 6 (3): 334-340, 2017. [PUBMED Abstract]
- Guadagnolo BA, Zagars GK, Araujo D, et al.: Outcomes after definitive treatment for cutaneous angiosarcoma of the face and scalp. Head Neck 33 (5): 661-7, 2011. [PUBMED Abstract]
- Scott MT, Portnow LH, Morris CG, et al.: Radiation therapy for angiosarcoma: the 35-year University of Florida experience. Am J Clin Oncol 36 (2): 174-80, 2013. [PUBMED Abstract]
- Dickson MA, D'Adamo DR, Keohan ML, et al.: Phase II Trial of Gemcitabine and Docetaxel with Bevacizumab in Soft Tissue Sarcoma. Sarcoma 2015: 532478, 2015. [PUBMED Abstract]
- North PE, Waner M, Mizeracki A, et al.: A unique microvascular phenotype shared by juvenile hemangiomas and human placenta. Arch Dermatol 137 (5): 559-70, 2001. [PUBMED Abstract]
- Boye E, Yu Y, Paranya G, et al.: Clonality and altered behavior of endothelial cells from hemangiomas. J Clin Invest 107 (6): 745-52, 2001. [PUBMED Abstract]
- Ravi V, Patel S: Vascular sarcomas. Curr Oncol Rep 15 (4): 347-55, 2013. [PUBMED Abstract]
- Koo J, Knight-Perry J, Galambos C, et al.: Pediatric Metastatic Cardiac Angiosarcoma Successfully Treated With Multimodal Therapy: Case Report and Review of Literature. J Pediatr Hematol Oncol 43 (2): e203-e206, 2021. [PUBMED Abstract]
Tratamiento del sarcoma de tejido blando infantil metastásico
Las opciones de tratamiento del sarcoma de tejido blando infantil metastásico son las siguientes:
- Tratamiento multimodal con quimioterapia, radioterapia y resección quirúrgica de las metástasis pulmonares.
Para obtener información sobre las opciones de tratamiento, consultar las secciones sobre cada tipo de tumor en este resumen.
El pronóstico para los niños con sarcoma metastásico de tejido blando es precario.[1-6] Estos niños deben recibir tratamiento combinado con quimioterapia, radioterapia y resección quirúrgica de las metástasis pulmonares. En un ensayo prospectivo aleatorizado, la quimioterapia con vincristina, dactinomicina, doxorrubicina y ciclofosfamida, con dacarbazina o sin esta, produjo respuestas favorables de los tumores en un tercio de los pacientes con enfermedad irresecable o metastásica. Sin embargo, la tasa estimada de supervivencia a 4 años fue baja. Menos de un tercio de los niños sobrevivió.[6-8]
La radioterapia.dirigida (radioterapia estereotáctica) es una alternativa para los sitios de metástasis; en particular, el pulmón.[9] La radioterapia dirigida también es una opción para el control local o de los sitios de metástasis, como los pulmones, los huesos o el encéfalo,[10,11] Sobre todo, en pacientes en los que la morbilidad de la resección es motivo de preocupación o cuya esperanza de vida es limitada.[9]
En un ensayo prospectivo de niños con sarcoma de tejido blando metastásico, los pacientes se asignaron al azar a recibir quimioterapia multifarmacológica con adición de bevacizumab o sin este.[12] No hubo diferencia en las tasas de supervivencia sin complicaciones o de supervivencia general entre los dos grupos del estudio.
Metástasis pulmonares
En general, se debe considerar el uso de un procedimiento quirúrgico con resección de toda la enfermedad macroscópica, en niños con metástasis pulmonares aisladas.[13] En los pacientes con metástasis pulmonares múltiples o recidivantes, es posible realizar procedimientos quirúrgicos adicionales si se considera que la morbilidad es aceptable. En una revisión retrospectiva, los pacientes con sarcoma sinovial y metástasis pulmonares que se sometieron a resección completa de todas las lesiones pulmonares metastásicas tuvieron mejor supervivencia que aquellos con resecciones incompletas.[13][Nivel de evidencia C1] La segmentectomía formal, la lobectomía y la disección de ganglios linfáticos mediastínicos son innecesarias.[14]
Un abordaje alternativo es la radioterapia enfocada (radioterapia estereotáctica fraccionada), que se usó de forma exitosa para controlar lesiones en adultos. La tasa estimada de supervivencia a 5 años después de la toracotomía con metástasectomía pulmonar osciló entre el 10 % y el 58 % en estudios en adultos.[9]
Bibliografía
- Demetri GD, Elias AD: Results of single-agent and combination chemotherapy for advanced soft tissue sarcomas. Implications for decision making in the clinic. Hematol Oncol Clin North Am 9 (4): 765-85, 1995. [PUBMED Abstract]
- Elias A, Ryan L, Sulkes A, et al.: Response to mesna, doxorubicin, ifosfamide, and dacarbazine in 108 patients with metastatic or unresectable sarcoma and no prior chemotherapy. J Clin Oncol 7 (9): 1208-16, 1989. [PUBMED Abstract]
- Edmonson JH, Ryan LM, Blum RH, et al.: Randomized comparison of doxorubicin alone versus ifosfamide plus doxorubicin or mitomycin, doxorubicin, and cisplatin against advanced soft tissue sarcomas. J Clin Oncol 11 (7): 1269-75, 1993. [PUBMED Abstract]
- Rao BN: Nonrhabdomyosarcoma in children: prognostic factors influencing survival. Semin Surg Oncol 9 (6): 524-31, 1993 Nov-Dec. [PUBMED Abstract]
- deCou JM, Rao BN, Parham DM, et al.: Malignant peripheral nerve sheath tumors: the St. Jude Children's Research Hospital experience. Ann Surg Oncol 2 (6): 524-9, 1995. [PUBMED Abstract]
- Pappo AS, Rao BN, Jenkins JJ, et al.: Metastatic nonrhabdomyosarcomatous soft-tissue sarcomas in children and adolescents: the St. Jude Children's Research Hospital experience. Med Pediatr Oncol 33 (2): 76-82, 1999. [PUBMED Abstract]
- Pratt CB, Pappo AS, Gieser P, et al.: Role of adjuvant chemotherapy in the treatment of surgically resected pediatric nonrhabdomyosarcomatous soft tissue sarcomas: A Pediatric Oncology Group Study. J Clin Oncol 17 (4): 1219, 1999. [PUBMED Abstract]
- Pratt CB, Maurer HM, Gieser P, et al.: Treatment of unresectable or metastatic pediatric soft tissue sarcomas with surgery, irradiation, and chemotherapy: a Pediatric Oncology Group study. Med Pediatr Oncol 30 (4): 201-9, 1998. [PUBMED Abstract]
- Dhakal S, Corbin KS, Milano MT, et al.: Stereotactic body radiotherapy for pulmonary metastases from soft-tissue sarcomas: excellent local lesion control and improved patient survival. Int J Radiat Oncol Biol Phys 82 (2): 940-5, 2012. [PUBMED Abstract]
- Howard TP, Boyle PJ, Marcus KJ, et al.: Clinical outcomes for pediatric patients receiving radiotherapy for solid tumor central nervous system metastases. Pediatr Blood Cancer 68 (12): e29331, 2021. [PUBMED Abstract]
- Cameron AL, Elze MC, Casanova M, et al.: The Impact of Radiation Therapy in Children and Adolescents With Metastatic Rhabdomyosarcoma. Int J Radiat Oncol Biol Phys 111 (4): 968-978, 2021. [PUBMED Abstract]
- Ferrari A, Merks JHM, Chisholm JC, et al.: Outcomes of metastatic non-rhabdomyosarcoma soft tissue sarcomas (NRSTS) treated within the BERNIE study: a randomised, phase II study evaluating the addition of bevacizumab to chemotherapy. Eur J Cancer 130: 72-80, 2020. [PUBMED Abstract]
- Stanelle EJ, Christison-Lagay ER, Wolden SL, et al.: Pulmonary metastasectomy in pediatric/adolescent patients with synovial sarcoma: an institutional review. J Pediatr Surg 48 (4): 757-63, 2013. [PUBMED Abstract]
- Putnam JB, Roth JA: Surgical treatment for pulmonary metastases from sarcoma. Hematol Oncol Clin North Am 9 (4): 869-87, 1995. [PUBMED Abstract]
Tratamiento del sarcoma de tejido blando infantil progresivo o recidivante
Con la posible excepción de los lactantes con fibrosarcoma infantil, el pronóstico de los pacientes con enfermedad progresiva o recidivante es precario. No hay ensayos prospectivos en los que se demuestre que la mejora del control local de los sarcomas de tejido blando en los niños mejorará la supervivencia. Por consiguiente, el tratamiento se debe individualizar según el sitio de recidiva, las características biológicas del tumor (por ejemplo, grado, invasión y tamaño), tratamientos previos y consideraciones específicas del paciente. Todos los pacientes con tumores recidivantes deberán considerar la opción de participar en ensayos clínicos.
En los resultados publicados de 2 estudios se abordan los desenlaces de niños con sarcoma sinovial recidivante. En un estudio, la mayoría de pacientes presentó una recidiva a distancia (29 de 44 pacientes),[1] mientras que en el segundo estudio, la mayoría de los pacientes presentó una recidiva local (27 de 37 pacientes).[2] La recidiva a distancia resultó ser una variable de pronóstico precario, mientras que la resecabilidad del tumor en el momento de la recidiva (según se manifestó por recidiva en una extremidad) se relacionó con desenlaces más favorables en ambos estudios.
La resección es el tratamiento estándar de los sarcomas de tejido blando infantil no rabdomiosarcomatosos recidivantes. Si el paciente aún no ha recibido radioterapia, se debe considerar el uso de radiación posoperatoria tras la resección local del tumor recidivante. En adultos se ha evaluado el tratamiento con procedimientos para conservar una de las extremidades acompañados de braquiterapia posoperatoria, pero no se ha estudiado de forma extensa en niños. La amputación quizás sea la única opción terapéutica para algunos niños con sarcoma de extremidad que recibieron radioterapia antes.
Las opciones de tratamiento de la enfermedad progresiva o recidivante son las siguientes:
Cirugía
Evidencia (cirugía):
- Resección quirúrgica de una recidiva local.
- En una revisión italiana de 73 pacientes con tumores malignos de vaina de nervio periférico recidivantes, se encontró que la mayoría de las recaídas eran locales.[3][Nivel de evidencia C1]
- El análisis multivariante mostró que los factores vinculados a una mejor supervivencia fueron ausencia de invasión tumoral en el momento del diagnóstico inicial (estadio T1), recidiva más de 12 meses después del diagnóstico inicial y logro de una segunda respuesta completa con resección quirúrgica de las recidivas.
- Solo el 15,8 % de los pacientes sometidos a resecciones quirúrgicas completas de las recidivas locales estaban vivos a los 5 años.
- En una revisión italiana de 73 pacientes con tumores malignos de vaina de nervio periférico recidivantes, se encontró que la mayoría de las recaídas eran locales.[3][Nivel de evidencia C1]
- Resección quirúrgica de una recidiva pulmonar aislada.
- En algunos pacientes, es posible que la metastasectomía pulmonar logre un control prolongado de la enfermedad.[4]
- En un análisis retrospectivo grande de pacientes con sarcoma de tejido blando recidivante, se observó que la recaída local aislada tuvo un pronóstico más favorable y que la resección de metástasis pulmonares mejoró la probabilidad de supervivencia.[5]
- En 31 niños y adolescentes menores de 23 años con metástasis pulmonares de sarcoma sinovial, la resección completa de metástasis pulmonares prolongó la supervivencia, en comparación con otros 10 pacientes que no eran aptos para una metastasectomía.[6][Nivel de evidencia C1]
- En algunos pacientes, es posible que la metastasectomía pulmonar logre un control prolongado de la enfermedad.[4]
- Resección quirúrgica de la recidiva local seguida de radioterapia o braquiterapia (si no se administró antes radioterapia).
- Amputación de extremidad (solo para algunos niños con sarcomas de extremidades que recibieron antes radioterapia).
Quimioterapia
Los fármacos quimioterapéuticos que se usan para tratar los sarcomas de tejido blando recidivantes son los siguientes:
Inhibidores de tirosina–cinasas
Evidencia (inhibidores de tirosina–cinasas):
- Pazopanib. Se aprobó el uso de pazopanib en el tratamiento de pacientes con sarcoma de tejido blando recidivante. El ensayo clínico que llevó a la aprobación se limitó a pacientes adultos. En el estudio se demostró la estabilización de la enfermedad y un aumento del tiempo transcurrido hasta la progresión, pero no se observó ninguna mejora de la supervivencia general.[11]
- En un ensayo de fase I de pazopanib, se notificó una respuesta parcial en 1 paciente con tumor desmoplásico de células redondas pequeñas y se notificó una estabilización prolongada de la enfermedad en 8 pacientes con sarcoma recidivante.[12][Nivel de evidencia B4]
- Un niño de 13 años y una niña de 14 años con sarcoma sinovial multirecidivante y metástasis pulmonares presentaron respuestas al pazopanib durante 14 y 15 meses, respectivamente.[13][Nivel de evidencia C2]
Inhibidores de puntos de control inmunitario
Evidencia (inhibidores de puntos control inmunitario):
- Pembrolizumab. La Sarcoma Alliance for Research through Collaboration dirigió un ensayo de fase II sobre el inhibidor de puntos de control pembrolizumab en pacientes de 18 años o más con sarcoma de tejido blando recidivante.[14][Nivel de evidencia C3]
- De 40 pacientes con sarcoma de tejido blando, 7 (18 %) presentaron una respuesta objetiva.
- De 10 pacientes con sarcoma pleomórfico indiferenciado, 4 (40 %) presentaron una respuesta objetiva, al igual que 2 (20 %) de 10 pacientes con liposarcoma y 1 (10 %) de 10 pacientes con sarcoma sinovial.
- Ninguno de los pacientes con leiomiosarcoma (n = 10) exhibió una respuesta objetiva.
Opciones de tratamiento en evaluación clínica
La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Ferrari A, De Salvo GL, Dall'Igna P, et al.: Salvage rates and prognostic factors after relapse in children and adolescents with initially localised synovial sarcoma. Eur J Cancer 48 (18): 3448-55, 2012. [PUBMED Abstract]
- Soole F, Maupain C, Defachelles AS, et al.: Synovial sarcoma relapses in children and adolescents: prognostic factors, treatment, and outcome. Pediatr Blood Cancer 61 (8): 1387-93, 2014. [PUBMED Abstract]
- Bergamaschi L, Bisogno G, Manzitti C, et al.: Salvage rates and prognostic factors after relapse in children and adolescents with malignant peripheral nerve sheath tumors. Pediatr Blood Cancer 65 (2): , 2018. [PUBMED Abstract]
- Belal A, Salah E, Hajjar W, et al.: Pulmonary metastatectomy for soft tissue sarcomas: is it valuable? J Cardiovasc Surg (Torino) 42 (6): 835-40, 2001. [PUBMED Abstract]
- Zagars GK, Ballo MT, Pisters PW, et al.: Prognostic factors for disease-specific survival after first relapse of soft-tissue sarcoma: analysis of 402 patients with disease relapse after initial conservative surgery and radiotherapy. Int J Radiat Oncol Biol Phys 57 (3): 739-47, 2003. [PUBMED Abstract]
- Stanelle EJ, Christison-Lagay ER, Wolden SL, et al.: Pulmonary metastasectomy in pediatric/adolescent patients with synovial sarcoma: an institutional review. J Pediatr Surg 48 (4): 757-63, 2013. [PUBMED Abstract]
- Maki RG, Wathen JK, Patel SR, et al.: Randomized phase II study of gemcitabine and docetaxel compared with gemcitabine alone in patients with metastatic soft tissue sarcomas: results of sarcoma alliance for research through collaboration study 002 [corrected]. J Clin Oncol 25 (19): 2755-63, 2007. [PUBMED Abstract]
- Le Cesne A, Cresta S, Maki RG, et al.: A retrospective analysis of antitumour activity with trabectedin in translocation-related sarcomas. Eur J Cancer 48 (16): 3036-44, 2012. [PUBMED Abstract]
- Garcia-Carbonero R, Supko JG, Maki RG, et al.: Ecteinascidin-743 (ET-743) for chemotherapy-naive patients with advanced soft tissue sarcomas: multicenter phase II and pharmacokinetic study. J Clin Oncol 23 (24): 5484-92, 2005. [PUBMED Abstract]
- Garcia-Carbonero R, Supko JG, Manola J, et al.: Phase II and pharmacokinetic study of ecteinascidin 743 in patients with progressive sarcomas of soft tissues refractory to chemotherapy. J Clin Oncol 22 (8): 1480-90, 2004. [PUBMED Abstract]
- van der Graaf WT, Blay JY, Chawla SP, et al.: Pazopanib for metastatic soft-tissue sarcoma (PALETTE): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet 379 (9829): 1879-86, 2012. [PUBMED Abstract]
- Glade Bender JL, Lee A, Reid JM, et al.: Phase I pharmacokinetic and pharmacodynamic study of pazopanib in children with soft tissue sarcoma and other refractory solid tumors: a children's oncology group phase I consortium report. J Clin Oncol 31 (24): 3034-43, 2013. [PUBMED Abstract]
- Casanova M, Basso E, Magni C, et al.: Response to pazopanib in two pediatric patients with pretreated relapsing synovial sarcoma. Tumori 103 (1): e1-e3, 2017. [PUBMED Abstract]
- Tawbi HA, Burgess M, Bolejack V, et al.: Pembrolizumab in advanced soft-tissue sarcoma and bone sarcoma (SARC028): a multicentre, two-cohort, single-arm, open-label, phase 2 trial. Lancet Oncol 18 (11): 1493-1501, 2017. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (05/12/2025)
Se incorporaron cambios editoriales en este resumen.
El Consejo editorial del PDQ sobre el tratamiento pediátrico es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del sarcoma de tejido blando infantil. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento pediátrico, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del sarcoma de tejido blando infantil son:
- Denise Adams, MD (Children's Hospital Boston)
- Louis S. Constine, MD (James P. Wilmot Cancer Center at University of Rochester Medical Center)
- Holcombe Edwin Grier, MD
- Andrea A. Hayes-Dixon, MD, FACS, FAAP (Howard University)
- William H. Meyer, MD
- Paul A. Meyers, MD (Memorial Sloan-Kettering Cancer Center)
- Thomas A. Olson, MD (Aflac Cancer and Blood Disorders Center of Children's Healthcare of Atlanta - Egleston Campus)
- Malcolm A. Smith, MD, PhD (National Cancer Institute)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento pediátrico emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento pediátrico. PDQ Tratamiento del sarcoma de tejido blando infantil. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/sarcoma-de-tejido-blando/pro/tratamiento-tejido-blando-infantil-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.