Tratamiento del linfoma no Hodgkin de células B de crecimiento lento (PDQ®)–Versión para profesionales de salud
Información general sobre el linfoma no Hodgkin de células B
Los linfomas no Hodgkin (LNH o linfomas no hodgkinianos) son un grupo heterogéneo de neoplasias malignas linfoproliferativas con diferentes modelos de comportamiento y respuestas terapéuticas.[1] Este resumen se centra principalmente en el LNH de células B de crecimiento lento (indolente, de bajo grado o escasa malignidad). Para obtener información sobre los linfomas de células B y células T, consultar Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido, Tratamiento del linfoma no Hodgkin periférico de células T y Tratamiento de la micosis fungoide y otros linfomas cutáneos de células T.
Al igual que los linfomas de Hodgkin, los LNH por lo general se originan en los tejidos linfoides y se diseminan a otros órganos. Sin embargo, el comportamiento de los LNH es mucho menos predecible que el de los linfomas de Hodgkin y tienen una tendencia mucho más alta a diseminarse por sitios extraganglionares. El pronóstico depende del tipo histológico, el estadio de la enfermedad y el tratamiento.
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por todos los tipos de LNH en los Estados Unidos en 2025:[2]
- Casos nuevos: 80 350.
- Defunciones: 19 390.
Los linfomas de células B representan alrededor del 85 % de los casos de LNH.[3]
Características anatómicas
Los LNH, por lo general, se originan en los tejidos linfoides.
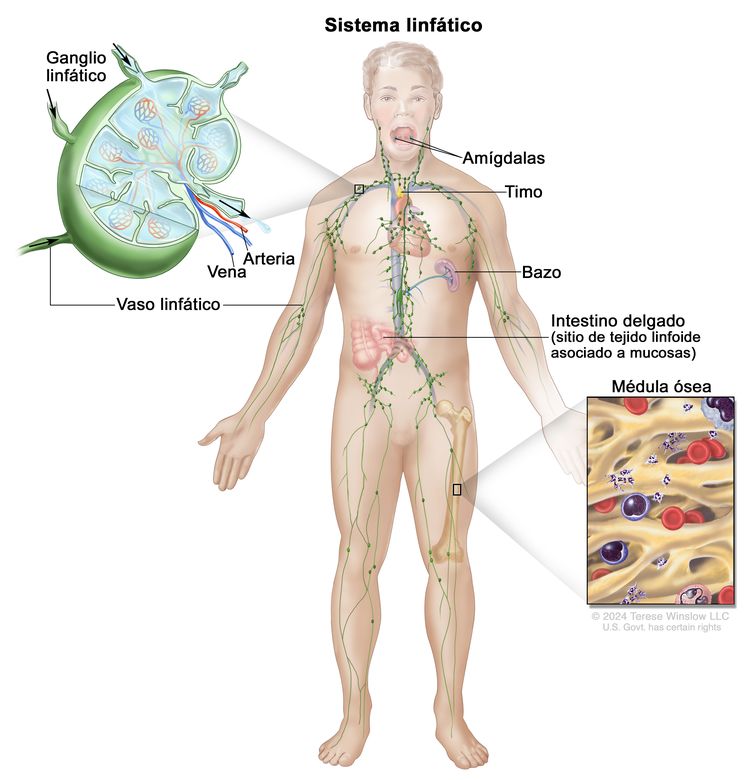
Pronóstico y supervivencia
Los LNH se dividen en dos grupos pronósticos: linfomas de crecimiento lento (indolentes o de bajo grado de malignidad) y linfomas de crecimiento rápido (agresivos o de alto grado de malignidad).
El LNH de crecimiento lento tiene un pronóstico relativamente bueno, con una mediana de supervivencia de hasta 20 años, pero por lo general no es curable en estadios clínicos avanzados.[4] El LNH de crecimiento lento temprano (estadios I y II) se puede tratar de manera eficaz con radioterapia sola. La mayoría de estos LNH de crecimiento lento son de tipo morfológico nodular (o folicular).
Los LNH de crecimiento rápido tienen una evolución natural más corta, pero un número significativo de estos pacientes se cura con regímenes de quimioterapia combinada intensiva.
La tasa de supervivencia general a 5 años es superior al 60 % en los pacientes con LNH que reciben un tratamiento moderno. Más del 50 % de los pacientes con LNH de crecimiento rápido se pueden curar. La mayoría de las recaídas se presentan en los primeros 2 años posteriores al tratamiento. El riesgo de recaída tardía es más alto en los pacientes que manifiestan ambos tipos histológicos: de crecimiento lento (indolente) y de crecimiento rápido (agresivo).[5]
Aunque el LNH de crecimiento lento es sensible a la inmunoterapia, la radioterapia y la quimioterapia, por lo general, se observa una tasa continua de recaída en los estadios avanzados. Sin embargo, a menudo es posible volver a tratar a los pacientes con gran éxito si el tipo histológico de la enfermedad sigue siendo de grado bajo. Los pacientes que desde el inicio presentan un LNH de crecimiento rápido o cuya enfermedad se convierte después en este tipo de linfoma, pueden lograr remisiones completas prolongadas con regímenes de quimioterapia combinada o de consolidación intensiva con apoyo de células madre o de médula ósea.[6,7]
Efectos tardíos del tratamiento del linfoma no Hodgkin
Se han observado efectos tardíos del tratamiento del linfoma no Hodgkin (LNH). Es posible que se presente una alteración de la fertilidad o la capacidad reproductiva después de la exposición a alquilantes.[8] Hasta tres décadas después del diagnóstico, los pacientes tienen un riesgo significativamente elevado de presentar segundos cánceres primarios, en especial los siguientes:[9-12]
- Cáncer de pulmón.
- Cáncer de encéfalo.
- Cáncer de riñón.
- Cáncer de vejiga.
- Melanoma.
- Linfoma de Hodgkin.
- Leucemia no linfocítica aguda.
La disfunción ventricular izquierda fue un efecto tardío significativo en los sobrevivientes a largo plazo de LNH de grado alto que recibieron más de 200 mg/m² de doxorrubicina.[8,13]
El síndrome mielodisplásico y la leucemia mielógena aguda son complicaciones tardías de la terapia mielosupresora con apoyo de médula ósea autógena o células madre periféricas, así como de la quimioterapia convencional con alquilantes.[10,14-21] La mayoría de estos pacientes presentan hematopoyesis clonal incluso antes del trasplante, lo que indica que la lesión hematológica por lo general se presenta durante la quimioterapia de inducción o reinducción.[16,22,23] Se realizó un seguimiento, durante una mediana de 10 años, de una serie de 605 pacientes que recibieron trasplante de médula ósea (TMO) autógeno con ciclofosfamida y radioterapia corporal total (como acondicionamiento). La incidencia de una segunda neoplasia maligna fue del 21 %, y el 10 % de esas neoplasias malignas fueron tumores sólidos.[24]
En un estudio de mujeres jóvenes que recibieron TMO autógeno, se notificaron embarazos exitosos con bebés que nacieron sin anomalías congénitas.[25] La tromboembolia venosa tardía se puede presentar después de un TMO alogénico o autógeno.[26]
Algunos pacientes presentan osteopenia u osteoporosis al inicio del tratamiento; es posible que la densidad ósea empeore después del tratamiento para el linfoma.[27]
En un estudio retrospectivo de cohortes de 21 690 sobrevivientes de linfoma difuso de células B grandes del California Cancer Registry, se evaluó el deterioro a largo plazo de la salud inmunitaria. Se encontraron cocientes de tasas de incidencia elevadas hasta 10 años después para neumonía (10,8 veces mayor), meningitis (5,3 veces mayor), deficiencia de inmunoglobulinas (17,6 veces mayor) y citopenias autoinmunitarias (12 veces mayor).[28] De manera similar, los pacientes con linfoma que reciben terapias dirigidas a las células B presentan respuestas humorales alteradas a la vacunación contra el virus causal de la COVID-19.[29,30]
Bibliografía
- Shankland KR, Armitage JO, Hancock BW: Non-Hodgkin lymphoma. Lancet 380 (9844): 848-57, 2012. [PUBMED Abstract]
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- American Cancer Society: Types of B-cell Lymphoma. American Cancer Society, 2019. Available online. Last accessed February 7, 2025.
- Tan D, Horning SJ, Hoppe RT, et al.: Improvements in observed and relative survival in follicular grade 1-2 lymphoma during 4 decades: the Stanford University experience. Blood 122 (6): 981-7, 2013. [PUBMED Abstract]
- Cabanillas F, Velasquez WS, Hagemeister FB, et al.: Clinical, biologic, and histologic features of late relapses in diffuse large cell lymphoma. Blood 79 (4): 1024-8, 1992. [PUBMED Abstract]
- Bastion Y, Sebban C, Berger F, et al.: Incidence, predictive factors, and outcome of lymphoma transformation in follicular lymphoma patients. J Clin Oncol 15 (4): 1587-94, 1997. [PUBMED Abstract]
- Yuen AR, Kamel OW, Halpern J, et al.: Long-term survival after histologic transformation of low-grade follicular lymphoma. J Clin Oncol 13 (7): 1726-33, 1995. [PUBMED Abstract]
- Haddy TB, Adde MA, McCalla J, et al.: Late effects in long-term survivors of high-grade non-Hodgkin's lymphomas. J Clin Oncol 16 (6): 2070-9, 1998. [PUBMED Abstract]
- Travis LB, Curtis RE, Glimelius B, et al.: Second cancers among long-term survivors of non-Hodgkin's lymphoma. J Natl Cancer Inst 85 (23): 1932-7, 1993. [PUBMED Abstract]
- Mudie NY, Swerdlow AJ, Higgins CD, et al.: Risk of second malignancy after non-Hodgkin's lymphoma: a British Cohort Study. J Clin Oncol 24 (10): 1568-74, 2006. [PUBMED Abstract]
- Hemminki K, Lenner P, Sundquist J, et al.: Risk of subsequent solid tumors after non-Hodgkin's lymphoma: effect of diagnostic age and time since diagnosis. J Clin Oncol 26 (11): 1850-7, 2008. [PUBMED Abstract]
- Major A, Smith DE, Ghosh D, et al.: Risk and subtypes of secondary primary malignancies in diffuse large B-cell lymphoma survivors change over time based on stage at diagnosis. Cancer 126 (1): 189-201, 2020. [PUBMED Abstract]
- Moser EC, Noordijk EM, van Leeuwen FE, et al.: Long-term risk of cardiovascular disease after treatment for aggressive non-Hodgkin lymphoma. Blood 107 (7): 2912-9, 2006. [PUBMED Abstract]
- Darrington DL, Vose JM, Anderson JR, et al.: Incidence and characterization of secondary myelodysplastic syndrome and acute myelogenous leukemia following high-dose chemoradiotherapy and autologous stem-cell transplantation for lymphoid malignancies. J Clin Oncol 12 (12): 2527-34, 1994. [PUBMED Abstract]
- Stone RM, Neuberg D, Soiffer R, et al.: Myelodysplastic syndrome as a late complication following autologous bone marrow transplantation for non-Hodgkin's lymphoma. J Clin Oncol 12 (12): 2535-42, 1994. [PUBMED Abstract]
- Armitage JO, Carbone PP, Connors JM, et al.: Treatment-related myelodysplasia and acute leukemia in non-Hodgkin's lymphoma patients. J Clin Oncol 21 (5): 897-906, 2003. [PUBMED Abstract]
- André M, Mounier N, Leleu X, et al.: Second cancers and late toxicities after treatment of aggressive non-Hodgkin lymphoma with the ACVBP regimen: a GELA cohort study on 2837 patients. Blood 103 (4): 1222-8, 2004. [PUBMED Abstract]
- Oddou S, Vey N, Viens P, et al.: Second neoplasms following high-dose chemotherapy and autologous stem cell transplantation for malignant lymphomas: a report of six cases in a cohort of 171 patients from a single institution. Leuk Lymphoma 31 (1-2): 187-94, 1998. [PUBMED Abstract]
- Lenz G, Dreyling M, Schiegnitz E, et al.: Moderate increase of secondary hematologic malignancies after myeloablative radiochemotherapy and autologous stem-cell transplantation in patients with indolent lymphoma: results of a prospective randomized trial of the German Low Grade Lymphoma Study Group. J Clin Oncol 22 (24): 4926-33, 2004. [PUBMED Abstract]
- McLaughlin P, Estey E, Glassman A, et al.: Myelodysplasia and acute myeloid leukemia following therapy for indolent lymphoma with fludarabine, mitoxantrone, and dexamethasone (FND) plus rituximab and interferon alpha. Blood 105 (12): 4573-5, 2005. [PUBMED Abstract]
- Morton LM, Curtis RE, Linet MS, et al.: Second malignancy risks after non-Hodgkin's lymphoma and chronic lymphocytic leukemia: differences by lymphoma subtype. J Clin Oncol 28 (33): 4935-44, 2010. [PUBMED Abstract]
- Mach-Pascual S, Legare RD, Lu D, et al.: Predictive value of clonality assays in patients with non-Hodgkin's lymphoma undergoing autologous bone marrow transplant: a single institution study. Blood 91 (12): 4496-503, 1998. [PUBMED Abstract]
- Lillington DM, Micallef IN, Carpenter E, et al.: Detection of chromosome abnormalities pre-high-dose treatment in patients developing therapy-related myelodysplasia and secondary acute myelogenous leukemia after treatment for non-Hodgkin's lymphoma. J Clin Oncol 19 (9): 2472-81, 2001. [PUBMED Abstract]
- Brown JR, Yeckes H, Friedberg JW, et al.: Increasing incidence of late second malignancies after conditioning with cyclophosphamide and total-body irradiation and autologous bone marrow transplantation for non-Hodgkin's lymphoma. J Clin Oncol 23 (10): 2208-14, 2005. [PUBMED Abstract]
- Jackson GH, Wood A, Taylor PR, et al.: Early high dose chemotherapy intensification with autologous bone marrow transplantation in lymphoma associated with retention of fertility and normal pregnancies in females. Scotland and Newcastle Lymphoma Group, UK. Leuk Lymphoma 28 (1-2): 127-32, 1997. [PUBMED Abstract]
- Gangaraju R, Chen Y, Hageman L, et al.: Risk of venous thromboembolism in patients with non-Hodgkin lymphoma surviving blood or marrow transplantation. Cancer 125 (24): 4498-4508, 2019. [PUBMED Abstract]
- Westin JR, Thompson MA, Cataldo VD, et al.: Zoledronic acid for prevention of bone loss in patients receiving primary therapy for lymphomas: a prospective, randomized controlled phase III trial. Clin Lymphoma Myeloma Leuk 13 (2): 99-105, 2013. [PUBMED Abstract]
- Shree T, Li Q, Glaser SL, et al.: Impaired Immune Health in Survivors of Diffuse Large B-Cell Lymphoma. J Clin Oncol 38 (15): 1664-1675, 2020. [PUBMED Abstract]
- Ghione P, Gu JJ, Attwood K, et al.: Impaired humoral responses to COVID-19 vaccination in patients with lymphoma receiving B-cell-directed therapies. Blood 138 (9): 811-814, 2021. [PUBMED Abstract]
- Terpos E, Trougakos IP, Gavriatopoulou M, et al.: Low neutralizing antibody responses against SARS-CoV-2 in older patients with myeloma after the first BNT162b2 vaccine dose. Blood 137 (26): 3674-3676, 2021. [PUBMED Abstract]
Clasificación celular del linfoma no Hodgkin de células B
Se debe consultar con un patólogo antes de realizar una biopsia porque algunos estudios exigen una preparación especial del tejido (por ejemplo, tejido congelado). El conocimiento de los marcadores de superficie celular y los reordenamientos de los genes de inmunoglobulinas y del receptor de células T puede ser útil al momento de tomar decisiones diagnósticas y terapéuticas. El exceso clonal de cadenas ligeras de inmunoglobulina permite diferenciar las células linfoides malignas de las células reactivas. Es muy importante que un hematopatólogo con experiencia en el diagnóstico de linfomas realice un examen minucioso de las muestras de biopsia externas porque las características histopatológicas afectan el pronóstico y el abordaje del tratamiento. Aunque se recomienda obtener biopsias de ganglios linfáticos cuando sea posible, a veces los datos inmunofenotípicos son suficientes para establecer un diagnóstico de linfoma cuando es preferible hacer un estudio citológico mediante aspiración con aguja fina o biopsia con aguja gruesa.[1,2]
Sistemas de clasificación tradicionales
En el pasado, la falta de un sistema de clasificación unificado impedía establecer un tratamiento uniforme para los pacientes con linfoma no Hodgkin (LNH). En 1982, se publicaron los resultados de un estudio de consenso que se conoce como Working Formulation.[3] Se combinaron los resultados de 6 sistemas de clasificación principales para formar una clasificación unificada que permitió la comparación de estudios de diferentes instituciones y países. La clasificación de Rappaport, que también aparece a continuación, ya no se usa mucho.
| Working Formulation [3] | Clasificación de Rappaport |
|---|---|
| Grado bajo | |
| A. Linfoma linfocítico de células pequeñas, compatible con leucemia linfocítica crónica | Linfoma linfocítico difuso bien diferenciado |
| B. Linfoma folicular con predominio de células hendidas pequeñas | Linfoma linfocítico nodular pobremente diferenciado |
| C. Linfoma folicular mixto con mezcla de células hendidas pequeñas y células grandes | Linfoma nodular mixto, linfocítico e histiocítico |
| Grado intermedio | |
| D. Linfoma folicular con predominio de células grandes | Linfoma histiocítico nodular |
| E. Linfoma difuso de células hendidas pequeñas | Linfoma linfocítico difuso pobremente diferenciado |
| F. Linfoma difuso mixto de células pequeñas y grandes | Linfoma difuso mixto, linfocítico e histiocítico |
| G. Linfoma difuso de células grandes hendidas o no hendidas | Linfoma histiocítico difuso |
| Grado alto | |
| H. Linfoma inmunoblástico de células grandes | Linfoma histiocítico difuso |
| I. Linfoma linfoblástico de células cerebriformes o no cerebriformes | Linfoma linfoblástico difuso |
| J. Linfoma de Burkitt o no Burkitt de células pequeñas no hendidas | Linfoma indiferenciado difuso de Burkitt o no Burkitt |
Sistemas de clasificación actuales
Se han descrito varias entidades patológicas nuevas a medida que el diagnóstico histopatológico del LNH se vuelve cada vez más sofisticado por el uso de métodos inmunológicos y genéticos.[4] Además, la comprensión y el tratamiento de muchos de los subtipos patológicos descritos antes han cambiado. Como resultado, la clasificación Working Formulation se volvió obsoleta y carece de utilidad para profesionales clínicos y patólogos. Por este motivo los patólogos europeos y norteamericanos propusieron la Revised European American Lymphoma Classification, una clasificación nueva conocida como clasificación REAL.[5-8] Desde 1995, los miembros de las sociedades europeas y estadounidenses de hemopatología han colaborado en la formulación de la nueva clasificación de la Organización Mundial de la Salud (OMS), que representa una versión actualizada del sistema REAL.[9,10]
Clasificación REAL modificada por la Organización Mundial de la Salud
En la modificación que la Organización Mundial de la Salud (OMS) hizo a la clasificación europea americana revisada del linfoma (Revised European American Lymphoma [REAL]) se reconocen tres categorías principales de neoplasias linfoides malignas según la morfología y el linaje celular: neoplasias de células B, neoplasias de células T o de células citolíticas naturales (NK), y linfoma de Hodgkin (LH). En esta clasificación, se incluyen los linfomas y las leucemias linfoides porque las fases sólidas y circulantes de estas enfermedades se encuentran en muchas neoplasias linfoides, así que la distinción entre ellas es artificial. Por ejemplo, la leucemia linfocítica crónica (LLC) de células B y el linfoma linfocítico de células B pequeñas son distintas manifestaciones de la misma neoplasia, al igual que los linfomas linfoblásticos y las leucemias linfocíticas agudas. Dentro de las categorías de células B y células T, se reconocen dos subdivisiones: neoplasias precursoras, que corresponden a los estadios más tempranos de diferenciación, y neoplasias diferenciadas más maduras.[9,10]
Neoplasias de células B
- Neoplasias de células B precursoras: leucemia linfoblástica aguda de células B precursoras o linfoma linfoblástico de células B precursoras.
- Neoplasias de células B periféricas.
- Leucemia linfocítica crónica de células B o linfoma linfocítico de células B pequeñas.
- Leucemia prolinfocítica de células B.
- Linfoma linfoplasmocítico o inmunocitoma.
- Linfoma de células de manto.
- Linfoma folicular.
- Linfoma extraganglionar de células B de zona marginal de tejido linfoide asociado a mucosas.
- Linfoma ganglionar de células B de zona marginal (± células B monocitoides).
- Linfoma esplénico de zona marginal (± linfocitos vellosos).
- Leucemia de células pilosas.
- Plasmocitoma o mieloma de células plasmáticas.
- Linfoma difuso de células B grandes.
- Linfoma de Burkitt.
Neoplasias de células T y posiblemente derivadas de células NK
- Neoplasias de células T precursoras: leucemia linfoblástica aguda de células T precursoras o linfoma linfoblástico de células T precursoras. Para obtener más información, consultar Tratamiento de la leucemia linfoblástica aguda.
- Neoplasias periféricas de células T-NK.
- Leucemia linfocítica crónica de células T o leucemia prolinfocítica de células T.
- Leucemia linfocítica granular de células T.
- Micosis fungoide (incluso el síndrome de Sézary).
- Linfoma periférico de células T sin otra indicación.
- Linfoma hepatoesplénico de células T γ-δ.
- Linfoma subcutáneo de células T similar a la paniculitis.
- Linfoma extraganglionar de células T-NK de tipo nasal.
- Linfomas ganglionares de origen de células T auxiliares foliculares (incluso linfoma angioinmunoblástico de células T, linfoma periférico de células T foliculares y linfoma ganglionar periférico de células T con fenotipo auxiliar folicular T).
- Linfoma intestinal de células T asociado a enteropatía.
- Linfoma intestinal epiteliotrópico monomórfico de células T.
- Leucemia o linfoma de células T en adultos (virus linfotrópico humano de células T de tipo 1 [VLHT] 1+).
- Linfoma anaplásico de células grandes de tipo sistémico primario.
- Linfoma anaplásico de células grandes de tipo cutáneo primario.
- Leucemia de células NK de crecimiento rápido (agresiva).
Linfoma de Hodgkin
- Linfoma de Hodgkin con predominio linfocítico nodular.
- Linfoma de Hodgkin clásico.
- Linfoma de Hodgkin con esclerosis nodular.
- Linfoma de Hodgkin clásico rico en linfocitos.
- Linfoma de Hodgkin con celularidad mixta.
- Linfoma de Hodgkin con agotamiento linfocítico.
La clasificación REAL abarca todas las neoplasias linfoproliferativas. Para obtener más información, consultar los siguientes resúmenes del PDQ:
- Tratamiento de la leucemia linfoblástica aguda
- Tratamiento de la leucemia linfocítica crónica
- Tratamiento de la leucemia de células pilosas
- Tratamiento del linfoma de Hodgkin
- Tratamiento del linfoma relacionado con el SIDA
- Tratamiento del linfoma no Hodgkin de células B de crecimiento lento
- Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido
- Tratamiento del linfoma no Hodgkin periférico de células T
- Tratamiento de la micosis fungoide y otros linfomas cutáneos de células T
- Tratamiento de las neoplasias de células plasmáticas (incluso mieloma múltiple)
- Tratamiento del linfoma primario del sistema nervioso central
Bibliografía
- Zeppa P, Marino G, Troncone G, et al.: Fine-needle cytology and flow cytometry immunophenotyping and subclassification of non-Hodgkin lymphoma: a critical review of 307 cases with technical suggestions. Cancer 102 (1): 55-65, 2004. [PUBMED Abstract]
- Young NA, Al-Saleem T: Diagnosis of lymphoma by fine-needle aspiration cytology using the revised European-American classification of lymphoid neoplasms. Cancer 87 (6): 325-45, 1999. [PUBMED Abstract]
- National Cancer Institute sponsored study of classifications of non-Hodgkin's lymphomas: summary and description of a working formulation for clinical usage. The Non-Hodgkin's Lymphoma Pathologic Classification Project. Cancer 49 (10): 2112-35, 1982. [PUBMED Abstract]
- Pugh WC: Is the working formulation adequate for the classification of the low grade lymphomas? Leuk Lymphoma 10 (Suppl 1): 1-8, 1993.
- Harris NL, Jaffe ES, Stein H, et al.: A revised European-American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group. Blood 84 (5): 1361-92, 1994. [PUBMED Abstract]
- Pittaluga S, Bijnens L, Teodorovic I, et al.: Clinical analysis of 670 cases in two trials of the European Organization for the Research and Treatment of Cancer Lymphoma Cooperative Group subtyped according to the Revised European-American Classification of Lymphoid Neoplasms: a comparison with the Working Formulation. Blood 87 (10): 4358-67, 1996. [PUBMED Abstract]
- Armitage JO, Weisenburger DD: New approach to classifying non-Hodgkin's lymphomas: clinical features of the major histologic subtypes. Non-Hodgkin's Lymphoma Classification Project. J Clin Oncol 16 (8): 2780-95, 1998. [PUBMED Abstract]
- A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin's lymphoma. The Non-Hodgkin's Lymphoma Classification Project. Blood 89 (11): 3909-18, 1997. [PUBMED Abstract]
- Pileri SA, Milani M, Fraternali-Orcioni G, et al.: From the R.E.A.L. Classification to the upcoming WHO scheme: a step toward universal categorization of lymphoma entities? Ann Oncol 9 (6): 607-12, 1998. [PUBMED Abstract]
- Society for Hematopathology Program: Society for Hematopathology Program. Am J Surg Pathol 21 (1): 114-121, 1997.
Información sobre los estadios del linfoma no Hodgkin de células B de crecimiento lento
El estadio es importante para la selección del tratamiento en pacientes con linfoma no Hodgkin (LNH). Por lo general, las tomografías computarizadas (TC) del tórax y el abdomen forman parte de la evaluación para la estadificación de todos los pacientes con linfoma. El sistema de estadificación para el LNH es similar al que se usa para el linfoma de Hodgkin (LH).
Es común que los pacientes con LNH presenten compromiso de los siguientes sitios:
- Ganglios linfáticos no adyacentes.
- Anillo de Waldeyer.
- Ganglios epitrocleares.
- Tubo digestivo.
- Sitios extraganglionares. (En ocasiones, una localización extraganglionar es el único sitio comprometido en pacientes con un linfoma difuso).
- Médula ósea.
- Hígado (muy común en pacientes con linfomas de grado bajo).
El examen citológico del líquido cefalorraquídeo a veces da un resultado positivo en pacientes con LNH de crecimiento rápido. El compromiso de los ganglios linfáticos hiliares y mediastínicos es menos común que en los pacientes con LH. Sin embargo, las adenopatías mediastínicas son una característica destacada del linfoma linfoblástico y del linfoma mediastínico primario de células B, que se presentan sobre todo en adultos jóvenes.
La mayoría de los pacientes con LNH consultan con una enfermedad avanzada (estadio III o IV) que a menudo se identifica mediante tomografías computarizadas (TC) o biopsias de la médula ósea y de otros sitios comprometidos accesibles. En una revisión retrospectiva de más de 32 000 casos de linfoma en Francia, hasta el 40 % de los diagnósticos se confirmaron mediante biopsia con aguja gruesa y el 60 % mediante biopsia por escisión.[1] Después de la revisión por expertos, la biopsia con aguja gruesa proporcionó un diagnóstico definitivo en el 92,3 % de los casos; mientras que la biopsia por escisión proporcionó un diagnóstico definitivo en el 98,1 % de los casos (P < 0,0001). Por lo general, no se requiere una biopsia laparoscópica o laparotomía para la estadificación, pero es posible que en raras ocasiones se necesite para establecer un diagnóstico o determinar el tipo histológico del linfoma.[2]
La tomografía por emisión de positrones (TEP) con flúor F 18-fludesoxiglucosa se puede usar para la estadificación inicial. También quizás se utilice durante el seguimiento después del tratamiento como complemento de la TC.[3] En múltiples estudios se demostró que las TEP intermedias después de 2 a 4 ciclos de terapia no aportan información pronóstica confiable. En un ensayo de grupo cooperativo grande (ECOG-E344 [NCT00274924]) se notificaron problemas de reproducibilidad entre los observadores. En 2 ensayos prospectivos y en 1 metanálisis no se observaron diferencias en los desenlaces entre los pacientes con resultados negativos en la TEP y los pacientes con resultados positivos en la TEP pero que tenían resultados negativos en la biopsia.[4-7]
En un estudio retrospectivo de 130 pacientes con linfoma difuso de células B grandes, la TEP permitió identificar el compromiso de la médula ósea con importancia clínica; la biopsia de médula ósea no llevó a la sobreestadificación de ningún paciente con linfoma.[8] En un estudio retrospectivo de 580 pacientes con linfoma folicular de 7 ensayos patrocinados por el Instituto Nacional del Cáncer, no se observó ninguna mejora en la evaluación de la respuesta al tratamiento cuando se añadió la biopsia de la médula ósea a las imágenes radiológicas.[9] La evaluación del LNH debe incluir una biopsia de la médula ósea cuando el resultado posiblemente conlleve un cambio en el tratamiento (por ejemplo, si se encuentra un estadio limitado vs. uno avanzado) o durante la evaluación de la presencia de citopenias.
En los pacientes con linfoma folicular, un resultado anormal en una TEP después del tratamiento conlleva un pronóstico más precario; sin embargo, no está claro si este resultado es predictivo cuando se implementa un tratamiento adicional o diferente.[10]
Sistema de estadificación
Clasificación de Lugano
El American Joint Committee on Cancer (AJCC) adoptó la clasificación de Lugano para evaluar y estadificar el linfoma.[11] El sistema de clasificación de Lugano reemplazó el sistema de clasificación de Ann Arbor, que se adoptó en 1971 en la conferencia de Ann Arbor,[12] y que fue modificado 18 años después en la reunión de Cotswolds.[13,14]
| Estadio | Descripción del estadio | Imagen |
|---|---|---|
| LCR = líquido cefalorraquídeo; TC = tomografía computarizada; LDCBG = linfoma difuso de células B grandes; LNH = linfoma no Hodgkin. | ||
| aHodgkin and Non-Hodgkin Lymphomas. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pp. 937-58. | ||
| bEl estadio II con gran masa tumoral (tumor voluminoso) quizás se considere un estadio temprano o avanzado en función de las características histológicas y los factores pronósticos del linfoma. | ||
| cLa definición de una gran masa tumoral varía según las características histológicas del linfoma. En la clasificación de Lugano, una gran masa tumoral en el linfoma de Hodgkin se define como una masa que mide más de un tercio del diámetro torácico en la TC del tórax, o una masa que mide >10 cm. Las definiciones recomendadas para una gran masa tumoral en el LNH varían de acuerdo a las características histológicas del linfoma. En el linfoma folicular, se sugirió la medida de 6 cm a partir del Follicular Lymphoma International Prognostic Index-2 y su validación. En el LDCBG, se han usado valores de corte que oscilan entre 5 cm y 10 cm, aunque el límite recomendado es de 10 cm. | ||
| Estadio limitado | ||
| I | Compromiso de un solo sitio linfático (es decir, una región ganglionar, el anillo de Waldeyer, el timo o el bazo). |
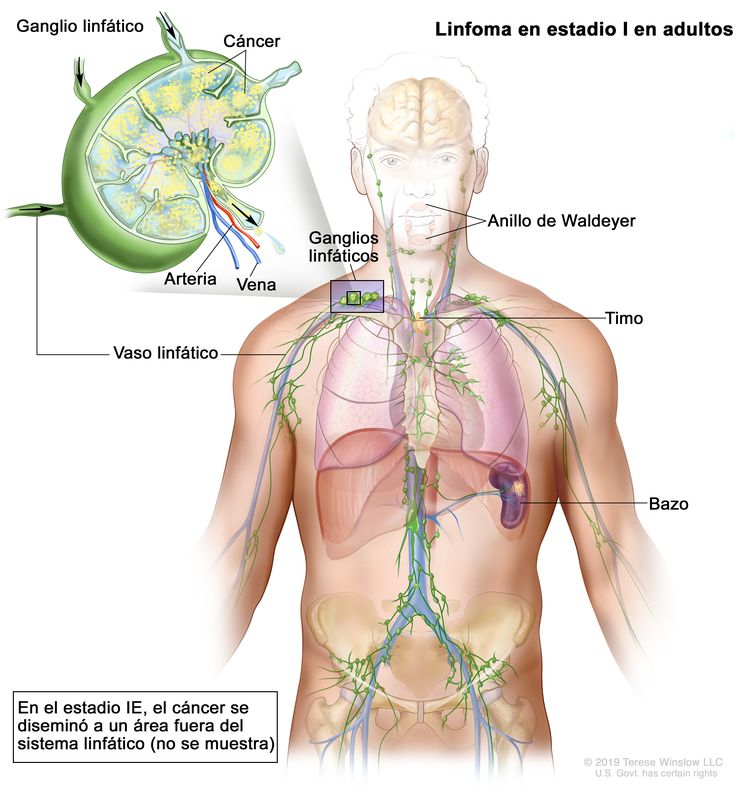 |
| IE | Compromiso de 1 solo sitio extralinfático sin compromiso ganglionar (infrecuente en el linfoma de Hodgkin). | |
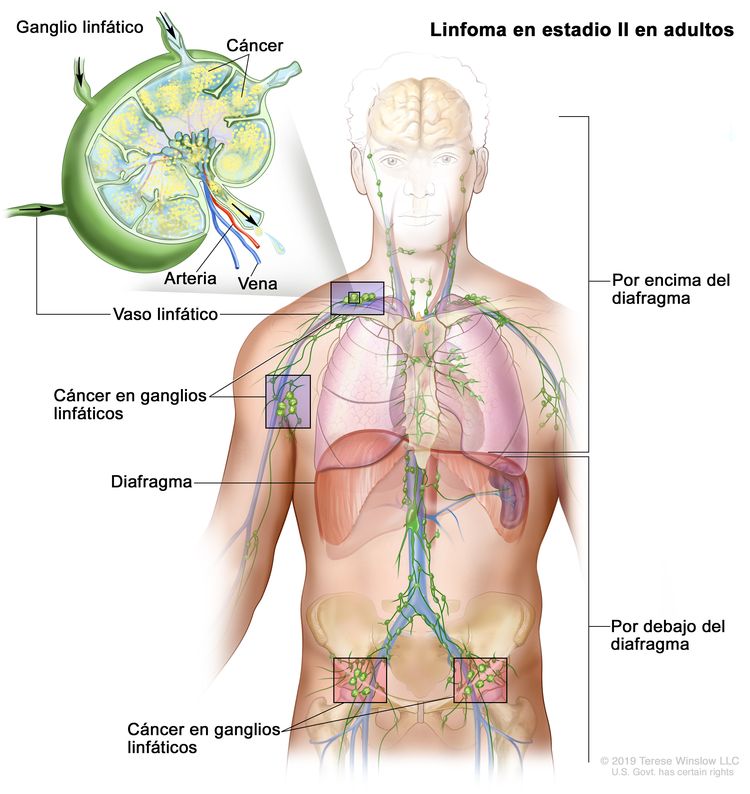
| II | Compromiso de 2 o más regiones ganglionares en el mismo lado del diafragma. |
 |
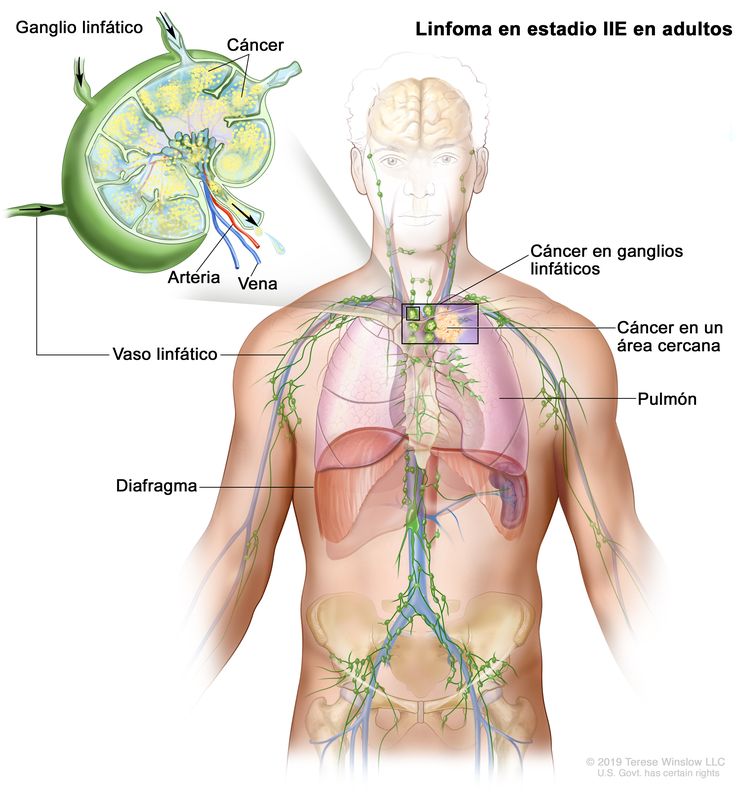
| IIE | Diseminación extralinfática adyacente desde un sitio ganglionar con compromiso de otras regiones ganglionares en el mismo lado del diafragma o sin este. |
 |
| II con gran masa tumoralb | Estadio II con gran masa tumoralc | |
| Estadio avanzado | ||
| III | Compromiso de regiones ganglionares en ambos lados del diafragma; adenopatías por encima del diafragma y compromiso esplénico. |
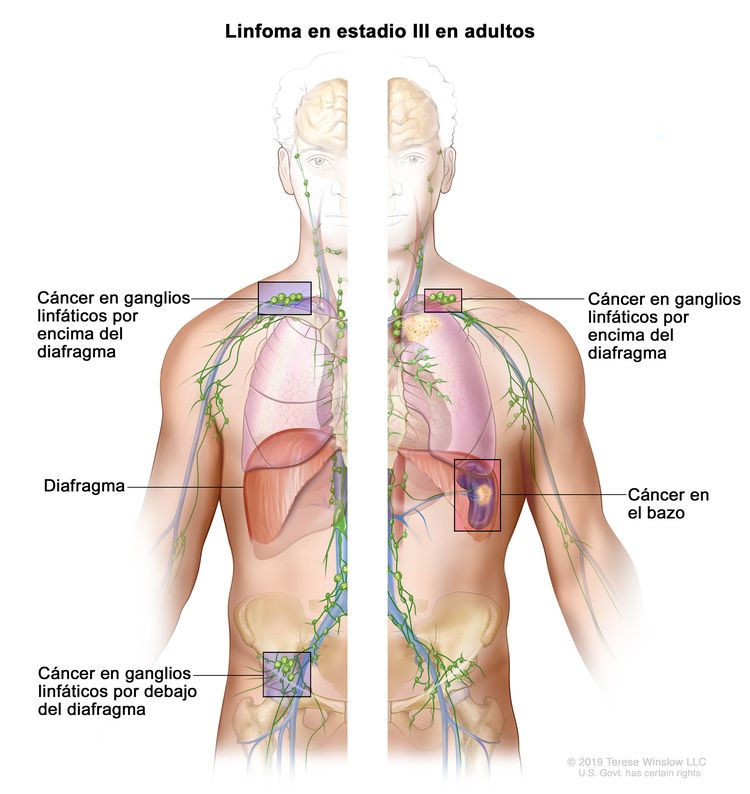 |
| IV | Compromiso difuso o diseminación a uno o más órganos extralinfáticos con compromiso ganglionar o sin este; compromiso de órgano extralinfático no adyacente con enfermedad ganglionar en estadio II; o compromiso de cualquier órgano extralinfático con enfermedad ganglionar en estadio III. El estadio IV incluye cualquier tipo de compromiso del LCR, la médula ósea y el hígado, o la presencia de lesiones pulmonares múltiples (diferentes a las lesiones por diseminación directa de una enfermedad en estadio IIE). |
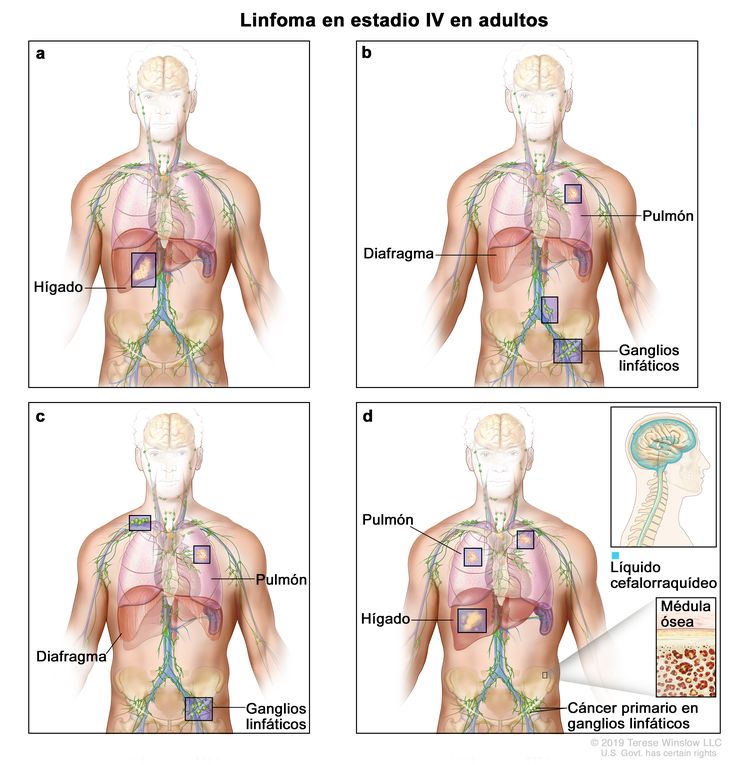 |
| Nota: Se utiliza la designación A o B junto con el grupo de estadio para el linfoma de Hodgkin. En el LNH ya no se utiliza la designación A ni B. | ||
En ocasiones, se usan otros sistemas de estadificación especializados. El médico debe estar al tanto del sistema que se usa en el informe del paciente.
La designación E se usa cuando aparecen neoplasias linfoides extraganglionares malignas en tejidos separados de los conglomerados linfáticos principales pero cercanos a estos. El estadio IV indica una enfermedad con diseminación difusa por todo un sitio extraganglionar, como el hígado. Si el compromiso de uno o más sitios extralinfáticos se documentó mediante estudio patológico, se usa el símbolo del sitio comprometido seguido por el signo más (+).
| N = ganglios | H = hígado | L = pulmón | M = médula ósea |
| S = bazo | P = pleura | O = hueso | D = piel |
En la práctica actual se asigna un estadio clínico a partir de los hallazgos de la evaluación clínica y un estadio patológico a partir de los hallazgos de los procedimientos invasivos adicionales a la biopsia inicial.
Por ejemplo, es posible que se encuentre un compromiso del hígado y la médula ósea mediante una biopsia percutánea en un paciente con adenopatía inguinal sin síntomas sistémicos que tiene un resultado positivo en el linfangiograma. El estadio exacto para dicho paciente sería estadio clínico IIA, estadio patológico IVA(H+)(M+).
Hay otros factores que no se incluyen en el sistema de estadificación anterior, pero que son importantes para la estadificación y el pronóstico de los pacientes con LNH. Estos factores son los siguientes:
- Edad.
- Estado funcional (EF).
- Tamaño del tumor.
- Concentraciones de lactato–deshidrogenasa (LDH).
- Número de sitios con compromiso extraganglionar.
Bibliografía
- Syrykh C, Chaouat C, Poullot E, et al.: Lymph node excisions provide more precise lymphoma diagnoses than core biopsies: a French Lymphopath network survey. Blood 140 (24): 2573-2583, 2022. [PUBMED Abstract]
- Mann GB, Conlon KC, LaQuaglia M, et al.: Emerging role of laparoscopy in the diagnosis of lymphoma. J Clin Oncol 16 (5): 1909-15, 1998. [PUBMED Abstract]
- Barrington SF, Mikhaeel NG, Kostakoglu L, et al.: Role of imaging in the staging and response assessment of lymphoma: consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol 32 (27): 3048-58, 2014. [PUBMED Abstract]
- Horning SJ, Juweid ME, Schöder H, et al.: Interim positron emission tomography scans in diffuse large B-cell lymphoma: an independent expert nuclear medicine evaluation of the Eastern Cooperative Oncology Group E3404 study. Blood 115 (4): 775-7; quiz 918, 2010. [PUBMED Abstract]
- Moskowitz CH, Schöder H, Teruya-Feldstein J, et al.: Risk-adapted dose-dense immunochemotherapy determined by interim FDG-PET in Advanced-stage diffuse large B-Cell lymphoma. J Clin Oncol 28 (11): 1896-903, 2010. [PUBMED Abstract]
- Pregno P, Chiappella A, Bellò M, et al.: Interim 18-FDG-PET/CT failed to predict the outcome in diffuse large B-cell lymphoma patients treated at the diagnosis with rituximab-CHOP. Blood 119 (9): 2066-73, 2012. [PUBMED Abstract]
- Sun N, Zhao J, Qiao W, et al.: Predictive value of interim PET/CT in DLBCL treated with R-CHOP: meta-analysis. Biomed Res Int 2015: 648572, 2015. [PUBMED Abstract]
- Khan AB, Barrington SF, Mikhaeel NG, et al.: PET-CT staging of DLBCL accurately identifies and provides new insight into the clinical significance of bone marrow involvement. Blood 122 (1): 61-7, 2013. [PUBMED Abstract]
- Rutherford SC, Yin J, Pederson L, et al.: Relevance of Bone Marrow Biopsies for Response Assessment in US National Cancer Institute National Clinical Trials Network Follicular Lymphoma Clinical Trials. J Clin Oncol 41 (2): 336-342, 2023. [PUBMED Abstract]
- Pyo J, Won Kim K, Jacene HA, et al.: End-therapy positron emission tomography for treatment response assessment in follicular lymphoma: a systematic review and meta-analysis. Clin Cancer Res 19 (23): 6566-77, 2013. [PUBMED Abstract]
- Hodgkin and non-Hodgkin lymphoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 937–58.
- Carbone PP, Kaplan HS, Musshoff K, et al.: Report of the Committee on Hodgkin's Disease Staging Classification. Cancer Res 31 (11): 1860-1, 1971. [PUBMED Abstract]
- Lister TA, Crowther D, Sutcliffe SB, et al.: Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin's disease: Cotswolds meeting. J Clin Oncol 7 (11): 1630-6, 1989. [PUBMED Abstract]
- National Cancer Institute sponsored study of classifications of non-Hodgkin's lymphomas: summary and description of a working formulation for clinical usage. The Non-Hodgkin's Lymphoma Pathologic Classification Project. Cancer 49 (10): 2112-35, 1982. [PUBMED Abstract]
Linfoma no Hodgkin de células B de crecimiento lento
El linfoma no Hodgkin (LNH) de crecimiento lento incluye los siguientes subtipos:
- Linfoma folicular (grados 1–3a).
- Linfoma linfoplasmocítico (macroglobulinemia de Waldenström).
- Linfoma de zona marginal.
Linfoma folicular (grados 1–3a)
El linfoma folicular representa el 20 % de todos los LNH y hasta el 70 % de los linfomas de crecimiento lento notificados en ensayos clínicos norteamericanos y europeos.[1-3] La mayoría de los pacientes con linfoma folicular tienen 50 años o más y exhiben una enfermedad diseminada en el momento del diagnóstico. El compromiso ganglionar es más común y, con frecuencia, se acompaña de enfermedad en el bazo y la médula ósea. El reordenamiento del gen BCL2 está presente en más del 90 % de los pacientes con linfoma folicular. La sobreexpresión de la proteína BCL2 se relaciona con la incapacidad de erradicar el linfoma por inhibición de la apoptosis.[4]
Pronóstico
El linfoma folicular se designa como de crecimiento lento (indolente) porque la mediana de supervivencia oscila entre 8 y 15 años, incluso en estadios avanzados.[5-7] Los pacientes con linfoma folicular en estadio avanzado no se curan con las opciones terapéuticas vigentes. La tasa de recaída es bastante constante en el tiempo, incluso en los pacientes que lograron respuestas completas al tratamiento.[8] La conducta expectante y el tratamiento diferido hasta que el paciente presente síntomas, es una opción para los pacientes con linfoma folicular en estadio avanzado.[9,10] En un índice internacional de linfoma folicular (Follicular Lymphoma International Prognostic Index [FLIPI]) [11-13] se identificaron 5 factores de riesgo significativos para el pronóstico de la supervivencia general (SG):
- Edad (≤60 vs. >60 años).
- Concentración sérica (normal vs. elevada) de lactato–deshidrogenasa (LDH).
- Estadio (estadios I o II vs. estadios III o IV).
- Concentración de hemoglobina (≥120 g/l vs. <120 g/l).
- Número de áreas ganglionares (≤4 vs. >4).
Los pacientes con menos de 2 factores de riesgo tienen una tasa de supervivencia a 10 años del 85 %, y aquellos con 3 o más factores de riesgo tienen una tasa de supervivencia a 10 años del 40 %.[11]En los criterios del índice pronóstico FLIPI-2 revisados, se propuso el reemplazo de la concentración sérica de LDH y el número de áreas ganglionares por la concentración elevada de microglobulina β2 y el tamaño de un ganglio linfático de más de 6 cm como factores pronósticos.[14] Aunque los índices FLIPI y FLIPI-2 permiten predecir la supervivencia sin progresión (SSP) y la SG, no es posible usarlos para determinar la necesidad de tratamiento ni para predecir la respuesta terapéutica.[11,14] La principal utilidad de FLIPI y FLIPI-2 es garantizar el equilibrio de los factores pronósticos o definir los requisitos de participación en ensayos clínicos aleatorizados. Es posible que personas con una puntuación de FLIPI adversa se beneficien de una conducta expectante o quizás respondan bien al tratamiento inicial. Un índice pronóstico alternativo que solo incluye la microglobulina ß2 y el compromiso de la médula ósea al inicio (PRIMA-PI) tiene la desventaja de que exige una prueba invasiva que, por lo general, no se requiere fuera del contexto de un ensayo clínico.[15] Otro índice pronóstico que solo incorporó variables clínicas no invasivas de ensayos de inmunoquimioterapia, superó los índices FLIPI, FLIPI-2 y PRIMA-PI.[16]
En 3 análisis retrospectivos, que abarcó un análisis conjunto de 5225 pacientes de 13 ensayos clínicos aleatorizados, se identificó un grupo de riesgo alto que tenía una tasa de SG a 5 años del 50 % cuando las recaídas ocurrieron dentro de los 24 meses posteriores a la quimioinmunoterapia de inducción.[17-19] En un cuarto análisis retrospectivo de 296 pacientes que recibieron bendamustina y rituximab, se encontró una tasa de SG a 2 años del 38 % (intervalo de confianza [IC] 95 %, 20−55 %) en aquellos con progresión de la enfermedad antes de 24 meses (POD24). La mayoría de estos pacientes (76 %) presentaron transformación de la enfermedad (progresión histológica a linfoma difuso de células B grandes [LDCBG]).[20] Estos pacientes con enfermedad POD24 de riesgo más alto representan una población de interés para realizar ensayos clínicos.
Abordajes terapéuticos
Debido a que los pacientes con linfoma folicular suelen presentar una evolución clínica de escasa malignidad y algunos son asintomáticos, la conducta expectante continúa siendo el estándar de atención después de la primera consulta. Esta opción también es estándar para los pacientes con enfermedad recidivante asintomática de evolución lenta. Cuando el tratamiento es necesario, se pueden usar numerosas opciones en varias secuencias con las que se obtiene una SG a 5 o 10 años equivalente.[9,21-23] El rituximab se puede administrar solo o en combinación con otras opciones de quimioterapia.[23-25] También es posible combinar el rituximab con el inmunomodulador lenalidomida para evitar la toxicidad a corto y largo plazo de los citotóxicos.[26-28] El obinutuzumab es un anticuerpo monoclonal completamente humanizado anti-CD20 que se administra solo o con quimioterapia combinada. Este fármaco es especialmente útil para los pacientes que presentan reacciones alérgicas graves al rituximab debido a anticuerpos humanos anti-ratón.[29] En ocasiones se usan células T con receptor quimérico para el antígeno (CAR) dirigido a CD19 en pacientes que presentan progresión de la enfermedad después de dos o más líneas de tratamiento.[30] En este entorno también es posible usar mosunetuzumab, un acoplador biespecífico de células T CD3 dirigido a CD20.[31] Se puede considerar la terapia de consolidación para la recaída de la enfermedad tras la terapia de reinducción con trasplante de células madre (TCM) autógeno o alogénico.[32]
Fuera del contexto de los ensayos clínicos, no se ha demostrado que el uso de pruebas de enfermedad residual medible (ERM) sea predictivo para dirigir el tratamiento de pacientes con linfoma folicular. En análisis retrospectivos de 2 ensayos prospectivos aleatorizados se encontró que aunque la negatividad para la ERM fue pronóstica del desenlace, el mantenimiento con rituximab o obinutuzumab prolongó la SSP en mayor medida entre los pacientes con enfermedad negativa para ERM.[33,34][Nivel de evidencia C2] No se indicó la interrupción del mantenimiento con rituximab o obinutuzumab en pacientes con enfermedad negativa para ERM, lo que invalidó cualquier posible cambio en el tratamiento según ese estado.
El linfoma folicular in situ y el linfoma folicular primario de duodeno son variantes de crecimiento lento que con poca frecuencia progresan o requieren tratamiento.[35,36] El linfoma folicular ganglionar de tipo pediátrico tiene un comportamiento de escasa malignidad y casi nunca recidiva; los pacientes adultos con esta variante histológica se caracterizan por una falta de reordenamiento de BCL2 junto con un índice de proliferación de Ki-67 superior al 30 % y una presentación localizada en estadio I.[37]
Los pacientes con linfoma de crecimiento lento a veces recaen y presentan un tipo histológico más maligno o agresivo. Si el patrón clínico de la recaída indica que la enfermedad exhibe un comportamiento más maligno, se deberá tomar una biopsia si esta es viable.[38] Si se confirma una conversión de la enfermedad a un tipo histológico más maligno, se debe cambiar el tratamiento a un régimen que corresponda al tipo histológico.[39] El crecimiento rápido o el crecimiento discordante en diferentes sitios de la enfermedad en ocasiones son indicadores de una conversión histológica.[38] En una revisión retrospectiva de 325 pacientes diagnosticados entre 1972 y 1999, el riesgo de transformación histológica a 10 años fue del 30 %.[40] En esta serie, los factores de riesgo alto para la transformación histológica posterior fueron estadio avanzado, FLIPI de riesgo alto y conducta expectante (en lugar de iniciar el tratamiento en el momento del diagnóstico). La tasa de SG a 5 años fue de más del 50 % para los pacientes cuya enfermedad presentó una transformación histológica maligna comprobada mediante biopsia en varios estudios de cohorte multicéntricos en los que se usó rituximab con quimioterapia a base de antraciclinas o derivados del platino, o un tratamiento similar seguido de TCM alogénico o autógeno.[38,41,42]
En un estudio prospectivo no aleatorizado, al cabo de una mediana de seguimiento de 6,8 años, 379 de 2652 pacientes (14 %) presentaron una transformación posterior a un tipo histológico más maligno después del diagnóstico inicial de linfoma folicular.[43][Nivel de evidencia C3] La mediana de SG después de la transformación fue de 5 años. Sin embargo, entre 47 pacientes con indicios de transformación junto con linfoma folicular en el momento del diagnóstico inicial, la SG no fue inferior a la de los pacientes que no presentaron transformación (tasa de SG a 5 años, 88 %; IC 95 %, 74–95 %).
El tratamiento del linfoma folicular de grado 3b es similar al del LDCBG. Para obtener más información, consultar Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido.
Linfoma linfoplasmocítico (macroglobulinemia de Waldenström)
El linfoma linfoplasmocítico (linfoplasmocitario, linfoplasmácitico o macroglobulinemia de Waldenström), suele asociarse con una paraproteína monoclonal sérica de tipo inmunoglobulina M (IgM).[44] La mayoría de los pacientes presentan compromiso medular, ganglionar y esplénico, y algunos exhiben síndrome de hiperviscosidad. La mayoría de los pacientes con macroglobulinemia de Waldenström son portadores de una variante de MYD88 lo que algunos patólogos consideran indicador de la enfermedad.[45] Es posible que otros linfomas también se asocien con paraproteínas séricas. Los pacientes con linfoma linfoplasmocítico se deben examinar para detectar una infección por el virus de la hepatitis C asociada.
En ocasiones se vigila a los pacientes asintomáticos para identificar signos de progresión de la enfermedad, sin necesidad de administrar quimioterapia de manera inmediata .[9,46,47]
Los factores pronósticos relacionados con los síntomas que requieren tratamiento son los siguientes:
- Edad de 70 años o más.
- Microglobulina β2 de 3 mg/dl o más.
- Aumento de las concentraciones séricas de LDH.[46]
En un modelo pronóstico con validación externa, se usa la edad y las concentraciones de albúmina y LDH.[48]
Abordajes terapéuticos
El tratamiento del linfoma linfoplasmocítico es similar al de otros linfomas de grado bajo, en especial al tratamiento del linfoma linfocítico difuso de células pequeñas o de la leucemia linfocítica crónica.[49-51] Si la viscosidad sérica relativa con respecto al agua es mayor de 4, el paciente quizás tenga síntomas de hiperviscosidad. La plasmaféresis es útil para los síntomas agudos temporales, como la retinopatía, la insuficiencia cardíaca congestiva y la disfunción del sistema nervioso central (SNC). También se puede combinar con quimioterapia para el control prolongado de la enfermedad. Los pacientes sintomáticos con una viscosidad sérica de 4 o más baja se suelen tratar con quimioinmunoterapia o terapias biológicas dirigidas. Es posible que se necesite administrar tratamiento a los pacientes con enfermedad por crioaglutininas crónica para corregir la anemia hemolítica; a menudo se emplea rituximab, bendamustina y corticoesteroides.[47] En ocasiones, se necesita una habitación climatizada cálida para los pacientes cuyas crioaglutininas se activan incluso ante el menor enfriamiento. Es posible que el sutimlimab, un anticuerpo monoclonal de tipo inmunoglobulina G4 que inhibe de manera selectiva la vía del complemento en C15, reduzca la hemólisis cuando las terapias dirigidas al linfoma linfoplasmocítico resultan ineficaces.[52]
Los regímenes de primera línea incluyen zanubrutinib (inhibidor de la tirosina–cinasa de Bruton [BTK]), rituximab e ibrutinib (otro inhibidor de BTK), rituximab solo, los análogos nucleosídicos y alquilantes, ya sea en monoterapia o como parte de la quimioterapia combinada.[53-56] En un ensayo prospectivo aleatorizado, 150 pacientes asintomáticos (incluso pacientes no tratados o con enfermedad recidivante) recibieron ibrutinib con rituximab o rituximab con un placebo. Al cabo de una mediana de seguimiento de 50 meses, la tasa de SSP a 4,5 años fue del 68 % en el grupo de ibrutinib y rituximab (IC 95 %, 55–78 %) y del 25 % en el grupo de rituximab y placebo (IC 95 %, 15–37 %) (cociente de riesgos instantáneos [CRI], 0,25; IC 95 %, 0,15–0,42; P < 0,0001). No hubo diferencias en la tasa de SG a 30 meses entre los 2 grupos (92–94 %).[55][Nivel de evidencia B1] El zanubrutinib, otro inhibidor de la BTK, se comparó con el ibrutinib en un ensayo clínico prospectivo aleatorizado de 164 pacientes con recaída de la enfermedad y 38 pacientes que no habían sido tratados.[56] Al cabo de una mediana de seguimiento de 44,4 meses, la tasa de SSP fue similar en ambos grupos en el 70 % al 78 % (CRI, 0,63; IC 95 %, 0,36–1,12), y la tasa de SG fue similar en ambos grupos en el 85 % al 87 % (CRI, 0,75; IC 95 %, 0,36–1,59).[57] El grupo de zanubrutinib presentó menos casos de fibrilación auricular (11 vs. 1) y un 50 % menos casos de hipertensión (no se proporcionaron datos estadísticos).[56][Nivel de evidencia C3] La inhibición de BTK con ibrutinib permitió que los 13 pacientes con anemia hemolítica autoinmunitaria mediada por anticuerpos fríos y acrocianosis alcanzaran la remisión clínica, independientemente de la afección subyacente o el estado de la variante en MYD88.[58][Nivel de evidencia C3]
Los pacientes sin tratamiento previo que recibieron rituximab tuvieron tasas de respuesta del 60 % al 80 %, pero se necesita vigilar de cerca la IgM sérica por un posible aumento repentino de esta paraproteína al comienzo del tratamiento.[59-61][Nivel de evidencia C3] El aumento de la IgM al iniciar el rituximab se evita con el uso simultáneo de un alquilante, como ciclofosfamida o los inhibidores del proteosoma, bortezomib o ixazomib.[47,62-64] Una combinación de bortezomib, dexametasona y rituximab se ha usado para evitar que la IgM vuelva a aumentar.[65-67] Los pacientes con linfoma linfoplasmocítico no tratados antes y que recibieron los análogos nucleosídicos cladribina y fludarabina, mostraron tasas de respuesta similares.[54,68,69][Nivel de evidencia C3] También obtienen tasas de respuesta similares los pacientes que recibieron monoterapias de fármacos alquilantes, como la bendamustina, el bortezomib o el venetoclax, y una quimioterapia combinada con rituximab o sin este.[54,62,64,70-74][Nivel de evidencia C3] En el caso poco frecuente de linfoma linfoplasmocítico que afecta el SNC (síndrome de Bing-Neel), el ibrutinib produjo una tasa de respuesta del 85 % en una serie anecdótica de 28 pacientes.[75][Nivel de evidencia C3]
La terapia mielosupresora con soporte de células madre hematopoyéticas autógenas o alogénicas está en evaluación clínica.[76-79] Los candidatos para recibir este abordaje deben evitar el uso a largo plazo de alquilantes o análogos nucleosídicos de purina, que pueden reducir las células madre hematopoyéticas o predisponer a los pacientes a mielodisplasia o leucemia aguda.[59,80] Después de una recaída durante la terapia con alquilantes, 92 pacientes con linfoma linfoplasmocítico se asignaron de manera aleatoria a recibir fludarabina o ciclofosfamida, doxorrubicina y prednisona. Aunque la supervivencia sin recaída favoreció la fludarabina (mediana de duración de 19 vs. 3 meses, P < 0,01), no se observaron diferencias en la SG.[81][Nivel de evidencia B1]
Linfoma de zona marginal
Los linfomas de zona marginal que tienen compromiso ganglionar se llaman linfomas de células B monocitoides o linfomas ganglionares de células B de zona marginal. Cuando estos linfomas afectan sitios extraganglionares (por ejemplo, tubo digestivo, tiroides, pulmón, mama, órbita y piel), se llaman linfomas de tejido linfático asociado a mucosas (MALT).[82,83] El linfoma esplénico de zona marginal es una entidad clínica distinta que, por lo general, se presenta con esplenomegalia masiva. Una variante del linfoma MALT se conoce como enfermedad inmunoproliferativa del intestino delgado (EIPID).[83] Un índice pronóstico de todos los linfomas de zona marginal incluye 3 factores de pronóstico adverso: edad de 70 años o más, enfermedad en estadio III o estadio IV, y concentración elevada de LDH.[84] Menos del 10 % de los pacientes presentan una transformación a un linfoma de grado más alto. En una revisión retrospectiva, los factores de riesgo de transformación incluyeron la concentración elevada de LDH, más de 4 sitios ganglionares en el momento del diagnóstico inicial de linfoma de zona marginal y el fracaso en lograr una respuesta completa después del tratamiento inicial.[85]
Linfoma gástrico de tejido linfoide asociado a mucosas
Muchos pacientes tienen antecedentes de una enfermedad autoinmunitaria, como la tiroiditis de Hashimoto, el síndrome de Sjögren o una gastritis por Helicobacter pylori. La mayoría de los pacientes presentan una enfermedad extraganglionar en estadio I o estadio II, a menudo en el estómago. El tratamiento de la infección por H. pylori resuelve casi todos los casos de compromiso gástrico localizado.[86,87] Después de administrar regímenes antibióticos estándar, el 50 % de los pacientes exhibe resolución del compromiso gástrico de tejido linfoide asociado a mucosas (MALT) en la endoscopia al cabo de 3 meses. Otros pacientes suelen curarse después de 12 a 18 meses de observación. Entre los pacientes que logran una remisión completa, el 30 % muestran monoclonalidad de un reordenamiento de la cadena pesada de las inmunoglobulinas en las biopsias de estómago al cabo de una mediana de seguimiento de 5 años.[88] Se desconoce la implicación clínica de este hallazgo. La translocación t(11;18) en pacientes con linfoma gástrico de MALT predice una respuesta inadecuada al tratamiento antibiótico y a los alquilantes orales, además de pruebas negativas para la infección por H. pylori.[89-91] Se ha hecho un seguimiento exitoso de los pacientes con enfermedad asintomática estable y biopsias positivas persistentes, con un abordaje de conducta expectante hasta el momento de progresión de la enfermedad.[87] Los pacientes con progresión de la enfermedad se tratan con radioterapia,[92-97] rituximab,[98] cirugía (gastrectomía total o gastrectomía parcial con radioterapia),[99] quimioterapia,[100] o terapia de modalidad combinada.[101] En un ensayo prospectivo de un solo grupo, se inscribieron 24 pacientes con linfoma gástrico de MALT negativo para H. pylori de diagnóstico reciente o en recaída.[97] La mayoría de los pacientes tuvieron una respuesta completa a 4 Gy de radioterapia y recibieron 20 Gy como terapia de rescate. La tasa de control local a 3 años fue del 96 % (IC 95 %, 88–100 %).[97][Nivel de evidencia C3] La ecografía endoscópica puede ayudar a los profesionales clínicos a vigilar las respuestas en estos pacientes.[102] En 4 series de casos que incluyeron a más de 100 pacientes con LDCBG en estadio IE o IIE con linfoma MALT o sin este (positivo para H. pylori), se notificaron remisiones completas duraderas en más del 50 % de los pacientes tras el tratamiento del H. pylori.[103-106]
Linfoma extragástrico de tejido linfoide asociado a mucosas
El compromiso localizado de otros sitios se puede tratar con radioterapia o cirugía.[93-95,107-110] En algunas series, los pacientes con linfoma extragástrico de MALT tienen una tasa de recaída más alta que los pacientes con linfoma gástrico de MALT, y pueden presentar recaídas después de muchos años, incluso décadas.[111] Muchas de estas recidivas comprometen sitios de MALT diferentes a la ubicación original.[112] Cuando se disemina a los ganglios linfáticos, la médula ósea o la sangre, esta entidad se comporta como otros linfomas de grado bajo.[113,114] En un ensayo prospectivo aleatorizado de 401 pacientes con linfoma extragástrico y extraganglionar de MALT se comparó el clorambucilo solo versus rituximab y clorambucilo versus rituximab solo.[115] Después de una mediana de seguimiento de 7,4 años, la supervivencia sin complicaciones fue del 68 % en el grupo de rituximab y clorambucilo, del 51 % en el grupo de rituximab solo y del 50 % en el grupo de clorambucilo solo (P = 0,0009). Sin embargo, la tasa de SG a 5 años fue del 90 % en todos los grupos.[115] En una revisión de la bibliografía que incluyó a 131 pacientes, se encontró que en los pacientes con linfoma de MALT en los anejos oculares, el tratamiento con antibióticos dirigidos a Chlamydia psittaci produjo remisiones duraderas en casi la mitad de los pacientes.[116][Nivel de evidencia C3] Estas respuestas a la doxiciclina se observaron sobre todo en ensayos italianos y con menor frecuencia en ensayos realizados en otros lugares geográficos.[117] Los linfomas de células B grandes en sitios de MALT se clasifican y tratan como linfomas difusos de células grandes.[118] En una revisión retrospectiva grande de linfomas primarios de MALT en los anejos oculares, se encontró que después de 10 años de seguimiento, en el 4 % de los pacientes en estadio I tratados con radioterapia se presentó transformación a LDCBG y el 3 % presentó compromiso del SNC.[119]
Linfoma ganglionar de zona marginal
Los pacientes con linfoma ganglionar de zona marginal (linfoma de células B monocitoides) se someten a conducta expectante o reciben tratamiento como el que se describe para el linfoma linfoplasmocítico. Se puede usar rituximab solo o combinado con citotóxicos (como bendamustina). El zanubrutinib está aprobado para los pacientes con recaída de la enfermedad después de recibir un régimen con rituximab. Esta aprobación se basó en un estudio de fase II de un solo grupo.[120] Después de una mediana de seguimiento de 15,7 meses, la tasa de respuesta general fue del 68,2 % y la tasa de respuesta completa fue del 25,8 %. La mediana de duración de la respuesta fue del 93 % a los 12 meses.[120][Nivel de evidencia C3] El ibrutinib también mostró una eficacia similar en pacientes con linfoma de zona marginal en recaída.[121][Nivel de evidencia C3] Al igual que con el linfoma folicular, los pacientes con POD24 que necesitaron iniciar el tratamiento tuvieron un pronóstico más precario (tasa de SG a 3 años del 53 %) que los pacientes sin POD24 (tasa de SG a 3 años del 95 %).[122] Entre los pacientes con infección por el virus de la hepatitis C (VHC) concomitante, del 40 % al 60 % lograron una remisión completa o parcial después de que desapareciera el RNA del VHC detectable con tratamiento antivírico.[123,124][Nivel de evidencia C3]
Linfoma abdominal mediterráneo
Otra versión del linfoma de MALT es la enfermedad conocida de forma variada como linfoma abdominal mediterráneo, enfermedad de cadena pesada o enfermedad inmunoproliferativa del intestino delgado (EIPID), que se presenta en adultos jóvenes en países del Mediterráneo oriental. Esta enfermedad responde a los antibióticos en sus estadios iniciales.[125] Se identificó que Campylobacter jejuni es una de las especies bacterianas relacionadas con la EIPID, y que el tratamiento antibiótico quizás produzca remisión de la enfermedad.[126]
Linfoma esplénico de zona marginal
El linfoma esplénico de zona marginal es un linfoma de crecimiento lento que se caracteriza por esplenomegalia masiva y compromiso de la sangre periférica y la médula ósea, por lo general, sin adenopatía.[127,128] Este tipo de linfoma también se conoce como linfoma esplénico con linfocitos vellosos. La esplenectomía a veces produce remisión prolongada.[129,130]
El tratamiento es similar al de otros linfomas de grado bajo y por lo general incluye rituximab solo o rituximab en combinación con análogos de las purinas o quimioterapia con alquilantes.[131] El linfoma esplénico de zona marginal no responde tan bien a la quimioterapia que suele ser eficaz para la leucemia linfocítica crónica.[127,131,132] Entre un pequeño número de pacientes con linfoma esplénico de zona marginal (linfoma esplénico con linfocitos vellosos) e infección por el VHC, la mayoría lograron una remisión completa o parcial tras la desaparición del RNA del VHC detectable gracias al tratamiento con interferón-α, con ribavirina o sin esta.[123,133]; [134][Nivel de evidencia C3] En contraste, no se observaron respuestas al interferón en 6 pacientes sin infección por el VHC.
Bibliografía
- Armitage JO, Weisenburger DD: New approach to classifying non-Hodgkin's lymphomas: clinical features of the major histologic subtypes. Non-Hodgkin's Lymphoma Classification Project. J Clin Oncol 16 (8): 2780-95, 1998. [PUBMED Abstract]
- A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin's lymphoma. The Non-Hodgkin's Lymphoma Classification Project. Blood 89 (11): 3909-18, 1997. [PUBMED Abstract]
- Society for Hematopathology Program: Society for Hematopathology Program. Am J Surg Pathol 21 (1): 114-121, 1997.
- López-Guillermo A, Cabanillas F, McDonnell TI, et al.: Correlation of bcl-2 rearrangement with clinical characteristics and outcome in indolent follicular lymphoma. Blood 93 (9): 3081-7, 1999. [PUBMED Abstract]
- Peterson BA, Petroni GR, Frizzera G, et al.: Prolonged single-agent versus combination chemotherapy in indolent follicular lymphomas: a study of the cancer and leukemia group B. J Clin Oncol 21 (1): 5-15, 2003. [PUBMED Abstract]
- Swenson WT, Wooldridge JE, Lynch CF, et al.: Improved survival of follicular lymphoma patients in the United States. J Clin Oncol 23 (22): 5019-26, 2005. [PUBMED Abstract]
- Liu Q, Fayad L, Cabanillas F, et al.: Improvement of overall and failure-free survival in stage IV follicular lymphoma: 25 years of treatment experience at The University of Texas M.D. Anderson Cancer Center. J Clin Oncol 24 (10): 1582-9, 2006. [PUBMED Abstract]
- Kahl BS, Yang DT: Follicular lymphoma: evolving therapeutic strategies. Blood 127 (17): 2055-63, 2016. [PUBMED Abstract]
- Ardeshna KM, Smith P, Norton A, et al.: Long-term effect of a watch and wait policy versus immediate systemic treatment for asymptomatic advanced-stage non-Hodgkin lymphoma: a randomised controlled trial. Lancet 362 (9383): 516-22, 2003. [PUBMED Abstract]
- Armitage JO, Longo DL: Is watch and wait still acceptable for patients with low-grade follicular lymphoma? Blood 127 (23): 2804-8, 2016. [PUBMED Abstract]
- Solal-Céligny P, Roy P, Colombat P, et al.: Follicular lymphoma international prognostic index. Blood 104 (5): 1258-65, 2004. [PUBMED Abstract]
- Perea G, Altés A, Montoto S, et al.: Prognostic indexes in follicular lymphoma: a comparison of different prognostic systems. Ann Oncol 16 (9): 1508-13, 2005. [PUBMED Abstract]
- Buske C, Hoster E, Dreyling M, et al.: The Follicular Lymphoma International Prognostic Index (FLIPI) separates high-risk from intermediate- or low-risk patients with advanced-stage follicular lymphoma treated front-line with rituximab and the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (R-CHOP) with respect to treatment outcome. Blood 108 (5): 1504-8, 2006. [PUBMED Abstract]
- Federico M, Bellei M, Marcheselli L, et al.: Follicular lymphoma international prognostic index 2: a new prognostic index for follicular lymphoma developed by the international follicular lymphoma prognostic factor project. J Clin Oncol 27 (27): 4555-62, 2009. [PUBMED Abstract]
- Bachy E, Maurer MJ, Habermann TM, et al.: A simplified scoring system in de novo follicular lymphoma treated initially with immunochemotherapy. Blood 132 (1): 49-58, 2018. [PUBMED Abstract]
- Mir F, Mattiello F, Grigg A, et al.: Follicular Lymphoma Evaluation Index (FLEX): A new clinical prognostic model that is superior to existing risk scores for predicting progression-free survival and early treatment failure after frontline immunochemotherapy. Am J Hematol 95 (12): 1503-1510, 2020. [PUBMED Abstract]
- Casulo C, Byrtek M, Dawson KL, et al.: Early Relapse of Follicular Lymphoma After Rituximab Plus Cyclophosphamide, Doxorubicin, Vincristine, and Prednisone Defines Patients at High Risk for Death: An Analysis From the National LymphoCare Study. J Clin Oncol 33 (23): 2516-22, 2015. [PUBMED Abstract]
- Shi Q, Flowers CR, Hiddemann W, et al.: Thirty-Month Complete Response as a Surrogate End Point in First-Line Follicular Lymphoma Therapy: An Individual Patient-Level Analysis of Multiple Randomized Trials. J Clin Oncol 35 (5): 552-560, 2017. [PUBMED Abstract]
- Casulo C, Dixon JG, Le-Rademacher J, et al.: Validation of POD24 as a robust early clinical end point of poor survival in FL from 5225 patients on 13 clinical trials. Blood 139 (11): 1684-1693, 2022. [PUBMED Abstract]
- Freeman CL, Kridel R, Moccia AA, et al.: Early progression after bendamustine-rituximab is associated with high risk of transformation in advanced stage follicular lymphoma. Blood 134 (9): 761-764, 2019. [PUBMED Abstract]
- Brice P, Bastion Y, Lepage E, et al.: Comparison in low-tumor-burden follicular lymphomas between an initial no-treatment policy, prednimustine, or interferon alfa: a randomized study from the Groupe d'Etude des Lymphomes Folliculaires. Groupe d'Etude des Lymphomes de l'Adulte. J Clin Oncol 15 (3): 1110-7, 1997. [PUBMED Abstract]
- Young RC, Longo DL, Glatstein E, et al.: The treatment of indolent lymphomas: watchful waiting v aggressive combined modality treatment. Semin Hematol 25 (2 Suppl 2): 11-6, 1988. [PUBMED Abstract]
- Luminari S, Ferrari A, Manni M, et al.: Long-Term Results of the FOLL05 Trial Comparing R-CVP Versus R-CHOP Versus R-FM for the Initial Treatment of Patients With Advanced-Stage Symptomatic Follicular Lymphoma. J Clin Oncol 36 (7): 689-696, 2018. [PUBMED Abstract]
- Lockmer S, Østenstad B, Hagberg H, et al.: Chemotherapy-Free Initial Treatment of Advanced Indolent Lymphoma Has Durable Effect With Low Toxicity: Results From Two Nordic Lymphoma Group Trials With More Than 10 Years of Follow-Up. J Clin Oncol : JCO1800262, 2018. [PUBMED Abstract]
- Cartron G, Bachy E, Tilly H, et al.: Randomized Phase III Trial Evaluating Subcutaneous Rituximab for the First-Line Treatment of Low-Tumor Burden Follicular Lymphoma: Results of a LYSA Study. J Clin Oncol 41 (19): 3523-3533, 2023. [PUBMED Abstract]
- Morschhauser F, Fowler NH, Feugier P, et al.: Rituximab plus Lenalidomide in Advanced Untreated Follicular Lymphoma. N Engl J Med 379 (10): 934-947, 2018. [PUBMED Abstract]
- Leonard JP, Trnený M, Izutsu K, et al.: Augment: a phase III randomized study of lenalidomide Plus rituximab (R2) vs rituximab/placebo in patients with relapsed/refractory indolent non-Hodgkin lymphoma. [Abstract] Blood 132 (Suppl 1): A-445, 2018.
- Zucca E, Rondeau S, Vanazzi A, et al.: Short regimen of rituximab plus lenalidomide in follicular lymphoma patients in need of first-line therapy. Blood 134 (4): 353-362, 2019. [PUBMED Abstract]
- Marcus R, Davies A, Ando K, et al.: Obinutuzumab for the First-Line Treatment of Follicular Lymphoma. N Engl J Med 377 (14): 1331-1344, 2017. [PUBMED Abstract]
- Jacobson CA, Chavez JC, Sehgal AR, et al.: Axicabtagene ciloleucel in relapsed or refractory indolent non-Hodgkin lymphoma (ZUMA-5): a single-arm, multicentre, phase 2 trial. Lancet Oncol 23 (1): 91-103, 2022. [PUBMED Abstract]
- Bartlett NL, Sehn LH, Matasar MJ, et al.: Mosunetuzumab monotherapy demonstrates durable efficacy with a manageable safety profile in patients with relapsed/refractory follicular lymphoma who received ≥2 prior therapies: updated results from a pivotal phase II study. [Abstract] Blood 140 (Suppl 1): A-610, 1467-70, 2022.
- Schaaf M, Reiser M, Borchmann P, et al.: High-dose therapy with autologous stem cell transplantation versus chemotherapy or immuno-chemotherapy for follicular lymphoma in adults. Cochrane Database Syst Rev 1: CD007678, 2012. [PUBMED Abstract]
- Luminari S, Manni M, Galimberti S, et al.: Response-Adapted Postinduction Strategy in Patients With Advanced-Stage Follicular Lymphoma: The FOLL12 Study. J Clin Oncol 40 (7): 729-739, 2022. [PUBMED Abstract]
- Pott C, Jurinovic V, Trotman J, et al.: Minimal Residual Disease Status Predicts Outcome in Patients With Previously Untreated Follicular Lymphoma: A Prospective Analysis of the Phase III GALLIUM Study. J Clin Oncol 42 (5): 550-561, 2024. [PUBMED Abstract]
- Schmatz AI, Streubel B, Kretschmer-Chott E, et al.: Primary follicular lymphoma of the duodenum is a distinct mucosal/submucosal variant of follicular lymphoma: a retrospective study of 63 cases. J Clin Oncol 29 (11): 1445-51, 2011. [PUBMED Abstract]
- Jegalian AG, Eberle FC, Pack SD, et al.: Follicular lymphoma in situ: clinical implications and comparisons with partial involvement by follicular lymphoma. Blood 118 (11): 2976-84, 2011. [PUBMED Abstract]
- Louissaint A, Ackerman AM, Dias-Santagata D, et al.: Pediatric-type nodal follicular lymphoma: an indolent clonal proliferation in children and adults with high proliferation index and no BCL2 rearrangement. Blood 120 (12): 2395-404, 2012. [PUBMED Abstract]
- Sarkozy C, Trneny M, Xerri L, et al.: Risk Factors and Outcomes for Patients With Follicular Lymphoma Who Had Histologic Transformation After Response to First-Line Immunochemotherapy in the PRIMA Trial. J Clin Oncol 34 (22): 2575-82, 2016. [PUBMED Abstract]
- Tsimberidou AM, O'Brien S, Khouri I, et al.: Clinical outcomes and prognostic factors in patients with Richter's syndrome treated with chemotherapy or chemoimmunotherapy with or without stem-cell transplantation. J Clin Oncol 24 (15): 2343-51, 2006. [PUBMED Abstract]
- Montoto S, Davies AJ, Matthews J, et al.: Risk and clinical implications of transformation of follicular lymphoma to diffuse large B-cell lymphoma. J Clin Oncol 25 (17): 2426-33, 2007. [PUBMED Abstract]
- Villa D, Crump M, Panzarella T, et al.: Autologous and allogeneic stem-cell transplantation for transformed follicular lymphoma: a report of the Canadian blood and marrow transplant group. J Clin Oncol 31 (9): 1164-71, 2013. [PUBMED Abstract]
- Williams CD, Harrison CN, Lister TA, et al.: High-dose therapy and autologous stem-cell support for chemosensitive transformed low-grade follicular non-Hodgkin's lymphoma: a case-matched study from the European Bone Marrow Transplant Registry. J Clin Oncol 19 (3): 727-35, 2001. [PUBMED Abstract]
- Wagner-Johnston ND, Link BK, Byrtek M, et al.: Outcomes of transformed follicular lymphoma in the modern era: a report from the National LymphoCare Study (NLCS). Blood 126 (7): 851-7, 2015. [PUBMED Abstract]
- Leblond V, Kastritis E, Advani R, et al.: Treatment recommendations from the Eighth International Workshop on Waldenström's Macroglobulinemia. Blood 128 (10): 1321-8, 2016. [PUBMED Abstract]
- Treon SP, Xu L, Yang G, et al.: MYD88 L265P somatic mutation in Waldenström's macroglobulinemia. N Engl J Med 367 (9): 826-33, 2012. [PUBMED Abstract]
- Dhodapkar MV, Hoering A, Gertz MA, et al.: Long-term survival in Waldenstrom macroglobulinemia: 10-year follow-up of Southwest Oncology Group-directed intergroup trial S9003. Blood 113 (4): 793-6, 2009. [PUBMED Abstract]
- Ansell SM, Kyle RA, Reeder CB, et al.: Diagnosis and management of Waldenström macroglobulinemia: Mayo stratification of macroglobulinemia and risk-adapted therapy (mSMART) guidelines. Mayo Clin Proc 85 (9): 824-33, 2010. [PUBMED Abstract]
- Zanwar S, Le-Rademacher J, Durot E, et al.: Simplified Risk Stratification Model for Patients With Waldenström Macroglobulinemia. J Clin Oncol 42 (21): 2527-2536, 2024. [PUBMED Abstract]
- Kapoor P, Ansell SM, Fonseca R, et al.: Diagnosis and Management of Waldenström Macroglobulinemia: Mayo Stratification of Macroglobulinemia and Risk-Adapted Therapy (mSMART) Guidelines 2016. JAMA Oncol 3 (9): 1257-1265, 2017. [PUBMED Abstract]
- Dimopoulos MA, Kastritis E: How I treat Waldenström macroglobulinemia. Blood 134 (23): 2022-2035, 2019. [PUBMED Abstract]
- Gertz MA: Waldenstrom Macroglobulinemia: Tailoring Therapy for the Individual. J Clin Oncol 40 (23): 2600-2608, 2022. [PUBMED Abstract]
- Röth A, Berentsen S, Barcellini W, et al.: Sutimlimab in patients with cold agglutinin disease: results of the randomized placebo-controlled phase 3 CADENZA trial. Blood 140 (9): 980-991, 2022. [PUBMED Abstract]
- Buske C, Dimopoulos MA, Grunenberg A, et al.: Bortezomib-Dexamethasone, Rituximab, and Cyclophosphamide as First-Line Treatment for Waldenström's Macroglobulinemia: A Prospectively Randomized Trial of the European Consortium for Waldenström's Macroglobulinemia. J Clin Oncol 41 (14): 2607-2616, 2023. [PUBMED Abstract]
- Leblond V, Johnson S, Chevret S, et al.: Results of a randomized trial of chlorambucil versus fludarabine for patients with untreated Waldenström macroglobulinemia, marginal zone lymphoma, or lymphoplasmacytic lymphoma. J Clin Oncol 31 (3): 301-7, 2013. [PUBMED Abstract]
- Buske C, Tedeschi A, Trotman J, et al.: Ibrutinib Plus Rituximab Versus Placebo Plus Rituximab for Waldenström's Macroglobulinemia: Final Analysis From the Randomized Phase III iNNOVATE Study. J Clin Oncol 40 (1): 52-62, 2022. [PUBMED Abstract]
- Tam CS, Opat S, D'Sa S, et al.: A randomized phase 3 trial of zanubrutinib vs ibrutinib in symptomatic Waldenström macroglobulinemia: the ASPEN study. Blood 136 (18): 2038-2050, 2020. [PUBMED Abstract]
- Dimopoulos MA, Opat S, D'Sa S, et al.: Zanubrutinib Versus Ibrutinib in Symptomatic Waldenström Macroglobulinemia: Final Analysis From the Randomized Phase III ASPEN Study. J Clin Oncol 41 (33): 5099-5106, 2023. [PUBMED Abstract]
- Jalink M, Berentsen S, Castillo JJ, et al.: Effect of ibrutinib treatment on hemolytic anemia and acrocyanosis in cold agglutinin disease/cold agglutinin syndrome. Blood 138 (20): 2002-2005, 2021. [PUBMED Abstract]
- Gertz MA, Anagnostopoulos A, Anderson K, et al.: Treatment recommendations in Waldenstrom's macroglobulinemia: consensus panel recommendations from the Second International Workshop on Waldenstrom's Macroglobulinemia. Semin Oncol 30 (2): 121-6, 2003. [PUBMED Abstract]
- Dimopoulos MA, Zervas C, Zomas A, et al.: Treatment of Waldenström's macroglobulinemia with rituximab. J Clin Oncol 20 (9): 2327-33, 2002. [PUBMED Abstract]
- Treon SP, Branagan AR, Hunter Z, et al.: Paradoxical increases in serum IgM and viscosity levels following rituximab in Waldenstrom's macroglobulinemia. Ann Oncol 15 (10): 1481-3, 2004. [PUBMED Abstract]
- Dimopoulos MA, Chen C, Kastritis E, et al.: Bortezomib as a treatment option in patients with Waldenström macroglobulinemia. Clin Lymphoma Myeloma Leuk 10 (2): 110-7, 2010. [PUBMED Abstract]
- Gavriatopoulou M, García-Sanz R, Kastritis E, et al.: BDR in newly diagnosed patients with WM: final analysis of a phase 2 study after a minimum follow-up of 6 years. Blood 129 (4): 456-459, 2017. [PUBMED Abstract]
- Kersten MJ, Amaador K, Minnema MC, et al.: Combining Ixazomib With Subcutaneous Rituximab and Dexamethasone in Relapsed or Refractory Waldenström's Macroglobulinemia: Final Analysis of the Phase I/II HOVON124/ECWM-R2 Study. J Clin Oncol 40 (1): 40-51, 2022. [PUBMED Abstract]
- Treon SP, Ioakimidis L, Soumerai JD, et al.: Primary therapy of Waldenström macroglobulinemia with bortezomib, dexamethasone, and rituximab: WMCTG clinical trial 05-180. J Clin Oncol 27 (23): 3830-5, 2009. [PUBMED Abstract]
- Dimopoulos MA, García-Sanz R, Gavriatopoulou M, et al.: Primary therapy of Waldenstrom macroglobulinemia (WM) with weekly bortezomib, low-dose dexamethasone, and rituximab (BDR): long-term results of a phase 2 study of the European Myeloma Network (EMN). Blood 122 (19): 3276-82, 2013. [PUBMED Abstract]
- Treon SP, Tripsas CK, Meid K, et al.: Carfilzomib, rituximab, and dexamethasone (CaRD) treatment offers a neuropathy-sparing approach for treating Waldenström's macroglobulinemia. Blood 124 (4): 503-10, 2014. [PUBMED Abstract]
- Dimopoulos MA, Alexanian R: Waldenstrom's macroglobulinemia. Blood 83 (6): 1452-9, 1994. [PUBMED Abstract]
- Laszlo D, Andreola G, Rigacci L, et al.: Rituximab and subcutaneous 2-chloro-2'-deoxyadenosine combination treatment for patients with Waldenstrom macroglobulinemia: clinical and biologic results of a phase II multicenter study. J Clin Oncol 28 (13): 2233-8, 2010. [PUBMED Abstract]
- García-Sanz R, Montoto S, Torrequebrada A, et al.: Waldenström macroglobulinaemia: presenting features and outcome in a series with 217 cases. Br J Haematol 115 (3): 575-82, 2001. [PUBMED Abstract]
- Buske C, Hoster E, Dreyling M, et al.: The addition of rituximab to front-line therapy with CHOP (R-CHOP) results in a higher response rate and longer time to treatment failure in patients with lymphoplasmacytic lymphoma: results of a randomized trial of the German Low-Grade Lymphoma Study Group (GLSG). Leukemia 23 (1): 153-61, 2009. [PUBMED Abstract]
- Ghobrial IM, Hong F, Padmanabhan S, et al.: Phase II trial of weekly bortezomib in combination with rituximab in relapsed or relapsed and refractory Waldenstrom macroglobulinemia. J Clin Oncol 28 (8): 1422-8, 2010. [PUBMED Abstract]
- Rummel MJ, Niederle N, Maschmeyer G, et al.: Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet 381 (9873): 1203-10, 2013. [PUBMED Abstract]
- Castillo JJ, Allan JN, Siddiqi T, et al.: Venetoclax in Previously Treated Waldenström Macroglobulinemia. J Clin Oncol 40 (1): 63-71, 2022. [PUBMED Abstract]
- Castillo JJ, Itchaki G, Paludo J, et al.: Ibrutinib for the treatment of Bing-Neel syndrome: a multicenter study. Blood 133 (4): 299-305, 2019. [PUBMED Abstract]
- Dreger P, Glass B, Kuse R, et al.: Myeloablative radiochemotherapy followed by reinfusion of purged autologous stem cells for Waldenström's macroglobulinaemia. Br J Haematol 106 (1): 115-8, 1999. [PUBMED Abstract]
- Desikan R, Dhodapkar M, Siegel D, et al.: High-dose therapy with autologous haemopoietic stem cell support for Waldenström's macroglobulinaemia. Br J Haematol 105 (4): 993-6, 1999. [PUBMED Abstract]
- Martin P, Chadburn A, Christos P, et al.: Intensive treatment strategies may not provide superior outcomes in mantle cell lymphoma: overall survival exceeding 7 years with standard therapies. Ann Oncol 19 (7): 1327-30, 2008. [PUBMED Abstract]
- Kyriakou C, Canals C, Cornelissen JJ, et al.: Allogeneic stem-cell transplantation in patients with Waldenström macroglobulinemia: report from the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 28 (33): 4926-34, 2010. [PUBMED Abstract]
- Leleu X, Soumerai J, Roccaro A, et al.: Increased incidence of transformation and myelodysplasia/acute leukemia in patients with Waldenström macroglobulinemia treated with nucleoside analogs. J Clin Oncol 27 (2): 250-5, 2009. [PUBMED Abstract]
- Leblond V, Lévy V, Maloisel F, et al.: Multicenter, randomized comparative trial of fludarabine and the combination of cyclophosphamide-doxorubicin-prednisone in 92 patients with Waldenström macroglobulinemia in first relapse or with primary refractory disease. Blood 98 (9): 2640-4, 2001. [PUBMED Abstract]
- Zucca E, Bertoni F: The spectrum of MALT lymphoma at different sites: biological and therapeutic relevance. Blood 127 (17): 2082-92, 2016. [PUBMED Abstract]
- Rossi D, Bertoni F, Zucca E: Marginal-Zone Lymphomas. N Engl J Med 386 (6): 568-581, 2022. [PUBMED Abstract]
- Thieblemont C, Cascione L, Conconi A, et al.: A MALT lymphoma prognostic index. Blood 130 (12): 1409-1417, 2017. [PUBMED Abstract]
- Alderuccio JP, Zhao W, Desai A, et al.: Risk Factors for Transformation to Higher-Grade Lymphoma and Its Impact on Survival in a Large Cohort of Patients With Marginal Zone Lymphoma From a Single Institution. J Clin Oncol : JCO1800138, 2018. [PUBMED Abstract]
- Zullo A, Hassan C, Andriani A, et al.: Eradication therapy for Helicobacter pylori in patients with gastric MALT lymphoma: a pooled data analysis. Am J Gastroenterol 104 (8): 1932-7; quiz 1938, 2009. [PUBMED Abstract]
- Nakamura S, Sugiyama T, Matsumoto T, et al.: Long-term clinical outcome of gastric MALT lymphoma after eradication of Helicobacter pylori: a multicentre cohort follow-up study of 420 patients in Japan. Gut 61 (4): 507-13, 2012. [PUBMED Abstract]
- Wündisch T, Thiede C, Morgner A, et al.: Long-term follow-up of gastric MALT lymphoma after Helicobacter pylori eradication. J Clin Oncol 23 (31): 8018-24, 2005. [PUBMED Abstract]
- Ye H, Liu H, Raderer M, et al.: High incidence of t(11;18)(q21;q21) in Helicobacter pylori-negative gastric MALT lymphoma. Blood 101 (7): 2547-50, 2003. [PUBMED Abstract]
- Lévy M, Copie-Bergman C, Gameiro C, et al.: Prognostic value of translocation t(11;18) in tumoral response of low-grade gastric lymphoma of mucosa-associated lymphoid tissue type to oral chemotherapy. J Clin Oncol 23 (22): 5061-6, 2005. [PUBMED Abstract]
- Nakamura S, Ye H, Bacon CM, et al.: Clinical impact of genetic aberrations in gastric MALT lymphoma: a comprehensive analysis using interphase fluorescence in situ hybridisation. Gut 56 (10): 1358-63, 2007. [PUBMED Abstract]
- Schechter NR, Yahalom J: Low-grade MALT lymphoma of the stomach: a review of treatment options. Int J Radiat Oncol Biol Phys 46 (5): 1093-103, 2000. [PUBMED Abstract]
- Tsang RW, Gospodarowicz MK, Pintilie M, et al.: Stage I and II MALT lymphoma: results of treatment with radiotherapy. Int J Radiat Oncol Biol Phys 50 (5): 1258-64, 2001. [PUBMED Abstract]
- Tsang RW, Gospodarowicz MK, Pintilie M, et al.: Localized mucosa-associated lymphoid tissue lymphoma treated with radiation therapy has excellent clinical outcome. J Clin Oncol 21 (22): 4157-64, 2003. [PUBMED Abstract]
- Tsai HK, Li S, Ng AK, et al.: Role of radiation therapy in the treatment of stage I/II mucosa-associated lymphoid tissue lymphoma. Ann Oncol 18 (4): 672-8, 2007. [PUBMED Abstract]
- De Leo AN, Bates JE, Lockney NA, et al.: Radiotherapy in Early-stage Gastric MALT: Improved Survival Without Increased Cardiac Death. Am J Clin Oncol 43 (11): 770-775, 2020. [PUBMED Abstract]
- Gunther JR, Xu J, Bhutani MS, et al.: Response-adapted ultra-low-dose 4 Gy radiation as definitive therapy of gastric MALT lymphoma: a single-centre, pilot trial. Lancet Haematol 11 (7): e521-e529, 2024. [PUBMED Abstract]
- Martinelli G, Laszlo D, Ferreri AJ, et al.: Clinical activity of rituximab in gastric marginal zone non-Hodgkin's lymphoma resistant to or not eligible for anti-Helicobacter pylori therapy. J Clin Oncol 23 (9): 1979-83, 2005. [PUBMED Abstract]
- Cogliatti SB, Schmid U, Schumacher U, et al.: Primary B-cell gastric lymphoma: a clinicopathological study of 145 patients. Gastroenterology 101 (5): 1159-70, 1991. [PUBMED Abstract]
- Zinzani PL, Magagnoli M, Galieni P, et al.: Nongastrointestinal low-grade mucosa-associated lymphoid tissue lymphoma: analysis of 75 patients. J Clin Oncol 17 (4): 1254, 1999. [PUBMED Abstract]
- Thieblemont C, Bastion Y, Berger F, et al.: Mucosa-associated lymphoid tissue gastrointestinal and nongastrointestinal lymphoma behavior: analysis of 108 patients. J Clin Oncol 15 (4): 1624-30, 1997. [PUBMED Abstract]
- Pavlick AC, Gerdes H, Portlock CS: Endoscopic ultrasound in the evaluation of gastric small lymphocytic mucosa-associated lymphoid tumors. J Clin Oncol 15 (5): 1761-6, 1997. [PUBMED Abstract]
- Morgner A, Miehlke S, Fischbach W, et al.: Complete remission of primary high-grade B-cell gastric lymphoma after cure of Helicobacter pylori infection. J Clin Oncol 19 (7): 2041-8, 2001. [PUBMED Abstract]
- Chen LT, Lin JT, Shyu RY, et al.: Prospective study of Helicobacter pylori eradication therapy in stage I(E) high-grade mucosa-associated lymphoid tissue lymphoma of the stomach. J Clin Oncol 19 (22): 4245-51, 2001. [PUBMED Abstract]
- Chen LT, Lin JT, Tai JJ, et al.: Long-term results of anti-Helicobacter pylori therapy in early-stage gastric high-grade transformed MALT lymphoma. J Natl Cancer Inst 97 (18): 1345-53, 2005. [PUBMED Abstract]
- Kuo SH, Yeh KH, Wu MS, et al.: Helicobacter pylori eradication therapy is effective in the treatment of early-stage H pylori-positive gastric diffuse large B-cell lymphomas. Blood 119 (21): 4838-44; quiz 5057, 2012. [PUBMED Abstract]
- Uno T, Isobe K, Shikama N, et al.: Radiotherapy for extranodal, marginal zone, B-cell lymphoma of mucosa-associated lymphoid tissue originating in the ocular adnexa: a multiinstitutional, retrospective review of 50 patients. Cancer 98 (4): 865-71, 2003. [PUBMED Abstract]
- Bayraktar S, Bayraktar UD, Stefanovic A, et al.: Primary ocular adnexal mucosa-associated lymphoid tissue lymphoma (MALT): single institution experience in a large cohort of patients. Br J Haematol 152 (1): 72-80, 2011. [PUBMED Abstract]
- Stefanovic A, Lossos IS: Extranodal marginal zone lymphoma of the ocular adnexa. Blood 114 (3): 501-10, 2009. [PUBMED Abstract]
- Vazquez A, Khan MN, Sanghvi S, et al.: Extranodal marginal zone lymphoma of mucosa-associated lymphoid tissue of the salivary glands: a population-based study from 1994 to 2009. Head Neck 37 (1): 18-22, 2015. [PUBMED Abstract]
- Raderer M, Streubel B, Woehrer S, et al.: High relapse rate in patients with MALT lymphoma warrants lifelong follow-up. Clin Cancer Res 11 (9): 3349-52, 2005. [PUBMED Abstract]
- Sretenovic M, Colovic M, Jankovic G, et al.: More than a third of non-gastric malt lymphomas are disseminated at diagnosis: a single center survey. Eur J Haematol 82 (5): 373-80, 2009. [PUBMED Abstract]
- Nathwani BN, Drachenberg MR, Hernandez AM, et al.: Nodal monocytoid B-cell lymphoma (nodal marginal-zone B-cell lymphoma). Semin Hematol 36 (2): 128-38, 1999. [PUBMED Abstract]
- Raderer M, Wöhrer S, Streubel B, et al.: Assessment of disease dissemination in gastric compared with extragastric mucosa-associated lymphoid tissue lymphoma using extensive staging: a single-center experience. J Clin Oncol 24 (19): 3136-41, 2006. [PUBMED Abstract]
- Zucca E, Conconi A, Martinelli G, et al.: Final Results of the IELSG-19 Randomized Trial of Mucosa-Associated Lymphoid Tissue Lymphoma: Improved Event-Free and Progression-Free Survival With Rituximab Plus Chlorambucil Versus Either Chlorambucil or Rituximab Monotherapy. J Clin Oncol 35 (17): 1905-1912, 2017. [PUBMED Abstract]
- Kiesewetter B, Raderer M: Antibiotic therapy in nongastrointestinal MALT lymphoma: a review of the literature. Blood 122 (8): 1350-7, 2013. [PUBMED Abstract]
- Grünberger B, Hauff W, Lukas J, et al.: 'Blind' antibiotic treatment targeting Chlamydia is not effective in patients with MALT lymphoma of the ocular adnexa. Ann Oncol 17 (3): 484-7, 2006. [PUBMED Abstract]
- Kuo SH, Chen LT, Yeh KH, et al.: Nuclear expression of BCL10 or nuclear factor kappa B predicts Helicobacter pylori-independent status of early-stage, high-grade gastric mucosa-associated lymphoid tissue lymphomas. J Clin Oncol 22 (17): 3491-7, 2004. [PUBMED Abstract]
- Desai A, Joag MG, Lekakis L, et al.: Long-term course of patients with primary ocular adnexal MALT lymphoma: a large single-institution cohort study. Blood 129 (3): 324-332, 2017. [PUBMED Abstract]
- Opat S, Tedeschi A, Linton K, et al.: The MAGNOLIA Trial: Zanubrutinib, a Next-Generation Bruton Tyrosine Kinase Inhibitor, Demonstrates Safety and Efficacy in Relapsed/Refractory Marginal Zone Lymphoma. Clin Cancer Res 27 (23): 6323-6332, 2021. [PUBMED Abstract]
- Noy A, de Vos S, Coleman M, et al.: Durable ibrutinib responses in relapsed/refractory marginal zone lymphoma: long-term follow-up and biomarker analysis. Blood Adv 4 (22): 5773-5784, 2020. [PUBMED Abstract]
- Luminari S, Merli M, Rattotti S, et al.: Early progression as a predictor of survival in marginal zone lymphomas: an analysis from the FIL-NF10 study. Blood 134 (10): 798-801, 2019. [PUBMED Abstract]
- Vallisa D, Bernuzzi P, Arcaini L, et al.: Role of anti-hepatitis C virus (HCV) treatment in HCV-related, low-grade, B-cell, non-Hodgkin's lymphoma: a multicenter Italian experience. J Clin Oncol 23 (3): 468-73, 2005. [PUBMED Abstract]
- Merli M, Rattotti S, Spina M, et al.: Direct-Acting Antivirals as Primary Treatment for Hepatitis C Virus-Associated Indolent Non-Hodgkin Lymphomas: The BArT Study of the Fondazione Italiana Linfomi. J Clin Oncol 40 (35): 4060-4070, 2022. [PUBMED Abstract]
- Isaacson PG: Gastrointestinal lymphoma. Hum Pathol 25 (10): 1020-9, 1994. [PUBMED Abstract]
- Lecuit M, Abachin E, Martin A, et al.: Immunoproliferative small intestinal disease associated with Campylobacter jejuni. N Engl J Med 350 (3): 239-48, 2004. [PUBMED Abstract]
- Arcaini L, Paulli M, Boveri E, et al.: Splenic and nodal marginal zone lymphomas are indolent disorders at high hepatitis C virus seroprevalence with distinct presenting features but similar morphologic and phenotypic profiles. Cancer 100 (1): 107-15, 2004. [PUBMED Abstract]
- Arcaini L, Rossi D, Paulli M: Splenic marginal zone lymphoma: from genetics to management. Blood 127 (17): 2072-81, 2016. [PUBMED Abstract]
- Bertoni F, Zucca E: State-of-the-art therapeutics: marginal-zone lymphoma. J Clin Oncol 23 (26): 6415-20, 2005. [PUBMED Abstract]
- Parry-Jones N, Matutes E, Gruszka-Westwood AM, et al.: Prognostic features of splenic lymphoma with villous lymphocytes: a report on 129 patients. Br J Haematol 120 (5): 759-64, 2003. [PUBMED Abstract]
- Arcaini L, Lazzarino M, Colombo N, et al.: Splenic marginal zone lymphoma: a prognostic model for clinical use. Blood 107 (12): 4643-9, 2006. [PUBMED Abstract]
- Iannitto E, Ambrosetti A, Ammatuna E, et al.: Splenic marginal zone lymphoma with or without villous lymphocytes. Hematologic findings and outcomes in a series of 57 patients. Cancer 101 (9): 2050-7, 2004. [PUBMED Abstract]
- Hermine O, Lefrère F, Bronowicki JP, et al.: Regression of splenic lymphoma with villous lymphocytes after treatment of hepatitis C virus infection. N Engl J Med 347 (2): 89-94, 2002. [PUBMED Abstract]
- Kelaidi C, Rollot F, Park S, et al.: Response to antiviral treatment in hepatitis C virus-associated marginal zone lymphomas. Leukemia 18 (10): 1711-6, 2004. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento del linfoma no Hodgkin de células B de crecimiento lento
El tratamiento del linfoma no Hodgkin (LNH) de crecimiento lento depende del tipo histológico y el estadio. Muchas de las mejoras en la supervivencia se han logrado debido a ensayos clínicos en los que se intentó mejorar el tratamiento convencional o estándar.
En los pacientes asintomáticos con formas de LNH de crecimiento lento en estadio avanzado, es posible diferir el tratamiento hasta que el paciente presente síntomas o la enfermedad progrese. Cuando se difiere el tratamiento, la evolución clínica de los pacientes con LNH de crecimiento lento es variable; se necesita una observación frecuente y cuidadosa para poder iniciar un tratamiento eficaz cuando se acelera la evolución clínica de la enfermedad. Algunos pacientes tienen un período prolongado de enfermedad de crecimiento lento, pero en otros la enfermedad evoluciona rápido a tipos más malignos de LNH, lo que exige un tratamiento inmediato.
Las técnicas de radioterapia son un poco diferentes de las que se utilizan para el tratamiento del linfoma de Hodgkin. La dosis de radioterapia por lo habitual oscila entre 25 Gy y 50 Gy, y depende de factores, como el tipo histológico de linfoma, el estadio de la enfermedad, el estado general del paciente, el objetivo del tratamiento (curativo o paliativo), la proximidad a órganos circundantes sensibles, y si se usa radioterapia sola o combinada con quimioterapia. Debido a la variedad de presentaciones clínicas de la enfermedad y de la recaída, a veces se incluye el tratamiento de sitios no habituales, como el anillo de Waldeyer, los ganglios epitrocleares o los ganglios mesentéricos. La morbilidad relacionada con el tratamiento se debe considerar en detalle. La mayoría de los pacientes que reciben radiación se tratan solo en un lado del diafragma. Las presentaciones localizadas del LNH extraganglionar se pueden tratar con técnicas dirigidas al campo comprometido con éxito significativo (>50 %).
Cuando la radioterapia mediastínica abarcará el lado izquierdo del corazón o se sabe que aumentará el riesgo de cáncer de mama en pacientes jóvenes, es posible considerar el uso de terapia con protones para reducir la dosis de radiación dirigida a los órganos en riesgo.[1] Para obtener más información, consultar la sección Síndrome de la vena cava superior en Síndromes cardiopulmonares.
Aunque los tratamientos actuales son curativos en una proporción significativa de los pacientes con linfoma, se están llevando a cabo numerosos ensayos clínicos para mejorar el tratamiento. En lo posible, los pacientes se deben incluir en estos estudios. Se propusieron pautas estandarizadas para evaluar la respuesta en los ensayos clínicos.[2]
En varias revisiones retrospectivas se indicó que la vigilancia rutinaria mediante imágenes aporta poco o ningún valor a los pacientes con linfoma difuso de células B grandes (LDCBG) que logran una remisión clínica completa después de la terapia de inducción. Además, resulta difícil determinar el valor pronóstico de la tomografía por emisión de positrones-tomografía computarizada provisional durante la terapia de inducción del LDCBG.[3-6]
Es posible evaluar la hepatitis B o C activa antes del tratamiento con rituximab o quimioterapia.[7,8] Los pacientes con infección por el virus de la hepatitis B (VHB) detectable se benefician de la profilaxis con entecavir en el entorno del tratamiento con rituximab.[9,10] Los pacientes con infección por el VHB resuelta (es decir, negativa para el antígeno de superficie del VHB, pero positiva para el anticuerpo central del VHB), presentan riesgo de reactivación de la infección por el VHB y necesitan vigilancia del DNA del VHB. En un estudio retrospectivo de 326 pacientes, la terapia profiláctica con análogos nucleósidos redujo la reactivación del VHB del 10,8 % al 2,1 %.[11] De forma similar, los pacientes que reciben rituximab con quimioterapia combinada o sin esta suelen recibir profilaxis con aciclovir o valaciclovir para el virus del herpes zóster y profilaxis con trimetoprima-sulfametoxazol o dapsona para la infección por Pneumocystis. El deterioro inmunitario a largo plazo se evaluó en un estudio retrospectivo de cohorte que incluyó 21 690 sobrevivientes de LDCBG del California Cancer Registry. Se encontraron cocientes de tasas de incidencia elevados hasta 10 años después para neumonía (10,8 veces mayor), meningitis (5,3 veces mayor), deficiencia de inmunoglobulina (17,6 veces mayor) y citopenias autoinmunitarias (12 veces mayor).[12]
En un registro danés de 2508 pacientes, la incidencia de insuficiencia cardíaca congestiva inducida por doxorrubicina aumentó en 115 sobrevivientes del LNH con antecedentes de enfermedad cardíaca (cociente de riesgos instantáneos [CRI], 2,71; intervalo de confianza [IC] 95 %, 1,15−6,36) o múltiples factores de riesgo cardiovascular (CRI, 2,86; IC 95 %, 1,56−5,23).[13]
Bibliografía
- Dabaja BS, Hoppe BS, Plastaras JP, et al.: Proton therapy for adults with mediastinal lymphomas: the International Lymphoma Radiation Oncology Group guidelines. Blood 132 (16): 1635-1646, 2018. [PUBMED Abstract]
- Cheson BD, Horning SJ, Coiffier B, et al.: Report of an international workshop to standardize response criteria for non-Hodgkin's lymphomas. NCI Sponsored International Working Group. J Clin Oncol 17 (4): 1244, 1999. [PUBMED Abstract]
- Mamot C, Klingbiel D, Hitz F, et al.: Final Results of a Prospective Evaluation of the Predictive Value of Interim Positron Emission Tomography in Patients With Diffuse Large B-Cell Lymphoma Treated With R-CHOP-14 (SAKK 38/07). J Clin Oncol 33 (23): 2523-9, 2015. [PUBMED Abstract]
- Thompson CA, Ghesquieres H, Maurer MJ, et al.: Utility of routine post-therapy surveillance imaging in diffuse large B-cell lymphoma. J Clin Oncol 32 (31): 3506-12, 2014. [PUBMED Abstract]
- El-Galaly TC, Jakobsen LH, Hutchings M, et al.: Routine Imaging for Diffuse Large B-Cell Lymphoma in First Complete Remission Does Not Improve Post-Treatment Survival: A Danish-Swedish Population-Based Study. J Clin Oncol 33 (34): 3993-8, 2015. [PUBMED Abstract]
- Huntington SF, Svoboda J, Doshi JA: Cost-effectiveness analysis of routine surveillance imaging of patients with diffuse large B-cell lymphoma in first remission. J Clin Oncol 33 (13): 1467-74, 2015. [PUBMED Abstract]
- Niitsu N, Hagiwara Y, Tanae K, et al.: Prospective analysis of hepatitis B virus reactivation in patients with diffuse large B-cell lymphoma after rituximab combination chemotherapy. J Clin Oncol 28 (34): 5097-100, 2010. [PUBMED Abstract]
- Dong HJ, Ni LN, Sheng GF, et al.: Risk of hepatitis B virus (HBV) reactivation in non-Hodgkin lymphoma patients receiving rituximab-chemotherapy: a meta-analysis. J Clin Virol 57 (3): 209-14, 2013. [PUBMED Abstract]
- Huang YH, Hsiao LT, Hong YC, et al.: Randomized controlled trial of entecavir prophylaxis for rituximab-associated hepatitis B virus reactivation in patients with lymphoma and resolved hepatitis B. J Clin Oncol 31 (22): 2765-72, 2013. [PUBMED Abstract]
- Li H, Zhang HM, Chen LF, et al.: Prophylactic lamivudine to improve the outcome of HBsAg-positive lymphoma patients during chemotherapy: a systematic review and meta-analysis. Clin Res Hepatol Gastroenterol 39 (1): 80-92, 2015. [PUBMED Abstract]
- Kusumoto S, Arcaini L, Hong X, et al.: Risk of HBV reactivation in patients with B-cell lymphomas receiving obinutuzumab or rituximab immunochemotherapy. Blood 133 (2): 137-146, 2019. [PUBMED Abstract]
- Shree T, Li Q, Glaser SL, et al.: Impaired Immune Health in Survivors of Diffuse Large B-Cell Lymphoma. J Clin Oncol 38 (15): 1664-1675, 2020. [PUBMED Abstract]
- Salz T, Zabor EC, de Nully Brown P, et al.: Preexisting Cardiovascular Risk and Subsequent Heart Failure Among Non-Hodgkin Lymphoma Survivors. J Clin Oncol 35 (34): 3837-3843, 2017. [PUBMED Abstract]
Tratamiento del linfoma no Hodgkin de células B de crecimiento lento en estadio I y del linfoma no Hodgkin de células B de crecimiento lento adyacente en estadio II
Aunque es poco común observar presentaciones localizadas del linfoma no Hodgkin (LNH) de células B, el objetivo del tratamiento es curarlo en los pacientes en los que se confirme la enfermedad localizada después de la estadificación apropiada.
Opciones de tratamiento del linfoma no Hodgkin de células B de crecimiento lento en estadio I y el linfoma no Hodgkin de células B de crecimiento lento adyacente en estadio II
Las opciones de tratamiento del linfoma no Hodgkin de células B de crecimiento lento en estadio I y el linfoma no Hodgkin de células B de crecimiento lento adyacente en estadio II son las siguientes:
En un ensayo prospectivo aleatorizado, 150 pacientes con linfoma folicular en estadio I o estadio II se asignaron al azar a recibir 30 Gy de radioterapia dirigida al campo comprometido sola o radioterapia y 6 ciclos de R-CVP (rituximab, ciclofosfamida, vincristina y prednisona). Después de una mediana de seguimiento de 9,6 años, la tasa de supervivencia sin progresión (SSP) a 10 años favoreció la terapia de modalidad combinada en un 59 % (intervalo de confianza [IC] 95 %, 46–74 %) versus un 41 % para la radioterapia sola (IC 95 %, 30–57 %) (P = 0,033). No hubo diferencia en la supervivencia general (SG) (87 % y 95 %, P = 0,40).[1][Nivel de evidencia B1]
En el National Lymphocare Study se identificaron 471 pacientes con linfoma folicular en estadio I. De estos pacientes, 206 se estadificaron de manera cuidadosa mediante aspirado y biopsia de médula ósea, tomografía computarizada (TC) o tomografía por emisión de positrones con tomografía computarizada (TEP-TC).[2] Los tratamientos no aleatorizados incluyeron radioterapia (27 %), quimioterapia con rituximab (quimioterapia R) (28 %), conducta expectante (17 %), quimioterapia R con radioterapia (13 %) y rituximab solo (12 %), aunque más de un tercio de los pacientes comenzó el estudio en el grupo de conducta expectante. Al cabo de una mediana de seguimiento de 57 meses, la SSP favoreció la quimioterapia R o la quimioterapia R con radioterapia, pero la SG fue casi idéntica, superior al 90 % para todos los pacientes.[2][Nivel de evidencia C2] Se necesitan ensayos clínicos para responder a preguntas como las siguientes:[3]
- ¿Se prefiere la conducta expectante o la radioterapia después de una TEP-TC normal tras la biopsia por excisión?
- ¿Se debería agregar rituximab a la radioterapia para el linfoma folicular en estadio I?
- ¿La quimioterapia R con radioterapia cumple alguna función en el tratamiento?
Radioterapia
El control a largo plazo de la enfermedad en los campos de radiación se puede lograr en un número significativo de pacientes con LNH de crecimiento lento en estadio I o estadio II mediante el uso de radioterapia. Esto requiere dosis de radiación que por lo general oscilan entre 25 Gy y 40 Gy dirigidas a sitios comprometidos o campos extendidos que cubren sitios ganglionares adyacentes.[1,4-6] Casi la mitad de todos los pacientes tratados con radioterapia sola tendrán recaída fuera del campo de radiación en un plazo de 10 años.[1,6,7]
En una revisión retrospectiva de 512 pacientes de un consorcio internacional, se evaluó a pacientes con linfoma folicular en estadio temprano que habían recibido al menos 24 Gy de radioterapia localizada en el momento de la presentación inicial. Al cabo de una mediana de seguimiento de 52 meses, el 29,1 % de los pacientes presentaron linfoma recidivante en una mediana de 23 meses (intervalo, 1−143 meses).[8] Al cabo de una mediana de seguimiento de 33 meses después de la recidiva, la tasa de SG a 3 años fue del 91,4 % una vez que los pacientes recibieron quimioterapia sistémica subsiguiente que incluyó rituximab.[8]
El uso de radioterapia de dosis muy bajas de 4 Gy (2 Gy en 2 fracciones) a veces conlleva tasas de remisión en el 50 % de los pacientes que no toleran dosis más altas.[9] En un ensayo prospectivo aleatorizado multicéntrico 548 pacientes con linfoma de zona marginal o linfoma folicular recibieron radioterapia: 4 Gy en 2 fracciones o 24 Gy en 12 fracciones.[10]
- Al cabo de una mediana de seguimiento de 73,8 meses, la tasa de respuesta completa local a 5 años fue del 89,9 % (85,5–93,1 %) después de 24 Gy y del 70,4 % (64,7–75,4 %) después de 4 Gy (cociente de riesgos instantáneos [CRI], 3,46; IC 95 %, 2,25–5,33, P < 0,0001).[10]
- Aunque el control local duradero fue superior en los pacientes que recibieron 24 Gy, el régimen de 4 Gy fue casi comparable con menor exposición a la radiación, además de una duración del tratamiento y un costo inferiores.
Rituximab con quimioterapia o sin esta
Cuando se contraindica la radioterapia, o cuando se prefiere un tratamiento alternativo, los pacientes con enfermedad sintomática que requieren tratamiento pueden recibir rituximab con quimioterapia o sin esta (como se describe más abajo para los pacientes en estadio más avanzado).[11] El valor del tratamiento adyuvante con radiación para disminuir la recaída, además de rituximab (un anticuerpo monoclonal anti-CD20), solo o en combinación con quimioterapia, se extrapoló de ensayos de pacientes con enfermedad en estadio avanzado y no se ha confirmado.[12,13]
Conducta expectante
Se puede considerar la conducta expectante para pacientes asintomáticos.[14] La conducta expectante nunca se ha comparado con la radioterapia inicial en un ensayo prospectivo aleatorizado. En un análisis retrospectivo de la base de datos del Surveillance, Epidemiology and End Results (SEER) Program de pacientes diagnosticados a lo largo de 30 años, se observaron mejores desenlaces con la administración de radioterapia inicial.[15]
Otros tratamientos indicados para pacientes con enfermedad en estadio avanzado
Los pacientes con enfermedad que no es posible tratar mediante radioterapia reciben el mismo tratamiento de los pacientes con linfoma de grado bajo en estadio III o en estadio IV.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- MacManus M, Fisher R, Roos D, et al.: Randomized Trial of Systemic Therapy After Involved-Field Radiotherapy in Patients With Early-Stage Follicular Lymphoma: TROG 99.03. J Clin Oncol 36 (29): 2918-2925, 2018. [PUBMED Abstract]
- Friedberg JW, Byrtek M, Link BK, et al.: Effectiveness of first-line management strategies for stage I follicular lymphoma: analysis of the National LymphoCare Study. J Clin Oncol 30 (27): 3368-75, 2012. [PUBMED Abstract]
- Montoto S: Management of localized-stage follicular lymphoma: changing the paradigm? J Clin Oncol 30 (27): 3328-9, 2012. [PUBMED Abstract]
- Haas RL, Poortmans P, de Jong D, et al.: High response rates and lasting remissions after low-dose involved field radiotherapy in indolent lymphomas. J Clin Oncol 21 (13): 2474-80, 2003. [PUBMED Abstract]
- Guckenberger M, Alexandrow N, Flentje M: Radiotherapy alone for stage I-III low grade follicular lymphoma: long-term outcome and comparison of extended field and total nodal irradiation. Radiat Oncol 7: 103, 2012. [PUBMED Abstract]
- Brady JL, Binkley MS, Hajj C, et al.: Definitive radiotherapy for localized follicular lymphoma staged by 18F-FDG PET-CT: a collaborative study by ILROG. Blood 133 (3): 237-245, 2019. [PUBMED Abstract]
- Guadagnolo BA, Li S, Neuberg D, et al.: Long-term outcome and mortality trends in early-stage, Grade 1-2 follicular lymphoma treated with radiation therapy. Int J Radiat Oncol Biol Phys 64 (3): 928-34, 2006. [PUBMED Abstract]
- Binkley MS, Brady JL, Hajj C, et al.: Salvage Treatment and Survival for Relapsed Follicular Lymphoma Following Primary Radiation Therapy: A Collaborative Study on Behalf of ILROG. Int J Radiat Oncol Biol Phys 104 (3): 522-529, 2019. [PUBMED Abstract]
- Hoskin PJ, Kirkwood AA, Popova B, et al.: 4 Gy versus 24 Gy radiotherapy for patients with indolent lymphoma (FORT): a randomised phase 3 non-inferiority trial. Lancet Oncol 15 (4): 457-63, 2014. [PUBMED Abstract]
- Hoskin P, Popova B, Schofield O, et al.: 4 Gy versus 24 Gy radiotherapy for follicular and marginal zone lymphoma (FoRT): long-term follow-up of a multicentre, randomised, phase 3, non-inferiority trial. Lancet Oncol 22 (3): 332-340, 2021. [PUBMED Abstract]
- Cartron G, Bachy E, Tilly H, et al.: Randomized Phase III Trial Evaluating Subcutaneous Rituximab for the First-Line Treatment of Low-Tumor Burden Follicular Lymphoma: Results of a LYSA Study. J Clin Oncol 41 (19): 3523-3533, 2023. [PUBMED Abstract]
- Kelsey SM, Newland AC, Hudson GV, et al.: A British National Lymphoma Investigation randomised trial of single agent chlorambucil plus radiotherapy versus radiotherapy alone in low grade, localised non-Hodgkins lymphoma. Med Oncol 11 (1): 19-25, 1994. [PUBMED Abstract]
- Seymour JF, Pro B, Fuller LM, et al.: Long-term follow-up of a prospective study of combined modality therapy for stage I-II indolent non-Hodgkin's lymphoma. J Clin Oncol 21 (11): 2115-22, 2003. [PUBMED Abstract]
- Advani R, Rosenberg SA, Horning SJ: Stage I and II follicular non-Hodgkin's lymphoma: long-term follow-up of no initial therapy. J Clin Oncol 22 (8): 1454-9, 2004. [PUBMED Abstract]
- Pugh TJ, Ballonoff A, Newman F, et al.: Improved survival in patients with early stage low-grade follicular lymphoma treated with radiation: a Surveillance, Epidemiology, and End Results database analysis. Cancer 116 (16): 3843-51, 2010. [PUBMED Abstract]
Tratamiento del linfoma no Hodgkin de células B de crecimiento lento no adyacente en estadios II, III y IV
El tratamiento óptimo de los estadios avanzados del linfoma no Hodgkin (LNH) de grado bajo es controvertido porque las opciones terapéuticas actuales producen tasas de curación bajas. Hay numerosos ensayos clínicos en curso para evaluar asuntos relacionados con el tratamiento y se insta a los pacientes a que participen en estos. La tasa de recaída es muy constante a lo largo del tiempo, incluso en pacientes que lograron una respuesta completa al tratamiento. A veces se producen recaídas muchos años después del tratamiento. En la actualidad, no hay ensayos aleatorizados que orienten a los profesionales clínicos sobre la elección inicial de conducta expectante, rituximab, análogos nucleosídicos, alquilantes, quimioterapia combinada, anticuerpos monoclonales radiomarcados o combinaciones de estas opciones.[1]; [2][Nivel de evidencia B1]
Para los pacientes con LNH de crecimiento lento no adyacente en estadios II y III, se ha propuesto la administración de radioterapia linfática central, pero no se recomienda su uso habitual como método de tratamiento.[3,4]
Los pacientes con infección por el virus de la hepatitis B (VHB) resuelta (es decir, negativa para el antígeno de superficie del VHB, pero positiva para el anticuerpo central del VHB), presentan riesgo de reactivación de la infección por el VHB y necesitan vigilancia del DNA del VHB. En un estudio retrospectivo de 326 pacientes, la terapia profiláctica con análogos nucleósidos redujo la reactivación del VHB del 10,8 % al 2,1 %.[5]
Opciones de tratamiento del linfoma no Hodgkin de células B de crecimiento lento no adyacente en estadio II, III y IV
Las opciones de tratamiento del linfoma no Hodgkin de células B de crecimiento lento no adyacente en estadio II, III y IV son las siguientes:
Debido a que ninguno de los tratamientos enumerados antes son curativos para la enfermedad en estadio avanzado, se encuentran en evaluación clínica varios abordajes innovadores.
Conducta expectante para pacientes asintomáticos
Debido a que la recaída puede ocurrir muchos años después del tratamiento, incluso en pacientes que han logrado respuestas completas, se puede considerar la posibilidad de diferir el tratamiento (es decir, conducta expectante hasta que el paciente se vuelva sintomático antes de iniciar el tratamiento).[2,6-8] El Follicular Lymphoma International Prognostic Index (FLIPI) y el FLIPI-2 revisado permiten predecir la supervivencia sin progresión (SSP) y la supervivencia general (SG), pero las puntuaciones no sirven para establecer la necesidad de tratamiento en pacientes asintomáticos.[9,10]
Evidencia (conducta expectante):
- En tres ensayos aleatorizados se comparó la conducta expectante con la quimioterapia inmediata.[7,11]; [12][Nivel de evidencia A1]
- En ninguno de los tres ensayos se observó una diferencia en la SG ni en la supervivencia por causa específica.
- En los pacientes asignados al azar a la conducta expectante, la mediana de tiempo para requerir tratamiento fue de 2 a 3 años. Un tercio de los pacientes en conducta expectante nunca requirió tratamiento (la mitad murió por otras causas y la otra mitad permaneció sin progresión después de 10 años).
- Un grupo seleccionado de 107 pacientes con linfoma folicular en estadio avanzado se trató con conducta expectante inicial; el tratamiento posterior se retrasó durante una mediana de 55 meses. Estos pacientes lograron un tiempo sin fracaso del tratamiento y una SG equivalentes en comparación con una cohorte similar que recibió tratamiento inmediato con rituximab.[13][Nivel de evidencia C2] Esto implica que la conducta expectante sigue siendo un abordaje relevante incluso en la era del rituximab.
Rituximab solo o en combinación con citotóxicos utilizados en el tratamiento de primera línea
La terapia estándar incluye rituximab, un anticuerpo monoclonal anti–CD20, ya sea solo, como se observó en el ensayo ECOG-E4402 (NCT00075946),[14-19] o en combinación con análogos nucleosídicos de purinas, como fludarabina o cladribina, alquilantes (con o sin corticoesteroides), o quimioterapia combinada. El rituximab se puede considerar como tratamiento de primera línea, solo o en combinación con otros medicamentos. Es posible administrar el rituximab por vía intravenosa (IV) o subcutánea (SC); y en versiones biosimilares, como CT-P10 y GP2013, y se ha observado eficacia e inocuidad equivalentes.[20-22] Las combinaciones son las siguientes:
- R-bendamustina: rituximab y bendamustina.[23-25]
- R-F: rituximab y fludarabina.[26]
- R-CVP: rituximab, ciclofosfamida, vincristina y prednisona.[27-30]
- R-CHOP: rituximab, ciclofosfamida, doxorrubicina, vincristina y prednisona.[29-33] En un metanálisis de Cochrane, no se pudo identificar un beneficio para la SG al añadir doxorrubicina a los regímenes quimioterapéuticos con rituximab o sin este.[34][Nivel de evidencia A1]
- R-FM: rituximab, fludarabina y mitoxantrona.[29,30,35]
- R-FCM: rituximab, fludarabina, ciclofosfamida y mitoxantrona.[36]
Evidencia (rituximab con quimioterapia o sin esta):
- En un ensayo prospectivo aleatorizado de 534 pacientes con linfoma folicular en estadio avanzado sin tratamiento previo, se compararon los regímenes R-CHOP, R-FM y R-CVP.[29]
- Después de una mediana de seguimiento de 84 meses, no hubo diferencia en la SG (tasa de SG a 8 años, 83 %, intervalo de confianza [IC] 95 %, 79–87 %), pero las tasas de SSP a 8 años favorecieron el tratamiento con R-CHOP (52 %) y R-FM (49 %) en comparación con R-CVP (42 %) (P para los 3 regímenes = 0,037).[29][Nivel de evidencia B1]
- En cuatro estudios prospectivos aleatorizados con pacientes sin tratamiento previo (que incluyeron a más de 1300 pacientes) y en un metanálisis de Cochrane que incluyó a pacientes con tratamiento previo y sin este (casi 1000 pacientes), el rituximab con quimioterapia combinada se comparó con la quimioterapia sola.[28,33,37]; [38,39][Nivel de evidencia A1]
- El rituximab con quimioterapia fue superior en términos de supervivencia sin complicaciones (SSC) o SSP (osciló entre 2–3 años) en todos los estudios; esta combinación también fue superior en términos de SG en todos menos uno de los estudios (el beneficio absoluto osciló entre 6–13 % a los 4 años, P < 0,04; cociente de riesgos instantáneos [CRI], 0,63 [0,51–0,79] para el metanálisis).
- En todos los ensayos participaron pacientes sintomáticos que necesitaban tratamiento. Estos resultados no se oponen a la conducta expectante cuando resulte apropiada.
- El resultado de la tomografía por emisión de positrones con flúor F 18-fludesoxiglucosa y tomografía computarizada (TEP-TC 18F-FDG) al finalizar el tratamiento con rituximab y terapia de inducción con quimioterapia es muy predictivo del desenlace. Aún no se sabe si decidir el tratamiento a partir del resultado de estas imágenes conduce a mejores desenlaces.[40,41]
- En un ensayo aleatorizado prospectivo (NCT00991211), 527 pacientes con linfoma de crecimiento lento y linfoma de células de manto se asignaron de manera aleatoria para recibir bendamustina y rituximab o R-CHOP.[24][Nivel de evidencia B1]
- Después de una mediana de seguimiento de 45 meses, la mediana de SSP favoreció al grupo de bendamustina (69 vs. 31 meses [CRI, 0,58; IC 95 %, 0,44–0,74; P < 0,0001]), pero no hubo diferencia en la SG.
- En comparación con el grupo de R-CHOP, el grupo de bendamustina presentó tasas significativamente más bajas de alopecia, toxicidad hematológica, estomatitis, neuropatía periférica e infecciones.
- En un ensayo aleatorizado prospectivo similar, 447 pacientes con linfoma de células de manto de crecimiento lento se asignaron a bendamustina y rituximab versus R-CHOP o R-CVP.[25][Nivel de evidencia B1]
- Al cabo de una mediana de seguimiento de 65 meses, la tasa de SSP a 5 años favoreció al grupo de bendamustina y rituximab, 65,5 % versus 55,8 % (CRI, 0,61; IC 95 %, 0,45–0,85; P = 0,0025), pero no hubo diferencia en la SG.
- En el grupo de bendamustina y rituximab el aumento de las muertes por causas cardiovasculares (7 vs. 1) y por neoplasias malignas secundarias diferentes al linfoma (5 vs. 3) quizás contribuyó a la ausencia de ventaja en la SG.
Lenalidomida y rituximab
La combinación del inmunomodulador lenalidomida y rituximab (régimen R2) se propuso como un régimen alternativo a las combinaciones de citotóxicos, que acarrean efectos tóxicos subsecuentes a corto y largo plazo.
Evidencia (lenalidomida y rituximab):
- En un ensayo prospectivo aleatorizado (RELEVANCE [NCT01650701]) de 1030 pacientes con linfoma folicular sin tratamiento previo, se comparó el uso de rituximab y lenalidomida durante 18 meses con el uso de rituximab y quimioterapia (por lo general, R-CHOP).[42,43] Todos los pacientes recibieron mantenimiento con rituximab hasta por 2 años.
- Al cabo de una mediana de seguimiento de 72 meses, la tasa de SSP a 6 años (60 % y 59 %) y la tasa de SG a 3 años (89 %) fueron idénticas (CRI para la SSP, 1,03; IC 95 %, 0,84–1,27; P = 0,78) (no se notificó el CRI para la SG).[42,43][Nivel de evidencia A1]
- En el ensayo se determinó que el régimen R2 es tan eficaz como el rituximab combinado con opciones de quimioterapia citotóxica. La tasa de transformación a linfoma de crecimiento rápido por año fue del 0,68 % en el grupo R2 y del 0,45 % en el grupo de quimioterapia R. Después de una mediana de seguimiento de 72 meses, no se observaron nuevas señales de seguridad.[43]
- En un ensayo prospectivo aleatorizado de 358 pacientes con linfoma de crecimiento lento resistente al tratamiento (por lo general, linfoma folicular), el régimen R2 se comparó con el rituximab solo.[44]
- Al cabo de una mediana de seguimiento de 28 meses, la mediana de SSP fue de 39,4 meses para el régimen R2 y de 14,1 meses para el rituximab solo (P < 0,0001), sin diferencias en la SG.[44][Nivel de evidencia B1]
Mantenimiento con rituximab
Luego de la terapia de inducción con rituximab solo o con rituximab y quimioterapia, es posible usar el rituximab 1 vez cada 2 o 3 meses como terapia de mantenimiento. Este abordaje se evaluó en varios estudios.
Evidencia (mantenimiento con rituximab en pacientes sin tratamiento previo):
- En el estudio PRIMA (NCT00140582), 1018 pacientes con enfermedad sintomática de riesgo alto sin tratamiento previo lograron una respuesta completa o una respuesta parcial después de la terapia de inducción con inmunoquimioterapia (por lo general, R-CHOP). Luego, los pacientes se asignaron al azar a 2 años de mantenimiento con rituximab versus ausencia de mantenimiento.[45][Nivel de evidencia B1]
- Al cabo de una mediana de seguimiento de 9,0 años, la mediana de SSP favoreció al grupo de mantenimiento con rituximab, (10,5 años) en comparación con el grupo de observación (4,1 años) (CRI 0,61; IC 95 %, 0,52–0,73; P < 0,001), pero no hubo diferencia en la SG.
- En el estudio United Kingdom/International Study (NCT00112931), 379 pacientes asintomáticos con carga de enfermedad baja sin tratamiento previo, se asignaron de manera aleatoria a conducta expectante versus inducción con rituximab, seguido de 2 años de mantenimiento con rituximab.[46][Nivel de evidencia A3]
- Si bien las tasas de SG y de transformación histológica no fueron diferentes a los 3 años, se favoreció el mantenimiento con rituximab con base a los resultados del análisis de calidad de vida (CV) (Mental Adjustment to Cancer Scale, P = 0,0004 a los 7 meses, Illness Coping Score, P = 0,0012 a los 7 meses) y del tiempo transcurrido hasta el inicio de un tratamiento nuevo durante 3 años (54 % para la conducta expectante vs. 12 % para el mantenimiento con rituximab [CRI, 0,21; IC 95 %, 0,14–0,31, P < 0,0001]).[46][Nivel de evidencia A3]
- En este estudio se indicó que para algunos pacientes la conducta expectante significó esperar preocupados.[47] Sin embargo, desde la perspectiva de las tasas de SG y de transformación histológica, no se observó beneficio del mantenimiento con rituximab.
- En el estudio RESORT (NCT00075946), 289 pacientes asintomáticos con carga de enfermedad baja sin tratamiento previo se asignaron de manera aleatoria a inducción con rituximab solo, con una estrategia de reiterar el tratamiento con rituximab en el momento de la recaída versus inducción con rituximab y mantenimiento con rituximab cada 13 semanas hasta el fracaso terapéutico.[48][Nivel de evidencia B3]
- Al cabo de una mediana de seguimiento de 8,7 años, la tasa a 7 años de ausencia de quimioterapia citotóxica o radioterapia fue del 83 % en los pacientes que recibieron rituximab de mantenimiento y del 63 % en los pacientes que recibieron inducción sola (CRI, 2,37; IC 95 %, 1,5–3,8; P = 0001). No hubo diferencia en la tasa de SG a 10 años (83 vs. 84 %; P = no significativa). Cuando se usó una estrategia de reiterar el tratamiento con dosis significativamente más bajas de rituximab, se logró un control similar de la enfermedad.
- El mantenimiento con rituximab induce un agotamiento prolongado de las células B, pero la morbilidad por infecciones no se evaluó después de 2015, cuando se terminaron de obtener los datos completos del protocolo (12 años después del inicio del estudio).
En estos 3 ensayos aleatorizados de pacientes sin tratamiento previo, no se observó una ventaja del mantenimiento con rituximab en comparación con la observación y la terapia de reinducción en el momento de la recaída. En los ensayos se indica que hay un beneficio del mantenimiento con rituximab después de la reinducción para una recaída de la enfermedad. Quedan muchas preguntas sin resolver sobre del mantenimiento con rituximab; en particular, aquellas relacionadas con la interrupción del tratamiento a los 2 años, así como su inocuidad y eficacia a largo plazo. En un ensayo en el que se prolongó el mantenimiento con rituximab a 5 años, se observaron una SSC y una SG similares en comparación con 1 año de mantenimiento tras la terapia de inducción con rituximab en pacientes sin tratamiento previo.[49][Nivel de evidencia A1]
- En el estudio FOLL12 (NCT02063685) participaron 807 pacientes de linfoma folicular con carga tumoral alta sin tratamiento previo. Los pacientes recibieron rituximab con quimioterapia de inducción y se asignaron de manera aleatoria para recibir mantenimiento con rituximab estándar (cada 8 semanas por 2 años) o tratamiento posinducción (vigilancia, mantenimiento con rituximab o radioinmunoterapia) según la respuesta metabólica completa y el estado negativo para la enfermedad residual medible.[50]
- Al cabo de una mediana de seguimiento de 53 meses, la tasa de SSP a 3 años fue del 86 % para los pacientes que recibieron el mantenimiento estándar y del 72 % para los pacientes que recibieron el tratamiento según la respuesta (P < 0,001). La tasa de SG a 3 años fue igual en ambos grupos (98 vs. 97 %; P = 0,238).[50][Nivel de evidencia B1]
- En este ensayo no se respalda el uso de una TEP-TC al final del tratamiento para orientar el mantenimiento con rituximab.
- En un ensayo prospectivo participaron 202 pacientes con linfoma folicular y carga tumoral baja sin tratamiento previo. Los pacientes se asignaron al azar para recibir 4 dosis semanales de rituximab IV (dosis estándar, 375 mg/m2) o 1 dosis de rituximab IV seguida de 3 dosis semanales de rituximab SC (1400 mg) y dosis de mantenimiento en los meses 3, 5, 7 y 9.[19]
- Al cabo de una mediana de seguimiento de 50,2 meses, la tasa de SSP a 4 años fue del 58 % (IC 95 %, 47,5–67 %) para los pacientes del grupo de dosis SC que recibieron terapia de mantenimiento, y del 41 % (IC 95 %, 30,6–51 %) (CRI, 0,585; 0,939–0,871; P = 0076) para los pacientes del grupo de IV que no recibieron terapia de mantenimiento.[19][Nivel de evidencia B1]
- No hubo diferencia en la SG ni en el tiempo hasta el siguiente tratamiento.
- Fuera del contexto de los ensayos clínicos, no se ha demostrado que el uso de pruebas de ERM sea predictivo para dirigir el tratamiento de pacientes con linfoma folicular. En análisis retrospectivos de 2 ensayos prospectivos aleatorizados se encontró que aunque la negatividad para la ERM fue pronóstica del desenlace, el mantenimiento con rituximab o obinutuzumab prolongó la SSP en mayor medida entre los pacientes con enfermedad negativa para ERM.[50,51][Nivel de evidencia C2] No se indicó la interrupción del mantenimiento con rituximab o obinutuzumab en pacientes con enfermedad negativa para ERM, lo que invalidó cualquier posible cambio en el tratamiento según ese estado.
En síntesis, en todos los estudios de pacientes sin tratamiento previo, se observo una mejora de la SSP sin cambio en la SG.
Evidencia (mantenimiento con rituximab en pacientes con tratamiento previo):
- En un ensayo prospectivo aleatorizado de 465 pacientes con linfoma folicular en recaída, aquellos que respondieron al tratamiento con R-CHOP o CHOP se asignaron de manera aleatoria para recibir mantenimiento con rituximab (1 dosis cada 3 meses durante 2 años) o no recibir mantenimiento.[52][Nivel de evidencia B1]
- Al cabo de una mediana de seguimiento de 6 meses, el mantenimiento con rituximab mejoró la mediana de SSP (44 vs. 16 meses; P < 0,001), pero el beneficio para la SG a 5 años fue marginal (74 vs. 64 %, P = 0,07).
- El beneficio del mantenimiento fue evidente incluso para los pacientes que recibieron rituximab durante la terapia de inducción. La mayoría de los pacientes de ambos grupos recibieron más rituximab durante el tratamiento de rescate posterior al protocolo.
- En un ensayo prospectivo aleatorizado de 280 pacientes con linfoma folicular en recaída, aquellos que respondieron a la quimioterapia con consolidación de trasplante autógeno de células madre se asignaron de manera aleatoria para recibir 4 dosis de rituximab de mantenimiento o no recibir mantenimiento.[53][Nivel de evidencia B1]
- Al cabo de una mediana de seguimiento de 8,3 años, las tasas de SSP a 10 años favorecieron al grupo de mantenimiento (54 vs. 37 % [CRI 0,66; IC 95 %, 0,47–0,91, P = 0,012]), pero no hubo diferencia en la SG.
- En un metanálisis de 9 ensayos aleatorizados con 2586 pacientes de linfoma folicular, la mayoría en recaída, el mantenimiento con rituximab se comparó con la ausencia de mantenimiento, y en los pacientes con tratamiento previo se observó que el mantenimiento con rituximab mejoró la SG (CRImuerte, 0,72; IC 95 %, 0,57–0,91).[54][Nivel de evidencia A1]
En pacientes con tratamiento previo hay más evidencia que indica una ventaja en la SG cuando se usa el mantenimiento con rituximab.
Obinutuzumab solo o en combinación con citotóxicos utilizados en el tratamiento de primera línea
El obinutuzumab es un anticuerpo monoclonal glucomanipulado anti-CD20 de tipo II que produce más citotoxicidad celular dependiente de anticuerpos que el rituximab.
Evidencia (obinutuzumab):
- En un ensayo prospectivo aleatorizado (NCT01332968) con 1202 pacientes de linfoma folicular sin tratamiento previo, se comparó el uso de combinaciones de obinutuzumab o de rituximab con una de tres opciones de quimioterapia según la elección del investigador: el 50 % con bendamustina; el 33 % con ciclofosfamida, doxorrubicina, vincristina y prednisona (CHOP); el 10 % con ciclofosfamida, vincristina y prednisona (CVP).[55] Después de 6 ciclos de terapia combinada, los pacientes recibieron 2 años de terapia de mantenimiento y recibieron el mismo anticuerpo cada 2 meses.
- Después de una mediana de seguimiento de 34,5 meses, la tasa de SSP a 3 años fue del 80 % en el grupo de obinutuzumab y del 73,3 % en el grupo de rituximab (CRI, 0,66; IC 95 %, 0,51–0,85; P = 0,001).[55][Nivel de evidencia B1]
- No hubo diferencia en la SG.
- En comparación con lo que se ha observado históricamente, hubo una tasa alta de muertes tóxicas entre los pacientes que usaron bendamustina en el grupo de obinutuzumab (5,6 %) y en el grupo de rituximab (4,4 %). El número de muertes por toxicidad durante la terapia de primera línea parece excesivo en pacientes con linfoma de crecimiento lento de grado bajo y medianas de supervivencia que exceden los 15 años. En cambio, la mortalidad por toxicidad fue del 1 % al 2 % cuando cualquiera de los anticuerpos se combinó con CHOP o CVP.
Se han planteado varios problemas sobre este estudio:
- Los efectos secundarios (reacciones a la infusión y efectos adversos posteriores) fueron significativamente más altos con obinutuzumab.
- El obinutuzumab cuesta mucho más que el rituximab.
En síntesis, en ausencia de modificaciones en la SG, resulta complicado decidir si se cambia el rituximab por obinutuzumab para combinarlo con quimioterapia en pacientes con linfoma folicular sin tratamiento previo. Las diferencias en la SSP quizás se pueden atribuir al desequilibrio en la dosificación del anticuerpo monoclonal; y el aumento de los efectos secundarios así como del costo son factores mitigantes. En este ensayo, la bendamustina combinada con cualquier anticuerpo condujo a tasas de mortalidad tóxica inaceptables.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Hagenbeek A, Eghbali H, Monfardini S, et al.: Phase III intergroup study of fludarabine phosphate compared with cyclophosphamide, vincristine, and prednisone chemotherapy in newly diagnosed patients with stage III and IV low-grade malignant Non-Hodgkin's lymphoma. J Clin Oncol 24 (10): 1590-6, 2006. [PUBMED Abstract]
- Gribben JG: How I treat indolent lymphoma. Blood 109 (11): 4617-26, 2007. [PUBMED Abstract]
- Jacobs JP, Murray KJ, Schultz CJ, et al.: Central lymphatic irradiation for stage III nodular malignant lymphoma: long-term results. J Clin Oncol 11 (2): 233-8, 1993. [PUBMED Abstract]
- Mendenhall NP, Million RR: Comprehensive lymphatic irradiation for stage II-III non-Hodgkin's lymphoma. Am J Clin Oncol 12 (3): 190-4, 1989. [PUBMED Abstract]
- Kusumoto S, Arcaini L, Hong X, et al.: Risk of HBV reactivation in patients with B-cell lymphomas receiving obinutuzumab or rituximab immunochemotherapy. Blood 133 (2): 137-146, 2019. [PUBMED Abstract]
- Eek R, Falkson G: The low-grade lymphoproliferative disorders. Oncology 54 (6): 441-58, 1997 Nov-Dec. [PUBMED Abstract]
- Ardeshna KM, Smith P, Norton A, et al.: Long-term effect of a watch and wait policy versus immediate systemic treatment for asymptomatic advanced-stage non-Hodgkin lymphoma: a randomised controlled trial. Lancet 362 (9383): 516-22, 2003. [PUBMED Abstract]
- Portlock CS, Rosenberg SA: No initial therapy for stage III and IV non-Hodgkin's lymphomas of favorable histologic types. Ann Intern Med 90 (1): 10-13, 1979.
- Solal-Céligny P, Roy P, Colombat P, et al.: Follicular lymphoma international prognostic index. Blood 104 (5): 1258-65, 2004. [PUBMED Abstract]
- Federico M, Bellei M, Marcheselli L, et al.: Follicular lymphoma international prognostic index 2: a new prognostic index for follicular lymphoma developed by the international follicular lymphoma prognostic factor project. J Clin Oncol 27 (27): 4555-62, 2009. [PUBMED Abstract]
- Brice P, Bastion Y, Lepage E, et al.: Comparison in low-tumor-burden follicular lymphomas between an initial no-treatment policy, prednimustine, or interferon alfa: a randomized study from the Groupe d'Etude des Lymphomes Folliculaires. Groupe d'Etude des Lymphomes de l'Adulte. J Clin Oncol 15 (3): 1110-7, 1997. [PUBMED Abstract]
- Young RC, Longo DL, Glatstein E, et al.: The treatment of indolent lymphomas: watchful waiting v aggressive combined modality treatment. Semin Hematol 25 (2 Suppl 2): 11-6, 1988. [PUBMED Abstract]
- Solal-Céligny P, Bellei M, Marcheselli L, et al.: Watchful waiting in low-tumor burden follicular lymphoma in the rituximab era: results of an F2-study database. J Clin Oncol 30 (31): 3848-53, 2012. [PUBMED Abstract]
- Ghielmini M, Schmitz SF, Cogliatti SB, et al.: Prolonged treatment with rituximab in patients with follicular lymphoma significantly increases event-free survival and response duration compared with the standard weekly x 4 schedule. Blood 103 (12): 4416-23, 2004. [PUBMED Abstract]
- Witzig TE, Vukov AM, Habermann TM, et al.: Rituximab therapy for patients with newly diagnosed, advanced-stage, follicular grade I non-Hodgkin's lymphoma: a phase II trial in the North Central Cancer Treatment Group. J Clin Oncol 23 (6): 1103-8, 2005. [PUBMED Abstract]
- Hainsworth JD, Litchy S, Shaffer DW, et al.: Maximizing therapeutic benefit of rituximab: maintenance therapy versus re-treatment at progression in patients with indolent non-Hodgkin's lymphoma--a randomized phase II trial of the Minnie Pearl Cancer Research Network. J Clin Oncol 23 (6): 1088-95, 2005. [PUBMED Abstract]
- Kahl BS, Hong F, Williams ME, et al.: Rituximab extended schedule or re-treatment trial for low-tumor burden follicular lymphoma: eastern cooperative oncology group protocol e4402. J Clin Oncol 32 (28): 3096-102, 2014. [PUBMED Abstract]
- Buske C, Hiddemann W: Rituximab maintenance therapy in indolent NHL: a clinical review. Leuk Res 30 (Suppl 1): S11-5, 2006. [PUBMED Abstract]
- Cartron G, Bachy E, Tilly H, et al.: Randomized Phase III Trial Evaluating Subcutaneous Rituximab for the First-Line Treatment of Low-Tumor Burden Follicular Lymphoma: Results of a LYSA Study. J Clin Oncol 41 (19): 3523-3533, 2023. [PUBMED Abstract]
- Kim WS, Buske C, Ogura M, et al.: Efficacy, pharmacokinetics, and safety of the biosimilar CT-P10 compared with rituximab in patients with previously untreated advanced-stage follicular lymphoma: a randomised, double-blind, parallel-group, non-inferiority phase 3 trial. Lancet Haematol 4 (8): e362-e373, 2017. [PUBMED Abstract]
- Davies A, Merli F, Mihaljević B, et al.: Efficacy and safety of subcutaneous rituximab versus intravenous rituximab for first-line treatment of follicular lymphoma (SABRINA): a randomised, open-label, phase 3 trial. Lancet Haematol 4 (6): e272-e282, 2017. [PUBMED Abstract]
- Jurczak W, Moreira I, Kanakasetty GB, et al.: Rituximab biosimilar and reference rituximab in patients with previously untreated advanced follicular lymphoma (ASSIST-FL): primary results from a confirmatory phase 3, double-blind, randomised, controlled study. Lancet Haematol 4 (8): e350-e361, 2017. [PUBMED Abstract]
- Robinson KS, Williams ME, van der Jagt RH, et al.: Phase II multicenter study of bendamustine plus rituximab in patients with relapsed indolent B-cell and mantle cell non-Hodgkin's lymphoma. J Clin Oncol 26 (27): 4473-9, 2008. [PUBMED Abstract]
- Rummel MJ, Niederle N, Maschmeyer G, et al.: Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet 381 (9873): 1203-10, 2013. [PUBMED Abstract]
- Flinn IW, van der Jagt R, Kahl B, et al.: First-Line Treatment of Patients With Indolent Non-Hodgkin Lymphoma or Mantle-Cell Lymphoma With Bendamustine Plus Rituximab Versus R-CHOP or R-CVP: Results of the BRIGHT 5-Year Follow-Up Study. J Clin Oncol 37 (12): 984-991, 2019. [PUBMED Abstract]
- Czuczman MS, Koryzna A, Mohr A, et al.: Rituximab in combination with fludarabine chemotherapy in low-grade or follicular lymphoma. J Clin Oncol 23 (4): 694-704, 2005. [PUBMED Abstract]
- Marcus R, Imrie K, Belch A, et al.: CVP chemotherapy plus rituximab compared with CVP as first-line treatment for advanced follicular lymphoma. Blood 105 (4): 1417-23, 2005. [PUBMED Abstract]
- Marcus R, Imrie K, Solal-Celigny P, et al.: Phase III study of R-CVP compared with cyclophosphamide, vincristine, and prednisone alone in patients with previously untreated advanced follicular lymphoma. J Clin Oncol 26 (28): 4579-86, 2008. [PUBMED Abstract]
- Federico M, Luminari S, Dondi A, et al.: R-CVP versus R-CHOP versus R-FM for the initial treatment of patients with advanced-stage follicular lymphoma: results of the FOLL05 trial conducted by the Fondazione Italiana Linfomi. J Clin Oncol 31 (12): 1506-13, 2013. [PUBMED Abstract]
- Luminari S, Ferrari A, Manni M, et al.: Long-Term Results of the FOLL05 Trial Comparing R-CVP Versus R-CHOP Versus R-FM for the Initial Treatment of Patients With Advanced-Stage Symptomatic Follicular Lymphoma. J Clin Oncol 36 (7): 689-696, 2018. [PUBMED Abstract]
- Czuczman MS, Weaver R, Alkuzweny B, et al.: Prolonged clinical and molecular remission in patients with low-grade or follicular non-Hodgkin's lymphoma treated with rituximab plus CHOP chemotherapy: 9-year follow-up. J Clin Oncol 22 (23): 4711-6, 2004. [PUBMED Abstract]
- Hainsworth JD, Litchy S, Morrissey LH, et al.: Rituximab plus short-duration chemotherapy as first-line treatment for follicular non-Hodgkin's lymphoma: a phase II trial of the Minnie Pearl Cancer Research Network. J Clin Oncol 23 (7): 1500-6, 2005. [PUBMED Abstract]
- Hiddemann W, Kneba M, Dreyling M, et al.: Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) significantly improves the outcome for patients with advanced-stage follicular lymphoma compared with therapy with CHOP alone: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood 106 (12): 3725-32, 2005. [PUBMED Abstract]
- Itchaki G, Gafter-Gvili A, Lahav M, et al.: Anthracycline-containing regimens for treatment of follicular lymphoma in adults. Cochrane Database Syst Rev 7: CD008909, 2013. [PUBMED Abstract]
- Zinzani PL, Pulsoni A, Perrotti A, et al.: Fludarabine plus mitoxantrone with and without rituximab versus CHOP with and without rituximab as front-line treatment for patients with follicular lymphoma. J Clin Oncol 22 (13): 2654-61, 2004. [PUBMED Abstract]
- Forstpointner R, Dreyling M, Repp R, et al.: The addition of rituximab to a combination of fludarabine, cyclophosphamide, mitoxantrone (FCM) significantly increases the response rate and prolongs survival as compared with FCM alone in patients with relapsed and refractory follicular and mantle cell lymphomas: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood 104 (10): 3064-71, 2004. [PUBMED Abstract]
- Herold M, Haas A, Srock S, et al.: Rituximab added to first-line mitoxantrone, chlorambucil, and prednisolone chemotherapy followed by interferon maintenance prolongs survival in patients with advanced follicular lymphoma: an East German Study Group Hematology and Oncology Study. J Clin Oncol 25 (15): 1986-92, 2007. [PUBMED Abstract]
- Salles GA, Mounier N, de Guibert S, et al.: Rituximab combined with chemotherapy and interferon in follicular lymphoma patients: final analysis of the GELA-GOELAMS FL2000 study with a 5-year follow-up. [Abstract] Blood 110 (11): A-792, 2007.
- Schulz H, Bohlius J, Skoetz N, et al.: Combined immunochemotherapy with rituximab improves overall survival in patients with follicular and mantle cell lymphoma: updated meta-analysis results. [Abstract] Blood 108 (11): A-2760, 2006.
- Dupuis J, Berriolo-Riedinger A, Julian A, et al.: Impact of [(18)F]fluorodeoxyglucose positron emission tomography response evaluation in patients with high-tumor burden follicular lymphoma treated with immunochemotherapy: a prospective study from the Groupe d'Etudes des Lymphomes de l'Adulte and GOELAMS. J Clin Oncol 30 (35): 4317-22, 2012. [PUBMED Abstract]
- Trotman J, Fournier M, Lamy T, et al.: Positron emission tomography-computed tomography (PET-CT) after induction therapy is highly predictive of patient outcome in follicular lymphoma: analysis of PET-CT in a subset of PRIMA trial participants. J Clin Oncol 29 (23): 3194-200, 2011. [PUBMED Abstract]
- Morschhauser F, Fowler NH, Feugier P, et al.: Rituximab plus Lenalidomide in Advanced Untreated Follicular Lymphoma. N Engl J Med 379 (10): 934-947, 2018. [PUBMED Abstract]
- Morschhauser F, Nastoupil L, Feugier P, et al.: Six-Year Results From RELEVANCE: Lenalidomide Plus Rituximab (R2) Versus Rituximab-Chemotherapy Followed by Rituximab Maintenance in Untreated Advanced Follicular Lymphoma. J Clin Oncol 40 (28): 3239-3245, 2022. [PUBMED Abstract]
- Leonard JP, Trneny M, Izutsu K, et al.: AUGMENT: A Phase III Study of Lenalidomide Plus Rituximab Versus Placebo Plus Rituximab in Relapsed or Refractory Indolent Lymphoma. J Clin Oncol 37 (14): 1188-1199, 2019. [PUBMED Abstract]
- Bachy E, Seymour JF, Feugier P, et al.: Sustained Progression-Free Survival Benefit of Rituximab Maintenance in Patients With Follicular Lymphoma: Long-Term Results of the PRIMA Study. J Clin Oncol 37 (31): 2815-2824, 2019. [PUBMED Abstract]
- Ardeshna KM, Qian W, Smith P, et al.: Rituximab versus a watch-and-wait approach in patients with advanced-stage, asymptomatic, non-bulky follicular lymphoma: an open-label randomised phase 3 trial. Lancet Oncol 15 (4): 424-35, 2014. [PUBMED Abstract]
- Ansell SM: Follicular lymphoma: watch and wait is watch and worry. Lancet Oncol 15 (4): 368-9, 2014. [PUBMED Abstract]
- Kahl BS, Jegede OA, Peterson C, et al.: Long-Term Follow-Up of the RESORT Study (E4402): A Randomized Phase III Comparison of Two Different Rituximab Dosing Strategies for Low-Tumor Burden Follicular Lymphoma. J Clin Oncol 42 (7): 774-778, 2024. [PUBMED Abstract]
- Taverna C, Martinelli G, Hitz F, et al.: Rituximab Maintenance for a Maximum of 5 Years After Single-Agent Rituximab Induction in Follicular Lymphoma: Results of the Randomized Controlled Phase III Trial SAKK 35/03. J Clin Oncol 34 (5): 495-500, 2016. [PUBMED Abstract]
- Luminari S, Manni M, Galimberti S, et al.: Response-Adapted Postinduction Strategy in Patients With Advanced-Stage Follicular Lymphoma: The FOLL12 Study. J Clin Oncol 40 (7): 729-739, 2022. [PUBMED Abstract]
- Pott C, Jurinovic V, Trotman J, et al.: Minimal Residual Disease Status Predicts Outcome in Patients With Previously Untreated Follicular Lymphoma: A Prospective Analysis of the Phase III GALLIUM Study. J Clin Oncol 42 (5): 550-561, 2024. [PUBMED Abstract]
- van Oers MH, Tönnissen E, Van Glabbeke M, et al.: BCL-2/IgH polymerase chain reaction status at the end of induction treatment is not predictive for progression-free survival in relapsed/resistant follicular lymphoma: results of a prospective randomized EORTC 20981 phase III intergroup study. J Clin Oncol 28 (13): 2246-52, 2010. [PUBMED Abstract]
- Pettengell R, Schmitz N, Gisselbrecht C, et al.: Rituximab purging and/or maintenance in patients undergoing autologous transplantation for relapsed follicular lymphoma: a prospective randomized trial from the lymphoma working party of the European group for blood and marrow transplantation. J Clin Oncol 31 (13): 1624-30, 2013. [PUBMED Abstract]
- Vidal L, Gafter-Gvili A, Salles G, et al.: Rituximab maintenance for the treatment of patients with follicular lymphoma: an updated systematic review and meta-analysis of randomized trials. J Natl Cancer Inst 103 (23): 1799-806, 2011. [PUBMED Abstract]
- Marcus R, Davies A, Ando K, et al.: Obinutuzumab for the First-Line Treatment of Follicular Lymphoma. N Engl J Med 377 (14): 1331-1344, 2017. [PUBMED Abstract]
Tratamiento del linfoma no Hodgkin de células B de crecimiento lento recidivante
En general, el tratamiento farmacológico estándar rara vez produce la cura de los pacientes con linfoma no Hodgkin (LNH) de células B en recaída. A menudo se obtienen remisiones prolongadas después de una recaída en pacientes con linfomas de crecimiento lento, pero por lo general vuelven a recaer. Una supervivencia favorable después de la recaída se relacionó con una edad menor de 60 años, remisión completa en lugar de remisión parcial y una respuesta con más de 2 años de duración.[1] Sin embargo, incluso los pacientes del subconjunto más favorable tienen una mortalidad 10 veces más alta en comparación con las tasas ajustadas por edad de la población de los Estados Unidos.[2]
Los pacientes con linfoma de crecimiento lento que recaen, a menudo logran controlar su enfermedad con quimioterapia en monoterapia o combinada, rituximab (un anticuerpo monoclonal anti-CD20), lenalidomida, anticuerpos monoclonales anti-CD20 radiomarcados o radioterapia paliativa.[3,4] Sin embargo, la ausencia a largo plazo de una segunda recaída es infrecuente y por lo general se presentan múltiples recaídas. Los pacientes con linfoma de crecimiento lento a veces recaen con un tipo histológico más maligno. Si el modelo clínico de recaída indica que la enfermedad tiene un comportamiento más maligno, se obtiene una biopsia. Si se confirma que la enfermedad se convirtió a un tipo histológico más maligno, se debe cambiar el tratamiento a un régimen que corresponda al tipo histológico.[5] El crecimiento rápido o el crecimiento discordante en diferentes sitios de la enfermedad en ocasiones son indicadores de una conversión histológica.
En una revisión retrospectiva de 325 pacientes diagnosticados entre 1972 y 1999, el riesgo a 10 años de transformación histológica fue del 30 %.[6] En esta serie, los factores de riesgo alto para la transformación histológica posterior fueron estadio avanzado, Follicular Lymphoma International Prognostic Index (FLIPI) de riesgo alto y conducta expectante (en lugar de iniciar el tratamiento en el momento del diagnóstico). La mediana de supervivencia después de la transformación fue de 1 a 2 años, con un 25 % de los pacientes vivos a los 5 años y cerca del 10 % al 20 % de los pacientes vivos 10 años después del segundo tratamiento.[7]
En un ensayo prospectivo con 631 pacientes de linfoma folicular, al cabo de una mediana de seguimiento de 60 meses en la era de rituximab (2002–2009), se encontró que la tasa de transformación a un tipo histológico de grado más alto a 5 años fue del 11 %.[8] La mediana de supervivencia general (SG) después de la transformación fue de 50 meses y la tasa de SG a 5 años fue del 66 % cuando la transformación se produjo más de 18 meses después del diagnóstico de linfoma folicular. En esta serie se describió un pronóstico mejor para los pacientes con transformación que en la era anterior a rituximab.
Para obtener descripciones de los regímenes utilizados para tratar las conversiones histológicas, consultar la sección Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido recidivante en Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido. La duración de la segunda remisión a veces es breve y es posible considerar la participación en ensayos clínicos.
Opciones de tratamiento del linfoma no Hodgkin de células B de crecimiento lento recidivante
Las opciones de tratamiento del linfoma no Hodgkin (LNH) de células B recidivante de crecimiento lento son las siguientes:
- Rituximab solo o en combinación con citotóxicos utilizados en el tratamiento de primera línea.
- Obinutuzumab solo o en combinación con citotóxicos utilizados en el tratamiento de primera línea.
- Lenalidomida y rituximab.
- Zanubrutinib y obinutuzumab.
- Inhibidor de EZH2.
- Acopladores biespecíficos de células T.
- Terapia de células T con receptor quimérico para el antígeno.
- Trasplante de células madre.
- Radioterapia paliativa.
Rituximab solo o en combinación con citotóxicos utilizados en el tratamiento de primera línea
El rituximab produce una tasa de respuesta del 40 % al 50 % en los pacientes con linfomas de células B de crecimiento lento en recaída.[9-13] El rituximab también se puede administrar con quimioterapia combinada.[14,15]
Evidencia (rituximab):
- En 3 estudios prospectivos aleatorizados de pacientes con linfoma de crecimiento lento recidivante y con tratamiento previo, los pacientes se asignaron de manera aleatoria para recibir mantenimiento con rituximab después de un segundo tratamiento con quimioterapia combinada (con rituximab o sin este durante la inducción) o rituximab solo.[16-18]
- En todos los ensayos se observó una prolongación de la duración de la respuesta.[16-18] En un ensayo con una mediana de seguimiento de 39 meses, se observó una mejora en la mediana de supervivencia sin progresión (SSP) (3,7 vs. 1,3 años, P < 0,001) y la tasa de SG a 5 años (74 vs. 64 %, P = 0,07), que favoreció el mantenimiento con rituximab.[17]
Obinutuzumab solo o en combinación con citotóxicos utilizados en el tratamiento de primera línea
El obinutuzumab es un anticuerpo monoclonal que se une a CD20 y tiene un epítopo de unión alternativo.
Evidencia (obinutuzumab):
- En un ensayo prospectivo aleatorizado (NCT01059630) de 396 pacientes con linfoma de crecimiento lento resistente al tratamiento con rituximab (en su mayoría linfoma folicular). Los pacientes recibieron obinutuzumab con bendamustina seguido de terapia de mantenimiento con obinutuzumab durante 2 años versus bendamustina sola sin terapia de mantenimiento[19,20][Nivel de evidencia A1]
- Después de una mediana de seguimiento de 31,8 meses, la tasa de SG a 2 años favoreció la combinación de obinutuzumab (74,5 vs. 65,1 %) (cociente de riesgos instantáneos [CRI], 0,67; intervalo de confianza [IC] 95 %, 0,47–0,96; P < 0,027). La mediana de SSP también favoreció la combinación de obinutuzumab (25,8 meses [IC 95 %, 19,5–41,1 meses] vs. 14,1 meses [IC 95 %, 12,6–16,0]) (CRI, 0,57; IC 95 %, 0,44–0,73; P < 0,001).[20][Nivel de evidencia A1]
- Este diseño no permitió evaluar la contribución de la terapia de mantenimiento al desenlace.
Lenalidomida y rituximab
Se notificaron respuestas a la lenalidomida en el 20 % al 56 % de los pacientes; en particular en aquellos con linfoma folicular y linfoma linfocítico de células pequeñas; se observaron respuestas aún mayores para la combinación de lenalidomida y rituximab.[21,22][Nivel de evidencia C3]
Zanubrutinib y obinutuzumab
Evidencia (zanubrutinib y obinutuzumab):
- En un estudio aleatorizado multicéntrico de fase II (ROSEWOOD [NCT03332017]) se incluyeron 217 pacientes con linfoma folicular en recaída o resistente al tratamiento después de recibir 2 o más líneas de tratamiento previas. Los pacientes recibieron el inhibidor oral de la tirosina–cinasa de Bruton zanubrutinib con obinutuzumab o obinutuzumab solo hasta la progresión de la enfermedad.[23][Nivel de evidencia B1]
- Al cabo de una mediana de seguimiento de 19,0 meses, la mediana de SSP fue de 28,0 meses en los pacientes que recibieron zanubrutinib y obinutuzumab y de 10,4 meses en los pacientes que recibieron obinutuzumab solo (CRI, 0,50; IC 95 %, 0,33–0,75; P < 0,001).
- La tasa de respuesta general fue del 69 % (IC 95 %, 61–76 %) en el grupo de zanubrutinib y obinutuzumab y del 46 % (IC 95 %, 34–58 %) en el grupo de obinutuzumab solo (P = 0,0012).
La Administración de Alimentos y Medicamentos de los Estados Unidos aprobó el uso de zanubrutinib con obinutuzumab para pacientes con linfoma folicular en recaída o resistente al tratamiento después de 2 o más líneas de tratamiento previas.
Inhibidor de EZH2
Tazemetostat
El tazemetostat es un inhibidor de EZH2, una histona–metiltransferasa necesaria para la formación de los centros germinativos de los ganglios linfáticos, en especial, cuando hay variantes activadoras de EZH2.
Evidencia (tazemetostat):
- En un estudio de fase II, participaron 99 pacientes con linfoma folicular en recaída o resistente al tratamiento, 45 presentaron variantes activadoras de EZH2 y 54 presentaron EZH2 de tipo natural (normal).[24]
- El tratamiento con tazemetostat produjo una tasa de respuesta objetiva del 69 % (IC 95 %, 53–82 %) en los pacientes con variantes activadoras EZH2 versus un 35 % (IC 95 %, 23–49%) en los pacientes con EZH2 de tipo natural.[24]
- Al cabo de una mediana de seguimiento de 22 meses, la mediana de SSP fue de 13,8 meses (IC 95 %, 10,7–22,0) para los pacientes con variantes activadoras de EZH2 y de 11,1 meses (IC 95 %, 3,7–14,6) para los pacientes con EZH2 de tipo natural.[24][Nivel de evidencia C3]
- Se presentaron efectos adversos relacionados con el tratamiento de grado 3 a 4 en el 4 % de los pacientes.
Acopladores biespecíficos de células T
Los acopladores biespecíficos de células T se unen a CD20 (o CD19) y a CD3 para dirigir la destrucción de los linfocitos B malignos por parte de las células B.[25,26] De manera similar a la terapia de células T con CAR, casi la mitad de los pacientes que reciben esta terapia experimentan el síndrome de liberación de citocinas.
Mosunetuzumab
El mosunetuzumab es un acoplador biespecífico de células T que se une a CD20 y CD3.
Evidencia (mosunetuzumab):
- En un estudio de fase II multicéntrico y de un solo grupo, 90 pacientes con linfoma folicular en recaída o resistente al tratamiento después de 2 o más líneas de tratamiento anteriores (incluso una terapia anti-CD20 y un alquilante) recibieron mosunetuzumab.[25]
- Al cabo de una mediana de seguimiento de 27 meses, la tasa de respuesta objetiva fue del 77,8 % (IC 95 %, 67,8–85,9 %) y la tasa de respuesta completa fue del 60,0 % (IC 95 %, 49,1–70,2 %), según la evaluación del investigador. No se alcanzó la mediana de SSP (según la evaluación del investigador). La SSP a 24 meses fue de 51,4 meses (IC 95 %, 39,4–63,3) después de recibir mosunetuzumab, en comparación con 23,5 meses (IC 95 %, 14,5–32,5) para el último tratamiento previo de los pacientes (quimioinmunoterapia de 63 %, inhibidor de PI3K de 8 %, terapia de células T CAR de 2 %, anticuerpo anti-CD20 con lenalidomida de 2 %, y otros).[27][Nivel de evidencia C3]
- El síndrome de liberación de citocinas se presentó en el 44 % de los pacientes; el 97 % de los casos fueron de grado 1 o 2.
Epcoritamab
El epcoritamab es un acoplador biespecífico de células T que se une a CD20 y CD3.
Evidencia (epcoritamab):
- En un estudio multicéntrico de un solo grupo (NCT03625037), se incluyeron 128 pacientes con linfoma folicular en recaída o resistente al tratamiento que habían recibido 2 o más líneas de tratamiento. Los pacientes recibieron epcoritamab.[28]
- Al cabo de una mediana de seguimiento de 17,4 meses, la tasa de respuesta general fue del 82,0 % (IC 95 % 74,3-88,3) y la tasa de respuesta completa fue del 62 % (IC 95 % 53,5-70,9).[28][Nivel de evidencia C3]
- Solo el 2 % de los pacientes presentaron episodios de síndrome de liberación de citocinas de grado 3 o superior.
Terapia de células T con receptor quimérico para el antígeno
La terapia de células T con receptor quimérico para el antígeno (CAR), con los medicamentos autógenos anti-CD19 axicabtagén ciloleucel (axi-cel), lisocabtagén maraleucel (liso-cel) o tisagenlecleucel (tisa-cel), se aprobó para los pacientes con linfoma folicular recidivante después de recibir 2 o más líneas de tratamiento previo.
Evidencia (terapia de células T con CAR):
- En un ensayo de fase II, 153 pacientes con linfoma folicular o linfoma de zona marginal en recaída o resistente al tratamiento recibieron axi-cel.[29]
- Después de una mediana de seguimiento de 17,5 meses, la tasa de respuesta general fue del 92 % (IC 95 %, 85–97 %) y la tasa de respuesta completa fue del 74 %.
- La tasa de SSP a 18 meses fue del 64,8 % (IC 95 %, 54,2–73,5 %).[29][Nivel de evidencia C3]
- El síndrome de liberación de citocinas se presentó en el 78 % de los pacientes y fue de grado 3 o 4 en el 6 % de los pacientes.
- De todos los pacientes, el 50 % necesitó tocilizumab y el 5 % vasopresores. Se presentaron episodios neurológicos de grado 3 o 4 en el 15 % de los pacientes.
- En un ensayo de fase II, 98 pacientes con linfoma folicular en recaída o resistente al tratamiento después de 2 o más líneas de tratamiento previo recibieron terapia de células T con CAR anti-CD19 con tisa-cel.[30]
- Al cabo de una mediana de seguimiento de 16,6 meses, la tasa de respuesta completa fue del 69,1 % (IC 95 %, 58,8–78,3 %) y la tasa de respuesta general fue del 86,2 % (77,5–92,4 %).[30][Nivel de evidencia C3]
- El síndrome de liberación de citocinas de grado 3 o 4 se presentó en el 48,5 % de los pacientes y el 37,1 % presentó neurotoxicidad de grado 3 o 4.
- En un ensayo de fase II (NCT04245839) se incluyeron 130 pacientes con linfoma folicular en recaída o resistente al tratamiento que habían recibido 2 o más líneas de tratamiento previas. Los pacientes tenían características de riesgo alto (progresión de la enfermedad dentro de los 24 meses posteriores a la quimioinmunoterapia de primera línea o enfermedad resistente al rituximab y los alquilantes). Los pacientes recibieron liso-cel.[31]
- Al cabo de una mediana de seguimiento de 18,9 meses, la tasa de SG a 4 años fue del 97 % (IC 95 %, 91,6–99,4 %), y la tasa de SSP a 4 años fue del 94 % (IC 95 %, 87,5–97,8 %).[31][Nivel de evidencia C3]
- El síndrome de liberación de citocinas se presentó en el 56 % de los pacientes y fue de grado 3 o mayor en el 1 % de los pacientes. Los efectos secundarios neurológicos se presentaron en el 15 % de los pacientes y fueron de grado 3 o superior en el 2 % de los pacientes.
Las células T con CAR se usan en pacientes de riesgo alto que presentaron recaída de la enfermedad de forma rápida tras la quimioinmunoterapia. Este abordaje se considera en el contexto de muchos otros fármacos disponibles.
Trasplante de células madre
En muchas instituciones, se utilizan trasplante de células madre (TCM) autógenos o alogénicos para pacientes de riesgo alto con recaída rápida de la enfermedad tras la quimioinmunoterapia. Este abordaje se considera en el contexto de otros numerosos fármacos disponibles.[32-36]
Evidencia (trasplante de células madre):
- En el German Low-Grade Lymphoma Study Group, 307 pacientes con linfoma folicular recibieron 2 ciclos de quimioterapia de inducción similar al régimen CHOP (ciclofosfamida, doxorrubicina, vincristina y prednisona) y, a continuación, se asignaron de manera aleatoria para recibir un trasplante de células madre (TCM) autógeno versus mantenimiento con interferón.[37]
- Al cabo de una mediana de seguimiento de 4,2 años, la tasa de SSP a 5 años fue del 65 % en los pacientes que recibieron trasplante versus el 33 % en los pacientes que recibieron interferón (P < 0,001). No hubo diferencia en la SG.[37][Nivel de evidencia B1]
Radioterapia paliativa
Se puede lograr paliación con dosis muy bajas (4 Gy) de radioterapia dirigida al campo comprometido en 2 fracciones en pacientes con recaídas de la enfermedad de crecimiento lento y rápido.[38] En un ensayo aleatorizado prospectivo, el tratamiento con 4 Gy fue inferior al tratamiento con 24 Gy en 12 fracciones para la SSP (77 vs. 92 %, P < 0,0001).[39][Nivel de evidencia B1]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Casulo C, Byrtek M, Dawson KL, et al.: Early Relapse of Follicular Lymphoma After Rituximab Plus Cyclophosphamide, Doxorubicin, Vincristine, and Prednisone Defines Patients at High Risk for Death: An Analysis From the National LymphoCare Study. J Clin Oncol 33 (23): 2516-22, 2015. [PUBMED Abstract]
- Weisdorf DJ, Andersen JW, Glick JH, et al.: Survival after relapse of low-grade non-Hodgkin's lymphoma: implications for marrow transplantation. J Clin Oncol 10 (6): 942-7, 1992. [PUBMED Abstract]
- Peterson BA: Current treatment of follicular low-grade lymphomas. Semin Oncol 26 (5 Suppl 14): 2-11, 1999. [PUBMED Abstract]
- Haas RL, Poortmans P, de Jong D, et al.: High response rates and lasting remissions after low-dose involved field radiotherapy in indolent lymphomas. J Clin Oncol 21 (13): 2474-80, 2003. [PUBMED Abstract]
- Tsimberidou AM, O'Brien S, Khouri I, et al.: Clinical outcomes and prognostic factors in patients with Richter's syndrome treated with chemotherapy or chemoimmunotherapy with or without stem-cell transplantation. J Clin Oncol 24 (15): 2343-51, 2006. [PUBMED Abstract]
- Montoto S, Davies AJ, Matthews J, et al.: Risk and clinical implications of transformation of follicular lymphoma to diffuse large B-cell lymphoma. J Clin Oncol 25 (17): 2426-33, 2007. [PUBMED Abstract]
- Yuen AR, Kamel OW, Halpern J, et al.: Long-term survival after histologic transformation of low-grade follicular lymphoma. J Clin Oncol 13 (7): 1726-33, 1995. [PUBMED Abstract]
- Link BK, Maurer MJ, Nowakowski GS, et al.: Rates and outcomes of follicular lymphoma transformation in the immunochemotherapy era: a report from the University of Iowa/MayoClinic Specialized Program of Research Excellence Molecular Epidemiology Resource. J Clin Oncol 31 (26): 3272-8, 2013. [PUBMED Abstract]
- Davis TA, White CA, Grillo-López AJ, et al.: Single-agent monoclonal antibody efficacy in bulky non-Hodgkin's lymphoma: results of a phase II trial of rituximab. J Clin Oncol 17 (6): 1851-7, 1999. [PUBMED Abstract]
- Piro LD, White CA, Grillo-López AJ, et al.: Extended Rituximab (anti-CD20 monoclonal antibody) therapy for relapsed or refractory low-grade or follicular non-Hodgkin's lymphoma. Ann Oncol 10 (6): 655-61, 1999. [PUBMED Abstract]
- Davis TA, Grillo-López AJ, White CA, et al.: Rituximab anti-CD20 monoclonal antibody therapy in non-Hodgkin's lymphoma: safety and efficacy of re-treatment. J Clin Oncol 18 (17): 3135-43, 2000. [PUBMED Abstract]
- Hainsworth JD, Litchy S, Shaffer DW, et al.: Maximizing therapeutic benefit of rituximab: maintenance therapy versus re-treatment at progression in patients with indolent non-Hodgkin's lymphoma--a randomized phase II trial of the Minnie Pearl Cancer Research Network. J Clin Oncol 23 (6): 1088-95, 2005. [PUBMED Abstract]
- Lockmer S, Østenstad B, Hagberg H, et al.: Chemotherapy-Free Initial Treatment of Advanced Indolent Lymphoma Has Durable Effect With Low Toxicity: Results From Two Nordic Lymphoma Group Trials With More Than 10 Years of Follow-Up. J Clin Oncol : JCO1800262, 2018. [PUBMED Abstract]
- Forstpointner R, Dreyling M, Repp R, et al.: The addition of rituximab to a combination of fludarabine, cyclophosphamide, mitoxantrone (FCM) significantly increases the response rate and prolongs survival as compared with FCM alone in patients with relapsed and refractory follicular and mantle cell lymphomas: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood 104 (10): 3064-71, 2004. [PUBMED Abstract]
- Canellos GP: CHOP may have been part of the beginning but certainly not the end: issues in risk-related therapy of large-cell lymphoma. J Clin Oncol 15 (5): 1713-6, 1997. [PUBMED Abstract]
- van Oers MH, Van Glabbeke M, Giurgea L, et al.: Rituximab maintenance treatment of relapsed/resistant follicular non-Hodgkin's lymphoma: long-term outcome of the EORTC 20981 phase III randomized intergroup study. J Clin Oncol 28 (17): 2853-8, 2010. [PUBMED Abstract]
- van Oers MH, Klasa R, Marcus RE, et al.: Rituximab maintenance improves clinical outcome of relapsed/resistant follicular non-Hodgkin lymphoma in patients both with and without rituximab during induction: results of a prospective randomized phase 3 intergroup trial. Blood 108 (10): 3295-301, 2006. [PUBMED Abstract]
- Martinelli G, Schmitz SF, Utiger U, et al.: Long-term follow-up of patients with follicular lymphoma receiving single-agent rituximab at two different schedules in trial SAKK 35/98. J Clin Oncol 28 (29): 4480-4, 2010. [PUBMED Abstract]
- Sehn LH, Chua N, Mayer J, et al.: Obinutuzumab plus bendamustine versus bendamustine monotherapy in patients with rituximab-refractory indolent non-Hodgkin lymphoma (GADOLIN): a randomised, controlled, open-label, multicentre, phase 3 trial. Lancet Oncol 17 (8): 1081-93, 2016. [PUBMED Abstract]
- Cheson BD, Chua N, Mayer J, et al.: Overall Survival Benefit in Patients With Rituximab-Refractory Indolent Non-Hodgkin Lymphoma Who Received Obinutuzumab Plus Bendamustine Induction and Obinutuzumab Maintenance in the GADOLIN Study. J Clin Oncol 36 (22): 2259-2266, 2018. [PUBMED Abstract]
- Witzig TE, Wiernik PH, Moore T, et al.: Lenalidomide oral monotherapy produces durable responses in relapsed or refractory indolent non-Hodgkin's Lymphoma. J Clin Oncol 27 (32): 5404-9, 2009. [PUBMED Abstract]
- Leonard JP, Jung SH, Johnson J, et al.: Randomized Trial of Lenalidomide Alone Versus Lenalidomide Plus Rituximab in Patients With Recurrent Follicular Lymphoma: CALGB 50401 (Alliance). J Clin Oncol 33 (31): 3635-40, 2015. [PUBMED Abstract]
- Zinzani PL, Mayer J, Flowers CR, et al.: ROSEWOOD: A Phase II Randomized Study of Zanubrutinib Plus Obinutuzumab Versus Obinutuzumab Monotherapy in Patients With Relapsed or Refractory Follicular Lymphoma. J Clin Oncol 41 (33): 5107-5117, 2023. [PUBMED Abstract]
- Morschhauser F, Tilly H, Chaidos A, et al.: Tazemetostat for patients with relapsed or refractory follicular lymphoma: an open-label, single-arm, multicentre, phase 2 trial. Lancet Oncol 21 (11): 1433-1442, 2020. [PUBMED Abstract]
- Budde LE, Sehn LH, Matasar M, et al.: Safety and efficacy of mosunetuzumab, a bispecific antibody, in patients with relapsed or refractory follicular lymphoma: a single-arm, multicentre, phase 2 study. Lancet Oncol 23 (8): 1055-1065, 2022. [PUBMED Abstract]
- Hutchings M, Mous R, Clausen MR, et al.: Dose escalation of subcutaneous epcoritamab in patients with relapsed or refractory B-cell non-Hodgkin lymphoma: an open-label, phase 1/2 study. Lancet 398 (10306): 1157-1169, 2021. [PUBMED Abstract]
- Bartlett NL, Sehn LH, Matasar MJ, et al.: Mosunetuzumab monotherapy demonstrates durable efficacy with a manageable safety profile in patients with relapsed/refractory follicular lymphoma who received ≥2 prior therapies: updated results from a pivotal phase II study. [Abstract] Blood 140 (Suppl 1): A-610, 1467-70, 2022.
- Linton KM, Vitolo U, Jurczak W, et al.: Epcoritamab monotherapy in patients with relapsed or refractory follicular lymphoma (EPCORE NHL-1): a phase 2 cohort of a single-arm, multicentre study. Lancet Haematol 11 (8): e593-e605, 2024. [PUBMED Abstract]
- Jacobson CA, Chavez JC, Sehgal AR, et al.: Axicabtagene ciloleucel in relapsed or refractory indolent non-Hodgkin lymphoma (ZUMA-5): a single-arm, multicentre, phase 2 trial. Lancet Oncol 23 (1): 91-103, 2022. [PUBMED Abstract]
- Fowler NH, Dickinson M, Dreyling M, et al.: Tisagenlecleucel in adult relapsed or refractory follicular lymphoma: the phase 2 ELARA trial. Nat Med 28 (2): 325-332, 2022. [PUBMED Abstract]
- Morschhauser F, Dahiya S, Palomba ML, et al.: Lisocabtagene maraleucel in follicular lymphoma: the phase 2 TRANSCEND FL study. Nat Med 30 (8): 2199-2207, 2024. [PUBMED Abstract]
- Freedman A, Friedberg JW, Gribben J: High-dose therapy for follicular lymphoma. Oncology (Huntingt) 14 (3): 321-6, 329; discussion 330-2, 338, 2000. [PUBMED Abstract]
- Brice P, Simon D, Bouabdallah R, et al.: High-dose therapy with autologous stem-cell transplantation (ASCT) after first progression prolonged survival of follicular lymphoma patients included in the prospective GELF 86 protocol. Ann Oncol 11 (12): 1585-90, 2000. [PUBMED Abstract]
- Khouri IF, McLaughlin P, Saliba RM, et al.: Eight-year experience with allogeneic stem cell transplantation for relapsed follicular lymphoma after nonmyeloablative conditioning with fludarabine, cyclophosphamide, and rituximab. Blood 111 (12): 5530-6, 2008. [PUBMED Abstract]
- Sebban C, Brice P, Delarue R, et al.: Impact of rituximab and/or high-dose therapy with autotransplant at time of relapse in patients with follicular lymphoma: a GELA study. J Clin Oncol 26 (21): 3614-20, 2008. [PUBMED Abstract]
- Thomson KJ, Morris EC, Milligan D, et al.: T-cell-depleted reduced-intensity transplantation followed by donor leukocyte infusions to promote graft-versus-lymphoma activity results in excellent long-term survival in patients with multiply relapsed follicular lymphoma. J Clin Oncol 28 (23): 3695-700, 2010. [PUBMED Abstract]
- Lenz G, Dreyling M, Schiegnitz E, et al.: Myeloablative radiochemotherapy followed by autologous stem cell transplantation in first remission prolongs progression-free survival in follicular lymphoma: results of a prospective, randomized trial of the German Low-Grade Lymphoma Study Group. Blood 104 (9): 2667-74, 2004. [PUBMED Abstract]
- Haas RL, Poortmans P, de Jong D, et al.: Effective palliation by low dose local radiotherapy for recurrent and/or chemotherapy refractory non-follicular lymphoma patients. Eur J Cancer 41 (12): 1724-30, 2005. [PUBMED Abstract]
- Hoskin PJ, Kirkwood AA, Popova B, et al.: 4 Gy versus 24 Gy radiotherapy for patients with indolent lymphoma (FORT): a randomised phase 3 non-inferiority trial. Lancet Oncol 15 (4): 457-63, 2014. [PUBMED Abstract]
Otros trastornos linfoproliferativos y afecciones relacionadas
Enfermedad de Castleman
Una biopsia de colecciones localizadas o multifocales de ganglios linfáticos a veces conduce al diagnóstico de enfermedad de Castleman (EC). En sentido estricto, este diagnóstico infrecuente no es un linfoma y tampoco es una neoplasia maligna. Sin embargo, hematólogos u oncólogos atienden y tratan a muchos pacientes con EC.
La EC localizada o unicéntrica suele ser asintomática y se observa en el mediastino, que es la presentación más común de la EC.[1] Para esta forma de crecimiento lento se utiliza la conducta expectante, la cirugía o la radioterapia. La EC multicéntrica (30 % de los pacientes con EC) se presenta con linfadenopatía en múltiples sitios; síntomas como fiebre, sudoración nocturna, pérdida de peso y fatiga; y anomalías de las pruebas de laboratorio como anemia, albúmina baja, proteína C-reactiva elevada y fibrinógeno alto.[1] La EC multicéntrica (ECM) se subdivide en ECM relacionada con el virus del herpes humano 8 (normalmente con VIH o con inmunodeficiencia grave) o ECM idiopática. Las citopenias y la tormenta de citocinas se atribuyen a la sobreproducción de interleucina-6 (IL-6). La ECM es una característica del síndrome POEMS (polineuropatía, organomegalia, endocrinopatía, gammapatía monoclonal y anomalías cutáneas) [2] y el síndrome TAFRO (trombocitopenia, anasarca, fiebre, reticulinofibrosis y organomegalia).[3,4] El tratamiento con siltuximab (un anticuerpo monoclonal anti–IL-6), rituximab (un anticuerpo monoclonal anti-CD20) o quimioterapéuticos se ha notificado en series anecdóticas no aleatorias.[5-8]
Linfoma histiocítico verdadero
Los linfomas histiocíticos verdaderos producen tumores muy poco frecuentes que exhiben diferenciación histiocítica y expresan marcadores histiocíticos en ausencia de marcadores inmunitarios de linaje específico de células B o T. Estos linfomas también se conocen como sarcomas histiocíticos o linfomas histiocitarios verdaderos.[9,10] Se debe tener cuidado con las pruebas inmunofenotípicas para excluir el linfoma anaplásico de células grandes y los síndromes hemofagocíticos causados por infecciones víricas, en especial las causadas por el virus de Epstein-Barr.
Opciones de tratamiento
El tratamiento es similar al de los linfomas difusos de células grandes en estadio comparable, pero todavía queda por definir el abordaje óptimo.
Bibliografía
- van Rhee F, Voorhees P, Dispenzieri A, et al.: International, evidence-based consensus treatment guidelines for idiopathic multicentric Castleman disease. Blood 132 (20): 2115-2124, 2018. [PUBMED Abstract]
- Dispenzieri A: POEMS Syndrome: 2019 Update on diagnosis, risk-stratification, and management. Am J Hematol 94 (7): 812-827, 2019. [PUBMED Abstract]
- Zhang Y, Suo SS, Yang HJ, et al.: Clinical features and treatment of 7 Chinese TAFRO syndromes from 96 de novo Castleman diseases: a 10-year retrospective study. J Cancer Res Clin Oncol 146 (2): 357-365, 2020. [PUBMED Abstract]
- Fujimoto S, Sakai T, Kawabata H, et al.: Is TAFRO syndrome a subtype of idiopathic multicentric Castleman disease? Am J Hematol 94 (9): 975-983, 2019. [PUBMED Abstract]
- Tonialini L, Bonfichi M, Ferrero S, et al.: Siltuximab in relapsed/refractory multicentric Castleman disease: Experience of the Italian NPP program. Hematol Oncol 36 (4): 689-692, 2018. [PUBMED Abstract]
- Dong Y, Zhang L, Nong L, et al.: Effectiveness of rituximab-containing treatment regimens in idiopathic multicentric Castleman disease. Ann Hematol 97 (9): 1641-1647, 2018. [PUBMED Abstract]
- Zhang L, Zhao AL, Duan MH, et al.: Phase 2 study using oral thalidomide-cyclophosphamide-prednisone for idiopathic multicentric Castleman disease. Blood 133 (16): 1720-1728, 2019. [PUBMED Abstract]
- van Rhee F, Wong RS, Munshi N, et al.: Siltuximab for multicentric Castleman's disease: a randomised, double-blind, placebo-controlled trial. Lancet Oncol 15 (9): 966-74, 2014. [PUBMED Abstract]
- Soslow RA, Davis RE, Warnke RA, et al.: True histiocytic lymphoma following therapy for lymphoblastic neoplasms. Blood 87 (12): 5207-12, 1996. [PUBMED Abstract]
- Kamel OW, Gocke CD, Kell DL, et al.: True histiocytic lymphoma: a study of 12 cases based on current definition. Leuk Lymphoma 18 (1-2): 81-6, 1995. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (04/30/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Este resumen es nuevo.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del linfoma no Hodgkin de células B de crecimiento lento en adultos. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del linfoma no Hodgkin de células B de crecimiento lento son:
- Eric J. Seifter, MD (Johns Hopkins University)
- Cole H. Sterling, MD (Johns Hopkins University)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del linfoma no Hodgkin de células B de crecimiento lento. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/linfoma/pro/tratamiento-linfoma-celulas-b-crecimiento-lento-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.