¿Qué son las hormonas sexuales masculinas?
Las hormonas son sustancias que producen las glándulas del cuerpo. Las hormonas circulan en la sangre y controlan la actividad de determinadas células u órganos.
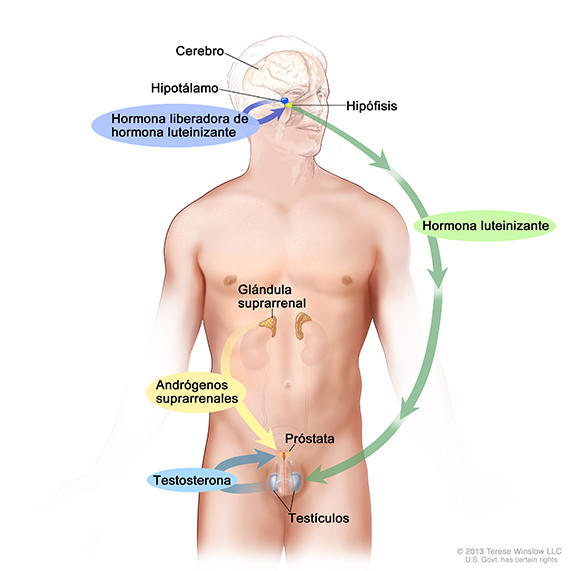
Los andrógenos (hormonas sexuales masculinas) son un tipo de hormona que controla el desarrollo y el mantenimiento de las características sexuales masculinas. Los andrógenos más abundantes en los hombres son la testosterona y la dihidrotestosterona (DHT).
Los andrógenos son necesarios para el crecimiento y el funcionamiento normal de la próstata, una glándula del aparato reproductor masculino que ayuda a producir el semen. Pero los andrógenos también favorecen el crecimiento de los cánceres de próstata: se unen al receptor de andrógeno (una proteína en las células de la próstata) y al activarlo, estimulan la multiplicación de las células normales o cancerosas en la próstata (1). Una vez que se activa, el receptor de andrógeno estimula la expresión de genes específicos que hacen que las células de la próstata se multipliquen (2).
Casi toda la testosterona se produce en los testículos; una cantidad pequeña se produce en las glándulas suprarrenales. Aunque no es normal que las células de la próstata produzcan testosterona, algunas células de cáncer de próstata adquieren la capacidad de hacerlo (3).
¿Cómo funciona la terapia hormonal contra el cáncer de próstata?
Cuando empiezan a formarse, los cánceres de próstata necesitan andrógenos para crecer. Las terapias hormonales son tratamientos que disminuyen las concentraciones de andrógenos o bloquean su acción, y que pueden impedir el crecimiento de estos cánceres de próstata; es por eso, que a este tipo de cáncer se lo llama cáncer de próstata sensible a la castración. Estos cánceres también se describen como dependientes de los andrógenos, sensibles a los andrógenos, sensibles a la castración o sensibles a las hormonas.
La mayoría de los cánceres de próstata con el tiempo dejan de responder a la terapia hormonal y se vuelven resistentes a la castración. Es decir, continúan creciendo aunque las concentraciones de andrógenos en el cuerpo sean muy bajas o no se detecten. En el pasado, a estos tumores también se los conocía como resistentes a las hormonas, independientes de los andrógenos o refractarios a las hormonas; sin embargo, estos términos ya casi no se usan porque el crecimiento de estos tumores no es completamente independientes de los andrógenos. De hecho, algunas terapias hormonales más nuevas se usan para el tratamiento de tumores que se han vuelto resistentes a la castración.
¿Qué tipos de terapia hormonal se usan para el cáncer de próstata?
La terapia hormonal para el cáncer de próstata inhibe la producción o el uso de andrógenos (4). Los tratamientos disponibles hacen esto de diferentes formas, como las siguientes:
- disminuyen la producción de andrógenos en los testículos
- inhiben la actividad de los andrógenos en todo el cuerpo
- interrumpen la producción (síntesis) de andrógenos en todo el cuerpo, incluso en las células de cáncer de próstata.
Tratamientos que disminuyen la producción de andrógenos en los testículos
Las terapias hormonales son el tratamiento más común para el cáncer de próstata y el primer tipo de terapia que reciben la mayoría de los hombres con cáncer de próstata. Esta terapia hormonal se llama terapia de privación de andrógenos (TPA) y se hace de varias formas:
- Orquiectomía (u orquidectomía): cirugía para extirpar un testículo o ambos. Con la extirpación de los testículos, que se llama castración quirúrgica, se disminuye del 90 % al 95 % la concentración de testosterona en la sangre (5).
- Agonistas de la hormona liberadora de hormona luteinizante: medicamentos llamados agonistas de la hormona liberadora de hormona luteinizante (LHRH), que a veces se conocen como análogos de la LHRH, para impedir que la hipófisis segregue hormona luteinizante. Estos agonistas son proteínas sintéticas con estructura parecida a la de la LHRH que se unen al receptor de LHRH en la hipófisis. La LHRH también se conoce como hormona liberadora de gonadotropina o GnRH, así que los agonistas de LHRH también se llaman agonistas de GnRH o análogos de GnRH.
En general, cuando las concentraciones de andrógenos en el cuerpo son bajas, el hipotálamo libera la LHRH. Esto estimula la hipófisis para que produzca hormona luteinizante, que a su vez estimula los testículos para que produzcan andrógenos. Los agonistas de LHRH, como la LHRH propia del cuerpo, al principio estimulan la producción de la hormona luteinizante. Sin embargo, la presencia continua de concentraciones altas de agonistas de LHRH hace que la hipófisis deje de producir hormona luteinizante. Como consecuencia, los testículos no reciben estimulación para producir andrógenos.
El tratamiento con un agonista de LHRH se llama castración médica o castración química. Pero a diferencia de la castración quirúrgica (orquiectomía), la castración médica es reversible. Una vez que se interrumpe el tratamiento, se vuelven a producir andrógenos.
Los agonistas de LHRH se administran por inyección o se implantan debajo de la piel. En los Estados Unidos, los agonistas de LHRH aprobados para el tratamiento de cáncer de próstata incluyen: la leuprorelina (Lupron Depot, Eligard, Camcevi), la goserelina (Zoladex) y la triptorelina (Trelstar).
Cuando los pacientes reciben un agonista de LHRH por primera vez, es probable que tengan un "repunte de testosterona". Este es un aumento temporal de la concentración de testosterona que se produce porque los agonistas de LHRH hacen que la hipófisis segregue la hormona luteinizante en exceso por un tiempo antes de inhibirla. El repunte empeora los síntomas clínicos, como el dolor de hueso, la obstrucción del uréter o del flujo urinario y la compresión de la médula espinal.
- Antagonistas de la hormona liberadora de hormona luteinizante: medicamentos llamados antagonistas de la hormona liberadora de hormona luteinizante (LHRH) que también se llaman antagonistas de la GnRH, para impedir que la LHRH se una a los receptores de esta hormona en la hipófisis. Es otro tipo de castración médica. Esto impide la secreción de hormona luteinizante, que inhibe la producción de andrógenos en los testículos. A diferencia de los agonistas de LHRH, los antagonistas de LHRH no causan un repunte de testosterona.
En los Estados Unidos, hay dos antagonistas de LHRH aprobados para el tratamiento de cáncer de próstata avanzado: el acetato de degarelix degarelix (Firmagon) que es inyectable, y el relugolix (Orgovyx) que es oral.
Tratamientos que inhiben la actividad de los andrógenos en todo el cuerpo
Cuando la terapia de privación de andrógenos (TPA) deja de funcionar, se usan los siguientes tratamientos:
- Inhibidores del receptor de andrógeno (o antagonistas del receptor de andrógeno): medicamentos que compiten con los andrógenos para unirse al receptor de andrógeno. Al evitar que los andrógenos se unan a los receptores, estos tratamientos reducen la capacidad de los andrógenos de promover la multiplicación de las células del cáncer de próstata.
Por lo común, los antagonistas de los receptores de andrógenos se utilizan junto con la terapia de privación de andrógenos (TPA) (orquiectomía o un agonista de la LHRH) porque la combinación reduce las concentraciones de estas hormonas y evita que los andrógenos restantes se unan a los receptores. La combinación se conoce a menudo como bloqueo combinado de andrógenos, bloqueo completo de andrógenos, bloqueo máximo de andrógenos o bloqueo total de andrógenos. Además de utilizarse como terapia hormonal para el cáncer de próstata, los antagonistas de los receptores de andrógenos se utilizan a veces durante algunas semanas al inicio de la TPA para prevenir los repuntes de testosterona.
Los antagonistas de los receptores de andrógenos aprobados en los Estados Unidos para tratar el cáncer de próstata incluyen los medicamentos de “primera generación” flutamida, bicalutamida (Casodex) y nilutamida (Nilandron), y los medicamentos de “segunda generación” enzalutamida (Xtandi), apalutamida (Erleada) y darolutamida (Nubeqa). Los medicamentos de segunda generación se unen al receptor de andrógenos y lo bloquean con más fuerza y de manera más específica que los medicamentos de primera generación (6). La darolutamida es el único antagonista de los receptores de andrógenos que no cruza la barrera hematoencefálica en los seres humanos, por lo que produce menos efectos secundarios relacionados con el sistema nervioso central. Los antagonistas de los receptores de andrógenos se administran en forma de pastillas por vía oral.
Tratamientos que inhiben la producción de andrógenos en todo el cuerpo
- Inhibidores de la síntesis de andrógenos: medicamentos que impiden la producción de andrógenos en todos los tejidos que los producen. Al igual que la terapia de privación de andrógenos (TPA), los inhibidores de la síntesis de andrógenos impiden que los testículos produzcan andrógenos; a diferencia de la TPA, también impiden que las glándulas suprarrenales y las células del cáncer de próstata produzcan andrógenos. Aunque solo se producen pequeñas cantidades de andrógenos fuera de los testículos, las concentraciones bajas que aún se conservan pueden ser suficientes para mantenerel crecimiento de algunos cánceres de próstata.
Con Los inhibidores de la síntesis de andrógenos reducen las concentraciones de testosterona en mayor medida que cualquier otro tratamiento conocido. Lo hacen mediante la inhibición de una enzima llamada CYP17. Esta enzima, que se encuentra en los tejidos tumorales de los testículos, las glándulas suprarrenales y la próstata, es necesaria para que el cuerpo produzca testosterona.
En los Estados Unidos, los inhibidores de la síntesis de andrógenos aprobados incluyen: la abiraterona (Yonsa, Zytiga) y el ketoconazol. Ambos se administran en forma de pastillas por vía oral.
La abiraterona se utiliza en combinación con la prednisona para tratar el cáncer de próstata metastásico, ya sea sensible a la castración o resistente a la castración. El ketoconazol está aprobado para otras indicaciones además del cáncer de próstata, pero a veces se utiliza para una indicación no aprobada, como tratamiento de segunda línea para el cáncer de próstata resistente a la castración; sin embargo, este uso es poco frecuente por que se dispone de antagonistas de los receptores de andrógenos de segunda generación.
¿Cómo se usa la terapia hormonal para tratar el cáncer de próstata sensible a la castración?
Es posible usar la terapia hormonal para tratar el cáncer de próstata sensible a la castración en las siguientes formas:
- Cáncer de próstata en estadio temprano con riesgo intermedio o alto de recidiva. Los hombres que reciben radioterapia para tratar el cáncer de próstata en etapa temprana y que tienen un riesgo intermedio o alto de recidiva, a menudo, también reciben TPA. Además, la TPA se usa después de la prostatectomía en hombres que tienen enfermedad de riesgo alto y compromiso de ganglios linfáticos (7, 8).
- Cáncer de próstata en recaída o recidivante. La terapia hormonal a menudo se usa sola para personas que presentan recidiva del cáncer de próstata después de un tratamiento anterior con radiación o cirugía. La terapia hormonal es el tratamiento estándar para aquellos que tienen una recidiva sintomática (que se documenta mediante tomografía computarizada, imágenes por resonancia magnética, tomografía por emisión de positrones con PSMA, o gammagrafía ósea) y es posible que se recomiende para algunas personas que presentan una "recidiva bioquímica" (aumento en la concentración del antígeno prostático específico [PSA] después del tratamiento con cirugía o radiación), sobre todo si la concentración de PSA aumenta de forma rápida.
- Cáncer de próstata avanzado o metastásico. Durante muchos años, la terapia de privación de andrógenos (TPA) sola fue el tratamiento estándar para los hombres que, en el momento del diagnóstico inicial del cáncer de próstata, presentaban una enfermedad metastásica (es decir, que se había propagado a otras partes del cuerpo) sensible a la castración (9). En la actualidad, estos hombres reciben tratamiento con TPA junto con otro tipo de terapia hormonal (abiraterona, enzalutamida o apalutamida) o TPA, el medicamento de quimioterapia docetaxel (Taxotere) y un antagonista del receptor de andrógenos de segunda generación, como abiraterona o darolutamida. Algunos de estos hombres, especialmente aquellos con metástasis extensas, a veces reciben tratamiento con TPA, quimioterapia y otro tipo de terapia hormonal (10)
Aunque la terapia hormonal puede demorar la progresión de la enfermedad metastásica y prolongar la supervivencia, en ocasiones también tiene efectos secundarios. Se recomienda hablar con el médico sobre los riesgos y los posibles beneficios de la terapia hormonal, así como de las formas de reducir algunos efectos secundarios.
- Alivio de los síntomas. La terapia hormonal a veces se usa sola para la paliación (alivio) o la prevención de síntomas locales cuando los hombres con cáncer de próstata localizado no son pacientes ideales para la cirugía o radioterapia (11). Esto incluye a quienes tienen una esperanza de vida limitada, tumores localmente avanzados u otros problemas de salud graves.
¿Cómo sé si la terapia hormonal funcionó?
Los médicos no pueden pronosticar por cuánto tiempo la terapia hormonal inhibirá la multiplicación de las células de cáncer de próstata en una persona. Por lo tanto, a los hombres que reciben terapia hormonal por más de unos meses, se les hace pruebas con regularidad para vigilar la concentración del PSA en la sangre. El aumento en la concentración del PSA indica que el cáncer comenzó a crecer de nuevo o se volvió resistente a la terapia hormonal que se está utilizando.
¿Cómo se trata el cáncer de próstata resistente a la castración?
Los tratamientos para el cáncer de próstata resistente a la castración son los siguientes:
- Bloqueo completo de andrógenos, es decir, terapia de privación de andrógenos más un antagonista del receptor de andrógenos (flutamida, bicalutamida, nilutamida, apalutamida, darolutamida o enzalutamida).
- Inhibición de la síntesis de andrógenos con abiraterona.
- Quimioterapia, en especial con docetaxel. Otro medicamento de quimioterapia; el cabazitaxel (Jevtana), está aprobado para el tratamiento del cáncer de próstata metastásico resistente a la castración que se trató antes con docetaxel.
- Radiofármacos, incluso el dicloruro de radio Ra 223 (Xofigo) y el lutecio Lu 177 vipivotida tetraxetán (Pluvicto). El radio Ra 223 se acumula en zonas de mucho recambio óseo (proceso en el que el tejido óseo viejo se reabsorbe y se vuelve a formar tejido óseo nuevo), como los sitios donde se forman las metástasis, y emite radiación para destruir las células cancerosas. El lutecio Lu 177 vipivotida tetraxetán se dirige a las células de la próstata, se une a ellas y emite radiación que las destruye.
- Medicamentos llamados inhibidores de PARP. Los inhibidores de PARP rucaparib (Rubraca), olaparib (Lynparza), talazoparib (Talzenna) y niraparib en combinación con la abiraterona (Akeega) están aprobados para el tratamiento de cánceres de próstata metastásicos resistentes a la castración con ciertos cambios genéticos que alteran la reparación del ADN en las células cancerosas.
- Inmunoterapia con una vacuna de células que se llama sipuleucel-T (Provenge). En esta vacuna se usan las células inmunitarias de la persona para combatir el cáncer de próstata metastásico que presenta pocos síntomas o ninguno.
Las personas con cáncer de próstata resistente a la castración que reciben estos tratamientos continuarán recibiendo TPA (por ejemplo, un agonista de LHRH) para mantener concentraciones bajas de testosterona, porque un aumento de la testosterona podría causar la progresión del tumor en algunos hombres (12).
¿Qué es la terapia de privación de andrógenos intermitente?
Los investigadores estudiaron si una técnica llamada privación de andrógenos intermitente demora la presentación de la resistencia a la terapia hormonal. Para la privación de andrógenos intermitente, la terapia hormonal se administra en ciclos con descansos entre las administraciones de los medicamentos en lugar de hacerlo de forma continua, en particular en personas con una recidiva bioquímica. El objetivo de la privación intermitente de andrógenos es demorar la presentación de la resistencia a la terapia hormonal. Un beneficio potencial adicional de este enfoque es que la interrupción temporal de los efectos secundarios de la terapia hormonal puede mejorar la calidad de vida de la persona. En ningún estudio se comparó la TPA intermitente con la TPA continua.
¿Cuáles son los efectos secundarios de la terapia hormonal para el cáncer de próstata?
Dado que los andrógenos afectan muchos otros órganos además de la próstata, la terapia de privación de andrógenos (TPA) tiene varios efectos secundarios (4, 13), como los siguientes:
- disminución del deseo sexual (libido)
- disfunción eréctil
- sofocos
- pérdida de densidad ósea
- fracturas de hueso
- disminución de la masa muscular y fuerza física
- cambios en los lípidos de la sangre
- resistencia a la insulina
- aumento de peso
- cambios de humor
- fatiga
- crecimiento del tejido mamario (ginecomastia)
Los antiandrógenos causan diarrea, sensibilidad en los senos (mamas), náuseas, sofocos, disminución de la libido y disfunción eréctil. El antiandrógeno flutamida causa daño al hígado, y la enzalutamida y la apalutamida causan fracturas. Con la darolutamida, se evitan algunos efectos secundarios relacionados con el sistema nervioso central que se observan con la enzalutamida y la apalutamida, como las convulsiones y las caídas.
Los inhibidores de la síntesis de andrógenos causan diarrea, picazón y sarpullido, fatiga, disfunción eréctil (si se usa a largo plazo) y, a veces, daño al hígado.
Aunque se demostró que agregar la TPA a la radioterapia aumenta la supervivencia en hombres con cáncer de próstata de riesgo alto, también empeora algunos efectos adversos de la radioterapia, en particular, los que afectan el funcionamiento sexual y la vitalidad (14). El riesgo de sufrir efectos secundarios aumenta cuanto más se prolongue el uso de terapia hormonal (13).
¿Cómo se disminuyen los efectos secundarios de la terapia hormonal para el cáncer de próstata?
Si los hombres reciben terapia hormonal a largo plazo, a veces los médicos recetan medicamentos para frenar la pérdida de la masa ósea o incluso para recuperarla. El ácido zoledrónico (Zometa) y el alendronato (Fosamax) son medicamentos que se llaman bisfosfonatos. Los bifosfonatos se usan para aumentar la densidad mineral ósea en los hombres que reciben terapia hormonal (15, 16). El denosumab (Prolia), un medicamento más nuevo, también aumenta la masa ósea, pero con un mecanismo diferente (17). Sin embargo, los medicamentos que se usan para tratar la disminución de masa ósea se relacionan con un efecto secundario poco común pero grave, llamado osteonecrosis maxilar (12).
Es posible que el ejercicio ayude a disminuir algunos de los efectos secundarios de la terapia hormonal, como la pérdida de masa ósea y de masa muscular, el aumento de peso, la fatiga y la resistencia a la insulina (12, 18). En algunos estudios clínicos se investiga si hacer ejercicio evita o cancela los efectos secundarios que causa la terapia hormonal para el cáncer de próstata.
Los efectos secundarios que produce la terapia hormonal para el cáncer de próstata en el funcionamiento sexual son muy difíciles de tratar. Los medicamentos para la disfunción eréctil, como el sildenafilo (Viagra), no suelen funcionar para quienes reciben terapia hormonal porque estos medicamentos no tratan la disminución de la libido (el deseo sexual) que se relaciona con la falta de andrógenos.
Para obtener más información sobre este tipo de efectos secundarios del tratamiento del cáncer, consulte Problemas de salud sexual en hombres con cáncer.
La mayoría de los efectos secundarios sexuales y emocionales por las concentraciones bajas de andrógenos suelen desaparecer con el tiempo al dejar la terapia hormonal. Sin embargo, sobre todo en el caso de las personas mayores o que recibieron TPA por mucho tiempo, es probable que las concentraciones de testosterona nunca vuelvan a ser las de antes y que los efectos secundarios no desaparezcan por completo. Algunos de los cambios físicos que ocurren con el tiempo, como la pérdida de masa ósea, no desaparecerán aunque termine la terapia hormonal.
Los pacientes se deben asegurar de mencionar al médico todos los medicamentos y los complementos que tomen, incluso las medicinas herbarias de venta libre. Algunas medicinas herbarias interactúan con enzimas que metabolizan medicamentos en el cuerpo, que podrían hacer que la terapia hormonal no funcione bien (19).