Detección del cáncer de cuello uterino
La detección sistemática es la búsqueda de una enfermedad antes de que se presenten síntomas. La detección del cáncer de cuello uterino es importante en la atención médica de rutina de las personas que tienen cuello uterino.
¿Qué son los exámenes de detección del cáncer de cuello uterino?
Los exámenes de detección son pruebas que se hacen con el objetivo de encontrar cambios precancerosos en las células del cuello uterino, cuando todavía es posible prevenir la formación de cáncer con el tratamiento. A veces, se encuentra cáncer durante un examen de detección para el cáncer de cuello uterino. Por lo general, es más fácil tratar un cáncer de cuello uterino que se encuentra en un estadio (etapa) temprano. Cuando aparecen los síntomas, es posible que el cáncer de cuello uterino haya empezado a diseminarse. Esto hace que el tratamiento sea más difícil.
Los tres exámenes principales para detectar el cáncer de cuello uterino son los siguientes:
- Prueba del virus del papiloma humano (VPH). Esta prueba examina las células para encontrar infecciones por los tipos de VPH de riesgo alto que a veces causan cáncer de cuello uterino.
- Prueba de Papanicolaou (Pap). En esta prueba se obtienen células del cuello uterino para ver si hay cambios causados por el VPH. Si no se administra tratamiento, los cambios pueden originar cáncer de cuello del útero. Esta prueba también se llama frotis de Pap, o citología cervical, vaginal o cervicovaginal. Con este examen es posible encontrar células precancerosas y células cancerosas en el cuello uterino. A veces se encuentran afecciones que no son cancerosas, como una infección o una inflamación.
- Prueba conjunta de Pap y del VPH. Este examen es una combinación de las dos pruebas para detectar los tipos de VPH de riesgo alto y los cambios en las células del cuello uterino.
¿Cuándo hacer los exámenes de detección para el cáncer de cuello uterino?
Varias organizaciones elaboran recomendaciones para la detección del cáncer de cuello uterino. Para obtener información en español consulte la Sociedad Americana contra el Cáncer (ACS), además, de la información en inglés de la United States Preventive Services Task Force (USPSTF; Comisión de Servicios Preventivos de los Estados Unidos). La frecuencia y el tipo de exámenes de detección para el cáncer de cuello uterino dependen de su edad y sus antecedentes médicos. La vacuna contra el VPH no previene la infección por todos los tipos de VPH de riesgo alto, por eso todas las personas vacunadas que tengan cuello uterino deben seguir las recomendaciones para la detección de este tipo de cáncer.
De 21 a 29 años
Si usted está en este grupo de edad, la USPSTF recomienda que la primera prueba de Pap se haga a los 21 años y, a partir de ese momento, cada 3 años. No necesita una prueba de Pap antes de los 21 años de edad así haya comenzado a tener relaciones sexuales.
De 30 a 65 años
Si usted está en este grupo de edad, la USPSTF recomienda que la detección del cáncer de cuello uterino se haga mediante uno de los siguientes métodos:
- Prueba del VPH cada 5 años.
- Prueba conjunta de Pap y del VPH cada 5 años.
- Prueba de Pap cada 3 años.
En las pautas actualizadas para el cáncer de cuello uterino de la ACS se recomienda comenzar los exámenes de detección a partir de los 25 años con una prueba del VPH y repetir esta prueba cada 5 años hasta los 65 años. Sin embargo, todavía es aceptable hacer una prueba conjunta de Pap y del VPH cada 5 años o una prueba de Pap cada 3 años. Para obtener más información sobre el motivo de estos cambios en las pautas, consulte Explicación de las recomendaciones de la Sociedad Americana contra el Cáncer sobre los exámenes de detección del cáncer de cuello uterino.
Mayores de 65 años
Si usted está en este grupo de edad, consulte con su proveedor de atención de la salud para saber si todavía es necesario hacer estos exámenes. Es probable que le recomiende no seguir haciendo los exámenes de detección con regularidad si los resultados han sido normales. Pero si los resultados recientes fueron anormales o si usted no se hace exámenes con regularidad, tal vez necesite continuar con la detección después de los 65 años.
Excepciones de las recomendaciones para la detección del cáncer de cuello uterino
Es posible que el equipo de atención de la salud le recomiende exámenes de detección más frecuentes en los siguientes casos:
- Es positivo para la infección por el virus de la inmunodeficiencia humana (VIH).
- Tiene un sistema inmunitario debilitado.
- Tuvo exposición, antes de nacer, a un medicamento que se llama dietilestilbestrol (DES), que se recetó a algunas mujeres embarazadas a mediados de los años setenta.
- Tuvo un resultado anormal reciente en una prueba de detección o en una biopsia para el cáncer de cuello uterino.
- Tuvo cáncer de cuello uterino.
No es necesario hacer exámenes de detección para el cáncer de cuello uterino si mediante una cirugía llamada histerectomía total, le extirparon (sacaron) el útero y el cuello uterino por motivos diferentes a un cáncer o células anormales en esta área. Pero si la histerectomía se hizo por un cáncer de cuello uterino o células precancerosas, pida una consulta médica para saber qué seguimiento necesita. En el caso de que se le haya extirpado el útero, pero no el cuello del útero (mediante histerectomía parcial, supracervical, subtotal o simple), debe continuar con los exámenes de detección habituales para el cáncer de cuello uterino.
¿Dónde hacer los exámenes de detección para el cáncer de cuello uterino?
La prueba del VPH y la de Pap se hacen en consultorios médicos, clínicas y centros de salud comunitarios. Muchas personas se someten a estas pruebas en los servicios de obstetricia y ginecología o en los servicios médicos de atención primaria.
Si usted no asiste de manera regular a un consultorio de atención primaria específico, las siguientes organizaciones brindan información sobre clínicas cerca de su casa que ofrecen los exámenes de detección para el cáncer de cuello uterino:
- Departamento de salud local o estatal.
- Portal de Internet en inglés National Breast and Cervical Cancer Early Detection Program (NBCCEDP; Programa Nacional de Detección Temprana del Cáncer de Mama y de Cuello Uterino), teléfono: 1-800-232-4636. Este programa ofrece servicios de detección y diagnóstico de cáncer de cuello uterino a personas con ingresos bajos, sin seguro o sin acceso a servicios de salud adecuados.
- Centro de salud de Planned Parenthood; teléfono: 1-800-230-7526.
- Servicio de Información de Cáncer del Instituto Nacional del Cáncer, teléfono: 1-800-422-6237.
El laboratorio suele tener listos los resultados de los exámenes de detección del cáncer de cuello uterino en alrededor de 1 a 3 semanas. Si el equipo de atención de la salud no le ha comunicado los resultados, llame y pida esta información. Asegúrese de entender si necesita algún seguimiento o pruebas.
¿Qué pasa durante los exámenes de detección del cáncer de cuello uterino?
Los exámenes de detección del cáncer de cuello uterino se suelen hacer durante un examen pélvico, que solo demora unos minutos. Durante este examen, se acostará en una camilla, con las rodillas dobladas y los pies apoyados en unos soportes. El proveedor de atención de la salud colocará un espéculo en la vagina para abrirla con delicadeza y observar el cuello del útero. Con un cepillo suave y angosto o una espátula diminuta, tomará una muestra pequeña de células del cuello uterino. Es posible que durante su cita, tenga la opción de recolectar la muestra cervical usted misma. Si está interesada en hacer esto, consulte con su proveedor de atención de la salud para obtener más información.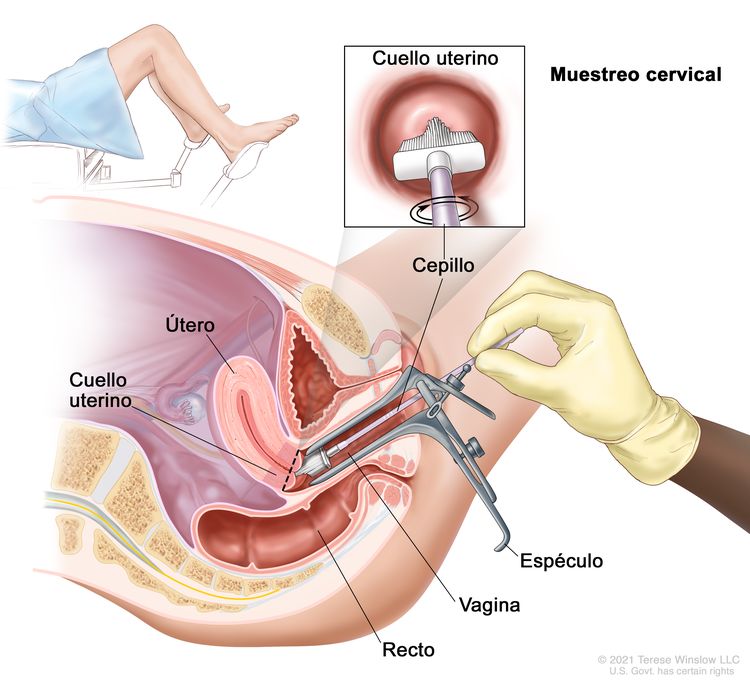
La muestra se envía al laboratorio y se hace una prueba del VPH, es decir se examinan las células para determinar si están infectadas por los tipos de VPH que causan cáncer. Es posible usar la misma muestra para hacer una prueba de Pap y verificar si hay células anormales. Cuando se hace la prueba del VPH y la prueba de Pap en una misma muestra, se llama prueba conjunta de Pap y del VPH.
En ocasiones un examen pélvico incluye otros pasos además de tomar muestras para las pruebas del VPH y de Pap. Por ejemplo, el proveedor de atención de la salud tal vez examine el tamaño, la forma y la posición del útero y los ovarios. Además, es posible que palpe alrededor de esta área para encontrar bultos o quistes. A veces también revisa el recto para comprobar si hay bultos o áreas anormales. Consulte al equipo de atención de la salud si necesita información sobre las pruebas para detectar infecciones de transmisión sexual.
La mayoría de proveedores de atención de la salud explican lo que se espera en cada paso del examen para brindarle una sensación de tranquilidad.
En investigaciones, se encontró que los exámenes de detección del cáncer de cuello uterino en ocasiones son menos eficaces en las personas con obesidad, tal vez porque en estas personas es más difícil observar el cuello del útero y obtener muestras de células. Los métodos para mejorar la observación del cuello uterino, como el uso de un espéculo más grande, son útiles.
¿Los exámenes de detección del cáncer de cuello uterino tienen algún riesgo?
Los exámenes de detección del cáncer de cuello uterino salvan vidas. Muy pocas personas que se han hecho exámenes de detección de rutina presentan cáncer de cuello uterino. Estos exámenes ayudan a detectar temprano los cambios en el cuello del útero, lo que reduce la posibilidad de una persona de morir por esta enfermedad. Pese a estos beneficios, los exámenes de detección no son perfectos y hay que tener en cuenta varios perjuicios posibles. Antes de someterse a la detección tal vez quiera consultarlo con el médico.
Algunos riesgos de los exámenes de detección para el cáncer de cuello uterino son los siguientes:
- Pruebas de seguimiento y tratamientos innecesarios. Mediante los exámenes de detección a veces se encuentran afecciones que quizás nunca ocasionarían problemas, pero que resultan en pruebas de seguimiento y tratamientos innecesarios. Las recomendaciones actuales para las pruebas de detección y los intervalos entre estas pruebas reducen la probabilidad de encontrar y tratar anomalías en las células del cuello uterino que habrían desaparecido por sí solas.
- Resultados positivos falsos. Los resultados de los exámenes de detección a veces son anormales, aunque no hayan cambios precancerosos ni cáncer. Cuando en una prueba de Pap se obtiene un resultado positivo falso (que muestra que hay cambios precancerosos o un cáncer cuando no los hay) es posible que cause ansiedad y por lo general se realizan más pruebas y procedimientos (como colposcopia, crioterapia o procedimiento de escisión electroquirúrgica con asa), que también pueden ocasionar perjuicios.
- Resultados negativos falsos. Los resultados de los exámenes de detección a veces son normales, aunque hayan cambios precancerosos o cáncer. Una persona que recibe un resultado negativo falso (que muestra que no hay cáncer cuando sí lo hay) tal vez tarde en buscar atención médica aunque tenga síntomas.
Para obtener información sobre la detección del cáncer de cuello uterino, consulte el folleto en inglés Understanding Cervical Changes: A Health Guide (Guía de la salud para entender los cambios que causa el cáncer en el cuello uterino).