Trasplante alogénico de células madre hematopoyéticas en pediatría (PDQ®)–Versión para profesionales de salud
Mejora de los resultados de los trasplantes alogénicos de células madre hematopoyéticas
Durante los últimos 20 años se produjeron adelantos importantes que condujeron a mejores desenlaces de las personas que reciben trasplantes de células madre hematopoyéticas (TCMH) de tipo alogénicos, también llamados alotrasplantes.[1-3] Las mejoras más importantes para la supervivencia se presentaron en procedimientos con donantes no emparentados y alternativos.[4-6] Algunas explicaciones posibles de estas mejoras en la supervivencia incluyen una selección de pacientes más precisa, mejores cuidados médicos de apoyo, regímenes de tratamiento perfeccionados, la optimización de los abordajes específicos para cada fuente de células madre y una mejor tipificación de los antígenos leucocitarios humanos (HLA). Las secciones que siguen se centran en los aspectos del TCMH que se pueden modificar, como el perfeccionamiento de la tipificación de HLA y de la selección de las fuentes de células madre.
Bibliografía
- Hahn T, McCarthy PL, Hassebroek A, et al.: Significant improvement in survival after allogeneic hematopoietic cell transplantation during a period of significantly increased use, older recipient age, and use of unrelated donors. J Clin Oncol 31 (19): 2437-49, 2013. [PUBMED Abstract]
- Horan JT, Logan BR, Agovi-Johnson MA, et al.: Reducing the risk for transplantation-related mortality after allogeneic hematopoietic cell transplantation: how much progress has been made? J Clin Oncol 29 (7): 805-13, 2011. [PUBMED Abstract]
- Wood WA, Lee SJ, Brazauskas R, et al.: Survival improvements in adolescents and young adults after myeloablative allogeneic transplantation for acute lymphoblastic leukemia. Biol Blood Marrow Transplant 20 (6): 829-36, 2014. [PUBMED Abstract]
- MacMillan ML, Davies SM, Nelson GO, et al.: Twenty years of unrelated donor bone marrow transplantation for pediatric acute leukemia facilitated by the National Marrow Donor Program. Biol Blood Marrow Transplant 14 (9 Suppl): 16-22, 2008. [PUBMED Abstract]
- Harvey J, Green A, Cornish J, et al.: Improved survival in matched unrelated donor transplant for childhood ALL since the introduction of high-resolution matching at HLA class I and II. Bone Marrow Transplant 47 (10): 1294-300, 2012. [PUBMED Abstract]
- Majhail NS, Chitphakdithai P, Logan B, et al.: Significant improvement in survival after unrelated donor hematopoietic cell transplantation in the recent era. Biol Blood Marrow Transplant 21 (1): 142-50, 2015. [PUBMED Abstract]
Indicaciones del trasplante alogénico de células madre hematopoyéticas para las neoplasias malignas hematológicas
Las indicaciones de trasplante de células madre hematopoyéticas (TCMH) varían con el tiempo a medida que las clasificaciones de riesgo para una determinada neoplasia maligna van cambiando y la eficacia de los tratamientos primarios mejora. Es mejor incluir indicaciones específicas en el contexto del tratamiento completo para una determinada enfermedad. Teniendo en cuenta esto, a continuación se proporcionan enlaces a secciones en resúmenes donde se tratan las indicaciones más comunes para el TCMH alogénico en pediatría.
-
Leucemia linfoblástica aguda (LLA).
- Para obtener más información, consultar la sección Tratamiento de la leucemia linfoblástica aguda infantil en recaída en Tratamiento de la leucemia linfoblástica aguda infantil.
-
Leucemia mieloide aguda (LMA).
- Para obtener más información, consultar la sección Tratamiento de la leucemia mieloide aguda infantil en Tratamiento de la leucemia mieloide aguda infantil.
-
Neoplasias mielodisplásicas (SMD).
- Para obtener más información, consultar la sección Tratamiento de las neoplasias mielodisplásicas infantiles en Tratamiento de las neoplasias mielodisplásicas infantiles.
-
Leucemia mielomonocítica juvenil (LMMJ).
- Para obtener más información, consultar la sección Tratamiento de la leucemia mielomonocítica juvenil en Tratamiento de la leucemia mielomonocítica juvenil.
-
Leucemia mieloide crónica (LMC).
- Para obtener más información, consultar la sección Tratamiento de la leucemia mieloide crónica infantil recidivante o resistente al tratamiento en Tratamiento de la leucemia mieloide crónica infantil.
Compatibilidad de los antígenos leucocitarios humanos y fuentes de células madre hematopoyéticas
Aspectos generales de los antígenos leucocitarios humanos
Para que el trasplante de células madre hematopoyéticas (TCMH) alogénico sea exitoso, es esencial que entre el donante y el receptor haya compatibilidad apropiada de los antígenos leucocitarios humanos (HLA) del complejo principal de histocompatibilidad ubicado en el cromosoma 6 (consultar la Figura 1, el Cuadro 1 y el Cuadro 2).
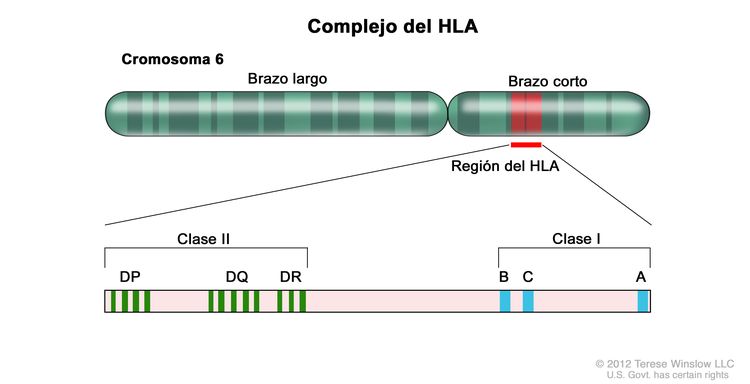
Los alelos de HLA de clase I (A, B, C, etc.) y clase II (DRB1, DRB3, DRB4, DRB5, DQB1, DPB1, etc.) son muy polimorfos; por consiguiente, encontrar donantes no emparentados con compatibilidad apropiada es una tarea difícil para algunos pacientes, en especial, de ciertos grupos raciales (por ejemplo, pacientes de ascendencia africana, hispana, asiática o de las islas del pacífico).[1,2] Los hermanos carnales de ambos sexos de pacientes con cáncer tienen una probabilidad del 25 % de presentar compatibilidad de HLA.
Los primeros métodos serológicos de evaluación de HLA definieron varios tipos de antígenos de HLA, pero luego las metodologías más precisas de análisis de DNA indicaron que hay incompatibilidades a nivel de los alelos de HLA hasta en el 40 % de quienes presentaban compatibilidad serológica de los antígenos de HLA. Estas diferencias tienen repercusiones clínicas porque el uso de donantes con incompatibilidades alélicas afecta la supervivencia y las tasas de enfermedad de injerto contra huésped (EICH) en un grado similar a las de incompatibilidades de antígenos.[3] Debido a esto, la tipificación de alelos de HLA a partir de DNA es estándar cuando se eligen donantes no emparentados.
El National Marrow Donor Program publicó directrices para evaluar la compatibilidad de HLA. En estas directrices se usa el término dominio de reconocimiento de antígeno para la compatibilidad alélica, que se refiere al hecho de que las similitudes alélicas usadas para definir el tipo específico de HLA están relacionadas con áreas cuya función es el reconocimiento de antígenos. Los polimorfismos de las proteínas HLA fuera de estas áreas no afectan la actividad de estas moléculas; por lo tanto, muchas veces no se evalúan como parte de las pruebas de HLA y es probable que no contribuyan a la incompatibilidad.[4]
| Antígenos de clase I | Antígenos de clase II | |||||
|---|---|---|---|---|---|---|
| MO = médula ósea, NA = no aplica, CMSP = células madre de sangre periférica. | ||||||
| aAntígeno de HLA: método serológico de baja resolución para definir una proteína de HLA. El resultado difiere de la tipificación alélica al menos el 40 % de las veces. Se designa con los 2 primeros números (es decir, para HLA B 35:01; el antígeno es HLA B 35). | ||||||
| bAlelo de HLA: método de resolución más alta para definir proteínas de HLA únicas mediante la tipificación de su gen por medio de secuenciación o de otros métodos que analizan el DNA para detectar diferencias específicas. Se designa por lo menos con 4 números (es decir, para HLA B 35:01; 35 es el antígeno y 01 es el alelo). | ||||||
| cLa Blood and Marrow Transplant Clinical Trials Network con el patrocinio del Instituto Nacional del Cáncer y el Instituto Nacional del Corazón, los Pulmones y la Sangre, publicó recomendaciones de consenso para la tipificación de HLA, incluso la tipificación de clase II ampliada para donantes incompatibles.[5] | ||||||
| dEs necesario confirmar la compatibilidad plena de los haplotipos entre hermanos de ambos sexos para corroborar la ausencia de cruces en la región desde A hasta DRB1. Si se hace una tipificación parental y se establecen sus haplotipos, es adecuada la tipificación a nivel de los antígenos de clase l. Cuando no se cuenta con los haplotipos parentales, se recomienda tipificar 8 alelos. | ||||||
| ePadre o madre, primo o prima, etc., con un fenotipo compatible o una compatibilidad de HLA casi perfecta. | ||||||
| Fuente de células madre | HLA A | HLA B | HLA C | HLA DRB1 | HLA DQB1; HLA DPB1; HLA DRB3,4,5 | |
| MO o CMSP de un hermano compatible de cualquier sexod | Antígeno o alelo | Antígeno o alelo | Opcional | Alelo | NA | |
| MO o CMSP de un hermano incompatible u otro donante emparentado de cualquier sexoe | Alelo | Alelo | Alelo | Alelo | Recomendado | |
| MO o CMSP de donante no emparentado | Alelo | Alelo | Alelo | Alelo | Recomendado | |
| Sangre de cordón umbilical de donante no emparentado | Antígeno (se recomienda de alelo) | Antígeno (se recomienda de alelo) | Se recomienda de alelo | Alelo | NA | |
| Si los siguientes antígenos y alelos de HLA son compatibles | Entonces se considera que el donante tiene el siguiente tipo de compatibilidad: |
|---|---|
| A, B y DRB1 | 6/6 |
| A, B, C y DRB1 | 8/8 |
| A, B, C, DRB1 y DQB1 | 10/10 |
| A, B, C, DRB1, DQB1 y DPB1 | 12/12 |
Consideraciones sobre la compatibilidad de los antígenos leucocitarios humanos de hermanos y donantes emparentados de ambos sexos
El donante emparentado que más se utiliza es un hermano carnal de cualquier sexo, es decir que comparte ambos progenitores y que tenga como mínimo una compatibilidad de HLA A, HLA B y HLA DRB1 en la evaluación de HLA a nivel de antígenos. Dada la distancia entre HLA A y HLA DRB1 en el cromosoma 6, hay una posibilidad de casi el 1 % de que se presente un episodio cruzado en un hermano compatible de cualquier sexo. Debido a que un episodio cruzado podría incluir el antígeno HLA C y dado que es posible que los progenitores compartan antígenos de HLA que en realidad difieren a nivel de alelos, muchos centros realizan la tipificación alélica de todos los antígenos de HLA clave (HLA A, B, C y DRB1) en los hermanos de ambos sexos con posibilidad de ser donantes. Cualquier donante emparentado que no sea un hermano carnal de cualquier sexo se debe someter a tipificación completa de HLA porque haplotipos similares que provienen de distintos progenitores podrían diferir a nivel de alelos.
Aunque en algunos estudios se usaron de manera indistinta donantes emparentados de cualquier sexo con un solo antígeno incompatible (compatibilidad antigénica 5/6) y hermanos de cualquier sexo compatibles, en un estudio numeroso del Center for International Blood and Marrow Transplant Research (CIBMTR) de receptores de TCMH en el ámbito pediátrico, se observó que el uso de donantes emparentados con compatibilidad antigénica 5/6 produjo tasas de EICH y supervivencia general (SG) equivalentes a las de donantes no emparentados con compatibilidad alélica 8/8, así como una supervivencia un poco inferior a la que se logró con hermanos de cualquier sexo completamente compatibles.[6] Todos los hermanos de cualquier sexo con incompatibilidades simples se deberá someter a una tipificación extensa para comprobar que si la incompatibilidad obedece a un cruce y solo se presenta con un antígeno. Si el equipo médico selecciona a hermanos de cualquier sexo con incompatibilidades múltiples como donantes, es posible que se justifique un abordaje haploidéntico.
Consideraciones sobre la compatibilidad de los antígenos leucocitarios humanos de donantes no emparentados
Se logran resultados óptimos con el trasplante alogénico de médula ósea de donantes no emparentados cuando se establece la compatibilidad a nivel de los alelos de los pares de antígenos HLA A, B, C y DRB1 (llamada compatibilidad 8/8) entre donante y receptor (consultar el Cuadro 2).[7] Una incompatibilidad de un solo antígeno o alelo en cualquiera de estos antígenos (compatibilidad 7/8) disminuye la probabilidad de supervivencia entre el 5 % y el 10 %; se produce un aumento similar en la cantidad de EICH aguda grave (grados III–IV).[7] De estos 4 pares de antígenos, en diferentes informes se observó que quizás las incompatibilidades de HLA A, C y DRB1 estén mucho más relacionadas con la mortalidad que las incompatibilidades de otros antígenos;[3,7,8] pero como las diferencias en el resultado son pequeñas e incongruentes, es difícil determinar cuál es la incompatibilidad más favorable entre distintos tipos de incompatibilidades de antígeno. Muchos grupos de investigación están intentando identificar antígenos o pares específicos de antígenos que se relacionan con resultados buenos o precarios. Por ejemplo, una incompatibilidad específica de HLA C (HLA-C*03:03/03:04) produce desenlaces similares a una compatibilidad del mismo tipo; por lo tanto, es aconsejable elegir esta incompatibilidad en una pareja de paciente y donante que, por lo demás, es compatible.[9]
Se sabe bien que las incompatibilidades en el antígeno DRB1 de clase II aumentan la incidencia de EICH y empeoran la supervivencia.[8] En datos posteriores también se observó que las incompatibilidades múltiples de DQB1, DPB1 y DRB3,4,5 conducen a desenlaces más precarios en el entorno de compatibilidades inferiores a 8/8.[10] Se estudiaron a fondo las incompatibilidades de DPB1 y se clasificaron como permisibles o no permisibles de acuerdo con la compatibilidad de epítopos de célula T. Los pacientes con compatibilidad 10/10 que tienen incompatibilidades no permisibles de DPB1 presentan más mortalidad relacionada con el trasplante, pero tienen tasas de supervivencia similares a las de los pacientes con compatibilidades de DPB1 o compatibilidades permisibles. Aquellos con compatibilidades 9/10 que presentan incompatibilidades de DPB1 no permisibles tienen una supervivencia más precaria que los pacientes con incompatibilidades permisibles o compatibilidades de DPB1.[11-13]
A partir de estos hallazgos, aunque se pueda usar de modo rutinario un donante no emparentado con compatibilidad 7/8 u 8/8, es posible que los centros mejoren aún más los desenlaces mediante las siguientes técnicas:
- Tipificación de antígenos extendida de DQB1, DPB1 y DRB3,4,5.[4,11-13]
- Extensión de las pruebas de HLA para la selección de donantes adecuados en el contexto de pacientes sensibilizados a HLA para evitar el riesgo de fracaso del injerto.[14,15] La sensibilización a HLA se detecta mediante pruebas que indican la presencia de anticuerpos específicos contra HLA, y se debe evitar el uso de donantes que tengan cualquier antígeno de HLA para el que se encuentren anticuerpos en el receptor.
- Uso de donantes más jóvenes.[5]
- Emparejamiento de receptores y donantes con pruebas positivas para citomegalovirus (CMV), y emparejamiento de receptores y donantes con pruebas negativas para CMV.[16]
- Uso de donantes no emparentados con tipos de sangre compatibles.[5]
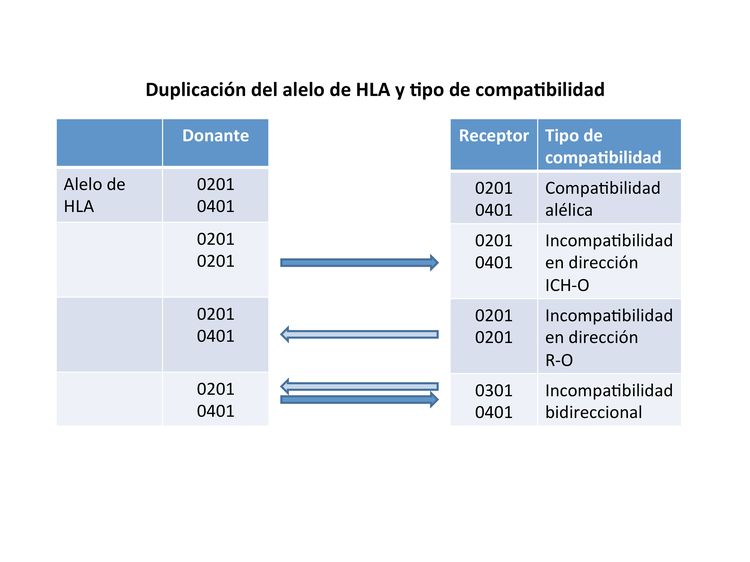
Si un donante o un receptor tienen una duplicación de uno de los alelos de HLA, presentarán una compatibilidad parcial y una incompatibilidad en una sola dirección. En la Figura 2 se ilustra que estas incompatibilidades se producirán en una dirección que favorece la EICH (ICH-O) o en una dirección que favorece el rechazo (R-O). Cuando se comparan donantes no emparentados con compatibilidad 8/8 y donantes con compatibilidad 7/8 en dirección ICH-O, 7/8 en dirección R-O o 7/8 en ambas direcciones, se encuentra que la incompatibilidad en dirección R-O conduce a tasas de EICH de grado III y IV similares a las tasas de la compatibilidad 8/8 y mejores que las de las otras dos combinaciones. Se prefiere la incompatibilidad 7/8 solo en dirección R-O a las incompatibilidades en dirección ICH-O o a aquellas incompatibilidades bidireccionales.[17] Es importante señalar que esta observación en donantes no emparentados difiere de las observaciones en receptores de sangre de cordón umbilical descritas a continuación.
Consideraciones sobre la compatibilidad de los antígenos leucocitarios humanos y la dosis de células para un trasplante con sangre de cordón umbilical de donante no emparentado
Otra fuente de células madre hematopoyéticas que por lo general se usa es la sangre de cordón umbilical de donantes no emparentados, que se extrae, inmediatamente después del parto, de placentas donadas. La sangre de cordón umbilical se procesa, se somete a tipificación de HLA, se criopreserva y almacena.
El trasplante de sangre de cordón umbilical de un donante no emparentado ha tenido éxito incluso con requisitos de compatibilidad de HLA menos estrictos en comparación con los trasplantes de donantes emparentados o no emparentados estándar; es probable que esto se deba a la limitada exposición antigénica en el útero y la diferencia en la composición inmunitaria. La compatibilidad de la sangre de cordón umbilical se ha realizado tradicionalmente en un nivel intermedio para HLA A y B, y a nivel de alelos (resolución alta) para DRB1. Esto significa que, hasta hace poco, se evaluaba la compatibilidad de solo 6 antígenos para elegir las unidades del trasplante.
SI bien se obtienen mejores desenlaces cuando se usan unidades con compatibilidad de HLA 6/6 o 5/6,[18] se lograron TCMH exitosos en muchos pacientes incluso cuando se usaron unidades con compatibilidad 4/6 o más bajas. En un estudio numeroso de CIBMTR/Eurocord, una mejor compatibilidad a nivel alélico de 8 antígenos (compatibilidad de HLA A, B, C y DRB1) produjo menos mortalidad relacionada con el trasplante y mejor supervivencia. El desenlace más favorable se observó con una compatibilidad alélica 8/8 versus compatibilidades 4/8 a 7/8, y se encontró una supervivencia precaria en los pacientes con incompatibilidades de 5 o más alelos. Los pacientes que recibieron sangre de cordón umbilical con compatibilidad 8/8 no necesitaron dosis más altas de células para lograr mejores desenlaces. Sin embargo, aquellos con incompatibilidades de 1 a 3 alelos presentaron menor mortalidad relacionada con el trasplante cuando recibieron recuentos totales de células nucleadas superiores a 3 × 107/kg, y aquellos con incompatibilidades de 4 alelos necesitaron recuentos totales de células nucleadas superiores a 5 × 107/kg para disminuir la mortalidad relacionada con el trasplante.[19] Se señaló que esta observación es especialmente importante en el caso de un trasplante de sangre de cordón umbilical para afecciones que no son malignas, donde cualquier incompatibilidad inferior a 7/8 alelos condujo a una supervivencia inferior.[20] En muchos centros se tipifican alelos adicionales y se usa la mejor compatibilidad posible, pero el efecto de las incompatibilidades de DQB1, DPB1 y DR3,4,5 no se ha estudiado en detalle.
Cuando se usan donantes no emparentados de células madre de sangre periférica (CMSP) o de médula ósea, la extensión de las pruebas de HLA permite establecer una selección adecuada de unidades de sangre de cordón umbilical en pacientes sensibilizados al HLA para evitar el riesgo de fracaso del injerto.[21,22] La evidencia también indica que la selección de una unidad incompatible de sangre de cordón umbilical, cuando la incompatibilidad incluye un antígeno materno no hereditario, a veces mejora la supervivencia.[23,24]
Al igual que los donantes no emparentados, algunas personas tienen duplicación de antígenos HLA (por ejemplo, el antígeno HLA A es 01 en ambos cromosomas). Cuando esto sucede en el producto de un donante y el antígeno es compatible con uno de los antígenos del receptor, la respuesta inmunitaria del receptor considerará los antígenos del donante como compatibles (compatibles, en la dirección de rechazo), pero la respuesta inmunitaria del donante considerará que hay incompatibilidad con el receptor (incompatibilidad en dirección de la EICH). Se observó que esta variación de incompatibilidad parcial es importante en los desenlaces del trasplante de sangre de cordón umbilical. Las incompatibilidades que se presentan solo en dirección EICH (es decir, ICH-O) producen menor mortalidad relacionada con el trasplante y mortalidad general que las incompatibilidades solo en dirección al rechazo (es decir, R-O).[25] Las incompatibilidades R-O conducen a desenlaces similares a las incompatibilidades bidireccionales.[26] Aunque en estos estudios se indica que es posible que sea beneficioso el uso de incompatibilidad unidireccional como criterio para seleccionar la sangre de cordón umbilical, en un análisis de la Eurocord-European Society for Blood and Marrow Transplantation (EBMT) se cuestiona el valor de este tipo de incompatibilidad.[27]
Hay dos aspectos del TCMH con sangre de cordón umbilical que hicieron posible una aplicación mucho más generalizada. En primer lugar, dado que un procedimiento puede ser exitoso con múltiples incompatibilidades de HLA, más de 95 % de los pacientes de una amplia gama de grupos étnicos logran encontrar al menos una unidad de sangre de cordón umbilical con compatibilidad 4/6.[1,28] En segundo lugar, tal como se mencionó antes, se demostró que la dosis adecuada de células (como mínimo, recuento total de células nucleadas de 2–3 × 107 /kg y recuento de células CD34+ de 1,7 × 105 /kg) se relaciona con mejor supervivencia.[29,30] Por lo general, se usa el recuento total de células nucleadas para evaluar las unidades porque no se han estandarizado las técnicas para medir las dosis de células positivas para CD34 (CD34+). Los primeros TCMH de sangre de cordón umbilical se hicieron en pacientes pequeños porque incluso las unidades grandes de sangre de cordón umbilical solo pueden proporcionar las dosis mínimas a los receptores que pesan hasta 40 kg o 50 kg. En estudios posteriores se demostró que las barreras por tamaño se podían superar usando 2 unidades de cordón umbilical, siempre y cuando ambas unidades exhiban al menos una compatibilidad HLA de 4/6 con el receptor. Actualmente, el trasplante de sangre de cordón umbilical se usa mucho para personas más grandes y en edad adulta debido a que 2 unidades de sangre de cordón umbilical proporcionan dosis más altas de células.[31]
Si una sola unidad proporciona una dosis adecuada de células, agregar una segunda unidad podría presentar desventajas.[32][Nivel de evidencia A1] En dos ensayos aleatorizados se observó que, en los niños que reciben unidades individuales de tamaño adecuado, la adición de una segunda unidad no alteró las tasas de recaída, la mortalidad relacionada con el trasplante ni la supervivencia, pero esto sí se vinculó con tasas más altas de EICH crónica grave.[32,33]
Los investigadores han demostrado que el uso de combinaciones de citocinas y otros compuestos para expandir la sangre de cordón umbilical por un período de tiempo antes de la infusión acelera la incorporación del injerto de las células de cordón umbilical en comparación con el abordaje estándar.[34-37] Si bien en algunos estudios, en los que se utilizaron múltiples unidades o unidades divididas, se demostró que la incorporación del injerto de las unidades expandidas se acelera, lo que luego da paso al uso de unidades no expandidas para la reconstitución a largo plazo,[38] en otros estudios se observó la persistencia de las células expandidas, lo que implica que las células madre se conservan durante el proceso de expansión.[36,37] Algunos de estos abordajes están en investigación. No se ha establecido la eficacia terapéutica, ni la repercusión en la supervivencia, de la sangre de cordón umbilical como fuente de células madre en el entorno pediátrico, de manera que la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) no ha autorizado el uso de ninguno de estos abordajes.
Trasplante de células madre hematopoyéticas haploidénticas
En los primeros estudios de trasplante de células madre hematopoyéticas (TCMH), se observaron porcentajes cada vez más altos de pacientes con EICH grave y tasas de supervivencia más baja a medida que aumentaron las incompatibilidades de HLA entre donantes y receptores.[39] En otros estudios se observó que, incluso con números muy altos de donantes no emparentados en los registros, los pacientes con haplotipos de HLA poco frecuentes y los pacientes de ciertos orígenes étnicos (por ejemplo, pacientes de ascendencia africana, hispana, asiática o de las islas del Pacífico) tienen una probabilidad baja de lograr los grados deseados de compatibilidad de HLA (compatibilidad alélica 7/8 u 8/8).[2]
Para permitir el acceso al TCMH de los pacientes sin opciones de encontrar un donante con plena compatibilidad de HLA, los investigadores formularon técnicas que permiten el uso de hermanos, progenitores u otros familiares de cualquier sexo que comparten con el paciente un solo haplotipo del complejo de HLA y tienen, por lo tanto, compatibilidad parcial. La mayoría de los abordajes formulados hasta la fecha dependen de la reducción intensiva de células T del producto antes de la infusión en el paciente. El desafío principal relacionado con este abordaje es la inmunodepresión intensa con recuperación inmunitaria diferida que puede resultar en infecciones mortales,[40] aumento de riesgo del trastorno linfoproliferativo relacionado con el virus de Epstein-Barr (VEB) y tasas altas de recaída.[41] Esto condujo a una supervivencia inferior en comparación con los TCMH de donante compatible que se hicieron en el pasado, y es por eso que el procedimiento solo se lleva a cabo en centros académicos más grandes que se dedican a investigar y perfeccionar este abordaje.
Sin embargo, los abordajes actuales están evolucionando rápido y conducen a mejores desenlaces: algunos grupos pediátricos notifican una supervivencia similar a la de los abordajes estándar.[42-45] Estos abordajes son los siguientes:
- Técnicas más nuevas para reducir la concentración de células T y añadir poblaciones celulares específicas (por ejemplo, selección negativa de CD3 o CD3/CD19 α-β) han disminuido la mortalidad relacionada con el trasplante.[46]; [44,45,47,48][Nivel de evidencia C2]
- Regímenes de toxicidad reducida que condujeron a una mejora de la supervivencia.
- Mejora de los cuidados médicos de apoyo que redujeron la probabilidad de morbilidad por infecciones o trastorno linfoproliferativo relacionado con el VEB.[49]
- Algunas combinaciones de pacientes y donantes que tienen incompatibilidades específicas de receptor inmunoglobulínico del linfocito citolítico natural mostraron una disminución de la probabilidad de recaída. Para obtener más información, consultar la sección Función de la incompatibilidad del receptor inmunoglobulínico del linfocito citolítico natural en el trasplante de células madre hematopoyéticas.
- Ciertas técnicas, como el uso de combinaciones de médula ósea preparada con factor estimulante de colonias de granulocitos y CMSP con reducción de células T mediante anticuerpos después del trasplante [50] o con ciclofosfamida después del TCMH (reducción quimioterapéutica de células T),[44,45,51]; [52][Nivel de evidencia C1] hicieron que estos procedimientos fueran más accesibles porque no requieren el procesamiento costoso y complicado necesario para la reducción tradicional de células T.
Con el uso de muchos tipos diferentes de abordajes haploidénticos se notifican tasas de supervivencia que oscilan entre el 25 % y el 80 %, según la técnica y el riesgo del paciente que se somete al procedimiento.[41,42,50,51]; [52][Nivel de evidencia C1En ensayos retrospectivos en adultos se observaron desenlaces similares después de trasplantes con donantes haploidénticos en comparación con trasplantes de donantes compatibles no emparentados o trasplantes de sangre de cordón umbilical.[53,54] En un ensayo prospectivo aleatorizado en adultos con neoplasias malignas hematológicas en el que se usaron regímenes de intensidad reducida se observó una supervivencia sin progresión similar, pero tasas más bajas de recaída y una mejor SG con el uso de donantes haploidénticos.[55] En ensayos pediátricos en los que se usan donantes haploidénticos se observaron mejores desenlaces con regímenes preparatorios mielosupresores y la supervivencia es comparable a la de los abordajes no haploidénticos.[44,45,48,56] En un ensayo prospectivo de pacientes pediátricos se observó que la supervivencia sin enfermedad (SSE) era superior con abordajes haploidénticos que con TCMH de donantes incompatibles no emparentados. Las tasas de SSE de los pacientes tratados con abordajes haploidénticos fueron similares a las de los pacientes que recibieron tratamiento con otras fuentes de células madre.[44]
Incluso más que con otras fuentes de células madre, los pacientes sometidos a procedimientos haploidénticos pueden producir anticuerpos anti-HLA que, si se dirigen contra antígenos haploidénticos no compartidos, quizás aumenten en forma considerable el riesgo de rechazo. Cuando sea posible, el equipo médico deberá elegir donantes con tipos de HLA contra los cuales el receptor no tiene ningún anticuerpo. Se publicaron recomendaciones para abordar mejor este problema.[57]
Comparación de productos de células madre
En la actualidad, se utilizan 3 productos de células madre, tanto de donantes emparentados como no emparentados, que son los siguientes:
- Médula ósea.
- CMSP.
- Sangre de cordón umbilical.
Es posible usar la médula ósea o las CMSP de donante emparentado, incluso con compatibilidad parcial de HLA (la mitad o más de antígenos [haploidéntico]), después de la reducción in vitro o in vivo de las células T; estos productos se comportan de modo diferente a otros productos de células madre. En el Cuadro 3, se presenta una comparación de productos de células madre.
| CMSP | MO | Sangre de cordón umbilical | MO o CMSP con reducción de células T | MO o CMSP haploidénticas con reducción de células T | |
|---|---|---|---|---|---|
| MO = médula ósea; TLP-VEB = trastorno linfoproliferativo relacionado con el virus de Epstein-Barr; EICH = enfermedad de injerto contra huésped; TCMH = trasplante de células madre hematopoyéticas; CMSP = células madre de sangre periférica. | |||||
| aSe presupone la ausencia de EICH. Si los pacientes presentan EICH, se demora la reconstitución inmunitaria hasta que se resuelva la EICH y se interrumpe el tratamiento inmunodepresor. | |||||
| bSi se utiliza un donante haploidéntico, puede pasar un período más prolongado hasta la reconstitución inmunitaria. | |||||
| Contenido de células T | Alto | Moderado | Bajo | Muy bajo | Muy bajo |
| Contenido de CD34+ | Moderado a alto | Moderado | Bajo (pero de potencia más alta) | Moderado a alto | Moderado a alto |
| Tiempo hasta la recuperación de neutrófilos | Rápido: mediana, 16 días (11–29 días) [58] | Moderado: mediana, 21 días (12–35 días) [58] | Más lento: mediana, 23 días (11–133 días) [33] | Rápido: mediana, 16 días (9–40 días) [59] | Rápido: mediana, 13 días (10–20 días) [60] |
| Riesgo de infecciones tempranas después del TCMH, TLP-VEB | Bajo a moderado | Moderado | Alto | Muy alto | Muy alto |
| Riesgo de rechazo del injerto | Bajo | Bajo a moderado | Moderado a alto | Moderado a alto | Moderado a alto |
| Tiempo hasta la reconstitución inmunitariaa | Rápido (6–12 meses) | Moderado (6–18 meses) | Lento (6–24 meses) | Lento (6–24 meses) | Lento (9–24 meses)b |
| Riesgo de EICH aguda | Moderado | Moderado | Moderado | Bajo | Bajo |
| Riesgo de EICH crónica | Alto | Moderado | Bajo | Bajo | Bajo |
Las diferencias principales entre los productos se observan en el número de células T y de células progenitoras CD34+; las CMSP tienen concentraciones muy altas de células T, la médula ósea tiene concentraciones intermedias, y la sangre de cordón umbilical y los productos con reducción de células T tienen concentraciones muy bajas de células T. En general, los pacientes que reciben productos con reducción de células T o sangre de cordón umbilical tienen una recuperación hematopoyética más lenta, mayor riesgo de infecciones, una reconstitución inmunitaria tardía, aumento del riesgo de fracaso del injerto y mayor riesgo de trastorno linfoproliferativo relacionado con el VEB. Esto contrasta con tasas más bajas de EICH y la capacidad de ofrecer un trasplante a pacientes para los que no se dispone de un donante con compatibilidad total de HLA. Las dosis más altas de células T y otras células en las CMSP producen una recuperación de neutrófilos y reconstitución inmunitaria rápidas, pero también aumentan las tasas de EICH crónica.
Hay pocos estudios en los que se comparan en forma directa los resultados de diferentes fuentes o productos de células madre en pacientes pediátricos.
Evidencia (comparación de desenlaces de fuentes o productos de células madre en la infancia):
- En un estudio retrospectivo de un registro de pacientes pediátricos sometidos a TCMH por leucemia aguda, se comparó a los pacientes que recibieron médula ósea de un donante emparentado con los que recibieron CMSP de un donante emparentado.[61]
- Aunque las cohortes de receptores de médula ósea y CMSP diferían un poco en sus perfiles de riesgo, después de la corrección estadística, se encontró que el aumento de riesgo de EICH y la mortalidad relacionada con el trasplante de CMSP produjo una supervivencia más precaria en el grupo de CMSP.
- En un estudio retrospectivo de niños japoneses con leucemia aguda, se comparó a 90 niños, de ambos sexos, que recibieron CMSP con 571 niños que recibieron médula ósea.[62]
- En el estudio se confirmó una mayor mortalidad relacionada con el trasplante debido a EICH y una supervivencia inferior en los niños que recibieron CMSP.
- En un ensayo numeroso de la Blood and Marrow Transplant Clinical Trials Network para pacientes que requerían donantes no emparentados se incluyeron algunos pacientes pediátricos. Los pacientes se asignaron de manera aleatoria a recibir médula ósea o CMSP. En este ensayo se demostró lo siguiente:[63]
- La SG fue idéntica con cualquiera de las fuentes, pero las tasas de EICH crónica fueron significativamente más altas en el grupo de CMSP, y hubo un pequeño aumento de los rechazos en el grupo de médula ósea.
- Los rechazos fueron poco frecuentes en los pacientes pediátricos.
- El número de pacientes pediátricos no fue suficiente para sacar conclusiones específicas sobre el riesgo de rechazo en niños que recibieron médula ósea.
Estos informes, junto con una falta de estudios prospectivos en los que se comparen médula ósea y CMSP, condujeron a que en la mayoría de protocolos pediátricos de trasplante se prefiera usar médula ósea en lugar de CMSP de donantes emparentados. Este abordaje también se sustenta en un metanálisis que incluyó ensayos retrospectivos adicionales.[64]
Los estudios publicados en los que se comparan la sangre de cordón umbilical y la médula ósea de donantes no emparentados fueron retrospectivos y presentaron debilidades inherentes a tales análisis.
Evidencia (comparación de los desenlaces obtenidos con sangre de cordón umbilical versus médula ósea de donantes no emparentados):
- En un estudio, se compararon pacientes pediátricos de leucemia linfoblástica aguda (LLA) sometidos a TCMH que recibieron médula ósea de donantes no emparentados con compatibilidad alélica de HLA 8/8, con pacientes que recibieron sangre de cordón umbilical de donantes no emparentados.[18]
- En el análisis se encontró que la mejor supervivencia se observó en los receptores de sangre de cordón umbilical de donantes con compatibilidad de HLA 6/6 ; la supervivencia después de recibir sangre de cordón umbilical de donantes no emparentados con compatibilidad de HLA 8/8 resultó ligeramente menor, pero fue estadísticamente idéntica a la supervivencia de los pacientes que recibieron unidades de sangre de cordón de donantes con compatibilidad de HLA 5/6 y 4/6.
- En un estudio de un solo centro en el que participaron en su mayoría adultos con leucemia mieloide aguda (LMA), síndrome mielodisplásico (SMD) y LLA, se compararon los desenlaces de los receptores de sangre de cordón umbilical con los desenlaces de los receptores de médula ósea o CMSP de donantes no emparentados compatibles e incompatibles.[65]
- En los receptores de sangre de cordón umbilical se observó una mejor supervivencia gracias a que estos pacientes presentaron menos recaídas; estos desenlaces se debieron sobre todo a la supervivencia más prolongada de los pacientes con enfermedad residual mínima (ERM) justo antes del trasplante.
- No se observaron diferencias en las recaídas ni en la supervivencia entre los pacientes con ERM antes del TCMH y los pacientes sin ERM antes del TCMH.
- Estos resultados son polémicos porque contradicen muchos otros estudios en los que se observó que la ERM antes del TCMH en los receptores de sangre de cordón umbilical condujo a un aumento de recaídas y tasas de supervivencia inferiores.[66-69]
- El CIBMTR hizo una comparación de los desenlaces de niños con LLA de riesgo bajo e intermedio y LMA que, entre 2000 y 2014, recibieron trasplantes de donantes alternativos (emparentados y no emparentados sin compatibilidad de HLA), como trasplantes de médula ósea con compatibilidad de HLA 7/8 (n = 172) y trasplantes de sangre de cordón umbilical con compatibilidad de HLA 4/6 o más alta (n = 1613).[70]
- En un análisis multivariante, los pacientes que recibieron médula ósea con compatibilidad de HLA 7/8 versus sangre del cordón umbilical presentaron resultados similares de supervivencia sin recaída de EICH (cociente de riesgos instantáneos [CRI], 1,12; intervalo de confianza [IC] 95 %, 0,87–1,45; P = 0,39), supervivencia sin recaía de EICH crónica (CRI, 1,06; IC 95 %, 0,82–1,38; P = 0,66) y SG (CRI, 1,07; IC 95 %, 0,80–1,44; P = 0,66).
- La recaída quizás fue un poco más alta en el grupo de médula ósea con compatibilidad de HLA 7/8 (CRI, 1,44; IC 95 %, 1,03–2,02; P = 0,03; en la publicación esto se denominó tendencia porque eligieron un valor de corte de 0,01 % para el control de múltiples comparaciones).
- Los pacientes en el grupo de médula ósea con compatibilidad de HLA 7/8 presentaron un riesgo significativamente más alto de EICH aguda de grado III a IV (CRI, 1,70; IC 95 %, 1,16–2,48; P = 0,006) y de EICH crónica (CRI, 6,17; IC 95 %, 2,2–17,33; P = 0,0006) que los pacientes en el grupo de sangre de cordón umbilical.
A partir de estos estudios, en la mayoría de los centros de trasplante se considera que la médula ósea de hermanos compatibles de cualquier sexo es la fuente preferida de células madre o productos de células madre. Si no se dispone de un donante fraterno, la médula ósea o las CMSP de un donante no emparentado plenamente compatible, la sangre de cordón umbilical de un donante con compatibilidad de HLA (de 4/6 a 6/6 o de 6/8 a 8/8) obtenidas de una sola unidad con una dosis de células adecuada, o un TCMH de donante haploidéntico conducen a tasas de supervivencia similares.[48][Nivel de evidencia C2] A pesar de que en los estudios de adultos que reciben médula ósea o CMSP con reducción de células T de donantes no emparentados se observaron desenlaces similares a los abordajes sin reducción de células T, no se han realizado ensayos pediátricos numerosos ni estudios retrospectivos en los que se compare la médula ósea o las CMSP con reducción de células T de donantes compatibles o haploidénticos.
Otras características del donante relacionadas con el desenlace
La compatibilidad de HLA ha sido siempre el factor más importante relacionado con una mejor supervivencia en TCMH alogénicos, pero se observó que otras características del donante afectan los desenlaces más importantes. Se ha demostrado que es importante administrar una dosis más alta de células cuando se usan donantes emparentados, no emparentados o haploidénticos de médula ósea o de CMSP.[71,72] Para para obtener más información, consultar la sección Consideraciones sobre la compatibilidad de HLA y la dosis de células para un trasplante con sangre de cordón umbilical de donante no emparentado. También se estudiaron los efectos de la edad del donante, el tipo de sangre, la presencia o ausencia de infección por CMV, el sexo y el número de partos de las mujeres donantes.
Lo ideal sería que, después de la evaluación de la compatibilidad de HLA, los centros de trasplante seleccionaran a los donantes según las siguientes características:
- Edad del donante. Se prefiere el donante más joven que esté disponible.[73,74]
- Estado del CMV en el receptor. Los donantes no infectados por el CMV se deben emparejar con receptores no infectados por el CMV y los donantes infectados por el CMV con receptores infectados por el CMV.[75]
- Compatibilidad del tipo de sangre del donante. Es preferible que haya compatibilidad entre el tipo de sangre del donante y el receptor, aunque esto no es indispensable. Si solo se cuenta con donantes con incompatibilidad sanguínea, se prefiere una incompatibilidad menor a una incompatibilidad mayor.[76-78]
- Sexo del donante y número de partos de donantes mujeres. Se prefieren donantes varones y mujeres nulíparas en lugar de mujeres que ya han tenido descendencia.[74,79]
Es infrecuente que la pareja de receptor y donante se ajuste a la perfección a este algoritmo; la elección de unas características en lugar de otras ha sido objeto de polémica.
Evidencia (características del donante y el receptor):
- En un estudio del CIBMTR se analizaron 6349 pacientes que se sometieron a trasplante debido a neoplasias hematológicas malignas entre 1988 y 2006. En el estudio se evaluó el efecto de las características del donante ajustado según el riesgo de enfermedad y otras características importantes del trasplante. A partir de datos del estudio se observó lo siguiente:[74]
- Además de la incompatibilidad de HLA, la edad más avanzada del donante y la incompatibilidad mayor o menor del tipo de sangre ABO aumentaron la mortalidad general.
- Las mujeres receptoras de injertos que ya habían tenido descendencia en el momento del trasplante presentaron tasas más bajas de recaída.
- Los receptores de injertos de donantes más jóvenes tuvieron tasas más bajas de EICH aguda.
- Los receptores de injertos de mujeres con hijos tuvieron tasas más altas de EICH crónica.
- El estado del CMV en el receptor fue más importante que en el donante (los receptores infectados por el CMV tienen un riesgo más alto de mortalidad sin importar si el donante está o no infectado por el CMV), aunque la combinación de un donante y receptor no infectados por el CMV mejora la supervivencia.
- En un estudio del EBMT, se evaluó mediante análisis multivariante una cohorte de confirmación del CIBMTR con 4690 pacientes que se sometieron a trasplante entre 2007 y 2011 para identificar factores de predicción de la supervivencia independientes. Los resultados del estudio fueron los siguientes:[80]
- Se confirmó que la edad más avanzada del donante se relaciona de manera independiente con una SG más precaria: por cada 10 años de incremento en la edad del donante aumentó el riesgo de mortalidad en un 5,5 %.
- La compatibilidad de HLA mantuvo el efecto más importante en la supervivencia; no se confirmó que la incompatibilidad de ABO tenga un efecto continuo.
- En un estudio de más de 10 000 pares de donantes y receptores compatibles se intentó definir una jerarquía que permita priorizar las características no relacionadas con los HLA (edad del donante, sexo, tipo de sangre, estado del CMV, etc.), que se sabe afectan los desenlaces.[81]
- Aunque en el estudio no se pudo crear un algoritmo jerárquico de factores modificables, se demostró que, con diferencia, la edad más joven del donante es el factor más importante; se observó una disminución del 3 % en la SG por cada incremento de 10 años en la edad del donante.
Por lo tanto, después de la compatibilidad de HLA, es probable que la edad del donante sea el factor a optimizar más importante. Cabe destacar, que si el receptor tiene una prueba negativa para el CMV, también constituye una prioridad fundamental encontrar un donante con una prueba negativa para el CMV.
En varios estudios se trató de identificar las características de los mejores donantes para los procedimientos haploidénticos. Al igual que para el trasplante convencional de médula ósea, el uso de donantes más jóvenes es beneficioso; pero los datos relacionados con el sexo de los donantes no son concluyentes. En los estudios en los que se lleva a cabo una reducción intensa del número de células T, se observaron mejores resultados cuando se usa como donante a la madre del paciente,[82] pero los resultados de los estudios en los que se utiliza ciclofosfamida o inmunodepresión intensa después del trasplante parecen favorecer a los donantes varones.[83,84] Se necesitan más estudios para aclarar esta cuestión importante.
En una comparación numerosa de donantes haploidénticos se observó un efecto de la incompatibilidad ABO en el injerto (el riesgo de rechazo se duplicó del 6 % al 12 % cuando había compatibilidad de ABO vs. incompatibilidad mayor de ABO); los pacientes que recibieron injertos de donantes con incompatibilidad bidireccional tuvieron un aumento de 2,4 veces en la EICH aguda de grado II a IV.[85] Al igual que con los donantes no haploidénticos, se notaron mejoras significativas de los desenlaces cuando se eligieron donantes más jóvenes para los procedimientos haploidénticos en comparación con los donantes de más edad; se observó un CRI de 1,13 con cada incremento de 10 años en la edad del donante.[86]
Bibliografía
- Barker JN, Byam CE, Kernan NA, et al.: Availability of cord blood extends allogeneic hematopoietic stem cell transplant access to racial and ethnic minorities. Biol Blood Marrow Transplant 16 (11): 1541-8, 2010. [PUBMED Abstract]
- Gragert L, Eapen M, Williams E, et al.: HLA match likelihoods for hematopoietic stem-cell grafts in the U.S. registry. N Engl J Med 371 (4): 339-48, 2014. [PUBMED Abstract]
- Woolfrey A, Klein JP, Haagenson M, et al.: HLA-C antigen mismatch is associated with worse outcome in unrelated donor peripheral blood stem cell transplantation. Biol Blood Marrow Transplant 17 (6): 885-92, 2011. [PUBMED Abstract]
- Dehn J, Spellman S, Hurley CK, et al.: Selection of unrelated donors and cord blood units for hematopoietic cell transplantation: guidelines from the NMDP/CIBMTR. Blood 134 (12): 924-934, 2019. [PUBMED Abstract]
- Howard CA, Fernandez-Vina MA, Appelbaum FR, et al.: Recommendations for donor human leukocyte antigen assessment and matching for allogeneic stem cell transplantation: consensus opinion of the Blood and Marrow Transplant Clinical Trials Network (BMT CTN). Biol Blood Marrow Transplant 21 (1): 4-7, 2015. [PUBMED Abstract]
- Shaw PJ, Kan F, Woo Ahn K, et al.: Outcomes of pediatric bone marrow transplantation for leukemia and myelodysplasia using matched sibling, mismatched related, or matched unrelated donors. Blood 116 (19): 4007-15, 2010. [PUBMED Abstract]
- Flomenberg N, Baxter-Lowe LA, Confer D, et al.: Impact of HLA class I and class II high-resolution matching on outcomes of unrelated donor bone marrow transplantation: HLA-C mismatching is associated with a strong adverse effect on transplantation outcome. Blood 104 (7): 1923-30, 2004. [PUBMED Abstract]
- Petersdorf EW, Kollman C, Hurley CK, et al.: Effect of HLA class II gene disparity on clinical outcome in unrelated donor hematopoietic cell transplantation for chronic myeloid leukemia: the US National Marrow Donor Program Experience. Blood 98 (10): 2922-9, 2001. [PUBMED Abstract]
- Fernandez-Viña MA, Wang T, Lee SJ, et al.: Identification of a permissible HLA mismatch in hematopoietic stem cell transplantation. Blood 123 (8): 1270-8, 2014. [PUBMED Abstract]
- Fernández-Viña MA, Klein JP, Haagenson M, et al.: Multiple mismatches at the low expression HLA loci DP, DQ, and DRB3/4/5 associate with adverse outcomes in hematopoietic stem cell transplantation. Blood 121 (22): 4603-10, 2013. [PUBMED Abstract]
- Fleischhauer K, Shaw BE, Gooley T, et al.: Effect of T-cell-epitope matching at HLA-DPB1 in recipients of unrelated-donor haemopoietic-cell transplantation: a retrospective study. Lancet Oncol 13 (4): 366-74, 2012. [PUBMED Abstract]
- Crocchiolo R, Zino E, Vago L, et al.: Nonpermissive HLA-DPB1 disparity is a significant independent risk factor for mortality after unrelated hematopoietic stem cell transplantation. Blood 114 (7): 1437-44, 2009. [PUBMED Abstract]
- Pidala J, Lee SJ, Ahn KW, et al.: Nonpermissive HLA-DPB1 mismatch increases mortality after myeloablative unrelated allogeneic hematopoietic cell transplantation. Blood 124 (16): 2596-606, 2014. [PUBMED Abstract]
- Spellman S, Bray R, Rosen-Bronson S, et al.: The detection of donor-directed, HLA-specific alloantibodies in recipients of unrelated hematopoietic cell transplantation is predictive of graft failure. Blood 115 (13): 2704-8, 2010. [PUBMED Abstract]
- Ciurea SO, Thall PF, Wang X, et al.: Donor-specific anti-HLA Abs and graft failure in matched unrelated donor hematopoietic stem cell transplantation. Blood 118 (22): 5957-64, 2011. [PUBMED Abstract]
- Shaw BE, Mayor NP, Szydlo RM, et al.: Recipient/donor HLA and CMV matching in recipients of T-cell-depleted unrelated donor haematopoietic cell transplants. Bone Marrow Transplant 52 (5): 717-725, 2017. [PUBMED Abstract]
- Hurley CK, Woolfrey A, Wang T, et al.: The impact of HLA unidirectional mismatches on the outcome of myeloablative hematopoietic stem cell transplantation with unrelated donors. Blood 121 (23): 4800-6, 2013. [PUBMED Abstract]
- Eapen M, Rubinstein P, Zhang MJ, et al.: Outcomes of transplantation of unrelated donor umbilical cord blood and bone marrow in children with acute leukaemia: a comparison study. Lancet 369 (9577): 1947-54, 2007. [PUBMED Abstract]
- Eapen M, Klein JP, Ruggeri A, et al.: Impact of allele-level HLA matching on outcomes after myeloablative single unit umbilical cord blood transplantation for hematologic malignancy. Blood 123 (1): 133-40, 2014. [PUBMED Abstract]
- Eapen M, Wang T, Veys PA, et al.: Allele-level HLA matching for umbilical cord blood transplantation for non-malignant diseases in children: a retrospective analysis. Lancet Haematol 4 (7): e325-e333, 2017. [PUBMED Abstract]
- Takanashi M, Atsuta Y, Fujiwara K, et al.: The impact of anti-HLA antibodies on unrelated cord blood transplantations. Blood 116 (15): 2839-46, 2010. [PUBMED Abstract]
- Cutler C, Kim HT, Sun L, et al.: Donor-specific anti-HLA antibodies predict outcome in double umbilical cord blood transplantation. Blood 118 (25): 6691-7, 2011. [PUBMED Abstract]
- Rocha V, Spellman S, Zhang MJ, et al.: Effect of HLA-matching recipients to donor noninherited maternal antigens on outcomes after mismatched umbilical cord blood transplantation for hematologic malignancy. Biol Blood Marrow Transplant 18 (12): 1890-6, 2012. [PUBMED Abstract]
- van Rood JJ, Stevens CE, Smits J, et al.: Reexposure of cord blood to noninherited maternal HLA antigens improves transplant outcome in hematological malignancies. Proc Natl Acad Sci U S A 106 (47): 19952-7, 2009. [PUBMED Abstract]
- Kanda J, Atsuta Y, Wake A, et al.: Impact of the direction of HLA mismatch on transplantation outcomes in single unrelated cord blood transplantation. Biol Blood Marrow Transplant 19 (2): 247-54, 2013. [PUBMED Abstract]
- Stevens CE, Carrier C, Carpenter C, et al.: HLA mismatch direction in cord blood transplantation: impact on outcome and implications for cord blood unit selection. Blood 118 (14): 3969-78, 2011. [PUBMED Abstract]
- Cunha R, Loiseau P, Ruggeri A, et al.: Impact of HLA mismatch direction on outcomes after umbilical cord blood transplantation for hematological malignant disorders: a retrospective Eurocord-EBMT analysis. Bone Marrow Transplant 49 (1): 24-9, 2014. [PUBMED Abstract]
- Barker JN, Rocha V, Scaradavou A: Optimizing unrelated donor cord blood transplantation. Biol Blood Marrow Transplant 15 (1 Suppl): 154-61, 2009. [PUBMED Abstract]
- Wagner JE, Barker JN, DeFor TE, et al.: Transplantation of unrelated donor umbilical cord blood in 102 patients with malignant and nonmalignant diseases: influence of CD34 cell dose and HLA disparity on treatment-related mortality and survival. Blood 100 (5): 1611-8, 2002. [PUBMED Abstract]
- Rubinstein P, Carrier C, Scaradavou A, et al.: Outcomes among 562 recipients of placental-blood transplants from unrelated donors. N Engl J Med 339 (22): 1565-77, 1998. [PUBMED Abstract]
- Barker JN, Weisdorf DJ, DeFor TE, et al.: Transplantation of 2 partially HLA-matched umbilical cord blood units to enhance engraftment in adults with hematologic malignancy. Blood 105 (3): 1343-7, 2005. [PUBMED Abstract]
- Michel G, Galambrun C, Sirvent A, et al.: Single- vs double-unit cord blood transplantation for children and young adults with acute leukemia or myelodysplastic syndrome. Blood 127 (26): 3450-7, 2016. [PUBMED Abstract]
- Wagner JE, Eapen M, Carter S, et al.: One-unit versus two-unit cord-blood transplantation for hematologic cancers. N Engl J Med 371 (18): 1685-94, 2014. [PUBMED Abstract]
- Stiff PJ, Montesinos P, Peled T, et al.: Cohort-Controlled Comparison of Umbilical Cord Blood Transplantation Using Carlecortemcel-L, a Single Progenitor-Enriched Cord Blood, to Double Cord Blood Unit Transplantation. Biol Blood Marrow Transplant 24 (7): 1463-1470, 2018. [PUBMED Abstract]
- Anand S, Thomas S, Hyslop T, et al.: Transplantation of Ex Vivo Expanded Umbilical Cord Blood (NiCord) Decreases Early Infection and Hospitalization. Biol Blood Marrow Transplant 23 (7): 1151-1157, 2017. [PUBMED Abstract]
- Wagner JE, Brunstein CG, Boitano AE, et al.: Phase I/II Trial of StemRegenin-1 Expanded Umbilical Cord Blood Hematopoietic Stem Cells Supports Testing as a Stand-Alone Graft. Cell Stem Cell 18 (1): 144-55, 2016. [PUBMED Abstract]
- Horwitz ME, Wease S, Blackwell B, et al.: Phase I/II Study of Stem-Cell Transplantation Using a Single Cord Blood Unit Expanded Ex Vivo With Nicotinamide. J Clin Oncol 37 (5): 367-374, 2019. [PUBMED Abstract]
- Delaney C, Heimfeld S, Brashem-Stein C, et al.: Notch-mediated expansion of human cord blood progenitor cells capable of rapid myeloid reconstitution. Nat Med 16 (2): 232-6, 2010. [PUBMED Abstract]
- Beatty PG, Clift RA, Mickelson EM, et al.: Marrow transplantation from related donors other than HLA-identical siblings. N Engl J Med 313 (13): 765-71, 1985. [PUBMED Abstract]
- Aversa F, Tabilio A, Velardi A, et al.: Treatment of high-risk acute leukemia with T-cell-depleted stem cells from related donors with one fully mismatched HLA haplotype. N Engl J Med 339 (17): 1186-93, 1998. [PUBMED Abstract]
- Barrett J, Gluckman E, Handgretinger R, et al.: Point-counterpoint: haploidentical family donors versus cord blood transplantation. Biol Blood Marrow Transplant 17 (1 Suppl): S89-93, 2011. [PUBMED Abstract]
- Leung W, Campana D, Yang J, et al.: High success rate of hematopoietic cell transplantation regardless of donor source in children with very high-risk leukemia. Blood 118 (2): 223-30, 2011. [PUBMED Abstract]
- González-Vicent M, Molina B, Andión M, et al.: Allogeneic hematopoietic transplantation using haploidentical donor vs. unrelated cord blood donor in pediatric patients: a single-center retrospective study. Eur J Haematol 87 (1): 46-53, 2011. [PUBMED Abstract]
- Pulsipher MA, Ahn KW, Bunin NJ, et al.: KIR-favorable TCR-αβ/CD19-depleted haploidentical HCT in children with ALL/AML/MDS: primary analysis of the PTCTC ONC1401 trial. Blood 140 (24): 2556-2572, 2022. [PUBMED Abstract]
- Merli P, Algeri M, Galaverna F, et al.: TCRαβ/CD19 cell-depleted HLA-haploidentical transplantation to treat pediatric acute leukemia: updated final analysis. Blood 143 (3): 279-289, 2024. [PUBMED Abstract]
- Handgretinger R, Chen X, Pfeiffer M, et al.: Feasibility and outcome of reduced-intensity conditioning in haploidentical transplantation. Ann N Y Acad Sci 1106: 279-89, 2007. [PUBMED Abstract]
- Locatelli F, Merli P, Pagliara D, et al.: Outcome of children with acute leukemia given HLA-haploidentical HSCT after αβ T-cell and B-cell depletion. Blood 130 (5): 677-685, 2017. [PUBMED Abstract]
- Bertaina A, Zecca M, Buldini B, et al.: Unrelated donor vs HLA-haploidentical α/β T-cell- and B-cell-depleted HSCT in children with acute leukemia. Blood 132 (24): 2594-2607, 2018. [PUBMED Abstract]
- Leen AM, Christin A, Myers GD, et al.: Cytotoxic T lymphocyte therapy with donor T cells prevents and treats adenovirus and Epstein-Barr virus infections after haploidentical and matched unrelated stem cell transplantation. Blood 114 (19): 4283-92, 2009. [PUBMED Abstract]
- Huang XJ, Liu DH, Liu KY, et al.: Haploidentical hematopoietic stem cell transplantation without in vitro T-cell depletion for the treatment of hematological malignancies. Bone Marrow Transplant 38 (4): 291-7, 2006. [PUBMED Abstract]
- Luznik L, Fuchs EJ: High-dose, post-transplantation cyclophosphamide to promote graft-host tolerance after allogeneic hematopoietic stem cell transplantation. Immunol Res 47 (1-3): 65-77, 2010. [PUBMED Abstract]
- Berger M, Lanino E, Cesaro S, et al.: Feasibility and Outcome of Haploidentical Hematopoietic Stem Cell Transplantation with Post-Transplant High-Dose Cyclophosphamide for Children and Adolescents with Hematologic Malignancies: An AIEOP-GITMO Retrospective Multicenter Study. Biol Blood Marrow Transplant 22 (5): 902-9, 2016. [PUBMED Abstract]
- Baker M, Wang H, Rowley SD, et al.: Comparative Outcomes after Haploidentical or Unrelated Donor Bone Marrow or Blood Stem Cell Transplantation in Adult Patients with Hematological Malignancies. Biol Blood Marrow Transplant 22 (11): 2047-2055, 2016. [PUBMED Abstract]
- Rashidi A, Slade M, DiPersio JF, et al.: Post-transplant high-dose cyclophosphamide after HLA-matched vs haploidentical hematopoietic cell transplantation for AML. Bone Marrow Transplant 51 (12): 1561-1564, 2016. [PUBMED Abstract]
- Fuchs EJ, O'Donnell PV, Eapen M, et al.: Double unrelated umbilical cord blood vs HLA-haploidentical bone marrow transplantation: the BMT CTN 1101 trial. Blood 137 (3): 420-428, 2021. [PUBMED Abstract]
- Symons HJ, Zahurak M, Cao Y, et al.: Myeloablative haploidentical BMT with posttransplant cyclophosphamide for hematologic malignancies in children and adults. Blood Adv 4 (16): 3913-3925, 2020. [PUBMED Abstract]
- Ciurea SO, Cao K, Fernandez-Vina M, et al.: The European Society for Blood and Marrow Transplantation (EBMT) Consensus Guidelines for the Detection and Treatment of Donor-specific Anti-HLA Antibodies (DSA) in Haploidentical Hematopoietic Cell Transplantation. Bone Marrow Transplant 53 (5): 521-534, 2018. [PUBMED Abstract]
- Bensinger WI, Martin PJ, Storer B, et al.: Transplantation of bone marrow as compared with peripheral-blood cells from HLA-identical relatives in patients with hematologic cancers. N Engl J Med 344 (3): 175-81, 2001. [PUBMED Abstract]
- Rocha V, Cornish J, Sievers EL, et al.: Comparison of outcomes of unrelated bone marrow and umbilical cord blood transplants in children with acute leukemia. Blood 97 (10): 2962-71, 2001. [PUBMED Abstract]
- Bertaina A, Merli P, Rutella S, et al.: HLA-haploidentical stem cell transplantation after removal of αβ+ T and B cells in children with nonmalignant disorders. Blood 124 (5): 822-6, 2014. [PUBMED Abstract]
- Eapen M, Horowitz MM, Klein JP, et al.: Higher mortality after allogeneic peripheral-blood transplantation compared with bone marrow in children and adolescents: the Histocompatibility and Alternate Stem Cell Source Working Committee of the International Bone Marrow Transplant Registry. J Clin Oncol 22 (24): 4872-80, 2004. [PUBMED Abstract]
- Shinzato A, Tabuchi K, Atsuta Y, et al.: PBSCT is associated with poorer survival and increased chronic GvHD than BMT in Japanese paediatric patients with acute leukaemia and an HLA-matched sibling donor. Pediatr Blood Cancer 60 (9): 1513-9, 2013. [PUBMED Abstract]
- Anasetti C, Logan BR, Lee SJ, et al.: Peripheral-blood stem cells versus bone marrow from unrelated donors. N Engl J Med 367 (16): 1487-96, 2012. [PUBMED Abstract]
- Shimosato Y, Tanoshima R, Tsujimoto SI, et al.: Allogeneic Bone Marrow Transplantation versus Peripheral Blood Stem Cell Transplantation for Hematologic Malignancies in Children: A Systematic Review and Meta-Analysis. Biol Blood Marrow Transplant 26 (1): 88-93, 2020. [PUBMED Abstract]
- Milano F, Gooley T, Wood B, et al.: Cord-Blood Transplantation in Patients with Minimal Residual Disease. N Engl J Med 375 (10): 944-53, 2016. [PUBMED Abstract]
- Ruggeri A, Michel G, Dalle JH, et al.: Impact of pretransplant minimal residual disease after cord blood transplantation for childhood acute lymphoblastic leukemia in remission: an Eurocord, PDWP-EBMT analysis. Leukemia 26 (12): 2455-61, 2012. [PUBMED Abstract]
- Bachanova V, Burke MJ, Yohe S, et al.: Unrelated cord blood transplantation in adult and pediatric acute lymphoblastic leukemia: effect of minimal residual disease on relapse and survival. Biol Blood Marrow Transplant 18 (6): 963-8, 2012. [PUBMED Abstract]
- Sutton R, Shaw PJ, Venn NC, et al.: Persistent MRD before and after allogeneic BMT predicts relapse in children with acute lymphoblastic leukaemia. Br J Haematol 168 (3): 395-404, 2015. [PUBMED Abstract]
- Sanchez-Garcia J, Serrano J, Serrano-Lopez J, et al.: Quantification of minimal residual disease levels by flow cytometry at time of transplant predicts outcome after myeloablative allogeneic transplantation in ALL. Bone Marrow Transplant 48 (3): 396-402, 2013. [PUBMED Abstract]
- Mehta RS, Holtan SG, Wang T, et al.: GRFS and CRFS in alternative donor hematopoietic cell transplantation for pediatric patients with acute leukemia. Blood Adv 3 (9): 1441-1449, 2019. [PUBMED Abstract]
- Pulsipher MA, Chitphakdithai P, Logan BR, et al.: Donor, recipient, and transplant characteristics as risk factors after unrelated donor PBSC transplantation: beneficial effects of higher CD34+ cell dose. Blood 114 (13): 2606-16, 2009. [PUBMED Abstract]
- Aversa F, Terenzi A, Tabilio A, et al.: Full haplotype-mismatched hematopoietic stem-cell transplantation: a phase II study in patients with acute leukemia at high risk of relapse. J Clin Oncol 23 (15): 3447-54, 2005. [PUBMED Abstract]
- Kollman C, Howe CW, Anasetti C, et al.: Donor characteristics as risk factors in recipients after transplantation of bone marrow from unrelated donors: the effect of donor age. Blood 98 (7): 2043-51, 2001. [PUBMED Abstract]
- Kollman C, Spellman SR, Zhang MJ, et al.: The effect of donor characteristics on survival after unrelated donor transplantation for hematologic malignancy. Blood 127 (2): 260-7, 2016. [PUBMED Abstract]
- Boeckh M, Nichols WG: The impact of cytomegalovirus serostatus of donor and recipient before hematopoietic stem cell transplantation in the era of antiviral prophylaxis and preemptive therapy. Blood 103 (6): 2003-8, 2004. [PUBMED Abstract]
- Seebach JD, Stussi G, Passweg JR, et al.: ABO blood group barrier in allogeneic bone marrow transplantation revisited. Biol Blood Marrow Transplant 11 (12): 1006-13, 2005. [PUBMED Abstract]
- Logan AC, Wang Z, Alimoghaddam K, et al.: ABO mismatch is associated with increased nonrelapse mortality after allogeneic hematopoietic cell transplantation. Biol Blood Marrow Transplant 21 (4): 746-54, 2015. [PUBMED Abstract]
- Stussi G, Muntwyler J, Passweg JR, et al.: Consequences of ABO incompatibility in allogeneic hematopoietic stem cell transplantation. Bone Marrow Transplant 30 (2): 87-93, 2002. [PUBMED Abstract]
- Loren AW, Bunin GR, Boudreau C, et al.: Impact of donor and recipient sex and parity on outcomes of HLA-identical sibling allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 12 (7): 758-69, 2006. [PUBMED Abstract]
- Canaani J, Savani BN, Labopin M, et al.: ABO incompatibility in mismatched unrelated donor allogeneic hematopoietic cell transplantation for acute myeloid leukemia: A report from the acute leukemia working party of the EBMT. Am J Hematol 92 (8): 789-796, 2017. [PUBMED Abstract]
- Shaw BE, Logan BR, Spellman SR, et al.: Development of an Unrelated Donor Selection Score Predictive of Survival after HCT: Donor Age Matters Most. Biol Blood Marrow Transplant 24 (5): 1049-1056, 2018. [PUBMED Abstract]
- Stern M, Ruggeri L, Mancusi A, et al.: Survival after T cell-depleted haploidentical stem cell transplantation is improved using the mother as donor. Blood 112 (7): 2990-5, 2008. [PUBMED Abstract]
- Ciurea SO, Champlin RE: Donor selection in T cell-replete haploidentical hematopoietic stem cell transplantation: knowns, unknowns, and controversies. Biol Blood Marrow Transplant 19 (2): 180-4, 2013. [PUBMED Abstract]
- Wang Y, Chang YJ, Xu LP, et al.: Who is the best donor for a related HLA haplotype-mismatched transplant? Blood 124 (6): 843-50, 2014. [PUBMED Abstract]
- Canaani J, Savani BN, Labopin M, et al.: Impact of ABO incompatibility on patients' outcome after haploidentical hematopoietic stem cell transplantation for acute myeloid leukemia - a report from the Acute Leukemia Working Party of the EBMT. Haematologica 102 (6): 1066-1074, 2017. [PUBMED Abstract]
- DeZern AE, Franklin C, Tsai HL, et al.: Relationship of donor age and relationship to outcomes of haploidentical transplantation with posttransplant cyclophosphamide. Blood Adv 5 (5): 1360-1368, 2021. [PUBMED Abstract]
Regímenes preparatorios para el trasplante alogénico de células madre hematopoyéticas
En los días previos a la infusión del producto de células madre (médula ósea, células madre de sangre periférica [CMSP] o sangre de cordón umbilical), los receptores de un trasplante de células madre hematopoyéticas (TCMH) reciben quimioterapia o inmunoterapia, a veces combinadas con radioterapia. Esto se denominó régimen preparatorio, y la intención original de este tratamiento fue lograr lo siguiente:
- Crear espacio en la médula ósea del receptor para la incorporación del injerto de las células del donante.
- Deprimir el sistema inmunitario o eliminar las células T del receptor para reducir al mínimo el riesgo de rechazo.
- Tratar el cáncer de manera intensiva (si estuviera presente) con dosis altas de fármacos activos para superar la resistencia al tratamiento.
A partir del reconocimiento de que las células T del donante pueden facilitar la incorporación del injerto y destruir tumores mediante los efectos del injerto contra leucemia (evitando la necesidad de crear espacio en la médula ósea y tratar el cáncer de manera intensiva), se formularon abordajes de TCMH de intensidad reducida o intensidad mínima que se centran en la inmunodepresión en lugar de la mielosupresión. La menor toxicidad de estos regímenes condujo a tasas más bajas de mortalidad relacionada con el trasplante. Además, permitió que personas de mayor edad fueran aptas para un TCMH, así como pacientes más jóvenes con comorbilidades anteriores al trasplante que presentan riesgo de toxicidad grave con los abordajes estándar de TCMH.[1]
Los regímenes preparatorios disponibles varían mucho según el grado de inmunodepresión y mielodepresión que causan; los regímenes de intensidad más baja dependen en gran medida de un fuerte efecto de injerto contra tumor (consultar la Figura 3).
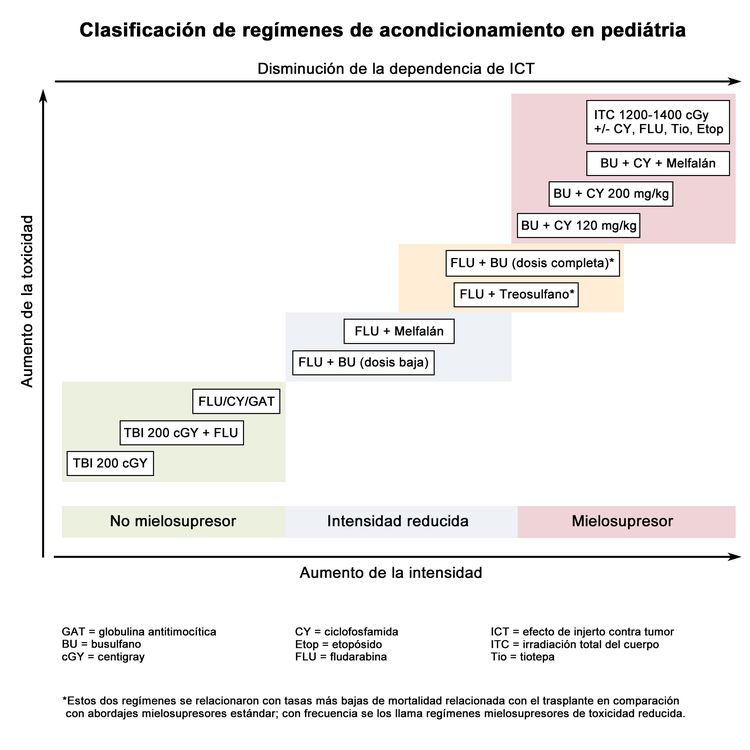
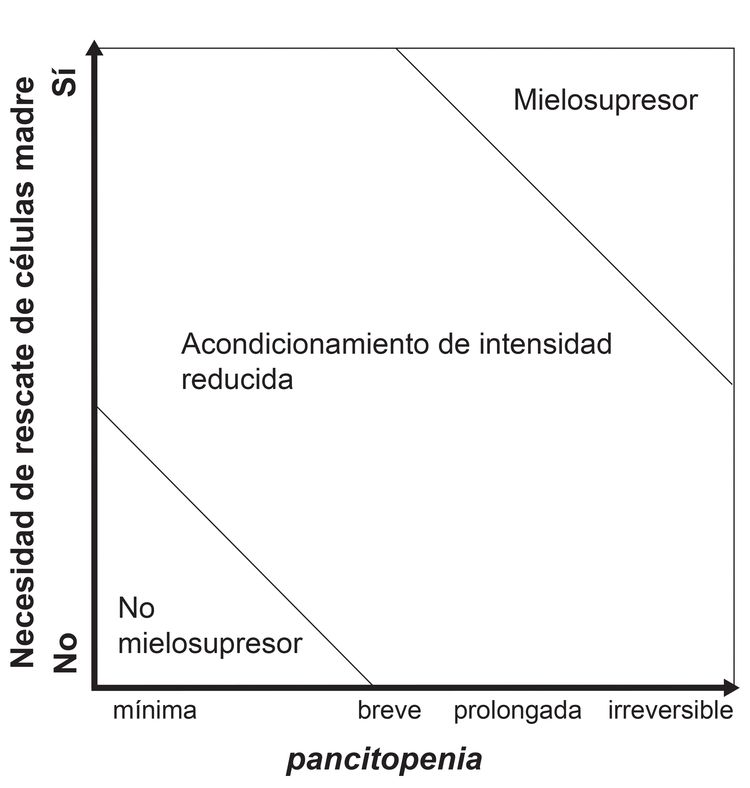
Si bien estos regímenes representan una gama amplia de grados de mielodepresión e inmunodepresión, se agruparon desde el punto de vista clínico en las siguientes 3 categorías principales (consultar la Figura 4):[2]
- Mielosupresores: abordajes intensivos que causan pancitopenia irreversible y exigen el rescate de células madre para restaurar la hematopoyesis.
- No mielosupresores: regímenes que causan citopenias mínimas y no exigen el apoyo de células madre.
- Acondicionamiento de intensidad reducida: regímenes de intensidad intermedia que no cumplen con la definición de los regímenes mielosupresores ni con la definición de los regímenes no mielosupresores.
Durante años, en los estudios retrospectivos se observaron resultados similares con el uso de abordajes de intensidad reducida y mielosupresores.[3,4] Sin embargo, en un ensayo de la Blood and Marrow Transplant Clinical Trials Network en pacientes adultos con leucemia mieloide aguda (LMA) y síndrome mielodisplásico (SMD) que se asignaron al azar para recibir un TCMH con abordajes mielosupresores o de intensidad reducida, se demostró la importancia de la intensidad del régimen.[5]
- A los 18 meses, la cantidad de recaídas fue mucho más alta en la cohorte del régimen de intensidad reducida (48 vs. 13,5 %, P < 0,001).
- Aunque en el grupo de mielosupresión la mortalidad relacionada con el tratamiento fue más alta (16 vs. 4 %, P = 0,002), las tasas de supervivencia sin recaída fueron superiores (69 vs. 47 %, P < 0,01) y las tasas de supervivencia general fueron más altas (76 vs. 68 %), con un valor de P = 0,07 no significativo.
Teniendo esto en cuenta, el uso de regímenes de acondicionamiento de intensidad reducida y no mielosupresores está bien establecido para adultos mayores que no pueden tolerar los abordajes mielosupresores más intensivos;[6-8] no obstante, estos abordajes se estudiaron en una cantidad limitada de pacientes más jóvenes con neoplasias malignas.[9-13] En un estudio grande del Pediatric Blood and Marrow Transplant Consortium se identificó a pacientes con riesgo alto de mortalidad relacionada con el trasplante en caso de recibir regímenes mielosupresores (por ejemplo, antecedentes de un trasplante con mielosupresión, disfunción orgánica grave o infección fúngica invasiva activa), y que se trataron con éxito con un régimen de intensidad reducida.[14] La mortalidad relacionada con el trasplante fue baja en este grupo de riesgo alto y la mayoría de los pacientes con enfermedad mínima o indetectable en el momento del trasplante presentaron supervivencia a largo plazo. Debido a que los riesgos de recaída son más altos con estos abordajes, en la actualidad su aplicación en el entorno pediátrico se limita a pacientes que no son aptos para regímenes mielosupresores, y es más probable que sean exitosos cuando los pacientes han logrado remisiones sin enfermedad residual mínima (ERM).[14]
Determinación del quimerismo del donante
Los abordajes mielosupresores intensivos resultan casi siempre en hematopoyesis derivada de las células del donante y la recuperación de los recuentos después del trasplante. La introducción de abordajes de acondicionamiento de intensidad reducida y abordajes no mielosupresores para el TCMH dio lugar a un ritmo más lento de transición a la hematopoyesis del donante (aumento gradual de una hematopoyesis parcial del donante a una total en el transcurso de unos meses) que a veces permanece parcial. Se formularon técnicas basadas en el ADN para diferenciar la hematopoyesis del donante de la del receptor; en estas técnicas se usa la palabra quimerismo para indicar si la hematopoyesis después del TCMH se deriva del donante o del receptor, de manera parcial o total.
El ritmo y grado de quimerismo del donante que un receptor de TCMH logra a largo plazo, tiene varias consecuencias. Para los pacientes tratados con regímenes de acondicionamiento de intensidad reducida o regímenes no mielosupresores, la progresión rápida a un quimerismo total del donante se relaciona con menor recaída, pero más enfermedad de injerto contra huésped (EICH).[15] El retraso en el ritmo de progresión a un quimerismo total del donante después de estos regímenes conduce a una EICH aguda de inicio tardío, que se presenta hasta 6 a 7 meses después de un TCMH (por lo general, ocurre en los siguientes 100 días del abordaje mielosupresor).[16] Una porción de los pacientes logra un quimerismo mixto estable de donante y receptor. El quimerismo mixto después de un TCMH se relaciona con más recaídas de neoplasias malignas y menos EICH; sin embargo, esta situación a menudo es ventajosa para el TCMH que no se hace para tratar una neoplasia maligna, donde solo se necesita un porcentaje de hematopoyesis normal para corregir el trastorno preexistente y la EICH no es beneficiosa.[17] Por último, se estableció que el riesgo de rechazo es más alto cuando en las mediciones seriadas se encuentra una disminución del quimerismo del donante, en especial del quimerismo específico de células T.[18]
Debido a las consecuencias de la persistencia del quimerismo en el receptor, la mayoría de los programas de trasplante hacen pruebas de quimerismo poco después de la incorporación del injerto y continúan el seguimiento del quimerismo de manera regular hasta que se logra una hematopoyesis de donante total y estable. Los investigadores definieron 2 abordajes para tratar el aumento del riesgo de recaída y de rechazo relacionados con el aumento del quimerismo del receptor: la interrupción rápida de la inmunodepresión y las infusiones de linfocitos de un donante (ILD). Estos abordajes se usan con frecuencia para tratar este problema y mostraron que, en algunos casos, disminuyen el riesgo de recaída y detienen el rechazo.[19-21] La sincronización de la disminución progresiva de la inmunodepresión y de las dosis y métodos de administración de la ILD para aumentar o estabilizar el quimerismo del donante varían entre los abordajes de trasplante y las instituciones. Para obtener más información, consultar la sección Uso de infusiones de linfocitos de un donante o interrupción temprana de la inmunodepresión para potenciar el efecto injerto contra leucemia.
Bibliografía
- Deeg HJ, Sandmaier BM: Who is fit for allogeneic transplantation? Blood 116 (23): 4762-70, 2010. [PUBMED Abstract]
- Bacigalupo A, Ballen K, Rizzo D, et al.: Defining the intensity of conditioning regimens: working definitions. Biol Blood Marrow Transplant 15 (12): 1628-33, 2009. [PUBMED Abstract]
- Luger SM, Ringdén O, Zhang MJ, et al.: Similar outcomes using myeloablative vs reduced-intensity allogeneic transplant preparative regimens for AML or MDS. Bone Marrow Transplant 47 (2): 203-11, 2012. [PUBMED Abstract]
- Pulsipher MA, Chitphakdithai P, Logan BR, et al.: Donor, recipient, and transplant characteristics as risk factors after unrelated donor PBSC transplantation: beneficial effects of higher CD34+ cell dose. Blood 114 (13): 2606-16, 2009. [PUBMED Abstract]
- Scott BL, Pasquini MC, Logan BR, et al.: Myeloablative Versus Reduced-Intensity Hematopoietic Cell Transplantation for Acute Myeloid Leukemia and Myelodysplastic Syndromes. J Clin Oncol 35 (11): 1154-1161, 2017. [PUBMED Abstract]
- Giralt S, Estey E, Albitar M, et al.: Engraftment of allogeneic hematopoietic progenitor cells with purine analog-containing chemotherapy: harnessing graft-versus-leukemia without myeloablative therapy. Blood 89 (12): 4531-6, 1997. [PUBMED Abstract]
- Slavin S, Nagler A, Naparstek E, et al.: Nonmyeloablative stem cell transplantation and cell therapy as an alternative to conventional bone marrow transplantation with lethal cytoreduction for the treatment of malignant and nonmalignant hematologic diseases. Blood 91 (3): 756-63, 1998. [PUBMED Abstract]
- Storb R, Yu C, Sandmaier BM, et al.: Mixed hematopoietic chimerism after marrow allografts. Transplantation in the ambulatory care setting. Ann N Y Acad Sci 872: 372-5; discussion 375-6, 1999. [PUBMED Abstract]
- Bradley MB, Satwani P, Baldinger L, et al.: Reduced intensity allogeneic umbilical cord blood transplantation in children and adolescent recipients with malignant and non-malignant diseases. Bone Marrow Transplant 40 (7): 621-31, 2007. [PUBMED Abstract]
- Del Toro G, Satwani P, Harrison L, et al.: A pilot study of reduced intensity conditioning and allogeneic stem cell transplantation from unrelated cord blood and matched family donors in children and adolescent recipients. Bone Marrow Transplant 33 (6): 613-22, 2004. [PUBMED Abstract]
- Gómez-Almaguer D, Ruiz-Argüelles GJ, Tarín-Arzaga Ldel C, et al.: Reduced-intensity stem cell transplantation in children and adolescents: the Mexican experience. Biol Blood Marrow Transplant 9 (3): 157-61, 2003. [PUBMED Abstract]
- Pulsipher MA, Woolfrey A: Nonmyeloablative transplantation in children. Current status and future prospects. Hematol Oncol Clin North Am 15 (5): 809-34, vii-viii, 2001. [PUBMED Abstract]
- Roman E, Cooney E, Harrison L, et al.: Preliminary results of the safety of immunotherapy with gemtuzumab ozogamicin following reduced intensity allogeneic stem cell transplant in children with CD33+ acute myeloid leukemia. Clin Cancer Res 11 (19 Pt 2): 7164s-7170s, 2005. [PUBMED Abstract]
- Pulsipher MA, Boucher KM, Wall D, et al.: Reduced-intensity allogeneic transplantation in pediatric patients ineligible for myeloablative therapy: results of the Pediatric Blood and Marrow Transplant Consortium Study ONC0313. Blood 114 (7): 1429-36, 2009. [PUBMED Abstract]
- Baron F, Baker JE, Storb R, et al.: Kinetics of engraftment in patients with hematologic malignancies given allogeneic hematopoietic cell transplantation after nonmyeloablative conditioning. Blood 104 (8): 2254-62, 2004. [PUBMED Abstract]
- Vigorito AC, Campregher PV, Storer BE, et al.: Evaluation of NIH consensus criteria for classification of late acute and chronic GVHD. Blood 114 (3): 702-8, 2009. [PUBMED Abstract]
- Marsh RA, Vaughn G, Kim MO, et al.: Reduced-intensity conditioning significantly improves survival of patients with hemophagocytic lymphohistiocytosis undergoing allogeneic hematopoietic cell transplantation. Blood 116 (26): 5824-31, 2010. [PUBMED Abstract]
- McSweeney PA, Niederwieser D, Shizuru JA, et al.: Hematopoietic cell transplantation in older patients with hematologic malignancies: replacing high-dose cytotoxic therapy with graft-versus-tumor effects. Blood 97 (11): 3390-400, 2001. [PUBMED Abstract]
- Bader P, Kreyenberg H, Hoelle W, et al.: Increasing mixed chimerism is an important prognostic factor for unfavorable outcome in children with acute lymphoblastic leukemia after allogeneic stem-cell transplantation: possible role for pre-emptive immunotherapy? J Clin Oncol 22 (9): 1696-705, 2004. [PUBMED Abstract]
- Horn B, Soni S, Khan S, et al.: Feasibility study of preemptive withdrawal of immunosuppression based on chimerism testing in children undergoing myeloablative allogeneic transplantation for hematologic malignancies. Bone Marrow Transplant 43 (6): 469-76, 2009. [PUBMED Abstract]
- Haines HL, Bleesing JJ, Davies SM, et al.: Outcomes of donor lymphocyte infusion for treatment of mixed donor chimerism after a reduced-intensity preparative regimen for pediatric patients with nonmalignant diseases. Biol Blood Marrow Transplant 21 (2): 288-92, 2015. [PUBMED Abstract]
Efectos inmunoterapéuticos de los trasplantes alogénicos de células madre hematopoyéticas
Efecto de injerto contra leucemia
Los primeros estudios de trasplante de células madre hematopoyéticas (TCMH) se centraron en la administración de regímenes preparatorios mielosupresores intensivos seguidos de rescate del sistema hematopoyético con médula ósea autógena o alogénica. Los investigadores observaron muy pronto que los abordajes alogénicos conducían a una reducción del riesgo de recaída causada por una reacción inmunoterapéutica del nuevo injerto de médula ósea contra los antígenos tumorales. Este fenómeno se denominó efecto de injerto contra leucemia (ICL) o injerto contra tumor (ICT), y se relacionó con incompatibilidades mayores y menores en los antígenos de HLA.
El efecto ICL representa un reto para su uso terapéutico debido a una fuerte relación entre el ICL y la enfermedad clínica de injerto contra huésped (EICH). En los abordajes estándar de TCMH, las tasas de supervivencia más altas se relacionaron con una EICH leve o moderada (leucemia mieloide aguda [LMA] de grado I o II y leucemia linfoblástica aguda [LLA] de grados I a III), en comparación con pacientes sin EICH que presentan más recaídas o pacientes con EICH grave que tienen mayor mortalidad relacionada con el trasplante.[1-3]; [4][Nivel de evidencia C2]
Es muy complejo comprender cuándo se presenta el efecto ICL y cómo usar el ICL en condiciones óptimas. Un método de estudio compara las tasas de recaída y supervivencia entre los pacientes sometidos a un TCMH mielosupresor de donantes autógenos o alogénicos para una enfermedad determinada.
- Leucemia y síndrome mielodisplásico: se observó una ventaja clara con el uso de abordajes alogénicos para la LLA, la LMA, la leucemia mielógena crónica (LMC) y el síndrome mielodisplásico (SMD). Para la LLA y la LMA específicamente, los abordajes de TCMH autógeno para la mayoría de los grupos de pacientes de riesgo alto mostraron resultados similares a los obtenidos con quimioterapia, mientras que los abordajes alogénicos produjeron resultados superiores.[5,6]
- Linfoma de Hodgkin y linfoma no Hodgkin: los pacientes con linfoma de Hodgkin (LH) o linfoma no Hodgkin (LNH) en general evolucionan mejor con los abordajes autógenos, aunque es posible que los abordajes alogénicos cumplan una función en casos de linfoma linfoblástico en recaída, linfoma que responde mal a la quimioterapia o linfoma que recayó después de un TCMH autógeno.[7]
Del uso de regímenes preparatorios de intensidad reducida surgieron conocimientos adicionales del beneficio terapéutico de ICL o ICT para determinadas enfermedades. Este abordaje de trasplante depende del efecto ICL porque para la mayoría de los pacientes la intensidad del régimen preparatorio no es suficiente para la cura. Si bien en algunos estudios se observó un beneficio con este abordaje en los pacientes que no son aptos para un trasplante estándar,[8] no se usa en la mayoría de los niños con cáncer que necesitan un TCMH porque, por lo general, los pacientes de cáncer infantil se pueden someter a métodos mielosupresores inocuos. Para obtener más información, consultar la sección Regímenes preparatorios para el trasplante alogénico de células madre hematopoyéticas.
Uso de infusiones de linfocitos de un donante o interrupción temprana de la inmunodepresión para potenciar el efecto injerto contra leucemia
El ICL terapéutico se puede lograr después del trasplante mediante una infusión de células que se dirigen de modo específico o inespecífico al tumor. El abordaje más común es el uso de infusiones de linfocitos de un donante (ILD). Para inducir el efecto ICL, este abordaje se basa en la continuidad de la incorporación del injerto de células T después del trasplante con el fin de prevenir el rechazo a los linfocitos infundidos del donante.
La ILD produce respuestas intensas en pacientes de LMC que recaen después del trasplante (un 60–80 % entra en remisión a largo plazo),[9] pero las respuestas de pacientes con otras enfermedades (como LMA y LLA) son menos intensas; las tasas de supervivencia a largo plazo son solo de un 20 % a un 30%.[10] El efecto ICL funciona de modo precario en pacientes de leucemia aguda que recaen temprano con grados altos de enfermedad activa. La recaída tardía (>6 meses después del trasplante) y el tratamiento quimioterapéutico de los pacientes con el objetivo de lograr una remisión completa antes de la ICL se relacionaron con mejores desenlaces.[11] También se ha estudiado la infusión de linfocitos de donantes modificados para mejorar el efecto ICL o de otras células (linfocitos citolíticos naturales [NK], etc.) de donantes, pero el uso todavía no es generalizado.
Otro método de administración terapéutica de la ICL es la interrupción rápida de la inmunodepresión después del TCMH. En algunos estudios se programan disminuciones progresivas más rápidas de la inmunodepresión de acuerdo con el tipo de donante (disminución más rápida con donantes emparentados que con donantes no emparentados debido al riesgo más bajo de EICH); en otros estudios se utilizan medidas sensibles de concentraciones bajas de células del receptor persistentes (quimerismo del receptor) o de enfermedad residual mínima para evaluar el riesgo de recaída y desencadenar una disminución rápida de la inmunodepresión.
En receptores de trasplantes que tienen LLA o LMA, se probó una combinación de interrupción temprana de la inmunodepresión después del TCMH y una ICL para prevenir la recaída de pacientes con riesgo alto de recaída debido al quimerismo persistente o progresivo del receptor.[12][Nivel de evidencia B4]; [13][Nivel de evidencia C2]
- Leucemia linfoblástica aguda: en un estudio se encontró un aumento del quimerismo del receptor en 46 de 101 pacientes de LLA. De los 46 pacientes, 31 se sometieron a interrupción de la inmunodepresión y algunos de ellos recibieron ILD cuando no se presentó EICH. Este grupo tuvo una tasa de supervivencia del 37 %, en comparación con el 0 % en los 15 pacientes que no se sometieron a este abordaje (P < 0,001).[14]
- Leucemia mieloide aguda: cerca del 20 % de los pacientes con LMA presentaron quimerismo mixto después del TCMH y se identificaron como de riesgo alto. De estos, el 54 % sobrevivió si se sometieron a interrupción de la inmunosupresión con ILD o sin ella; no hubo sobrevivientes entre los que no recibieron esta terapia.[15]
Otros abordajes inmunológicos y de terapia celular en evaluación
Función de la incompatibilidad del receptor inmunoglobulínico del linfocito citolítico natural en el trasplante de células madre hematopoyéticas
Se observó que la incompatibilidad de los linfocitos NK de un donante en el entorno posterior a un TCMH promueven los siguientes aspectos:[16-18]
- Incorporación del injerto.
- Disminución de la EICH.
- Reducción de las recaídas por neoplasias malignas hematológicas.
- Mejora de la supervivencia.
La función de los linfocitos NK se modula mediante interacciones entre varias familias de receptores, incluso los receptores inmunoglobulínicos de linfocitos NK (KIR) activadores e inhibidores. El efecto KIR en el entorno de un TCMH alogénico depende de la expresión de inhibidores específicos KIR en los linfocitos NK derivados del donante, y de la presencia o ausencia de sus moléculas de HLA compatibles de clase I (ligandos de KIR) en las células leucémicas y las células normales del receptor. En general, la presencia de ligandos de KIR específicos que interactúan con sus contrapartes moleculares inhibitorias de KIR previene que los linfocitos NK ataquen las células sanas. En el entorno de trasplantes alogénicos, las células leucémicas del receptor difieren genéticamente de los linfocitos NK del donante, y es posible que no tengan el ligando de KIR inhibitorio apropiado. La incompatibilidad entre el ligando y el receptor permite la destrucción de las células leucémicas del receptor por parte de linfocitos NK en el caso de ciertas combinaciones genéticas de donante y receptor.
La observación original de reducción de recaída con ciertas combinaciones de ligandos de KIR se realizó en el entorno de un trasplante haploidéntico con reducción de células T y fue más intensa después de un TCMH para la LMA.[17,19] Sin embargo, en algunos estudios de trasplante haploidéntico no se ha demostrado este efecto.[20] Junto con la reducción de la recaída, en estos estudios se indicó una disminución de la EICH con combinaciones apropiadas del ligando de KIR. En muchos estudios posteriores no se detectaron efectos en la supervivencia de un TCMH con incompatibilidad de KIR cuando se utilizaron métodos estándar de trasplante,[21-24] por lo que se concluyó que la reducción de células T quizá sea necesaria para eliminar otras formas de interacciones celulares inhibitorias.
Se indicó una disminución de la recaída y mejor supervivencia cuando entre donante y receptor hay incompatibilidad del ligando de KIR después de un TCMH de sangre de cordón umbilical (procedimiento con reducción relativa de células T).[25,26] En contraste con esta noción, en un estudio se demostró que algunas combinaciones con incompatibilidad de KIR (receptor activador KIR2DS con el ligando HLA C1) pueden conducir a una disminución de las recaídas de la LMA después de un TCMH sin reducción de células T.[27] La función de la incompatibilidad de KIR en el TCMH de donantes fraternos y en enfermedades diferentes a la LMA es objeto de polémica, pero en el ámbito de la pediatría al menos 2 grupos notificaron desenlaces superiores con tipos específicos de incompatibilidad de KIR en pacientes con LLA.[28-30]
Un reto actual relacionado con los estudios sobre KIR es que se han utilizado diferentes abordajes para identificar la incompatibilidad de KIR y determinar cuáles son las combinaciones de las moléculas KIR en los pares de donante y receptor.[19,31,32] Se ha demostrado que las moléculas KIR activadoras también contribuyen a este efecto.[33] La estandarización de la clasificación y los estudios prospectivos deberían ayudar a aclarar la utilidad e importancia de este abordaje. Debido a que un número limitado de centros realiza TCMH haploidénticos y a que los resultados de otros abordajes de TCMH son preliminares, la mayoría de los programas de trasplante no usan la incompatibilidad KIR como parte de su estrategia de elección de donantes. La compatibilidad de HLA total se considera el aspecto más importante para el desenlace; las consideraciones de incompatibilidad de KIR o la elección de donantes con características de activación de KIR favorables siguen siendo secundarias.
Trasplante de linfocitos citolíticos naturales
Las infusiones de linfocitos NK se han estudiado como método de tratamiento de pacientes de riesgo alto y para la consolidación de pacientes en remisión debido al bajo riesgo de EICH y su demostrada eficacia para reducir la recaída en los entornos posteriores a TCMH haploidénticos.
Evidencia (desenlaces de trasplante de linfocitos citolíticos naturales):
- Un grupo de la University of Minnesota comparó varios abordajes de diferentes poblaciones de linfocitos NK.[34]
- Al principio, en el estudio no se logró demostrar la eficacia de los linfocitos NK autógenos, pero encontró que un tratamiento inmunosupresor intensivo seguido de linfocitos NK haploidénticos purificados y mantenimiento con interleucina-2 (IL-2) condujo a la remisión en 5 de 19 pacientes con LMA de riesgo alto.
- Los investigadores del St. Jude Children Research Hospital trataron a 10 pacientes con LMA de riesgo intermedio que habían completado la quimioterapia y estaban en remisión con dosis más bajas de inmunodepresores seguidas de infusiones de linfocitos NK haploidénticos e IL-2 para la consolidación.[35]
- Se observó la expansión de los linfocitos NK en los 9 pares de donante y receptor con incompatibilidad de KIR.
- Los 10 niños permanecían en remisión a los 2 años.
- Está en marcha un estudio de seguimiento de fase II, así como muchas investigaciones sobre la terapia con linfocitos NK para algunos tipos de cáncer.
Si bien las tasas de supervivencia iniciales en esta cohorte de LMA de riesgo alto son buenas, serán necesarios estudios multicéntricos para confirmar y establecer la eficacia de estos tipos de abordajes con linfocitos NK.
- Otros investigadores han usado linfocitos NK expandidos o activados antes del TCMH y después de este.[36] En un abordaje en el que se usó un cultivo de linfocitos NK haploidénticos con IL-21 unido a membrana se demostró expansión notable y alta actividad. Estas células luego se infundieron al paciente justo antes de un TCMH haploidéntico y se administraron más infusiones los días 7 y 28 después del TCMH.[36]
Bibliografía
- Yeshurun M, Weisdorf D, Rowe JM, et al.: The impact of the graft-versus-leukemia effect on survival in acute lymphoblastic leukemia. Blood Adv 3 (4): 670-680, 2019. [PUBMED Abstract]
- Pulsipher MA, Langholz B, Wall DA, et al.: The addition of sirolimus to tacrolimus/methotrexate GVHD prophylaxis in children with ALL: a phase 3 Children's Oncology Group/Pediatric Blood and Marrow Transplant Consortium trial. Blood 123 (13): 2017-25, 2014. [PUBMED Abstract]
- Neudorf S, Sanders J, Kobrinsky N, et al.: Allogeneic bone marrow transplantation for children with acute myelocytic leukemia in first remission demonstrates a role for graft versus leukemia in the maintenance of disease-free survival. Blood 103 (10): 3655-61, 2004. [PUBMED Abstract]
- Boyiadzis M, Arora M, Klein JP, et al.: Impact of Chronic Graft-versus-Host Disease on Late Relapse and Survival on 7,489 Patients after Myeloablative Allogeneic Hematopoietic Cell Transplantation for Leukemia. Clin Cancer Res 21 (9): 2020-8, 2015. [PUBMED Abstract]
- Woods WG, Neudorf S, Gold S, et al.: A comparison of allogeneic bone marrow transplantation, autologous bone marrow transplantation, and aggressive chemotherapy in children with acute myeloid leukemia in remission. Blood 97 (1): 56-62, 2001. [PUBMED Abstract]
- Ribera JM, Ortega JJ, Oriol A, et al.: Comparison of intensive chemotherapy, allogeneic, or autologous stem-cell transplantation as postremission treatment for children with very high risk acute lymphoblastic leukemia: PETHEMA ALL-93 Trial. J Clin Oncol 25 (1): 16-24, 2007. [PUBMED Abstract]
- Gross TG, Hale GA, He W, et al.: Hematopoietic stem cell transplantation for refractory or recurrent non-Hodgkin lymphoma in children and adolescents. Biol Blood Marrow Transplant 16 (2): 223-30, 2010. [PUBMED Abstract]
- Pulsipher MA, Boucher KM, Wall D, et al.: Reduced-intensity allogeneic transplantation in pediatric patients ineligible for myeloablative therapy: results of the Pediatric Blood and Marrow Transplant Consortium Study ONC0313. Blood 114 (7): 1429-36, 2009. [PUBMED Abstract]
- Porter DL, Collins RH, Shpilberg O, et al.: Long-term follow-up of patients who achieved complete remission after donor leukocyte infusions. Biol Blood Marrow Transplant 5 (4): 253-61, 1999. [PUBMED Abstract]
- Levine JE, Barrett AJ, Zhang MJ, et al.: Donor leukocyte infusions to treat hematologic malignancy relapse following allo-SCT in a pediatric population. Bone Marrow Transplant 42 (3): 201-5, 2008. [PUBMED Abstract]
- Warlick ED, DeFor T, Blazar BR, et al.: Successful remission rates and survival after lymphodepleting chemotherapy and donor lymphocyte infusion for relapsed hematologic malignancies postallogeneic hematopoietic cell transplantation. Biol Blood Marrow Transplant 18 (3): 480-6, 2012. [PUBMED Abstract]
- Horn B, Petrovic A, Wahlstrom J, et al.: Chimerism-based pre-emptive immunotherapy with fast withdrawal of immunosuppression and donor lymphocyte infusions after allogeneic stem cell transplantation for pediatric hematologic malignancies. Biol Blood Marrow Transplant 21 (4): 729-37, 2015. [PUBMED Abstract]
- Horn B, Wahlstrom JT, Melton A, et al.: Early mixed chimerism-based preemptive immunotherapy in children undergoing allogeneic hematopoietic stem cell transplantation for acute leukemia. Pediatr Blood Cancer 64 (8): , 2017. [PUBMED Abstract]
- Bader P, Kreyenberg H, Hoelle W, et al.: Increasing mixed chimerism is an important prognostic factor for unfavorable outcome in children with acute lymphoblastic leukemia after allogeneic stem-cell transplantation: possible role for pre-emptive immunotherapy? J Clin Oncol 22 (9): 1696-705, 2004. [PUBMED Abstract]
- Rettinger E, Willasch AM, Kreyenberg H, et al.: Preemptive immunotherapy in childhood acute myeloid leukemia for patients showing evidence of mixed chimerism after allogeneic stem cell transplantation. Blood 118 (20): 5681-8, 2011. [PUBMED Abstract]
- Ruggeri L, Capanni M, Urbani E, et al.: Effectiveness of donor natural killer cell alloreactivity in mismatched hematopoietic transplants. Science 295 (5562): 2097-100, 2002. [PUBMED Abstract]
- Giebel S, Locatelli F, Lamparelli T, et al.: Survival advantage with KIR ligand incompatibility in hematopoietic stem cell transplantation from unrelated donors. Blood 102 (3): 814-9, 2003. [PUBMED Abstract]
- Bari R, Rujkijyanont P, Sullivan E, et al.: Effect of donor KIR2DL1 allelic polymorphism on the outcome of pediatric allogeneic hematopoietic stem-cell transplantation. J Clin Oncol 31 (30): 3782-90, 2013. [PUBMED Abstract]
- Ruggeri L, Mancusi A, Capanni M, et al.: Donor natural killer cell allorecognition of missing self in haploidentical hematopoietic transplantation for acute myeloid leukemia: challenging its predictive value. Blood 110 (1): 433-40, 2007. [PUBMED Abstract]
- Merli P, Algeri M, Galaverna F, et al.: TCRαβ/CD19 cell-depleted HLA-haploidentical transplantation to treat pediatric acute leukemia: updated final analysis. Blood 143 (3): 279-289, 2024. [PUBMED Abstract]
- Davies SM, Ruggieri L, DeFor T, et al.: Evaluation of KIR ligand incompatibility in mismatched unrelated donor hematopoietic transplants. Killer immunoglobulin-like receptor. Blood 100 (10): 3825-7, 2002. [PUBMED Abstract]
- Farag SS, Bacigalupo A, Eapen M, et al.: The effect of KIR ligand incompatibility on the outcome of unrelated donor transplantation: a report from the center for international blood and marrow transplant research, the European blood and marrow transplant registry, and the Dutch registry. Biol Blood Marrow Transplant 12 (8): 876-84, 2006. [PUBMED Abstract]
- Davies SM, Iannone R, Alonzo TA, et al.: A Phase 2 Trial of KIR-Mismatched Unrelated Donor Transplantation Using in Vivo T Cell Depletion with Antithymocyte Globulin in Acute Myelogenous Leukemia: Children's Oncology Group AAML05P1 Study. Biol Blood Marrow Transplant 26 (4): 712-717, 2020. [PUBMED Abstract]
- Verneris MR, Miller JS, Hsu KC, et al.: Investigation of donor KIR content and matching in children undergoing hematopoietic cell transplantation for acute leukemia. Blood Adv 4 (7): 1350-1356, 2020. [PUBMED Abstract]
- Cooley S, Trachtenberg E, Bergemann TL, et al.: Donors with group B KIR haplotypes improve relapse-free survival after unrelated hematopoietic cell transplantation for acute myelogenous leukemia. Blood 113 (3): 726-32, 2009. [PUBMED Abstract]
- Willemze R, Rodrigues CA, Labopin M, et al.: KIR-ligand incompatibility in the graft-versus-host direction improves outcomes after umbilical cord blood transplantation for acute leukemia. Leukemia 23 (3): 492-500, 2009. [PUBMED Abstract]
- Venstrom JM, Pittari G, Gooley TA, et al.: HLA-C-dependent prevention of leukemia relapse by donor activating KIR2DS1. N Engl J Med 367 (9): 805-16, 2012. [PUBMED Abstract]
- Leung W: Use of NK cell activity in cure by transplant. Br J Haematol 155 (1): 14-29, 2011. [PUBMED Abstract]
- Leung W, Campana D, Yang J, et al.: High success rate of hematopoietic cell transplantation regardless of donor source in children with very high-risk leukemia. Blood 118 (2): 223-30, 2011. [PUBMED Abstract]
- Oevermann L, Michaelis SU, Mezger M, et al.: KIR B haplotype donors confer a reduced risk for relapse after haploidentical transplantation in children with ALL. Blood 124 (17): 2744-7, 2014. [PUBMED Abstract]
- Leung W, Iyengar R, Triplett B, et al.: Comparison of killer Ig-like receptor genotyping and phenotyping for selection of allogeneic blood stem cell donors. J Immunol 174 (10): 6540-5, 2005. [PUBMED Abstract]
- Pulsipher MA, Ahn KW, Bunin NJ, et al.: KIR-favorable TCR-αβ/CD19-depleted haploidentical HCT in children with ALL/AML/MDS: primary analysis of the PTCTC ONC1401 trial. Blood 140 (24): 2556-2572, 2022. [PUBMED Abstract]
- Cooley S, Weisdorf DJ, Guethlein LA, et al.: Donor selection for natural killer cell receptor genes leads to superior survival after unrelated transplantation for acute myelogenous leukemia. Blood 116 (14): 2411-9, 2010. [PUBMED Abstract]
- Miller JS, Soignier Y, Panoskaltsis-Mortari A, et al.: Successful adoptive transfer and in vivo expansion of human haploidentical NK cells in patients with cancer. Blood 105 (8): 3051-7, 2005. [PUBMED Abstract]
- Rubnitz JE, Inaba H, Ribeiro RC, et al.: NKAML: a pilot study to determine the safety and feasibility of haploidentical natural killer cell transplantation in childhood acute myeloid leukemia. J Clin Oncol 28 (6): 955-9, 2010. [PUBMED Abstract]
- Ciurea SO, Schafer JR, Bassett R, et al.: Phase 1 clinical trial using mbIL21 ex vivo-expanded donor-derived NK cells after haploidentical transplantation. Blood 130 (16): 1857-1868, 2017. [PUBMED Abstract]
Opciones de tratamiento en evaluación clínica
La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación se presenta un ejemplo de un ensayo clínico nacional o institucional en curso:
- ASCT2031 (NCT05457556) (Mismatched Related Donor [Haplo] Versus Matched Unrelated Donor [MUD] Hematopoietic Stem Cell Transplantation [HSCT] for Children, Adolescents, and Young Adults with Acute Leukemia or Myelodysplastic Syndrome [MDS]): ensayo controlado aleatorizado de fase III en el que se compararán los desenlaces del trasplante de células madre hematopoyéticas (TCMH) de donante emparentado de cualquier sexo (haplo) y el TCMH de donante emparentado con compatibilidad (MUD) en pacientes con leucemias agudas o síndrome mielodisplásico. Los pacientes que disponen de ambas fuentes de donantes (MUD y haplo) se asignarán de manera aleatoria al Grupo A (TCMH haplo) o al Grupo B (TCMH MUD). La aleatorización se estratificará por edad del paciente, estado de remisión completa y tipo de enfermedad. Los pacientes que no disponen de ambos donantes (MUD y haplo), pero tienen un donante haplo, se asignarán al Grupo C y recibirán un TCMH haplo sin pasar por la aleatorización. Se espera que en el Grupo C se inscriba un mayor número de pacientes que pertenecen a minorías, porque es más frecuente que estos carezcan de donantes MUD que los pacientes blancos. Este tercer grupo permitirá hacer comparaciones directas entre los desenlaces del TCMH haplo en pacientes pertenecientes a minorías y en pacientes blancos.
Los criterios de valoración clínica, enfermedad de injerto contra huésped (EICH) grave y supervivencia sin enfermedad (SSE) en el TCMH haplo versus el TCMH MUD, se compararán como objetivos coprimarios. La hipótesis mantiene que la incidencia de EICH grave será menor en el TCMH haplo que en el TCMH MUD y que la SSE no será inferior en el TCMH haplo.
Actualizaciones más recientes a este resumen (06/12/2024)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este resumen.
El Consejo editorial del PDQ sobre el tratamiento pediátrico es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el uso del trasplante alogénico de células madre hematopoyéticas para el tratamiento de cánceres infantiles. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento pediátrico, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Trasplante alogénico de células madre hematopoyéticas en pediatría son:
- Thomas G. Gross, MD, PhD (National Cancer Institute)
- Michael A. Pulsipher, MD (Huntsman Cancer Institute at University of Utah)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento pediátrico emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento pediátrico. PDQ Trasplante alogénico de células madre hematopoyéticas en pediatría. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/infantil/trasplante-celulas-madre-pro/alogenico. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.