Tratamiento del carcinoma de células de Merkel (PDQ®)–Versión para profesionales de salud
Información general sobre el carcinoma de células de Merkel
El carcinoma de células de Merkel (CCM) fue descrito por primera vez por Toker en 1972 como carcinoma trabecular de la piel.[1] Otros nombres del CCM son tumor de Toker, carcinoma primario de células pequeñas de piel, tumor neuroendocrino cutáneo primario, tumor neuroendocrino primario de piel y tricodiscoma maligno.[2]
El CCM es un carcinoma neuroendocrino de crecimiento rápido que aparece en la unión dermoepidérmica (consultar la Figura 1) y es la segunda causa más común de muerte por cáncer de piel después del melanoma.[3,4] Aunque el origen exacto y la función de las células de Merkel está en investigación, se piensa que tienen características tanto de origen epitelial como neuroendocrino y que surgen de células con función de sensibilidad al tacto (mecanorreceptores).[5-11]
Históricamente, las opciones de tratamiento para los pacientes con enfermedad en estadio avanzado han sido limitadas; no obstante, los nuevos abordajes de inmunoterapia producen respuestas duraderas.[12]
Características anatómicas

Incidencia y mortalidad
La incidencia del CCM aumenta de forma progresiva con la edad. Se han notificado pocos casos en pacientes menores de 50 años y la mediana de edad en el momento del diagnóstico es de alrededor de 65 años (consultar la Figura 2).[13] La incidencia es considerablemente mayor en las personas blancas que en las personas negras y es ligeramente mayor en hombres que en mujeres.[13-17]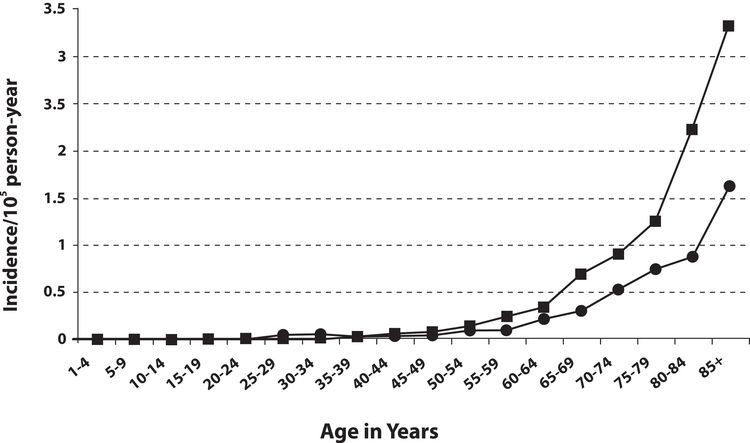
El CCM se presenta con mayor frecuencia en áreas de la piel expuestas al sol; en particular, la cabeza y el cuello, seguido por las extremidades y luego, el tronco.[5,16,18] Se notificó una incidencia mayor en regiones geográficas con índices más altos de radiación ultravioleta B en la luz solar.[16]
En 2013, se notificó que el CCM tuvo una incidencia anual de 0,7 casos por 100 000 personas en los Estados Unidos.[19] La incidencia ha aumentado en las últimas décadas, casi se duplicó entre 2000 y 2013 en los Estados Unidos. Este aumento se relaciona posiblemente con herramientas de diagnóstico patológico más exactas, una mejor conciencia clínica del CCM, una población que envejece, una mayor exposición al sol en poblaciones susceptibles, y mejores herramientas de registro. La incidencia también es más alta en poblaciones con inmunodepresión (infección por elvirus de la inmunodeficiencia humana [VIH], neoplasias malignas hematológicas, medicamentos inmunodepresores, etc.).[20] Desde el año 2000, se han registrado cerca de 25 000 casos de CCM en los Estados Unidos, incluso más de 2200 casos nuevos notificados en 2014 a los registros combinados del National Program of Cancer Registries y el SEER, en los que se capturan más del 98 % de casos en la población de los Estados Unidos y los 10 sitios más comunes de CCM (consultar el Cuadro 1).[17]
| Localización anatómica | Casos (%) |
|---|---|
| SAI = sin otra indicación; SEER = Surveillance, Epidemiology, and End Results Program. | |
| aAlbores-Saavedra J et al: Merkel cell carcinoma demographics, morphology, and survival based on 3,870 cases: A population-based study. J Cutan Pathol. Reproducción autorizada. © 2009 Publicado por Wiley-Blackwell. Todos los derechos reservados.[17] | |
| Piel, cara | 1041 (26,9) |
| Piel de miembro superior y hombro | 853 (22,0) |
| Piel de miembro inferior y cadera | 578 (14,9) |
| Piel del tronco | 410 (10,6) |
| Piel de cuero cabelludo y cuello | 348 (9,0) |
| Piel, SAI | 234 (6,0) |
| Oído externo | 120 (3,1) |
| Párpado | 98 (2,5) |
| Piel del labio | 91 (2,4) |
| Sitio primario desconocido | 31 (0,8) |
| Total | 3804 (98,3) |
En varias series de casos, hasta el 97 % de los CCM aparecen en la piel. Los CCM primarios en otras localizaciones fueron muy poco frecuentes, así como los CCM de sitio primario desconocido.[17]
En los datos del registro SEER se observó un exceso en el riesgo de CCM como primero o segundo cáncer en pacientes con varios cánceres primarios.[21] En los registros nacionales del cáncer de tres países escandinavos se identificaron varios segundos cánceres diagnosticados después de un CCM.[22]
Patogenia
Se ha observado un aumento de la incidencia de CCM en personas tratadas por psoriasis con dosis altas de metoxaleno (psoraleno) y radiación ultravioleta A (PUVA) (3 de 1380 pacientes, un 0,2 %). Esto también se ha observado en personas con depresión inmunitaria crónica, en especial, por leucemia linfocítica crónica, infección por el VIH y trasplante previo de un órgano sólido.[16,23]
En 2008, se notificó por primera vez un poliomavirus nuevo (poliomavirus de células de Merkel, [MCPyV]) en muestras tumorales de CCM [24], un hallazgo que se confirmó después en otros laboratorios.[25-27] También se dio cuenta de índices altos de ADN vírico e integración clonal del virus en tumores de CCM [28] junto con la expresión de ciertos antígenos virales en las células de CCM y la presencia de anticuerpos antivirales. No todos los casos de CCM estan relacionados con la infección por MCPyV.[29]
Se detectaron índices muy bajos de MCPyV en la piel normal distante del tumor primario de un CCM en un porcentaje significativo de pacientes con trastornos cutáneos no relacionados con el CCM, en la piel con apariencia normal de personas sanas y en cánceres de piel no melanoma en personas con depresión inmunitaria.[10,30-32] Se han utilizado varios métodos para identificar y cuantificar la presencia del MCPyV en las muestras tumorales de CCM, otras muestras no tumorales, así como en la sangre, la orina y otros tejidos.[33,34]
La importancia de los nuevos hallazgos sobre el MCPyV permanece incierta. El significado pronóstico de la carga viral, las concentraciones de los títulos de anticuerpos y la función de inmunodepresión subyacente en las personas portadoras de este virus (debido a enfermedades y medicamentos) siguen en investigación.
La prevalencia del MCPyV difiere entre los pacientes con CCM de los Estados Unidos y Europa en oposición con Australia. Es posible que hayan dos vías independientes para el surgimiento del CCM: una que es impulsada por la presencia del MCPyV y otra impulsada principalmente por el daño solar, en especial, según se observó en los pacientes de series australianas.[25,29,35]
Aunque no se ha identificado un marcador único para el CCM, se informó de una variedad de marcadores moleculares y citogenéticos del CCM.[7,10,36]
Presentación clínica
El CCM se presenta por lo general como un nódulo dérmico solitario, indoloro, endurecido, de color ligeramente eritematoso a violeta intenso y, con poca frecuencia, ulcerado. El CCM puede infiltrar localmente a través de los vasos linfáticos dérmicos, lo que da lugar a múltiples lesiones satélite. Debido a su apariencia clínica inespecífica, pocas veces se presume la presencia de CCM antes de realizar una biopsia.[5] Las fotos de las lesiones de la piel a causa del CCM ilustran su variabilidad clínica.[37]
Se propuso la siguiente fórmula nemotécnica en inglés para resumir las características clínicas del CCM:[18]
AEIOU
- A = asymptomatic (asintomático).
- E = expanding rapidly (expansión rápida).
- I = immune suppressed (inmunodepresión).
- O = older than 50 years (mayor de 50 años).
- U = UV-exposed skin (piel expuesta a rayos ultravioleta).
No todos los pacientes cuentan con todos los elementos de esta fórmula mnemónica; sin embargo, el 89 % de los pacientes cumplieron con 3 o más criterios, el 52 % cumplieron con 4 o más criterios y 7 % cumplieron con los 5 criterios.[18]
Evaluación clínica inicial
Debido a que la diseminación locorregional es común, los pacientes con diagnóstico reciente de CCM necesitan un examen físico cuidadoso que incluya la búsqueda de lesiones satélite y compromiso ganglionar regional.
Las pruebas con imágenes se adaptan de acuerdo con el cuadro clínico y se deben considerar todos los signos y síntomas relevantes. No se ha realizado un estudio sistemático de las pruebas con imágenes óptimas para los pacientes con diagnóstico reciente ni está claro si todos estos pacientes, en especial, aquellos con tumores primarios más pequeños, se benefician de imágenes detalladas.
Si se realizan pruebas con imágenes, estas tal vez incluyan una tomografía computarizada (TC) del tórax y el abdomen para descartar un cáncer primario de células pequeñas de pulmón, así como metástasis a distancia y regionales. A veces también se recomiendan estudios con imágenes diseñados para evaluar los signos y síntomas sospechosos. En una serie, las TC rindieron una tasa de falsos negativos del 80 % para las metástasis regionales.[38] Las presentaciones clínicas en la cabeza y el cuello tal vez exijan pruebas con imágenes adicionales. Si bien se han utilizado las imágenes por resonancia magnética para evaluar un CCM, estas no se han estudiado de manera sistemática.[39] Los resultados de tomografías por emisión de positrones con flúor F 18-fluorodesoxiglucosa se notificaron en determinados casos.[40,41] Se han recomendado exámenes rutinarios de sangre al inicio, pero no se estudiaron de manera sistemática. No se conocen marcadores tumorales circulantes específicos para el CCM.
Resultados de la estadificación inicial
De acuerdo con las series de casos retrospectivos notificados en el transcurso de varias décadas, los resultados de la estadificación clínica inicial de un CCM varían mucho en la literatura. De los cánceres invasivos, el 48,6 % tenían invasión local, el 31,1 % tenían invasión regional y el 8,2 % tenían invasión a distancia.[17]
El CCM que se manifiesta en ganglios regionales sin una lesión primaria identificable se encuentra en una minoría de pacientes y el porcentaje de estos casos varía en las series notificadas. Los tumores sin una lesión primaria identificable se atribuyeron a una regresión espontánea del tumor primario o a un carcinoma neuroendocrino metastásico de sitio oculto en la exploración clínica.[8,17,18,42,43]
Progresión clínica
En un análisis de pacientes de 18 series de casos, 279 de 926 pacientes (30,1 %) presentaron recidiva local durante el seguimiento, excepto aquellos que presentaron al inicio una enfermedad metastásica a distancia. Estos casos se atribuyeron normalmente a márgenes quirúrgicos inadecuados o a la falta de radioterapia adyuvante. Además, 545 de 982 pacientes (55,5 %) tenían metástasis en los ganglios linfáticos en el momento del diagnóstico o durante el seguimiento.[8]
En el mismo análisis de 18 series de casos, los sitios más comunes de metástasis a distancia fueron los ganglios linfáticos distantes (60,1 %), una parte distante de la piel (30,3 %), el pulmón (23,4 %), el sistema nervioso central (18,4 %) y el hueso (15,2 %).[8] También se notificaron muchos otros sitios de enfermedad y la distribución de sitios metastásicos varía en las series de casos.
En una serie de 237 pacientes que se presentaron al inicio con enfermedad local o regional, la mediana de tiempo hasta la recidiva fue de 9 meses (intervalo, 2–70 meses). Noventa y uno por ciento de las recidivas se presentaron dentro de los 2 años a partir del diagnóstico.[44]
Posibles factores pronósticos
El grado de diseminación de la enfermedad en el momento de la presentación inicial quizás proporcione el cálculo más útil para pronóstico.[7]
Los procedimientos diagnósticos, como la biopsia del ganglio linfático centinela, quizás ayuden a diferenciar la enfermedad local y regional en el momento de la presentación inicial. Un tercio de los pacientes que carecen de ganglios clínicamente palpables o radiológicamente visibles tendrán enfermedad regional evidente en el microscopio.[38] Es posible que el compromiso ganglionar sea mucho más bajo en los pacientes con tumores pequeños (por ejemplo, ≤1,0 cm).[45]
En muchos estudios retrospectivos se evaluó la relación entre una variedad amplia de factores biológicos e histológicos con la supervivencia y el control locorregional.[7,8,17,38,44,46-57][Nivel de evidencia C2] En muchos de estos informes hay confusión por números pequeños, posible sesgo de selección, sesgo de verificación, seguimiento corto, carencia de un protocolo clínico uniforme tanto para la estadificación como para el tratamiento, y falta de potencia para detectar diferencias moderadas.
En un estudio retrospectivo amplio de una sola institución se evaluaron los factores histológicos potencialmente relacionados con el pronóstico de 156 pacientes con CCM durante una mediana de seguimiento de 51 meses (intervalo, 2–224 meses).[55][Nivel de evidencia C1] Aunque este informe estuvo sujeto al posible sesgo de selección y al sesgo de verificación, tanto en el análisis univariante como en el multivariante se observó una relación entre una mejor supervivencia por causa específica y un patrón de crecimiento circunscrito versus un tumor de poca profundidad con patrón infiltrante versus un tumor de gran profundidad sin invasión linfovascular versus la presencia de invasión linfovascular. La adopción de estos resultados en un algoritmo pronóstico general, aguarda la confirmación independiente por medio de estudios con potencia adecuada.
En un estudio realizado en 2009 se investigó si la presencia del MCPyV recién identificado en muestras tumorales de CCM influyó en los desenlaces clínicos de 114 pacientes con CCM en Finlandia. En este pequeño estudio, los pacientes cuyos tumores exhibieron positividad para el MCPyV presentaron una mejor supervivencia que los pacientes cuyos tumores exhibieron negatividad para el MCPyV.[58][Nivel de evidencia C2] Se necesita estandarización de los procedimientos para identificar y cuantificar el MCPyV y los anticuerpos relevantes a fin de mejorar el entendimiento de los aspectos pronósticos y epidemiológicos.[10]
Pronóstico
Los parámetros más importantes para el pronóstico del CCM son el tamaño del tumor y la presencia de metástasis locorregionales o a distancia. Estos factores constituyen la base del sistema de estadificación del American Joint Committee on Cancer para el CCM.[59,60] Si bien el tamaño del tumor primario en aumento se correlaciona con un mayor riesgo de enfermedad metastásica, los tumores del CCM de cualquier tamaño suponen un riesgo significativo de metástasis oculta; ello apoya el uso de la biopsia de ganglio linfático centinela para todos los casos.[61] Es posible que otras características del tumor primario, como la invasión linfovascular y el modelo de crecimiento del tumor, también tengan significación pronóstica. La enfermedad ganglionar clínicamente detectable se relaciona con un desenlace peor que el que se presenta con metástasis microscópicas.[55,59] Otros hallazgos vinculados con un pronóstico más precario es el compromiso dispuesto en láminas en las metástasis ganglionares y un número creciente de ganglios linfáticos metastásicos.[60,62]
El grueso de la bibliografía sobre el CCM corresponde a series de casos pequeñas sujetas a muchos factores de confusión. Por esta razón, las tasas de recaída y supervivencia por estadio de las que se tienen informes varían mucho en la bibliografía. En general, la enfermedad en los estadios más bajos se relaciona con una mejor supervivencia general.[63]. Para obtener más información consultar la sección Posibles factores pronósticos.
En un informe se notificó que los desenlaces clínicos de pacientes que presentan al inicio una enfermedad local de volumen pequeño y ganglios linfáticos sin compromiso tumoral confirmados mediante estudio patológico tienen una tasa de supervivencia por causa específica a 5 años superior al 90 %.[44,55][Nivel de evidencia C2]
En un resumen tabulado de los resultados de 12 series de tratamiento del CCM se ilustra la dificultad de comparar los datos de los resultados entre las series.[7]
En la Figura 3 se resumen los datos de supervivencia por estadio para el CCM (1973–2006) según el sistema de estadificación del CCM del registro del SEER adoptado en 1973.[17]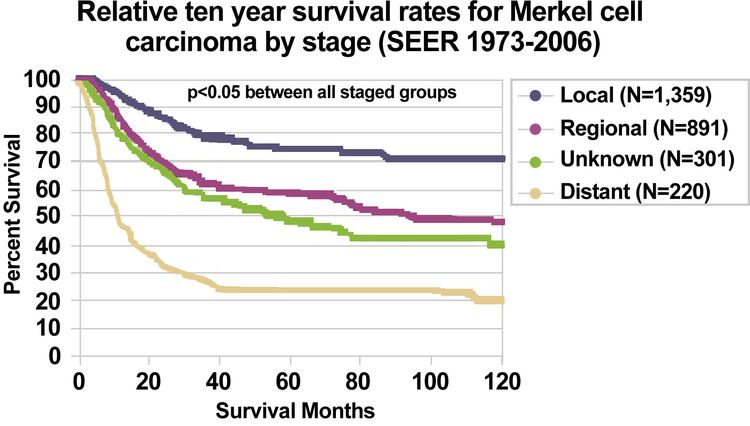
Bibliografía
- Toker C: Trabecular carcinoma of the skin. Arch Dermatol 105 (1): 107-10, 1972. [PUBMED Abstract]
- Schwartz RA, Lambert WC: The Merkel cell carcinoma: a 50-year retrospect. J Surg Oncol 89 (1): 5, 2005. [PUBMED Abstract]
- Agelli M, Clegg LX, Becker JC, et al.: The etiology and epidemiology of merkel cell carcinoma. Curr Probl Cancer 34 (1): 14-37, 2010 Jan-Feb. [PUBMED Abstract]
- Harms PW: Update on Merkel Cell Carcinoma. Clin Lab Med 37 (3): 485-501, 2017. [PUBMED Abstract]
- Nghiem P, McKee PH, Haynes HA: Merkel cell (cutaneous neuroendocrine) carcinoma. In: Sober AJ, Haluska FG, eds.: Skin Cancer. BC Decker Inc., 2001, pp 127-141.
- Nghiem P, James N: Merkel cell carcinoma. In: Wolff K, Goldsmith LA, Katz SI, et al., eds.: Fitzpatrick's Dermatology in General Medicine. 7th ed. McGraw-Hill , 2008, pp 1087-94.
- Eng TY, Boersma MG, Fuller CD, et al.: A comprehensive review of the treatment of Merkel cell carcinoma. Am J Clin Oncol 30 (6): 624-36, 2007. [PUBMED Abstract]
- Medina-Franco H, Urist MM, Fiveash J, et al.: Multimodality treatment of Merkel cell carcinoma: case series and literature review of 1024 cases. Ann Surg Oncol 8 (3): 204-8, 2001. [PUBMED Abstract]
- Busse PM, Clark JR, Muse VV, et al.: Case records of the Massachusetts General Hospital. Case 19-2008. A 63-year-old HIV-positive man with cutaneous Merkel-cell carcinoma. N Engl J Med 358 (25): 2717-23, 2008. [PUBMED Abstract]
- Rockville Merkel Cell Carcinoma Group: Merkel cell carcinoma: recent progress and current priorities on etiology, pathogenesis, and clinical management. J Clin Oncol 27 (24): 4021-6, 2009. [PUBMED Abstract]
- Calder KB, Smoller BR: New insights into merkel cell carcinoma. Adv Anat Pathol 17 (3): 155-61, 2010. [PUBMED Abstract]
- Cassler NM, Merrill D, Bichakjian CK, et al.: Merkel Cell Carcinoma Therapeutic Update. Curr Treat Options Oncol 17 (7): 36, 2016. [PUBMED Abstract]
- Agelli M, Clegg LX: Epidemiology of primary Merkel cell carcinoma in the United States. J Am Acad Dermatol 49 (5): 832-41, 2003. [PUBMED Abstract]
- Hodgson NC: Merkel cell carcinoma: changing incidence trends. J Surg Oncol 89 (1): 1-4, 2005. [PUBMED Abstract]
- Young JL, Ward KC, Ries LAG: Cancer of rare sites. In: Ries LAG, Young JL, Keel GE, et al., eds.: SEER Survival Monograph: Cancer Survival Among Adults: U. S. SEER Program, 1988-2001, Patient and Tumor Characteristics. National Cancer Institute, 2007. NIH Pub. No. 07-6215, pp 251-61.
- Miller RW, Rabkin CS: Merkel cell carcinoma and melanoma: etiological similarities and differences. Cancer Epidemiol Biomarkers Prev 8 (2): 153-8, 1999. [PUBMED Abstract]
- Albores-Saavedra J, Batich K, Chable-Montero F, et al.: Merkel cell carcinoma demographics, morphology, and survival based on 3870 cases: a population based study. J Cutan Pathol 37 (1): 20-7, 2010. [PUBMED Abstract]
- Heath M, Jaimes N, Lemos B, et al.: Clinical characteristics of Merkel cell carcinoma at diagnosis in 195 patients: the AEIOU features. J Am Acad Dermatol 58 (3): 375-81, 2008. [PUBMED Abstract]
- Paulson KG, Park SY, Vandeven NA, et al.: Merkel cell carcinoma: Current US incidence and projected increases based on changing demographics. J Am Acad Dermatol 78 (3): 457-463.e2, 2018. [PUBMED Abstract]
- Ma JE, Brewer JD: Merkel cell carcinoma in immunosuppressed patients. Cancers (Basel) 6 (3): 1328-50, 2014. [PUBMED Abstract]
- Howard RA, Dores GM, Curtis RE, et al.: Merkel cell carcinoma and multiple primary cancers. Cancer Epidemiol Biomarkers Prev 15 (8): 1545-9, 2006. [PUBMED Abstract]
- Bzhalava D, Bray F, Storm H, et al.: Risk of second cancers after the diagnosis of Merkel cell carcinoma in Scandinavia. Br J Cancer 104 (1): 178-80, 2011. [PUBMED Abstract]
- Lunder EJ, Stern RS: Merkel-cell carcinomas in patients treated with methoxsalen and ultraviolet A radiation. N Engl J Med 339 (17): 1247-8, 1998. [PUBMED Abstract]
- Feng H, Shuda M, Chang Y, et al.: Clonal integration of a polyomavirus in human Merkel cell carcinoma. Science 319 (5866): 1096-100, 2008. [PUBMED Abstract]
- Garneski KM, Warcola AH, Feng Q, et al.: Merkel cell polyomavirus is more frequently present in North American than Australian Merkel cell carcinoma tumors. J Invest Dermatol 129 (1): 246-8, 2009. [PUBMED Abstract]
- Becker JC, Houben R, Ugurel S, et al.: MC polyomavirus is frequently present in Merkel cell carcinoma of European patients. J Invest Dermatol 129 (1): 248-50, 2009. [PUBMED Abstract]
- Kassem A, Schöpflin A, Diaz C, et al.: Frequent detection of Merkel cell polyomavirus in human Merkel cell carcinomas and identification of a unique deletion in the VP1 gene. Cancer Res 68 (13): 5009-13, 2008. [PUBMED Abstract]
- Houben R, Schrama D, Becker JC: Molecular pathogenesis of Merkel cell carcinoma. Exp Dermatol 18 (3): 193-8, 2009. [PUBMED Abstract]
- Paik JY, Hall G, Clarkson A, et al.: Immunohistochemistry for Merkel cell polyomavirus is highly specific but not sensitive for the diagnosis of Merkel cell carcinoma in the Australian population. Hum Pathol 42 (10): 1385-90, 2011. [PUBMED Abstract]
- Andres C, Belloni B, Puchta U, et al.: Prevalence of MCPyV in Merkel cell carcinoma and non-MCC tumors. J Cutan Pathol 37 (1): 28-34, 2010. [PUBMED Abstract]
- Kassem A, Technau K, Kurz AK, et al.: Merkel cell polyomavirus sequences are frequently detected in nonmelanoma skin cancer of immunosuppressed patients. Int J Cancer 125 (2): 356-61, 2009. [PUBMED Abstract]
- Foulongne V, Dereure O, Kluger N, et al.: Merkel cell polyomavirus DNA detection in lesional and nonlesional skin from patients with Merkel cell carcinoma or other skin diseases. Br J Dermatol 162 (1): 59-63, 2010. [PUBMED Abstract]
- DeCaprio JA: Does detection of Merkel cell polyomavirus in Merkel cell carcinoma provide prognostic information? J Natl Cancer Inst 101 (13): 905-7, 2009. [PUBMED Abstract]
- Laude HC, Jonchère B, Maubec E, et al.: Distinct merkel cell polyomavirus molecular features in tumour and non tumour specimens from patients with merkel cell carcinoma. PLoS Pathog 6 (8): , 2010. [PUBMED Abstract]
- Buck CB, Lowy DR: Immune readouts may have prognostic value for the course of merkel cell carcinoma, a virally associated disease. J Clin Oncol 29 (12): 1506-8, 2011. [PUBMED Abstract]
- Lemos B, Nghiem P: Merkel cell carcinoma: more deaths but still no pathway to blame. J Invest Dermatol 127 (9): 2100-3, 2007. [PUBMED Abstract]
- Seattle Cancer Care Alliance: Merkel Cell Carcinoma Information for Patients and Their Physicians: Clinical Photos/Images. Seattle, Wa: Seattle Cancer Care Alliance Skin Oncology Clinic, 2009. Available online. Last accessed May 9, 2025.
- Gupta SG, Wang LC, Peñas PF, et al.: Sentinel lymph node biopsy for evaluation and treatment of patients with Merkel cell carcinoma: The Dana-Farber experience and meta-analysis of the literature. Arch Dermatol 142 (6): 685-90, 2006. [PUBMED Abstract]
- Anderson SE, Beer KT, Banic A, et al.: MRI of merkel cell carcinoma: histologic correlation and review of the literature. AJR Am J Roentgenol 185 (6): 1441-8, 2005. [PUBMED Abstract]
- Iagaru A, Quon A, McDougall IR, et al.: Merkel cell carcinoma: Is there a role for 2-deoxy-2-[f-18]fluoro-D-glucose-positron emission tomography/computed tomography? Mol Imaging Biol 8 (4): 212-7, 2006 Jul-Aug. [PUBMED Abstract]
- Belhocine T, Pierard GE, Frühling J, et al.: Clinical added-value of 18FDG PET in neuroendocrine-merkel cell carcinoma. Oncol Rep 16 (2): 347-52, 2006. [PUBMED Abstract]
- Missotten GS, de Wolff-Rouendaal D, de Keizer RJ: Merkel cell carcinoma of the eyelid review of the literature and report of patients with Merkel cell carcinoma showing spontaneous regression. Ophthalmology 115 (1): 195-201, 2008. [PUBMED Abstract]
- Richetta AG, Mancini M, Torroni A, et al.: Total spontaneous regression of advanced merkel cell carcinoma after biopsy: review and a new case. Dermatol Surg 34 (6): 815-22, 2008. [PUBMED Abstract]
- Allen PJ, Bowne WB, Jaques DP, et al.: Merkel cell carcinoma: prognosis and treatment of patients from a single institution. J Clin Oncol 23 (10): 2300-9, 2005. [PUBMED Abstract]
- Stokes JB, Graw KS, Dengel LT, et al.: Patients with Merkel cell carcinoma tumors < or = 1.0 cm in diameter are unlikely to harbor regional lymph node metastasis. J Clin Oncol 27 (23): 3772-7, 2009. [PUBMED Abstract]
- Jabbour J, Cumming R, Scolyer RA, et al.: Merkel cell carcinoma: assessing the effect of wide local excision, lymph node dissection, and radiotherapy on recurrence and survival in early-stage disease--results from a review of 82 consecutive cases diagnosed between 1992 and 2004. Ann Surg Oncol 14 (6): 1943-52, 2007. [PUBMED Abstract]
- Henness S, Vereecken P: Management of Merkel tumours: an evidence-based review. Curr Opin Oncol 20 (3): 280-6, 2008. [PUBMED Abstract]
- Skelton HG, Smith KJ, Hitchcock CL, et al.: Merkel cell carcinoma: analysis of clinical, histologic, and immunohistologic features of 132 cases with relation to survival. J Am Acad Dermatol 37 (5 Pt 1): 734-9, 1997. [PUBMED Abstract]
- Sandel HD, Day T, Richardson MS, et al.: Merkel cell carcinoma: does tumor size or depth of invasion correlate with recurrence, metastasis, or patient survival? Laryngoscope 116 (5): 791-5, 2006. [PUBMED Abstract]
- Llombart B, Monteagudo C, López-Guerrero JA, et al.: Clinicopathological and immunohistochemical analysis of 20 cases of Merkel cell carcinoma in search of prognostic markers. Histopathology 46 (6): 622-34, 2005. [PUBMED Abstract]
- Senchenkov A, Barnes SA, Moran SL: Predictors of survival and recurrence in the surgical treatment of merkel cell carcinoma of the extremities. J Surg Oncol 95 (3): 229-34, 2007. [PUBMED Abstract]
- Goldberg SR, Neifeld JP, Frable WJ: Prognostic value of tumor thickness in patients with Merkel cell carcinoma. J Surg Oncol 95 (8): 618-22, 2007. [PUBMED Abstract]
- Heath ML, Nghiem P: Merkel cell carcinoma: if no breslow, then what? J Surg Oncol 95 (8): 614-5, 2007. [PUBMED Abstract]
- Tai P: Merkel cell cancer: update on biology and treatment. Curr Opin Oncol 20 (2): 196-200, 2008. [PUBMED Abstract]
- Andea AA, Coit DG, Amin B, et al.: Merkel cell carcinoma: histologic features and prognosis. Cancer 113 (9): 2549-58, 2008. [PUBMED Abstract]
- Paulson KG, Iyer JG, Tegeder AR, et al.: Transcriptome-wide studies of merkel cell carcinoma and validation of intratumoral CD8+ lymphocyte invasion as an independent predictor of survival. J Clin Oncol 29 (12): 1539-46, 2011. [PUBMED Abstract]
- Fields RC, Busam KJ, Chou JF, et al.: Recurrence and survival in patients undergoing sentinel lymph node biopsy for merkel cell carcinoma: analysis of 153 patients from a single institution. Ann Surg Oncol 18 (9): 2529-37, 2011. [PUBMED Abstract]
- Sihto H, Kukko H, Koljonen V, et al.: Clinical factors associated with Merkel cell polyomavirus infection in Merkel cell carcinoma. J Natl Cancer Inst 101 (13): 938-45, 2009. [PUBMED Abstract]
- Harms KL, Healy MA, Nghiem P, et al.: Analysis of Prognostic Factors from 9387 Merkel Cell Carcinoma Cases Forms the Basis for the New 8th Edition AJCC Staging System. Ann Surg Oncol 23 (11): 3564-3571, 2016. [PUBMED Abstract]
- Iyer JG, Storer BE, Paulson KG, et al.: Relationships among primary tumor size, number of involved nodes, and survival for 8044 cases of Merkel cell carcinoma. J Am Acad Dermatol 70 (4): 637-643, 2014. [PUBMED Abstract]
- Schwartz JL, Griffith KA, Lowe L, et al.: Features predicting sentinel lymph node positivity in Merkel cell carcinoma. J Clin Oncol 29 (8): 1036-41, 2011. [PUBMED Abstract]
- Ko JS, Prieto VG, Elson PJ, et al.: Histological pattern of Merkel cell carcinoma sentinel lymph node metastasis improves stratification of Stage III patients. Mod Pathol 29 (2): 122-30, 2016. [PUBMED Abstract]
- Eng TY, Boersma MG, Fuller CD, et al.: Treatment of merkel cell carcinoma. Am J Clin Oncol 27 (5): 510-5, 2004. [PUBMED Abstract]
Clasificación celular del carcinoma de células de Merkel
Aunque el origen y la función exactas de las células de Merkel permanecen bajo investigación, se piensa que tienen características de origen tanto epitelial como neuroendocrino y que surgen de células con función de sensibilidad al tacto (mecanorreceptores).[1-4]
Las características histopatológicas incluyen gránulos neurosecretores en el citoplasma con centros densos detectados mediante microscopia electrónica y análisis inmunohistoquímico con citoqueratina 20 (consultar la Figura 4).[5]
Un panel de reactivos inmunitarios (consultar la Figura 4) permite distinguir el carcinoma de células de Merkel (CCM) y otros tumores de apariencia semejante, como el carcinoma neuroendocrino del pulmón (es decir, carcinoma de células pequeñas), el linfoma, el tumor neuroectodérmico primitivo periférico, el tumor carcinoide metastásico y el melanoma de células pequeñas.[5]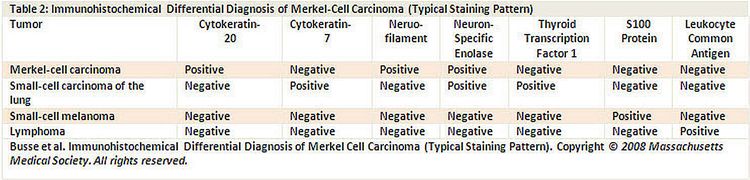
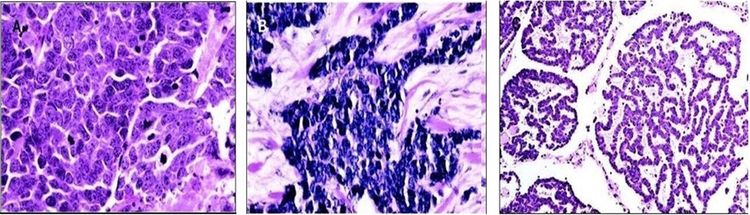
Desde el punto de vista histológico, el CCM se clasificó en tres subtipos diferentes:[6-9]
- Trabecular: estructura clásica, tipo de célula grande, densidad alta o gránulos detectados mediante examen ecográfico.
- Intermedio: estructura sólida (más común).
- Células pequeñas: difuso, pocos gránulos de densidad alta detectados mediante examen ecográfico (segundo tipo más común).
Son comunes las mezclas de variantes.[6-8] Pese a que en algunas series de casos retrospectivos pequeñas se indicaron correlaciones entre ciertas características histológicas y el desenlace, la evidencia siguen siendo incierta.[10-12]
Un grupo indicó una lista de 12 elementos que se deberían describir en los informes patológicos de las lesiones primarias resecadas y 9 elementos que se describen en los informes de patología de los ganglios linfáticos centinela. La importancia pronóstica de estos elementos no ha sido validada de forma prospectiva.[13]
Si los siguientes datos quedan registrados para cada paciente con CCM, se puede estadificar a cualquier paciente con el sistema de estadificación disponible o con un nuevo sistema de estadificación:
- Tamaño del tumor primario (dimensión patológica o clínica máxima en centímetros).
- Presencia o ausencia de invasión tumoral primaria en el hueso, el músculo, la fascia o el cartílago.
- Presencia o ausencia de metástasis ganglionares.
- Método usado en la evaluación del estado del compromiso ganglionar (examen clínico o patológico).
- Presencia o ausencia de metástasis a distancia.
El College of American Pathologists publicó un protocolo para el examen de muestras de pacientes con CCM de la piel.[14]
Para obtener más información, consultar la sección Información sobre los estadios del carcinoma de células de Merkel.
Las variantes histológicas del CCM se presentan en la Figura 5.[15]
Bibliografía
- Nghiem P, McKee PH, Haynes HA: Merkel cell (cutaneous neuroendocrine) carcinoma. In: Sober AJ, Haluska FG, eds.: Skin Cancer. BC Decker Inc., 2001, pp 127-141.
- Bichakjian CK, Nghiem P, Johnson T, et al.: Merkel Cell Carcinoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 549-62.
- Eng TY, Boersma MG, Fuller CD, et al.: A comprehensive review of the treatment of Merkel cell carcinoma. Am J Clin Oncol 30 (6): 624-36, 2007. [PUBMED Abstract]
- Medina-Franco H, Urist MM, Fiveash J, et al.: Multimodality treatment of Merkel cell carcinoma: case series and literature review of 1024 cases. Ann Surg Oncol 8 (3): 204-8, 2001. [PUBMED Abstract]
- Busse PM, Clark JR, Muse VV, et al.: Case records of the Massachusetts General Hospital. Case 19-2008. A 63-year-old HIV-positive man with cutaneous Merkel-cell carcinoma. N Engl J Med 358 (25): 2717-23, 2008. [PUBMED Abstract]
- Haag ML, Glass LF, Fenske NA: Merkel cell carcinoma. Diagnosis and treatment. Dermatol Surg 21 (8): 669-83, 1995. [PUBMED Abstract]
- Ratner D, Nelson BR, Brown MD, et al.: Merkel cell carcinoma. J Am Acad Dermatol 29 (2 Pt 1): 143-56, 1993. [PUBMED Abstract]
- Gould VE, Moll R, Moll I, et al.: Neuroendocrine (Merkel) cells of the skin: hyperplasias, dysplasias, and neoplasms. Lab Invest 52 (4): 334-53, 1985. [PUBMED Abstract]
- Albores-Saavedra J, Batich K, Chable-Montero F, et al.: Merkel cell carcinoma demographics, morphology, and survival based on 3870 cases: a population based study. J Cutan Pathol 37 (1): 20-7, 2010. [PUBMED Abstract]
- Alam M: Management of Merkel cell carcinoma: What we know. Arch Dermatol 142 (6): 771-4, 2006. [PUBMED Abstract]
- Heath ML, Nghiem P: Merkel cell carcinoma: if no breslow, then what? J Surg Oncol 95 (8): 614-5, 2007. [PUBMED Abstract]
- Andea AA, Coit DG, Amin B, et al.: Merkel cell carcinoma: histologic features and prognosis. Cancer 113 (9): 2549-58, 2008. [PUBMED Abstract]
- Bichakjian CK, Lowe L, Lao CD, et al.: Merkel cell carcinoma: critical review with guidelines for multidisciplinary management. Cancer 110 (1): 1-12, 2007. [PUBMED Abstract]
- Rao P, Balzer BL, Lemos BD, et al.: Protocol for the examination of specimens from patients with merkel cell carcinoma of the skin. Arch Pathol Lab Med 134 (3): 341-4, 2010. [PUBMED Abstract]
- Goessling W, McKee PH, Mayer RJ: Merkel cell carcinoma. J Clin Oncol 20 (2): 588-98, 2002. [PUBMED Abstract]
Información sobre los estadios del carcinoma de células de Merkel
Anteriormente, en la mayoría de las publicaciones se utilizaron cinco sistemas de estadificación, que compiten entre sí, para describir el carcinoma de células de Merkel (CCM).
| Primer Autor | Fecha de publicación | Institución(es) | No. de pacientes en las series de casos | Fechas de los casos |
|---|---|---|---|---|
| MSKCC = Memorial Sloan Kettering Cancer Center; N/A = No aplicable. | ||||
| aEl sistema del MSKCC ha evolucionado con el tiempo. Los autores del MSKCC publicaron una serie adicional de casos con 256 pacientes.[1] | ||||
| Yiengpruksawan [2] | 1991 | MSKCCa | 77 | 1969–1989 |
| Allen [3] | 1999 | MSKCCa | 102 | 1969–1996 |
| Allen [4] | 2005 | MSKCCa | 250 | 1970–2002 |
| American Joint Committee on Cancer [5] | 2017 | N/A | N/A | |
| Clark [6] | 2007 | Westmead Hospital, Sidney, Australia | 110 | |
| Princess Margaret Hospital/University Health Network, Toronto, Canadá | ||||
| Sydney Head and Neck Cancer Institute/Royal Prince Alfred Hospital, Sidney, Australia | ||||
Estos sistemas de estadificación son sumamente contradictorios entre sí. La enfermedad en estadio III puede significar cualquier cosa desde enfermedad local avanzada hasta enfermedad ganglionar o enfermedad metastásica a distancia. Además, todos los sistemas de estadificación del CCM en uso se basan en menos de 300 pacientes.
Agrupamiento por estadios y definiciones TNM del American Joint Committee on Cancer
Para abordar estos problemas, el American Joint Committee on Cancer (AJCC) estableció un nuevo sistema de estadificación de consenso específico para definir el CCM.[7] Antes de la publicación de este sistema nuevo, el AJCC proponía el uso del sistema de estadificación del no melanoma.
Entre los cánceres estadificados con este sistema se incluye el carcinoma neuroendocrino cutáneo primario.
Grupo de estadio clínico (cTNM)
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínico. | ||
| aReproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| 0 | Tis, N0, M0 | Tis = tumor primario in situ. |
| N0 = sin metástasis en ganglios linfáticos regionales detectadas en la exploración clínica o radiológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínico. | ||
| aReproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| I | T1, N0, M0 | T1 = diámetro clínico máximo del tumor ≤2 cm. |
| N0 = sin metástasis en ganglios linfáticos regionales detectadas en la exploración clínica o radiológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínico. | ||
| aReproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| IIA | T2–3, N0, M0 | T2 = diámetro clínico máximo del tumor >2 cm, pero ≤5 cm. |
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| N0 = sin metástasis en ganglios linfáticos regionales detectadas en la exploración clínica o radiológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| IIB | T4, N0, M0 | T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. |
| N0 = sin metástasis en ganglios linfáticos regionales detectadas en la exploración clínica o radiológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínico. | ||
| aReproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| III | T0–4, N1–3, M0 | T0 = sin indicios de tumor primario. |
| Tis = tumor primario in situ. | ||
| T1 = diámetro clínico máximo del tumor ≤2 cm. | ||
| T2 = diámetro clínico máximo del tumor >2, pero ≤5 cm. | ||
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. | ||
| N1 = metástasis en ganglios linfáticos regionales. | ||
| N2 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario) sin metástasis en ganglios linfáticos. | ||
| N3 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario) con metástasis en ganglios linfáticos. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínico. | ||
| aReproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| IV | T0–4, cualquier N, M1 | T0 = sin indicios de tumor primario. |
| Tis = tumor primario in situ. | ||
| T1 = diámetro clínico máximo del tumor ≤2 cm. | ||
| T2 = diámetro clínico máximo del tumor >2, pero ≤5 cm. | ||
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. | ||
| NX = ganglios linfáticos regionales no evaluables por métodos clínicos (por ejemplo, se extirparon antes por otro motivo, o por constitución). | ||
| N0 = sin metástasis en ganglios linfáticos regionales detectadas en la exploración clínica o radiológica. | ||
| N1 = metástasis en ganglios linfáticos regionales. | ||
| N2 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario) sin metástasis en ganglios linfáticos. | ||
| N3 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario) con metástasis en ganglios linfáticos. | ||
| M1 = metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
Grupo de estadio patológico (pTNM)
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; p = patológico. | ||
| aReproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| 0 | Tis, pN0, M0 | Tis = tumor primario in situ. |
| pN0 = sin metástasis en ganglios linfáticos regionales detectadas en la evaluación patológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; p = patológico. | ||
| aReproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| I | T1, pN0, M0 | T1 = diámetro clínico máximo del tumor ≤2 cm. |
| pN0 = sin metástasis en ganglios linfáticos regionales detectadas en la evaluación patológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; p = patológico. | ||
| aReproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| IIA | T2–3, pN0, M0 | T2 = diámetro clínico máximo del tumor >2, pero ≤5 cm. |
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| pN0 = sin metástasis en ganglios linfáticos regionales detectadas en la evaluación patológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| IIB | T4, pN0, M0 | T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. |
| pN0 = sin metástasis en ganglios linfáticos regionales detectadas en la evaluación patológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; p = patológico. | ||
| aReproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| IIIA | T1–4, pN1a(sn) o pN1a, M0 | T1 = diámetro clínico máximo del tumor ≤2 cm. |
| T2 = diámetro clínico máximo del tumor >2 cm, pero ≤5 cm. | ||
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. | ||
| pN1a(sn) = metástasis en ganglio linfático regional oculta en la evaluación clínica que se identifica únicamente mediante biopsia del ganglio linfático centinela. | ||
| pN1a = metástasis en ganglio linfático regional oculta en la evaluación clínica después de una disección de ganglio linfático. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| T0, pN1b, M0 | T0 = sin indicios de tumor primario. | |
| pN1b = metástasis en ganglio linfático regional detectada mediante exploración clínica o radiológica, confirmada en la evaluación microscópica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| IIIB | T1–4, pN1b–3, M0 | T1 = diámetro clínico máximo del tumor ≤2 cm. |
| T2 = diámetro clínico máximo del tumor >2 cm, pero ≤5 cm. | ||
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. | ||
| pN1b = metástasis en ganglio linfático regional detectada mediante exploración clínica o radiológica, confirmada en la evaluación microscópica. | ||
| pN2 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario) sin metástasis en ganglios linfáticos. | ||
| pN3 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario) con metástasis en ganglios linfáticos. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; p = patológico. | ||
| aReproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| IV | T0–4, cualquier pN, pM1 | T0 = sin indicios de tumor primario. |
| T1 = diámetro clínico máximo del tumor ≤2 cm. | ||
| T2 = diámetro clínico máximo del tumor >2 cm, pero ≤5 cm. | ||
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. | ||
| pNX = ganglios linfáticos regionales no evaluables (por ejemplo, se extirparon antes por otro motivo o no se extirparon para evaluación patológica). | ||
| pN0 = sin metástasis en ganglios linfáticos regionales detectadas en la evaluación patológica. | ||
| pN1 = metástasis en ganglios linfáticos regionales. | ||
| –pN1a(sn) = metástasis en ganglio linfático regional oculta en la evaluación clínica que se identifica únicamente mediante biopsia del ganglio linfático centinela. | ||
| –pN1a = metástasis en ganglio linfático regional oculta en la evaluación clínica después de una disección de ganglio linfático. | ||
| –pN1b = metástasis en ganglio linfático regional detectada mediante exploración clínica o radiológica, confirmada en la evaluación microscópica. | ||
| pN2 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario) sin metástasis en ganglios linfáticos. | ||
| pN3 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario) con metástasis en ganglios linfáticos. | ||
| pM1 = metástasis a distancia confirmadas en la evaluación microscópica. | ||
| –pM1a = metástasis a distancia en la piel, el tejido celular subcutáneo o en ganglios linfáticos regionales, confirmadas en la evaluación microscópica. | ||
| –pM1b = metástasis en el pulmón, confirmada en la evaluación microscópica. | ||
| pM1c = metástasis en todos los otros sitios distantes, confirmadas en la evaluación microscópica. | ||
Antes de la publicación del nuevo sistema de estadificación de consenso del AJCC, se favoreció el más reciente sistema de cuatro etapas del Memorial Sloan Kettering Cancer Center (MSKCC) porque se basaba en un mayor número de pacientes y era el de mejor validación.[1] Los estadios del MSKCC son los siguientes:
- Estadio I: enfermedad local que mide <2 cm.
- Estadio II: enfermedad local que mide ≥2 cm.
- Estadio III: enfermedad ganglionar regional.
- Estadio IV: enfermedad metastásica a distancia.
Un grupo indicó una lista de 12 elementos que se deben describir en los informes patológicos de lesiones primarias resecadas y 9 elementos que se describen en los informes patológicos de los ganglios linfáticos centinelas. La importancia pronóstica de estos elementos no ha sido validada de forma prospectiva.[8] El manual de estadificación de 2009 del AJCC también especifica una variedad de factores que se deben recopilar en los informes patológicos.
Bibliografía
- Andea AA, Coit DG, Amin B, et al.: Merkel cell carcinoma: histologic features and prognosis. Cancer 113 (9): 2549-58, 2008. [PUBMED Abstract]
- Yiengpruksawan A, Coit DG, Thaler HT, et al.: Merkel cell carcinoma. Prognosis and management. Arch Surg 126 (12): 1514-9, 1991. [PUBMED Abstract]
- Allen PJ, Zhang ZF, Coit DG: Surgical management of Merkel cell carcinoma. Ann Surg 229 (1): 97-105, 1999. [PUBMED Abstract]
- Allen PJ, Bowne WB, Jaques DP, et al.: Merkel cell carcinoma: prognosis and treatment of patients from a single institution. J Clin Oncol 23 (10): 2300-9, 2005. [PUBMED Abstract]
- Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017.
- Clark JR, Veness MJ, Gilbert R, et al.: Merkel cell carcinoma of the head and neck: is adjuvant radiotherapy necessary? Head Neck 29 (3): 249-57, 2007. [PUBMED Abstract]
- Bichakjian CK, Nghiem P, Johnson T, et al.: Merkel Cell Carcinoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 549-62.
- Bichakjian CK, Lowe L, Lao CD, et al.: Merkel cell carcinoma: critical review with guidelines for multidisciplinary management. Cancer 110 (1): 1-12, 2007. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento del carcinoma de células de Merkel
El carcinoma de células de Merkel (CCM) es un tumor poco común. La mayoría de las recomendaciones clínicas para su tratamiento que se encuentran en la bibliografía se basan en series de casos que describen un número relativamente reducido de pacientes que no participaron en ensayos clínicos formales, no se evaluaron con procedimientos de estadificación clínica uniformes, no se trataron con protocolos de tratamiento uniformes ni se les recomendó un seguimiento regular. Estos informes también tienen posibles factores de confusión debidos a posibles sesgos de selección y verificación, así como un seguimiento breve. Tampoco tienen la potencia para detectar diferencias moderadas en el desenlace.
Además, los desenlaces de pacientes con enfermedad en estadio I y estadio II según el American Joint Committee on Cancer a menudo se notifican juntos. A falta de resultados de ensayos clínicos con exámenes, tratamientos y seguimiento prescritos, la mayoría de los pacientes con CCM se trataron usando preferencias institucionales o profesionales que consideran los elementos específicos de cada caso, así como las preferencias de los pacientes.
Hay dos filosofías divergentes acerca del método más apropiado para tratar un CCM. Según la primera filosofía, el CCM se trata como otros cánceres de piel no melanoma, con énfasis en el tratamiento de la enfermedad locorregional con cirugía y radioterapia según resulte apropiado. Según la segunda filosofía, el CCM se trata de acuerdo con las características biológicas. Este abordaje es análogo al del cáncer de pulmón de células pequeñas, que se supone es una enfermedad sistémica, y conduce a una recomendación más rutinaria para usar la quimioterapia sistémica adyuvante.[1]
Cirugía de la lesión primaria
En una revisión de 18 series de casos, 279 de 926 pacientes (30,1 %) presentaron recidiva local durante el seguimiento, con exclusión de los que sufrían de enfermedad metastásica a distancia en el momento de la presentación inicial. Estas recidivas se atribuyeron normalmente a márgenes quirúrgicos inadecuados o, posiblemente, a una falta de radioterapia adyuvante.[2,3]
Dado la propensión del CCM a recidivar localmente (a veces con lesiones satélites o metástasis en tránsito), se recomendó la extirpación local amplia para reducir el riesgo de recidiva local en los pacientes con enfermedad en estadios clínicos I o II.
Las recomendaciones acerca del ancho y la profundidad mínimas adecuadas para el margen tisular normal que se extirpa alrededor del tumor primario varían entre las diversas series retrospectivas de casos, pero este tema no se ha estudiado de manera sistemática.[3-7][Nivel de evidencia C2] No se dispone de datos definitivos que indiquen que los márgenes muy amplios mejoren la supervivencia general (SG), aunque algunos informes indican que los márgenes más amplios mejoran el control local.[3][Nivel de evidencia C2] La evaluación de los márgenes en una sección congelada a veces es útil, en especial, cuando el tumor está en un sitio anatómico que no permite obtener márgenes amplios.
Algunos autores han preconizado el uso de la cirugía micrográfica de Mohs como una técnica que preserva el tejido. La tasa de recaída notificada es similar o mejor que la de la extirpación amplia, pero se trataron relativamente pocos casos de esta manera y ninguno en ensayos controlados aleatorizados.[7-10][Nivel de evidencia C2]
Cirugía de ganglio linfático regional
En algunas series de casos, las tasas de recidiva locorregional son altas cuando se omite la estadificación ganglionar patológica. La estadificación ganglionar quirúrgica en pacientes sin compromiso clínico permitió identificar ganglios con compromiso tumoral en el 25 % al 35 % de los pacientes.[4,11,12][Nivel de evidencia C2] En una serie retrospectiva con 213 pacientes que se sometieron a tratamiento quirúrgico del tumor primario y evaluación de los ganglios de drenaje, se encontró compromiso ganglionar en 2 de 54 pacientes con tumores pequeños (por ejemplo, ≤1,0 cm) y 51 de 159 pacientes con tumores mayores de 1,0 cm.[13]Nivel de evidencia C2
La función de la disección electiva de ganglios linfáticos (DEGL), cuando no hay compromiso clínico ganglionar, no se ha estudiado en ensayos clínicos formales. En las series de casos pequeñas, se recomendó la DEGL para los tumores primarios más grandes, los tumores con más de 10 mitosis por campo de gran aumento, invasión linfática o vascular, y los subtipos histológicos de células pequeñas.[14-16][Nivel de evidencia C2]
Se indicó la biopsia del ganglio linfático centinela (GLC) como la opción inicial preferida para completar la DEGL durante una estadificación adecuada del CCM. La biopsia del GLC produce menos morbilidad que la disección ganglionar completa. Además, para los sitios del CCM con drenaje linfático indeterminado, como aquellos en la espalda, se pueden usar técnicas de biopsia del GLC para identificar los lechos apropiados de ganglios linfáticos. Si se realiza, la biopsia del GLC se hace en el momento de la resección amplia, cuando los canales linfáticos locales todavía están intactos.
En varios informes, se encontró que el uso de técnicas de biopsia del GLC para el CCM es confiable y reproducible.[17-20] Sin embargo, sigue sin aclararse el significado del compromiso del GLC.
- En un metanálisis de diez series de casos se encontró que el compromiso del GLC predijo firmemente un riesgo alto de recidiva a corto plazo y que la disección ganglionar terapéutica posterior fue eficaz para prevenir la recidiva ganglionar regional a corto plazo.[21]
- En otro metanálisis se incluyeron 12 series de casos retrospectivos (solo con coincidencia parcial con la colección de series de casos del metanálisis anterior).[12][Nivel de evidencia C2]
- La biopsia del GLC detectó la diseminación del CCM en un tercio de los pacientes cuyos tumores, de otro modo, se habrían subestadificado clínica y radiológicamente.
- La tasa de recidiva fue tres veces más alta en los pacientes con una biopsia del GLC que mostró cáncer en comparación con aquellos en los que no se observó cáncer en la biopsia del GLC (P = 0,03).
- Entre 2006 y 2010, en una serie retrospectiva grande de una sola institución con 95 pacientes (97 tumores primarios) se identificó un GLC en 93 casos, y se observaron tumores ganglionares en 42 pacientes. Se usaron técnicas inmunohistoquímicas para evaluar el compromiso ganglionar. Varios modelos de tumores y características de los pacientes se estudiaron a fin de predecir el compromiso ganglionar. No hubo un subgrupo de pacientes con predicción de menos del 15 % al 20 % de probabilidad de compromiso del GLC, lo que indicó que se podría considerar hacer la biopsia del GLC para todos los pacientes con posibilidad de curación que no tienen compromiso clínico de los ganglios linfáticos o metástasis a distancia.[22][Nivel de evidencia C2]
- De 1996 a 2010, en otro ensayo retrospectivo de una sola institución en 153 pacientes con CCM localizado que se sometieron a biopsia del GLC, se analizaron los factores relacionados con el compromiso del GLC. Los mejores factores pronósticos para una biopsia del GLC que muestre cáncer fueron el tamaño del tumor y la invasión linfovascular.[22,23][Nivel de evidencia C2]
A falta de ensayos clínicos aleatorizados y prospectivos con potencia adecuada, quedan pendientes las siguientes preguntas:[4,12,21,24][Nivel de evidencia C2]
- ¿Debería cada biopsia del GLC con resultado que muestre compromiso por cáncer seguirse de manera sistemática de una cirugía ganglionar definitiva o radioterapia?
- ¿Se podría demostrar que los desenlaces mejoran al agregar radiación de manera sistemática cuando la cirugía de ganglios linfáticos revela tumores en múltiples ganglios, diseminación extracapsular o invasión linfovascular?
- ¿Los pacientes con CCM que miden menos de 1 cm se deben someter de manera sistemática a una disección del ganglio linfático centinela (DGLC)?
- ¿Deberían los pacientes sin examen ganglionar o en quienes no se encontró compromiso ganglionar ser sometidos de manera sistemática a radioterapia local o locorregional?
- ¿Deberían las técnicas de tinción inmunohistoquímica utilizarse para identificar las micrometástasis de ganglios linfáticos?, ¿tiene relevancia clínica la enfermedad micrometastásica en los ganglios?
La cirugía de ganglios linfáticos se usa de manera primaria para la estadificación y para guiar los tratamientos adicionales.
A partir de un número reducido de estudios retrospectivos, la disección terapéutica de los ganglios linfáticos regionales después de una DGLC que muestra compromiso por cáncer parece reducir al mínimo, pero no eliminar por completo, el riesgo posterior de recidiva en los ganglios regionales y de metástasis en tránsito.[4,21,24][Nivel de evidencia C2] No hay datos de ensayos prospectivos aleatorizados que demuestren que la cirugía ganglionar regional definitiva mejore la supervivencia.
Radioterapia
Debido a la gran malignidad que caracteriza al CCM, su evidente radiosensibilidad y la incidencia elevada de recidivas locales y regionales (como las metástasis en tránsito después de una cirugía solo en el lecho del tumor), algunos médicos recomendaron radioterapia adyuvante dirigida al sitio primario y a la cuenca ganglionar. Se ha considerado la radiación dirigida a la cuenca ganglionar administrada al mismo tiempo que la radiación dirigida al sitio primario, en especial, para pacientes con tumores más grandes, tumores localmente inoperables, márgenes de extirpación estrechos o con compromiso tumoral que no se pueden mejorar con cirugía adicional y aquellos con ganglios regionales comprometidos, en especial, después de una DGLC (estadio II).[10,11,14,15,25][Nivel de evidencia C2] En varias series retrospectivas pequeñas se observó que la radioterapia con una cirugía adecuada mejora el control locorregional en comparación con la cirugía sola, [2,5,26-29] mientras que en otras series no se observaron los mismos resultados.[4,8][Nivel de evidencia C2]
A falta de ensayos clínicos aleatorizados y prospectivos con potencia adecuada, quedan pendientes las siguientes preguntas:[4,8,9,12,21,24,26,30-34][Nivel de evidencia C2]
- ¿Debería cada biopsia del GLC con resultado que muestre compromiso por cáncer seguirse de manera sistemática de una cirugía ganglionar definitiva o radioterapia?
- ¿Se podría demostrar que los desenlaces mejoran al agregar radiación de manera sistemática cuando la cirugía de ganglios linfáticos revela tumores en múltiples ganglios, diseminación extracapsular o invasión linfovascular?
- ¿Deberían los pacientes sin examen ganglionar o en quienes no se encontró compromiso ganglionar ser sometidos de manera sistemática a radioterapia local o locorregional?
Debido a lo pequeño de estas series retrospectivas no aleatorizadas, no se ha comprobado que la radioterapia muestre alguna ventaja específica.
Cuando se recomienda, la dosis de radiación suele ser por lo menos de 50 Gy en fracciones de 2 Gy dirigidas al lecho quirúrgico con márgenes y a los vasos linfáticos regionales de drenaje. Para pacientes con tumores no resecados o tumores con evidencia de diseminación microscópica más allá de los márgenes resecados, se recomendaron dosis más altas de entre 56 Gy y 65 Gy dirigidas al sitio primario.[5,10,11,14,15,27,31,35][Nivel de evidencia C2] Dichas dosis no se estudiaron de forma prospectiva en ensayos clínicos.
En series de casos pequeñas con pacientes muy seleccionados, no aleatorizados y con diversas características clínicas, se ha informado de control local o regional del CCM con radioterapia sola.[29,36] Típicamente, estos pacientes tienen tumores primarios o ganglios inoperables o se consideró que desde el punto de vista médico no eran aptos para someterlos a cirugía.[29,36][Nivel de evidencia C2]
Los datos del Retrospective Surveillance, Epidemiology and End Results (SEER) Program indican que añadir radioterapia a la cirugía confiere una ventaja de supervivencia, pero las conclusiones resultan complicadas debido a los datos incompletos de los pacientes, la ausencia de un protocolo para la evaluación y el tratamiento, y el posible sesgo del muestreo.[32] Se necesitan ensayos clínicos prospectivos aleatorizados para evaluar si la combinación de cirugía con radioterapia afecta la supervivencia.[33,34][Nivel de evidencia C2]
Inmunoterapia
Cerca del 70 % al 80 % de los casos de CCM en los Estados Unidos obedecen al poliomavirus de células de Merkel (MCPyV). Entre los CCM que presentan el virus, las oncoproteínas víricas (antígenos T) se expresan constitutivamente y promueven el crecimiento. Además, los pacientes con respuesta inmunitaria estimulada frente al MCPyV exhiben mejores desenlaces de la enfermedad, lo que proporciona un fundamento para el uso de la inmunoterapia. Aunque hay pocos ensayos aleatorizados, varios inhibidores de puntos de control inmunitario han demostrado mejorar la supervivencia y presentan buena tolerabilidad en pacientes con CCM avanzado, en comparación con la quimioterapia usada en los controles históricos. Por lo tanto, los inhibidores de puntos de control inmunitario se consideran el tratamiento de primera línea recomendado para la mayoría de pacientes. Hay ensayos en curso para evaluar el uso de los inhibidores de puntos de control inmunitario en el entorno neoadyuvante y adyuvante.
Avelumab
El avelumab es un anticuerpo monoclonal contra el ligando 1 de muerte programada (PD-L1).
Evidencia (avelumab):
- En un ensayo de fase II (JAVELIN Merkel 200 [NCT02155647]), un grupo de 88 pacientes con CCM metastásico recibió avelumab (10 mg/kg intravenoso [IV] cada 2 semanas). Estos pacientes habían recibido antes quimioterapia.[37]
- La tasa de respuesta objetiva fue del 33 %, y el 11 % de los pacientes presentó una respuesta completa. La mediana de tiempo hasta la respuesta fue de 6,1 semanas y fue independiente del estado del MCPyV o PD-L1. Las respuestas fueron duraderas; el 74 % duró más de 1 año. La mediana de SG fue de 12,6 meses, más del doble de la mediana histórica obtenida con la quimioterapia de segunda línea.
A partir de los resultados de este estudio, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el avelumab en 2017 para el tratamiento de pacientes con CCM metastásico, sin importar el antecedente de administración de quimioterapia.[37-39]
- El avelumab también se estudió en el entorno de primera línea en un ensayo de fase II de un solo grupo de 116 pacientes.[40]
- Al cabo de una mediana de seguimiento de 21,2 meses, el 30,2% (intervalo de confianza [IC] 95 %, 22,0–39,4 %) de los pacientes tenía una respuesta duradera (>6 meses). La tasa de respuesta objetiva fue del 39,7 %, y la mediana de SG fue de 20,3 meses (IC 95 %, 12,4–no estimable).[40][Nivel de evidencia C3]
- En el análisis exploratorio se encontró que las respuestas fueron más altas en los pacientes con expresión de PD-L1 y en aquellos con resultados negativos para MCPyV.
Pembrolizumab
El pembrolizumab es un anticuerpo monoclonal humanizado de tipo IgG4 contra la proteína 1 de muerte celular programada (PD-1).
Evidencia (pembrolizumab):
- El pembrolizumab se estudió en un ensayo de fase II (NCT02267603) de tratamiento sistémico primario para pacientes con CCM en estadio IIIB irresecable o estadio IV. Un grupo de 50 pacientes se sometió a tratamiento.[41][Nivel de evidencia C3]
- La tasa de respuesta objetiva fue del 58 % (IC 95 %, 43,2–71,8 %); el 30 % de los pacientes presentó respuesta completa y el 28 %, respuesta parcial. Si bien la tasa de respuesta fue similar a las tasas históricas de la quimioterapia de primera línea, las respuestas al pembrolizumab duraron más. La mediana de supervivencia sin progresión (SSP) fue de 16,8 meses (IC 95 %, 4,6–43,4), y la tasa de SG a 3 años fue del 59,4 %.
La FDA aprobó el pembrolizumab en diciembre de 2018.
Retifanlimab
El retifanlimab es un anticuerpo monoclonal anti–PD-1.
Evidencia (retifanlimab):
- El retifanlimab se evaluó en un ensayo de fase II (POD1UM-201 [NCT03599713]), publicado como resumen, de 101 pacientes con CCM avanzado sin tratamiento previo. Los pacientes recibieron 500 mg intravenoso (IV) cada 4 semanas.[42,43]
- En los resultados preliminares después de una mediana de seguimiento de 17,6 meses se observó una tasa de respuesta completa del 16,8 %, una tasa de respuesta parcial del 38,6 %, y una tasa de respuesta general del 53,5 % (IC 95 %, 43,3–63,5 %).[42,43][Nivel de evidencia C3]
- La mediana de SSP fue de 12,7 meses (IC 95 %, 7,3–24,9) y la mediana de duración de la respuesta fue de 25,3 meses (IC 95 %, 14,2–no estimable). La mediana de SG no se había alcanzado hasta el momento de la evaluación.
A partir de los resultados de este ensayo, la FDA otorgó la aprobación acelerada para el retifanlimab en mayo de 2023.
Nivolumab
El nivolumab es un anticuerpo monoclonal anti–PD-1.
Evidencia (nivolumab):
- El nivolumab se estudió en un ensayo de fase I/II (CheckMate 358 [NCT02488759]), publicado como resumen, en pacientes con cánceres asociados con virus, como el CCM. Se aceptaron pacientes con antecedentes de hasta 2 líneas de tratamiento previas. Los pacientes con CCM metastásico podían participar sin importar el estado respecto al MCPyV ni el antecedente de quimioterapia.[44,45]
- Los datos de 25 pacientes con enfermedad metastásica mostraron una tasa de respuesta general del 60 % al cabo de una mediana de duración del tratamiento de 15,8 meses. En los resultados preliminares se notificó una tasa de respuesta continuada del 87 %, y respuestas en 13 de 15 pacientes en el momento del último seguimiento (mediana de seguimiento, 6 meses).[44,45][Nivel de evidencia C3]
- Este ensayo incluyó una segunda cohorte para investigar nivolumab y ipilimumab (1 mg/kg) en pacientes con CCM metastásico.
La FDA no ha autorizado el uso de nivolumab para el tratamiento del CCM.
Quimioterapia
En los pacientes con CCM, se ha utilizado una variedad de regímenes quimioterapéuticos en los entornos de terapia adyuvante, enfermedad avanzada y recidivante.[5,34,46,47][Nivel de evidencia C2] Pese a que no se han realizado ensayos clínicos de fase III que permitan demostrar que la quimioterapia adyuvante produce mejorías en la SG, algunos médicos recomiendan su uso en la mayoría de los casos debido a las siguientes razones:
- Se estableció una analogía biológica entre el CCM y el carcinoma de células pequeñas de pulmón que tiene características histológicas similares y se considera una enfermedad sistémica.
- El riesgo de metástasis y progresión del CCM es alto.
- Se observaron buenas tasas de respuesta clínica inicial con algunos regímenes quimioterapéuticos.
Siempre que sea posible, se debe alentar la participación de los pacientes en ensayos clínicos.
Desde 1997 a 2001, el Trans-Tasman Radiation Oncology Group realizó una evaluación de fase II que incluyó a 53 pacientes con CCM y enfermedad locorregional de riesgo alto. El riesgo alto se definió como una recidiva que se presenta después del tratamiento inicial, ganglios linfáticos comprometidos, tumor primario mayor de 1 cm, enfermedad residual macroscópica después de la cirugía o tumor primario oculto con ganglios linfáticos comprometidos. El tratamiento incluyó radioterapia locorregional (50 Gy en 25 fracciones), carboplatino simultáneo (área bajo la curva [ABC] 4,5) y etopósido IV (89 mg/m2 los días 1 a 3 de las semanas 1, 4, 7 y 10). La cirugía no se estandarizó ni para el tumor primario ni los ganglios linfáticos, y 12 pacientes tenían márgenes estrechos, márgenes con compromiso tumoral o enfermedad residual macroscópica. A 28 pacientes no se les extirparon los lechos ganglionares y el resto se sometió a diversas cirugías ganglionares. Después de una mediana de seguimiento de 48 meses, la tasa de SG a 3 años fue del 76 %, la tasa de control locorregional fue del 75 % y la tasa de control a distancia fue del 76 %. Las reacciones de la piel a la radiación y la neutropenia febril fueron reacciones clínicas tóxicas agudas importantes. Dada la heterogeneidad de la población y la cirugía no estandarizada, es difícil inferir un beneficio terapéutico claro de la quimioterapia.[48][Nivel de evidencia C1]
En un informe posterior, los mismos investigadores evaluaron a un subconjunto de estos pacientes del protocolo (N = 40, después de excluir a los pacientes con tumores primarios desconocidos). Este grupo de pacientes se comparó con un grupo de 61 controles históricos tratados en las mismas instituciones sin quimioterapia, que recibieron el diagnóstico antes de 1997 y que no contaban con estudios rutinarios de estadificación por imágenes. Se administró radioterapia a 50 pacientes. No se observó ningún beneficio significativo de la supervivencia para los pacientes que recibieron quimioterapia.[49]
En un ensayo clínico piloto posterior con 18 pacientes realizado entre 2004 y 2006, los mismos investigadores intentaron reducir la toxicidad dérmica y hematológica observada en el Study 96-07. El carboplatino (ABC, 2) se administró semanalmente durante la radioterapia desde el día 1 por un máximo de 5 dosis, seguidas de 3 ciclos de carboplatino (ABC 4,5 y 80 mg/m2 de etopósido IV los días 1 a 3, empezando 3 semanas después de la radiación y repitiéndolo cada 3 semanas durante 3 ciclos). La radioterapia fue similar a la del ensayo anterior.[48] Los resultados iniciales indican menos toxicidad hematológica y cutánea, todavía no hay informes de otros desenlaces clínicos.[50]
También se dio cuenta del uso de quimioterapia en determinados pacientes con enfermedad localmente avanzada y metastásica. En un estudio retrospectivo con 107 pacientes, el 57 % de los pacientes con enfermedad metastásica y el 69 % con enfermedad localmente avanzada respondieron a la quimioterapia inicial. La mediana de SG fue de 9 meses para los pacientes con enfermedad metastásica y de 24 meses para los pacientes con enfermedad localmente avanzada. Se proyectó que la tasa de SG a los 3 años sería del 17 % para los pacientes con enfermedad metastásica y del 35 % para los pacientes con enfermedad avanzada local. Sin embargo, la toxicidad fue significativa y no hubo un beneficio claro, en particular para los pacientes de más edad.[51][Nivel de evidencia C2]
Seguimiento
Las técnicas de seguimiento más apropiadas y su frecuencia para los pacientes tratados por un CCM no se han estudiado de forma prospectiva. Debido a la propensión a la recidiva local y regional, los médicos deberían realizar por lo menos un examen físico minucioso del sitio de la enfermedad inicial y los ganglios linfáticos regionales. Se indican estudios con imágenes para evaluar los signos y los síntomas de interés o para identificar a tiempo las metástasis a distancia. Sin embargo, no hay datos que indiquen que la detección a tiempo y el tratamiento de nuevas metástasis a distancia resulten en un aumento de la supervivencia.
En una serie de 237 pacientes que presentaban al inicio enfermedad local o regional, la mediana del tiempo hasta la recidiva fue de 9 meses (intervalo, 2–70 meses). Noventa y uno por ciento de las recidivas se presentaron dentro de los 2 años desde el momento del diagnóstico.[4] Se propuso que la intensidad del seguimiento se puede disminuir gradualmente después de 2 a 3 años debido a que es probable que la mayoría de las recidivas ya estén presentes.[4]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Busse PM, Clark JR, Muse VV, et al.: Case records of the Massachusetts General Hospital. Case 19-2008. A 63-year-old HIV-positive man with cutaneous Merkel-cell carcinoma. N Engl J Med 358 (25): 2717-23, 2008. [PUBMED Abstract]
- Medina-Franco H, Urist MM, Fiveash J, et al.: Multimodality treatment of Merkel cell carcinoma: case series and literature review of 1024 cases. Ann Surg Oncol 8 (3): 204-8, 2001. [PUBMED Abstract]
- Nghiem P, James N: Merkel cell carcinoma. In: Wolff K, Goldsmith LA, Katz SI, et al., eds.: Fitzpatrick's Dermatology in General Medicine. 7th ed. McGraw-Hill , 2008, pp 1087-94.
- Allen PJ, Bowne WB, Jaques DP, et al.: Merkel cell carcinoma: prognosis and treatment of patients from a single institution. J Clin Oncol 23 (10): 2300-9, 2005. [PUBMED Abstract]
- Goessling W, McKee PH, Mayer RJ: Merkel cell carcinoma. J Clin Oncol 20 (2): 588-98, 2002. [PUBMED Abstract]
- Senchenkov A, Barnes SA, Moran SL: Predictors of survival and recurrence in the surgical treatment of merkel cell carcinoma of the extremities. J Surg Oncol 95 (3): 229-34, 2007. [PUBMED Abstract]
- Nghiem P, McKee PH, Haynes HA: Merkel cell (cutaneous neuroendocrine) carcinoma. In: Sober AJ, Haluska FG, eds.: Skin Cancer. BC Decker Inc., 2001, pp 127-141.
- Boyer JD, Zitelli JA, Brodland DG, et al.: Local control of primary Merkel cell carcinoma: review of 45 cases treated with Mohs micrographic surgery with and without adjuvant radiation. J Am Acad Dermatol 47 (6): 885-92, 2002. [PUBMED Abstract]
- Wilson LD, Gruber SB: Merkel cell carcinoma and the controversial role of adjuvant radiation therapy: clinical choices in the absence of statistical evidence. J Am Acad Dermatol 50 (3): 435-7; discussion 437-8, 2004. [PUBMED Abstract]
- Gollard R, Weber R, Kosty MP, et al.: Merkel cell carcinoma: review of 22 cases with surgical, pathologic, and therapeutic considerations. Cancer 88 (8): 1842-51, 2000. [PUBMED Abstract]
- Eng TY, Boersma MG, Fuller CD, et al.: A comprehensive review of the treatment of Merkel cell carcinoma. Am J Clin Oncol 30 (6): 624-36, 2007. [PUBMED Abstract]
- Gupta SG, Wang LC, Peñas PF, et al.: Sentinel lymph node biopsy for evaluation and treatment of patients with Merkel cell carcinoma: The Dana-Farber experience and meta-analysis of the literature. Arch Dermatol 142 (6): 685-90, 2006. [PUBMED Abstract]
- Stokes JB, Graw KS, Dengel LT, et al.: Patients with Merkel cell carcinoma tumors < or = 1.0 cm in diameter are unlikely to harbor regional lymph node metastasis. J Clin Oncol 27 (23): 3772-7, 2009. [PUBMED Abstract]
- Haag ML, Glass LF, Fenske NA: Merkel cell carcinoma. Diagnosis and treatment. Dermatol Surg 21 (8): 669-83, 1995. [PUBMED Abstract]
- Ratner D, Nelson BR, Brown MD, et al.: Merkel cell carcinoma. J Am Acad Dermatol 29 (2 Pt 1): 143-56, 1993. [PUBMED Abstract]
- Yiengpruksawan A, Coit DG, Thaler HT, et al.: Merkel cell carcinoma. Prognosis and management. Arch Surg 126 (12): 1514-9, 1991. [PUBMED Abstract]
- Messina JL, Reintgen DS, Cruse CW, et al.: Selective lymphadenectomy in patients with Merkel cell (cutaneous neuroendocrine) carcinoma. Ann Surg Oncol 4 (5): 389-95, 1997 Jul-Aug. [PUBMED Abstract]
- Hill AD, Brady MS, Coit DG: Intraoperative lymphatic mapping and sentinel lymph node biopsy for Merkel cell carcinoma. Br J Surg 86 (4): 518-21, 1999. [PUBMED Abstract]
- Wasserberg N, Schachter J, Fenig E, et al.: Applicability of the sentinel node technique to Merkel cell carcinoma. Dermatol Surg 26 (2): 138-41, 2000. [PUBMED Abstract]
- Rodrigues LK, Leong SP, Kashani-Sabet M, et al.: Early experience with sentinel lymph node mapping for Merkel cell carcinoma. J Am Acad Dermatol 45 (2): 303-8, 2001. [PUBMED Abstract]
- Mehrany K, Otley CC, Weenig RH, et al.: A meta-analysis of the prognostic significance of sentinel lymph node status in Merkel cell carcinoma. Dermatol Surg 28 (2): 113-7; discussion 117, 2002. [PUBMED Abstract]
- Schwartz JL, Griffith KA, Lowe L, et al.: Features predicting sentinel lymph node positivity in Merkel cell carcinoma. J Clin Oncol 29 (8): 1036-41, 2011. [PUBMED Abstract]
- Fields RC, Busam KJ, Chou JF, et al.: Recurrence and survival in patients undergoing sentinel lymph node biopsy for merkel cell carcinoma: analysis of 153 patients from a single institution. Ann Surg Oncol 18 (9): 2529-37, 2011. [PUBMED Abstract]
- Maza S, Trefzer U, Hofmann M, et al.: Impact of sentinel lymph node biopsy in patients with Merkel cell carcinoma: results of a prospective study and review of the literature. Eur J Nucl Med Mol Imaging 33 (4): 433-40, 2006. [PUBMED Abstract]
- Goepfert H, Remmler D, Silva E, et al.: Merkel cell carcinoma (endocrine carcinoma of the skin) of the head and neck. Arch Otolaryngol 110 (11): 707-12, 1984. [PUBMED Abstract]
- Lewis KG, Weinstock MA, Weaver AL, et al.: Adjuvant local irradiation for Merkel cell carcinoma. Arch Dermatol 142 (6): 693-700, 2006. [PUBMED Abstract]
- Veness MJ, Perera L, McCourt J, et al.: Merkel cell carcinoma: improved outcome with adjuvant radiotherapy. ANZ J Surg 75 (5): 275-81, 2005. [PUBMED Abstract]
- Jabbour J, Cumming R, Scolyer RA, et al.: Merkel cell carcinoma: assessing the effect of wide local excision, lymph node dissection, and radiotherapy on recurrence and survival in early-stage disease--results from a review of 82 consecutive cases diagnosed between 1992 and 2004. Ann Surg Oncol 14 (6): 1943-52, 2007. [PUBMED Abstract]
- Veness M, Foote M, Gebski V, et al.: The role of radiotherapy alone in patients with merkel cell carcinoma: reporting the Australian experience of 43 patients. Int J Radiat Oncol Biol Phys 78 (3): 703-9, 2010. [PUBMED Abstract]
- Meeuwissen JA, Bourne RG, Kearsley JH: The importance of postoperative radiation therapy in the treatment of Merkel cell carcinoma. Int J Radiat Oncol Biol Phys 31 (2): 325-31, 1995. [PUBMED Abstract]
- Marks ME, Kim RY, Salter MM: Radiotherapy as an adjunct in the management of Merkel cell carcinoma. Cancer 65 (1): 60-4, 1990. [PUBMED Abstract]
- Mojica P, Smith D, Ellenhorn JD: Adjuvant radiation therapy is associated with improved survival in Merkel cell carcinoma of the skin. J Clin Oncol 25 (9): 1043-7, 2007. [PUBMED Abstract]
- Housman DM, Decker RH, Wilson LD: Regarding adjuvant radiation therapy in merkel cell carcinoma: selection bias and its affect on overall survival. J Clin Oncol 25 (28): 4503-4; author reply 4504-5, 2007. [PUBMED Abstract]
- Garneski KM, Nghiem P: Merkel cell carcinoma adjuvant therapy: current data support radiation but not chemotherapy. J Am Acad Dermatol 57 (1): 166-9, 2007. [PUBMED Abstract]
- Foote M, Harvey J, Porceddu S, et al.: Effect of radiotherapy dose and volume on relapse in Merkel cell cancer of the skin. Int J Radiat Oncol Biol Phys 77 (3): 677-84, 2010. [PUBMED Abstract]
- Fang LC, Lemos B, Douglas J, et al.: Radiation monotherapy as regional treatment for lymph node-positive Merkel cell carcinoma. Cancer 116 (7): 1783-90, 2010. [PUBMED Abstract]
- Kaufman HL, Russell JS, Hamid O, et al.: Updated efficacy of avelumab in patients with previously treated metastatic Merkel cell carcinoma after ≥1 year of follow-up: JAVELIN Merkel 200, a phase 2 clinical trial. J Immunother Cancer 6 (1): 7, 2018. [PUBMED Abstract]
- Becker JC, Lorenz E, Ugurel S, et al.: Evaluation of real-world treatment outcomes in patients with distant metastatic Merkel cell carcinoma following second-line chemotherapy in Europe. Oncotarget 8 (45): 79731-79741, 2017. [PUBMED Abstract]
- Cowey CL, Mahnke L, Espirito J, et al.: Real-world treatment outcomes in patients with metastatic Merkel cell carcinoma treated with chemotherapy in the USA. Future Oncol 13 (19): 1699-1710, 2017. [PUBMED Abstract]
- D'Angelo SP, Lebbé C, Mortier L, et al.: First-line avelumab in a cohort of 116 patients with metastatic Merkel cell carcinoma (JAVELIN Merkel 200): primary and biomarker analyses of a phase II study. J Immunother Cancer 9 (7): , 2021. [PUBMED Abstract]
- Nghiem PT, Bhatia S, Lipson EJ, et al.: PD-1 Blockade with Pembrolizumab in Advanced Merkel-Cell Carcinoma. N Engl J Med 374 (26): 2542-52, 2016. [PUBMED Abstract]
- Grignani G, Rutkowski P, Lebbe C, et al.: Updated results from POD1UM-201: A phase II study of retifanlimab in patients with advanced or metastatic Merkel cell carcinoma (MCC). [Abstract] Ann Oncol 34 (Suppl 2): A-1146P, S686, 2023.
- Grignani G, Rutkowski P, Lebbé C, et al.: Updated results from POD1UM-201: A phase 2 study of retifanlimab in patients with advanced or metastatic Merkel cell carcinoma. In: Grignani G, Rutkowski P, Lebbe C, et al.: Updated results from POD1UM-201: A phase II study of retifanlimab in patients with advanced or metastatic Merkel cell carcinoma (MCC). 34 (Suppl 2): A-1146P, S686, 2023, Poster. Available online. Last accessed May 9, 2025.
- Bhatia S, Topalian SL, Sharfman WH, et al.: Non-comparative, open-label, international, multicenter phase I/II study of nivolumab (NIVO) ± ipilimumab (IPI) in patients (pts) with recurrent/metastatic merkel cell carcinoma (MCC) (CheckMate 358). [Abstract] J Clin Oncol 41 (Suppl 16): A-9506, 2023.
- Topalian SL, Bhatia S, Hollebecque A, et al.: Abstract CT074: Non-comparative, open-label, multiple cohort, phase 1/2 study to evaluate nivolumab (NIVO) in patients with virus-associated tumors (CheckMate 358): efficacy and safety in Merkel cell carcinoma (MCC). [Abstract] Cancer Res 77 (13 Suppl): A-CT074, 2017.
- Tai PT, Yu E, Winquist E, et al.: Chemotherapy in neuroendocrine/Merkel cell carcinoma of the skin: case series and review of 204 cases. J Clin Oncol 18 (12): 2493-9, 2000. [PUBMED Abstract]
- Henness S, Vereecken P: Management of Merkel tumours: an evidence-based review. Curr Opin Oncol 20 (3): 280-6, 2008. [PUBMED Abstract]
- Poulsen M, Rischin D, Walpole E, et al.: High-risk Merkel cell carcinoma of the skin treated with synchronous carboplatin/etoposide and radiation: a Trans-Tasman Radiation Oncology Group Study--TROG 96:07. J Clin Oncol 21 (23): 4371-6, 2003. [PUBMED Abstract]
- Poulsen MG, Rischin D, Porter I, et al.: Does chemotherapy improve survival in high-risk stage I and II Merkel cell carcinoma of the skin? Int J Radiat Oncol Biol Phys 64 (1): 114-9, 2006. [PUBMED Abstract]
- Poulsen M, Walpole E, Harvey J, et al.: Weekly carboplatin reduces toxicity during synchronous chemoradiotherapy for Merkel cell carcinoma of skin. Int J Radiat Oncol Biol Phys 72 (4): 1070-4, 2008. [PUBMED Abstract]
- Voog E, Biron P, Martin JP, et al.: Chemotherapy for patients with locally advanced or metastatic Merkel cell carcinoma. Cancer 85 (12): 2589-95, 1999. [PUBMED Abstract]
Tratamiento del carcinoma de células de Merkel en estadios I y II
El carcinoma de células de Merkel (CCM) en estadio I y II solo incluye a los pacientes con enfermedad local.
La extirpación con márgenes de 1 a 2 cm y la radioterapia son los pilares del tratamiento de los tumores primarios de CCM. A menudo, se recomienda la radioterapia adyuvante dirigida al sitio del tumor primario. Sin embargo, se puede evitar la morbilidad de la radiación y mantener bajas las tasas de recidiva local, como se observa en un subconjunto de pacientes con lesiones pequeñas de riesgo bajo (es decir, tumores que miden <2 cm sin otros factores pronósticos adversos).[1]
Debido al riesgo de enfermedad ganglionar oculta, se recomienda la biopsia del ganglio linfático centinela (GLC) para pacientes sin enfermedad metastásica detectable en forma clínica.[2] En la actualidad, un depósito metastásico de cualquier tamaño se considera resultado positivo para la estadificación de los ganglios linfáticos (N) regionales; en consecuencia, se utilizan pruebas inmunohistoquímicas de forma rutinaria para mejorar la detección de micrometástasis en el GLC.[3,4]
Opciones de tratamiento del carcinoma de células de Merkel en estadio I y II
Las opciones de tratamiento para CCM en estadio I y estadio II son las siguientes:
- Extirpación local con margen sin compromiso tumoral, con intención de mantener la función.
- La evaluación ganglionar quirúrgica, que normalmente se inicia con un procedimiento en el GLC, se puede considerar en aquellos pacientes con riesgo significativo de enfermedad ganglionar. Además, se puede considerar la disección ganglionar definitiva si se encuentra compromiso ganglionar; ello conllevaría a elevar la clasificación del cáncer del paciente a un estadio III.
- Una opción es administrar radioterapia local si hay inquietud sobre el margen de extirpación del tumor primario. A veces se usa radioterapia regional si el procedimiento de estadificación ganglionar es incompleto o se omitió. En los sitios donde la localización de los ganglios linfáticos regionales primarios es incierta (por ejemplo, en la mitad de la espalda), la selección del campo para el ganglio regional es problemática.
- Se alienta la participación en ensayos clínicos.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Frohm ML, Griffith KA, Harms KL, et al.: Recurrence and Survival in Patients With Merkel Cell Carcinoma Undergoing Surgery Without Adjuvant Radiation Therapy to the Primary Site. JAMA Dermatol 152 (9): 1001-7, 2016. [PUBMED Abstract]
- Cassler NM, Merrill D, Bichakjian CK, et al.: Merkel Cell Carcinoma Therapeutic Update. Curr Treat Options Oncol 17 (7): 36, 2016. [PUBMED Abstract]
- Harms PW: Update on Merkel Cell Carcinoma. Clin Lab Med 37 (3): 485-501, 2017. [PUBMED Abstract]
- Su LD, Lowe L, Bradford CR, et al.: Immunostaining for cytokeratin 20 improves detection of micrometastatic Merkel cell carcinoma in sentinel lymph nodes. J Am Acad Dermatol 46 (5): 661-6, 2002. [PUBMED Abstract]
Tratamiento del carcinoma de células de Merkel en estadio III
El carcinoma de células de Merkel (CCM) en estadio III incluye a los pacientes con enfermedad ganglionar.
Opciones de tratamiento del carcinoma de células de Merkel en estadio III
Las opciones de tratamiento para el CCM en estadio III son las siguientes:
- Extirpación local con margen sin compromiso tumoral, con intención de mantener la función.
- Procedimiento en el ganglio centinela seguido, posiblemente, de una cirugía ganglionar regional más definitiva si se encuentra compromiso ganglionar.
- Radiación ganglionar local y regional, especialmente si hay inquietud sobre cuán adecuado es el margen de extirpación del tumor primario o el riesgo de recidiva locorregional después de la cirugía ganglionar (por ejemplo, ganglios primarios múltiples, diseminación extracapsular, invasión linfovascular y evidencia de metástasis en tránsito).
- Se ha administrado quimioterapia sistémica e inmunoterapia a los pacientes con el riesgo más alto de recidiva, pero los datos disponibles no han mostrado ventaja clínica en cuanto a la supervivencia.
- Se alienta la participación en ensayos clínicos.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Tratamiento del carcinoma de células de Merkel en estadio IV
El carcinoma de células de Merkel (CCM) en estadio IV incluye a los pacientes con metástasis a distancia.
La inmunoterapia con un solo fármaco es el tratamiento sistémico inicial preferido para los pacientes con enfermedad metastásica. Se puede considerar la quimioterapia sistémica como opción en los pacientes con enfermedad en estadio IV que tienen un buen estado funcional y que no son aptos para recibir inmunoterapia o su enfermedad progresó mientras recibían este tratamiento. Aunque se observaron respuestas ante diversos regímenes, se carece de evidencia en cuanto a los resultados de la quimioterapia sobre el control permanente de la enfermedad o la supervivencia a largo plazo.
Si la quimioterapia no se considera una opción apropiada, los pacientes con enfermedad en estadio IV pueden considerar someterse a otra cirugía o recibir radioterapia como tratamiento paliativo local o regional.
Opciones de tratamiento del carcinoma de células de Merkel en estadio IV
Las opciones de tratamiento para el CCM en estadio IV son las siguientes:
- Inmunoterapia con un solo fármaco.
- Paliación con quimioterapia, cirugía o radioterapia según lo que resulte apropiado desde el punto de vista clínico.
- Se alienta enfáticamente la participación en ensayos clínicos.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Tratamiento del carcinoma de células de Merkel recidivante
El carcinoma de células Merkel (CMM) es un tumor raro. Las recomendaciones y los resultados de los diversos tratamientos para pacientes con CCM se incluyen en muchas series de casos numerosas [1-3][Nivel de evidencia C2] y en varios ensayos clínicos de fase II.[4][Nivel de evidencia C1] Habitualmente, los tratamientos se individualizan según la preferencia del paciente y los elementos específicos de cada caso. Los pacientes deben considerar la participación en ensayos clínicos.
Opciones de tratamiento del carcinoma de células de Merkel recidivante
Recidiva local
Las opciones de tratamiento para los pacientes con recidiva local incluyen cirugía local más amplia si fuera posible, seguida de radioterapia si no se administró antes.
Asimismo, se puede considerar la disección de ganglios linfáticos regionales (DGLR) si los ganglios regionales de drenaje no se extirparon antes.
Debido a la precariedad del pronóstico después de la recidiva, también se puede considerar la terapia sistémica, aunque no hay evidencia de que mejore la supervivencia.
Recidiva ganglionar
Las opciones del tratamiento para los pacientes con recidiva ganglionar regional sola incluyen la DGLR y la radioterapia adyuvante si los ganglios regionales de drenaje no se trataron antes. Debido a la precariedad del pronóstico después de la recidiva, también se puede considerar la terapia sistémica, aunque no hay datos probatorios de que esta mejore la supervivencia.
Recidiva a distancia
En los pacientes con enfermedad a distancia, varios fármacos de inmunoterapia han producido respuestas duraderas y se recomienda su uso en monoterapia como tratamiento sistémico de primera línea para la mayoría de los pacientes. Entre estos fármacos, el avelumab y el pembrolizumab cuentan con los datos de seguimiento más prolongado publicados. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) autorizó el uso de estos fármacos.[5-7][Nivel de evidencia C3] La FDA también otorgó aprobación acelerada para el retifanlimab, y está pendiente el seguimiento posterior.[8][Nivel de evidencia C3]
La quimioterapia es una opción para los pacientes que no son aptos para recibir inmunoterapia o que su enfermedad progresó mientras recibía este tratamiento, también es una opción para pacientes específicos que obtienen beneficio de una respuesta rápida.[1-4,9,10][Nivel de evidencia C2] Aunque se han notificado respuestas a la quimioterapia en pacientes seleccionados con enfermedad local avanzada y metastásica, la toxicidad ha sido importante y la duración de la respuesta, limitada. Cuando esté indicado se puede ofrecer radioterapia o cirugía como tratamiento paliativo dirigido a los sitios de recidiva, en especial si la quimioterapia no es una opción.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Goessling W, McKee PH, Mayer RJ: Merkel cell carcinoma. J Clin Oncol 20 (2): 588-98, 2002. [PUBMED Abstract]
- Henness S, Vereecken P: Management of Merkel tumours: an evidence-based review. Curr Opin Oncol 20 (3): 280-6, 2008. [PUBMED Abstract]
- Voog E, Biron P, Martin JP, et al.: Chemotherapy for patients with locally advanced or metastatic Merkel cell carcinoma. Cancer 85 (12): 2589-95, 1999. [PUBMED Abstract]
- Poulsen M, Rischin D, Walpole E, et al.: High-risk Merkel cell carcinoma of the skin treated with synchronous carboplatin/etoposide and radiation: a Trans-Tasman Radiation Oncology Group Study--TROG 96:07. J Clin Oncol 21 (23): 4371-6, 2003. [PUBMED Abstract]
- Kaufman HL, Russell JS, Hamid O, et al.: Updated efficacy of avelumab in patients with previously treated metastatic Merkel cell carcinoma after ≥1 year of follow-up: JAVELIN Merkel 200, a phase 2 clinical trial. J Immunother Cancer 6 (1): 7, 2018. [PUBMED Abstract]
- D'Angelo SP, Lebbé C, Mortier L, et al.: First-line avelumab in a cohort of 116 patients with metastatic Merkel cell carcinoma (JAVELIN Merkel 200): primary and biomarker analyses of a phase II study. J Immunother Cancer 9 (7): , 2021. [PUBMED Abstract]
- Nghiem PT, Bhatia S, Lipson EJ, et al.: PD-1 Blockade with Pembrolizumab in Advanced Merkel-Cell Carcinoma. N Engl J Med 374 (26): 2542-52, 2016. [PUBMED Abstract]
- Grignani G, Rutkowski P, Lebbe C, et al.: Updated results from POD1UM-201: A phase II study of retifanlimab in patients with advanced or metastatic Merkel cell carcinoma (MCC). [Abstract] Ann Oncol 34 (Suppl 2): A-1146P, S686, 2023.
- Eng TY, Boersma MG, Fuller CD, et al.: A comprehensive review of the treatment of Merkel cell carcinoma. Am J Clin Oncol 30 (6): 624-36, 2007. [PUBMED Abstract]
- Tai PT, Yu E, Winquist E, et al.: Chemotherapy in neuroendocrine/Merkel cell carcinoma of the skin: case series and review of 204 cases. J Clin Oncol 18 (12): 2493-9, 2000. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (04/24/2024)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Aspectos generales de las opciones de tratamiento del carcinoma de células de Merkel
Se añadió texto para indicar que aunque hay pocos ensayos aleatorizados, varios inhibidores de puntos de control inmunitario han demostrado mejorar la supervivencia y presentan buena tolerabilidad en pacientes con carcinoma de células de Merkel (CCM) avanzado, en comparación con la quimioterapia usada en los controles históricos. Por lo tanto, los inhibidores de puntos de control inmunitario se consideran el tratamiento de primera línea recomendado para la mayoría de pacientes. Hay ensayos en curso para evaluar el uso de los inhibidores de puntos de control inmunitario en el entorno neoadyuvante y adyuvante.
Se añadió Avelumab como subsección nueva.
Se añadió Pembrolizumab como subsección nueva.
Se añadió Retifanlimab como subsección nueva.
Se añadió Nivolumab como subsección nueva.
Tratamiento del carcinoma de células de Merkel en estadio III
Se revisó texto para indicar que se ha administrado quimioterapia sistémica e inmunoterapia a los pacientes con el riesgo más alto de recidiva, pero los datos disponibles no han mostrado ventaja clínica en cuanto a la supervivencia.
Tratamiento del carcinoma de células de Merkel en estadio IV
Se revisó texto para indicar que la inmunoterapia con un solo fármaco es el tratamiento sistémico inicial preferido para los pacientes con enfermedad metastásica. Se puede considerar la quimioterapia sistémica como opción en los pacientes con enfermedad en estadio IV que tienen un buen estado funcional y que no son aptos para recibir inmunoterapia o su enfermedad progresó mientras recibían este tratamiento.
Tratamiento del carcinoma de células de Merkel recidivante
Se revisó texto para indicar que las recomendaciones y los resultados de los diversos tratamientos para pacientes con CCM se incluyen en muchas series de casos numerosas y en varios ensayos clínicos de fase II. Los pacientes deben considerar la participación en ensayos clínicos.
La sección Recidiva a distancia fue objeto de revisión intensiva.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del carcinoma de células de Merkel. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
El revisor principal del sumario sobre Tratamiento del carcinoma de células de Merkel es:
- Shaheer A. Khan, DO (Columbia University Irving Medical Center)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del carcinoma de células de Merkel. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/piel/pro/tratamiento-celulas-de-merkel-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.