Tratamiento del melanoma infantil (PDQ®)–Versión para profesionales de salud
Incidencia
El melanoma, aunque es un cáncer poco frecuente en los niños, es el cáncer de piel más común durante la niñez, seguido del carcinoma de células basales y el carcinoma de células escamosas.[1-8]
En los Estados Unidos, se diagnostican alrededor de 300 casos de melanoma cada año en pacientes menores de 20 años; cifra que representa el 0,3 % de todos los casos nuevos de melanoma.[9] El melanoma explica alrededor del 3 % de todos los cánceres en adolescentes de 15 a 19 años.[10]
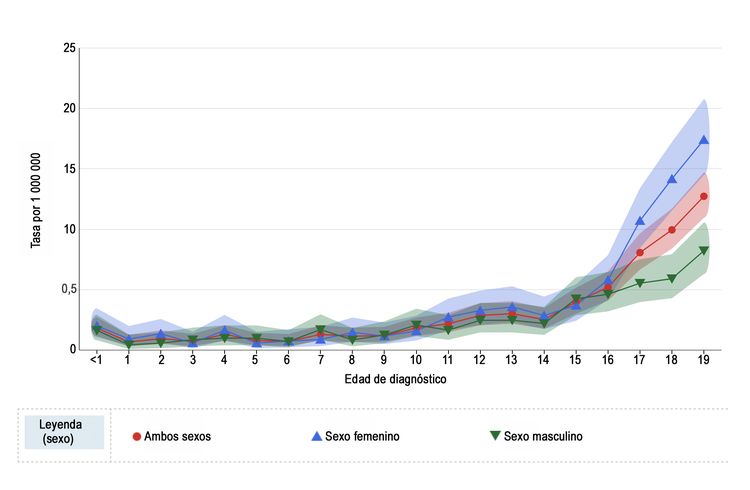
La incidencia anual de melanoma en los Estados Unidos aumenta con la edad, según se indica en la Figura 1 del National Childhood Cancer Registry (NCCR). [10] En los niños menores de 10 años, la tasa de incidencia es de alrededor de 1 a 2 casos por 1 millón de personas. Durante la adolescencia, las tasas aumentan de manera constante con la edad, aunque son mucho más bajas que las tasas observadas en adultos.[10,11]
En la Figura 1 también se observa que, entre los adolescentes de 15 a 19 años, las tasas de melanoma son significativamente más altas en mujeres (10,4 por 1 millón; intervalo de confianza [IC] 95 %, 9,4–11,5) que en hombres (5,7 por 1 millón; IC 95 %, 5,0–6,6). Las tasas de incidencia para niños menores de 15 años no son significativamente diferentes entre niños y niñas.
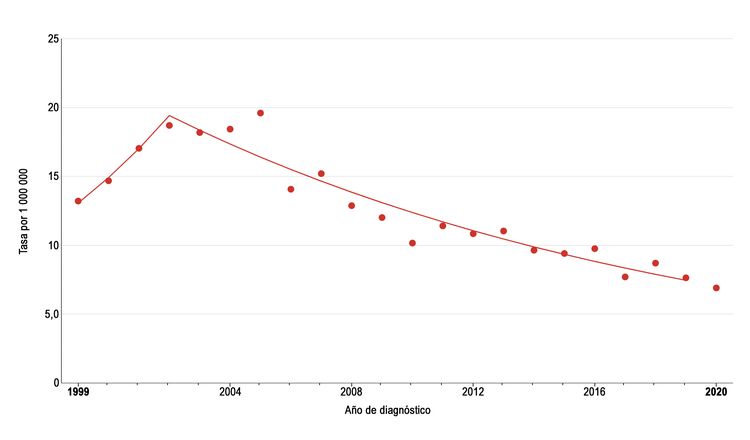
La incidencia de melanoma en pediatría (edad 0–19 años) aumentó en promedio un 1,6 % por año entre 1975 y 1996. Como se observa en la Figura 2, la incidencia de melanoma continuó aumentando durante 2003 para los adolescentes (edad 15–19 años), pero luego cayó de manera significativa alrededor de un 6 % por año.[10] Durante el mismo periodo, la incidencia se redujo un poco en niños de ambos sexos de 0 a 14 años, pero el cambio en el tiempo no fue significativo. La razón de la reducción en la incidencia de melanoma entre adolescentes de 15 a 19 años no se conoce, pero las posibles explicaciones incluyen el uso de bloqueador solar y ropa protectora, aumento de la atención dermatológica y disminución en el acceso a las cámaras de bronceado.[11]
En un estudio retrospectivo de 22 524 informes patológicos de la piel de pacientes menores de 20 años, se identificaron 38 melanomas; entre ellos, 33 en adolescentes de 15 a 19 años. Los investigadores informaron que fue necesario extirpar 479,8 lesiones para identificar 1 melanoma; esto es 20 veces más que la cantidad necesaria en la población adulta.[12]
Bibliografía
- Sasson M, Mallory SB: Malignant primary skin tumors in children. Curr Opin Pediatr 8 (4): 372-7, 1996. [PUBMED Abstract]
- Fishman C, Mihm MC, Sober AJ: Diagnosis and management of nevi and cutaneous melanoma in infants and children. Clin Dermatol 20 (1): 44-50, 2002 Jan-Feb. [PUBMED Abstract]
- Hamre MR, Chuba P, Bakhshi S, et al.: Cutaneous melanoma in childhood and adolescence. Pediatr Hematol Oncol 19 (5): 309-17, 2002 Jul-Aug. [PUBMED Abstract]
- Ceballos PI, Ruiz-Maldonado R, Mihm MC: Melanoma in children. N Engl J Med 332 (10): 656-62, 1995. [PUBMED Abstract]
- Schmid-Wendtner MH, Berking C, Baumert J, et al.: Cutaneous melanoma in childhood and adolescence: an analysis of 36 patients. J Am Acad Dermatol 46 (6): 874-9, 2002. [PUBMED Abstract]
- Pappo AS: Melanoma in children and adolescents. Eur J Cancer 39 (18): 2651-61, 2003. [PUBMED Abstract]
- Huynh PM, Grant-Kels JM, Grin CM: Childhood melanoma: update and treatment. Int J Dermatol 44 (9): 715-23, 2005. [PUBMED Abstract]
- Christenson LJ, Borrowman TA, Vachon CM, et al.: Incidence of basal cell and squamous cell carcinomas in a population younger than 40 years. JAMA 294 (6): 681-90, 2005. [PUBMED Abstract]
- National Cancer Institute: SEER Stat Fact Sheets: Melanoma of the Skin. Bethesda, Md: National Cancer Institute. Available online. Last accessed December 15, 2023.
- National Cancer Institute: NCCR*Explorer: An interactive website for NCCR cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed February 25, 2025.
- Paulson KG, Gupta D, Kim TS, et al.: Age-Specific Incidence of Melanoma in the United States. JAMA Dermatol 156 (1): 57-64, 2020. [PUBMED Abstract]
- Moscarella E, Zalaudek I, Cerroni L, et al.: Excised melanocytic lesions in children and adolescents - a 10-year survey. Br J Dermatol 167 (2): 368-73, 2012. [PUBMED Abstract]
Factores de riesgo
Las afecciones relacionadas con un aumento del riesgo de melanoma en niños y adolescentes son las siguientes:
- Nevos melanocíticos gigantes.[1]
- Xeroderma pigmentoso. Este trastorno recesivo poco frecuente se caracteriza por una sensibilidad extrema a la luz solar, queratosis y diferentes manifestaciones neurológicas.[1] Para obtener más información sobre el xeroderma pigmentoso, consultar Genética del cáncer de piel.
- Inmunodeficiencia o inmunodepresión.[2]
- Retinoblastoma hereditario.[3]
- Síndrome de Werner.[4,5]
- Melanosis neurocutánea. Este trastorno inusual surge en el contexto de nevos melanocíticos congénitos y se caracteriza por nevos congénitos grandes o múltiples en la piel y melanosis meníngea o melanoma. Alrededor del 2,5 % de los pacientes con nevos congénitos grandes presentan esta afección; el riesgo es más alto en quienes tienen muchos nevos satelitales.[6,7]
Los pacientes con melanoma en el sistema nervioso central (SNC) y síndrome de nevos melanocíticos congénitos tienen un pronóstico desfavorable y una mortalidad del 100 %. La mayoría de estos pacientes tienen variantes de NRAS. Por lo tanto, los inhibidores de la vía de la proteína–cinasa activada por mitógenos podrían usarse para el tratamiento de esta enfermedad. Cuatro niños tratados con un inhibidor de MEK presentaron mejorías sintomáticas transitorias; sin embargo, todos los pacientes murieron debido a progresión de la enfermedad.[8] En un registro alemán se identificaron 5 niños con melanomas en el SNC que presentaban melanocitosis neurocutánea.[9] Todos los pacientes murieron entre 0,3 y 0,8 años después del diagnóstico.
- Antecedentes familiares de melanoma.
Los rasgos fenotípicos relacionados con un aumento del riesgo de melanoma en adultos y que también se han documentado en niños y adolescentes con melanoma son los siguientes:[10-16]
- Exposición a los rayos ultravioleta de la luz solar. Una mayor exposición a la radiación ultravioleta (UV) ambiental aumenta el riesgo de contraer la enfermedad.
- Cabello rojo.
- Ojos azules.
- Poca capacidad para broncearse.
- Pecas.
- Nevos displásicos.
- Número elevado de nevos melanocíticos.
Los genes que presentan variantes patogénicas germinales asociadas con aumento del riesgo de melanoma en niños son los siguientes:
- Gen MC1R. Un consorcio internacional realizó una revisión retrospectiva de las variantes patogénicas germinales del gen MC1R.[17] Los investigadores analizaron los datos de 233 pacientes jóvenes (edad ≤20 años), 932 pacientes adultos (edad ≥35 años) y 932 adultos sanos que sirvieron como grupo de control. Las variantes de MC1R fueron más frecuentes en los niños y adolescentes con melanoma que en los adultos con melanoma. Este resultado fue más evidente en pacientes de 18 años o menos.
- Gen CDKN2A (gen p16). El melanoma familiar explica del 8 % al 12 % de los casos de melanoma. Se han descrito variantes patogénicas germinales de p16 en hasta un 7 % de las familias con 2 familiares de primer grado afectados por melanoma, y en hasta un 80 % de las familias con 1 miembro afectado por múltiples melanomas primarios.[18] En un estudio prospectivo de 60 familias con más de 3 miembros con melanoma,[19] se encontró que la mitad de estas familias tenía una variante patogénica germinal de CDKN2A. Con independencia del estado de CDKN2A, el porcentaje de pacientes con melanoma infantil en las familias con predisposición al melanoma es entre 6 y 28 veces el porcentaje de la población general de pacientes con melanoma en los Estados Unidos. En las familias que portan una variante de CDKN2A, los niños con melanoma exhibieron una propensión significativa a tener múltiples melanomas en comparación con los familiares que tenían más de 20 años en el momento del diagnóstico (71 vs. 38 %, respectivamente; P = 0,004). Las familias que portan una variante de CDKN2A tuvieron porcentajes significativamente más altos de pacientes pediátricos con melanoma en comparación con las familias que no portan una variante de CDKN2A (11,1 vs. 2,5 %, respectivamente; P = 0,004).
- Variante de MITF p.E318K. En una serie de pacientes menores de 21 años, 3 de 123 pacientes (2,4 %) exhibían una sustitución en MITF que se consideró que confiere un riesgo moderado de melanoma cutáneo.[20,21]
Bibliografía
- Ceballos PI, Ruiz-Maldonado R, Mihm MC: Melanoma in children. N Engl J Med 332 (10): 656-62, 1995. [PUBMED Abstract]
- Pappo AS: Melanoma in children and adolescents. Eur J Cancer 39 (18): 2651-61, 2003. [PUBMED Abstract]
- Kleinerman RA, Tucker MA, Tarone RE, et al.: Risk of new cancers after radiotherapy in long-term survivors of retinoblastoma: an extended follow-up. J Clin Oncol 23 (10): 2272-9, 2005. [PUBMED Abstract]
- Shibuya H, Kato A, Kai N, et al.: A case of Werner syndrome with three primary lesions of malignant melanoma. J Dermatol 32 (9): 737-44, 2005. [PUBMED Abstract]
- Kleinerman RA, Yu CL, Little MP, et al.: Variation of second cancer risk by family history of retinoblastoma among long-term survivors. J Clin Oncol 30 (9): 950-7, 2012. [PUBMED Abstract]
- Hale EK, Stein J, Ben-Porat L, et al.: Association of melanoma and neurocutaneous melanocytosis with large congenital melanocytic naevi--results from the NYU-LCMN registry. Br J Dermatol 152 (3): 512-7, 2005. [PUBMED Abstract]
- Makkar HS, Frieden IJ: Neurocutaneous melanosis. Semin Cutan Med Surg 23 (2): 138-44, 2004. [PUBMED Abstract]
- Kinsler VA, O'Hare P, Jacques T, et al.: MEK inhibition appears to improve symptom control in primary NRAS-driven CNS melanoma in children. Br J Cancer 116 (8): 990-993, 2017. [PUBMED Abstract]
- Abele M, Forchhammer S, Eigentler TK, et al.: Melanoma of the central nervous system based on neurocutaneous melanocytosis in childhood: A rare but fatal condition. Pediatr Blood Cancer 71 (4): e30859, 2024. [PUBMED Abstract]
- Heffernan AE, O'Sullivan A: Pediatric sun exposure. Nurse Pract 23 (7): 67-8, 71-8, 83-6, 1998. [PUBMED Abstract]
- Berg P, Lindelöf B: Differences in malignant melanoma between children and adolescents. A 35-year epidemiological study. Arch Dermatol 133 (3): 295-7, 1997. [PUBMED Abstract]
- Elwood JM, Jopson J: Melanoma and sun exposure: an overview of published studies. Int J Cancer 73 (2): 198-203, 1997. [PUBMED Abstract]
- Strouse JJ, Fears TR, Tucker MA, et al.: Pediatric melanoma: risk factor and survival analysis of the surveillance, epidemiology and end results database. J Clin Oncol 23 (21): 4735-41, 2005. [PUBMED Abstract]
- Whiteman DC, Valery P, McWhirter W, et al.: Risk factors for childhood melanoma in Queensland, Australia. Int J Cancer 70 (1): 26-31, 1997. [PUBMED Abstract]
- Tucker MA, Fraser MC, Goldstein AM, et al.: A natural history of melanomas and dysplastic nevi: an atlas of lesions in melanoma-prone families. Cancer 94 (12): 3192-209, 2002. [PUBMED Abstract]
- Ducharme EE, Silverberg NB: Pediatric malignant melanoma: an update on epidemiology, detection, and prevention. Cutis 84 (4): 192-8, 2009. [PUBMED Abstract]
- Pellegrini C, Botta F, Massi D, et al.: MC1R variants in childhood and adolescent melanoma: a retrospective pooled analysis of a multicentre cohort. Lancet Child Adolesc Health 3 (5): 332-342, 2019. [PUBMED Abstract]
- Soufir N, Avril MF, Chompret A, et al.: Prevalence of p16 and CDK4 germline mutations in 48 melanoma-prone families in France. The French Familial Melanoma Study Group. Hum Mol Genet 7 (2): 209-16, 1998. [PUBMED Abstract]
- Goldstein AM, Stidd KC, Yang XR, et al.: Pediatric melanoma in melanoma-prone families. Cancer 124 (18): 3715-3723, 2018. [PUBMED Abstract]
- Pellegrini C, Raimondi S, Di Nardo L, et al.: Melanoma in children and adolescents: analysis of susceptibility genes in 123 Italian patients. J Eur Acad Dermatol Venereol 36 (2): 213-221, 2022. [PUBMED Abstract]
- Guhan SM, Artomov M, McCormick S, et al.: Cancer risks associated with the germline MITF(E318K) variant. Sci Rep 10 (1): 17051, 2020. [PUBMED Abstract]
Evaluación diagnóstica
El diagnóstico de melanoma infantil a veces es difícil, muchas de estas lesiones se confunden con las llamadas lesiones melanocíticas con potencial maligno desconocido.[1] En cuanto a sus características biológicas, estas lesiones son diferentes del melanoma y de los nevos benignos.[1,2] Los términos nevo de Spitz y melanoma spitzoide, que también se usan mucho, crean más confusión. En un estudio retrospectivo se encontró que los niños de 10 años o más eran más propensos a presentar lesiones amelanóticas, hemorragia, color uniforme, diámetro variable y elevación (protuberancia nueva).[3][Nivel de evidencia C1]
La evaluación diagnóstica del melanoma infantil incluye los siguientes aspectos:
- Biopsia o extirpación. La biopsia o extirpación es necesaria para diagnosticar cualquier cáncer de piel y decidir si se necesita más tratamiento. Aunque los carcinomas de células basales y los carcinoma de células escamosas por lo general se curan con cirugía sola, el melanoma exige mayor consideración por su potencial de metástasis. El ancho de los márgenes quirúrgicos para la extirpación de un melanoma se determina según el sitio, el tamaño y el grosor de la lesión; y oscila entre 0,5 cm para las lesiones in situ y 2 cm o más para las lesiones más gruesas.[4] En algunos casos específicos es posible que se necesite una extirpación amplia con injerto de piel con el fin de obtener márgenes sin compromiso tumoral. La biopsia parcial por rasurado en ocasiones compromete la microestadificación y se relaciona con tratamientos quirúrgicos definitivos y más invasivos.[5]
- Evaluación ganglionar. La valoración de los ganglios linfáticos regionales mediante biopsia de ganglio linfático centinela se ha vuelto un procedimiento de rutina en muchos centros.[6,7] Se recomienda obtener la biopsia de ganglio linfático centinela en los pacientes con lesiones que miden 0,8 cm o más,[4] y en los pacientes con lesiones de menos de 0,8 cm que presentan ulceración u otras características desfavorables como invasión linfovascular, tasa mitótica alta, edad temprana o biopsia con márgenes positivos para compromiso tumoral.[4,6,8-10]
Las indicaciones para este tipo de biopsia en pacientes con melanomas spitzoides no se han definido con claridad. En una revisión sistemática de 541 pacientes con tumores de Spitz atípicos, 303 (56 %) se sometieron a biopsia de ganglio centinela y 119 (39 %) tenían compromiso de un ganglio centinela. De estos pacientes, 97 se sometieron a otra disección ganglionar y se identificaron ganglios afectados en 18 de ellos (19 %).[11] A pesar de la alta frecuencia de metástasis ganglionares, solo 6 pacientes presentaron enfermedad diseminada. Este resultado desafía el beneficio pronóstico y terapéutico del procedimiento en niños con este tipo de lesiones. En el futuro, los marcadores moleculares, como la presencia de variantes en el promotor de TERT quizás ayuden a identificar qué pacientes se podrían beneficiar de este procedimiento.[12]
En la sección Tratamiento del melanoma infantil se explica la función de la disección ganglionar completa después de identificar compromiso de un ganglio linfático centinela y la utilidad de las terapias adyuvantes en estos pacientes.
- Evaluación de laboratorio y pruebas con imágenes. Los pacientes que presentan un melanoma convencional o de tipo adulto deben someterse a evaluación mediante pruebas de laboratorio e imágenes según las directrices para adultos. Para obtener más información, consultar la sección Información sobre los estadios del melanoma en Tratamiento del melanoma. Por el contrario, los pacientes con melanoma spitzoide tienen un riesgo bajo de recidiva y desenlaces clínicos excelentes, por lo tanto no necesitan una evaluación radiográfica extensa en el momento del diagnóstico ni durante el seguimiento.[13]
Un panel de expertos de diferentes especialidades coordinado por el Children's Oncology Group realizó recomendaciones para la evaluación diagnóstica y el abordaje quirúrgico de los melanomas cutáneos, los tumores de Spitz atípicos y los tumores melanocíticos diferentes a los de Spitz.[14]
Bibliografía
- Berk DR, LaBuz E, Dadras SS, et al.: Melanoma and melanocytic tumors of uncertain malignant potential in children, adolescents and young adults--the Stanford experience 1995-2008. Pediatr Dermatol 27 (3): 244-54, 2010 May-Jun. [PUBMED Abstract]
- Cerroni L, Barnhill R, Elder D, et al.: Melanocytic tumors of uncertain malignant potential: results of a tutorial held at the XXIX Symposium of the International Society of Dermatopathology in Graz, October 2008. Am J Surg Pathol 34 (3): 314-26, 2010. [PUBMED Abstract]
- Cordoro KM, Gupta D, Frieden IJ, et al.: Pediatric melanoma: results of a large cohort study and proposal for modified ABCD detection criteria for children. J Am Acad Dermatol 68 (6): 913-25, 2013. [PUBMED Abstract]
- Ferrari A, Lopez Almaraz R, Reguerre Y, et al.: Cutaneous melanoma in children and adolescents: The EXPeRT/PARTNER diagnostic and therapeutic recommendations. Pediatr Blood Cancer 68 (Suppl 4): e28992, 2021. [PUBMED Abstract]
- Arjunan A, Wardrop M, Malek MM, et al.: Treatment outcomes following partial shave biopsy of atypical and malignant melanocytic tumors in pediatric patients. Melanoma Res 34 (6): 544-548, 2024. [PUBMED Abstract]
- Shah NC, Gerstle JT, Stuart M, et al.: Use of sentinel lymph node biopsy and high-dose interferon in pediatric patients with high-risk melanoma: the Hospital for Sick Children experience. J Pediatr Hematol Oncol 28 (8): 496-500, 2006. [PUBMED Abstract]
- Kayton ML, La Quaglia MP: Sentinel node biopsy for melanocytic tumors in children. Semin Diagn Pathol 25 (2): 95-9, 2008. [PUBMED Abstract]
- Swetter SM, Thompson JA, Albertini MR, et al.: NCCN Guidelines® Insights: Melanoma: Cutaneous, Version 2.2021. J Natl Compr Canc Netw 19 (4): 364-376, 2021. [PUBMED Abstract]
- Ariyan CE, Coit DG: Clinical aspects of sentinel lymph node biopsy in melanoma. Semin Diagn Pathol 25 (2): 86-94, 2008. [PUBMED Abstract]
- Pacella SJ, Lowe L, Bradford C, et al.: The utility of sentinel lymph node biopsy in head and neck melanoma in the pediatric population. Plast Reconstr Surg 112 (5): 1257-65, 2003. [PUBMED Abstract]
- Lallas A, Kyrgidis A, Ferrara G, et al.: Atypical Spitz tumours and sentinel lymph node biopsy: a systematic review. Lancet Oncol 15 (4): e178-83, 2014. [PUBMED Abstract]
- Lee S, Barnhill RL, Dummer R, et al.: TERT Promoter Mutations Are Predictive of Aggressive Clinical Behavior in Patients with Spitzoid Melanocytic Neoplasms. Sci Rep 5: 11200, 2015. [PUBMED Abstract]
- Halalsheh H, Kaste SC, Navid F, et al.: The role of routine imaging in pediatric cutaneous melanoma. Pediatr Blood Cancer 65 (12): e27412, 2018. [PUBMED Abstract]
- Sargen MR, Barnhill RL, Elder DE, et al.: Evaluation and Surgical Management of Pediatric Cutaneous Melanoma and Atypical Spitz and Non-Spitz Melanocytic Tumors (Melanocytomas): A Report From Children's Oncology Group. J Clin Oncol 43 (9): 1157-1167, 2025. [PUBMED Abstract]
Características moleculares
El diagnóstico exacto de las lesiones melanocíticas en pediatría es fundamental para la estratificación del riesgo adecuada y la planificación del tratamiento.
Las afecciones relacionadas con el melanoma que tienen potencial maligno y surgen en la población pediátrica se clasifican en tres grupos generales:[1]
- Tumores melanocíticos spitzoides, que incluyen desde los tumores de Spitz atípicos hasta los melanomas spitzoides.
- Melanoma en adolescentes mayores que comparte características con el melanoma en adultos (es decir, melanoma convencional).
- Nevo melanocítico congénito gigante.
Las lesiones clasificadas como lesiones de Spitz representan un reto diagnóstico y la evaluación morfológica sola tiene grandes limitaciones y exhibe un consenso bajo entre diferentes observadores expertos.[2]
En las lesiones melanocíticas se han notificado alteraciones genómicas que comprometen varios genes. Las características de cada tipo de tumor se resumen en el Cuadro 1.
- El panorama genómico de los melanomas spitzoides se caracteriza por fusiones que afectan varios genes de cinasas, entre ellos, RET, MAP3K8, ROS1, NTRK1, ALK, MET y BRAF.[3-6] Estos genes de fusión se han notificado en cerca del 50 % de los casos y se presentan de manera mutuamente excluyente.[1,4]
- En un análisis retrospectivo de tumores spitzoides de 49 pacientes, se usó secuenciación del genoma completo y del transcriptoma (RNA-Seq) y se encontraron fusiones en el marco de lectura o interrupción por truncamiento del extremo C de MAP3K8 en el 33 % de los casos.[6]
- Las variantes en el promotor de TERT son poco frecuentes en las lesiones melanocíticas spitzoides y solo se observaron en 4 de 56 pacientes evaluados en una serie. No obstante, los 4 casos con variantes en el promotor de TERT presentaron metástasis hematógenas y murieron. Este hallazgo respalda el potencial de las variantes en el promotor de TERT como factor predictivo del comportamiento clínico maligno de las neoplasias melanocíticas spitzoides en la niñez, pero se necesitan más estudios para definir la función del estado del promotor de TERT natural como factor predictivo del comportamiento clínico en pacientes con tumores spitzoides en el sitio primario.[4]
- En un análisis retrospectivo de 352 casos de nevos de Spitz se identificaron oncoiniciadores en el 76 % de los pacientes.[7] Ninguna característica microscópica permitió predecir de manera confiable los casos que presentaban sobrexpresión de ROS1 y NTRK1. Por el contrario, la configuración plexiforme se asoció con sobrexpresión de ALK. La variante de pseudo-schwannoma fue muy sugestiva de casos con reordenamiento de NTRK3. Un tumor atípico maligno, la atipia celular grave y la pérdida de p16 se asociaron con reordenamientos del gen MAP3K8. La arquitectura en láminas y la fibrosis estromal marcada se asociaron con fusiones en BRAF.
En otro estudio, 128 lesiones se clasificaron como tumores de Spitz de acuerdo a sus características morfológicas (80 tumores de Spitz, 26 melanomas de Spitz, 22 melanomas con características de tipo Spitz).[8]
- Se presentaron fusiones o truncamientos de cinasas en el 81 % de los casos de tumores de Spitz y en el 77 % de los casos de melanomas de Spitz. En comparación, el 84 % de los melanomas con características de tipo Spitz tenían variantes de BRAF, NRAS o NF1, y el 61 % de estos casos también exhibían variantes en el promotor de TERT.
- Entre los pacientes del grupo de tumores de Spitz cuyos melanomas recidivaron, 1 paciente con variante BRAF V600E y variante en el promotor de TERT presentó una recidiva a distancia y murió. Otro paciente con una fusión de MAP3K8 tuvo una recidiva local.
- De los pacientes con melanoma de Spitz, 2 presentaron recidivas, ambos tenían variantes BRAF V600E.
- Los 3 pacientes del grupo de melanoma con características spitzoides que presentaron recidiva tenían una variante en BRAF o en NRAS y variantes simultáneas en el promotor de TERT.
- Después de reclasificar a estos pacientes según sus características clínicas y genómicas, y de añadir las variantes de BRAF o NRAS dentro de la categoría de melanoma con características de tipo Spitz, se pudo observar una diferencia significativa en las tasas de supervivencia sin recidiva entre los grupos con tumores de Spitz. Estos hallazgos indican que la incorporación de las características genómicas permite mejorar la clasificación de las lesiones.
Melanoma convencional o clásico. El panorama genómico del melanoma convencional en la niñez se caracteriza por muchas de las alteraciones genómicas que se encuentran en el melanoma de adultos.[1] En un informe del Pediatric Cancer Genome Project se describió que 15 casos de melanoma convencional presentaban una carga elevada de variantes somáticas de un solo nucleótido, variantes en el promotor de TERT (12 de 13) y variantes BRAF V600 activadoras (13 de 15). Los casos de melanoma también presentaban una firma de variantes característica de la lesión por luz ultravioleta (UV). Además, dos tercios de los casos presentaban variantes de MC1R relacionadas con aumento de la susceptibilidad al melanoma. En un estudio australiano se comparó la secuenciación de genoma completo de melanomas en adolescentes y jóvenes (intervalo de edad, 15–30 años) con la secuenciación de melanomas en adultos de más edad.[9] La frecuencia de variantes somáticas en BRAF (96 %) y PTEN (36 %) en la cohorte de adolescentes y jóvenes fue el doble de las tasas observadas en la cohorte de adultos. Los melanomas durante la adolescencia y juventud presentan una proporción más alta de firmas de variantes no relacionadas con la radiación UV que los melanomas de adultos maduros.
Nevos melanocíticos congénitos gigantes. Se informó que los nevos melanocíticos congénitos gigantes tienen variantes activadoras NRASQ61 sin otras variantes recurrentes.[10] También se notificó mosaicismo somático para las variantes NRASQ61 en pacientes con múltiples nevos melanocíticos congénitos y melanosis cutánea.[11]
Al integrar el análisis genómico en la evaluación de las lesiones melanocíticas infantiles es posible optimizar la exactitud del diagnóstico y obtener información pronóstica de importancia para el médico tratante. En un registro prospectivo de 70 pacientes con lesiones melanocíticas infantiles, la evaluación clinicopatológica y genómica integral optimizó el diagnóstico patológico y mejoró la capacidad de predecir desenlaces clínicos en estos pacientes.[12]
- Tumor de Spitz atípico o melanoma de Spitz.
- Los pacientes con tumores de Spitz atípicos o melanomas de Spitz eran más jóvenes y por lo general los tumores estaban en las extremidades.
- Las lesiones genómicas de estos pacientes se caracterizaron por fusiones de cinasas que afectaron con mayor frecuencia los genes MAP3K8 y ALK.
- A pesar de que el 62 % de los pacientes a los que se les tomaron muestras de ganglios linfáticos tenía enfermedad ganglionar, ninguno presentó metástasis a distancia y 2 tuvieron recidivas locorregionales.
- De los 33 pacientes analizados, ninguno presentó variantes en el promotor de TERT. Sin embargo, 15 pacientes tuvieron deleciones de CDKN2A. Estos hallazgos indican que las variantes en el promotor de TERT quizás sean factores pronósticos más acertados del comportamiento clínico agresivo (formación de metástasis) de estas lesiones.
- Melanoma convencional o clásico.
- Los pacientes con melanoma convencional (n = 17) eran mayores y con más frecuencia sus tumores se encontraban en el cuero cabelludo o el torso.
- De 12 pacientes, 7 presentaron compromiso de ganglio linfático centinela.
- De 17 pacientes, 11 presentaron variantes BRAF V600E.
- De 16 pacientes, 7 tenían variantes en el promotor de TERT y 3 de estos pacientes murieron.
- Nevos gigantes.
- De los 4 pacientes con melanoma que surgió a partir de un nevo gigante, todos tenían variantes NRASQ61 y fallecieron por la enfermedad.
| Tumor | Gen afectado |
|---|---|
| Melanoma | BRAF, NRAS, KIT, NF1 |
| Melanoma de Spitz | Fusión de cinasas (RET, ROS, MET, ALK, BRAF, MAP3K8 NTRK1); pérdida de BAP1 en presencia de una variante en BRAF |
| Nevo de Spitz | HRAS; BRAF y NRAS (infrecuentes); fusiones de cinasas (ROS, ALK, NTRK1, BRAF, RET, MAP3K8) |
| Nevo adquirido | BRAF |
| Nevo displásico | BRAF, NRAS |
| Nevo azul | GNAQ |
| Melanoma ocular | GNAQ |
| Nevos congénitos | NRAS |
Bibliografía
- Lu C, Zhang J, Nagahawatte P, et al.: The genomic landscape of childhood and adolescent melanoma. J Invest Dermatol 135 (3): 816-23, 2015. [PUBMED Abstract]
- Gerami P, Busam K, Cochran A, et al.: Histomorphologic assessment and interobserver diagnostic reproducibility of atypical spitzoid melanocytic neoplasms with long-term follow-up. Am J Surg Pathol 38 (7): 934-40, 2014. [PUBMED Abstract]
- Wiesner T, He J, Yelensky R, et al.: Kinase fusions are frequent in Spitz tumours and spitzoid melanomas. Nat Commun 5: 3116, 2014. [PUBMED Abstract]
- Lee S, Barnhill RL, Dummer R, et al.: TERT Promoter Mutations Are Predictive of Aggressive Clinical Behavior in Patients with Spitzoid Melanocytic Neoplasms. Sci Rep 5: 11200, 2015. [PUBMED Abstract]
- Yeh I, Botton T, Talevich E, et al.: Activating MET kinase rearrangements in melanoma and Spitz tumours. Nat Commun 6: 7174, 2015. [PUBMED Abstract]
- Newman S, Fan L, Pribnow A, et al.: Clinical genome sequencing uncovers potentially targetable truncations and fusions of MAP3K8 in spitzoid and other melanomas. Nat Med 25 (4): 597-602, 2019. [PUBMED Abstract]
- Kervarrec T, Pissaloux D, Tirode F, et al.: Morphologic features in a series of 352 Spitz melanocytic proliferations help predict their oncogenic drivers. Virchows Arch 480 (2): 369-382, 2022. [PUBMED Abstract]
- Quan VL, Zhang B, Zhang Y, et al.: Integrating Next-Generation Sequencing with Morphology Improves Prognostic and Biologic Classification of Spitz Neoplasms. J Invest Dermatol 140 (8): 1599-1608, 2020. [PUBMED Abstract]
- Wilmott JS, Johansson PA, Newell F, et al.: Whole genome sequencing of melanomas in adolescent and young adults reveals distinct mutation landscapes and the potential role of germline variants in disease susceptibility. Int J Cancer 144 (5): 1049-1060, 2019. [PUBMED Abstract]
- Charbel C, Fontaine RH, Malouf GG, et al.: NRAS mutation is the sole recurrent somatic mutation in large congenital melanocytic nevi. J Invest Dermatol 134 (4): 1067-74, 2014. [PUBMED Abstract]
- Kinsler VA, Thomas AC, Ishida M, et al.: Multiple congenital melanocytic nevi and neurocutaneous melanosis are caused by postzygotic mutations in codon 61 of NRAS. J Invest Dermatol 133 (9): 2229-36, 2013. [PUBMED Abstract]
- Pappo AS, McPherson V, Pan H, et al.: A prospective, comprehensive registry that integrates the molecular analysis of pediatric and adolescent melanocytic lesions. Cancer 127 (20): 3825-3831, 2021. [PUBMED Abstract]
Pronóstico y factores pronósticos
Los niños y adolescentes con melanoma por lo general tienen un desenlace favorable. En el Cuadro 2 se observan tasas de supervivencia a 5 años para niños y adolescentes con melanoma en los Estados Unidos, según la edad, entre los años 2013 y 2019.[1]
| Edad (años) | Tasa de supervivencia relativa a 5 años (%) | Límite inferior del intervalo de confianza de 95 % | Límite superior del intervalo de confianza de 95 % |
|---|---|---|---|
| aAdaptación de National Childhood Cancer Registry. NCCR*Explorer: An interactive website for NCCR cancer statistics [Internet]. Instituto Nacional del Cáncer; sept. 7 de 2023. [actualizado el 8 de sept. de 2023; citado el 12 de agosto de 2024]. Disponible en: https://nccrexplorer.ccdi.cancer.gov. | |||
| <1 | 85 | 63 | 94 |
| 1–4 | 83 | 71 | 90 |
| 5–9 | 99 | 95 | 100 |
| 10–14 | 95 | 90 | 97 |
| 15–19 | 97 | 95 | 99 |
El melanoma infantil comparte muchas características con el melanoma en adultos, y el pronóstico depende del estadio de la enfermedad.[2] Del mismo modo que en los adultos, la mayoría de los casos en pediatría (cerca del 75 %) tienen una enfermedad localizada y un desenlace excelente.[3-5]
El desenlace de los pacientes con enfermedad ganglionar es intermedio, se anticipa que cerca del 60 % sobrevivirá a largo plazo.[4-6] En un estudio, el desenlace para los pacientes con enfermedad metastásica fue favorable,[4] pero no se logró replicar este resultado en otro estudio de la National Cancer Database.[6]
Los siguientes elementos suelen ser comunes en niños menores de 10 años que tienen melanoma:[2,4,6,7]
- Características de pronóstico precario.
- Raza diferente a la blanca.
- Tumores primarios en la cabeza y el cuello.
- Lesiones primarias más gruesas.
- Incidencia más alta de características morfológicas spitzoides, invasión vascular y metástasis ganglionares.
- Síndromes de predisposición al melanoma.
Se ha generalizado el uso de la biopsia de ganglio linfático centinela para la estadificación del melanoma infantil. El grosor del tumor primario y la presencia de ulceración se correlacionan con una incidencia alta de compromiso ganglionar.[8] Los datos de estudios en los que se analizó el compromiso ganglionar y la ausencia de efecto en el desenlace son los siguientes:
- Los pacientes más jóvenes presentan una incidencia más alta de compromiso ganglionar; pero este hallazgo no afecta significativamente los desenlaces clínicos.[7,9]
- En otra serie de melanoma infantil, una incidencia más alta de compromiso ganglionar no afectó la supervivencia.[10-12]
- En un estudio de cohorte retrospectivo de la National Cancer Database, se revisaron todos los registros de los pacientes con un diagnóstico inicial de melanoma entre 1998 y 2011. Los datos se obtuvieron de historias clínicas, informes quirúrgicos, e informes de patología y no se sometieron a revisión central. Se identificaron 350 928 pacientes con información adecuada; 306 pacientes tenían entre 1 y 10 años (niños), y 3659 pacientes tenían entre 11 y 20 años (adolescentes).[13]
- Los niños presentaron una supervivencia general (SG) más larga que los adolescentes (cociente de riesgos instantáneos [CRI], 0,50; intervalo de confianza [IC] 95 %, 0,25–0,98) y los adultos mayores de 20 años (CRI, 0,11; IC 95 %, 0,06–0,21).
- Los adolescentes tuvieron una SG más larga que los adultos.
- No se encontraron diferencias en la SG entre los niños con compromiso ganglionar y sin este.
- En los niños, la biopsia de ganglio linfático centinela y la disección ganglionar completa no se relacionaron con un aumento de la SG.
- En los adolescentes, el compromiso ganglionar fue un factor de pronóstico adverso significativo (CRI, 4,82; IC 95 %, 3,38–6,87).
La relación entre el grosor de la lesión y el desenlace clínico del melanoma infantil es objeto de controversia.[4-6,14-18] Además, no resulta claro por qué algunas variables que se correlacionan con la supervivencia en los adultos no se repiten en los niños. Una explicación de esta diferencia podría ser la inclusión de pacientes con lesiones que no son verdaderos melanomas en la serie de adultos, si se considera la problemática distinción histológica entre un melanoma verdadero y las lesiones melanocíticas con potencial maligno desconocido. Estos pacientes no se incluyen en los ensayos pediátricos.[19,20]
Bibliografía
- National Cancer Institute: NCCR*Explorer: An interactive website for NCCR cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed February 25, 2025.
- Paradela S, Fonseca E, Pita-Fernández S, et al.: Prognostic factors for melanoma in children and adolescents: a clinicopathologic, single-center study of 137 Patients. Cancer 116 (18): 4334-44, 2010. [PUBMED Abstract]
- Wong JR, Harris JK, Rodriguez-Galindo C, et al.: Incidence of childhood and adolescent melanoma in the United States: 1973-2009. Pediatrics 131 (5): 846-54, 2013. [PUBMED Abstract]
- Strouse JJ, Fears TR, Tucker MA, et al.: Pediatric melanoma: risk factor and survival analysis of the surveillance, epidemiology and end results database. J Clin Oncol 23 (21): 4735-41, 2005. [PUBMED Abstract]
- Brecht IB, Garbe C, Gefeller O, et al.: 443 paediatric cases of malignant melanoma registered with the German Central Malignant Melanoma Registry between 1983 and 2011. Eur J Cancer 51 (7): 861-8, 2015. [PUBMED Abstract]
- Lange JR, Palis BE, Chang DC, et al.: Melanoma in children and teenagers: an analysis of patients from the National Cancer Data Base. J Clin Oncol 25 (11): 1363-8, 2007. [PUBMED Abstract]
- Moore-Olufemi S, Herzog C, Warneke C, et al.: Outcomes in pediatric melanoma: comparing prepubertal to adolescent pediatric patients. Ann Surg 253 (6): 1211-5, 2011. [PUBMED Abstract]
- Mu E, Lange JR, Strouse JJ: Comparison of the use and results of sentinel lymph node biopsy in children and young adults with melanoma. Cancer 118 (10): 2700-7, 2012. [PUBMED Abstract]
- Balch CM, Soong SJ, Gershenwald JE, et al.: Age as a prognostic factor in patients with localized melanoma and regional metastases. Ann Surg Oncol 20 (12): 3961-8, 2013. [PUBMED Abstract]
- Gibbs P, Moore A, Robinson W, et al.: Pediatric melanoma: are recent advances in the management of adult melanoma relevant to the pediatric population. J Pediatr Hematol Oncol 22 (5): 428-32, 2000 Sep-Oct. [PUBMED Abstract]
- Livestro DP, Kaine EM, Michaelson JS, et al.: Melanoma in the young: differences and similarities with adult melanoma: a case-matched controlled analysis. Cancer 110 (3): 614-24, 2007. [PUBMED Abstract]
- Han D, Zager JS, Han G, et al.: The unique clinical characteristics of melanoma diagnosed in children. Ann Surg Oncol 19 (12): 3888-95, 2012. [PUBMED Abstract]
- Lorimer PD, White RL, Walsh K, et al.: Pediatric and Adolescent Melanoma: A National Cancer Data Base Update. Ann Surg Oncol 23 (12): 4058-4066, 2016. [PUBMED Abstract]
- Rao BN, Hayes FA, Pratt CB, et al.: Malignant melanoma in children: its management and prognosis. J Pediatr Surg 25 (2): 198-203, 1990. [PUBMED Abstract]
- Aldrink JH, Selim MA, Diesen DL, et al.: Pediatric melanoma: a single-institution experience of 150 patients. J Pediatr Surg 44 (8): 1514-21, 2009. [PUBMED Abstract]
- Tcheung WJ, Marcello JE, Puri PK, et al.: Evaluation of 39 cases of pediatric cutaneous head and neck melanoma. J Am Acad Dermatol 65 (2): e37-42, 2011. [PUBMED Abstract]
- Ferrari A, Bisogno G, Cecchetto G, et al.: Cutaneous melanoma in children and adolescents: the Italian rare tumors in pediatric age project experience. J Pediatr 164 (2): 376-82.e1-2, 2014. [PUBMED Abstract]
- Stanelle EJ, Busam KJ, Rich BS, et al.: Early-stage non-Spitzoid cutaneous melanoma in patients younger than 22 years of age at diagnosis: long-term follow-up and survival analysis. J Pediatr Surg 50 (6): 1019-23, 2015. [PUBMED Abstract]
- Lohmann CM, Coit DG, Brady MS, et al.: Sentinel lymph node biopsy in patients with diagnostically controversial spitzoid melanocytic tumors. Am J Surg Pathol 26 (1): 47-55, 2002. [PUBMED Abstract]
- Su LD, Fullen DR, Sondak VK, et al.: Sentinel lymph node biopsy for patients with problematic spitzoid melanocytic lesions: a report on 18 patients. Cancer 97 (2): 499-507, 2003. [PUBMED Abstract]
Consideraciones especiales para el tratamiento de niños con cáncer
El cáncer en niños y adolescentes es raro, aunque desde 1975 se ha observado un aumento gradual de la incidencia general.[1] Los niños y adolescentes con cáncer se deben derivar a centros médicos que cuenten con equipos multidisciplinarios de especialistas en oncología con experiencia en el tratamiento de los cánceres que se presentan en la niñez y la adolescencia. Este equipo multidisciplinario incorpora la pericia de los siguientes especialistas en pediatría y otros para asegurar que los niños reciban el tratamiento, los cuidados médicos de apoyo y la rehabilitación que les permitan lograr una supervivencia y calidad de vida óptimas:
- Médicos de atención primaria.
- Cirujanos pediatras.
- Patólogos.
- Radioncólogo pediatras.
- Oncólogos y hematólogos pediatras.
- Oftalmólogos.
- Especialistas en rehabilitación.
- Enfermeros de oncología pediátrica.
- Trabajadores o asistentes sociales.
- Profesionales de la vida infantil.
- Psicólogos.
- Nutricionistas y dietistas.
Para obtener información específica sobre los cuidados médicos de apoyo para niños y adolescentes con cáncer, consultar los resúmenes de Cuidados médicos de apoyo y cuidados paliativos.
La American Academy of Pediatrics estableció pautas para los centros de oncología pediátrica y su función en el tratamiento de los pacientes con cáncer infantil.[2] En estos centros, se dispone de ensayos clínicos para la mayoría de los tipos de cáncer que se presentan en niños y adolescentes, y se ofrece la oportunidad de participar a la mayoría de los pacientes y familiares. Por lo general, los ensayos clínicos para los niños y adolescentes con cáncer se diseñan a fin de comparar un tratamiento que parece mejor con el tratamiento estándar actual. En otros tipos de ensayos clínicos se prueban tratamientos nuevos cuando no hay un tratamiento estándar para el cáncer que se ha diagnosticado. La mayoría de los avances en la identificación de tratamientos curativos para los cánceres infantiles se lograron mediante ensayos clínicos. Para obtener información sobre los ensayos clínicos en curso, consultar el portal de Internet del NCI.
Se han logrado mejoras notables en la supervivencia de niños y adolescentes con cáncer. Entre 1975 y 2020, la mortalidad por cáncer infantil disminuyó en más del 50 %.[3-5] Los sobrevivientes del cáncer que se presenta en edad pediátrica necesitan un seguimiento minucioso, ya que es posible que los efectos secundarios del tratamiento del cáncer persistan o se presenten meses o años después de este. Para obtener información específica sobre la incidencia, el tipo y la vigilancia de los efectos tardíos en los sobrevivientes de cáncer infantil, consultar Efectos tardíos del tratamiento anticanceroso en la niñez.
El cáncer infantil (cáncer en edad pediátrica) es una enfermedad rara con cerca de 15 000 casos anuales diagnosticados antes de los 20 años de edad en los Estados Unidos.[6] En la Rare Diseases Act of 2002 de los Estados Unidos se define una enfermedad rara como la que afecta a poblaciones de menos de 200 000 personas. Por lo tanto, todos los cánceres infantiles se consideran enfermedades raras.
La designación de un tumor raro es diferente entre los grupos pediátricos y de adultos. En el caso de los adultos, se considera que un cáncer es raro cuando su incidencia anual es inferior a 6 casos por 100 000 personas. Representan hasta el 24 % de los cánceres diagnosticados en la Unión Europea y alrededor del 20 % de los cánceres diagnosticados en los Estados Unidos.[7,8] Además, tal como se indica a continuación, la designación de un tumor raro durante la niñez y adolescencia no es uniforme entre los grupos internacionales:
- En una iniciativa conjunta de la European Union Joint Action on Rare Cancers y el European Cooperative Study Group for Rare Pediatric Cancers se estimó que el 11 % de todos los cánceres en pacientes menores de 20 años se podrían clasificar como muy raros. Este grupo de consenso definió los cánceres muy raros como los cánceres con incidencia anual inferior a 2 casos por millón de personas. Sin embargo, también se incluyen en este grupo de tumores muy raros otros 3 tipos histológicos (carcinoma de tiroides, melanoma y cáncer de testículo) con incidencias superiores a 2 casos por millón de personas, porque se cuenta con poco conocimiento y experiencia sobre el tratamiento de estos tumores.[9]
- El Children's Oncology Group (COG) define los cánceres raros en pediatría según la lista del subgrupo XI de la International Classification of Childhood Cancer, en la que se incluyen los cánceres de tiroides, los cánceres de piel melanoma y no melanoma, además de los múltiples tipos de carcinomas (por ejemplo, los carcinomas de corteza suprarrenal, los carcinomas de nasofaringe y la mayoría de los carcinomas de tipo adulto, como los cánceres de mama, los cánceres colorrectales, etc.).[10] Estos cánceres representan casi el 5 % de aquellos diagnosticados entre los 0 y 14 años de edad y casi el 27 % de los que se diagnostican entre los 15 a 19 años de edad.[4]
La mayoría de los cánceres del subgrupo XI son melanomas o cánceres de tiroides, mientras que otros tipos de cáncer solo representan el 2 % de los cánceres diagnosticados entre los 0 y 14 años de edad y el 9,3 % de los cánceres entre los 15 y 19 años de edad.
Estudiar estos cánceres raros es un reto por el número bajo de pacientes con cualquier diagnóstico individual, el predominio de estos cánceres raros en adolescentes y la carencia de ensayos clínicos con adolescentes que tienen estos cánceres.
También es posible obtener información sobre estos tumores en fuentes relacionadas con el cáncer en adultos, por ejemplo, en Tratamiento del melanoma.
Bibliografía
- Smith MA, Seibel NL, Altekruse SF, et al.: Outcomes for children and adolescents with cancer: challenges for the twenty-first century. J Clin Oncol 28 (15): 2625-34, 2010. [PUBMED Abstract]
- American Academy of Pediatrics: Standards for pediatric cancer centers. Pediatrics 134 (2): 410-4, 2014. Also available online. Last accessed February 25, 2025.
- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014. [PUBMED Abstract]
- National Cancer Institute: NCCR*Explorer: An interactive website for NCCR cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed February 25, 2025.
- Surveillance Research Program, National Cancer Institute: SEER*Explorer: An interactive website for SEER cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed December 30, 2024.
- Ward E, DeSantis C, Robbins A, et al.: Childhood and adolescent cancer statistics, 2014. CA Cancer J Clin 64 (2): 83-103, 2014 Mar-Apr. [PUBMED Abstract]
- Gatta G, Capocaccia R, Botta L, et al.: Burden and centralised treatment in Europe of rare tumours: results of RARECAREnet-a population-based study. Lancet Oncol 18 (8): 1022-1039, 2017. [PUBMED Abstract]
- DeSantis CE, Kramer JL, Jemal A: The burden of rare cancers in the United States. CA Cancer J Clin 67 (4): 261-272, 2017. [PUBMED Abstract]
- Ferrari A, Brecht IB, Gatta G, et al.: Defining and listing very rare cancers of paediatric age: consensus of the Joint Action on Rare Cancers in cooperation with the European Cooperative Study Group for Pediatric Rare Tumors. Eur J Cancer 110: 120-126, 2019. [PUBMED Abstract]
- Pappo AS, Krailo M, Chen Z, et al.: Infrequent tumor initiative of the Children's Oncology Group: initial lessons learned and their impact on future plans. J Clin Oncol 28 (33): 5011-6, 2010. [PUBMED Abstract]
Tratamiento del melanoma infantil
El European Cooperative Study Group for Pediatric Rare Tumors que es parte del proyecto PARTNER (Paediatric Rare Tumours Network - European Registry) publicó recomendaciones para el diagnóstico y tratamiento de niños y adolescentes con melanoma cutáneo. Algunas de estas recomendaciones se han incorporado y resumido en las secciones que siguen.[1] Un panel de expertos de diferentes especialidades coordinado por el Children's Oncology Group realizó recomendaciones para la evaluación diagnóstica y el abordaje quirúrgico de los melanomas cutáneos, los tumores de Spitz atípicos y los tumores melanocíticos diferentes a los de Spitz.[2]
Las opciones de tratamiento del melanoma infantil son las siguientes:
- Cirugía y, en determinados casos, biopsia de ganglio linfático centinela con disección ganglionar.
- Inhibidores de puntos de control inmunitario o inhibidores de BRAF/MEK.
Cirugía
La cirugía es el tratamiento preferido para los pacientes con melanoma localizado. Las directrices actuales recomiendan los siguientes márgenes de resección:
- 0,5 cm para el melanoma in situ.
- 1 cm para el melanoma de menos de 1 mm de grosor.
- 1 cm a 2 cm para el melanoma de 1,01 mm a 2 mm de grosor.
- 2 cm para un tumor de más de 2 mm de grosor.
Se deberá considerar una biopsia de ganglio linfático centinela en los pacientes con lesiones delgadas (≤1 mm) y ulceración, tasa mitótica mayor de 1/mm2, edad temprana, y lesiones de más de 1 mm, con características adversas o sin ellas. Los pacientes más jóvenes tienen una incidencia más alta de compromiso de ganglio linfático centinela, y esta característica afecta de manera adversa los desenlaces clínicos.[3,4]
Si hay compromiso del ganglio linfático centinela, se deberá analizar la opción de una disección ganglionar completa. En un ensayo de adultos participaron 1934 pacientes con compromiso de ganglio linfático centinela detectado mediante prueba inmunohistoquímica o reacción en cadena de la polimerasa. Los pacientes se asignaron al azar a someterse a una disección ganglionar completa u observación. La tasa de supervivencia a 3 años específica para el melanoma fue similar en ambos grupos (86 %), mientras que la tasa de supervivencia sin enfermedad (SSE) fue un poco más alta en el grupo de disección (68 vs. 63 %; P = 0,05). Esta ventaja de la SSE se relacionó con una disminución en la tasa de recidiva ganglionar debido a que no hubo diferencia en las tasas de supervivencia sin metástasis a distancia. Se desconoce la forma en que estos resultados afectarán la determinación futura del tratamiento quirúrgico del melanoma durante la infancia y adolescencia.[5]
Inhibidor de puntos de control inmunitario e inhibidores de BRAF o MEK
Las terapias dirigidas y la inmunoterapia que han demostrado eficacia para los adultos con melanoma deberían probarse en pacientes pediátricos con melanoma convencional y con enfermedad metastásica, recidivante o progresiva.
Evidencia (terapia dirigida e inmunoterapia):
- En un ensayo de fase I de ipilimumab en niños y adolescentes, que recibieron una dosis de 5 mg/kg o 10 mg/kg cada 3 semanas durante 4 ciclos, se inscribieron 12 pacientes con melanoma.[6]
- Un paciente presentó enfermedad estable prolongada.
- Este tratamiento se relacionó con un perfil de toxicidad similar al que se observó en los adultos.
- En un estudio de fase II de ipilimumab en adolescentes con melanoma no se logró la meta de inscripción y se cerró. No obstante, en pacientes de 12 a 17 años con melanoma se notificó actividad de este medicamento y un perfil de inocuidad similar al de adultos.[7][Nivel de evidencia B4]
- Después de 1 año, 3 de 4 pacientes que recibieron 3 mg/kg, y 5 de 8 pacientes que recibieron 10 mg/kg seguían vivos.
- Se observó respuesta parcial en 2 pacientes que recibieron 10 mg/kg, y enfermedad estable en 1 paciente que recibió 3 mg/kg.
- En los adultos con melanoma cutáneo en estadio III que se extirpó por completo, se demostró un aumento de la SSE y la supervivencia general con la administración de ipilimumab en dosis de 10 mg/kg cada 3 semanas durante 4 dosis, seguidas de 1 dosis cada 3 meses hasta un máximo de 3 años. Este régimen causó poca alteración de la calidad de vida relacionada con la salud.
- En un ensayo de fase I/II de nivolumab en niños y adultos con tumores sólidos o linfoma en recaída o resistentes al tratamiento, se administró a los pacientes una dosis de 3 mg/kg cada 14 días.[8]
- El único paciente con melanoma no respondió al tratamiento.
- En un ensayo de fase I/II sin anonimato y de un solo grupo de pembrolizumab en pacientes pediátricos con melanoma en estadio avanzado, o con tumores sólidos o linfoma resistentes al tratamiento, en recaída, en estadio avanzado o positivos para el ligando 1 de muerte celular programada (PD-L1), se notificó lo siguiente:[9]
- Se inscribieron 8 pacientes con melanoma y no se observaron respuestas en estos pacientes.
- De estos pacientes, 5 eran negativos para PD-L1.
- El Children's Oncology Group llevó adelante un ensayo de fase I/II de ipilimumab y nivolumab en 55 niños y adultos jóvenes con tumores sólidos resistentes al tratamiento o recidivantes.[10]
- En el estudio se determinó una dosis recomendada para la fase II de 3 mg/kg para el nivolumab y de 1 mg/kg para el ipilimumab.
- En el ensayo no se incluyeron pacientes con melanoma. Sin embargo, se observaron respuestas parciales en un paciente con rabdomiosarcoma y en un paciente con sarcoma de Ewing.
- En una revisión retrospectiva se identificaron 99 pacientes con melanoma (edad, 18 años o menos) que se trataron con terapia sistémica en 15 centros académicos italianos. De los pacientes, 81 recibieron terapia anti–PD-1. La mediana de edad fue de 14 años (intervalo, 2–18 años), y 37 pacientes tenían 12 años o menos. De los pacientes, 38 recibieron terapia anti–PD-1 en el entorno adyuvante.[11]
- En los pacientes que recibieron terapia adyuvante anti–PD-1, la tasa de supervivencia sin progresión a 3 años fue de 70,6 %, y la tasa de supervivencia general (SG) fue del 81,1 %.
- De los 56 pacientes que recibieron terapia sistémica para la enfermedad avanzada, 43 recibieron terapia de primera línea a base de anti–PD-1, mientras que 12 pacientes recibieron una segunda línea y 5 pacientes recibieron una tercera línea. Entre los pacientes que recibieron terapia de primera línea con anti–PD-1 en monoterapia, la tasa de respuesta objetiva fue del 25 %, y la tasa de SG a 3 años fue del 34 %.
- Los efectos tóxicos fueron congruentes con los de los estudios previos en los que se incluyeron pacientes adultos con melanoma.
- El dabrafenib y el trametinib se estudiaron en dos ensayos de pacientes pediátricos con gliomas de grado bajo que albergaban alteraciones BRAF V600. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó esta combinación para dicha indicación.[12,13] La FDA también aprobó esta indicación para el tratamiento de pacientes con melanoma.
No se han realizado ensayos específicos para el tratamiento de pacientes pediátricos con melanoma. Sin embargo, la FDA aprobó las siguientes terapias dirigidas e inmunoterapias para pacientes pediátricos y adolescentes con melanoma a partir de los estudios en poblaciones de adultos que incluyeron o no la participación de pacientes en edad pediátrica:
- A partir de los buenos resultados de dos ensayos clínicos aleatorizados, la FDA aprobó el uso de pembrolizumab adyuvante para el tratamiento de pacientes de 12 años o más con melanoma resecado en estadio IIb, IIc y III.[14,15]
- A partir de los buenos resultados de dos ensayos clínicos aleatorizados, la FDA aprobó el uso de nivolumab adyuvante para el tratamiento de pacientes de 12 años o más con melanoma resecado en estadio IIb a IV.[16,17]
- A partir de los buenos resultados de un ensayo clínico aleatorizado realizado en adultos, la FDA aprobó el uso de nivolumab e ipilimumab para el tratamiento de niños de 12 años o más con melanoma irresecable o metastásico.[18]
- A partir de los buenos resultados de un ensayo clínico aleatorizado, la FDA aprobó el uso de nivolumab con relatlimab para el tratamiento de niños de 12 año o más con melanoma irresecable o metastásico.[19]
- Si bien no se han realizado ensayos clínicos prospectivos con inhibidores de BRAF o MEK en niños y adolescentes con melanoma, en dos estudios de adultos se observó que la combinación adyuvante de dabrafenib y trametinib produce un riesgo significativamente más bajo de recidiva en pacientes con melanoma en estadio III resecado mediante cirugía y en pacientes con melanoma metastásico que alberga la alteración BRAF V600 y que no recibieron tratamiento.[20,21] La FDA otorgó la aprobación acelerada a esta combinación de medicamentos para el tratamiento de pacientes con melanoma irresecable o metastásico que alberga variantes BRAF V600E o V600K y para el tratamiento adyuvante de pacientes con melanoma que alberga variantes BRAF V600E o V600K.
Para obtener más información, consultar Tratamiento del melanoma.
Bibliografía
- Ferrari A, Lopez Almaraz R, Reguerre Y, et al.: Cutaneous melanoma in children and adolescents: The EXPeRT/PARTNER diagnostic and therapeutic recommendations. Pediatr Blood Cancer 68 (Suppl 4): e28992, 2021. [PUBMED Abstract]
- Sargen MR, Barnhill RL, Elder DE, et al.: Evaluation and Surgical Management of Pediatric Cutaneous Melanoma and Atypical Spitz and Non-Spitz Melanocytic Tumors (Melanocytomas): A Report From Children's Oncology Group. J Clin Oncol 43 (9): 1157-1167, 2025. [PUBMED Abstract]
- Mu E, Lange JR, Strouse JJ: Comparison of the use and results of sentinel lymph node biopsy in children and young adults with melanoma. Cancer 118 (10): 2700-7, 2012. [PUBMED Abstract]
- Han D, Zager JS, Han G, et al.: The unique clinical characteristics of melanoma diagnosed in children. Ann Surg Oncol 19 (12): 3888-95, 2012. [PUBMED Abstract]
- Eggermont AM, Chiarion-Sileni V, Grob JJ, et al.: Prolonged Survival in Stage III Melanoma with Ipilimumab Adjuvant Therapy. N Engl J Med 375 (19): 1845-1855, 2016. [PUBMED Abstract]
- Merchant MS, Wright M, Baird K, et al.: Phase I Clinical Trial of Ipilimumab in Pediatric Patients with Advanced Solid Tumors. Clin Cancer Res 22 (6): 1364-70, 2016. [PUBMED Abstract]
- Geoerger B, Bergeron C, Gore L, et al.: Phase II study of ipilimumab in adolescents with unresectable stage III or IV malignant melanoma. Eur J Cancer 86: 358-363, 2017. [PUBMED Abstract]
- Davis KL, Fox E, Merchant MS, et al.: Nivolumab in children and young adults with relapsed or refractory solid tumours or lymphoma (ADVL1412): a multicentre, open-label, single-arm, phase 1-2 trial. Lancet Oncol 21 (4): 541-550, 2020. [PUBMED Abstract]
- Geoerger B, Kang HJ, Yalon-Oren M, et al.: Pembrolizumab in paediatric patients with advanced melanoma or a PD-L1-positive, advanced, relapsed, or refractory solid tumour or lymphoma (KEYNOTE-051): interim analysis of an open-label, single-arm, phase 1-2 trial. Lancet Oncol 21 (1): 121-133, 2020. [PUBMED Abstract]
- Davis KL, Fox E, Isikwei E, et al.: A Phase I/II Trial of Nivolumab plus Ipilimumab in Children and Young Adults with Relapsed/Refractory Solid Tumors: A Children's Oncology Group Study ADVL1412. Clin Cancer Res 28 (23): 5088-5097, 2022. [PUBMED Abstract]
- Mandalà M, Ferrari A, Brecht IB, et al.: Efficacy of anti PD-1 therapy in children and adolescent melanoma patients (MELCAYA study). Eur J Cancer 211: 114305, 2024. [PUBMED Abstract]
- Hargrave DR, Bouffet E, Tabori U, et al.: Efficacy and Safety of Dabrafenib in Pediatric Patients with BRAF V600 Mutation-Positive Relapsed or Refractory Low-Grade Glioma: Results from a Phase I/IIa Study. Clin Cancer Res 25 (24): 7303-7311, 2019. [PUBMED Abstract]
- Bouffet E, Hansford JR, Garrè ML, et al.: Dabrafenib plus Trametinib in Pediatric Glioma with BRAF V600 Mutations. N Engl J Med 389 (12): 1108-1120, 2023. [PUBMED Abstract]
- Eggermont AMM, Blank CU, Mandala M, et al.: Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. N Engl J Med 378 (19): 1789-1801, 2018. [PUBMED Abstract]
- Luke JJ, Rutkowski P, Queirolo P, et al.: Pembrolizumab versus placebo as adjuvant therapy in completely resected stage IIB or IIC melanoma (KEYNOTE-716): a randomised, double-blind, phase 3 trial. Lancet 399 (10336): 1718-1729, 2022. [PUBMED Abstract]
- Kirkwood JM, Del Vecchio M, Weber J, et al.: Adjuvant nivolumab in resected stage IIB/C melanoma: primary results from the randomized, phase 3 CheckMate 76K trial. Nat Med 29 (11): 2835-2843, 2023. [PUBMED Abstract]
- Weber J, Mandala M, Del Vecchio M, et al.: Adjuvant Nivolumab versus Ipilimumab in Resected Stage III or IV Melanoma. N Engl J Med 377 (19): 1824-1835, 2017. [PUBMED Abstract]
- Wolchok JD, Chiarion-Sileni V, Gonzalez R, et al.: Overall Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med 377 (14): 1345-1356, 2017. [PUBMED Abstract]
- Tawbi HA, Schadendorf D, Lipson EJ, et al.: Relatlimab and Nivolumab versus Nivolumab in Untreated Advanced Melanoma. N Engl J Med 386 (1): 24-34, 2022. [PUBMED Abstract]
- Robert C, Karaszewska B, Schachter J, et al.: Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med 372 (1): 30-9, 2015. [PUBMED Abstract]
- Long GV, Hauschild A, Santinami M, et al.: Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma. N Engl J Med 377 (19): 1813-1823, 2017. [PUBMED Abstract]
Opciones de tratamiento en evaluación clínica para el melanoma infantil
La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación, se presenta un ejemplo de un ensayo clínico nacional o institucional en curso:
- NCT02332668 (A Study of Pembrolizumab [MK-3475] in Pediatric Participants With Advanced Melanoma or Advanced, Relapsed, or Refractory PD-L1-Positive Solid Tumors or Lymphoma [MK-3475-051/KEYNOTE-051]): este es un estudio en dos partes de pembrolizumab en niños con melanoma en estadio avanzado, o un tumor sólido o linfoma en estadio avanzado, en recaída o resistente al tratamiento positivo para el ligando 1 de muerte celular programada (PD-L1). En la parte 1 se intentará encontrar la dosis máxima tolerada o administrada, confirmar la dosis, y determinar la dosis recomendada de fase II para el tratamiento con pembrolizumab. En la parte 2 se evaluarán con mayor profundidad la inocuidad y la eficacia de la dosis de la fase II recomendada para pacientes pediátricos.
Actualizaciones más recientes a este resumen (05/02/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se añadió texto para indicar que la biopsia parcial por rasurado en ocasiones compromete la microestadificación y se relaciona con tratamientos quirúrgicos definitivos y más invasivos (se citó a Arjunan et al. como referencia 5).
Se añadió texto para indicar que un panel de expertos de diferentes especialidades coordinado por el Children's Oncology Group realizó recomendaciones para la evaluación diagnóstica y el abordaje quirúrgico de los melanomas cutáneos, los tumores de Spitz atípicos y los tumores melanocíticos diferentes a los de Spitz (se citó a Sargen et al. como referencia 14).
Tratamiento del melanoma infantil
Se añadió texto para indicar que un panel de expertos de diferentes especialidades coordinado por el Children's Oncology Group realizó recomendaciones para la evaluación diagnóstica y el abordaje quirúrgico de los melanomas cutáneos, los tumores de Spitz atípicos y los tumores melanocíticos diferentes a los de Spitz (se citó a Sargen et al. como referencia 2).
Se añadió texto sobre los resultados de una revisión retrospectiva en la que se identificaron 99 pacientes con melanoma que se trataron con terapia sistémica, 81 de los cuales recibieron terapia anti–PD-1 (se citó a Mandalà et al. como referencia 11).
El Consejo editorial del PDQ sobre el tratamiento pediátrico es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del melanoma infantil. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento pediátrico, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del melanoma infantil son:
- Denise Adams, MD (Children's Hospital Boston)
- Karen J. Marcus, MD, FACR (Dana-Farber of Boston Children's Cancer Center and Blood Disorders Harvard Medical School)
- William H. Meyer, MD
- Paul A. Meyers, MD (Memorial Sloan-Kettering Cancer Center)
- Thomas A. Olson, MD (Aflac Cancer and Blood Disorders Center of Children's Healthcare of Atlanta - Egleston Campus)
- Arthur Kim Ritchey, MD (Children's Hospital of Pittsburgh of UPMC)
- Carlos Rodriguez-Galindo, MD (St. Jude Children's Research Hospital)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento pediátrico emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento pediátrico. PDQ Tratamiento del melanoma infantil. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/piel/pro/tratamiento-melanoma-infantil-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.