Tratamiento del cáncer de pulmón de células no pequeñas (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer de pulmón de células no pequeñas
El cáncer de pulmón de células no pequeñas (CPCNP) incluye todos los tipos de cáncer epitelial de pulmón excepto el cáncer de pulmón de células pequeñas (CPCP). Los tipos más comunes de CPCNP son el carcinoma de células escamosas, el carcinoma de células grandes y el adenocarcinoma. Hay otros tipos menos frecuentes y variantes histológicas poco comunes en todos los tipos. Aunque el CPCNP se relaciona con el consumo de cigarrillos, es posible que se presenten adenocarcinomas en pacientes que nunca fumaron.
El CPCNP suele ser un tipo de cáncer menos sensible a la quimioterapia y la radioterapia que el CPCP. En ocasiones, los pacientes con enfermedad resecable se curan con cirugía sola o cirugía seguida de quimioterapia. El control local se puede lograr con radioterapia en muchos pacientes que tienen una enfermedad irresecable, pero solo unos pocos se curan. Los pacientes con enfermedad localmente avanzada irresecable a veces logran una supervivencia prolongada con radioterapia y quimioterapia. Los pacientes con enfermedad metastásica avanzada pueden obtener una mejora de la supervivencia y paliación de los síntomas con quimioterapia, fármacos dirigidos y otras medidas de apoyo.
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por cáncer de pulmón (CPCNP y CPCP combinados) en los Estados Unidos para 2024:[1]
- Casos nuevos: 234 580.
- Defunciones: 125 070.
El cáncer de pulmón es la principal causa de mortalidad por cáncer en los Estados Unidos. De 2013 a 2019, la tasa de supervivencia relativa a 5 años en los pacientes de cáncer de pulmón fue del 25 %. La tasa de supervivencia relativa a 5 años para los pacientes con enfermedad en estadio localizado (63 %), estadio regional (35 %) y estadio a distancia (8 %) varía mucho.[1]
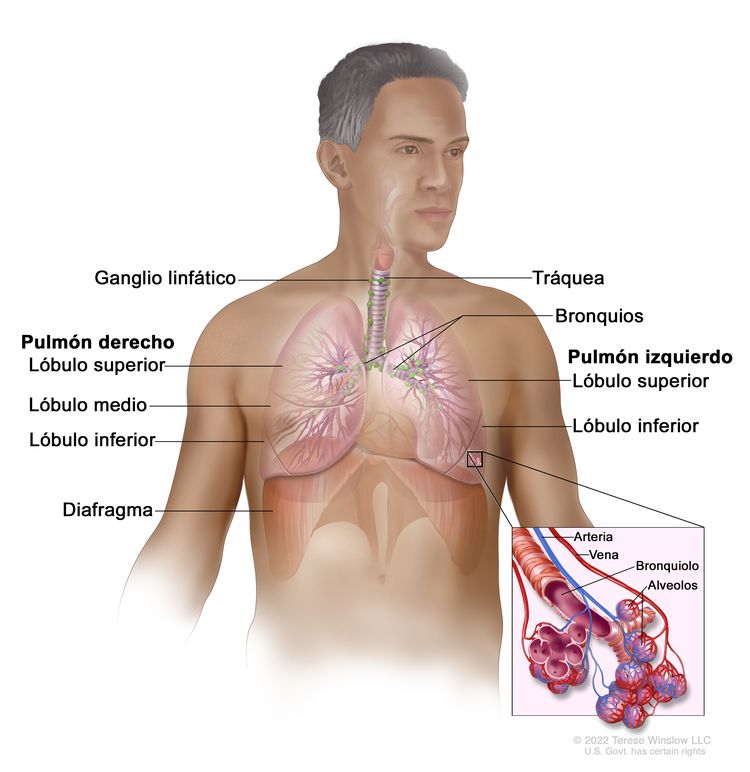
Características anatómicas
El CPCNP surge de las células epiteliales pulmonares desde los bronquios principales hasta los alvéolos terminales. El tipo histológico de CPCNP se correlaciona con el sitio de origen y refleja las variaciones epiteliales de las vías respiratorias desde los bronquios hasta los alvéolos. Por lo general, el carcinoma de células escamosas surge cerca de un bronquio principal. El adenocarcinoma y el carcinoma bronquioloalveolar por lo común surgen en el tejido pulmonar periférico.
Patogenia
La carcinogénesis pulmonar relacionada con el consumo de cigarrillos es un proceso de múltiples fases. El carcinoma de células escamosas y el adenocarcinoma tienen lesiones precursoras premalignas específicas. Antes de que el epitelio pulmonar cause invasión, se observan cambios morfológicos como los siguientes:
- Hiperplasia.
- Metaplasia.
- Displasia.
- Carcinoma in situ.
La displasia y el carcinoma in situ se consideran las principales lesiones premalignas porque es más probable que progresen a un cáncer invasivo y es menos probable que desaparezcan de manera espontánea.
Factores de riesgo
El envejecimiento es el factor de riesgo más importante para la mayoría de los cánceres. Otros factores de riesgo del cáncer de pulmón son los siguientes:
- Antecedentes o consumo actual de tabaco: cigarrillos, pipas y cigarros.[2]
- Exposición pasiva a las sustancias causantes de cáncer del humo ambiental de tabaco.[3,4]
- Exposición ocupacional al amianto, arsénico, cromo, berilio, níquel u otras sustancias.[5]
- Exposición a cualquiera de las siguientes fuentes de radiación:
- Residencia en un área con contaminación ambiental.[10-12]
- Antecedentes familiares de cáncer de pulmón.[13]
- Infección por el virus de la inmunodeficiencia humana.[14]
- Complementos de betacaroteno en personas que fuman mucho.[15,16]
El factor de riesgo más importante para el cáncer de pulmón es el consumo de cigarrillos. Para un fumador, el riesgo de cáncer de pulmón es, en promedio, 10 veces más alto que para una persona que nunca fumó o una persona que fumó <100 cigarrillos durante toda la vida. El riesgo aumenta con la cantidad de cigarrillos, la duración del hábito y la edad de inicio.
El abandono del hábito de fumar disminuye las lesiones precancerosas y el riesgo de cáncer de pulmón. Los exfumadores siguen teniendo un riesgo alto de cáncer de pulmón durante años después de dejar de fumar. La exposición al amianto (asbesto) quizás tenga un efecto sinérgico con el consumo de cigarrillos en el riesgo de cáncer de pulmón.[17]
Además, después de la resección de un cáncer de pulmón, el riesgo anual de que se presente un segundo cáncer de pulmón es del 1 al 2 % en cada paciente.[18]
Un número importante de pacientes que se curan de un cáncer de pulmón vinculado al consumo de tabaco presentan una segunda neoplasia maligna. En el ensayo del Lung Cancer Study Group en el que se estudió a un grupo de 907 pacientes con tumores resecados en estadio T1, N0, la tasa anual de segundos cánceres no pulmonares fue del 1,8 % y la tasa anual de nuevos cánceres pulmonares fue del 1,6 %.[19] En otros estudios se notificó un riesgo aún más alto de segundos tumores en sobrevivientes a largo plazo, incluso tasas del 10 % para segundos cánceres de pulmón y del 20 % para todos los segundos cánceres.[20]
Debido al riesgo persistente de segundos canceres de pulmón en los exfumadores, se han evaluado diversas estrategias de quimioprevención en ensayos controlados aleatorizados. En ninguno de los ensayos de fase III con betacaroteno, retinol, ácido 13-cis retinoico, alfatocoferol, N-acetilcisteína o ácido acetilsalicílico se demostraron resultados beneficiosos reproducibles.[16,21-24][Nivel de evidencia A1] Se está evaluando la quimioprevención de segundos cánceres primarios de tracto aerodigestivo superior para pacientes de cáncer de pulmón en estadio temprano.
Para obtener más información, consultar Prevención del cáncer de pulmón.
Exámenes de detección
En pacientes que tienen un riesgo alto de cáncer de pulmón, la única modalidad de examen de detección temprana que demostró cambio en la mortalidad es la tomografía computarizada (TC) helicoidal de dosis bajas.[25] En los estudios no se logró demostrar que la detección por medio de radiografía del tórax y análisis citológico del esputo disminuya las tasas de mortalidad por cáncer de pulmón.
Para obtener más información, consultar la sección Exámenes de detección con tomografía computarizada de dosis bajas; Beneficios en Exámenes de detección del cáncer de pulmón.
Cuadro clínico inicial
Es posible que el cáncer de pulmón produzca síntomas o se encuentre de manera fortuita en una imagen del tórax. Los síntomas más comunes en el momento del cuadro clínico inicial son los siguientes:
- Tos que empeora.
- Dolor torácico.
- Hemoptisis.
- Malestar general.
- Pérdida de peso.
- Disnea.
- Ronquera.
En ocasiones los síntomas son consecuencia de la invasión local o la compresión de estructuras torácicas adyacentes, por ejemplo, compresión del esófago que causa disfagia, compresión de los nervios laríngeos que causa ronquera, o compresión de la vena cava superior que causa edema facial y distensión de las venas superficiales de la cabeza y el cuello.
A veces se presentan síntomas de metástasis a distancia, entre estos, alteraciones neurológicas o cambios en la personalidad debidos a una metástasis encefálica o dolor por una metástasis ósea. Muy pocas veces, los pacientes tienen síntomas y signos iniciales de enfermedades paraneoplásicas como un hipocratismo digital por la osteoartropatía hipertrófica o una hipercalcemia debido a la producción de una proteína similar a la hormona paratiroidea.
Durante el examen físico, quizás se identifique linfadenopatía supraclavicular, derrame pleural, colapso lobar, neumonía no resuelta o signos de enfermedades relacionadas, como la enfermedad pulmonar obstructiva crónica o la fibrosis pulmonar.
Diagnóstico
Las pruebas complementarias para los pacientes en quienes se sospecha un CPCNP se dirigen a confirmar el diagnóstico y determinar el grado de la enfermedad. Las opciones de tratamiento se determinan a partir del tipo histológico, el estadio, la salud general y las comorbilidades del paciente.
Los procedimientos que se usan para determinar la presencia de cáncer son los siguientes:
- Anamnesis.
- Examen físico.
- Pruebas de laboratorio habituales.
- Radiografía del tórax.
- TC del tórax con contraste.
- Biopsia.
Antes de que el paciente empiece el tratamiento del cáncer de pulmón, un patólogo con experiencia en este tipo de cáncer debe revisar el material patológico. Esto es muy importante porque en el examen microscópico el CPCNP se puede confundir con el CPCP, que reacciona bien a la quimioterapia y que por lo general no se trata con cirugía.[26] Aunque las pruebas inmunohistoquímicas y de microscopía electrónica son muy valiosas para el diagnóstico y la subclasificación, la mayoría de los tumores de pulmón se clasifican mediante criterios de microscopía óptica.
Para obtener más información sobre las pruebas y procedimientos que se usan en la estadificación, consultar la sección Evaluación general para la estadificación.
Factores pronósticos
En varios estudios se intentó identificar la importancia pronóstica de una variedad de factores clinicopatológicos.[20,27-30] Los factores que se correlacionan con un pronóstico precario son los siguientes:
- Estadio más avanzado.
- Síntomas pulmonares o constitucionales.
- Tumor de tamaño grande (>3 cm).
- Metástasis en múltiples ganglios linfáticos dentro de una estación ganglionar TNM definida.[31-41] Para obtener más información, consultar la sección Evaluación de las metástasis ganglionares mediastínicas.
- Invasión vascular.[28,42-44]
Para los pacientes con enfermedad inoperable, un estado funcional precario y una pérdida de peso corporal de más del 10 % afectan el pronóstico de manera adversa. Estos pacientes se excluyen de los ensayos clínicos para evaluar intervenciones multimodales intensivas.
En múltiples análisis retrospectivos de datos de ensayos clínicos, la edad avanzada sola no modificó la respuesta al tratamiento o la supervivencia.[45]
Debido a que el tratamiento es insatisfactorio para casi todos los pacientes de CPCNP, los pacientes aptos deberán considerar la participación en ensayos clínicos. Para obtener información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2024. American Cancer Society, 2024. Available online. Last accessed December 30, 2024.
- Alberg AJ, Ford JG, Samet JM, et al.: Epidemiology of lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 132 (3 Suppl): 29S-55S, 2007. [PUBMED Abstract]
- Tulunay OE, Hecht SS, Carmella SG, et al.: Urinary metabolites of a tobacco-specific lung carcinogen in nonsmoking hospitality workers. Cancer Epidemiol Biomarkers Prev 14 (5): 1283-6, 2005. [PUBMED Abstract]
- Anderson KE, Kliris J, Murphy L, et al.: Metabolites of a tobacco-specific lung carcinogen in nonsmoking casino patrons. Cancer Epidemiol Biomarkers Prev 12 (12): 1544-6, 2003. [PUBMED Abstract]
- Straif K, Benbrahim-Tallaa L, Baan R, et al.: A review of human carcinogens--part C: metals, arsenic, dusts, and fibres. Lancet Oncol 10 (5): 453-4, 2009. [PUBMED Abstract]
- Friedman DL, Whitton J, Leisenring W, et al.: Subsequent neoplasms in 5-year survivors of childhood cancer: the Childhood Cancer Survivor Study. J Natl Cancer Inst 102 (14): 1083-95, 2010. [PUBMED Abstract]
- Gray A, Read S, McGale P, et al.: Lung cancer deaths from indoor radon and the cost effectiveness and potential of policies to reduce them. BMJ 338: a3110, 2009. [PUBMED Abstract]
- Berrington de González A, Kim KP, Berg CD: Low-dose lung computed tomography screening before age 55: estimates of the mortality reduction required to outweigh the radiation-induced cancer risk. J Med Screen 15 (3): 153-8, 2008. [PUBMED Abstract]
- Shimizu Y, Kato H, Schull WJ: Studies of the mortality of A-bomb survivors. 9. Mortality, 1950-1985: Part 2. Cancer mortality based on the recently revised doses (DS86). Radiat Res 121 (2): 120-41, 1990. [PUBMED Abstract]
- Katanoda K, Sobue T, Satoh H, et al.: An association between long-term exposure to ambient air pollution and mortality from lung cancer and respiratory diseases in Japan. J Epidemiol 21 (2): 132-43, 2011. [PUBMED Abstract]
- Cao J, Yang C, Li J, et al.: Association between long-term exposure to outdoor air pollution and mortality in China: a cohort study. J Hazard Mater 186 (2-3): 1594-600, 2011. [PUBMED Abstract]
- Hales S, Blakely T, Woodward A: Air pollution and mortality in New Zealand: cohort study. J Epidemiol Community Health 66 (5): 468-73, 2012. [PUBMED Abstract]
- Lissowska J, Foretova L, Dabek J, et al.: Family history and lung cancer risk: international multicentre case-control study in Eastern and Central Europe and meta-analyses. Cancer Causes Control 21 (7): 1091-104, 2010. [PUBMED Abstract]
- Shiels MS, Cole SR, Kirk GD, et al.: A meta-analysis of the incidence of non-AIDS cancers in HIV-infected individuals. J Acquir Immune Defic Syndr 52 (5): 611-22, 2009. [PUBMED Abstract]
- The effect of vitamin E and beta carotene on the incidence of lung cancer and other cancers in male smokers. The Alpha-Tocopherol, Beta Carotene Cancer Prevention Study Group. N Engl J Med 330 (15): 1029-35, 1994. [PUBMED Abstract]
- Omenn GS, Goodman GE, Thornquist MD, et al.: Effects of a combination of beta carotene and vitamin A on lung cancer and cardiovascular disease. N Engl J Med 334 (18): 1150-5, 1996. [PUBMED Abstract]
- Wingo PA, Ries LA, Giovino GA, et al.: Annual report to the nation on the status of cancer, 1973-1996, with a special section on lung cancer and tobacco smoking. J Natl Cancer Inst 91 (8): 675-90, 1999. [PUBMED Abstract]
- Johnson BE: Second lung cancers in patients after treatment for an initial lung cancer. J Natl Cancer Inst 90 (18): 1335-45, 1998. [PUBMED Abstract]
- Thomas P, Rubinstein L: Cancer recurrence after resection: T1 N0 non-small cell lung cancer. Lung Cancer Study Group. Ann Thorac Surg 49 (2): 242-6; discussion 246-7, 1990. [PUBMED Abstract]
- Martini N, Bains MS, Burt ME, et al.: Incidence of local recurrence and second primary tumors in resected stage I lung cancer. J Thorac Cardiovasc Surg 109 (1): 120-9, 1995. [PUBMED Abstract]
- van Boxem AJ, Westerga J, Venmans BJ, et al.: Photodynamic therapy, Nd-YAG laser and electrocautery for treating early-stage intraluminal cancer: which to choose? Lung Cancer 31 (1): 31-6, 2001. [PUBMED Abstract]
- Blumberg J, Block G: The Alpha-Tocopherol, Beta-Carotene Cancer Prevention Study in Finland. Nutr Rev 52 (7): 242-5, 1994. [PUBMED Abstract]
- Lippman SM, Lee JJ, Karp DD, et al.: Randomized phase III intergroup trial of isotretinoin to prevent second primary tumors in stage I non-small-cell lung cancer. J Natl Cancer Inst 93 (8): 605-18, 2001. [PUBMED Abstract]
- van Zandwijk N, Dalesio O, Pastorino U, et al.: EUROSCAN, a randomized trial of vitamin A and N-acetylcysteine in patients with head and neck cancer or lung cancer. For the EUropean Organization for Research and Treatment of Cancer Head and Neck and Lung Cancer Cooperative Groups. J Natl Cancer Inst 92 (12): 977-86, 2000. [PUBMED Abstract]
- Aberle DR, Adams AM, Berg CD, et al.: Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med 365 (5): 395-409, 2011. [PUBMED Abstract]
- Travis WD, Colby TV, Corrin B, et al.: Histological typing of lung and pleural tumours. 3rd ed. Springer-Verlag, 1999.
- Albain KS, Crowley JJ, LeBlanc M, et al.: Survival determinants in extensive-stage non-small-cell lung cancer: the Southwest Oncology Group experience. J Clin Oncol 9 (9): 1618-26, 1991. [PUBMED Abstract]
- Macchiarini P, Fontanini G, Hardin MJ, et al.: Blood vessel invasion by tumor cells predicts recurrence in completely resected T1 N0 M0 non-small-cell lung cancer. J Thorac Cardiovasc Surg 106 (1): 80-9, 1993. [PUBMED Abstract]
- Ichinose Y, Yano T, Asoh H, et al.: Prognostic factors obtained by a pathologic examination in completely resected non-small-cell lung cancer. An analysis in each pathologic stage. J Thorac Cardiovasc Surg 110 (3): 601-5, 1995. [PUBMED Abstract]
- Fontanini G, Bigini D, Vignati S, et al.: Microvessel count predicts metastatic disease and survival in non-small cell lung cancer. J Pathol 177 (1): 57-63, 1995. [PUBMED Abstract]
- Sayar A, Turna A, Kiliçgün A, et al.: Prognostic significance of surgical-pathologic multiple-station N1 disease in non-small cell carcinoma of the lung. Eur J Cardiothorac Surg 25 (3): 434-8, 2004. [PUBMED Abstract]
- Osaki T, Nagashima A, Yoshimatsu T, et al.: Survival and characteristics of lymph node involvement in patients with N1 non-small cell lung cancer. Lung Cancer 43 (2): 151-7, 2004. [PUBMED Abstract]
- Ichinose Y, Kato H, Koike T, et al.: Overall survival and local recurrence of 406 completely resected stage IIIa-N2 non-small cell lung cancer patients: questionnaire survey of the Japan Clinical Oncology Group to plan for clinical trials. Lung Cancer 34 (1): 29-36, 2001. [PUBMED Abstract]
- Tanaka F, Yanagihara K, Otake Y, et al.: Prognostic factors in patients with resected pathologic (p-) T1-2N1M0 non-small cell lung cancer (NSCLC). Eur J Cardiothorac Surg 19 (5): 555-61, 2001. [PUBMED Abstract]
- Asamura H, Suzuki K, Kondo H, et al.: Where is the boundary between N1 and N2 stations in lung cancer? Ann Thorac Surg 70 (6): 1839-45; discussion 1845-6, 2000. [PUBMED Abstract]
- Riquet M, Manac'h D, Le Pimpec-Barthes F, et al.: Prognostic significance of surgical-pathologic N1 disease in non-small cell carcinoma of the lung. Ann Thorac Surg 67 (6): 1572-6, 1999. [PUBMED Abstract]
- van Velzen E, Snijder RJ, Brutel de la Rivière A, et al.: Lymph node type as a prognostic factor for survival in T2 N1 M0 non-small cell lung carcinoma. Ann Thorac Surg 63 (5): 1436-40, 1997. [PUBMED Abstract]
- Vansteenkiste JF, De Leyn PR, Deneffe GJ, et al.: Survival and prognostic factors in resected N2 non-small cell lung cancer: a study of 140 cases. Leuven Lung Cancer Group. Ann Thorac Surg 63 (5): 1441-50, 1997. [PUBMED Abstract]
- Izbicki JR, Passlick B, Karg O, et al.: Impact of radical systematic mediastinal lymphadenectomy on tumor staging in lung cancer. Ann Thorac Surg 59 (1): 209-14, 1995. [PUBMED Abstract]
- Martini N, Burt ME, Bains MS, et al.: Survival after resection of stage II non-small cell lung cancer. Ann Thorac Surg 54 (3): 460-5; discussion 466, 1992. [PUBMED Abstract]
- Naruke T, Goya T, Tsuchiya R, et al.: Prognosis and survival in resected lung carcinoma based on the new international staging system. J Thorac Cardiovasc Surg 96 (3): 440-7, 1988. [PUBMED Abstract]
- Thomas P, Doddoli C, Thirion X, et al.: Stage I non-small cell lung cancer: a pragmatic approach to prognosis after complete resection. Ann Thorac Surg 73 (4): 1065-70, 2002. [PUBMED Abstract]
- Macchiarini P, Fontanini G, Hardin MJ, et al.: Relation of neovascularisation to metastasis of non-small-cell lung cancer. Lancet 340 (8812): 145-6, 1992. [PUBMED Abstract]
- Khan OA, Fitzgerald JJ, Field ML, et al.: Histological determinants of survival in completely resected T1-2N1M0 nonsmall cell cancer of the lung. Ann Thorac Surg 77 (4): 1173-8, 2004. [PUBMED Abstract]
- Earle CC, Tsai JS, Gelber RD, et al.: Effectiveness of chemotherapy for advanced lung cancer in the elderly: instrumental variable and propensity analysis. J Clin Oncol 19 (4): 1064-70, 2001. [PUBMED Abstract]
Clasificación celular y molecular del cáncer de pulmón de células no pequeñas
La Organización Mundial de la Salud (OMS) y la International Association for the Study of Lung Cancer (IASLC) clasificaron los tumores epiteliales malignos de células no pequeñas de pulmón. Los tres subtipos principales de cáncer de pulmón de células no pequeñas (CPCNP) son los siguientes:
- Carcinoma de células escamosas (25 % de los cánceres de pulmón).
- Adenocarcinoma (40 % de los cánceres de pulmón).
- Carcinoma de células grandes (10 % de los cánceres de pulmón).
Hay otros tipos adicionales, como carcinoma adenoescamoso, carcinomas sarcomatoides, tumores de tipo de glándulas salivales y otros carcinomas sin clasificación. Existen muchos subtipos en estas categorías.[1]
Tipos de tumores
Carcinoma de células escamosas
La mayoría de los carcinomas de células escamosas de pulmón tienen una ubicación central en los bronquios principales. Los carcinomas de células escamosas tienen un vínculo más fuerte con el consumo de tabaco que otras formas de CPCNP. La incidencia del carcinoma de células escamosas de pulmón ha disminuido en los últimos años.
Adenocarcinoma
Ahora el adenocarcinoma es el subtipo histológico predominante en muchos países y su subclasificación es importante. La frecuencia de la heterogeneidad histológica es una de las características más problemáticas de los adenocarcinomas de pulmón. Son más comunes los adenocarcinomas que tienen mezclas de subtipos histológicos que los tumores con una configuración única (acinar, papilar o bronquioloalveolar) o un adenocarcinoma sólido con formación de mucina.
Los criterios para el diagnóstico del carcinoma bronquioloalveolar han variado mucho en el pasado. La definición actual de la OMS/IASLC es mucho más restringida que la que usaban la mayoría de los patólogos antes porque se restringe solo a los tumores no invasivos.
Si se identifica la invasión estromal, vascular o pleural de un adenocarcinoma que tiene un componente de carcinoma bronquioloalveolar extenso, la clasificación sería un adenocarcinoma de subtipo mixto con predominio de una configuración bronquioloalveolar acompañada de una configuración focal acinar, sólida o papilar, según lo que se observe en el componente invasivo. Sin embargo, no está claro si el carcinoma bronquioloalveolar seguirá siendo una entidad clínica separada. En 2011 un grupo multidisciplinario de expertos representantes de la IASLC, la American Thoracic Society y la European Respiratory Society propusieron una revisión importante de la clasificación de adenocarcinomas que implica la reclasificación de lo que se denominaba carcinoma bronquioloalveolar en subgrupos histológicos nuevos.
En la clasificación de la OMS/IASLC se reconocen las siguientes variantes de adenocarcinoma:
- Adenocarcinoma fetal bien diferenciado.
- Adenocarcinoma mucinoso (coloide).
- Cistoadenocarcinoma mucinoso.
- Adenocarcinoma de células en anillo de sello.
- Adenocarcinoma de células claras.
Carcinoma de células grandes
Además de la categoría general de carcinoma de células grandes, en la clasificación de OMS/IASLC se reconocen variantes poco comunes como las siguientes:
- Carcinoma neuroendocrino de células grandes.
- Carcinoma basaloide.
- Carcinoma tipo linfoepitelioma.
- Carcinoma de células claras.
- Carcinoma de células grandes con fenotipo rabdoide.
El carcinoma basaloide también se reconoce como una variante del carcinoma de células escamosas y, en pocas ocasiones, los adenocarcinomas tienen una configuración basaloide; sin embargo, se considera que los tumores sin ninguna de estas características son variantes del carcinoma de células grandes.
Tumores neuroendocrinos
El carcinoma neuroendocrino de células grandes se reconoce como un tipo histológico de grado alto del carcinoma de células no pequeñas. Tiene un pronóstico muy precario, similar al del cáncer de pulmón de células pequeñas (CPCP). El carcinoide atípico se reconoce como un tumor neuroendocrino de grado intermedio cuyo pronóstico se ubica entre el del carcinoide típico, el CPCP de grado alto y el carcinoma neuroendocrino de células grandes.
La diferenciación neuroendocrina se identifica mediante análisis inmunohistoquímico o microscopía electrónica entre el 10 % y el 20 % de los CPCNP comunes sin morfología neuroendocrina. En el esquema de clasificación de la OMS/IASLC no se incluyen oficialmente estos tumores porque no se ha establecido bien la importancia clínica y terapéutica de la diferenciación neuroendocrina del CPCNP. Estos tumores se conocen en grupo como CPCNP con diferenciación neuroendocrina.
Carcinomas con elementos pleomórficos, sarcomatoides o sarcomatosos
Este grupo de tumores es poco frecuente. Los carcinomas de células fusiformes y los carcinomas de células gigantes representan solo el 0,4 % de todas las neoplasias malignas de pulmón, y los carcinosarcomas representan solo el 0,1 % de todas las neoplasias malignas de pulmón. Además, este grupo de tumores representan una serie continua que tiene heterogeneidad histológica, así como características de diferenciación epitelial y mesenquimatosa. A partir de los datos clínicos y moleculares, se considera que el blastoma pulmonar bifásico es parte del grupo de carcinomas con elementos pleomórficos, sarcomatoides o sarcomatosos.
Características moleculares
La identificación de mutaciones en el cáncer de pulmón llevó a la formulación de la terapia dirigida molecular para mejorar la supervivencia en subgrupos de pacientes con enfermedad metastásica.[2] En particular, ahora es posible definir subgrupos de adenocarcinoma según la presencia de mutaciones específicas en los genes que codifican los componentes del receptor del factor de crecimiento epidérmico (EGFR) y de las vías de señalización de proteínas cinasas activadas por mitógeno (MAPK) y de las fosfatidilinositol 3-cinasas (PI3K). Estas mutaciones quizás permitan definir mecanismos de sensibilidad farmacológica y resistencia primaria o adquirida a los inhibidores de la cinasas. Las alteraciones genómicas que quizás sirvan de diana para las terapias aprobadas o para los tratamientos que están en desarrollo incluyen a los siguientes genes:
- EGFR.
- ALK.
- BRAF.
- ROS1.
- RET.
- NTRK1, NTRK2 y NTRK3.
- MET.
- KRAS.
- HER2.
Las mutaciones en EGFR y ALK predominan en los adenocarcinomas de personas no fumadoras, y las mutaciones en KRAS y BRAF son más comunes en fumadores o exfumadores. Las mutaciones en EGFR permiten predecir mejorías en la tasa de respuesta y la supervivencia sin progresión de los pacientes que reciben inhibidores de EGFR. En un conjunto de 2142 muestras de adenocarcinoma de pulmón de pacientes tratados en el Memorial Sloan Kettering Cancer Center, se encontraron deleciones del exón 19 de EGFR y la mutación L858R en EGFR en el 15 % de los tumores de exfumadores (181 de 1218; intervalo de confianza [IC] 95 % 13–17 %), el 6 % de los fumadores activos (20 de 344; IC 95 %, 4–9 %), y el 52 % de aquellos que nunca fumaron (302 de 580; IC 95 %, 48–56 %; P< 0,001 para los que alguna vez fumaron vs. quienes nunca fumaron).[3]
Las fusiones de los genes ALK y EML4 producen translocaciones entre el 3 % y el 7 % de los pacientes con CPCNP no seleccionados que responden a la inhibición farmacológica de ALK con fármacos como el crizotinib. También se notificaron fusiones sensibilizantes de ALK con otros genes.
Bibliografía
- Travis WD, Brambilla E, Nicholson AG, et al.: The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol 10 (9): 1243-1260, 2015. [PUBMED Abstract]
- Pao W, Girard N: New driver mutations in non-small-cell lung cancer. Lancet Oncol 12 (2): 175-80, 2011. [PUBMED Abstract]
- D'Angelo SP, Pietanza MC, Johnson ML, et al.: Incidence of EGFR exon 19 deletions and L858R in tumor specimens from men and cigarette smokers with lung adenocarcinomas. J Clin Oncol 29 (15): 2066-70, 2011. [PUBMED Abstract]
Información sobre los estadios del cáncer de pulmón de células no pequeñas
Evaluación general para la estadificación
La determinación del estadio del cáncer de pulmón de células no pequeñas (CPCNP) tiene consecuencias terapéuticas y pronósticas importantes. Es fundamental hacer una evaluación diagnóstica cuidadosa inicial para establecer la localización y el grado de compromiso tumoral primario y metastásico a fin de proporcionar a los pacientes una atención adecuada.
En general, los síntomas, los signos físicos, los hallazgos de laboratorio y la percepción del riesgo de metástasis a distancia sirven para evaluar si hay metástasis a distancia. A veces se hacen otras pruebas, como gammagrafías óseas y tomografías computarizadas (TC) o imágenes por resonancia magnética (IRM) del encéfalo si se sospecha que hay metástasis en la evaluación inicial o si se está considerando iniciar un tratamiento local intensivo y de modalidad combinada para los pacientes con enfermedad en estadio III.
El estadio tiene una importancia decisiva para la selección del tratamiento. El estadio de la enfermedad se basa en una combinación de factores clínicos y patológicos.[1] La distinción entre estadio clínico y estadio patológico se deberá considerar cuando se evalúan los informes de resultados de supervivencia.
Los procedimientos que se utilizan para determinar el estadio son los siguientes:
- Anamnesis.
- Examen físico.
- Pruebas de laboratorio habituales.
- Radiografía del tórax.
- TC del tórax con contraste.
- Tomografía por emisión de positrones con flúor F 18-fludesoxiglucosa (TEP con 18F-FDG).
Los procedimientos que se usan para obtener muestras de tejido son la broncoscopia, la mediastinoscopia o la mediastinotomía anterior.
La estadificación patológica del CPCNP exige que se examine el tumor, conozcan los márgenes de resección y determine el estado de los ganglios linfáticos.
En el momento del diagnóstico, los pacientes de CPCNP se dividen en tres grupos que reflejan tanto el grado de extensión de la enfermedad como el abordaje de tratamiento. Estos grupos son los siguientes:
- Enfermedad resecable mediante cirugía (por lo general, estadio l, estadio II y determinados tumores en estadio III).
- Tiene el mejor pronóstico, que depende de una variedad de factores relacionados con el tumor y el paciente.
- Los pacientes con enfermedad resecable que tienen contraindicaciones médicas para la cirugía son aptos para recibir radioterapia curativa.
- La quimioterapia adyuvante combinada posoperatoria a base de cisplatino a veces ofrece una ventaja para la supervivencia de los pacientes con CPCNP en estadio II o IIIA que tuvieron una resección tumoral.
- Enfermedad avanzada local (T3–T4) o regional (N2–N3).
- Tiene una evolución natural variada.
- Determinados pacientes con tumores avanzados a nivel local se benefician de los tratamientos de modalidad combinada.
- Los pacientes con enfermedad irresecable o enfermedad N2–N3 se tratan con radioterapia combinada con quimioterapia.
- Determinados pacientes con enfermedad T3 o N2 se tratan de manera eficaz con resección quirúrgica y quimioterapia preoperatoria o posoperatoria, o con quimiorradioterapia.
- Enfermedad con metástasis a distancia (incluye metástasis a distancia [M1] identificadas en el momento del diagnóstico).
- Es posible que se trate con terapia sistémica (quimioterapia, inmunoterapia o terapia dirigida). A veces, se usa radioterapia para la paliación.
Evaluación de las metástasis ganglionares mediastínicas
Evaluación quirúrgica
La estadificación quirúrgica del mediastino se considera estándar cuando se necesita una evaluación exacta del estado ganglionar para determinar el tratamiento.
La estadificación exacta de los ganglios linfáticos mediastínicos proporciona información pronóstica importante.
Evidencia (estado ganglionar):
- La relación entre la supervivencia y el número de ganglios linfáticos examinados durante la cirugía de pacientes con CPCNP en estadio I tratados con resección quirúrgica definitiva se evaluó a partir de información de la base de datos poblacional Surveillance, Epidemiology and End Results (SEER) Program del período 1990–2000.[2] Participaron 16 800 pacientes en el estudio.
- El análisis de la supervivencia general de los pacientes que no recibieron radioterapia, se realizó al comparar el grupo de referencia (1 a 4 ganglios) con los siguientes grupos:
- Los pacientes con 5 a 8 ganglios linfáticos evaluados durante la cirugía presentaron un aumento de la supervivencia moderado pero estadísticamente significativo, con un cociente de riesgos instantáneos (CRI) proporcional de 0,90 (intervalo de confianza [IC] 95 %, 0,84–0,97).
- En los pacientes con 9 a 12 ganglios evaluados, el CRI fue de 0,86 (IC 95 %, 0,79–0,95).
- En los pacientes con 13 a 16 ganglios evaluados, el CRI fue de 0,78 (IC 95 %, 0,68–0,90).
- No hubo mejoría gradual después de la evaluación de más de 16 ganglios linfáticos.
Los resultados correspondientes a la mortalidad específica por cáncer de pulmón en los pacientes que recibieron radioterapia no fueron muy diferentes.
- Estos resultados indican que la supervivencia de los pacientes después de la resección del CPCNP se relaciona con el número de ganglios linfáticos evaluados durante la cirugía. Debido a que es muy probable que esto se deba a una reducción del error de estadificación, es decir, una menor probabilidad de pasar por alto los ganglios linfáticos comprometidos a medida que aumenta el número de ganglios sometidos a muestreo, se indica que la evaluación del estado ganglionar debe incluir entre 11 y 16 ganglios linfáticos.
- El análisis de la supervivencia general de los pacientes que no recibieron radioterapia, se realizó al comparar el grupo de referencia (1 a 4 ganglios) con los siguientes grupos:
Imágenes por tomografía computarizada
La tomografía computarizada (TC) se usa principalmente para determinar el tamaño del tumor. La TC se debe extender hacía abajo para incluir el hígado y las glándulas suprarrenales. Las imágenes por resonancia magnética (IRM) del tórax y el abdomen superior no ofrecen ventajas sobre la TC.[3]
Evidencia (exploración con TC):
- Se realizó una revisión sistemática de la bibliografía médica sobre la exactitud de la TC para la estadificación mediastínica no invasiva del cáncer de pulmón. En los 35 estudios publicados entre 1991 y junio de 2006, se identificaron 5111 pacientes evaluables. En casi todos los estudios se especificó que la TC se hizo después de la administración intravenosa de material de contraste y que un resultado positivo se definía por la presencia de uno o más ganglios linfáticos con un diámetro de más de 1 cm en el eje corto.[4]
- La mediana de prevalencia de metástasis mediastínica fue del 28 % (intervalo, 18–56 %).
- Los cálculos conjuntos de la TC para identificar una metástasis ganglionar mediastínica fueron del 51 % (IC 95 %, 47–54 %) para la sensibilidad y del 86 % (IC 95 %, 84–88 %) para la especificidad. Se detallaron los correspondientes cocientes de verosimilitud positivos (3,4 %) y negativos (0,6 %).
- Los resultados de la revisión sistemática son similares a los de un metanálisis amplio en el que se notificaron las medianas de sensibilidad y especificidad de la TC para identificar ganglios mediastínicos malignos: un 61 % de sensibilidad y un 79 % de especificidad.[5]
- En un metanálisis anterior se notificó una tasa de sensibilidad promedio del 64 % y una tasa de especificidad del 74 %.[6]
Tomografía por emisión de positrones con flúor F 18-fludesoxiglucosa
La disponibilidad y el uso extenso de las tomografías por emisión de positrones con flúor F 18-fludesoxiglucosa (TEP con 18F-FDG) para la estadificación ha modificado el abordaje de estadificación de los ganglios linfáticos mediastínicos y las metástasis a distancia.
En los ensayos aleatorizados en los que se evalúa la utilidad de las TEP con 18F-FDG para los pacientes con CPCNP potencialmente resecables, se notificaron resultados contradictorios en términos de la reducción relativa del número de toracotomías no curativas.
Aunque la evidencia actual es contradictoria, las TEP con 18F-FDG quizás mejoren los resultados para el cáncer de pulmón en estadio temprano al identificar pacientes con indicios de enfermedad metastásica fuera del campo de resección quirúrgica, que no se detecta en los procedimientos de estadificación preoperatoria estándar.
Evidencia (TEP con 18F-FDG):
- En una revisión sistemática, una ampliación de una valoración de tecnología sanitaria de 2001 del Institute for Clinical and Evaluative Sciences, se evaluó la exactitud y la utilidad de la TEP con 18F-FDG para el diagnóstico y estadificación del cáncer de pulmón.[7] En una búsqueda sistemática de informes publicados, se identificaron 12 informes resumidos de la evidencia y 15 estudios prospectivos sobre la exactitud diagnóstica de la TEP con 18F-FDG.
- La TEP con 18F-FDG parece ser superior a la TC para la estadificación mediastínica del CPCNP.
- La TEP con 18F-FDG también tiene una sensibilidad alta y una especificidad razonable para diferenciar entre las lesiones benignas y las lesiones malignas, incluso de hasta 1 cm.
- En una revisión sistemática de la bibliografía médica sobre la exactitud de la TEP con 18F-FDG para la estadificación mediastínica no invasiva en pacientes con cáncer de pulmón, se identificaron 44 estudios publicados entre 1994 y 2006 con 2865 pacientes evaluables.[4]
- La mediana de prevalencia de metástasis mediastínicas fue del 29 % (intervalo, 5–64 %).
- Los cálculos conjuntos para identificar una metástasis mediastínica fueron del 74 % (IC 95 %, 69–79 %) para la sensibilidad y del 85 % (IC 95 %, 82–88 %) para la especificidad.
- Se detallaron los correspondientes cocientes de verosimilitud positivos (4,9 %) y negativos (0,3 %) para la estadificación mediastínica mediante TEP con 18F-FDG.
- Estos hallazgos demostraron que la TEP con 18F-FDG es más exacta que la TC para la estadificación mediastínica de pacientes con cáncer de pulmón.
Los análisis de decisiones muestran que el uso de la TEP con 18F-FDG quizás reduzca los costos generales de la atención médica mediante la identificación de pacientes con resultados negativos falsos en las TC mediastínicas o con sitios de metástasis no detectados de otra manera.[8-10] En los estudios se concluyó que el ahorro por no hacer una mediastinoscopia para lesiones mediastínicas detectadas en la TEP con 18F-FDG era inaceptable debido al número alto de resultados positivos falsos.[8-10] En un estudio aleatorizado se encontró que la adición de TEP con 18F-FDG a la estadificación convencional se relacionó con un número significativamente más bajo de toracotomías.[11] En otro ensayo aleatorizado en el que se evaluó el efecto de la TEP con 18F-FDG para el abordaje clínico, se encontró que esta prueba proporcionó información adicional sobre el estadio correcto, pero no condujo a un número significativamente más bajo de toracotomías.[12]
Combinación de tomografía computarizada y tomografía por emisión de positrones con flúor F 18-fludesoxiglucosa
La combinación de una TC y una TEP con 18F-FDG tiene mayor sensibilidad y especificidad que la TC sola.[13]
Evidencia (TC o TEP con 18F-FDG):
- Cuando no hay indicios de enfermedad metastásica a distancia en la TC, la TEP con 18F-FDG complementa la TC para la estadificación mediastínica. En numerosos estudios no aleatorizados de TEP con 18F-FDG, se usa la evaluación quirúrgica de los ganglios linfáticos mediastínicos (es decir, mediastinoscopia o toracotomía con disección de ganglios linfáticos mediastínicos) como tratamiento de referencia para la comparación.
- En un metanálisis se evaluó el rendimiento condicional de la TEP con 18F-FDG y la TC.
- Se notificó que, en pacientes con adenopatías, la TEP con 18F-FDG tiene una mediana del 100 % para la sensibilidad y una mediana del 78 % para la especificidad.[5]
- La TEP con 18F-FDG se considera muy exacta para identificar el compromiso ganglionar maligno cuando hay adenopatías. Sin embargo, la TEP con 18F-FDG identificará de forma errónea una neoplasia maligna en casi un cuarto de los pacientes con adenopatías por otras causas, por lo general, inflamatorias o infecciosas.[14,15]
- En pacientes con ganglios linfáticos mediastínicos de tamaño normal, la TEP con 18F-FDG tiene una mediana del 82 % para la sensibilidad y una mediana del 93 % para la especificidad.[5] Estos datos indican que alrededor del 20 % de los pacientes con ganglios linfáticos de tamaño normal pero con compromiso maligno tuvieron un resultado negativo falso en la TEP con 18F-FDG.
Para los pacientes de CPCNP operable desde el punto de vista clínico, la evidencia científica apoya la idea de llevar a cabo una biopsia de los ganglios linfáticos mediastínicos que midan más de 1 cm en el eje transversal más corto que se observa en la TC torácica o que obtengan un resultado positivo en la TEP con 18F-FDG. El resultado negativo en la TEP con 18F-FDG no significa que se descarte una biopsia de las adenopatías mediastínicas detectadas mediante radiografía. La mediastinoscopia es necesaria para detectar cáncer en los ganglios linfáticos mediastínicos cuando los resultados de la TC y la TEP con 18F-FDG no concuerdan.
Evaluación de las metástasis encefálicas
Los pacientes con riesgo de metástasis encefálicas se estadifican mediante TC o IRM.
Evidencia (estadificación mediante tomografía computarizada o imágenes por resonancia magnética):
- En un estudio, se asignó al azar a 332 pacientes de CPCNP potencialmente operable y sin síntomas neurológicos, para someterse a una tomografía computarizada (TC) o imágenes por resonancia magnética (IRM) encefálicas a fin de detectar metástasis encefálicas ocultas antes de la cirugía del pulmón.[16]
- La IRM demostró una tendencia hacia una tasa de detección preoperatoria más alta que la TC (P = 0,069), con una tasa general de detección de alrededor del 7 % desde el pretratamiento hasta 12 meses después de la cirugía.
- Los pacientes con enfermedad en estadio I o estadio II tuvieron una tasa de detección del 4 % (es decir, 8 detecciones en 200 pacientes); sin embargo, en los pacientes con enfermedad en estadio III, la tasa de detección fue del 11,4 % (es decir, 15 detecciones en 132 pacientes).
- La media del diámetro máximo de las metástasis encefálicas fue significativamente menor en el grupo de IRM.
Se desconoce si esta mejora en la tasa de detección con IRM se traduce en mejores resultados. No todos los pacientes toleran una IRM; en estos pacientes, la TC con contraste se considera un sustituto razonable.
Evaluación de las metástasis a distancia en sitios fuera del encéfalo
En numerosos estudios no aleatorizados prospectivos y retrospectivos, se demostró que la TEP con 18F-FDG ofrece más ventajas diagnósticas que las imágenes convencionales para la estadificación de la enfermedad metastásica a distancia; sin embargo, las TEP con 18F-FDG estándar tienen limitaciones. Las TEP con 18F-FDG no se deberían extender por debajo de la pelvis, y es posible que no detecten metástasis óseas en los huesos largos de las extremidades inferiores. Debido a que el marcador metabólico utilizado en la TEP con 18F-FDG se acumula en el encéfalo y las vías urinarias, esta prueba no es confiable para detectar metástasis en estos sitios.[16]
Revisión del International System for Staging Lung Cancer
El American Joint Committee on Cancer (AJCC) y la Union Internationale Contre le Cancer adoptaron en 2010 el International System for Staging Lung Cancer revisado a partir de la información de una base de datos clínicos de más de 5000 pacientes.[17,18] Estas revisiones proporcionan una especificidad pronóstica más alta para grupos de pacientes; sin embargo, la correlación entre estadio y pronóstico es anterior al período de disponibilidad amplia de la TEP.
Agrupamiento por estadios y definiciones TNM del American Joint Committee on Cancer
El AJCC designó los estadios mediante la clasificación TNM (tumor, ganglio linfático y metástasis) para definir el CPCNP.[18]
| Categoría T | Criterio T | |
|---|---|---|
| aReproducción autorizada por AJCC: Lung. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 431–56. | ||
| TX | Tumor primario no evaluable, o tumor comprobado por la presencia de células malignas en el esputo o el líquido de lavado bronquial, pero no se observó tumor en las imágenes ni en la broncoscopia. | |
| T0 | Sin indicios de tumor primario. | |
| Tis | Carcinoma in situ; carcinoma de células escamosas in situ; adenocarcinoma in situ; adenocarcinoma con patrón lepídico puro; ≤3 cm en su mayor dimensión. | |
| T1 | Tumor ≤3 cm en su mayor dimensión, rodeado de pulmón o pleura visceral, sin indicios de invasión proximal al bronquio lobular (es decir, no está en el bronquio principal) en la broncoscopia. | |
| T1mi | Adenocarcinoma con invasión mínima, es decir, adenocarcinoma (≤3 cm en su mayor dimensión) con un patrón en su mayoría lepídico, e invasión ≤5 mm en su mayor dimensión. | |
| T1a | Tumor ≤1 cm en su mayor dimensión. Aunque son tumores poco frecuentes, también se clasifican como T1a los tumores de cualquier tamaño con diseminación superficial y un componente invasivo limitado a la pared bronquial que se puede extender a nivel proximal hasta el bronquio principal. | |
| T1b | Tumor >1 cm pero ≤2 cm en su mayor dimensión. | |
| T1c | Tumor >2 cm pero ≤3 cm en su mayor dimensión. | |
| T2 | Tumor >3 cm, pero ≤5 cm o que tiene una de las siguientes características: compromiso del bronquio principal a cualquier distancia de la carina, pero sin comprometerla; invasión de la pleura visceral (PL1 o PL2); presencia de atelectasia o neumonitis obstructiva que afectan la región hiliar y compromete todo el pulmón o una parte de este. Los tumores T2 con estas características se clasifican como T2a si son ≤4 cm o si no es posible determinar el tamaño, y como T2b si son >4 cm pero ≤5 cm. | |
| T2a | Tumor >3 cm pero ≤4 cm en su mayor dimensión. | |
| T2b | Tumor >4 cm pero ≤5 cm en su mayor dimensión. | |
| T3 | Tumor >5 cm, pero ≤7 cm en su mayor dimensión o con invasión directa de cualquiera de los siguientes sitios: pleura parietal (PL3), pared torácica (incluye los tumores del surco superior), nervio frénico, pericardio parietal; o uno o más nódulos tumorales separados en el mismo lóbulo que el tumor primario. | |
| T4 | Tumor >7 cm o tumor de cualquier tamaño con invasión de uno o más de los siguientes sitios: diafragma, mediastino, corazón, vasos principales, tráquea, nervio laríngeo recurrente, esófago, cuerpo vertebral o carina; o uno o más nódulos tumorales separados en un lóbulo ipsilateral diferente al del tumor primario. | |
| Categoría N | Criterio N |
|---|---|
| aReproducción autorizada por AJCC: Lung. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp 431–56. | |
| NX | Ganglios linfáticos regionales no evaluables. |
| N0 | Sin metástasis en ganglios linfáticos regionales. |
| N1 | Metástasis ganglionares peribronquiales ipsilaterales o hiliares ipsilaterales y metástasis ganglionares intrapulmonares, incluso con compromiso por extensión directa. |
| N2 | Metástasis en uno o más ganglios linfáticos ipsilaterales mediastínicos o subcarinales. |
| N3 | Metástasis ganglionares mediastínicas contralaterales, hiliares contralaterales, escalenas ipsilaterales o contralaterales, o supraclaviculares. |
| Categoría M | Criterio M | |
|---|---|---|
| aReproducción autorizada por AJCC: Lung. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp 431–56. | ||
| M0 | Sin metástasis a distancia. | |
| M1 | Metástasis a distancia. | |
| M1a | Tumor con uno o más nódulos tumorales separados en un lóbulo contralateral, tumor con nódulos pleurales o pericárdicos, o tumor con derrame maligno pleural o pericárdico. La mayoría de los derrames pleurales o pericárdicos en pacientes de cáncer de pulmón se deben al tumor. Sin embargo, en algunos pacientes se obtienen resultados negativos para compromiso tumoral en múltiples estudios microscópicos del líquido pleural o pericárdico y el líquido no tiene sangre ni es exudativo. Si estos elementos y el juicio clínico indican que el derrame no se relaciona con el tumor, el derrame se debe excluir de la descripción para la estadificación. | |
| M1b | Metástasis extratorácica única en un solo órgano (incluso compromiso de un solo ganglio no regional). | |
| M1c | Metástasis extratorácicas múltiples en uno o más órganos. | |
| Estadio | Clasificación TNM | Imagen |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada por AJCC: Lung. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp 431–56. | ||
| Carcinoma oculto | TX, N0, M0 | |
| 0 | Tis, N0, M0 | |
| IA1 | T1mi, N0, M0 | 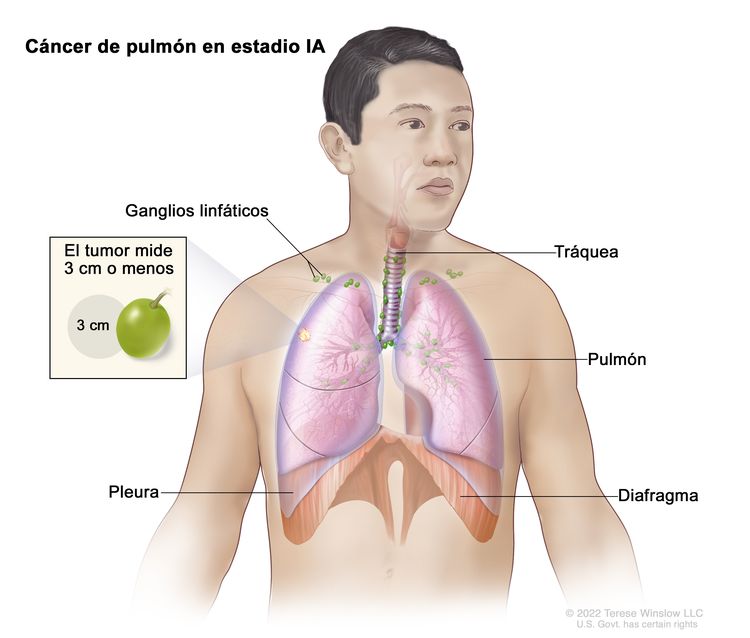 |
| T1a, N0, M0 | ||
| IA2 | T1b, N0, M0 | |
| IA3 | T1c, N0, M0 | |
| IB | T2a, N0, M0 | 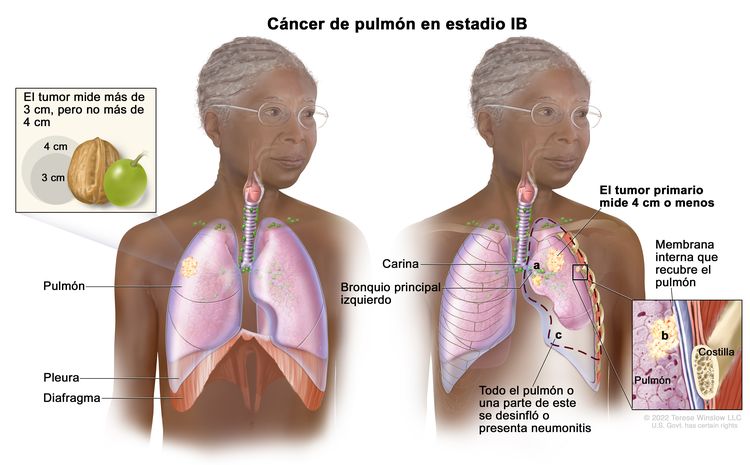 |
| IIA | T2b, N0, M0 | 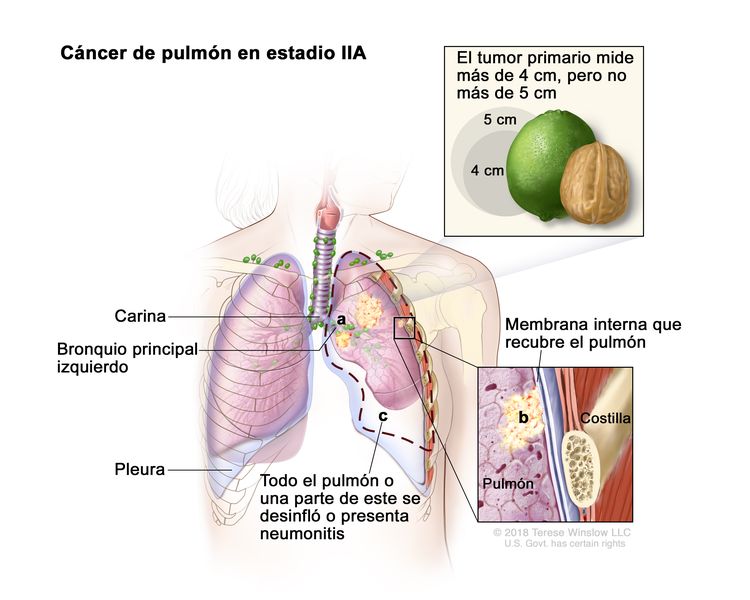 |
| IIB | T1a, N1, M0 | 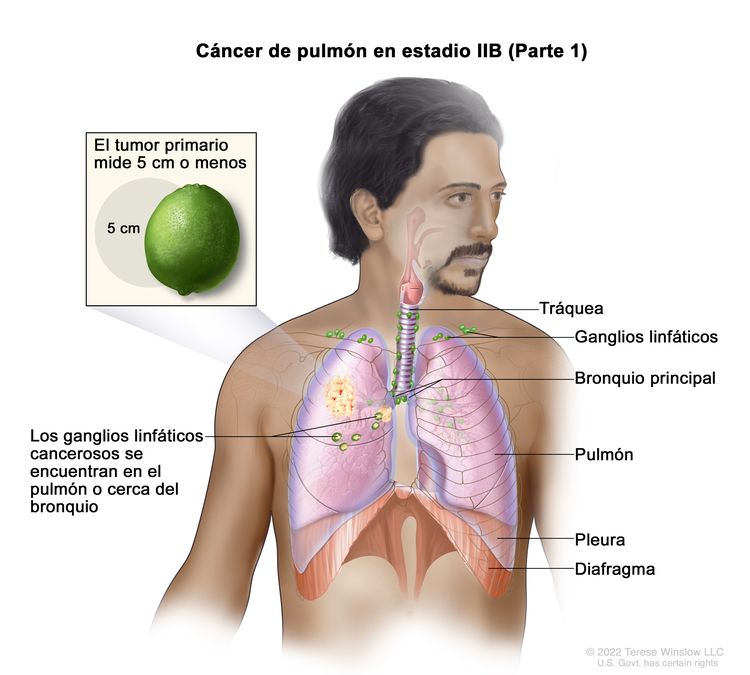 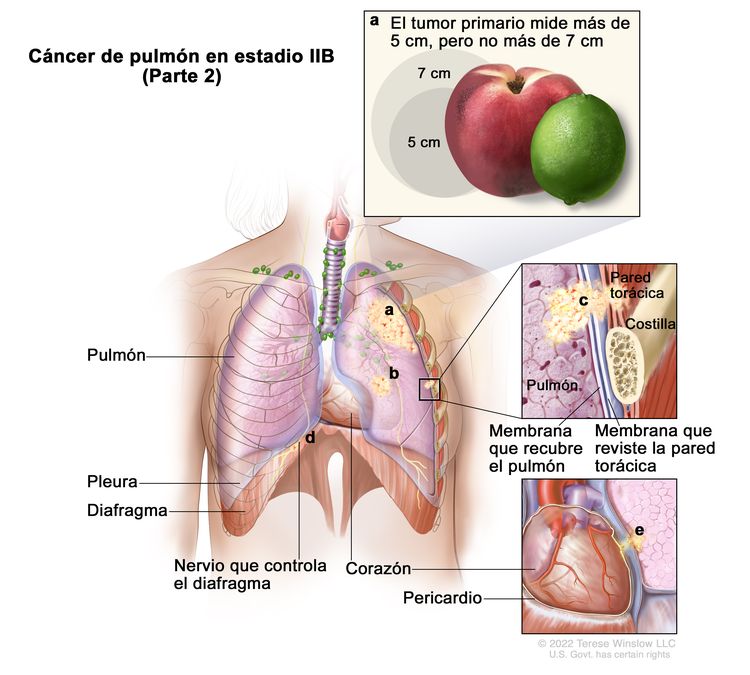 |
| T1b, N1, M0 | ||
| T1c, N1, M0 | ||
| T2a, N1, M0 | ||
| T2b, N1, M0 | ||
| T3, N0, M0 | ||
| IIIA | T1a, N2, M0 | 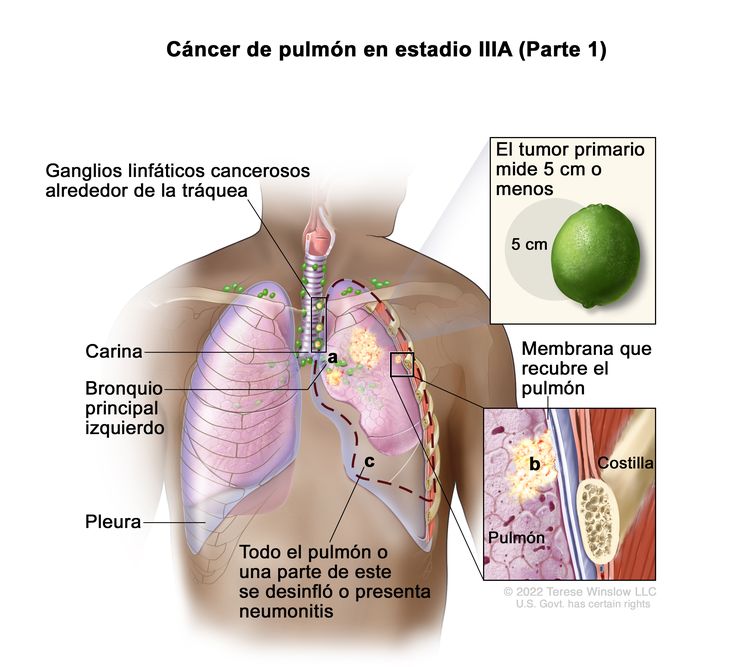 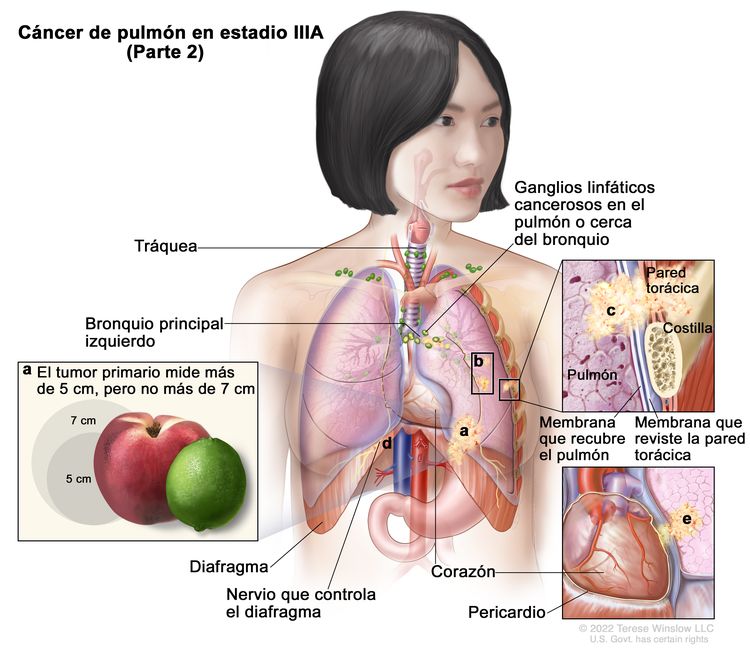 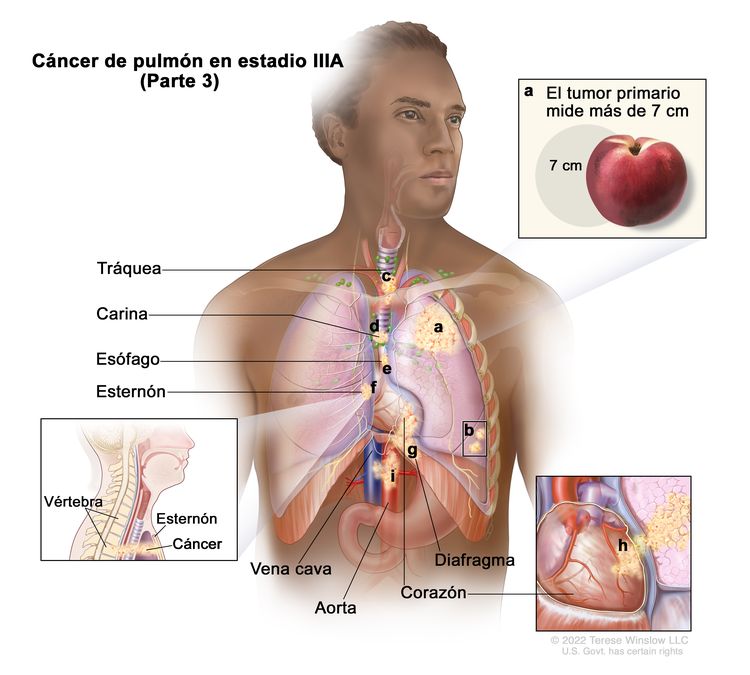 |
| T1b, N2, M0 | ||
| T1c, N2, M0 | ||
| T2a, N2, M0 | ||
| T2b, N2, M0 | ||
| T3, N1, M0 | ||
| T4, N0, M0 | ||
| T4, N1, M0 | ||
| IIIB | T1a, N3, M0 | 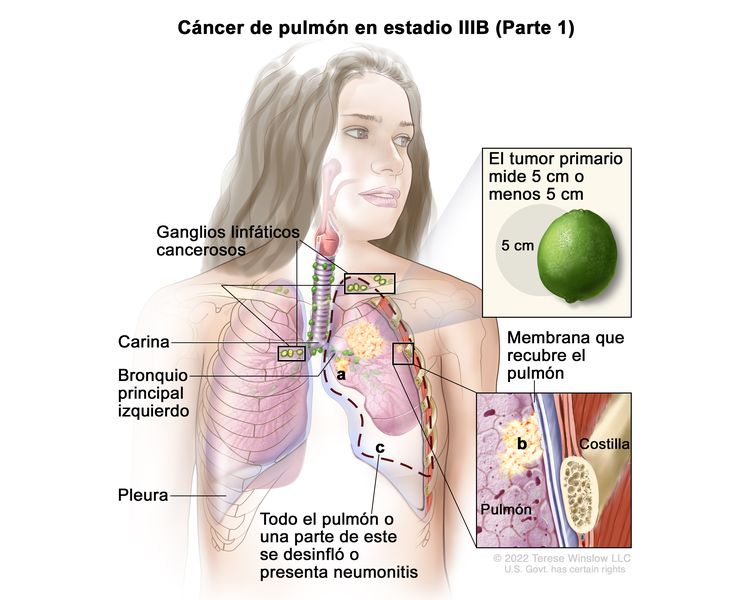 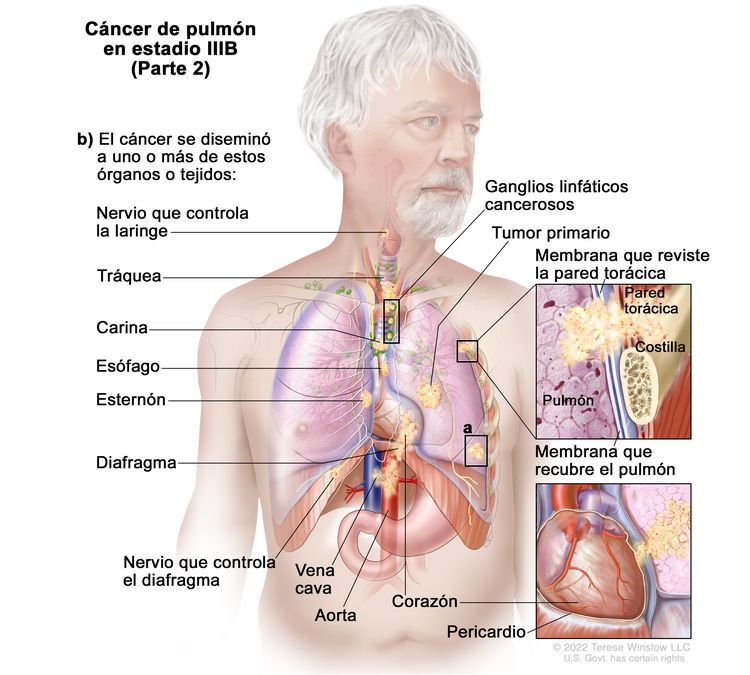 |
| T1b, N3, M0 | ||
| T1c, N3, M0 | ||
| T2a, N3, M0 | ||
| T2b, N3, M0 | ||
| T3, N2, M0 | ||
| T4, N2, M0 | ||
| IIIC | T3, N3, M0 | 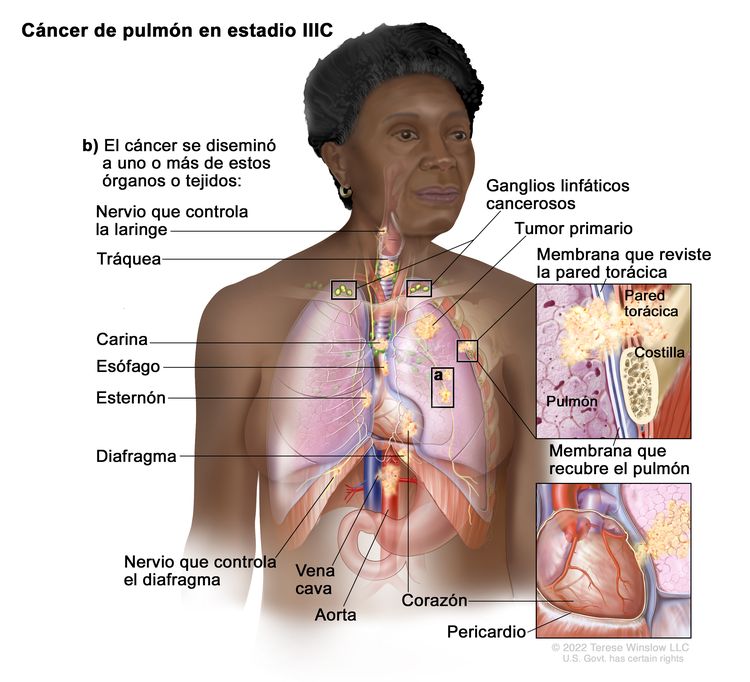 |
| T4, N3, M0 | ||
| IV | Cualquier T, cualquier N, M1 | |
| IVA | Cualquier T, cualquier N, M1a | 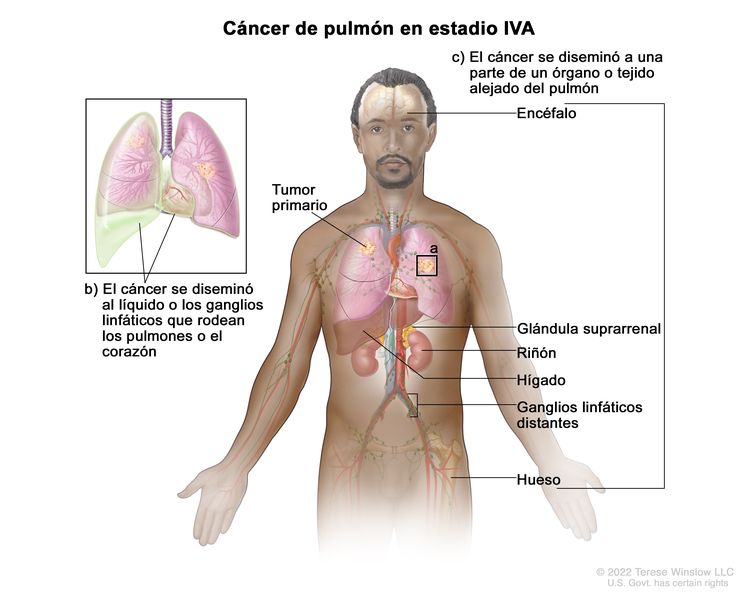 |
| Cualquier T, cualquier N, M1b | ||
| IVB | Cualquier T, cualquier N, M1c | 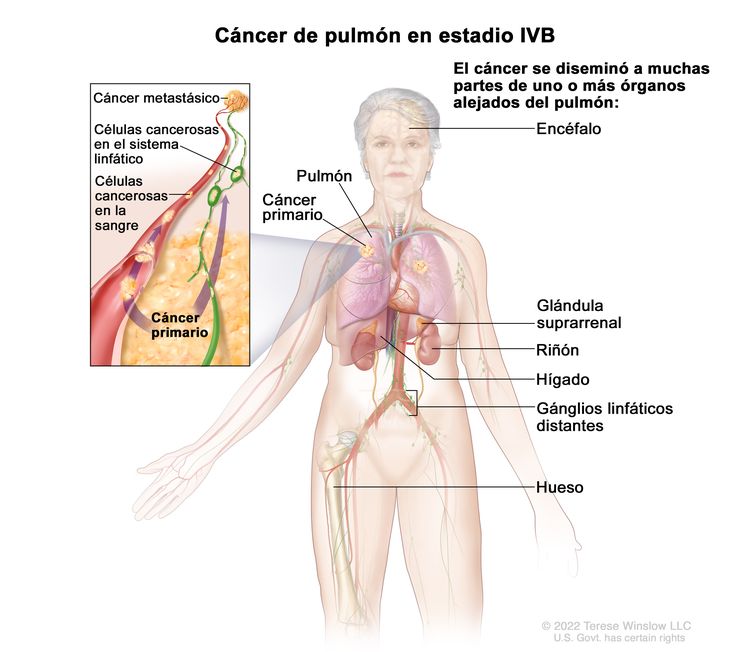 |
Bibliografía
- Pfister DG, Johnson DH, Azzoli CG, et al.: American Society of Clinical Oncology treatment of unresectable non-small-cell lung cancer guideline: update 2003. J Clin Oncol 22 (2): 330-53, 2004. [PUBMED Abstract]
- Ludwig MS, Goodman M, Miller DL, et al.: Postoperative survival and the number of lymph nodes sampled during resection of node-negative non-small cell lung cancer. Chest 128 (3): 1545-50, 2005. [PUBMED Abstract]
- Webb WR, Gatsonis C, Zerhouni EA, et al.: CT and MR imaging in staging non-small cell bronchogenic carcinoma: report of the Radiologic Diagnostic Oncology Group. Radiology 178 (3): 705-13, 1991. [PUBMED Abstract]
- Toloza EM, Harpole L, McCrory DC: Noninvasive staging of non-small cell lung cancer: a review of the current evidence. Chest 123 (1 Suppl): 137S-146S, 2003. [PUBMED Abstract]
- Gould MK, Kuschner WG, Rydzak CE, et al.: Test performance of positron emission tomography and computed tomography for mediastinal staging in patients with non-small-cell lung cancer: a meta-analysis. Ann Intern Med 139 (11): 879-92, 2003. [PUBMED Abstract]
- Dwamena BA, Sonnad SS, Angobaldo JO, et al.: Metastases from non-small cell lung cancer: mediastinal staging in the 1990s--meta-analytic comparison of PET and CT. Radiology 213 (2): 530-6, 1999. [PUBMED Abstract]
- Ung YC, Maziak DE, Vanderveen JA, et al.: 18Fluorodeoxyglucose positron emission tomography in the diagnosis and staging of lung cancer: a systematic review. J Natl Cancer Inst 99 (23): 1753-67, 2007. [PUBMED Abstract]
- Dietlein M, Weber K, Gandjour A, et al.: Cost-effectiveness of FDG-PET for the management of potentially operable non-small cell lung cancer: priority for a PET-based strategy after nodal-negative CT results. Eur J Nucl Med 27 (11): 1598-609, 2000. [PUBMED Abstract]
- Scott WJ, Shepherd J, Gambhir SS: Cost-effectiveness of FDG-PET for staging non-small cell lung cancer: a decision analysis. Ann Thorac Surg 66 (6): 1876-83; discussion 1883-5, 1998. [PUBMED Abstract]
- Gambhir SS, Hoh CK, Phelps ME, et al.: Decision tree sensitivity analysis for cost-effectiveness of FDG-PET in the staging and management of non-small-cell lung carcinoma. J Nucl Med 37 (9): 1428-36, 1996. [PUBMED Abstract]
- van Tinteren H, Hoekstra OS, Smit EF, et al.: Effectiveness of positron emission tomography in the preoperative assessment of patients with suspected non-small-cell lung cancer: the PLUS multicentre randomised trial. Lancet 359 (9315): 1388-93, 2002. [PUBMED Abstract]
- Viney RC, Boyer MJ, King MT, et al.: Randomized controlled trial of the role of positron emission tomography in the management of stage I and II non-small-cell lung cancer. J Clin Oncol 22 (12): 2357-62, 2004. [PUBMED Abstract]
- Vansteenkiste JF, Stroobants SG, De Leyn PR, et al.: Lymph node staging in non-small-cell lung cancer with FDG-PET scan: a prospective study on 690 lymph node stations from 68 patients. J Clin Oncol 16 (6): 2142-9, 1998. [PUBMED Abstract]
- Roberts PF, Follette DM, von Haag D, et al.: Factors associated with false-positive staging of lung cancer by positron emission tomography. Ann Thorac Surg 70 (4): 1154-9; discussion 1159-60, 2000. [PUBMED Abstract]
- Liewald F, Grosse S, Storck M, et al.: How useful is positron emission tomography for lymphnode staging in non-small-cell lung cancer? Thorac Cardiovasc Surg 48 (2): 93-6, 2000. [PUBMED Abstract]
- Yokoi K, Kamiya N, Matsuguma H, et al.: Detection of brain metastasis in potentially operable non-small cell lung cancer: a comparison of CT and MRI. Chest 115 (3): 714-9, 1999. [PUBMED Abstract]
- Mountain CF: Revisions in the International System for Staging Lung Cancer. Chest 111 (6): 1710-7, 1997. [PUBMED Abstract]
- Lung. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 431–56.
Aspectos generales de las opciones de tratamiento del cáncer de pulmón de células no pequeñas
Los resultados del tratamiento estándar del cáncer de pulmón de células no pequeñas (CPCNP) son precarios, excepto para los cánceres más localizados. Todos los pacientes con diagnóstico reciente de CPCNP se consideran potencialmente aptos para participar en estudios en los que se evalúen nuevas formas de tratamiento.
Las decisiones de tratamiento se fundamentan en algunos de los siguientes factores:
- Conocimiento del tipo histológico y características moleculares.
- Tamaño y localización del tumor.
- Compromiso de la pleura.
- Márgenes quirúrgicos.
- Estado y localización de los ganglios linfáticos por estación.
- Grado tumoral.
- Invasión linfovascular.
La cirugía es la opción terapéutica con mayor posibilidad de cura para esta enfermedad. La quimioterapia posoperatoria quizás proporcione un beneficio adicional para los pacientes de CPCNP sometidos a resección tumoral. La radioterapia combinada con quimioterapia cura a un número pequeño de pacientes y sirve de paliativo para la mayoría. Es posible que la irradiación craneal profiláctica reduzca la incidencia de metástasis encefálicas, pero no hay indicios de beneficio para la supervivencia y no se conoce el efecto en la calidad de vida.[1,2] Para los pacientes con enfermedad en estadio avanzado, la quimioterapia o los inhibidores de la cinasa del receptor del factor de crecimiento epidérmico (EGFR) ofrecen mejoras modestas en la mediana de supervivencia, aunque la supervivencia general es precaria.[3,4]
La quimioterapia produce una mejora a corto plazo de los síntomas relacionados con la enfermedad en pacientes de CPCNP avanzado. En varios ensayos clínicos se intentó evaluar el efecto de la quimioterapia en los síntomas relacionados con el tumor y en la calidad de vida. En conjunto, en estos estudios se indica que los síntomas relacionados con el tumor a veces se alivian con quimioterapia, sin afectar de manera adversa la calidad de vida general;[5,6] sin embargo, se necesita estudiar más el efecto de la quimioterapia en la calidad de vida. En general, los pacientes de edad avanzada clínicamente aptos obtienen los mismos beneficios del tratamiento que los pacientes más jóvenes.
La identificación de mutaciones génicas en el cáncer de pulmón llevó a la formulación de terapia molecular con el fin de mejorar la supervivencia en subgrupos de pacientes con enfermedad metastásica.[7] En particular, las anomalías genéticas en las vías señalización de EGFR, MAPK y PI3K en subtipos de CPCNP quizás permitan definir mecanismos de sensibilidad farmacológica y resistencia primaria o adquirida a los inhibidores de la cinasas. Las mutaciones en EGFR predicen claramente una mejora en la tasa de respuesta y la supervivencia sin progresión de los inhibidores de EGFR. Las fusiones de los genes ALK y EML4, y otros genes, hacen que se elaboren productos de translocaciones en entre el 3 % y el 7 % de los pacientes con CPCNP no seleccionados que responden a la inhibición farmacológica de ALK con fármacos como el alectinib. El oncogén MET codifica el receptor del factor de crecimiento de hepatocitos. La amplificación de este gen se relacionó con resistencia secundaria a los inhibidores de la tirosina–cinasa del EGFR. Se observan fusiones recurrentes que afectan el gen ROS1 en hasta el 2 % de los CPCNP y son sensibles al tratamiento con crizotinib y entrectinib. Las fusiones del gen NTRK se presentan en hasta el 1 % de los CPCNP y es posible tratarlos con los inhibidores de TRK, larotrectinib y entrectinib. Para obtener más información, consultar la sección Características moleculares.
Las opciones de tratamiento para cada estadio de CPCNP se presentan en el Cuadro 5.
| Estadio (definiciones TNM) | Opciones de tratamiento | |
|---|---|---|
| ALK = cinasa del linfoma anaplásico; EGFR = receptor del factor de crecimiento epidérmico; HER2 = receptor 2 del factor de crecimiento epidérmico humano; mTOR = blanco de la rapamicina en los mamíferos; CPCNP = cáncer de pulmón de células no pequeñas; NTRK = tirosina–cinasa neurotrófica; ITC = inhibidores de tirosina–cinasas; TNM = tumor, ganglio linfático, metástasis. | ||
| CPCNP oculto | Cirugía | |
| CPCNP en estadio 0 | Cirugía | |
| Terapias endobronquiales | ||
| CPCNP en estadios IA y IB | Cirugía | |
| Terapia adyuvante | ||
| Radioterapia | ||
| CPCNP en estadios IIA y IIB | Cirugía con terapia adyuvante o terapia neoadyuvante o sin estas | |
| Radioterapia | ||
| CPCNP en estadio IIIA | Enfermedad resecada o resecable | Cirugía con terapia adyuvante o terapia neoadyuvante |
| Terapia neoadyuvante | ||
| Inmunoterapia perioperativa (neoadyuvante y adyuvante) con quimioterapia | ||
| Terapia adyuvante | ||
| Enfermedad irresecable | Quimiorradioterapia | |
| Radioterapia | ||
| Tumores del surco superior | Cirugía | |
| Quimiorradioterapia seguida de cirugía | ||
| Radioterapia sola | ||
| Tumores con invasión de la pared torácica | Cirugía | |
| Cirugía y radioterapia | ||
| Radioterapia sola | ||
| Quimioterapia combinada con radioterapia o cirugía | ||
| CPCNP en estadios IIIB y IIIC | Quimioterapia y radioterapia consecutivas o simultáneas | |
| Radioterapia sola | ||
| CPCNP en estadio IV de diagnóstico reciente, en recaída y recidivante | Quimioterapia citotóxica combinada | |
| Quimioterapia combinada con anticuerpos monoclonales | ||
| Terapia de mantenimiento luego de la quimioterapia de primera línea (para pacientes con enfermedad estable o que responden después de 4 ciclos de quimioterapia combinada con derivados del platino) | ||
| ITC del EGFR con quimioterapia o sin esta (para pacientes con mutaciones en EGFR) | ||
| Terapia dirigida a EGFR (para pacientes con mutaciones de inserción del exón 20 EGFR) | ||
| Inhibidores de ALK (para pacientes con translocaciones de ALK) | ||
| Inhibidores de BRAF V600E y MEK (para pacientes con mutaciones BRAF V600E) | ||
| Inhibidores de ROS1 (para pacientes con reordenamientos de ROS1) | ||
| Inhibidores del receptor de la tirosina–cinasa neurotrófica (para pacientes con fusiones de NTRK) | ||
| Inhibidores de RET (para pacientes con fusiones de RET) | ||
| Inhibidores de MET (para pacientes con mutaciones de omisión del exón 14 de MET) | ||
| Inhibidores de puntos de control inmunitario con quimioterapia o sin esta | ||
| Inhibidores de mTOR (para pacientes con tumores neuroendocrinos irresecables, localmente avanzados o metastásicos, progresivos, bien diferenciados y no funcionantes) | ||
| Terapias locales y consideraciones especiales | ||
| CPCNP en estadio IV progresivo, en recaída y recidivante | Quimioterapia | |
| Terapia dirigida a EGFR | ||
| ITC dirigido a ALK | ||
| Inhibidores de BRAF V600E y MEK (para pacientes con mutaciones BRAF V600E) | ||
| Terapia dirigida a ROS1 | ||
| Inhibidores del receptor de la tirosina–cinasa neurotrófica (para pacientes con fusiones de NTRK) | ||
| Inhibidores de RET (para pacientes con fusiones de RET) | ||
| Inhibidores de MET (para pacientes con mutaciones de omisión del exón 14 de MET) | ||
| Inhibidores de KRAS G12C (para pacientes con mutaciones KRASG12C) | ||
| Terapia dirigida a HER2 (para pacientes con mutaciones en HER2) | ||
| Inmunoterapia | ||
| Inhibidores de mTOR (para pacientes con tumores neuroendocrinos irresecables, localmente avanzados o metastásicos, progresivos, bien diferenciados y no funcionantes) | ||
Además de las opciones de tratamiento del Cuadro 5, a continuación se enumeran las opciones de tratamiento en evaluación clínica:
- Tratamiento local combinado (cirugía).
- Tratamiento regional (radioterapia).
- Tratamientos sistémicos (quimioterapia, inmunoterapia y fármacos dirigidos).
- Formulación de terapias sistémicas más eficaces.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Lester JF, MacBeth FR, Coles B: Prophylactic cranial irradiation for preventing brain metastases in patients undergoing radical treatment for non-small-cell lung cancer: a Cochrane Review. Int J Radiat Oncol Biol Phys 63 (3): 690-4, 2005. [PUBMED Abstract]
- Pöttgen C, Eberhardt W, Grannass A, et al.: Prophylactic cranial irradiation in operable stage IIIA non small-cell lung cancer treated with neoadjuvant chemoradiotherapy: results from a German multicenter randomized trial. J Clin Oncol 25 (31): 4987-92, 2007. [PUBMED Abstract]
- Chemotherapy for non-small cell lung cancer. Non-small Cell Lung Cancer Collaborative Group. Cochrane Database Syst Rev (2): CD002139, 2000. [PUBMED Abstract]
- Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. Non-small Cell Lung Cancer Collaborative Group. BMJ 311 (7010): 899-909, 1995. [PUBMED Abstract]
- Spiro SG, Rudd RM, Souhami RL, et al.: Chemotherapy versus supportive care in advanced non-small cell lung cancer: improved survival without detriment to quality of life. Thorax 59 (10): 828-36, 2004. [PUBMED Abstract]
- Clegg A, Scott DA, Hewitson P, et al.: Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review. Thorax 57 (1): 20-8, 2002. [PUBMED Abstract]
- Pao W, Girard N: New driver mutations in non-small-cell lung cancer. Lancet Oncol 12 (2): 175-80, 2011. [PUBMED Abstract]
Tratamiento del cáncer de pulmón de células no pequeñas oculto
La evaluación diagnóstica del cáncer de pulmón oculto suele incluir radiografía de tórax y broncoscopia selectiva con un seguimiento minucioso (por ejemplo, con tomografía computarizada) cuando se considera necesario para determinar el sitio y la naturaleza del tumor primario; los tumores que se descubren en esta forma por lo general están en estadio temprano y son curables mediante cirugía.
Después de descubrir el tumor primario, se determina el estadio del tumor para elegir el tratamiento. El tratamiento es idéntico al que se recomienda para otros pacientes de cáncer de pulmón de células no pequeñas (CPCNP) con una enfermedad en estadio similar.
Opciones de tratamiento para el cáncer de pulmón de células no pequeñas oculto
La opción de tratamiento para el cáncer de pulmón de células no pequeñas oculto es la siguiente:
- Cirugía.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Tratamiento del cáncer de pulmón de células no pequeñas en estadio 0
El cáncer de pulmón de células no pequeñas (CPCNP) en estadio 0 a menudo progresa a cáncer invasivo.[1-3] A veces se plantea a los pacientes la posibilidad de someterse a broncoscopias de vigilancia y cuando se detectan lesiones entonces se recomienda tratamiento con potencial curativo.
Opciones de tratamiento para el cáncer de pulmón de células no pequeñas en estadio 0
Las opciones de tratamiento para el CPCNP en estadio 0 son las siguientes:
- Cirugía.
- Terapias endobronquiales como la terapia fotodinámica, la electrocauterización, la crioterapia y la terapia láser con granate de itrio y aluminio dopado con neodimio (Nd-YAG).
Cirugía
La segmentectomía o resección en cuña se usan para preservar la mayor cantidad de tejido pulmonar normal porque los pacientes con CPCNP en estadio 0 tienen un riesgo alto de segundos cánceres de pulmón. Debido a que estos tumores por definición no son invasivos ni producen metástasis, deberían curarse mediante resección quirúrgica; no obstante, es frecuente que estas lesiones se encuentren a nivel central y quizás exijan una lobectomía.
Terapias endobronquiales
Los pacientes con lesiones centrales tal vez sean aptos para someterse a terapias endobronquiales curativas. Las terapias endobronquiales que preservan el funcionamiento pulmonar son la terapia fotodinámica, la electrocauterización, la crioterapia y la terapia láser con Nd-YAG.[3-6]
Evidencia (terapias endobronquiales):
- En series de casos pequeñas se notificaron tasas de respuesta completa altas y supervivencias a largo plazo en determinados pacientes.[7,8][Nivel de evidencia C2]
La eficacia de estas modalidades de tratamiento para la atención de pacientes de CPCNP en estadio temprano aún no se ha comprobado en ensayos controlados aleatorizados específicos.
En estos pacientes, la incidencia de segundos cánceres primarios es alta.[1,2]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Woolner LB, Fontana RS, Cortese DA, et al.: Roentgenographically occult lung cancer: pathologic findings and frequency of multicentricity during a 10-year period. Mayo Clin Proc 59 (7): 453-66, 1984. [PUBMED Abstract]
- Venmans BJ, van Boxem TJ, Smit EF, et al.: Outcome of bronchial carcinoma in situ. Chest 117 (6): 1572-6, 2000. [PUBMED Abstract]
- Jeremy George P, Banerjee AK, Read CA, et al.: Surveillance for the detection of early lung cancer in patients with bronchial dysplasia. Thorax 62 (1): 43-50, 2007. [PUBMED Abstract]
- Kennedy TC, McWilliams A, Edell E, et al.: Bronchial intraepithelial neoplasia/early central airways lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 132 (3 Suppl): 221S-233S, 2007. [PUBMED Abstract]
- Corti L, Toniolo L, Boso C, et al.: Long-term survival of patients treated with photodynamic therapy for carcinoma in situ and early non-small-cell lung carcinoma. Lasers Surg Med 39 (5): 394-402, 2007. [PUBMED Abstract]
- Deygas N, Froudarakis M, Ozenne G, et al.: Cryotherapy in early superficial bronchogenic carcinoma. Chest 120 (1): 26-31, 2001. [PUBMED Abstract]
- van Boxem TJ, Venmans BJ, Schramel FM, et al.: Radiographically occult lung cancer treated with fibreoptic bronchoscopic electrocautery: a pilot study of a simple and inexpensive technique. Eur Respir J 11 (1): 169-72, 1998. [PUBMED Abstract]
- van Boxem AJ, Westerga J, Venmans BJ, et al.: Photodynamic therapy, Nd-YAG laser and electrocautery for treating early-stage intraluminal cancer: which to choose? Lung Cancer 31 (1): 31-6, 2001. [PUBMED Abstract]
Tratamiento del cáncer de pulmón de células no pequeñas en estadios lA y IB
Opciones de tratamiento para el cáncer de pulmón de células no pequeñas en estadios lA y IB
Las opciones de tratamiento para el cáncer de pulmón de células no pequeñas en estadio lA y el cáncer de pulmón de células no pequeñas en estadio IB son las siguientes:
- Cirugía.
- Terapia adyuvante.
- Quimioterapia adyuvante (para pacientes con tumores grandes en estadio IB).
- Terapia dirigida adyuvante (para pacientes con tumores en estadio IB con mutaciones en EGFR).
- Inmunoterapia adyuvante (para pacientes con tumores en estadio IB >4 cm).
- Radioterapia (para pacientes que no son aptos para cirugía o deciden evitarla).
La quimioterapia y la radioterapia no mostraron mejorar la supervivencia de los pacientes de cáncer de pulmón de células no pequeñas (CPCNP) en estadio I sometidos a resección tumoral completa.
Cirugía
La cirugía es el tratamiento preferido para los pacientes de CPCNP en estadio I. Según el caso es posible llevar a cabo una lobectomía, una resección segmentaria, una resección en cuña o una resección en manguito, cuando se considere apropiado. Los pacientes con alteración del funcionamiento pulmonar se consideran aptos para una resección segmentaria o una resección en cuña del tumor primario. La evaluación preoperatoria minuciosa del estado general de salud del paciente, en especial de la capacidad pulmonar de reserva, es muy importante ya que permite analizar los beneficios de la cirugía. La tasa de mortalidad posoperatoria inmediata para la lobectomía se relaciona con la edad; pero se anticipa una tasa de mortalidad del 3 % al 5 %.[1]
Evidencia (cirugía):
- El Lung Cancer Study Group dirigió un estudio aleatorizado (LCSG-821) en el que se comparó la lobectomía y la resección limitada para pacientes con cáncer de pulmón en estadio I. En el estudio se observaron los siguientes resultados:[2]
- Una reducción de la recidiva local en los pacientes tratados con lobectomía en comparación con escisión limitada.
- No hubo una diferencia significativa para la supervivencia general (SG).
- Se notificaron resultados similares en una comparación no aleatorizada de segmentectomía anatómica y lobectomía.[3]
- Se observó una ventaja de la supervivencia con la lobectomía en los pacientes con tumores que miden más de 3 cm, pero no para aquellos con tumores que miden menos de 3 cm.
- La tasa de recidiva locorregional fue significativamente menor luego de la lobectomía, sin importar el tamaño del tumor.
- En un estudio de pacientes en estadio I se observaron los siguientes resultados:[4]
- Aquellos tratados con resecciones en cuña o resecciones segmentarias tuvieron una tasa local de recidiva del 50 % (es decir, 31 recidivas en 62 pacientes) a pesar de haberse sometido a resecciones completas.[4]
- En un ensayo de fase III multicéntrico, de ausencia de inferioridad (NCT00499330) se evaluó la resección lobular o sublobular en pacientes con CPCNP en estadio IA periférico. Un total de 697 pacientes con tumores N0 en estadio clínico T1a (tumor <2 cm) se asignaron al azar para someterse a resección sublobular o lobular después de obtener confirmación intraoperatoria de que la enfermedad no comprometía ganglios linfáticos del mediastino y la región hiliar. El criterio principal de valoración fue la supervivencia sin enfermedad (SSE).[5][Nivel de evidencia B1]
- Al cabo de una mediana de seguimiento de 7 años, la resección sublobular no fue inferior a la resección lobular para la SSE (cociente de riesgos instantáneos [CRI], 1,01; intervalo de confianza [IC] 90 %, 0,83–1,24; P unilateral = 0,02 para la ausencia de inferioridad).
- La SG fue similar luego de una resección sublobular o una resección lobular (CRI, 0,95; IC 95 %, 0,72–1,26).
- No se detectaron diferencias importantes en la incidencia de recidiva de la enfermedad locorregional o distal entre los 2 grupos.
- Al cabo de 6 meses desde la cirugía, la dimensión de la reducción desde el inicio en el porcentaje del VEF1 (volumen espiratorio forzado en el primer segundo de la espiración) predicha fue mayor en el grupo de la lobectomía (-6 %; IC 95 %, -8 % a -5 %) que en el grupo de la resección sublobular (-4 %; IC 95 %, -5 % a -2 %). La dimensión de la reducción del porcentaje de la CVF (capacidad vital forzada) predicha también fue superior después de la lobectomía (-5 %; IC 95 %, -7 % a -3 %) que después de la resección sublobular (-3 %; IC 95 %, -4 % a -1 %).
Estos resultados indican que la resección sublobular mediante segmentectomía o resección en cuña es eficaz para el tratamiento del CPCNP N0 en estadio T1a cuando la muestra intraoperatoria de ganglios linfáticos de la región hiliar o del mediastino es negativa.
- En la Colaboración Cochrane se revisaron 11 ensayos aleatorizados con 1910 pacientes sometidos a intervenciones quirúrgicas para el cáncer de pulmón en estadios tempranos (I–IIIA).[6] En el análisis conjunto se notificaron los siguientes resultados:
- La supervivencia a 4 años fue superior en pacientes de CPCNP resecable en estadios I, II o IIIA sometidos a resección con disección completa de ganglios linfáticos mediastínicos (DCGLM) a nivel ipsilateral, en comparación con los sometidos a resección con muestreo de ganglios linfáticos; el CRI estimado fue de 0,78 (intervalo de confianza [IC] 95 %, 0,65–0,93, P = 0,005).[6][Nivel de evidencia A1]
- Hubo una reducción significativa de todos los tipos de recidiva del cáncer (local o a distancia) en el grupo de DCGLM (riesgo relativo [RR] = 0,79; IC 95 %, 0,66–0,95; P = 0,01), que se explicó en gran parte por la reducción en el número de recidivas a distancia (RR = 0,78; IC 95 %, 0,61–1,00; P = 0,05).
- No hubo diferencia en la mortalidad operatoria.
- La fuga de aire durante más de 5 días fue significativamente más frecuente en los pacientes asignados a DCGLM (RR = 2,94; IC 95 %, 1,01–8,54; P = 0,05).
- En un gran ensayo aleatorizado de fase III (ACOSOG-Z0030 [NCT00003831]), se evaluó la DCGLM versus el muestreo ganglionar.[7,8]
- En los análisis preliminares de morbilidad y mortalidad operatoria se observaron tasas comparables para los procedimientos.[7,8]
- No hubo diferencias en la SG, la SSE, la recidiva local ni la recidiva regional.[8][Nivel de evidencia A1]
La evidencia indica que, para el cáncer de pulmón, la resección combinada con DCGLM no se relaciona con una mejora de la supervivencia, en comparación con la resección combinada con muestreo ganglionar mediastínico sistemático en pacientes de CPCNP en estadios I, II o IIIA.[8][Nivel de evidencia A1]
Las conclusiones acerca de la eficacia de la cirugía para los pacientes de CPCNP local y locorregional se ven limitadas por el número bajo de participantes estudiados hasta la fecha y las posibles debilidades metodológicas de los ensayos.
Terapia adyuvante
Muchos de los pacientes sometidos a cirugía más tarde presentan metástasis regionales o a distancia.[9] Estos pacientes son aptos para participar en estudios clínicos en los que se evalúe el tratamiento posoperatorio con quimioterapia y radioterapia. En la actualidad, se considera que ni la quimioterapia ni la radioterapia mejoran la supervivencia de los pacientes con CPCNP en estadio I sometidos a resección tumoral completa.
Quimioterapia adyuvante
A partir de un metanálisis, no se recomienda la quimioterapia posoperatoria fuera del entorno de un ensayo clínico para pacientes de CPCNP en estadio l sometidos a resección tumoral completa.[10] Sin embargo, es posible que la terapia adyuvante beneficie a los pacientes con tumores en estadio IB que midan más de 4 cm.
Evidencia (quimioterapia adyuvante para pacientes con CPCNP en estadio IB):
- En el estudio del Cancer and Leukemia Group B (CALGB-9633 [NCT00002852]), se evaluaron los resultados en términos de SG para el carboplatino y el paclitaxel adyuvantes versus la observación en 344 pacientes de CPCNP en estadio IB sometidos a resección tumoral (es decir, CPCNP T2, N0 patológico). Al cabo de 4 a 8 semanas de la resección, los pacientes se asignaron al azar para someterse a quimioterapia posoperatoria u observación.[11]
- La supervivencia no fue significativamente diferente (CRI, 0,83; IC 90 %, 0,64–1,08; P = 0,12) en el momento de una mediana de seguimiento de 74 meses.
- El efecto tóxico predominante fue la neutropenia de grado 3 a 4; no hubo muertes relacionadas con el tratamiento.
- En un análisis exploratorio posterior, se observó una diferencia significativa para la supervivencia a favor de la quimioterapia posoperatoria en pacientes con tumores de 4 cm o más de diámetro (CRI, 0,69; IC 90 %, 0,48–0,99; P = 0,043).
Debido a la magnitud de las diferencias observadas en la supervivencia, es posible que el estudio CALGB-9633 no haya tenido suficiente potencia estadística como para detectar mejoras de supervivencia pequeñas, pero significativas desde el punto de vista clínico. Además, el uso de carboplatino versus una combinación con cisplatino quizás haya afectado los resultados. En este momento, no hay datos confiables de evidencia sobre una mejora en la supervivencia de la quimioterapia posoperatoria para los pacientes con CPCNP en estadio IB.[11][Nivel de evidencia A1]
Terapia dirigida adyuvante (para pacientes de cáncer de pulmón de células no pequeñas en estadio IB con mutaciones en EGFR)
En un ensayo clínico de fase III en el que se evaluó la terapia dirigida adyuvante con osimertinib para los pacientes de CPCNP con mutaciones en EGFR y CPCNP en estadios IB a IIIA sometidos a resección tumoral, se observó una mejora de la SG.
Evidencia (terapia dirigida adyuvante con osimertinib para pacientes con CPCNP en estadio IB con mutaciones en EGFR):
- En el ensayo con enmascaramiento doble y controlado con placebo de fase III ADAURA (NCT02511106), 682 pacientes con CPCNP en estadio IB a IIIA sometidos a resección tumoral y con mutaciones sensibilizantes en EGFR (determinadas a nivel central, deleción en el exón 19 o mutación L858R en el exón 21) se asignaron al azar para recibir 80 mg de osimertinib por vía oral al día o un placebo por 3 años. Se permitió la administración de quimioterapia adyuvante posoperatoria estándar y no fue obligatoria; el médico y el paciente tomaron las decisiones relacionadas con la quimioterapia adyuvante antes de la inscripción al ensayo. Hubo 399 pacientes que recibieron osimertinib y 342 pacientes que recibieron un placebo.[12][Nivel de evidencia A1]
- En la población general del estudio, la tasa de SG a 5 años fue del 88 % en el grupo de osimertinib y del 78 % en el grupo de placebo (CRI generalde muerte, 0,49; IC 95,03 %, 0,34–0,70; P < 0,001).
- Entre los pacientes con enfermedad en estadios II a IIIA, la tasa de SG a 5 años fue del 85 % en el grupo de osimertinib y del 73 % en el grupo de placebo (CRI generalde muerte, 0,49; IC 95,03 %, 0,33–0,73; P < 0,001).
- El perfil de efectos adversos es congruente con otros estudios en los que se usa osimertinib, a excepción de la neumonía relacionada con el COVID-19 que se notificó con posterioridad.
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el uso de osimertinib como terapia adyuvante para pacientes con CPCNP en estadios IB a IIIA con deleciones en el exón 19 o mutaciones L858R en el exón 21 de EGFR.
Inmunoterapia adyuvante
Evidencia (inmunoterapia adyuvante con pembrolizumab para pacientes con tumores en estadio IB >4 cm):
- En el ensayo PEARLS/KEYNOTE-091 (NCT02504372) de fase III, multicéntrico, sin enmascaramiento se asignaron al azar 1177 pacientes con CPCNP en estadios IB (tumor >4 cm) a IIIA con resección completa para recibir pembrolizumab (200 mg cada 3 semanas) o placebo durante un máximo de 18 ciclos, o hasta que se presentara progresión de la enfermedad o los efectos tóxicos fueran inaceptables. Los pacientes comenzaron a recibir el tratamiento del estudio después de la resección o, si estaba indicado, después de la quimioterapia adyuvante (durante un máximo de 4 ciclos). Los criterios principales de valoración duales fueron la SSE en la población general del estudio y la SSE en los pacientes con un puntaje de proporción tumoral (TPS) del ligando 1 de muerte programada (PD-L1) del 50 % o más, según se determinó mediante la prueba PD-L1 IHC 22C3 pharmDx. Estos criterios de valoración se notificaron en un análisis intermedio prespecificado al cabo de una mediana de seguimiento de 35,6 meses (intervalo intercuartílico, 27,1–45,5).[13][Nivel de evidencia B1]
- En la población general del estudio, la mediana de SSE fue de 53,6 meses (IC 95 %, 39,2–no alcanzada [NA]) en el grupo de pembrolizumab y de 42,0 meses (IC 95 %, 31,3–NA) en el grupo de placebo (CRI, 0,76; IC 95 %, 0,63–0,91; P = 0,0014).
- En la población con TPS del PD-L1 ≥50 %, la mediana de SSE no se alcanzó con pembrolizumab (IC 95 %, 44,3–NA) ni con placebo (IC 95 %, 35,8–NA) (CRI, 0,82; IC 95 %, 0,57–1,18; P = 0,14).
- Los datos de SG eran preliminares en el momento del análisis interino prespecificado.
- No se identificaron nuevos indicios de toxicidad en este estudio.
La FDA aprobó el uso de pembrolizumab en monoterapia para el tratamiento adyuvante después de la resección y para la quimioterapia con derivados del platino en pacientes con CPCNP en estadios IB (T2a ≥4 cm), II o IIIA. Cabe destacar, que la ficha técnica de la FDA especifica que el pembrolizumab se puede usar como terapia adyuvante después de la quimioterapia con derivados del platino. Sin embargo, la quimioterapia no fue necesaria en la población general de pacientes que se evaluó en el estudio KEYNOTE-091.
Radioterapia adyuvante externa
La utilidad de la radioterapia adyuvante o posoperatoria (RTPO) se evaluó y se encontró que no mejora el desenlace en pacientes con CPCNP en estadio I sometidos a resección tumoral completa.[14]
Braquiterapia adyuvante
En pacientes con CPCNP en estadio I sometidos a resecciones sublobulares, se estudió la utilidad de la braquiterapia intraoperatoria (adyuvante) aplicada en la línea de sutura para mejorar el control local y no se encontró que mejorara los desenlaces.
Evidencia (braquiterapia adyuvante):
- En un ensayo de fase III en el que se asignó al azar a 222 pacientes a resección sublobular con braquiterapia dirigida a la línea de sutura o sin esta, se notificaron los siguientes resultados:[15]
- No hubo diferencia en el criterio principal de valoración de recidiva local (cálculo a 5 años, 14,0 vs. 16,7 %; P = 0,59).
- No hubo diferencia en las tasas de SG (cálculo a 5 años, 61,4 vs. 55,6 %; P = 0,38).[15][Nivel de evidencia B1] vs. [Nivel de evidencia A1]
Radioterapia
Una cantidad considerable de pacientes no son aptos para la resección quirúrgica estándar debido a que tienen afecciones comórbidas que acarrean un riesgo perioperatorio alto inaceptable. Los pacientes con tumores potencialmente resecables que tienen contraindicaciones médicas para someterse a cirugía o aquellos con enfermedad inoperable en estadio l y suficiente capacidad pulmonar de reserva quizás sean aptos para recibir radioterapia con intención curativa.[16-18] En los estudios observacionales no aleatorizados en los que se compararon los resultados del tratamiento con resección, radioterapia y observación, se describieron tiempos de supervivencia más cortos y una mortalidad más alta para los pacientes sometidos solo a observación.[16,19]
Radioterapia convencional
Es tradicional que la dosis de radioterapia primaria convencional oscile entre 60 a 70 Gy, se administre con un aparato de megavoltaje en fracciones convencionales (1,8–2,0 Gy por día) y se dirija al plano medio del volumen conocido del tumor.
Las mejoras en las técnicas de radiación incluyen técnicas de planificación que tienen en cuenta el movimiento tumoral, técnicas de planificación más conformadas (por ejemplo, radioterapia conformada tridimensional y radioterapia de intensidad modulada), así como el uso de imágenes para guiar el tratamiento. Los abordajes modernos para la administración de radioterapia de haz externo (RHE) incluyen radioterapia hipofraccionada y radioterapia corporal estereotáctica (RCE). No obstante, no hay muchos datos confiables derivados de ensayos comparativos para determinar qué abordajes producen desenlaces superiores.[17,18]
Evidencia (radioterapia convencional):
- En la serie retrospectiva más numerosa de radioterapia convencional, los pacientes con enfermedad inoperable recibieron tratamiento con radioterapia definitiva.[20-22]
- Los pacientes lograron tasas de supervivencia a 5 años del 10 % al 30 %.[20-22]
- En varias series se demostró que los pacientes con tumores T1, N0 tenían mejores desenlaces; en este subgrupo, se encontraron tasas de supervivencia a 5 años del 30 % al 60 %.[20,21,23]
- Sin embargo, el fracaso solo local se presenta en cerca del 50 % de los pacientes tratados con radioterapia convencional en dosis que oscilan de 60 a 65 Gy.[24,25]
- En un solo informe de pacientes mayores de 70 años con lesiones resecables de menos de 4 cm, pero con enfermedad inoperable por contraindicaciones médicas o que se rehusaron a someterse a la cirugía, se notificó lo siguiente:[23]
- La supervivencia a 5 años después de la radioterapia con intención curativa fue comparable a la de un grupo de control histórico de pacientes de edad similar sometidos a cirugía con intención curativa.
- En una serie de casos pequeña en la que se usaron controles emparejados, se notificaron los siguientes resultados:[4]
- La adición de braquiterapia endobronquial mejoró el control de la enfermedad local en comparación con la RHE.[4][Nivel de evidencia C2]
Radioterapia hipofraccionada
La radioterapia hipofraccionada supone la administración de una dosis diaria un poco más alta de radioterapia (por ejemplo, 2,4–4,0 Gy) durante un período más breve en comparación con la radioterapia fraccionada convencional. En múltiples ensayos prospectivos de fase I/II, se demostró que la radioterapia hipofraccionada en dosis de 60 a 70 Gy administradas durante 3 a 4 semanas (2,4 a 4,0 Gy diarios) produjo una incidencia baja de efectos tóxicos moderados a graves, tasas de SG a 2 años del 50 % al 60 %, y control tumoral local a 2 años del 80 % al 90 %.[26-28][Nivel de evidencia C1]
Radioterapia corporal estereotáctica
La radioterapia corporal estereotáctica (RCE) supone la administración de radioterapia muy conformada y en dosis altas durante un ciclo muy hipofraccionado (por ejemplo, 1 a 5 tratamientos) durante 1 a 2 semanas. Por lo general, los regímenes utilizados incluyen 18 Gy × 3, 12 a 12,5 Gy × 4 y 10 a 12 Gy × 5; estos regímenes proporcionan una dosis biológicamente más eficaz que los regímenes tradicionales de radioterapia convencional.
En numerosos ensayos prospectivos de fase I/II, así como en series institucionales, se demostró que la RCE produce una incidencia baja de efectos tóxicos pulmonares (menos del 10 % de riesgo de neumonía sintomática por radiación), tasas de SG a 2 años del 50 % al 60 %, y un control tumoral a 2 años del 90 % al 95 %.[29-35][Nivel de evidencia C1]
Evidencia (RCE):
- En ensayos tempranos de fase I/II conducidos en la Indiana University, se identificó que la dosis máxima tolerada de RCE de 3 fracciones fue de 18 Gy × 3 para tumores T1.
- Este régimen produjo una SG a 2 años del 55 % y un control tumoral local a 2 años del 95 %.
- Se observó una incidencia alta inaceptable (8,6 %) de efectos tóxicos de grado 5 en pacientes con tumores de origen central (definidos como aquellos a 2 cm o menos del árbol traqueobronquial desde la tráquea hasta el nivel de los bronquios lobulares).[30]
- En un ensayo multicéntrico posterior (RTOG-0236 [NCT00087438]), se estudió el régimen de 18 Gy × 3 en 55 pacientes con tumores periféricos únicos T1 a T2.
- En este ensayo, se demostró una SG a 3 años del 56 % y un control del tumor primario a 3 años del 98 %.
- La incidencia de efectos tóxicos moderados a graves fue baja, se presentaron efectos tóxicos de grado 3 en el 24 % de los pacientes, efectos tóxicos de grado 4 en el 4 % de los pacientes y no se observaron efectos tóxicos de grado 5; la incidencia de neumonía por radiación de grado 3 fue del 4 %.[34]
- En la serie más numerosa notificada por el VU University Medical Center Amsterdam, se trató a 676 pacientes con tumores T1 a T2 con 3, 5 y 8 fracciones de RCE y un abordaje adaptado al riesgo (un régimen de fraccionamiento adaptado según la proximidad del tumor a los órganos vitales).
- Luego de una mediana de seguimiento de 32,9 meses, la mediana de SG fue de 40,7 meses y el control tumoral local a los 2 años fue del 95 %.[35]
- Si bien la ubicación central es una contraindicación para la RCE de 3 fracciones de acuerdo con el estudio de fase II de Indiana, en una revisión sistemática posterior de informes publicados sobre 315 pacientes con 563 tumores de origen central, se demostró una incidencia mucho más baja de efectos tóxicos graves, entre estos, del 1 % al 5 % para el riesgo de efectos de grado 5 con los regímenes más prolongados de RCE (por ejemplo, 4 a 10 fracciones).[36]
- Está en curso un ensayo multicéntrico de fase I/II (RTOG-0813 [NCT00750269]) para identificar la dosis máxima tolerada de un régimen de RCE de 5 fracciones para tumores de origen central.
También se está llevando a cabo un ensayo aleatorizado de radioterapia hipofraccionada versus RCE (LUSTRE [NCT01968941]) para determinar el régimen de radioterapia óptimo; sin embargo, ya se generalizó el uso de la RCE para pacientes de CPCNP en estadio I con enfermedad inoperable por contraindicaciones médicas.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Ginsberg RJ, Hill LD, Eagan RT, et al.: Modern thirty-day operative mortality for surgical resections in lung cancer. J Thorac Cardiovasc Surg 86 (5): 654-8, 1983. [PUBMED Abstract]
- Ginsberg RJ, Rubinstein LV: Randomized trial of lobectomy versus limited resection for T1 N0 non-small cell lung cancer. Lung Cancer Study Group. Ann Thorac Surg 60 (3): 615-22; discussion 622-3, 1995. [PUBMED Abstract]
- Warren WH, Faber LP: Segmentectomy versus lobectomy in patients with stage I pulmonary carcinoma. Five-year survival and patterns of intrathoracic recurrence. J Thorac Cardiovasc Surg 107 (4): 1087-93; discussion 1093-4, 1994. [PUBMED Abstract]
- Mantz CA, Dosoretz DE, Rubenstein JH, et al.: Endobronchial brachytherapy and optimization of local disease control in medically inoperable non-small cell lung carcinoma: a matched-pair analysis. Brachytherapy 3 (4): 183-90, 2004. [PUBMED Abstract]
- Altorki N, Wang X, Kozono D, et al.: Lobar or Sublobar Resection for Peripheral Stage IA Non-Small-Cell Lung Cancer. N Engl J Med 388 (6): 489-498, 2023. [PUBMED Abstract]
- Manser R, Wright G, Hart D, et al.: Surgery for early stage non-small cell lung cancer. Cochrane Database Syst Rev (1): CD004699, 2005. [PUBMED Abstract]
- Allen MS, Darling GE, Pechet TT, et al.: Morbidity and mortality of major pulmonary resections in patients with early-stage lung cancer: initial results of the randomized, prospective ACOSOG Z0030 trial. Ann Thorac Surg 81 (3): 1013-9; discussion 1019-20, 2006. [PUBMED Abstract]
- Darling GE, Allen MS, Decker PA, et al.: Randomized trial of mediastinal lymph node sampling versus complete lymphadenectomy during pulmonary resection in the patient with N0 or N1 (less than hilar) non-small cell carcinoma: results of the American College of Surgery Oncology Group Z0030 Trial. J Thorac Cardiovasc Surg 141 (3): 662-70, 2011. [PUBMED Abstract]
- Martini N, Bains MS, Burt ME, et al.: Incidence of local recurrence and second primary tumors in resected stage I lung cancer. J Thorac Cardiovasc Surg 109 (1): 120-9, 1995. [PUBMED Abstract]
- Pignon JP, Tribodet H, Scagliotti GV, et al.: Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol 26 (21): 3552-9, 2008. [PUBMED Abstract]
- Strauss GM, Herndon JE, Maddaus MA, et al.: Adjuvant paclitaxel plus carboplatin compared with observation in stage IB non-small-cell lung cancer: CALGB 9633 with the Cancer and Leukemia Group B, Radiation Therapy Oncology Group, and North Central Cancer Treatment Group Study Groups. J Clin Oncol 26 (31): 5043-51, 2008. [PUBMED Abstract]
- Tsuboi M, Herbst RS, John T, et al.: Overall Survival with Osimertinib in Resected EGFR-Mutated NSCLC. N Engl J Med 389 (2): 137-147, 2023. [PUBMED Abstract]
- O'Brien M, Paz-Ares L, Marreaud S, et al.: Pembrolizumab versus placebo as adjuvant therapy for completely resected stage IB-IIIA non-small-cell lung cancer (PEARLS/KEYNOTE-091): an interim analysis of a randomised, triple-blind, phase 3 trial. Lancet Oncol 23 (10): 1274-1286, 2022. [PUBMED Abstract]
- PORT Meta-analysis Trialists Group: Postoperative radiotherapy for non-small cell lung cancer. Cochrane Database Syst Rev (2): CD002142, 2005. [PUBMED Abstract]
- Fernando HC, Landreneau RJ, Mandrekar SJ, et al.: Impact of brachytherapy on local recurrence rates after sublobar resection: results from ACOSOG Z4032 (Alliance), a phase III randomized trial for high-risk operable non-small-cell lung cancer. J Clin Oncol 32 (23): 2456-62, 2014. [PUBMED Abstract]
- McGarry RC, Song G, des Rosiers P, et al.: Observation-only management of early stage, medically inoperable lung cancer: poor outcome. Chest 121 (4): 1155-8, 2002. [PUBMED Abstract]
- Lanni TB, Grills IS, Kestin LL, et al.: Stereotactic radiotherapy reduces treatment cost while improving overall survival and local control over standard fractionated radiation therapy for medically inoperable non-small-cell lung cancer. Am J Clin Oncol 34 (5): 494-8, 2011. [PUBMED Abstract]
- Grutters JP, Kessels AG, Pijls-Johannesma M, et al.: Comparison of the effectiveness of radiotherapy with photons, protons and carbon-ions for non-small cell lung cancer: a meta-analysis. Radiother Oncol 95 (1): 32-40, 2010. [PUBMED Abstract]
- Raz DJ, Zell JA, Ou SH, et al.: Natural history of stage I non-small cell lung cancer: implications for early detection. Chest 132 (1): 193-9, 2007. [PUBMED Abstract]
- Dosoretz DE, Katin MJ, Blitzer PH, et al.: Radiation therapy in the management of medically inoperable carcinoma of the lung: results and implications for future treatment strategies. Int J Radiat Oncol Biol Phys 24 (1): 3-9, 1992. [PUBMED Abstract]
- Gauden S, Ramsay J, Tripcony L: The curative treatment by radiotherapy alone of stage I non-small cell carcinoma of the lung. Chest 108 (5): 1278-82, 1995. [PUBMED Abstract]
- Sibley GS, Jamieson TA, Marks LB, et al.: Radiotherapy alone for medically inoperable stage I non-small-cell lung cancer: the Duke experience. Int J Radiat Oncol Biol Phys 40 (1): 149-54, 1998. [PUBMED Abstract]
- Noordijk EM, vd Poest Clement E, Hermans J, et al.: Radiotherapy as an alternative to surgery in elderly patients with resectable lung cancer. Radiother Oncol 13 (2): 83-9, 1988. [PUBMED Abstract]
- Dosoretz DE, Galmarini D, Rubenstein JH, et al.: Local control in medically inoperable lung cancer: an analysis of its importance in outcome and factors determining the probability of tumor eradication. Int J Radiat Oncol Biol Phys 27 (3): 507-16, 1993. [PUBMED Abstract]
- Kaskowitz L, Graham MV, Emami B, et al.: Radiation therapy alone for stage I non-small cell lung cancer. Int J Radiat Oncol Biol Phys 27 (3): 517-23, 1993. [PUBMED Abstract]
- Bradley J, Graham MV, Winter K, et al.: Toxicity and outcome results of RTOG 9311: a phase I-II dose-escalation study using three-dimensional conformal radiotherapy in patients with inoperable non-small-cell lung carcinoma. Int J Radiat Oncol Biol Phys 61 (2): 318-28, 2005. [PUBMED Abstract]
- Bogart JA, Hodgson L, Seagren SL, et al.: Phase I study of accelerated conformal radiotherapy for stage I non-small-cell lung cancer in patients with pulmonary dysfunction: CALGB 39904. J Clin Oncol 28 (2): 202-6, 2010. [PUBMED Abstract]
- Cheung P, Faria S, Ahmed S, et al.: Phase II study of accelerated hypofractionated three-dimensional conformal radiotherapy for stage T1-3 N0 M0 non-small cell lung cancer: NCIC CTG BR.25. J Natl Cancer Inst 106 (8): , 2014. [PUBMED Abstract]
- Timmerman R, Papiez L, McGarry R, et al.: Extracranial stereotactic radioablation: results of a phase I study in medically inoperable stage I non-small cell lung cancer. Chest 124 (5): 1946-55, 2003. [PUBMED Abstract]
- Timmerman R, McGarry R, Yiannoutsos C, et al.: Excessive toxicity when treating central tumors in a phase II study of stereotactic body radiation therapy for medically inoperable early-stage lung cancer. J Clin Oncol 24 (30): 4833-9, 2006. [PUBMED Abstract]
- Lagerwaard FJ, Haasbeek CJ, Smit EF, et al.: Outcomes of risk-adapted fractionated stereotactic radiotherapy for stage I non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 70 (3): 685-92, 2008. [PUBMED Abstract]
- Baumann P, Nyman J, Hoyer M, et al.: Outcome in a prospective phase II trial of medically inoperable stage I non-small-cell lung cancer patients treated with stereotactic body radiotherapy. J Clin Oncol 27 (20): 3290-6, 2009. [PUBMED Abstract]
- Fakiris AJ, McGarry RC, Yiannoutsos CT, et al.: Stereotactic body radiation therapy for early-stage non-small-cell lung carcinoma: four-year results of a prospective phase II study. Int J Radiat Oncol Biol Phys 75 (3): 677-82, 2009. [PUBMED Abstract]
- Timmerman R, Paulus R, Galvin J, et al.: Stereotactic body radiation therapy for inoperable early stage lung cancer. JAMA 303 (11): 1070-6, 2010. [PUBMED Abstract]
- Senthi S, Lagerwaard FJ, Haasbeek CJ, et al.: Patterns of disease recurrence after stereotactic ablative radiotherapy for early stage non-small-cell lung cancer: a retrospective analysis. Lancet Oncol 13 (8): 802-9, 2012. [PUBMED Abstract]
- Senthi S, Haasbeek CJ, Slotman BJ, et al.: Outcomes of stereotactic ablative radiotherapy for central lung tumours: a systematic review. Radiother Oncol 106 (3): 276-82, 2013. [PUBMED Abstract]
Tratamiento del cáncer de pulmón de células no pequeñas en estadios IIA y IIB
Opciones de tratamiento para el cáncer de pulmón de células no pequeñas en estadios IIA y IIB
Las opciones de tratamiento para el cáncer de pulmón de células no pequeñas en estadio IIA y el cáncer de pulmón de células no pequeñas en estadio IIB son las siguientes:
- Cirugía con terapia adyuvante o terapia neoadyuvante o sin estas.
- Radioterapia (para pacientes no aptos para cirugía).
- Participación en ensayos clínicos de radioterapia luego de una cirugía curativa.
La radioterapia adyuvante no mostró mejorar los resultados en los pacientes de CPCNP en estadio II.
Cirugía con terapia adyuvante, terapia neoadyuvante o sin estas
Cirugía sola
La cirugía es el tratamiento preferido para pacientes de CPCNP en estadio II. Según el caso, es posible llevar a cabo una lobectomía, una neumonectomía, una resección segmentaria, una resección en cuña o una resección en manguito, cuando se considere apropiado. La evaluación preoperatoria minuciosa del estado general de salud del paciente, en especial de la capacidad pulmonar de reserva, es muy importante ya que permite analizar los beneficios de la cirugía. Además de la tasa de mortalidad postoperatoria inmediata y de la mortalidad relacionada con la edad, se prevé una tasa de mortalidad del 5 % al 8 % con la neumonectomía y una tasa de mortalidad del 3 % al 5 % con la lobectomía.
Evidencia (cirugía):
- En la Colaboración Cochrane se revisaron 11 ensayos aleatorizados con 1910 pacientes sometidos a intervenciones quirúrgicas para el cáncer de pulmón en estadio temprano (I–IIIA).[1] En el análisis conjunto se notificaron los siguientes resultados:
- La supervivencia a 4 años fue superior en pacientes de CPCNP resecable en estadios I, II o IIIA sometidos a resección con disección completa de ganglios linfáticos mediastínicos (DCGLM) a nivel ipsilateral, en comparación con los sometidos a resección con muestreo de ganglios linfáticos; el cociente de riesgos instantáneos (CRI) se calculó en 0,78 (intervalo de confianza [IC] 95 %, 0,65–0,93, P = 0,005).[1][Nivel de evidencia A1]
- En el grupo de DCGLM, hubo una reducción significativa de la recidiva de cáncer local o a distancia (riesgo relativo [RR] = 0,79; IC 95 %, 0,66–0,95; P = 0,01), debida sobre todo a una reducción del número de recidivas a distancia (RR = 0,78; IC 95 %, 0,61–1,00; P = 0,05).
- No hubo diferencia en la mortalidad operatoria.
- La fuga de aire durante más de 5 días fue significativamente más frecuente en los pacientes asignados a DCGLM (RR = 2,94; IC 95 %, 1,01–8,54; P = 0,05).
- En un gran ensayo aleatorizado de fase III (ACOSOG-Z0030 [NCT00003831]), se evaluó la DCGLM versus el muestreo ganglionar.[2]
- En los análisis preliminares de morbilidad y mortalidad operatoria se observaron tasas comparables para los procedimientos.[2]
- No hubo diferencias en la supervivencia general (SG), la supervivencia sin enfermedad (SSE), la recidiva local y la recidiva regional.[3][Nivel de evidencia A1]
La evidencia indica que, para el cáncer de pulmón, la resección combinada con DCGLM no se relaciona con una mejoría de la supervivencia, en comparación con la resección combinada con muestreo ganglionar mediastínico sistemático en pacientes de CPCNP en estadios I, II o IIIA.[3][Nivel de evidencia A1]
Las conclusiones acerca de la eficacia de la cirugía para los pacientes de CPCNP local y locorregional son limitadas debido al número pequeño de participantes estudiados y las posibles debilidades metodológicas de los ensayos.
Quimioterapia adyuvante
La mayor parte de la evidencia indica que la quimioterapia posoperatoria con cisplatino proporciona una ventaja significativa para la supervivencia de los pacientes de CPCNP en estadio II sometidos a resección tumoral. La quimioterapia preoperatoria también puede proporcionar un beneficio para la supervivencia. Aún no se ha determinado la secuencia óptima de la cirugía y la quimioterapia, ni los beneficios y riesgos de la radioterapia posoperatoria para los pacientes con CPCNP resecable.
Después de la cirugía, muchos pacientes presentan metástasis regionales o a distancia.[4] En varios ensayos controlados aleatorizados y metanálisis, se evaluó el uso de la quimioterapia adyuvante administrada a pacientes de CPCNP en estadios I, II y IIIA.[5-11]
Evidencia (quimioterapia adyuvante):
- En un metanálisis de los 5 ensayos más grandes (4584 pacientes) llevados a cabo después de 1995, se recopilaron y combinaron datos individualizados de los desenlaces de pacientes con CPCNP sometidos a resección tumoral completa que recibieron quimioterapia con derivados del platino.[7]
- Al cabo de una mediana de seguimiento de 5,2 años, el CRI generalde muerte fue de 0,89 (IC 95 %, 0,82–0,96; P = 0,005), lo que equivale a un beneficio absoluto a 5 años del 5,4 % para la quimioterapia.
- El beneficio varió según el estadio (prueba de tendencia, P = 0,04; CRI para el estadio IA = 1,40; IC 95 %, 0,95–2,06; CRI para el estadio IB = 0,93; IC 95 %, 0,78–1,10; CRI para el estadio II = 0,83; IC 95 %, 0,73–0,95, y CRI para el estadio III = 0,83; IC 95 %, 0,72–0,94).
- El efecto de la quimioterapia no varió significativamente (prueba de interacción, P = 0,11) según los medicamentos relacionados, como vinorelbina (CRI, 0,80; IC 95 %, 0,70–0,91), etopósido o alcaloides de vinca (CRI, 0,92; IC 95 %, 0,80–1,07), u otros fármacos (CRI, 0,97; IC 95 %, 0,84–1,13).
- El mayor beneficio observado con la biquimioterapia con cisplatino y vinorelbina, comparado con otros regímenes, se debe interpretar con cautela ya que los pacientes tratados con vinorelbina recibieron una dosis de cisplatino significativamente más alta.
- En el metanálisis [7] y en los estudios individuales [5,12] se apoya la administración de quimioterapia a base de cisplatino en combinación con vinorelbina.
- En el análisis conjunto del ensayo Lung Adjuvant Cisplatin Evaluation (LACE), se notificó una SG superior para la población del ensayo y los pacientes con enfermedad en estadio II (CRI conjunto = 0,83, IC 95 %, 0,73–0,95), en comparación con el ensayo de Adjuvant Navelbine International Trialist Association (ANITA) (CRI, 0,71, IC 95 %, 0,49–1,03) y en el ensayo del National Cancer Institute of Canada Clinical Trials Group JBR.10 (CRI, 0,59, IC 95 %, 0,42–0,85).
- El efecto de la quimioterapia fue más alto en los pacientes con mejor estado funcional.
- No hubo interacción entre el efecto de la quimioterapia ni ninguno de los siguientes factores:
- Sexo.
- Edad.
- Características histológicas.
- Tipo de cirugía.
- Radioterapia planificada.
- Dosis total de cisplatino planificada.
- En una análisis retrospectivo de un ensayo en fase III de cisplatino y vinorelbina posoperatorios, se encontró beneficio para los pacientes mayores de 65 años.[13]
- La quimioterapia prolongó significativamente la SG de los pacientes mayores de 65 años (CRI, 0,61; IC 95 %, 0,38–0,98; P = 0,04).
- No hubo diferencias significativas por grupo de edad con respecto a los efectos tóxicos, las hospitalizaciones o las muertes relacionadas con el tratamiento, aunque los pacientes mayores de 65 años recibieron menos tratamiento.[13]
- En varios ensayos controlados aleatorizados y en metanálisis se evaluó el uso de la quimioterapia posoperatoria para pacientes de CPCNP en estadios I, II y IIIA.[5-11]
De acuerdo con estos datos, es posible que los pacientes de cáncer de pulmón en estadio II sometidos a resección tumoral completa se beneficien de la quimioterapia posoperatoria a base de cisplatino.[13][Nivel de evidencia A1]
Terapia dirigida adyuvante (para pacientes con mutaciones en EGFR)
En un ensayo clínico de fase III en el que se evaluó la terapia dirigida adyuvante con osimertinib para los pacientes de CPCNP con mutaciones en EGFR y CPCNP en estadios IB a IIIA sometidos a resección tumoral, se observó una mejora de la SG.
Evidencia (terapia dirigida adyuvante con osimertinib para pacientes con CPCNP con mutaciones en EGFR en estadio IIA y IIB):
- En el ensayo con enmascaramiento doble y controlado con placebo de fase III ADAURA (NCT02511106), 682 pacientes con CPCNP en estadio IB a estadio IIIA sometidos a resección tumoral y con mutaciones sensibilizantes en EGFR (determinadas a nivel central, deleción en el exón 19 o mutación L858R en el exón 21), se asignaron al azar para recibir 80 mg de osimertinib por vía oral al día o un placebo por 3 años. Se permitió la administración de quimioterapia adyuvante posoperatoria estándar y no fue obligatoria; el médico y el paciente tomaron las decisiones relacionadas con la quimioterapia adyuvante antes de la inscripción al ensayo. Hubo 399 pacientes que recibieron osimertinib y 342 pacientes que recibieron un placebo.[14][Nivel de evidencia A1]
- En la población general del estudio, la tasa de SG a 5 años fue del 88 % en el grupo de osimertinib y del 78 % en el grupo de placebo (CRI generalde muerte, 0,49; IC 95,03 %, 0,34–0,70; P < 0,001).
- Entre los pacientes con enfermedad en estadios II a IIIA, la tasa de SG a 5 años fue del 85 % en el grupo de osimertinib y del 73 % en el grupo de placebo (CRI generalde muerte, 0,49; IC 95,03 %, 0,33–0,73; P < 0,001).
- El perfil de efectos adversos es congruente con otros estudios en los que se usa osimertinib, a excepción de la neumonía relacionada con el COVID-19 que se notificó con posterioridad.
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el uso de osimertinib como terapia adyuvante para pacientes con CPCNP en estadios IB a IIIA con deleciones en el exón 19 o mutaciones L858R en el exón 21 de EGFR.
Inmunoterapia adyuvante
Se ha observado que la inmunoterapia adyuvante en pacientes con CPCNP en estadio IB a IIIA resecable aumenta la SSE de manera significativa.[15,16]
Evidencia (inmunoterapia adyuvante con pembrolizumab para pacientes con tumores en estadios IIA y IIB >4 cm):
- En el ensayo PEARLS/KEYNOTE-091 (NCT02504372) de fase III, multicéntrico, sin enmascaramiento se asignaron al azar 1177 pacientes con CPCNP en estadios IB (tumor >4 cm) a IIIA con resección completa para recibir pembrolizumab (200 mg cada 3 semanas) o placebo durante un máximo de 18 ciclos, o hasta que se presentara progresión de la enfermedad o los efectos tóxicos fueran inaceptables. Los pacientes comenzaron a recibir el tratamiento del estudio después de la resección o, si estaba indicado, después de la quimioterapia adyuvante (durante un máximo de 4 ciclos). Los criterios principales de valoración duales fueron la SSE en la población general del estudio y la SSE en los pacientes con un puntaje de proporción tumoral (TPS) de PD-L1 del 50 % o más, según se determinó mediante la prueba PD-L1 IHC 22C3 pharmDx. Estos criterios de valoración se notificaron en un análisis intermedio prespecificado al cabo de una mediana de seguimiento de 35,6 meses (intervalo intercuartílico [IIC], 27,1–45,5).[15][Nivel de evidencia B1]
- En la población general del estudio, la mediana de SSE fue de 53,6 meses (IC 95 %, 39,2–no alcanzada [NA]) en el grupo de pembrolizumab y de 42,0 meses (IC 95 %, 31,3–NA) en el grupo de placebo (CRI, 0,76; IC 95 %, 0,63–0,91; P = 0,0014).
- En la población con TPS del PD-L1 ≥50 %, la mediana de SSE no se alcanzó con pembrolizumab (IC 95 %, 44,3–NA) ni con placebo (IC 95 %, 35,8–NA) (CRI, 0,82; IC 95 %, 0,57–1,18; P = 0,14).
- Los datos de SG eran preliminares en el momento del análisis interino prespecificado.
- No se identificaron nuevos indicios de toxicidad en este estudio.
La FDA aprobó el uso de pembrolizumab en monoterapia para el tratamiento adyuvante después de la resección y para la quimioterapia con derivados del platino en pacientes con CPCNP en estadios IB (T2a ≥4 cm), II o IIIA. Cabe destacar, que la ficha técnica de la FDA especifica que el pembrolizumab se puede usar como terapia adyuvante después de la quimioterapia con derivados del platino. Sin embargo, la quimioterapia no fue necesaria en la población general de pacientes que se evaluó en el estudio KEYNOTE-091.
Evidencia (inmunoterapia adyuvante con atezolizumab para pacientes con CPCNP en estadios IIA y IIB):
- El IMpower010 (NCT02486718) fue un ensayo multicéntrico sin anonimato de fase III, en el que se asignó al azar a 1005 pacientes con CPCNP en estadio IB (tumor >4 cm) a IIIA sometidos a resección tumoral. Los pacientes recibieron atezolizumab (1200 mg cada 21 días por vía intravenosa) o el mejor cuidado de apoyo disponible por 16 ciclos o 1 año después de la quimioterapia adyuvante estándar con derivados del platino. Los pacientes se inscribieron después de la resección, si eran eligibles para quimioterapia a base de cisplatino, y fueron aleatorizados después de la finalización de la quimioterapia si todavía eran eligibles y no presentaban progresión de la enfermedad. El criterio principal de valoración fue la SSE evaluada por el investigador.[16]
- El criterio principal de valoración se probó de forma jerárquica, primero en el subgrupo de la población en estadio II a IIIA cuyos tumores expresaron PD-L1 en al menos el 1 % de las células tumorales (se usó el anticuerpo SP263), después en todos los pacientes de la población en estadio II a IIIA y, por último, en la población por intención de tratar (estadio IB a IIIA). De los 882 pacientes asignados al azar y que tenían enfermedad en estadio II a IIIA, 476 tenían tumores que expresaban PD-L1 en al menos el 1 % de las células tumorales mediante prueba SP263.[16][Nivel de evidencia B1]
- Después de una mediana de seguimiento de 32,2 meses, el tratamiento con atezolizumab mejoró la SSE en comparación con el mejor cuidado de apoyo en los pacientes de la población en estadio II a IIIA cuyos tumores expresaron PD-L1 en al menos el 1 % de las células tumorales (CRI, 0,66; IC 95 %, 0,50–0,88; P = 0,0039). A los 24 meses, la tasa de SSE fue del 74,6 % para el grupo de atezolizumab y del 61,0 % para el mejor grupo de cuidados de apoyo.
- El atezolizumab también mejoró la SSE en todos los pacientes de la población en estadio II a IIIA (CRI, 0,79; IC 95 %, 0,64–0,96; P = 0,020). A los 24 meses, la tasa de SSE fue del 70,2 % para el grupo de atezolizumab y del 61,6 % para el mejor grupo de cuidados de apoyo.
- En la población por intención de tratar, que incluyó a pacientes con enfermedad en estadio IB a IIIA, el CRISSE fue del 0,81 (IC 95 %, 0,67–0,99; P = 0,040). Sin embargo, la SSE no superó el límite de significación estadística.
- Los datos de SG son preliminares.
- No se observaron nuevas señales de seguridad.
La FDA aprobó el atezolizumab para el tratamiento adyuvante de pacientes con CPCNP en estadio II a IIIA cuyos tumores expresan PD-L1 en al menos el 1 % de las células tumorales.
Radioterapia adyuvante
Se analizó el valor de la radioterapia posoperatoria (RTPO) o adyuvante.[17]
Evidencia (radioterapia adyuvante):
- En un metanálisis de los resultados de 10 ensayos controlados aleatorizados con 2232 personas, se notificaron los siguientes resultados:[17]
- Un aumento relativo del 18 % del riesgo de muerte para los pacientes que recibieron RTPO en comparación con cirugía sola (CRI, 1,18; P = 0,002). Esto equivale a una disminución absoluta del 6 % a los 2 años (IC 95 %, 2–9 %) y una reducción del 58 % al 52 % para la SG. En los análisis exploratorios de subgrupos se indicó que este efecto perjudicial fue mayor en los pacientes con enfermedad en estadio I/II, N0–N1, mientras que en los pacientes con enfermedad en estadio III N2 no hubo signos evidentes de un efecto adverso.
- En los resultados de supervivencia sin recidiva local (CRI, 1,13; P = 0,02), supervivencia sin recidiva a distancia (CRI, 1,14; P = 0,02) y supervivencia sin recidiva general (CRI, 1,10; P = 0,06) también se observaron los efectos perjudiciales de la RTPO.[17][Nivel de evidencia A1]
Se necesitan más análisis para determinar si es posible modificar esos desenlaces mediante perfeccionamientos técnicos, mejores definiciones de los volúmenes diana y limitaciones del volumen cardíaco en los campos de radiación.
Quimioterapia neoadyuvante
La función de la quimioterapia antes de la cirugía se probó en ensayos clínicos. Los beneficios propuestos para la quimioterapia preoperatoria son los siguientes:
- Reducción del tamaño del tumor que a veces facilita la resección quirúrgica.
- Erradicación temprana de las micrometástasis.
- Tolerabilidad mejorada.
Sin embargo, en ocasiones la quimioterapia preoperatoria retrasa una cirugía potencialmente curativa.
Evidencia (quimioterapia neoadyuvante):
- La Colaboración Cochrane notificó una revisión sistemática y un metanálisis de 7 ensayos controlados aleatorizados con 988 pacientes en los que se analizó la combinación de quimioterapia preoperatoria y cirugía versus cirugía sola. En estos ensayos, se evaluó a pacientes de CPCNP en estadios I, II y IIIA.[18]
- La quimioterapia preoperatoria proporcionó un beneficio absoluto del 6 % para la supervivencia en todos los estadios de la enfermedad, que osciló entre el 14 % y el 20 % a los 5 años (CRI, 0,82; IC 95 %, 0,69–0,97; P = 0,022).[18][Nivel de evidencia A1]
- En este análisis no se lograron abordar preguntas como el tipo específico de pacientes que se beneficiarían más o menos de la quimioterapia preoperatoria.
- En el ensayo más numeroso notificado hasta la fecha, se asignó al azar a 519 pacientes para someterse a cirugía sola o a 3 ciclos de quimioterapia con derivados del platino seguida de cirugía. La mayoría de los pacientes (61 %) tenía una enfermedad en estadio clínico I, el 31 % tenía una enfermedad en estadio II y el 7 % tenía una enfermedad en estadio III.[19]
- No se observó ventaja para la supervivencia.[19]
- Las complicaciones posoperatorias fueron similares entre los grupos y no se observó deterioro de la calidad de vida.
- No hubo indicios de beneficio en términos de la SG (CRI, 1,02; IC 95 %, 0,80–1,31; P = 0,86).
- Cuando se actualizó la revisión sistemática con la adición del resultado mencionado, se encontró un beneficio relativo para la supervivencia del 12 % en el uso de quimioterapia adyuvante preoperatoria (1507 pacientes, CRI, 0,88; IC 95 %, 0,76–1,01; P = 0,07), que equivale a una mejoría absoluta de la supervivencia a 5 años del 5 %.
Inmunoterapia neoadyuvante con quimioterapia
Nivolumab y quimioterapia con derivados del platino
En el ensayo CheckMate 816, se evaluó el nivolumab (un anticuerpo anti-proteína de muerte celular programada 1) en combinación con quimioterapia a base de derivados del platino como terapia neoadyuvante en pacientes con CPCNP resecable (≥4 cm o compromiso ganglionar). El tratamiento con nivolumab produjo mejores tasas de supervivencia sin complicaciones (SSC) y de respuesta patológica completa en comparación con la quimioterapia sola.
Evidencia (nivolumab y quimioterapia con derivados del platino):
- En el ensayo sin enmascaramiento de fase III, CheckMate 816 (NCT02998528), se inscribieron 538 pacientes con CPCNP resecable en estadios IB a IIIA. Cabe destacar, que los pacientes con enfermedad en estadio IB tenían tumores que medían al menos 4 cm y se clasificaron según los criterios de estadificación de la séptima edición del AJCC que se usó en este estudio; estos tumores en la actualidad se clasifican como tumores en estadio IIA según los criterios de estadificación de la octava edición del AJCC. Los pacientes se asignaron al azar para recibir nivolumab (360 mg) en combinación con biquimioterapia con derivados del platino o biquimioterapia con derivados del platino sola cada 3 semanas por 3 ciclos antes de someterse a cirugía definitiva. Los criterios principales de valoración fueron la SSC (definida como el tiempo desde la aleatorización hasta cualquier indicio de progresión de la enfermedad con exclusión de la cirugía, progresión o recidiva de la enfermedad después de la cirugía, progresión de la enfermedad en ausencia de cirugía o muerte por cualquier causa) y la respuesta patológica completa (definida como el 0 % de células tumorales residuales viables en el tumor primario y las muestras ganglionares) evaluada mediante revisión central independiente con enmascaramiento.[20][Nivel de evidencia B1]
- Al cabo de un seguimiento mínimo de 21 meses, la mediana de SSC fue de 31,6 meses (IC 95 %, 30,2–no alcanzado) en el grupo de nivolumab con quimioterapia y de 20,8 meses (IC 95 %, 14,0–26,7) en el grupo de quimioterapia sola (CRI, 0,63; IC 97,38 %, 0,43–0,91; P = 0,005).
- El porcentaje estimado de pacientes que sobrevivieron sin progresión de la enfermedad ni recidiva al cabo de 1 año fue del 76,1 % en los pacientes que recibieron nivolumab con quimioterapia y del 63,4 % en los pacientes que recibieron quimioterapia sola. La magnitud del beneficio fue mayor en 1) los pacientes con enfermedad en estadio IIIA versus los pacientes con enfermedad en estadio IB o II (CRI, 0,54; IC 95 %, 0,37–0,80 vs. CRI, 0,87; IC 95 %, 0,48–1,56), 2) los pacientes con expresión de PD-L1 ≥1 % en el tumor versus <1 % (CRI, 0,41; IC 95 %, 0,24–0,70 vs. CRI, 0,85; IC 95 %, 0,54–1,32), y 3) los pacientes con características histológicas no escamosas versus escamosas.
- Se observó respuesta patológica completa en el 24 % (IC 95 %, 18,0– 31,0 %) de los pacientes que recibieron nivolumab con quimioterapia y en el 2,2 % (IC 95 %, 0,6–5,6 %) de los pacientes que recibieron quimioterapia sola (oportunidad relativa [OR], 13,94; IC 99 %, 3,49–55,75; P < 0,001).
- No se alcanzo la mediana de la SG en ninguno de los grupos (CRIde muerte, 0,57; IC 99,67 %, 0,30–1,07; P = 0,008).
- Se presentaron efectos adversos de grado 3 o 4 relacionados con el tratamiento en el 33,5 % de pacientes en el grupo de nivolumab con quimioterapia y en el 36,9 % de pacientes en el grupo de quimioterapia sola. Los efectos adversos relacionados con el tratamiento condujeron a la interrupción del mismo en el 10,2 % de los pacientes en el grupo de nivolumab con quimioterapia y en el 9,7 % de los pacientes en el grupo de quimioterapia sola.
La FDA aprobó el uso de nivolumab en combinación con un régimen de biquimioterapia con derivados del platino para el tratamiento neoadyuvante de pacientes con CPCNP resecable (tumores ≥4 cm o con compromiso ganglionar).
Inmunoterapia perioperatoria (neoadyuvante y adyuvante) con quimioterapia
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha aprobado varios inhibidores de puntos de control inmunitario para poblaciones seleccionadas de pacientes con cáncer de pulmón de células no pequeñas (CPCNP) potencialmente resecable, ya sea en el entorno neoadyuvante (nivolumab) o adyuvante (atezolizumab, durvalumab o pembrolizumab). En ensayos de fase III en curso está en evaluación la función de los inhibidores de puntos de control inmunitario perioperatorios. Estos regímenes para pacientes con CPCNP potencialmente resecable en estadios II a III incluyen inhibidores de puntos de control inmunitario neoadyuvantes con quimioterapia seguida de cirugía e inhibidores de puntos de control inmunitario adyuvantes. En comparación con la quimioterapia neoadyuvante sola, los resultados iniciales de los estudios de regímenes perioperatorios con inhibidores de puntos de control inmunitario mostraron mejoras en varios desenlaces clave, como la SSC, la respuesta patológica mayor, la respuesta patológica completa o la SG.
Pembrolizumab perioperatorio y quimioterapia a base de derivados del platino
Evidencia (pembrolizumab neoadyuvante con quimioterapia y pembrolizumab adyuvante):
- En el ensayo con enmascaramiento doble de fase III KEYNOTE-671 (NCT03425643) participaron 797 pacientes con CPCNP en estadio II, IIIA o IIIB (≥1 ganglio mediastínico ipsilateral o ganglio subcarinal) no tratado. Los pacientes se asignaron al azar a recibir pembrolizumab neoadyuvante (200 mg cada 3 semanas) o placebo con quimioterapia a base de cisplatino durante 4 ciclos, seguida de cirugía y pembrolizumab adyuvante o placebo, durante un máximo de 13 ciclos, o hasta que se presentara progresión de la enfermedad o efectos tóxicos inaceptables. Los criterios principales de valoración duales fueron la SSC (definida como el tiempo transcurrido desde la aleatorización hasta la progresión local que imposibilitó la cirugía, la presencia de un tumor irresecable, la progresión o la recidiva, o la muerte) y la SG. En el momento del segundo análisis interino, la mediana de seguimiento fue de 36,6 meses (intervalo, 27,6–47,8).[21][Nivel de evidencia A1]
- La mediana de SSP fue de 47,2 meses (IC 95 %, 32,9–NA) en el grupo de pembrolizumab y de 18,3 meses (IC 95 %, 14,8–22,1) en el grupo de placebo (CRI, 0,59; IC 95 %, 0,48–0,72).
- La tasa de SG a 36 meses calculada fue del 71 % (IC 95 %, 66–76 %) en el grupo de pembrolizumab y del 64 % (IC 95 %, 58–69 %) en el grupo de placebo (CRI, 0,72; IC 95 %, 0,56–0,93; P unilateral = 0,0052; límite, P unilateral = 0,0054).
- Se notificaron los siguientes criterios secundarios de valoración:
- Se presentó una respuesta patológica mayor en el 30,2 % de los pacientes del grupo de pembrolizumab y en el 11 % de los pacientes del grupo de placebo (P < 0,0001).
- Se produjo una respuesta patológica completa en el 18,1 % de los pacientes del grupo de pembrolizumab y en el 4 % de los pacientes del grupo de placebo (P < 0,0001).
- Se observaron eventos adversos relacionados con el tratamiento en 179 de 396 pacientes (45 %) del grupo de pembrolizumab y en 151 de 399 pacientes (38 %) del grupo de placebo. Los eventos adversos relacionados con el tratamiento produjeron la muerte de 4 pacientes (1 %) en el grupo de pembrolizumab y de 3 pacientes (1 %) en el grupo de placebo.
Durvalumab perioperatorio y quimioterapia a base de derivados del platino
Evidencia (durvalumab y quimioterapia a base de derivados del platino):
- En el ensayo de fase III AEGEAN (NCT03800134) se investigó el uso de durvalumab perioperatorio con quimioterapia neoadyuvante, en comparación con la quimioterapia neoadyuvante sola en pacientes con CPCNP resecable (estadios II a IIIB [N2]). Los pacientes recibieron 4 ciclos de tratamiento cada 3 semanas antes de la cirugía, seguidos de durvalumab adyuvante o placebo por vía intravenosa cada 4 semanas durante 12 ciclos. En la población por intención de tratar modificada (740 pacientes) se incluyó a todos los pacientes asignados al azar, excluidos aquellos con alteraciones documentadas en los genes EGFR o ALK. El primer análisis interino planificado se produjo con un 31,9 % de madurez de los datos y al cabo de una mediana de seguimiento de 1 año. Los criterios principales de valoración fueron la SSC y la respuesta patológica completa.[22][Nivel de evidencia B1]
- A los 12 meses, la tasa de SSC fue del 73,4 % en los pacientes que recibieron durvalumab (IC 95 %, 67,9–78,1 %) y del 64,5 % en los pacientes que recibieron quimioterapia sola (IC 95 %, 58,8–69,6 %).
- La respuesta patológica completa fue significativamente más alta con durvalumab perioperatorio (17,2 %), en comparación con la quimioterapia sola (4,3 %, P < 0,001).
- Se observó beneficio en la SSC y respuesta patológica completa, con independencia del estadio y la expresión de PD-L1.
- El perfil de inocuidad fue compatible con los perfiles conocidos de durvalumab y quimioterapia.
Nivolumab perioperatorio y quimioterapia a base de derivados del platino
Evidencia (nivolumab neoadyuvante con quimioterapia y nivolumab adyuvante):
- En el ensayo con doble enmascaramiento de fase III Checkmate 77T (NCT04025879) se inscribieron 735 pacientes con CPCNP resecable en estadios IIA (>4 cm) a IIIB (estadio ganglionar N2, en una o múltiples estaciones). Los pacientes no tenían variantes en el gen EGFR ni translocaciones en ALK y se les asignó al azar para recibir nivolumab neoadyuvante con quimioterapia o quimioterapia neoadyuvante con placebo en 4 ciclos cada 3 semanas, seguida de cirugía y nivolumab adyuvante o placebo cada 4 semanas durante 1 año. El criterio principal de valoración fue la SSC, de acuerdo con una revisión independiente enmascarada. Los criterios secundarios de valoración fueron la respuesta patológica completa y la respuesta patológica mayor, según una revisión independiente enmascarada, así como la SG y la inocuidad.[23]
- Al cabo de una mediana de seguimiento de 25,4 meses (intervalo, 15,7–44,2), la tasa de SSC a 18 meses fue del 70,2 % en el grupo de nivolumab y del 50 % en el grupo de quimioterapia (CRIprogresión de la enfermedad o recidiva, cirugía abortada o muerte, 0,58; IC 97,36 %, 0,42–0,81; P < 0,001).[23][Nivel de evidencia B1]
- La tasa de respuesta patológica completa fue del 25,3 % en el grupo de nivolumab y del 4,7 % en el grupo de quimioterapia (OR, 6,64; IC 95 %, 3,40–12,97).
- La tasa de respuesta patológica mayor (≤10 % células tumorales viables residuales tras la cirugía en el tumor primario y en los ganglios linfáticos muestreados) fue del 35,4 % en el grupo de nivolumab y del 12,1 % en el grupo de quimioterapia (OR, 4,01; IC 95 %, 2,48–6,49).
- Se presentaron eventos adversos de grado 3 o 4 relacionados con el tratamiento en el 32,5 % de los pacientes en el grupo de nivolumab y del 25,2 % de los pacientes en el grupo de quimioterapia.
Toripalimab perioperatorio y quimioterapia a base de derivados del platino
Evidencia (toripalimab y quimioterapia a base de derivados del platino):
- En un ensayo aleatorizado de fase III (Neotorch [NCT04158440]) se evaluó la eficacia y la inocuidad del toripalimab, en combinación con quimioterapia neoadyuvante a base de derivados del platino, seguida de toripalimab de mantenimiento versus quimioterapia sola en pacientes con CPCNP resecable en estadio II, IIIA o IIIB (N2) sin alteraciones en EGFR o ALK. Los pacientes se estratificaron según el estadio de la enfermedad (II, IIIA o IIIB), estado de expresión tumoral de PD-L1 (≥1 %, <1 %, o no evaluable mediante el ensayo de tinción JS311IHC), abordaje quirúrgico planificado (neumonectomía o lobectomía) y subtipo histológico (escamoso vs. no escamoso). Se asignaron al azar 501 pacientes con CPCNP resecable en estadios II a III para recibir 1) toripalimab y quimioterapia a base de derivados del platino durante 3 ciclos antes de la cirugía y 1 ciclo después de la cirugía, seguido de toripalimab de mantenimiento en monoterapia durante hasta 13 ciclos o 2) quimioterapia a base de derivados del platino sola durante 3 ciclos antes de la cirugía y 1 ciclo después de la cirugía. Los criterios coprincipales de valoración fueron la SSC (definida como el tiempo transcurrido desde la aleatorización hasta la primera documentación de la progresión de la enfermedad que conduce a la imposibilidad de operar, la progresión posoperatoria, la recidiva local o a distancia, o la muerte por cualquier causa) y la respuesta patológica mayor (≤10 % o menos de células tumorales viables en el lecho tumoral). Los criterios secundarios de valoración fueron la SG, la respuesta patológica completa, la SSE después de la cirugía y la inocuidad.[24]
- En un análisis interino preespecificado de la SSC en pacientes con CPCNP en estadio III (n = 404) al cabo de una mediana de seguimiento de 18,3 meses (RIC, 12,7–22,5 meses), no se alcanzó la mediana de SSC (IC 95 %, 24,4 meses–NA) en el grupo de toripalimab y fue de 15,1 meses (IC 95 %, 10,6–21,9) en el grupo de placebo (CRI, 0,40; IC 95 %, 0,28–0,57; P <0,001).
- Las tasas de SSC a 1 y 2 años fueron del 84,4 % y del 64,7 %, respectivamente, en el grupo de toripalimab y del 57 % y el 38,7 %, respectivamente, en el grupo de placebo. En todos los subgrupos se observó un efecto constante sobre la SSC a favor del toripalimab.
- Después de la extirpación quirúrgica, se presentó una respuesta patológica mayor en 98 pacientes (48,5 %) del grupo de toripalimab y 17 pacientes (8,4 %) del grupo de placebo (diferencia entre grupos, 40,2 %; IC 95 %, 32,2–48,1 %; P < 0,001).
La FDA no ha aprobado el uso de este medicamento en pacientes con cáncer de pulmón.
Radioterapia
Los pacientes con tumores potencialmente resecables que tienen contraindicaciones médicas para someterse a cirugía o aquellos con enfermedad inoperable en estadio II y suficiente capacidad pulmonar de reserva quizás sean aptos para recibir radioterapia con intención curativa.[25] La radioterapia primaria a menudo se hace con una dosis de alrededor de 60 Gy dirigidos al plano medio del volumen tumoral identificado, usando un aparato de megavoltaje y fraccionamiento convencional. A menudo, se usa una dosis de refuerzo dirigida al campo focalizado por colimador del tumor primario para mejorar el control local. Para obtener resultados óptimos, se necesita una planificación cuidadosa del tratamiento con una definición precisa del volumen proyectado para evitar, dentro de lo posible, las estructuras normales vitales. Esta planificación exige el uso de un simulador.
En los pacientes con excelente estado funcional, se anticipa una tasa de supervivencia a 3 años del 20 % cuando se logra administrar un ciclo completo de radioterapia con intención curativa.
Evidencia (radioterapia):
- En la mayor serie retrospectiva de la que se tiene informe hasta hoy, 152 pacientes de CPCNP inoperable por contraindicaciones médicas se trataron con radioterapia definitiva. En el estudio se notificaron los siguientes resultados:[26]
- Una tasa de SG a 5 años del 10 %.
- Una tasa actuarial de SSE del 60 % en 44 pacientes con tumores T1.
- En este estudio retrospectivo también se indicó que la mejoría de la SSE se obtiene con dosis de radioterapia mayores de 60 Gy.[26]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Manser R, Wright G, Hart D, et al.: Surgery for early stage non-small cell lung cancer. Cochrane Database Syst Rev (1): CD004699, 2005. [PUBMED Abstract]
- Allen MS, Darling GE, Pechet TT, et al.: Morbidity and mortality of major pulmonary resections in patients with early-stage lung cancer: initial results of the randomized, prospective ACOSOG Z0030 trial. Ann Thorac Surg 81 (3): 1013-9; discussion 1019-20, 2006. [PUBMED Abstract]
- Darling GE, Allen MS, Decker PA, et al.: Randomized trial of mediastinal lymph node sampling versus complete lymphadenectomy during pulmonary resection in the patient with N0 or N1 (less than hilar) non-small cell carcinoma: results of the American College of Surgery Oncology Group Z0030 Trial. J Thorac Cardiovasc Surg 141 (3): 662-70, 2011. [PUBMED Abstract]
- Martini N, Bains MS, Burt ME, et al.: Incidence of local recurrence and second primary tumors in resected stage I lung cancer. J Thorac Cardiovasc Surg 109 (1): 120-9, 1995. [PUBMED Abstract]
- Winton T, Livingston R, Johnson D, et al.: Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer. N Engl J Med 352 (25): 2589-97, 2005. [PUBMED Abstract]
- Arriagada R, Bergman B, Dunant A, et al.: Cisplatin-based adjuvant chemotherapy in patients with completely resected non-small-cell lung cancer. N Engl J Med 350 (4): 351-60, 2004. [PUBMED Abstract]
- Pignon JP, Tribodet H, Scagliotti GV, et al.: Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol 26 (21): 3552-9, 2008. [PUBMED Abstract]
- Scagliotti GV, Fossati R, Torri V, et al.: Randomized study of adjuvant chemotherapy for completely resected stage I, II, or IIIA non-small-cell Lung cancer. J Natl Cancer Inst 95 (19): 1453-61, 2003. [PUBMED Abstract]
- Hotta K, Matsuo K, Ueoka H, et al.: Role of adjuvant chemotherapy in patients with resected non-small-cell lung cancer: reappraisal with a meta-analysis of randomized controlled trials. J Clin Oncol 22 (19): 3860-7, 2004. [PUBMED Abstract]
- Edell ES, Cortese DA: Photodynamic therapy in the management of early superficial squamous cell carcinoma as an alternative to surgical resection. Chest 102 (5): 1319-22, 1992. [PUBMED Abstract]
- Corti L, Toniolo L, Boso C, et al.: Long-term survival of patients treated with photodynamic therapy for carcinoma in situ and early non-small-cell lung carcinoma. Lasers Surg Med 39 (5): 394-402, 2007. [PUBMED Abstract]
- Douillard JY, Rosell R, De Lena M, et al.: Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): a randomised controlled trial. Lancet Oncol 7 (9): 719-27, 2006. [PUBMED Abstract]
- Pepe C, Hasan B, Winton TL, et al.: Adjuvant vinorelbine and cisplatin in elderly patients: National Cancer Institute of Canada and Intergroup Study JBR.10. J Clin Oncol 25 (12): 1553-61, 2007. [PUBMED Abstract]
- Tsuboi M, Herbst RS, John T, et al.: Overall Survival with Osimertinib in Resected EGFR-Mutated NSCLC. N Engl J Med 389 (2): 137-147, 2023. [PUBMED Abstract]
- O'Brien M, Paz-Ares L, Marreaud S, et al.: Pembrolizumab versus placebo as adjuvant therapy for completely resected stage IB-IIIA non-small-cell lung cancer (PEARLS/KEYNOTE-091): an interim analysis of a randomised, triple-blind, phase 3 trial. Lancet Oncol 23 (10): 1274-1286, 2022. [PUBMED Abstract]
- Felip E, Altorki N, Zhou C, et al.: Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet 398 (10308): 1344-1357, 2021. [PUBMED Abstract]
- PORT Meta-analysis Trialists Group: Postoperative radiotherapy for non-small cell lung cancer. Cochrane Database Syst Rev (2): CD002142, 2005. [PUBMED Abstract]
- Burdett SS, Stewart LA, Rydzewska L: Chemotherapy and surgery versus surgery alone in non-small cell lung cancer. Cochrane Database Syst Rev (3): CD006157, 2007. [PUBMED Abstract]
- Gilligan D, Nicolson M, Smith I, et al.: Preoperative chemotherapy in patients with resectable non-small cell lung cancer: results of the MRC LU22/NVALT 2/EORTC 08012 multicentre randomised trial and update of systematic review. Lancet 369 (9577): 1929-37, 2007. [PUBMED Abstract]
- Forde PM, Spicer J, Lu S, et al.: Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer. N Engl J Med 386 (21): 1973-1985, 2022. [PUBMED Abstract]
- Spicer JD, Garassino MC, Wakelee H, et al.: Neoadjuvant pembrolizumab plus chemotherapy followed by adjuvant pembrolizumab compared with neoadjuvant chemotherapy alone in patients with early-stage non-small-cell lung cancer (KEYNOTE-671): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 404 (10459): 1240-1252, 2024. [PUBMED Abstract]
- Heymach JV, Harpole D, Mitsudomi T, et al.: Perioperative Durvalumab for Resectable Non-Small-Cell Lung Cancer. N Engl J Med 389 (18): 1672-1684, 2023. [PUBMED Abstract]
- Cascone T, Awad MM, Spicer JD, et al.: Perioperative Nivolumab in Resectable Lung Cancer. N Engl J Med 390 (19): 1756-1769, 2024. [PUBMED Abstract]
- Lu S, Zhang W, Wu L, et al.: Perioperative Toripalimab Plus Chemotherapy for Patients With Resectable Non-Small Cell Lung Cancer: The Neotorch Randomized Clinical Trial. JAMA 331 (3): 201-211, 2024. [PUBMED Abstract]
- Komaki R, Cox JD, Hartz AJ, et al.: Characteristics of long-term survivors after treatment for inoperable carcinoma of the lung. Am J Clin Oncol 8 (5): 362-70, 1985. [PUBMED Abstract]
- Dosoretz DE, Katin MJ, Blitzer PH, et al.: Radiation therapy in the management of medically inoperable carcinoma of the lung: results and implications for future treatment strategies. Int J Radiat Oncol Biol Phys 24 (1): 3-9, 1992. [PUBMED Abstract]
Tratamiento del cáncer de pulmón de células no pequeñas en estadio IIIA
Los pacientes de cáncer de pulmón de células no pequeñas (CPCNP) en estadio IIIA constituyen un grupo heterogéneo. Los pacientes a veces tienen metástasis en los ganglios mediastínicos ipsilaterales, tumores T3 potencialmente resecables que invaden la pared torácica, o compromiso mediastínico y metástasis en los ganglios linfáticos peribronquiales o hiliares (N1). La presentación inicial de la enfermedad abarca desde tumores resecables con metástasis ganglionares microscópicas hasta tumores irresecables, voluminosos con compromiso de múltiples estaciones ganglionares.
Los pacientes con enfermedad en estadio clínico IIIA N2 tienen una tasa de supervivencia general (SG) a 5 años del 10 % al 15 %; sin embargo, los pacientes con un compromiso mediastínico voluminoso (por ejemplo, visible mediante radiografía de tórax) tienen una tasa de supervivencia a 5 años del 2 % al 5 %. De acuerdo con las circunstancias clínicas, las principales formas de tratamiento para los pacientes de CPCNP en estadio IIIA son la radioterapia, la quimioterapia, la cirugía y las combinaciones de estas modalidades.
Las opciones de tratamiento varían de acuerdo con la ubicación del tumor y la posibilidad de resección.
Opciones de tratamiento para el cáncer de pulmón de células no pequeñas en estadio IIIA resecado o resecable
Las opciones de tratamiento para la enfermedad resecada o resecable son las siguientes:
- Cirugía con terapia neoadyuvante o terapia adyuvante.
- Terapia neoadyuvante.
- Inmunoterapia perioperativa (neoadyuvante y adyuvante) con quimioterapia.
- Terapia adyuvante.
- Quimioterapia adyuvante.
- Terapia dirigida adyuvante (para pacientes con mutaciones en EGFR).
- Inmunoterapia adyuvante.
- Quimiorradioterapia adyuvante.
- Radioterapia adyuvante.
Durante la toracotomía se encuentran metástasis ganglionares mediastínicas N2 en algunos pacientes, incluso cuando se hace una estadificación preoperatoria cuidadosa.
La mayoría de los datos de evidencia indican que la quimioterapia posoperatoria con cisplatino proporciona una ventaja significativa para la supervivencia de los pacientes de CPCNP con enfermedad oculta N2 descubierta durante la cirugía. Aún no se ha determinado la secuencia óptima de la cirugía y la quimioterapia, ni los beneficios y riesgos de la radioterapia posoperatoria para los pacientes con CPCNP resecable.
Cirugía
Los pacientes a veces se benefician de una cirugía seguida de quimioterapia posoperatoria cuando se puede hacer una resección completa del tumor y los ganglios linfáticos. La evidencia indica que la resección del cáncer de pulmón con disección completa de ganglios linfáticos mediastínicos (DCGLM) a nivel ipsilateral no se relaciona con una mejora de la supervivencia, en comparación con la resección con muestreo sistemático de ganglios linfáticos mediastínicos en pacientes de CPCNP en estadio l, II o IIIA.[1][Nivel de evidencia A1]
En un ensayo de fase III, la adición de cirugía a la quimiorradioterapia para pacientes de CPCNP en estadio IIIA no proporcionó una mejora de la SG, pero mejoró la supervivencia sin progresión (SSP) y el control local.[2][Nivel de evidencia B1]
Evidencia (cirugía):
- En la Colaboración Cochrane se revisaron 11 ensayos aleatorizados con 1910 pacientes sometidos a intervenciones quirúrgicas para el cáncer de pulmón en estadio temprano (I–IIIA).[3] En el análisis conjunto se notificaron los siguientes resultados:
- La supervivencia a 4 años fue superior en pacientes de CPCNP resecable en estadios I, II o IIIA sometidos a resección con disección completa de ganglios linfáticos mediastínicos (DCGLM) a nivel ipsilateral, en comparación con los sometidos a resección con muestreo de ganglios linfáticos; el cociente de riesgos instantáneos (CRI) se calculó en 0,78 (intervalo de confianza [IC] 95 %, 0,65–0,93, P = 0,005).[3][Nivel de evidencia A1]
- En un gran estudio aleatorizado de fase III (ACOSOG-Z0030), se evaluó la DCGLM versus el muestreo de ganglios linfáticos. En los análisis preliminares de morbilidad y mortalidad operatoria se observaron tasas comparables para los procedimientos.[4]
- No hubo diferencias en la SG, la supervivencia sin enfermedad (SSE), la recidiva local ni la recidiva regional.[1][Nivel de evidencia A1]
Las conclusiones acerca de la eficacia de la cirugía para los pacientes de CPCNP local y locorregional son limitadas debido al número pequeño de participantes estudiados hasta la fecha y las posibles debilidades metodológicas de los ensayos.
Terapia neoadyuvante
Quimioterapia neoadyuvante
La función de la quimioterapia administrada antes de la cirugía en pacientes de CPCNP en estadio IIIA se ha estudiado de manera extensa en ensayos clínicos. Los beneficios propuestos para la quimioterapia preoperatoria (neoadyuvante) son los siguientes:
- Reducción del tamaño del tumor que a veces facilita la resección quirúrgica.
- Erradicación temprana de las micrometástasis.
- Tolerabilidad mejorada.
Evidencia (quimioterapia neoadyuvante):
- La Colaboración Cochrane notificó una revisión sistemática y un metanálisis de 7 ensayos controlados aleatorizados con 988 pacientes en los que se analizó la combinación de quimioterapia preoperatoria y cirugía versus cirugía sola.[5] En estos ensayos, se evaluó a pacientes de CPCNP en estadios I, II y IIIA.
- La quimioterapia preoperatoria proporcionó un beneficio absoluto del 6 % para la supervivencia en todos los estadios de la enfermedad, que osciló entre el 14 % y el 20 % a los 5 años (CRI, 0,82; IC 95 %, 0,69–0,97; P = 0,022).[5][Nivel de evidencia A1]
- En este análisis no se lograron abordar preguntas como el tipo específico de pacientes que se beneficiarían más o menos de la quimioterapia preoperatoria.[6]
- En el ensayo más numeroso notificado hasta la fecha, se asignó al azar a 519 pacientes para someterse a cirugía sola o a 3 ciclos de quimioterapia con derivados del platino seguida de cirugía.[7] La mayoría de los pacientes (61 %) tenía una enfermedad en estadio clínico I, el 31 % tenía una enfermedad en estadio II y el 7 % tenía una enfermedad en estadio III.
- Las complicaciones posoperatorias fueron similares entre los grupos y no se observó deterioro de la calidad de vida.
- No hubo indicios de beneficio en términos de la SG (CRI, 1,02; IC 95 %, 0,80–1,31; P = 0,86).
- Cuando se actualizó la revisión sistemática con la adición del presente resultado, se encontró un beneficio relativo de supervivencia del 12 % para el uso de quimioterapia preoperatoria (1507 pacientes; CRI, 0,88; IC 95 %, 0,76–1,01; P = 0,07), lo que equivale a una mejoría absoluta de la supervivencia a 5 años del 5 %.[7]
Quimiorradioterapia neoadyuvante
La administración simultánea de quimioterapia y radioterapia neoadyuvantes antes de la cirugía puede intensificar el tratamiento y aumentar la probabilidad del descenso del estadio de la carga tumoral. Los regímenes de uso común que se probaron en el entorno de fase II incluyen el cisplatino con etopósido (EP5050) y el carboplatino con paclitaxel semanal.[8,9] En un ensayo aleatorizado de quimiorradioterapia neoadyuvante y cirugía versus quimiorradioterapia simultánea sola, no hubo diferencia en la SG, pero la cirugía mejoró la SSP y el control local.[2][Nivel de evidencia B1]
Evidencia (quimiorradioterapia neoadyuvante):
- En el ensayo Intergroup-0139 (NCT00002550), se comparó la quimiorradioterapia sola y la quimiorradioterapia neoadyuvante seguida de cirugía en 396 pacientes de CPCNP en estadio IIIA (N2).[2]
- La cirugía no mejoró la SG (la tasa de SG a 5 años, 27 vs. 20 %; CRI, 0,87; 0,70–1,10; P = 0,24).
- La cirugía mejoró la SSP (la tasa de SSP a 5 años, 22 vs. 11 %; CRI, 0,77; 0,62–0,96; P = 0,017) y disminuyó el riesgo de recidiva local (10 vs. 22 %; P = 0,002).
- Hubo un aumento de la mortalidad relacionada con el tratamiento cuando se administró quimiorradioterapia neoadyuvante con cirugía (8 vs. 2 %); en especial, en el subgrupo de pacientes sometidos a neumonectomía.
No se ha realizado hasta la fecha una comparación directa de quimioterapia neoadyuvante versus quimiorradioterapia neoadyuvante con regímenes modernos de tratamiento; todavía no queda claro el abordaje neoadyuvante óptimo.
Inmunoterapia neoadyuvante con quimioterapia
Nivolumab y quimioterapia con derivados del platino
En el ensayo CheckMate 816, se evaluó el nivolumab (un anticuerpo anti-proteína de muerte celular programada 1) en combinación con quimioterapia a base de derivados del platino como terapia neoadyuvante en pacientes con CPCNP resecable (≥4 cm o compromiso ganglionar). El tratamiento con nivolumab produjo mejores tasas de supervivencia sin complicaciones (SSC) y de respuesta patológica completa en comparación con la quimioterapia sola.
Evidencia (nivolumab y quimioterapia con derivados del platino):
- En el ensayo sin enmascaramiento de fase III, CheckMate 816 (NCT02998528), se inscribieron 538 pacientes con CPCNP resecable en estadios IB a IIIA. Cabe destacar, que los pacientes con enfermedad en estadio IB tenían tumores que medían al menos 4 cm y se clasificaron según los criterios de estadificación de la séptima edición del AJCC que se usó en este estudio; estos tumores en la actualidad se clasifican como tumores en estadio IIA según los criterios de estadificación de la octava edición del AJCC. Los pacientes se asignaron al azar para recibir nivolumab (360 mg) en combinación con biquimioterapia con derivados del platino o biquimioterapia con derivados del platino sola cada 3 semanas por 3 ciclos antes de someterse a cirugía definitiva. Los criterios principales de valoración fueron la SSC (definida como el tiempo desde la aleatorización hasta cualquier indicio de progresión de la enfermedad con exclusión de la cirugía, progresión o recidiva de la enfermedad después de la cirugía, progresión de la enfermedad en ausencia de cirugía o muerte por cualquier causa) y la respuesta patológica completa (definida como el 0 % de células tumorales residuales viables en el tumor primario y las muestras ganglionares) evaluada mediante revisión central independiente con enmascaramiento.[10][Nivel de evidencia B1]
- Al cabo de un seguimiento mínimo de 21 meses, la mediana de SSC fue de 31,6 meses (IC 95 %, 30,2–no alcanzado) en el grupo de nivolumab con quimioterapia y de 20,8 meses (IC 95 %, 14,0–26,7) en el grupo de quimioterapia sola (CRI, 0,63; IC 97,38 %, 0,43–0,91; P = 0,005).
- El porcentaje estimado de pacientes que sobrevivieron sin progresión de la enfermedad ni recidiva al cabo de 1 año fue del 76,1 % en los pacientes que recibieron nivolumab con quimioterapia y del 63,4 % en los pacientes que recibieron quimioterapia sola. La magnitud del beneficio fue mayor en 1) los pacientes con enfermedad en estadio IIIA versus los pacientes con enfermedad en estadio IB o II (CRI, 0,54; IC 95 %, 0,37–0,80 vs. CRI, 0,87; IC 95 %, 0,48–1,56), 2) los pacientes con expresión de PD-L1 ≥1 % en el tumor versus <1 % (CRI, 0,41; IC 95 %, 0,24–0,70 vs. CRI, 0,85; IC 95 %, 0,54–1,32), y 3) los pacientes con características histológicas no escamosas versus escamosas.
- Se observó respuesta patológica completa en el 24 % (IC 95 %, 18,0– 31,0 %) de los pacientes que recibieron nivolumab con quimioterapia y en el 2,2 % (IC 95 %, 0,6–5,6 %) de los pacientes que recibieron quimioterapia sola (oportunidad relativa, 13,94; IC 99 %, 3,49–55,75; P < 0,001).
- No se alcanzo la mediana de la SG en ninguno de los grupos (CRIde muerte, 0,57; IC 99,67 %, 0,30–1,07; P = 0,008).
- Se presentaron efectos adversos de grado 3 o 4 relacionados con el tratamiento en el 33,5 % de pacientes en el grupo de nivolumab con quimioterapia y en el 36,9 % de pacientes en el grupo de quimioterapia sola. Los efectos adversos relacionados con el tratamiento condujeron a la interrupción del mismo en el 10,2 % de los pacientes en el grupo de nivolumab con quimioterapia y en el 9,7 % de los pacientes en el grupo de quimioterapia sola.
- El NADIM (NCT03081689) fue un ensayo sin enmascaramiento, multicéntrico y de un solo grupo para pacientes con CPCNP en estadio IIIA con enfermedad resecable mediante cirugía. Los pacientes recibieron paclitaxel neoadyuvante y carboplatino con nivolumab (360 mg) cada 21 días durante 3 ciclos, seguidos de nivolumab adyuvante en monoterapia durante 1 año (240 mg una vez cada 2 semanas durante 4 meses, seguido de 480 mg una vez cada 4 semanas durante 8 meses). La población por intención de tratar (ITT) incluyó a todos los pacientes que recibieron tratamiento neoadyuvante. La población por protocolo incluyó a todos los pacientes que se sometieron a resección tumoral y recibieron, al menos, un ciclo de terapia adyuvante. La mediana de seguimiento fue de 38 meses (IC 95 %, 36,7–40,7), con un 94 % de madurez a los 36 meses y un 90 % de madurez a los 42 meses.[11]
- La tasa de SG a los 36 meses fue del 81,9 % (IC 95 %, 66,8–90,6 %) en la población ITT y del 91 % (IC 95 %, 74,2–97,0 %) en la población por protocolo.[11][Nivel de evidencia A1]
- En la población ITT, la tasa de SSP fue del 69,6 % (IC 95 %, 54,1–80,7 %) a los 36 y 42 meses. En la población por protocolo, la tasa de SSP fue del 81,1 % (IC 95 %, 64,4–90,5 %) a los 36 y 42 meses.
- La respuesta patológica importante se definió como la presencia de un 10 % o menos de células tumorales en el tumor primario. El 82,9 % de los pacientes tuvieron una respuesta patológica importante, incluso un 63,4 % tuvieron una respuesta patológica completa. De los pacientes, un 17,1 % tuvieron una respuesta incompleta.
- La carga mutacional tumoral y el estado de PD-L1 no fueron predictivos de la supervivencia.
El DNA tumoral circulante (ctDNA) de muestras de plasma obtenidas antes y después del tratamiento neoadyuvante (pero antes de la cirugía) se analizó mediante el análisis de secuenciación de nueva generación TruSight Oncology 500 ctDNA, con base en captura por hibridación, en un secuenciador NovaSeq (Illumina).
- Las concentraciones bajas de ctADN antes del tratamiento se relacionaron de manera significativa con una mejor SSP (CRI, 0,20; IC 95 %, 0,06–0,63) y SG (CRI, 0,07; IC 95 %, 0,01–0,39).
- Las concentraciones indetectables de ctADN tras el tratamiento neoadyuvante se relacionaron de manera significativa con la SSP (CRI, 0,26; IC 95 %, 0,07–0,93) y SG (CRI, 0,04; IC 95 %, 0,00–0,55).
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el uso de nivolumab en combinación con biquimioterapia con derivados del platino para el tratamiento neoadyuvante de pacientes con CPCNP resecable (tumores ≥4 cm o con compromiso ganglionar).
Inmunoterapia perioperatoria (neoadyuvante y adyuvante) con quimioterapia
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha aprobado varios inhibidores de puntos de control inmunitario para poblaciones seleccionadas de pacientes con cáncer de pulmón de células no pequeñas (CPCNP) potencialmente resecable, ya sea en el entorno neoadyuvante (nivolumab) o adyuvante (atezolizumab, durvalumab o pembrolizumab). En ensayos de fase III en curso está en evaluación la función de los inhibidores de puntos de control inmunitario perioperatorios. Estos regímenes para pacientes con CPCNP potencialmente resecable en estadios II a III incluyen inhibidores de puntos de control inmunitario neoadyuvantes con quimioterapia seguida de cirugía e inhibidores de puntos de control inmunitario adyuvantes. En comparación con la quimioterapia neoadyuvante sola, los resultados iniciales de los estudios de regímenes perioperatorios con inhibidores de puntos de control inmunitario mostraron mejoras en varios desenlaces clave, como la SSC, la respuesta patológica mayor, la respuesta patológica completa o la SG.
Pembrolizumab perioperatorio y quimioterapia a base de derivados del platino
Evidencia (pembrolizumab neoadyuvante con quimioterapia y pembrolizumab adyuvante):
- En el ensayo con enmascaramiento doble de fase III KEYNOTE-671 (NCT03425643) participaron 797 pacientes con CPCNP en estadio II, IIIA o IIIB (≥1 ganglio mediastínico ipsilateral o ganglio subcarinal) no tratado. Los pacientes se asignaron al azar a recibir pembrolizumab neoadyuvante (200 mg cada 3 semanas) o placebo con quimioterapia a base de cisplatino durante 4 ciclos, seguida de cirugía y pembrolizumab adyuvante o placebo, durante un máximo de 13 ciclos, o hasta que se presentara progresión de la enfermedad o efectos tóxicos inaceptables. Los criterios principales de valoración duales fueron la SSC (definida como el tiempo transcurrido desde la aleatorización hasta la progresión local que imposibilitó la cirugía, la presencia de un tumor irresecable, la progresión o la recidiva, o la muerte) y la SG. En el momento del segundo análisis interino, la mediana de seguimiento fue de 36,6 meses (intervalo, 27,6–47,8).[12][Nivel de evidencia A1]
- La mediana de SSP fue de 47,2 meses (IC 95 %, 32,9–NA) en el grupo de pembrolizumab y de 18,3 meses (IC 95 %, 14,8–22,1) en el grupo de placebo (CRI, 0,59; IC 95 %, 0,48–0,72).
- La tasa de SG a 36 meses calculada fue del 71 % (IC 95 %, 66–76 %) en el grupo de pembrolizumab y del 64 % (IC 95 %, 58–69 %) en el grupo de placebo (CRI, 0,72; IC 95 %, 0,56–0,93; P unilateral = 0,0052; límite, P unilateral = 0,0054).
- Se notificaron los siguientes criterios secundarios de valoración:
- Se presentó una respuesta patológica mayor en el 30,2 % de los pacientes del grupo de pembrolizumab y en el 11 % de los pacientes del grupo de placebo (P < 0,0001).
- Se produjo una respuesta patológica completa en el 18,1 % de los pacientes del grupo de pembrolizumab y en el 4 % de los pacientes del grupo de placebo (P < 0,0001).
- Se observaron eventos adversos relacionados con el tratamiento en 179 de 396 pacientes (45 %) del grupo de pembrolizumab y en 151 de 399 pacientes (38 %) del grupo de placebo. Los eventos adversos relacionados con el tratamiento produjeron la muerte de 4 pacientes (1 %) en el grupo de pembrolizumab y de 3 pacientes (1 %) en el grupo de placebo.
Durvalumab perioperatorio y quimioterapia a base de derivados del platino
Evidencia (durvalumab y quimioterapia a base de derivados del platino):
- En el ensayo de fase III AEGEAN (NCT03800134) se investigó el uso de durvalumab perioperatorio con quimioterapia neoadyuvante, en comparación con la quimioterapia neoadyuvante sola en pacientes con CPCNP resecable (estadios II a IIIB [N2]). Los pacientes recibieron 4 ciclos de tratamiento cada 3 semanas antes de la cirugía, seguidos de durvalumab adyuvante o placebo por vía intravenosa cada 4 semanas durante 12 ciclos. En la población por intención de tratar modificada (740 pacientes) se incluyó a todos los pacientes asignados al azar, excluidos aquellos con alteraciones documentadas en los genes EGFR o ALK. El primer análisis interino planificado se produjo con un 31,9 % de madurez de los datos y al cabo de una mediana de seguimiento de 1 año. Los criterios principales de valoración fueron la SSC y la respuesta patológica completa.[13][Nivel de evidencia B1]
- A los 12 meses, la tasa de SSC fue del 73,4 % en los pacientes que recibieron durvalumab (IC 95 %, 67,9–78,1 %) y del 64,5 % en los pacientes que recibieron quimioterapia sola (IC 95 %, 58,8–69,6 %).
- La respuesta patológica completa fue significativamente más alta con durvalumab perioperatorio (17,2 %), en comparación con la quimioterapia sola (4,3 %, P < 0,001).
- Se observó beneficio en la SSC y respuesta patológica completa, con independencia del estadio y la expresión de PD-L1.
- El perfil de inocuidad fue compatible con los perfiles conocidos de durvalumab y quimioterapia.
Nivolumab perioperatorio y quimioterapia a base de derivados del platino
Evidencia (nivolumab neoadyuvante con quimioterapia y nivolumab adyuvante):
- En el ensayo con doble enmascaramiento de fase III Checkmate 77T (NCT04025879) se inscribieron 735 pacientes con CPCNP resecable en estadios IIA (>4 cm) a IIIB (estadio ganglionar N2, en una o múltiples estaciones). Los pacientes no tenían variantes en el gen EGFR ni translocaciones en ALK y se les asignó al azar para recibir nivolumab neoadyuvante con quimioterapia o quimioterapia neoadyuvante con placebo en 4 ciclos cada 3 semanas, seguida de cirugía y nivolumab adyuvante o placebo cada 4 semanas durante 1 año. El criterio principal de valoración fue la SSC, de acuerdo con una revisión independiente enmascarada. Los criterios secundarios de valoración fueron la respuesta patológica completa y la respuesta patológica mayor, según una revisión independiente enmascarada, así como la SG y la inocuidad.[14]
- Al cabo de una mediana de seguimiento de 25,4 meses (intervalo, 15,7–44,2), la tasa de SSC a 18 meses fue del 70,2 % en el grupo de nivolumab y del 50 % en el grupo de quimioterapia (CRIprogresión de la enfermedad o recidiva, cirugía abortada o muerte, 0,58; IC 97,36 %, 0,42–0,81; P < 0,001).[14][Nivel de evidencia B1]
- La tasa de respuesta patológica completa fue del 25,3 % en el grupo de nivolumab y del 4,7 % en el grupo de quimioterapia (OR, 6,64; IC 95 %, 3,40–12,97).
- La tasa de respuesta patológica mayor (≤10 % células tumorales viables residuales tras la cirugía en el tumor primario y en los ganglios linfáticos muestreados) fue del 35,4 % en el grupo de nivolumab y del 12,1 % en el grupo de quimioterapia (OR, 4,01; IC 95 %, 2,48–6,49).
- Se presentaron eventos adversos de grado 3 o 4 relacionados con el tratamiento en el 32,5 % de los pacientes en el grupo de nivolumab y del 25,2 % de los pacientes en el grupo de quimioterapia.
Toripalimab perioperatorio y quimioterapia a base de derivados del platino
Evidencia (toripalimab y quimioterapia a base de derivados del platino):
- En un ensayo aleatorizado de fase III (Neotorch [NCT04158440]) se evaluó la eficacia y la inocuidad del toripalimab, en combinación con quimioterapia neoadyuvante a base de derivados del platino, seguida de toripalimab de mantenimiento versus quimioterapia sola en pacientes con CPCNP resecable en estadio II, IIIA o IIIB (N2) sin alteraciones en EGFR o ALK. Los pacientes se estratificaron según el estadio de la enfermedad (II, IIIA o IIIB), estado de expresión tumoral de PD-L1 (≥1 %, <1 %, o no evaluable mediante el ensayo de tinción JS311IHC), abordaje quirúrgico planificado (neumonectomía o lobectomía) y subtipo histológico (escamoso vs. no escamoso). Se asignaron al azar 501 pacientes con CPCNP resecable en estadios II a III para recibir 1) toripalimab y quimioterapia a base de derivados del platino durante 3 ciclos antes de la cirugía y 1 ciclo después de la cirugía, seguido de toripalimab de mantenimiento en monoterapia durante hasta 13 ciclos o 2) quimioterapia a base de derivados del platino sola durante 3 ciclos antes de la cirugía y 1 ciclo después de la cirugía. Los criterios coprincipales de valoración fueron la SSC (definida como el tiempo transcurrido desde la aleatorización hasta la primera documentación de la progresión de la enfermedad que conduce a la imposibilidad de operar, la progresión posoperatoria, la recidiva local o a distancia, o la muerte por cualquier causa) y la respuesta patológica mayor (≤10 % o menos de células tumorales viables en el lecho tumoral). Los criterios secundarios de valoración fueron la SG, la respuesta patológica completa, la SSE después de la cirugía y la inocuidad.[15]
- En un análisis interino preespecificado de la SSC en pacientes con CPCNP en estadio III (n = 404) al cabo de una mediana de seguimiento de 18,3 meses (RIC, 12,7–22,5 meses), no se alcanzó la mediana de SSC (IC 95 %, 24,4 meses–NA) en el grupo de toripalimab y fue de 15,1 meses (IC 95 %, 10,6–21,9) en el grupo de placebo (CRI, 0,40; IC 95 %, 0,28–0,57; P <0,001).
- Las tasas de SSC a 1 y 2 años fueron del 84,4 % y del 64,7 %, respectivamente, en el grupo de toripalimab y del 57 % y el 38,7 %, respectivamente, en el grupo de placebo. En todos los subgrupos se observó un efecto constante sobre la SSC a favor del toripalimab.
- Después de la extirpación quirúrgica, se presentó una respuesta patológica mayor en 98 pacientes (48,5 %) del grupo de toripalimab y 17 pacientes (8,4 %) del grupo de placebo (diferencia entre grupos, 40,2 %; IC 95 %, 32,2–48,1 %; P < 0,001).
La FDA no ha aprobado el uso de este medicamento en pacientes con cáncer de pulmón.
Terapia adyuvante
Quimioterapia adyuvante
Es posible que los pacientes de CPCNP en estadio II sometidos a resección tumoral completa se beneficien de la quimioterapia posoperatoria con cisplatino.[16][Nivel de evidencia A1]
Evidencia (quimioterapia adyuvante):
La evidencia de los ensayos clínicos controlados aleatorizados indica que, si el CPCNP en estadio IIIA se encuentra de manera inesperada durante una cirugía, la quimioterapia que se administra después de una resección completa mejora la supervivencia.
En varios ensayos controlados aleatorizados y en metanálisis se evaluó el uso de la quimioterapia posoperatoria para pacientes de CPCNP en estadios I, II y IIIA.[16-22]
- En un metanálisis, se recopilaron y combinaron datos individualizados de los desenlaces de pacientes de los 5 ensayos más numerosos (4584 pacientes), llevados a cabo después de 1995, acerca de la quimioterapia con derivados del platino en pacientes de CPCNP sometidos a resección tumoral completa.[16]
- Al cabo de una mediana de seguimiento de 5,2 años, el CRI generalde muerte fue de 0,89 (IC 95 %, 0,82–0,96; P = 0,005), lo que equivale a un beneficio absoluto a 5 años del 5,4 % para la quimioterapia.
- El efecto de la quimioterapia no varió significativamente (prueba de interacción, P = 0,11) según los medicamentos relacionados, como vinorelbina (CRI, 0,80; IC 95 %, 0,70–0,91), etopósido o alcaloides de vinca (CRI, 0,92; IC 95 %, 0,80–1,07), u otros fármacos (CRI, 0,97; IC 95 %, 0,84–1,13).
- El beneficio varió según el estadio (CRI para el estadio IIIA, 0,83; IC 95 %, 0,72–0,94).
- El mayor beneficio observado con la biquimioterapia con cisplatino y vinorelbina, en comparación con otros regímenes, se debe interpretar con cautela ya que los pacientes tratados con vinorelbina recibieron una dosis de cisplatino significativamente más alta.
- En 2 ensayos (Combination Chemotherapy Compared With No Treatment Following Surgery in Treating Patients With Non-small Cell Lung Cancer [FRE-IALT] y el ensayo del Adjuvant Navelbine International Trialist Association [ANITA]), se notificaron beneficios significativos para la SG relacionados con el uso de la quimioterapia adyuvante para una enfermedad en estadio IIIA.[6,18]
- Para el subgrupo de pacientes en estadio IIIA del ensayo ANITA (n = 325), el CRI fue de 0,69 (IC 95 %, 0,53–0,90) y el resultado para los pacientes del ensayo FRE-IALT (n = 728) fue un CRI de 0,79 (IC 95 %, 0,66–0,95).
- El efecto de la quimioterapia fue más alto en los pacientes con mejor estado funcional.
- No hubo interacción entre el efecto de la quimioterapia y ninguno de los siguientes factores:
- Sexo.
- Edad.
- Características histológicas.
- Tipo de cirugía.
- Radioterapia planificada.
- Dosis total de cisplatino planificada.
- En una análisis retrospectivo de un ensayo en fase III de cisplatino y vinorelbina posoperatorios, se encontró beneficio para los pacientes mayores de 65 años.[23]
- La quimioterapia prolongó significativamente la SG de los pacientes mayores de 65 años (CRI, 0,61; IC 95 %, 0,38–0,98; P = 0,04).
- No hubo diferencias significativas por grupo de edad con respecto a los efectos tóxicos, las hospitalizaciones o las muertes relacionadas con el tratamiento, aunque los pacientes mayores de 65 años recibieron menos tratamiento.
Terapia dirigida adyuvante (para pacientes con mutaciones en EGFR)
En un ensayo clínico de fase III en el que se evaluó la terapia dirigida adyuvante con osimertinib para los pacientes de CPCNP con mutaciones en EGFR y CPCNP en estadios IB a IIIA sometidos a resección tumoral, se observó una mejora de la SG.
Evidencia (terapia dirigida adyuvante con osimertinib para pacientes con CPCNP y mutaciones en EGFR en estadio IIIA):
- En el ensayo con enmascaramiento doble y controlado con placebo de fase III ADAURA (NCT02511106), 682 pacientes con CPCNP en estadio IB a estadio IIIA sometidos a resección tumoral y con mutaciones sensibilizantes en EGFR (determinadas a nivel central, deleción en el exón 19 o mutación L858R en el exón 21), se asignaron al azar para recibir 80 mg de osimertinib por vía oral al día o un placebo por 3 años. Se permitió la administración de quimioterapia adyuvante posoperatoria estándar y no fue obligatoria; el médico y el paciente tomaron las decisiones relacionadas con la quimioterapia adyuvante antes de la inscripción al ensayo. Hubo 399 pacientes que recibieron osimertinib y 342 pacientes que recibieron placebo.[24][Nivel de evidencia A1]
- En la población general del estudio, la tasa de SG a 5 años fue del 88 % en el grupo de osimertinib y del 78 % en el grupo de placebo (CRI generalde muerte, 0,49; IC 95,03 %, 0,34–0,70; P < 0,001).
- Entre los pacientes con enfermedad en estadios II a IIIA, la tasa de SG a 5 años fue del 85 % en el grupo de osimertinib y del 73 % en el grupo de placebo (CRI generalde muerte, 0,49; IC 95,03 %, 0,33–0,73; P < 0,001).
- El perfil de efectos adversos es congruente con otros estudios en los que se usa osimertinib, a excepción de la neumonía relacionada con el COVID-19 que se notificó con posterioridad.
La FDA aprobó el uso de osimertinib como terapia adyuvante para pacientes con CPCNP en estadios IB a IIIA con deleciones en el exón 19 o mutaciones L858R en el exón 21 de EGFR.
Inmunoterapia adyuvante
Se estudió la inmunoterapia adyuvante en pacientes con CPCNP en estadio IIIA a IB resecable y se observó que mejoró la SSE de manera significativa.[25,26]
Evidencia (inmunoterapia adyuvante con pembrolizumab para pacientes con CPCNP en estadio IIIA):
- En el ensayo PEARLS/KEYNOTE-091 (NCT02504372) de fase III, multicéntrico, sin enmascaramiento se asignaron al azar 1177 pacientes con CPCNP en estadios IB (tumor >4 cm) a IIIA con resección completa para recibir pembrolizumab (200 mg cada 3 semanas) o placebo durante un máximo de 18 ciclos, o hasta que se presentara progresión de la enfermedad o los efectos tóxicos fueran inaceptables. Los pacientes comenzaron a recibir el tratamiento del estudio después de la resección o, si estaba indicado, después de la quimioterapia adyuvante (durante un máximo de 4 ciclos). Los criterios principales de valoración duales fueron la SSE en la población general del estudio y la SSE en los pacientes con un puntaje de proporción tumoral (TPS) de PD-L1 del 50 % o más, según se determinó mediante la prueba PD-L1 IHC 22C3 pharmDx. Estos criterios de valoración se notificaron en un análisis intermedio prespecificado al cabo de una mediana de seguimiento de 35,6 meses (intervalo intercuartílico, 27,1–45,5).[25][Nivel de evidencia B1]
- En la población general del estudio, la mediana de SSE fue de 53,6 meses (IC 95 %, 39,2–no alcanzada [NA]) en el grupo de pembrolizumab y de 42,0 meses (IC 95 %, 31,3–NA) en el grupo de placebo (CRI, 0,76; IC 95 %, 0,63–0,91; P = 0,0014).
- En la población con TPS PD-L1 ≥50 %, la mediana de SSE no se alcanzó con pembrolizumab (IC 95 %, 44,3–NA) ni con placebo (IC 95 %, 35,8–NA) (CRI, 0,82; IC 95 %, 0,57–1,18; P = 0,14).
- Los datos de SG eran preliminares en el momento del análisis interino prespecificado.
- No se identificaron nuevos indicios de toxicidad en este estudio.
La FDA aprobó el uso de pembrolizumab en monoterapia para el tratamiento adyuvante después de la resección y para la quimioterapia con derivados del platino en pacientes con CPCNP en estadios IB (T2a ≥4 cm), II o IIIA. Cabe destacar, que la ficha técnica de la FDA especifica que el pembrolizumab se puede usar como terapia adyuvante después de la quimioterapia con derivados del platino. Sin embargo, la quimioterapia no fue necesaria en la población general de pacientes que se evaluó en el estudio KEYNOTE-091.
Evidencia (inmunoterapia adyuvante con atezolizumab para CPCNP resecable en estadio IIIA):
- El IMpower010 (NCT02486718) fue un ensayo sin anonimato y multicéntrico de fase III que asignó de forma aleatoria a 1005 pacientes con estadio IB resecable de forma quirúrgica (tumor >4 cm) para estadificar los CPCNP en estadio IIIA. Los pacientes recibieron atezolizumab (1200 mg cada 21 días por vía intravenosa) o el mejor apoyo de cuidados por 16 ciclos o 1 año después de la quimioterapia adyuvante estándar con derivados del platino. Los pacientes se inscribieron después de la resección, si eran eligibles para quimioterapia a base de cisplatino, y fueron aleatorizados después de la finalización de la quimioterapia si seguían siendo eligibles y no presentaron progresión de la enfermedad. El criterio principal de valoración fue la SSE evaluada por el investigador.[26]
- El criterio principal de valoración se probó de forma jerárquica, primero en el subgrupo de la población de estadio IIIA cuyos tumores expresaron PD-L1 en al menos el 1 % de las células tumorales (se usó el anticuerpo SP263), después en todos los pacientes de la población en estadio II a IIIA y, por último, en la población por intención de tratar (estadio IB a IIIA). De los 882 pacientes que se asignaron de forma aleatoria y que tenían enfermedad en estadio II a IIIA, 476 tenían tumores que expresaban PD-L1 en al menos el 1 % de las células cancerosas para SP263.[26][Nivel de evidencia B1]
- Después de una mediana de seguimiento de 32,2 meses, el tratamiento con atezolizumab mejoró la SSE en comparación con el mejor cuidado de apoyo en los pacientes en la población en estadio II a IIIA cuyos tumores expresaron PD-L1 en al menos el 1 % de las células cancerosas (CRI, 0,66; IC 95 %, 0,50–0,88; P = 0,0039). A los 24 meses, la tasa de SSE era del 74,6 % para el grupo de atezolizumab y el 61,0 % para el mejor grupo de cuidados de apoyo.
- Atezolizumab también mejoró la SSE en todos los pacientes en la población en estadio II a IIIA (CRI, 0,79; IC 95 %, 0,64–0,96; P = 0,020). A los 24 meses, la tasa SSE era del 70,2 % para el grupo de atezolizumab y del 61,6 % para el mejor grupo de cuidados de apoyo.
- En la población por intención de tratar, que incluyó a pacientes con enfermedad de estadio IB a IIIA, el CRISSE era de 0,81 (IC 95 %, 0,67–0,99; P = 0,040). Sin embargo, no se cruzó el límite de la significación estadística para la SSE.
- Los datos de SG son prematuros.
- No se observaron nuevas señales de seguridad.
La FDA aprobó el atezolizumab para el tratamiento adyuvante de pacientes con CPCNP en estadio II a IIIA cuyos tumores expresaron PD-L1 en al menos el 1 % de células cancerosas.
Quimiorradioterapia adyuvante
El uso de la combinación de quimioterapia y radioterapia antes o después de la cirugía se debe considerar en proceso de investigación, y es necesario evaluar este uso en ensayos clínicos futuros.
Evidencia (quimiorradioterapia adyuvante):
- En cinco ensayos aleatorizados se evaluó el valor de la quimiorradioterapia adyuvante en comparación con la radioterapia después de la resección quirúrgica.[5,7,27-29][Nivel de evidencia A1]
- En un solo ensayo, se notificó mejora de la SSE; en ningún ensayo se notificó una mejora de la SG.
- En tres ensayos se comparó la quimioterapia combinada con derivados del platino seguida de cirugía versus la quimioterapia con derivados del platino seguida de radioterapia (60–69,6 Gy) sola para determinar si la cirugía o la radioterapia eran más eficaces.[29-31] Aunque los estudios fueron pequeños, se inscribieron 73 pacientes (Radiation Therapy Oncology Group [RTOG]) (RTOG 89-01), 107 pacientes (The University of Texas M.D. Anderson Cancer Center) y 333 pacientes (European Organisation for Research and Treatment of Cancer [EORTC-08941; NCT00002623]) con enfermedad en estadio IIIA (N2); en ninguno de los ensayos se notificaron diferencias en el control local o la supervivencia.[29-31][Nivel de evidencia A1]
- En la serie más grande (EORTC-08941), 579 pacientes con CPCNP en estadio IIIA (N2) comprobado mediante estudio citológico o histológico recibieron 3 ciclos de quimioterapia de inducción con derivados del platino.[31] Los 333 pacientes que respondieron se asignaron al azar para una resección quirúrgica o radioterapia. De los 154 pacientes del grupo cirugía (92 %), se logró una resección radical en el 50 %, descenso del estadio patológico en el 42 % y respuesta completa en el 5 %; después de la cirugía murieron un 4 % de los pacientes. Se administró radioterapia posoperatoria (RTPO) a 62 pacientes (40 %) en el grupo de cirugía. De los 154 pacientes del grupo de radioterapia (93 %), el cumplimiento terapéutico general con la radiación prescrita fue del 55 %; además, se presentaron efectos tóxicos esofágicos y pulmonares agudos y tardíos de grados 3 a 4 en el 4 % y el 7 % de los pacientes; 1 paciente murió de neumonía por radiación.
- La mediana de SG fue de 16,4 meses para los pacientes del grupo de resección vs. 17,5 meses para los pacientes del grupo de radioterapia; la tasa de SG a 5 años fue del 15,7 % para los pacientes del grupo de resección versus el 14 % para los pacientes del grupo de radioterapia (CRI 1,06; IC 95 %, 0,84–1,35).[31]
- Las tasas de SSP también fueron similares en ambos grupos. A partir de estos valores bajos de morbilidad y mortalidad, se concluyó que la radioterapia se debe considerar el tratamiento locorregional preferido para estos pacientes.[31]
- En la serie más grande (EORTC-08941), 579 pacientes con CPCNP en estadio IIIA (N2) comprobado mediante estudio citológico o histológico recibieron 3 ciclos de quimioterapia de inducción con derivados del platino.[31] Los 333 pacientes que respondieron se asignaron al azar para una resección quirúrgica o radioterapia. De los 154 pacientes del grupo cirugía (92 %), se logró una resección radical en el 50 %, descenso del estadio patológico en el 42 % y respuesta completa en el 5 %; después de la cirugía murieron un 4 % de los pacientes. Se administró radioterapia posoperatoria (RTPO) a 62 pacientes (40 %) en el grupo de cirugía. De los 154 pacientes del grupo de radioterapia (93 %), el cumplimiento terapéutico general con la radiación prescrita fue del 55 %; además, se presentaron efectos tóxicos esofágicos y pulmonares agudos y tardíos de grados 3 a 4 en el 4 % y el 7 % de los pacientes; 1 paciente murió de neumonía por radiación.
Radioterapia adyuvante
Se evaluó el valor de la RTPO.[27] Aunque en algunos estudios se indica que la RTPO quizás mejore el control local en los pacientes con compromiso ganglionar sometidos a resección tumoral, su capacidad para mejorar la supervivencia todavía es polémica. No se conoce la dosis óptima de RTPO torácica. En la mayoría de los estudios se cita el uso de dosis que oscilan entre 30 Gy a 60 Gy, administradas por lo general en fracciones de 2 Gy a 2,5 Gy.[27]
Según se describe en el estudio JBR.10 (NCT00002583) del National Cancer Institute of Canada (NCIC) Clinical Trials Group, se puede considerar la RTPO para determinados pacientes a fin de reducir el riesgo de recidiva local si se presenta alguna de las siguientes situaciones:[23]
- Compromiso de múltiples estaciones ganglionares.
- Diseminación extracapsular del tumor.
- Márgenes de resección estrechos o con compromiso microscópico.
Evidencia (radioterapia adyuvante):
En la evidencia obtenida de un metanálisis numeroso, de análisis de subconjuntos de ensayos aleatorizados y de un estudio poblacional numeroso, se indicó que la RTPO quizás reduzca la recidiva local. Los resultados de estos estudios sobre los efectos de la RTPO en la SG resultan contradictorios.
- En un metanálisis de 10 ensayos aleatorizados en los que se evaluó la RTPO versus la cirugía sola, se observó el siguiente resultado:
- No hubo ninguna diferencia de la SG en todo el grupo de RTPO ni en el subconjunto de pacientes N2.[18][Nivel de evidencia A1]
- En los resultados de un subanálisis no aleatorizado del ensayo ANITA en el que se comparó la SG a 5 años en pacientes N2 que recibieron o no RTPO, se encontró el siguiente resultado:[6]
- Se observaron tasas de supervivencia más altas en los pacientes que recibieron radioterapia en el grupo de observación (21 % con RTPO vs. 17 % sin RTPO) y en el grupo de quimioterapia (47 % con RTPO vs. 34 % sin RTPO); sin embargo, no se realizaron pruebas de comparación estadística.[6]
- En los resultados del Surveillance, Epidemiology, and End Results (SEER) Program [28] se indican los siguientes aspectos:
- En un gran estudio retrospectivo de SEER (n = 7465), se encontraron tasas de supervivencia superiores relacionadas con la radioterapia para la enfermedad N2 (CRI, 0,855; IC 95 %, 0,762–0,959).
Hay un beneficio del uso de la RTPO para la enfermedad en estadio IIIA (N2); la función de la RTPO para el CPCNP en estadio temprano se debe aclarar en ensayos de fase III en . Se necesitan más análisis para determinar si es posible modificar estos desenlaces mediante perfeccionamientos técnicos, mejores definiciones de los volúmenes diana y limitaciones del volumen cardíaco en los portales de radiación.[18]
Opciones de tratamiento para el cáncer de pulmón de células no pequeñas irresecable en estadio IIIA
Las opciones de tratamiento para el CPCNP irresecable en estadio IIIA son las siguientes:
Quimiorradioterapia
La adición de quimioterapia consecutiva y simultánea a la radioterapia, se evaluó en ensayos prospectivos aleatorizados y metanálisis. En general, el tratamiento simultáneo proporciona un beneficio más alto para la supervivencia, pero aumenta los efectos tóxicos.
La quimiorradioterapia simultánea con derivados del platino quizás mejore la supervivencia de los pacientes de CPCNP localmente avanzado. Sin embargo, los datos disponibles son insuficientes para definir con exactitud el alcance del beneficio potencial del tratamiento y el programa de quimioterapia óptimo.[32]
Evidencia (quimiorradioterapia):
- En un metanálisis de datos individualizados de pacientes de 11 ensayos clínicos aleatorizados se observaron los siguientes resultados:[33]
- Las combinaciones de quimioterapia con cisplatino y radioterapia producen una reducción del 10 % en el riesgo de muerte en comparación con la radioterapia sola.[33][Nivel de evidencia A1]
- En un metanálisis de 13 ensayos (2214 pacientes evaluables), se observaron los siguientes resultados:[34]
- La administración simultánea de quimioterapia y radioterapia radical redujo el riesgo de muerte a 2 años (riesgo relativo [RR] = 0,93; IC 95 %, 0,88–0,98, P = 0,01).
- En los 11 ensayos de quimioterapia con derivados del platino, el RR fue de 0,93 (IC 95 %, 0,87–0,99, P = 0,02).[34]
- En un metanálisis de los datos individualizados de 1764 pacientes en 9 ensayos, se observaron los siguientes resultados:[32]
- El CRIde muerte en los pacientes tratados con quimiorradioterapia comparado con la radioterapia sola fue de 0,89 (IC 95 %, 0,81–0,98; P = 0,02), que corresponde a un beneficio absoluto para la quimioterapia del 4 % a los 2 años.
- La combinación de un derivado del platino con etopósido fue más eficaz que el uso de un derivado del platino solo.
Quimiorradioterapia simultánea versus quimiorradioterapia consecutiva
En los resultados de dos ensayos aleatorizados (incluso el RTOG-9410 [NCT01134861]) y de un metanálisis se indica que la administración simultánea de la quimiorradioterapia proporciona un beneficio superior para la supervivencia, aunque con más efectos tóxicos, que la administración consecutiva de la quimiorradioterapia.[35-37][Nivel de evidencia A1]
Evidencia (quimiorradioterapia simultánea vs. consecutiva):
- En el primer ensayo, una combinación de mitomicina C, vindesina y cisplatino que se administró de manera simultánea con un ciclo dividido de radioterapia en dosis de 56 Gy, se comparó con quimioterapia seguida de radioterapia continua diaria en dosis de 56 Gy.[35]
- Las tasas de SG a 5 años favorecieron la terapia simultánea (27 vs. 9 %).
- La mielodepresión fue más alta en los pacientes del grupo de tratamiento simultáneo, pero la mortalidad relacionada con el tratamiento fue menor de 1 % en ambos grupos.[35]
- En el segundo ensayo, se asignó al azar a 610 pacientes para recibir tratamiento consecutivo de quimioterapia con cisplatino y vinblastina seguida de 63 Gy de radioterapia, tratamiento de quimiorradioterapia simultánea usando el mismo régimen, o tratamiento simultáneo de quimioterapia con cisplatino y etopósido combinada con radioterapia 2 veces por día.[37]
- La mediana de supervivencia y la supervivencia a 5 años fueron superiores en el grupo de quimioterapia simultánea con radioterapia diaria en comparación con el régimen consecutivo (17 vs. 14,6 meses y 16 vs. 10 % [P = 0,046]).[37]
- En dos estudios más pequeños también se notificaron resultados de SG que fueron favorables para la quimiorradioterapia simultánea en comparación con la administración consecutiva, aunque los resultados no fueron estadísticamente significativos.[36,38][Nivel de evidencia A1]
- En un metanálisis de 3 ensayos, se evaluó el tratamiento simultáneo versus el tratamiento consecutivo (711 pacientes).[34]
- En el análisis, se indicó un beneficio significativo del tratamiento simultáneo versus el tratamiento consecutivo (RR = 0,86; IC 95 %, 0,78–0,95; P = 0,003). En todos los estudios se usaron regímenes a base de cisplatino y radioterapia una vez por día.[34]
- Se registraron más muertes (tasa de SG del 3 %) en el grupo de tratamiento simultáneo, pero la diferencia no alcanzó significación estadística (RR = 1,60; IC, 0,75–3,44; P = 0,2).
- Hubo más esofagitis aguda (de grado 3 o más grave) con el tratamiento simultáneo (intervalo, 17–26 %) en comparación con el tratamiento consecutivo (intervalo, 0–4 %; RR= 6,77; P = 0,001). En general, la incidencia de neutropenia (de grado 3 o más grave) fue similar en ambos grupos.
Aumento escalonado de la dosis de radioterapia para la quimiorradioterapia simultánea
En los ensayos de fase I/II, se demostró la viabilidad de usar un aumento escalonado de la dosis de radioterapia hasta 74 Gy para la quimioterapia simultánea, a partir del perfeccionamiento de la tecnología de administración de radioterapia en la década de 1990, que incluyó el ajuste según el movimiento del tumor y el uso de imágenes para guiar el tratamiento.[39-41] Sin embargo, en un ensayo de fase III sobre el uso de una dosis convencional de 60 Gy versus el aumento escalonado de la dosis hasta 74 Gy con administración simultánea de carboplatino y paclitaxel cada semana, no se demostró una mejora del control local o la SSP; además, la SG fue más precaria con el aumento escalonado de la dosis (CRI, 1,38; IC 95 %, 1,09–1,76; P = 0,004). No hubo un aumento significativo de los efectos de grado 5 cuando se usó la dosis escalonada (10 vs. 2 %) y una incidencia más alta de esofagitis de grado 3 (21 vs. 7 %; P = 0,0003). Por lo tanto, no hay un beneficio claro del aumento escalonado de la dosis de radiación más allá de 60 Gy para el CPCNP en estadio III.[42][Nivel de evidencia A1]
Terapia de consolidación seguida de quimiorradioterapia simultánea
Evidencia (terapia de consolidación seguida de quimiorradioterapia simultánea):
- En el estudio aleatorizado de fase III PROCLAIM [NCT00686959], se inscribieron a 598 pacientes con un diagnóstico reciente de CPCNP no escamosas irresecable en estadio IIIA/B.[43] Los pacientes se asignaron al azar en una proporción de 1:1 a uno de los siguientes dos grupos:
- Grupo A: pemetrexed (500 mg/m2) y cisplatino (75 mg/m2) intravenosos cada 3 semanas durante 3 ciclos con radioterapia torácica simultánea (60 a 66 Gy), seguida de consolidación con pemetrexed cada 3 semanas durante 4 ciclos.
- Grupo B: terapia estándar con etopósido (50 mg/m2) y cisplatino (50 mg/m2) intravenosos cada 4 semanas durante 2 ciclos con radioterapia torácica simultánea (60 a 66 Gy), seguida de biquimioterapia de consolidación con derivados del platino durante 2 ciclos.
El objetivo principal fue la SG. El estudio se diseñó como ensayo de superioridad con una potencia estadística del 80 % para detectar un CRI de SG de 0,74 con un error de tipo 1 de 0,05. En este estudio se asignó al azar a 598 pacientes (grupo A, 301 y grupo B, 297) y se trató a 555 pacientes (grupo A, 283 y grupo B, 272).
- La inscripción se interrumpió antes de tiempo debido a resultados intranscendentes.
- La SG del grupo A no fue superior al grupo B (CRI, 0,98; IC 95 %, 0,79–1,20; mediana de SG de 26,8 vs. 25,0 meses; P = 0,831).
- En el grupo A se observó una incidencia mucho más baja de efectos adversos relacionados con los fármacos de grados 3 a 4 (64,0 vs. 76,8 %; P = 0,001), incluso de neutropenia (24,4 vs. 44,5 %; P < 0,001) durante el período general de tratamiento.
Inmunoterapia de consolidación
Durvalumab
El durvalumab es un anticuerpo monoclonal humano selectivo de tipo IgG1 que bloquea la unión de PD-L1 a la proteína de muerte programada (PD-1) y el CD80, lo que permite que las células T reconozcan y destruyan células tumorales.[44]
Evidencia (durvalumab seguido de quimiorradioterapia simultánea):
- En el ensayo de fase III PACIFIC (NCT02125461), se inscribieron 713 pacientes de CPCNP en estadio III cuya enfermedad no había progresado después de 2 o más ciclos de quimiorradioterapia con derivados del platino. Los pacientes se asignaron al azar en una proporción de 2:1 a recibir durvalumab (10 mg/kg intravenosos) o placebo (cada 2 semanas hasta por 12 meses).[44]
- Al cabo de una mediana de seguimiento de 34,2 meses en todos los pacientes y de 61,6 meses en los pacientes que fueron objeto de censura estadística, la mediana de SG fue de 47,5 meses en todos los pacientes y de 29,1 meses en los pacientes que fueron objeto de censura estadística (CRI estratificado, 0,72; IC 95 %, 0,59–0,89). La mediana de SSP fue de 16,9 meses en el grupo de durvalumab y de 5,6 meses en el grupo de placebo (CRI estratificado, 0,55; IC 95 %, 0,45–0,68).
- Las tasas de SG a 5 años estimadas fueron del 42,9 % (IC 95 %, 38,2–47,4 %) en el grupo de durvalumab y del 33,4 % (IC 95 %, 27,3–39,6 %) en el grupo de placebo.[45][Nivel de evidencia A1]
- Las tasas de SSP a 5 años estimadas fueron del 33,1 % (IC 95 %, 28,0–38,2 %) en el grupo de durvalumab y del 19 % (IC 95 %, 13,6–25,2 %) en el grupo de placebo.
- Se presentaron efectos adversos de grado 3 o 4 en el 29,9 % de los pacientes tratados con durvalumab y en el 26,1 % de los pacientes que recibieron placebo. El efecto adverso de grado 3 o 4 más frecuente fue la neumonía en el 4,4 % de los pacientes que recibieron durvalumab y en el 3,8 % de los pacientes que recibieron placebo.
Osimertinib (para pacientes con mutaciones en EGFR)
Evidencia (osimertinib seguido de quimiorradioterapia concurrente):
- En el ensayo con doble enmascaramiento, controlado por placebo, de fase III LAURA (NCT03521154) se incluyó a pacientes con CPCNP irresecable en estadio III con mutación en EGFR que no progresó durante o después de la quimiorradioterapia. Se asignó al azar a 216 pacientes que se habían sometido a quimiorradioterapia a recibir osimertinib (n = 143) o placebo (n = 73). El criterio de valoración principal fue la SSP evaluada mediante una revisión central independiente con enmascaramiento.[46]
- La mediana de SSP fue de 39,1 meses con osimertinib y de 5,6 meses con placebo (CRIprogresión de la enfermedad o muerte, 0,16; IC 95 %, 0,10–0,24; P < 0,001).
- A los 36 meses, la tasa de SG fue del 84 % para los pacientes del grupo de osimertinib (IC 95 %, 75–89 %) y del 74 % para los pacientes del grupo de placebo (IC 95 %, 57–85 %) (CRImuerte, 0,81; IC 95 %, 0,42–1,56; P = 0,53) (con un 20 % de madurez de datos).[46][Nivel de evidencia A1]
- Se produjeron efectos adversos de grado 3 o superior en el 35 % de los pacientes del grupo de osimertinib y en el 12 % de los pacientes del grupo de placebo. Se notificó neumonitis por radiación en el 48 % de los pacientes del grupo de osimertinib y en el 38 % de los pacientes del grupo de placebo.
Otras terapias sistémicas de consolidación
La adición de quimioterapia de inducción antes de la quimiorradioterapia simultánea no demostró mejoría de la supervivencia.[47][Nivel de evidencia A1]
En ensayos aleatorizados de otras terapias sistémicas de consolidación, como la administración de docetaxel,[48] gefitinib,[49] y tecemotida (inmunoterapia específica para el antígeno MUC1) [50] no se han observado mejoras de la SG.[Nivel de evidencia A1]
Radioterapia
Tumores irresecables localmente avanzados
La radioterapia sola a veces beneficia a los pacientes con CPCNP irresecable localmente avanzado en estadio IIIA.
La radioterapia administrada en programas de dosis tradicionales o fraccionadas (desde 1,8–2,0 Gy diarios por fracción hasta 60–70 Gy durante 6 a 7 semanas) produce una paliación significativa de los síntomas y mejora reproducible de la supervivencia a largo plazo en el 5 % al 10 % de los pacientes.[51]
Evidencia (radioterapia para el tratamiento de un tumor irresecable localmente avanzado):
- En un estudio clínico aleatorizado prospectivo, se observaron los siguientes resultados:[52]
- La administración continua de radioterapia (incluso durante los fines de semana) en 3 fracciones diarias (radioterapia hiperfraccionada acelerada continua) mejoró la SG en comparación con la radioterapia administrada en una fracción diaria.[52][Nivel de evidencia A1]
- Los modelos de fracaso terapéutico para los pacientes tratados con radioterapia sola incluyeron tanto fracasos locorregionales como fracasos a distancia.
Aunque los pacientes con enfermedad irresecable en estadio IIIA a veces se benefician de la radioterapia, los resultados a largo plazo en general son desalentadores debido a la recaída local y sistémica.
Tratamiento paliativo
La radioterapia a veces es eficaz como paliativo para los pacientes de CPCNP con compromiso local sintomático, entre ellos, los pacientes que tienen los siguientes síntomas:
- Compresión traqueal, esofágica o bronquial.
- Dolor.
- Parálisis de las cuerdas vocales.
- Hemoptisis.
- Síndrome de la vena cava superior.
En algunos casos, la terapia láser endobronquial o la braquiterapia se usan para el alivio de la obstrucción de las lesiones proximales.[53]
Evidencia (radioterapia para el tratamiento paliativo):
- En una revisión sistemática, se identificaron 6 ensayos aleatorizados de dosis altas de braquiterapia endobronquial sola, con radioterapia de haz externo (RHE) o terapia láser.[54]
- Se esperaba que el uso de la RHE sola produjera mejor paliación general de los síntomas y una necesidad más baja de nuevos tratamientos para los pacientes sin tratamiento previo.[54][Nivel de evidencia A3]
- Aunque es frecuente que se recete la RHE para la paliación de los síntomas, no hay acuerdo sobre el programa de fraccionamiento que se debe utilizar.
- Al parecer, diferentes regímenes multifraccionados de RHE ofrecen un alivio sintomático semejante;[55-60] no obstante, la radioterapia de fracción única quizás sea insuficiente para el alivio sintomático en comparación con los regímenes hipofraccionados o los regímenes estándar, como se describió en el ensayo NCIC del Clinical Trials Group (NCT00003685).[57][Nivel de evidencia A3]
- Se ha obtenido evidencia de un aumento modesto en la supervivencia para los pacientes con mejor estado funcional que reciben dosis altas de RHE.[55,56][Nivel de evidencia A1]
- Las dosis altas de braquiterapia endobronquial, cuando su administración fue técnicamente viable, proporcionaron paliación a los pacientes sintomáticos con obstrucción endobronquial recidivante tratados antes con RHE.
Opciones de tratamiento para los tumores del surco superior
Las opciones de tratamiento para los tumores del surco superior son las siguientes:
Los CPCNP del surco superior, que a menudo se denominan tumores de Pancoast, se presentan en menos del 5 % de los pacientes.[61,62] Los tumores del surco superior se suelen formar en el vértice del pulmón y son difíciles de tratar debido a su cercanía con las estructuras de la abertura torácica superior. En esta localización, los tumores pueden invadir la pleura parietal, la pared torácica, el plexo braquial, los vasos subclavios, el ganglio estrellado y los cuerpos vertebrales adyacentes. No obstante, los tumores de Pancoast son susceptibles al tratamiento curativo en especial, en pacientes con enfermedad T3, N0.
Los factores de pronóstico adverso incluyen la presencia de metástasis ganglionares mediastínicas (enfermedad N2), compromiso de la columna vertebral o de un vaso subclavio (enfermedad T4) y resección limitada (R1 o R2).
Cirugía
Evidencia (cirugía):
- En series de casos retrospectivas se notificó que la resección completa se logró solo en el 64 % de los tumores T3, N0 y en el 39 % de los tumores T4, N0.[63]
Quimiorradioterapia seguida de cirugía
Evidencia (quimiorradioterapia):
- En dos grandes ensayos prospectivos multicéntricos de fase II, se evaluó la quimiorradioterapia de inducción seguida de resección.[64,65]
- En el primer ensayo (NCT00002642), se inscribieron 110 pacientes aptos con tumores del surco superior en estadio clínico T3–4, N0-1, sin indicios de otro compromiso en la mediastinoscopia.[65] El tratamiento de inducción fue 2 ciclos de etopósido y cisplatino con 45 Gy de radioterapia simultánea.
- El régimen de inducción se toleró bien y solo 5 participantes tuvieron efectos tóxicos de grado 3 o más graves.
- La quimiorradioterapia de inducción a veces elimina la lesión primaria. El tratamiento de inducción se completó en 104 pacientes (95 %). De los 95 pacientes aptos para cirugía, 88 (80 %) se sometieron a toracotomía, 2 (1,8 %) murieron después de la cirugía y en 83 (76 %) se lograron resecciones completas.
- Se observó una respuesta patológica completa o una enfermedad microscópica mínima en 61 muestras de resección (56 %). La respuesta patológica completa se relacionó con una supervivencia más larga en comparación con la presencia de enfermedad residual (P = 0,02).
- La supervivencia a 5 años fue del 44 % para todos los pacientes y del 54 % para los pacientes sometidos a resección completa, sin diferencias en los tumores T3 o T4. La progresión de la enfermedad se presentó sobre todo en sitios distantes.
- En el segundo ensayo, se inscribió a 75 pacientes y se los trató con terapia de inducción con mitomicina C, vindesina y cisplatino combinada con 45 Gy de radioterapia.[64] Se hizo resección quirúrgica a 57 pacientes (76 %), y se logró la resección completa en 51 (68 %).
- Se observó una respuesta patológica completa en 12 pacientes.
- En 8 pacientes se observaron complicaciones posoperatorias graves, entre estas, quilotórax, empiema, neumonía, síndrome de dificultad respiratoria del adulto y hemorragia. Hubo 3 muertes relacionadas con el tratamiento.
- Al cabo de 3 años, la tasa de SSE fue del 49 % y la SG fue del 61 %; a los 5 años, la tasa de SSE fue del 45 % y la SG fue del 56 %.[64][Nivel de evidencia C2]
- En el primer ensayo (NCT00002642), se inscribieron 110 pacientes aptos con tumores del surco superior en estadio clínico T3–4, N0-1, sin indicios de otro compromiso en la mediastinoscopia.[65] El tratamiento de inducción fue 2 ciclos de etopósido y cisplatino con 45 Gy de radioterapia simultánea.
Aumento escalonado de la dosis de radioterapia para la quimiorradioterapia simultánea
En los ensayos de fase I/II, se demostró la viabilidad de usar un aumento escalonado de la dosis de radioterapia hasta 74 Gy para la quimioterapia simultánea, a partir del perfeccionamiento de la tecnología de administración de radioterapia en la década de 1990, que incluyó el ajuste según el movimiento del tumor y el uso de imágenes para guiar el tratamiento.[39-41] Sin embargo, en un ensayo de fase III sobre el uso de una dosis convencional de 60 Gy versus el aumento escalonado de la dosis hasta 74 Gy con administración simultánea de carboplatino y paclitaxel cada semana, no se demostró una mejora del control local o la SSP; además, la SG fue más precaria con el aumento escalonado de la dosis (CRI, 1,38 [1,09–1,76]; P = 0,004). Hubo un aumento no significativo de los efectos de grado 5 con el aumento escalonado de la dosis (10 vs. 2 %) y una incidencia más alta de esofagitis de grado 3 (21 vs. 7 %; P = 0,0003). Por lo tanto, no hay un beneficio claro del aumento escalonado de la dosis de radiación más allá de 60 Gy para el CPCNP en estadio III.[42][Nivel de evidencia A1]
Radioterapia sola
Si bien la radioterapia es una parte integral del tratamiento de los tumores de Pancoast, las variaciones de las dosis, las técnicas de tratamiento y la estadificación de diversas series publicadas hacen que sea difícil determinar su eficacia.[61,62]
En series retrospectivas pequeñas de radioterapia administrada a pacientes que solo se estadificaron clínicamente, se notificaron tasas de supervivencia a 5 años del 0 al 40 % según el estadio T, la dosis total de radiación y otros factores pronósticos. La radioterapia de inducción y la resección en bloque demostraron potencial de curación.
Evidencia (radioterapia):
Opciones de tratamiento para los tumores con invasión de la pared torácica
Las opciones de tratamiento para los tumores con invasión de la pared torácica son las siguientes:
- Cirugía.
- Cirugía y radioterapia.
- Radioterapia sola.
- Quimioterapia combinada con radioterapia o cirugía.
En determinados pacientes que tienen tumores primarios voluminosos con invasión directa de la pared torácica, el tratamiento quirúrgico permite obtener una supervivencia a largo plazo cuando se logra la resección tumoral completa.
Evidencia (cirugía radical):
- En una serie de casos pequeña con 97 pacientes, la tasa de supervivencia a 5 años para los pacientes con enfermedad T3, N0, M0 sometidos a resección tumoral completa fue del 44,2 %. Para los pacientes con enfermedad T3, N1, M0 sometidos a resección tumoral completa, la tasa de supervivencia a 5 años fue del 40,0 %. Para los pacientes con enfermedad T3, N2, M0 sometidos a resección tumoral completa, la tasa de supervivencia a 5 años fue del 6,2 %.[66][Nivel de evidencia C2]
- En una serie de casos pequeña con 104 pacientes, la tasa de supervivencia a 5 años para los pacientes con enfermedad T3, N0, M0 sometidos a resección tumoral completa fue del 67,3 %. Para los pacientes con enfermedad T3, N1, M0 sometidos a resección tumoral completa, la tasa de supervivencia a 5 años fue del 100,0 %. Para los pacientes con enfermedad T3, N2, M0 sometidos a resección tumoral completa, la tasa de supervivencia a 5 años fue del 17,9 %.[67][Nivel de evidencia C2]
- En una serie de casos de 309 pacientes tratados en 3 centros, los desenlaces fueron superiores para los pacientes que se sometieron a una resección en bloque en comparación con los pacientes que se sometieron a una resección extrapleural (60,3 vs. 39,1 %; P = 0,03).[68][Nivel de evidencia C2]
Se recomienda usar quimioterapia adyuvante y reservar la radioterapia para los casos con márgenes de resección mal definidos. Las tasas de supervivencia fueron más bajas en los pacientes sometidos a resección incompleta que tenían compromiso mediastínico ganglionar. Se han evaluado abordajes de modalidad combinada a fin de mejorar la capacidad para lograr una resección completa.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Darling GE, Allen MS, Decker PA, et al.: Randomized trial of mediastinal lymph node sampling versus complete lymphadenectomy during pulmonary resection in the patient with N0 or N1 (less than hilar) non-small cell carcinoma: results of the American College of Surgery Oncology Group Z0030 Trial. J Thorac Cardiovasc Surg 141 (3): 662-70, 2011. [PUBMED Abstract]
- Albain KS, Swann RS, Rusch VW, et al.: Radiotherapy plus chemotherapy with or without surgical resection for stage III non-small-cell lung cancer: a phase III randomised controlled trial. Lancet 374 (9687): 379-86, 2009. [PUBMED Abstract]
- Manser R, Wright G, Hart D, et al.: Surgery for early stage non-small cell lung cancer. Cochrane Database Syst Rev (1): CD004699, 2005. [PUBMED Abstract]
- Allen MS, Darling GE, Pechet TT, et al.: Morbidity and mortality of major pulmonary resections in patients with early-stage lung cancer: initial results of the randomized, prospective ACOSOG Z0030 trial. Ann Thorac Surg 81 (3): 1013-9; discussion 1019-20, 2006. [PUBMED Abstract]
- Burdett SS, Stewart LA, Rydzewska L: Chemotherapy and surgery versus surgery alone in non-small cell lung cancer. Cochrane Database Syst Rev (3): CD006157, 2007. [PUBMED Abstract]
- Douillard JY, Rosell R, De Lena M, et al.: Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): a randomised controlled trial. Lancet Oncol 7 (9): 719-27, 2006. [PUBMED Abstract]
- Gilligan D, Nicolson M, Smith I, et al.: Preoperative chemotherapy in patients with resectable non-small cell lung cancer: results of the MRC LU22/NVALT 2/EORTC 08012 multicentre randomised trial and update of systematic review. Lancet 369 (9577): 1929-37, 2007. [PUBMED Abstract]
- Albain KS, Rusch VW, Crowley JJ, et al.: Concurrent cisplatin/etoposide plus chest radiotherapy followed by surgery for stages IIIA (N2) and IIIB non-small-cell lung cancer: mature results of Southwest Oncology Group phase II study 8805. J Clin Oncol 13 (8): 1880-92, 1995. [PUBMED Abstract]
- Suntharalingam M, Paulus R, Edelman MJ, et al.: Radiation therapy oncology group protocol 02-29: a phase II trial of neoadjuvant therapy with concurrent chemotherapy and full-dose radiation therapy followed by surgical resection and consolidative therapy for locally advanced non-small cell carcinoma of the lung. Int J Radiat Oncol Biol Phys 84 (2): 456-63, 2012. [PUBMED Abstract]
- Forde PM, Spicer J, Lu S, et al.: Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer. N Engl J Med 386 (21): 1973-1985, 2022. [PUBMED Abstract]
- Provencio M, Serna-Blasco R, Nadal E, et al.: Overall Survival and Biomarker Analysis of Neoadjuvant Nivolumab Plus Chemotherapy in Operable Stage IIIA Non-Small-Cell Lung Cancer (NADIM phase II trial). J Clin Oncol 40 (25): 2924-2933, 2022. [PUBMED Abstract]
- Spicer JD, Garassino MC, Wakelee H, et al.: Neoadjuvant pembrolizumab plus chemotherapy followed by adjuvant pembrolizumab compared with neoadjuvant chemotherapy alone in patients with early-stage non-small-cell lung cancer (KEYNOTE-671): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 404 (10459): 1240-1252, 2024. [PUBMED Abstract]
- Heymach JV, Harpole D, Mitsudomi T, et al.: Perioperative Durvalumab for Resectable Non-Small-Cell Lung Cancer. N Engl J Med 389 (18): 1672-1684, 2023. [PUBMED Abstract]
- Cascone T, Awad MM, Spicer JD, et al.: Perioperative Nivolumab in Resectable Lung Cancer. N Engl J Med 390 (19): 1756-1769, 2024. [PUBMED Abstract]
- Lu S, Zhang W, Wu L, et al.: Perioperative Toripalimab Plus Chemotherapy for Patients With Resectable Non-Small Cell Lung Cancer: The Neotorch Randomized Clinical Trial. JAMA 331 (3): 201-211, 2024. [PUBMED Abstract]
- Pignon JP, Tribodet H, Scagliotti GV, et al.: Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol 26 (21): 3552-9, 2008. [PUBMED Abstract]
- Winton T, Livingston R, Johnson D, et al.: Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer. N Engl J Med 352 (25): 2589-97, 2005. [PUBMED Abstract]
- Arriagada R, Bergman B, Dunant A, et al.: Cisplatin-based adjuvant chemotherapy in patients with completely resected non-small-cell lung cancer. N Engl J Med 350 (4): 351-60, 2004. [PUBMED Abstract]
- Scagliotti GV, Fossati R, Torri V, et al.: Randomized study of adjuvant chemotherapy for completely resected stage I, II, or IIIA non-small-cell Lung cancer. J Natl Cancer Inst 95 (19): 1453-61, 2003. [PUBMED Abstract]
- Hotta K, Matsuo K, Ueoka H, et al.: Role of adjuvant chemotherapy in patients with resected non-small-cell lung cancer: reappraisal with a meta-analysis of randomized controlled trials. J Clin Oncol 22 (19): 3860-7, 2004. [PUBMED Abstract]
- Edell ES, Cortese DA: Photodynamic therapy in the management of early superficial squamous cell carcinoma as an alternative to surgical resection. Chest 102 (5): 1319-22, 1992. [PUBMED Abstract]
- Corti L, Toniolo L, Boso C, et al.: Long-term survival of patients treated with photodynamic therapy for carcinoma in situ and early non-small-cell lung carcinoma. Lasers Surg Med 39 (5): 394-402, 2007. [PUBMED Abstract]
- Pepe C, Hasan B, Winton TL, et al.: Adjuvant vinorelbine and cisplatin in elderly patients: National Cancer Institute of Canada and Intergroup Study JBR.10. J Clin Oncol 25 (12): 1553-61, 2007. [PUBMED Abstract]
- Tsuboi M, Herbst RS, John T, et al.: Overall Survival with Osimertinib in Resected EGFR-Mutated NSCLC. N Engl J Med 389 (2): 137-147, 2023. [PUBMED Abstract]
- O'Brien M, Paz-Ares L, Marreaud S, et al.: Pembrolizumab versus placebo as adjuvant therapy for completely resected stage IB-IIIA non-small-cell lung cancer (PEARLS/KEYNOTE-091): an interim analysis of a randomised, triple-blind, phase 3 trial. Lancet Oncol 23 (10): 1274-1286, 2022. [PUBMED Abstract]
- Felip E, Altorki N, Zhou C, et al.: Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet 398 (10308): 1344-1357, 2021. [PUBMED Abstract]
- PORT Meta-analysis Trialists Group: Postoperative radiotherapy for non-small cell lung cancer. Cochrane Database Syst Rev (2): CD002142, 2005. [PUBMED Abstract]
- Lally BE, Zelterman D, Colasanto JM, et al.: Postoperative radiotherapy for stage II or III non-small-cell lung cancer using the surveillance, epidemiology, and end results database. J Clin Oncol 24 (19): 2998-3006, 2006. [PUBMED Abstract]
- Johnstone DW, Byhardt RW, Ettinger D, et al.: Phase III study comparing chemotherapy and radiotherapy with preoperative chemotherapy and surgical resection in patients with non-small-cell lung cancer with spread to mediastinal lymph nodes (N2); final report of RTOG 89-01. Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys 54 (2): 365-9, 2002. [PUBMED Abstract]
- Taylor NA, Liao ZX, Cox JD, et al.: Equivalent outcome of patients with clinical Stage IIIA non-small-cell lung cancer treated with concurrent chemoradiation compared with induction chemotherapy followed by surgical resection. Int J Radiat Oncol Biol Phys 58 (1): 204-12, 2004. [PUBMED Abstract]
- van Meerbeeck JP, Kramer GW, Van Schil PE, et al.: Randomized controlled trial of resection versus radiotherapy after induction chemotherapy in stage IIIA-N2 non-small-cell lung cancer. J Natl Cancer Inst 99 (6): 442-50, 2007. [PUBMED Abstract]
- Aupérin A, Le Péchoux C, Pignon JP, et al.: Concomitant radio-chemotherapy based on platin compounds in patients with locally advanced non-small cell lung cancer (NSCLC): a meta-analysis of individual data from 1764 patients. Ann Oncol 17 (3): 473-83, 2006. [PUBMED Abstract]
- Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. Non-small Cell Lung Cancer Collaborative Group. BMJ 311 (7010): 899-909, 1995. [PUBMED Abstract]
- Rowell NP, O'rourke NP: Concurrent chemoradiotherapy in non-small cell lung cancer. Cochrane Database Syst Rev (4): CD002140, 2004. [PUBMED Abstract]
- Furuse K, Fukuoka M, Kawahara M, et al.: Phase III study of concurrent versus sequential thoracic radiotherapy in combination with mitomycin, vindesine, and cisplatin in unresectable stage III non-small-cell lung cancer. J Clin Oncol 17 (9): 2692-9, 1999. [PUBMED Abstract]
- Fournel P, Robinet G, Thomas P, et al.: Randomized phase III trial of sequential chemoradiotherapy compared with concurrent chemoradiotherapy in locally advanced non-small-cell lung cancer: Groupe Lyon-Saint-Etienne d'Oncologie Thoracique-Groupe Français de Pneumo-Cancérologie NPC 95-01 Study. J Clin Oncol 23 (25): 5910-7, 2005. [PUBMED Abstract]
- Curran WJ, Paulus R, Langer CJ, et al.: Sequential vs. concurrent chemoradiation for stage III non-small cell lung cancer: randomized phase III trial RTOG 9410. J Natl Cancer Inst 103 (19): 1452-60, 2011. [PUBMED Abstract]
- Zatloukal P, Petruzelka L, Zemanova M, et al.: Concurrent versus sequential chemoradiotherapy with cisplatin and vinorelbine in locally advanced non-small cell lung cancer: a randomized study. Lung Cancer 46 (1): 87-98, 2004. [PUBMED Abstract]
- Rosenman JG, Halle JS, Socinski MA, et al.: High-dose conformal radiotherapy for treatment of stage IIIA/IIIB non-small-cell lung cancer: technical issues and results of a phase I/II trial. Int J Radiat Oncol Biol Phys 54 (2): 348-56, 2002. [PUBMED Abstract]
- Socinski MA, Blackstock AW, Bogart JA, et al.: Randomized phase II trial of induction chemotherapy followed by concurrent chemotherapy and dose-escalated thoracic conformal radiotherapy (74 Gy) in stage III non-small-cell lung cancer: CALGB 30105. J Clin Oncol 26 (15): 2457-63, 2008. [PUBMED Abstract]
- Bradley JD, Bae K, Graham MV, et al.: Primary analysis of the phase II component of a phase I/II dose intensification study using three-dimensional conformal radiation therapy and concurrent chemotherapy for patients with inoperable non-small-cell lung cancer: RTOG 0117. J Clin Oncol 28 (14): 2475-80, 2010. [PUBMED Abstract]
- Bradley JD, Paulus R, Komaki R, et al.: Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): a randomised, two-by-two factorial phase 3 study. Lancet Oncol 16 (2): 187-99, 2015. [PUBMED Abstract]
- Senan S, Brade A, Wang LH, et al.: PROCLAIM: Randomized Phase III Trial of Pemetrexed-Cisplatin or Etoposide-Cisplatin Plus Thoracic Radiation Therapy Followed by Consolidation Chemotherapy in Locally Advanced Nonsquamous Non-Small-Cell Lung Cancer. J Clin Oncol 34 (9): 953-62, 2016. [PUBMED Abstract]
- Antonia SJ, Villegas A, Daniel D, et al.: Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med 377 (20): 1919-1929, 2017. [PUBMED Abstract]
- Spigel DR, Faivre-Finn C, Gray JE, et al.: Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. J Clin Oncol 40 (12): 1301-1311, 2022. [PUBMED Abstract]
- Lu S, Kato T, Dong X, et al.: Osimertinib after Chemoradiotherapy in Stage III EGFR-Mutated NSCLC. N Engl J Med 391 (7): 585-597, 2024. [PUBMED Abstract]
- Vokes EE, Herndon JE, Kelley MJ, et al.: Induction chemotherapy followed by chemoradiotherapy compared with chemoradiotherapy alone for regionally advanced unresectable stage III Non-small-cell lung cancer: Cancer and Leukemia Group B. J Clin Oncol 25 (13): 1698-704, 2007. [PUBMED Abstract]
- Hanna N, Neubauer M, Yiannoutsos C, et al.: Phase III study of cisplatin, etoposide, and concurrent chest radiation with or without consolidation docetaxel in patients with inoperable stage III non-small-cell lung cancer: the Hoosier Oncology Group and U.S. Oncology. J Clin Oncol 26 (35): 5755-60, 2008. [PUBMED Abstract]
- Kelly K, Chansky K, Gaspar LE, et al.: Phase III trial of maintenance gefitinib or placebo after concurrent chemoradiotherapy and docetaxel consolidation in inoperable stage III non-small-cell lung cancer: SWOG S0023. J Clin Oncol 26 (15): 2450-6, 2008. [PUBMED Abstract]
- Butts C, Socinski MA, Mitchell PL, et al.: Tecemotide (L-BLP25) versus placebo after chemoradiotherapy for stage III non-small-cell lung cancer (START): a randomised, double-blind, phase 3 trial. Lancet Oncol 15 (1): 59-68, 2014. [PUBMED Abstract]
- Komaki R, Cox JD, Hartz AJ, et al.: Characteristics of long-term survivors after treatment for inoperable carcinoma of the lung. Am J Clin Oncol 8 (5): 362-70, 1985. [PUBMED Abstract]
- Saunders M, Dische S, Barrett A, et al.: Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial. CHART Steering Committee. Lancet 350 (9072): 161-5, 1997. [PUBMED Abstract]
- Miller JI, Phillips TW: Neodymium:YAG laser and brachytherapy in the management of inoperable bronchogenic carcinoma. Ann Thorac Surg 50 (2): 190-5; discussion 195-6, 1990. [PUBMED Abstract]
- Ung YC, Yu E, Falkson C, et al.: The role of high-dose-rate brachytherapy in the palliation of symptoms in patients with non-small-cell lung cancer: a systematic review. Brachytherapy 5 (3): 189-202, 2006 Jul-Sep. [PUBMED Abstract]
- Sundstrøm S, Bremnes R, Aasebø U, et al.: Hypofractionated palliative radiotherapy (17 Gy per two fractions) in advanced non-small-cell lung carcinoma is comparable to standard fractionation for symptom control and survival: a national phase III trial. J Clin Oncol 22 (5): 801-10, 2004. [PUBMED Abstract]
- Lester JF, Macbeth FR, Toy E, et al.: Palliative radiotherapy regimens for non-small cell lung cancer. Cochrane Database Syst Rev (4): CD002143, 2006. [PUBMED Abstract]
- Bezjak A, Dixon P, Brundage M, et al.: Randomized phase III trial of single versus fractionated thoracic radiation in the palliation of patients with lung cancer (NCIC CTG SC.15). Int J Radiat Oncol Biol Phys 54 (3): 719-28, 2002. [PUBMED Abstract]
- Erridge SC, Gaze MN, Price A, et al.: Symptom control and quality of life in people with lung cancer: a randomised trial of two palliative radiotherapy fractionation schedules. Clin Oncol (R Coll Radiol) 17 (1): 61-7, 2005. [PUBMED Abstract]
- Kramer GW, Wanders SL, Noordijk EM, et al.: Results of the Dutch National study of the palliative effect of irradiation using two different treatment schemes for non-small-cell lung cancer. J Clin Oncol 23 (13): 2962-70, 2005. [PUBMED Abstract]
- Senkus-Konefka E, Dziadziuszko R, Bednaruk-Młyński E, et al.: A prospective, randomised study to compare two palliative radiotherapy schedules for non-small-cell lung cancer (NSCLC). Br J Cancer 92 (6): 1038-45, 2005. [PUBMED Abstract]
- Rusch VW: Management of Pancoast tumours. Lancet Oncol 7 (12): 997-1005, 2006. [PUBMED Abstract]
- Narayan S, Thomas CR: Multimodality therapy for Pancoast tumor. Nat Clin Pract Oncol 3 (9): 484-91, 2006. [PUBMED Abstract]
- Rusch VW, Parekh KR, Leon L, et al.: Factors determining outcome after surgical resection of T3 and T4 lung cancers of the superior sulcus. J Thorac Cardiovasc Surg 119 (6): 1147-53, 2000. [PUBMED Abstract]
- Kunitoh H, Kato H, Tsuboi M, et al.: Phase II trial of preoperative chemoradiotherapy followed by surgical resection in patients with superior sulcus non-small-cell lung cancers: report of Japan Clinical Oncology Group trial 9806. J Clin Oncol 26 (4): 644-9, 2008. [PUBMED Abstract]
- Rusch VW, Giroux DJ, Kraut MJ, et al.: Induction chemoradiation and surgical resection for superior sulcus non-small-cell lung carcinomas: long-term results of Southwest Oncology Group Trial 9416 (Intergroup Trial 0160). J Clin Oncol 25 (3): 313-8, 2007. [PUBMED Abstract]
- Matsuoka H, Nishio W, Okada M, et al.: Resection of chest wall invasion in patients with non-small cell lung cancer. Eur J Cardiothorac Surg 26 (6): 1200-4, 2004. [PUBMED Abstract]
- Facciolo F, Cardillo G, Lopergolo M, et al.: Chest wall invasion in non-small cell lung carcinoma: a rationale for en bloc resection. J Thorac Cardiovasc Surg 121 (4): 649-56, 2001. [PUBMED Abstract]
- Doddoli C, D'Journo B, Le Pimpec-Barthes F, et al.: Lung cancer invading the chest wall: a plea for en-bloc resection but the need for new treatment strategies. Ann Thorac Surg 80 (6): 2032-40, 2005. [PUBMED Abstract]
Tratamiento del cáncer de pulmón de células no pequeñas en estadios IIIB y IIIC
De acuerdo con el registro del Surveillance, Epidemiology, and End Results (SEER) Program, la incidencia estimada del cáncer de pulmón de células no pequeñas (CPCNP) en estadio IIIB es del 17,6 %.[1] La tasa de supervivencia a 5 años prevista para la mayoría de los pacientes con CPCNP en estadio clínico IIIB es del 3 % al 7 %.[2] En series de casos pequeñas, determinados pacientes con enfermedad T4, N0–1 (clasificados en este grupo porque presentaban uno o más nódulos tumorales satélites dentro del lóbulo primario) tuvieron tasas de supervivencia a 5 años del 20 %.[3,4][Nivel de evidencia C1]
Opciones de tratamiento para el cáncer de pulmón de células no pequeñas en estadios IIIB y IIIC
Las opciones de tratamiento para el CPCNP en estadio IIIB y el CPCNP en estadio IIIC son las siguientes:
- Quimioterapia y radioterapia consecutivas o simultáneas.
- Radioterapia sola.
- Nuevos programas de fraccionamiento.
- Radiosensibilizadores (NCT02186847).
- Abordajes de modalidad combinada.
- Incorporación de fármacos de terapia dirigida en el tratamiento de modalidad combinada para pacientes que tienen tumores con una mutación en EGFR o translocación de ALK (RTOG-1306 [NCT01822496]; 11-464 [NCT01553942])(en evaluación clínica).
- Radioterapia adaptativa con evaluación de la respuesta durante el tratamiento mediante tomografía por emisión de positrones (RTOG-1106/ACRIN-6697).
En general, los pacientes de CPCNP en estadios IIIB y IIIC no se benefician de la cirugía sola y el tratamiento más apropiado al inicio es quimioterapia, quimiorradioterapia o radioterapia sola, según los siguientes factores:
- Sitios de compromiso tumoral.
- Estado funcional del paciente.
La mayoría de los pacientes con un estado funcional bueno son aptos para recibir quimiorradioterapia combinada, excepto en los siguientes casos:
- Algunos pacientes con enfermedad T4, N0 pueden recibir terapia de modalidad combinada y cirugía de modo similar al tratamiento de pacientes con tumores del surco superior.
Los pacientes de CPCNP en estadio IIIB o IIIC son aptos para participar en ensayos clínicos que quizás produzcan mejoras en el control de la enfermedad.
Quimioterapia y radioterapia consecutivas o simultáneas
En muchos estudios aleatorizados con pacientes de CPCNP irresecable en estadio III, se observa que el tratamiento preoperatorio simultáneo de quimioterapia con derivados del platino y radioterapia dirigida al tórax se relaciona con una mejora en la supervivencia en comparación con la radioterapia sola. Aunque los pacientes con enfermedad no resecable en estadios IIIB o IIIC se pueden beneficiar de la radioterapia, los desenlaces a largo plazo por lo general son precarios, a menudo por recaída local o sistémica. La adición de quimioterapia (consecutiva o simultánea) a la radioterapia se evaluó en ensayos prospectivos aleatorizados.
Evidencia (quimioterapia y radioterapia consecutivas o simultáneas):
- En un metanálisis de datos individualizados de pacientes de 11 ensayos clínicos aleatorizados se observaron los siguientes resultados:[5]
- Las combinaciones de quimioterapia con cisplatino y radioterapia producen una reducción del 10 % en el riesgo de muerte en comparación con la radioterapia sola.[5][Nivel de evidencia A1]
- En un metanálisis de 13 ensayos (2214 pacientes evaluables), se observaron los siguientes resultados:[6]
- La adición de quimioterapia simultánea a la radioterapia radical redujo el riesgo de muerte a los 2 años (riesgo relativo [RR] = 0,93; intervalo de confianza [IC] 95 %, 0,88–0,98, P = 0,01).
- En los 11 ensayos de quimioterapia con derivados del platino, el RR fue de 0,93 (IC 95 %, 0,87–0,99, P = 0,02).[6]
- En un metanálisis de los datos individualizados de 1764 pacientes se evaluaron 9 ensayos.[7]
- El cociente de riesgos instantáneos (CRI)de muerte en los pacientes tratados con quimiorradioterapia comparado con radioterapia sola fue de 0,89 (IC 95 %, 0,81–0,98; P = 0,02), lo que corresponde a un beneficio absoluto para la quimioterapia del 4 % a los 2 años.
- La combinación de un derivado del platino con etopósido fue más eficaz que el uso de un derivado del platino solo. La quimioterapia con derivados del platino administrada de forma simultánea con radioterapia quizás mejore la supervivencia de los pacientes de CPCNP localmente avanzado. Sin embargo, los datos disponibles son insuficientes para definir con exactitud el alcance del beneficio potencial del tratamiento y el programa de quimioterapia óptimo.[7]
- En los resultados de dos ensayos aleatorizados (incluso el RTOG-9410 [NCT01134861]) y de un metanálisis se indica que la administración simultánea de quimiorradioterapia proporciona mayor beneficio para la supervivencia, aunque causa más efectos tóxicos, que la administración consecutiva de quimioterapia y radioterapia.[8-10][Nivel de evidencia A1]
- En el primer ensayo, una combinación de mitomicina C, vindesina y cisplatino que se administró de manera simultánea con un ciclo dividido de radioterapia en dosis de 56 Gy, se comparó con quimioterapia seguida de radioterapia continua diaria en dosis de 56 Gy.[8]
- Las tasas de supervivencia general (SG) a 5 años favorecieron el tratamiento simultáneo (27 vs. 9 %).
- La mielodepresión fue más alta en los pacientes del grupo de tratamiento simultáneo, pero la mortalidad relacionada con el tratamiento fue menor del 1 % en ambos grupos.[8]
- En el segundo ensayo, se asignó al azar a 610 pacientes para recibir tratamiento consecutivo de quimioterapia con cisplatino y vinblastina seguida de 63 Gy de radioterapia, tratamiento de quimiorradioterapia simultánea usando el mismo régimen, o tratamiento simultáneo de quimioterapia con cisplatino y etopósido combinada con radioterapia 2 veces por día.[9,10]
- La mediana de supervivencia y la supervivencia a 5 años fueron superiores en el grupo de quimioterapia simultánea con radioterapia diaria en comparación con el régimen consecutivo (17 vs. 14,6 meses y 16 vs. 10 % [P = 0,046]).
- En dos estudios más pequeños también se notificaron resultados de SG que fueron favorables para la quimiorradioterapia simultánea en comparación con la administración consecutiva, aunque los resultados no fueron estadísticamente significativos.[10][Nivel de evidencia A1]; [11]
- En el primer ensayo, una combinación de mitomicina C, vindesina y cisplatino que se administró de manera simultánea con un ciclo dividido de radioterapia en dosis de 56 Gy, se comparó con quimioterapia seguida de radioterapia continua diaria en dosis de 56 Gy.[8]
- En un metanálisis de 3 ensayos, se evaluó el tratamiento simultáneo versus el tratamiento consecutivo (711 pacientes).[6]
- En el análisis se indicó un beneficio significativo del tratamiento simultáneo versus el consecutivo (RR = 0,86; IC 95 %, 0,78–0,95; P = 0,003). En todos los estudios se usaron regímenes a base de cisplatino y radioterapia una vez por día.[6]
- Se registraron más muertes (tasa general del 3 %) en el grupo de tratamiento simultáneo, pero la diferencia no alcanzó significación estadística (RR = 1,60; IC 95 %, 0,75–3,44; P = 0,2).
- Hubo más esofagitis aguda (de grado 3 o más grave) con el tratamiento simultáneo (intervalo, 17–26 %) en comparación con el tratamiento consecutivo (intervalo, 0–4 %; RR= 6,77; P = 0,001). En general, la incidencia de neutropenia (de grado 3 o más grave) fue similar en ambos grupos.
Aumento escalonado de la dosis de radioterapia para la quimiorradioterapia simultánea
En los ensayos de fase I/II, se demostró la viabilidad de usar un aumento escalonado de la dosis de radioterapia hasta 74 Gy para la quimioterapia simultánea, a partir del perfeccionamiento de la tecnología de administración de radioterapia en la década de 1990, que incluyó el ajuste según el movimiento del tumor y el uso de imágenes para guiar el tratamiento.[12-14] Sin embargo, en un ensayo de fase III sobre el uso de una dosis convencional de 60 Gy versus el aumento escalonado de la dosis hasta 74 Gy con administración simultánea de carboplatino y paclitaxel cada semana, no se demostró una mejora del control local o la supervivencia sin progresión (SSP); además, la SG fue más precaria con el aumento escalonado de la dosis (CRI, 1,38 [1,09–1,76]; P = 0,004). Hubo un aumento no significativo de los efectos de grado 5 con el aumento escalonado de la dosis (10 vs. 2 %) y una incidencia más alta de esofagitis de grado 3 (21 vs. 7 %; P = 0,0003).[15][Nivel de evidencia A1]
Terapia sistémica de consolidación antes de la quimiorradioterapia simultánea o después de esta
Inmunoterapia de consolidación
Durvalumab
El durvalumab es un anticuerpo monoclonal humano selectivo de tipo IgG1 que bloquea la unión del ligando 1 de muerte programada (PD-L1) a la proteína de muerte programada (PD-1) y el CD80, lo que permite que las células T reconozcan y destruyan células tumorales.[16]
Evidencia (durvalumab):
- En el ensayo de fase III PACIFIC (NCT02125461), se inscribieron 713 pacientes de CPCNP en estadio III cuya enfermedad no había progresado después de 2 o más ciclos de quimiorradioterapia con derivados del platino. Los pacientes se asignaron al azar en una proporción de 2:1 a recibir durvalumab (10 mg/kg intravenosos) o placebo (cada 2 semanas hasta por 12 meses).[16] Los criterios de valoración coprimarios fueron la SSP evaluada mediante revisión central independiente y la SG (no planeada para el análisis interino).
- En el análisis interino, se alcanzó el criterio de valoración coprimario para la SSP. La mediana de SSP fue de 16,8 meses con durvalumab versus 5,6 meses con placebo (CRI, 0,52; IC 95 %, 0,42–0,65; P < 0,001).[16][Nivel de evidencia B1] La tasa de SSP a 18 meses fue del 44,2 % con durvalumab versus el 27 % con placebo.
- El beneficio de la SSP se observó en todos los subgrupos predeterminados y fue independiente de la expresión de PD-L1 antes de la quimiorradioterapia, o del consumo de tabaco. Se observaron mutaciones en EGFR en el 6 % de los pacientes (29 tratados con durvalumab vs. 14 tratados con placebo). El CRI no estratificado para el subgrupo con mutaciones en EGFR fue de 0,76 (IC 95 %, 0,35–1,64).
- Se presentaron efectos adversos de grado 3 o 4 en el 29,9 % de los pacientes tratados con durvalumab y en el 26,1 % de los pacientes que recibieron placebo. El efecto adverso de grado 3 o 4 más frecuente fue la neumonía en el 4,4 % de los pacientes tratados con durvalumab y en el 3,8 % de los pacientes que recibieron placebo.
- La SG no se evaluó en el análisis interino.
Osimertinib (para pacientes con mutaciones en EGFR)
Evidencia (osimertinib seguido de quimiorradioterapia concurrente):
- En el ensayo con doble enmascaramiento, controlado por placebo, de fase III LAURA (NCT03521154) se incluyó a pacientes con CPCNP irresecable en estadio III con mutación en EGFR que no progresó durante o después de la quimiorradioterapia. Se asignó al azar a 216 pacientes que se habían sometido a quimiorradioterapia a recibir osimertinib (n = 143) o placebo (n = 73). El criterio de valoración principal fue la SSP evaluada mediante una revisión central independiente con enmascaramiento.[17]
- La mediana de SSP fue de 39,1 meses con osimertinib y de 5,6 meses con placebo (CRIprogresión de la enfermedad o muerte, 0,16; IC 95 %, 0,10–0,24; P < 0,001).
- A los 36 meses, la tasa de SG fue del 84 % para los pacientes del grupo de osimertinib (IC 95 %, 75–89 %) y del 74 % para los pacientes del grupo de placebo (IC 95 %, 57–85 %) (CRImuerte, 0,81; IC 95 %, 0,42–1,56; P = 0,53) (con un 20 % de madurez de datos).[17][Nivel de evidencia A1]
- Se produjeron efectos adversos de grado 3 o superior en el 35 % de los pacientes del grupo de osimertinib y en el 12 % de los pacientes del grupo de placebo. Se notificó neumonitis por radiación en el 48 % de los pacientes del grupo de osimertinib y en el 38 % de los pacientes del grupo de placebo.
Otras terapias sistémicas de consolidación
La adición de quimioterapia de inducción antes de la quimiorradioterapia simultánea no demostró mejoría de la supervivencia.[18][Nivel de evidencia A1]
En ensayos aleatorizados de otras terapias sistémicas de consolidación, como la administración de docetaxel,[19] gefitinib,[20] y tecemotida (inmunoterapia específica para el antígeno MUC1) [21] no se observaron mejoras de la SG.[Nivel de evidencia A1]
La función de la terapia sistémica de consolidación después de la quimiorradioterapia simultánea para el CPCNP irresecable aún no está clara. En ensayos aleatorizados de fase III sobre terapias sistémicas de consolidación, como la quimioterapia convencional (docetaxel),[19] los inhibidores de tirosina–cinasas (gefitinib),[20] y la inmunoterapia (tecemotida: inmunoterapia específica para el antígeno MUC1) [21] no se observaron mejoras de la SG.[Nivel de evidencia A1]
Radioterapia sola
Radioterapia para el tratamiento de un tumor irresecable localmente avanzado en pacientes que no son aptos para recibir quimioterapia
La radioterapia sola a veces beneficia a los pacientes de CPCNP irresecable localmente avanzado en estadio III.
La radioterapia administrada en programas de dosis tradicionales o fraccionadas (desde 1,8–2,0 Gy diarios por fracción hasta 60–70 Gy durante 6 a 7 semanas) produce una paliación significativa de los síntomas y mejora reproducible de la supervivencia a largo plazo en el 5 % al 10 % de los pacientes.[22]
Evidencia (radioterapia para el tratamiento de un tumor irresecable localmente avanzado):
- En un estudio clínico aleatorizado prospectivo, se observaron los siguientes resultados:
- La radioterapia administrada en tres fracciones diarias mejoró la SG, en comparación con la radioterapia administrada en una fracción diaria.[23][Nivel de evidencia A1]
- Los modelos de fracaso terapéutico para los pacientes tratados con radioterapia sola incluyeron tanto fracasos locorregionales como fracasos a distancia.
Radioterapia para pacientes que necesitan tratamiento paliativo
La radioterapia a veces es eficaz como paliativo para los pacientes de CPCNP con compromiso local sintomático, entre ellos, los pacientes que tienen los siguientes síntomas:
- Compresión traqueal, esofágica o bronquial.
- Dolor.
- Parálisis de las cuerdas vocales.
- Hemoptisis.
- Síndrome de la vena cava superior.
En algunos casos, la terapia láser endobronquial o la braquiterapia se usan para el alivio de la obstrucción de las lesiones proximales.[24]
Evidencia (radioterapia para el tratamiento paliativo):
- En una revisión sistemática, se identificaron 6 ensayos aleatorizados de dosis altas de braquiterapia endobronquial sola, con radioterapia de haz externo (RHE) o terapia láser.[25]
- Se esperaba que el uso de la RHE sola produjera mejor paliación general de los síntomas y una necesidad más baja de nuevos tratamientos para los pacientes sin tratamiento previo.[25][Nivel de evidencia A3]
- Las dosis altas de braquiterapia endobronquial, cuando su administración fue técnicamente viable, proporcionaron paliación a los pacientes sintomáticos con obstrucción endobronquial recidivante tratados antes con RHE.
- Aunque es frecuente que se recete la RHE para la paliación de los síntomas, no hay acuerdo sobre el programa de fraccionamiento que se debe utilizar.
- Parece que diferentes regímenes multifraccionados de RHE proveen un alivio sintomático semejante;[26-31] no obstante, la radioterapia de fracción única quizás sea insuficiente para el alivio sintomático en comparación con los regímenes hipofraccionados o los regímenes estándar, como se describió en el ensayo National Cancer Institute of Canada Clinical Trials Group (NCT00003685).[28][Nivel de evidencia A3]
- Se ha obtenido evidencia de un aumento modesto en la supervivencia para los pacientes con mejor estado funcional que reciben dosis altas de radioterapia.[26,27][Nivel de evidencia A1]
Los pacientes con enfermedad en estadio IIIB o IIIC con un estado funcional precario son aptos para recibir radioterapia dirigida al tórax con el fin de aliviar los síntomas pulmonares (por ejemplo, tos, dificultad respiratoria, hemoptisis o dolor).[22][Nivel de evidencia C1] Para obtener más información, consultar Síndromes cardiopulmonares y El dolor y el cáncer.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Wisnivesky JP, Yankelevitz D, Henschke CI: Stage of lung cancer in relation to its size: part 2. Evidence. Chest 127 (4): 1136-9, 2005. [PUBMED Abstract]
- Mountain CF: Revisions in the International System for Staging Lung Cancer. Chest 111 (6): 1710-7, 1997. [PUBMED Abstract]
- Deslauriers J, Brisson J, Cartier R, et al.: Carcinoma of the lung. Evaluation of satellite nodules as a factor influencing prognosis after resection. J Thorac Cardiovasc Surg 97 (4): 504-12, 1989. [PUBMED Abstract]
- Urschel JD, Urschel DM, Anderson TM, et al.: Prognostic implications of pulmonary satellite nodules: are the 1997 staging revisions appropriate? Lung Cancer 21 (2): 83-7; discussion 89-91, 1998. [PUBMED Abstract]
- Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. Non-small Cell Lung Cancer Collaborative Group. BMJ 311 (7010): 899-909, 1995. [PUBMED Abstract]
- Rowell NP, O'rourke NP: Concurrent chemoradiotherapy in non-small cell lung cancer. Cochrane Database Syst Rev (4): CD002140, 2004. [PUBMED Abstract]
- Aupérin A, Le Péchoux C, Pignon JP, et al.: Concomitant radio-chemotherapy based on platin compounds in patients with locally advanced non-small cell lung cancer (NSCLC): a meta-analysis of individual data from 1764 patients. Ann Oncol 17 (3): 473-83, 2006. [PUBMED Abstract]
- Furuse K, Fukuoka M, Kawahara M, et al.: Phase III study of concurrent versus sequential thoracic radiotherapy in combination with mitomycin, vindesine, and cisplatin in unresectable stage III non-small-cell lung cancer. J Clin Oncol 17 (9): 2692-9, 1999. [PUBMED Abstract]
- Curran WJ, Paulus R, Langer CJ, et al.: Sequential vs. concurrent chemoradiation for stage III non-small cell lung cancer: randomized phase III trial RTOG 9410. J Natl Cancer Inst 103 (19): 1452-60, 2011. [PUBMED Abstract]
- Fournel P, Robinet G, Thomas P, et al.: Randomized phase III trial of sequential chemoradiotherapy compared with concurrent chemoradiotherapy in locally advanced non-small-cell lung cancer: Groupe Lyon-Saint-Etienne d'Oncologie Thoracique-Groupe Français de Pneumo-Cancérologie NPC 95-01 Study. J Clin Oncol 23 (25): 5910-7, 2005. [PUBMED Abstract]
- Zatloukal P, Petruzelka L, Zemanova M, et al.: Concurrent versus sequential chemoradiotherapy with cisplatin and vinorelbine in locally advanced non-small cell lung cancer: a randomized study. Lung Cancer 46 (1): 87-98, 2004. [PUBMED Abstract]
- Rosenman JG, Halle JS, Socinski MA, et al.: High-dose conformal radiotherapy for treatment of stage IIIA/IIIB non-small-cell lung cancer: technical issues and results of a phase I/II trial. Int J Radiat Oncol Biol Phys 54 (2): 348-56, 2002. [PUBMED Abstract]
- Socinski MA, Blackstock AW, Bogart JA, et al.: Randomized phase II trial of induction chemotherapy followed by concurrent chemotherapy and dose-escalated thoracic conformal radiotherapy (74 Gy) in stage III non-small-cell lung cancer: CALGB 30105. J Clin Oncol 26 (15): 2457-63, 2008. [PUBMED Abstract]
- Bradley JD, Bae K, Graham MV, et al.: Primary analysis of the phase II component of a phase I/II dose intensification study using three-dimensional conformal radiation therapy and concurrent chemotherapy for patients with inoperable non-small-cell lung cancer: RTOG 0117. J Clin Oncol 28 (14): 2475-80, 2010. [PUBMED Abstract]
- Bradley JD, Paulus R, Komaki R, et al.: Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): a randomised, two-by-two factorial phase 3 study. Lancet Oncol 16 (2): 187-99, 2015. [PUBMED Abstract]
- Antonia SJ, Villegas A, Daniel D, et al.: Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med 377 (20): 1919-1929, 2017. [PUBMED Abstract]
- Lu S, Kato T, Dong X, et al.: Osimertinib after Chemoradiotherapy in Stage III EGFR-Mutated NSCLC. N Engl J Med 391 (7): 585-597, 2024. [PUBMED Abstract]
- Vokes EE, Herndon JE, Kelley MJ, et al.: Induction chemotherapy followed by chemoradiotherapy compared with chemoradiotherapy alone for regionally advanced unresectable stage III Non-small-cell lung cancer: Cancer and Leukemia Group B. J Clin Oncol 25 (13): 1698-704, 2007. [PUBMED Abstract]
- Hanna N, Neubauer M, Yiannoutsos C, et al.: Phase III study of cisplatin, etoposide, and concurrent chest radiation with or without consolidation docetaxel in patients with inoperable stage III non-small-cell lung cancer: the Hoosier Oncology Group and U.S. Oncology. J Clin Oncol 26 (35): 5755-60, 2008. [PUBMED Abstract]
- Kelly K, Chansky K, Gaspar LE, et al.: Phase III trial of maintenance gefitinib or placebo after concurrent chemoradiotherapy and docetaxel consolidation in inoperable stage III non-small-cell lung cancer: SWOG S0023. J Clin Oncol 26 (15): 2450-6, 2008. [PUBMED Abstract]
- Butts C, Socinski MA, Mitchell PL, et al.: Tecemotide (L-BLP25) versus placebo after chemoradiotherapy for stage III non-small-cell lung cancer (START): a randomised, double-blind, phase 3 trial. Lancet Oncol 15 (1): 59-68, 2014. [PUBMED Abstract]
- Langendijk JA, ten Velde GP, Aaronson NK, et al.: Quality of life after palliative radiotherapy in non-small cell lung cancer: a prospective study. Int J Radiat Oncol Biol Phys 47 (1): 149-55, 2000. [PUBMED Abstract]
- Komaki R, Cox JD, Hartz AJ, et al.: Characteristics of long-term survivors after treatment for inoperable carcinoma of the lung. Am J Clin Oncol 8 (5): 362-70, 1985. [PUBMED Abstract]
- Miller JI, Phillips TW: Neodymium:YAG laser and brachytherapy in the management of inoperable bronchogenic carcinoma. Ann Thorac Surg 50 (2): 190-5; discussion 195-6, 1990. [PUBMED Abstract]
- Ung YC, Yu E, Falkson C, et al.: The role of high-dose-rate brachytherapy in the palliation of symptoms in patients with non-small-cell lung cancer: a systematic review. Brachytherapy 5 (3): 189-202, 2006 Jul-Sep. [PUBMED Abstract]
- Sundstrøm S, Bremnes R, Aasebø U, et al.: Hypofractionated palliative radiotherapy (17 Gy per two fractions) in advanced non-small-cell lung carcinoma is comparable to standard fractionation for symptom control and survival: a national phase III trial. J Clin Oncol 22 (5): 801-10, 2004. [PUBMED Abstract]
- Lester JF, Macbeth FR, Toy E, et al.: Palliative radiotherapy regimens for non-small cell lung cancer. Cochrane Database Syst Rev (4): CD002143, 2006. [PUBMED Abstract]
- Bezjak A, Dixon P, Brundage M, et al.: Randomized phase III trial of single versus fractionated thoracic radiation in the palliation of patients with lung cancer (NCIC CTG SC.15). Int J Radiat Oncol Biol Phys 54 (3): 719-28, 2002. [PUBMED Abstract]
- Erridge SC, Gaze MN, Price A, et al.: Symptom control and quality of life in people with lung cancer: a randomised trial of two palliative radiotherapy fractionation schedules. Clin Oncol (R Coll Radiol) 17 (1): 61-7, 2005. [PUBMED Abstract]
- Kramer GW, Wanders SL, Noordijk EM, et al.: Results of the Dutch National study of the palliative effect of irradiation using two different treatment schemes for non-small-cell lung cancer. J Clin Oncol 23 (13): 2962-70, 2005. [PUBMED Abstract]
- Senkus-Konefka E, Dziadziuszko R, Bednaruk-Młyński E, et al.: A prospective, randomised study to compare two palliative radiotherapy schedules for non-small-cell lung cancer (NSCLC). Br J Cancer 92 (6): 1038-45, 2005. [PUBMED Abstract]
Tratamiento del cáncer de pulmón de células no pequeñas en estadio IV de diagnóstico reciente, en recaída y recidivante
Factores que afectan la selección del tratamiento
De todos los pacientes con diagnóstico reciente de un cáncer de pulmón de células no pequeñas (CPCNP), el 40 % presentan la enfermedad en estadio IV. Los objetivos del tratamiento son la prolongación de la supervivencia y el control de los síntomas relacionados con la enfermedad. Las opciones de tratamiento incluyen quimioterapia citotóxica, fármacos de terapia dirigida e inmunoterapia. Los factores que influyen en la selección del tratamiento son la comorbilidad, el estado funcional, las características histológicas, y las características moleculares e inmunológicas del cáncer. Por lo tanto, es muy importante evaluar los cambios genómicos del tumor y la expresión del ligando 1 de la proteína de muerte programada (PD-L1) antes de empezar el tratamiento. En determinados casos se administran radioterapia y cirugía para paliar los síntomas.
Los factores que afectan la selección del tratamiento son los siguientes:
Antecedentes y características moleculares
Los pacientes con un tumor de tipo histológico de células no escamosas, buen estado funcional, sin antecedentes de hemoptisis, hemorragia o episodios cardiovasculares recientes quizás se beneficien de la adición de bevacizumab al paclitaxel y carboplatino. Los pacientes con tumores que albergan mutaciones sensibilizantes en los exones 19 o 21 de EGFR, en particular aquellos originarios del este de Asia, que nunca fumaron y que tienen un adenocarcinoma quizás se beneficien de los inhibidores de la tirosina–cinasa (ITC) del receptor del factor de crecimiento epidérmico (EGFR) como alternativa a la quimioterapia de primera o segunda línea. Los pacientes con tumores que albergan translocaciones de ALK, reordenamientos de ROS1 o fusiones de la tirosina–cinasa neurotrófica (NTRK) quizás se beneficien de los inhibidores de la cinasa del linfoma anaplásico (ALK), ROS1 o NTRK como alternativa a la quimioterapia de primera o segunda línea.
Los pacientes con tumores que expresan PD-L1 (>50 % por inmunohistoquímica) tienen mejor supervivencia con pembrolizumab. En el cáncer de pulmón de células no escamosas avanzado la adición de pembrolizumab a la quimioterapia de carboplatino y pemetrexed mejora la supervivencia sin importar el grado de expresión de PD-L1.[1][Nivel de evidencia A1] Para los pacientes con CPCNP en estadio IV o recidivante y expresión de PD-L1 en al menos un 1 % de las células tumorales, la combinación de inmunoterapia con nivolumab e ipilimumab como terapia de primera línea aumenta la supervivencia general (SG).[2][Nivel de evidencia A1] La terapia sistémica de segunda línea con nivolumab, docetaxel, pemetrexed o pembrolizumab para los tumores que expresan PD-L1 también mejora la supervivencia de los pacientes con buen estado funcional (que no recibieron el mismo fármaco o uno similar durante la terapia de primera línea).[3][Nivel de evidencia A1]
La función de la terapia sistémica en pacientes con un estado funcional del Eastern Cooperative Oncology Group (ECOG) menor de 2 es menos clara.
Los pacientes con adenocarcinoma tal vez se beneficien de recibir pemetrexed [4] y bevacizumab, así como la quimioterapia combinada con pembrolizumab. Los pacientes de tumores neuroendocrinos irresecables, localmente avanzados o metastásicos, bien diferenciados y no funcionantes se benefician con el everólimus, un inhibidor del blanco de la rapamicina en los mamíferos (mTOR).
Edad y comorbilidad
La evidencia apoya el concepto que indica que los pacientes de más edad con buen estado funcional y comorbilidad limitada quizás se beneficien de la quimioterapia combinada. La edad por sí sola no debe dictar las decisiones relacionadas con el tratamiento en pacientes de CPCNP avanzado. Los pacientes de más edad con un buen estado funcional disfrutan de mejor supervivencia y calidad de vida cuando reciben quimioterapia en comparación con cuidados de apoyo solamente. Se debe ser cauto al extrapolar los datos de pacientes de 70 a 79 años de edad a los pacientes de 80 o más años porque solo un número muy reducido de pacientes mayores de 80 años participaron en ensayos clínicos y el beneficio en este grupo es incierto.[5,6]
Evidencia (edad y comorbilidad):
- Los regímenes de quimioterapia combinada con derivados del platino proporcionan beneficios clínicos cuando se comparan con los cuidados de apoyo o con monoterapia; sin embargo, este tratamiento se contraindica en algunos pacientes de edad avanzada debido a reducción de la reserva funcional de muchos órganos relacionada con la edad o por afecciones comórbidas. Cerca de dos tercios de los pacientes con CPCNP tienen 65 o más años, y casi el 40 % tienen 70 o más años.[7] Los datos de Surveillance, Epidemiology, and End Results (SEER) Program indican que el porcentaje de pacientes mayores de 70 años es de alrededor del 50 %.
- En una revisión de datos de SEER de Medicare de 1994 a 1999 se encontró una tasa de uso de quimioterapia mucho más baja que la esperada para la población general.[8] En los mismos datos se indicó que las personas de más edad tal vez tengan más comorbilidades o una tasa más alta de compromiso funcional, lo que podría dificultar la participación en un estudio, o incluso contraindicarla; la falta de datos de ensayos clínicos a veces influye en la decisión de tratar a un paciente con quimioterapia estándar.
- Está claro que la monoquimioterapia y la quimioterapia combinada benefician por lo menos a algunos pacientes de más edad. En el Elderly Lung Cancer Vinorelbine Italian Study, se aleatorizó a 154 pacientes mayores de 70 años para recibir vinorelbina o cuidados médicos de apoyo.[9]
- Los pacientes que se trataron con vinorelbina tuvieron una tasa de supervivencia a 1 año del 32 %, en comparación con el 14 % para los que se trataron solo con cuidados médicos de apoyo. Los parámetros de calidad de vida también mejoraron significativamente en el grupo de quimioterapia, y los efectos tóxicos fueron de carácter aceptable.
- En un ensayo realizado en Japón se comparó el docetaxel con la vinorelbina en monoterapia en 180 pacientes mayores de 70 años con buen estado funcional.[10]
- Las tasas de respuesta (22 vs. 10 %) y de supervivencia sin progresión (SSP) (5,4 vs. 3,1 meses) fueron significativamente mejores con el docetaxel, pero la mediana de supervivencia (14,3 vs. 9,9 meses) y las tasas de supervivencia a 1 año (59 vs. 37 %) no alcanzaron significación estadística.
- Mediante el análisis de datos retrospectivos se comparó un grupo de pacientes más jóvenes (edad <70 años) con un grupo de pacientes mayores (edad ≥70 años) que participaron en ensayos aleatorizados numerosos sobre combinaciones biquimioterapéuticas, también se demostró que los pacientes de más edad obtienen el mismo beneficio de supervivencia, pero tienen un riesgo más alto de efectos tóxicos en la médula ósea.[5,6,11-14]
Estado funcional
El estado funcional es uno de los factores de pronóstico más importantes para la supervivencia de pacientes con CPCNP.[15] El beneficio de la terapia para este grupo de pacientes se evaluó en análisis retrospectivos y ensayos clínicos prospectivos.
Los resultados respaldan el uso de evaluaciones adicionales de los abordajes quimioterapéuticos para el CPCNP metastásico y localmente avanzado; sin embargo, la eficacia de las combinaciones actuales de quimioterapia con derivados del platino no permite determinar qué régimen específico que se debe considerar estándar. Fuera del entorno de ensayos clínicos, la quimioterapia se deberá administrar solo a pacientes con un buen estado funcional y lesiones tumorales evaluables, y para pacientes que deseen este tratamiento después de informarles acerca de los riesgos previstos y los beneficios limitados.
En ensayos controlados aleatorizados de pacientes con enfermedad en estadio IV y buen estado funcional, se observó que la quimioterapia a base de cisplatino mejora la supervivencia y produce la paliación de los síntomas relacionados con la enfermedad.[3][Nivel de evidencia A1]
Evidencia (estado funcional):
- En el ensayo (CLB-9730 [NCT00003117]) del Cancer and Leukemia Group B, se inscribieron 99 pacientes con un estado funcional de 2 (18 % de la población del estudio) para comparar la combinación de carboplatino y paclitaxel con el paclitaxel en monoterapia.[13]
- La mediana de supervivencia de los pacientes con un estado funcional de 2 fue de 3,0 meses y la tasa de supervivencia a 1 año fue del 14 % en comparación con los pacientes con un estado funcional de 0 a 1, que tuvieron una mediana de supervivencia de 8,8 meses y una supervivencia a 1 año del 38 %; esto demuestra el pronóstico precario que acarrea un estado funcional más bajo. Estas diferencias fueron estadísticamente significativas.
- Cuando se hizo el análisis de los pacientes con estado funcional de 2 según el grupo de tratamiento, los pacientes que recibieron quimioterapia combinada tuvieron una tasa de respuesta significativamente más alta (24 vs. 10 %), una mediana de supervivencia más larga (4,7 vs. 2,4 meses), y una tasa de supervivencia a 1 año más larga (18 vs. 10 %) en comparación con los pacientes que recibieron monoterapia de paclitaxel.[13]
- En un ensayo de fase III se comparó el pemetrexed en monoterapia con la combinación de carboplatino y pemetrexed en 205 pacientes con un estado funcional de 2 que no habían recibido quimioterapia.[16][Nivel de evidencia A1]
- La mediana de SG fue de 5,3 meses para los pacientes del grupo de pemetrexed solo y de 9,3 meses para el grupo de carboplatino y pemetrexed (cociente de riesgos instantáneos [CRI], 0,62; intervalo de confianza [IC] 95 %, 0,46–0,83; P = 0,001).
- La mediana de SSP fue de 2,8 meses para el grupo de pemetrexed solo y de 5,8 meses para el grupo de carboplatino y pemetrexed (P < 0,001).
- Las tasas de respuesta fueron del 10,3 % para el grupo de pemetrexed solo y del 23,8 % para el grupo de carboplatino y pemetrexed (P = 0,032).
- Como se esperaba, los efectos secundarios fueron más frecuentes en el grupo que recibió la combinación.
En este estudio, que se realizó en ocho centros del Brasil y un centro de los Estados Unidos, se notificaron tasas de SG y SSP más altas que las observadas tradicionalmente en la mayoría del resto de estudios publicados. Esto tal vez indique diferencias en la selección de pacientes.
- Se publicó un análisis de un subconjunto de 68 pacientes con un estado funcional de 2 de un ensayo en el que se asignó al azar a más de 1200 pacientes a 4 regímenes con derivados del platino.
- A pesar de una elevada incidencia de efectos adversos, incluso 5 muertes, en el análisis final se observó que los efectos tóxicos generales en los pacientes con un estado funcional de 2 no fueron significativamente diferentes de los pacientes con un estado funcional de 0 a 1.
- En el análisis de eficacia, se observó una tasa de respuesta general del 14 %, una mediana de supervivencia de 4,1 meses y una tasa de supervivencia a un año del 19 %; todas las cifras fueron mucho más bajas que las cifras de los pacientes con estado funcional de 0 a 1.
- En un ensayo aleatorizado de fase II (E-1599 [NCT00006004]) de dosis atenuadas de cisplatino y gemcitabina comparadas con carboplatino y paclitaxel participaron 102 pacientes con un estado funcional de 2.[17]
- Las tasas de respuesta fueron del 25 % en el grupo de cisplatino y gemcitabina, y del 16 % en el grupo de carboplatino y paclitaxel; la mediana de supervivencia fue de 6,8 meses en el grupo de cisplatino y gemcitabina, y de 6,1 meses en el grupo de carboplatino y paclitaxel; las tasas de supervivencia a 1 año fueron del 25 % en el grupo de cisplatino y gemcitabina y del 19 % en el grupo de carboplatino y paclitaxel. Ninguna de estas diferencias fue estadísticamente significativa, pero la supervivencia fue más prolongada que la prevista según los controles históricos.
- Los resultados de dos ensayos indican que es posible que los pacientes con un estado funcional de 2 presenten mejora sintomática.[18,19]
Opciones de tratamiento para el cáncer de pulmón de células no pequeñas en estadio IV de diagnóstico reciente, en recaída y recidivante (terapia de primera línea)
Las opciones de tratamiento para pacientes con enfermedad en estadio IV de diagnóstico reciente, en recaída y recidivante son las siguientes:
- Quimioterapia citotóxica combinada con derivados del platino (cisplatino o carboplatino) y paclitaxel, gemcitabina, docetaxel, vinorelbina, irinotecán, paclitaxel unido a una proteína o pemetrexed.
- Quimioterapia combinada con anticuerpos monoclonales.
- Terapia de mantenimiento después de la quimioterapia de primera línea (para pacientes con enfermedad estable o que responde después de cuatro ciclos de quimioterapia combinada con derivados del platino).
- Terapia de mantenimiento luego de la quimioterapia de primera línea.
- Pemetrexed luego de la quimioterapia combinada de primera línea con derivados del platino.
- Inhibidores de la tirosina–cinasa (ITC) del receptor del factor de crecimiento epidérmico (EGFR) con quimioterapia o sin esta (para pacientes con mutaciones en EGFR).
- Terapia dirigida a EGFR (para pacientes con mutaciones de inserción del exón 20 en EGFR).
- Inhibidores de la cinasa del linfoma anaplásico (ALK) (para pacientes con translocaciones en ALK).
- Inhibidores de BRAF V600E y MEK (para pacientes con mutaciones BRAF V600E).
- Inhibidores de ROS1 (para pacientes con reordenamientos de ROS1).
- Inhibidores del receptor de la tirosina–cinasa neurotrófica (NTRK) (para pacientes con fusiones de NTRK).
- Inhibidores de RET (para pacientes con fusiones de RET).
- Inhibidores de MET (para pacientes con mutaciones de omisión del exón 14 de MET).
- Inhibidores de puntos de control inmunitario con quimioterapia o sin esta.
- Inhibidores del blanco de la rapamicina en los mamíferos (mTOR) (para pacientes con tumores neuroendocrinos irresecables, localmente avanzados o metastásicos, progresivos, bien diferenciados y no funcionantes).
- Tratamientos locales y consideraciones especiales.
- Terapia láser endobronquial y braquiterapia (para lesiones obstructivas).[20]
- Radioterapia de haz externo (RHE) (principalmente para la paliación de los síntomas locales del crecimiento tumoral).[21-23]
- Tratamiento del segundo tumor primario.
- Tratamiento de las metástasis encefálicas.
- La participación en un ensayo clínico se puede considerar como terapia de primera línea.
Quimioterapia citotóxica combinada
Quimioterapia combinada
En ensayos controlados aleatorizados y en metanálisis se evaluaron extensamente el tipo y el número de fármacos quimioterapéuticos que se deben usar para el tratamiento de pacientes con CPCNP avanzado.
En varios ensayos aleatorizados se evaluaron distintas combinaciones farmacológicas con cisplatino o carboplatino en pacientes de CPCNP avanzado sin tratamiento previo. A partir del metanálisis de los ensayos, se obtuvieron las siguientes conclusiones:
- Determinadas combinaciones de tres medicamentos que incorporan fármacos dirigidos quizás mejoren la supervivencia.
- Los inhibidores de EGFR podrían beneficiar a determinados pacientes con mutaciones en EGFR.
- La quimioterapia de mantenimiento después de cuatro ciclos de quimioterapia combinada con derivados del platino a veces mejora la SSP y la SG.
- Las combinaciones de derivados del platino con vinorelbina, paclitaxel, docetaxel, gemcitabina, irinotecán, paclitaxel unido a una proteína y pemetrexed producen mejoras similares en la supervivencia. Los tipos y la frecuencia de los efectos tóxicos difieren, y es posible que esto determine el régimen preferido para un paciente determinado. Los pacientes con adenocarcinoma tal vez se beneficien del pemetrexed.
- El cisplatino y el carboplatino proporcionan mejorías similares en los desenlaces, pero producen diferentes efectos tóxicos. En algunos ensayos y metanálisis, pero no en todos, se indica que los desenlaces con cisplatino son superiores, aunque acarrean un riesgo más alto de ciertos efectos tóxicos como náuseas y vómitos.
- Las combinaciones sin derivados del platino no ofrecen ventajas sobre la quimioterapia con derivados del platino, incluso en algunos estudios se demuestra inferioridad de las combinaciones.
- Las combinaciones de tres fármacos quimioterapéuticos de uso frecuente no producen una supervivencia superior, y son más tóxicas que las combinaciones de dos fármacos.
Evidencia (quimioterapia combinada):
- La colaboración Cochrane revisó datos de todos los ensayos controlados aleatorizados publicados entre enero de 1980 y junio de 2006 en los que se compararon regímenes de biquimioterapia y de monoquimioterapia, o se compararon regímenes farmacológicos triples y dobles en pacientes de CPCNP avanzado.[24] Se encontraron 65 ensayos (13 601 pacientes).
- En los ensayos en los que se compararon regímenes de biquimioterapia y monoquimioterapia, se observó un aumento significativo de la respuesta tumoral (oportunidad relativa [OR], 0,42; IC 95 %, 0,37–0,47; P > 0,001) y la supervivencia a 1 año (OR, 0,80; IC 95 %, 0,70–0,91; P > 0,001) a favor del régimen de biquimioterapia. El beneficio absoluto para la supervivencia a 1 año fue del 5 %, que corresponde con un aumento desde el 30 % para la monoquimioterapia hasta el 35 % para la biquimioterapia. En los pacientes que recibieron biquimioterapia, las tasas de efectos tóxicos de grados 3 y 4 aumentaron estadísticamente en comparación con los pacientes que recibieron monoquimioterapia, con una OR que osciló entre 1,2 y 6,2. Las tasas de infección no aumentaron con los regímenes de biquimioterapia.
- No hubo aumento de la supervivencia a 1 año (OR, 1,01; IC 95 %, 0,85–1,21; P = 0,88) para los regímenes de quimioterapia triple versus los regímenes de biquimioterapia. La mediana del cociente de supervivencia fue de 1,00 (IC 95 %, 0,94–1,06, P = 0,97).
- En varios metanálisis se evaluó si los regímenes con cisplatino o carboplatino eran mejores; los resultados fueron desiguales.[25-27] En un metanálisis se notificaron datos individualizados de 2968 pacientes que participaron en 9 ensayos aleatorizados.[25]
- La tasa de respuesta objetiva fue más alta para los pacientes tratados con cisplatino (30 %) que para los tratados con carboplatino (24 %); (OR = 1,37; IC 95 %, 1,16–1,61; P < 0,001).
- El tratamiento con carboplatino se relacionó con un aumento sin significación estadística en el riesgo de mortalidad en comparación con el tratamiento con cisplatino (CRI, 1,07; IC 95 %, 0,99–1,15; P = 0,100).
- En los pacientes con tumores de células no escamosas y en los pacientes tratados con quimioterapia de tercera generación, la quimioterapia con carboplatino se relacionó con un aumento de la mortalidad con significación estadística (CRI, 1,12; IC 95 %, 1,01–1,23 para los pacientes con tumores de células no escamosas; y CRI, 1,11; IC 95 %, 1,01–1,21 para los pacientes tratados con quimioterapia de tercera generación).
- En el metanálisis también se evaluaron los efectos tóxicos relacionados con el tratamiento. Se observó más trombocitopenia con el carboplatino que el cisplatino (12 vs. 6 %; OR = 2,27; IC 95 %, 1,71–3,01; P < 0,001), mientras que el cisplatino causó más náuseas y vómitos (8 vs. 18 %; OR, 0,42; IC 95 %, 0,33–0,53; P < 0,001) y más efectos tóxicos renales (0,5 % vs. 1,5 %; OR, 0,37; IC 95 %, 0,15–0,88; P = 0,018).
- Los autores concluyeron que el tratamiento con cisplatino no se relacionó con un aumento importante del riesgo general de efectos tóxicos graves. Las conclusiones de este metanálisis detallado de datos individualizados de pacientes coinciden con las conclusiones de otros metanálisis en los que se analizaron los mismos ensayos clínicos, pero solo usaron datos publicados.
- En 3 metanálisis bibliográficos se incluyeron ensayos de comparación de las combinaciones con derivados del platino y otros medicamentos.[28-30]
- En el primer metanálisis se identificaron 37 ensayos evaluables con 7633 pacientes.[28]
- Un aumento del 62 % en la OR para la respuesta se atribuyó al tratamiento con derivados del platino (OR = 1,62; IC 95 %, 1,46–1,8; P < 0,001). La tasa de supervivencia a 1 año aumentó en un 5 % cuando se usaron regímenes con derivados del platino (34 vs. 29 %; OR = 1,21; IC 95 %, 1,09–1,35; P = 0,003).
- No se encontró un aumento estadísticamente significativo de la supervivencia a 1 año cuando se compararon los tratamientos con derivados del platino y los regímenes combinados de tercera generación (OR = 1,11; IC 95 %, 0,96–1,28; P = 0,17).
- Los efectos tóxicos de los regímenes con derivados del platino fueron significativamente más altos para los efectos hematológicos y renales, así como para las náuseas y los vómitos, pero no para los efectos tóxicos neurológicos, la tasa de neutropenia febril o la tasa de mortalidad tóxica. Estos resultados son compatibles con el segundo metanálisis bibliográfico.
- En el segundo metanálisis, se identificaron 17 ensayos con 4920 pacientes.[29]
- El uso de regímenes de biquimioterapia con derivados del platino se relacionó con una supervivencia a 1 año un poco más alta (riesgo relativo [RR] = 1,08; IC 95 %, 1,01–1,16, P = 0,03) y mejor respuesta parcial (RR = 1,11, IC 95 %, 1,02–1,21; P = 0,02), pero el riesgo de anemia, náuseas y efectos tóxicos neurológicos fue más alto.
- En un subanálisis, los regímenes de biquimioterapia con cisplatino mejoraron la supervivencia a 1 año (RR = 1,16; IC 95 %, 1,06–1,27; P = 0,001), la respuesta completa (RR = 2,29; IC 95 %, 1,08–4,88; P = 0,03) y la respuesta parcial (RR = 1,19; IC 95 %, 1,07–1,32; P = 0,002), con un aumento del riesgo de anemia, neutropenia, efectos tóxicos neurológicos y náuseas.
- Por el contrario, los regímenes de biquimioterapia con carboplatino no aumentaron la supervivencia a 1 año (RR = 0,95; IC 95 %, 0,85–1,07; P = 0,43).
- En el tercer metanálisis de ensayos aleatorizados de fase III sobre quimioterapia de primera línea de combinaciones con derivados del platino versus combinaciones con otros fármacos, se identificaron 14 ensayos.[30] Los grupos de investigación fueron gemcitabina con vinorelbina (n = 4), gemcitabina con un taxano (n = 7), gemcitabina con epirrubicina (n = 1), paclitaxel con vinorelbina (n = 1), y gemcitabina con ifosfamida (n = 1). Este metanálisis se limitó a la serie de 11 estudios de fase III en los que se usaron regímenes de biquimioterapia con derivados del platino (2298 en el grupo con derivados del platino y 2304 en el grupo sin derivados del platino).
- Los pacientes tratados con un régimen con derivados del platino se beneficiaron de una reducción estadísticamente significativa del riesgo de muerte a 1 año (OR = 0,88; IC 95 %, 0,78–0,99; P = 0,044) y un riesgo más bajo de resistencia a la quimioterapia (OR = 0,87; IC, 0,73–0,99; P = 0,049).
- Se notificaron 44 (1,9 %) muertes relacionadas con la toxicidad de los regímenes con derivados del platino y 29 (1,3 %) muertes relacionadas con la toxicidad de los regímenes sin derivados del platino (OR = 1,53; IC, 0,96–2,49; P = 0,08). Se demostró un aumento estadísticamente significativo del riesgo de efectos tóxicos digestivos y hematológicos de grados 3 a 4 para los pacientes que recibieron quimioterapia con derivados del platino. No hubo un aumento estadísticamente significativo del riesgo de neutropenia febril (OR, 1,23; IC 95 %, 0,94–1,60; P = 0,063).
- En el primer metanálisis se identificaron 37 ensayos evaluables con 7633 pacientes.[28]
Programa de medicamentos y dosis de administración
No es posible recomendar de manera definitiva un programa de medicamentos y dosis de administración para las diferentes combinaciones de medicamentos activos, excepto para el carboplatino, el pemetrexed y el pembrolizumab para pacientes con un tipo histológico de células no escamosas.
Evidencia (programa de medicamentos y dosis de administración):
- En un metanálisis de 7 ensayos con 2867 pacientes se evaluó el beneficio de docetaxel versus vinorelbina.[31] El docetaxel se administró con un derivado del platino en tres ensayos, se combinó con gemcitabina en dos ensayos y se administró en monoterapia en otros dos ensayos. En seis ensayos se administró un alcaloide de vinca (vinorelbina en seis ensayos y vindesina en un ensayo) combinado con cisplatino, y en un ensayo se administró el alcaloide solo.
- El cálculo conjunto de la SG mostró una mejora del 11 % en favor del docetaxel (CRI, 0,89; IC 95 %, 0,82–0,96; P = 0,004). Se observaron mejorías similares en el análisis de sensibilidad de comparación con vinorelbina o cuando solo se analizó un régimen de biquimioterapia.
- La neutropenia de grados 3 a 4 y los efectos adversos graves de grados 3 a 4 fueron menos frecuentes con los regímenes a base de docetaxel (OR, 0,59; IC 95 %, 0,38–0,89; P = 0,013) que para los regímenes a base de un alcaloide de vinca (OR = 0,68; IC 95 %, 0,55–0,84; P < 0,001).
- En dos ensayos aleatorizados se comparó la administración semanal versus la administración cada 3 semanas de dosis de paclitaxel y carboplatino; no se notificaron diferencias significativas en la eficacia, y la tolerabilidad fue mejor para la administración semanal.[32,33] Aunque los metanálisis de ensayos controlados aleatorizados indican que las combinaciones de cisplatino tal vez sean superiores a las combinaciones de carboplatino o las combinaciones sin derivados del platino, se debe sopesar la importancia clínica de las diferencias de eficacia contra la tolerabilidad prevista, la logística de administración y la familiaridad del personal médico para tomar decisiones de tratamiento para cada paciente.
- En un gran estudio aleatorizado de no inferioridad de fase III se comparó la SG en 1725 pacientes con CPCNP IIIB/IV y estado funcional 0 a 1 que no habían recibido quimioterapia.[4] Los pacientes recibieron cisplatino en dosis de 75 mg/m2 el día 1 con gemcitabina 1250 mg/m2 los días 1 y 8 (n = 863), o cisplatino 75 mg/m2 con pemetrexed 500 mg/m2 el día 1 (n = 862) cada 3 semanas hasta por 6 ciclos.
- La SG para el grupo de cisplatino con pemetrexed (mediana de supervivencia de 10,3 meses) no fue inferior a la SG para el grupo de cisplatino con gemcitabina (mediana de supervivencia 10,3 meses; CRI, 0,94; IC 95 %, 0,84–1,05).
- En los pacientes con adenocarcinoma (n = 847), la SG fue estadísticamente superior cuando recibieron cisplatino con pemetrexed (12,6 meses) versus cisplatino con gemcitabina (10,9 meses); en los pacientes con carcinoma de células grandes (n = 153), la SG fue estadísticamente superior cuando recibieron cisplatino con pemetrexed (10,4 meses) versus cisplatino con gemcitabina (6,7 meses).
- En contraste, los pacientes con tipo histológico de células escamosas (n = 473) tuvieron una mejoría considerable de la supervivencia cuando recibieron cisplatino con gemcitabina (10,8 meses) versus cisplatino con pemetrexed (9,4 meses). En el grupo de cisplatino con pemetrexed, las tasas de efectos de grado 3 o 4 fueron significativamente más bajas para la neutropenia, la anemia y la trombocitopenia (P ≤ 0,001); la neutropenia febril (P = 0,002); y la alopecia (P < 0,001); pero las náuseas de grado 3 o 4 (P = 0,004) fueron más comunes.
- En los resultados de este estudio se indicó que la combinación de cisplatino con pemetrexed es otro régimen de biquimioterapia alternativo para la quimioterapia de primera línea en pacientes con CPCNP avanzado. Además, se indicó que los desenlaces pueden variar según el tipo histológico.
Quimioterapia combinada con anticuerpos monoclonales
Bevacizumab
Evidencia (bevacizumab):
- En dos ensayos aleatorizados se evaluó la adición de bevacizumab (un anticuerpo dirigido al factor de crecimiento endotelial vascular) a la quimioterapia combinada estándar de primera línea.
- En un estudio aleatorizado de 878 pacientes de CPCNP en estadio IIIB/IV recidivante o avanzado, 444 recibieron paclitaxel con carboplatino, y 434 pacientes recibieron paclitaxel, carboplatino y bevacizumab.[34] Se administraron 6 ciclos de quimioterapia cada 3 semanas y se administró bevacizumab cada 3 semanas hasta que se manifestara progresión de la enfermedad o los efectos tóxicos fueran intolerables. Se excluyó a los pacientes con tumores de células escamosas, metástasis encefálicas, hemoptisis de importante clínica, o funcionamiento orgánico o estado funcional inadecuados (estado funcional del ECOG >1).
- La mediana de supervivencia para el grupo asignado a quimioterapia con bevacizumab fue de 12,3 meses en comparación con 10,3 meses para el grupo de quimioterapia sola (CRIde muerte, 0,79, P = 0,003).
- En el grupo de quimioterapia con bevacizumab, la mediana de SSP fue de 6,2 meses (CRIde progresión de la enfermedad, 0,66; P < 0,001) y la tasa de respuesta fue de 35 % (P < 0,001) en comparación con una SSP de 4,5 meses (CRIde progresión de la enfermedad, 0,66; P < 0,001) y una tasa de respuesta del 15 % (P < 0,001) en el grupo de quimioterapia sola.
- Las tasas de hemorragia de importancia clínica fueron del 4,4 % en el grupo asignado a quimioterapia con bevacizumab y del 0,7 % en el grupo de quimioterapia sola (P < 0,001). Hubo 15 muertes relacionadas con el tratamiento en el grupo de quimioterapia con bevacizumab, entre ellas, 5 muertes por hemorragia pulmonar.
- Para este subgrupo de pacientes de CPCNP, añadir bevacizumab a la quimioterapia con paclitaxel y carboplatino puede proporcionar beneficio de supervivencia.[34][Nivel de evidencia A1]
- En otro ensayo aleatorizado de fase III se investigó la eficacia y la inocuidad de la combinación de cisplatino, gemcitabina y bevacizumab.[35] Los pacientes se asignaron al azar para recibir cisplatino (80 mg/m2) y gemcitabina (1250 mg/m2) hasta por 6 ciclos, con dosis bajas de bevacizumab (7,5 mg/kg), dosis altas de bevacizumab (15 mg/kg), o placebo cada 3 semanas hasta la progresión de la enfermedad. El criterio principal de valoración se cambió de SG a SSP durante el curso del estudio. Se inscribieron 1043 pacientes (grupo de placebo, n = 347; grupo de dosis bajas, n = 345; grupo de dosis altas, n = 351).
- La SSP fue significativamente más prolongada con la adición de bevacizumab; los CRI para la SSP fueron de 0,75 en el grupo de dosis bajas (mediana de SSP, 6,7 vs. 6,1 meses en el grupo de placebo; P = 0,03) y de 0,82 meses en el grupo de dosis alta en comparación con el grupo de placebo (mediana de SSP, 6,5 vs. 6,1 meses en el grupo de placebo; P = 0,03).[35][Nivel de evidencia A1]
- Las tasas de respuesta objetiva también mejoraron con la adición de bevacizumab, estas fueron del 20,1 % para el grupo de placebo, del 34,1 % para el grupo de dosis bajas de bevacizumab y del 30,4 % para el grupo de dosis altas de bevacizumab con cisplatino y gemcitabina.
- La frecuencia de efectos adversos de grado 3 o más graves fue similar en todos los grupos.
- Las tasas de hemorragias pulmonares de grado 3 o más graves fueron del 1,5 % o menos en todos los grupos a pesar de que el 9 % de los pacientes recibieron anticoagulación terapéutica.
- Estos resultados sustentan la adición de bevacizumab a la quimioterapia con derivados del platino, pero los resultados son menos impresionantes que para la combinación de carboplatino y paclitaxel.
- Es más, en este estudio no se observó diferencia significativa en la supervivencia, según se informó en el resumen.
- En conjunto, estos hallazgos indican que el tipo de quimioterapia de base quizás sea importante cuando se añade bevacizumab.
- En un estudio aleatorizado de 878 pacientes de CPCNP en estadio IIIB/IV recidivante o avanzado, 444 recibieron paclitaxel con carboplatino, y 434 pacientes recibieron paclitaxel, carboplatino y bevacizumab.[34] Se administraron 6 ciclos de quimioterapia cada 3 semanas y se administró bevacizumab cada 3 semanas hasta que se manifestara progresión de la enfermedad o los efectos tóxicos fueran intolerables. Se excluyó a los pacientes con tumores de células escamosas, metástasis encefálicas, hemoptisis de importante clínica, o funcionamiento orgánico o estado funcional inadecuados (estado funcional del ECOG >1).
Cetuximab
Evidencia (cetuximab):
- En dos ensayos se evaluó la adición de cetuximab a la quimioterapia combinada de primera línea.[36,37]
- En el primer ensayo, 676 pacientes de CPCNP en estadio IIIB (derrame pleural) o CPCNP en estadio IV que no habían recibido quimioterapia y que no tenían restricciones derivadas del tipo histológico o la expresión del EGFR, recibieron cetuximab con un taxano (paclitaxel o docetaxel con carboplatino) o quimioterapia combinada.[36]
- La adición de cetuximab no produjo mejoría estadísticamente significativa de la SSP, el criterio principal de valoración de este estudio, o de la SG.
- La mediana de SSP fue de 4,40 meses para los pacientes del grupo de quimioterapia con cetuximab versus 4,24 meses para los pacientes del grupo de quimioterapia con un taxano y carboplatino (CRI, 0,902; IC 95 %, 0,761–1,069; P = 0,236).
- La mediana de SG fue 9,69 meses para los pacientes del grupo de quimioterapia con cetuximab versus 8,38 meses para el grupo de quimioterapia sola (CRI, 0,890; IC 95 %, 0,754–1,051; P = 0,169).
- En los análisis específicos por grupos de tratamiento, no se encontraron relaciones significativas entre la expresión de EGFR, una mutación en EGFR, el número de copias de EGFR o las mutaciones en KRAS, y la SSP, la SG o la respuesta al tratamiento.[38]
- El segundo ensayo abarcó 1125 pacientes de CPCNP en estadio IIIB/IV avanzado con expresión de EGFR y que no habían recibido quimioterapia, estos pacientes iniciaron tratamiento de quimioterapia con cisplatino, vinorelbina y cetuximab, o quimioterapia sola.[37]
- El criterio principal de valoración del estudio, la SG, fue más prolongado para los pacientes tratados con cetuximab y quimioterapia (mediana 11,3 vs. 10,1 meses; CRIde muerte, 0,871; IC de 95 %, 0,762–0,996; P = 0,044).
- En todos los subgrupos histológicos se observó un beneficio en la supervivencia; sin embargo, este beneficio no se observó en los pacientes que no eran blancos o en los pacientes asiáticos. Solo fue significativa la interacción entre el tratamiento y el origen étnico (P = 0,011).
- El principal efecto adverso relacionado con el cetuximab fue una erupción acneiforme (grado 3, 10 %).
- No resulta claro si la diferencia de resultados en estos dos estudios, fue producto de las diferencias en la población estudiada, la caracterización del tumor según la expresión de EGFR o los regímenes quimioterapéuticos.
- En el primer ensayo, 676 pacientes de CPCNP en estadio IIIB (derrame pleural) o CPCNP en estadio IV que no habían recibido quimioterapia y que no tenían restricciones derivadas del tipo histológico o la expresión del EGFR, recibieron cetuximab con un taxano (paclitaxel o docetaxel con carboplatino) o quimioterapia combinada.[36]
Necitumumab
Evidencia (necitumumab):
- En dos ensayos de fase III, se evaluó la adición del necitumumab (anticuerpo de segunda generación dirigido contra el EGFR tipo inmunoglobulina humana G1 recombinada) a un régimen de biquimioterapia con un derivado del platino para el tratamiento de primera línea de pacientes con CPCNP escamosas o no escamosas en estadio avanzado.[39,40]
- En el ensayo SQUIRE (NCT00981058) se asignó al azar a 1093 pacientes de CPCNP escamosas en estadio avanzado a recibir quimioterapia de primera línea con cisplatino y gemcitabina, o el mismo régimen con la adición de necitumumab (800 mg los días 1 y 8 de cada ciclo).[40]
- La mediana de SG se prolongó con la adición de necitumumab (11,5 vs. 9,9 meses; P = 0,01).
- La SSP también se prolongó con la adición de necitumumab (5,7 vs. 5,5 meses); sin embargo, la tasa de respuesta general fue similar en ambos grupos (31 vs. 28 %).
- Los efectos adversos de grado 3 y 4 fueron más altos en el grupo que recibió necitumumab (72 vs. 62 %).
- El necitumumab se relacionó con grados más altos de efectos tóxicos y un beneficio relativamente modesto.
- En el ensayo INSPIRE (NCT00982111) se asignó al azar a 633 pacientes de CPCNP y no escamosas en estadio avanzado a recibir quimioterapia de primera línea con cisplatino y pemetrexed, o cisplatino y pemetrexed con adición de necitumumab (800 mg los días 1 y 8 de cada ciclo).[39]
- En este estudio, no se observó beneficio de la adición de necitumumab a la quimioterapia estándar de primera línea para un CPCNP y no escamosas en estadio avanzado.
- La SG fue de 11,3 meses (IC 95 %, 9,5–13,4) para los pacientes del grupo que recibió necitumumab versus 11,5 meses (IC 95 %, 10,1–13,1) para los pacientes del grupo de quimioterapia sola; P = 0,96. Del mismo modo, no hubo diferencias en la respuesta objetiva o SSP entre los grupos.
- Los efectos adversos graves y los de grado 3 a 4, incluso episodios tromboembólicos, fueron más frecuentes en los pacientes del grupo de necitumumab; las muertes relacionadas con el tratamiento también fueron más frecuentes (5 vs. 3 %).
- A partir de estos resultados, no se recomienda añadir necitumumab a la quimioterapia de primera línea estándar para pacientes de CPCNP y no escamosas en estadio avanzado.
- En el ensayo SQUIRE (NCT00981058) se asignó al azar a 1093 pacientes de CPCNP escamosas en estadio avanzado a recibir quimioterapia de primera línea con cisplatino y gemcitabina, o el mismo régimen con la adición de necitumumab (800 mg los días 1 y 8 de cada ciclo).[40]
Terapia de mantenimiento luego de la quimioterapia de primera línea (para pacientes con enfermedad estable o que responde después de cuatro ciclos de quimioterapia combinada con derivados del platino)
Una estrategia de tratamiento que se ha investigado mucho para el CPCNP es la terapia de mantenimiento luego de la respuesta inicial a la quimioterapia. Las opciones de terapias de mantenimiento investigadas son las siguientes:
- Continuación del régimen de quimioterapia combinada inicial.
- Continuación de la monoquimioterapia.
- Introducción de un fármaco nuevo como mantenimiento.
En múltiples ensayos aleatorizados se evaluó la eficacia de continuar la quimioterapia citotóxica combinada de primera línea después de 3 o 4 ciclos.
Evidencia (terapia de mantenimiento luego de la quimioterapia de primera línea):
- En ninguno de los ensayos de continuación de las combinaciones citotóxicas se encontró una ventaja significativa para la SG cuando se prolonga el periodo de tratamiento o se usan más de 4 ciclos de quimioterapia. En dos estudios con pacientes de CPCNP y no escamosas se demostró mejores tasas de SSP y SG con el cambio o la continuación de la quimioterapia de mantenimiento (por ejemplo, pemetrexed de mantenimiento después de cisplatino y gemcitabina iniciales, o pemetrexed de mantenimiento después de cisplatino y pemetrexed iniciales).[41]
- En tres ensayos se encontró una mejora estadísticamente significativa de la SSP o del tiempo transcurrido hasta la progresión cuando se usó quimioterapia adicional.[42-44]
- No se notificó una mejora uniforme en la calidad de vida.[43,45,46]
- Los efectos tóxicos relacionados con la quimioterapia fueron más altos con la quimioterapia prologada.[45,46]
Estos datos indican que la SSP y la SG para pacientes de CPCNP y no escamosas se pueden mejorar cuando se continua una quimioterapia eficaz después de cuatro ciclos o se inicia de manera inmediata otro régimen de quimioterapia. Sin embargo, la mejora en la SSP se ve menoscabada por un aumento de los efectos adversos, incluso los causados por la quimioterapia citotóxica adicional, además de la falta de una mejoría sostenida en la calidad de vida. En los pacientes que presentan enfermedad estable o que responden al tratamiento de primera línea, la evidencia no sustenta la continuación de la quimioterapia citotóxica combinada hasta que aparezca progresión de la enfermedad ni el inicio de otro tipo de quimioterapia antes de la progresión de la enfermedad. En conjunto, en estos ensayos se indica que la quimioterapia citotóxica combinada de primera línea se debe suspender en el momento de progresión de la enfermedad o luego de 4 ciclos en los pacientes cuya enfermedad no responde al tratamiento y no se deben administrar más de 6 ciclos de quimioterapia.[42,43,45,46] En los pacientes con CPCNP y no escamosas que responden al tratamiento o tienen una enfermedad estable después de 4 a 6 ciclos de quimioterapia combinada con derivados del platino, se debe considerar el uso de quimioterapia de mantenimiento con pemetrexed.[41]
Evidencia (quimioterapia combinada de primera línea con derivados del platino seguida de pemetrexed):
En los hallazgos de dos ensayos aleatorizados (NCT00102804 y NCT00789373) se observaron mejores desenlaces con la adición de pemetrexed después de la quimioterapia combinada estándar de primera línea con derivados del platino.[44,47]
- En el primer ensayo, 663 pacientes con enfermedad en estadio IIIB o IV que no progresó durante 4 ciclos de quimioterapia con derivados del platino sin pemetrexed, se asignaron al azar (proporción 2:1) para recibir pemetrexed o placebo hasta la progresión de la enfermedad.[47]
- Tanto el criterio principal de valoración de SSP como el criterio secundario de valoración de SG se prolongaron de manera estadísticamente significativa cuando se añadió pemetrexed de mantenimiento (mediana de SSP, 4,3 vs.2,6 meses; CRI, 0,50; IC 95 %, 0,42–0,61, P < 0,0001; mediana SG, 13,4 vs. 10,6 meses; CRI, 0,79; IC 95 %, 0,65–0,95; P = 0,012).
- No se observó beneficio en los pacientes con tipo histológico de células escamosas.
- Los efectos tóxicos de grado 3 o mayor y la descontinuación del tratamiento como resultado de efectos tóxicos relacionados con el medicamento fueron más frecuentes en el grupo de pemetrexed que en el grupo de placebo.
- No se presentaron muertes relacionadas con el pemetrexed.
- Relativamente menos pacientes en el grupo de pemetrexed en comparación con el grupo de placebo recibieron tratamiento sistémico después de la descontinuación (227 [51 %] vs. 149 [67 %]; P = 0,0001).
- La calidad de vida durante la terapia de mantenimiento con pemetrexed fue similar a la del placebo, salvo por un aumento leve en la pérdida de apetito, un empeoramiento del dolor tardío y hemoptisis, según la Lung Cancer Symptom Scale.[48] Los resultados de calidad de vida se deben evaluar con precaución, porque hubo un grado alto de censura (> 50 %) para el criterio principal de valoración de calidad de vida: el tiempo hasta el empeoramiento de los síntomas.
- En los ensayos, no se evaluó el pemetrexed de mantenimiento versus el pemetrexed en el momento de la progresión.
- En el segundo ensayo, 539 pacientes con CPCNP y no escamosas sin progresión después del tratamiento con pemetrexed y cisplatino se asignaron al azar para continuar con pemetrexed o placebo.[44]
- Hubo una mejora estadísticamente significativa en el criterio principal de valoración de la SSP (4,1 vs. 2,8 meses, CRI, 0,62; IC 95 %, 0,49–0,79) y en el criterio secundario de valoración de la SG (13,9 vs. 11 meses; CRI, 0,78; IC 95 %, 0,64–0,96).[41,44][Nivel de evidencia B1]
Inhibidores de la tirosina–cinasa del EGFR con quimioterapia o sin esta (para pacientes con mutaciones en EGFR)
Determinados pacientes con mutaciones activadoras en EGFR quizás se beneficien de la monoterapia con un inhibidor de la tirosina–cinasa (ITC) del EGFR. En ensayos controlados aleatorizados con pacientes de CPCNP con mutaciones en EGFR que no habían recibido quimioterapia, se observó que los inhibidores de EGFR solos mejoraron la SSP y la SG, y tuvieron perfiles de toxicidad favorables en comparación con la quimioterapia combinada. La combinación del ITC del EGFR con quimioterapia demostró una mejor SSP, en comparación con el ITC del EGFR en monoterapia, y representa otra opción de tratamiento.
Osimertinib solo
Evidencia (osimertinib solo):
- En un ensayo multicéntrico controlado aleatorizado con enmascaramiento doble de fase III (FLAURA [NCT02296125]), se comparó el osimertinib, un ITC del EGFR irreversible oral de tercera generación, que inhibe tanto las mutaciones sensibilizantes del ITC del EGFR como la mutación de resistencia T790M en EGFR, con un ITC del EGFR (gefitinib o erlotinib) como tratamiento estándar de primera línea para pacientes con CPCNP avanzado sin tratamiento previo y cuyos tumores tenían mutaciones en EGFR (deleción del exón 19 o L858R), según se comprobó mediante un examen de detección aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA).[49] Los 556 pacientes se asignaron al azar en una proporción de 1:1.
- La SSP, el criterio principal de valoración, fue significativamente más prolongada con el osimertinib (18,9 vs. 10,2 meses; CRI, 0,46; IC 95 %, 0,37–0,57, P < 0,001).[49][Nivel de evidencia B1]
- La tasa de respuesta objetiva fue similar en ambos grupos (80 % para el grupo de osimertinib vs. 76 % para el grupo de terapia estándar con un ITC del EGFR).
- La progresión en el sistema nervioso central (SNC) se observó con menos frecuencia en el grupo de osimertinib que en el grupo de terapia estándar con un ITC del EGFR (6 vs. 15 %).
- La mediana de duración de la respuesta (DR) fue de 17,2 meses (IC 95 %, 13,8–22,0) con el osimertinib versus 8,5 meses (IC 95 %, 7,3–9,8) con la terapia estándar de ITC del EGFR.
- La SG fue un criterio de valoración secundario. Con una mediana de seguimiento de, al menos, 39 meses en cada grupo, la mediana de SG fue de 38,6 meses (IC 95 %, 34,5–41,8) en el grupo de osimertinib y de 31,8 meses (IC 95 %, 26,6–36,0) en el grupo de ITC del EGFR estándar (CRImuerte 0,80; 95,05 % IC, 0,64–1,00; P = 0,046).[50][Nivel de evidencia A1]
- La tasa de cruce del grupo de ITC del EGFR estándar al grupo de osimertinib fue del 31 % (85 de 277) entre los pacientes asignados al grupo de ITC del EGFR estándar y del 47 % (85 de 180) entre los pacientes que abandonaron el ITC del EGFR. Los autores mencionaron que este cruce probablemente contribuyó a la duración de la SG en el ITC del EGFR (31,8 meses).
- No se observaron nuevas señales de inocuidad. Las tasas de efectos adversos de grado 3 o superior y los eventos adversos que llevaron al abandono del tratamiento fueron similares entre los grupos. Los efectos adversos que produjeron la interrupción, reducción o abandono de la dosis fueron del 43 %, 5 % y 15%, respectivamente, en el grupo de osimertinib y del 41 %, 4 % y 18 %, respectivamente, en el grupo de ITC del EGFR.
La FDA aprobó el osimertinib para el tratamiento de primera línea del CPCNP con mutación en EGFR (deleción del exón 19 o L858R).
Las SSP y SG más prolongadas, la actividad contra la mutación T790M en EGFR, además de las mutaciones sensibilizantes del ITC del EGFR, la disminución de la frecuencia de progresión en el SNC y buena tolerabilidad, hacen del osimertinib la opción preferida para el tratamiento de pacientes con CPCNP avanzado con mutación en EGFR, en comparación con los ITC del EGFR de primera y segunda generación.
Osimertinib y quimioterapia
Evidencia (osimertinib y quimioterapia):
- En un ensayo de fase III, sin enmascaramiento, aleatorizado, multicéntrico (FLAURA2 [NCT04035486]) se comparó osimertinib y quimioterapia con osimertinib solo en pacientes con CPCNP avanzado que presentaba una mutación en EGFR (deleción del exón 19 o mutación L858R) y que no habían recibido tratamiento para la enfermedad avanzada. Los pacientes recibieron osimertinib (80 mg una vez al día) y quimioterapia (pemetrexed [500 mg/m2 de superficie corporal] y cisplatino [75 mg/m2] o carboplatino [dosificación con ajuste farmacológico, área bajo la curva (ABC) = 5]) u osimertinib en monoterapia (80 mg una vez al día). En el grupo de combinación, la quimioterapia se administró durante 4 ciclos de 21 días, seguida de terapia de mantenimiento con osimertinib y pemetrexed (500 mg/m2) cada 3 semanas. Un total de 557 pacientes aptos para participar en el estudio se asignaron al azar en una proporción 1:1. El criterio principal de valoración fue la SSP medida por el investigador.[51]
- La SSP fue de 25,5 meses (24,7–no se pudo determinar) en los pacientes del grupo de osimertinib y quimioterapia, y de 16,7 meses (14,1–21,3) en los pacientes del grupo de osimertinib en monoterapia (CRI, 0,62; IC 95 %, 0,49–0,79; P < 0,001).[51][Nivel de evidencia B1] La SSP se evaluó de acuerdo a revisión central independiente con enmascaramiento y fue congruente con el análisis primario (CRI, 0,62; IC 95 %, 0,48–0,80).
- Al cabo de 24 meses, el 57 % (IC 95 %, 50–63%) de los pacientes en el grupo de osimertinib y quimioterapia, y el 41 % (IC 95 %, 35–47 %) de los pacientes del grupo de osimertinib solo estaban vivos y sin progresión.
- Se observó una respuesta objetiva (completa o parcial) en el 83 % de los pacientes que recibieron osimertinib y quimioterapia, y en el 76 % de aquellos que recibieron osimertinib solo.
- La mediana de DR fue de 24,0 meses (IC 95 %, 20,9–27,8) en el grupo de osimertinib y quimioterapia y de 15,3 meses (IC 95 %, 12,7–19,4), en el grupo de osimertinib solo.
- Los efectos adversos de grado 3 o superior por cualquier causa fueron más comunes en el grupo de la combinación (64 %) que en la quimioterapia (27 %), congruente con los efectos adversos relacionados con la quimioterapia que ya se conocen. La combinación de osimertinib y pemetrexed con un derivado del platino presentó un perfil de inocuidad que coincide con los perfiles establecidos para esos fármacos.
El análisis de la SG, un criterio secundario de valoración, requiere de seguimiento adicional (madurez de los datos, 27 %).
Dacomitinib
Evidencia (dacomitinib):
- En un ensayo multicéntrico, aleatorizado y sin anonimato de fase III (ARCHER 1050 [NCT01774721]), se comparó el dacomitinib, un ITC del EGFR de segunda generación e irreversible administrado por vía oral en una dosis de 45 mg por día con el gefitinib administrado por vía oral en una dosis de 250 mg por día, como tratamiento de primera línea para pacientes de CPCNP recién diagnosticado en estadio avanzado que albergan las siguientes mutaciones en EGFR: deleción del exón 19 o mutaciones de sustitución L858R en el exón 21, detectadas mediante una prueba aprobada por la FDA.[52] Se asignó al azar a 452 pacientes aptos en una proporción 1:1. El criterio principal de valoración fue la SSP evaluada por una revisión independiente enmascarada de la población por intención de tratar.
- La mediana de SSP fue de 14,7 meses en el grupo de dacomitinib y de 9,2 meses en el grupo de gefitinib (CRI, 0,59; IC 95 %, 0,47−0,74; P < 0,0001).[52][Nivel de evidencia B1]
- La tasa de respuesta objetiva fue similar entre los dos grupos (75 % para el grupo de dacomitinib vs. 72 % para el grupo de gefitinib; P = 0,42).
- La mediana de DR fue más prolongada en el grupo de dacomitinib (14,8 vs. 8,3 meses; CRI, 0,4; IC 95 %, 0,31−0,53; P < 0,0001).
- La mediana de SG fue de 34,1 meses con dacomitinib vs. 26 .8 meses con gefitinib (CRI, 0,76; IC 95 %, 0,58−0,99; P = 0,44).[52]
- Los efectos adversos de grado 3 o más altos por cualquier causa se presentaron en el 63 % de los pacientes que recibieron dacomitinib y en el 41 % de los pacientes que recibieron gefitinib. Los efectos adversos más comunes de grados 3 o 4 fueron dermatitis acneiforme (14 % en el grupo de dacomitinib vs. ninguno en el grupo de gefitinib), diarrea (8 vs. 1 %) y elevación de las concentraciones de alanina–aminotransferasa (ALT) (1 vs. 8 %). Los efectos adversos graves relacionados con el tratamiento) fueron más frecuentes en el grupo de dacomitinib (9 vs. 4 %). La interrupción permanente del medicamento en estudio debido a efectos adversos relacionados con el tratamiento fue más frecuente en el grupo de dacomitinib (10 vs. 7 %). Las reducciones de la dosis también fueron más frecuentes en el grupo de dacomitinib (66 vs. 8 %).
La FDA aprobó el dacomitinib para el tratamiento de primera línea de pacientes de CPCNP metastásico con deleción del exón 19 de EGFR o mutaciones de sustitución L858R en el exón 21 detectadas mediante una prueba aprobada por la FDA.
Gefitinib
Evidencia (gefitinib):
- En un ensayo aleatorizado multicéntrico de fase III de Asia oriental, se comparó gefitinib con carboplatino y paclitaxel como tratamiento de primera línea en pacientes seleccionados con adenocarcinoma pulmonar avanzado que nunca habían fumado o eran fumadores ocasionales.[53]
- En el estudio se alcanzó el objetivo principal que era demostrar la superioridad del gefitinib comparado con la combinación de carboplatino y paclitaxel para la SSP (CRIde progresión o muerte = 0,74; IC 95 %, 0,65–0,85; P < 0,001).
- La mediana de SSP fue de 5,7 meses en el grupo de gefitinib y 5,8 meses en el grupo de carboplatino y paclitaxel.[53][Nivel de evidencia B1]
- Después de descontinuar la quimioterapia y mientras se continuaba con el gefitinib, se observó una separación clara a favor del gefitinib en las curvas de la SSP.
- Las tasas de SSP a 12 meses fueron del 24,9 % en el grupo de gefitinib y 6,7 en el grupo de carboplatino y paclitaxel.
- En el ensayo, más del 90 % de los pacientes con mutaciones tenían del19 o mutaciones L858R en el exón 21, que son sensibles a los inhibidores de EGFR. En el subgrupo de pacientes con una mutación, la SSP fue significativamente más prolongada en quienes recibieron gefitinib (CRI 0,48; IC 95 %, 0,36–0,64; P < 0,001); sin embargo, en el subgrupo de pacientes sin una mutación, la SSP fue significativamente más prolongada en los pacientes que recibieron la combinación carboplatino y paclitaxel (CRI con gefitinib, 2,85; IC 95 %, 2,05–3,98; P < 0,001). Hubo una interacción significativa entre el tratamiento y la mutación en EGFR con respecto a la SSP (P < 0,001).[53]
- La SG fue similar para los pacientes que recibieron gefitinib, carboplatino y paclitaxel, sin diferencia significativa entre los tratamientos en general (CRI, 0,90; IC 95 %, 0,79–1,02; P = 0,109), en los subgrupos que expresaban una mutación en EGFR (CRI, 1,00; IC 95 %, 0,76– 1,33; P = 0,990) o en los que no expresaban una mutación en EGFR (CRI, 1,18; IC 95 %, 0,86–1,63; P = 0,309; tratamiento según la interacción de la mutación en EGFR, P = 0,480). Una proporción alta (64,3 %) de los pacientes con una mutación en EGFR que se asignaron al azar al régimen de carboplatino y paclitaxel recibieron después un ITC del EGFR. La SSP fue significativamente más larga con gefitinib para los pacientes cuyos tumores presentaban al mismo tiempo un número alto de copias del gen EGFR y una mutación en EGFR (CRI, 0,48; IC 95 %, 0,34–0,67), pero la SSP fue significativamente más corta para los pacientes con un número alto de copias del gen EGFR que no tenían una mutación en EGFR (CRI, 3,85; IC 95 %, 2,09–7,09).
- En un ensayo prospectivo de fase III de Japón, se confirmó que los pacientes de CPCNP con mutaciones en EGFR mejoraron la SSP, pero no la SG cuando recibieron gefitinib. En el ensayo, participaron 230 pacientes de CPCNP metastásico y con mutaciones en EGFR que no habían recibido quimioterapia. Los pacientes se asignaron al azar para recibir gefitinib o carboplatino y paclitaxel.[54]
- En el análisis interino planificado con datos de los primeros 200 pacientes, la SSP fue significativamente más larga en el grupo de gefitinib que en el grupo de quimioterapia estándar (CRIde muerte o progresión de la enfermedad con gefitinib, 0,36; P < 0,001), lo que llegó a la interrupción anticipada del estudio.
- El grupo de gefitinib tuvo una mediana de SSP significativamente más larga (10,8 vs. 5,4 en el grupo de quimioterapia; CRI, 0,30; IC 95 %, 0,22–0,41 P < 0,001).[54][Nivel de evidencia B1] La mediana de SG fue de 30,5 meses en el grupo de gefitinib y de 23,6 meses en el grupo de quimioterapia estándar (P = 0,31).
- En otro ensayo de fase III de Japón, también se confirmó en forma prospectiva que los pacientes de CPCNP con mutaciones en EGFR presentaron una mejoría de la SSP, pero no de la SG cuando recibieron gefitinib. En el segundo ensayo, el West Japanese Oncology Group dirigió un estudio de fase III (WJTOG3405) con 177 pacientes de 75 años o menos con CPCNP en estadio IIIB/IV o recidiva posoperatoria que albergaban mutaciones en EGFR (deleción del exón 19 o la mutación puntual L858R) y que no habían recibido quimioterapia.[55]
- Los pacientes se asignaron al azar para recibir gefitinib o una combinación de cisplatino y docetaxel (administrados cada 21 días por 3 a 6 ciclos). El criterio principal de valoración fue la SSP.
- El grupo de gefitinib tuvo una SSP significativamente más larga que el grupo de cisplatino y docetaxel, con una mediana de SSP de 9,2 meses (IC 95 %, 8,0–13,9) versus 6,3 meses (intervalo, 5,8–7,8; CRI, 0,489; IC 95 %, 0,336–0,710; orden logarítmico P < 0,0001).[55][Nivel de evidencia B1]
Erlotinib
Evidencia (erlotinib):
- En un ensayo aleatorizado sin anonimato de fase III (NCT00874419) realizado en China, 165 pacientes mayores de 18 años con CPCNP en estadio IIIB/IV diagnosticado mediante estudio histológico y con confirmación de expresión de una mutación activadora en EGFR (es decir, deleción del exón 19 o mutación puntual L858R en el exón 21) recibieron erlotinib oral (150 mg/día) hasta que presentaron progresión de la enfermedad o efectos tóxicos inaceptables, o hasta completar 4 ciclos de gemcitabina y carboplatino.[56]
- La mediana de SSP fue significativamente más larga para los pacientes tratados con erlotinib que para los pacientes tratados con quimioterapia (13,1 [IC 95 %, 10,58–16,53] vs. 4,6 meses [intervalo, 4,21–5,42 meses]; CRI, 0,16; IC 95 %, 0,10–0,26; P < 0,0001).[56][Nivel de evidencia B1]
- En un estudio europeo (EURTAC [NCT00446225]), 1227 pacientes con CPCNP avanzado se sometieron a exámenes para detectar mutaciones en EGFR. De estos, 174 pacientes con mutaciones en EGFR se asignaron al azar para recibir erlotinib o quimioterapia con derivados del platino.[57] El criterio principal de valoración fue la SSP.
- En un análisis interino de los primeros 153 pacientes, la SSP en el grupo de quimioterapia fue de 5,2 meses (IC 95 %, 4,5–5,8), comparada con 9,7 meses (IC 95 %, 8,4–12,3) en el grupo del erlotinib (CRI, 0,37; P < 0,0001). La mediana de supervivencia fue de 19,3 meses en los pacientes del grupo de quimioterapia y de 19,5 meses en los pacientes del grupo de erlotinib (CRI, 0,80; P = 0,42).[58][Nivel de evidencia B1]
Afatinib
Evidencia (afatinib):
- En un estudio aleatorizado de fase III sin anonimato (LUX-Lung 3 [NCT00949650]), 345 pacientes de origen asiático (72 %) y blancos (26 %) con CPCNP en estadio IIIB/IV y confirmación de mutaciones en EGFR (es decir, deleción del exón 19, L858R u otras [38 de 345 pacientes presentaban otras mutaciones menos comunes]) fueron evaluados y 340 pacientes recibieron al menos una dosis del medicamento en estudio, 40 mg diarios de afatinib oral, un ITC irreversible del EGFR o receptor del factor de crecimiento epidérmico humano diario o hasta completar máximo de 6 ciclos de cisplatino y pemetrexed como tratamiento de primera línea.[59]
- El criterio principal de valoración fue la SSP. En este estudio, el grupo de afatinib tuvo una SSP significativamente más larga que el grupo de cisplatino y pemetrexed; con una mediana de SSP de 11,1 meses para afatinib y de 6,9 meses para la quimioterapia (CRI, 0,58; IC 95 %, 0,43–0,78; P = 0,001).[59][Nivel de evidencia B1]
- La evaluación de la SG fue un criterio secundario de valoración que se notificó por separado.[60] De manera similar al análisis de la SSP, la SG se estratificó según el tipo de mutación en EGFR y el origen étnico.
- Tras una mediana de seguimiento de 41 meses, la mediana de SG fue de 28,2 meses en los pacientes de ambos grupos (CRI, 0,88; IC 95 %, 0,66–1,17; P = 0,39).
- En los pacientes que albergaban mutaciones en EGFR comunes (es decir, deleción del exón 19 y L858R), la supervivencia no difirió significativamente entre los grupos de tratamiento (CRI 0,78; IC 95 %, 0,58–1,06; P = 0,11). No obstante, en el análisis por subgrupos previsto se demostraron ventajas de supervivencia con afatinib en comparación con la quimioterapia en pacientes de tumores que albergaban la mutación del19 en EGFR (mediana de SG, 33,3 vs. 21,1 meses; CRI, 0,54; IC 95 %, 0,36–0,79; P = 0,0015), pero no se encontraron diferencias significativas entre los grupos de tratamiento de pacientes de tumores que albergaban la mutación L858R (mediana de SG, 27,6 vs. 40,3 meses; CRI, 1,30; IC 95 %, 0,80–2,11; P = 0,29).
- El afatinib de primera línea se relacionó con una ventaja significativa de la supervivencia en comparación con la quimioterapia en pacientes de CPCNP que albergaban mutaciones del19 en EGFR pero no en pacientes que albergaban mutaciones L858R en EGFR, ni en la población general de pacientes con cualquier mutación en EGFR.[60][Nivel de evidencia A1]
- En un estudio aleatorizado de fase III sin anonimato (LUX-Lung 6 [NCT01121393]), 364 pacientes de Asia oriental con CPCNP en estadios IIIB/IV y mutaciones en EGFR confirmadas (es decir, deleción del exón 19, L858R u otras), se asignaron al azar (proporción 2:1) para recibir 40 mg diarios de afatinib, o gemcitabina con cisplatino diarios hasta por 6 ciclos como tratamiento de primera línea.[61]
- El criterio principal de valoración fue la SSP. La mediana de SSP fue significativamente más larga en el grupo de afatinib (11,0 meses, IC 95 %, 9,7–13,7) que en el grupo de gemcitabina con cisplatino (5,6 meses, [intervalo, 5,1–6,7 meses]; CRI, 0,28; IC 95 %, 0,20–0,39; P < 0,0001).[61][Nivel de evidencia B1]
- La evaluación de la SG fue un criterio secundario de valoración que se notificó por separado.[60] De manera similar al análisis de la SSP, la SG se estratificó según el tipo de mutación en EGFR y el origen étnico.
- Tras una mediana de seguimiento de 33 meses, la mediana de SG fue de 23,1 meses en los pacientes del grupo afatinib y 23,5 meses en los pacientes del grupo de quimioterapia (CRI, 0,93; IC 95 %, 0,72–1,22; P = 0,61).
- En los pacientes que albergaban mutaciones en EGFR comunes (es decir, deleción del exón 19 y L858R), la supervivencia no difirió significativamente entre los grupos de tratamiento (CRI 0,83; IC 95 %, 0,62–1,09; P = 0,18). No obstante, en el análisis por subgrupos previsto se demostraron ventajas de supervivencia con afatinib en comparación con la quimioterapia en pacientes con tumores que albergaban la mutación del19 en EGFR (mediana de SG, 31,4 vs. 18,4 meses; CRI, 0,64; IC 95 %, 0,44-0,94; P = 0,023), pero no se encontraron diferencias significativas entre los grupos de tratamiento de pacientes con tumores que albergaban la mutación L858R (mediana de SG, 19,6 vs. 24,3 meses; CRI, 1,22; IC 95 %, 0,81-1,83; P = 0,34).
- El afatinib de primera línea se relacionó con una ventaja significativa de la supervivencia en comparación con la quimioterapia en pacientes con CPCNP que albergaban mutaciones del19 en EGFR pero no en pacientes que albergaban mutaciones L858R en EGFR, ni en la población general de pacientes con cualquier mutación en EGFR.[60][Nivel de evidencia A1]
Terapia dirigida a EGFR (para pacientes con mutaciones de inserción del exón 20 en EGFR)
Amivantamab
El amivantamab ya se ha aprobado para pacientes con CPCNP metastásico o localmente avanzado que alberga mutaciones de inserción del exón 20 en EGFR y cuya enfermedad ha progresado durante el tratamiento de quimioterapia con derivados del platino o después de esta.
Evidencia (amivantamab y quimioterapia):
- En el ensayo de fase III aleatorizado PAPILLON (NCT04538664) se comparó amivantamab y quimioterapia con quimioterapia sola como tratamiento de primera línea para pacientes con CPCNP avanzado e inserciones del exón 20 en EGFR. A los pacientes del grupo de quimioterapia sola que presentaron progresión de la enfermedad se les permitió abandonar el grupo y recibir amivantamab en monoterapia. En total 308 pacientes se asignaron al azar en una proporción 1:1 para recibir amivantamab con carboplatino y pemetrexed, o carboplatino y pemetrexed. El criterio principal de valoración fue la SSP mediante una revisión central independiente con enmascaramiento. La mediana de seguimiento fue de 14,9 meses.[62][Nivel de evidencia B1]
- Al cabo de 18 meses, la tasa de SSP fue del 31 % en los pacientes que recibieron amivantamab y quimioterapia, y del 3 % en los pacientes que recibieron quimioterapia sola.
- La tasa de respuesta objetiva fue superior en el grupo de amivantamab y quimioterapia (73 %) que en grupo de quimioterapia sola (47 %).
- En un análisis de SG interino, no se observó diferencia estadísticamente significativa.
- Los efectos adversos más frecuentes con amivantamab y quimioterapia fueron toxicidad hematológica, exantema y paroniquia. El 42 % de los pacientes presentó reacciones a la infusión.
En el estudio se demostró que amivantamab y quimioterapia es una opción de tratamiento de primera línea eficaz para pacientes con CPCNP e inserciones del exón 20 en EGFR a partir de una SSP superior en comparación con la quimioterapia sola.[62]
Inhibidores de ALK (para pacientes con translocaciones de ALK)
Alectinib
Evidencia (alectinib):
- En un estudio aleatorizado sin anonimato de fase III (ensayo ALEX [NCT02075840]), 303 pacientes de CPCNP con reordenamiento de ALK sin tratamiento previo, recibieron alectinib (600 mg 2 veces por día) o crizotinib (250 mg 2 veces por día).[63] El criterio principal de valoración fue la SSP evaluada por el investigador.
- La tasa de SSP fue significativamente más alta con alectinib que crizotinib; la tasa de supervivencia sin complicaciones a 12 meses fue del 68,4 % para el grupo de alectinib (IC 95 %, 61,0–75,9 %) en comparación con el 48,7 % para el grupo de crizotinib (IC 95 %, 40,4–56,9 %) (CRI, 0,47; IC 95 %, 0,34–0,65; P < 0,001). La mediana de SSP no se alcanzó con alectinib. Los resultados de la SSP evaluada por un comité de revisión independiente fueron congruentes.[63][Nivel de evidencia B1]
- La progresión en el SNC fue menos frecuente con alectinib (12 %) que crizotinib (45 %) (CRI, 0,16; IC 95 %, 0,10–0,28; P <0,001).
- La tasa de respuesta fue similar en ambos grupos, el 82,9 % para el grupo de alectinib en comparación con el 75,5 % para el grupo de crizotinib (P = 0,09).
- Los efectos adversos de grado 3 a 5 fueron menos comunes con alectinib (41 %) que crizotinib (50 %).
- En otro ensayo aleatorizado sin anonimato de fase III (J-ALEX) participaron 207 pacientes japoneses de CPCNP con expresión de ALK, que no habían recibido inhibidores de ALK ni quimioterapia o que solo habían recibido un régimen de quimioterapia. Los pacientes fueron asignados al azar en una proporción de 1:1 para recibir alectinib (300 mg 2 veces por día, dosis aprobada en Japón, menor que la dosis de 600 mg 2 veces por día aprobada en otras partes) versus crizotinib (250 mg 2 veces por día).[64] El criterio principal de valoración fue la SSP evaluada por un comité de revisión independiente.
- En el momento límite para la inclusión de datos en el análisis interino secundario, el comité de supervisión independiente de datos determinó que el criterio principal de valoración se cumplió (CRI, 0,34; IC 99,7 %, 0,17–0,71; P <0,0001) y recomendó la divulgación inmediata de los datos. La mediana de SSP no se alcanzó con el alectinib, pero se alcanzó a los 10,2 meses de tratamiento con crizotinib.
- Los efectos adversos de grado 3 o 4 se presentaron con menor frecuencia en el grupo de alectinib (tasa de incidencia del 26 %) que de crizotinib (tasa de incidencia del 52 %).
Lorlatinib
Evidencia (lorlatinib):
- En el ensayo de fase III CROWN (NCT03052608), se inscribieron pacientes de CPCNP con reordenamientos de ALK quienes no habían recibido terapia sistémica previa para la enfermedad metastásica. En el ensayo, se asignaron al azar 296 pacientes para recibir lorlatinib (100 mg diarios) o crizotinib (250 mg dos veces al día). El criterio principal de valoración fue la SSP según se determinó mediante revisión central independiente con enmascaramiento.[65][Nivel de evidencia B1]
- Se llevó a cabo un análisis interino previsto después de que ocurrieran cerca del 75 % de los eventos que se esperaban de la progresión de la enfermedad o el fallecimiento. El porcentaje de pacientes vivos sin progresión a los 12 meses fue cerca del 78 % (IC 95 %, 70–84 %) en el grupo de lorlatinib y del 39 % (IC 95%, 30–48 %) en el grupo de crizotinib. Se presentaron respuestas objetivas en el 76 % de los pacientes que recibieron lorlatinib y en el 58 % de los pacientes que recibieron crizotinib.
- En un análisis posterior se observó una mejora de la SSP en el grupo de lorlatinib, en comparación con el grupo de crizotinib en pacientes con metástasis encefálica y sin esta al inicio del estudio (tasas de SSP a 12 meses: 78 vs. 22 % y 78 vs. 45 %, respectivamente).[66]
- Hubo una incidencia acumulativa a 12 meses de progresión en el SNC más baja con lorlatinib, en comparación con crizotinib en pacientes con metástasis encefálicas al inicio del estudio (7 vs. 72 %) y sin estas (1 vs. 18 %).
- Se relacionó el lorlatinib con más efectos adversos de grados 3 a 4 que el crizotinib (72 vs. 56 %), el más común fue alteraciones en las concentraciones de lípidos. Se suspendió el tratamiento en el 7 % de los pacientes que recibieron lorlatinib y en el 9 % de los que recibieron crizotinib.[65]
- Con los datos de inocuidad actualizados en el análisis posterior se observó que el 35 % de los pacientes tuvo eventos adversos en el SNC con lorlatinib, en su mayoría con gravedad de grado 1. Estos incluyeron alteración de la memoria y efectos sobre el estado de ánimo, como ansiedad, depresión e inestabilidad. La presencia de efectos adversos en el SNC no produjo una diferencia clínicamente significativa en la calidad de vida notificada por los pacientes. En el momento del análisis, el 56 % de los efectos adversos en el SNC se habían resuelto (33 % sin intervención; 17 % con modificación de la dosis de lorlatinib) y el 38 % no se habían resuelto. La modificación de la dosis de lorlatinib no tuvo un efecto importante sobre la SSP.
La FDA aprobó el uso de lorlatinib en pacientes con CPCNP metastásico cuyos tumores son positivos para ALK; esto último detectado mediante una prueba autorizada por la FDA.
Crizotinib
Evidencia (crizotinib):
- En un estudio aleatorizado sin anonimato de fase III, 343 pacientes de CPCNP en estadios IIIB/IV que albergaban translocaciones de ALK recibieron 250 mg de crizotinib oral 2 veces por día o la combinación de pemetrexed con cisplatino o carboplatino hasta por 6 ciclos.[67] En el momento de la progresión de la enfermedad, se permitió que los pacientes del grupo de quimioterapia pasaran al grupo de crizotinib; el 60 % de los pacientes del grupo de quimioterapia después recibieron crizotinib. El criterio principal de valoración de este estudio fue la SSP.
- En el estudio se alcanzó el criterio principal de valoración y se demostró que el crizotinib es superior a la quimioterapia para prolongar la SSP (mediana, 10,9 vs. 7,0 meses; CRI, 0,454; IC 95 %, 0,346–0,596; P < 0,0001).[68][Nivel de evidencia B1]
Ceritinib
Evidencia (ceritinib):
- En un estudio aleatorizado sin anonimato de fase III, 376 pacientes de CPCNP y no escamosas en estadio IIIB/IV con reordenamiento de ALK, recibieron 750 mg diarios de ceritinib oral o quimioterapia con derivados del platino (cisplatino o carboplatino con pemetrexed) cada 3 semanas durante 4 ciclos, seguidos de mantenimiento con pemetrexed.[69] El criterio principal de valoración fue la SSP y se permitió que los pacientes pasaran del grupo de quimioterapia al grupo de ceritinib en el momento de una progresión documentada.
- La mediana de SSP, evaluada mediante una revisión independiente enmascarada, fue de 16,6 meses en el grupo de ceritinib y de 8,1 meses en el grupo de quimioterapia (CRI, 0,55; IC 95 %, 0,42–0,73; P < 0,00001).
- La mediana de SG no se alcanzó en el grupo de ceritinib y fue de 26,2 meses en el grupo de quimioterapia (CRI, 0,73; IC 95 %, 0,50–1,08; P = 0,056).[69][Nivel de evidencia B1]
Brigatinib
Evidencia (brigatinib):
- En un ensayo sin anonimato de fase II (NCT02094573), se inscribió a 222 pacientes de CPCNP localmente avanzado o metastásico con translocación de ALK cuya enfermedad progresó después del tratamiento con crizotinib. Los pacientes se asignaron al azar para recibir 90 mg diarios (n = 112; 109 tratados) o 180 mg diarios con un período de 7 días de preinclusión de 90 mg diarios (n = 110).[70]
- El criterio principal de valoración evaluado por los investigadores fue la tasa de respuesta objetiva. Esta fue del 45 % (IC 97,5 %, 34–56 %) para los pacientes que recibieron dosis de 90 mg y del 54 % (IC 97,5 %, 43–65 %) para los pacientes que recibieron dosis de 180 mg.
- La mediana de SSP fue de 9,2 meses (IC 95 %, 7,4–15,6) para los pacientes que recibieron dosis de 90 mg y de 12,9 meses (IC 95 %, 11,1–no alcanzada) para los pacientes que recibieron dosis de 180 mg.
- En el momento límite para la inclusión de datos, la mediana de DR fue de 13,8 meses (IC 95 %, 5,6–13,8) para los pacientes que recibieron dosis de 90 mg y de 11,1 meses (IC 95 %) 9,2–13,8) para los pacientes que recibieron dosis de 180 mg.[70][Nivel de evidencia B3]
- La tasa de respuesta objetiva en el SNC en pacientes con lesiones cuantificables en el SNC fue del 42 % para los pacientes que recibieron dosis de 90 mg diarios (n = 26) y del 67 % para los pacientes que recibieron dosis de 180 mg diarios (n = 18).
- Los efectos adversos comunes, que en su mayoría fueron de grado 1 o 2, se presentaron en entre el 27 % y el 38 % de los pacientes que recibieron la dosis más alta y fueron náuseas, diarrea, cefalea y tos. Un subconjunto de efectos pulmonares adversos de inicio temprano (mediana de inicio, día 2) se presentaron en 14 de 219 pacientes tratados (todos los grados, un 6 %; grado ≥3, un 3 %); ninguno se presentó después del aumento escalonado de la dosis a 180 mg. Estos efectos fueron disnea, hipoxia, tos, neumonía o neumonitis. Se trataron mediante la interrupción de la dosis. De los 14 pacientes, 7 se volvieron a tratar con éxito con brigatinib.
- La FDA aprobó la dosis de brigatinib de 90 mg diarios durante 7 días y, si se tolera la dosis, se aumenta a 180 mg diarios.
Inhibidores de BRAF V600E y MEK (para pacientes con mutaciones BRAF V600E)
Las mutaciones BRAF V600E se presentan en entre el 1 % y el 2 % de los adenocarcinomas de pulmón.
Dabrafenib y trametinib
Evidencia (dabrafenib y trametinib):
- En un estudio multicéntrico de fase II (NCT01336634), sin aleatorización ni enmascaramiento, 36 pacientes de CPCNP metastásico sin tratamiento previo que obtuvieron resultados positivos para mutaciones BRAF V600E se trataron con dabrafenib (inhibidor de BRAF) 150 mg 2 veces por día y trametinib (inhibidor de MEK) 2 mg por día.[71] Las mutaciones BRAF V600E se identificaron mediante el Oncomine Dx Target Test (ThermoFisher Scientific). El criterio principal de valoración fue la respuesta general evaluada por el investigador.
- La tasa de respuesta general fue del 64 % (IC 95 %, 46–79 %). De los pacientes, el 6 % tuvieron una respuesta completa y el 58 % una respuesta parcial.
- La mediana de SSP evaluada por el investigador fue de 10,9 meses (IC 95 %, 7,0–16,6). La mediana calculada del tiempo de DR fue de 10,4 meses (IC 95 %, 8,3–17,9). En el momento límite para la inclusión de datos, el 47 % había muerto, y la mediana de SG fue de 24,6 meses (IC 95 %, 12,3–no estimable).
- De los pacientes, el 69 % presentaron por lo menos un efecto adverso de grados 3 o 4; los más comunes fueron fiebre, aumento de la ALT, hipertensión o vómito. Los efectos adversos llevaron al abandono permanente del medicamento en el 22 % de los pacientes, interrupción transitoria o retraso del tratamiento en el 75 % de los pacientes, y disminución de la dosis en el 39 % de los pacientes.[71][Nivel de evidencia C3]
La FDA aprobó la combinación de dabrafenib y trametinib para el tratamiento de pacientes con CPCNP cuyos tumores albergan mutaciones BRAF V600E detectadas mediante una prueba autorizada por la FDA.
Inhibidores de ROS1 (para pacientes con reordenamientos de ROS1)
Los reordenamientos de ROS1 se presentan en cerca del 1 % de los pacientes con CPCNP.[72] La FDA aprobó el uso de crizotinib y entrectinib en pacientes de CPCNP y reordenamientos de ROS1; entrectinib tiene mayor actividad contra la enfermedad intracraneal.
Entrectinib
La FDA aprobó el entrectinib para el tratamiento de pacientes de CPCNP metastásico con tumores positivos para ROS1, con independencia del número de terapias sistémicas previas.
Evidencia (entrectinib):
- La seguridad y la actividad clínica del entrectinib para tratar el CPCNP metastásico positivo para una fusión de ROS1 se determinó mediante el análisis integrado de 3 ensayos clínicos multicéntricos, de un solo grupo, sin enmascaramiento (ALKA-372-001/EudraCT, 2012-000148-88, STARTRK-1 [NCT02097810] y STARTRK-2 [NCT02568267]).[73] El entrectinib se administró por vía oral en una dosis de al menos 600 mg una vez por día. Los criterios principales de valoración fueron la tasa de respuesta objetiva y la DR, que se determinaron mediante revisión central independiente con enmascaramiento. Cabe destacar, que los criterios de valoración de tiempo transcurrido hasta el episodio son difíciles de interpretar cuando no se cuenta con un grupo control. La evaluación de muestras tumorales para la fusión génica de ROS1 se hizo de forma prospectiva en laboratorios locales utilizando pruebas de FISH o una prueba de laboratorio de secuenciación de última generación (NGS).
De los pacientes, 17 (32 %) no habían recibido terapia sistémica previa, 23 (43 %) habían recibido una terapia previa y 13 (25 %) habían recibido dos o más líneas de tratamiento. En la valoración inicial, 23 (43 %) pacientes presentaban enfermedad del SNC. Entre los pacientes, 31 (59 %) nunca habían fumado y 52 (98 %) presentaban características histológicas de adenocarcinoma.
- La tasa de respuesta objetiva en 53 pacientes evaluables por eficacia fue del 77 % (IC 95 %, 64−88 %). Entre ellos, el 6 % presentaron una respuesta completa y el 72 % tuvieron una respuesta parcial. En los pacientes con enfermedad del SNC al inicio del estudio, la tasa de respuesta objetiva fue del 74 % (IC 95 %, 52−90 %) y todos los pacientes tuvieron una respuesta parcial. En los pacientes sin enfermedad del SNC al inicio del estudio, la tasa de respuesta general fue del 80 % (IC 95 %, 61−92 %) (10 % tuvieron respuesta completa y 70 % tuvieron respuesta parcial).[73][Nivel de evidencia C3]
- La mediana de DR fue de 24,6 meses (IC 95 %, 11,4−34,8) en los pacientes evaluables por eficacia; 12,6 meses (IC 95 %, 6,5−no estimable) en los pacientes con enfermedad del SNC al inicio del estudio, y de 24,6 meses (IC 95 %, 11,4−34,8) en aquellos sin enfermedad del SNC al inicio del estudio.
- Se evaluaron los efectos adversos relacionados con el tratamiento en 134 pacientes de la población evaluable por inocuidad. Se observaron efectos adversos relacionados con el tratamiento de grado 1 o 2 en 79 (59 %) pacientes y efectos adversos relacionados con el tratamiento de grado 3 o 4 en 46 (34 %) pacientes. Además, 15 (11 %) pacientes presentaron efectos adversos relacionados con el tratamiento graves. No hubo muertes relacionadas con el tratamiento.
- La mediana de SSP fue de 19 meses (IC 95 %, 12,2−36,6) en los pacientes evaluables por eficacia; 13,6 meses (IC 95 %, 4,5−no estimable) en los pacientes con enfermedad del SNC al inicio del estudio, y 26,3 meses (IC 95 %, 15,7−36,6) en aquellos sin enfermedad del SNC al inicio del estudio.
Crizotinib
El crizotinib se aprobó para pacientes de CPCNP metastásico cuyos tumores expresan ROS1 con independencia del número de tratamientos sistémicos recibidos antes.
Evidencia (crizotinib):
- En una ampliación de una cohorte de un estudio de fase I de crizotinib, 50 pacientes de CPCNP en estadio avanzado que exhibían reordenamientos de ROS1 se trataron con 250 mg de crizotinib oral 2 veces por día.[74] Los reordenamientos de ROS1 se identificaron mediante FISH con sondas de separación o un ensayo de reacción en cadena de la polimerasa con retrotranscripción. Siete pacientes (14 %) no se habían tratado para la enfermedad en estadio avanzado, 21 pacientes (42 %) se habían sometido a un tratamiento y 22 pacientes (44 %) se habían sometido a más de un tratamiento. El criterio principal de valoración fue la tasa de respuesta.
- La tasa general de respuesta fue del 72 % (IC 95 %, 58–84 %). Del total de pacientes, el 6 % presentó una respuesta completa, el 66 % presentó una respuesta parcial y el 18 % presentó enfermedad estable, como su mejor respuesta.
- La mediana de SSP fue de 19,2 meses (IC 95 %, 14,4–no alcanzada). Se calculó una mediana de DR de 17,6 meses (IC 95 %, 14,5‒no alcanzada).[74][Nivel de evidencia C3]
- En un ensayo sin anonimato de fase II de un solo grupo, 127 pacientes de Asia oriental de CPCNP con expresión de ROS1 se trataron con 250 mg de crizotinib 2 veces por día.[75] En este ensayo, 24 pacientes (18,9%) no se habían tratado para la enfermedad en estadio avanzado, 53 pacientes (41,7%) habían recibido un tratamiento previo y 50 pacientes (39%) habían recibido 2 o 3 tratamientos previos. El criterio principal de valoración fue la tasa de respuesta objetiva evaluada por revisión independiente.
- La tasa de respuesta objetiva fue del 71,7 % (IC 95 %, 63,0–79,3 %). Las tasas de respuesta fueron similares, sin importar el número de tratamientos previos. Del total de pacientes, el 13,4 % presentó una respuesta completa, el 58,3 % presentó una respuesta parcial y el 16,5 % presentó una enfermedad estable, como su mejor respuesta.[75][Nivel de evidencia C3]
- La mediana de SSP fue de 15,9 meses (IC 95 %, 12,9–24). La DR fue de 19,7 meses (IC 95 %, 14,1‒no alcanzada).
- La SG fue de 32,5 meses (IC 95 %, 32,5–no alcanzada).
Inhibidores del receptor de la tirosina–cinasa neurotrófica (para pacientes con fusiones de NTRK)
Las fusiones génicas somáticas de NTRK se presentan en un grupo amplio de tumores sólidos, incluso en menos del 0,5 % de los tumores del CPCNP.[76,77] Estas fusiones ocurren más a menudo en pacientes no fumadores que tienen adenocarcinoma de pulmón.
Larotrectinib
Evidencia (larotrectinib):
- El larotrectinib se estudió en tres protocolos: en un estudio de fase I con adultos, un estudio de fase I/II con niños y un estudio de fase II con adolescentes y adultos.[78] En los tumores se confirmó la presencia de fusiones usando FISH o NGS. En el análisis combinado, el criterio principal de valoración fue la tasa de respuesta objetiva evaluada por revisión independiente y participación de reguladores con el objetivo de excluir el límite más bajo de menos del 30 % de tasa de respuesta. Participaron en total 55 pacientes con mediana de edad de 45 años (intervalo, 4 a 76 años), que tenían 17 tipos de tumores con expresión de diferentes fusiones de NTRK. Todos los pacientes presentaban enfermedad metastásica (82 %) o enfermedad avanzada irresecable local (18 %). Los participantes habían recibido una mediana de dos tratamientos sistémicos previos.
- La tasa de respuesta objetiva fue del 75 % (IC 95 %, 61‒75 %) y del 73 % de las respuestas duraron por lo menos 6 meses.[78][Nivel de evidencia C3]
- El tratamiento se toleró bien y el 93 % de los efectos adversos fueron de grado 1 a 2; los efectos adversos de grado 3 o 4 más comunes fueron anemia (11 % de los pacientes), transaminitis (7 %) y neutropenia (7 %).
La FDA aprobó el larotrectinib para el tratamiento de pacientes con tumores localmente avanzados o metastásicos que albergan una fusión génica de NTRK, pero que no adquirieron ninguna mutación que genere resistencia, no cuentan con alternativas de tratamiento que sean satisfactorias o cuyo cáncer progresó después del tratamiento.
Entrectinib
La FDA otorgó la aprobación acelerada al entrectinib para el tratamiento de tumores sólidos que exhiben una fusión génica de NTRK sin una mutación de resistencia adquirida conocida, que además son metastásicos, progresaron después del tratamiento, no cuentan con una terapia alternativa, o para los casos en que una resección quirúrgica es probable que produzca complicaciones graves.
Evidencia (entrectinib):
- La inocuidad y la actividad clínica del entrectinib en pacientes que no habían recibido previamente inhibidores de NTRK, con tumores sólidos metastásicos o localmente avanzados (incluso CPCNP) que exhibían las fusiones génicas de NTRK1, NTRK2 o NTRK3 se determinó mediante análisis integrado de 3 ensayos clínicos de fase temprana, multicéntricos, de un solo grupo y sin enmascaramiento (ALKA-372-001/EudraCT, 2012-000148-88, STARTRK-1 [NCT02097810] y STARTRK-2 [NCT02568267]).[79] El tratamiento abarcó entrectinib que se administró por vía oral en una dosis de al menos 600 mg una vez por día. Los criterios principales de valoración fueron la tasa de respuesta objetiva y la mediana de DR, que se determinaron mediante revisión central independiente con enmascaramiento. Cabe destacar, que los criterios de valoración de tiempo transcurrido hasta el episodio son difíciles de interpretar cuando no se cuenta con un grupo control. La identificación de estados positivos para la fusión génica de NTRK se hizo de forma prospectiva en laboratorios locales o en un laboratorio central utilizando diferentes pruebas a base de ácidos nucleicos.
De 54 pacientes en la población evaluable por eficacia positiva para la fusión génica de NTRK, 20 (37 %) no habían recibido terapia sistémica previa, 11 (20 %) habían recibido 1 terapia sistémica previa y 23 (43 %) habían recibido 2 o más terapias sistémicas previas. Entre ellos, 12 (22 %) pacientes presentaban enfermedad del SNC al inicio del estudio y 10 (19 %) pacientes tenían CPCNP. De los 54 pacientes, 52 (96 %) tenían una fusión génica de NTRK detectada mediante NGS y 2 (4 %) tenían una fusión génica de NTRK detectada mediante otras pruebas de ácidos nucleicos.
- La tasa de respuesta objetiva en 54 pacientes fue del 57 % (IC 95 %, 43,2−70,8 %). Entre ellos, el 7 % presentaron una respuesta completa y el 50 % tuvieron una respuesta parcial. Entre los pacientes con enfermedad del SNC al inicio del estudio, el 50 % alcanzaron una respuesta (todas respuestas parciales), mientras que entre los pacientes sin enfermedad del SNC al inicio, el 60 % alcanzaron una respuesta (10 % respuesta completa; el 50 % respuesta parcial).[79][Nivel de evidencia C3]
- La mediana de DR en pacientes evaluables por eficacia fue de 10,4 meses (IC 95 %, 7,1−no estimable). En los pacientes con enfermedad del SNC al inicio del estudio la DR no fue estimable y en los pacientes sin enfermedad del SNC al inicio fue de 12,9 meses (IC 95 %, 7,1−no estimable).
- En los 10 pacientes con CPCNP, la tasa de respuesta fue del 70 % (IC 95 %, 35−93 %) y la DR osciló entre 1,9 y 20,1 meses. Para obtener más información en inglés, consultar prescribing information.
- La población evaluable por inocuidad consistió en 68 pacientes con tumores positivos para la fusión de NTRK. La mayoría de los efectos adversos relacionados con el tratamiento fueron de grado 1 o 2 y fueron reversibles. Los efectos adversos relacionados con el tratamiento de grado 3 o 4 más frecuentes fueron aumento de peso (10 %) y anemia (12 %). Se notificaron efectos adversos relacionados con el tratamiento graves en 7 (10 %) pacientes. Debido a los efectos adversos relacionados con el tratamiento, 3 pacientes tuvieron interrupciones de la dosis y 27 (40 %) pacientes tuvieron reducciones de la dosis. No hubo muertes relacionadas con el tratamiento.
- La mediana de SSP fue de 11,2 meses (IC 95 %, 8,0−14,9). En pacientes que presentaban enfermedad del SNC al inicio del estudio, la mediana de SSP fue de 7,7 meses (IC 95 %, 4,7−no estimable), y en los pacientes sin enfermedad del SNC al inicio del estudio, fue de 12 meses (IC 95 %, 8,7−15,7).
Inhibidores de RET (para pacientes con fusiones de RET)
Las fusiones somáticas de RET ocurren en el 1 % al 2 % de los pacientes con CPCNP y en pacientes con cáncer de tiroides.[80]
Selpercatinib
Evidencia (selpercatinib):
- En un estudio de fase I/II (LIBRETTO-001 [NCT03157128]), se inscribieron pacientes con tumores sólidos positivos para fusiones de RET. La fusión de RET se determinó con una prueba molecular local (NGS, FISH o un ensayo de reacción en cadena de la polimerasa) sin confirmación central. El criterio principal de valoración fue la respuesta objetiva.[81][Nivel de evidencia C3]
- Se hizo un análisis actualizado en 316 pacientes con CPCNP positivos para la fusión de RET.[81]
- Entre los 69 pacientes que nunca había recibido tratamiento, la tasa de respuesta objetiva fue del 84 % (IC 95 %, 73–92 %) y el 6 % de los pacientes alcanzaron respuestas completas. La mediana de DR fue de 20,2 meses (IC 95 %, 13,0–no se pudo evaluar); el 40 % de las respuestas persistían en el momento del cierre de la base de datos (mediana de seguimiento, 20,3 meses). La mediana de SSP fue de 22,0 meses; el 35 % de los pacientes estaban vivos y sin progresión de la enfermedad en el momento del cierre de la base de datos (mediana de seguimiento, 21,9 meses).
- De los 247 pacientes que habían recibido quimioterapia con derivados del platino en el pasado, la tasa de respuesta objetiva fue del 61 % (IC 95 %, 55–67 %) y el 7 % alcanzó respuestas completas. La mediana de DR fue de 28,6 meses (IC 95 %, 20,4–no se pudo evaluar); el 49 % de las respuestas persistían (mediana de seguimiento, 21,2 meses). La mediana de SSP fue de 24,9 meses; el 38 % de los pacientes estaban vivos y sin progresión en el momento del cierre de la base de datos (mediana de seguimiento, 24,7 meses).
- De 26 pacientes con metástasis en el SNC cuantificable mediante un comité revisor independiente, la tasa de respuesta objetiva intracraneal fue del 85 % (IC 95 %, 65–96 %) y el 27 % presentó respuestas completas.
- En la población total del análisis de inocuidad (n = 796), la mediana de duración de tratamiento fue de 36,1 meses.
- No hubo cambios significativos en el perfil de inocuidad. La mayoría de los efectos adversos fueron de grado 1 a 2. Los más comunes fueron edema, diarrea, fatiga, xerostomía, hipertensión, aumento de ALT y de aspartato–aminotransferasa (AST), y exantema.
La FDA aprobó el uso de selpercatinib para el tratamiento de adultos con CPCNP localmente avanzado o metastásico con fusión del gen RET detectada mediante una prueba autorizada por la FDA.
Pralsetinib
Evidencia (pralsetinib):
- En un estudio de fase I/II (ARROW [NCT03037385]) se inscribieron pacientes con tumores sólidos positivos para fusiones de RET. De los pacientes, 233 tuvieron CPCNP positivo para la fusión de RET. El estado de fusión de RET se determinó mediante una prueba molecular local del tumor o del ácido nucleico tumoral circulante (ADNtc) en sangre, sin confirmación central. El criterio principal de valoración
fue la respuesta objetiva.[82][Nivel de evidencia C3]
- De estos pacientes, 92 que recibieron quimioterapia a base de derivados del platino y 29 que no habían recibido ningún tratamiento (además de no ser candidatos para el tratamiento estándar con derivados del platino) recibieron pralsetinib antes de la fecha límite de inscripción para la eficacia (11 de julio de 2019). La cohorte de eficacia estuvo formada por 87 pacientes que recibieron tratamiento previo y 27 pacientes que no habían recibido tratamiento ya que tenían enfermedad medible según la validación central inicial.
- La tasa de respuesta general fue del 61 % (IC 95 %, 50 %–71 %) para los 87 pacientes que recibieron quimioterapia a base de derivados del platino, incluso el 6 % de respuestas completas. No se alcanzó la mediana de DR (15,2 meses–no estimable).
- La tasa de respuesta general fue del 70 % (IC 95 %, 50 %–86 %) para los 27 pacientes que no recibieron tratamiento previo, incluso el 11 % de respuestas completas. La mediana de DR fue de 9,0 meses (6,3–no estimable).
- En la cohorte de seguridad de 233 pacientes, el 93 % presentó efectos adversos relacionados con el tratamiento, incluso el 48 % de grado 3 o peor. Los efectos adversos de grado 3 o peor relacionados con el tratamiento más comunes fueron neutropenia (18 %), hipertensión (11 %) y anemia (10 %). Se redujeron las dosis en el 38 % de los pacientes y el 6 % interrumpieron el tratamiento debido a los efectos adversos.
Inhibidores de MET (para pacientes con mutaciones de omisión del exón 14 de MET)
La desregulación del protooncogén MET, que resulta de la alteración de los distintos sitios de empalme, conduce a la pérdida del exón 14 de MET y a un aumento de la señalización de MET. Estas alteraciones en MET promueven la proliferación, supervivencia, invasión y metástasis de tumores y se presentan en el 3 al 4 % de los pacientes de CPCNP.[83]
Tepotinib
Evidencia (tepotinib):
- En un estudio sin anonimato de fase II (VISION [NCT02864992]), participaron pacientes con mutaciones de omisión del exón 14 de MET. Se inscribieron en el ensayo 152 pacientes que recibieron tepotinib (500 mg por vía oral una vez al día). El estado de MET se determinó de forma central, mediante biopsia líquida (obtención de DNA que circula libre en el plasma; n = 66) o mediante biopsia de tejido (n = 60). Ambos métodos produjeron resultados positivos en 27 pacientes. El criterio principal de valoración fue la respuesta objetiva.[84][Nivel de evidencia C3]
- Entre los 99 pacientes a quienes se les dio seguimiento durante por lo menos 9 meses (es decir, la población de eficacia), la tasa de respuesta objetiva según se evaluó mediante revisión independiente fue del 46 % (IC 95 %, 36–57 %), con una mediana de DR de 11,1 meses (IC 95 %, 7,2–no estimable). Las tasas de respuesta fueron similares en los grupos de biopsia líquida y biopsia de tejido.
- Las respuestas fueron similares con independencia del estado de terapia previa.
- Se presentaron efectos adversos de grado 3 o mayor en el 28 % de los pacientes, estos incluyeron edema periférico en el 7 % de los pacientes. Los efectos adversos condujeron a la interrupción del tratamiento en el 11 % de los pacientes.
Capmatinib
Evidencia (capmatinib):
- En un estudio de fase II (GEOMETRY [NCT02414139]), se evaluó el capmatinib (400 mg por vía oral dos veces al día) en pacientes con mutaciones de omisión del exón 14 de MET o amplificación de MET. El estado de MET se determinó a nivel central. Se inscribió un total de 364 pacientes. El criterio principal de valoración fue la respuesta global.[85][Nivel de evidencia C3]
- Entre los 69 pacientes con mutaciones de omisión del exón 14 de MET que recibieron 1 o 2 líneas de terapia previa, la tasa de respuesta objetiva fue del 41 % (IC 95 %, 29–53 %). La mediana de DR fue de 9,7 meses (IC 95 %, 5,6–13,0).
- Entre los 28 pacientes con mutaciones de omisión del exón 14 de MET que no habían recibido ningún tratamiento antes, la tasa de respuesta objetiva fue del 68 % (IC 95 %, 48–84 %). La mediana de DR fue de 12,6 meses (IC 95 %, 5,6–no estimable).
- Las tasas de respuesta en los pacientes con amplificación de MET sin la omisión del exón 14 no alcanzaron el umbral preespecificado para la actividad clínica relevante.
- Se presentaron efectos adversos de grado 3 a 4 en un 67 % de los pacientes. Los eventos más comunes, con independencia de la causalidad, fueron edema periférico, náusea, vómito y aumento de la creatinina. Los efectos adversos condujeron a la interrupción de la terapia en el 11 % de los pacientes.
Inhibidores de puntos de control inmunitario con quimioterapia o sin esta
El pembrolizumab es un anticuerpo monoclonal humanizado que inhibe la interacción entre el punto de control inmunitario coinhibitorio de la proteína de muerte programada (PD-1) (que se expresa en las células tumorales y en las células inmunitarias infiltrantes) y sus ligandos, PD-L1 y PD-L2.[86]
Pembrolizumab con quimioterapia
Evidencia (pembrolizumab con quimioterapia):
- En un ensayo con enmascaramiento doble de fase III (KEYNOTE-189 [NCT02578680]) se asignó al azar en una proporción de 2:1 a 616 pacientes de CPCNP y no escamosas metastásico sin mutaciones sensibilizantes en EGFR ni reordenamientos de ALK que no se habían sometido a tratamiento previo para la enfermedad metastásica. Los pacientes recibieron pemetrexed y un fármaco derivado del platino con 200 mg de pembrolizumab o placebo cada 3 semanas durante 4 ciclos, seguidos de pembrolizumab o placebo hasta por 35 ciclos, acompañado de mantenimiento con pemetrexed.[1] Se permitió el cruce al grupo de monoterapia con pembrolizumab después de comprobar una progresión de la enfermedad en los pacientes del grupo de combinación con placebo. Los criterios principales de valoración fueron la SG y SSP evaluadas por un comité independiente que hizo una revisión radiológica central enmascarada.
- En el análisis actualizado a 5 años, la mediana de tiempo desde la aleatorización hasta el cierre de la base de datos fue de 64,6 meses (intervalo, 60,1–72,4).[87]
- Después de 5 años, el pembrolizumab con pemetrexed y un fármaco derivado del platino se relacionó con una mejora en la SG y en la SSP, en comparación con el placebo con pemetrexed y un fármaco derivado del platino en pacientes con CPCNP no escamosas metastásico, con independencia de la expresión de PD-L1. En la población por intención de tratar, las tasas de SG a 5 años fueron del 19,4 % en el grupo de pembrolizumab con pemetrexed y un fármaco deriv % en el grupo de placebo con pemetrexed y un fármaco derivado del platino.
- La supervivencia fue más elevada en los pacientes con un mayor puntaje de proporción tumoral (TPS) PD-L1, sobre todo en el subgrupo con TPS >50 % (29,6% vs. 21,4 %).
- Hubo 57 pacientes que completaron 35 ciclos de pembrolizumab. En estos pacientes, la tasa de respuesta objetiva fue del 86,0 % y la tasa de SG a 3 años luego de haber completado los 35 ciclos (alrededor de 5 años después de la aleatorización) fue del 71,9 %.[87]
- En 113 pacientes (27,9 %) se presentaron efectos adversos inmunitarios y 27 pacientes (13,4 %) tuvieron reacciones relacionadas con la infusión.
- Los efectos adversos de grado 3 o mayor se presentaron con una frecuencia similar en ambos grupos (71,9 % en el grupo de combinación de pembrolizumab vs. 66,8 % en el grupo de combinación de placebo).
- En un estudio de fase III, aleatorizado, de doble enmascaramiento (KEYNOTE-407 [NCT02775435]) se incluyeron pacientes con CPCNP de células escamosas metastásico que no habían recibido tratamiento. Los pacientes se asignaron al azar en una proporción 1:1 para recibir 200 mg de pembrolizumab o placebo con carboplatino y paclitaxel o nab-paclitaxel 1 vez cada 3 semanas 3 durante 4 ciclos, seguido de pembrolizumab o placebo durante 35 ciclos (pembrolizumab con quimioterapia, n = 5278; placebo con quimioterapia, n = 5281). Los criterios principales de valoración fueron la SG y la SSP de acuerdo a RECIST (versión 1.1) mediante revisión central con enmascaramiento.[88]
- La mediana de tiempo desde la aleatorización hasta el cierre de la base de datos fue de 56,9 meses (intervalo, 49,9–66,2). La SG y la SSP fueron superiores con pembrolizumab y quimioterapia que con placebo y quimioterapia (CRI, 0,71 [0,59–0,85] y 0,62 [0,52–0,74]), respectivamente; IC 95 %). Las tasas de SG a 5 años fueron 18,4 % y 9,7 %, respectivamente.[88][Nivel de evidencia A1]
- Un total de 55 pacientes completaron los 35 ciclos de pembrolizumab. La tasa de respuesta objetiva fue de 90,9 % y la tasa de SG a 3 años luego de haber completado los 35 ciclos (alrededor de 5 años después de la aleatorización) fue del 69,5 %.
Pembrolizumab solo
Evidencia (pembrolizumab solo):
- En un estudio sin anonimato de fase III (KEYNOTE-024) se asignó al azar a 305 pacientes con CPCNP avanzado no tratado que expresaba PD-L1 en el 50 % o más de células tumorales, pero sin mutaciones sensibilizantes en EGFR o translocaciones de ALK, para recibir pembrolizumab intravenoso (200 mg cada 3 semanas hasta por 35 ciclos) o quimioterapia con derivados del platino (4–6 ciclos, a elección del investigador; se permitió el mantenimiento con pemetrexed para los tumores no escamosos).[86] El criterio principal de valoración fue la SSP.
- La expresión de PD-L1 se evaluó a nivel central mediante prueba inmunohistoquímica para el PD-L1 con el ensayo 22C3 pharmDx. Se encontró una expresión tumoral de PD-L1 del 50 % o más en el 30,2 % de las 1653 muestras examinadas.
- El pembrolizumab fue superior a la quimioterapia para mejorar la mediana de SSP (10,3 vs. 6,0 meses; CRI, 0,50; IC 95 %, 0,37–0,68; P < 0,001). La tasa de respuesta general (44,8 vs. 27,8 %), la mediana de DR (no alcanzada, [intervalo 1,9–14,5 meses] vs. 6,3 meses [intervalo, 2,1–12,6 meses]), y el cálculo de tasa de SG a los 6 meses (80,2 vs. 72,4 %; CRI, 0,60; IC 95 %, 0,41–0,89; P = 0,005) en todos los casos fueron mayores con pembrolizumab que para la quimioterapia.
- Durante un seguimiento más prolongado de este estudio, se confirmó una ventaja de SG a favor del pembrolizumab; la mediana de SG para los pacientes que recibieron pembrolizumab fue de 30 meses (IC 95 %, 18,3 meses–no alcanzada) versus 14,2 meses para los pacientes que recibieron quimioterapia; luego se produjo un 75 % de cruce al grupo de inmunoterapia, lo que indica que el cruce no afectó la supervivencia.[89]
- Los efectos adversos (de cualquier grado) fueron menos frecuentes para pembrolizumab que para la quimioterapia (73,4 vs. 90,0 %).
- Se presentaron efectos adversos de grados 3 a 5 en el 26,6 % de los pacientes tratados con pembrolizumab y en el 53,3 % de los pacientes tratados con quimioterapia.
- Los efectos inmunitarios de grados 3 o 4 se presentaron en el 9,7 % de los pacientes tratados con pembrolizumab y en el 0,7 % de los pacientes tratados con quimioterapia.
- Los efectos inmunitarios de grados 3 o 4 vinculados con el pembrolizumab fueron reacciones cutáneas graves (3,9 %), neumonitis (2,6 %) y colitis (1,3 %).
- No se presentaron efectos inmunitarios de grado 5.
- El tratamiento con pembrolizumab demostró una mejora significativa de la SSP, la SG y la DR, con efectos adversos menos frecuentes en comparación con el tratamiento de quimioterapia.[86][Nivel de evidencia B1]
- En un estudio de fase III sin anonimato (KEYNOTE-042 [NCT02220894]) se incluyeron pacientes con CPCNP metastásico o localmente avanzado sin alteraciones en EGFR o ALK con un puntaje TPS de PD-L1 mayor del 1 %. Los pacientes se asignaron al azar para recibir 200 mg de pembrolizumab 1 vez cada 3 semanas durante 35 ciclos, o quimioterapia (carboplatino con paclitaxel o pemetrexed) durante 4 a 6 ciclos con opción a recibir pemetrexed de mantenimiento (pembrolizumab, n = 637; quimioterapia, n = 637). Los criterios principales de valoración fueron la SG en la población con a TPS PD-L1 superior al 50 %, superior al 20 % y superior al 1 %.[90]
- La mediana de seguimiento fue de 61,1 meses (intervalo, 50,0–76,3).
- Los resultados de SG favorecieron a pembrolizumab versus quimioterapia, con independencia del puntaje TPS de PD-L1.
- El CRI fue de 0,68 (IC 95 %, 0,57–0,81) para el grupo con TPS >50 %, de 0,75 (IC 95 %, 0,64–0,87) para el grupo con TPS >20 % y del 0,79 (IC 95 %, 0,70–0,89) para el grupo con TPS >1 %.
- Las tasas de SG en los pacientes que recibieron pembrolizumab fueron del 21,9 % (TPS >50 %), 19,4 % (TPS >1 %) y 16,6 % (TPS >1 %).
- Las reacciones adversas más frecuentes notificadas en al menos el 10 % de los pacientes que recibieron pembrolizumab en monoterapia en el KEYNOTE-042 incluyeron fatiga, disminución del apetito, disnea, tos, exantema, estreñimiento, diarrea, náusea, hipotiroidismo, neumonía, fiebre y pérdida de peso.
La FDA aprobó el pembrolizumab combinado con pemetrexed y carboplatino como tratamiento de primera línea para pacientes con CPCNP y no escamosas metastásico, con independencia de la expresión de PD-L1. La FDA también aprobó el pembrolizumab en monoterapia para pacientes con CPCNP y no escamosas metastásico cuyos tumores expresan PD-L1 (>1 %) (tinción que se determina mediante prueba aprobada por la FDA). Antes de recibir pembrolizumab los pacientes con anomalías genómicas tumorales en EGFR o ALK deben presentar progresión de la enfermedad mientras reciben tratamientos aprobados por la FDA (consultar la ficha técnica en inglés de la FDA para pembrolizumab).
Cemiplimab-rwlc con quimioterapia
Evidencia (cemiplimab-rwlc con quimioterapia):
- En el ensayo controlado con placebo y enmascaramiento doble de fase III, (EMPOWER-Lung 3 [NCT03409614]), se analizó el cemiplimab-rwlc con biquimioterapia con derivados del platino en 466 pacientes con CPCNP avanzado en estadio III o IV. Los pacientes no habían recibido quimioterapia previa y no tenían anomalías genómicas tumorales en EGFR, ALK ni ROS1. Los pacientes se asignaron al azar (2:1) para recibir cemiplimab-rwlc 350 mg (n = 312) o placebo (n = 154) cada 3 semanas por hasta 108 semanas con 4 ciclos de biquimioterapia con derivados del platino. Asimismo, los pacientes recibieron mantenimiento con pemetrexed según se indicó. El criterio principal de valoración fue la SG. El ensayo alcanzó el criterio de eficacia preestablecido para la SG y se interrumpió de forma temprana de acuerdo con las recomendaciones del Independent Data Monitoring Committee.[91][Nivel de evidencia A1]
- La mediana de la SG fue de 21,9 meses (IC 95%, 15,5–no evaluable [NE]) en el grupo de cemiplimab-rwlc con quimioterapia y de 13 meses (IC 95 %, 11,9–16,1) en el grupo de placebo con quimioterapia (CRI, 0,71; IC 95 %, 0,53–0,93; P = 0,014).
- La mediana de la SSP (criterio secundario de valoración) fue de 8,2 meses (IC 95 %, 6,4–9,3) en el grupo de cemiplimab-rwlc con quimioterapia y de 5,0 meses (IC 95 %, 4,3–6,2) en el grupo de placebo con quimioterapia (CRI, 0,56; IC 95 %, 0,44–0,70; P < 0,0001).
- La proporción estimada de pacientes vivos al cabo de 12 meses (criterio secundario de valoración adicional) fue del 65,7 % (IC 95 %, 59,9–70,9 %) en el grupo de cemiplimab-rwlc con quimioterapia y del 56,1 % (IC 95 %, 47,5–63,8 %) en el grupo de placebo con quimioterapia.
- Se presentaron efectos adversos de grado 3 o mayor en el 43,6 % (136 de 312) de los pacientes que recibieron cemiplimab-rwlc con quimioterapia y en el 31,4 % (48 de 153) de los pacientes que recibieron placebo con quimioterapia.
- Las reacciones adversas más comunes (≥15 %) fueron alopecia, dolor osteomuscular, náuseas, fatiga, neuropatía periférica y disminución del apetito.
La FDA aprobó el cemiplimab-rwlc en combinación con quimioterapia a base de platino para el tratamiento de pacientes adultos con CPCNP avanzado y sin anomalías en EGFR, ALK o ROS1.
Cemiplimab-rwlc solo
Evidencia (Cemiplimab-rwlc solo):
- En el estudio sin enmascaramiento de fase III (EMPOWER-Lung 1 [NCT03088540]), se inscribieron 710 pacientes con CPCNP avanzado y tumor con al menos el 50 % de expresión de PD-L1. Los pacientes se asignaron al azar (1:1) para recibir 350 mg de cemiplimab-rwlc cada 3 semanas por hasta 108 semanas o biquimioterapia con derivados del platino. Fue posible el cruce de quimioterapia a cemiplimab-rwlc en caso de que se presentara progresión de la enfermedad. Además, a los pacientes que tuvieron progresión con cemiplimab solo se les dio la opción de continuar recibiendo cemiplimab-rwlc y 4 ciclos de quimioterapia. Los criterios principales de valoración fueron la SG y la SSP evaluados mediante revisión central independiente con enmascaramiento. La mediana de seguimiento de la población por intención de tratar fue de 37 meses.[92,93][Nivel de evidencia A1]
- Al cabo de 35 meses de seguimiento, la mediana de SG en los pacientes con expresión de PD-L1 ≥50 % fue de 26,1 meses con cemiplimab-rwlc y de 13,3 meses con quimioterapia (CRI, 0,57; P < 0,0001).
- La mediana de SSP fue de 8,1 meses en los pacientes que recibieron cemiplimab-rwlc y de 5,3 meses en los pacientes que recibieron quimioterapia (CRI, 0,51; P < 0,0001).
- La tasa de respuesta objetiva fue del 46 % en los pacientes que recibieron cemiplimab-rwlc y del 21 % en los pacientes que recibieron quimioterapia (OR, 3,264; P < 0,0001).
- Los beneficios fueron superiores en los pacientes con expresión de PD-L1 ≥90 % versus del 50 % al 89 %.
- De 64 pacientes que recibieron cemiplimab-rwlc y quimioterapia después de la progresión inicial con cemiplimab-rwlc solo, la mediana de SSP fue de 6,6 meses, la tasa de respuesta objetiva fue del 31 % y la SG fue de 15,1 meses.
- Las reacciones adversas más comunes (>10 %) con cemiplimab-rwlc fueron dolor osteomuscular, exantema, anemia, fatiga, disminución del apetito, neumonía y tos. El perfil de inocuidad de cemiplimab-rwlc se mantuvo uniforme durante el seguimiento a largo plazo.
La FDA aprobó el cemiplimab-rwlc para el tratamiento de pacientes con CPCNP avanzado (localmente avanzado, que no son candidatos para una resección quirúrgica ni quimiorradiación definitiva, o metastásico) y tumor con al menos el 50 % de expresión de PD-L1 y sin anomalías genómicas en EGFR, ALK anaplásico o ROS1.
Tremelimumab
El tremelimumab es un anticuerpo monoclonal totalmente humano anti antígeno 4 del linfocito T citotóxico (CTLA-4). Este fármaco es un inhibidor de puntos de control inmunitario.
Durvalumab y tremelimumab con quimioterapia
Evidencia (durvalumab y tremelimumab con quimioterapia):
- En el ensayo sin enmascaramiento de fase III, POSEIDON (NCT03164616), se estudió el tremelimumab y durvalumab con quimioterapia, el durvalumab con quimioterapia, y la quimioterapia sola como terapia de primera línea en pacientes con CPCNP metastásico. Los criterios principales de valoración fueron la SSP y la SG para el durvalumab con quimioterapia versus quimioterapia. Los criterios secundarios de valoración claves controlados por alfa fueron la SSP y la SG para el tremelimumab y durvalumab con quimioterapia versus quimioterapia. Los pacientes se asignaron al azar (1:1:1) a uno de los siguientes 3 grupos:[94][Nivel de evidencia B1]
- Grupo 1: 75 mg de tremelimumab con 1500 mg de durvalumab con quimioterapia a base de platino durante 4 ciclos de 21 días seguido por durvalumab una vez cada 4 semanas hasta la progresión y una dosis adicional de tremelimumab en la semana 16.
- Grupo 2: durvalumab con quimioterapia durante 4 ciclos de 21 días seguido por durvalumab una vez cada 4 semanas hasta la progresión.
- Grupo 3: quimioterapia a base de platino durante 6 ciclos de 21 días (con mantenimiento de pemetrexed o sin este).
Se observaron los siguientes resultados:
- El tratamiento con durvalumab mejoró de forma considerable la SSP en comparación con la quimioterapia sola. La mediana de SSP fue de 5,5 meses en los pacientes que recibieron durvalumab con quimioterapia y de 4,8 meses en los pacientes que recibieron quimioterapia sola (CRI, 0,74; IC 95 %, 0,62–0,89; P = 0,0009).
- La tendencia para la mejora de la SG no alcanzó significancia estadística en los pacientes de los grupos 2 y 3. La mediana de SG fue de 13,3 meses en los pacientes que recibieron durvalumab con quimioterapia y de 11,7 meses en los pacientes que recibieron quimioterapia sola (CRI, 0,86; IC 95 %, 0,72–1,02; P = 0,0758). La tasa de SG a 24 meses fue del 29,6 % en el grupo de durvalumab con quimioterapia y del 22,1 % en el grupo de quimioterapia sola.
- La SSP y la SG mejoraron de forma considerable cuando se añadió el tremelimumab al tratamiento de durvalumab con quimioterapia en comparación con la quimioterapia sola. La mediana de SSP fue de 6,2 meses en los pacientes que recibieron tremelimumab y durvalumab con quimioterapia y de 4,8 meses en los pacientes que recibieron quimioterapia sola (CRI, 0,72; IC 95 %, 0,60–0,86; P = 0,0003). La mediana de SG fue de 14,0 meses en el grupo de tremelimumab y de 11,7 meses en el grupo de quimioterapia sola (CRI, 0,77; IC 95 %, 0,65–0,92; P = 0,0030). La tasa de SG a los 24 meses fue del 32,9 % en el grupo de tremelimumab y durvalumab con quimioterapia y del 22,1 % en el grupo de quimioterapia sola. Asimismo, con esta combinación se demostraron resultados congruentes de SG en todos los grados de expresión de PD-L1.
- Se presentaron efectos adversos de grados 3 a 4 relacionados con el tratamiento en el 51,8 % de los pacientes que recibieron tremelimumab y durvalumab con quimioterapia, en el 14,1 % de los pacientes que recibieron durvalumab y quimioterapia y en el 9,9 % de los pacientes que recibieron quimioterapia sola.
La FDA aprobó el tremelimumab en combinación con durvalumab y quimioterapia a base de platino para el tratamiento de pacientes adultos con CPCNP metastásico y sin anomalías genómicas tumorales con efecto sensibilizante en EGFR o ALK. La aprobación se fundamentó en la comparación que se hizo entre los grupos de tratamiento 1 y 3.
Atezolizumab solo
Evidencia (atezolizumab solo):
- En un estudio sin enmascaramiento de fase III (IMpower110 [NCT02409342]), se inscribió 572 pacientes de CPCNP no escamosas o escamosas metastásico que no habían recibido tratamiento antes. Los pacientes tenían expresión de PD-L1 en al menos el 1 % de las células tumorales o al menos en el 1 % de las células inmunitarias de infiltración tumoral. Los pacientes se asignaron al azar para recibir atezolizumab (1200 mg intravenoso) o quimioterapia con derivados del platino (4 o 6 ciclos) 1 vez cada 3 semanas. El criterio principal de valoración fue la SG en la población de PD-L1 seleccionada de la que se excluyeron a aquellos con mutaciones sensibilizantes en EGFR o translocaciones de ALK.[95][Nivel de evidencia A1]
- El análisis de SP142 mediante inmunohistoquímica se usó para evaluar la expresión de PD-L1. Una expresión alta se definió como más del 50 % de células tumorales o más del 10 % de células inmunitarias de infiltración tumoral con expresión de PD-L1.
- En los 205 pacientes con expresión alta de PD-L1, la mediana de la SG fue de 20,2 meses para los pacientes que recibieron atezolizumab y 13,1 meses para los pacientes que recibieron quimioterapia (CRIde muerte, 0,59; P = 0,01).
- Se presentaron efectos adversos de grado 3 a 4 en el 30,1 % de los pacientes que recibieron atezolizumab y el 52,5 % de los pacientes que recibieron quimioterapia.
Se aprobó el atezolizumab en monoterapia para el tratamiento de primera línea de pacientes con expresión alta de PD-L1 (tinción de PD-L1 ≥50 % de las células tumorales o células inmunitarias infiltrantes del tumor con tinción de PD-L1 que cubren el ≥10 % del área tumoral), detectada mediante prueba autorizada por la FDA, en ausencia de anomalías genómicas en EGFR o ALK.
Atezolizumab con quimioterapia
Evidencia (atezolizumab en combinación con carboplatino y quimioterapia de nab-paclitaxel):
- En un estudio de fase III sin anonimato (IMpower130 [NCT02367781]) se incluyeron 724 pacientes con CPCNP no escamosas en estadio IV para el que no habían recibido tratamiento. Los pacientes se asignaron al azar en una proporción 2:1 para recibir atezolizumab (1200 mg intravenoso cada 3 semanas) y quimioterapia (carboplatino, ABC 6 mg/ml por minuto cada 3 semanas con 100 mg/m2 de nab-paclitaxel intravenosos cada semana), o quimioterapia sola administrada 1 vez por semana durante 4 a 6 ciclos. La terapia de mantenimiento se administró a todos los pacientes de la siguiente manera: 1) los pacientes en el grupo de atezolizumab y quimioterapia recibieron 1200 mg de atezolizumab intravenoso cada 3 semanas hasta que el investigador determinara pérdida de beneficio clínico o toxicidad, y 2) los pacientes en el grupo de quimioterapia sola recibieron los mejores cuidados médicos de apoyo o terapia de mantenimiento con cambio a pemetrexed hasta la progresión de la enfermedad o toxicidad. Los criterios coprimarios de valoración fueron la SSP determinada por el investigador y la SG en la población por intención de tratar que presentaba tumores con EGFR natural y ALK natural.[96][Nivel de evidencia A1]
- En la población por intención de tratar de tipo natural, la mediana de SG fue de 18,6 meses (IC 95 %, 16,0–21,2) en el grupo de atezolizumab y quimioterapia, y de 13,9 meses (IC 95 %, 12,0–18,7) en el grupo de quimioterapia (CRI estratificado, 0,79; IC 95 %, 0,64–0,98; P = 0,033).
- La mediana de SSP fue de 7 meses (IC 95 %, 6,2–7,3) en el grupo de atezolizumab y quimioterapia, y de 5,5 meses (IC 95 %, 4,4–5,9) en el grupo de quimioterapia (CRI estratificado, 0,64; IC 95 %, 0,54–0,77; P < 0,0001).
- En el análisis de subgrupos se observó un beneficio en la SSP con atezolizumab que abarcó varios subgrupos clínicos, a excepción de los pacientes con metástasis hepáticas donde el atezolizumab adicional no mejoró la SG en comparación con la quimioterapia sola, y de los pacientes con alteraciones genómicas en EGFR y en ALK.
- El beneficio en la SG y la SSP con atezolizumab también se observó en la población por intención de tratar de tipo natural, con independencia de la expresión de PD-L1.
- Se presentaron efectos adversos de grado 3 o 4 en el 81 % de los pacientes que recibieron atezolizumab y quimioterapia versus el 71 % de los pacientes que recibieron quimioterapia sola. Se presentaron efectos adversos relacionados con el sistema inmunitario en el 45 % de los pacientes que recibieron atezolizumab con quimioterapia y en la mayoría de los casos la gravedad fue de grado 1 o 2. Los efectos adversos relacionados con el sistema inmunitario fueron exantema (24 %), hipotiroidismo (15 %) y hepatitis (10 %).
El atezolizumab en combinación con nab-paclitaxel y carboplatino se aprobó como tratamiento de primera línea para pacientes con CPCNP no escamosas metastásico sin anomalías genómicas en EGFR o ALK.
Atezolizumab y bevacizumab con quimioterapia
Evidencia (atezolizumab en combinación con carboplatino, paclitaxel y bevacizumab):
- En un estudio de fase III sin anonimato (IMpower150 [NCT02366143]),1202 pacientes con CPCNP no escamosas metastásico en estadio IV o recidivante se asignaron al azar en una proporción 1:1:1 para recibir atezolizumab con carboplatino y paclitaxel (grupo ACP), atezolizumab con bevacizumab, carboplatino y paclitaxel (grupo ABCP) o bevacizumab con carboplatino y paclitaxel (grupo BCP). El tratamiento consistió en 4 a 6 ciclos de 21 días. El atezolizumab se administró por vía intravenosa en una dosis de 1200 mg, el bevacizumab en una dosis de 15 mg por kilogramo de peso corporal, carboplatino con un área bajo la curva de concentración-tiempo de 6 mg/ml por minuto y paclitaxel en una dosis de 200 mg/m2 (175 mg/m2 para los pacientes asiático). Los pacientes continuaron recibiendo atezolizumab, bevacizumab o ambos hasta que la enfermedad progresó o presentaron efectos tóxicos inaceptables. Los criterios coprimarios de valoración fueron la SSP, en la población por intención de tratar con tumores que presentaban EGFR natural y ALK natural y entre los pacientes con tumores de tipo natural con expresión alta de una firma génica del efector de células T (Teff) en el tumor, y la SG en la población de tipo natural.[97][Nivel de evidencia A1]
- La mediana de SSP fue más prolongada en el grupo ABCP (8,3 meses) que en el grupo BCP (6,8 meses) (CRI, 0,62; IC 95 %, 0,52–0,74; P < 0,001). En la población de tipo natural con Teff elevado, la SSP fue de 11,3 meses versus 6,8 meses (CRI, 0,51; IC 95 %, 0,38–0,68; P 0,001). La SSP también fue más prolongada en el grupo ABCP versus el grupo BCP en la población por intención de tratar que presentaba alteraciones genómicas en EGFR y ALK, entre los pacientes con expresión de PD-L1 baja o ausente, expresión baja de la firma génica de Teff y pacientes con metástasis hepáticas.
- La mediana de SG entre los pacientes con tumores de tipo natural fue más prolongada en el grupo ABCP (19,2 meses), en comparación con el grupo BCP (14,7 meses) (CRI, 0,78; IC 95 %, 0,64–0,96; P = 0,02).
- Se presentaron eventos adversos relacionados con el tratamiento de grado 3 o 4 en el 56 % de los pacientes del grupo ABCP versus 48 % de los pacientes en el grupo BCP. La mayoría de los efectos adversos relacionados al sistema inmunitario en el grupo ABCP fueron de grado 1 o 2, siendo los más frecuentes exantema, hipotiroidismo, hipertiroidismo, hepatitis, neumonía y colitis. Hubo 11 (2,8 %) muertes relacionadas con el tratamiento en el grupo ABCP y 9 pacientes (2,3 %) en el grupo BCP. De las muertes en el grupo ABCP, 5 fueron por hemorragia pulmonar o hemoptisis, y 4 de esas 5 muertes fueron de pacientes con características de riesgo alto, incluso tumores que invaden vasos sanguíneos grandes o cavitación tumoral.
El uso de atezolizumab en combinación con bevacizumab, paclitaxel y carboplatino se aprobó como tratamiento de primera línea de pacientes con CPCNP no escamosas metastásico sin anomalías genómicas en EGFR o ALK.
Nivolumab e ipilimumab
Nivolumab, un anticuerpo anti PD-1 completamente humano, e ipilimumab, un anticuerpo anti CTLA-4 totalmente humano, son inhibidores de punto de control inmunitario con mecanismos de acción diferentes pero complementarios.[98]
Evidencia (nivolumab con ipilimumab):
- En un estudio de fase III sin anonimato (CheckMate 227 [NCT02477826]) se evaluó el nivolumab en combinación con ipilimumab versus quimioterapia como tratamiento de primera línea para el CPCNP en estadio IV o recidivante que no presenta mutaciones sensibilizantes en EGFR o translocaciones de ALK. Los pacientes (n = 1739) se agruparon según el estado PD-L1 del tumor (≥1 % o <1 %). Los pacientes con una expresión de PD-L1 de al menos un 1 % se asignaron al azar para recibir nivolumab (3 mg/kg cada 2 semanas) e ipilimumab (1 mg/kg cada 6 semanas), nivolumab (240 mg cada 2 semanas) solo o biquimioterapia con derivados del platino cada 3 semanas por hasta 4 ciclos. Los pacientes con una expresión de PD-L1 menor al 1 % se asignaron al azar para recibir nivolumab e ipilimumab, nivolumab y biquimioterapia con derivados del platino o biquimioterapia con derivados del platino (cada 3 semanas). Los pacientes recibieron el tratamiento hasta que la enfermedad progresó, los efectos tóxicos fueron inaceptables o hasta cumplir los 2 años de tratamiento con inmunoterapia. Los criterios coprimarios de valoración fueron la SG para nivolumab e ipilimumab en comparación con la quimioterapia en pacientes con tumores que presentaban una expresión de PD-L1 de al menos un 1 %, y la SSP para nivolumab e ipilimumab en comparación con la quimioterapia en pacientes con una carga mutacional del tumor alta (TMB) (mutaciones por megabase ≥10).[2,99][Nivel de evidencia A1]
- Entre los pacientes con expresión tumoral de PD-L1 ≥1 % (n = 1189), la mediana de SG fue de 17,1 meses (IC 95 %, 15,0–20,2) para nivolumab e ipilimumab y de 14,9 meses (IC 95 %, 12,7–16,7) para la quimioterapia (CRI, 0,77; IC 95 %, 0,66–0,91; P = 0,007). En los desenlaces a 5 años de nivolumab e ipilimumab versus quimioterapia se observó un beneficio clínico persistente; la tasa de SG fue del 24 % para nivolumab e ipilimumab y del 14 % para la quimioterapia sola.[98]
- En los pacientes con CPCNP y TMB alto, la mediana de SSP fue de 7,2 meses (IC 95 %, 5,5–13,2) para nivolumab e ipilimumab, versus 5,5 meses (IC 95 %, 4,4–5,8) para la quimioterapia sola (CRI, 0,58; IC 97,5 %, 0,41–0,81; P < 0,001).
- Entre los pacientes con expresión tumoral de PD-L1 <1 % (n = 550), la mediana de SG fue de 17,4 meses (IC 95 %, 13,2–22,0) para nivolumab e ipilimumab y 12,2 meses (IC 95 %, 9,2–14,3) para la quimioterapia sola (CRI, 0,65; IC 95 %, 0,52–0,81). En los desenlaces a 5 años de nivolumab e ipilimumab versus quimioterapia sola se observó un beneficio clínico persistente; la tasa de SG fue de 19 % para nivolumab e ipilimumab y del 7 % para la quimioterapia sola.[98]
- La frecuencia de efectos adversos relacionados con el tratamiento de grados 3 a 4 fue similar en ambos grupos (32,8 % para nivolumab e ipilimumab vs. 36,0 % para la quimioterapia sola). Los efectos adversos relacionados con el tratamiento que produjeron interrupción del tratamiento fueron más frecuentes en el grupo de nivolumab e ipilimumab que en el de quimioterapia sola (24,5 vs. 13,9 %).
- Hubo 8 muertes relacionadas al tratamiento en el grupo de nivolumab e ipilimumab (4 neumonitis, 1 shock, 1 miocarditis, 1 necrosis tubular aguda y 1 taponamiento cardíaco) y 6 en el grupo de quimioterapia (2 sepsis, 1 neutropenia febril, 1 ictus multifocal, 1 enfermedad pulmonar intersticial y 1 trombocitopenia).
La FDA aprobó el uso de nivolumab e ipilimumab como tratamiento de primera línea para pacientes con CPCNP avanzado con expresión de PD-L1 de al menos un 1 % y ausencia de anomalías genómicas en EGFR o ALK. Si bien la FDA no ha aprobado este régimen para pacientes con expresión de PD-L1 menor al 1 %, en el CheckMate 227 se notificó un beneficio clínico persistente en dichos pacientes.
Inhibidores del blanco de la rapamicina en los mamíferos
Everólimus
El everólimus se administra a pacientes con tumores neuroendocrinos irresecables, localmente avanzados o metastásicos, progresivos, bien diferenciados y no funcionantes.
El everólimus, un inhibidor oral del blanco de la rapamicina en los mamíferos (mTOR), es clínicamente activo contra tumores neuroendocrinos pancreáticos y no pancreáticos en estadio avanzado.[100] De acuerdo con los resultados del ensayo clínico RADIANT-4,[100] la FDA aprobó el everólimus para el tratamiento de pacientes adultos con tumores neuroendocrinos de origen pulmonar o gastrointestinal que son irresecables, localmente avanzados o metastásicos, progresivos, bien diferenciados (de grado bajo o intermedio) y no funcionantes.
Evidencia (everólimus):
- En un ensayo aleatorizado de fase III con enmascaramiento doble y controlado con placebo (RADIANT-4), se evaluó el everólimus para pacientes mayores de 18 años con tumores neuroendocrinos de origen pulmonar o gastrointestinal en estadio avanzado, progresivo, bien diferenciados y no funcionantes.[100] Los pacientes aptos se asignaron al azar en una proporción 2:1 para recibir 10 mg diarios de everólimus oral o un placebo, en ambos casos con los mejores cuidados médicos de apoyo. Se inscribió a un total de 302 pacientes (205 en el grupo de everólimus y 97 en el grupo de placebo), incluso 90 pacientes con tumores neuroendocrinos de origen pulmonar (63 en el grupo de everólimus y 27 en el grupo de placebo). El criterio principal de valoración fue la SSP evaluada mediante revisión radiológica central en la población con intención de tratar.
- La mediana de SSP fue de 11,0 meses en el grupo de everólimus y de 3,9 meses en el grupo de placebo (CRI, 0,48; IC 95 %, 0,35−0,67; P < 0,00001). [100][Nivel de evidencia B1]
- En un análisis a posteriori del subgrupo de pulmón, la mediana de SSP evaluada mediante revisión central fue de 9,2 meses en el grupo de everólimus y de 3,6 meses en el grupo de placebo (CRI, 0,50; IC 95 %, 0,28−0,88).[100]
- La tasa de respuesta objetiva fue del 2 % en los pacientes que recibieron everólimus y del 1 % en los pacientes que recibieron placebo. Se observó la estabilización de la enfermedad en el 81 % de los pacientes en el grupo de everólimus y en el 64 % de los pacientes en el grupo de placebo.
- La mediana de duración del tratamiento fue más larga en los pacientes que recibieron everólimus comparada con aquellos que recibieron el placebo (40,4 vs. 19,6 semanas).
- En un análisis intermedio planificado de la SG, se observó una reducción del 36 % en el riesgo estimado de muerte con everólimus en comparación con el placebo (CRI, 0,64; IC 95 %, 0,40−1,05). Estos resultados no fueron estadísticamente significativos.
- Los efectos adversos relacionados con el tratamiento más comunes fueron estomatitis, diarrea, fatiga, infecciones, exantema y edema periférico. Los efectos adversos relacionados con los fármacos más comunes de grados 3 o 4 fueron estomatitis, diarrea, infecciones, anemia y fatiga. Los efectos adversos de grados 3 o 4 condujeron a la interrupción del tratamiento del 12 % de los pacientes en el grupo de everólimus y del 3 % de los pacientes en el grupo de placebo.
Terapias locales y consideraciones especiales
Terapia láser endobronquial o braquiterapia (para lesiones obstructivas)
La radioterapia a veces es eficaz como paliativo para los pacientes de CPCNP con compromiso local sintomático que tengan cualquiera de las siguientes manifestaciones:
- Compresión traqueal, esofágica o bronquial.
- Dolor.
- Parálisis de las cuerdas vocales.
- Hemoptisis.
- Síndrome de la vena cava superior.
En algunos casos, la terapia láser endobronquial o la braquiterapia se usan para el alivio de la obstrucción de las lesiones proximales.[20]
Radioterapia de haz externo (principalmente para la paliación de los síntomas locales del crecimiento tumoral)
Si bien la RHE se prescribe con frecuencia para la paliación de síntomas, no hay consenso sobre el esquema de fraccionamiento que se debe usar. Parece que diferentes regímenes multifraccionados proveen un alivio sintomático semejante;[101-106] la radiación de fracción única tal vez sea insuficiente para aliviar los síntomas en comparación con los regímenes hipofraccionados o estándar, como se comprobó en el ensayo NCT00003685.[21][Nivel de evidencia A3] Se ha obtenido evidencia de un aumento modesto en la supervivencia de los pacientes con mejor estado funcional que reciben dosis altas de radioterapia.[23,107][Nivel de evidencia A1] En los pacientes asintomáticos sometidos a observación rigurosa, a menudo se puede diferir el tratamiento de manera apropiada hasta que se presenten síntomas o signos de un tumor progresivo.
Evidencia (radioterapia):
- En una revisión sistemática se identificaron seis ensayos aleatorizados de dosis altas de braquiterapia endobronquial sola o con RHE, o terapia láser.[108]
- Se esperaba que el uso de la RHE sola produjera mejor paliación general de los síntomas y una necesidad más baja de nuevos tratamientos para los pacientes sin tratamiento previo.[108][Nivel de evidencia A3]
- Las dosis altas de braquiterapia endobronquial, cuando su administración fue técnicamente viable, proporcionaron paliación a los pacientes sintomáticos con obstrucción endobronquial recidivante tratados antes con RHE.
Tratamiento del segundo tumor primario
Es poco común observar metástasis pulmonares solitarias de un carcinoma broncogénico tratado inicialmente mediante resección. Con frecuencia el pulmón es el sitio de segundas neoplasias malignas primarias en pacientes con cáncer primario de pulmón. A veces es difícil determinar si la lesión nueva es un nuevo cáncer primario o una metástasis. En algunos estudios se indica que en la mayoría de los pacientes la lesión nueva es un segundo tumor primario, y después de su resección, determinados pacientes quizás logren una supervivencia a largo plazo. Por lo tanto, si el primer tumor primario se controló, el segundo tumor primario deberá resecarse, si es posible.[109,110]
Tratamiento de las metástasis encefálicas
Los pacientes que presentan al inicio una metástasis encefálica solitaria después de la resección de una lesión primaria de un CPCNP y que no muestran indicios de un tumor extracraneal quizás logren una supervivencia sin enfermedad prolongada mediante escisión quirúrgica de la metástasis encefálica y radioterapia posoperatoria dirigida a todo el encéfalo.[111,112] En estas circunstancias, las metástasis encefálicas no resecables se pueden tratar con radiocirugía estereotáctica.[113]
Alrededor del 50 % de los pacientes tratados con resección y radioterapia posoperatoria presentaran recidiva encefálica; algunos pacientes serán aptos para tratamiento adicional.[114] En estos pacientes seleccionados con buen estado funcional y que no tienen metástasis progresivas fuera del encéfalo, las opciones de tratamiento incluyen una nueva operación o radiocirugía estereotáctica.[113,114] Para la mayoría de los pacientes se puede considerar el uso de radioterapia; sin embargo, el beneficio paliativo de este tratamiento es limitado.[115][Nivel de evidencia C2]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al.: Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. N Engl J Med 378 (22): 2078-2092, 2018. [PUBMED Abstract]
- Hellmann MD, Paz-Ares L, Bernabe Caro R, et al.: Nivolumab plus Ipilimumab in Advanced Non-Small-Cell Lung Cancer. N Engl J Med 381 (21): 2020-2031, 2019. [PUBMED Abstract]
- Weick JK, Crowley J, Natale RB, et al.: A randomized trial of five cisplatin-containing treatments in patients with metastatic non-small-cell lung cancer: a Southwest Oncology Group study. J Clin Oncol 9 (7): 1157-62, 1991. [PUBMED Abstract]
- Scagliotti GV, Parikh P, von Pawel J, et al.: Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer. J Clin Oncol 26 (21): 3543-51, 2008. [PUBMED Abstract]
- Langer CJ, Vangel M, Schiller J, et al.: Age-specific subanalysis of ECOG 1594: fit elderly patients (70-80 YRS) with NSCLC do as well as younger pts (<70). [Abstract] Proceedings of the American Society of Clinical Oncology 22: A-2571, 2003.
- Langer CJ, Manola J, Bernardo P, et al.: Cisplatin-based therapy for elderly patients with advanced non-small-cell lung cancer: implications of Eastern Cooperative Oncology Group 5592, a randomized trial. J Natl Cancer Inst 94 (3): 173-81, 2002. [PUBMED Abstract]
- Ries LA: Influence of extent of disease, histology, and demographic factors on lung cancer survival in the SEER population-based data. Semin Surg Oncol 10 (1): 21-30, 1994 Jan-Feb. [PUBMED Abstract]
- Ramsey SD, Howlader N, Etzioni RD, et al.: Chemotherapy use, outcomes, and costs for older persons with advanced non-small-cell lung cancer: evidence from surveillance, epidemiology and end results-Medicare. J Clin Oncol 22 (24): 4971-8, 2004. [PUBMED Abstract]
- Effects of vinorelbine on quality of life and survival of elderly patients with advanced non-small-cell lung cancer. The Elderly Lung Cancer Vinorelbine Italian Study Group. J Natl Cancer Inst 91 (1): 66-72, 1999. [PUBMED Abstract]
- Takeda K, Kudoh S, Nakagawa K, et al.: Randomized phase III study of docetaxel (D) versus vinorelbine (V) for elderly patients (pts) with advanced non-small cell lung cancer (NSCLC): Results of a West Japan Thoracic Oncology Group trial (WJTOG9904). [Abstract] J Clin Oncol 23 (Suppl 16): A-7009, 2005.
- Schiller JH, Harrington D, Belani CP, et al.: Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer. N Engl J Med 346 (2): 92-8, 2002. [PUBMED Abstract]
- Belani CP, Fossella F: Elderly subgroup analysis of a randomized phase III study of docetaxel plus platinum combinations versus vinorelbine plus cisplatin for first-line treatment of advanced nonsmall cell lung carcinoma (TAX 326). Cancer 104 (12): 2766-74, 2005. [PUBMED Abstract]
- Lilenbaum RC, Herndon JE, List MA, et al.: Single-agent versus combination chemotherapy in advanced non-small-cell lung cancer: the cancer and leukemia group B (study 9730). J Clin Oncol 23 (1): 190-6, 2005. [PUBMED Abstract]
- Hensing TA, Peterman AH, Schell MJ, et al.: The impact of age on toxicity, response rate, quality of life, and survival in patients with advanced, Stage IIIB or IV nonsmall cell lung carcinoma treated with carboplatin and paclitaxel. Cancer 98 (4): 779-88, 2003. [PUBMED Abstract]
- Sweeney CJ, Zhu J, Sandler AB, et al.: Outcome of patients with a performance status of 2 in Eastern Cooperative Oncology Group Study E1594: a Phase II trial in patients with metastatic nonsmall cell lung carcinoma . Cancer 92 (10): 2639-47, 2001. [PUBMED Abstract]
- Zukin M, Barrios CH, Pereira JR, et al.: Randomized phase III trial of single-agent pemetrexed versus carboplatin and pemetrexed in patients with advanced non-small-cell lung cancer and Eastern Cooperative Oncology Group performance status of 2. J Clin Oncol 31 (23): 2849-53, 2013. [PUBMED Abstract]
- Tester WJ, Stephenson P, Langer CJ, et al.: ECOG 1599: randomized phase II study of paclitaxel/carboplatin or gemcitabine/cisplatin in performance status (PS) 2 patients with advanced non-small cell lung cancer (NSCLC). [Abstract] J Clin Oncol 22 (Suppl 14): A-7055, 630s, 2004.
- Vansteenkiste JF, Vandebroek JE, Nackaerts KL, et al.: Clinical-benefit response in advanced non-small-cell lung cancer: A multicentre prospective randomised phase III study of single agent gemcitabine versus cisplatin-vindesine. Ann Oncol 12 (9): 1221-30, 2001. [PUBMED Abstract]
- Hickish TF, Smith IE, O'Brien ME, et al.: Clinical benefit from palliative chemotherapy in non-small-cell lung cancer extends to the elderly and those with poor prognostic factors. Br J Cancer 78 (1): 28-33, 1998. [PUBMED Abstract]
- Miller JI, Phillips TW: Neodymium:YAG laser and brachytherapy in the management of inoperable bronchogenic carcinoma. Ann Thorac Surg 50 (2): 190-5; discussion 195-6, 1990. [PUBMED Abstract]
- Bezjak A, Dixon P, Brundage M, et al.: Randomized phase III trial of single versus fractionated thoracic radiation in the palliation of patients with lung cancer (NCIC CTG SC.15). Int J Radiat Oncol Biol Phys 54 (3): 719-28, 2002. [PUBMED Abstract]
- Macbeth F, Toy E, Coles B, et al.: Palliative radiotherapy regimens for non-small cell lung cancer. Cochrane Database Syst Rev (3): CD002143, 2001. [PUBMED Abstract]
- Sundstrøm S, Bremnes R, Aasebø U, et al.: Hypofractionated palliative radiotherapy (17 Gy per two fractions) in advanced non-small-cell lung carcinoma is comparable to standard fractionation for symptom control and survival: a national phase III trial. J Clin Oncol 22 (5): 801-10, 2004. [PUBMED Abstract]
- Delbaldo C, Michiels S, Rolland E, et al.: Second or third additional chemotherapy drug for non-small cell lung cancer in patients with advanced disease. Cochrane Database Syst Rev (4): CD004569, 2007. [PUBMED Abstract]
- Ardizzoni A, Boni L, Tiseo M, et al.: Cisplatin- versus carboplatin-based chemotherapy in first-line treatment of advanced non-small-cell lung cancer: an individual patient data meta-analysis. J Natl Cancer Inst 99 (11): 847-57, 2007. [PUBMED Abstract]
- Jiang J, Liang X, Zhou X, et al.: A meta-analysis of randomized controlled trials comparing carboplatin-based to cisplatin-based chemotherapy in advanced non-small cell lung cancer. Lung Cancer 57 (3): 348-58, 2007. [PUBMED Abstract]
- Hotta K, Matsuo K, Ueoka H, et al.: Meta-analysis of randomized clinical trials comparing Cisplatin to Carboplatin in patients with advanced non-small-cell lung cancer. J Clin Oncol 22 (19): 3852-9, 2004. [PUBMED Abstract]
- D'Addario G, Pintilie M, Leighl NB, et al.: Platinum-based versus non-platinum-based chemotherapy in advanced non-small-cell lung cancer: a meta-analysis of the published literature. J Clin Oncol 23 (13): 2926-36, 2005. [PUBMED Abstract]
- Rajeswaran A, Trojan A, Burnand B, et al.: Efficacy and side effects of cisplatin- and carboplatin-based doublet chemotherapeutic regimens versus non-platinum-based doublet chemotherapeutic regimens as first line treatment of metastatic non-small cell lung carcinoma: a systematic review of randomized controlled trials. Lung Cancer 59 (1): 1-11, 2008. [PUBMED Abstract]
- Pujol JL, Barlesi F, Daurès JP: Should chemotherapy combinations for advanced non-small cell lung cancer be platinum-based? A meta-analysis of phase III randomized trials. Lung Cancer 51 (3): 335-45, 2006. [PUBMED Abstract]
- Douillard JY, Laporte S, Fossella F, et al.: Comparison of docetaxel- and vinca alkaloid-based chemotherapy in the first-line treatment of advanced non-small cell lung cancer: a meta-analysis of seven randomized clinical trials. J Thorac Oncol 2 (10): 939-46, 2007. [PUBMED Abstract]
- Belani CP, Ramalingam S, Perry MC, et al.: Randomized, phase III study of weekly paclitaxel in combination with carboplatin versus standard every-3-weeks administration of carboplatin and paclitaxel for patients with previously untreated advanced non-small-cell lung cancer. J Clin Oncol 26 (3): 468-73, 2008. [PUBMED Abstract]
- Schuette W, Blankenburg T, Guschall W, et al.: Multicenter randomized trial for stage IIIB/IV non-small-cell lung cancer using every-3-week versus weekly paclitaxel/carboplatin. Clin Lung Cancer 7 (5): 338-43, 2006. [PUBMED Abstract]
- Sandler A, Gray R, Perry MC, et al.: Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer. N Engl J Med 355 (24): 2542-50, 2006. [PUBMED Abstract]
- Reck M, von Pawel J, Zatloukal P, et al.: Phase III trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-small-cell lung cancer: AVAil. J Clin Oncol 27 (8): 1227-34, 2009. [PUBMED Abstract]
- Lynch TJ, Patel T, Dreisbach L, et al.: Cetuximab and first-line taxane/carboplatin chemotherapy in advanced non-small-cell lung cancer: results of the randomized multicenter phase III trial BMS099. J Clin Oncol 28 (6): 911-7, 2010. [PUBMED Abstract]
- Pirker R, Pereira JR, Szczesna A, et al.: Cetuximab plus chemotherapy in patients with advanced non-small-cell lung cancer (FLEX): an open-label randomised phase III trial. Lancet 373 (9674): 1525-31, 2009. [PUBMED Abstract]
- Khambata-Ford S, Harbison CT, Hart LL, et al.: Analysis of potential predictive markers of cetuximab benefit in BMS099, a phase III study of cetuximab and first-line taxane/carboplatin in advanced non-small-cell lung cancer. J Clin Oncol 28 (6): 918-27, 2010. [PUBMED Abstract]
- Paz-Ares L, Mezger J, Ciuleanu TE, et al.: Necitumumab plus pemetrexed and cisplatin as first-line therapy in patients with stage IV non-squamous non-small-cell lung cancer (INSPIRE): an open-label, randomised, controlled phase 3 study. Lancet Oncol 16 (3): 328-37, 2015. [PUBMED Abstract]
- Thatcher N, Hirsch FR, Luft AV, et al.: Necitumumab plus gemcitabine and cisplatin versus gemcitabine and cisplatin alone as first-line therapy in patients with stage IV squamous non-small-cell lung cancer (SQUIRE): an open-label, randomised, controlled phase 3 trial. Lancet Oncol 16 (7): 763-74, 2015. [PUBMED Abstract]
- Paz-Ares LG, de Marinis F, Dediu M, et al.: PARAMOUNT: Final overall survival results of the phase III study of maintenance pemetrexed versus placebo immediately after induction treatment with pemetrexed plus cisplatin for advanced nonsquamous non-small-cell lung cancer. J Clin Oncol 31 (23): 2895-902, 2013. [PUBMED Abstract]
- Brodowicz T, Krzakowski M, Zwitter M, et al.: Cisplatin and gemcitabine first-line chemotherapy followed by maintenance gemcitabine or best supportive care in advanced non-small cell lung cancer: a phase III trial. Lung Cancer 52 (2): 155-63, 2006. [PUBMED Abstract]
- Park JO, Kim SW, Ahn JS, et al.: Phase III trial of two versus four additional cycles in patients who are nonprogressive after two cycles of platinum-based chemotherapy in non small-cell lung cancer. J Clin Oncol 25 (33): 5233-9, 2007. [PUBMED Abstract]
- Paz-Ares L, de Marinis F, Dediu M, et al.: Maintenance therapy with pemetrexed plus best supportive care versus placebo plus best supportive care after induction therapy with pemetrexed plus cisplatin for advanced non-squamous non-small-cell lung cancer (PARAMOUNT): a double-blind, phase 3, randomised controlled trial. Lancet Oncol 13 (3): 247-55, 2012. [PUBMED Abstract]
- Socinski MA, Schell MJ, Peterman A, et al.: Phase III trial comparing a defined duration of therapy versus continuous therapy followed by second-line therapy in advanced-stage IIIB/IV non-small-cell lung cancer. J Clin Oncol 20 (5): 1335-43, 2002. [PUBMED Abstract]
- von Plessen C, Bergman B, Andresen O, et al.: Palliative chemotherapy beyond three courses conveys no survival or consistent quality-of-life benefits in advanced non-small-cell lung cancer. Br J Cancer 95 (8): 966-73, 2006. [PUBMED Abstract]
- Ciuleanu T, Brodowicz T, Zielinski C, et al.: Maintenance pemetrexed plus best supportive care versus placebo plus best supportive care for non-small-cell lung cancer: a randomised, double-blind, phase 3 study. Lancet 374 (9699): 1432-40, 2009. [PUBMED Abstract]
- Belani CP, Brodowicz T, Ciuleanu TE, et al.: Quality of life in patients with advanced non-small-cell lung cancer given maintenance treatment with pemetrexed versus placebo (H3E-MC-JMEN): results from a randomised, double-blind, phase 3 study. Lancet Oncol 13 (3): 292-9, 2012. [PUBMED Abstract]
- Soria JC, Ohe Y, Vansteenkiste J, et al.: Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. N Engl J Med 378 (2): 113-125, 2018. [PUBMED Abstract]
- Ramalingam SS, Vansteenkiste J, Planchard D, et al.: Overall Survival with Osimertinib in Untreated, EGFR-Mutated Advanced NSCLC. N Engl J Med 382 (1): 41-50, 2020. [PUBMED Abstract]
- Planchard D, Jänne PA, Cheng Y, et al.: Osimertinib with or without Chemotherapy in EGFR-Mutated Advanced NSCLC. N Engl J Med 389 (21): 1935-1948, 2023. [PUBMED Abstract]
- Wu YL, Cheng Y, Zhou X, et al.: Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation-positive non-small-cell lung cancer (ARCHER 1050): a randomised, open-label, phase 3 trial. Lancet Oncol 18 (11): 1454-1466, 2017. [PUBMED Abstract]
- Mok TS, Wu YL, Thongprasert S, et al.: Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 361 (10): 947-57, 2009. [PUBMED Abstract]
- Maemondo M, Inoue A, Kobayashi K, et al.: Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med 362 (25): 2380-8, 2010. [PUBMED Abstract]
- Mitsudomi T, Morita S, Yatabe Y, et al.: Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol 11 (2): 121-8, 2010. [PUBMED Abstract]
- Zhou C, Wu YL, Chen G, et al.: Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol 12 (8): 735-42, 2011. [PUBMED Abstract]
- Rosell R, Gervais R, Vergnenegre A, et al.: Erlotinib versus chemotherapy (CT) in advanced non-small cell lung cancer (NSCLC) patients (p) with epidermal growth factor receptor (EGFR) mutations: Interim results of the European Erlotinib Versus Chemotherapy (EURTAC) phase III randomized trial. [Abstract] J Clin Oncol 29 (Suppl 15): A-7503, 2011.
- Rosell R, Carcereny E, Gervais R, et al.: Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 13 (3): 239-46, 2012. [PUBMED Abstract]
- Sequist LV, Yang JC, Yamamoto N, et al.: Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 31 (27): 3327-34, 2013. [PUBMED Abstract]
- Yang JC, Wu YL, Schuler M, et al.: Afatinib versus cisplatin-based chemotherapy for EGFR mutation-positive lung adenocarcinoma (LUX-Lung 3 and LUX-Lung 6): analysis of overall survival data from two randomised, phase 3 trials. Lancet Oncol 16 (2): 141-51, 2015. [PUBMED Abstract]
- Wu YL, Zhou C, Hu CP, et al.: Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol 15 (2): 213-22, 2014. [PUBMED Abstract]
- Zhou C, Tang KJ, Cho BC, et al.: Amivantamab plus Chemotherapy in NSCLC with EGFR Exon 20 Insertions. N Engl J Med 389 (22): 2039-2051, 2023. [PUBMED Abstract]
- Peters S, Camidge DR, Shaw AT, et al.: Alectinib versus Crizotinib in Untreated ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med 377 (9): 829-838, 2017. [PUBMED Abstract]
- Hida T, Nokihara H, Kondo M, et al.: Alectinib versus crizotinib in patients with ALK-positive non-small-cell lung cancer (J-ALEX): an open-label, randomised phase 3 trial. Lancet 390 (10089): 29-39, 2017. [PUBMED Abstract]
- Shaw AT, Bauer TM, de Marinis F, et al.: First-Line Lorlatinib or Crizotinib in Advanced ALK-Positive Lung Cancer. N Engl J Med 383 (21): 2018-2029, 2020. [PUBMED Abstract]
- Solomon BJ, Bauer TM, Ignatius Ou SH, et al.: Post Hoc Analysis of Lorlatinib Intracranial Efficacy and Safety in Patients With ALK-Positive Advanced Non-Small-Cell Lung Cancer From the Phase III CROWN Study. J Clin Oncol 40 (31): 3593-3602, 2022. [PUBMED Abstract]
- Solomon BJ, Mok T, Kim DW, et al.: First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med 371 (23): 2167-77, 2014. [PUBMED Abstract]
- Mok T, Kim D, Wu Y, et al.: First-line crizotinib versus pemetrexed-cisplatin or pemetrexed-carboplatin in patients (pts) with advanced ALK-positive non-squamous non-small cell lung cancer (NSCLC): results of a phase III study (PROFILE 1014). [Abstract] J Clin Oncol 32 (Suppl 15): A-8002, 2014.
- Soria JC, Tan DSW, Chiari R, et al.: First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer (ASCEND-4): a randomised, open-label, phase 3 study. Lancet 389 (10072): 917-929, 2017. [PUBMED Abstract]
- Kim DW, Tiseo M, Ahn MJ, et al.: Brigatinib in Patients With Crizotinib-Refractory Anaplastic Lymphoma Kinase-Positive Non-Small-Cell Lung Cancer: A Randomized, Multicenter Phase II Trial. J Clin Oncol 35 (22): 2490-2498, 2017. [PUBMED Abstract]
- Planchard D, Smit EF, Groen HJM, et al.: Dabrafenib plus trametinib in patients with previously untreated BRAF(V600E)-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol 18 (10): 1307-1316, 2017. [PUBMED Abstract]
- Gainor JF, Shaw AT: Novel targets in non-small cell lung cancer: ROS1 and RET fusions. Oncologist 18 (7): 865-75, 2013. [PUBMED Abstract]
- Drilon A, Siena S, Dziadziuszko R, et al.: Entrectinib in ROS1 fusion-positive non-small-cell lung cancer: integrated analysis of three phase 1-2 trials. Lancet Oncol 21 (2): 261-270, 2020. [PUBMED Abstract]
- Shaw AT, Ou SH, Bang YJ, et al.: Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med 371 (21): 1963-71, 2014. [PUBMED Abstract]
- Wu YL, Yang JC, Kim DW, et al.: Phase II Study of Crizotinib in East Asian Patients With ROS1-Positive Advanced Non-Small-Cell Lung Cancer. J Clin Oncol 36 (14): 1405-1411, 2018. [PUBMED Abstract]
- Farago AF, Le LP, Zheng Z, et al.: Durable Clinical Response to Entrectinib in NTRK1-Rearranged Non-Small Cell Lung Cancer. J Thorac Oncol 10 (12): 1670-4, 2015. [PUBMED Abstract]
- Gatalica Z, Xiu J, Swensen J, et al.: Molecular characterization of cancers with NTRK gene fusions. Mod Pathol 32 (1): 147-153, 2019. [PUBMED Abstract]
- Drilon A, Laetsch TW, Kummar S, et al.: Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children. N Engl J Med 378 (8): 731-739, 2018. [PUBMED Abstract]
- Doebele RC, Drilon A, Paz-Ares L, et al.: Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol 21 (2): 271-282, 2020. [PUBMED Abstract]
- Drilon A, Hu ZI, Lai GGY, et al.: Targeting RET-driven cancers: lessons from evolving preclinical and clinical landscapes. Nat Rev Clin Oncol 15 (3): 151-167, 2018. [PUBMED Abstract]
- Drilon A, Subbiah V, Gautschi O, et al.: Selpercatinib in Patients With RET Fusion-Positive Non-Small-Cell Lung Cancer: Updated Safety and Efficacy From the Registrational LIBRETTO-001 Phase I/II Trial. J Clin Oncol 41 (2): 385-394, 2023. [PUBMED Abstract]
- Gainor JF, Curigliano G, Kim DW, et al.: Pralsetinib for RET fusion-positive non-small-cell lung cancer (ARROW): a multi-cohort, open-label, phase 1/2 study. Lancet Oncol 22 (7): 959-969, 2021. [PUBMED Abstract]
- Awad MM, Oxnard GR, Jackman DM, et al.: MET Exon 14 Mutations in Non-Small-Cell Lung Cancer Are Associated With Advanced Age and Stage-Dependent MET Genomic Amplification and c-Met Overexpression. J Clin Oncol 34 (7): 721-30, 2016. [PUBMED Abstract]
- Paik PK, Felip E, Veillon R, et al.: Tepotinib in Non-Small-Cell Lung Cancer with MET Exon 14 Skipping Mutations. N Engl J Med 383 (10): 931-943, 2020. [PUBMED Abstract]
- Wolf J, Seto T, Han JY, et al.: Capmatinib in MET Exon 14-Mutated or MET-Amplified Non-Small-Cell Lung Cancer. N Engl J Med 383 (10): 944-957, 2020. [PUBMED Abstract]
- Reck M, Rodríguez-Abreu D, Robinson AG, et al.: Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med 375 (19): 1823-1833, 2016. [PUBMED Abstract]
- Garassino MC, Gadgeel S, Speranza G, et al.: Pembrolizumab Plus Pemetrexed and Platinum in Nonsquamous Non-Small-Cell Lung Cancer: 5-Year Outcomes From the Phase 3 KEYNOTE-189 Study. J Clin Oncol 41 (11): 1992-1998, 2023. [PUBMED Abstract]
- Novello S, Kowalski DM, Luft A, et al.: Pembrolizumab Plus Chemotherapy in Squamous Non-Small-Cell Lung Cancer: 5-Year Update of the Phase III KEYNOTE-407 Study. J Clin Oncol 41 (11): 1999-2006, 2023. [PUBMED Abstract]
- Reck M, Rodríguez-Abreu D, Robinson AG, et al.: Updated Analysis of KEYNOTE-024: Pembrolizumab Versus Platinum-Based Chemotherapy for Advanced Non-Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score of 50% or Greater. J Clin Oncol 37 (7): 537-546, 2019. [PUBMED Abstract]
- de Castro G, Kudaba I, Wu YL, et al.: Five-Year Outcomes With Pembrolizumab Versus Chemotherapy as First-Line Therapy in Patients With Non-Small-Cell Lung Cancer and Programmed Death Ligand-1 Tumor Proportion Score ≥ 1% in the KEYNOTE-042 Study. J Clin Oncol 41 (11): 1986-1991, 2023. [PUBMED Abstract]
- Gogishvili M, Melkadze T, Makharadze T, et al.: Cemiplimab plus chemotherapy versus chemotherapy alone in non-small cell lung cancer: a randomized, controlled, double-blind phase 3 trial. Nat Med 28 (11): 2374-2380, 2022. [PUBMED Abstract]
- Sezer A, Kilickap S, Gümüş M, et al.: Cemiplimab monotherapy for first-line treatment of advanced non-small-cell lung cancer with PD-L1 of at least 50%: a multicentre, open-label, global, phase 3, randomised, controlled trial. Lancet 397 (10274): 592-604, 2021. [PUBMED Abstract]
- Özgüroğlu M, Kilickap S, Sezer A, et al.: First-line cemiplimab monotherapy and continued cemiplimab beyond progression plus chemotherapy for advanced non-small-cell lung cancer with PD-L1 50% or more (EMPOWER-Lung 1): 35-month follow-up from a mutlicentre, open-label, randomised, phase 3 trial. Lancet Oncol 24 (9): 989-1001, 2023. [PUBMED Abstract]
- Johnson ML, Cho BC, Luft A, et al.: Durvalumab With or Without Tremelimumab in Combination With Chemotherapy as First-Line Therapy for Metastatic Non-Small-Cell Lung Cancer: The Phase III POSEIDON Study. J Clin Oncol 41 (6): 1213-1227, 2023. [PUBMED Abstract]
- Herbst RS, Giaccone G, de Marinis F, et al.: Atezolizumab for First-Line Treatment of PD-L1-Selected Patients with NSCLC. N Engl J Med 383 (14): 1328-1339, 2020. [PUBMED Abstract]
- West H, McCleod M, Hussein M, et al.: Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 20 (7): 924-937, 2019. [PUBMED Abstract]
- Socinski MA, Jotte RM, Cappuzzo F, et al.: Atezolizumab for First-Line Treatment of Metastatic Nonsquamous NSCLC. N Engl J Med 378 (24): 2288-2301, 2018. [PUBMED Abstract]
- Brahmer JR, Lee JS, Ciuleanu TE, et al.: Five-Year Survival Outcomes With Nivolumab Plus Ipilimumab Versus Chemotherapy as First-Line Treatment for Metastatic Non-Small-Cell Lung Cancer in CheckMate 227. J Clin Oncol 41 (6): 1200-1212, 2023. [PUBMED Abstract]
- Hellmann MD, Ciuleanu TE, Pluzanski A, et al.: Nivolumab plus Ipilimumab in Lung Cancer with a High Tumor Mutational Burden. N Engl J Med 378 (22): 2093-2104, 2018. [PUBMED Abstract]
- Yao JC, Fazio N, Singh S, et al.: Everolimus for the treatment of advanced, non-functional neuroendocrine tumours of the lung or gastrointestinal tract (RADIANT-4): a randomised, placebo-controlled, phase 3 study. Lancet 387 (10022): 968-977, 2016. [PUBMED Abstract]
- Danson S, Middleton MR, O'Byrne KJ, et al.: Phase III trial of gemcitabine and carboplatin versus mitomycin, ifosfamide, and cisplatin or mitomycin, vinblastine, and cisplatin in patients with advanced nonsmall cell lung carcinoma. Cancer 98 (3): 542-53, 2003. [PUBMED Abstract]
- Pfister DG, Johnson DH, Azzoli CG, et al.: American Society of Clinical Oncology treatment of unresectable non-small-cell lung cancer guideline: update 2003. J Clin Oncol 22 (2): 330-53, 2004. [PUBMED Abstract]
- Smit EF, van Meerbeeck JP, Lianes P, et al.: Three-arm randomized study of two cisplatin-based regimens and paclitaxel plus gemcitabine in advanced non-small-cell lung cancer: a phase III trial of the European Organization for Research and Treatment of Cancer Lung Cancer Group--EORTC 08975. J Clin Oncol 21 (21): 3909-17, 2003. [PUBMED Abstract]
- Kubota K, Watanabe K, Kunitoh H, et al.: Phase III randomized trial of docetaxel plus cisplatin versus vindesine plus cisplatin in patients with stage IV non-small-cell lung cancer: the Japanese Taxotere Lung Cancer Study Group. J Clin Oncol 22 (2): 254-61, 2004. [PUBMED Abstract]
- Georgoulias V, Ardavanis A, Agelidou A, et al.: Docetaxel versus docetaxel plus cisplatin as front-line treatment of patients with advanced non-small-cell lung cancer: a randomized, multicenter phase III trial. J Clin Oncol 22 (13): 2602-9, 2004. [PUBMED Abstract]
- Sandler AB, Nemunaitis J, Denham C, et al.: Phase III trial of gemcitabine plus cisplatin versus cisplatin alone in patients with locally advanced or metastatic non-small-cell lung cancer. J Clin Oncol 18 (1): 122-30, 2000. [PUBMED Abstract]
- Lester JF, Macbeth FR, Toy E, et al.: Palliative radiotherapy regimens for non-small cell lung cancer. Cochrane Database Syst Rev (4): CD002143, 2006. [PUBMED Abstract]
- Ung YC, Yu E, Falkson C, et al.: The role of high-dose-rate brachytherapy in the palliation of symptoms in patients with non-small-cell lung cancer: a systematic review. Brachytherapy 5 (3): 189-202, 2006 Jul-Sep. [PUBMED Abstract]
- Salerno TA, Munro DD, Blundell PE, et al.: Second primary bronchogenic carcinoma: life-table analysis of surgical treatment. Ann Thorac Surg 27 (1): 3-6, 1979. [PUBMED Abstract]
- Yellin A, Hill LR, Benfield JR: Bronchogenic carcinoma associated with upper aerodigestive cancers. J Thorac Cardiovasc Surg 91 (5): 674-83, 1986. [PUBMED Abstract]
- Patchell RA, Tibbs PA, Walsh JW, et al.: A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med 322 (8): 494-500, 1990. [PUBMED Abstract]
- Mandell L, Hilaris B, Sullivan M, et al.: The treatment of single brain metastasis from non-oat cell lung carcinoma. Surgery and radiation versus radiation therapy alone. Cancer 58 (3): 641-9, 1986. [PUBMED Abstract]
- Loeffler JS, Kooy HM, Wen PY, et al.: The treatment of recurrent brain metastases with stereotactic radiosurgery. J Clin Oncol 8 (4): 576-82, 1990. [PUBMED Abstract]
- Arbit E, Wroński M, Burt M, et al.: The treatment of patients with recurrent brain metastases. A retrospective analysis of 109 patients with nonsmall cell lung cancer. Cancer 76 (5): 765-73, 1995. [PUBMED Abstract]
- Hazuka MB, Kinzie JJ: Brain metastases: results and effects of re-irradiation. Int J Radiat Oncol Biol Phys 15 (2): 433-7, 1988. [PUBMED Abstract]
Tratamiento del cáncer de pulmón de células no pequeñas en estadio IV progresivo, en recaída y recidivante
Opciones de tratamiento para el cáncer de pulmón de células no pequeñas en estadio IV, progresivo, en recaída y recidivante (terapia de segunda línea)
Las opciones de tratamiento (terapia de segunda línea) para el cáncer de pulmón de células no pequeñas (CPCNP) en estadio IV progresivo, en recaída y recidivante son las siguientes:
- Quimioterapia.
- Terapia dirigida a EGFR.
- Terapia dirigida a EGFR luego de la quimioterapia de primera línea (para pacientes con mutaciones sensibilizantes en EGFR).
- Terapia dirigida a EGFR (para pacientes con mutaciones T790M en EGFR adquiridas luego de una terapia dirigida a EGFR previa).
- Terapia dirigida a EGFR luego de la quimioterapia de primera línea (para pacientes con mutaciones de inserción del exón 20 en EGFR)
- Inhibidores de tirosina–cinasas (ITC) dirigidos a ALK.
- Inhibidores de BRAF y MEK (para pacientes con mutaciones BRAF V600E).
- Terapia dirigida a ROS1.
- Inhibidores del receptor de la tirosina–cinasa neurotrófica (para pacientes con fusiones de NTRK).
- Inhibidores de RET (para pacientes con fusiones de RET).
- Inhibidores de MET (para pacientes con mutaciones de omisión del exón 14 de MET).
- Inhibidores de KRAS G12C (para pacientes con mutaciones KRASG12C).
- Terapia dirigida a HER2 (para pacientes con mutaciones en HER2).
- Inmunoterapia.
- Inhibidores del blanco de la rapamicina en los mamíferos (mTOR) (para pacientes con tumores neuroendocrinos irresecables, localmente avanzados o metastásicos, progresivos, bien diferenciados y no funcionantes).
- La participación en ensayos clínicos se puede considerar como terapia de segunda línea.
Quimioterapia
El uso de quimioterapia ha producido respuestas objetivas y una pequeña mejoría de la supervivencia en los pacientes con enfermedad metastásica.[1][Nivel de evidencia A1] En estudios en los que se ha examinado la respuesta sintomática, se informó que la mejoría de los síntomas subjetivos se presenta con mayor frecuencia que la respuesta objetiva.[2,3] Se puede ofrecer tratamiento con un régimen de quimioterapia con derivados del platino para la paliación de los síntomas a los pacientes con recidiva sintomática, que tienen buen estado funcional y están bien informados. La terapia de segunda línea se puede considerar para los pacientes que recayeron después de la quimioterapia con derivados del platino.
Docetaxel
Evidencia (docetaxel):
- En dos estudios prospectivos se observó mejoría de la supervivencia con el uso de docetaxel en comparación con vinorelbina, ifosfamida, o el mejor cuidado de apoyo;[4,5] sin embargo, no se han definido bien los criterios para la selección apropiada de los pacientes que recibirían el tratamiento de segunda línea.[6]
- Se dio a conocer un metanálisis de 5 ensayos con 865 pacientes en los que se evaluó la eficacia y la inocuidad del docetaxel administrado 1 vez por semana o cada 3 semanas.[7] En ese análisis, se observaron los siguientes resultados:
- La mediana de supervivencia fue de 27,4 semanas en los pacientes tratados cada 3 semanas y de 26,1 semanas en los pacientes tratados cada semana (orden logarítmico P = 0,24).
- La neutropenia y la neutropenia febril fueron significativamente menos graves con el docetaxel semanal (P < 0,001 para ambos); sin embargo, no se observaron diferencias significativas en la anemia, la trombocitopenia y los efectos tóxicos no hematológicos.
Docetaxel y ramucirumab
Evidencia (docetaxel y ramucirumab):
- En un ensayo controlado con placebo con enmascaramiento doble de fase III, se asignó al azar a 1253 pacientes con estado funcional del Eastern Cooperative Oncology Group (ECOG) de 0 a 1, cuya enfermedad progresó después de la quimioterapia de primera línea, a recibir docetaxel y placebo, o docetaxel y ramucirumab.[8][Nivel de evidencia A1] El ramucirumab es un anticuerpo monoclonal humano tipo inmunoglobulina G1 que se dirige al dominio extracelular del receptor 2 del factor de crecimiento endotelial vascular. El criterio principal de valoración del estudio fue la supervivencia general (SG), y los criterios secundarios de valoración fueron la supervivencia sin progresión (SSP) y la tasa de respuesta objetiva. En el estudio, se inscribieron pacientes de CPCNP no escamosas o escamosas; sin embargo, se excluyeron los pacientes con hipertensión precariamente controlada, perforación o fistula gastrointestinal, episodio tromboembólico dentro de los 6 meses previos (antes de la asignación aleatoria), hemoptisis macroscópica dentro de los 2 meses previos o hemorragia gastrointestinal de grado 3 a 4 dentro de los 3 meses previos. Además, en el ensayo no se incluyeron pacientes que tenían tumores con compromiso de vasos principales o cavitación intratumoral.
- La adición del ramucirumab al docetaxel comparada con placebo y docetaxel condujo a un aumento de la mediana de SG (10,5 vs. 9,1 meses; cociente de riesgos instantáneos [CRI], 0,86; intervalo de confianza [IC] 95 %, 0,75–0,98), la tasa de respuesta objetiva (23 vs. 14 %), y la SSP (4,5 vs. 3 meses). La mejora de la SG con la adición de ramucirumab fue constante entre los subgrupos con subtipos histológicos de células escamosas y no escamosas.
- Se presentaron efectos adversos de grados 3 a 4 relacionados con el tratamiento en el 79 % de los pacientes que recibieron docetaxel y ramucirumab en comparación con el 71 % de los pacientes que recibieron docetaxel y placebo. Los efectos tóxicos más comunes relacionados con la adición de ramucirumab al docetaxel fueron neutropenia febril, fatiga e hipertensión. No hubo una diferencia significativa en la incidencia de hemorragias de grado 3 a 4 entre los grupos.
- A partir de este estudio, la adición de ramucirumab a la quimioterapia con docetaxel se puede considerar para los pacientes de CPCNP en estadio avanzado con buen estado funcional que tienen enfermedad progresiva después de la quimioterapia de primera línea.
Pemetrexed
Evidencia (pemetrexed):
- En un ensayo aleatorizado de fase III con 571 pacientes que se diseñó para demostrar que el pemetrexed no es inferior al docetaxel, se observó lo siguiente:
- En el ensayo, se demostró que no hay diferencias en las tasas de respuesta, la SSP o la SG.[9][Nivel de evidencia A1]
- Es importante resaltar que los pacientes con tipo histológico de células escamosa se beneficiaron del uso de docetaxel y aquellos con tipo histológico de células no escamosas se beneficiaron más del uso de pemetrexed.[10]
Terapia dirigida a EGFR
El CPCNP avanzado que contiene las mutaciones características en el gen del receptor del factor de crecimiento epidérmico EGFR, de manera más frecuente deleciones del exón 19 o mutaciones L858R en el exón 21, son muy sensibles a los ITC de EGFR. El abordaje estándar para decidir si se usan los ITC de EGFR en el tratamiento de un paciente con CPCNP avanzado es analizar el tumor para determinar la presencia o ausencia de una mutación oncoiniciadora en EGFR. Las inserciones del exón 20 en EGFR son mutaciones infrecuentes que no son sensibles a los ITC de EGFR usados en el tratamiento del CPCNP con mutaciones sensibilizantes en EGFR.
Terapia dirigida a EGFR luego de la quimioterapia de primera línea (para pacientes con mutaciones sensibilizantes en EGFR)
Erlotinib
Evidencia (erlotinib):
En dos ensayos controlados aleatorizados con placebo, se indicó que el erlotinib prolonga la supervivencia y el tiempo transcurrido hasta que se presentan síntomas de deterioro en pacientes con CPCNP después de la quimioterapia de primera o segunda línea en comparación con un placebo, [11,12] pero no mejora la supervivencia en comparación con la quimioterapia estándar de segunda línea con docetaxel o pemetrexed.[13]
- En un ensayo de erlotinib versus el mejor cuidado de apoyo se incluyeron 731 pacientes, el 49 % recibieron antes 2 regímenes de quimioterapia y el 93 % recibieron antes quimioterapia con derivados del platino.
- La SG fue de 6,7 en los pacientes que recibieron antes dos regímenes de quimioterapia y de 4,7 meses en quienes recibieron antes quimioterapia con derivados del platino. El CRI fue de 0,70 (P < 0,001) a favor del erlotinib.[11][Nivel de evidencia A1]
- En un segundo ensayo (NCT00556322), que se diseñó para demostrar la superioridad del erlotinib versus la quimioterapia estándar de segunda línea después de la progresión de la enfermedad durante la terapia combinada con un derivado del platino de primera línea, en este estudio se asignó al azar a 424 pacientes.
- No hubo diferencia en el criterio principal de valoración de la SG (mediana de SG, 5,3 vs. 5,5 meses; CRI, 0,96; IC 95 %, 0,78–1,19).[13][Nivel de evidencia A1]
Gefitinib
Evidencia (gefitinib):
- En un estudio aleatorizado de fase III en el que se evaluó el gefitinib versus un placebo en 1692 pacientes de CPCNP previamente tratados, se observaron los siguientes resultados:
- El gefitinib no mejoró la SG.
- La mediana de supervivencia no difirió significativamente entre los grupos en la población en general (5,6 meses para gefitinib y 5,1 meses para el placebo; CRI, 0,89, IC 95 %, 0,77–1,02; P = 0,087) o entre los 812 pacientes con adenocarcinoma (6,3 vs. 5,4 meses; CRI, 0,84; IC, 0,68–1,03; P = 0,089).
- En los análisis de subgrupos planificados con anticipación se observó una supervivencia significativamente más larga en el grupo de gefitinib que en el grupo de placebo para los pacientes que nunca habían fumado (n = 375; IC 95 %, 0,67 [0,49–0,92]; P = 0,012; mediana de supervivencia de 8,9 vs. 6,1 meses) y para los pacientes de origen asiático (n = 342; IC 95 %, 0,66 [0,48–0,91]; P = 0,01; mediana de supervivencia 9,5 vs. 5,5 meses).[14][Nivel de evidencia A1]
- En un ensayo aleatorizado grande, se comparó gefitinib con docetaxel en pacientes de CPCNP localmente avanzado o metastásico que habían recibido tratamiento previo con quimioterapia con derivados del platino.[15] El objetivo principal fue comparar la SG de los grupos mediante análisis coprimario y así evaluar la ausencia de inferioridad en la población general y la superioridad en los pacientes con un número alto de copias del gen EGFR en la población por intención de tratar. Los 1466 pacientes se asignaron al azar para recibir gefitinib (250 mg diarios por vía oral; n = 733) o docetaxel (75 mg/m2 intravenoso [IV] cada 3 semanas; n = 733).
- La ausencia de inferioridad del gefitinib comparado con el docetaxel se confirmó para la SG (CRI, 1,020; IC 95 %, 0,905–1,150). Sin embargo, no se demostró la superioridad del gefitinib en pacientes con un número alto de copias del gen EGFR (85 vs. 89 pacientes) (CRI, 1,09; IC 95 %, 0,78–1,51; P = 0,62).
- En el grupo de gefitinib, los efectos adversos más comunes fueron erupción cutánea o acné (49 vs. 10 %) y diarrea (35 vs. 25 %). En el grupo de docetaxel, los efectos más comunes fueron neutropenia (5 vs. 74 %), astenia (25 vs. 47 %) y alopecia (3 vs. 36 %).
- En este ensayo se estableció la ausencia de inferioridad para la supervivencia de los pacientes tratados con gefitinib en comparación con docetaxel, lo que indica que el gefitinib es un tratamiento válido para los pacientes de CPCNP en estadio avanzado previamente tratados.
Es más probable que la respuesta objetiva al erlotinib y el gefitinib se presente en pacientes con carcinoma bronquioloalveolar que nunca han fumado, mujeres y de raza de Asia Oriental o tiene adenocarcinoma o carcinoma bronquioloalveolar.[16-22] Las respuestas quizás se relacionen con la presencia de mutaciones sensibilizantes en el dominio tirosina–cinasa de EGFR [17-19,21,22] y con la ausencia de mutaciones en KRAS.[20-22][Nivel de evidencia C2] El beneficio de supervivencia es mayor en los pacientes que expresan la proteína EGFR en pruebas inmunohistoquímicas o tienen aumento en el número de copias del gen EGFR en estudios de hibridación fluorescente in situ (FISH),[21,22] pero la utilidad clínica de las pruebas inmunohistoquímicas de EGFR se ha cuestionado.[23]
Afatinib
Evidencia (afatinib):
- El afatinib, un inhibidor irreversible de la familia de receptores ErbB se comparó con el erlotinib como tratamiento de segunda línea en pacientes con carcinoma de células escamosas avanzado. En un ensayo de aleatorizado controlado de fase III (LUX-Lung 8 [NCT01523587]), los pacientes con CPCNP escamosas en estadio IIIB/IV y progresión de la enfermedad después de la quimioterapia con derivados del platino, se asignaron al azar en una proporción 1:1 para recibir afatinib (398 pacientes, 40 mg orales diarios) o erlotinib (397 pacientes, 150 mg orales diarios).[24][Nivel de evidencia B1] El criterio principal de valoración fue la SSP. Los criterios secundarios de valoración fueron la SG y la tasa de respuesta.
- Después de una mediana de seguimiento de 6,7 meses, la SSP fue de 2,4 versus 1,9 meses (CRI, 0,82; IC 95 %, 0,68–1,00).
- Después de una mediana de seguimiento de 18,4 meses, la mediana de SG fue significativamente más larga en el grupo de afatinib (7,9 vs. 6,8 meses; CRI, 0,81; IC 95 %, 0,69–0,95; P = 0,007). La supervivencia a los 6 meses (63,6 % vs. 54,6 %; P = 0,009), 12 meses (36,4 % vs. 28,2 %; P = 0,015) y 18 meses (22 % vs. 14,4 %; P = 0,013) fueron significativamente mejores en los pacientes que recibieron afatinib.
- No se presentaron diferencias significativas en la tasa de respuesta en los dos grupos (6 vs. 3 %; P = 0,551).
- La frecuencia de efectos adversos fue similar entre los 2 grupos, el 57 % de los pacientes presentó efectos adversos de grado 3 o mayor. La diarrea y la estomatitis relacionadas con el tratamiento de grado 3 fueron más comunes en el grupo de afatinib; no obstante, la erupción o el acné de grado 3 fueron más comunes en los pacientes que recibieron erlotinib.
- El afatinib, en comparación con el erlotinib, representa otra opción para el tratamiento de segunda línea de pacientes con CPCNP escamosas en estadio IV.
Terapia dirigida a EGFR (para pacientes con mutaciones T790M en EGFR adquiridas luego de una terapia previa dirigida a EGFR)
Osimertinib
Evidencia (osimertinib):
- En un estudio sin anonimato de fase III (AURA 3 [NCT02151981]) se evaluó el osimertinib en pacientes de CPCNP con mutaciones sensibilizantes en EGFR cuya enfermedad progresó después de recibir inhibidores de EGFR como terapia de primera línea y que tenían la mutación resistente T790M en EGFR según se determinó en la prueba cobas® EGFR Mutation Test.[25] En el ensayo se asignó al azar a 419 pacientes (en una proporción 2:1) para recibir 80 mg orales diarios de osimertinib, o pemetrexed con carboplatino, o cisplatino IV cada 3 semanas durante un máximo de 6 ciclos; se permitió que el grupo de quimioterapia recibiera pemetrexed de mantenimiento. El criterio principal de valoración fue la SSP.
- El osimertinib fue superior a la quimioterapia para prolongar la mediana de SSP (10,1 vs. 4,4 meses; CRI, 0,30; IC 95 %, 0,23–0,41; P < 0,001).
- La respuesta objetiva fue del 71 % para el osimertinib versus el 31 % para la terapia con derivados del platino (oportunidad relativa para la respuesta objetiva, 5,39; IC 95 %, 3,47–8,48; P < 0,001).
- Entre los 144 pacientes con metástasis en el sistema nervioso central (SNC), la mediana de duración de la SSP fue de 8,5 meses con osimertinib versus 4,2 meses con terapia con derivados del platino (CRI, 0,32; IC 95 %, 0,21–0,49).
- Los efectos adversos de grado 3 o mayor se presentaron en el 23 % de los pacientes tratados con osimertinib versus el 47 % de los pacientes tratados con derivados del platino.[25][Nivel de evidencia B1]
Terapia dirigida a EGFR luego de la quimioterapia de primea línea (para pacientes con mutaciones de inserción del exón 20 en EGFR)
Amivantamab
Evidencia (amivantamab):
- En un estudio sin enmascaramiento de aumento gradual y administración ampliada de la dosis de fase I (CHRYSALIS [NCT02609776]), se investigó el amivantamab, un anticuerpo biespecífico contra EGFR-MET, en varios grupos de pacientes. Un grupo de 114 pacientes con mutaciones de inserción del exón 20 en EGFR que se habían tratado con quimioterapia a base de platino recibieron la dosis recomendada para el amivantamab en la fase II (1050 mg [1400 mg si >80 kg] IV) una vez a la semana durante las primeras 4 semanas y luego una vez cada 2 semanas comenzando a la semana 5. El criterio principal de valoración en el grupo de administración ampliada de la dosis fue la tasa de respuesta general.[26][Nivel de evidencia C3]
- En el momento de la fecha límite para la inclusión de datos, 81 pacientes eran evaluables y contaban por lo menos con 3 evaluaciones de la enfermedad. La tasa de respuesta general fue del 40 % (IC 95 %, 29–51 %), incluso 3 respuestas completas. La mediana de duración de la respuesta (DR) fue de 11,1 meses (IC 95 % IC, 6,9–no se alcanzó). La tasa de beneficio clínico (incluso los pacientes con enfermedad estable) fue del 74 % (IC 95 %, 63–83 %).
- La mediana de SSP fue de 8,3 meses (IC 95 %, 6,5–10,9); los datos de SG no son definitivos.
- Los efectos adversos más comunes fueron exantema (86 %), reacciones a la infusión (66 %) y paroniquia (45 %). Los pacientes presentaron efectos adversos relacionados con la inhibición de EGFR (exantema, paroniquia, estomatitis, prurito y diarrea) y de MET (hipoalbuminemia, edema periférico). Los efectos adversos de grado 3 o mayor se presentaron en el 35 % de los pacientes, los más comunes fueron exantema (4 %) y reacciones a la infusión (3 %).
- Las reacciones a la infusión se presentaron de manera primaria durante la primera exposición al amivantamab. Se administró la primera dosis dividida durante 2 días para reducir la toxicidad.
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) otorgó la aprobación acelerada para el uso del amivantamab en el tratamiento de los pacientes con mutaciones del exón 20 en EGFR cuya enfermedad progresó durante el tratamiento a base de derivados del platino o después.
Mobocertinib
Evidencia (mobocertinib):
- En un ensayo clínico sin anonimato de aumento gradual y administración ampliada de la dosis de fase I/II (NCT02716116), se examinó el tratamiento con mobocertinib en varios subgrupos de pacientes definidos por características moleculares e histológicas. Esta investigación de 3 partes incluyó una cohorte de aumento gradual de la dosis, una cohorte de administración ampliada de la dosis en los subgrupos definidos y una cohorte de extensión (EXCLAIM). Un grupo de 114 pacientes con mutaciones de inserción del exón 20 en EGFR tratados antes con regímenes a base de platino recibieron el mobocertinib (160 mg oral) una vez al día. El criterio principal de valoración fue la respuesta general, evaluada por un comité de revisión independiente.[27][Nivel de evidencia C3]
- La tasa de respuesta general fue del 28 % (IC 95 %, 20–37 %), con una mediana de DR de 17,5 meses (IC 95 %, 7,4–20,3).
- La mediana de SSC fue de 7,3 meses (IC 95 %, 5,5–9,2), y la mediana de SG fue de 24,0 meses (IC 95 %, 14,6–28,8).
- Los efectos adversos más frecuentes fueron diarrea (91 % de cualquier grado, el 21 % de grado >3) y exantema (45 %). La mayoría de los efectos adversos fueron de grado 1 a 2, controlados con modificación de la dosis, cuidados médicos de apoyo o interrupción de la dosis. El 17 % de los participantes descontinuó el tratamiento debido a efectos adversos. Un paciente murió por insuficiencia cardiaca que se cree estuvo vinculada con el tratamiento.
La FDA otorgó la aprobación acelerada para el uso del mobocertinib en el tratamiento de pacientes con mutaciones del exón 20 en EGFR cuya enfermedad progresó durante el tratamiento a base de derivados del platino o después.
Inhibidores de tirosina–cinasas dirigidos a ALK
Inhibidores de tirosina–cinasas dirigidos a ALK luego de la quimioterapia de primera línea
Crizotinib
Evidencia (crizotinib):
- En un estudio (NCT00585195) en el que se realizaron exámenes para detectar reordenamientos de ALK en 1500 pacientes de CPCNP, se identificó a 82 pacientes con enfermedad avanzada y expresión de ALK que se inscribieron en un ensayo clínico de ampliación de una cohorte realizado después del aumento escalonado de la dosis de fase I, en este estudio se estableció que la dosis recomendada para una inhibición dual con crizotinib y un inhibidor de ALK es de 250 mg 2 veces por día en ciclos de 28 días.[28] La mayoría de pacientes habían recibido tratamiento previo.
- Al cabo de una media de duración del tratamiento de 6,4 meses, la tasa de respuesta general fue del 57 % (47 de 82 pacientes, 46 respuestas parciales confirmadas y 1 respuesta completa confirmada); 27 pacientes (33 %) presentaban enfermedad estable.[28][Nivel de evidencia C2]
- El cálculo de la probabilidad de una SSP a 6 meses fue del 72 %.
- La tasa de SG a 1 año fue del 74 % (IC 95 %, 63–82 %), y la tasa de SG a 2 años fue del 54 % (40–66 %).
- La supervivencia en 30 pacientes con expresión de ALK que recibieron crizotinib en el entorno de segunda o tercera línea fue significativamente más larga que en 23 controles con expresión de ALK, identificados en una cohorte diferente que recibió cualquier terapia de segunda línea (mediana de SG no alcanzada [IC 95 %, 14 meses–no alcanzada] vs. 6 meses [IC 95 %, 4–17]; la tasa de SG a 1 año, 70 % [IC 95 %, 50–83 %] vs. 44 % [IC 95 %, 23–64 %] y la tasa de SG a 2 años, 55 % [33–72 %] vs. 12 % [2–30 %]; CRI, 0,36; IC 95 %, 0,17–0,75; P = 0,004).[29][Nivel de evidencia C2]
- Los efectos tóxicos comunes fueron efectos secundarios gastrointestinales (leves) de grado 1 o 2.
- Los pacientes con reordenamientos de ALK fueron más jóvenes que aquellos sin reordenamientos; la mayoría de los pacientes tenían escasa exposición al tabaco o ninguna exposición al tabaco; todos los pacientes tenían adenocarcinomas.
- En un estudio aleatorizado sin anonimato de fase III, 347 pacientes de CPCNP en estadios IIIB/IV que albergaban translocaciones de ALK y que se habían sometido antes a un régimen de quimioterapia con derivados del platino, recibieron crizotinib (250 mg oral 2 veces por día) o quimioterapia (pemetrexed 500 mg/m2 si no habían recibido pemetrexed, o recibieron docetaxel 75mg/m2 IV cada 21 días).[30]
- El criterio principal de valoración fue la SSP. La mediana de SSP fue significativamente más larga en favor del crizotinib (7,7 vs. 3,0 meses, P < 0,001).[30][Nivel de evidencia B1]
- La SG, el criterio secundario de valoración, no fue significativamente diferente, pero hubo un cruce importante de pacientes en el diseño.
Inhibidores de tirosina–cinasas dirigidos a ALK luego de una terapia previa con inhibidores de tirosina–cinasas dirigidos a ALK
Ceritinib
Evidencia (ceritinib):
- En un ensayo sin anonimato de un solo grupo, se inscribió a 163 pacientes de CPCNP en estadios IIIB/IV que expresaban translocación de ALK, y cuya enfermedad progresó mientras recibían crizotinib o no lo toleraron.[31] El criterio principal de valoración fue la tasa de respuesta objetiva, de acuerdo con los Response Evaluation Criteria In Solid Tumors (RECIST, versión 1.0) con un criterio secundario de valoración de DR.
- La tasa de respuesta objetiva evaluada por revisión independiente enmascarada fue del 43,6 % (IC 95 %, 36–52 %) y la mediana de DR fue de 7,1 meses (intervalo, 5,6–no estimable).[31][Nivel de evidencia C3]
- Cabe destacar que, el 38 % de los pacientes necesitaron una modificación de la dosis debido a efectos tóxicos gastrointestinales; se presentó un aumento de la alanina-transaminasa a más de 5 veces del límite normal superior en un 27 % de los pacientes.
Alectinib
Evidencia (alectinib):
- En un ensayo sin anonimato de fase II (NCT01871805), se inscribió a 87 pacientes de CPCNP en estadio IIIB/IV con translocación de ALK y cuya enfermedad progresó después del tratamiento con crizotinib.[32]
- El criterio principal de valoración fue la respuesta objetiva de acuerdo con RECIST (versión 1.1). En el momento del análisis del criterio principal de valoración de este estudio en marcha, el 48 % de los pacientes (IC 95 %, 36–60 %) exhibían una respuesta parcial confirmada y el 32 % presentaban enfermedad estable según una revisión independiente enmascarada. La mediana de DR fue de 13,5 meses (IC 95 %, 6,7–no estimable). El cálculo de la mediana de DR fue de 8,1 meses (IC 95 %, 6,2–12,6).[32][Nivel de evidencia C3]
- Al inicio, 16 pacientes tenían enfermedad cuantificable en el SNC, y entre ellos, 11 habían recibido radioterapia. La tasa de respuesta general en el SNC fue del 75 % (IC 95 %, 48–93 %); el 25 % lograron una respuesta completa y el 50 % lograron una respuesta parcial.
- Los efectos secundarios más comunes fueron de grado 1 o 2; los efectos adversos más frecuentes, que se presentaron en el 23 % al 36 % de los pacientes, fueron estreñimiento, fatiga, mialgia y edema periférico. Fue necesario interrumpir las dosis en el 36 % de los pacientes y se redujo las dosis a un 16 % de los pacientes.
- En un segundo ensayo sin anonimato de fase II, se inscribió a 138 pacientes de cáncer de pulmón en estadio IIIB/IV con expresión de ALK cuya enfermedad progresó con crizotinib.[33]
- El criterio principal de valoración fue la tasa de respuesta objetiva evaluada por una revisión central independiente. La tasa de respuesta objetiva fue del 50 % (IC 95 %, 41–59 %). La mediana de DR fue de 11,2 meses (IC 95 %, 9,6–no alcanzada). La mediana de SSP fue de 8,9 meses (IC 95 %, 5,6–11,3).[33][Nivel de evidencia C3]
- La tasa de respuesta objetiva en el SNC de 35 pacientes con lesiones cuantificables en el SNC fue del 57 % (IC 95 %, 39–74 %).
- Los efectos adversos comunes, que en su mayoría fueron de grado 1 o 2, se presentaron en el 25 % al 33 % de los pacientes y fueron estreñimiento, fatiga y edema periférico.
Brigatinib
Evidencia (brigatinib):
- En un ensayo sin anonimato de fase II (NCT02094573), se inscribió a 222 pacientes de CPCNP localmente avanzado o metastásico con translocación de ALK cuya enfermedad progresó después del tratamiento con crizotinib. Los pacientes se asignaron al azar para recibir 90 mg diarios (n = 112, 109 tratados) o 180 mg diarios con un período de 7 días de preinclusión de 90 mg diarios (n = 110).[34]
- El criterio principal de valoración evaluado por los investigadores fue la tasa de respuesta objetiva. La tasa de respuesta objetiva fue del 45 % (IC 97,5 %, 34–56 %) para los pacientes que recibieron dosis de 90 mg y del 54 % (IC 97,5 %, 43–65 %) para los pacientes que recibieron dosis de 180 mg.
- La mediana de SSP fue de 9,2 meses (IC 95 %, 7,4–15,6) para los pacientes que recibieron dosis de 90 mg y de 12,9 meses (IC 95 %, 11,1–no alcanzada) para los pacientes que recibieron dosis de 180 mg.
- En el momento límite de inclusión de datos, la mediana de DR fue de 13,8 meses (IC 95 %, 5,6–13,8) para los pacientes que recibieron dosis de 90 mg y de 11,1 meses (IC 95 %) 9,2–13,8) para los pacientes que recibieron dosis de 180 mg.[34][Nivel de evidencia B3]
- La tasa de respuesta objetiva en el SNC en pacientes con lesiones cuantificables en el SNC fue del 42 % para los pacientes que recibieron dosis de 90 mg diarios (n = 26) y del 67 % para los pacientes que recibieron dosis de 180 mg diarios (n = 18).
- Los efectos adversos comunes, que en su mayoría fueron de grado 1 o 2, se presentaron en el 27 % al 38 % de los pacientes que recibieron la dosis más alta y fueron náuseas, diarrea, cefalea y tos. Un subconjunto de efectos pulmonares adversos de inicio temprano (mediana de inicio, día 2) se presentaron en 14 de 219 pacientes tratados (todos los grados, 6 %; grado ≥3, 3 %); ninguno se presentó después del aumento escalonado de la dosis a 180 mg. Estos efectos fueron disnea, hipoxia, tos, neumonía o neumonitis. Se trataron mediante la interrupción de la dosis. De los 14 pacientes, 7 se volvieron a tratar con éxito con brigatinib.
- La FDA aprobó la dosis de brigatinib de 90 mg diarios durante 7 días y, si se tolera la dosis, se aumenta a 180 mg diarios.
Lorlatinib
Evidencia (lorlatinib):
- En un estudio en marcha sin anonimato de fase II de múltiples cohortes, se inscribió a pacientes de CPCNP con reordenamientos de ALK en 6 cohortes de expansión (EXP) de acuerdo con el estado de ALK y los antecedentes de tratamiento.[35] Los pacientes recibieron 100 mg diarios de lorlatinib de forma continua en ciclos de 21 días. El criterio principal de valoración fue la respuesta tumoral general y la respuesta tumoral intracraneal determinadas mediante una revisión central independiente, según lo evaluado en los conjuntos de subgrupos clave.[35][Nivel de evidencia C3]
- El número de pacientes que se trataron, las tasas de respuesta objetiva y de respuesta intracraneal en cada cohorte o conjunto de cohortes son las siguientes:
- EXP1 (n = 30, sin tratamiento previo).
- Tasa de respuesta objetiva, del 90,0 % (IC 95 %, 73,5‒97,9 %).
- Tasa de respuesta intracraneal (n = 3), del 66,7 % (IC 95 %, 9,4‒99,2 %).
- EXP2 (n = 27, previamente solo crizotinib) y EXP3A (n = 32, previamente crizotinib y quimioterapia).
- Tasa de respuesta objetiva, del 69,5 % (IC 95 %, 56,1‒80,8 %).
- Tasa de respuesta intracraneal (n = 23), del 87,0 % (IC 95 %, 66,4‒97,2 %).
- EXP3B (n = 28, previamente un inhibidor de ALK de segunda generación con quimioterapia o sin esta).
- Tasa de respuesta objetiva, del 32,1 % (IC 95 %, 15,9‒52,4 %).
- Tasa de respuesta intracraneal (n = 9), del 55,6 % (IC 95 %, 21,2‒86,3 %).
- EXP4 (n = 65, previamente 2 inhibidores ALK con quimioterapia o sin esta) y EXP5 (n = 46, previamente 3 líneas de inhibidores de ALK, con quimioterapia o sin esta).
- Tasa de respuesta objetiva, del 38,7 % (IC 95 %, 29,6‒48,5 %).
- Tasa de respuesta intracraneal (n = 49), del 53,1 % (IC 95 %, 38,3‒67,5 %).
- EXP1 (n = 30, sin tratamiento previo).
- Ninguno de los conjuntos de cohortes alcanzó la mediana de DR.
- El evento adverso más común fue hipercolesterolemia (16 % de grado 3–4) y el 3 % de los pacientes interrumpieron el tratamiento debido a efectos adversos.
- El número de pacientes que se trataron, las tasas de respuesta objetiva y de respuesta intracraneal en cada cohorte o conjunto de cohortes son las siguientes:
Inhibidores de BRAF V600E y MEK (para pacientes con mutaciones BRAF V600E)
Las mutaciones BRAF V600E se presentan en el 1 % al 2 % de los adenocarcinomas de pulmón.
Dabrafenib y trametinib
Evidencia (dabrafenib y trametinib):
- En un estudio multicéntrico no aleatorizado sin anonimato de fase II (NCT01336634), 57 pacientes con progresión después de por lo menos 1 a 3 regímenes previos con derivados del platino que tenían CPCNP metastásico y mutaciones BRAF V600E se trataron con dabrafenib (inhibidor de BRAF) 150 mg 2 veces por día y trametinib (inhibidor de MEK) 2 mg diarios.[36] Las mutaciones BRAF V600E se comprobaron mediante pruebas locales. El criterio principal de valoración fue la respuesta general evaluada por el investigador.
- La tasa de respuesta general fue del 63,2 % (IC 95 %, 49,3–75,6 %), determinada de modo independiente por evaluaciones realizadas por el investigador y por un comité de revisión independiente. En la evaluación del investigador se encontraron 2 de 36 respuestas completas y el comité de revisión independiente consideró que todas las respuestas fueron parciales.
- La mediana de SSP evaluada por el investigador fue de 9,7 meses (IC 95 %, 6,9–19,6 meses). La mediana de DR calculada fue de 9,0 meses (IC 95 %, 6,9–18,3). Los datos de SG son preliminares.
- De los pacientes, el 49 % presentaron por lo menos un efecto adverso de grado 3 o 4; los más comunes fueron neutropenia, hiponatremia y anemia.[36][Nivel de evidencia C3]
La FDA aprobó la combinación de dabrafenib y trametinib para el tratamiento de pacientes con CPCNP cuyos tumores albergan mutaciones BRAF V600E detectadas mediante una prueba autorizada por la FDA.
Terapia dirigida a ROS1
Los reordenamientos de ROS1 se presentan en cerca del 1 % de los pacientes con CPCNP.[37] Crizotinib y entrectinib se aprobaron para el uso en pacientes de CPCNP con reordenamientos de ROS1; entrectinib exhibió más actividad contra la enfermedad intracraneal.
Entrectinib
La FDA aprobó el entrectinib para el tratamiento de pacientes de CPCNP metastásico con tumores positivos para ROS1, con independencia del número de terapias sistémicas previas.
Evidencia (entrectinib):
- La seguridad y la actividad clínica del entrectinib para tratar el CPCNP metastásico positivo para una fusión de ROS1 se determinó mediante el análisis integrado de 3 ensayos clínicos multicéntricos, de un solo grupo, sin enmascaramiento (ALKA-372-001/EudraCT, 2012-000148-88, STARTRK-1 [NCT02097810] y STARTRK-2 [NCT02568267]).[38] El entrectinib se administró por vía oral en una dosis de al menos 600 mg una vez por día. Los criterios principales de valoración fueron la tasa de respuesta objetiva y la DR que se determinaron mediante revisión central independiente con enmascaramiento. Cabe destacar, que los criterios de valoración de tiempo transcurrido hasta el episodio son difíciles de interpretar cuando no se cuenta con un grupo control. La evaluación de muestras tumorales para la fusión génica de ROS1 se hizo de forma prospectiva en laboratorios locales utilizando un método de FISH o una prueba de laboratorio de secuenciación de nueva generación (NGS).
De los pacientes, 17 (32 %) no habían recibido terapia sistémica previa, 23 (43 %) habían recibido una terapia previa y 13 (25 %) habían recibido dos o más líneas de tratamiento. En la valoración inicial, 23 (43 %) pacientes presentaban enfermedad del SNC. Entre los pacientes, 31 (59 %) nunca habían fumado y 52 (98 %) presentaban características histológicas de adenocarcinoma.
- La tasa de respuesta objetiva en 53 pacientes evaluables por eficacia fue del 77 % (IC 95 %, 64−88 %). Entre ellos, el 6 % presentaron una respuesta completa y el 72 % tuvieron una respuesta parcial. En los pacientes con enfermedad del SNC al inicio del estudio, la tasa de respuesta completa fue del 74 % y todos los pacientes tuvieron una respuesta parcial. En los pacientes sin enfermedad del SNC al inicio del estudio, la tasa de respuesta general fue del 80 % (tasa de respuesta completa del 10 %; tasa de respuesta parcial del 70 %).[38][Nivel de evidencia C3]
- La mediana de DR fue de 24,6 meses (IC 95 %, 11,4−34,8) en los pacientes evaluables para la eficacia; 12,6 meses (IC 95 %, 6,5−no estimable) en los pacientes con enfermedad del SNC al inicio del estudio y 24,6 meses (IC 95 %, 11,4−34,8) en aquellos sin enfermedad del SNC al inicio del estudio.
- Se evaluaron los efectos adversos relacionados con el tratamiento (EART) en 134 pacientes de la población evaluable por inocuidad. Se observaron efectos adversos relacionados con el tratamiento de grado 1 o 2 en 79 (59 %) pacientes y de grado 3 o 4 en 46 (34 %) pacientes. Además, 15 (11 %) pacientes presentaron efectos adversos relacionados con el tratamiento graves. No hubo muertes relacionadas con el tratamiento.
- La mediana de SSP fue de 19 meses (IC 95 %, 12,2−36,6) en los pacientes evaluables por eficacia; 13,6 meses (IC 95 %, 4,5−no estimable) en los pacientes con enfermedad del SNC al inicio del estudio y 26,3 meses (IC 95 %, 15,7−36,6) en aquellos sin enfermedad del SNC al inicio del estudio.
Crizotinib
El crizotinib se aprobó para pacientes de CPCNP metastásico cuyos tumores expresan reordenamientos de ROS1 con independencia del número de tratamientos sistémicos recibidos antes.
Evidencia (crizotinib):
- En una ampliación de una cohorte de un estudio de fase I de crizotinib, 50 pacientes de CPCNP en estadio avanzado que exhibían reordenamientos de ROS1 se trataron con 250 mg de crizotinib oral 2 veces por día.[39] Los reordenamientos de ROS1 se identificaron mediante FISH con sondas de separación o un ensayo de reacción en cadena de la polimerasa con retrotranscripción. Siete pacientes (14 %) no se habían tratado para la enfermedad en estadio avanzado, 21 pacientes (42 %) se habían sometido a tratamiento previo y 22 pacientes (44 %) se habían sometido a más de un tratamiento previo. El criterio principal de valoración fue la tasa de respuesta.
- La tasa de respuesta general fue del 72 % (IC 95 %, 58–84 %). Del total de pacientes, el 6 % presentó una respuesta completa, el 66 % presentó una respuesta parcial y el 18 % presentó enfermedad estable, como su mejor respuesta.
- La mediana de SSP fue de 19,2 meses (IC 95 %, 14,4–no alcanzada). El cálculo de DR fue de 17,6 meses (IC 95 %, 14,5–no alcanzada).[39][Nivel de evidencia C3]
- En un ensayo sin anonimato de fase II de un solo grupo, 127 pacientes de Asia oriental de CPCNP con expresión de ROS1 se trataron con 250 mg de crizotinib 2 veces por día.[40] En este ensayo, 24 pacientes (18,9 %) no se habían tratado para la enfermedad en estadio avanzado, 53 pacientes (41,7 %) habían recibido un tratamiento previo y 50 pacientes (39 %) habían recibido 2 o 3 tratamientos previos. El criterio principal de valoración fue la tasa de respuesta objetiva evaluada por revisión independiente.
- La tasa de respuesta objetiva fue del 71,7 % (IC 95 %, 63,0–79,3 %). Las tasas de respuesta fueron similares, sin importar el número de tratamientos previos. Del total de pacientes, el 13,4 % presentó una respuesta completa, el 58,3 % presentó una respuesta parcial y el 16,5 % presentó una enfermedad estable, como su mejor respuesta.[40][Nivel de evidencia C3]
- La mediana de SSP fue de 15,9 meses (IC 95 %, 12,9–24). La DR fue de 19,7 meses (IC 95 %, 14,1‒no alcanzada).
- La SG fue de 32,5 meses (IC 95 %, 32,5–no alcanzada).
Inhibidores del receptor de la tirosina–cinasa neurotrófica (para pacientes con fusiones de NTRK)
Las fusiones génicas somáticas de NTRK se presentan en un grupo amplio de tumores sólidos, incluso en menos del 0,5 % de los tumores del CPCNP.[41,42] Estas fusiones ocurren más a menudo en pacientes no fumadores que tienen adenocarcinoma de pulmón.
Larotrectinib
Evidencia (larotrectinib):
- El larotrectinib se estudió en tres protocolos: en un estudio de fase I con adultos, un estudio de fase I/II con niños y un estudio de fase II con adolescentes y adultos.[43] En los tumores se confirmó la presencia de fusiones usando métodos de FISH o NSG. En el análisis combinado, el criterio principal de valoración fue la tasa de respuesta objetiva evaluada por revisión independiente y participación de reguladores con el objetivo de excluir el límite más bajo de menos del 30 % de tasa de respuesta. Participaron 55 pacientes con mediana de edad de 45 años (intervalo, 4 meses a 76 años), que tenían 17 tipos de tumores con expresión de diferentes fusiones de NTRK. Todos los pacientes presentaban enfermedad metastásica (82 %) o enfermedad avanzada irresecable local (18 %). Los participantes habían recibido una mediana de dos tratamientos sistémicos previos.
- La tasa de respuesta objetiva fue del 75 % (IC 95 %, 61‒75 %) y el 73 % de las respuestas duraron por lo menos 6 meses.[43][Nivel de evidencia C3]
- El tratamiento se toleró bien y el 93 % de los efectos adversos fueron de grado 1 a 2; los efectos adversos de grado 3 o 4 más comunes fueron anemia (11 % de los pacientes), transaminitis (7 %) y neutropenia (7 %).
La FDA aprobó el larotrectinib para el tratamiento de pacientes con tumores localmente avanzados o metastásicos que albergan una fusión génica de NTRK, pero que no adquirieron ninguna mutación que genere resistencia, no cuentan con alternativas de tratamiento que sean satisfactorias o cuyo cáncer progresó después del tratamiento.
Entrectinib
La FDA otorgó la aprobación acelerada para el uso del entrectinib en el tratamiento de tumores sólidos que exhiben una fusión génica de NTRK sin una mutación de resistencia adquirida conocida, que además son metastásicos, progresaron después del tratamiento, no se dispone de una terapia alternativa o para los casos en los que una resección quirúrgica es probable que produzca complicaciones graves.
Evidencia (entrectinib):
- La inocuidad y la actividad clínica del entrectinib en pacientes que no habían recibido previamente inhibidores de NTRK, con tumores sólidos metastásicos o localmente avanzados (incluso CPCNP) que exhibían las fusiones génicas de NTRK1, NTRK2 o NTRK3 se determinó mediante análisis integrado de 3 ensayos clínicos de fase temprana, multicéntricos, de un solo grupo y sin enmascaramiento (ALKA-372-001/EudraCT, 2012-000148-88, STARTRK-1 [NCT02097810] y STARTRK-2 [NCT02568267]).[44] El tratamiento abarcó entrectinib que se administró por vía oral en una dosis de al menos 600 mg una vez por día. Los criterios principales de valoración fueron la tasa de respuesta objetiva y la mediana de DR, que se determinaron mediante revisión central independiente con enmascaramiento. Cabe destacar, que los criterios de valoración de tiempo transcurrido hasta el episodio son difíciles de interpretar cuando no se cuenta con un grupo control. La identificación de estados positivos para la fusión génica de NTRK se hizo de forma prospectiva en laboratorios locales o en un laboratorio central utilizando diferentes pruebas de ácidos nucleicos.
De 54 pacientes en la población evaluable por eficacia positiva para la fusión génica de NTRK, 20 (37 %) no habían recibido terapia sistémica previa, 11 (20 %) habían recibido 1 terapia sistémica previa y 23 (43 %) habían recibido 2 o más terapias sistémicas previas. Entre ellos, 12 (22 %) pacientes presentaban enfermedad del SNC al inicio del estudio y 10 (19 %) pacientes tenían CPCNP. De los 54 pacientes, 52 (96 %) tenían una fusión génica de NTRK detectada mediante NGS y 2 (4 %) tenían una fusión génica de NTRK detectada mediante otras pruebas de ácidos nucleicos.
- La tasa de respuesta objetiva en 54 pacientes fue del 57 % (IC 95 %, 43,2−70,8 %). Entre ellos, el 7 % presentaron una respuesta completa y el 50 % tuvieron una respuesta parcial. Entre los pacientes con enfermedad del SNC al inicio del estudio, el 50 % alcanzaron una respuesta (todas respuestas parciales), mientras que entre los pacientes sin enfermedad del SNC al inicio, el 60 % alcanzaron una respuesta (10 % respuesta completa; el 50 % respuesta parcial).[44][Nivel de evidencia C3]
- La mediana de DR en pacientes evaluables por eficacia fue de 10,4 meses (IC 95 %, 7,1−no estimable). En los pacientes con enfermedad del SNC al inicio del estudio la DR no fue estimable y en los pacientes sin enfermedad del SNC al inicio fue de 12,9 meses (IC 95 %, 7,1−no estimable).
- En los 10 pacientes con CPCNP, la tasa de respuesta fue del 70 % (IC 95 %, 35−93 %) y la DR osciló entre 1,9 y 20,1 meses. Para obtener más información en inglés, consultar prescribing information.
- La población evaluable para la inocuidad consistió en 68 pacientes con tumores positivos para la fusión de NTRK. La mayoría de los efectos adversos relacionados con el tratamiento fueron de grado 1 o 2 y fueron reversibles. Los de grado 3 o 4 más frecuentes fueron aumento de peso (10 %) y anemia (12 %). Se notificaron efectos adversos relacionados con el tratamiento graves en 7 (10 %) pacientes. Debido a dichos efectos adversos, 3 pacientes tuvieron interrupciones de la dosis y 27 (40 %) pacientes tuvieron reducciones de la dosis. No hubo muertes relacionadas con el tratamiento.
- La mediana de SSP fue de 11,2 meses (IC 95 %, 8,0−14,9). En pacientes que presentaban enfermedad del SNC al inicio del estudio, la mediana de SSP fue de 7,7 meses (IC 95 %, 4,7−no estimable), y en los pacientes sin enfermedad del SNC al inicio del estudio, fue de 12 meses (IC 95 %, 8,7−15,7).
Inhibidores de RET (para pacientes con fusiones de RET)
Las fusiones somáticas de RET ocurren en entre el 1 % y el 2 % de los pacientes con CPCNP y en pacientes con cáncer de tiroides.[45]
Selpercatinib
Evidencia (selpercatinib):
- En un estudio de fase I/II (LIBRETTO-001 [NCT03157128]), se inscribieron pacientes con tumores sólidos positivos para fusiones de RET. Se determinó el estado positivo para la fusión de RET con una prueba molecular local (NGS, FISH o un ensayo de reacción en cadena de la polimerasa) sin confirmación central. El criterio principal de valoración fue la respuesta objetiva.[46][Nivel de evidencia C3]
- Se hizo un análisis actualizado en 316 pacientes con CPCNP positivos para la fusión de RET.[46]
- Entre los 69 pacientes que nunca había recibido tratamiento, la tasa de respuesta objetiva fue del 84 % (IC 95 %, 73–92 %) y el 6 % de los pacientes alcanzaron respuestas completas. La mediana de DR fue de 20,2 meses (IC 95 %, 13,0–no se pudo evaluar); el 40 % de las respuestas persistían en el momento del cierre de la base de datos (mediana de seguimiento, 20,3 meses). La mediana de SSP fue de 22,0 meses; el 35 % de los pacientes estaban vivos y sin progresión de la enfermedad en el momento del cierre de la base de datos (mediana de seguimiento, 21,9 meses).
- De los 247 pacientes que habían recibido quimioterapia con derivados del platino en el pasado, la tasa de respuesta objetiva fue del 61 % (IC 95 %, 55–67 %) y el 7 % alcanzó respuestas completas. La mediana de DR fue de 28,6 meses (IC 95 %, 20,4–no se pudo evaluar); el 49 % de las respuestas persistían (mediana de seguimiento, 21,2 meses). La mediana de SSP fue de 24,9 meses; el 38 % de los pacientes estaban vivos y sin progresión en el momento del cierre de la base de datos (mediana de seguimiento, 24,7 meses).
- De 26 pacientes con metástasis en el SNC cuantificable mediante un comité revisor independiente, la tasa de respuesta objetiva intracraneal fue del 85 % (IC 95 %, 65–96 %) y el 27 % presentó respuestas completas.
- En la población total del análisis de inocuidad (n = 796), la mediana de duración de tratamiento fue de 36,1 meses.
- No hubo cambios significativos en el perfil de inocuidad. La mayoría de los efectos adversos fueron de grado 1 a 2. Los más comunes fueron edema, diarrea, fatiga, xerostomía, hipertensión, aumento de ALT y de aspartato–aminotransferasa (AST), y exantema.
La FDA aprobó el uso de selpercatinib para el tratamiento de adultos con CPCNP localmente avanzado o metastásico con fusión del gen RET detectada mediante una prueba autorizada por la FDA.
Pralsetinib
Evidencia (pralsetinib):
- En un estudio de fase I/II (ARROW [NCT03037385]) se inscribieron pacientes con tumores sólidos positivos para fusiones de RET. De los pacientes, 233 tuvieron CPCNP positivo para la fusión de RET. El estado de fusión de RET se determinó mediante una prueba molecular local del tumor o del ácido nucleico tumoral circulante (ADNtc) en sangre, sin confirmación central. El criterio principal de valoración
fue la respuesta objetiva.[47][Nivel de evidencia C3]
- De estos pacientes, 92 que recibieron quimioterapia a base de derivados del platino y 29 que no habían recibido ningún tratamiento (además de no ser candidatos para el tratamiento estándar con derivados del platino) recibieron pralsetinib antes de la fecha límite de inscripción para la eficacia (11 de julio de 2019). La cohorte de eficacia estuvo formada por 87 pacientes que recibieron tratamiento previo y 27 pacientes que no habían recibido tratamiento ya que tenían enfermedad medible según la validación central inicial.
- La tasa de respuesta general fue del 61 % (IC 95 %, 50–71 %) para los 87 pacientes que recibieron quimioterapia a base de derivados del platino, incluso el 6 % de respuestas completas. No se alcanzó la mediana de DR (15,2 meses–no estimable).
- La tasa de respuesta general fue del 70 % (IC 95 %, 50–86 %) para los 27 pacientes que no recibieron tratamiento previo, incluso el 11 % de respuestas completas. La mediana de DR fue de 9,0 meses (6,3–no estimable).
- En la cohorte de seguridad de 233 pacientes, el 93 % presentó efectos adversos relacionados con el tratamiento, incluso el 48 % de grado 3 o peor. Los efectos adversos de grado 3 o peor relacionados con el tratamiento más comunes fueron neutropenia (18 %), hipertensión (11 %) y anemia (10 %). Se redujeron las dosis en el 38 % de los pacientes y el 6 % interrumpieron el tratamiento debido a los efectos adversos.
Inhibidores de MET (para pacientes con mutaciones de omisión del exón 14 de MET)
La desregulación del protooncogén MET, que resulta de la alteración de los distintos sitios de empalme, conduce a la pérdida del exón 14 de MET y a un aumento de la señalización de MET. Estas alteraciones en MET promueven la proliferación, supervivencia, invasión y metástasis de tumores y se presentan en entre el 3 % y el 4 % de los pacientes de CPCNP.[48]
Tepotinib
Evidencia (tepotinib):
- En un estudio sin anonimato de fase II (VISION [NCT02864992]), participaron pacientes con mutaciones de omisión del exón 14 de MET. Se inscribieron en el ensayo 152 pacientes que recibieron tepotinib (500 mg por vía oral una vez al día). El estado de MET se determinó de forma central, mediante biopsia líquida (obtención de DNA que circula libre en el plasma; n = 66) o mediante biopsia de tejido (n = 60). Ambos métodos produjeron resultados positivos en 27 pacientes. El criterio principal de valoración fue la respuesta objetiva.[49][Nivel de evidencia C3]
- Entre los 99 pacientes a quienes se les hizo el seguimiento durante por lo menos 9 meses (es decir, la población de eficacia), la tasa de respuesta objetiva según se evaluó mediante revisión independiente fue del 46 % (IC 95 %, 36–57 %), con una mediana de DR de 11,1 meses (IC 95 %, 7,2–no estimable). Las tasas de respuesta fueron similares en los grupos de biopsia líquida y biopsia de tejido.
- Las respuestas fueron similares con independencia del estado de terapia previa.
- Se presentaron efectos adversos de grado 3 o mayor en el 28 % de los pacientes, estos incluyeron edema periférico en el 7 % de los pacientes. Los efectos adversos condujeron a la interrupción del tratamiento en el 11 % de los pacientes.
Capmatinib
Evidencia (capmatinib):
- En un estudio de fase II (GEOMETRY [NCT02414139]), se evaluó el capmatinib (400 mg por vía oral dos veces al día) en pacientes con mutaciones de omisión del exón 14 de MET o amplificación de MET. El estado de MET se determinó a nivel central. Se inscribió un total de 364 pacientes. El criterio principal de valoración fue la respuesta global.[50][Nivel de evidencia C3]
- Entre los 69 pacientes con mutaciones de omisión del exón 14 de MET que recibieron 1 o 2 líneas de terapia previa, la tasa de respuesta objetiva fue del 41 % (IC 95 %, 29–53 %). La mediana de DR fue de 9,7 meses (IC 95 %, 5,6–13,0).
- Entre los 28 pacientes con mutaciones de omisión del exón 14 de MET que no habían recibido ningún tratamiento antes, la tasa de respuesta objetiva fue del 68 % (IC 95 %, 48–84 %). La mediana de DR fue de 12,6 meses (IC 95 %, 5,6–no estimable).
- Las tasas de respuesta en los pacientes con amplificación de MET sin la omisión del exón 14 no alcanzaron el umbral preespecificado para la actividad clínica relevante.
- Se presentaron efectos adversos de grado 3 a 4 en el 67 % de los pacientes. Los efectos más comunes, con independencia de la causalidad, fueron edema periférico, náusea, vómito y aumento de la creatinina. Los efectos adversos condujeron a la interrupción de la terapia en el 11 % de los pacientes.
Inhibidores de KRAS G12C (para pacientes con mutaciones KRASG12C)
Se encuentran mutaciones activadoras en KRAS en el 25 % al 30 % de CPCNP no escamosas, lo que da lugar a la activación de vías oncogénicas de secuencia descendente y al crecimiento descontrolado. La variante de un solo nucleótido G12C, con glicina sustituida por cisteína en el codón 12, es la variante más frecuente en CPCNP, se presenta en alrededor del 13 % de los adenocarcinomas de pulmón.[51]
Adagrasib
Evidencia (adagrasib):
- En el ensayo clínico de fase I/II de cohorte de expansión múltiple KRYSTAL-1 (NCT03785249) se investigó el uso del adagrasib (600 mg vía oral, 2 veces al día) en pacientes con tumores sólidos en estadio avanzado. En una cohorte de fase II del ensayo, se incluyeron pacientes con CPCNP y mutaciones KRAS G12C que habían recibido quimioterapia con derivados de platino y terapia anti–proteína de muerte programada (PD-1) y anti–ligando 1 de muerte programada (PD-L1). En la cohorte se incluyeron 116 pacientes; el 98,3 % había recibido antes quimioterapia e inmunoterapia. El criterio principal de valoración fue la respuesta objetiva evaluada mediante revisión central independiente con enmascaramiento.[52][Nivel de evidencia C3]
- Entre 112 pacientes evaluables, la tasa de respuesta objetiva confirmada fue del 42,9 % (IC 95 %, 33,5–52,6 %), hubo incluso una respuesta completa (0,9 %). La mediana de DR fue de 8,5 meses (IC 95 %, 6,2–13,8). Se logró el control de la enfermedad en el 79,5 % de los pacientes (IC 95 %, 70,8–86,5 %).
- La mediana de SSP fue de 6,5 meses (IC 95 %, 4,7–8,4) y la mediana de SG fue de 12,6 meses (IC 95 %, 9,2–19,2).
- Entre 33 pacientes con enfermedad metastásica estable en el SNC para la que se había administrado tratamiento en el pasado, la tasa de respuesta objetiva fue del 33,3 % (IC 95 %, 18,0–51,8 %).
- Se presentaron efectos adversos de grado 3 o mayor en el 44,8 % de los pacientes, entre los que se incluyen 2 muertes. Los efectos adversos más comunes fueron diarrea, náuseas, fatiga, vómitos, disnea, elevación de la creatinina, aumento de la ALT, aumento de la AST y disminución del apetito. Los efectos adversos causaron la interrupción del tratamiento en el 6,9 % de los pacientes.
La FDA aprobó el adagrasib para el tratamiento de adultos con CPCNP localmente avanzado o metastásico y mutaciones KRAS G12C, detectadas mediante una prueba autorizada por la FDA, que hayan recibido al menos un tratamiento sistémico previo.[53]
Sotorasib
Evidencia (sotorasib):
- En un ensayo clínico de fase II (CodeBreaK 100 [NCT03600883]) se evaluó el sotorasib (960 mg por vía oral 1 vez al día) en pacientes con mutaciones KRASG12C que recibieron en el pasado tratamientos estándar. Se inscribió a un total de 126 pacientes. De los 124 pacientes evaluables, la mayoría (81 %) recibió antes un tratamiento a base de derivados del platino e inhibidores de PD-1 o del PD-L1. El criterio principal de valoración fue la respuesta general según una revisión central independiente.[51][Nivel de evidencia C3]
- Para los 124 pacientes evaluables, la tasa de respuesta general fue del 37,1 % (IC 95 %, 28,6–46,2 %), incluso respuestas completas en el 3,2 %. La mediana de DR fue de 11,1 meses (IC 95 %, 6,9–no fue posible evaluar). Se logró el control de la enfermedad en el 80,6 % de los pacientes (IC 95 %, 72,6 %–87,2 %).
- La mediana de SSP fue de 6,8 meses (IC 95 %, 5,1–8,2) y la mediana de SG fue de 12,5 meses (IC 95 %, 10,0–no fue posible evaluar).
- Se presentaron efectos adversos de grado 3 a 4 en el 20,6 % de los pacientes. Los efectos adversos más comunes que se consideraron relacionados con el tratamiento fueron la diarrea, las náuseas, los aumentos de la ALT o AST y la fatiga. Los episodios adversos llevaron a la interrupción del tratamiento en el 7,1 % de los pacientes.
La FDA aprobó el sotorasib para el tratamiento de pacientes adultos con CPCNP localmente avanzado o metastásico con mutación KRASG12C, detectada mediante una prueba aprobada por la FDA, que hayan recibido al menos un tratamiento sistémico previo.
Terapia dirigida a HER2 (para pacientes con mutaciones en HER2)
Las mutaciones en el gen del receptor 2 del factor de crecimiento epidérmico humano (HER2) se encuentran en el 1 % al 4 % de los pacientes con CPCNP no escamosas. Estas mutaciones se relacionan con el sexo femenino, la etnia asiática, la ausencia de antecedentes de tabaquismo, la incidencia alta de metástasis encefálicas, las características histológicas de diferenciación moderada a precaria para el adenocarcinoma y el pronóstico precario.[54,55]
Trastuzumab deruxtecán
El trastuzumab deruxtecán es un conjugado anticuerpo-fármaco que combina un anticuerpo monoclonal anti-HER2 humanizado con un inhibidor de la topoisomerasa I.
Evidencia (trastuzumab deruxtecán):
- En el ensayo multicéntrico sin enmascaramiento de 2 cohortes y fase II, DESTINY-Lung01 (NCT03505710), se investigó el trastuzumab deruxtecán en una dosis de 6,4 mg/kg de peso corporal. Los pacientes inscritos tenían CPCNP no escamosas irresecable o metastásico con sobreexpresión de HER2 o mutación en HER2 y recaída de la enfermedad durante el tratamiento estándar o enfermedad resistente al tratamiento estándar. Los pacientes que habían recibido antes un anticuerpo HER2 o un conjugado anticuerpo-fármaco no fueron aptos. Sin embargo, aquellos que habían recibido un ITC del HER2, sí lo fueron. El criterio principal de valoración fue la respuesta objetiva evaluada mediante revisión central independiente. Participaron 91 pacientes de CPCNP con mutación en HER2; el 95 % habían recibido terapia a base de platino, y el 66 % había recibido inmunoterapia con anticuerpos anti-PD-1 o anti-PD-L1.[55][Nivel de evidencia C3]
- Se evaluó la respuesta de los 91 pacientes. La tasa de respuesta objetiva confirmada fue del 55 % (IC 95 %, 44–65 %), incluso una respuesta completa (1 %). La mediana de la DR fue de 9,3 meses (IC 95 %, 5,7–14,7). Se observó control de la enfermedad en el 92 % de los pacientes (IC 95 %, 85–97 %).
- La mediana de SSP fue de 8,2 meses (IC 95 %, 6,0–11,9). La mediana de SG fue 17,8 meses (IC 95 %, 13,8–22,1).
- De 33 pacientes con metástasis en el SNC al inicio, 14 habían recibido en el pasado radioterapia dirigida al encéfalo y 19 no la habían recibido. De estos pacientes, 8 (57 %) y 10 (53 %), respectivamente, presentaron respuestas parciales. En los pacientes con metástasis en el SNC al comienzo del estudio, la mediana de SSP fue de 7,1 meses (IC 95 %, 5,5–9,8) y la mediana de SG fue de 13,8 meses (IC 95 %, 9,8–20,9).
- Se presentaron efectos adversos de grados 3 o mayor relacionados con el fármaco en el 46 % de los pacientes. Los efectos adversos más comunes fueron náuseas, fatiga, alopecia, vómitos, neutropenia, anemia, diarrea, disminución del apetito, leucopenia y estreñimiento. Los efectos adversos más comunes de grados 3 o mayor relacionados con los fármacos fueron neutropenia (19 %) y anemia (10 %).
- Los efectos adversos relacionados con los fármacos que condujeron a la interrupción del tratamiento en 23 pacientes (25 %), incluyeron neumonitis en 12 pacientes (13 %) y enfermedad pulmonar intersticial en 5 pacientes (5 %).
- Hubo 2 muertes por enfermedad pulmonar intersticial relacionadas con el fármaco.
La FDA otorgó la aprobación acelerada del trastuzumab deruxtecán para el tratamiento de pacientes con CPCNP irresecable o metastásico cuyos tumores tienen mutaciones activadoras en HER2, detectadas mediante prueba aprobada por la FDA y que han recibido una terapia sistémica previa. Esta aprobación se fundamentó en la tasa de respuesta objetiva y la DR.
Inmunoterapia
El nivolumab es un anticuerpo monoclonal totalmente humano que inhibe el punto de control inmunitario coinhibitorio de PD-1, que se expresa en las células tumorales y en las células inmunitarias infiltrantes.[56,57] El pembrolizumab es un anticuerpo monoclonal humanizado que inhibe la interacción entre el punto de control inmunitario coinhibitorio de PD-1 que se expresa en las células tumorales y en las células inmunitarias infiltrantes, y sus ligandos, PD-L1 y PD-L2.[58] Atezolizumab es un anticuerpo que bloquea PD-L1.
Nivolumab
Evidencia (nivolumab):
En dos ensayos clínicos de fase III, uno llevado a cabo con pacientes de CPCNP escamosas tratados antes con derivados del platino y el otro llevado a cabo con pacientes de CPCNP no escamosas, se demostró una mejora significativa de la SG con nivolumab en comparación con el tratamiento estándar previo de quimioterapia con docetaxel.[56,57][Nivel de evidencia A1] Además, las tasas de efectos tóxicos relacionados con el tratamiento de grados 3 y 4 en ambos ensayos fueron significativamente más bajas con nivolumab que docetaxel. Cabe resaltar, que todos los pacientes inscritos en estudios de fase III de nivolumab tenían un estado funcional de 0 o 1 según el ECOG; se excluyó de la inscripción a los pacientes con enfermedades autoinmunitarias, enfermedad pulmonar intersticial sintomática o aquellos sometidos a inmunodepresión sistémica.
- En un ensayo aleatorizado sin anonimato de fase III, se asignó a 272 pacientes con CPCNP escamosas en estadio avanzado que se habían sometido a un régimen de quimioterapia con derivados del platino a recibir nivolumab (3 mg/kg cada 2 semanas) o docetaxel (75 mg/m2 cada 3 semanas), administrados hasta la progresión de la enfermedad.[56] El criterio principal de valoración de este estudio fue la SG.
- Se demostró que el nivolumab produjo mejoría significativa de la mediana de SG en comparación con el docetaxel (9,2 vs. 6 meses; P < 0,001). Además, la tasa de respuesta (20 vs. 9 %; P = 0,008) y la mediana de SSP (de 3,5 vs. 2,8 meses; P < 0,001) favorecieron al nivolumab.
- Las tasas de efectos tóxicos relacionados con el tratamiento fueron significativamente más bajas con nivolumab en comparación con docetaxel (todos los grados, el 58 % para nivolumab versus el 86 % para docetaxel; grados 3–4, el 7 % para nivolumab versus el 55 % para docetaxel).
- En un ensayo aleatorizado sin anonimato de fase III, participaron 582 pacientes con CPCNP no escamosas en estadio avanzado, que se habían sometido a un régimen de quimioterapia con derivados del platino. Los pacientes se asignaron al azar para recibir nivolumab (3 mg/kg cada 2 semanas) o docetaxel (75 mg/m2 cada 3 semanas), administrados hasta la progresión de la enfermedad.[57] Se permitió la participación de pacientes que habían recibido quimioterapia de mantenimiento después de la biquimioterapia con derivados del platino de primera línea; también se permitió que los pacientes con mutaciones en EGFR o translocaciones de ALK recibieran un régimen de tratamiento adicional con un ITC. El criterio principal de valoración de este estudio fue la SG.
- Los pacientes que recibieron nivolumab tuvieron una mejora significativa de la mediana de SG en comparación con los pacientes que recibieron docetaxel (12,2 vs. 9,4 meses; CRI, 0,73; IC, 0,59–0,89; P = 0,002). En este estudio, la tasa de respuesta (19 vs. 12 %; P = 0,02), pero no la mediana de SSP (2,3 meses para nivolumab vs. 4,2 meses para docetaxel) favoreció al nivolumab. La mediana de DR fue de 17,2 meses para nivolumab y de 5,6 meses para docetaxel.
- Las tasas de efectos tóxicos relacionados con el tratamiento fueron significativamente más bajas con nivolumab en comparación con docetaxel (todos los grados, el 69 % para nivolumab versus el 88 % para docetaxel; grados 3–4, el 10 % para nivolumab versus el 54 % para docetaxel).
En ambos ensayos se demostró un beneficio clínico a largo plazo en los resultados a 2 años. Las tasas de SG a 2 años de nivolumab en comparación con docetaxel para los pacientes de CPCNP escamosas fueron del 23 % (IC 95 %, 16–30 %) versus el 8 % (IC 95 %, 4–13 %), y las tasas de SG en CPCNP y no escamosas fueron del 29 % (IC 95 %, 24–34 %) versus el 16 % (IC 95 %, 12–20 %).[59] Se observaron respuestas continuadas a los 2 años en 10 (37 %) pacientes con CPCNP escamosas en quienes se confirmó la respuesta, además de 19 (34 %) entre 56 pacientes con CPCNP y no escamosas en quienes se confirmó la respuesta. Ningún paciente tratado con docetaxel en ninguno de los estudios presentó una respuesta continuada.
En la actualidad, nivolumab se considera un fármaco de terapia estándar de segunda línea para pacientes de CPCNP metastásico con progresión, o un fármaco para administrar después de la quimioterapia con derivados del platino de primera línea; el nivolumab se relaciona con mejor supervivencia y tasas más bajas de efectos tóxicos que el docetaxel. Sin embargo, hasta la fecha en los ensayos clínicos no han participado pacientes con antecedentes de enfermedades autoinmunitarias, enfermedad pulmonar intersticial o con un estado funcional del ECOG superior a 1. Los pacientes con afecciones autoinmunitarias no se pueden tratar con nivolumab. Es necesaria una vigilancia estricta de todos los pacientes para detectar efectos tóxicos autoinmunitarios del tratamiento. En la ficha técnica en inglés de la FDA para nivolumab se incluyen algoritmos específicos para el tratamiento de los efectos tóxicos autoinmunitarios.
Pembrolizumab
Evidencia (pembrolizumab):
- En un estudio de fase I de ampliación de múltiples cohortes, el pembrolizumab demostró actividad importante con respecto a la tasa de respuesta y la DR.[58][Nivel de evidencia C3]
- En el estudio, 495 pacientes recibieron pembrolizumab 2 mg/kg cada 3 semanas, 10 mg/kg cada 3 semanas o 10 mg/kg cada 2 semanas. No se observaron diferencias significativas entre los diferentes programas de tratamiento. Los criterios de exclusión clave fueron presencia de una enfermedad autoinmunitaria, antecedentes de neumonía, necesidad de administrar inmunodepresores sistémicos y un estado funcional superior a 1. La tasa de respuesta objetiva fue del 19,4 % (IC 95 %, 16,0–23,2 %), que incluyó una tasa de respuesta del 18,0 % (IC 95 %, 14,4–22,2 %) en 394 los pacientes con tratamiento previo y del 24,8 % (IC 95 %, 16,7–34,3 %) en 101 pacientes sin tratamiento previo. La mediana de SSP fue de 3,7 meses (IC 95 %, 2,9–4,1) para todos los pacientes, de 3,0 meses (IC 95 %, 2,2–4,0) para los pacientes con tratamiento previo y de 6,0 meses (IC 95 %, 4,1–8,6) para los pacientes sin tratamiento previo. La mediana de DR fue de 12,5 meses (intervalo, 1,0–23,3 meses) en todos los pacientes.
- En el estudio se evaluó la eficacia del pembrolizumab en pacientes con concentraciones altas de PD-L1, evaluadas mediante el clon 22C3 del anticuerpo anti-PD-L1. Cuando se usó un valor de corte para la tinción membranosa de por lo menos el 50 % de células tumorales en un grupo de validación de 73 pacientes, la tasa de respuesta fue del 45,2 % (IC 95 %, 33,5–57,3 %) y la mediana de SSP en este grupo fue de 6,3 meses (IC 95 %, 2,9–12,5). No se alcanzó la mediana de SG en el momento de la publicación.
- La prevalencia estimada de PD-L1 determinada mediante tinción tumoral en 1143 pacientes sometidos a exámenes de detección (824 con muestras evaluables), es como sigue: el 23,2 % tenían un 50 % o más células tumorales con tinción; el 37,6 % tenían entre un 1 % y un 49 % células tumorales con tinción y el 39,2 % tenían menos del 1 % de células tumorales con tinción.
- Los efectos adversos más comunes fueron fatiga, prurito y pérdida de apetito. Se notificó que los efectos adversos de grado 3 o mayor afectaron al 9,5 % de los pacientes. Los efectos adversos inflamatorios e inmunitarios que se presentaron en más del 2 % de los pacientes fueron reacciones relacionadas con la infusión (3,0 %), hipotiroidismo (6,9 %) y neumonía (3,6 %).
- En un ensayo clínico aleatorizado de fase II/III, los pacientes de CPCNP con expresión de PD-L1 en al menos el 1 % de las células tumorales y que se habían sometido a tratamiento previo, se asignaron al azar (1:1:1) para recibir pembrolizumab (2 mg/kg), pembrolizumab (10 mg/kg) o docetaxel (75 mg/m2) cada 3 semanas.[60][Nivel de evidencia A1] Los criterios principales de valoración fueron la SG y la SSP en la población total y en los pacientes con expresión de PD-L1 en un mínimo del 50 % de las células tumorales. En este estudio, se inscribieron 1034 pacientes asignados de la siguiente manera: 345 a pembrolizumab (2 mg/kg); 346 a pembrolizumab (10 mg/kg); y 343 a docetaxel.
- En la población total, la mediana de SG fue de 10,4 meses con pembrolizumab (2 mg/kg), 12,7 meses con pembrolizumab (10 mg/kg) y 8,5 meses con docetaxel. La SG fue significativamente más prolongada para el pembrolizumab (2 mg/kg) en comparación con el docetaxel (CRI 0,71; IC 95 %, 0,58–0,88; P = 0,0008), y para el pembrolizumab (10 mg/kg) en comparación con el docetaxel (CRI, 0,61; IC, 0,49–0,75; P < 0,0001).
- En la población total, la SSP no se prolongó en los grupos de pembrolizumab en comparación con el grupo de docetaxel.
- Entre los pacientes con expresión de PD-L1 en un mínimo del 50 % de células tumorales, la SG fue significativamente más prolongada para el pembrolizumab (2 mg/kg) en comparación con el docetaxel (mediana de 14,9 vs. 8,2 meses; CRI 0,54, IC 95 %, 0,38–0,77; P = 0,0002) y para el pembrolizumab (10 mg/kg) en comparación con el docetaxel (mediana de 17,3 vs. 8,2 meses; CRI, 0,50; IC, 0,36–0,70; P < 0,0001).
- En el grupo de pacientes con expresión de PD-L1 en un mínimo del 50 % de células tumorales, la SSP fue significativamente más prolongada para el pembrolizumab (2 mg/kg) en comparación con el docetaxel (mediana de 5,0 vs. 4,1 meses; CRI 0,59; IC 95 %, 0,44–0,78; P = 0,0001) y para el pembrolizumab (10 mg/kg) en comparación con el docetaxel (mediana de 5,2 vs. 4,1 meses; CRI, 0,59; IC, 0,45–0,78; P < 0,0001).
- Los efectos adversos de grados 3 a 5 relacionados con el tratamiento fueron menos comunes con el pembrolizumab que con el docetaxel: 43 (13 %) de los 339 pacientes que recibieron pembrolizumab en dosis de 2 mg/kg, 55 (16 %) de los 343 pacientes que recibieron pembrolizumab en dosis de 10 mg/kg, y 109 (35 %) de los 309 pacientes que recibieron docetaxel.
La FDA otorgó la aprobación acelerada para el uso del pembrolizumab como terapia de segunda línea en pacientes con CPCNP cuyos tumores expresan PD-L1 (>50 % de tinción mediante una prueba aprobada por la FDA) y tienen progresión de la enfermedad o después de una quimioterapia de primera línea. Antes de recibir pembrolizumab los pacientes con anomalías genómicas tumorales en EGFR o ALK deben presentar progresión de la enfermedad mientras reciben tratamientos aprobados por la FDA (consultar la ficha técnica en inglés de la FDA para pembrolizumab).
Atezolizumab
Evidencia (atezolizumab):
- En 2 ensayos clínicos internacionales, aleatorizados y sin anonimato (OAK [NCT02008227] y POPLAR [NCT01903993]) se demostró la eficacia y la inocuidad del atezolizumab en 1137 pacientes de CPCNP que habían recibido quimioterapia con derivados del platino.[61,62][Nivel de evidencia A1] En comparación con el docetaxel, el tratamiento con atezolizumab en la población de pacientes prevista produjo mejoría de las tasas de SG en el estudio OAK (4,2 meses) y el estudio POPLAR (2,9 meses).
- En el ensayo OAK, la mediana de SG fue de 13,8 meses para el grupo de atezolizumab (IC 95 %, 11,8–15,7) en comparación con 9,6 meses para el grupo de docetaxel (IC 95 %, 8,6–11,2) (CRI, 0,74; IC 95 %, 0,63–0,87; P = 0,0004).
- La mediana de SG en el ensayo POPLAR fue de 12,6 meses para el grupo de atezolizumab (IC 95 %, 9,7–16,0) y 9,7 meses para el grupo de docetaxel (IC 95 %, 8,6–12,0) (CRI, 0,69; IC 95 %, 0,52–0,92).
- Aunque la magnitud de la mejora se relacionó con la expresión inmunohistoquímica de PD-L1 en las células tumorales y en las células inmunitarias de infiltración tumoral, se observaron beneficios de supervivencia con el uso de atezolizumab en los pacientes con tumores con expresión de PD-L1 o sin esta.
- En el ensayo POPLAR, las reacciones adversas más comunes (≥20 %) se presentaron en los pacientes que recibieron atezolizumab, estas fueron fatiga, disminución del apetito, disnea, tos, náuseas, dolor osteomuscular y estreñimiento.
- Los efectos adversos más comunes (≥2 %) de grado 3 a 4 en pacientes tratados con atezolizumab fueron disnea, neumonía, hipoxia, hiponatremia, fatiga, anemia, dolor osteomuscular, aumento de la ALT y la AST, disfagia y artralgia.
- En los pacientes que recibieron atezolizumab, los efectos adversos inmunitarios de trascendencia clínica fueron neumonitis, hepatitis, colitis y enfermedad tiroidea.
Inhibidores del blanco de la rapamicina en los mamíferos
Everólimus
El everólimus se administra a pacientes con tumores neuroendocrinos irresecables, localmente avanzados o metastásicos, progresivos, bien diferenciados y no funcionantes.
El everólimus, un inhibidor del blanco de la rapamicina en los mamíferos (mTOR), es clínicamente activo contra los tumores neuroendocrinos pancreáticos y no pancreáticos en estadio avanzado.[63] De acuerdo con los resultados del ensayo clínico RADIANT-4,[63] la FDA aprobó el everólimus para el tratamiento de pacientes adultos con tumores neuroendocrinos de origen pulmonar o gastrointestinal que son irresecables, localmente avanzados o metastásicos, bien diferenciados (grado bajo o intermedio) y no funcionantes.
Evidencia (everólimus):
- En un ensayo aleatorizado de fase III con enmascaramiento doble y controlado con placebo (RADIANT-4 [NCT01524783]), se evaluó el everólimus para pacientes mayores de 18 años con tumores endocrinos de origen pulmonar o gastrointestinal en estadio avanzado, progresivos, bien diferenciados y no funcionantes.[63] Los pacientes aptos se asignaron al azar en una proporción 2:1 para recibir 10 mg orales diarios de everólimus o un placebo, en ambos casos con los mejores cuidados médicos de apoyo. Se inscribió a un total de 302 pacientes (205 en el grupo de everólimus y 97 en el grupo de placebo), incluso 90 pacientes con tumores neuroendocrinos de origen pulmonar (63 en el grupo de everólimus y 27 en el grupo de placebo). El criterio principal de valoración fue la SSP evaluada mediante una revisión radiológica central en la población por intención de tratar.
- La mediana de SSP fue de 11,0 meses en el grupo de everólimus y de 3,9 meses en el grupo de placebo (CRI, 0,48; IC 95 %, 0,35−0,67; P < 0,00001). [63][Nivel de evidencia B1]
- En un análisis a posteriori del subgrupo de pulmón, la mediana de SSP evaluada mediante revisión central fue de 9,2 meses en el grupo de everólimus y de 3,6 meses en el grupo de placebo (CRI, 0,50; IC 95 %, 0,28−0,88).[63]
- La tasa de respuesta objetiva fue del 2 % en los pacientes que recibieron everólimus y del 1 % en los pacientes que recibieron placebo. Se observó la estabilización de la enfermedad en el 81 % de los pacientes en el grupo de everólimus y del 64 % de los pacientes en el grupo de placebo.
- La mediana de duración del tratamiento fue más larga en los pacientes que recibieron everólimus comparada con aquellos que recibieron el placebo (40,4 vs. 19,6 semanas).
- En un análisis intermedio planificado de la SG, se observó una reducción del 36 % en el riesgo estimado de muerte con everólimus en comparación con el placebo (CRI, 0,64; IC 95 %, 0,40−1,05). Estos resultados no fueron estadísticamente significativos.
- Los EART más comunes fueron estomatitis, diarrea, fatiga, infecciones, exantema y edema periférico. Los efectos adversos relacionados con los fármacos más comunes de grados 3 o 4 fueron estomatitis, diarrea, infecciones, anemia y fatiga. Los efectos adversos de grados 3 o 4 condujeron a la interrupción del tratamiento del 12 % de los pacientes en el grupo de everólimus y del 3 % de los pacientes en el grupo de placebo.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Souquet PJ, Chauvin F, Boissel JP, et al.: Polychemotherapy in advanced non small cell lung cancer: a meta-analysis. Lancet 342 (8862): 19-21, 1993. [PUBMED Abstract]
- Ellis PA, Smith IE, Hardy JR, et al.: Symptom relief with MVP (mitomycin C, vinblastine and cisplatin) chemotherapy in advanced non-small-cell lung cancer. Br J Cancer 71 (2): 366-70, 1995. [PUBMED Abstract]
- Girling DJ, et al.: Randomized trial of etoposide cyclophosphamide methotrexate and vincristine versus etoposide and vincristine in the palliative treatment of patients with small-cell lung cancer and poor prognosis. Br J Cancer 67 (Suppl 20): A-4;2, 14, 1993.
- Fossella FV, DeVore R, Kerr RN, et al.: Randomized phase III trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group. J Clin Oncol 18 (12): 2354-62, 2000. [PUBMED Abstract]
- Shepherd FA, Dancey J, Ramlau R, et al.: Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol 18 (10): 2095-103, 2000. [PUBMED Abstract]
- Huisman C, Smit EF, Giaccone G, et al.: Second-line chemotherapy in relapsing or refractory non-small-cell lung cancer: a review. J Clin Oncol 18 (21): 3722-30, 2000. [PUBMED Abstract]
- Di Maio M, Perrone F, Chiodini P, et al.: Individual patient data meta-analysis of docetaxel administered once every 3 weeks compared with once every week second-line treatment of advanced non-small-cell lung cancer. J Clin Oncol 25 (11): 1377-82, 2007. [PUBMED Abstract]
- Garon EB, Ciuleanu TE, Arrieta O, et al.: Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage IV non-small-cell lung cancer after disease progression on platinum-based therapy (REVEL): a multicentre, double-blind, randomised phase 3 trial. Lancet 384 (9944): 665-73, 2014. [PUBMED Abstract]
- Hanna N, Shepherd FA, Fossella FV, et al.: Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J Clin Oncol 22 (9): 1589-97, 2004. [PUBMED Abstract]
- Scagliotti G, Hanna N, Fossella F, et al.: The differential efficacy of pemetrexed according to NSCLC histology: a review of two Phase III studies. Oncologist 14 (3): 253-63, 2009. [PUBMED Abstract]
- Shepherd FA, Rodrigues Pereira J, Ciuleanu T, et al.: Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med 353 (2): 123-32, 2005. [PUBMED Abstract]
- Bezjak A, Tu D, Seymour L, et al.: Symptom improvement in lung cancer patients treated with erlotinib: quality of life analysis of the National Cancer Institute of Canada Clinical Trials Group Study BR.21. J Clin Oncol 24 (24): 3831-7, 2006. [PUBMED Abstract]
- Ciuleanu T, Stelmakh L, Cicenas S, et al.: Efficacy and safety of erlotinib versus chemotherapy in second-line treatment of patients with advanced, non-small-cell lung cancer with poor prognosis (TITAN): a randomised multicentre, open-label, phase 3 study. Lancet Oncol 13 (3): 300-8, 2012. [PUBMED Abstract]
- Thatcher N, Chang A, Parikh P, et al.: Gefitinib plus best supportive care in previously treated patients with refractory advanced non-small-cell lung cancer: results from a randomised, placebo-controlled, multicentre study (Iressa Survival Evaluation in Lung Cancer). Lancet 366 (9496): 1527-37, 2005 Oct 29-Nov 4. [PUBMED Abstract]
- Kim ES, Hirsh V, Mok T, et al.: Gefitinib versus docetaxel in previously treated non-small-cell lung cancer (INTEREST): a randomised phase III trial. Lancet 372 (9652): 1809-18, 2008. [PUBMED Abstract]
- Miller VA, Kris MG, Shah N, et al.: Bronchioloalveolar pathologic subtype and smoking history predict sensitivity to gefitinib in advanced non-small-cell lung cancer. J Clin Oncol 22 (6): 1103-9, 2004. [PUBMED Abstract]
- Paez JG, Jänne PA, Lee JC, et al.: EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science 304 (5676): 1497-500, 2004. [PUBMED Abstract]
- Lynch TJ, Bell DW, Sordella R, et al.: Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N Engl J Med 350 (21): 2129-39, 2004. [PUBMED Abstract]
- Pao W, Miller V, Zakowski M, et al.: EGF receptor gene mutations are common in lung cancers from "never smokers" and are associated with sensitivity of tumors to gefitinib and erlotinib. Proc Natl Acad Sci U S A 101 (36): 13306-11, 2004. [PUBMED Abstract]
- Pao W, Wang TY, Riely GJ, et al.: KRAS mutations and primary resistance of lung adenocarcinomas to gefitinib or erlotinib. PLoS Med 2 (1): e17, 2005. [PUBMED Abstract]
- Tsao MS, Sakurada A, Cutz JC, et al.: Erlotinib in lung cancer - molecular and clinical predictors of outcome. N Engl J Med 353 (2): 133-44, 2005. [PUBMED Abstract]
- Hirsch FR, Varella-Garcia M, Bunn PA, et al.: Molecular predictors of outcome with gefitinib in a phase III placebo-controlled study in advanced non-small-cell lung cancer. J Clin Oncol 24 (31): 5034-42, 2006. [PUBMED Abstract]
- Clark GM, Zborowski DM, Culbertson JL, et al.: Clinical utility of epidermal growth factor receptor expression for selecting patients with advanced non-small cell lung cancer for treatment with erlotinib. J Thorac Oncol 1 (8): 837-46, 2006. [PUBMED Abstract]
- Soria JC, Felip E, Cobo M, et al.: Afatinib versus erlotinib as second-line treatment of patients with advanced squamous cell carcinoma of the lung (LUX-Lung 8): an open-label randomised controlled phase 3 trial. Lancet Oncol 16 (8): 897-907, 2015. [PUBMED Abstract]
- Mok TS, Wu Y-L, Ahn M-J, et al.: Osimertinib or Platinum-Pemetrexed in EGFR T790M-Positive Lung Cancer. N Engl J Med 376 (7): 629-640, 2017. [PUBMED Abstract]
- Park K, Haura EB, Leighl NB, et al.: Amivantamab in EGFR Exon 20 Insertion-Mutated Non-Small-Cell Lung Cancer Progressing on Platinum Chemotherapy: Initial Results From the CHRYSALIS Phase I Study. J Clin Oncol 39 (30): 3391-3402, 2021. [PUBMED Abstract]
- Zhou C, Ramalingam SS, Kim TM, et al.: Treatment Outcomes and Safety of Mobocertinib in Platinum-Pretreated Patients With EGFR Exon 20 Insertion-Positive Metastatic Non-Small Cell Lung Cancer: A Phase 1/2 Open-label Nonrandomized Clinical Trial. JAMA Oncol 7 (12): e214761, 2021. [PUBMED Abstract]
- Kwak EL, Bang YJ, Camidge DR, et al.: Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer. N Engl J Med 363 (18): 1693-703, 2010. [PUBMED Abstract]
- Shaw AT, Yeap BY, Solomon BJ, et al.: Effect of crizotinib on overall survival in patients with advanced non-small-cell lung cancer harbouring ALK gene rearrangement: a retrospective analysis. Lancet Oncol 12 (11): 1004-12, 2011. [PUBMED Abstract]
- Shaw AT, Kim DW, Nakagawa K, et al.: Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med 368 (25): 2385-94, 2013. [PUBMED Abstract]
- Shaw AT, Kim DW, Mehra R, et al.: Ceritinib in ALK-rearranged non-small-cell lung cancer. N Engl J Med 370 (13): 1189-97, 2014. [PUBMED Abstract]
- Shaw AT, Gandhi L, Gadgeel S, et al.: Alectinib in ALK-positive, crizotinib-resistant, non-small-cell lung cancer: a single-group, multicentre, phase 2 trial. Lancet Oncol 17 (2): 234-42, 2016. [PUBMED Abstract]
- Ou SH, Ahn JS, De Petris L, et al.: Alectinib in Crizotinib-Refractory ALK-Rearranged Non-Small-Cell Lung Cancer: A Phase II Global Study. J Clin Oncol 34 (7): 661-8, 2016. [PUBMED Abstract]
- Kim DW, Tiseo M, Ahn MJ, et al.: Brigatinib in Patients With Crizotinib-Refractory Anaplastic Lymphoma Kinase-Positive Non-Small-Cell Lung Cancer: A Randomized, Multicenter Phase II Trial. J Clin Oncol 35 (22): 2490-2498, 2017. [PUBMED Abstract]
- Solomon BJ, Besse B, Bauer TM, et al.: Lorlatinib in patients with ALK-positive non-small-cell lung cancer: results from a global phase 2 study. Lancet Oncol 19 (12): 1654-1667, 2018. [PUBMED Abstract]
- Planchard D, Besse B, Groen HJM, et al.: Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol 17 (7): 984-993, 2016. [PUBMED Abstract]
- Gainor JF, Shaw AT: Novel targets in non-small cell lung cancer: ROS1 and RET fusions. Oncologist 18 (7): 865-75, 2013. [PUBMED Abstract]
- Drilon A, Siena S, Dziadziuszko R, et al.: Entrectinib in ROS1 fusion-positive non-small-cell lung cancer: integrated analysis of three phase 1-2 trials. Lancet Oncol 21 (2): 261-270, 2020. [PUBMED Abstract]
- Shaw AT, Ou SH, Bang YJ, et al.: Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med 371 (21): 1963-71, 2014. [PUBMED Abstract]
- Wu YL, Yang JC, Kim DW, et al.: Phase II Study of Crizotinib in East Asian Patients With ROS1-Positive Advanced Non-Small-Cell Lung Cancer. J Clin Oncol 36 (14): 1405-1411, 2018. [PUBMED Abstract]
- Farago AF, Le LP, Zheng Z, et al.: Durable Clinical Response to Entrectinib in NTRK1-Rearranged Non-Small Cell Lung Cancer. J Thorac Oncol 10 (12): 1670-4, 2015. [PUBMED Abstract]
- Gatalica Z, Xiu J, Swensen J, et al.: Molecular characterization of cancers with NTRK gene fusions. Mod Pathol 32 (1): 147-153, 2019. [PUBMED Abstract]
- Drilon A, Laetsch TW, Kummar S, et al.: Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children. N Engl J Med 378 (8): 731-739, 2018. [PUBMED Abstract]
- Doebele RC, Drilon A, Paz-Ares L, et al.: Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol 21 (2): 271-282, 2020. [PUBMED Abstract]
- Drilon A, Hu ZI, Lai GGY, et al.: Targeting RET-driven cancers: lessons from evolving preclinical and clinical landscapes. Nat Rev Clin Oncol 15 (3): 151-167, 2018. [PUBMED Abstract]
- Drilon A, Subbiah V, Gautschi O, et al.: Selpercatinib in Patients With RET Fusion-Positive Non-Small-Cell Lung Cancer: Updated Safety and Efficacy From the Registrational LIBRETTO-001 Phase I/II Trial. J Clin Oncol 41 (2): 385-394, 2023. [PUBMED Abstract]
- Gainor JF, Curigliano G, Kim DW, et al.: Pralsetinib for RET fusion-positive non-small-cell lung cancer (ARROW): a multi-cohort, open-label, phase 1/2 study. Lancet Oncol 22 (7): 959-969, 2021. [PUBMED Abstract]
- Awad MM, Oxnard GR, Jackman DM, et al.: MET Exon 14 Mutations in Non-Small-Cell Lung Cancer Are Associated With Advanced Age and Stage-Dependent MET Genomic Amplification and c-Met Overexpression. J Clin Oncol 34 (7): 721-30, 2016. [PUBMED Abstract]
- Paik PK, Felip E, Veillon R, et al.: Tepotinib in Non-Small-Cell Lung Cancer with MET Exon 14 Skipping Mutations. N Engl J Med 383 (10): 931-943, 2020. [PUBMED Abstract]
- Wolf J, Seto T, Han JY, et al.: Capmatinib in MET Exon 14-Mutated or MET-Amplified Non-Small-Cell Lung Cancer. N Engl J Med 383 (10): 944-957, 2020. [PUBMED Abstract]
- Skoulidis F, Li BT, Dy GK, et al.: Sotorasib for Lung Cancers with KRAS p.G12C Mutation. N Engl J Med 384 (25): 2371-2381, 2021. [PUBMED Abstract]
- Jänne PA, Riely GJ, Gadgeel SM, et al.: Adagrasib in Non-Small-Cell Lung Cancer Harboring a KRASG12C Mutation. N Engl J Med 387 (2): 120-131, 2022. [PUBMED Abstract]
- U.S. Food and Drug Administration: FDA grants accelerated approval to adagrasib for KRAS G12C-mutated NSCLC. Food and Drug Administration, 2022. Available online. Last accessed January 24, 2025.
- Riudavets M, Sullivan I, Abdayem P, et al.: Targeting HER2 in non-small-cell lung cancer (NSCLC): a glimpse of hope? An updated review on therapeutic strategies in NSCLC harbouring HER2 alterations. ESMO Open 6 (5): 100260, 2021. [PUBMED Abstract]
- Li BT, Smit EF, Goto Y, et al.: Trastuzumab Deruxtecan in HER2-Mutant Non-Small-Cell Lung Cancer. N Engl J Med 386 (3): 241-251, 2022. [PUBMED Abstract]
- Brahmer J, Reckamp KL, Baas P, et al.: Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med 373 (2): 123-35, 2015. [PUBMED Abstract]
- Borghaei H, Paz-Ares L, Horn L, et al.: Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 373 (17): 1627-39, 2015. [PUBMED Abstract]
- Garon EB, Rizvi NA, Hui R, et al.: Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med 372 (21): 2018-28, 2015. [PUBMED Abstract]
- Horn L, Spigel DR, Vokes EE, et al.: Nivolumab Versus Docetaxel in Previously Treated Patients With Advanced Non-Small-Cell Lung Cancer: Two-Year Outcomes From Two Randomized, Open-Label, Phase III Trials (CheckMate 017 and CheckMate 057). J Clin Oncol 35 (35): 3924-3933, 2017. [PUBMED Abstract]
- Herbst RS, Baas P, Kim DW, et al.: Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 387 (10027): 1540-50, 2016. [PUBMED Abstract]
- Rittmeyer A, Barlesi F, Waterkamp D, et al.: Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet 389 (10066): 255-265, 2017. [PUBMED Abstract]
- Fehrenbacher L, Spira A, Ballinger M, et al.: Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 387 (10030): 1837-46, 2016. [PUBMED Abstract]
- Yao JC, Fazio N, Singh S, et al.: Everolimus for the treatment of advanced, non-functional neuroendocrine tumours of the lung or gastrointestinal tract (RADIANT-4): a randomised, placebo-controlled, phase 3 study. Lancet 387 (10022): 968-977, 2016. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (02/20/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Este resumen fue objeto de amplia revisión.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de pulmón de células no pequeñas. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de pulmón de células no pequeñas son:
- Janet Dancey, MD, FRCPC (Ontario Institute for Cancer Research & NCIC Clinical Trials Group)
- Meredith McAdams, MD (National Cancer Institute)
- Monaliben Patel, MD (University of Rochester Medical Center)
- Arun Rajan, MD (National Cancer Institute)
- Eva Szabo, MD (National Cancer Institute)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de pulmón de células no pequeñas. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/pulmon/pro/tratamiento-pulmon-celulas-no-pequenas-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.