Un “medicamento vivo”
Las células T con CAR equivalen a “dar a los pacientes un medicamento vivo”, explicó el doctor Renier Brentjens, del Centro Oncológico Memorial Sloan Kettering en Nueva York, otro de los pioneros en el campo de las células T con CAR.
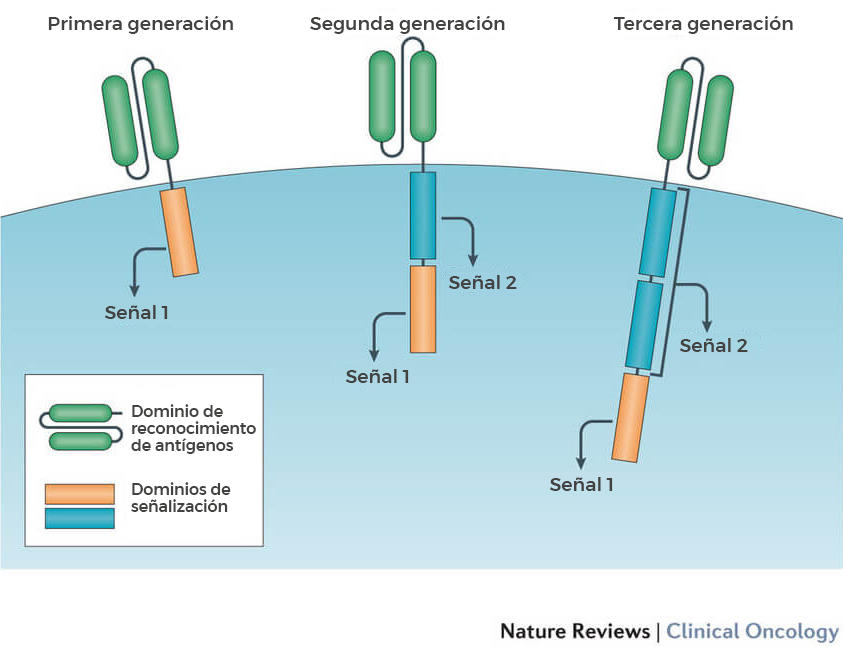
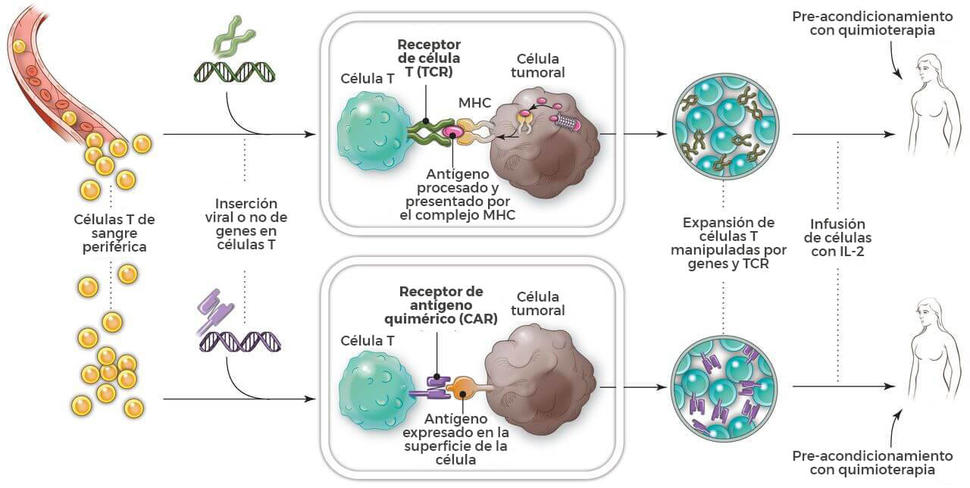
Como lo implica su nombre, la columna central de la terapia de células T con CAR son las células T, que se dicen con frecuencia caballos de tiro del sistema inmunitario debido a su función crítica en colocar armoniosamente la respuesta inmunitaria y destruir las células infectadas por patógenos. La terapia requiere la extracción de sangre de los pacientes y la separación de las células T. A continuación, con el uso de un virus desarmado, las células T se manipulan genéticamente para producir receptores en sus superficies llamados receptores de antígeno quimérico, o CAR.
Estos receptores son “moléculas sintéticas, no existen naturalmente”, explicó el doctor Carl June, del Centro Oncológico Abramson de la Universidad de Pensilvania, durante una presentación reciente sobre células T con CAR en la sede de los Institutos Nacionales de la Salud. El doctor June ha dirigido una serie de estudios clínicos de células T con CAR, sobre todo en pacientes con leucemia.
Estos receptores especiales permiten que las células T reconozcan y se peguen a una proteína específica o antígeno, en las células de tumores. Las terapias de células T con CAR, por su formulación ulterior, atacan a un antígeno que se encuentra en las células B llamado CD19 (vea “Producción de una célula T con CAR”).
Una vez que se hayan manipulado las células T recolectadas para que expresen el CAR específico al antígeno, se “expanden” en el laboratorio en cientos de millones.
El paso final es la infusión de las células T con CAR en el paciente (a lo cual se precede con un esquema de quimioterapia para “destrucción de linfocitos”). Si todo sale como se planeó, las células manipuladas se multiplican todavía más en el cuerpo del paciente y, con la guía de su receptor manipulado, reconocen y destruyen a las células cancerosas que albergan el antígeno en sus superficies.
Una posible opción cuando no había ninguna
La formulación inicial de las terapias de células T con CAR se ha concentrado más que nada en la LLA, el cáncer más común en los niños.
Más de 80 % de los niños diagnosticados con LLA que surge en las células B — el tipo predominante de LLA infantil— se curarán con quimioterapia intensiva. Pero para pacientes cuyos cánceres regresan después de la quimioterapia o de un trasplante de células madre, las opciones de tratamiento son “prácticamente nulas”, dijo el doctor Stephan Grupp, del Hospital Infantil de Filadelfia (CHOP).
La leucemia linfoblástica aguda recidivante, de hecho, es una causa principal de muerte por cáncer infantil.
El doctor Grupp ha dirigido varios estudios de células T con CAR en niños y en adultos jóvenes con LLA que ha regresado o que no respondía a las terapias existentes. En uno de estos primeros estudios, que usaron células T con CAR que atacaban el CD19, todos los signos de cáncer desaparecieron (una respuesta completa) en 27 de los 30 pacientes tratados en el estudio.
Estos éxitos iniciales sentaron la base para un estudio más grande de una terapia de células T con CAR llamada tisagenlecleucel (Kymriah™) que atacaba al CD19. Muchos de los pacientes que participaron en el estudio, financiado por Novartis, tuvieron remisiones completas y de larga duración. Basándose en los resultados del estudio, la FDA aprobó el tisagenlecleucel en agosto de 2017.
Resultados semejantes se han visto en estudios de células T con CAR que atacan al CD19 dirigidos por investigadores de la Unidad de Oncología Pediátrica (POB) del CCR.
El progreso logrado con la terapia de células T con CAR en niños con LLA “ha sido fantástico”, dijo el doctor Terry Fry, investigador principal de varios estudios de la POB en células T con CAR. Las células T con CAR que atacan al CD19 se probaron inicialmente en adultos. Pero el hecho de que la primera aprobación es de una terapia para niños y adolescentes con LLA es un momento crítico, continuó el doctor Fry.
Que la administración apruebe una nueva terapia en niños antes de aprobarla para adultos “es casi inaudito en oncología”, dijo él.
Sin embargo, no hay escasez de datos prometedores sobre células T con CAR que se usen para tratar a pacientes adultos con cánceres hemáticos. Las células T con CAR que atacan al CD19 han producido fuertes resultados no solo en pacientes con LLA sino también en pacientes con linfomas. Por ejemplo, en un estudio pequeño dirigido por el NCI de células T con CAR principalmente en pacientes con linfoma avanzado difuso de células B grandes, más de la mitad tuvieron respuestas completas al tratamiento.
“Nuestros datos proveen la primera mirada verdadera a la posibilidad de este planteamiento en pacientes con linfomas agresivos, quienes, hasta este punto, prácticamente no se podían tratar", dijo el principal investigador del estudio, doctor James Kochenderfer de la Unidad de Trasplante e Inmunología Experimentales del NCI.
Desde ese tiempo, las conclusiones de un estudio grande financiado por Kite Pharmaceuticals (quienes tienen un convenio de investigación con el NCI para crear terapias basadas en transferencia celular adoptiva) han confirmado esos resultados iniciales, los cuales se espera que ayuden a apoyar la aprobación de la FDA del producto de Kite para algunos pacientes con linfoma.
Los resultados en linfoma hasta la fecha “han sido increíblemente exitosos”, dijo el doctor Kochenderfer, “y casi es seguro que las células T con CAR serán una terapia que se use frecuentemente para varios tipos de linfoma”.
Los avances rápidos en la terapia de células T con CAR y su crecimiento han excedido las expectativas aun de quienes creían en su potencial al principio.
“¿Pensé que podría funcionar? Sí”, dijo el doctor Brentjens. Pero él pensó inicialmente que sería una “terapia de botica” limitada a un grupo muy pequeño, definido, de pacientes. La experiencia en los últimos 5 años, incluyendo la entrada de la industria biofarmacéutica en el campo, ha alterado su punto de vista.
“Tenemos cohortes de pacientes que habrían sido considerados terminales y que ahora tienen remisiones duraderas y significativas con buena calidad de vida hasta por 5 años”, continuó él. “Entonces, el entusiasmo por esta tecnología es ahora bastante elevado”.
Entender y controlar los efectos secundarios
Como todas las terapias contra el cáncer, la terapia de células T con CAR puede causar varios efectos secundarios preocupantes y algunas veces fatales. Uno de los más frecuentes es el síndrome de liberación de citocinas (CRS).
Como parte de sus funciones relacionadas con lo inmunitario, las células T liberan citocinas, mensajeros químicos que ayudan a estimular y a dirigir la respuesta inmunitaria. En el caso de CRS, hay una rápida y masiva liberación de citocinas en el torrente sanguíneo, lo que puede llevar a fiebres peligrosamente altas y a bajas precipitosas de la presión arterial.
Irónicamente, el CRS se considera un efecto de la terapia de células T con CAR “en el blanco” — es decir, su presencia demuestra que células T activas están trabajando en el cuerpo. Generalmente, los pacientes con la enfermedad más extensa antes de recibir las células T con CAR tienen más probabilidad de experimentar CRS grave, explicó el doctor Kochenderfer.
En muchos pacientes, tanto niños como adultos, el CRS puede controlarse con terapias convencionales de apoyo, incluyendo esteroides. Y, conforme los investigadores adquieren más experiencia con la terapia de células T con CAR, ellos han aprendido a manejar mejor los más graves casos de CRS.
Hace varios años, por ejemplo, el equipo de investigación en el CHOP notó que los pacientes que experimentaban un CRS grave todos ellos tenían concentraciones altas de IL-6, una citocina que es secretada por células T y macrófagos en respuesta a la inflamación. Entonces ellos se dirigieron a las terapias aprobadas para tratar padecimientos inflamatorios como la artritis juvenil, incluyendo el fármaco tocilizumab (Actemra®), el cual bloquea la actividad del IL-6.
Ese planteamiento funcionó y resolvió rápidamente el problema en la mayoría de los pacientes. Desde ese tiempo, tocilizumab se ha convertido en una terapia convencional para controlar el CRS grave.
“Hemos aprendido cómo graduarlo [CRS], hemos aprendido cómo tratarlo”, dijo el doctor Grupp en una reunión del comité consultivo de la FDA sobre la terapia dirigida al CD19 de Novartis. “Y el bloqueo del IL-6 fue realmente clave”.
Otro posible efecto secundario de la terapia de células T con CAR — un efecto fuera del blanco— es la muerte en masa, una detrás de otra, de las células B, lo cual se conoce como aplasia de células B. El CD19 se expresa también en células B normales, las cuales son responsables de producir anticuerpos que matan a los patógenos. Estas células B normales son destruidas también a menudo por las células T con CAR infusas. Para compensar, muchos pacientes necesitan recibir terapia de inmunoglobulina, la cual les provee los anticuerpos necesarios para combatir las infecciones.
Más recientemente, otro efecto secundario grave y posiblemente fatal —la inflamación del cerebro, o edema cerebral— se ha visto en algunos de los estudios más grandes que se llevan a cabo para apoyar la posible aprobación de la FDA de terapias de células T con CAR para pacientes con leucemias avanzadas. Una compañía, de hecho, decidió suspender la producción ulterior de su terapia principal de células T con CAR después de que varios pacientes murieron en estudios clínicos como resultado de edema cerebral inducido por tratamiento.
Sin embargo, el problema parece ser limitado, siendo que los directores de otros estudios de terapias de células T con CAR no reportan casos de edema cerebral.
Otras, llamadas neurotoxicidades —como confusión o actividad como de convulsión— se han visto en la mayoría de los estudios de terapias de células T con CAR. Pero, en casi todos los pacientes, el problema es de corta duración y reversible, dijo el doctor Brentjens.
Hubo especulación al principio de que estas neurotoxicidades podrían relacionarse con el CRS. Aunque los investigadores están tratando todavía de manejar los mecanismos, añadió él, “pienso que la mayoría de los investigadores [en el campo] estarían de acuerdo en que son distintas al CRS”.
Nuevos antígenos en el blanco de células T con CAR
La investigación de las células T con CAR continúa avanzando a paso acelerado, más que nada en pacientes con cánceres hemáticos, pero también en pacientes con tumores sólidos. Conforme la industria biofarmacéutica se ocupa cada vez más en este campo, por ejemplo, el número de estudios clínicos que evalúan las células T con CAR se ha expandido dramáticamente, de solo un puñado hace 5 años a más de 180 y en aumento.
La mayoría de estos estudios llevados a cabo hasta la fecha han usado células T con CAR que atacan al CD19. Pero eso está cambiando con rapidez, en parte debido a la necesidad.
Algunos pacientes con LLA, por ejemplo, no responden a la terapia dirigida al CD19. Y, aun en quienes experimentan una respuesta completa, hasta un tercio verán que su enfermedad regresa en un año, dice el doctor Fry. Muchos de estos casos de recurrencia de la enfermedad se han asociado con el hecho de que las células de LLA ya no expresen CD19, un fenómeno que se conoce como pérdida de antígeno.
Así, en niños y en adultos jóvenes con LLA avanzada, los investigadores de la POB del NCI están probando las células T con CAR que atacan a la proteína CD22, la cual es también sobreexpresada a menudo por las células de LLA. En el primer estudio de células T con CAR que atacan al CD22, la mayoría de los pacientes tratados tuvieron remisiones completas, incluyendo los pacientes cuyo cáncer había avanzado después de tener inicialmente una respuesta completa a la terapia dirigida contra el CD19.
De forma similar al caso de las células T con CAR que atacan al CD19, no obstante, no son raras las recaídas después del tratamiento dirigido al CD22, explicó el doctor Fry.
“Hay definitivamente espacio para mejorar desde el punto de vista de la durabilidad de las remisiones”, dijo él.
Una posible forma de mejorar la durabilidad y quizás al menos evitar la pérdida de antígeno, si no evitarlo por completo, es la de atacar simultáneamente muchos antígenos. Los investigadores del NCI, por ejemplo, están preparando células T que atacan tanto al CD19 como al CD22. Esperan iniciar un estudio para evaluar este planteamiento nuevo antes de finalizar 2017, dijo el doctor Fry.
Investigadores del CHOP están evaluando también una célula T con CAR que ataca tanto al CD19 como al CD123, otro antígeno que se encuentra ordinariamente en las células de leucemia. Estudios iniciales en modelos animales han sugerido que este ataque doble puede evitar la pérdida de antígenos.
Se han identificado blancos de antígenos para la terapia de células T con CAR en otros cánceres hemáticos, incluso en mieloma múltiple.
El doctor Kochendorfer y sus colegas en el NCI, como parte de la colaboración con Kite, han preparado células T con CAR que atacan a la proteína BCMA, la cual se encuentra en casi todas las células de mieloma. Los primero resultados de un estudio de células T con CAR que atacan a la BCMA fueron positivos, y Kite sigue adelante con la prueba de células que atacan a la BCMA en un estudio grande.
¿Extensión de células T con CAR a tumores sólidos?
Hay cierto escepticismo de que las células T con CAR tengan el mismo éxito en los tumores sólidos. El doctor Rosenberg cree que encontrar antígenos adecuados para atacar a los tumores sólidos —lo cual ha sido un reto mayor— puede resultar demasiado difícil en la mayoría de los casos.
“Los esfuerzos para identificar antígenos únicos en la superficie de tumores sólidos han sido infructuosos en gran medida”, dijo él.
Los investigadores calculan que la abrumadora mayoría de antígenos de tumores residen dentro de las células de los tumores, fuera del alcance de los receptores de antígeno quiméricos, los cuales pueden unirse solo a antígenos en la superficie de las células.
Como resultado, de la misma forma como ya se ha mostrado en el melanoma, dice el doctor Rosenberg que él cree que otras formas de transferencia celular adoptiva pueden ser más adecuadas para tumores sólidos.
Pero eso no significa que los investigadores no están tratando con las células T con CAR.
Por ejemplo, los investigadores están efectuando estudios de células T con CAR que atacan a la proteína mesotelina, la cual es sobreexpresada en las células de tumores en los cánceres más letales, incluyendo cánceres de páncreas y de pulmón, y a la proteína EGFRvIII, la cual está presente en casi todas las células tumorales en pacientes con el agresivo cáncer de cerebro glioblastoma.
Informes iniciales de estos estudios, no obstante, no han reportado el mismo éxito que se ha visto en los cánceres hemáticos.
“En cuanto a atacar a los antígenos en tumores sólidos en la misma forma como atacamos al CD19, no creo que va a funcionar en la mayoría de los casos”, reconoció el doctor Brentjens.
Otro obstáculo clave con los tumores sólidos, explicó él, es que los componentes del microentorno que los rodean conspiran para mitigar la respuesta inmunitaria.
Por esto, el éxito contra los tumores sólidos puede requerir una “super célula T”, dijo él, que haya sido manipulada para superar el entorno supresor de lo inmunitario de muchos tumores sólidos avanzados. Trabajar en una célula T con CAR con estas propiedades —una célula T con CAR con “armadura”— está en proceso en el Memorial Sloan Kettering, dijo él.
Evolución de terapias de células T con CAR
Se están probando otras sutilezas o reconfiguraciones de las células T con CAR. Un planteamiento es la creación de terapias de células T con CAR que usan células inmunitarias recolectadas no de pacientes sino de donantes sanos. La idea es crear terapias de células T con CAR que estén a la mano y disponibles de inmediato para usarse y que no necesiten ser producidas para cada paciente.
La compañía francesa Cellectis, de hecho, ha lanzado ya en los Estados Unidos un estudio en fase I de su producto a la mano de células T con CAR que atacan al CD19 para pacientes con leucemia mieloide aguda avanzada. El producto de la compañía —el cual se elabora usando una tecnología de edición de genes conocida como TALEN— ha sido usado ya en Europa, incluso en dos lactantes con LLA que habían agotado todas las otras opciones de tratamiento. En ambos casos, el tratamiento fue efectivo.
Muchos otros planteamientos están en investigación. Los investigadores, por ejemplo, están usando nanotecnología para crear células T con CAR dentro del cuerpo, preparando células T con CAR con “interruptores apagados” como un medio de evitar o limitar los efectos secundarios como el CRS y usando la tecnología de edición de genes CRISPR/Cas9 para manipular con más precisión las células T.
Pero hay todavía más por hacer en cuanto a las terapias de células T con CAR, dijo el doctor Fry.
Él está especialmente entusiasmado con la posibilidad de usar las células T con CAR más pronto en el proceso para niños con LLA, especialmente los que tienen un alto riesgo (según factores clínicos específicos) de que regrese su enfermedad después de su quimioterapia inicial, la cual se administra aproximadamente a los 2 años y medio.
En este escenario, explicó él, si indicadores iniciales sugieren que estos pacientes de alto riesgo no tendrían una respuesta óptima a la quimioterapia, esta se podría interrumpir, y los pacientes podrían ser tratados con células T con CAR.
Para los pacientes que respondan bien, “ellos podrían librarse de 2 años más de quimioterapia”, dijo el doctor Fry. “Es asombroso pensar en esto”.