Genética del cáncer gástrico (PDQ®)–Versión para profesionales de salud
Introducción
El cáncer gástrico es uno de los cánceres que se diagnostican con más frecuencia en el mundo, con una incidencia de más de 1 millón de casos y un número estimado de 769 000 muertes en 2020. A nivel mundial, este cáncer ocupó el quinto lugar en la incidencia de cáncer y el cuarto lugar en la mortalidad por cáncer en 2020.[1,2] Se calcula que en 2025 habrán 30 300 casos nuevos de cáncer gástrico y que 10 780 personas morirán por este cáncer en los Estados Unidos.[3] En poblaciones de pacientes atendidos en clínicas, entre el 15 % y el 20 % de los pacientes con cáncer gástrico presentan variantes patogénicas en genes de cáncer hereditario.[4,5]
Los genes que predisponen al cáncer gástrico difuso hereditario (HDGC) son los siguientes:
El HDGC es el síndrome de predisposición al cáncer gástrico hereditario más común. Esta enfermedad no tiene una lesión precursora fácilmente detectable. Para obtener más información, consultar Cáncer gástrico difuso hereditario.
También hay síndromes de cáncer hereditario que predisponen a otras formas de cáncer gástrico; estos síndromes son los siguientes:
- Síndrome de Lynch: la causa de este síndrome son variantes patogénicas en los genes MLH1, MSH2, MSH6, PMS2 y EPCAM. Aún se desconoce la cuantía del riesgo de cáncer gástrico relacionado con el síndrome de Lynch y la función de los exámenes de detección de este cáncer, en especial porque todavía no se ha identificado un precursor del cáncer gástrico relacionado con el síndrome de Lynch.[6]
- Poliposis adenomatosa familiar (PAF), adenocarcinoma gástrico y poliposis proximal del estómago (GAPPS): estas afecciones se deben a variantes patogénicas en el gen APC. Por lo general, hay pólipos de las glándulas fúndicas que preceden al cáncer gástrico.[7]
- Síndrome de Peutz-Jeghers (SPJ): la causa de este síndrome son variantes patogénicas en el gen STK11. Por lo general, hay pólipos hamartomatosos que preceden al cáncer gástrico.[8]
- Síndrome de poliposis juvenil (PJ): la causa de este síndrome son variantes patogénicas en los genes SMAD4 y BMPR1A. Por lo general, hay pólipos hamartomatosos que preceden al cáncer gástrico.
En cada uno de estos síndromes, la presencia de pólipos gástricos y el riesgo de cáncer gástrico tiene una importancia secundaria frente al desarrollo de pólipos colorrectales y cáncer colorrectal. La carga de pólipos gástricos (incluso cantidad y tamaño) y el riesgo de cáncer gástrico varían de persona a persona.
Para obtener más información sobre estos síndromes genéticos, consultar el Cuadro 1.
Factores de riesgo del cáncer gástrico
Factores de riesgo ambiental
Las tasas de incidencia del cáncer gástrico son más altas en Asia oriental y Europa oriental, mientras que suelen ser bajas en América del Norte, Europa del Norte y África.[2] Es muy probable que la causa de estas diferencias regionales sean factores de riesgo ambientales y hereditarios.
Los factores de riesgo ambientales del cáncer gástrico son los siguientes:
1. Infección por Helicobacter pylori (H. pylori).
- Este quizás sea el factor de riesgo ambiental con mayor repercusión en el cáncer gástrico.
- La infección por H. pylori en ocasiones produce cambios histológicos en el estómago, que pueden comenzar con una gastritis activa crónica y progresar a atrofia gástrica, metaplasia intestinal, displasia gástrica y, finalmente, cáncer gástrico.[9,10]
- La combinación de la infección por H. pylori y la presencia de variantes patogénicas germinales en genes de recombinación homóloga (ATM, BRCA1, BRCA2 y PALB2) aumenta el riesgo de cáncer gástrico de manera aditiva. En un estudio de 38 153 controles y 10 426 casos de cáncer gástrico en Japón se encontró que las variantes patogénicas germinales en 9 genes (APC, ATM, BRCA1, BRCA2, CDH1, MLH1, MSH2, MSH6 y PALB2) se asociaban con aumento del riesgo de cáncer gástrico.[11] El riesgo relativo (RR) de cáncer gástrico en personas que tienen una infección por H. pylori y una variante patogénica en 1 de 4 genes de recombinación homóloga fue de 16,01 (intervalo de confianza, 2,22–29,8). El riesgo persistió después de ajustar por los factores de riesgo ambiental como consumo de tabaco, obesidad e ingesta de sal. No hubo incremento del riesgo en las personas que tenían una infección por H. pylori y una variante patogénica en un gen de reparación de errores de emparejamiento. Los autores identificaron que los resultados se refieren de manera primaria a población japonesa, dado que las tasas de incidencia del cáncer gástrico y la infección por H. pylori son mucho más altas en las poblaciones del este de Asía que en las poblaciones occidentales.
2. Alimentación.
- El tipo de dieta influye en la variación regional de la incidencia del cáncer gástrico.[12,13]
- El riesgo de cáncer gástrico aumenta cuando las personas consumen alimentos conservados con sal.[13,14]
- Una ingesta baja de frutas y el consumo de una gran cantidad de carnes o pescados procesados, asados o emparillados también puede aumentar el riesgo de cáncer gástrico.[13]
3. Efectos de la migración.
- El riesgo de cáncer gástrico también cambia por la migración (es decir, por los efectos derivados de la emigración de una región con riesgo alto de cáncer gástrico a una región con riesgo bajo de este cáncer o viceversa).
- En estudios se demostró que la incidencia de cáncer gástrico en inmigrantes se correlaciona de manera estrecha con la incidencia de cáncer gástrico en su nuevo país anfitrión después de una o dos generaciones.[15-17]
5. Consumo de bebidas alcohólicas.[13,14]
6. Evidencia emergente para la obesidad y la enfermedad por reflujo gastroesofágico (ERGE).
7. Desigualdades raciales y étnicas.
- Hay desigualdades raciales y étnicas llamativas relacionadas con la incidencia del cáncer gástrico en los Estados Unidos.[20-25]
- Se necesitan estudios que examinen los factores de riesgo genéticos y no genéticos, como los determinantes sociales de la salud, para comprender y reducir las desigualdades en la incidencia del cáncer gástrico que se observan en varios grupos raciales y étnicos minoritarios.
Hay justificación clínica para una vigilancia más intensiva en personas con factores de riesgo de cáncer gástrico de origen hereditario, ambiental o étnico. No obstante, se necesitan más datos que indiquen si estos factores de riesgo aumentan o disminuyen el riesgo de cáncer gástrico en personas con variantes patogénicas de cáncer gástrico hereditario. Para obtener más información sobre los factores de riesgo del cáncer gástrico en la población general, consultar Exámenes de detección del cáncer de estómago (gástrico).
Factores de riesgo familiares
Las personas con antecedentes familiares de cáncer gástrico tienen un mayor riesgo de presentar este tipo de cáncer.[26] Por ejemplo, en 7 estudios diferentes se encontró que el RR de cáncer gástrico aumentó entre 1,5 y 3,5 veces en las personas que tenían un familiar de primer grado con cáncer gástrico en comparación con quienes no lo tenían.[27-33] Sin embargo, estos fueron estudios retrospectivos, y las estimaciones de riesgo quizás se confundieron por el sesgo de recuerdo (es decir, recordar casos de cáncer en familiares), los factores ambientales y alimentarios compartidos, además de los diferentes países en los que se llevaron a cabo los estudios. El factor de riesgo ambiental o alimentario más destacado fue la infección por H. pylori. Cuando una persona tiene una infección por H. pylori, sus familiares también tienen una mayor probabilidad de presentar una infección por H. pylori. En estudios de cohortes más pequeños se indicó la presencia de un riesgo residual hereditario de cáncer gástrico después de corregir por la presencia de una infección por H. pylori. La mayoría de estos estudios no tuvieron en cuenta las variantes patogénicas de cáncer gástrico hereditario.[34] En una revisión retrospectiva grande de pacientes japoneses (con cáncer gástrico y sin este) se encontró un fuerte aumento aditivo del riesgo de cáncer gástrico en personas con infección por H. pylori, sobre todo en aquellas con variantes patogénicas de ATM, BRCA1, BRCA2 o PALB2.[11] En un estudio escandinavo, se demostró que el valor de concordancia para el cáncer gástrico fue más alto en gemelos monocigóticos que en gemelos dicigóticos. Esto indica que el riesgo de cáncer gástrico a veces es hereditario.[35]
También se ha estudiado la heredabilidad del cáncer gástrico en familias con múltiples casos de cáncer gástrico. En un informe de 1964, se describió a una familia maorí nativa numerosa de Nueva Zelanda.[36] Luego, a finales de los años noventa, en otro estudio se estableció un ligamiento genético entre el gen CDH1, que codifica una molécula de adhesión celular, y los casos de cáncer gástrico de la familia maorí original (identificada en 1964) y en otras 2 familias maoríes. En este estudio, los investigadores encontraron una regulación por disminución de la expresión del gen CDH1 en personas maoríes con cáncer gástrico avanzado.[36-39] Las variantes patogénicas germinales en el gen CDH1 se encontraron por primera vez en personas afectadas dentro de estas familias maoríes, y más tarde, en familias con cáncer gástrico difuso hereditario de todo el mundo. Luego, se añadió el cáncer de mama lobulillar femenino y las fisuras orofaciales al espectro fenotípico de las variantes patogénicas en el gen CDH1.[40]
Lesiones precancerosas
En el estómago, el adenocarcinoma gástrico puede surgir de lesiones visibles, de una progresión histológica de una atrofia mucosa o, con menor frecuencia, de lesiones invisibles (es decir, infiltración submucosa, como se observa en el adenocarcinoma gástrico de tipo difuso). En esta sección se revisan los pólipos gástricos y los cambios histológicos relacionados con la gastritis crónica que predisponen a una persona al cáncer gástrico.
Pólipos gástricos
Los pólipos gástricos son comunes en la población de los Estados Unidos y se encuentran en hasta el 6 % de las personas que se someten a una endoscopia. Sin embargo, es infrecuente que estos pólipos se conviertan en cáncer gástrico.[41] Cuando los pólipos gástricos se encuentran aislados, por lo general son de naturaleza esporádica. Sin embargo, los pólipos gástricos a veces se vinculan con síndromes de cáncer hereditario, en especial, los síndromes hamartomatosos o poliposos. Los pólipos gástricos se clasifican según sus características anatomopatológicas de la siguiente manera:
- Pólipos adenomatosos.
- Pólipos hiperplásicos.
- Pólipos inflamatorios.
- Pólipos hamartomatosos (relacionado con SPJ, PJ y el síndrome de hamartoma tumoral PTEN).
- Pólipos de las glándulas fúndicas.[42]
En general, el potencial maligno de un pólipo se determina por las características histológicas, el tamaño y el grado de displasia, si está presente. Los pólipos adenomatosos e hiperplásicos tienen el potencial maligno más alto, en especial cuando hay infección por H. pylori. Por el contrario, los pólipos de las glándulas fúndicas (con displasia o sin esta) rara vez evolucionan hasta convertirse en cáncer gástrico, incluso en personas con PAF.[43]
Los pólipos de las glándulas fúndicas del estómago son comunes y, por lo general, se relacionan con el consumo a largo plazo de inhibidores de la bomba de protones (IBP).[44] Por lo general, los pólipos de las glándulas fúndicas no aumentan el riesgo de cáncer gástrico porque estos pólipos no son de naturaleza neoplásica. Sin embargo, el síndrome GAPPS es una excepción a esta regla. En el GAPPS, el riesgo de cáncer gástrico se correlaciona en gran medida con la poliposis de las glándulas fúndicas. Para obtener más información en inglés sobre GAPPS y PAF, consultar Genetics of Colorectal Cancer y Gastric Adenocarcinoma and Proximal Polyposis of the Stomach.
Los pólipos inflamatorios e hiperplásicos exhiben muchas características anatomopatológicas diferentes. A diferencia del colon, en el que los pólipos hiperplásicos acarrean poco riesgo o ningún riesgo de cáncer, los pólipos hiperplásicos en el estómago a veces se agrandan y presentan focos displásicos.[45] Este tipo de pólipos no se relacionan de manera clara con ningún síndrome de cáncer gástrico hereditario conocido.
Los pólipos hamartomatosos se observan en el estómago de pacientes con SPJ, PJ y PHTS. Para obtener más información en inglés sobre estos síndromes de cáncer hereditario, consultar Genetics of Colorectal Cancer. Por lo general, los pólipos hamartomatosos no son de naturaleza displásica. Sin embargo, a veces presentan focos displásicos. En consecuencia, es posible que estos pólipos aumenten el riesgo de cáncer gástrico, en especial en personas con síndromes de cáncer gástrico hereditario. No está claro si los pólipos gástricos hamartomatosos eventualmente se convierten en cáncer gástrico o si tan solo son indicativos de un entorno de riesgo alto en el estómago. El riesgo de cáncer gástrico se calcula según el síndrome de cáncer hereditario.
Los adenomas gástricos representan alrededor del 10 % de todos los pólipos gástricos. El potencial maligno de un adenoma gástrico se determina por su subtipo histológico y tamaño.[46] Por ejemplo, los adenomas de glándulas pilóricas y los adenomas gástricos de tipo intestinal tienen el potencial maligno más alto, mientras que los adenomas gástricos de tipo foveolar tienen el potencial maligno más bajo.[47,48]
Gastritis crónica
La gastritis crónica, un diagnóstico histológico definido por la presencia de un infiltrado celular mononuclear en la lámina propia del estómago, se produce debido a exposiciones ambientales o gastritis autoinmunitaria. La gastritis crónica puede provocar metaplasia intestinal gástrica. La infección por H. pylori es el factor de riesgo más común de metaplasia intestinal. Otros factores de riesgo de metaplasia intestinal son la anemia perniciosa, la gastritis autoinmunitaria, la etnia, la historia familiar de cáncer gástrico, los hábitos de alimentación, así como el consumo de tabaco y bebidas alcohólicas.[49] Después de que aparece la gastritis crónica, la mucosa del estómago en ocasiones sufre una serie de cambios progresivos, conocidos como cascada de Correa, que con el tiempo producen cáncer gástrico.
Los pasos de la cascada de Correa son los siguientes:
Aunque estos cambios histológicos se relacionan con un aumento del riesgo de cáncer gástrico en la población general, se desconoce la prevalencia de estos hallazgos y el riesgo de cáncer relacionados en los síndromes de cáncer hereditario. Cada paso en la cascada de Correa solo se presenta en una minoría de pacientes. Existe gran controversia sobre la vigilancia adecuada de los pacientes con metaplasia intestinal.[52]
Evaluación endoscópica
Los exámenes de detección del cáncer gástrico no se realizan de forma rutinaria en los Estados Unidos, donde la incidencia del cáncer gástrico es relativamente baja. Tampoco se suelen realizar exámenes de detección del cáncer gástrico en personas con historia familiar de cáncer gástrico en las que no se ha identificado una variante patogénica de cáncer gástrico hereditario. Se necesitan estudios multicéntricos prospectivos grandes para determinar si los programas de detección del cáncer gástrico mejorarían la mortalidad en personas con historia familiar de cáncer gástrico de los Estados Unidos. En este país, solo hay directrices de vigilancia del cáncer gástrico en personas con variantes patogénicas en el gen CDH1 u otros genes de riesgo de cáncer gástrico (para obtener más información, consultar el Cuadro 1).[53,54] El International Gastric Cancer Linkage Consortium recomienda que las personas con antecedentes familiares de cáncer gástrico difuso sin causas genéticas identificables (es decir, un síndrome similar al HDGC) se sometan a vigilancia del cáncer gástrico.[55] Para obtener más información, consultar la sección Familias con casos de cáncer similar al cáncer gástrico difuso hereditario: definición y abordaje en Cáncer gástrico difuso hereditario.
Cuando se examina a cualquier paciente con riesgo de cáncer gástrico hereditario mediante endoscopia, se evalúan la presencia de pólipos gástricos y de infección por H. pylori, a pesar de la falta de evidencia que demuestre que H.pylori aumenta el riesgo de cáncer gástrico en el entorno de todos los síndromes de cáncer hereditario.[11]
A continuación, se muestra un foco pequeño de metaplasia intestinal en el antro. La metaplasia intestinal no siempre es visible en la endoscopia. En cambio, a menudo se detecta cuando se toman biopsias aleatorias del estómago.[49] En investigaciones emergentes se han identificado estrategias para mejorar la detección endoscópica de dichos focos. Las poblaciones con tasas altas de prevalencia de metaplasia intestinal gástrica y displasia gástrica tienen tasas altas de incidencia de cáncer gástrico.[49]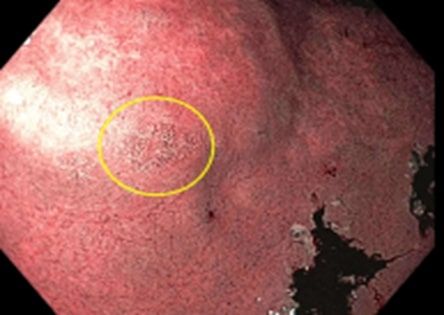
Bibliografía
- Allemani C, Matsuda T, Di Carlo V, et al.: Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet 391 (10125): 1023-1075, 2018. [PUBMED Abstract]
- Sung H, Ferlay J, Siegel RL, et al.: Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 71 (3): 209-249, 2021. [PUBMED Abstract]
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Uson PLS, Kunze KL, Golafshar MA, et al.: Germline Cancer Testing in Unselected Patients with Gastric and Esophageal Cancers: A Multi-center Prospective Study. Dig Dis Sci 67 (11): 5107-5115, 2022. [PUBMED Abstract]
- Ku GY, Kemel Y, Maron SB, et al.: Prevalence of Germline Alterations on Targeted Tumor-Normal Sequencing of Esophagogastric Cancer. JAMA Netw Open 4 (7): e2114753, 2021. [PUBMED Abstract]
- Møller P, Seppälä TT, Bernstein I, et al.: Cancer risk and survival in path_MMR carriers by gene and gender up to 75 years of age: a report from the Prospective Lynch Syndrome Database. Gut 67 (7): 1306-1316, 2018. [PUBMED Abstract]
- Abraham SC, Nobukawa B, Giardiello FM, et al.: Fundic gland polyps in familial adenomatous polyposis: neoplasms with frequent somatic adenomatous polyposis coli gene alterations. Am J Pathol 157 (3): 747-54, 2000. [PUBMED Abstract]
- Giardiello FM, Brensinger JD, Tersmette AC, et al.: Very high risk of cancer in familial Peutz-Jeghers syndrome. Gastroenterology 119 (6): 1447-53, 2000. [PUBMED Abstract]
- Correa P, Haenszel W, Cuello C, et al.: A model for gastric cancer epidemiology. Lancet 2 (7924): 58-60, 1975. [PUBMED Abstract]
- Hooi JKY, Lai WY, Ng WK, et al.: Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology 153 (2): 420-429, 2017. [PUBMED Abstract]
- Usui Y, Taniyama Y, Endo M, et al.: Helicobacter pylori, Homologous-Recombination Genes, and Gastric Cancer. N Engl J Med 388 (13): 1181-1190, 2023. [PUBMED Abstract]
- Tsugane S, Sasazuki S: Diet and the risk of gastric cancer: review of epidemiological evidence. Gastric Cancer 10 (2): 75-83, 2007. [PUBMED Abstract]
- Liu SJ, Huang PD, Xu JM, et al.: Diet and gastric cancer risk: an umbrella review of systematic reviews and meta-analyses of prospective cohort studies. J Cancer Res Clin Oncol 148 (8): 1855-1868, 2022. [PUBMED Abstract]
- Song Y, Liu X, Cheng W, et al.: The global, regional and national burden of stomach cancer and its attributable risk factors from 1990 to 2019. Sci Rep 12 (1): 11542, 2022. [PUBMED Abstract]
- Shimizu H, Mack TM, Ross RK, et al.: Cancer of the gastrointestinal tract among Japanese and white immigrants in Los Angeles County. J Natl Cancer Inst 78 (2): 223-8, 1987. [PUBMED Abstract]
- Mousavi SM, Brandt A, Weires M, et al.: Cancer incidence among Iranian immigrants in Sweden and Iranian residents compared to the native Swedish population. Eur J Cancer 46 (3): 599-605, 2010. [PUBMED Abstract]
- Lee J, Demissie K, Lu SE, et al.: Cancer incidence among Korean-American immigrants in the United States and native Koreans in South Korea. Cancer Control 14 (1): 78-85, 2007. [PUBMED Abstract]
- Bouras E, Tsilidis KK, Triggi M, et al.: Diet and Risk of Gastric Cancer: An Umbrella Review. Nutrients 14 (9): , 2022. [PUBMED Abstract]
- Poly TN, Lin MC, Syed-Abdul S, et al.: Proton Pump Inhibitor Use and Risk of Gastric Cancer: Current Evidence from Epidemiological Studies and Critical Appraisal. Cancers (Basel) 14 (13): , 2022. [PUBMED Abstract]
- Shah SC, McKinley M, Gupta S, et al.: Population-Based Analysis of Differences in Gastric Cancer Incidence Among Races and Ethnicities in Individuals Age 50 Years and Older. Gastroenterology 159 (5): 1705-1714.e2, 2020. [PUBMED Abstract]
- Anderson WF, Rabkin CS, Turner N, et al.: The Changing Face of Noncardia Gastric Cancer Incidence Among US Non-Hispanic Whites. J Natl Cancer Inst 110 (6): 608-615, 2018. [PUBMED Abstract]
- Islami F, DeSantis CE, Jemal A: Incidence Trends of Esophageal and Gastric Cancer Subtypes by Race, Ethnicity, and Age in the United States, 1997-2014. Clin Gastroenterol Hepatol 17 (3): 429-439, 2019. [PUBMED Abstract]
- Holowatyj AN, Ulrich CM, Lewis MA: Racial/Ethnic Patterns of Young-Onset Noncardia Gastric Cancer. Cancer Prev Res (Phila) 12 (11): 771-780, 2019. [PUBMED Abstract]
- De B, Rhome R, Jairam V, et al.: Gastric adenocarcinoma in young adult patients: patterns of care and survival in the United States. Gastric Cancer 21 (6): 889-899, 2018. [PUBMED Abstract]
- Gupta S, Tao L, Murphy JD, et al.: Race/Ethnicity-, Socioeconomic Status-, and Anatomic Subsite-Specific Risks for Gastric Cancer. Gastroenterology 156 (1): 59-62.e4, 2019. [PUBMED Abstract]
- Hemminki K, Sundquist J, Ji J: Familial risk for gastric carcinoma: an updated study from Sweden. Br J Cancer 96 (8): 1272-7, 2007. [PUBMED Abstract]
- Yaghoobi M, Bijarchi R, Narod SA: Family history and the risk of gastric cancer. Br J Cancer 102 (2): 237-42, 2010. [PUBMED Abstract]
- Lissowska J, Groves FD, Sobin LH, et al.: Family history and risk of stomach cancer in Warsaw, Poland. Eur J Cancer Prev 8 (3): 223-7, 1999. [PUBMED Abstract]
- Palli D, Russo A, Ottini L, et al.: Red meat, family history, and increased risk of gastric cancer with microsatellite instability. Cancer Res 61 (14): 5415-9, 2001. [PUBMED Abstract]
- Dhillon PK, Farrow DC, Vaughan TL, et al.: Family history of cancer and risk of esophageal and gastric cancers in the United States. Int J Cancer 93 (1): 148-52, 2001. [PUBMED Abstract]
- Minami Y, Tateno H: Associations between cigarette smoking and the risk of four leading cancers in Miyagi Prefecture, Japan: a multi-site case-control study. Cancer Sci 94 (6): 540-7, 2003. [PUBMED Abstract]
- Eto K, Ohyama S, Yamaguchi T, et al.: Familial clustering in subgroups of gastric cancer stratified by histology, age group and location. Eur J Surg Oncol 32 (7): 743-8, 2006. [PUBMED Abstract]
- Chen MJ, Wu DC, Ko YC, et al.: Personal history and family history as a predictor of gastric cardiac adenocarcinoma risk: a case-control study in Taiwan. Am J Gastroenterol 99 (7): 1250-7, 2004. [PUBMED Abstract]
- Yatsuya H, Toyoshima H, Tamakoshi A, et al.: Individual and joint impact of family history and Helicobacter pylori infection on the risk of stomach cancer: a nested case-control study. Br J Cancer 91 (5): 929-34, 2004. [PUBMED Abstract]
- Lichtenstein P, Holm NV, Verkasalo PK, et al.: Environmental and heritable factors in the causation of cancer--analyses of cohorts of twins from Sweden, Denmark, and Finland. N Engl J Med 343 (2): 78-85, 2000. [PUBMED Abstract]
- JONES EG: FAMILIAL GASTRIC CANCER. N Z Med J 63: 287-96, 1964. [PUBMED Abstract]
- Guilford P, Hopkins J, Harraway J, et al.: E-cadherin germline mutations in familial gastric cancer. Nature 392 (6674): 402-5, 1998. [PUBMED Abstract]
- Guilford PJ, Hopkins JB, Grady WM, et al.: E-cadherin germline mutations define an inherited cancer syndrome dominated by diffuse gastric cancer. Hum Mutat 14 (3): 249-55, 1999. [PUBMED Abstract]
- Corso G, Marrelli D, Pascale V, et al.: Frequency of CDH1 germline mutations in gastric carcinoma coming from high- and low-risk areas: metanalysis and systematic review of the literature. BMC Cancer 12: 8, 2012. [PUBMED Abstract]
- Brooks-Wilson AR, Kaurah P, Suriano G, et al.: Germline E-cadherin mutations in hereditary diffuse gastric cancer: assessment of 42 new families and review of genetic screening criteria. J Med Genet 41 (7): 508-17, 2004. [PUBMED Abstract]
- Carmack SW, Genta RM, Schuler CM, et al.: The current spectrum of gastric polyps: a 1-year national study of over 120,000 patients. Am J Gastroenterol 104 (6): 1524-32, 2009. [PUBMED Abstract]
- Gullo I, Grillo F, Mastracci L, et al.: Precancerous lesions of the stomach, gastric cancer and hereditary gastric cancer syndromes. Pathologica 112 (3): 166-185, 2020. [PUBMED Abstract]
- Mankaney G, Leone P, Cruise M, et al.: Gastric cancer in FAP: a concerning rise in incidence. Fam Cancer 16 (3): 371-376, 2017. [PUBMED Abstract]
- Martin FC, Chenevix-Trench G, Yeomans ND: Systematic review with meta-analysis: fundic gland polyps and proton pump inhibitors. Aliment Pharmacol Ther 44 (9): 915-925, 2016. [PUBMED Abstract]
- Jain R, Chetty R: Gastric hyperplastic polyps: a review. Dig Dis Sci 54 (9): 1839-46, 2009. [PUBMED Abstract]
- Stolte M, Sticht T, Eidt S, et al.: Frequency, location, and age and sex distribution of various types of gastric polyp. Endoscopy 26 (8): 659-65, 1994. [PUBMED Abstract]
- Abraham SC, Park SJ, Lee JH, et al.: Genetic alterations in gastric adenomas of intestinal and foveolar phenotypes. Mod Pathol 16 (8): 786-95, 2003. [PUBMED Abstract]
- Chen ZM, Scudiere JR, Abraham SC, et al.: Pyloric gland adenoma: an entity distinct from gastric foveolar type adenoma. Am J Surg Pathol 33 (2): 186-93, 2009. [PUBMED Abstract]
- Altayar O, Davitkov P, Shah SC, et al.: AGA Technical Review on Gastric Intestinal Metaplasia-Epidemiology and Risk Factors. Gastroenterology 158 (3): 732-744.e16, 2020. [PUBMED Abstract]
- Correa P: Human gastric carcinogenesis: a multistep and multifactorial process--First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res 52 (24): 6735-40, 1992. [PUBMED Abstract]
- Neumann WL, Coss E, Rugge M, et al.: Autoimmune atrophic gastritis--pathogenesis, pathology and management. Nat Rev Gastroenterol Hepatol 10 (9): 529-41, 2013. [PUBMED Abstract]
- Dinis-Ribeiro M, Kuipers EJ: How to Manage a Patient With Gastric Intestinal Metaplasia: An International Perspective. Gastroenterology 158 (6): 1534-1537, 2020. [PUBMED Abstract]
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Colorectal. Version 1.2023. Plymouth Meeting, PA: National Comprehensive Cancer Network, 2023. Available with free registration. Last accessed June 28, 2023.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 3.2023. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2023. Available online with free registration. Last accessed October 17, 2024.
- Blair VR, McLeod M, Carneiro F, et al.: Hereditary diffuse gastric cancer: updated clinical practice guidelines. Lancet Oncol 21 (8): e386-e397, 2020. [PUBMED Abstract]
Evaluación genética en personas con antecedentes personales o familiares de cáncer gástrico
Los síndromes de cáncer gástrico hereditarios causan entre el 15 % y el 20 % de los casos de cáncer gástrico.[1-3] Cuando se sospecha que una persona tiene un síndrome de cáncer gástrico hereditario, se recomienda que los proveedores de atención médica obtengan una historia familiar detallada de tres generaciones y realicen pruebas genéticas, si es apropiado. La recopilación de los antecedentes personales y familiares detallados es esencial para la evaluación del riesgo de cáncer gástrico.
Es importante tener en cuenta los siguientes elementos cuando se recopila la historia familiar de un paciente:
- Número de familiares con cáncer en el mismo lado de la familia.
- Tipos de cáncer de los familiares (incluso el subtipo histológico de cada cáncer).a
- Edad de diagnóstico en cada caso.
- Antecedentes de pólipos digestivos o gastrointestinales en los familiares (incluso el subtipo histológico de cada pólipo).
- Número de familiares con labio o paladar hendido (se ha establecido un vínculo entre estas fisuras y el cáncer gástrico hereditario relacionado con el gen CDH1).[4]
a[Nota: Se recomienda que el análisis de la historia familiar se centre en el cáncer gástrico y en otros tipos de cáncer (como el cáncer de mama lobulillar) que se sabe tienen un posible vínculo con el cáncer gástrico difuso hereditario (HDGC).]
Para obtener más información sobre la recopilación de la historia familiar, consultar la sección Registro de la historia familiar en Evaluación del riesgo de cáncer y asesoramiento genético.
En entornos clínicos atareados, o con mucho volumen de pacientes, quizás no sea posible obtener una historia familiar completa.[5] En algunos estudios se ha encontrado que las personas a menudo tienen información incompleta o inexacta sobre los casos de cáncer en sus familiares.[6-9] Además, los pacientes a menudo notifican más casos o menos casos del número real de familiares que han tenido cáncer gástrico.
La notificación inexacta de los antecedentes familiares de cáncer gástrico puede verse afectada por varios factores. En medicina, el estómago tiene una definición y una ubicación anatómica específicas, mientras que la definición pública del estómago es más ambigua, lo que podría llevar a notificaciones inexactas.[7] Hay múltiples órganos dentro de la cavidad abdominal que los pacientes confunden con el estómago. En algunos estudios se ha demostrado que muchos pacientes no saben dónde se encuentran los órganos del cuerpo.[10]
Se debe considerar la escasa validez de la autonoficación de los antecedentes familiares de cáncer gástrico durante la evaluación genética del paciente y al formular las recomendaciones de tratamiento clínico de una persona. En algunos estudios se ha evaluado la exactitud de la autonotificación de antecedentes familiares mediante la comparación de la información recopilada con fuentes de confirmación, como certificados de defunción, registros de cáncer e informes histopatológicos.[6-9,11] En un estudio retrospectivo del Reino Unido, se compararon 595 notas clínicas con fuentes de confirmación y se encontró un aumento del error cuando los pacientes notificaron neoplasias malignas localizadas en la cavidad abdominal.[7] En una revisión sistemática, se encontró que solo del 22 % al 67 % de los diagnósticos de cáncer gástrico notificados se verificaron mediante fuentes de confirmación.[11] Para obtener más información, consultar la sección Exactitud de la historia familiar en Evaluación del riesgo de cáncer y asesoramiento genético.
La obtención de documentación patológica de los antecedentes personales o familiares de cáncer y pólipos también es esencial cuando se evalúa el riesgo de cáncer gástrico hereditario del paciente. Esta documentación es especialmente importante porque los criterios para las pruebas genéticas han cambiado a lo largo de los años y, a su vez, se han ampliado los criterios clínicos.[12] Es importante obtener informes patológicos de los pacientes para confirmar los subtipos histológicos de cáncer cuando sea posible. El carcinoma de células en anillo de sello, el cáncer gástrico difuso y los subtipos patológicos de carcinoma pobremente diferenciados son característicos de los síndromes de cáncer gástrico hereditario, en particular, del HDGC relacionado con el gen CDH1. Estos tipos histológicos suelen relacionarse con la linitis plástica (es decir, un estómago no distensible por infiltración difusa). Varios pólipos digestivos y gastrointestinales (por ejemplo, adenomas tubulares y hamartomas) se relacionan con otros síndromes de cáncer hereditario como el síndrome de Peutz-Jeghers, el síndrome de poliposis juvenil (PJ), la poliposis adenomatosa familiar (PAF), el adenocarcinoma gástrico y la poliposis proximal del estómago (GAPPS).[13] Los pólipos de las glándulas fúndicas son uno de los hallazgos más comunes en las endoscopias superiores de rutina. Si bien estos pólipos de las glándulas fúndicas son un hallazgo característico en personas con PAF, también son frecuentes en personas de la población general que toman inhibidores de la bomba de protones. Por lo tanto, los pólipos de las glándulas fúndicas por lo general no son indicativos de un síndrome de cáncer hereditario subyacente. Para obtener más información sobre la clasificación celular del cáncer gástrico, consultar Tratamiento del cáncer de estómago.
El diagnóstico de cáncer antes de los 50 años es una característica distintiva de los síndromes de cáncer hereditarios. También existen formas atenuadas de los síndromes de cáncer hereditario que se reconocen cada vez más. En estos síndromes atenuados, la edad de inicio del cáncer gástrico a veces es posterior a los 50 años.[14]
Enfoque para las pruebas genéticas
El cáncer gástrico por lo general se identifica en un estadio avanzado.[15] Esto es importante a la hora de considerar el enfoque para las pruebas genéticas. Estas pruebas son urgentes para los pacientes con cáncer gástrico avanzado y el proceso debe incluir el consentimiento informado, la recolección de muestras y la explicación de los resultados de las pruebas genéticas.[16] Sin embargo, el momento oportuno para las pruebas genéticas deberá equilibrarse con las prioridades de tratamiento y el estado funcional del paciente. Para obtener más información, consultar la sección La importancia de iniciar las pruebas en un familiar afectado en Evaluación del riesgo de cáncer y asesoramiento genético.
Hay criterios específicos para las pruebas genéticas de la línea germinal en los siguientes genes relacionados con el cáncer gástrico o los pólipos gástricos: CDH1, CTNNA1, APC, STK11, SMAD4, y los genes del síndrome de Lynch (MLH1, MSH2, MSH6 y EPCAM).[12] Una opción es obtener primero pruebas del gen o los genes para los que se cumplen los criterios clínicos de un síndrome de cáncer hereditario. Es posible que esto no sea lo ideal cuando hay antecedentes familiares de tipos de cáncer que se pueden relacionar con varios síndromes de cáncer gástrico hereditario. En este caso la evaluación podría prolongarse y ser muy costosa, puesto que cada gen sospechoso se analizaría de forma secuencial después de obtener resultados no informativos. Cuando los tipos de cáncer de la historia familiar se superponen con múltiples síndromes de cáncer gástrico hereditario, los proveedores pueden analizar primero los genes que se encuentran al principio en la lista de diagnósticos diferenciales. Si no se identifican variantes patogénicas en estas pruebas iniciales, entonces los proveedores podrían recurrir de manera automática a un análisis multigénico de cáncer gástrico hereditario más grande. Si se prefiere el método de la prueba genética de un solo gen, es posible que antes de comenzar las pruebas los proveedores necesiten identificar un laboratorio que ofrezca la opción de recurrir de manera automática al análisis de otros genes (ante resultados no informativos).
Cuando en la historia familiar del paciente hay múltiples tipos de cáncer que se solapan con más de un síndrome de cáncer hereditario, otra opción es ordenar un panel multigénico que incluya todos los genes sospechosos. Esta opción suele ser la más comúnmente utilizada en las clínicas de cáncer hereditario. En un panel multigénico se analizan de manera simultánea muchos genes para detectar variantes patogénicas y probablemente patogénicas, a menudo con costos comparables a las pruebas genéticas de un solo gen. Los paneles multigénicos para el cáncer hereditario incluyen aquellos específicos por sitio de cáncer, genes de riesgo alto o moderado, basadas en guías y los llamados paneles "pancáncer", es decir para múltiples tipos de cáncer.[17] Debido a las numerosas opciones de pruebas de panel, los profesionales de la salud deben prestar especial atención a la elección de la prueba más apropiada según el diagnóstico diferencial de cada paciente. Por ejemplo, se recomienda la prueba genética para las variantes patogénicas en los genes CDH1 y CTNNA1 cuando se cumplen los criterios para el HDGC. Además, se debe incluir el análisis del promotor 1B en el gen APC cuando se realizan pruebas para GAPPS.
Para obtener más información sobre la selección de la prueba genética adecuada, consultar la sección Determinación de la prueba a utilizar en Evaluación del riesgo de cáncer y asesoramiento genético.
Repercusiones de los paneles multigénicos
En esta sección se resumen las consecuencias para los pacientes sometidos a paneles multigénicos de síndromes de cáncer gástrico hereditario. Para obtener más información sobre los paneles multigénicos, incluso aspectos como la educación genética, las consideraciones del asesoramiento y la investigación, consultar la sección Análisis multigénicos en Evaluación del riesgo de cáncer y asesoramiento genético.
El uso de paneles multigénicos conlleva desafíos, como el descubrimiento inesperado de variantes patogénicas en genes que no se habrían considerado según los antecedentes personales o familiares del paciente. Las variantes patogénicas en muchos genes de cáncer hereditario aumentan el riesgo de presentar más de un tipo de cáncer. Por ejemplo, las variantes patogénicas en el gen CDH1 se relacionan con un aumento del riesgo de cáncer gástrico difuso y cáncer de mama lobulillar.[14,18,19] Los dilemas del control del riesgo de cáncer gástrico surgen cuando las personas con antecedentes personales o familiares de cáncer de mama encuentran, de manera inesperada, una variante patogénica en el gen CDH1 en los paneles multigénicos. El resultado de esta prueba puede complicar la toma de decisiones médicas, ya que estas personas no suelen participar en una detección sistemática intensificada del cáncer gástrico únicamente por sus antecedentes personales o familiares. Además, no hay recomendaciones eficaces para la detección sistemática del cáncer gástrico en portadores de una alteración en el gen CDH1. Por lo tanto, todas las personas que tienen una variante patogénica en el gen CDH1 reciben asesoramiento sobre la opción de someterse a una gastrectomía total preventiva, una cirugía con tasas de complicaciones posoperatorias de hasta el 10 % y una probabilidad alta de secuelas crónicas.[12,20] El descubrimiento inesperado de una variante del gen CDH1 en los paneles multigénicos en ausencia de antecedentes familiares de cáncer gástrico es una situación difícil que se encuentra cada vez más en la práctica clínica.[21,22] Se recomienda el asesoramiento genético previo a la prueba cuando los pacientes se someten a paneles multigénicos. Este asesoramiento genético puede incluir un análisis sobre posibles hallazgos inesperados de las pruebas genéticas y las implicaciones de la identificación de variantes patogénicas en genes que no se entienden bien, incluso una revisión de las limitaciones de las recomendaciones para el control del riesgo de cáncer.[22,23]
Pruebas genéticas en cascada
Las pruebas genéticas en cascada permiten identificar a familiares que están en riesgo de una afección genética siguiendo el camino lógico de una variante patogénica dentro de una familia. Las pruebas genéticas en cascada se ofrecen de forma rutinaria a familiares en riesgo una vez que se identifica una variante patogénica. Para obtener más información, consultar la sección Pruebas genéticas en cascada en los miembros de una familia en Evaluación del riesgo de cáncer y asesoramiento genético. En algunos casos, el paciente ya tendrá cáncer gástrico avanzado cuando se identifica la variante patogénica en el gen CDH1. Muchos pacientes no presentan síntomas de cáncer gástrico hasta que el cáncer ha progresado a estadios avanzados. El cáncer gástrico a menudo es incurable y solo el 31 % de los pacientes con este diagnóstico sobreviven 5 años o más.[15] Es posible que los pacientes con cáncer gástrico estén en un proceso de deterioro cuando reciben los resultados de la prueba genética y que no puedan comunicar estos resultado a sus familiares. Es ideal, que los probandos y los profesionales clínicos trabajen juntos para identificar a familiares en riesgo que pueden incluirse en las pruebas en cascada.[24] Debido a que no se hace detección sistemática del cáncer gástrico en la población general, las pruebas genéticas en cascada son fundamentales para identificar a las personas asintomáticas de riesgo alto que pueden beneficiarse de las recomendaciones personalizadas sobre la detección temprana y el tratamiento del cáncer gástrico.
Bibliografía
- Uson PLS, Kunze KL, Golafshar MA, et al.: Germline Cancer Testing in Unselected Patients with Gastric and Esophageal Cancers: A Multi-center Prospective Study. Dig Dis Sci 67 (11): 5107-5115, 2022. [PUBMED Abstract]
- Ku GY, Kemel Y, Maron SB, et al.: Prevalence of Germline Alterations on Targeted Tumor-Normal Sequencing of Esophagogastric Cancer. JAMA Netw Open 4 (7): e2114753, 2021. [PUBMED Abstract]
- Oliveira C, Pinheiro H, Figueiredo J, et al.: Familial gastric cancer: genetic susceptibility, pathology, and implications for management. Lancet Oncol 16 (2): e60-70, 2015. [PUBMED Abstract]
- Frebourg T, Oliveira C, Hochain P, et al.: Cleft lip/palate and CDH1/E-cadherin mutations in families with hereditary diffuse gastric cancer. J Med Genet 43 (2): 138-42, 2006. [PUBMED Abstract]
- Qureshi N, Wilson B, Santaguida P, et al.: Collection and use of cancer family history in primary care. Evid Rep Technol Assess (Full Rep) (159): 1-84, 2007. [PUBMED Abstract]
- Mitchell RJ, Brewster D, Campbell H, et al.: Accuracy of reporting of family history of colorectal cancer. Gut 53 (2): 291-5, 2004. [PUBMED Abstract]
- Douglas FS, O'Dair LC, Robinson M, et al.: The accuracy of diagnoses as reported in families with cancer: a retrospective study. J Med Genet 36 (4): 309-12, 1999. [PUBMED Abstract]
- Ozanne EM, O'Connell A, Bouzan C, et al.: Bias in the reporting of family history: implications for clinical care. J Genet Couns 21 (4): 547-56, 2012. [PUBMED Abstract]
- Mai PL, Garceau AO, Graubard BI, et al.: Confirmation of family cancer history reported in a population-based survey. J Natl Cancer Inst 103 (10): 788-97, 2011. [PUBMED Abstract]
- Rashid A, Jagger C: Patients' knowledge of anatomical location of major organs within the human body: a comparison between Asians and non-Asians. Fam Pract 13 (5): 450-4, 1996. [PUBMED Abstract]
- Fiederling J, Shams AZ, Haug U: Validity of self-reported family history of cancer: A systematic literature review on selected cancers. Int J Cancer 139 (7): 1449-60, 2016. [PUBMED Abstract]
- Blair VR, McLeod M, Carneiro F, et al.: Hereditary diffuse gastric cancer: updated clinical practice guidelines. Lancet Oncol 21 (8): e386-e397, 2020. [PUBMED Abstract]
- Colvin H, Yamamoto K, Wada N, et al.: Hereditary Gastric Cancer Syndromes. Surg Oncol Clin N Am 24 (4): 765-77, 2015. [PUBMED Abstract]
- Xicola RM, Li S, Rodriguez N, et al.: Clinical features and cancer risk in families with pathogenic CDH1 variants irrespective of clinical criteria. J Med Genet 56 (12): 838-843, 2019. [PUBMED Abstract]
- National Cancer Institute: SEER Cancer Stat Facts: Stomach Cancer. Bethesda, Md: National Cancer Institute. Available online. Last accessed February 21, 2025.
- Hampel H, Bennett RL, Buchanan A, et al.: A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors: referral indications for cancer predisposition assessment. Genet Med 17 (1): 70-87, 2015. [PUBMED Abstract]
- Domchek SM, Bradbury A, Garber JE, et al.: Multiplex genetic testing for cancer susceptibility: out on the high wire without a net? J Clin Oncol 31 (10): 1267-70, 2013. [PUBMED Abstract]
- Pharoah PD, Guilford P, Caldas C, et al.: Incidence of gastric cancer and breast cancer in CDH1 (E-cadherin) mutation carriers from hereditary diffuse gastric cancer families. Gastroenterology 121 (6): 1348-53, 2001. [PUBMED Abstract]
- Corso G, Intra M, Trentin C, et al.: CDH1 germline mutations and hereditary lobular breast cancer. Fam Cancer 15 (2): 215-9, 2016. [PUBMED Abstract]
- van der Kaaij RT, van Kessel JP, van Dieren JM, et al.: Outcomes after prophylactic gastrectomy for hereditary diffuse gastric cancer. Br J Surg 105 (2): e176-e182, 2018. [PUBMED Abstract]
- Lowstuter K, Espenschied CR, Sturgeon D, et al.: Unexpected CDH1 Mutations Identified on Multigene Panels Pose Clinical Management Challenges. JCO Precis Oncol 1: 1-12, 2017. [PUBMED Abstract]
- Katona BW, Clark DF, Domchek SM: CDH1 on Multigene Panel Testing: Look Before You Leap. J Natl Cancer Inst 112 (4): 330-334, 2020. [PUBMED Abstract]
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 3.2023. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2023. Available online with free registration. Last accessed October 17, 2024.
- Hampel H: Genetic counseling and cascade genetic testing in Lynch syndrome. Fam Cancer 15 (3): 423-7, 2016. [PUBMED Abstract]
Genes principales y síndromes genéticos relacionados con el cáncer gástrico
En el Cuadro 1 se enumeran los principales síndromes hereditarios relacionados con un aumento del riesgo de cáncer gástrico junto con los genes de susceptibilidad correspondientes. Para obtener más información en inglés sobre los cánceres gástricos hereditarios relacionados con los genes CDH1 y CTNNA1, consultar Cáncer gástrico difuso hereditario. En todo este resumen se describe el riesgo de cáncer gástrico de los otros síndromes mencionados en el cuadro y también se proporcionan enlaces a otros resúmenes del PDQ con información adicional.
| Síndromea | Gen | Riesgo de cáncer gástrico | Tipo anatomopatológico de cáncer gástrico | Vigilancia del cáncer gástrico | Otras características |
|---|---|---|---|---|---|
| SNC = sistema nervioso central; CCR = cáncer colorrectal; EGD = esofagogastroduodenoscopia; GIST = tumor de estroma gastrointestinal. | |||||
| aTodas las afecciones se heredan de manera autosómica dominante, a menos que se especifique lo contrario. | |||||
| bLas lesiones de riesgo alto incluyen adenomas tubulares, pólipos con displasia de grado alto y adenomas de glándulas pilóricas. | |||||
| cNo se recomienda la gastrectomía total profiláctica antes de los 40 años de edad. Sin embargo, se puede considerar en ciertos pacientes, en especial aquellos con antecedentes familiares de cáncer gástrico antes de los 25 años. | |||||
| Cáncer gástrico difuso hereditario | CDH1 y CTNNA1 | 33–83 % [1-5] | Carcinoma de células de anillo de sello de tipo difuso | EGD con múltiples biopsias aleatorias de estómago cada 6–12 meses o gastrectomía total preventiva entre los 18–40 años de edadc [6] | Solo para el gen CDH1: Cáncer de mama lobulillar, labio o paladar hendido. En la actualidad, se desconoce si el gen CTNNA1 se relaciona con el cáncer de mama lobulillar, o con el labio o paladar hendido |
| Síndrome de poliposis adenomatosa familiar (en inglés) (PAF) | APC | 1,3–5 % en PAF y PAFA.[7,8] | Tipo intestinal | La EGD para la vigilancia duodenal también es adecuada para la vigilancia del cáncer gástrico. Es posible considerar una gastrectomía en pacientes con lesiones de riesgo alto que no se pueden tratar por vía endoscópicab [9] | Pólipos gástricos (pólipos y adenomas de glándulas fúndicas), CCR, pólipos colorrectales (adenomas), tumores desmoides, tumores y cánceres de duodeno, cáncer de tiroides, cáncer de encéfalo, cáncer de ampolla, cáncer de páncreas y hepatoblastoma |
| Poliposis adenomatosa familiar atenuada (en inglés) (PAFA) | APC | ||||
| Adenocarcinoma gástrico y poliposis proximal del estómago (en inglés) (GAPPS) | APC (variantes patogénicas o variantes de un solo nucleótido en la región promotora 1B del gen APC que se relacionan con GAPPS-7) | En GAPPS, el riesgo de cáncer gástrico aumenta significativamente, pero se desconoce la magnitud exacta [10] | |||
| Síndrome de Lynch (en inglés) (también conocido como cáncer colorrectal hereditario no polipósico [HNPCC]) | MLH1, MSH2, MSH6, PMS2, EPCAM | 0,2–9 % | Tipo intestinal | Vigilancia del tubo digestivo superior con EGD (preferiblemente junto con colonoscopia) a partir de los 30–40 años (o antes según la historia familiar del paciente). Repetir la EGD cada 2–4 años [9] | CCR, cáncer de endometrio, cáncer de ovario, cáncer de mama, cáncer de páncreas, cáncer de vejiga, cáncer de vías biliares, cáncer urotelial, cáncer de intestino delgado, cáncer de próstata y tumor de encéfalo o del SNC |
| Síndrome de Peutz-Jeghers (en inglés) | STK11 (también conocido como LKB1) | 29 % [9] | Tipo intestinal (que surge de displasia en los hamartomas) | EGD cada 2–3 años comenzando al final de la adolescencia [9] | Pólipos gastrointestinales hamartomatosos; cáncer de mama; CCR; cáncer de intestino delgado; cáncer de páncreas; tumores de células de Sertoli de ovario y testículo; adenoma maligno de cuello uterino; cáncer de endometrio; cáncer de pulmón; hiperpigmentación mucocutánea de la boca, los labios, la nariz, los ojos, los genitales o los dedos |
| Síndrome de poliposis juvenil (en inglés) | SMAD4, BMPR1A | 21 % si hay varios pólipos | Tipo intestinal (que surge de displasia en pólipos juveniles o hamartomas) | EGD cada 2–3 años. Si se encuentran pólipos, EGD a intervalos más cortos según el tamaño, el número y el tipo anatomopatológico del pólipo [9] | Pólipos colorrectales juveniles o hamartomatosos, CCR, telangiectasia hemorrágica hereditaria |
| Síndrome de Li-Fraumeni (en inglés) | TP53 | 2,8 % | Posiblemente de tipo intestinal | Cáncer de mama, carcinoma de corteza suprarrenal, sarcoma, tumor de encéfalo o SNC, leucemia | |
Bibliografía
- Roberts ME, Ranola JMO, Marshall ML, et al.: Comparison of CDH1 Penetrance Estimates in Clinically Ascertained Families vs Families Ascertained for Multiple Gastric Cancers. JAMA Oncol 5 (9): 1325-1331, 2019. [PUBMED Abstract]
- Pharoah PD, Guilford P, Caldas C, et al.: Incidence of gastric cancer and breast cancer in CDH1 (E-cadherin) mutation carriers from hereditary diffuse gastric cancer families. Gastroenterology 121 (6): 1348-53, 2001. [PUBMED Abstract]
- Hansford S, Kaurah P, Li-Chang H, et al.: Hereditary Diffuse Gastric Cancer Syndrome: CDH1 Mutations and Beyond. JAMA Oncol 1 (1): 23-32, 2015. [PUBMED Abstract]
- Kaurah P, MacMillan A, Boyd N, et al.: Founder and recurrent CDH1 mutations in families with hereditary diffuse gastric cancer. JAMA 297 (21): 2360-72, 2007. [PUBMED Abstract]
- Xicola RM, Li S, Rodriguez N, et al.: Clinical features and cancer risk in families with pathogenic CDH1 variants irrespective of clinical criteria. J Med Genet 56 (12): 838-843, 2019. [PUBMED Abstract]
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Gastric Cancer. Version 1.2023. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2023. Available online with free registration. Last accessed October 17, 2024.
- Cannon AR, Keener M, Neklason D, et al.: Surgical Interventions, Malignancies, and Causes of Death in a FAP Patient Registry. J Gastrointest Surg 25 (2): 452-456, 2021. [PUBMED Abstract]
- Mankaney G, Leone P, Cruise M, et al.: Gastric cancer in FAP: a concerning rise in incidence. Fam Cancer 16 (3): 371-376, 2017. [PUBMED Abstract]
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Colorectal. Version 1.2023. Plymouth Meeting, PA: National Comprehensive Cancer Network, 2023. Available with free registration. Last accessed June 28, 2023.
- Li J, Woods SL, Healey S, et al.: Point Mutations in Exon 1B of APC Reveal Gastric Adenocarcinoma and Proximal Polyposis of the Stomach as a Familial Adenomatous Polyposis Variant. Am J Hum Genet 98 (5): 830-842, 2016. [PUBMED Abstract]
Otros genes relacionados con el cáncer gástrico
Con evidencia preliminar se estableció un vínculo entre el cáncer gástrico y otros genes que, por lo general, no se relacionan con este tipo de cáncer, como ATM, BRCA1, BRCA2, BRIP1, PALB2 y RAD51D. En algunos estudios se indica una posible relación entre el riesgo de cáncer gástrico y las variantes patogénicas, tanto en los genes de cáncer gástrico establecidos, como en los genes de riesgo moderado y alto que no suelen estar relacionados con el cáncer gástrico. Sin embargo, no se indican cambios en la práctica clínica a partir de esta evidencia preliminar.
En múltiples estudios se han buscado los genes candidatos en casos de cáncer gástrico hereditario que no estaban asociados con variantes patogénicas de CDH1. Algunos de estos casos podrían explicarse por la presencia de variantes patogénicas en genes que participan en la reparación del DNA por recombinación homóloga, en especial el gen PALB2:
- En uno de los estudios iniciales para identificar variantes que podrían aumentar el riesgo de cáncer gástrico, se hizo secuenciación del exoma completo (WES) en 28 pacientes y secuenciación de genes candidatos en 333 pacientes.[1] En 11 casos, se identificaron variantes patogénicas en genes que regulan la reparación homóloga, incluso 8 variantes patogénicas de PALB2, 2 variantes patogénicas de BRCA1, y 1 variante patogénica de RAD51C. En la WES de 4 muestras tumorales (de 3 portadores de PALB2 y 1 portador de RAD51C) no se encontró pérdida de la heterocigosidad (LOH). Sin embargo, los tumores (4/4) tenían aumento de una firma mutacional que es característica de los defectos de la reparación homóloga, lo que indica un vínculo causal entre estos genes y el riesgo de cáncer gástrico.
- En otro estudio de 28 pacientes con resultados negativos para CDH1 y diagnóstico clínico de cáncer gástrico difuso hereditario se usó WES.[2] Se encontró una variante de perdida de función de PALB2 en 1 paciente con antecedentes de cáncer gástrico y cáncer de mama. También se encontraron dos variantes patogénicas en el gen MSH2 (gen de reparación de errores de emparejamiento), y dos variantes en el gen RECQL5 (gen de reparación del DNA).
- En una gran investigación de variantes de predisposición al cáncer, 5 de 443 pacientes con cáncer gástrico portaban las variantes de pérdida de función de PALB2 con LOH variable (2 de 5 tumores), lo que se ha observado en otros tumores asociados a PALB2.[3]
- No obstante, en un estudio de 58 pacientes que cumplieron con los criterios de inclusión de cáncer gástrico difuso hereditario, pero cuyos resultados dieron negativo para variantes patogénicas de CDH1, se notificaron resultados contradictorios.[4] Contrario a estudios similares, en la secuenciación de PALB2 no se descubrieron variantes patogénicas en estos pacientes.
En resumen, estos hallazgos indican que los defectos en los genes de reparación homóloga aumentan el riesgo de cáncer gástrico y resaltan la función del gen de predisposición al cáncer PALB2 como posible gen candidato para el cáncer gástrico hereditario. No obstante, se necesitan estudios de casos y controles para confirmar si el gen PALB2 se asocia con la susceptibilidad al cáncer gástrico hereditario. La detección sistemática del cáncer gástrico no está indicada en portadores de PALB2.
A continuación, se describen otros estudios donde se investigan posibles genes candidatos del cáncer gástrico:
- Se estudió un grupo de 51 adultos con cáncer gástrico (de cualquier tipo histológico) que formaban parte de una red internacional de investigación sobre cáncer hereditario. Estas personas se seleccionaron de forma retrospectiva para someterse a pruebas genéticas de la línea germinal con un panel de 706 genes candidatos.[5] Se identificaron 20 variantes patogénicas o probablemente patogénicas en 18 participantes (35 %). Algunas de estas variantes patogénicas se encontraban en genes que tradicionalmente no se relacionaban con el cáncer gástrico, como ATM, BRCA2, BRIP1, FANCC y TP53.
- En otro estudio de 34 pacientes con cáncer gástrico, que no se seleccionaron según sus características clínicas o historia familiar de cáncer, se encontró una tasa del 17,6 % de variantes patogénicas en un panel que examinó entre 83 y 84 genes.[6] Se identificaron dos variantes patogénicas en BRCA1 y una variante patogénica en cada uno de los siguientes genes: BRCA2, CDH1, FH y SDHA.
- En un estudio transversal realizado en un centro oncológico terciario, se evaluó la presencia de variantes patogénicas con un panel de 76 u 88 genes en 243 pacientes con cáncer gástrico que aceptaron someterse a secuenciación somática y germinal emparejada.[7] Se encontraron variantes patogénicas germinales en 48 pacientes con cáncer gástrico (19,8 %). Entre los genes de penetrancia alta y moderada que no se relacionaban clásicamente con el cáncer gástrico, las variantes patogénicas se encontraron con mayor frecuencia en BRCA1, BRCA2 y ATM.
- En uno de los estudios más grandes se incluyeron 282 pacientes con cáncer gástrico de ascendencia china Han.[8] Estos pacientes se inscribieron en centros médicos de Beijing y se sometieron a un panel de 69 genes de cáncer, lo que reveló que el 7,1 % de los pacientes tenían variantes patogénicas. Las variantes patogénicas se encontraron con mayor frecuencia en el gen ATM (tasa de detección, 1,1 % [3/282 pacientes]), seguido de los genes BRCA1, BRIP1 y RAD51D, con una tasa de detección de un 0,7 % (2/282 pacientes).
Se necesitan nuevos estudios para determinar si hay una relación causal entre estos genes y el riesgo de cáncer gástrico. Sin embargo, la tasa de variantes patogénicas encontrada en estos estudios respalda el uso de paneles multigénicos en pacientes con cáncer gástrico sometidos a pruebas genéticas de la línea germinal. Para obtener más información en inglés, consultar la sección Other Cancer Risks en BRCA1 and BRCA2: Cancer Risks and Management.
Bibliografía
- Sahasrabudhe R, Lott P, Bohorquez M, et al.: Germline Mutations in PALB2, BRCA1, and RAD51C, Which Regulate DNA Recombination Repair, in Patients With Gastric Cancer. Gastroenterology 152 (5): 983-986.e6, 2017. [PUBMED Abstract]
- Fewings E, Larionov A, Redman J, et al.: Germline pathogenic variants in PALB2 and other cancer-predisposing genes in families with hereditary diffuse gastric cancer without CDH1 mutation: a whole-exome sequencing study. Lancet Gastroenterol Hepatol 3 (7): 489-498, 2018. [PUBMED Abstract]
- Huang KL, Mashl RJ, Wu Y, et al.: Pathogenic Germline Variants in 10,389 Adult Cancers. Cell 173 (2): 355-370.e14, 2018. [PUBMED Abstract]
- Carreño M, Pena-Couso L, Mercadillo F, et al.: Investigation on the Role of PALB2 Gene in CDH1-Negative Patients With Hereditary Diffuse Gastric Cancer. Clin Transl Gastroenterol 11 (12): e00280, 2020. [PUBMED Abstract]
- Slavin T, Neuhausen SL, Rybak C, et al.: Genetic Gastric Cancer Susceptibility in the International Clinical Cancer Genomics Community Research Network. Cancer Genet 216-217: 111-119, 2017. [PUBMED Abstract]
- Uson PLS, Kunze KL, Golafshar MA, et al.: Germline Cancer Testing in Unselected Patients with Gastric and Esophageal Cancers: A Multi-center Prospective Study. Dig Dis Sci 67 (11): 5107-5115, 2022. [PUBMED Abstract]
- Ku GY, Kemel Y, Maron SB, et al.: Prevalence of Germline Alterations on Targeted Tumor-Normal Sequencing of Esophagogastric Cancer. JAMA Netw Open 4 (7): e2114753, 2021. [PUBMED Abstract]
- Ji K, Ao S, He L, et al.: Characteristics of cancer susceptibility genes mutations in 282 patients with gastric adenocarcinoma. Chin J Cancer Res 32 (4): 508-515, 2020. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (05/16/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2025 (se citó a la American Cancer Society como referencia 3).
El Consejo editorial del PDQ sobre la genética del cáncer es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre la genética del cáncer gástrico. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre la genética del cáncer, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Genética del cáncer gástrico son:
- Grace-Ann O. Fasaye, ScM, CGC (National Cancer Institute)
- Gautam Mankaney, MD (Virginia Mason Franciscan Health)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre la genética del cáncer emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre la genética del cáncer. PDQ Genética del cáncer gástrico. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/estomago/pro/genetica-cancer-gastrico-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
La información en estos resúmenes no se debe utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.