Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido (PDQ®)–Versión para profesionales de salud
Información general sobre el linfoma no Hodgkin de células B
Los linfomas no Hodgkin (LNH o linfomas no hodgkinianos) son un grupo heterogéneo de neoplasias malignas linfoproliferativas con diferentes modelos de comportamiento y respuestas terapéuticas.[1] Este resumen se centra principalmente en el LNH de células B de crecimiento rápido (agresivo o de alto grado de malignidad). Para obtener información sobre los linfomas de células B y células T, consultar Tratamiento del linfoma no Hodgkin de células B de crecimiento lento, Tratamiento del linfoma no Hodgkin periférico de células T y Tratamiento de la micosis fungoide y otros linfomas cutáneos de células T.
Al igual que los linfomas de Hodgkin, los LNH por lo general se originan en los tejidos linfoides y se disemina a otros órganos. Sin embargo, el comportamiento de los LNH es mucho menos predecible que el de los linfomas de Hodgkin y tienen una tendencia mucho más alta a diseminarse por sitios extraganglionares. El pronóstico depende del tipo histológico, el estadio de la enfermedad y el tratamiento.
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por todos los tipos de LNH en los Estados Unidos en 2025:[2]
- Casos nuevos: 80 350.
- Defunciones: 19 390.
Los linfomas de células B representan alrededor del 85 % de los casos de LNH.[3]
Características anatómicas
Los LNH, por lo general, se originan en los tejidos linfoides.
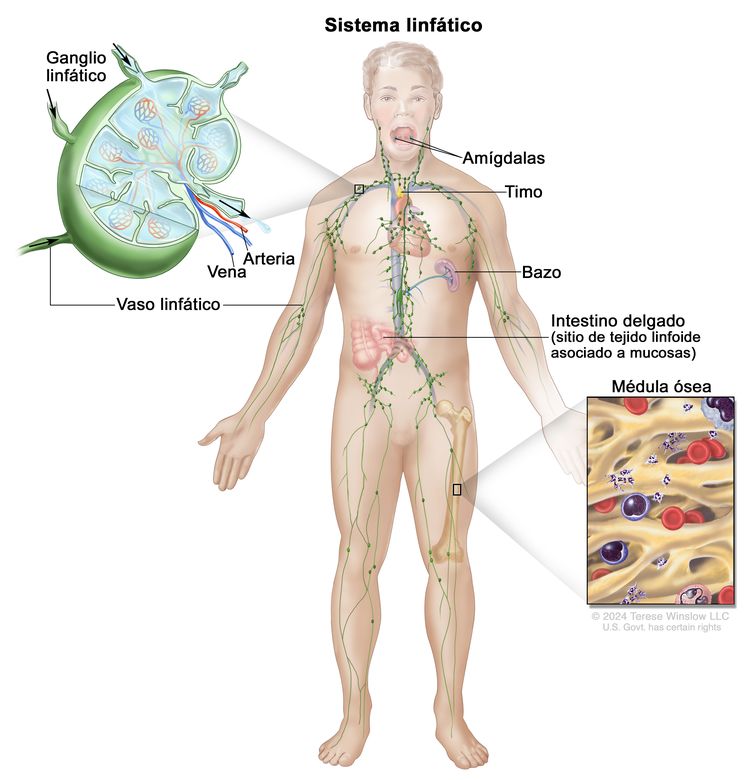
Pronóstico y supervivencia
Los LNH se dividen en dos grupos pronósticos: linfomas de crecimiento lento (indolentes o de bajo grado de malignidad) y linfomas de crecimiento rápido (agresivos o de alto grado de malignidad).
Los LNH de crecimiento lento tienen un pronóstico relativamente bueno, con una mediana de supervivencia de hasta 20 años, pero por lo general no son curables en estadios clínicos avanzados.[4]
Los LNH de crecimiento rápido tienen un pronóstico más precario en el corto plazo, pero un número significativo de los pacientes se cura con regímenes de quimioterapia combinada intensiva. Los pacientes que desde el inicio presentan un LNH de crecimiento rápido o cuya enfermedad se convierte en un linfoma de este tipo, pueden lograr remisiones completas prolongadas con regímenes de quimioterapia combinada o de consolidación intensiva con apoyo de células madre o de médula ósea.[5,6]
La tasa de supervivencia general a 5 años es superior al 60 % en los pacientes con LNH que reciben un tratamiento moderno. Más del 70 % de los pacientes con LNH de crecimiento rápido se pueden curar. La mayoría de las recaídas se presentan en los primeros 2 años posteriores al tratamiento. El riesgo de recaída tardía es más alto en los pacientes que manifiestan ambos tipos histológicos: de crecimiento lento (indolente) y de crecimiento rápido (agresivo).[7]
Efectos tardíos del tratamiento del linfoma no Hodgkin
Se han observado efectos tardíos del tratamiento del linfoma no Hodgkin (LNH). Es posible que se presente una alteración de la fertilidad o la capacidad reproductiva después de la exposición a alquilantes.[8] Hasta tres décadas después del diagnóstico, los pacientes tienen un riesgo significativamente elevado de presentar segundos cánceres primarios, en especial los siguientes:[9-12]
- Cáncer de pulmón.
- Cáncer de encéfalo.
- Cáncer de riñón.
- Cáncer de vejiga.
- Melanoma.
- Linfoma de Hodgkin.
- Leucemia no linfocítica aguda.
La disfunción ventricular izquierda fue un efecto tardío significativo en los sobrevivientes a largo plazo de LNH de grado alto que recibieron más de 200 mg/m² de doxorrubicina.[8,13]
El síndrome mielodisplásico y la leucemia mielógena aguda son complicaciones tardías de la terapia mielosupresora con apoyo de médula ósea autógena o células madre periféricas, así como de la quimioterapia convencional con alquilantes.[10,14-21] La mayoría de estos pacientes presentan hematopoyesis clonal incluso antes del trasplante, lo que indica que la lesión hematológica por lo general se presenta durante la quimioterapia de inducción o reinducción.[16,22,23] Se realizó un seguimiento, durante una mediana de 10 años, de una serie de 605 pacientes que recibieron trasplante de médula ósea (TMO) autógeno con ciclofosfamida y radioterapia corporal total (como acondicionamiento). La incidencia de una segunda neoplasia maligna fue del 21 %, y el 10 % de esas neoplasias malignas fueron tumores sólidos.[24]
En un estudio de mujeres jóvenes que recibieron TMO autógeno, se notificaron embarazos exitosos con bebés que nacieron sin anomalías congénitas.[25] La tromboembolia venosa tardía se puede presentar después de un TMO alogénico o autógeno.[26]
Algunos pacientes presentan osteopenia u osteoporosis al inicio del tratamiento; es posible que la densidad ósea empeore después del tratamiento para el linfoma.[27]
En un estudio retrospectivo de cohortes de 21 690 sobrevivientes de linfoma difuso de células B grandes del California Cancer Registry, se evaluó el deterioro a largo plazo de la salud inmunitaria. Se encontraron cocientes de tasas de incidencia elevadas hasta 10 años después para neumonía (10,8 veces mayor), meningitis (5,3 veces mayor), deficiencia de inmunoglobulinas (17,6 veces mayor) y citopenias autoinmunitarias (12 veces mayor).[28] De manera similar, los pacientes con linfoma que reciben terapias dirigidas a las células B presentan respuestas humorales alteradas a la vacunación contra el virus causal de la COVID-19.[29,30]
Bibliografía
- Shankland KR, Armitage JO, Hancock BW: Non-Hodgkin lymphoma. Lancet 380 (9844): 848-57, 2012. [PUBMED Abstract]
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- American Cancer Society: Types of B-cell Lymphoma. American Cancer Society, 2019. Available online. Last accessed February 7, 2025.
- Tan D, Horning SJ, Hoppe RT, et al.: Improvements in observed and relative survival in follicular grade 1-2 lymphoma during 4 decades: the Stanford University experience. Blood 122 (6): 981-7, 2013. [PUBMED Abstract]
- Bastion Y, Sebban C, Berger F, et al.: Incidence, predictive factors, and outcome of lymphoma transformation in follicular lymphoma patients. J Clin Oncol 15 (4): 1587-94, 1997. [PUBMED Abstract]
- Yuen AR, Kamel OW, Halpern J, et al.: Long-term survival after histologic transformation of low-grade follicular lymphoma. J Clin Oncol 13 (7): 1726-33, 1995. [PUBMED Abstract]
- Cabanillas F, Velasquez WS, Hagemeister FB, et al.: Clinical, biologic, and histologic features of late relapses in diffuse large cell lymphoma. Blood 79 (4): 1024-8, 1992. [PUBMED Abstract]
- Haddy TB, Adde MA, McCalla J, et al.: Late effects in long-term survivors of high-grade non-Hodgkin's lymphomas. J Clin Oncol 16 (6): 2070-9, 1998. [PUBMED Abstract]
- Travis LB, Curtis RE, Glimelius B, et al.: Second cancers among long-term survivors of non-Hodgkin's lymphoma. J Natl Cancer Inst 85 (23): 1932-7, 1993. [PUBMED Abstract]
- Mudie NY, Swerdlow AJ, Higgins CD, et al.: Risk of second malignancy after non-Hodgkin's lymphoma: a British Cohort Study. J Clin Oncol 24 (10): 1568-74, 2006. [PUBMED Abstract]
- Hemminki K, Lenner P, Sundquist J, et al.: Risk of subsequent solid tumors after non-Hodgkin's lymphoma: effect of diagnostic age and time since diagnosis. J Clin Oncol 26 (11): 1850-7, 2008. [PUBMED Abstract]
- Major A, Smith DE, Ghosh D, et al.: Risk and subtypes of secondary primary malignancies in diffuse large B-cell lymphoma survivors change over time based on stage at diagnosis. Cancer 126 (1): 189-201, 2020. [PUBMED Abstract]
- Moser EC, Noordijk EM, van Leeuwen FE, et al.: Long-term risk of cardiovascular disease after treatment for aggressive non-Hodgkin lymphoma. Blood 107 (7): 2912-9, 2006. [PUBMED Abstract]
- Darrington DL, Vose JM, Anderson JR, et al.: Incidence and characterization of secondary myelodysplastic syndrome and acute myelogenous leukemia following high-dose chemoradiotherapy and autologous stem-cell transplantation for lymphoid malignancies. J Clin Oncol 12 (12): 2527-34, 1994. [PUBMED Abstract]
- Stone RM, Neuberg D, Soiffer R, et al.: Myelodysplastic syndrome as a late complication following autologous bone marrow transplantation for non-Hodgkin's lymphoma. J Clin Oncol 12 (12): 2535-42, 1994. [PUBMED Abstract]
- Armitage JO, Carbone PP, Connors JM, et al.: Treatment-related myelodysplasia and acute leukemia in non-Hodgkin's lymphoma patients. J Clin Oncol 21 (5): 897-906, 2003. [PUBMED Abstract]
- André M, Mounier N, Leleu X, et al.: Second cancers and late toxicities after treatment of aggressive non-Hodgkin lymphoma with the ACVBP regimen: a GELA cohort study on 2837 patients. Blood 103 (4): 1222-8, 2004. [PUBMED Abstract]
- Oddou S, Vey N, Viens P, et al.: Second neoplasms following high-dose chemotherapy and autologous stem cell transplantation for malignant lymphomas: a report of six cases in a cohort of 171 patients from a single institution. Leuk Lymphoma 31 (1-2): 187-94, 1998. [PUBMED Abstract]
- Lenz G, Dreyling M, Schiegnitz E, et al.: Moderate increase of secondary hematologic malignancies after myeloablative radiochemotherapy and autologous stem-cell transplantation in patients with indolent lymphoma: results of a prospective randomized trial of the German Low Grade Lymphoma Study Group. J Clin Oncol 22 (24): 4926-33, 2004. [PUBMED Abstract]
- McLaughlin P, Estey E, Glassman A, et al.: Myelodysplasia and acute myeloid leukemia following therapy for indolent lymphoma with fludarabine, mitoxantrone, and dexamethasone (FND) plus rituximab and interferon alpha. Blood 105 (12): 4573-5, 2005. [PUBMED Abstract]
- Morton LM, Curtis RE, Linet MS, et al.: Second malignancy risks after non-Hodgkin's lymphoma and chronic lymphocytic leukemia: differences by lymphoma subtype. J Clin Oncol 28 (33): 4935-44, 2010. [PUBMED Abstract]
- Mach-Pascual S, Legare RD, Lu D, et al.: Predictive value of clonality assays in patients with non-Hodgkin's lymphoma undergoing autologous bone marrow transplant: a single institution study. Blood 91 (12): 4496-503, 1998. [PUBMED Abstract]
- Lillington DM, Micallef IN, Carpenter E, et al.: Detection of chromosome abnormalities pre-high-dose treatment in patients developing therapy-related myelodysplasia and secondary acute myelogenous leukemia after treatment for non-Hodgkin's lymphoma. J Clin Oncol 19 (9): 2472-81, 2001. [PUBMED Abstract]
- Brown JR, Yeckes H, Friedberg JW, et al.: Increasing incidence of late second malignancies after conditioning with cyclophosphamide and total-body irradiation and autologous bone marrow transplantation for non-Hodgkin's lymphoma. J Clin Oncol 23 (10): 2208-14, 2005. [PUBMED Abstract]
- Jackson GH, Wood A, Taylor PR, et al.: Early high dose chemotherapy intensification with autologous bone marrow transplantation in lymphoma associated with retention of fertility and normal pregnancies in females. Scotland and Newcastle Lymphoma Group, UK. Leuk Lymphoma 28 (1-2): 127-32, 1997. [PUBMED Abstract]
- Gangaraju R, Chen Y, Hageman L, et al.: Risk of venous thromboembolism in patients with non-Hodgkin lymphoma surviving blood or marrow transplantation. Cancer 125 (24): 4498-4508, 2019. [PUBMED Abstract]
- Westin JR, Thompson MA, Cataldo VD, et al.: Zoledronic acid for prevention of bone loss in patients receiving primary therapy for lymphomas: a prospective, randomized controlled phase III trial. Clin Lymphoma Myeloma Leuk 13 (2): 99-105, 2013. [PUBMED Abstract]
- Shree T, Li Q, Glaser SL, et al.: Impaired Immune Health in Survivors of Diffuse Large B-Cell Lymphoma. J Clin Oncol 38 (15): 1664-1675, 2020. [PUBMED Abstract]
- Ghione P, Gu JJ, Attwood K, et al.: Impaired humoral responses to COVID-19 vaccination in patients with lymphoma receiving B-cell-directed therapies. Blood 138 (9): 811-814, 2021. [PUBMED Abstract]
- Terpos E, Trougakos IP, Gavriatopoulou M, et al.: Low neutralizing antibody responses against SARS-CoV-2 in older patients with myeloma after the first BNT162b2 vaccine dose. Blood 137 (26): 3674-3676, 2021. [PUBMED Abstract]
Clasificación celular del linfoma no Hodgkin de células B
Se debe consultar con un patólogo antes de realizar una biopsia porque algunos estudios exigen una preparación especial del tejido (por ejemplo, tejido congelado). El conocimiento de los marcadores de superficie celular y los reordenamientos de los genes de inmunoglobulinas y del receptor de células T puede ser útil al momento de tomar decisiones diagnósticas y terapéuticas. El exceso clonal de cadenas ligeras de inmunoglobulina permite diferenciar las células linfoides malignas de las células reactivas. Es muy importante que un hematopatólogo con experiencia en el diagnóstico de linfomas realice un examen minucioso de las muestras de biopsia externas porque las características histopatológicas afectan el pronóstico y el abordaje del tratamiento. Aunque se recomienda obtener biopsias de ganglios linfáticos cuando sea posible, a veces los datos inmunofenotípicos son suficientes para establecer un diagnóstico de linfoma cuando es preferible hacer un estudio citológico mediante aspiración con aguja fina o biopsia con aguja gruesa.[1,2]
Sistemas de clasificación tradicionales
En el pasado, la falta de un sistema de clasificación unificado impedía establecer un tratamiento uniforme para los pacientes con linfoma no Hodgkin (LNH). En 1982, se publicaron los resultados de un estudio de consenso que se conoce como Working Formulation.[3] Se combinaron los resultados de 6 sistemas de clasificación principales para formar una clasificación unificada que permitió la comparación de estudios de diferentes instituciones y países. La clasificación de Rappaport, que también aparece a continuación, ya no se usa mucho.
| Working Formulation [3] | Clasificación de Rappaport |
|---|---|
| Grado bajo | |
| A. Linfoma linfocítico de células pequeñas, compatible con leucemia linfocítica crónica | Linfoma linfocítico difuso bien diferenciado |
| B. Linfoma folicular con predominio de células hendidas pequeñas | Linfoma linfocítico nodular pobremente diferenciado |
| C. Linfoma folicular mixto con mezcla de células hendidas pequeñas y células grandes | Linfoma nodular mixto, linfocítico e histiocítico |
| Grado intermedio | |
| D. Linfoma folicular con predominio de células grandes | Linfoma histiocítico nodular |
| E. Linfoma difuso de células hendidas pequeñas | Linfoma linfocítico difuso pobremente diferenciado |
| F. Linfoma difuso mixto de células pequeñas y grandes | Linfoma difuso mixto, linfocítico e histiocítico |
| G. Linfoma difuso de células grandes hendidas o no hendidas | Linfoma histiocítico difuso |
| Grado alto | |
| H. Linfoma inmunoblástico de células grandes | Linfoma histiocítico difuso |
| I. Linfoma linfoblástico con células cerebriformes o no cerebriformes | Linfoma linfoblástico difuso |
| J. Linfoma de Burkitt o no Burkitt de células pequeñas no hendidas | Linfoma indiferenciado difuso de Burkitt o no Burkitt |
Sistemas de clasificación actuales
Se han descrito varias entidades patológicas nuevas a medida que el diagnóstico histopatológico del LNH se vuelve cada vez más sofisticado por el uso de métodos inmunológicos y genéticos.[4] Además, la comprensión y el tratamiento de muchos de los subtipos patológicos descritos antes han cambiado. Como resultado, la clasificación Working Formulation se volvió obsoleta y carece de utilidad para profesionales clínicos y patólogos. Por este motivo los patólogos europeos y norteamericanos propusieron la Revised European American Lymphoma Classification, una clasificación nueva conocida como clasificación REAL.[5-8] Desde 1995, los miembros de las sociedades europeas y estadounidenses de hemopatología han colaborado en la formulación de la nueva clasificación de la Organización Mundial de la Salud (OMS), que representa una versión actualizada del sistema REAL.[9,10]
Clasificación REAL modificada por la Organización Mundial de la Salud
En la modificación que la Organización Mundial de la Salud (OMS) hizo a la clasificación europea americana revisada del linfoma (Revised European American Lymphoma [REAL]) se reconocen tres categorías principales de neoplasias linfoides malignas según la morfología y el linaje celular: neoplasias de células B, neoplasias de células T o de células citolíticas naturales (NK), y linfoma de Hodgkin (LH). En esta clasificación, se incluyen los linfomas y las leucemias linfoides porque las fases sólidas y circulantes de estas enfermedades se encuentran en muchas neoplasias linfoides, así que la distinción entre ellas es artificial. Por ejemplo, la leucemia linfocítica crónica (LLC) de células B y el linfoma linfocítico de células B pequeñas son distintas manifestaciones de la misma neoplasia, al igual que los linfomas linfoblásticos y las leucemias linfocíticas agudas. Dentro de las categorías de células B y células T, se reconocen dos subdivisiones: neoplasias precursoras, que corresponden a los estadios más tempranos de diferenciación, y neoplasias diferenciadas más maduras.[9,10]
Neoplasias de células B
- Neoplasias de células B precursoras: leucemia linfoblástica aguda de células B precursoras o linfoma linfoblástico de células B precursoras.
- Neoplasias de células B periféricas.
- Leucemia linfocítica crónica de células B o linfoma linfocítico de células B pequeñas.
- Leucemia prolinfocítica de células B.
- Linfoma linfoplasmocítico o inmunocitoma.
- Linfoma de células de manto.
- Linfoma folicular.
- Linfoma extraganglionar de células B de zona marginal de tejido linfoide asociado a mucosas.
- Linfoma ganglionar de células B de zona marginal (± células B monocitoides).
- Linfoma esplénico de zona marginal (± linfocitos vellosos).
- Leucemia de células pilosas.
- Plasmocitoma o mieloma de células plasmáticas.
- Linfoma difuso de células B grandes.
- Linfoma de Burkitt.
Neoplasias de células T y posiblemente derivadas de células NK
- Neoplasias de células T precursoras: leucemia linfoblástica aguda de células T precursoras o linfoma linfoblástico de células T precursoras. Para obtener más información, consultar Tratamiento de la leucemia linfoblástica aguda.
- Neoplasias periféricas de células T-NK.
- Leucemia linfocítica crónica de células T o leucemia prolinfocítica de células T.
- Leucemia linfocítica granular de células T.
- Micosis fungoide (incluso el síndrome de Sézary).
- Linfoma periférico de células T sin otra indicación.
- Linfoma hepatoesplénico de células T γ-δ.
- Linfoma subcutáneo de células T similar a la paniculitis.
- Linfoma extraganglionar de células T-NK de tipo nasal.
- Linfomas ganglionares de origen de células T auxiliares foliculares (incluso linfoma angioinmunoblástico de células T, linfoma periférico de células T foliculares y linfoma ganglionar periférico de células T con fenotipo auxiliar folicular T).
- Linfoma intestinal de células T asociado a enteropatía.
- Linfoma intestinal epiteliotrópico monomórfico de células T.
- Leucemia o linfoma de células T en adultos (virus linfotrópico humano de células T de tipo 1 [VLHT] 1+).
- Linfoma anaplásico de células grandes de tipo sistémico primario.
- Linfoma anaplásico de células grandes de tipo cutáneo primario.
- Leucemia de células NK de crecimiento rápido (agresiva).
Linfoma de Hodgkin
- Linfoma de Hodgkin con predominio linfocítico nodular.
- Linfoma de Hodgkin clásico.
- Linfoma de Hodgkin con esclerosis nodular.
- Linfoma de Hodgkin clásico rico en linfocitos.
- Linfoma de Hodgkin con celularidad mixta.
- Linfoma de Hodgkin con agotamiento linfocítico.
La clasificación REAL abarca todas las neoplasias linfoproliferativas. Para obtener más información, consultar los siguientes resúmenes del PDQ:
- Tratamiento de la leucemia linfoblástica aguda
- Tratamiento de la leucemia linfocítica crónica
- Tratamiento de la leucemia de células pilosas
- Tratamiento del linfoma de Hodgkin
- Tratamiento del linfoma relacionado con el SIDA
- Tratamiento del linfoma no Hodgkin de células B de crecimiento lento
- Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido
- Tratamiento del linfoma no Hodgkin periférico de células T
- Tratamiento de la micosis fungoide y otros linfomas cutáneos de células T
- Tratamiento de las neoplasias de células plasmáticas (incluso mieloma múltiple)
- Tratamiento del linfoma primario del sistema nervioso central
Bibliografía
- Zeppa P, Marino G, Troncone G, et al.: Fine-needle cytology and flow cytometry immunophenotyping and subclassification of non-Hodgkin lymphoma: a critical review of 307 cases with technical suggestions. Cancer 102 (1): 55-65, 2004. [PUBMED Abstract]
- Young NA, Al-Saleem T: Diagnosis of lymphoma by fine-needle aspiration cytology using the revised European-American classification of lymphoid neoplasms. Cancer 87 (6): 325-45, 1999. [PUBMED Abstract]
- National Cancer Institute sponsored study of classifications of non-Hodgkin's lymphomas: summary and description of a working formulation for clinical usage. The Non-Hodgkin's Lymphoma Pathologic Classification Project. Cancer 49 (10): 2112-35, 1982. [PUBMED Abstract]
- Pugh WC: Is the working formulation adequate for the classification of the low grade lymphomas? Leuk Lymphoma 10 (Suppl 1): 1-8, 1993.
- Harris NL, Jaffe ES, Stein H, et al.: A revised European-American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group. Blood 84 (5): 1361-92, 1994. [PUBMED Abstract]
- Pittaluga S, Bijnens L, Teodorovic I, et al.: Clinical analysis of 670 cases in two trials of the European Organization for the Research and Treatment of Cancer Lymphoma Cooperative Group subtyped according to the Revised European-American Classification of Lymphoid Neoplasms: a comparison with the Working Formulation. Blood 87 (10): 4358-67, 1996. [PUBMED Abstract]
- Armitage JO, Weisenburger DD: New approach to classifying non-Hodgkin's lymphomas: clinical features of the major histologic subtypes. Non-Hodgkin's Lymphoma Classification Project. J Clin Oncol 16 (8): 2780-95, 1998. [PUBMED Abstract]
- A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin's lymphoma. The Non-Hodgkin's Lymphoma Classification Project. Blood 89 (11): 3909-18, 1997. [PUBMED Abstract]
- Pileri SA, Milani M, Fraternali-Orcioni G, et al.: From the R.E.A.L. Classification to the upcoming WHO scheme: a step toward universal categorization of lymphoma entities? Ann Oncol 9 (6): 607-12, 1998. [PUBMED Abstract]
- Society for Hematopathology Program: Society for Hematopathology Program. Am J Surg Pathol 21 (1): 114-121, 1997.
Información sobre los estadios del linfoma no Hodgkin de células B de crecimiento rápido
El estadio es importante para la selección del tratamiento en pacientes con linfoma no Hodgkin (LNH). Por lo general, las tomografías computarizadas (TC) del tórax y el abdomen forman parte de la evaluación para la estadificación de todos los pacientes con linfoma. El sistema de estadificación para el LNH es similar al que se usa para el linfoma de Hodgkin (LH).
Es común que los pacientes con LNH presenten compromiso de los siguientes sitios:
- Ganglios linfáticos no adyacentes.
- Anillo de Waldeyer.
- Ganglios epitrocleares.
- Tubo digestivo.
- Sitios extraganglionares. (En ocasiones, una localización extraganglionar es el único sitio comprometido en pacientes con un linfoma difuso).
- Médula ósea.
- Hígado (muy común en pacientes con linfomas de grado bajo).
El examen citológico del líquido cefalorraquídeo a veces da un resultado positivo en pacientes con LNH de crecimiento rápido. El compromiso de los ganglios linfáticos hiliares y mediastínicos es menos común que en los pacientes con LH. Sin embargo, las adenopatías mediastínicas son una característica destacada del linfoma linfoblástico y del linfoma mediastínico primario de células B, que se presentan sobre todo en adultos jóvenes.
La mayoría de los pacientes con LNH consultan con una enfermedad avanzada (estadio III o IV) que a menudo se identifica mediante tomografías computarizadas (TC) o biopsias de la médula ósea y de otros sitios comprometidos accesibles. En una revisión retrospectiva de más de 32 000 casos de linfoma en Francia, hasta el 40 % de los diagnósticos se confirmaron mediante biopsia con aguja gruesa y el 60 % mediante biopsia por escisión.[1] Después de la revisión por expertos, la biopsia con aguja gruesa proporcionó un diagnóstico definitivo en el 92,3 % de los casos; mientras que la biopsia por escisión proporcionó un diagnóstico definitivo en el 98,1 % de los casos (P < 0,0001). Por lo general, no se requiere una biopsia laparoscópica o laparotomía para la estadificación, pero es posible que en raras ocasiones se necesite para establecer un diagnóstico o determinar el tipo histológico del linfoma.[2]
La tomografía por emisión de positrones (TEP) con flúor F 18-fludesoxiglucosa se puede usar para la estadificación inicial. También quizás se utilice durante el seguimiento después del tratamiento como complemento de la TC.[3] En múltiples estudios se demostró que las TEP intermedias después de 2 a 4 ciclos de terapia no aportan información pronóstica confiable. En un ensayo de grupo cooperativo grande (ECOG-E344 [NCT00274924]) se notificaron problemas de reproducibilidad entre los observadores. En 2 ensayos prospectivos y en 1 metanálisis no se observaron diferencias en los desenlaces entre los pacientes con resultados negativos en la TEP y los pacientes con resultados positivos en la TEP pero que tenían resultados negativos en la biopsia.[4-7]
En un estudio retrospectivo de 130 pacientes con linfoma difuso de células B grandes, la TEP permitió identificar el compromiso de la médula ósea con importancia clínica; la biopsia de médula ósea no llevó a la sobreestadificación de ningún paciente con linfoma.[8] En un estudio retrospectivo de 580 pacientes con linfoma folicular de 7 ensayos patrocinados por el Instituto Nacional del Cáncer, no se observó ninguna mejora en la evaluación de la respuesta al tratamiento cuando se añadió la biopsia de la médula ósea a las imágenes radiológicas.[9] La evaluación del LNH debe incluir una biopsia de la médula ósea cuando el resultado posiblemente conlleve un cambio en el tratamiento (por ejemplo, si se encuentra un estadio limitado vs. uno avanzado) o durante la evaluación de la presencia de citopenias.
En los pacientes con linfoma folicular, un resultado anormal en una TEP después del tratamiento conlleva un pronóstico más precario; sin embargo, no está claro si este resultado es predictivo cuando se implementa un tratamiento adicional o diferente.[10]
Sistema de estadificación
Clasificación de Lugano
El American Joint Committee on Cancer (AJCC) adoptó la clasificación de Lugano para evaluar y estadificar el linfoma.[11] El sistema de clasificación de Lugano reemplazó el sistema de clasificación de Ann Arbor, que se adoptó en 1971 en la conferencia de Ann Arbor,[12] y que fue modificado 18 años después en la reunión de Cotswolds.[13,14]
| Estadio | Descripción del estadio | Imagen |
|---|---|---|
| LCR = líquido cefalorraquídeo; TC = tomografía computarizada; LDCBG = linfoma difuso de células B grandes; LNH = linfoma no Hodgkin. | ||
| aHodgkin and Non-Hodgkin Lymphomas. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pp. 937-58. | ||
| bEl estadio II con gran masa tumoral (tumor voluminoso) quizás se considere un estadio temprano o avanzado en función de las características histológicas y los factores pronósticos del linfoma. | ||
| cLa definición de una gran masa tumoral varía según las características histológicas del linfoma. En la clasificación de Lugano, una gran masa tumoral en el linfoma de Hodgkin se define como una masa que mide más de un tercio del diámetro torácico en la TC del tórax, o una masa que mide >10 cm. Las definiciones recomendadas para una gran masa tumoral en el LNH varían de acuerdo a las características histológicas del linfoma. En el linfoma folicular, se sugirió la medida de 6 cm a partir del Follicular Lymphoma International Prognostic Index-2 y su validación. En el LDCBG, se han usado valores de corte que oscilan entre 5 cm y 10 cm, aunque el límite recomendado es de 10 cm. | ||
| Estadio limitado | ||
| I | Compromiso de un solo sitio linfático (es decir, una región ganglionar, el anillo de Waldeyer, el timo o el bazo). |
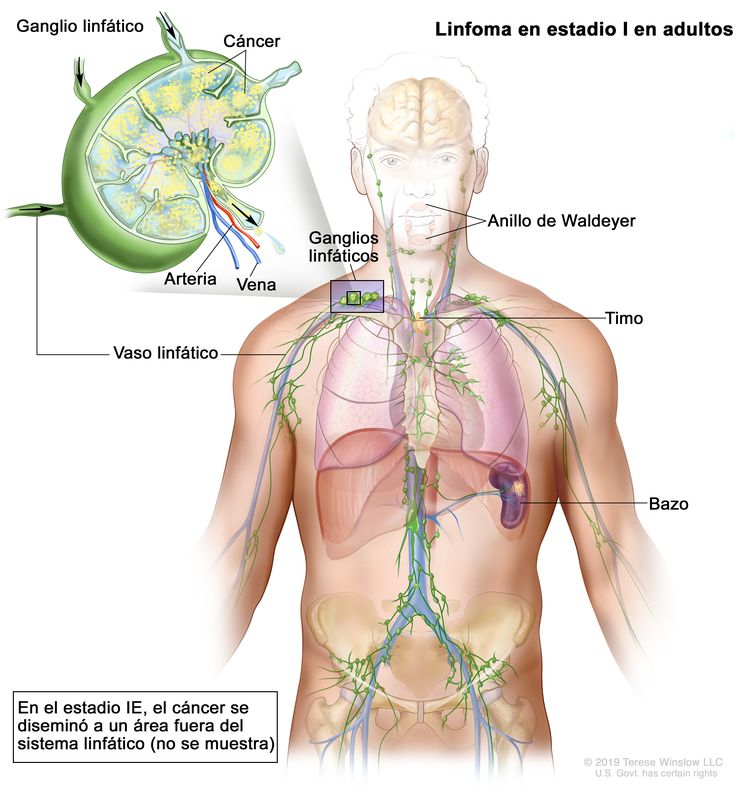 |
| IE | Compromiso de 1 solo sitio extralinfático sin compromiso ganglionar (infrecuente en el linfoma de Hodgkin). | |
| II | Compromiso de 2 o más regiones ganglionares en el mismo lado del diafragma. |
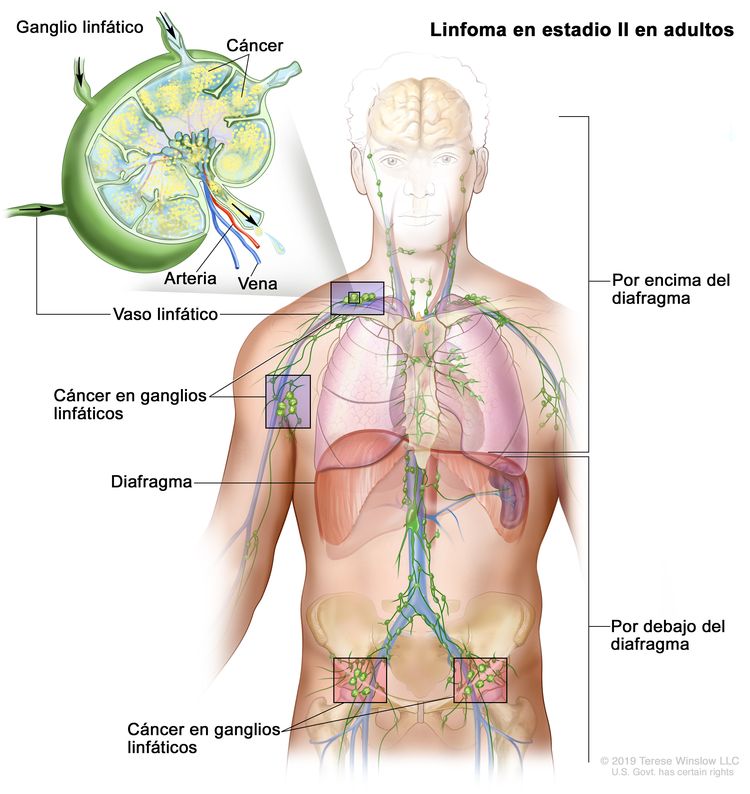 |
| IIE | Diseminación extralinfática adyacente desde un sitio ganglionar con compromiso de otras regiones ganglionares en el mismo lado del diafragma o sin este. |
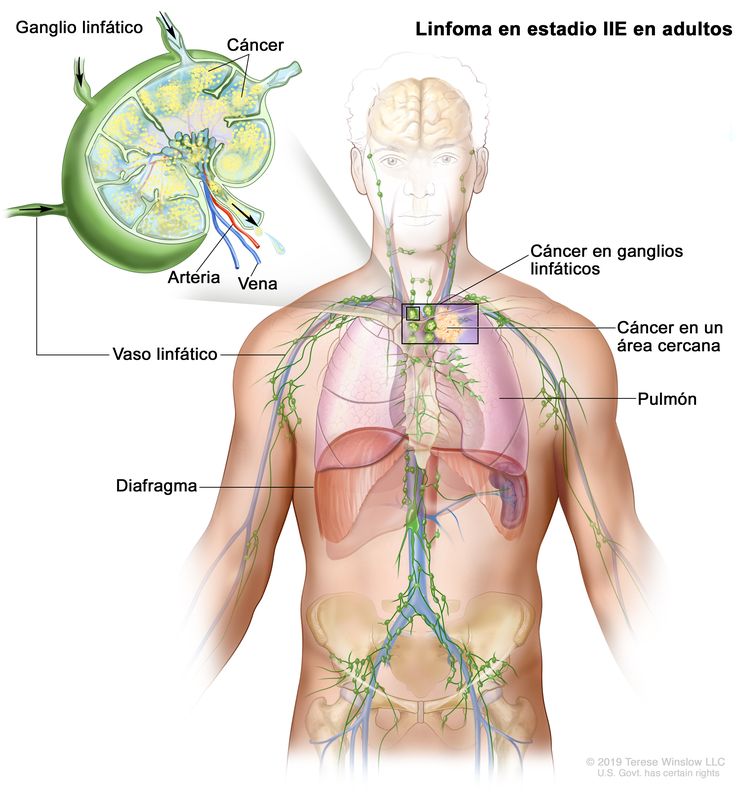 |
| II con gran masa tumoralb | Estadio II con gran masa tumoralc | |
| Estadio avanzado | ||
| III | Compromiso de regiones ganglionares en ambos lados del diafragma; adenopatías por encima del diafragma y compromiso esplénico. |
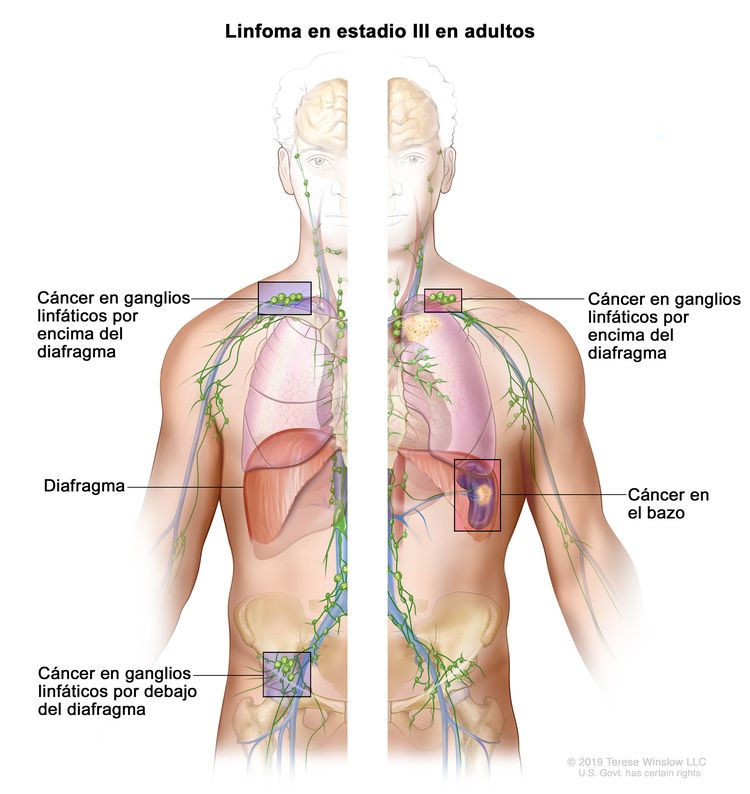 |
| IV | Compromiso difuso o diseminación a uno o más órganos extralinfáticos con compromiso ganglionar o sin este; compromiso de órgano extralinfático no adyacente con enfermedad ganglionar en estadio II; o compromiso de cualquier órgano extralinfático con enfermedad ganglionar en estadio III. El estadio IV incluye cualquier tipo de compromiso del LCR, la médula ósea y el hígado, o la presencia de lesiones pulmonares múltiples (diferentes a las lesiones por diseminación directa de una enfermedad en estadio IIE). |
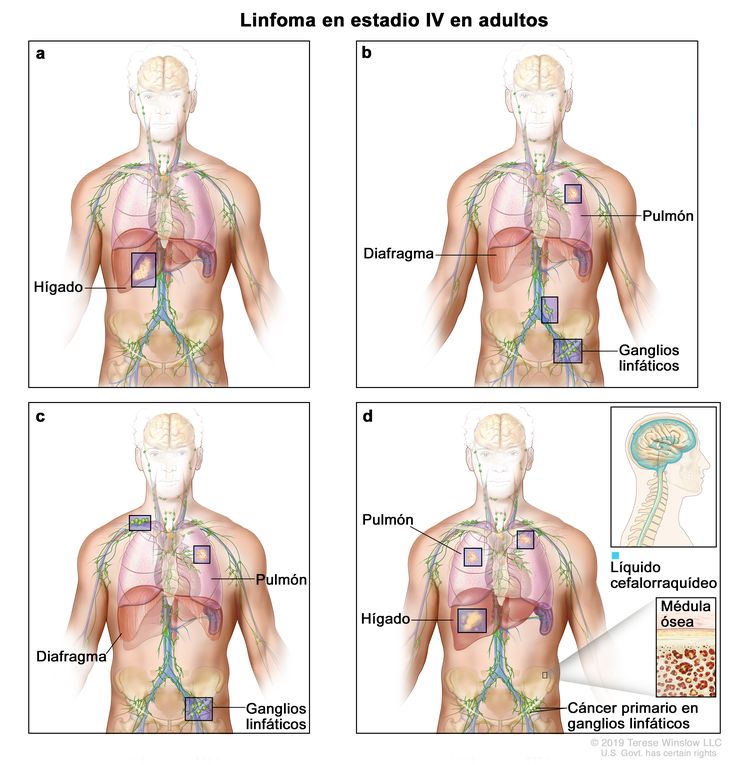 |
| Nota: Se utiliza la designación A o B junto con el grupo de estadio para el linfoma de Hodgkin. En el LNH ya no se utiliza la designación A ni B. | ||
En ocasiones, se usan otros sistemas de estadificación especializados. El médico debe estar al tanto del sistema que se usa en el informe del paciente.
La designación E se usa cuando aparecen neoplasias linfoides extraganglionares malignas en tejidos separados de los conglomerados linfáticos principales pero cercanos a estos. El estadio IV indica una enfermedad con diseminación difusa por todo un sitio extraganglionar, como el hígado. Si el compromiso de uno o más sitios extralinfáticos se documentó mediante estudio patológico, se usa el símbolo del sitio comprometido seguido por el signo más (+).
| N = ganglios | H = hígado | L = pulmón | M = médula ósea |
| S = bazo | P = pleura | O = hueso | D = piel |
En la práctica actual se asigna un estadio clínico a partir de los hallazgos de la evaluación clínica y un estadio patológico a partir de los hallazgos de los procedimientos invasivos adicionales a la biopsia inicial.
Por ejemplo, es posible que se encuentre un compromiso del hígado y la médula ósea mediante una biopsia percutánea en un paciente con adenopatía inguinal sin síntomas sistémicos que tiene un resultado positivo en el linfangiograma. El estadio exacto para dicho paciente sería estadio clínico IIA, estadio patológico IVA(H+)(M+).
Hay otros factores que no se incluyen en el sistema de estadificación anterior, pero que son importantes para la estadificación y el pronóstico de los pacientes con LNH. Estos factores son los siguientes:
- Edad.
- Estado funcional (EF).
- Tamaño del tumor.
- Concentraciones de lactato–deshidrogenasa (LDH).
- Número de sitios con compromiso extraganglionar.
En el índice pronóstico internacional de la National Comprehensive Cancer Network (National Comprehensive Cancer Network International Prognostic Index [NCCN-IPI]) para el linfoma no Hodgkin (LNH) de crecimiento rápido (linfoma difuso de células grandes) se identifican los siguientes 5 factores de riesgo significativos para el pronóstico de la supervivencia general (SG) y los puntajes de riesgo relacionado:[15]
- Edad.
- <40 años: 0.
- 41–60 años: 1.
- 61–75 años: 2.
- >75 años: 3.
- Estadio III o IV: 1.
- Estado funcional (EF) 2, 3 o 4: 1.
- Concentración sérica de lactato–deshidrogenasa (LDH).
- Normalizada: 0.
- >1x–3x: 1.
- >3x: 2.
- Número de sitios extraganglionares ≥2: 1.
Puntajes de riesgo:
- Bajo (0 o 1): Tasa de SG a 5 años, 96 %; tasa de supervivencia sin progresión (SSP), 91 %.
- Intermedio bajo (2 o 3): Tasa de SG a 5 años, 82 %; tasa de SSP, 74 %.
- Intermedio alto (4 o 5): Tasa de SG a 5 años, 64 %; tasa de SSP, 51 %.
- Alto (>6): Tasa de SG a 5 años, 33 %; tasa de SSP, 30 %.
Se utilizan modificaciones del IPI ajustadas por edad y estadio para los pacientes más jóvenes con enfermedad localizada.[16] Los intervalos de tiempo más cortos entre el diagnóstico y el tratamiento son marcadores indirectos de factores biológicos de pronóstico precario.[17]
Las alteraciones del gen BCL2 y un reordenamiento del gen MYC o la sobreexpresión dual del gen MYC, o ambos, confieren un pronóstico particularmente precario.[18,19] Los pacientes con riesgo alto de recaída quizás se beneficien de terapia de consolidación u otros abordajes en evaluación clínica.[20] La obtención de perfiles moleculares de expresión génica mediante micromatrices de ADN quizás sirva en el futuro para ayudar a estratificar a los pacientes en grupos de tratamiento dirigido a dianas específicas y para mejorar la predicción de la supervivencia después de la quimioterapia estándar.[21]
Bibliografía
- Syrykh C, Chaouat C, Poullot E, et al.: Lymph node excisions provide more precise lymphoma diagnoses than core biopsies: a French Lymphopath network survey. Blood 140 (24): 2573-2583, 2022. [PUBMED Abstract]
- Mann GB, Conlon KC, LaQuaglia M, et al.: Emerging role of laparoscopy in the diagnosis of lymphoma. J Clin Oncol 16 (5): 1909-15, 1998. [PUBMED Abstract]
- Barrington SF, Mikhaeel NG, Kostakoglu L, et al.: Role of imaging in the staging and response assessment of lymphoma: consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol 32 (27): 3048-58, 2014. [PUBMED Abstract]
- Horning SJ, Juweid ME, Schöder H, et al.: Interim positron emission tomography scans in diffuse large B-cell lymphoma: an independent expert nuclear medicine evaluation of the Eastern Cooperative Oncology Group E3404 study. Blood 115 (4): 775-7; quiz 918, 2010. [PUBMED Abstract]
- Moskowitz CH, Schöder H, Teruya-Feldstein J, et al.: Risk-adapted dose-dense immunochemotherapy determined by interim FDG-PET in Advanced-stage diffuse large B-Cell lymphoma. J Clin Oncol 28 (11): 1896-903, 2010. [PUBMED Abstract]
- Pregno P, Chiappella A, Bellò M, et al.: Interim 18-FDG-PET/CT failed to predict the outcome in diffuse large B-cell lymphoma patients treated at the diagnosis with rituximab-CHOP. Blood 119 (9): 2066-73, 2012. [PUBMED Abstract]
- Sun N, Zhao J, Qiao W, et al.: Predictive value of interim PET/CT in DLBCL treated with R-CHOP: meta-analysis. Biomed Res Int 2015: 648572, 2015. [PUBMED Abstract]
- Khan AB, Barrington SF, Mikhaeel NG, et al.: PET-CT staging of DLBCL accurately identifies and provides new insight into the clinical significance of bone marrow involvement. Blood 122 (1): 61-7, 2013. [PUBMED Abstract]
- Rutherford SC, Yin J, Pederson L, et al.: Relevance of Bone Marrow Biopsies for Response Assessment in US National Cancer Institute National Clinical Trials Network Follicular Lymphoma Clinical Trials. J Clin Oncol 41 (2): 336-342, 2023. [PUBMED Abstract]
- Pyo J, Won Kim K, Jacene HA, et al.: End-therapy positron emission tomography for treatment response assessment in follicular lymphoma: a systematic review and meta-analysis. Clin Cancer Res 19 (23): 6566-77, 2013. [PUBMED Abstract]
- Hodgkin and non-Hodgkin lymphoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 937–58.
- Carbone PP, Kaplan HS, Musshoff K, et al.: Report of the Committee on Hodgkin's Disease Staging Classification. Cancer Res 31 (11): 1860-1, 1971. [PUBMED Abstract]
- Lister TA, Crowther D, Sutcliffe SB, et al.: Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin's disease: Cotswolds meeting. J Clin Oncol 7 (11): 1630-6, 1989. [PUBMED Abstract]
- National Cancer Institute sponsored study of classifications of non-Hodgkin's lymphomas: summary and description of a working formulation for clinical usage. The Non-Hodgkin's Lymphoma Pathologic Classification Project. Cancer 49 (10): 2112-35, 1982. [PUBMED Abstract]
- Zhou Z, Sehn LH, Rademaker AW, et al.: An enhanced International Prognostic Index (NCCN-IPI) for patients with diffuse large B-cell lymphoma treated in the rituximab era. Blood 123 (6): 837-42, 2014. [PUBMED Abstract]
- Møller MB, Christensen BE, Pedersen NT: Prognosis of localized diffuse large B-cell lymphoma in younger patients. Cancer 98 (3): 516-21, 2003. [PUBMED Abstract]
- Maurer MJ, Ghesquières H, Link BK, et al.: Diagnosis-to-Treatment Interval Is an Important Clinical Factor in Newly Diagnosed Diffuse Large B-Cell Lymphoma and Has Implication for Bias in Clinical Trials. J Clin Oncol 36 (16): 1603-1610, 2018. [PUBMED Abstract]
- Scott DW, King RL, Staiger AM, et al.: High-grade B-cell lymphoma with MYC and BCL2 and/or BCL6 rearrangements with diffuse large B-cell lymphoma morphology. Blood 131 (18): 2060-2064, 2018. [PUBMED Abstract]
- Horn H, Ziepert M, Becher C, et al.: MYC status in concert with BCL2 and BCL6 expression predicts outcome in diffuse large B-cell lymphoma. Blood 121 (12): 2253-63, 2013. [PUBMED Abstract]
- A predictive model for aggressive non-Hodgkin's lymphoma. The International Non-Hodgkin's Lymphoma Prognostic Factors Project. N Engl J Med 329 (14): 987-94, 1993. [PUBMED Abstract]
- Sha C, Barrans S, Cucco F, et al.: Molecular High-Grade B-Cell Lymphoma: Defining a Poor-Risk Group That Requires Different Approaches to Therapy. J Clin Oncol 37 (3): 202-212, 2019. [PUBMED Abstract]
Linfoma no Hodgkin de células B de crecimiento rápido
El linfoma no Hodgkin (LNH) de células B de crecimiento rápido incluye los siguientes subtipos:
- Linfoma difuso de células B grandes.
- Linfoma mediastínico primario de células B grandes.
- Linfoma intravascular de células B grandes (linfomatosis intravascular).
- Linfoma folicular (grado 3b).
- Linfoma de células de manto.
- Linfoma de Burkitt o linfoma difuso de células pequeñas no hendidas.
- Linfoma linfoblástico de células B.
- Linfoma primario de efusiones.
- Linfoma plasmoblástico (plasmablástico).
- Trastorno linfoproliferativo postrasplante polimórfico.
- Granulomatosis linfomatoide.
Linfoma difuso de células B grandes
El linfoma difuso de células B grandes (LDCBG) es el tipo más común de LNH y representa el 30 % de los casos recién diagnosticados.[1] La mayoría de los pacientes presentan masas que crecen rápido, a menudo con síntomas locales y sistémicos (designados como síntomas B, con fiebre, hiperhidrosis nocturna recurrente o pérdida de peso). Para obtener más información sobre la pérdida de peso, consultar La nutrición en el tratamiento del cáncer.
Algunos casos de linfoma de células B grandes tienen un fondo de células T reactivas e histiocitos, en este caso se la denomina linfoma de células T y de células B grandes rico en histiocitos. Este subtipo de linfoma de células grandes a menudo compromete el hígado, el bazo y la médula ósea; sin embargo, el desenlace es equivalente al de pacientes con LDCBG en estadios similares.[2-4] En el momento del diagnóstico, algunos pacientes con LDCBG presentan de manera simultánea un componente de crecimiento lento de células B pequeñas. Si bien la supervivencia general (SG) es similar al del LDCBG de novo después de la quimioterapia multifarmacológica, hay un riesgo más alto de recaída de la enfermedad de crecimiento lento.[5]
Pronóstico
En la mayoría de los pacientes, la enfermedad localizada se puede curar con terapia de modalidad combinada o quimioterapia combinada sola, por lo general, R-CHOP (rituximab, ciclofosfamida, doxorrubicina, vincristina y prednisona).[6] Entre los pacientes con enfermedad en estadio avanzado, el 50 % se curan con quimioterapia combinada a base de doxorrubicina y rituximab, por lo general, Pola-R-CHP (polatuzumab, rituximab, ciclofosfamida, doxorrubicina y prednisona) o R-CHOP.[7-10]
La National Comprehensive Cancer Network identificó los factores de riesgo y las puntuaciones de riesgo asociadas.
Las alteraciones del gen BCL2 y un reordenamiento del gen MYC o la sobreexpresión dual del gen MYC, o ambos, confieren un pronóstico particularmente precario.[11-13] En este grupo de riesgo alto se están explorando terapias de dosis intensivas, infusiones y consolidación con trasplante de células madre (TCM).[14-17]
En una revisión retrospectiva de 117 pacientes con LDCBG en recaída o resistente al tratamiento sometidos a TCM autógeno, la tasa de SG a 4 años fue del 25 % en los pacientes de linfomas con mutación doble (reordenamiento de BCL2 y MYC), del 61 % en los pacientes de linfomas con expresión doble (sin reordenamiento, pero con aumento de la expresión de BCL2 y MYC), y del 70 % en los pacientes sin estas características.[18]
La obtención de perfiles moleculares de expresión génica mediante micromatrices de ADN quizás sirva en el futuro para ayudar a estratificar a los pacientes en grupos de tratamiento dirigido a dianas específicas y para mejorar la predicción de la supervivencia después de la quimioterapia estándar.[19] Por ejemplo, los linfomas de células B grandes positivos para ALK verdaderos son muy poco frecuentes y no responden bien al tratamiento convencional con R-CHOP. Se notificaron respuestas esporádicas a inhibidores de ALK como lorlatinib o alectinib.[20][Nivel de evidencia C3] Es probable que la coexpresión de CD20 y CD30 defina a un subgrupo de pacientes con LDCBG que tienen una firma molecular única y un pronóstico más favorable. Los pacientes en este subgrupo pueden recibir un tratamiento anti-CD30 específico, como brentuximab vedotina.[21] Los pacientes con LDCBG sin complicaciones después de 2 años tienen una SG posterior equivalente a la de la población general emparejada por edad y sexo.[22]
Es posible que los pacientes con riesgo alto de recaída en el sistema nervioso central (SNC) cumplan los requisitos para recibir profilaxis. Para obtener más información, consultar Profilaxis del sistema nervioso central en la sección Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido no adyacente en estadios II, III y IV.
Linfoma mediastínico primario de células B grandes
El linfoma mediastínico (tímico) primario de células B grandes es un subtipo de LDCBG con características moleculares que se asemejan más al linfoma de Hodgkin (LH) con esclerosis nodular.[23] Los linfomas mediastínicos con características intermedias entre un linfoma mediastínico primario de células B y un LH con esclerosis nodular se llaman linfomas mediastínicos de zona gris.[24,25] Por lo general, las pacientes son mujeres jóvenes (mediana de edad, 30–40 años). Estas pacientes presentan una masa mediastínica anterior localmente invasiva que a veces produce síntomas respiratorios o síndrome de la vena cava superior.
El pronóstico y el tratamiento es igual que para otros pacientes con LDCBG en estadio comparable. En estudios no controlados de fase II en los que se emplean dosis ajustadas de R-EPOCH (etopósido, prednisona, vincristina, ciclofosfamida y doxorrubicina con rituximab) o R-CHOP, se observaron tasas de curación altas y se evitó la irradiación mediastínica.[25-31][Nivel de evidencia C1] Estos resultados indican que los pacientes que reciben regímenes a base de R-CHOP quizás eviten las complicaciones graves y a largo plazo de la radioterapia cuando se administra con quimioterapia. El uso de imágenes por tomografía por emisión de positrones con flúor F 18-fludesoxiglucosa (18F-FDG) y tomografía computarizada (TEP-TC) es polémico después del tratamiento. Todavía no está claro si la TEP permite identificar de manera confiable a los pacientes que deben recibir radioterapia de consolidación o que deben omitirla.[26,32-34]
En una revisión retrospectiva de 109 pacientes con linfoma mediastínico primario de células B grandes se indicó que el 63 % de ellos tenía una TEP-TC negativa al final del tratamiento (puntuación de Deauville 1–3).[35] A estos pacientes no se les ofreció radioterapia. La tasa de tiempo hasta la progresión a 5 años (similar a la supervivencia sin enfermedad, pero restringida a la recaída del linfoma) fue del 90 % (intervalo de confianza [IC] 95 %, 74–95 %) y la tasa de SG a 5 años fue del 97 % (IC 95 %, 88–99 %) .[35][Nivel de evidencia C3] Los pacientes con una TEP-TC positiva al final del tratamiento recibieron radioterapia de consolidación. No está claro si los pacientes de este estudio hubieran evolucionado igual de bien sin radioterapia. En lugar de usar radioterapia, los profesionales clínicos tienen la posibilidad de vigilar a lo largo del tiempo la mejora de los pacientes con puntuaciones de Deauville 4 en las imágenes de TEP-TC al final del tratamiento. Sin embargo, este abordaje no se ha estudiado en ningún ensayo clínico.
Debido a que el linfoma mediastínico primario de células B grandes se caracteriza por una expresión alta del ligando de muerte celular programada 1 (PD-L1) y una expresión variable de CD30, en un estudio de fase II se evaluó nivolumab con brentuximab vedotina en 30 pacientes con recaída de la enfermedad. Al cabo de una mediana de seguimiento de 11,1 meses, la tasa de respuesta objetiva fue del 73 % (IC 95 %, 54−88 %).[36][Nivel de evidencia C3] De manera similar, en un ensayo de fase II sobre pembrolizumab en 53 pacientes con enfermedad recidivante o resistente al tratamiento, se observó una tasa de respuesta objetiva del 41,5 %. Al cabo de una mediana de seguimiento de 48,7 meses, la tasa de supervivencia sin progresión (SSP) a 4 años fue del 33 % y la tasa de SG a 4 años fue del 45,3 %.[37][Nivel de evidencia C3] Entre los 11 pacientes que lograron una respuesta completa, todos permanecían con respuesta completa en el momento del análisis final.
Entre los pacientes que habían recibido dos líneas de tratamiento previas, más de la mitad de los que recibieron terapia de células T con receptor quimérico para el antígeno (CAR) de lisocabtagén maraleucel (liso-cel) presentaron respuesta de la enfermedad.[38][Nivel de evidencia C3]
Linfoma intravascular de células B grandes (linfomatosis intravascular)
La linfomatosis intravascular se caracteriza como un linfoma de células grandes limitado al lumen intravascular. En la linfomatosis intravascular, los órganos que más a menudo están comprometidos son el encéfalo, los riñones, los pulmones y la piel.
El pronóstico es similar al del LDCBG convencional en estadio IV cuando se administra una quimioterapia combinada intensiva a base de R-CHOP, como se usa en casos de LDCBG.[39-41]
Linfoma folicular (grado 3b)
Pronóstico
La evolución natural del linfoma folicular de células grandes es polémica.[42]Si bien hay acuerdo acerca del número significativo de sobrevivientes sin enfermedad a largo plazo que tenían una enfermedad en estadio temprano, la posibilidad de curación de los pacientes con enfermedad avanzada (estadio III o estadio IV) permanece incierta. Algunos grupos notifican una tasa de recaída continua semejante a la de otros linfomas foliculares (patrón de linfoma de crecimiento lento).[43] Otros investigadores notifican una estabilización del tiempo sin progresión hasta los niveles previstos para un linfoma de crecimiento rápido (40 % a 10 años).[44,45] Las causas de esta discrepancia quizás sean las variaciones en la clasificación histológica entre diferentes instituciones y el número escaso de pacientes con linfoma folicular de células grandes. En una revisión retrospectiva de 252 pacientes, todos tratados con quimioterapia combinada con antraciclinas, se observó que los pacientes con más del 50 % de componentes difusos en la biopsia tuvieron una SG mucho más precaria que otros pacientes con linfoma folicular de células grandes.[46]
Abordajes terapéuticos
El tratamiento del linfoma folicular de células grandes se parece más al tratamiento de un LNH de crecimiento rápido que de crecimiento lento. Este abordaje se sustenta en el hecho de que el tratamiento con quimioterapia de dosis alta y trasplante de células madre hematopoyéticas periféricas autógenas tiene el mismo potencial curativo en pacientes con linfoma folicular de células grandes o linfoma difuso de células grandes, que recaen.[47][Nivel de evidencia C1]
Entre los pacientes que habían recibido dos líneas de tratamiento previas, más de la mitad de los que recibieron terapia de células T con CAR de lisocabtagén maraleucel presentaron respuesta de la enfermedad.[38][Nivel de evidencia C3]
Linfoma de células de manto
El linfoma de células de manto (LCM) se encuentra en los ganglios linfáticos, el bazo, la médula ósea, la sangre, y a veces en el aparato digestivo (poliposis linfomatosa).[48] El LCM se caracteriza por células B foliculares del manto positivas para CD5, una translocación de los cromosomas 11 y 14, así como la sobreexpresión de la proteína ciclina D1.[48] El LCM se divide en dos subtipos clínicos. El primero es una versión clásica con linfadenopatía y expresión alta de SOX-11 que se manifiesta con una evolución clínica más maligna y un pronóstico más precario. El segundo es una versión leucémica no ganglionar con expresión baja de SOX-11, una evolución clínica menos maligna y un mejor pronóstico.[49] La presencia de un cariotipo complejo predice una respuesta precaria a la terapia de inducción y una supervivencia inferior.[50] Con frecuencia hay superposición del cuadro clínico inicial de estos subtipos, y las implicaciones terapéuticas no están claras. Sin embargo, ambas versiones pueden converger durante la evolución y convertirse en un fenotipo blastoide o resistente al tratamiento debido a inestabilidad genómica y selección.[51,52] Las variantes del gen TP53 se relacionan, en especial, con la progresión temprana de la enfermedad y la muerte en pacientes que reciben quimioinmunoterapia convencional e inhibidores de la tirosina–cinasa de Bruton (BTK) como segunda línea.[53]
Al igual que los linfomas de grado bajo, el LCM es incurable con quimioterapia a base de antraciclinas y se presenta en pacientes de más edad con una enfermedad avanzada que, por lo general, es asintomática. Sin embargo, la mediana de supervivencia es significativamente más corta (5–7 años) que la de otros linfomas. Este tipo histológico ahora se considera un linfoma de crecimiento rápido.[54] El patrón difuso y la variante blastoide indican una evolución más maligna y una supervivencia más corta; mientras que el tipo de la zona de manto quizás tenga una evolución menos maligna.[52,55] Es posible que una tasa de proliferación celular elevada (aumento de Ki-67, índice mitótico y microglobulina β2) se relacione con un pronóstico más precario.[56,57]
Abordajes terapéuticos
Los pacientes asintomáticos con puntuaciones del índice pronóstico internacional (IPI) de riesgo bajo quizás evolucionen bien cuando se difiere el tratamiento inicial.[58,59][Nivel de evidencia C3] No hay un abordaje estándar para el LCM. Se han usado varios regímenes de quimioterapia de inducción para la enfermedad progresiva sintomática. Estos regímenes varían en intensidad: rituximab solo, rituximab con ibrutinib, rituximab y bendamustina, R-CHOP o regímenes intensivos de dosis altas, como R-hiper-CVAD (rituximab con dosis hiperfraccionadas de ciclofosfamida, vincristina, doxorrubicina y dexametasona alternadas con metotrexato y citarabina). Después de estos regímenes, algunos médicos usan un TCM autógeno o alogénico para la consolidación, mientras que otros prefieren el mantenimiento con rituximab y reservan la consolidación con dosis altas para más adelante.[60] El ibrutinib, la lenalidomida y el bortezomib han mostrado actividad en pacientes con recaídas, y ahora estos medicamentos se incorporan al tratamiento inicial.[61-66]
No está claro qué abordaje terapéutico se traduce en la mejor supervivencia a largo plazo para esta entidad clinicopatológica.
En un ensayo de fase II de pacientes mayores de 64 años con LCM no tratado, 50 pacientes recibieron el inhibidor del receptor de células B, ibrutinib con rituximab. Al cabo de una mediana de seguimiento de 45 meses, la tasa de respuesta general fue del 96 %, la tasa de respuesta completa fue del 71 %, la tasa de SSP a 3 años fue del 87 % y la tasa de SG a 3 años fue del 94 %.[66][Nivel de evidencia C3] En un ensayo de fase II de 131 pacientes de 65 años o menos con LCM no tratado, la administración durante 1 año de ibrutinib y 4 semanas de rituximab, produjo una tasa de respuesta completa del 89 % antes de cualquier tipo de consolidación con quimioterapia.[67][Nivel de evidencia C3] En otro ensayo de fase II con ibrutinib y rituximab se incluyó a pacientes asintomáticos con LCM no tratado; la tasa de respuesta completa fue del 87 %.[68][Nivel de evidencia C3] Los pacientes con tratamiento previo que recibieron ibrutinib tuvieron una tasa de respuesta del 86 % (tasa de respuesta completa del 21 %) y una mediana de SSP de 14 meses.[63][Nivel de evidencia C3] En un ensayo prospectivo aleatorizado, 280 pacientes con LCM en recaída o resistente al tratamiento recibieron ibrutinib o temsirólimus.[69] Después de una mediana de seguimiento de 15 meses, la mediana de SSP favoreció al ibrutinib (14,6 vs. 6,2 meses; cociente de riesgos instantáneos [CRI], 0,43; IC 95 %, 0,32–0,58, P < 0,001).[69][Nivel de evidencia B1] En un estudio de fase II de 23 pacientes con LCM en recaída o resistente al tratamiento, se combinó el ibrutinib con otro fármaco activo, venetoclax.[70] Se obtuvieron resultados sin precedentes: un 71 % de los pacientes tuvo una respuesta completa y, de ellos, el 78 % mantuvo la respuesta al cabo de 15 meses.[70][Nivel de evidencia C3]
En un ensayo aleatorizado prospectivo se incluyeron 523 pacientes de 65 años o más con LCM. Los pacientes se asignaron de manera aleatoria para recibir ibrutinib, bendamustina y rituximab o bendamustina y rituximab solos.[71] Después de una mediana de seguimiento de 84,7 meses, la mediana de SSP fue de 80,6 meses para los pacientes que recibieron ibrutinib y de 52,9 meses para los pacientes que recibieron bendamustina y rituximab solos (CRI, 0,75; IC 95 %, 0,59–0,96; P = 0,01). No hubo diferencia en la tasa de SG a 7 años (55,0 vs. 56,8 %; CRI, 1,07; IC 95 %, 0,81–1,40).[71][Nivel de evidencia B1] No está claro si los pacientes que reciben ibrutinib solo podrían lograr estos mismos resultados sin recibir quimioterapia convencional. La magnitud del beneficio que se observó en los resultados para la SSP contrastó con el beneficio insuficiente para la SG después de 7 años, lo que podría poner en duda la inocuidad a largo plazo de esta combinación.
En un ensayo prospectivo aleatorizado, 560 pacientes mayores de 60 años que no eran aptos para un TCM recibieron R-CHOP o R-FC (rituximab, fludarabina y ciclofosfamida) durante 6 a 8 ciclos, luego los pacientes que respondieron se asignaron en forma aleatoria a terapia de mantenimiento con rituximab o interferón α.[72] Al cabo de una mediana de seguimiento de 7,6 años, la mediana de SG fue significativamente más corta después de R-FC que después de R-CHOP (3,9 vs. 6,4 años; P = 0,0054).[72][Nivel de evidencia A1] En el mismo ensayo, al cabo de una mediana de seguimiento de 8 años en los 316 pacientes que respondieron, el mantenimiento con rituximab mejoró la SG en comparación con el mantenimiento con interferón (mediana de SG, 9,8 vs. 7,1 años; P = 0,009).[72][Nivel de evidencia A1] Los pacientes que respondieron a R-CHOP se beneficiaron más del rituximab en la SG (mediana, 9,8 vs. 6,4 años; P = 0,0026).[72][Nivel de evidencia C1] En un ensayo aleatorizado, se comparó bendamustina y rituximab (BR) con R-CHOP y se observó una mejora de la SSP (35 vs. 22 meses; CRI, 0,49; IC 95 %, 0,28–0,79;P = 0,004), pero ninguna diferencia en la SG.[73][Nivel de evidencia B1] Sin embargo, en este ensayo no se observó ningún beneficio para el mantenimiento del rituximab después de BR. En un ensayo prospectivo aleatorizado de 487 pacientes, se comparó el régimen VR-CAP (bortezomib, rituximab, ciclofosfamida, doxorrubicina y prednisona) con R-CHOP.[74] Al cabo de una mediana de seguimiento de 82 meses, la mediana de SG fue superior para VR-CAP (90,7 meses) en comparación con R-CHOP (55,7 meses) (CRI, 0,66; IC 95 %, 0,51−0,85; P = 0,001).[74][Nivel de evidencia A1]
En un ensayo prospectivo aleatorizado con 497 pacientes menores de 65 años se compararon 6 ciclos de R-CHOP y 6 ciclos alternados de R-CHOP con R-DHAP (rituximab, dexametasona, citarabina y cisplatino); ambos grupos recibieron un TCM autógeno.[75,76][Nivel de evidencia B1] Al cabo de una mediana de seguimiento de 10,6 años, la tasa de SSP a 10 años fue del 73 % en los pacientes que recibieron R-DHAP y del 57 % en los que recibieron R-CHOP (CRI, 0,56; P = 0,038), pero no hubo diferencias en las tasas de SG a 10 años (60 % [R-DHAP] vs. 55 % [R-CHOP]; CRI, 0,80; 0,61–1,06; P = 0,12).[77][Nivel de evidencia B1] Este es el ensayo aleatorizado al que se hace referencia en todos los artículos subsiguientes en el que se establece una función de la citarabina en la terapia de inducción; la falta definitiva de ventaja en la supervivencia pone en duda esta afirmación.
En los ensayos aleatorizados no se han confirmado los beneficios para la SG en los pacientes que reciben terapia de consolidación con TCM autógeno o alogénico desde que se empezó a usar el rituximab.[78-83] En un análisis retrospectivo de 1265 pacientes menores de 65 años aptos para trasplante, no se observó ningún beneficio del TCM autógeno en el tiempo hasta el siguiente tratamiento (CRI, 0,84; IC 95 %, 0,68–1,03) ni en la SG (CRI, 0,86; IC 95 %, 0,63–1,18).[84][Nivel de evidencia C3] En este mismo análisis retrospectivo de cohortes del mundo real se encontró beneficio para el mantenimiento con rituximab (después de la inducción de BR) en el tiempo hasta el siguiente tratamiento (CRI, 1,96; IC 95 %, 1,61–2,38; P < 0,001) y la SG (CRI, 1,51; IC 95 %, 1,19–1,92; P < 0,001).[84][Nivel de evidencia C3]
En un ensayo prospectivo (NCT00921414) de 299 pacientes con LCM no tratado, 257 pacientes que respondieron recibieron 4 ciclos de R-DHAP y un TCM autógeno. Los pacientes se asignaron de manera aleatoria para recibir terapia de mantenimiento con rituximab por 3 años versus ninguna terapia de mantenimiento. Después de la aleatorización y al cabo de una mediana de seguimiento de 7,5 años, la tasa de SG a 7 años favoreció al grupo de mantenimiento de rituximab en un 83 % (IC 95 %, 74,7–89,0 %) versus el grupo sin mantenimiento en un 72 % (IC 95 %, 62,9–79,5 %) (CRI, 0,63; IC 95 %, 0,37–1,08).[85][Nivel de evidencia A1] La tasa de SSP a 7 años fue del 78,5 % en el grupo de rituximab con mantenimiento (IC 95 %, 69,9–85,0 %) y del 47,4 % en el grupo sin mantenimiento (IC 95 %, 39,9–56,3 %) (CRI, 0,36; IC 95 %, 0,23–0,56; P < 0,0001).[85]
La lenalidomida con o sin rituximab también produce tasas de respuesta de alrededor del 50 % en pacientes en recaída, y tasas de respuesta incluso más altas en pacientes sin tratamiento previo.[62,65,86,87][Nivel de evidencia C3]
El acalabrutinib (otro inhibidor del receptor de células B de la vía de la tirosina–cinasa de Bruton [BTK]) se estudió en 124 pacientes con LCM en recaída o resistente al tratamiento.[88] En un estudio de fase II, la tasa de respuesta general fue del 81 %, la tasa de respuesta completa fue del 40 %, y la tasa de SSP a 1 año fue del 67 %.[88][Nivel de evidencia C3] Asimismo, en un estudio de fase II de 86 pacientes con LCM en recaída o resistente al tratamiento, se evaluó el inhibidor de BTK zanubrutinib.[89] Después de una mediana de seguimiento de 35,3 meses, la tasa de respuesta general fue del 84 %, la tasa de respuesta completa fue del 78 % y la mediana de SSP fue de 33,0 meses.[89][Nivel de evidencia C3]
Los pacientes con LCM en recaída o resistente al tratamiento cuya enfermedad no respondió al ibrutinib o acalabrutinib se inscribieron en un ensayo de fase II (ZUMA-2 [NCT02601313]) de brexucabtagén autoleucel, una terapia de células T con CAR anti-CD19.[90] Al cabo de una mediana de seguimiento de 36 meses, 68 pacientes tuvieron una tasa de respuesta objetiva del 91 % (IC 95 %, 82−97 %) y una tasa de respuesta completa del 68 % (IC 95 %, 55−78 %). Las medianas de SSP y de SG fueron de 25,8 meses (IC 95 %, 10–48) y de 46,6 meses (IC 95 %, 24,9–no estimable), respectivamente.[90][Nivel de evidencia C3] De los pacientes, el 15 % presentó un síndrome de liberación de citocinas de grado 3 o superior, y el 31 % de los pacientes presentó complicaciones neurológicas. En una evaluación retrospectiva posterior hecha en 16 instituciones, se incluyeron 168 pacientes que recibieron brexucabtagén autoleucel como parte del U.S. Lymphoma CAR-T Consortium. En el estudio se observaron resultados similares a los del ensayo ZUMA-2.[91][Nivel de evidencia C3]
Los pacientes con LCM en recaída o resistente al tratamiento que habían recibido una mediana de 3 líneas previas de tratamiento se inscribieron en un ensayo de fase I (TRANSCEND-NHL-001 [NCT02631044]) de lisocabtagén maraleucel (liso-cel), una terapia de células T con CAR anti-CD19.[92] Al cabo de una mediana de seguimiento de 16,1 meses, 68 pacientes tuvieron una tasa de respuesta objetiva del 83,1 % (IC 95 %, 73,3–90,5%) y una tasa de respuesta completa del 72,3 % (IC 95 %, 61,4–81,6 %). La mediana de duración de la respuesta fue de 15,7 meses (IC 95 %, 6,2–24,0).[92][Nivel de evidencia C3] Se notificó síndrome de liberación de citocinas en el 61 % de los pacientes, pero solo el 1 % presentó gravedad de grado 3 o 4.
El inhibidor de BTK reversible, no covalente, pirtobrutinib, se evaluó en un estudio de fase I/II de 164 pacientes con LCM. En este estudio, 79 pacientes (87 %) recibieron al menos una dosis de la dosis recomendada de fase II de 200 mg una vez al día. Entre 90 pacientes tratados antes con inhibidores covalentes de BTK incluidos en la cohorte de eficacia primaria, la tasa de respuesta general fue del 57,8 % (IC 95 %, 46,9–68,1 %), que incluyó una tasa de respuesta completa del 20,0 %. Al cabo de una mediana de seguimiento de 12 meses, la mediana de duración de la respuesta fue de 21,6 meses (IC 95 %, 7,5–no alcanzado). En la cohorte de inocuidad de 164 pacientes con LCM, los eventos adversos emergentes del tratamiento más comunes fueron fatiga (29,9 %), diarrea (21,3 %) y disnea (16,5 %). Se presentó hemorragia de grado 3 o superior en el 3,7 % de los pacientes y fibrilación o aleteo auricular en el 1,2 %. Solo el 3 % de los pacientes interrumpió el tratamiento con pirtobrutinib debido a un evento adverso relacionado con el tratamiento.[93][Nivel de evidencia C3] La Administración de Alimentos y Medicamentos de los Estados Unidos aprobó el pirtobrutinib para pacientes que recibieron al menos dos líneas de tratamiento previas, incluso otro inhibidor de BTK.
En síntesis, la secuenciación óptima de estas terapias diversas no está clara y es objeto de un ensayo clínico intergrupal en curso. Rituximab, lenalidomida, ibrutinib, acalabrutinib, zanubrutinib, pirtobrutinib y venetoclax son fármacos biológicos dirigidos que a veces conducen a estrategias de tratamiento sin quimioterapia para los pacientes con LCM.[94] La mayoría de los estudios respaldan la terapia de mantenimiento con rituximab durante 2 a 3 años después de la terapia de inducción (con consolidación o sin esta).[72,84,95,96]
En ningún ensayo prospectivo aleatorizado se ha estudiado la administración rutinaria de profilaxis del sistema nervioso central (SNC) en el LCM de riesgo alto. El uso de metotrexato intratecal o de dosis altas y el uso de terapias sistémicas con penetración en el SNC, como el ibrutinib, la citarabina en dosis altas o el venetoclax, no se ha estudiado ni se ha comprobado su eficacia en esta situación.[52]
Fuera del contexto de los ensayos clínicos, no se ha demostrado que el uso de pruebas de enfermedad residual medible (ERM) sea predictivo para dirigir el tratamiento de pacientes con LCM. En un análisis retrospectivo de un ensayo clínico prospectivo aleatorizado, si bien la negatividad de la ERM fue pronóstica para el valor del rituximab de mantenimiento en el LCM, el mantenimiento con rituximab prolongó la SSP y la SG en la mayoría de los pacientes con enfermedad negativa para ERM.[97][Nivel de evidencia C1] La interrupción del mantenimiento con rituximab no se indicó en pacientes con enfermedad negativa para ERM, lo que invalidó cualquier posible cambio en el tratamiento según ese estado.
Linfoma de Burkitt o linfoma difuso de células pequeñas no hendidas
El linfoma de Burkitt o el linfoma difuso de células pequeñas no hendidas por lo general afecta a pacientes más jóvenes y es el tipo más común de LNH en pediatría.[98] Estos tipos de linfomas extraganglionares de células B de crecimiento rápido se caracterizan por la translocación y desregulación del gen MYC en el cromosoma 8.[99] Un subgrupo de pacientes con translocación doble de MYC y BCL2 tuvieron un desenlace muy precario a pesar del tratamiento intensivo (mediana de SG, 5 meses).[100][Nivel de evidencia C1]
En algunos pacientes con células B más grandes hay una superposición morfológica con el LDCBG. Estos linfomas de células grandes de tipo Burkitt exhiben una desregulación de MYC, tasas de proliferación muy altas y un perfil de expresión génica compatible con el linfoma de Burkitt clásico.[101-103] En casos endémicos, a menudo en África, hay compromiso de los huesos faciales o maxilares en los niños, y en su mayoría contienen genomas del virus de Epstein-Barr (VEB). Los casos esporádicos suelen afectar el aparato digestivo, los ovarios o los riñones. Los pacientes presentan masas de crecimiento rápido y una concentración muy alta de lactato–deshidrogenasa (LDH), pero en algunos casos se curan con quimioterapia combinada intensiva a base de doxorrubicina.
Abordajes terapéuticos
El tratamiento del linfoma de Burkitt o el linfoma difuso de células pequeñas no hendidas incluye regímenes multifarmacológicos intensivos en combinación con rituximab, similares a los que se usan para los linfomas de crecimiento rápido en estadios avanzados (LDCBG).[104-107] Una quimioterapia combinada intensiva, como la que se utiliza para el linfoma de Burkitt infantil resultó muy exitosa en los pacientes adultos con enfermedad en estadio avanzado, que lograron una supervivencia sin enfermedad a 5 años superior al 60 %.[108-111] Los factores pronósticos adversos incluyen enfermedad abdominal voluminosa y concentración sérica alta de LDH. Los pacientes con linfoma de Burkitt tienen un riesgo de por vida del 20 % al 30 % de compromiso del SNC. Se necesita profilaxis con quimioterapia intratecal durante la terapia de inducción.[112] Los pacientes con linfoma de Burkitt relacionado con el virus de la inmunodeficiencia humana (VIH) también se benefician de una modificación menos tóxica de los regímenes multifarmacológicos intensivos en combinación con rituximab.[113][Nivel de evidencia C3] Para obtener más información, consultar Tratamiento del linfoma primario del sistema nervioso central y Tratamiento del linfoma relacionado con el SIDA.
Linfoma linfoblástico de células B
El linfoma linfoblástico de células B (células T precursoras) es una forma muy maligna de LNH. El tratamiento por lo general es similar al de la leucemia linfoblástica aguda. La quimioterapia combinada intensiva con trasplante de médula ósea o sin este es el tratamiento estándar para este tipo histológico muy maligno de LNH.[114-116] A veces, se administra radioterapia dirigida a las áreas con masas tumorales voluminosas. Debido a que estas formas de LNH tienden a progresar rápido, la quimioterapia combinada se administra de inmediato una vez que se confirma el diagnóstico. Los aspectos más importantes de la evaluación de estadificación antes del tratamiento incluyen una revisión minuciosa de las piezas patológicas, las muestras de aspirado de la médula ósea, las muestras de biopsias, las pruebas citológicas del líquido cefalorraquídeo y de los marcadores de linfocitos. Para obtener más información, consultar Tratamiento de la leucemia linfoblástica aguda.
Linfoma primario de efusiones
El linfoma primario de efusiones casi siempre ocurre en la cavidad pleural, pericárdica o abdominal en ausencia de una masa tumoral identificable.[117] A menudo los pacientes son seropositivos para el VIH y, por lo general, el tumor contiene el virus del herpes relacionado con el sarcoma de Kaposi o el virus del herpes humano 8.[118]
Pronóstico
El pronóstico del linfoma primario de efusiones es muy precario.
Abordajes terapéuticos
El tratamiento suele ser similar al de los linfomas difusos de células grandes en estadio comparable.
Linfoma plasmoblástico
El linfoma plasmoblástico (plasmablástico) se observa con más frecuencia en pacientes con infección por el VIH y suele contener células B grandes negativas para CD20 con características plasmacíticas. Este tipo de linfoma tiene una evolución clínica muy maligna, con respuestas precarias y remisiones cortas a la quimioterapia estándar.[119] Hay informes esporádicos en los que se indica que a veces es posible administrar la quimioterapia intensiva que se usa para el linfoma de Burkitt o el linfoma linfoblástico, seguida de consolidación con TCM en los pacientes que responden a esta.[119-121]
Trastorno linfoproliferativo postrasplante polimórfico
Los pacientes sometidos a trasplante de corazón, pulmón, hígado, riñón o páncreas suelen necesitar inmunodepresión de por vida. Esto a veces produce un trastorno linfoproliferativo postrasplante (TLPT) en el 1 % al 3 % de los receptores; el cual es similar a un linfoma de crecimiento rápido.[122] Los patólogos pueden diferenciar la hiperplasia policlonal de células B y el linfoma monoclonal de células B que casi siempre se relacionan con el VEB.[123]
Pronóstico
Los factores de pronóstico precario del TLPT son el estado funcional deficiente, el compromiso del órgano trasplantado, un índice pronóstico internacional alto, una LDH elevada y enfermedad en múltiples sitios.[124,125]
Opciones de tratamiento
En algunos casos la interrupción del tratamiento inmunodepresor lleva a la erradicación del linfoma.[126,127] Cuando esto no es exitoso ni posible, se considera el uso de un curso de rituximab, ya que ha mostrado remisiones duraderas en alrededor de un 60 % de los pacientes y tiene un perfil de toxicidad favorable.[126,128,129] Si estas medidas fracasan, se recomienda la quimioterapia combinada a base de doxorrubicina (R-CHOP), aunque en algunos pacientes es posible evitar el tratamiento citotóxico.[129,130] Las presentaciones localizadas se pueden controlar con cirugía o radioterapia sola. Estas masas localizadas, que a veces crecen durante meses, a menudo tienen un fenotipo policlonal y tienden a surgir en el transcurso de semanas o pocos meses tras el trasplante.[123] La enfermedad multifocal rápidamente progresiva se presenta de manera más tardía después del trasplante (>1 año), a menudo tiene un fenotipo monoclonal y se relaciona con el VEB.[131] Estos pacientes en ocasiones presentan remisiones prolongadas con los regímenes de quimioterapia estándar que se usan para el linfoma de crecimiento rápido.[131-133] Los casos de TLPT negativo para VEB se presentan todavía más tarde (mediana de 5 años después del trasplante) y tienen un pronóstico más precario; en estas circunstancias la administración directa de quimioterapia R-CHOP es posible.[134] En pacientes con una enfermedad resistente a la quimioterapia se obtuvo una respuesta clínica sostenida con una inmunotoxina (un antígeno de superficie de las células B anti-CD22 unido a ricina, una toxina vegetal).[135] También está en evaluación clínica un anticuerpo monoclonal anti-interleucina 6.[136]
Granulomatosis linfomatoide
La granulomatosis linfomatoide es un linfoma de células B grandes positivo para el VEB con un fondo predominante de células T.[137,138] En el examen histológico se observa angioinvasión y vasculitis que a menudo se manifiestan como lesiones pulmonares o compromiso de los senos paranasales.
Los pacientes se tratan como los que tienen linfoma difuso de células grandes y necesitan quimioterapia combinada a base de doxorrubicina.
Bibliografía
- Sehn LH, Salles G: Diffuse Large B-Cell Lymphoma. N Engl J Med 384 (9): 842-858, 2021. [PUBMED Abstract]
- Delabie J, Vandenberghe E, Kennes C, et al.: Histiocyte-rich B-cell lymphoma. A distinct clinicopathologic entity possibly related to lymphocyte predominant Hodgkin's disease, paragranuloma subtype. Am J Surg Pathol 16 (1): 37-48, 1992. [PUBMED Abstract]
- Achten R, Verhoef G, Vanuytsel L, et al.: T-cell/histiocyte-rich large B-cell lymphoma: a distinct clinicopathologic entity. J Clin Oncol 20 (5): 1269-77, 2002. [PUBMED Abstract]
- Bouabdallah R, Mounier N, Guettier C, et al.: T-cell/histiocyte-rich large B-cell lymphomas and classical diffuse large B-cell lymphomas have similar outcome after chemotherapy: a matched-control analysis. J Clin Oncol 21 (7): 1271-7, 2003. [PUBMED Abstract]
- Ghesquières H, Berger F, Felman P, et al.: Clinicopathologic characteristics and outcome of diffuse large B-cell lymphomas presenting with an associated low-grade component at diagnosis. J Clin Oncol 24 (33): 5234-41, 2006. [PUBMED Abstract]
- Miller TP, Dahlberg S, Cassady JR, et al.: Chemotherapy alone compared with chemotherapy plus radiotherapy for localized intermediate- and high-grade non-Hodgkin's lymphoma. N Engl J Med 339 (1): 21-6, 1998. [PUBMED Abstract]
- Coiffier B, Lepage E, Briere J, et al.: CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma. N Engl J Med 346 (4): 235-42, 2002. [PUBMED Abstract]
- Coiffier B: State-of-the-art therapeutics: diffuse large B-cell lymphoma. J Clin Oncol 23 (26): 6387-93, 2005. [PUBMED Abstract]
- Habermann TM, Weller EA, Morrison VA, et al.: Rituximab-CHOP versus CHOP alone or with maintenance rituximab in older patients with diffuse large B-cell lymphoma. J Clin Oncol 24 (19): 3121-7, 2006. [PUBMED Abstract]
- Tilly H, Morschhauser F, Sehn LH, et al.: Polatuzumab Vedotin in Previously Untreated Diffuse Large B-Cell Lymphoma. N Engl J Med 386 (4): 351-363, 2022. [PUBMED Abstract]
- Scott DW, King RL, Staiger AM, et al.: High-grade B-cell lymphoma with MYC and BCL2 and/or BCL6 rearrangements with diffuse large B-cell lymphoma morphology. Blood 131 (18): 2060-2064, 2018. [PUBMED Abstract]
- Horn H, Ziepert M, Becher C, et al.: MYC status in concert with BCL2 and BCL6 expression predicts outcome in diffuse large B-cell lymphoma. Blood 121 (12): 2253-63, 2013. [PUBMED Abstract]
- Staiger AM, Ziepert M, Horn H, et al.: Clinical Impact of the Cell-of-Origin Classification and the MYC/ BCL2 Dual Expresser Status in Diffuse Large B-Cell Lymphoma Treated Within Prospective Clinical Trials of the German High-Grade Non-Hodgkin's Lymphoma Study Group. J Clin Oncol 35 (22): 2515-2526, 2017. [PUBMED Abstract]
- Howlett C, Snedecor SJ, Landsburg DJ, et al.: Front-line, dose-escalated immunochemotherapy is associated with a significant progression-free survival advantage in patients with double-hit lymphomas: a systematic review and meta-analysis. Br J Haematol 170 (4): 504-14, 2015. [PUBMED Abstract]
- Sesques P, Johnson NA: Approach to the diagnosis and treatment of high-grade B-cell lymphomas with MYC and BCL2 and/or BCL6 rearrangements. Blood 129 (3): 280-288, 2017. [PUBMED Abstract]
- Landsburg DJ, Falkiewicz MK, Maly J, et al.: Outcomes of Patients With Double-Hit Lymphoma Who Achieve First Complete Remission. J Clin Oncol 35 (20): 2260-2267, 2017. [PUBMED Abstract]
- Canellos GP: CHOP may have been part of the beginning but certainly not the end: issues in risk-related therapy of large-cell lymphoma. J Clin Oncol 15 (5): 1713-6, 1997. [PUBMED Abstract]
- Herrera AF, Mei M, Low L, et al.: Relapsed or Refractory Double-Expressor and Double-Hit Lymphomas Have Inferior Progression-Free Survival After Autologous Stem-Cell Transplantation. J Clin Oncol 35 (1): 24-31, 2017. [PUBMED Abstract]
- Sha C, Barrans S, Cucco F, et al.: Molecular High-Grade B-Cell Lymphoma: Defining a Poor-Risk Group That Requires Different Approaches to Therapy. J Clin Oncol 37 (3): 202-212, 2019. [PUBMED Abstract]
- Soumerai JD, Rosenthal A, Harkins S, et al.: Next-generation ALK inhibitors are highly active in ALK-positive large B-cell lymphoma. Blood 140 (16): 1822-1826, 2022. [PUBMED Abstract]
- Hu S, Xu-Monette ZY, Balasubramanyam A, et al.: CD30 expression defines a novel subgroup of diffuse large B-cell lymphoma with favorable prognosis and distinct gene expression signature: a report from the International DLBCL Rituximab-CHOP Consortium Program Study. Blood 121 (14): 2715-24, 2013. [PUBMED Abstract]
- Maurer MJ, Ghesquières H, Jais JP, et al.: Event-free survival at 24 months is a robust end point for disease-related outcome in diffuse large B-cell lymphoma treated with immunochemotherapy. J Clin Oncol 32 (10): 1066-73, 2014. [PUBMED Abstract]
- Savage KJ: Primary mediastinal large B-cell lymphoma. Blood 140 (9): 955-970, 2022. [PUBMED Abstract]
- van Besien K, Kelta M, Bahaguna P: Primary mediastinal B-cell lymphoma: a review of pathology and management. J Clin Oncol 19 (6): 1855-64, 2001. [PUBMED Abstract]
- Dunleavy K, Wilson WH: Primary mediastinal B-cell lymphoma and mediastinal gray zone lymphoma: do they require a unique therapeutic approach? Blood 125 (1): 33-9, 2015. [PUBMED Abstract]
- Dunleavy K, Pittaluga S, Maeda LS, et al.: Dose-adjusted EPOCH-rituximab therapy in primary mediastinal B-cell lymphoma. N Engl J Med 368 (15): 1408-16, 2013. [PUBMED Abstract]
- Savage KJ, Yenson PR, Shenkier T, et al.: The outcome of primary mediastinal large B-cell lymphoma in the R-CHOP treatment era. [Abstract] Blood 120 (21): A-303, 2012.
- Vassilakopoulos TP, Pangalis GA, Katsigiannis A, et al.: Rituximab, cyclophosphamide, doxorubicin, vincristine, and prednisone with or without radiotherapy in primary mediastinal large B-cell lymphoma: the emerging standard of care. Oncologist 17 (2): 239-49, 2012. [PUBMED Abstract]
- Rieger M, Osterborg A, Pettengell R, et al.: Primary mediastinal B-cell lymphoma treated with CHOP-like chemotherapy with or without rituximab: results of the Mabthera International Trial Group study. Ann Oncol 22 (3): 664-70, 2011. [PUBMED Abstract]
- Gleeson M, Hawkes EA, Cunningham D, et al.: Rituximab, cyclophosphamide, doxorubicin, vincristine and prednisolone (R-CHOP) in the management of primary mediastinal B-cell lymphoma: a subgroup analysis of the UK NCRI R-CHOP 14 versus 21 trial. Br J Haematol 175 (4): 668-672, 2016. [PUBMED Abstract]
- Held G, Thurner L, Poeschel V, et al.: Role of radiotherapy and dose-densification of R-CHOP in primary mediastinal B-cell lymphoma: A subgroup analysis of the unfolder trial of the German Lymphoma Alliance (GLA). [Abstract] J Clin Oncol 38 (Suppl 15): A-8041, 2021.
- Martelli M, Ceriani L, Zucca E, et al.: [18F]fluorodeoxyglucose positron emission tomography predicts survival after chemoimmunotherapy for primary mediastinal large B-cell lymphoma: results of the International Extranodal Lymphoma Study Group IELSG-26 Study. J Clin Oncol 32 (17): 1769-75, 2014. [PUBMED Abstract]
- Zinzani PL, Broccoli A, Casadei B, et al.: The role of rituximab and positron emission tomography in the treatment of primary mediastinal large B-cell lymphoma: experience on 74 patients. Hematol Oncol 33 (4): 145-50, 2015. [PUBMED Abstract]
- Ceriani L, Martelli M, Conconi A, et al.: Prognostic models for primary mediastinal (thymic) B-cell lymphoma derived from 18-FDG PET/CT quantitative parameters in the International Extranodal Lymphoma Study Group (IELSG) 26 study. Br J Haematol 178 (4): 588-591, 2017. [PUBMED Abstract]
- Hayden AR, Tonseth P, Lee DG, et al.: Outcome of primary mediastinal large B-cell lymphoma using R-CHOP: impact of a PET-adapted approach. Blood 136 (24): 2803-2811, 2020. [PUBMED Abstract]
- Zinzani PL, Santoro A, Gritti G, et al.: Nivolumab Combined With Brentuximab Vedotin for Relapsed/Refractory Primary Mediastinal Large B-Cell Lymphoma: Efficacy and Safety From the Phase II CheckMate 436 Study. J Clin Oncol 37 (33): 3081-3089, 2019. [PUBMED Abstract]
- Zinzani PL, Thieblemont C, Melnichenko V, et al.: Pembrolizumab in relapsed or refractory primary mediastinal large B-cell lymphoma: final analysis of KEYNOTE-170. Blood 142 (2): 141-145, 2023. [PUBMED Abstract]
- Abramson JS, Palomba ML, Gordon LI, et al.: Lisocabtagene maraleucel for patients with relapsed or refractory large B-cell lymphomas (TRANSCEND NHL 001): a multicentre seamless design study. Lancet 396 (10254): 839-852, 2020. [PUBMED Abstract]
- Shimada K, Matsue K, Yamamoto K, et al.: Retrospective analysis of intravascular large B-cell lymphoma treated with rituximab-containing chemotherapy as reported by the IVL study group in Japan. J Clin Oncol 26 (19): 3189-95, 2008. [PUBMED Abstract]
- Ponzoni M, Ferreri AJ, Campo E, et al.: Definition, diagnosis, and management of intravascular large B-cell lymphoma: proposals and perspectives from an international consensus meeting. J Clin Oncol 25 (21): 3168-73, 2007. [PUBMED Abstract]
- Shimada K, Yamaguchi M, Atsuta Y, et al.: Rituximab, cyclophosphamide, doxorubicin, vincristine, and prednisolone combined with high-dose methotrexate plus intrathecal chemotherapy for newly diagnosed intravascular large B-cell lymphoma (PRIMEUR-IVL): a multicentre, single-arm, phase 2 trial. Lancet Oncol 21 (4): 593-602, 2020. [PUBMED Abstract]
- Longo DL: What's the deal with follicular lymphomas? J Clin Oncol 11 (2): 202-8, 1993. [PUBMED Abstract]
- Anderson JR, Vose JM, Bierman PJ, et al.: Clinical features and prognosis of follicular large-cell lymphoma: a report from the Nebraska Lymphoma Study Group. J Clin Oncol 11 (2): 218-24, 1993. [PUBMED Abstract]
- Bartlett NL, Rizeq M, Dorfman RF, et al.: Follicular large-cell lymphoma: intermediate or low grade? J Clin Oncol 12 (7): 1349-57, 1994. [PUBMED Abstract]
- Wendum D, Sebban C, Gaulard P, et al.: Follicular large-cell lymphoma treated with intensive chemotherapy: an analysis of 89 cases included in the LNH87 trial and comparison with the outcome of diffuse large B-cell lymphoma. Groupe d'Etude des Lymphomes de l'Adulte. J Clin Oncol 15 (4): 1654-63, 1997. [PUBMED Abstract]
- Hans CP, Weisenburger DD, Vose JM, et al.: A significant diffuse component predicts for inferior survival in grade 3 follicular lymphoma, but cytologic subtypes do not predict survival. Blood 101 (6): 2363-7, 2003. [PUBMED Abstract]
- Vose JM, Bierman PJ, Lynch JC, et al.: Effect of follicularity on autologous transplantation for large-cell non-Hodgkin's lymphoma. J Clin Oncol 16 (3): 844-9, 1998. [PUBMED Abstract]
- Cohen JB, Zain JM, Kahl BS: Current Approaches to Mantle Cell Lymphoma: Diagnosis, Prognosis, and Therapies. Am Soc Clin Oncol Educ Book 37: 512-525, 2017. [PUBMED Abstract]
- Clot G, Jares P, Giné E, et al.: A gene signature that distinguishes conventional and leukemic nonnodal mantle cell lymphoma helps predict outcome. Blood 132 (4): 413-422, 2018. [PUBMED Abstract]
- Greenwell IB, Staton AD, Lee MJ, et al.: Complex karyotype in patients with mantle cell lymphoma predicts inferior survival and poor response to intensive induction therapy. Cancer 124 (11): 2306-2315, 2018. [PUBMED Abstract]
- Dreyling M, Klapper W, Rule S: Blastoid and pleomorphic mantle cell lymphoma: still a diagnostic and therapeutic challenge! Blood 132 (26): 2722-2729, 2018. [PUBMED Abstract]
- Jain P, Dreyling M, Seymour JF, et al.: High-Risk Mantle Cell Lymphoma: Definition, Current Challenges, and Management. J Clin Oncol 38 (36): 4302-4316, 2020. [PUBMED Abstract]
- Lew TE, Minson A, Dickinson M, et al.: Treatment approaches for patients with TP53-mutated mantle cell lymphoma. Lancet Haematol 10 (2): e142-e154, 2023. [PUBMED Abstract]
- Herrmann A, Hoster E, Zwingers T, et al.: Improvement of overall survival in advanced stage mantle cell lymphoma. J Clin Oncol 27 (4): 511-8, 2009. [PUBMED Abstract]
- Majlis A, Pugh WC, Rodriguez MA, et al.: Mantle cell lymphoma: correlation of clinical outcome and biologic features with three histologic variants. J Clin Oncol 15 (4): 1664-71, 1997. [PUBMED Abstract]
- Tiemann M, Schrader C, Klapper W, et al.: Histopathology, cell proliferation indices and clinical outcome in 304 patients with mantle cell lymphoma (MCL): a clinicopathological study from the European MCL Network. Br J Haematol 131 (1): 29-38, 2005. [PUBMED Abstract]
- Campo E, Raffeld M, Jaffe ES: Mantle-cell lymphoma. Semin Hematol 36 (2): 115-27, 1999. [PUBMED Abstract]
- Martin P, Chadburn A, Christos P, et al.: Outcome of deferred initial therapy in mantle-cell lymphoma. J Clin Oncol 27 (8): 1209-13, 2009. [PUBMED Abstract]
- Cohen JB, Han X, Jemal A, et al.: Deferred therapy is associated with improved overall survival in patients with newly diagnosed mantle cell lymphoma. Cancer 122 (15): 2356-63, 2016. [PUBMED Abstract]
- Gerson JN, Handorf E, Villa D, et al.: Survival Outcomes of Younger Patients With Mantle Cell Lymphoma Treated in the Rituximab Era. J Clin Oncol 37 (6): 471-480, 2019. [PUBMED Abstract]
- Goy A, Kalayoglu Besisik S, Drach J, et al.: Longer-term follow-up and outcome by tumour cell proliferation rate (Ki-67) in patients with relapsed/refractory mantle cell lymphoma treated with lenalidomide on MCL-001(EMERGE) pivotal trial. Br J Haematol 170 (4): 496-503, 2015. [PUBMED Abstract]
- Ruan J, Martin P, Shah B, et al.: Lenalidomide plus Rituximab as Initial Treatment for Mantle-Cell Lymphoma. N Engl J Med 373 (19): 1835-44, 2015. [PUBMED Abstract]
- Wang ML, Rule S, Martin P, et al.: Targeting BTK with ibrutinib in relapsed or refractory mantle-cell lymphoma. N Engl J Med 369 (6): 507-16, 2013. [PUBMED Abstract]
- Wang ML, Blum KA, Martin P, et al.: Long-term follow-up of MCL patients treated with single-agent ibrutinib: updated safety and efficacy results. Blood 126 (6): 739-45, 2015. [PUBMED Abstract]
- Ruan J, Martin P, Christos P, et al.: Five-year follow-up of lenalidomide plus rituximab as initial treatment of mantle cell lymphoma. Blood 132 (19): 2016-2025, 2018. [PUBMED Abstract]
- Jain P, Zhao S, Lee HJ, et al.: Ibrutinib With Rituximab in First-Line Treatment of Older Patients With Mantle Cell Lymphoma. J Clin Oncol 40 (2): 202-212, 2022. [PUBMED Abstract]
- Wang ML, Jain P, Zhao S, et al.: Ibrutinib-rituximab followed by R-HCVAD as frontline treatment for young patients (≤65 years) with mantle cell lymphoma (WINDOW-1): a single-arm, phase 2 trial. Lancet Oncol 23 (3): 406-415, 2022. [PUBMED Abstract]
- Giné E, de la Cruz F, Jiménez Ubieto A, et al.: Ibrutinib in Combination With Rituximab for Indolent Clinical Forms of Mantle Cell Lymphoma (IMCL-2015): A Multicenter, Open-Label, Single-Arm, Phase II Trial. J Clin Oncol 40 (11): 1196-1205, 2022. [PUBMED Abstract]
- Dreyling M, Jurczak W, Jerkeman M, et al.: Ibrutinib versus temsirolimus in patients with relapsed or refractory mantle-cell lymphoma: an international, randomised, open-label, phase 3 study. Lancet 387 (10020): 770-8, 2016. [PUBMED Abstract]
- Tam CS, Anderson MA, Pott C, et al.: Ibrutinib plus Venetoclax for the Treatment of Mantle-Cell Lymphoma. N Engl J Med 378 (13): 1211-1223, 2018. [PUBMED Abstract]
- Wang ML, Jurczak W, Jerkeman M, et al.: Ibrutinib plus Bendamustine and Rituximab in Untreated Mantle-Cell Lymphoma. N Engl J Med 386 (26): 2482-2494, 2022. [PUBMED Abstract]
- Kluin-Nelemans HC, Hoster E, Hermine O, et al.: Treatment of Older Patients With Mantle Cell Lymphoma (MCL): Long-Term Follow-Up of the Randomized European MCL Elderly Trial. J Clin Oncol 38 (3): 248-256, 2020. [PUBMED Abstract]
- Rummel MJ, Niederle N, Maschmeyer G, et al.: Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet 381 (9873): 1203-10, 2013. [PUBMED Abstract]
- Robak T, Jin J, Pylypenko H, et al.: Frontline bortezomib, rituximab, cyclophosphamide, doxorubicin, and prednisone (VR-CAP) versus rituximab, cyclophosphamide, doxorubicin, vincristine, and prednisone (R-CHOP) in transplantation-ineligible patients with newly diagnosed mantle cell lymphoma: final overall survival results of a randomised, open-label, phase 3 study. Lancet Oncol 19 (11): 1449-1458, 2018. [PUBMED Abstract]
- Hermine O, Hoster E, Walewski J, et al.: Addition of high-dose cytarabine to immunochemotherapy before autologous stem-cell transplantation in patients aged 65 years or younger with mantle cell lymphoma (MCL Younger): a randomised, open-label, phase 3 trial of the European Mantle Cell Lymphoma Network. Lancet 388 (10044): 565-75, 2016. [PUBMED Abstract]
- Hermine O, Jiang L, Walewski J, et al.: Addition of high-dose cytarabine to immunochemotherapy before autologous stem-cell transplantation in patients aged 65 years or younger with mantle cell lymphoma (MCL younger): a long-term follow-up of the randomized, open-label, phase 3 trial of the European Mantle Cell Lymphoma Network. [Abstract] Blood 138 (Suppl 1); A-380, 2021.
- Hermine O, Jiang L, Walewski J, et al.: High-Dose Cytarabine and Autologous Stem-Cell Transplantation in Mantle Cell Lymphoma: Long-Term Follow-Up of the Randomized Mantle Cell Lymphoma Younger Trial of the European Mantle Cell Lymphoma Network. J Clin Oncol 41 (3): 479-484, 2023. [PUBMED Abstract]
- Khouri IF, Lee MS, Saliba RM, et al.: Nonablative allogeneic stem-cell transplantation for advanced/recurrent mantle-cell lymphoma. J Clin Oncol 21 (23): 4407-12, 2003. [PUBMED Abstract]
- Dreyling M, Lenz G, Hoster E, et al.: Early consolidation by myeloablative radiochemotherapy followed by autologous stem cell transplantation in first remission significantly prolongs progression-free survival in mantle-cell lymphoma: results of a prospective randomized trial of the European MCL Network. Blood 105 (7): 2677-84, 2005. [PUBMED Abstract]
- Geisler CH, Kolstad A, Laurell A, et al.: Long-term progression-free survival of mantle cell lymphoma after intensive front-line immunochemotherapy with in vivo-purged stem cell rescue: a nonrandomized phase 2 multicenter study by the Nordic Lymphoma Group. Blood 112 (7): 2687-93, 2008. [PUBMED Abstract]
- Tam CS, Bassett R, Ledesma C, et al.: Mature results of the M. D. Anderson Cancer Center risk-adapted transplantation strategy in mantle cell lymphoma. Blood 113 (18): 4144-52, 2009. [PUBMED Abstract]
- Damon LE, Johnson JL, Niedzwiecki D, et al.: Immunochemotherapy and autologous stem-cell transplantation for untreated patients with mantle-cell lymphoma: CALGB 59909. J Clin Oncol 27 (36): 6101-8, 2009. [PUBMED Abstract]
- Fenske TS, Zhang MJ, Carreras J, et al.: Autologous or reduced-intensity conditioning allogeneic hematopoietic cell transplantation for chemotherapy-sensitive mantle-cell lymphoma: analysis of transplantation timing and modality. J Clin Oncol 32 (4): 273-81, 2014. [PUBMED Abstract]
- Martin P, Cohen JB, Wang M, et al.: Treatment Outcomes and Roles of Transplantation and Maintenance Rituximab in Patients With Previously Untreated Mantle Cell Lymphoma: Results From Large Real-World Cohorts. J Clin Oncol 41 (3): 541-554, 2023. [PUBMED Abstract]
- Sarkozy C, Thieblemont C, Oberic L, et al.: Long-Term Follow-Up of Rituximab Maintenance in Young Patients With Mantle-Cell Lymphoma Included in the LYMA Trial: A LYSA Study. J Clin Oncol 42 (7): 769-773, 2024. [PUBMED Abstract]
- Wang M, Fayad L, Wagner-Bartak N, et al.: Lenalidomide in combination with rituximab for patients with relapsed or refractory mantle-cell lymphoma: a phase 1/2 clinical trial. Lancet Oncol 13 (7): 716-23, 2012. [PUBMED Abstract]
- Trněný M, Lamy T, Walewski J, et al.: Lenalidomide versus investigator's choice in relapsed or refractory mantle cell lymphoma (MCL-002; SPRINT): a phase 2, randomised, multicentre trial. Lancet Oncol 17 (3): 319-31, 2016. [PUBMED Abstract]
- Wang M, Rule S, Zinzani PL, et al.: Acalabrutinib in relapsed or refractory mantle cell lymphoma (ACE-LY-004): a single-arm, multicentre, phase 2 trial. Lancet 391 (10121): 659-667, 2018. [PUBMED Abstract]
- Song Y, Zhou K, Zou D, et al.: Zanubrutinib in relapsed/refractory mantle cell lymphoma: long-term efficacy and safety results from a phase 2 study. Blood 139 (21): 3148-3158, 2022. [PUBMED Abstract]
- Wang M, Munoz J, Goy A, et al.: Three-Year Follow-Up of KTE-X19 in Patients With Relapsed/Refractory Mantle Cell Lymphoma, Including High-Risk Subgroups, in the ZUMA-2 Study. J Clin Oncol 41 (3): 555-567, 2023. [PUBMED Abstract]
- Wang Y, Jain P, Locke FL, et al.: Brexucabtagene Autoleucel for Relapsed or Refractory Mantle Cell Lymphoma in Standard-of-Care Practice: Results From the US Lymphoma CAR T Consortium. J Clin Oncol 41 (14): 2594-2606, 2023. [PUBMED Abstract]
- Wang M, Siddiqi T, Gordon LI, et al.: Lisocabtagene Maraleucel in Relapsed/Refractory Mantle Cell Lymphoma: Primary Analysis of the Mantle Cell Lymphoma Cohort From TRANSCEND NHL 001, a Phase I Multicenter Seamless Design Study. J Clin Oncol 42 (10): 1146-1157, 2024. [PUBMED Abstract]
- Wang ML, Jurczak W, Zinzani PL, et al.: Pirtobrutinib in Covalent Bruton Tyrosine Kinase Inhibitor Pretreated Mantle-Cell Lymphoma. J Clin Oncol 41 (24): 3988-3997, 2023. [PUBMED Abstract]
- Martin P, Ruan J, Leonard JP: The potential for chemotherapy-free strategies in mantle cell lymphoma. Blood 130 (17): 1881-1888, 2017. [PUBMED Abstract]
- Le Gouill S, Thieblemont C, Oberic L, et al.: Rituximab after Autologous Stem-Cell Transplantation in Mantle-Cell Lymphoma. N Engl J Med 377 (13): 1250-1260, 2017. [PUBMED Abstract]
- Forstpointner R, Unterhalt M, Dreyling M, et al.: Maintenance therapy with rituximab leads to a significant prolongation of response duration after salvage therapy with a combination of rituximab, fludarabine, cyclophosphamide, and mitoxantrone (R-FCM) in patients with recurring and refractory follicular and mantle cell lymphomas: Results of a prospective randomized study of the German Low Grade Lymphoma Study Group (GLSG). Blood 108 (13): 4003-8, 2006. [PUBMED Abstract]
- Hoster E, Delfau-Larue MH, Macintyre E, et al.: Predictive Value of Minimal Residual Disease for Efficacy of Rituximab Maintenance in Mantle Cell Lymphoma: Results From the European Mantle Cell Lymphoma Elderly Trial. J Clin Oncol 42 (5): 538-549, 2024. [PUBMED Abstract]
- Blum KA, Lozanski G, Byrd JC: Adult Burkitt leukemia and lymphoma. Blood 104 (10): 3009-20, 2004. [PUBMED Abstract]
- Onciu M, Schlette E, Zhou Y, et al.: Secondary chromosomal abnormalities predict outcome in pediatric and adult high-stage Burkitt lymphoma. Cancer 107 (5): 1084-92, 2006. [PUBMED Abstract]
- Macpherson N, Lesack D, Klasa R, et al.: Small noncleaved, non-Burkitt's (Burkit-Like) lymphoma: cytogenetics predict outcome and reflect clinical presentation. J Clin Oncol 17 (5): 1558-67, 1999. [PUBMED Abstract]
- Dave SS, Fu K, Wright GW, et al.: Molecular diagnosis of Burkitt's lymphoma. N Engl J Med 354 (23): 2431-42, 2006. [PUBMED Abstract]
- Hummel M, Bentink S, Berger H, et al.: A biologic definition of Burkitt's lymphoma from transcriptional and genomic profiling. N Engl J Med 354 (23): 2419-30, 2006. [PUBMED Abstract]
- Salaverria I, Siebert R: The gray zone between Burkitt's lymphoma and diffuse large B-cell lymphoma from a genetics perspective. J Clin Oncol 29 (14): 1835-43, 2011. [PUBMED Abstract]
- Thomas DA, Faderl S, O'Brien S, et al.: Chemoimmunotherapy with hyper-CVAD plus rituximab for the treatment of adult Burkitt and Burkitt-type lymphoma or acute lymphoblastic leukemia. Cancer 106 (7): 1569-80, 2006. [PUBMED Abstract]
- Dunleavy K, Pittaluga S, Shovlin M, et al.: Low-intensity therapy in adults with Burkitt's lymphoma. N Engl J Med 369 (20): 1915-25, 2013. [PUBMED Abstract]
- Hoelzer D, Walewski J, Döhner H, et al.: Improved outcome of adult Burkitt lymphoma/leukemia with rituximab and chemotherapy: report of a large prospective multicenter trial. Blood 124 (26): 3870-9, 2014. [PUBMED Abstract]
- Ribrag V, Koscielny S, Bosq J, et al.: Rituximab and dose-dense chemotherapy for adults with Burkitt's lymphoma: a randomised, controlled, open-label, phase 3 trial. Lancet 387 (10036): 2402-11, 2016. [PUBMED Abstract]
- Magrath I, Adde M, Shad A, et al.: Adults and children with small non-cleaved-cell lymphoma have a similar excellent outcome when treated with the same chemotherapy regimen. J Clin Oncol 14 (3): 925-34, 1996. [PUBMED Abstract]
- Hoelzer D, Ludwig WD, Thiel E, et al.: Improved outcome in adult B-cell acute lymphoblastic leukemia. Blood 87 (2): 495-508, 1996. [PUBMED Abstract]
- Lee EJ, Petroni GR, Schiffer CA, et al.: Brief-duration high-intensity chemotherapy for patients with small noncleaved-cell lymphoma or FAB L3 acute lymphocytic leukemia: results of cancer and leukemia group B study 9251. J Clin Oncol 19 (20): 4014-22, 2001. [PUBMED Abstract]
- Mead GM, Sydes MR, Walewski J, et al.: An international evaluation of CODOX-M and CODOX-M alternating with IVAC in adult Burkitt's lymphoma: results of United Kingdom Lymphoma Group LY06 study. Ann Oncol 13 (8): 1264-74, 2002. [PUBMED Abstract]
- Rizzieri DA, Johnson JL, Niedzwiecki D, et al.: Intensive chemotherapy with and without cranial radiation for Burkitt leukemia and lymphoma: final results of Cancer and Leukemia Group B Study 9251. Cancer 100 (7): 1438-48, 2004. [PUBMED Abstract]
- Noy A, Lee JY, Cesarman E, et al.: AMC 048: modified CODOX-M/IVAC-rituximab is safe and effective for HIV-associated Burkitt lymphoma. Blood 126 (2): 160-6, 2015. [PUBMED Abstract]
- Verdonck LF, Dekker AW, de Gast GC, et al.: Autologous bone marrow transplantation for adult poor-risk lymphoblastic lymphoma in first remission. J Clin Oncol 10 (4): 644-6, 1992. [PUBMED Abstract]
- Thomas DA, O'Brien S, Cortes J, et al.: Outcome with the hyper-CVAD regimens in lymphoblastic lymphoma. Blood 104 (6): 1624-30, 2004. [PUBMED Abstract]
- Sweetenham JW, Santini G, Qian W, et al.: High-dose therapy and autologous stem-cell transplantation versus conventional-dose consolidation/maintenance therapy as postremission therapy for adult patients with lymphoblastic lymphoma: results of a randomized trial of the European Group for Blood and Marrow Transplantation and the United Kingdom Lymphoma Group. J Clin Oncol 19 (11): 2927-36, 2001. [PUBMED Abstract]
- Nador RG, Cesarman E, Chadburn A, et al.: Primary effusion lymphoma: a distinct clinicopathologic entity associated with the Kaposi's sarcoma-associated herpes virus. Blood 88 (2): 645-56, 1996. [PUBMED Abstract]
- Shimada K, Hayakawa F, Kiyoi H: Biology and management of primary effusion lymphoma. Blood 132 (18): 1879-1888, 2018. [PUBMED Abstract]
- Castillo JJ, Bibas M, Miranda RN: The biology and treatment of plasmablastic lymphoma. Blood 125 (15): 2323-30, 2015. [PUBMED Abstract]
- Al-Malki MM, Castillo JJ, Sloan JM, et al.: Hematopoietic cell transplantation for plasmablastic lymphoma: a review. Biol Blood Marrow Transplant 20 (12): 1877-84, 2014. [PUBMED Abstract]
- Cattaneo C, Re A, Ungari M, et al.: Plasmablastic lymphoma among human immunodeficiency virus-positive patients: results of a single center's experience. Leuk Lymphoma 56 (1): 267-9, 2015. [PUBMED Abstract]
- Morrison VA, Dunn DL, Manivel JC, et al.: Clinical characteristics of post-transplant lymphoproliferative disorders. Am J Med 97 (1): 14-24, 1994. [PUBMED Abstract]
- Knowles DM, Cesarman E, Chadburn A, et al.: Correlative morphologic and molecular genetic analysis demonstrates three distinct categories of posttransplantation lymphoproliferative disorders. Blood 85 (2): 552-65, 1995. [PUBMED Abstract]
- Leblond V, Dhedin N, Mamzer Bruneel MF, et al.: Identification of prognostic factors in 61 patients with posttransplantation lymphoproliferative disorders. J Clin Oncol 19 (3): 772-8, 2001. [PUBMED Abstract]
- Ghobrial IM, Habermann TM, Maurer MJ, et al.: Prognostic analysis for survival in adult solid organ transplant recipients with post-transplantation lymphoproliferative disorders. J Clin Oncol 23 (30): 7574-82, 2005. [PUBMED Abstract]
- Evens AM, David KA, Helenowski I, et al.: Multicenter analysis of 80 solid organ transplantation recipients with post-transplantation lymphoproliferative disease: outcomes and prognostic factors in the modern era. J Clin Oncol 28 (6): 1038-46, 2010. [PUBMED Abstract]
- Dierickx D, Tousseyn T, Gheysens O: How I treat posttransplant lymphoproliferative disorders. Blood 126 (20): 2274-83, 2015. [PUBMED Abstract]
- Kuehnle I, Huls MH, Liu Z, et al.: CD20 monoclonal antibody (rituximab) for therapy of Epstein-Barr virus lymphoma after hemopoietic stem-cell transplantation. Blood 95 (4): 1502-5, 2000. [PUBMED Abstract]
- Trappe RU, Dierickx D, Zimmermann H, et al.: Response to Rituximab Induction Is a Predictive Marker in B-Cell Post-Transplant Lymphoproliferative Disorder and Allows Successful Stratification Into Rituximab or R-CHOP Consolidation in an International, Prospective, Multicenter Phase II Trial. J Clin Oncol 35 (5): 536-543, 2017. [PUBMED Abstract]
- Leblond V, Sutton L, Dorent R, et al.: Lymphoproliferative disorders after organ transplantation: a report of 24 cases observed in a single center. J Clin Oncol 13 (4): 961-8, 1995. [PUBMED Abstract]
- Mamzer-Bruneel MF, Lomé C, Morelon E, et al.: Durable remission after aggressive chemotherapy for very late post-kidney transplant lymphoproliferation: A report of 16 cases observed in a single center. J Clin Oncol 18 (21): 3622-32, 2000. [PUBMED Abstract]
- Swinnen LJ: Durable remission after aggressive chemotherapy for post-cardiac transplant lymphoproliferation. Leuk Lymphoma 28 (1-2): 89-101, 1997. [PUBMED Abstract]
- McCarthy M, Ramage J, McNair A, et al.: The clinical diversity and role of chemotherapy in lymphoproliferative disorder in liver transplant recipients. J Hepatol 27 (6): 1015-21, 1997. [PUBMED Abstract]
- Leblond V, Davi F, Charlotte F, et al.: Posttransplant lymphoproliferative disorders not associated with Epstein-Barr virus: a distinct entity? J Clin Oncol 16 (6): 2052-9, 1998. [PUBMED Abstract]
- Senderowicz AM, Vitetta E, Headlee D, et al.: Complete sustained response of a refractory, post-transplantation, large B-cell lymphoma to an anti-CD22 immunotoxin. Ann Intern Med 126 (11): 882-5, 1997. [PUBMED Abstract]
- Haddad E, Paczesny S, Leblond V, et al.: Treatment of B-lymphoproliferative disorder with a monoclonal anti-interleukin-6 antibody in 12 patients: a multicenter phase 1-2 clinical trial. Blood 97 (6): 1590-7, 2001. [PUBMED Abstract]
- Guinee D, Jaffe E, Kingma D, et al.: Pulmonary lymphomatoid granulomatosis. Evidence for a proliferation of Epstein-Barr virus infected B-lymphocytes with a prominent T-cell component and vasculitis. Am J Surg Pathol 18 (8): 753-64, 1994. [PUBMED Abstract]
- Myers JL, Kurtin PJ, Katzenstein AL, et al.: Lymphomatoid granulomatosis. Evidence of immunophenotypic diversity and relationship to Epstein-Barr virus infection. Am J Surg Pathol 19 (11): 1300-12, 1995. [PUBMED Abstract]
Otros trastornos linfoproliferativos y relacionados
Enfermedad de Castleman
Una biopsia de colecciones localizadas o multifocales de ganglios linfáticos a veces conduce al diagnóstico de enfermedad de Castleman (EC). En sentido estricto, este diagnóstico infrecuente no es un linfoma y tampoco es una neoplasia maligna. Sin embargo, hematólogos u oncólogos atienden y tratan a muchos pacientes con EC.
La EC localizada o unicéntrica suele ser asintomática y se produce en el mediastino, que es la presentación más común de la EC.[1] Para esta forma de crecimiento lento se utiliza la conducta expectante, la cirugía o la radioterapia. La EC multicéntrica (30 % de los pacientes con EC) se presenta con linfadenopatía en múltiples sitios; síntomas como fiebre, sudoración nocturna, pérdida de peso y fatiga; y anomalías de las pruebas de laboratorio como anemia, albúmina baja, proteína C-reactiva elevada y fibrinógeno alto.[1] La EC multicéntrica (ECM) se subdivide en ECM relacionada con el virus del herpes humano 8 (normalmente con infección por el VIH o inmunodeficiencia grave) o ECM idiopática. Las citopenias y la tormenta de citocinas se atribuyen a la sobreproducción de interleucina-6 (IL-6). La ECM es una característica del síndrome POEMS (polineuropatía, organomegalia, endocrinopatía, gammapatía monoclonal y anomalías cutáneas) [2] y el síndrome TAFRO (trombocitopenia, anasarca, fiebre, reticulinofibrosis y organomegalia).[3,4] El tratamiento con siltuximab (un anticuerpo monoclonal anti–IL-6), rituximab (un anticuerpo monoclonal anti-CD20) o quimioterapéuticos se ha notificado en series esporádicas no aleatorizadas.[5-8]
Linfoma histiocítico verdadero
Los linfomas histiocíticos verdaderos producen tumores muy poco frecuentes que exhiben diferenciación histiocítica y expresan marcadores histiocíticos en ausencia de marcadores inmunitarios de linaje específico de células B o T. También se llaman sarcomas histiocíticos o linfomas histiocitarios verdaderos.[9,10] Se debe tener cuidado con las pruebas inmunofenotípicas para excluir el linfoma anaplásico de células grandes y los síndromes hemofagocíticos causados por infecciones víricas, en especial las causadas por el virus de Epstein-Barr.
Opciones de tratamiento
El tratamiento es similar al de los linfomas difusos de células grandes en estadio comparable, pero todavía queda por definir el abordaje óptimo.
Bibliografía
- van Rhee F, Voorhees P, Dispenzieri A, et al.: International, evidence-based consensus treatment guidelines for idiopathic multicentric Castleman disease. Blood 132 (20): 2115-2124, 2018. [PUBMED Abstract]
- Dispenzieri A: POEMS Syndrome: 2019 Update on diagnosis, risk-stratification, and management. Am J Hematol 94 (7): 812-827, 2019. [PUBMED Abstract]
- Zhang Y, Suo SS, Yang HJ, et al.: Clinical features and treatment of 7 Chinese TAFRO syndromes from 96 de novo Castleman diseases: a 10-year retrospective study. J Cancer Res Clin Oncol 146 (2): 357-365, 2020. [PUBMED Abstract]
- Fujimoto S, Sakai T, Kawabata H, et al.: Is TAFRO syndrome a subtype of idiopathic multicentric Castleman disease? Am J Hematol 94 (9): 975-983, 2019. [PUBMED Abstract]
- Tonialini L, Bonfichi M, Ferrero S, et al.: Siltuximab in relapsed/refractory multicentric Castleman disease: Experience of the Italian NPP program. Hematol Oncol 36 (4): 689-692, 2018. [PUBMED Abstract]
- Dong Y, Zhang L, Nong L, et al.: Effectiveness of rituximab-containing treatment regimens in idiopathic multicentric Castleman disease. Ann Hematol 97 (9): 1641-1647, 2018. [PUBMED Abstract]
- Zhang L, Zhao AL, Duan MH, et al.: Phase 2 study using oral thalidomide-cyclophosphamide-prednisone for idiopathic multicentric Castleman disease. Blood 133 (16): 1720-1728, 2019. [PUBMED Abstract]
- van Rhee F, Wong RS, Munshi N, et al.: Siltuximab for multicentric Castleman's disease: a randomised, double-blind, placebo-controlled trial. Lancet Oncol 15 (9): 966-74, 2014. [PUBMED Abstract]
- Soslow RA, Davis RE, Warnke RA, et al.: True histiocytic lymphoma following therapy for lymphoblastic neoplasms. Blood 87 (12): 5207-12, 1996. [PUBMED Abstract]
- Kamel OW, Gocke CD, Kell DL, et al.: True histiocytic lymphoma: a study of 12 cases based on current definition. Leuk Lymphoma 18 (1-2): 81-6, 1995. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento del linfoma no Hodgkin de células B de crecimiento rápido
El tratamiento del linfoma no Hodgkin (LNH) de crecimiento rápido depende del tipo histológico y el estadio. Muchas de las mejoras en la supervivencia se han logrado debido a ensayos clínicos en los que se intentó mejorar el tratamiento convencional o estándar.
En los pacientes asintomáticos con formas de LNH de crecimiento lento en estadio avanzado, es posible diferir el tratamiento hasta que el paciente presente síntomas o la enfermedad progrese. Cuando se difiere el tratamiento, la evolución clínica de los pacientes con LNH de crecimiento lento es variable; se necesita una observación frecuente y cuidadosa para poder iniciar un tratamiento eficaz cuando se acelera la evolución clínica de la enfermedad. Algunos pacientes tienen un período prolongado de enfermedad de crecimiento lento, pero en otros la enfermedad evoluciona rápido a tipos más malignos de LNH, lo que exige un tratamiento inmediato.
Las técnicas de radioterapia son un poco diferentes de las que se utilizan para el tratamiento del linfoma de Hodgkin. La dosis de radioterapia por lo habitual oscila entre 25 Gy y 50 Gy, y depende de factores como el tipo histológico de linfoma, el estadio, el estado general del paciente, el objetivo del tratamiento (curativo o paliativo), la proximidad a órganos circundantes sensibles, y si se usa radioterapia sola o combinada con quimioterapia. Debido a la variedad de presentaciones clínicas de la enfermedad y de la recaída, a veces se incluyen en el tratamiento sitios no habituales, como el anillo de Waldeyer, los ganglios epitrocleares o los ganglios mesentéricos. La morbilidad relacionada con el tratamiento se debe considerar en detalle. La mayoría de los pacientes que reciben radiación se tratan solo en un lado del diafragma. Las presentaciones localizadas del LNH extraganglionar se pueden tratar con técnicas dirigidas al campo comprometido con éxito significativo (>50 %).
Cuando la radioterapia mediastínica abarcará el lado izquierdo del corazón o se sabe que aumentará el riesgo de cáncer de mama en pacientes jóvenes, es posible considerar el uso de terapia con protones para reducir la dosis de radiación dirigida a los órganos en riesgo.[1] Para obtener más información, consultar la sección Síndrome de la vena cava superior en Síndromes cardiopulmonares.
| Estadio | Opciones de tratamiento |
|---|---|
| CAR = receptor quimérico para el antígeno; Pola-R-CHP = polatuzumab vedotina, rituximab, ciclofosfamida, doxorrubicina y prednisona; R-ACVBP = rituximab, doxorrubicina, ciclofosfamida, vindesina, bleomicina y prednisona; R-CHOP = rituximab, ciclofosfamida, doxorrubicina, vincristina y prednisona. | |
| Linfoma no Hodgkin de células B de crecimiento rápido en estadio I y de crecimiento rápido adyacente en estadio II | R-CHOP con radioterapia dirigida al campo comprometido o sin esta |
| R-ACVBP | |
| Linfoma no Hodgkin de células B de crecimiento rápido no adyacente en estadios II, III o IV | Pola-R-CHP (para IPI 2 a 5) |
| R-CHOP | |
| Consolidación con radioterapia dirigida a los sitios de enfermedad con gran masa tumoral (en evaluación clínica) | |
| Linfoma no Hodgkin de células B de crecimiento rápido recidivante | Terapia de células T con CAR para la enfermedad primaria resistente al tratamiento o en recaída durante el primer año posterior al tratamiento (o para la recaída después de un TCM autógeno) |
| Consolidación con trasplante de médula ósea o de células madre | |
| Tafasitamab y lenalidomida | |
| Acopladores biespecíficos de células T | |
| Polatuzumab vedotina, rituximab y bendamustina | |
| Loncastuximab tesirina | |
| Rituximab y lenalidomida | |
| Radioterapia paliativa | |
| Linfoma linfoblástico de células B o leucemia linfoblástica aguda | Consultar Tratamiento de la leucemia linfoblástica aguda |
| Linfoma difuso de células pequeñas no hendidas o linfoma de Burkitt | Regímenes multifarmacológicos intensivos |
| Profilaxis del sistema nervioso central | |
Aunque los tratamientos existentes son curativos en una proporción significativa de los pacientes con linfoma, se están llevando a cabo numerosos ensayos clínicos para mejorar el tratamiento. Si es posible, los pacientes pueden participar en estos estudios. Se han propuesto pautas estandarizadas para evaluar la respuesta en los ensayos clínicos.[2]
En varias revisiones retrospectivas se indicó que la vigilancia rutinaria mediante imágenes aporta poco o ningún valor a los pacientes con linfoma difuso de células B grandes (LDCBG) que logran una remisión clínica completa después de la terapia de inducción. Además, resulta difícil determinar el valor pronóstico de la tomografía por emisión de positrones-tomografía computarizada provisional durante la terapia de inducción del LDCBG.[3-6]
Los linfomas de crecimiento rápido se observan cada vez más en pacientes con infección por el VIH. El tratamiento de estos pacientes exige consideraciones especiales. Para obtener más información, consultar Tratamiento del linfoma relacionado con el SIDA.
Además de la detección del VIH en pacientes con linfomas de crecimiento rápido, se puede evaluar la presencia de hepatitis B o C activa antes del tratamiento con rituximab o quimioterapia.[7,8] Los pacientes con infección por el virus de la hepatitis B (VHB) detectable se benefician de la profilaxis con entecavir en el entorno del tratamiento con rituximab.[9,10] Los pacientes con infección por el VHB resuelta (es decir, negativa para el antígeno de superficie del VHB, pero positiva para el anticuerpo central del VHB), presentan riesgo de reactivación de la infección por el VHB y necesitan vigilancia del DNA del VHB. En un estudio retrospectivo de 326 pacientes, la terapia profiláctica con análogos nucleosídicos redujo la reactivación del VHB del 10,8 % al 2,1 %.[11] De forma similar, los pacientes que reciben rituximab con quimioterapia combinada o sin esta suelen recibir profilaxis con aciclovir o valaciclovir para el virus del herpes zóster y profilaxis con trimetoprima-sulfametoxazol o dapsona para la infección por Pneumocystis. El deterioro inmunitario a largo plazo se evaluó en un estudio retrospectivo de cohorte que incluyó 21 690 sobrevivientes de LDCBG del California Cancer Registry. Se encontraron cocientes de tasas de incidencia elevadas hasta 10 años después de neumonía (10,8 veces mayor), meningitis (5,3 veces mayor), deficiencia de inmunoglobulina (17,6 veces mayor) y citopenias autoinmunitarias (12 veces mayor).[12]
En un registro danés de 2508 pacientes, la incidencia de insuficiencia cardíaca congestiva inducida por doxorrubicina aumentó en 115 sobrevivientes del LNH con antecedentes de enfermedad cardíaca (cociente de riesgos instantáneos [CRI], 2,71; intervalo de confianza [IC] 95 %, 1,15−6,36) o múltiples factores de riesgo cardiovascular (CRI, 2,86; IC 95 %, 1,56−5,23).[13]
Para obtener más información, consultar Tratamiento del linfoma primario del sistema nervioso central.
Bibliografía
- Dabaja BS, Hoppe BS, Plastaras JP, et al.: Proton therapy for adults with mediastinal lymphomas: the International Lymphoma Radiation Oncology Group guidelines. Blood 132 (16): 1635-1646, 2018. [PUBMED Abstract]
- Cheson BD, Horning SJ, Coiffier B, et al.: Report of an international workshop to standardize response criteria for non-Hodgkin's lymphomas. NCI Sponsored International Working Group. J Clin Oncol 17 (4): 1244, 1999. [PUBMED Abstract]
- Mamot C, Klingbiel D, Hitz F, et al.: Final Results of a Prospective Evaluation of the Predictive Value of Interim Positron Emission Tomography in Patients With Diffuse Large B-Cell Lymphoma Treated With R-CHOP-14 (SAKK 38/07). J Clin Oncol 33 (23): 2523-9, 2015. [PUBMED Abstract]
- Thompson CA, Ghesquieres H, Maurer MJ, et al.: Utility of routine post-therapy surveillance imaging in diffuse large B-cell lymphoma. J Clin Oncol 32 (31): 3506-12, 2014. [PUBMED Abstract]
- El-Galaly TC, Jakobsen LH, Hutchings M, et al.: Routine Imaging for Diffuse Large B-Cell Lymphoma in First Complete Remission Does Not Improve Post-Treatment Survival: A Danish-Swedish Population-Based Study. J Clin Oncol 33 (34): 3993-8, 2015. [PUBMED Abstract]
- Huntington SF, Svoboda J, Doshi JA: Cost-effectiveness analysis of routine surveillance imaging of patients with diffuse large B-cell lymphoma in first remission. J Clin Oncol 33 (13): 1467-74, 2015. [PUBMED Abstract]
- Niitsu N, Hagiwara Y, Tanae K, et al.: Prospective analysis of hepatitis B virus reactivation in patients with diffuse large B-cell lymphoma after rituximab combination chemotherapy. J Clin Oncol 28 (34): 5097-100, 2010. [PUBMED Abstract]
- Dong HJ, Ni LN, Sheng GF, et al.: Risk of hepatitis B virus (HBV) reactivation in non-Hodgkin lymphoma patients receiving rituximab-chemotherapy: a meta-analysis. J Clin Virol 57 (3): 209-14, 2013. [PUBMED Abstract]
- Huang YH, Hsiao LT, Hong YC, et al.: Randomized controlled trial of entecavir prophylaxis for rituximab-associated hepatitis B virus reactivation in patients with lymphoma and resolved hepatitis B. J Clin Oncol 31 (22): 2765-72, 2013. [PUBMED Abstract]
- Li H, Zhang HM, Chen LF, et al.: Prophylactic lamivudine to improve the outcome of HBsAg-positive lymphoma patients during chemotherapy: a systematic review and meta-analysis. Clin Res Hepatol Gastroenterol 39 (1): 80-92, 2015. [PUBMED Abstract]
- Kusumoto S, Arcaini L, Hong X, et al.: Risk of HBV reactivation in patients with B-cell lymphomas receiving obinutuzumab or rituximab immunochemotherapy. Blood 133 (2): 137-146, 2019. [PUBMED Abstract]
- Shree T, Li Q, Glaser SL, et al.: Impaired Immune Health in Survivors of Diffuse Large B-Cell Lymphoma. J Clin Oncol 38 (15): 1664-1675, 2020. [PUBMED Abstract]
- Salz T, Zabor EC, de Nully Brown P, et al.: Preexisting Cardiovascular Risk and Subsequent Heart Failure Among Non-Hodgkin Lymphoma Survivors. J Clin Oncol 35 (34): 3837-3843, 2017. [PUBMED Abstract]
Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido en estadio I y de crecimiento rápido adyacente en estadio II
Los pacientes con linfoma difuso de células B grandes (LDCBG) de crecimiento rápido en estadio I o de crecimiento rápido adyacente en estadio II son aptos para recibir quimioterapia combinada con radioterapia dirigida al campo comprometido (RTCC) o sin esta.
Los pacientes con infección por el VHB resuelta (es decir, negativa para el antígeno de superficie del VHB, pero positiva para el anticuerpo central del VHB), presentan riesgo de reactivación de la infección por el VHB y necesitan vigilancia del DNA del VHB. En un estudio retrospectivo de 326 pacientes, la terapia profiláctica con análogos nucleosídicos redujo la reactivación del VHB del 10,8 % al 2,1 %.[1]
Linfoma difuso de células B grandes gástrico en estadio IE o IIE
En 4 series de casos participaron más de 100 pacientes con enfermedad en estadio IE o IIE (con o sin compromiso de tejido linfático asociado a mucosas) e infección por Helicobacter pylori. En las series se notificó que más del 50 % de los pacientes lograron una remisión completa duradera después de la terapia antibiótica apropiada para erradicar H. pylori.[2-5][Nivel de evidencia C3]
Opciones de tratamiento del linfoma no Hodgkin de células B de crecimiento rápido en estadio I y de crecimiento rápido adyacente en estadio II
Las opciones de tratamiento del linfoma no Hodgkin de células B de crecimiento rápido en estadio I y de crecimiento rápido adyacente en estadio II son las siguientes:
- R-CHOP (rituximab, ciclofosfamida, doxorrubicina, vincristina y prednisona) con radioterapia dirigida al campo comprometido (RTCC) o sin esta.
- R-ACVBP (rituximab, doxorrubicina, ciclofosfamida, vindesina, bleomicina y prednisona).[6,7]
R-CHOP con radioterapia dirigida al campo comprometido o sin esta
El rituximab es eficaz para la enfermedad en estadio avanzado. Sin embargo, su uso solo se respaldó en comparaciones retrospectivas de estudios sobre R-CHOP con radioterapia o sin esta.[8][Nivel de evidencia C2]
- R-CHOP (4 a 6 ciclos).
- R-CHOP (3 a 6 ciclos) y RTCC.
Evidencia (R-CHOP con o sin RTCC):
- En un ensayo prospectivo aleatorizado de 334 pacientes con LDCBG sin gran masa tumoral (≤7 cm) en estadio I o estadio II, los pacientes recibieron 4 a 6 ciclos de R-CHOP-14 (R-CHOP administrado cada 2 semanas) y luego se asignaron de manera aleatoria para recibir 40 Gy de radioterapia o a no recibir radioterapia.[9]
- Después de una mediana de seguimiento de 64 meses, la supervivencia sin complicaciones a 5 años (89–92 %, P = 0,18) y la supervivencia general (SG) a 5 años (92–96 %, P = 0,32) fueron iguales.[9][Nivel de evidencia A1]
De manera semejante a los resultados de los estudios aleatorizados de radioterapia antes de la era de rituximab, es posible diferir la radioterapia para los pacientes con enfermedad en estadio temprano sin gran masa tumoral. Para los pacientes que no toleran un curso prolongado de quimioterapia, se obtienen resultados equivalentes con 3 ciclos de R-CHOP y radioterapia de acuerdo a ensayos retrospectivos de un solo grupo.[8]
- Después de una mediana de seguimiento de 64 meses, la supervivencia sin complicaciones a 5 años (89–92 %, P = 0,18) y la supervivencia general (SG) a 5 años (92–96 %, P = 0,32) fueron iguales.[9][Nivel de evidencia A1]
- En un ensayo prospectivo aleatorizado (NCT00278421) de 592 pacientes menores de 60 años con LDCBG sin gran masa tumoral (<7,5 cm) en estadio I o estadio II, los pacientes se asignaron de manera aleatoria para recibir 4 o 6 ciclos de R-CHOP (con 2 ciclos más de rituximab después de 4 ciclos).[10]
- Después de una mediana de seguimiento de 66 meses, la tasa de supervivencia sin progresión (SSP) a 3 años fue del 96 % (intervalo de confianza [IC] 95 %, 94−99 %) para los pacientes que recibieron 4 ciclos de R-CHOP, esta fue un 3 % mejor (el límite inferior del valor unilateral de IC 95 % fue 0) que la tasa de SSP de los pacientes que recibieron 6 ciclos, lo que estableció la ausencia de inferioridad para el régimen de 4 ciclos.[10][Nivel de evidencia B1]
- En un análisis retrospectivo realizado en el Memorial Sloan Kettering Cancer Center entre 2001 y 2015, se incluyeron 341 pacientes con enfermedad en estadio I. En el análisis se observó que el 66 % de los pacientes tenían una presentación extraganglionar. Después de R-CHOP (o un régimen similar), con radioterapia o sin esta, la tasa de supervivencia sin enfermedad a 5 años fue del 77 %, y la tasa de SG a 5 años fue del 94 %.[11][Nivel de evidencia C3] En un análisis multivariante se indicó que la radioterapia puede mejorar los desenlaces de los pacientes con enfermedad extraganglionar con compromiso identificado en la tomografía por emisión de positrones (TEP) al final del tratamiento. Esta hipótesis debe confirmarse en un ensayo prospectivo aleatorizado.[11]
En síntesis, 4 ciclos de R-CHOP son suficientes para los pacientes de LDCBG sin gran masa tumoral (<7 cm) en estadio I o estadio II con pronóstico favorable. En los pacientes con pronóstico desfavorable, se pueden administrar 6 ciclos de R-CHOP o 3 ciclos de R-CHOP y 40 Gy de radioterapia. No se han estudiado en ensayos aleatorizados a los pacientes en estadio temprano con gran masa tumoral (>7,5 cm); por lo general estos pacientes reciben una terapia de modalidad combinada con 4 a 6 ciclos de R-CHOP y radioterapia. Aunque en un estudio retrospectivo se indicó que los pacientes con enfermedad extraganglionar en estadio I y una TEP positiva al final del tratamiento se pueden beneficiar de la radioterapia, esta hipótesis se debe confirmar en un ensayo prospectivo aleatorizado.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Kusumoto S, Arcaini L, Hong X, et al.: Risk of HBV reactivation in patients with B-cell lymphomas receiving obinutuzumab or rituximab immunochemotherapy. Blood 133 (2): 137-146, 2019. [PUBMED Abstract]
- Morgner A, Miehlke S, Fischbach W, et al.: Complete remission of primary high-grade B-cell gastric lymphoma after cure of Helicobacter pylori infection. J Clin Oncol 19 (7): 2041-8, 2001. [PUBMED Abstract]
- Chen LT, Lin JT, Shyu RY, et al.: Prospective study of Helicobacter pylori eradication therapy in stage I(E) high-grade mucosa-associated lymphoid tissue lymphoma of the stomach. J Clin Oncol 19 (22): 4245-51, 2001. [PUBMED Abstract]
- Chen LT, Lin JT, Tai JJ, et al.: Long-term results of anti-Helicobacter pylori therapy in early-stage gastric high-grade transformed MALT lymphoma. J Natl Cancer Inst 97 (18): 1345-53, 2005. [PUBMED Abstract]
- Kuo SH, Yeh KH, Wu MS, et al.: Helicobacter pylori eradication therapy is effective in the treatment of early-stage H pylori-positive gastric diffuse large B-cell lymphomas. Blood 119 (21): 4838-44; quiz 5057, 2012. [PUBMED Abstract]
- Reyes F, Lepage E, Ganem G, et al.: ACVBP versus CHOP plus radiotherapy for localized aggressive lymphoma. N Engl J Med 352 (12): 1197-205, 2005. [PUBMED Abstract]
- Ketterer N, Coiffier B, Thieblemont C, et al.: Phase III study of ACVBP versus ACVBP plus rituximab for patients with localized low-risk diffuse large B-cell lymphoma (LNH03-1B). Ann Oncol 24 (4): 1032-7, 2013. [PUBMED Abstract]
- Persky DO, Unger JM, Spier CM, et al.: Phase II study of rituximab plus three cycles of CHOP and involved-field radiotherapy for patients with limited-stage aggressive B-cell lymphoma: Southwest Oncology Group study 0014. J Clin Oncol 26 (14): 2258-63, 2008. [PUBMED Abstract]
- Lamy T, Damaj G, Soubeyran P, et al.: R-CHOP 14 with or without radiotherapy in nonbulky limited-stage diffuse large B-cell lymphoma. Blood 131 (2): 174-181, 2018. [PUBMED Abstract]
- Poeschel V, Held G, Ziepert M, et al.: Four versus six cycles of CHOP chemotherapy in combination with six applications of rituximab in patients with aggressive B-cell lymphoma with favourable prognosis (FLYER): a randomised, phase 3, non-inferiority trial. Lancet 394 (10216): 2271-2281, 2019. [PUBMED Abstract]
- Bobillo S, Joffe E, Lavery JA, et al.: Clinical characteristics and outcomes of extranodal stage I diffuse large B-cell lymphoma in the rituximab era. Blood 137 (1): 39-48, 2021. [PUBMED Abstract]
Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido no adyacente en estadios II, III y IV
El tratamiento aceptado para los pacientes con linfoma no Hodgkin (LNH) de crecimiento rápido en estadios avanzados es la quimioterapia combinada, sola o complementada con radioterapia dirigida al campo local.[1]
En esta sección se mencionan las siguientes combinaciones farmacológicas:
- Pola-R-CHP: polatuzumab vedotina, rituximab, ciclofosfamida, doxorrubicina y prednisona.
- R-CHOP: rituximab, ciclofosfamida, doxorrubicina, vincristina y prednisona.
- R-ACVBP: rituximab, un anticuerpo monoclonal anti-CD20, doxorrubicina, ciclofosfamida, vindesina, bleomicina y prednisona.
Opciones de tratamiento del linfoma no Hodgkin de células B de crecimiento rápido no adyacente en estadios II, III y IV
Las opciones de tratamiento del linfoma no Hodgkin de células B de crecimiento rápido no adyacente en estadios II, III y IV son las siguientes:
- POLA-R-CHP (para la puntuación del índice pronóstico internacional [IPI] de la National Comprehensive Cancer Network de 2 a 5).
- R-CHOP.
- Consolidación con radioterapia dirigida a los sitios de enfermedad con gran masa tumoral (en evaluación clínica).
Pola-R-CHP
El régimen R-CHOP se comparó con el régimen Pola-R-CHP. El polatuzumab es un conjugado anticuerpo-fármaco compuesto por un anticuerpo monoclonal anti-CD79B unido a la vedotina (monometil auristatina E), un inhibidor de los microtúbulos.
Evidencia (Pola-R-CHP):
- En un estudio prospectivo aleatorizado (POLARIX [NCT03274492]) de 879 pacientes con linfoma difuso de células B grandes (LDCBG) sin tratamiento previo y una puntuación IPI de 2 o más, se comparó R-CHOP con Pola-R-CHP.[2] El polatuzumab vedotina sustituyó a la vincristina para mitigar la toxicidad neurológica.
- Al cabo de una mediana de seguimiento de 28,2 meses, la tasa de supervivencia sin progresión (SSP) a 2 años fue significativamente más alta en el grupo de Pola-R-CHP que en el grupo de R-CHOP: 76,7 % (intervalo de confianza [IC] 95 %, 72,7–80,0 %) versus 70,2 % (IC 95 %, 65,8–74,6 %) (cociente de riesgos instantáneos [CRI], 0,73; IC 95 %, 0,57–0,95; P = 0,02).[2][Nivel de evidencia B1]
- La tasa de supervivencia general (SG) a 2 años fue del 88,7 % (IC 95 %, 85,7–91,6 %) para los pacientes que recibieron Pola-R-CHP y del 88,6 % (IC 95 %, 85,6–91,6 %) para los pacientes que recibieron R-CHOP (CRI, 0,94; IC 95 %, 0,65–1,37; P = 0,75).
- En un análisis de la subpoblación asiática de este ensayo, se observó una mejora similar del 7,7 % en la SSP a 2 años con Pola-R-CHP versus R-CHOP.[3][Nivel de evidencia C2]
El intervalo de seguimiento fue demasiado corto como para establecer si la mejora del 6 % en la tasa de SSP se estabilizará o mejorará después de 2 años, y no hay evidencia de ventaja en la SG. Sin embargo, los desenlaces actualizados con una mediana de seguimiento de 3 años mostraron una mejora continua de la SSP, lo que llevó a la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) a aprobar el régimen Pola-R-CHP. Este régimen es el primero, en más de 20 años, en ser aprobado por la FDA para el tratamiento de pacientes con enfermedad no adyacente en estadio II, III o IV. El nuevo régimen cuesta más del doble que R-CHOP según los precios de adquisición de 2022, y es posible que el polatuzumab no esté disponible en muchos lugares del mundo.
El régimen Pola-R-CHP demostró una eficacia considerable en pacientes con LDCBG y tumores de origen diferente a las células B de centro germinal (GBC), en su mayoría aquellos con el subtipo de células B activadas (ABC).[4] En el ensayo POLARIX, el CRISSP de Pola-R-CHP versus R-CHOP en pacientes con tumores del subtipo ABC fue de 0,34 (IC 95 %, 0,13–0,85), y el CRISG para esos pacientes fue de 0,27 (IC 95 %, 0,06–1,26). Por el contrario, no se observó dicho beneficio en los pacientes con tumores del subtipo GBC en este ensayo. El CRISSP fue de 1,18 (IC 95 %, 0,75–1,84) y el CRISG fue de 1,64 (IC 95 %, 0,87–3,07) para el régimen Pola-R-CHP. Esta eficacia diferencial a favor de subtipos diferentes a GCB o el subtipo ABC se observó en 5 ensayos prospectivos de fase I y II del régimen Pola-R-CHP en pacientes con enfermedad en recaída o resistente al tratamiento, con un análisis combinado de los datos que mostró un nivel de significancia con P < 0,001.[4] Al combinar los datos de un ensayo aleatorizado de fase II en el que se estudió Pola-R-CHP en pacientes con enfermedad en recaída o resistente al tratamiento con los datos del ensayo POLARIX de pacientes con enfermedad no tratada, el CRIrecaída, progresión y muerte fue de 0,25 para pacientes con tumores del subtipo ABC y de 0,98 para pacientes con tumores del subtipo GCB (P < 0,001).[4] La única excepción a esta observación es el claro beneficio de Pola-R-CHP en pacientes con el subtipo GCB y variante doble (gen MYC y gen BCL2). Dado el aumento de las tasas de neutropenia febril en los pacientes que reciben Pola-R-CHP y la importante toxicidad financiera, es razonable considerar el régimen R-CHOP como un régimen estándar para los pacientes con LDCBG del subtipo GCB sin variante doble. Sin embargo, la evaluación del subtipo GCB mediante las pruebas de inmunofenotipificación disponibles en el mercado es menos exacta que la evaluación de las firmas genéticas moleculares utilizadas en el estudio POLARIX. Es posible que algunos pacientes no obtengan el beneficio de SSP del polatuzumab. Algunos profesionales clínicos pecan por exceso de precaución y usan el régimen Pola-R-CHP para el subtipo de GCB cuando los pacientes presentan otras características de riesgo alto (por ejemplo, positividad para CD5 o compromiso en 2 o más sitios extraganglionares).
R-CHOP
En los siguientes estudios se estableció el régimen R-CHOP como el régimen estándar para los pacientes con LDCBG recién diagnosticado y enfermedad no adyacente en estadios II, III o IV durante más de 20 años.[5] La intensificación de la dosis de R-CHOP en un ciclo de 14 días versus un ciclo de 21 días no produjo mejores desenlaces.[6] R-CHOP es el régimen preferido cuando el polatuzumab no está disponible o no es asequible, o cuando está contraindicado debido a efectos secundarios adversos.
Evidencia (R-CHOP):
- El régimen R-CHOP mostró una mejora de la supervivencia sin complicaciones (SSC) y la SG en comparación con el régimen CHOP (ciclofosfamida, doxorrubicina, vincristina y prednisona) solo, en 399 pacientes mayores de 60 años con LDCBG en estadio avanzado (tasa de SSC, 57 vs. 38 %; P = 0,002, y tasa de SG, 70 vs. 57 %;P = 0,007 a los 2 años).[7][Nivel de evidencia A1] Al cabo de una mediana de seguimiento de 10 años, la tasa de SG de los pacientes que recibieron R-CHOP en comparación con los pacientes que recibieron CHOP fue del 44 % versus el 28 % (P < 0,0001).[8]
- De manera similar, en 326 pacientes evaluables menores de 61 años, el régimen R-CHOP mostró una mejora de la SSC y la SG en comparación con CHOP solo (tasa de SSC, 79 vs. 59 %, P = 0,001, y tasa de SG, 93 vs. 84 %,P = 0,001 a los 3 años).[9][Nivel de evidencia A1]
- En un estudio aleatorizado (DSHNHL-1999-1A [NCT00052936]) de 1222 pacientes mayores de 60 años, se comparó el régimen R-CHOP administrado cada 2 semanas durante 6 u 8 ciclos con el régimen CHOP administrado cada 2 semanas durante 6 u 8 ciclos.[10] Después de una mediana de seguimiento de 72 meses, la SSC favoreció la administración de R-CHOP cada 2 semanas durante 6 u 8 ciclos (tasa de SSC a 6 años, 74 vs. 56 %; P < 0,0001). La SG favoreció el régimen R-CHOP de solo 6 ciclos debido al aumento de efectos tóxicos en el grupo de 8 ciclos (tasa de SG a 6 años, 90 vs. 80 %; P = 0,0004).[10][Nivel de evidencia A1] No se hizo una comparación entre los regímenes estándar de R-CHOP o CHOP administrados cada 3 semanas.
- En un ensayo (NCT00140595) de 380 pacientes menores de 60 años con LDCBG y una puntuación ajustada por edad del IPI de 1, los pacientes se asignaron de manera aleatoria para recibir ACVBP y R-ACVBP acompañados de consolidación con metotrexato, ifosfamida, etopósido y citarabina versus CHOP y rituximab.[11] Después de una mediana de seguimiento de 44 meses, las tasas de SG a 3 años favorecieron al régimen R-ACVBP (92 vs. 84 %; CRI, 0,44; IC 95 %, 0,28–0,81,P = 0,007).[11][Nivel de evidencia A1] Los efectos tóxicos considerablemente peores con R-ACVBP, la población destinataria reducida (<60 años con concentración elevada de lactato–deshidrogenasa [LDH] o enfermedad en estadio III o IV, pero no ambas) y la falta de un ensayo confirmatorio quizás impidan la adopción del régimen R-ACVBP como un nuevo estándar de atención.[12]
No hay estudios validados para la intensificación del tratamiento de acuerdo con la tomografía por emisión de positrones interina.[13] R-CHOP tiene potencial curativo incluso en pacientes mayores de 80 años que son frágiles y requieren dosis reducidas de los componentes de R-CHOP. En una revisión retrospectiva de 239 pacientes, la tasa de supervivencia por causa específica a 5 años fue del 48 % (IC 95 %, 41−55 %).[14][Nivel de evidencia C3]
Menos del 10 % de los pacientes con LDCBG presentan un linfoma de crecimiento lento simultáneo en el momento del diagnóstico, y en su mayoría son de fenotipo GCB. En una revisión retrospectiva de 1324 pacientes se observaron resultados similares de la SSC (CRI, 1,19) y la SG (CRI, 1,09).[15][Nivel de evidencia C3] En 847 pacientes tratados con R-CHOP y que no presentaban enfermedad 24 meses después del tratamiento, la tasa de recaída del linfoma de crecimiento lento a los 5 años fue más alta con un diagnóstico de linfoma folicular simultáneo (7,4 vs. 2,1 % a los 5 años, P < 0,01) y con un fenotipo GCB (3,9 vs. 0,0 % a los 5 años, P = 0,02).[16]
En los ensayos clínicos, se siguen explorando modificaciones del régimen R-CHOP para mejorar la eficacia.
Consolidación con radioterapia dirigida a los sitios de enfermedad con gran masa tumoral
Después de la quimioterapia de inducción con R-CHOP (o regímenes similares), la adición de radioterapia dirigida al campo comprometido en los sitios de enfermedad con gran masa tumoral inicial (≥5–10 cm) o sitios extralinfáticos aún es polémica.[17-19] Se debe considerar el aumento de los riesgos, como la aparición de efectos tóxicos a largo plazo (por ejemplo, neoplasias malignas secundarias).
Trasplante de médula ósea o de células madre
En varios ensayos prospectivos aleatorizados se evaluó la función de la consolidación con TMO o TCM autógenos versus quimioterapia sola en pacientes con linfoma difuso de células grandes en la primera remisión.[20-27]; [28-30][Nivel de evidencia A1] Aunque en algunos de estos ensayos se observaron aumentos significativos de la SSC (del 10 % al 20 %) en los pacientes que recibieron terapia de dosis altas, no se pudieron demostrar diferencias significativas en la SG de forma prospectiva en ninguna de las series.
En análisis retrospectivos con pacientes de riesgo intermedio (2 factores de riesgo) o riesgo alto (más de 3 factores de riesgo) según la puntuación de IPI, se indicó una mejora para la supervivencia con el TMO en 2 ensayos.[21,27] En estos estudios no se establece que la consolidación con dosis altas cumpla una función en los pacientes con linfoma de crecimiento rápido con riesgo alto real de recaída; además, se demuestra que la SSC quizás es un sustituto inadecuado de la SG en estos pacientes.[31]
Factores pronósticos
En el índice pronóstico internacional de la National Comprehensive Cancer Network (National Comprehensive Cancer Network International Prognostic Index [NCCN-IPI]) para el linfoma no Hodgkin (LNH) de crecimiento rápido (linfoma difuso de células grandes) se identifican los siguientes 5 factores de riesgo significativos para el pronóstico de la supervivencia general (SG) y los puntajes de riesgo relacionado:[32]
- Edad.
- <40 años: 0.
- 41–60 años: 1.
- 61–75 años: 2.
- >75 años: 3.
- Estadio III o IV: 1.
- Estado funcional (EF) 2, 3 o 4: 1.
- Concentración sérica de lactato–deshidrogenasa (LDH).
- Normalizada: 0.
- >1x–3x: 1.
- >3x: 2.
- Número de sitios extraganglionares ≥2: 1.
Puntajes de riesgo:
- Bajo (0 o 1): Tasa de SG a 5 años, 96 %; tasa de supervivencia sin progresión (SSP), 91 %.
- Intermedio bajo (2 o 3): Tasa de SG a 5 años, 82 %; tasa de SSP, 74 %.
- Intermedio alto (4 o 5): Tasa de SG a 5 años, 64 %; tasa de SSP, 51 %.
- Alto (>6): Tasa de SG a 5 años, 33 %; tasa de SSP, 30 %.
Se utilizan modificaciones del IPI ajustadas por edad y estadio para los pacientes más jóvenes con enfermedad localizada.[33] Los intervalos de tiempo más cortos entre el diagnóstico y el tratamiento son marcadores indirectos de factores biológicos de pronóstico precario.[34]
La identificación de alteraciones en el gen BCL2 y el reordenamiento del gen MYC o la sobreexpresión dual del gen MYC, o ambos, confieren un pronóstico muy adverso.[35-38] Los pacientes en riesgo alto de recaída se consideran aptos para participar en ensayos clínicos.[39] La obtención de perfiles moleculares de expresión génica mediante micromatrices de ADN quizás sirva en el futuro para ayudar a estratificar a los pacientes en grupos de tratamiento dirigido a dianas específicas y para mejorar la predicción de la supervivencia después de la quimioterapia estándar.[40]
Tratamiento del síndrome de lisis tumoral
Los pacientes con linfadenopatía extensa, gran masa tumoral y elevación de las concentraciones séricas de ácido úrico y LDH tienen un riesgo alto de síndrome de lisis tumoral que da lugar a trastornos metabólicos como hiperuricemia, hiperpotasemia, hiperfosfatemia, hipocalcemia e insuficiencia renal aguda subsiguiente.[41] Las opciones de tratamiento son hidratación alcalina, alopurinol y rasburicasa (urato–oxidasa recombinante).[42]
Profilaxis del sistema nervioso central
La herramienta CNS-IPI predice qué pacientes tienen un riesgo de recaída en el SNC superior al 10 %.[43,44] El German Lymphoma Study Group formuló este instrumento y se validó en la base de datos de British Columbia Cancer Agency. Se usó la presencia de 4 a 6 de los factores de riesgo del CNS-IPI (edad >60 años, estado funcional ≥2, concentración elevada de LDH, enfermedad en estadio III o IV, >1 sitio extraganglionar o compromiso renal o suprarrenal) para definir el grupo de riesgo alto de recaída en el SNC (un riesgo del 12 % de compromiso del SNC al cabo de 2 años).[44]
Por lo general, se recomienda la profilaxis del SNC (a menudo con 4 a 6 dosis de metotrexato intratecal) para los pacientes con compromiso testicular.[45-47][Nivel de evidencia C3] En un análisis retrospectivo de los estudios alemanes RICOVER, se comparó el metotrexato intratecal con la ausencia de profilaxis en los pacientes con LDCBG. Este estudio se llevó a cabo durante la era del tratamiento con R-CHOP. Con la posible excepción de los pacientes con compromiso testicular, en el análisis se observó que el metotrexato intratecal no redujo el riesgo de enfermedad en el SNC.[48][Nivel de evidencia C3]
Algunos médicos usan dosis altas de metotrexato intravenoso (IV) (por lo general, 4 dosis) como alternativa al tratamiento intratecal porque mejora la administración del fármaco y disminuye la morbilidad del paciente.[43,49] En 5 estudios retrospectivos y un metanálisis de red en los que se evaluaron dosis altas de metotrexato solo en pacientes con LDCBG de riesgo alto tampoco se observó mejoría en la tasa de recaída en el SNC.[50-55][Nivel de evidencia C3] Los pacientes que se consideran en riesgo alto de recaída en el SNC (por ejemplo, pacientes con enfermedad testicular, renal o suprarrenal y 3 o más sitios extraganglionares) pueden recibir metotrexato intratecal o dosis altas de metotrexato IV, pero la falta de estudios aleatorizados pone en duda este estándar y demuestra la necesidad urgente de contar con mejores terapias validadas mediante ensayos clínicos.[43,43] Si bien no hay evidencia suficiente para respaldar un beneficio significativo de la profilaxis del SNC en la mayoría de los pacientes de riesgo alto, el riesgo percibido de no tratar la recaída en el SNC a menudo ha superado la falta de evidencia de su eficacia.[43] Aunque los pacientes con compromiso testicular, renal o suprarrenal se consideran una excepción, solo se ha notificado un beneficio esporádico con el metotrexato intratecal o el metotrexato de dosis altas IV en la reducción de la recidiva en el SNC.[45-47][Nivel de evidencia C3]
En análisis retrospectivos, la adición de rituximab a los regímenes a base de CHOP redujo de modo significativo el riesgo de recaída en el SNC.[48,56][Nivel de evidencia C3] Los pacientes con diseminación al SNC en el momento del diagnóstico o en el momento de la recaída suelen recibir rituximab y metotrexato de dosis altas o citarabina seguidas de trasplante de células madre (TCM) autógeno, pero este abordaje no se ha evaluado en ensayos aleatorizados.[57,58][Nivel de evidencia C3]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Shankland KR, Armitage JO, Hancock BW: Non-Hodgkin lymphoma. Lancet 380 (9844): 848-57, 2012. [PUBMED Abstract]
- Tilly H, Morschhauser F, Sehn LH, et al.: Polatuzumab Vedotin in Previously Untreated Diffuse Large B-Cell Lymphoma. N Engl J Med 386 (4): 351-363, 2022. [PUBMED Abstract]
- Song Y, Tilly H, Rai S, et al.: Polatuzumab vedotin in previously untreated DLBCL: an Asia subpopulation analysis from the phase 3 POLARIX trial. Blood 141 (16): 1971-1981, 2023. [PUBMED Abstract]
- Palmer AC, Kurtz DM, Alizadeh AA: Cell-of-Origin Subtypes and Therapeutic Benefit from Polatuzumab Vedotin. N Engl J Med 389 (8): 764-766, 2023. [PUBMED Abstract]
- Coiffier B: State-of-the-art therapeutics: diffuse large B-cell lymphoma. J Clin Oncol 23 (26): 6387-93, 2005. [PUBMED Abstract]
- Cunningham D, Hawkes EA, Jack A, et al.: Rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisolone in patients with newly diagnosed diffuse large B-cell non-Hodgkin lymphoma: a phase 3 comparison of dose intensification with 14-day versus 21-day cycles. Lancet 381 (9880): 1817-26, 2013. [PUBMED Abstract]
- Coiffier B, Lepage E, Briere J, et al.: CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma. N Engl J Med 346 (4): 235-42, 2002. [PUBMED Abstract]
- Coiffier B, Thieblemont C, Van Den Neste E, et al.: Long-term outcome of patients in the LNH-98.5 trial, the first randomized study comparing rituximab-CHOP to standard CHOP chemotherapy in DLBCL patients: a study by the Groupe d'Etudes des Lymphomes de l'Adulte. Blood 116 (12): 2040-5, 2010. [PUBMED Abstract]
- Pfreundschuh M, Trümper L, Osterborg A, et al.: CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group. Lancet Oncol 7 (5): 379-91, 2006. [PUBMED Abstract]
- Pfreundschuh M, Kuhnt E, Trümper L, et al.: CHOP-like chemotherapy with or without rituximab in young patients with good-prognosis diffuse large-B-cell lymphoma: 6-year results of an open-label randomised study of the MabThera International Trial (MInT) Group. Lancet Oncol 12 (11): 1013-22, 2011. [PUBMED Abstract]
- Récher C, Coiffier B, Haioun C, et al.: Intensified chemotherapy with ACVBP plus rituximab versus standard CHOP plus rituximab for the treatment of diffuse large B-cell lymphoma (LNH03-2B): an open-label randomised phase 3 trial. Lancet 378 (9806): 1858-67, 2011. [PUBMED Abstract]
- Casasnovas RO, Ysebaert L, Thieblemont C, et al.: FDG-PET-driven consolidation strategy in diffuse large B-cell lymphoma: final results of a randomized phase 2 study. Blood 130 (11): 1315-1326, 2017. [PUBMED Abstract]
- Dührsen U, Müller S, Hertenstein B, et al.: Positron Emission Tomography-Guided Therapy of Aggressive Non-Hodgkin Lymphomas (PETAL): A Multicenter, Randomized Phase III Trial. J Clin Oncol 36 (20): 2024-2034, 2018. [PUBMED Abstract]
- Gobba S, Moccia AA, Gulden-Sala W, et al.: Outcome of patients older than 80 years with diffuse large B-cell lymphoma (DLBCL) treated with "standard" immunochemotherapy: A large retrospective study from 4 institutions. Hematol Oncol 36 (1): 84-92, 2018. [PUBMED Abstract]
- Wang Y, Link BK, Witzig TE, et al.: Impact of concurrent indolent lymphoma on the clinical outcome of newly diagnosed diffuse large B-cell lymphoma. Blood 134 (16): 1289-1297, 2019. [PUBMED Abstract]
- Wang Y, Farooq U, Link BK, et al.: Late Relapses in Patients With Diffuse Large B-Cell Lymphoma Treated With Immunochemotherapy. J Clin Oncol 37 (21): 1819-1827, 2019. [PUBMED Abstract]
- Held G, Murawski N, Ziepert M, et al.: Role of radiotherapy to bulky disease in elderly patients with aggressive B-cell lymphoma. J Clin Oncol 32 (11): 1112-8, 2014. [PUBMED Abstract]
- Kahl BS: Bulky aggressive B-cell lymphoma: to radiate or not to radiate--that is the question. J Clin Oncol 32 (11): 1097-8, 2014. [PUBMED Abstract]
- Phan J, Mazloom A, Medeiros LJ, et al.: Benefit of consolidative radiation therapy in patients with diffuse large B-cell lymphoma treated with R-CHOP chemotherapy. J Clin Oncol 28 (27): 4170-6, 2010. [PUBMED Abstract]
- Haioun C, Lepage E, Gisselbrecht C, et al.: Survival benefit of high-dose therapy in poor-risk aggressive non-Hodgkin's lymphoma: final analysis of the prospective LNH87-2 protocol--a groupe d'Etude des lymphomes de l'Adulte study. J Clin Oncol 18 (16): 3025-30, 2000. [PUBMED Abstract]
- Haioun C, Lepage E, Gisselbrecht C, et al.: Benefit of autologous bone marrow transplantation over sequential chemotherapy in poor-risk aggressive non-Hodgkin's lymphoma: updated results of the prospective study LNH87-2. Groupe d'Etude des Lymphomes de l'Adulte. J Clin Oncol 15 (3): 1131-7, 1997. [PUBMED Abstract]
- Santini G, Salvagno L, Leoni P, et al.: VACOP-B versus VACOP-B plus autologous bone marrow transplantation for advanced diffuse non-Hodgkin's lymphoma: results of a prospective randomized trial by the non-Hodgkin's Lymphoma Cooperative Study Group. J Clin Oncol 16 (8): 2796-802, 1998. [PUBMED Abstract]
- Gianni AM, Bregni M, Siena S, et al.: High-dose chemotherapy and autologous bone marrow transplantation compared with MACOP-B in aggressive B-cell lymphoma. N Engl J Med 336 (18): 1290-7, 1997. [PUBMED Abstract]
- Kluin-Nelemans HC, Zagonel V, Anastasopoulou A, et al.: Standard chemotherapy with or without high-dose chemotherapy for aggressive non-Hodgkin's lymphoma: randomized phase III EORTC study. J Natl Cancer Inst 93 (1): 22-30, 2001. [PUBMED Abstract]
- Gisselbrecht C, Lepage E, Molina T, et al.: Shortened first-line high-dose chemotherapy for patients with poor-prognosis aggressive lymphoma. J Clin Oncol 20 (10): 2472-9, 2002. [PUBMED Abstract]
- Martelli M, Gherlinzoni F, De Renzo A, et al.: Early autologous stem-cell transplantation versus conventional chemotherapy as front-line therapy in high-risk, aggressive non-Hodgkin's lymphoma: an Italian multicenter randomized trial. J Clin Oncol 21 (7): 1255-62, 2003. [PUBMED Abstract]
- Milpied N, Deconinck E, Gaillard F, et al.: Initial treatment of aggressive lymphoma with high-dose chemotherapy and autologous stem-cell support. N Engl J Med 350 (13): 1287-95, 2004. [PUBMED Abstract]
- Betticher DC, Martinelli G, Radford JA, et al.: Sequential high dose chemotherapy as initial treatment for aggressive sub-types of non-Hodgkin lymphoma: results of the international randomized phase III trial (MISTRAL). Ann Oncol 17 (10): 1546-52, 2006. [PUBMED Abstract]
- Stiff PJ, Unger JM, Cook JR, et al.: Autologous transplantation as consolidation for aggressive non-Hodgkin's lymphoma. N Engl J Med 369 (18): 1681-90, 2013. [PUBMED Abstract]
- Chiappella A, Martelli M, Angelucci E, et al.: Rituximab-dose-dense chemotherapy with or without high-dose chemotherapy plus autologous stem-cell transplantation in high-risk diffuse large B-cell lymphoma (DLCL04): final results of a multicentre, open-label, randomised, controlled, phase 3 study. Lancet Oncol 18 (8): 1076-1088, 2017. [PUBMED Abstract]
- Shipp MA, Abeloff MD, Antman KH, et al.: International Consensus Conference on high-dose therapy with hematopoietic stem-cell transplantation in aggressive non-Hodgkin's lymphomas: report of the jury. Ann Oncol 10 (1): 13-9, 1999. [PUBMED Abstract]
- Zhou Z, Sehn LH, Rademaker AW, et al.: An enhanced International Prognostic Index (NCCN-IPI) for patients with diffuse large B-cell lymphoma treated in the rituximab era. Blood 123 (6): 837-42, 2014. [PUBMED Abstract]
- Møller MB, Christensen BE, Pedersen NT: Prognosis of localized diffuse large B-cell lymphoma in younger patients. Cancer 98 (3): 516-21, 2003. [PUBMED Abstract]
- Maurer MJ, Ghesquières H, Link BK, et al.: Diagnosis-to-Treatment Interval Is an Important Clinical Factor in Newly Diagnosed Diffuse Large B-Cell Lymphoma and Has Implication for Bias in Clinical Trials. J Clin Oncol 36 (16): 1603-1610, 2018. [PUBMED Abstract]
- Cuccuini W, Briere J, Mounier N, et al.: MYC+ diffuse large B-cell lymphoma is not salvaged by classical R-ICE or R-DHAP followed by BEAM plus autologous stem cell transplantation. Blood 119 (20): 4619-24, 2012. [PUBMED Abstract]
- Johnson NA, Slack GW, Savage KJ, et al.: Concurrent expression of MYC and BCL2 in diffuse large B-cell lymphoma treated with rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone. J Clin Oncol 30 (28): 3452-9, 2012. [PUBMED Abstract]
- Green TM, Young KH, Visco C, et al.: Immunohistochemical double-hit score is a strong predictor of outcome in patients with diffuse large B-cell lymphoma treated with rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone. J Clin Oncol 30 (28): 3460-7, 2012. [PUBMED Abstract]
- Horn H, Ziepert M, Becher C, et al.: MYC status in concert with BCL2 and BCL6 expression predicts outcome in diffuse large B-cell lymphoma. Blood 121 (12): 2253-63, 2013. [PUBMED Abstract]
- Canellos GP: CHOP may have been part of the beginning but certainly not the end: issues in risk-related therapy of large-cell lymphoma. J Clin Oncol 15 (5): 1713-6, 1997. [PUBMED Abstract]
- Sha C, Barrans S, Cucco F, et al.: Molecular High-Grade B-Cell Lymphoma: Defining a Poor-Risk Group That Requires Different Approaches to Therapy. J Clin Oncol 37 (3): 202-212, 2019. [PUBMED Abstract]
- Coiffier B, Altman A, Pui CH, et al.: Guidelines for the management of pediatric and adult tumor lysis syndrome: an evidence-based review. J Clin Oncol 26 (16): 2767-78, 2008. [PUBMED Abstract]
- Cortes J, Moore JO, Maziarz RT, et al.: Control of plasma uric acid in adults at risk for tumor Lysis syndrome: efficacy and safety of rasburicase alone and rasburicase followed by allopurinol compared with allopurinol alone--results of a multicenter phase III study. J Clin Oncol 28 (27): 4207-13, 2010. [PUBMED Abstract]
- Eyre TA, Savage KJ, Cheah CY, et al.: CNS prophylaxis for diffuse large B-cell lymphoma. Lancet Oncol 23 (9): e416-e426, 2022. [PUBMED Abstract]
- Schmitz N, Zeynalova S, Nickelsen M, et al.: CNS International Prognostic Index: A Risk Model for CNS Relapse in Patients With Diffuse Large B-Cell Lymphoma Treated With R-CHOP. J Clin Oncol 34 (26): 3150-6, 2016. [PUBMED Abstract]
- Zucca E, Conconi A, Mughal TI, et al.: Patterns of outcome and prognostic factors in primary large-cell lymphoma of the testis in a survey by the International Extranodal Lymphoma Study Group. J Clin Oncol 21 (1): 20-7, 2003. [PUBMED Abstract]
- Vitolo U, Chiappella A, Ferreri AJ, et al.: First-line treatment for primary testicular diffuse large B-cell lymphoma with rituximab-CHOP, CNS prophylaxis, and contralateral testis irradiation: final results of an international phase II trial. J Clin Oncol 29 (20): 2766-72, 2011. [PUBMED Abstract]
- Cheah CY, Wirth A, Seymour JF: Primary testicular lymphoma. Blood 123 (4): 486-93, 2014. [PUBMED Abstract]
- Boehme V, Schmitz N, Zeynalova S, et al.: CNS events in elderly patients with aggressive lymphoma treated with modern chemotherapy (CHOP-14) with or without rituximab: an analysis of patients treated in the RICOVER-60 trial of the German High-Grade Non-Hodgkin Lymphoma Study Group (DSHNHL). Blood 113 (17): 3896-902, 2009. [PUBMED Abstract]
- Glantz MJ, Cole BF, Recht L, et al.: High-dose intravenous methotrexate for patients with nonleukemic leptomeningeal cancer: is intrathecal chemotherapy necessary? J Clin Oncol 16 (4): 1561-7, 1998. [PUBMED Abstract]
- Puckrin R, El Darsa H, Ghosh S, et al.: Ineffectiveness of high-dose methotrexate for prevention of CNS relapse in diffuse large B-cell lymphoma. Am J Hematol 96 (7): 764-771, 2021. [PUBMED Abstract]
- Jeong H, Cho H, Kim H, et al.: Efficacy and safety of prophylactic high-dose MTX in high-risk DLBCL: a treatment intent-based analysis. Blood Adv 5 (8): 2142-2152, 2021. [PUBMED Abstract]
- Orellana-Noia VM, Reed DR, McCook AA, et al.: Single-route CNS prophylaxis for aggressive non-Hodgkin lymphomas: real-world outcomes from 21 US academic institutions. Blood 139 (3): 413-423, 2022. [PUBMED Abstract]
- Lewis KL, Jakobsen LH, Villa D, et al.: High-dose methotrexate is not associated with reduction in CNS relapse in patients with aggressive B-cell lymphoma: an international retrospective study of 2300 high-risk patients. [Abstract] Blood 138 (Suppl 1): A-181, 2021.
- Wilson MR, Eyre TA, Kirkwood AA, et al.: Timing of high-dose methotrexate CNS prophylaxis in DLBCL: a multicenter international analysis of 1384 patients. Blood 139 (16): 2499-2511, 2022. [PUBMED Abstract]
- Haddad PA, Hammoud D, Gallagher KM: Effective central nervous system (CNS) prophylaxis chemotherapy approach in high risk diffuse large B-cell lymphoma (DLBCL): a network meta-analysis. [Abstract] Blood 138 (Suppl 1): A-1461, 2021.
- Villa D, Connors JM, Shenkier TN, et al.: Incidence and risk factors for central nervous system relapse in patients with diffuse large B-cell lymphoma: the impact of the addition of rituximab to CHOP chemotherapy. Ann Oncol 21 (5): 1046-52, 2010. [PUBMED Abstract]
- Ferreri AJ, Donadoni G, Cabras MG, et al.: High Doses of Antimetabolites Followed by High-Dose Sequential Chemoimmunotherapy and Autologous Stem-Cell Transplantation in Patients With Systemic B-Cell Lymphoma and Secondary CNS Involvement: Final Results of a Multicenter Phase II Trial. J Clin Oncol 33 (33): 3903-10, 2015. [PUBMED Abstract]
- Schmitz N, Wu HS: Advances in the Treatment of Secondary CNS Lymphoma. J Clin Oncol 33 (33): 3851-3, 2015. [PUBMED Abstract]
Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido recidivante
Opciones de tratamiento del linfoma no Hodgkin de células B de crecimiento rápido recidivante
En una revisión retrospectiva de múltiples ensayos internacionales, se identificaron 636 pacientes con linfoma difuso de células B grandes (LDCBG) resistente al tratamiento que se definió como enfermedad progresiva o estable, durante la quimioterapia o justo en el momento de finalizar un curso de quimioterapia completo, o recaída dentro del primer año posterior a un trasplante de células madre (TCM) autógeno.[1] Cuando se usó terapia subsiguiente, la tasa de respuesta objetiva fue del 26 %, la tasa de respuesta completa fue del 7 %, la mediana de supervivencia general (SG) fue de 6,3 meses y solo el 20 % de los pacientes estaban vivos a los 2 años. Incluso con la quimioterapia de reinducción con un TCM autógeno planificado, los desenlaces siguen siendo precarios.[2]
Las opciones de tratamiento del linfoma no Hodgkin de células B de crecimiento rápido recidivante son las siguientes:
- Terapia de células T con receptor quimérico para el antígeno (CAR) para la enfermedad primaria resistente al tratamiento o la recaída durante el primer año posterior al tratamiento (o para la recaída después de un TCM autógeno).
- Axicabtagén ciloleucel (axi-cel).
- Lisocabtagén maraleucel (liso-cel).
- Consolidación con trasplante de médula ósea o células madre.
- Tafasitamab y lenalidomida.
- Acopladores biespecíficos de células T.
- Polatuzumab vedotina con rituximab y bendamustina.
- Loncastuximab tesirina.
- Rituximab y lenalidomida.
- Radioterapia paliativa.
Terapia de células T con CAR para la enfermedad primaria resistente al tratamiento o la recaída durante el primer año posterior al tratamiento o después de un TCM autógeno
Los pacientes con LDCB que presentan recaída durante el tratamiento o dentro de los 2 meses siguientes a recibir R-CHOP (rituximab, ciclofosfamida, doxorrubicina, vincristina y prednisona) tienen una enfermedad primaria resistente al tratamiento. Cualquier paciente con recaída de la enfermedad durante el primero año posterior a la quimioterapia con R-CHOP o con enfermedad primaria resistente al tratamiento tiene un pronóstico precario incluso con la reinducción mediante quimioinmunoterapia seguida de un TCM autógeno.[1,2] Los pacientes que recibieron terapia de células T con CAR tuvieron una tasa de supervivencia sin progresión (SSP) a 3 años del 40 % al 50 % al cabo de un seguimiento de 40 meses, un resultado equivalente, de manera retrospectiva, al del TCM autógeno en los registros de médula ósea.[3-6]
En 3 ensayos aleatorizados, se comparó la quimioinmunoterapia seguida de un TCM autógeno y terapia de células T con CAR con quimioinmunoterapia puente o sin esta para pacientes con riesgo alto de recaída de la enfermedad, definida como enfermedad primaria resistente al tratamiento o en recaída dentro de los 12 meses posteriores al tratamiento con R-CHOP inicial.
Evidencia (terapia de células T con CAR):
- En un ensayo aleatorizado prospectivo se incluyeron 359 pacientes con enfermedad primaria resistente al tratamiento o en recaída dentro de los 12 meses posteriores a la quimioterapia R-CHOP inicial. Los pacientes recibieron la terapia de células T con CAR, axicabtagén ciloleucel (axi-cel), con solo corticoesteroides como terapia puente o quimioinmunoterapia de segunda línea (por lo general, R-ICE [rituximab, ifosfamida, etopósido y carboplatino] o R-DHAP [rituximab, dexametasona, dosis altas de citarabina y cisplatino]) seguida de un TCM autógeno.[7,8]
- Al cabo de una mediana de seguimiento de 47,2 meses, la mediana de SG no se alcanzó en la cohorte de axi-cel y fue de 31,1 meses en la cohorte de quimioinmunoterapia. La tasa estimada de SG a 4 años fue del 54,6 % en los pacientes que recibieron axi-cel y del 46,0 % en los pacientes que recibieron quimioinmunoterapia (cociente de riesgos instantáneos [CRI]muerte, 0,73; intervalo de confianza [IC] 95 %, 0,54–0,98; P = 0,03).[8][Nivel de evidencia A1]
- La mediana de SSP evaluada por el investigador fue de 14,7 meses en la cohorte axi-cel y de 3,7 meses en la cohorte de quimioterapia (CRI 0,51; IC 95 % 0,38–0,67).
- En el grupo de quimioinmunoterapia, el 64 % de los pacientes no recibió el TCM autógeno mientras estaban en el estudio debido a respuesta inadecuada, progresión o muerte.[7]
- Se obtuvieron diferencias clínica y estadísticamente significativas en la calidad de vida en el grupo de terapia de células T con CAR en los días 100 y 150, en comparación con el estándar de atención.[7][Nivel de evidencia A2]
- Se presentó síndrome de liberación de citocinas de grado 3 o 4 en el 6 % de los pacientes y neurotoxicidad de grado 3 o 4 en el 21 % de los pacientes.
- En un ensayo aleatorizado prospectivo se incluyeron 184 pacientes con enfermedad primaria resistente al tratamiento o en recaída dentro de los 12 meses posteriores a la quimioterapia R-CHOP inicial. Los pacientes recibieron terapia de células T con CAR, lisocabtagén maraleucel (liso-cel); el 63 % de los pacientes recibieron terapia puente o quimioinmunoterapia de segunda línea, seguida de TCM autógeno.[9]
- Al cabo de una mediana de seguimiento de 17,5 meses, no se alcanzó la mediana de SSP en los pacientes que recibieron liso-cel y fue de 6,2 meses en los pacientes que recibieron quimioinmunoterapia seguida de TCM autógeno (CRI, 0,40; P < 0,0001).[9][Nivel de evidencia B1]
- En el grupo de quimioinmunoterapia del estudio, el 53 % de los pacientes no recibió el TCM autógeno debido a respuesta inadecuada, progresión o muerte.[9]
- Se presentó síndrome de liberación de citocinas de grado 3 en el 1 % de los pacientes y neurotoxicidad de grado 3 en el 4 % de los pacientes. No se produjeron eventos de grado 4 ni 5.
- En un ensayo aleatorizado prospectivo se incluyeron 322 pacientes con enfermedad primaria resistente al tratamiento o en recaída dentro de los 12 meses posteriores a la quimioterapia R-CHOP inicial. Los pacientes recibieron terapia de células T con CAR, tisagenlecleucel; la mayoría de los pacientes recibieron terapia puente para alcanzar una respuesta, o quimioinmunoterapia de segunda línea seguida de TCM autógeno.[10]
- No hubo diferencia en la supervivencia sin complicaciones (SSC) para los pacientes de ninguno de los grupos (CRI, 1,07; IC 95 %, 0,82–1,40; P = 0,69).[10][Nivel de evidencia B1]
- En el grupo de terapia de células T con CAR, el 48 % de los pacientes recibieron dos o más ciclos de quimioinmunoterapia como parte de la terapia puente. Es posible que este abordaje de terapia puente haya producido un número inaceptable de casos de enfermedad progresiva.
En síntesis:
- En los pacientes con LDCBG recidivante de riesgo alto con enfermedad primaria resistente al tratamiento o en recaída dentro de los 12 meses posteriores al tratamiento con quimioterapia a base de R-CHOP, los regímenes de inducción con axi-cel y liso-cel se consideran superiores en comparación con los regímenes de quimioinmunoterapia, como R-ICE, R-DHAP y R-GDP (rituximab, gemcitabina, dexametasona y cisplatino).
- El intervalo hasta que los pacientes reciban las células T con CAR debe reducirse, la manera óptima de lograr esto es mediante el uso de solo corticoesteroides, la eliminación de la quimioinmunoterapia puente y la administración rápida (tanto como sea posible) de la infusión del producto de células T con CAR.
- La preferencia por la terapia de células T con CAR en lugar de la quimioinmunoterapia seguida de TCM autógeno no se aplica a los pacientes que recaen más de 12 meses después de la terapia con R-CHOP.
- La American Society of Clinical Oncology (ASCO) ha elaborado directrices para el tratamiento de los efectos adversos en pacientes que reciben terapia de células T con CAR.[11]
- Se notificaron desenlaces más precarios cuando se hizo la aféresis para el tratamiento de células T con CAR justo después del tratamiento con bendamustina. En una revisión multicéntrica retrospectiva de 439 pacientes que recibieron infusión de células T con CAR dirigidas a CD-19, 80 pacientes habían recibido bendamustina previa. Al cabo de una mediana de seguimiento de 20,6 meses después de la infusión de células T con CAR, los pacientes que habían recibido bendamustina antes tuvieron una tasa de respuesta general más baja (53 vs. 72 %, P < 0,01), una mediana de SSP más precaria (3,1 vs. 6,2 meses, P = 0,04) y una mediana de SG más precaria (4,6 vs. 23,5 meses, P < 0,01).[12][Nivel de evidencia C1]
Consolidación con trasplante de médula ósea o trasplante de células madre
Trasplante de médula ósea
La consolidación con trasplante de médula ósea (TMO) es una opción de tratamiento para los pacientes con recaída del linfoma.[13] En estudios preliminares se indica que entre el 20 % y el 40 % de los pacientes permanecerán sin enfermedad a largo plazo, pero el porcentaje preciso depende de la selección de los pacientes y del tratamiento específico que se use. Los regímenes farmacológicos de preparación varían; algunos investigadores también usan la irradiación corporal total. Se ha logrado un éxito similar con médula autógena, con médula purgada o sin purgar, y con médula alogénica.[14,15]; [16,17][[18]]
Evidencia (TMO):
- En un ensayo prospectivo aleatorizado (EORTC-PARMA) con 215 pacientes menores de 60 años en la primera o segunda recaída de un linfoma de crecimiento rápido y sin compromiso de la médula ósea o del sistema nervioso central, los pacientes recibieron 2 ciclos de quimioterapia combinada intensiva. Los 109 pacientes que respondieron se asignaron de manera aleatoria para recibir 4 ciclos adicionales de quimioterapia y radioterapia dirigida al campo comprometido (RTCC) versus un trasplante de médula ósea (TMO) autógeno seguido de RTCC. Al cabo de una mediana de seguimiento a 5 años, la tasa de SSC mejoró significativamente con el trasplante (46 vs. 12 %). La tasa de SG también fue significativamente mejor con el trasplante (53 vs. 32 %).[19][Nivel de evidencia A1] El TMO de rescate no tuvo éxito en los pacientes con enfermedad en recaída del grupo sin trasplante.
En general, los pacientes que respondieron al tratamiento inicial y que respondieron al tratamiento convencional para la recaída antes del TMO obtuvieron los mejores resultados.[20]
- En un ensayo prospectivo, los pacientes con recaída tardía (>12 meses después del diagnóstico) tuvieron mejor SG que los pacientes con recaída temprana (la tasa de supervivencia a 8 años fue del 29 vs. 13 %, P = 0,001).[21][Nivel de evidencia C1]
Trasplante de células madre periférico
El trasplante de células madre (TCM) periférico ha producido resultados equivalentes al TCM autógeno estándar.[22,23] Incluso los pacientes que nunca han presentado una remisión completa con quimioterapia convencional pueden tener una SSP prolongada (31 % a los 5 años) después de la quimioterapia de dosis alta y un TCM hematopoyético si conservan la quimiosensibilidad a la terapia de reinducción.[24][Nivel de evidencia C2] Algunos pacientes con recaída después de un TCM autógeno previo pueden presentar remisiones duraderas después de un TCM alogénico mielosupresor o no mielosupresor.[25,26]; [27][Nivel de evidencia C3] El acondicionamiento de intensidad reducida para el TCM alogénico suele incluir fludarabina con busulfano o fludarabina con ciclofosfamida, con 2 Gy de irradiación corporal total o sin este.[28]
Evidencia (TCM periférico):
- En un ensayo prospectivo aleatorizado, 396 pacientes con LDCBG en primera recaída o resistente al tratamiento de primera línea recibieron R-ICE o R-DHAP seguido de TCM autógeno.[29]
- No hubo diferencia en la SSC o la SG a 3 años.[29][Nivel de evidencia A1]
- En un ensayo prospectivo aleatorizado, 619 pacientes con linfoma de crecimiento rápido en recaída o resistente al tratamiento recibieron R-DHAP o R-GDP, seguidos de TCM autógeno.[30]
- Al cabo de una mediana de seguimiento de 53 meses, no hubo diferencias en la SSC o la SG, pero los pacientes que recibieron R-GDP notificaron menos efectos tóxicos.[30][Nivel de evidencia A3]
Terapia de células T con CAR para la recaída después de un trasplante de células madre autógeno
En caso de recaída de la enfermedad después de un trasplante de células madre (TCM) autógeno, muchos pacientes reciben consolidación con terapia de células T con CAR.
En múltiples ensayos se describen pacientes con linfoma de células B grandes resistente al tratamiento que recibieron una infusión de células T modificadas para expresar un CAR dirigido al antígeno CD19 que se expresa en las células B malignas mediante el uso de 3 compuestos diferentes: axi-cel, tisagenlecleucel y liso-cel.[31-35] En cada estudio se notificó una tasa de respuesta completa del 50 % al 60 % y una tasa de SG a 2 años del 40 % al 50 %, pero aún no se ha determinado la duración a largo plazo de la respuesta en estos pacientes muy específicos.[31-33][Nivel de evidencia C3] Este tratamiento es una opción para los pacientes con enfermedad resistente al tratamiento. Estos resultados se verificaron fuera del estudio en 2 informes que incluyeron 397 pacientes que recibieron tratamiento después de la aprobación de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA).[36,37][Nivel de evidencia C3] Es posible que, si son aptos, los pacientes con riesgo más alto que responden bien reciban consolidación con un TCM alogénico subsecuente.
La ASCO ha elaborado directrices para el tratamiento de los efectos adversos en pacientes que reciben terapia de células T con CAR.[11]
Tafasitamab y lenalidomida
El tafasitamab es un anticuerpo monoclonal anti-CD19 humanizado con una región Fc fucosilada para mejorar la citotoxicidad celular dependiente de anticuerpos. El tafasitamab se ha estudiado en su mayoría en combinación con lenalidomida.
Evidencia (tafasitamab y lenalidomida):
- En un estudio de fase II, 80 pacientes con LCBG en recaída o resistente al tratamiento no apto para recibir un TCM se trataron con tafasitamab y lenalidomida. En el estudio se excluyeron pacientes con características citogenéticas de riesgo alto (reordenamientos de MYC y BCL2 o BCL6) y aquellos que habían recibido más de 4 líneas de tratamiento previas o terapia dirigida a CD19.[38]
- La tasa de respuesta completa fue del 43 % y la tasa de respuesta objetiva fue del 60 %.
La FDA aprobó la combinación de tafasitamab y lenalidomida para pacientes con LDCBG en recaída o resistente al tratamiento.[38][Nivel de evidencia C3] No está claro si el uso de esta terapia dirigida a CD19 puede interferir en la consolidación de células T con CAR dirigido a CD19.
Acopladores biespecíficos de células T
Los acopladores biespecíficos de células T (BiTE) se unen a CD20 (o CD19) y a CD3 para hacer que las células T destruyan células B malignas.[39]
Epcoritamab
El epcoritamab es un BiTE dirigido a CD20. Se administra por vía subcutánea cada 28 días hasta la progresión de la enfermedad o la toxicidad inaceptable con aumento escalonado semanal de la dosis durante el ciclo 1.
Evidencia (epcoritamab):
- En un ensayo de fase I/II (NCT03625037) se incluyeron 157 pacientes con LDCBG en recaída o resistente al tratamiento después de 2 o más líneas de tratamiento previas.[40]
- Al cabo de una mediana de seguimiento de 10,7 meses, la tasa de respuesta general a 4 años fue del 63,1 % (IC 95 %, 55,0–70,6 %), y la tasa de respuesta completa fue del 38,9 % (IC 95 %, 31,2–46,9 %).[40][Nivel de evidencia C3]
- La mediana de SSP fue de 4,4 meses (IC 95 %, 3,0–7,9).
- No se alcanzó la mediana de SG (IC 95 %, 11,3–no alcanzada).
- El síndrome de liberación de citocinas se presentó en el 49,7 % de los pacientes y fue de grado 3 o mayor en el 2,5 % de los pacientes. El síndrome de neurotoxicidad asociada a células inmunoefectoras (ICANS) se presentó en el 6,4 % de los pacientes y fue de grado 3 o superior en el 0,6 % de los pacientes.
- Los resultados no fueron significativamente diferentes entre 61 receptores de terapia de células T con CAR dirigida a CD19 previa.
Glofitamab
El glofitamab es un BiTE dirigido a CD20 con bivalencia para CD20. Se administra por vía intravenosa cada 21 días durante un máximo de 12 ciclos con aumento escalonado semanal de la dosis durante el ciclo 1.
Evidencia (glofitamab):
- En un ensayo de fase I/II se incluyeron 155 pacientes con LDCBG en recaída o resistente al tratamiento después de 2 o más líneas de tratamiento previas.[39]
- Al cabo de una mediana de seguimiento de 12,6 meses, la tasa de respuesta general a 4 años fue del 52 % (IC 95 %, 43–60 %), y la tasa de respuesta completa fue del 39 % (IC 95 %, 32–48 %).[39][Nivel de evidencia C3]
- La mediana de SSP fue de 4,9 meses (IC 95 %, 3,4–8,1).
- La tasa estimada de SG a 12 meses fue del 50 % (IC 95 %, 41–58 %).
- El síndrome de liberación de citocinas se presentó en el 63 % de los pacientes y fue de grado 3 o mayor en el 4 % de los pacientes. El ICANS se presentó en el 8 % de los pacientes y fue de grado 3 o superior en el 3 % de los pacientes.
- Los resultados no fueron significativamente diferentes entre 52 receptores de terapia de células T con CAR dirigida a CD19 previa.
Polatuzumab vedotina, rituximab y bendamustina
El polatuzumab vedotina es un anticuerpo monoclonal dirigido a CD79b conjugado con el citotóxico vedotina (un conjugado anticuerpo-fármaco).
Evidencia (polatuzumab vedotina, rituximab y bendamustina):
- En un ensayo aleatorizado prospectivo, 80 pacientes con LDCBG en recaída o resistente al tratamiento que no eran aptos para recibir un TCM se trataron con polatuzumab vedotina combinado con bendamustina y rituximab (BR) o BR solo; el criterio principal de valoración fue la respuesta completa.[41]
- La tasa de respuesta completa determinada mediante tomografía por emisión de positrones con tomografía computarizada fue del 40 % para la combinación de polatuzumab vedotina y BR, en comparación con una tasa del 18 % para BR solo (P = 0,026).[41]
- De manera similar, la mediana de la SSP fue más alta para los pacientes que recibieron la combinación de polatuzumab vedotina (9,5 meses) que para los pacientes que recibieron BR solo (3,7 meses) (CRI, 0,36; IC 95 %, 0,21−0,63; P < 0,001); la SG fue de 12,4 meses para los pacientes que recibieron la combinación de polatuzumab vedotina versus 4,7 meses para los pacientes que recibieron BR solo (CRI, 0,42; IC 95 %, 0,24−0,75; P = 0,002).[41][Nivel de evidencia C1]
La FDA aprobó la combinación de polatuzumab vedotina y BR para pacientes con LDCBG en recaída o resistente al tratamiento.
Loncastuximab tesirina
El loncastuximab tesirina es un anticuerpo dirigido a CD19 conjugado con la citotoxina dímero de pirrolobenzodiazepina (un conjugado anticuerpo-fármaco).[42]
Evidencia (loncastuximab tesirina):
- En un ensayo de fase I y en otro ensayo posterior de fase II se incluyeron 184 pacientes con LDCBG en recaída o resistente al tratamiento que no eran aptos para recibir un TCM después de 2 o más líneas de tratamiento.
- La tasa de respuesta general fue del 48,3 % (IC 95 %, 39,9–56,7 %) y la tasa de respuesta completa fue del 24 %.[43,44][Nivel de evidencia C3]
Rituximab y lenalidomida
Evidencia (rituximab y lenalidomida):
- En 2 ensayos de fase II, 49 pacientes demostraron una tasa de respuesta general para el rituximab y lenalidomida del 19 % al 35 %.[45,46][Nivel de evidencia C3]
Radioterapia paliativa
En general, los pacientes con linfoma de crecimiento rápido que recaen con un tipo histológico de crecimiento lento se benefician de la terapia paliativa.[47] Es posible lograr la paliación con dosis muy bajas (4 Gy) de RTCC en los pacientes con recaída de la enfermedad de crecimiento rápido y lento.[48]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Crump M, Neelapu SS, Farooq U, et al.: Outcomes in refractory diffuse large B-cell lymphoma: results from the international SCHOLAR-1 study. Blood 130 (16): 1800-1808, 2017. [PUBMED Abstract]
- Ayers EC, Li S, Medeiros LJ, et al.: Outcomes in patients with aggressive B-cell non-Hodgkin lymphoma after intensive frontline treatment failure. Cancer 126 (2): 293-303, 2020. [PUBMED Abstract]
- Schuster SJ, Tam CS, Borchmann P, et al.: Long-term clinical outcomes of tisagenlecleucel in patients with relapsed or refractory aggressive B-cell lymphomas (JULIET): a multicentre, open-label, single-arm, phase 2 study. Lancet Oncol 22 (10): 1403-1415, 2021. [PUBMED Abstract]
- Shah NN, Ahn KW, Litovich C, et al.: Is autologous transplant in relapsed DLBCL patients achieving only a PET+ PR appropriate in the CAR T-cell era? Blood 137 (10): 1416-1423, 2021. [PUBMED Abstract]
- Shadman M, Pasquini M, Ahn KW, et al.: Autologous transplant vs chimeric antigen receptor T-cell therapy for relapsed DLBCL in partial remission. Blood 139 (9): 1330-1339, 2022. [PUBMED Abstract]
- Cappell KM, Sherry RM, Yang JC, et al.: Long-Term Follow-Up of Anti-CD19 Chimeric Antigen Receptor T-Cell Therapy. J Clin Oncol 38 (32): 3805-3815, 2020. [PUBMED Abstract]
- Locke FL, Miklos DB, Jacobson CA, et al.: Axicabtagene Ciloleucel as Second-Line Therapy for Large B-Cell Lymphoma. N Engl J Med 386 (7): 640-654, 2022. [PUBMED Abstract]
- Westin JR, Oluwole OO, Kersten MJ, et al.: Survival with Axicabtagene Ciloleucel in Large B-Cell Lymphoma. N Engl J Med 389 (2): 148-157, 2023. [PUBMED Abstract]
- Abramson JS, Solomon SR, Arnason J, et al.: Lisocabtagene maraleucel as second-line therapy for large B-cell lymphoma: primary analysis of the phase 3 TRANSFORM study. Blood 141 (14): 1675-1684, 2023. [PUBMED Abstract]
- Bishop MR, Dickinson M, Purtill D, et al.: Second-Line Tisagenlecleucel or Standard Care in Aggressive B-Cell Lymphoma. N Engl J Med 386 (7): 629-639, 2022. [PUBMED Abstract]
- Santomasso BD, Nastoupil LJ, Adkins S, et al.: Management of Immune-Related Adverse Events in Patients Treated With Chimeric Antigen Receptor T-Cell Therapy: ASCO Guideline. J Clin Oncol 39 (35): 3978-3992, 2021. [PUBMED Abstract]
- Iacoboni G, Navarro V, Martín-López AÁ, et al.: Recent Bendamustine Treatment Before Apheresis Has a Negative Impact on Outcomes in Patients With Large B-Cell Lymphoma Receiving Chimeric Antigen Receptor T-Cell Therapy. J Clin Oncol 42 (2): 205-217, 2024. [PUBMED Abstract]
- Shipp MA, Abeloff MD, Antman KH, et al.: International Consensus Conference on high-dose therapy with hematopoietic stem-cell transplantation in aggressive non-Hodgkin's lymphomas: report of the jury. Ann Oncol 10 (1): 13-9, 1999. [PUBMED Abstract]
- Freedman AS, Takvorian T, Anderson KC, et al.: Autologous bone marrow transplantation in B-cell non-Hodgkin's lymphoma: very low treatment-related mortality in 100 patients in sensitive relapse. J Clin Oncol 8 (5): 784-91, 1990. [PUBMED Abstract]
- Phillips GL, Fay JW, Herzig RH, et al.: The treatment of progressive non-Hodgkin's lymphoma with intensive chemoradiotherapy and autologous marrow transplantation. Blood 75 (4): 831-8, 1990. [PUBMED Abstract]
- Chopra R, Goldstone AH, Pearce R, et al.: Autologous versus allogeneic bone marrow transplantation for non-Hodgkin's lymphoma: a case-controlled analysis of the European Bone Marrow Transplant Group Registry data. J Clin Oncol 10 (11): 1690-5, 1992. [PUBMED Abstract]
- Ratanatharathorn V, Uberti J, Karanes C, et al.: Prospective comparative trial of autologous versus allogeneic bone marrow transplantation in patients with non-Hodgkin's lymphoma. Blood 84 (4): 1050-5, 1994. [PUBMED Abstract]
- Mills W, Chopra R, McMillan A, et al.: BEAM chemotherapy and autologous bone marrow transplantation for patients with relapsed or refractory non-Hodgkin's lymphoma. J Clin Oncol 13 (3): 588-95, 1995. [PUBMED Abstract]
- Philip T, Guglielmi C, Hagenbeek A, et al.: Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin's lymphoma. N Engl J Med 333 (23): 1540-5, 1995. [PUBMED Abstract]
- Vellenga E, van Putten WL, van 't Veer MB, et al.: Rituximab improves the treatment results of DHAP-VIM-DHAP and ASCT in relapsed/progressive aggressive CD20+ NHL: a prospective randomized HOVON trial. Blood 111 (2): 537-43, 2008. [PUBMED Abstract]
- Guglielmi C, Gomez F, Philip T, et al.: Time to relapse has prognostic value in patients with aggressive lymphoma enrolled onto the Parma trial. J Clin Oncol 16 (10): 3264-9, 1998. [PUBMED Abstract]
- Vose JM, Anderson JR, Kessinger A, et al.: High-dose chemotherapy and autologous hematopoietic stem-cell transplantation for aggressive non-Hodgkin's lymphoma. J Clin Oncol 11 (10): 1846-51, 1993. [PUBMED Abstract]
- Liberti G, Pearce R, Taghipour G, et al.: Comparison of peripheral blood stem-cell and autologous bone marrow transplantation for lymphoma patients: a case-controlled analysis of the EBMT Registry data. Lymphoma Working Party of the EBMT. Ann Oncol 5 (Suppl 2): 151-3, 1994. [PUBMED Abstract]
- Vose JM, Zhang MJ, Rowlings PA, et al.: Autologous transplantation for diffuse aggressive non-Hodgkin's lymphoma in patients never achieving remission: a report from the Autologous Blood and Marrow Transplant Registry. J Clin Oncol 19 (2): 406-13, 2001. [PUBMED Abstract]
- van Kampen RJ, Canals C, Schouten HC, et al.: Allogeneic stem-cell transplantation as salvage therapy for patients with diffuse large B-cell non-Hodgkin's lymphoma relapsing after an autologous stem-cell transplantation: an analysis of the European Group for Blood and Marrow Transplantation Registry. J Clin Oncol 29 (10): 1342-8, 2011. [PUBMED Abstract]
- Freytes CO, Loberiza FR, Rizzo JD, et al.: Myeloablative allogeneic hematopoietic stem cell transplantation in patients who experience relapse after autologous stem cell transplantation for lymphoma: a report of the International Bone Marrow Transplant Registry. Blood 104 (12): 3797-803, 2004. [PUBMED Abstract]
- Rezvani AR, Norasetthada L, Gooley T, et al.: Non-myeloablative allogeneic haematopoietic cell transplantation for relapsed diffuse large B-cell lymphoma: a multicentre experience. Br J Haematol 143 (3): 395-403, 2008. [PUBMED Abstract]
- Ghosh N, Ahmed S, Ahn KW, et al.: Association of Reduced-Intensity Conditioning Regimens With Overall Survival Among Patients With Non-Hodgkin Lymphoma Undergoing Allogeneic Transplant. JAMA Oncol 6 (7): 1011-1018, 2020. [PUBMED Abstract]
- Gisselbrecht C, Glass B, Mounier N, et al.: Salvage regimens with autologous transplantation for relapsed large B-cell lymphoma in the rituximab era. J Clin Oncol 28 (27): 4184-90, 2010. [PUBMED Abstract]
- Crump M, Kuruvilla J, Couban S, et al.: Randomized comparison of gemcitabine, dexamethasone, and cisplatin versus dexamethasone, cytarabine, and cisplatin chemotherapy before autologous stem-cell transplantation for relapsed and refractory aggressive lymphomas: NCIC-CTG LY.12. J Clin Oncol 32 (31): 3490-6, 2014. [PUBMED Abstract]
- Neelapu SS, Locke FL, Bartlett NL, et al.: Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. N Engl J Med 377 (26): 2531-2544, 2017. [PUBMED Abstract]
- Schuster SJ, Bishop MR, Tam CS, et al.: Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. N Engl J Med 380 (1): 45-56, 2019. [PUBMED Abstract]
- Locke FL, Ghobadi A, Jacobson CA, et al.: Long-term safety and activity of axicabtagene ciloleucel in refractory large B-cell lymphoma (ZUMA-1): a single-arm, multicentre, phase 1-2 trial. Lancet Oncol 20 (1): 31-42, 2019. [PUBMED Abstract]
- Abramson JS, Palomba ML, Gordon LI, et al.: Lisocabtagene maraleucel for patients with relapsed or refractory large B-cell lymphomas (TRANSCEND NHL 001): a multicentre seamless design study. Lancet 396 (10254): 839-852, 2020. [PUBMED Abstract]
- Lin JK, Muffly LS, Spinner MA, et al.: Cost Effectiveness of Chimeric Antigen Receptor T-Cell Therapy in Multiply Relapsed or Refractory Adult Large B-Cell Lymphoma. J Clin Oncol 37 (24): 2105-2119, 2019. [PUBMED Abstract]
- Jacobson CA, Hunter BD, Redd R, et al.: Axicabtagene Ciloleucel in the Non-Trial Setting: Outcomes and Correlates of Response, Resistance, and Toxicity. J Clin Oncol 38 (27): 3095-3106, 2020. [PUBMED Abstract]
- Nastoupil LJ, Jain MD, Feng L, et al.: Standard-of-Care Axicabtagene Ciloleucel for Relapsed or Refractory Large B-Cell Lymphoma: Results From the US Lymphoma CAR T Consortium. J Clin Oncol 38 (27): 3119-3128, 2020. [PUBMED Abstract]
- Salles G, Duell J, González Barca E, et al.: Tafasitamab plus lenalidomide in relapsed or refractory diffuse large B-cell lymphoma (L-MIND): a multicentre, prospective, single-arm, phase 2 study. Lancet Oncol 21 (7): 978-988, 2020. [PUBMED Abstract]
- Dickinson MJ, Carlo-Stella C, Morschhauser F, et al.: Glofitamab for Relapsed or Refractory Diffuse Large B-Cell Lymphoma. N Engl J Med 387 (24): 2220-2231, 2022. [PUBMED Abstract]
- Thieblemont C, Phillips T, Ghesquieres H, et al.: Epcoritamab, a Novel, Subcutaneous CD3xCD20 Bispecific T-Cell-Engaging Antibody, in Relapsed or Refractory Large B-Cell Lymphoma: Dose Expansion in a Phase I/II Trial. J Clin Oncol 41 (12): 2238-2247, 2023. [PUBMED Abstract]
- Sehn LH, Herrera AF, Flowers CR, et al.: Polatuzumab Vedotin in Relapsed or Refractory Diffuse Large B-Cell Lymphoma. J Clin Oncol 38 (2): 155-165, 2020. [PUBMED Abstract]
- Calabretta E, Hamadani M, Zinzani PL, et al.: The antibody-drug conjugate loncastuximab tesirine for the treatment of diffuse large B-cell lymphoma. Blood 140 (4): 303-308, 2022. [PUBMED Abstract]
- Caimi PF, Ai W, Alderuccio JP, et al.: Loncastuximab tesirine in relapsed or refractory diffuse large B-cell lymphoma (LOTIS-2): a multicentre, open-label, single-arm, phase 2 trial. Lancet Oncol 22 (6): 790-800, 2021. [PUBMED Abstract]
- Hamadani M, Radford J, Carlo-Stella C, et al.: Final results of a phase 1 study of loncastuximab tesirine in relapsed/refractory B-cell non-Hodgkin lymphoma. Blood 137 (19): 2634-2645, 2021. [PUBMED Abstract]
- Zinzani PL, Pellegrini C, Gandolfi L, et al.: Combination of lenalidomide and rituximab in elderly patients with relapsed or refractory diffuse large B-cell lymphoma: a phase 2 trial. Clin Lymphoma Myeloma Leuk 11 (6): 462-6, 2011. [PUBMED Abstract]
- Wiernik PH, Lossos IS, Tuscano JM, et al.: Lenalidomide monotherapy in relapsed or refractory aggressive non-Hodgkin's lymphoma. J Clin Oncol 26 (30): 4952-7, 2008. [PUBMED Abstract]
- Lee AY, Connors JM, Klimo P, et al.: Late relapse in patients with diffuse large-cell lymphoma treated with MACOP-B. J Clin Oncol 15 (5): 1745-53, 1997. [PUBMED Abstract]
- Haas RL, Poortmans P, de Jong D, et al.: Effective palliation by low dose local radiotherapy for recurrent and/or chemotherapy refractory non-follicular lymphoma patients. Eur J Cancer 41 (12): 1724-30, 2005. [PUBMED Abstract]
Tratamiento del linfoma linfoblástico de células B y la leucemia linfoblástica aguda de células B
El linfoma linfoblástico es una forma muy maligna de linfoma no Hodgkin que se presenta, a menudo, pero no de manera exclusiva, en pacientes jóvenes. El linfoma linfoblástico es la manifestación linfomatosa de la leucemia linfoblástica aguda (LLA). Los paradigmas de tratamiento se basan en los ensayos clínicos para la LLA, porque el linfoma linfoblástico y la LLA se consideran diferentes manifestaciones de la misma enfermedad biológica. El linfoma linfoblástico a menudo produce masas mediastínicas grandes y tiene una gran tendencia a diseminarse a la médula ósea y el sistema nervioso central SNC. Para obtener más información, consultar Tratamiento de la leucemia linfoblástica aguda.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Tratamiento del linfoma difuso de células pequeñas no hendidas o linfoma de Burkitt
El linfoma difuso de células pequeñas no hendidas o linfoma de Burkitt, en general, afecta a pacientes más jóvenes y constituyen el tipo más común de linfoma no Hodgkin en pediatría.[1,2] El linfoma de células B de grado alto, sin otra indicación, incluye linfomas con características morfológicas tipo Burkitt o blastoides, sin mutación doble en el análisis citogenético y los que exhiben un fenotipo de células B de centro germinal.[3] Hasta la mitad de los pacientes presentan un único reordenamiento de MYC. El tratamiento óptimo no está bien definido porque el diagnóstico es poco frecuente. Se suelen elegir los regímenes usados para el linfoma de Burkitt con profilaxis del sistema nervioso central (SNC).[3]
Opciones de tratamiento del linfoma difuso de células pequeñas no hendidas o linfoma de Burkitt
Las opciones de tratamiento del linfoma difuso de células pequeñas no hendidas o linfoma de Burkitt son las siguientes:
Regímenes multifarmacológicos intensivos
El tratamiento del linfoma difuso de células pequeñas no hendidas o linfoma de Burkitt suele ser un régimen multifarmacológico intensivo similar a los usados para los linfomas de crecimiento rápido en estadio avanzado (como el linfoma difuso de células grandes).[4-6] Los factores pronósticos adversos incluyen la edad mayor a 40 años, una elevación de las concentraciones séricas de lactato–deshidrogenasa (>3 veces de lo normal), estado funcional 2 o superior según el Eastern Cooperative Oncology Group y compromiso del SNC.[2] En una revisión retrospectiva de 641 pacientes adultos con linfoma de Burkitt de 30 centros oncológicos de los Estados Unidos, se encontró una tasa de supervivencia sin progresión (SSP) a 3 años del 64 %. Entre los pacientes, el 19 % presentó compromiso en el SNC y el 14 % presentó enfermedad primaria resistente al tratamiento; la tasa de mortalidad relacionada con el tratamiento fue del 10 %.[2]
Evidencia (regímenes multifarmacológicos intensivos):
- La quimioterapia combinada intensiva, similar a la que se usa para el linfoma de Burkitt infantil, ha resultado muy exitosa en pacientes adultos. Más del 60 % de los pacientes en estadio avanzado estaban sin enfermedad a los 5 años.[6-9]
- El rituximab se ha incorporado a estos regímenes intensivos de quimioterapia combinada. En un ensayo no aleatorizado multicéntrico prospectivo de un solo grupo, en 363 pacientes de 16 a 85 años, se observó una tasa de SSP a 5 años del 71 % y una tasa de supervivencia general a 5 años del 80 %.[5][Nivel de evidencia C1]
Profilaxis del sistema nervioso central
Los pacientes con linfoma difuso de células pequeñas no hendidas o linfoma de Burkitt tienen un riesgo de por vida del 20 % al 30 % de compromiso del SNC. Se recomienda la profilaxis del SNC con metotrexato para todos los pacientes, por lo general, se administran de 4 a 6 inyecciones intratecales.[10] Para obtener más información, consultar Tratamiento de la leucemia linfoblástica aguda.
Evidencia (profilaxis del sistema nervioso central):
- En una serie de 41 pacientes tratados con quimioterapia sistémica e intratecal, el 44 % de aquellos que presentaron enfermedad en el SNC y el 13 % de aquellos que recayeron con compromiso del SNC sobrevivieron a largo plazo sin enfermedad.[11] Los modelos de recaída en el SNC fueron similares con independencia de que los pacientes recibieran o no radioterapia, pero se notó un aumento de alteraciones neurológicas en aquellos que recibieron radioterapia.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Blum KA, Lozanski G, Byrd JC: Adult Burkitt leukemia and lymphoma. Blood 104 (10): 3009-20, 2004. [PUBMED Abstract]
- Evens AM, Danilov A, Jagadeesh D, et al.: Burkitt lymphoma in the modern era: real-world outcomes and prognostication across 30 US cancer centers. Blood 137 (3): 374-386, 2021. [PUBMED Abstract]
- Olszewski AJ, Kurt H, Evens AM: Defining and treating high-grade B-cell lymphoma, NOS. Blood 140 (9): 943-954, 2022. [PUBMED Abstract]
- Thomas DA, Faderl S, O'Brien S, et al.: Chemoimmunotherapy with hyper-CVAD plus rituximab for the treatment of adult Burkitt and Burkitt-type lymphoma or acute lymphoblastic leukemia. Cancer 106 (7): 1569-80, 2006. [PUBMED Abstract]
- Hoelzer D, Walewski J, Döhner H, et al.: Improved outcome of adult Burkitt lymphoma/leukemia with rituximab and chemotherapy: report of a large prospective multicenter trial. Blood 124 (26): 3870-9, 2014. [PUBMED Abstract]
- Roschewski M, Dunleavy K, Abramson JS, et al.: Multicenter Study of Risk-Adapted Therapy With Dose-Adjusted EPOCH-R in Adults With Untreated Burkitt Lymphoma. J Clin Oncol 38 (22): 2519-2529, 2020. [PUBMED Abstract]
- Magrath I, Adde M, Shad A, et al.: Adults and children with small non-cleaved-cell lymphoma have a similar excellent outcome when treated with the same chemotherapy regimen. J Clin Oncol 14 (3): 925-34, 1996. [PUBMED Abstract]
- Hoelzer D, Ludwig WD, Thiel E, et al.: Improved outcome in adult B-cell acute lymphoblastic leukemia. Blood 87 (2): 495-508, 1996. [PUBMED Abstract]
- Mead GM, Sydes MR, Walewski J, et al.: An international evaluation of CODOX-M and CODOX-M alternating with IVAC in adult Burkitt's lymphoma: results of United Kingdom Lymphoma Group LY06 study. Ann Oncol 13 (8): 1264-74, 2002. [PUBMED Abstract]
- Rizzieri DA, Johnson JL, Niedzwiecki D, et al.: Intensive chemotherapy with and without cranial radiation for Burkitt leukemia and lymphoma: final results of Cancer and Leukemia Group B Study 9251. Cancer 100 (7): 1438-48, 2004. [PUBMED Abstract]
- Magrath IT, Haddy TB, Adde MA: Treatment of patients with high grade non-Hodgkin's lymphomas and central nervous system involvement: is radiation an essential component of therapy? Leuk Lymphoma 21 (1-2): 99-105, 1996. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (05/15/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Este resumen es nuevo.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del linfoma no Hodgkin de células B de crecimiento rápido en adultos. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido son:
- Eric J. Seifter, MD (Johns Hopkins University)
- Cole H. Sterling, MD (Johns Hopkins University)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/linfoma/pro/tratamiento-linfoma-celulas-b-crecimiento-rapido-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.