Tratamiento del linfoma no Hodgkin periférico de células T (PDQ®)–Versión para profesionales de salud
Información general sobre el linfoma no Hodgkin periférico de células T
Los linfomas de células T son un grupo heterogéneo de neoplasias malignas linfoproliferativas de células o linfocitos T, que representan menos del 15 % de los linfomas no Hodgkin (LNH). Estas neoplasias también se conocen como linfomas no hodgkinianos de células T.[1] Alrededor del 85 % de los casos de LNH son linfomas de células B. Para obtener más información, consultar Tratamiento del linfoma no Hodgkin de células B de crecimiento lento y Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido.
Los linfomas de células T se dividen en el linfoma linfoblástico de células T o leucemia linfocítica aguda, los linfomas cutáneos de células T y los linfomas periféricos de células T (LPCT).
El linfoma linfoblástico de células T o leucemia linfoblástica aguda es una enfermedad que surge de células T muy tempranas, suele comprometer el timo y es más común en adultos jóvenes. A menudo, la enfermedad del tipo linfoma se trata de manera similar a la del tipo leucemia. Para obtener más información, consultar Tratamiento de la leucemia linfoblástica aguda infantil.
Los linfomas cutáneos de células T comienzan en la piel e incluyen, entre otros, la micosis fungoide, el síndrome de Sézary y el linfoma anaplásico de células grandes cutáneo primario. Para obtener más información, consultar Tratamiento de la micosis fungoide y otros linfomas cutáneos de células T.
Los LPCT se originan a partir de células T maduras y, por lo general, surge en los tejidos linfoides y se pueden diseminar a otros órganos. Los subconjuntos de LPCT incluyen el linfoma anaplásico de células grandes (LACG), el linfoma angioinmunoblástico de células T (LACT), el linfoma extraganglionar de células T-NK, los linfomas periféricos de células T sin otra indicación (LPCT-SAI), el linfoma de células T asociado a enteropatía (LTAE), la leucemia o linfoma de células T en adultos (LLCTA) y la leucemia prolinfocítica de células T (LPL-T), entre otros.
Incidencia y mortalidad
Los linfomas de células T representan menos del 15 % de los casos de LNH. La mayoría de los subtipos de linfomas de células T se relacionan con desenlaces más precarios que los de los linfomas de células B.[1]
Características anatómicas
Los LNH, por lo general, se originan en los tejidos linfoides.
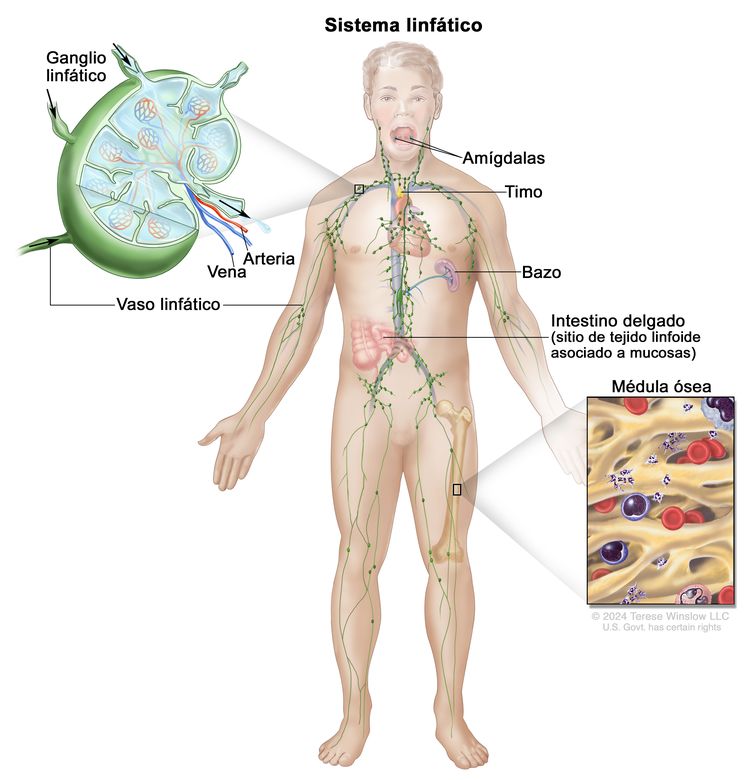
Pronóstico y supervivencia
El pronóstico del LPCT varía según el subtipo, el estadio y otros factores. En general, el LPCT se relaciona con un pronóstico precario, con una tasa de supervivencia a 5 años del 30 % al 40 %.[2,3] Mientras que los desenlaces son mejores para los pacientes con LACG positivo para ALK, con una mediana de supervivencia general (SG) a 5 años del 70 % al 80 %;[2-4] otros subconjuntos de linfomas se relacionan con una supervivencia más precaria, como el linfoma anaplásico de células grandes negativo para ALK, el linfoma inmunoblástico de células T, el linfoma periférico de células T sin otra indicación, el linfoma hepatoesplénico de células T, el linfoma de células T asociado a enteropatía, y el linfoma extraganglionar de células T-NK.[5,6]
A diferencia de los LNH de células B, que incluyen tipos de linfoma de crecimiento lento (es decir, de bajo grado de malignidad o indolentes) y de crecimiento rápido (es decir, de alto grado de malignidad o agresivos), la mayoría de los LPCT se consideran de crecimiento rápido.[7] Al igual que con la mayoría de los otros linfomas de crecimiento rápido, los LPCT a menudo se curan con terapia sistémica, aunque las opciones de tratamiento eficaces son más limitadas, en especial cuando hay recaída o resistencia al tratamiento.[8,9]
Aunque los tratamientos vigentes son curativos en una proporción significativa de los pacientes con linfoma, se están llevando a cabo numerosos ensayos clínicos para mejorar el tratamiento. En lo posible, los pacientes se deben incluir en estos estudios.
Además, en estos pacientes con linfomas de crecimiento rápido se recomienda la detección sistemática de la infección por el virus de la inmunodeficiencia humana (VIH) y la presencia de hepatitis B o C activa antes de que comiencen la quimioterapia.[10,11] Los pacientes en quienes se detecta el virus de la hepatitis B (VHB) se benefician de la profilaxis con entecavir.[12,13] Los pacientes con infección por el VHB resuelta (es decir, enfermedad negativa para el antígeno de superficie del virus de la hepatitis B, pero positiva para el anticuerpo central del mismo virus) están en riesgo de reactivación de la infección por el VHB y necesitan vigilancia del DNA del VHB. En un estudio retrospectivo de 326 pacientes, la terapia profiláctica con nucleósidos redujo la reactivación de la infección por el VHB de un 10,8 % a un 2,1 %.[14] Los pacientes a los que se administra quimioterapia combinada suelen recibir profilaxis con aciclovir o valaciclovir para el virus del herpes zóster y profilaxis con trimetoprima-sulfametoxazol o dapsona para Pneumocystis.
Bibliografía
- American Cancer Society: Types of T-cell lymphoma. American Cancer Society, 2018. Available online. Last accessed May 13, 2025.
- Vose J, Armitage J, Weisenburger D, et al.: International peripheral T-cell and natural killer/T-cell lymphoma study: pathology findings and clinical outcomes. J Clin Oncol 26 (25): 4124-30, 2008. [PUBMED Abstract]
- Ellin F, Landström J, Jerkeman M, et al.: Real-world data on prognostic factors and treatment in peripheral T-cell lymphomas: a study from the Swedish Lymphoma Registry. Blood 124 (10): 1570-7, 2014. [PUBMED Abstract]
- Sibon D, Fournier M, Brière J, et al.: Long-term outcome of adults with systemic anaplastic large-cell lymphoma treated within the Groupe d'Etude des Lymphomes de l'Adulte trials. J Clin Oncol 30 (32): 3939-46, 2012. [PUBMED Abstract]
- Petrich AM, Helenowski IB, Bryan LJ, et al.: Factors predicting survival in peripheral T-cell lymphoma in the USA: a population-based analysis of 8802 patients in the modern era. Br J Haematol 168 (5): 708-18, 2015. [PUBMED Abstract]
- Foss FM, Horwitz SM, Civallero M, et al.: Incidence and outcomes of rare T cell lymphomas from the T Cell Project: hepatosplenic, enteropathy associated and peripheral gamma delta T cell lymphomas. Am J Hematol 95 (2): 151-155, 2020. [PUBMED Abstract]
- Armitage JO: The aggressive peripheral T-cell lymphomas: 2017. Am J Hematol 92 (7): 706-715, 2017. [PUBMED Abstract]
- Bellei M, Foss FM, Shustov AR, et al.: The outcome of peripheral T-cell lymphoma patients failing first-line therapy: a report from the prospective, International T-Cell Project. Haematologica 103 (7): 1191-1197, 2018. [PUBMED Abstract]
- Lansigan F, Horwitz SM, Pinter-Brown LC, et al.: Outcomes for Relapsed and Refractory Peripheral T-Cell Lymphoma Patients after Front-Line Therapy from the COMPLETE Registry. Acta Haematol 143 (1): 40-50, 2020. [PUBMED Abstract]
- Niitsu N, Hagiwara Y, Tanae K, et al.: Prospective analysis of hepatitis B virus reactivation in patients with diffuse large B-cell lymphoma after rituximab combination chemotherapy. J Clin Oncol 28 (34): 5097-100, 2010. [PUBMED Abstract]
- Dong HJ, Ni LN, Sheng GF, et al.: Risk of hepatitis B virus (HBV) reactivation in non-Hodgkin lymphoma patients receiving rituximab-chemotherapy: a meta-analysis. J Clin Virol 57 (3): 209-14, 2013. [PUBMED Abstract]
- Huang YH, Hsiao LT, Hong YC, et al.: Randomized controlled trial of entecavir prophylaxis for rituximab-associated hepatitis B virus reactivation in patients with lymphoma and resolved hepatitis B. J Clin Oncol 31 (22): 2765-72, 2013. [PUBMED Abstract]
- Li H, Zhang HM, Chen LF, et al.: Prophylactic lamivudine to improve the outcome of HBsAg-positive lymphoma patients during chemotherapy: a systematic review and meta-analysis. Clin Res Hepatol Gastroenterol 39 (1): 80-92, 2015. [PUBMED Abstract]
- Kusumoto S, Arcaini L, Hong X, et al.: Risk of HBV reactivation in patients with B-cell lymphomas receiving obinutuzumab or rituximab immunochemotherapy. Blood 133 (2): 137-146, 2019. [PUBMED Abstract]
Efectos tardíos del tratamiento del linfoma no Hodgkin periférico de células T
Se han observado efectos tardíos del tratamiento del linfoma no Hodgkin (LNH). Es posible que se presente una alteración de la fertilidad o la capacidad reproductiva después de la exposición a alquilantes.[1] Hasta tres décadas después del diagnóstico, los pacientes tienen un riesgo significativamente elevado de presentar segundos cánceres primarios, en especial los siguientes:[2-5]
- Cáncer de pulmón.
- Cáncer de encéfalo.
- Cáncer de riñón.
- Cáncer de vejiga.
- Melanoma.
- Linfoma de Hodgkin.
- Leucemia no linfocítica aguda.
La disfunción ventricular izquierda fue un efecto tardío significativo en los sobrevivientes a largo plazo de LNH de grado alto que recibieron más de 200 mg/m² de doxorrubicina.[1,6]
El síndrome mielodisplásico y la leucemia mielógena aguda son complicaciones tardías de la terapia mielosupresora con apoyo de médula ósea autógena o células madre periféricas, así como de la quimioterapia convencional con alquilantes.[3,7-14] La mayoría de estos pacientes presentan hematopoyesis clonal incluso antes del trasplante, lo que indica que la lesión hematológica por lo general se presenta durante la quimioterapia de inducción o reinducción.[9,15,16] Se realizó un seguimiento, durante una mediana de 10 años, de una serie de 605 pacientes que recibieron trasplante de médula ósea (TMO) autógeno con ciclofosfamida y radioterapia corporal total (como acondicionamiento). La incidencia de una segunda neoplasia maligna fue del 21 %, y el 10 % de esas neoplasias malignas fueron tumores sólidos.[17]
En un estudio de mujeres jóvenes que recibieron TMO autógeno, se notificaron embarazos exitosos con bebés que nacieron sin anomalías congénitas.[18] La tromboembolia venosa tardía se puede presentar después de un TMO alogénico o autógeno.[19]
Algunos pacientes presentan osteopenia u osteoporosis al inicio del tratamiento; es posible que la densidad ósea empeore después del tratamiento para el linfoma.[20]
Bibliografía
- Haddy TB, Adde MA, McCalla J, et al.: Late effects in long-term survivors of high-grade non-Hodgkin's lymphomas. J Clin Oncol 16 (6): 2070-9, 1998. [PUBMED Abstract]
- Travis LB, Curtis RE, Glimelius B, et al.: Second cancers among long-term survivors of non-Hodgkin's lymphoma. J Natl Cancer Inst 85 (23): 1932-7, 1993. [PUBMED Abstract]
- Mudie NY, Swerdlow AJ, Higgins CD, et al.: Risk of second malignancy after non-Hodgkin's lymphoma: a British Cohort Study. J Clin Oncol 24 (10): 1568-74, 2006. [PUBMED Abstract]
- Hemminki K, Lenner P, Sundquist J, et al.: Risk of subsequent solid tumors after non-Hodgkin's lymphoma: effect of diagnostic age and time since diagnosis. J Clin Oncol 26 (11): 1850-7, 2008. [PUBMED Abstract]
- Major A, Smith DE, Ghosh D, et al.: Risk and subtypes of secondary primary malignancies in diffuse large B-cell lymphoma survivors change over time based on stage at diagnosis. Cancer 126 (1): 189-201, 2020. [PUBMED Abstract]
- Moser EC, Noordijk EM, van Leeuwen FE, et al.: Long-term risk of cardiovascular disease after treatment for aggressive non-Hodgkin lymphoma. Blood 107 (7): 2912-9, 2006. [PUBMED Abstract]
- Darrington DL, Vose JM, Anderson JR, et al.: Incidence and characterization of secondary myelodysplastic syndrome and acute myelogenous leukemia following high-dose chemoradiotherapy and autologous stem-cell transplantation for lymphoid malignancies. J Clin Oncol 12 (12): 2527-34, 1994. [PUBMED Abstract]
- Stone RM, Neuberg D, Soiffer R, et al.: Myelodysplastic syndrome as a late complication following autologous bone marrow transplantation for non-Hodgkin's lymphoma. J Clin Oncol 12 (12): 2535-42, 1994. [PUBMED Abstract]
- Armitage JO, Carbone PP, Connors JM, et al.: Treatment-related myelodysplasia and acute leukemia in non-Hodgkin's lymphoma patients. J Clin Oncol 21 (5): 897-906, 2003. [PUBMED Abstract]
- André M, Mounier N, Leleu X, et al.: Second cancers and late toxicities after treatment of aggressive non-Hodgkin lymphoma with the ACVBP regimen: a GELA cohort study on 2837 patients. Blood 103 (4): 1222-8, 2004. [PUBMED Abstract]
- Oddou S, Vey N, Viens P, et al.: Second neoplasms following high-dose chemotherapy and autologous stem cell transplantation for malignant lymphomas: a report of six cases in a cohort of 171 patients from a single institution. Leuk Lymphoma 31 (1-2): 187-94, 1998. [PUBMED Abstract]
- Lenz G, Dreyling M, Schiegnitz E, et al.: Moderate increase of secondary hematologic malignancies after myeloablative radiochemotherapy and autologous stem-cell transplantation in patients with indolent lymphoma: results of a prospective randomized trial of the German Low Grade Lymphoma Study Group. J Clin Oncol 22 (24): 4926-33, 2004. [PUBMED Abstract]
- McLaughlin P, Estey E, Glassman A, et al.: Myelodysplasia and acute myeloid leukemia following therapy for indolent lymphoma with fludarabine, mitoxantrone, and dexamethasone (FND) plus rituximab and interferon alpha. Blood 105 (12): 4573-5, 2005. [PUBMED Abstract]
- Morton LM, Curtis RE, Linet MS, et al.: Second malignancy risks after non-Hodgkin's lymphoma and chronic lymphocytic leukemia: differences by lymphoma subtype. J Clin Oncol 28 (33): 4935-44, 2010. [PUBMED Abstract]
- Mach-Pascual S, Legare RD, Lu D, et al.: Predictive value of clonality assays in patients with non-Hodgkin's lymphoma undergoing autologous bone marrow transplant: a single institution study. Blood 91 (12): 4496-503, 1998. [PUBMED Abstract]
- Lillington DM, Micallef IN, Carpenter E, et al.: Detection of chromosome abnormalities pre-high-dose treatment in patients developing therapy-related myelodysplasia and secondary acute myelogenous leukemia after treatment for non-Hodgkin's lymphoma. J Clin Oncol 19 (9): 2472-81, 2001. [PUBMED Abstract]
- Brown JR, Yeckes H, Friedberg JW, et al.: Increasing incidence of late second malignancies after conditioning with cyclophosphamide and total-body irradiation and autologous bone marrow transplantation for non-Hodgkin's lymphoma. J Clin Oncol 23 (10): 2208-14, 2005. [PUBMED Abstract]
- Jackson GH, Wood A, Taylor PR, et al.: Early high dose chemotherapy intensification with autologous bone marrow transplantation in lymphoma associated with retention of fertility and normal pregnancies in females. Scotland and Newcastle Lymphoma Group, UK. Leuk Lymphoma 28 (1-2): 127-32, 1997. [PUBMED Abstract]
- Gangaraju R, Chen Y, Hageman L, et al.: Risk of venous thromboembolism in patients with non-Hodgkin lymphoma surviving blood or marrow transplantation. Cancer 125 (24): 4498-4508, 2019. [PUBMED Abstract]
- Westin JR, Thompson MA, Cataldo VD, et al.: Zoledronic acid for prevention of bone loss in patients receiving primary therapy for lymphomas: a prospective, randomized controlled phase III trial. Clin Lymphoma Myeloma Leuk 13 (2): 99-105, 2013. [PUBMED Abstract]
Clasificación celular del linfoma no Hodgkin periférico de células T
Se debe consultar con un patólogo antes de realizar una biopsia porque algunos estudios exigen una preparación especial del tejido (por ejemplo, tejido congelado). El conocimiento de los marcadores de superficie celular y los reordenamientos de los genes de inmunoglobulinas y del receptor de células T puede ser útil al momento de tomar decisiones diagnósticas y terapéuticas. El exceso clonal de cadenas ligeras de inmunoglobulina permite diferenciar las células linfoides malignas de las células reactivas. Es muy importante que un hematopatólogo con experiencia en el diagnóstico de linfomas realice un examen minucioso de las muestras de biopsia externas porque las características histopatológicas afectan el pronóstico y el abordaje del tratamiento. Aunque se recomienda obtener biopsias de ganglios linfáticos cuando sea posible, a veces los datos inmunofenotípicos son suficientes para establecer un diagnóstico de linfoma cuando es preferible hacer un estudio citológico mediante aspiración con aguja fina o biopsia con aguja gruesa.[1,2]
Sistemas de clasificación vigentes
Clasificación REAL modificada por la Organización Mundial de la Salud
En la modificación que la Organización Mundial de la Salud (OMS) hizo a la clasificación europea americana revisada del linfoma (Revised European American Lymphoma [REAL]) se reconocen tres categorías principales de neoplasias linfoides malignas según la morfología y el linaje celular: neoplasias de células B, neoplasias de células T o de células citolíticas naturales (NK), y linfoma de Hodgkin (LH). En esta clasificación, se incluyen los linfomas y las leucemias linfoides porque las fases sólidas y circulantes de estas enfermedades se encuentran en muchas neoplasias linfoides, así que la distinción entre ellas es artificial. Por ejemplo, la leucemia linfocítica crónica (LLC) de células B y el linfoma linfocítico de células B pequeñas son distintas manifestaciones de la misma neoplasia, al igual que los linfomas linfoblásticos y las leucemias linfocíticas agudas. Dentro de las categorías de células B y células T, se reconocen dos subdivisiones: neoplasias precursoras, que corresponden a los estadios más tempranos de diferenciación, y neoplasias diferenciadas más maduras.[3,4]
Neoplasias de células B
- Neoplasias de células B precursoras: leucemia linfoblástica aguda de células B precursoras o linfoma linfoblástico de células B precursoras.
- Neoplasias de células B periféricas.
- Leucemia linfocítica crónica de células B o linfoma linfocítico de células B pequeñas.
- Leucemia prolinfocítica de células B.
- Linfoma linfoplasmocítico o inmunocitoma.
- Linfoma de células de manto.
- Linfoma folicular.
- Linfoma extraganglionar de células B de zona marginal de tejido linfoide asociado a mucosas.
- Linfoma ganglionar de células B de zona marginal (± células B monocitoides).
- Linfoma esplénico de zona marginal (± linfocitos vellosos).
- Leucemia de células pilosas.
- Plasmocitoma o mieloma de células plasmáticas.
- Linfoma difuso de células B grandes.
- Linfoma de Burkitt.
Neoplasias de células T y posiblemente derivadas de células NK
- Neoplasias de células T precursoras: leucemia linfoblástica aguda de células T precursoras o linfoma linfoblástico de células T precursoras. Para obtener más información, consultar Tratamiento de la leucemia linfoblástica aguda.
- Neoplasias periféricas de células T-NK.
- Leucemia linfocítica crónica de células T o leucemia prolinfocítica de células T.
- Leucemia linfocítica granular de células T.
- Micosis fungoide (incluso el síndrome de Sézary).
- Linfoma periférico de células T sin otra indicación.
- Linfoma hepatoesplénico de células T γ-δ.
- Linfoma subcutáneo de células T similar a la paniculitis.
- Linfoma extraganglionar de células T-NK de tipo nasal.
- Linfomas ganglionares de origen de células T auxiliares foliculares (incluso linfoma angioinmunoblástico de células T, linfoma periférico de células T foliculares y linfoma ganglionar periférico de células T con fenotipo auxiliar folicular T).
- Linfoma intestinal de células T asociado a enteropatía.
- Linfoma intestinal epiteliotrópico monomórfico de células T.
- Leucemia o linfoma de células T en adultos (virus linfotrópico humano de células T de tipo 1 [VLHT] 1+).
- Linfoma anaplásico de células grandes de tipo sistémico primario.
- Linfoma anaplásico de células grandes de tipo cutáneo primario.
- Leucemia de células NK de crecimiento rápido (agresiva).
Linfoma de Hodgkin
- Linfoma de Hodgkin con predominio linfocítico nodular.
- Linfoma de Hodgkin clásico.
- Linfoma de Hodgkin con esclerosis nodular.
- Linfoma de Hodgkin clásico rico en linfocitos.
- Linfoma de Hodgkin con celularidad mixta.
- Linfoma de Hodgkin con agotamiento linfocítico.
La clasificación REAL abarca todas las neoplasias linfoproliferativas. Para obtener más información, consultar los siguientes resúmenes del PDQ:
- Tratamiento de la leucemia linfoblástica aguda
- Tratamiento de la leucemia linfocítica crónica
- Tratamiento de la leucemia de células pilosas
- Tratamiento del linfoma de Hodgkin
- Tratamiento del linfoma relacionado con el SIDA
- Tratamiento del linfoma no Hodgkin de células B de crecimiento lento
- Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido
- Tratamiento del linfoma no Hodgkin periférico de células T
- Tratamiento de la micosis fungoide y otros linfomas cutáneos de células T
- Tratamiento de las neoplasias de células plasmáticas (incluso mieloma múltiple)
- Tratamiento del linfoma primario del sistema nervioso central
Subtipos del linfoma no Hodgkin periférico de células T
Los linfomas no Hodgkin periféricos de células T incluyen, entre otros, los siguientes subtipos:
- Linfoma anaplásico de células grandes.
- Linfomas ganglionares (nodales) de origen en las células T cooperadoras foliculares (incluso el linfoma angioinmunoblástico de células T, el linfoma periférico de células T foliculares y el linfoma ganglionar periférico de células T con fenotipo T cooperador folicular).
- Linfoma periférico de células T sin otra indicación.
- Linfoma extraganglionar de células T-NK (linfocitos T/NK).
- Linfoma intestinal de células T asociado a enteropatía y monomórfico epiteliotrópico.
- Linfoma hepatoesplénico de células T.
- Linfoma de células T de crecimiento lento (indolente) de tubo digestivo.
- Leucemia o linfoma de células T en adultos.
- Leucemia prolinfocítica de células T.
- Linfomas cutáneos de células T (como la micosis fungoide y el síndrome de Sézary, el linfoma subcutáneo de células T similar a la paniculitis, el linfoma anaplásico de células grandes cutáneo primario, el linfoma cutáneo primario de células T γ-δ, y otros). Para obtener más información, consultar Tratamiento de la micosis fungoide y otros linfomas cutáneos de células T.
- Leucemia linfocítica granular de células T. Para obtener más información, consultar Tratamiento de la leucemia linfocítica crónica.
Bibliografía
- Zeppa P, Marino G, Troncone G, et al.: Fine-needle cytology and flow cytometry immunophenotyping and subclassification of non-Hodgkin lymphoma: a critical review of 307 cases with technical suggestions. Cancer 102 (1): 55-65, 2004. [PUBMED Abstract]
- Young NA, Al-Saleem T: Diagnosis of lymphoma by fine-needle aspiration cytology using the revised European-American classification of lymphoid neoplasms. Cancer 87 (6): 325-45, 1999. [PUBMED Abstract]
- Pileri SA, Milani M, Fraternali-Orcioni G, et al.: From the R.E.A.L. Classification to the upcoming WHO scheme: a step toward universal categorization of lymphoma entities? Ann Oncol 9 (6): 607-12, 1998. [PUBMED Abstract]
- Society for Hematopathology Program: Society for Hematopathology Program. Am J Surg Pathol 21 (1): 114-121, 1997.
Información sobre los estadios del linfoma no Hodgkin periférico de células T
El estadio es importante para la selección del tratamiento en pacientes con linfoma no Hodgkin (LNH). Por lo general, las tomografías computarizadas (TC) del tórax y el abdomen forman parte de la evaluación para la estadificación de todos los pacientes con linfoma. El sistema de estadificación para el LNH es similar al que se usa para el linfoma de Hodgkin (LH).
Es común que los pacientes con LNH presenten compromiso de los siguientes sitios:
- Ganglios linfáticos no adyacentes.
- Anillo de Waldeyer.
- Ganglios epitrocleares.
- Tubo digestivo.
- Sitios extraganglionares. (En ocasiones, una localización extraganglionar es el único sitio comprometido en pacientes con un linfoma difuso).
- Médula ósea.
- Hígado (muy común en pacientes con linfomas de grado bajo).
El examen citológico del líquido cefalorraquídeo a veces da un resultado positivo en pacientes con LNH de crecimiento rápido. El compromiso de los ganglios linfáticos hiliares y mediastínicos es menos común que en los pacientes con LH. Sin embargo, las adenopatías mediastínicas son una característica destacada del linfoma linfoblástico y del linfoma mediastínico primario de células B, que se presentan sobre todo en adultos jóvenes.
La mayoría de los pacientes con LNH consultan con una enfermedad avanzada (estadio III o IV) que a menudo se identifica mediante tomografías computarizadas (TC) o biopsias de la médula ósea y de otros sitios comprometidos accesibles. En una revisión retrospectiva de más de 32 000 casos de linfoma en Francia, hasta el 40 % de los diagnósticos se confirmaron mediante biopsia con aguja gruesa y el 60 % mediante biopsia por escisión.[1] Después de la revisión por expertos, la biopsia con aguja gruesa proporcionó un diagnóstico definitivo en el 92,3 % de los casos; mientras que la biopsia por escisión proporcionó un diagnóstico definitivo en el 98,1 % de los casos (P < 0,0001). Por lo general, no se requiere una biopsia laparoscópica o laparotomía para la estadificación, pero es posible que en raras ocasiones se necesite para establecer un diagnóstico o determinar el tipo histológico del linfoma.[2]
La tomografía por emisión de positrones (TEP) con flúor F 18-fludesoxiglucosa se puede usar para la estadificación inicial. También quizás se utilice durante el seguimiento después del tratamiento como complemento de la TC.[3] En múltiples estudios se demostró que las TEP intermedias después de 2 a 4 ciclos de terapia no aportan información pronóstica confiable. En un ensayo de grupo cooperativo grande (ECOG-E344 [NCT00274924]) se notificaron problemas de reproducibilidad entre los observadores. En 2 ensayos prospectivos y en 1 metanálisis no se observaron diferencias en los desenlaces entre los pacientes con resultados negativos en la TEP y los pacientes con resultados positivos en la TEP pero que tenían resultados negativos en la biopsia.[4-7]
En un estudio retrospectivo de 130 pacientes con linfoma difuso de células B grandes, la TEP permitió identificar el compromiso de la médula ósea con importancia clínica; la biopsia de médula ósea no llevó a la sobreestadificación de ningún paciente con linfoma.[8] En un estudio retrospectivo de 580 pacientes con linfoma folicular de 7 ensayos patrocinados por el Instituto Nacional del Cáncer, no se observó ninguna mejora en la evaluación de la respuesta al tratamiento cuando se añadió la biopsia de la médula ósea a las imágenes radiológicas.[9] La evaluación del LNH debe incluir una biopsia de la médula ósea cuando el resultado posiblemente conlleve un cambio en el tratamiento (por ejemplo, si se encuentra un estadio limitado vs. uno avanzado) o durante la evaluación de la presencia de citopenias.
Sistema de estadificación
Clasificación de Lugano
El American Joint Committee on Cancer (AJCC) adoptó la clasificación de Lugano para evaluar y estadificar el linfoma.[10] El sistema de clasificación de Lugano reemplazó el sistema de clasificación de Ann Arbor, que se adoptó en 1971 en la conferencia de Ann Arbor,[11] y que fue modificado 18 años después en la reunión de Cotswolds.[12,13]
| Estadio | Descripción del estadio | Imagen |
|---|---|---|
| LCR = líquido cefalorraquídeo; TC = tomografía computarizada; LDCBG = linfoma difuso de células B grandes; LNH = linfoma no Hodgkin. | ||
| aHodgkin and Non-Hodgkin Lymphomas. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8.ª edición Nueva York, NY: Springer, 2017, pp. 937-58. | ||
| bEl estadio II con gran masa tumoral (tumor voluminoso) quizás se considere un estadio temprano o avanzado en función de las características histológicas y los factores pronósticos del linfoma. | ||
| cLa definición de una gran masa tumoral varía según las características histológicas del linfoma. En la clasificación de Lugano, una gran masa tumoral en el linfoma de Hodgkin se define como una masa que mide más de un tercio del diámetro torácico en la TC del tórax, o una masa que mide >10 cm. Las definiciones recomendadas para una gran masa tumoral en el LNH varían de acuerdo a las características histológicas del linfoma. En el linfoma folicular, se sugirió la medida de 6 cm a partir del Follicular Lymphoma International Prognostic Index-2 y su validación. En el LDCBG, se han usado valores de corte que oscilan entre 5 cm y 10 cm, aunque el límite recomendado es de 10 cm. | ||
| Estadio limitado | ||
| I | Compromiso de un solo sitio linfático (es decir, una región ganglionar, el anillo de Waldeyer, el timo o el bazo). |
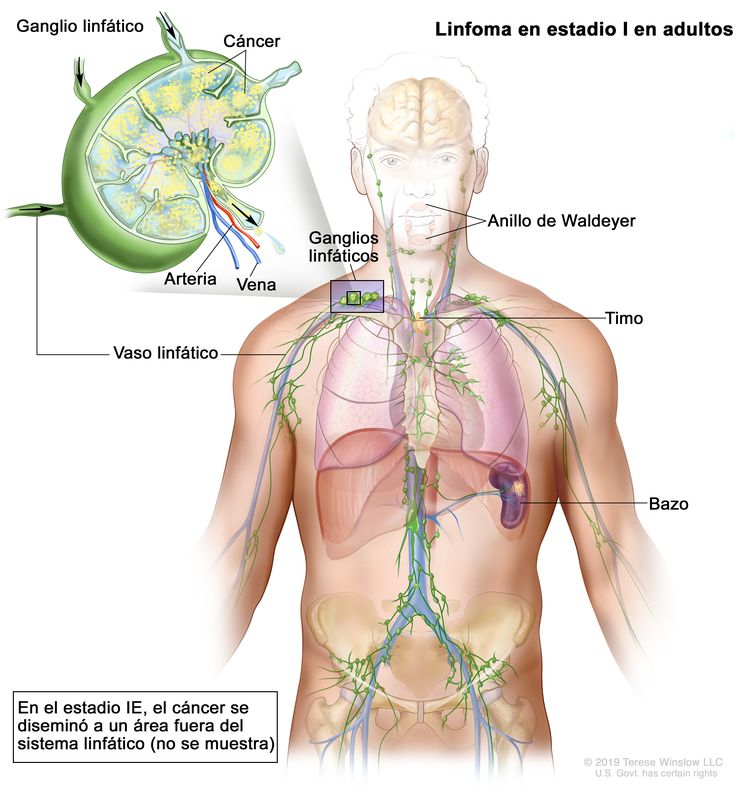 |
| IE | Compromiso de 1 solo sitio extralinfático sin compromiso ganglionar (infrecuente en el linfoma de Hodgkin). | |
| II | Compromiso de 2 o más regiones ganglionares en el mismo lado del diafragma. |
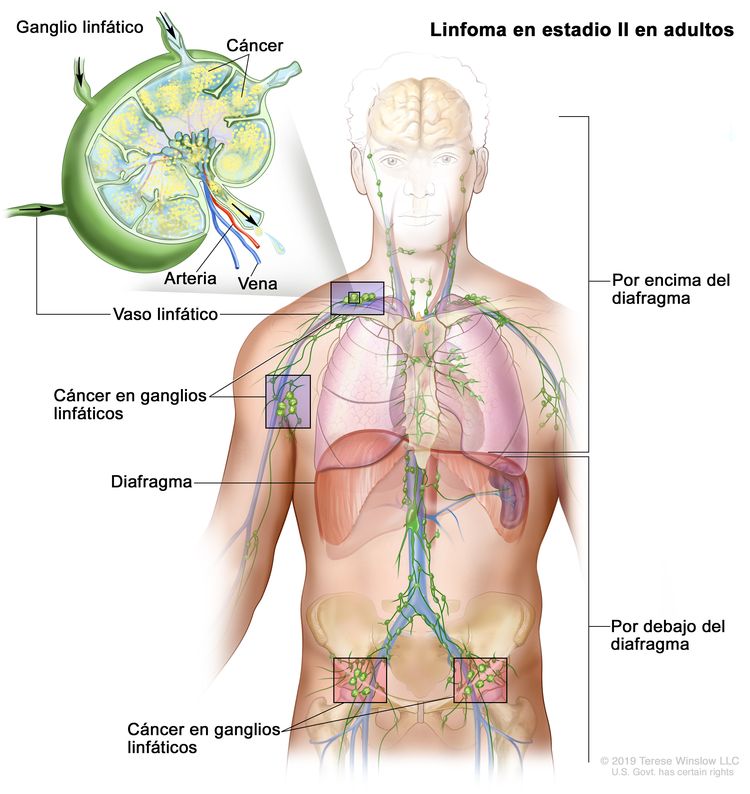 |
| IIE | Diseminación extralinfática adyacente desde un sitio ganglionar con compromiso de otras regiones ganglionares en el mismo lado del diafragma o sin este. |
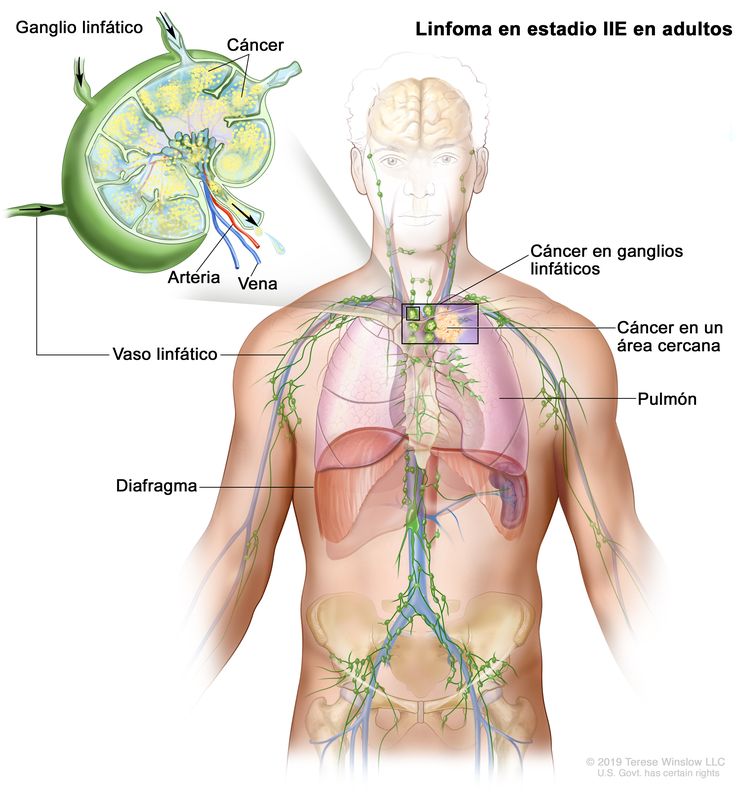 |
| II con gran masa tumoralb | Estadio II con gran masa tumoralc | |
| Estadio avanzado | ||
| III | Compromiso de regiones ganglionares en ambos lados del diafragma; adenopatías por encima del diafragma y compromiso esplénico. |
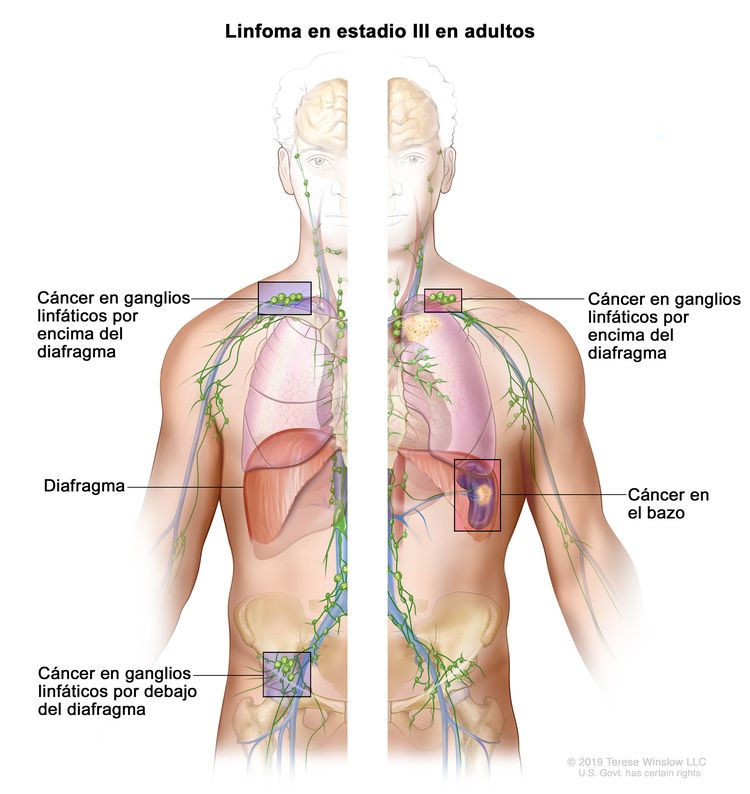 |
| IV | Compromiso difuso o diseminación a uno o más órganos extralinfáticos con compromiso ganglionar o sin este; compromiso de órgano extralinfático no adyacente con enfermedad ganglionar en estadio II; o compromiso de cualquier órgano extralinfático con enfermedad ganglionar en estadio III. El estadio IV incluye cualquier tipo de compromiso del LCR, la médula ósea y el hígado, o la presencia de lesiones pulmonares múltiples (diferentes a las lesiones por diseminación directa de una enfermedad en estadio IIE). |
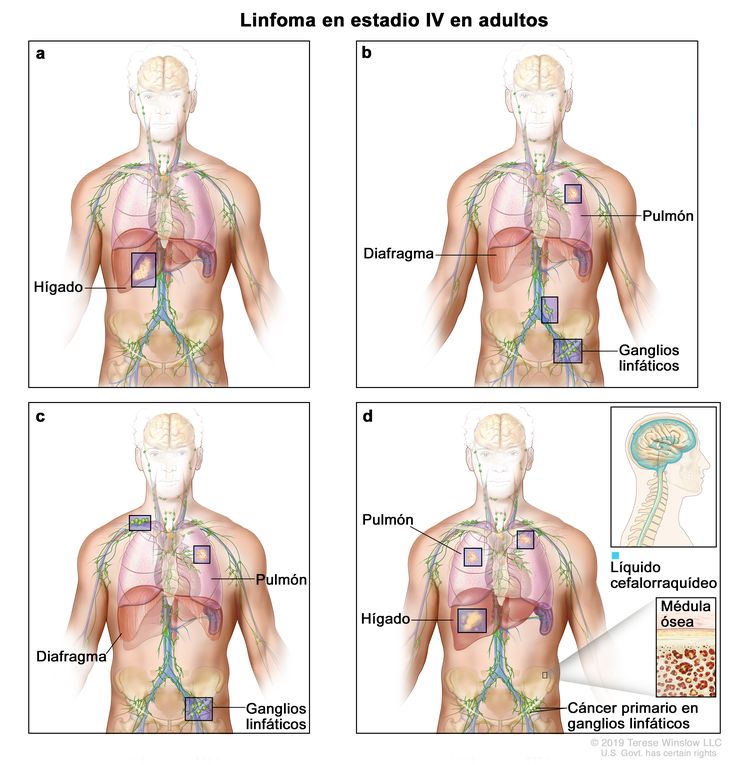 |
| Nota: Se utiliza la designación A o B junto con el grupo de estadio para el linfoma de Hodgkin. En el LNH ya no se utiliza la designación A ni B. | ||
En ocasiones, se usan otros sistemas de estadificación especializados. El médico debe estar al tanto del sistema que se usa en el informe del paciente.
La designación E se usa cuando aparecen neoplasias linfoides extraganglionares malignas en tejidos separados de los conglomerados linfáticos principales pero cercanos a estos. El estadio IV indica una enfermedad con diseminación difusa por todo un sitio extraganglionar, como el hígado. Si el compromiso de uno o más sitios extralinfáticos se documentó mediante estudio patológico, se usa el símbolo del sitio comprometido seguido por el signo más (+).
| N = ganglios | H = hígado | L = pulmón | M = médula ósea |
| S = bazo | P = pleura | O = hueso | D = piel |
En la práctica actual se asigna un estadio clínico a partir de los hallazgos de la evaluación clínica y un estadio patológico a partir de los hallazgos de los procedimientos invasivos adicionales a la biopsia inicial.
Por ejemplo, es posible que se encuentre un compromiso del hígado y la médula ósea mediante una biopsia percutánea en un paciente con adenopatía inguinal sin síntomas sistémicos que tiene un resultado positivo en el linfangiograma. El estadio exacto para dicho paciente sería estadio clínico IIA, estadio patológico IVA(H+)(M+).
Hay otros factores que no se incluyen en el sistema de estadificación anterior, pero que son importantes para la estadificación y el pronóstico de los pacientes con LNH. Estos factores son los siguientes:
- Edad.
- Estado funcional (EF).
- Tamaño del tumor.
- Concentraciones de lactato–deshidrogenasa (LDH).
- Número de sitios con compromiso extraganglionar.
En el índice pronóstico internacional de la National Comprehensive Cancer Network (National Comprehensive Cancer Network International Prognostic Index [NCCN-IPI]) para el linfoma no Hodgkin (LNH) de crecimiento rápido (linfoma difuso de células grandes) se identifican los siguientes 5 factores de riesgo significativos para el pronóstico de la supervivencia general (SG) y los puntajes de riesgo relacionado:[14]
- Edad.
- <40 años: 0.
- 41–60 años: 1.
- 61–75 años: 2.
- >75 años: 3.
- Estadio III o IV: 1.
- Estado funcional (EF) 2, 3 o 4: 1.
- Concentración sérica de lactato–deshidrogenasa (LDH).
- Normalizada: 0.
- >1x–3x: 1.
- >3x: 2.
- Número de sitios extraganglionares ≥2: 1.
Puntajes de riesgo:
- Bajo (0 o 1): Tasa de SG a 5 años, 96 %; tasa de supervivencia sin progresión (SSP), 91 %.
- Intermedio bajo (2 o 3): Tasa de SG a 5 años, 82 %; tasa de SSP, 74 %.
- Intermedio alto (4 o 5): Tasa de SG a 5 años, 64 %; tasa de SSP, 51 %.
- Alto (>6): Tasa de SG a 5 años, 33 %; tasa de SSP, 30 %.
Bibliografía
- Syrykh C, Chaouat C, Poullot E, et al.: Lymph node excisions provide more precise lymphoma diagnoses than core biopsies: a French Lymphopath network survey. Blood 140 (24): 2573-2583, 2022. [PUBMED Abstract]
- Mann GB, Conlon KC, LaQuaglia M, et al.: Emerging role of laparoscopy in the diagnosis of lymphoma. J Clin Oncol 16 (5): 1909-15, 1998. [PUBMED Abstract]
- Barrington SF, Mikhaeel NG, Kostakoglu L, et al.: Role of imaging in the staging and response assessment of lymphoma: consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol 32 (27): 3048-58, 2014. [PUBMED Abstract]
- Horning SJ, Juweid ME, Schöder H, et al.: Interim positron emission tomography scans in diffuse large B-cell lymphoma: an independent expert nuclear medicine evaluation of the Eastern Cooperative Oncology Group E3404 study. Blood 115 (4): 775-7; quiz 918, 2010. [PUBMED Abstract]
- Moskowitz CH, Schöder H, Teruya-Feldstein J, et al.: Risk-adapted dose-dense immunochemotherapy determined by interim FDG-PET in Advanced-stage diffuse large B-Cell lymphoma. J Clin Oncol 28 (11): 1896-903, 2010. [PUBMED Abstract]
- Pregno P, Chiappella A, Bellò M, et al.: Interim 18-FDG-PET/CT failed to predict the outcome in diffuse large B-cell lymphoma patients treated at the diagnosis with rituximab-CHOP. Blood 119 (9): 2066-73, 2012. [PUBMED Abstract]
- Sun N, Zhao J, Qiao W, et al.: Predictive value of interim PET/CT in DLBCL treated with R-CHOP: meta-analysis. Biomed Res Int 2015: 648572, 2015. [PUBMED Abstract]
- Khan AB, Barrington SF, Mikhaeel NG, et al.: PET-CT staging of DLBCL accurately identifies and provides new insight into the clinical significance of bone marrow involvement. Blood 122 (1): 61-7, 2013. [PUBMED Abstract]
- Rutherford SC, Yin J, Pederson L, et al.: Relevance of Bone Marrow Biopsies for Response Assessment in US National Cancer Institute National Clinical Trials Network Follicular Lymphoma Clinical Trials. J Clin Oncol 41 (2): 336-342, 2023. [PUBMED Abstract]
- Hodgkin and non-Hodgkin lymphoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 937–58.
- Carbone PP, Kaplan HS, Musshoff K, et al.: Report of the Committee on Hodgkin's Disease Staging Classification. Cancer Res 31 (11): 1860-1, 1971. [PUBMED Abstract]
- Lister TA, Crowther D, Sutcliffe SB, et al.: Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin's disease: Cotswolds meeting. J Clin Oncol 7 (11): 1630-6, 1989. [PUBMED Abstract]
- National Cancer Institute sponsored study of classifications of non-Hodgkin's lymphomas: summary and description of a working formulation for clinical usage. The Non-Hodgkin's Lymphoma Pathologic Classification Project. Cancer 49 (10): 2112-35, 1982. [PUBMED Abstract]
- Zhou Z, Sehn LH, Rademaker AW, et al.: An enhanced International Prognostic Index (NCCN-IPI) for patients with diffuse large B-cell lymphoma treated in the rituximab era. Blood 123 (6): 837-42, 2014. [PUBMED Abstract]
Tratamiento del linfoma anaplásico de células grandes
El linfoma anaplásico de células grandes (LACG) es un linfoma periférico de células T relacionado con el antígeno CD30. La translocación en los cromosomas 2 y 5 crea una proteína de fusión única formada por la nucleofosmina y la cinasa del linfoma anaplásico (ALK).[1,2] Los pacientes cuyos linfomas expresan ALK en pruebas inmunohistoquímicas son, por lo general, más jóvenes y a veces presentan síntomas sistémicos, compromiso extraganglionar y enfermedad en estadio avanzado. Sin embargo, tienen una tasa de supervivencia más favorable que los pacientes con enfermedad negativa para ALK.[3,4] El LACG negativo para ALK se ha caracterizado además por la presencia de reordenamientos cromosómicos en DUSP22 y variantes patogénicas de TP63. Si bien los reordenamientos en el gen DUSP22 se relacionan con un mejor pronóstico, las variantes patogénicas de TP63 se relacionan con desenlaces más precarios.[5]
Opciones de tratamiento del linfoma anaplásico de células grandes
- En un ensayo aleatorizado prospectivo se incluyeron 452 pacientes con linfoma de células T positivo para CD30 (expresión de CD30 >10 %). De estos pacientes, el 70 % tenía LACG (22 % con enfermedad positiva para ALK y 48 % con enfermedad negativa para ALK). En el ensayo se comparó el régimen estándar utilizado antes, CHOP (ciclofosfamida, doxorrubicina, vincristina y prednisona), con brentuximab vedotina (un anticuerpo monoclonal anti-CD30 conjugado con un citotóxico) combinado con ciclofosfamida, doxorrubicina y prednisona (régimen A+CHP).[6]
- Al cabo de una mediana de seguimiento de 47,6 meses, las tasas de supervivencia general (SG) a 5 años fueron del 70,1 % (intervalo de confianza [IC] 95 %, 63,3–75,9 %) para los pacientes que recibieron A+CHP y del 61,0 % (IC 95 %, 54,0–67,3 %) para los pacientes que recibieron CHOP (cociente de riesgos instantáneos [CRI], 0,72; IC 95 %, 0,53–0,99).[7][Nivel de evidencia A1]
- Las tasas de supervivencia sin progresión (SSP) a 5 años fueron del 51,4 % (IC 95 %, 42,8–59,4 %) para los pacientes que recibieron A+CHP y del 43,0 % (IC 95 %, 35,8–50,0 %) para los pacientes que recibieron CHOP (CRI, 0,70; IC 95 %, 0,53–0,91).
- Esto permitió establecer el régimen A+CHP como una nueva opción para los pacientes con LACG u otros linfomas de células T positivos para CD30, como el linfoma angioinmunoblástico de células T y el linfoma periférico de células T sin otra indicación.
- En pacientes con recaída de la enfermedad, se notificaron respuestas anecdóticas con brentuximab vedotina,[8-11] romidepsina[12] y pralatrexato.[13][[14][Nivel de evidencia C3]
- En un estudio de fase II (NCT00866047), el 66 % de 58 pacientes logró una respuesta completa con brentuximab vedotina.[11]
- Al cabo de una mediana de seguimiento de 58 meses, la tasa de SSP a 5 años fue del 57 % (IC 95 %, 41–74 %) y la tasa de SG a 5 años fue del 79 % (IC 95 %, 65–92 %). De los pacientes que lograron una respuesta completa, el 42 % se sometió a trasplante de células madre (TCM) hematopoyéticas.[11][Nivel de evidencia C3]
- En una revisión retrospectiva, 39 pacientes con recaída de la enfermedad tuvieron una tasa de SSP a 3 años del 50 % después de un TCM autógeno o alogénico.[15][Nivel de evidencia C2]
- En una revisión retrospectiva de 84 pacientes con LACG negativo para ALK, se indicó un beneficio en la supervivencia con el TCM autógeno. Esta hipótesis requiere confirmación en un ensayo prospectivo aleatorizado.[16][Nivel de evidencia C3]
- En un estudio retrospectivo, se incluyeron 182 pacientes con LACG en recaída o resistente al tratamiento (23 % positivos para ALK, 21 % negativos para ALK y 56 % con estado para ALK desconocido) sometidos a TCM alogénico.[17]
- La tasa de SSP a 5 años fue del 41 % (IC 95 %, 34–49 %) y la tasa de SG a 5 años fue del 41 % (IC 95 %, 49–64 %).[17][Nivel de evidencia C3]
- En el análisis multivariante, la raza afroamericana (CRI, 2,7; IC 95 %, 1,6–4,8; P < 0,001) y la enfermedad resistente al tratamiento en el momento del TCM alogénico (CRI, 3,2; IC 95 %, 1,6–6,2; P < 0,001) fueron factores predictivos de SG inferior.
- Aunque la positividad para ALK fue un factor de pronóstico favorable, en este estudio los desenlaces después de un TCM alogénico no variaron significativamente a partir del estado de ALK.
El LACG en la niñez por lo general se caracteriza por enfermedad sistémica y cutánea con tasas de respuesta elevadas y una SG buena cuando se usa quimioterapia combinada a base de doxorrubicina.[18] El crizotinib, un inhibidor de ALK, se ha combinado con quimioterapia en pacientes pediátricos sin tratamiento previo, y el crizotinib se ha usado para controlar la enfermedad en pacientes pediátricos con recaídas múltiples.[19,20] El crizotinib acarrea un riesgo alto (alrededor del 25 %) de tromboembolia, en especial, embolia pulmonar, por lo que se recomienda administrar profilaxis. No hay informes que respalden el uso de crizotinib en adultos.
Linfoma anaplásico de células grandes asociado a implantes de mama
Los pacientes con LACG asociado a implantes o prótesis de mama a veces evolucionan bien sin quimioterapia después de someterse a capsulectomía y extracción del implante si la enfermedad está confinada a la cápsula fibrosa y no hay masas ni linfadenopatía relacionadas.[21-24] La mayoría de los pacientes con LACG asociado a implantes de mama presentan una deleción característica en 20Q13.13 que quizás sea útil para el diagnóstico ya que ayuda a diferenciarlo del LACG cutáneo o sistémico.[25]
El LACG cutáneo primario es una entidad distinta que suele ser negativa para ALK y tiene una evolución clínica muy lenta (indolente o de grado bajo). El LACG asociado a implantes de mama casi siempre se presenta con implantes que tienen una superficie texturizada (los llamados implantes macrotexturizados) que ayuda a adherirse a la mama. En todo el mundo se han emitido advertencias, suspensiones y prohibiciones de implantes macrotexturizados. El riesgo de LACG asociado a implantes de mama es de cerca de 1 de cada 12 000 personas, pero este riesgo quizás aumente con un seguimiento posterior.[26]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Bai RY, Ouyang T, Miething C, et al.: Nucleophosmin-anaplastic lymphoma kinase associated with anaplastic large-cell lymphoma activates the phosphatidylinositol 3-kinase/Akt antiapoptotic signaling pathway. Blood 96 (13): 4319-27, 2000. [PUBMED Abstract]
- Hapgood G, Savage KJ: The biology and management of systemic anaplastic large cell lymphoma. Blood 126 (1): 17-25, 2015. [PUBMED Abstract]
- Gascoyne RD, Aoun P, Wu D, et al.: Prognostic significance of anaplastic lymphoma kinase (ALK) protein expression in adults with anaplastic large cell lymphoma. Blood 93 (11): 3913-21, 1999. [PUBMED Abstract]
- Sibon D, Fournier M, Brière J, et al.: Long-term outcome of adults with systemic anaplastic large-cell lymphoma treated within the Groupe d'Etude des Lymphomes de l'Adulte trials. J Clin Oncol 30 (32): 3939-46, 2012. [PUBMED Abstract]
- Onaindia A, de Villambrosía SG, Prieto-Torres L, et al.: DUSP22-rearranged anaplastic lymphomas are characterized by specific morphological features and a lack of cytotoxic and JAK/STAT surrogate markers. Haematologica 104 (4): e158-e162, 2019. [PUBMED Abstract]
- Horwitz S, O'Connor OA, Pro B, et al.: Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON-2): a global, double-blind, randomised, phase 3 trial. Lancet 393 (10168): 229-240, 2019. [PUBMED Abstract]
- Horwitz S, O'Connor OA, Pro B, et al.: The ECHELON-2 Trial: 5-year results of a randomized, phase III study of brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma. Ann Oncol 33 (3): 288-298, 2022. [PUBMED Abstract]
- Younes A, Bartlett NL, Leonard JP, et al.: Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas. N Engl J Med 363 (19): 1812-21, 2010. [PUBMED Abstract]
- Pro B, Advani R, Brice P, et al.: Brentuximab vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large-cell lymphoma: results of a phase II study. J Clin Oncol 30 (18): 2190-6, 2012. [PUBMED Abstract]
- Prince HM, Kim YH, Horwitz SM, et al.: Brentuximab vedotin or physician's choice in CD30-positive cutaneous T-cell lymphoma (ALCANZA): an international, open-label, randomised, phase 3, multicentre trial. Lancet 390 (10094): 555-566, 2017. [PUBMED Abstract]
- Pro B, Advani R, Brice P, et al.: Five-year results of brentuximab vedotin in patients with relapsed or refractory systemic anaplastic large cell lymphoma. Blood 130 (25): 2709-2717, 2017. [PUBMED Abstract]
- O'Connor OA, Horwitz S, Masszi T, et al.: Belinostat in Patients With Relapsed or Refractory Peripheral T-Cell Lymphoma: Results of the Pivotal Phase II BELIEF (CLN-19) Study. J Clin Oncol 33 (23): 2492-9, 2015. [PUBMED Abstract]
- Coiffier B, Pro B, Prince HM, et al.: Results from a pivotal, open-label, phase II study of romidepsin in relapsed or refractory peripheral T-cell lymphoma after prior systemic therapy. J Clin Oncol 30 (6): 631-6, 2012. [PUBMED Abstract]
- O'Connor OA, Horwitz S, Hamlin P, et al.: Phase II-I-II study of two different doses and schedules of pralatrexate, a high-affinity substrate for the reduced folate carrier, in patients with relapsed or refractory lymphoma reveals marked activity in T-cell malignancies. J Clin Oncol 27 (26): 4357-64, 2009. [PUBMED Abstract]
- Smith SM, Burns LJ, van Besien K, et al.: Hematopoietic cell transplantation for systemic mature T-cell non-Hodgkin lymphoma. J Clin Oncol 31 (25): 3100-9, 2013. [PUBMED Abstract]
- Brink M, Meeuwes FO, van der Poel MWM, et al.: Impact of etoposide and ASCT on survival among patients aged <65 years with stage II to IV PTCL: a population-based cohort study. Blood 140 (9): 1009-1019, 2022. [PUBMED Abstract]
- Furqan F, Ahn KW, Chen Y, et al.: Allogeneic haematopoietic cell transplant in patients with relapsed/refractory anaplastic large cell lymphoma. Br J Haematol 200 (1): 54-63, 2023. [PUBMED Abstract]
- Seidemann K, Tiemann M, Schrappe M, et al.: Short-pulse B-non-Hodgkin lymphoma-type chemotherapy is efficacious treatment for pediatric anaplastic large cell lymphoma: a report of the Berlin-Frankfurt-Münster Group Trial NHL-BFM 90. Blood 97 (12): 3699-706, 2001. [PUBMED Abstract]
- Lowe EJ, Reilly AF, Lim MS, et al.: Crizotinib in Combination With Chemotherapy for Pediatric Patients With ALK+ Anaplastic Large-Cell Lymphoma: The Results of Children's Oncology Group Trial ANHL12P1. J Clin Oncol 41 (11): 2043-2053, 2023. [PUBMED Abstract]
- Mossé YP, Voss SD, Lim MS, et al.: Targeting ALK With Crizotinib in Pediatric Anaplastic Large Cell Lymphoma and Inflammatory Myofibroblastic Tumor: A Children's Oncology Group Study. J Clin Oncol 35 (28): 3215-3221, 2017. [PUBMED Abstract]
- Miranda RN, Aladily TN, Prince HM, et al.: Breast implant-associated anaplastic large-cell lymphoma: long-term follow-up of 60 patients. J Clin Oncol 32 (2): 114-20, 2014. [PUBMED Abstract]
- Clemens MW, Medeiros LJ, Butler CE, et al.: Complete Surgical Excision Is Essential for the Management of Patients With Breast Implant-Associated Anaplastic Large-Cell Lymphoma. J Clin Oncol 34 (2): 160-8, 2016. [PUBMED Abstract]
- Mehta-Shah N, Clemens MW, Horwitz SM: How I treat breast implant-associated anaplastic large cell lymphoma. Blood 132 (18): 1889-1898, 2018. [PUBMED Abstract]
- Jaffe ES, Ashar BS, Clemens MW, et al.: Best Practices Guideline for the Pathologic Diagnosis of Breast Implant-Associated Anaplastic Large-Cell Lymphoma. J Clin Oncol 38 (10): 1102-1111, 2020. [PUBMED Abstract]
- Los-de Vries GT, de Boer M, van Dijk E, et al.: Chromosome 20 loss is characteristic of breast implant-associated anaplastic large cell lymphoma. Blood 136 (25): 2927-2932, 2020. [PUBMED Abstract]
- Kinslow CJ, Kim A, Sanchez GI, et al.: Incidence of Anaplastic Large-Cell Lymphoma of the Breast in the US, 2000 to 2018. JAMA Oncol 8 (9): 1354-1356, 2022. [PUBMED Abstract]
Tratamiento de los linfomas ganglionares de origen en las células T cooperadoras foliculares
En la clasificación de la Organización Mundial de la Salud (OMS) de 2016 se reconoció que los linfomas ganglionares de origen en las células T cooperadoras foliculares (TFH) eran un subconjunto distinto del linfoma periférico de células T (LPCT). Cuando se unifica según el origen de células TFH positivas para CD4 (CD4+), este subconjunto incluye los siguientes subtipos:[1]
- Linfoma angioinmunoblástico de células T (LACT o LAIT).
- Linfoma periférico de células T foliculares.
- Linfoma ganglionar periférico de células T (LPCT) con fenotipo T cooperador folicular (fenotipo TFH).
El LACT es el más común de esta lista, y el segundo subtipo más común de LPCT.[2-5] Los pacientes suelen presentar linfadenopatía grave, fiebre, hiperhidrosis nocturna, pérdida de peso, exantema, prueba de Coombs positiva e hipergammaglobulinemia policlonal.[6] Las infecciones oportunistas son frecuentes debido a una inmunodeficiencia subyacente. En la mayoría de los pacientes afectados, se detectan genomas del virus de Epstein-Barr en las células B.[7] Para obtener más información sobre la pérdida de peso, consultar La nutrición en el tratamiento del cáncer y para obtener más información sobre el exantema, consultar Prurito.
Los subtipos restantes de linfomas ganglionares de origen en las células TFH, como el linfoma periférico de células T foliculares y linfoma ganglionar periférico de células T con fenotipo TFH, se derivan de la misma célula de origen. Sin embargo, a diferencia del LACT, estos subtipos no se asocian con hipervascularidad en la biopsia ganglionar y, a menudo, carecen de los síntomas hiperinflamatorios característicos del LACT.[1]
Opciones de tratamiento de los linfomas ganglionares de origen en las células T cooperadoras foliculares.
Quimioterapia combinada a base de doxorrubicina, como el régimen CHO(E)P (ciclofosfamida, doxorrubicina, vincristina, etopósido y prednisona), se usa con frecuencia en pacientes con LACT y otros linfomas ganglionares de origen en las células TFH.[2,5] En los casos positivos para CD30, el estándar de atención sugerido es brentuximab vedotina combinado con ciclofosfamida, doxorrubicina y prednisona.[8][Nivel de evidencia C3] Los pacientes con LACT se incluyeron en un ensayo clínico en el que participaron, en su mayoría, pacientes con linfoma anaplásico de células grandes. No se puede establecer un beneficio para este subgrupo más pequeño de LACT.[8,9][Nivel de evidencia C3] Para obtener más información, consultar la sección Tratamiento del linfoma anaplásico de células grandes.
En el International Peripheral T-Cell Lymphoma Project, que incluyó 22 centros internacionales, se identificaron 243 pacientes con LACT. La tasa de supervivencia general a 5 años fue del 33 % y la tasa de supervivencia sin fracaso terapéutico fue del 18 %.[10] En informes anecdóticos se describió el uso de quimioterapia mieloablativa y radioterapia con apoyo autógeno o alogénico de células madre periféricas.[11-16][Nivel de evidencia C3] Además, se notificaron respuestas anecdóticas en pacientes que recibieron ciclosporina,[17] pralatrexato,[18] bendamustina,[19] belinostat,[20] el inhibidor de histona–desacetilasa romidepsina, hipometilantes (HM),[21,22] y brentuximab vedotina (incluso con poca o ninguna expresión de CD30 en el linfoma).[23,24][Nivel de evidencia C3] También se notificaron algunas remisiones espontáneas y respuestas prolongadas al tratamiento con corticoesteroides solos. Dado el aumento de la frecuencia de variantes patogénicas de los genes que regulan la modificación epigenética, como TET2, IDH2 y DNMT3A, hay un mayor interés en las terapias dirigidas a estas anomalías con HM e inhibidores de la histona–desacetilasa, y hay informes anecdóticos de mejora de la eficacia, en comparación con otros subconjuntos de LPCT.[21,22,25][Nivel de evidencia C3] Se necesitan más estudios para caracterizar mejor la eficacia de este abordaje.[21,22,25]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Yoon SE, Cho J, Kim YJ, et al.: Comprehensive analysis of clinical, pathological, and genomic characteristics of follicular helper T-cell derived lymphomas. Exp Hematol Oncol 10 (1): 33, 2021. [PUBMED Abstract]
- Siegert W, Agthe A, Griesser H, et al.: Treatment of angioimmunoblastic lymphadenopathy (AILD)-type T-cell lymphoma using prednisone with or without the COPBLAM/IMVP-16 regimen. A multicenter study. Kiel Lymphoma Study Group. Ann Intern Med 117 (5): 364-70, 1992. [PUBMED Abstract]
- Jaffe ES: Angioimmunoblastic T-cell lymphoma: new insights, but the clinical challenge remains. Ann Oncol 6 (7): 631-2, 1995. [PUBMED Abstract]
- Siegert W, Nerl C, Agthe A, et al.: Angioimmunoblastic lymphadenopathy (AILD)-type T-cell lymphoma: prognostic impact of clinical observations and laboratory findings at presentation. The Kiel Lymphoma Study Group. Ann Oncol 6 (7): 659-64, 1995. [PUBMED Abstract]
- Lunning MA, Vose JM: Angioimmunoblastic T-cell lymphoma: the many-faced lymphoma. Blood 129 (9): 1095-1102, 2017. [PUBMED Abstract]
- Rizvi MA, Evens AM, Tallman MS, et al.: T-cell non-Hodgkin lymphoma. Blood 107 (4): 1255-64, 2006. [PUBMED Abstract]
- Bräuninger A, Spieker T, Willenbrock K, et al.: Survival and clonal expansion of mutating "forbidden" (immunoglobulin receptor-deficient) epstein-barr virus-infected b cells in angioimmunoblastic t cell lymphoma. J Exp Med 194 (7): 927-40, 2001. [PUBMED Abstract]
- Horwitz S, O'Connor OA, Pro B, et al.: Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON-2): a global, double-blind, randomised, phase 3 trial. Lancet 393 (10168): 229-240, 2019. [PUBMED Abstract]
- Horwitz S, O'Connor OA, Pro B, et al.: The ECHELON-2 Trial: 5-year results of a randomized, phase III study of brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma. Ann Oncol 33 (3): 288-298, 2022. [PUBMED Abstract]
- Federico M, Rudiger T, Bellei M, et al.: Clinicopathologic characteristics of angioimmunoblastic T-cell lymphoma: analysis of the international peripheral T-cell lymphoma project. J Clin Oncol 31 (2): 240-6, 2013. [PUBMED Abstract]
- Reimer P, Rüdiger T, Geissinger E, et al.: Autologous stem-cell transplantation as first-line therapy in peripheral T-cell lymphomas: results of a prospective multicenter study. J Clin Oncol 27 (1): 106-13, 2009. [PUBMED Abstract]
- Le Gouill S, Milpied N, Buzyn A, et al.: Graft-versus-lymphoma effect for aggressive T-cell lymphomas in adults: a study by the Société Francaise de Greffe de Moëlle et de Thérapie Cellulaire. J Clin Oncol 26 (14): 2264-71, 2008. [PUBMED Abstract]
- Kyriakou C, Canals C, Finke J, et al.: Allogeneic stem cell transplantation is able to induce long-term remissions in angioimmunoblastic T-cell lymphoma: a retrospective study from the lymphoma working party of the European group for blood and marrow transplantation. J Clin Oncol 27 (24): 3951-8, 2009. [PUBMED Abstract]
- Park SI, Horwitz SM, Foss FM, et al.: The role of autologous stem cell transplantation in patients with nodal peripheral T-cell lymphomas in first complete remission: Report from COMPLETE, a prospective, multicenter cohort study. Cancer 125 (9): 1507-1517, 2019. [PUBMED Abstract]
- Brink M, Meeuwes FO, van der Poel MWM, et al.: Impact of etoposide and ASCT on survival among patients aged <65 years with stage II to IV PTCL: a population-based cohort study. Blood 140 (9): 1009-1019, 2022. [PUBMED Abstract]
- Los-de Vries GT, de Boer M, van Dijk E, et al.: Chromosome 20 loss is characteristic of breast implant-associated anaplastic large cell lymphoma. Blood 136 (25): 2927-2932, 2020. [PUBMED Abstract]
- Advani R, Horwitz S, Zelenetz A, et al.: Angioimmunoblastic T cell lymphoma: treatment experience with cyclosporine. Leuk Lymphoma 48 (3): 521-5, 2007. [PUBMED Abstract]
- Amengual JE, Lichtenstein R, Lue J, et al.: A phase 1 study of romidepsin and pralatrexate reveals marked activity in relapsed and refractory T-cell lymphoma. Blood 131 (4): 397-407, 2018. [PUBMED Abstract]
- Damaj G, Gressin R, Bouabdallah K, et al.: Results from a prospective, open-label, phase II trial of bendamustine in refractory or relapsed T-cell lymphomas: the BENTLY trial. J Clin Oncol 31 (1): 104-10, 2013. [PUBMED Abstract]
- O'Connor OA, Horwitz S, Masszi T, et al.: Belinostat in Patients With Relapsed or Refractory Peripheral T-Cell Lymphoma: Results of the Pivotal Phase II BELIEF (CLN-19) Study. J Clin Oncol 33 (23): 2492-9, 2015. [PUBMED Abstract]
- Wong J, Gruber E, Maher B, et al.: Integrated clinical and genomic evaluation of guadecitabine (SGI-110) in peripheral T-cell lymphoma. Leukemia 36 (6): 1654-1665, 2022. [PUBMED Abstract]
- Lemonnier F, Dupuis J, Sujobert P, et al.: Treatment with 5-azacytidine induces a sustained response in patients with angioimmunoblastic T-cell lymphoma. Blood 132 (21): 2305-2309, 2018. [PUBMED Abstract]
- Coiffier B, Pro B, Prince HM, et al.: Results from a pivotal, open-label, phase II study of romidepsin in relapsed or refractory peripheral T-cell lymphoma after prior systemic therapy. J Clin Oncol 30 (6): 631-6, 2012. [PUBMED Abstract]
- Fanale MA, Horwitz SM, Forero-Torres A, et al.: Five-year outcomes for frontline brentuximab vedotin with CHP for CD30-expressing peripheral T-cell lymphomas. Blood 131 (19): 2120-2124, 2018. [PUBMED Abstract]
- Pro B, Horwitz SM, Prince HM, et al.: Romidepsin induces durable responses in patients with relapsed or refractory angioimmunoblastic T-cell lymphoma. Hematol Oncol 35 (4): 914-917, 2017. [PUBMED Abstract]
Tratamiento del linfoma periférico de células T sin otra indicación
Los pacientes con linfoma periférico de células T sin otra indicación (LPCT-SAI) tienen linfoma difuso mixto o de células grandes que expresa un fenotipo de superficie celular de células T postímicas (o periféricas) que expresan CD4 o, con menos frecuencia, CD8.[1] Los LPCT-SAI abarcan un grupo heterogéneo de linfomas ganglionares de células T que requerirán una definición más detallada en el futuro.[2,3] En los estudios de perfiles de expresión génica se identificaron dos subtipos distintos de LPCT-SAI según los factores de transcripción GATA3 y TBX21. Los resultados de la investigación inicial y los informes anecdóticos indican que estos subtipos pueden tener implicaciones pronósticas importantes y podrían predecir la respuesta a ciertos tratamientos.[4] Se necesitan más estudios para una caracterización adicional de su relevancia clínica.
Pronóstico
La mayoría de los investigadores notifican tasas de respuesta y supervivencia más precarias para los pacientes con LPCT-SAI que para los pacientes con linfomas de crecimiento rápido de células B en estadios comparables.[3,5] La mayoría de los pacientes presentan múltiples factores de pronóstico adverso (es decir, edad avanzada, estadio IV, compromiso de múltiples sitios extraganglionares y concentraciones elevadas de lactato–deshidrogenasa), y tienen tasas bajas (<20 %) de supervivencia sin fracaso terapéutico y de supervivencia general (SG) a 5 años.[3,5] Al igual que con otros linfomas (por ejemplo, el linfoma difuso de células B grandes [LDCBG] o el linfoma folicular), la supervivencia sin complicaciones (SSC) a los 24 meses predice una tasa de SG a 5 años del 78 %.[6]
Opciones de tratamiento del linfoma periférico de células T sin otra indicación
El tratamiento incluye quimioterapia combinada a base de doxorrubicina, como ciclofosfamida, doxorrubicina, vincristina y prednisona (CHOP) o CHO(E)P (ciclofosfamida, doxorrubicina, vincristina, etopósido y prednisona). Las dosis son las mismas que se usan para el LDCBG.[7] En los casos positivos para CD30, el estándar de atención propuesto es brentuximab vedotina combinada con ciclofosfamida, doxorrubicina y prednisona.[8][Nivel de evidencia C3] Los pacientes con LPCT-SAI se incluyeron en un ensayo clínico en el que participaron, en su mayoría, pacientes con linfoma anaplásico de células grandes. No se puede establecer un beneficio para este subgrupo más pequeño de LPCT-SAI.[8,9][Nivel de evidencia C3] Para obtener más información, consultar la sección Tratamiento del linfoma anaplásico de células grandes.
En pacientes con enfermedad en estadio temprano, los resultados anecdóticos de series retrospectivas son contradictorios en cuanto a la importancia de la radioterapia de consolidación después de la quimioterapia combinada.[10][Nivel de evidencia C3] En múltiples ensayos de fase II o retrospectivos, se administró terapia de consolidación con quimioterapia de dosis alta y trasplante de células madre (TCM) hematopoyéticas autógeno o alogénico a pacientes con LPCT en estadio avanzado después de la terapia de inducción. La evidencia que respalda este abordaje es anecdótica.[11-18][Nivel de evidencia C3]
Evidencia (CHOP, CHO[E]P u otras opciones para la enfermedad recidivante):
- En un ensayo prospectivo aleatorizado, se incluyeron 104 pacientes menores de 61 años con LPCT en estadio II, III o IV (excepto linfoma anaplásico de células grandes positivo para ALK). Los pacientes recibieron un TCM autógeno o un TCM alogénico como terapia de consolidación después de la inducción con CHO(E)P seguido de DHAP (dexametasona, citarabina y cisplatino).[19][Nivel de evidencia C3]
- Al cabo de una mediana de seguimiento de 42 meses, la tasa de SSC a 3 años fue del 43 % para los pacientes que recibieron un TCM alogénico y del 38 % para los pacientes que recibieron un TCM autógeno.
- La tasa de SG a 3 años fue del 57 % para los pacientes que recibieron un TCM alogénico y del 70 % para los pacientes que recibieron un TCM autógeno (P = no significativa).
- Ninguno de los 21 pacientes que respondieron y que se sometieron a un TCM alogénico presentó recaída, mientras que el 36 % de los pacientes que se sometieron a un TCM autógeno sí presentaron recaída.
- De 26 pacientes (31 %) que recibieron un TCM alogénico, 8 murieron por enfermedad de injerto contra huésped. Ninguno de los 41 pacientes sometidos a un TCM autógeno murió por toxicidad.
- El aumento de la mortalidad relacionada con el trasplante anuló el beneficio del efecto de tipo injerto contra linfoma.
- En un ensayo prospectivo de 109 pacientes evaluables con enfermedad recidivante, el tratamiento con pralatrexato produjo una tasa de respuesta del 30 % y una mediana de duración de la respuesta de 10 meses.[20,21][Nivel de evidencia C3]
- Se observaron tasas de respuesta similares en 130 pacientes evaluables con enfermedad recidivante que recibieron romidepsina en un ensayo prospectivo.[21][Nivel de evidencia C3]
- Se observaron respuestas anecdóticas con una combinación de pralatrexato y romidepsina,[22] bendamustina en monoterapia,[23] belinostat,[24] y brentuximab vedotina (incluso en linfomas con poca o ninguna expresión de CD30).[25][Nivel de evidencia C3]
La incorporación de estos fármacos nuevos con quimioterapia CHOP está en evaluación clínica.[3,8]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Rüdiger T, Weisenburger DD, Anderson JR, et al.: Peripheral T-cell lymphoma (excluding anaplastic large-cell lymphoma): results from the Non-Hodgkin's Lymphoma Classification Project. Ann Oncol 13 (1): 140-9, 2002. [PUBMED Abstract]
- Rizvi MA, Evens AM, Tallman MS, et al.: T-cell non-Hodgkin lymphoma. Blood 107 (4): 1255-64, 2006. [PUBMED Abstract]
- Weisenburger DD, Savage KJ, Harris NL, et al.: Peripheral T-cell lymphoma, not otherwise specified: a report of 340 cases from the International Peripheral T-cell Lymphoma Project. Blood 117 (12): 3402-8, 2011. [PUBMED Abstract]
- Amador C, Greiner TC, Heavican TB, et al.: Reproducing the molecular subclassification of peripheral T-cell lymphoma-NOS by immunohistochemistry. Blood 134 (24): 2159-2170, 2019. [PUBMED Abstract]
- Sonnen R, Schmidt WP, Müller-Hermelink HK, et al.: The International Prognostic Index determines the outcome of patients with nodal mature T-cell lymphomas. Br J Haematol 129 (3): 366-72, 2005. [PUBMED Abstract]
- Maurer MJ, Ellin F, Srour L, et al.: International Assessment of Event-Free Survival at 24 Months and Subsequent Survival in Peripheral T-Cell Lymphoma. J Clin Oncol 35 (36): 4019-4026, 2017. [PUBMED Abstract]
- Carson KR, Horwitz SM, Pinter-Brown LC, et al.: A prospective cohort study of patients with peripheral T-cell lymphoma in the United States. Cancer 123 (7): 1174-1183, 2017. [PUBMED Abstract]
- Horwitz S, O'Connor OA, Pro B, et al.: Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON-2): a global, double-blind, randomised, phase 3 trial. Lancet 393 (10168): 229-240, 2019. [PUBMED Abstract]
- Horwitz S, O'Connor OA, Pro B, et al.: The ECHELON-2 Trial: 5-year results of a randomized, phase III study of brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma. Ann Oncol 33 (3): 288-298, 2022. [PUBMED Abstract]
- Briski R, Feldman AL, Bailey NG, et al.: Survival in patients with limited-stage peripheral T-cell lymphomas. Leuk Lymphoma 56 (6): 1665-70, 2015. [PUBMED Abstract]
- Rodriguez J, Munsell M, Yazji S, et al.: Impact of high-dose chemotherapy on peripheral T-cell lymphomas. J Clin Oncol 19 (17): 3766-70, 2001. [PUBMED Abstract]
- Reimer P, Rüdiger T, Geissinger E, et al.: Autologous stem-cell transplantation as first-line therapy in peripheral T-cell lymphomas: results of a prospective multicenter study. J Clin Oncol 27 (1): 106-13, 2009. [PUBMED Abstract]
- Le Gouill S, Milpied N, Buzyn A, et al.: Graft-versus-lymphoma effect for aggressive T-cell lymphomas in adults: a study by the Société Francaise de Greffe de Moëlle et de Thérapie Cellulaire. J Clin Oncol 26 (14): 2264-71, 2008. [PUBMED Abstract]
- d'Amore F, Relander T, Lauritzsen GF, et al.: Up-front autologous stem-cell transplantation in peripheral T-cell lymphoma: NLG-T-01. J Clin Oncol 30 (25): 3093-9, 2012. [PUBMED Abstract]
- Schmitz N, Lenz G, Stelljes M: Allogeneic hematopoietic stem cell transplantation for T-cell lymphomas. Blood 132 (3): 245-253, 2018. [PUBMED Abstract]
- Park SI, Horwitz SM, Foss FM, et al.: The role of autologous stem cell transplantation in patients with nodal peripheral T-cell lymphomas in first complete remission: Report from COMPLETE, a prospective, multicenter cohort study. Cancer 125 (9): 1507-1517, 2019. [PUBMED Abstract]
- Brink M, Meeuwes FO, van der Poel MWM, et al.: Impact of etoposide and ASCT on survival among patients aged <65 years with stage II to IV PTCL: a population-based cohort study. Blood 140 (9): 1009-1019, 2022. [PUBMED Abstract]
- Los-de Vries GT, de Boer M, van Dijk E, et al.: Chromosome 20 loss is characteristic of breast implant-associated anaplastic large cell lymphoma. Blood 136 (25): 2927-2932, 2020. [PUBMED Abstract]
- Schmitz N, Truemper L, Bouabdallah K, et al.: A randomized phase 3 trial of autologous vs allogeneic transplantation as part of first-line therapy in poor-risk peripheral T-NHL. Blood 137 (19): 2646-2656, 2021. [PUBMED Abstract]
- O'Connor OA, Pro B, Pinter-Brown L, et al.: Pralatrexate in patients with relapsed or refractory peripheral T-cell lymphoma: results from the pivotal PROPEL study. J Clin Oncol 29 (9): 1182-9, 2011. [PUBMED Abstract]
- Coiffier B, Pro B, Prince HM, et al.: Results from a pivotal, open-label, phase II study of romidepsin in relapsed or refractory peripheral T-cell lymphoma after prior systemic therapy. J Clin Oncol 30 (6): 631-6, 2012. [PUBMED Abstract]
- Amengual JE, Lichtenstein R, Lue J, et al.: A phase 1 study of romidepsin and pralatrexate reveals marked activity in relapsed and refractory T-cell lymphoma. Blood 131 (4): 397-407, 2018. [PUBMED Abstract]
- Damaj G, Gressin R, Bouabdallah K, et al.: Results from a prospective, open-label, phase II trial of bendamustine in refractory or relapsed T-cell lymphomas: the BENTLY trial. J Clin Oncol 31 (1): 104-10, 2013. [PUBMED Abstract]
- O'Connor OA, Horwitz S, Masszi T, et al.: Belinostat in Patients With Relapsed or Refractory Peripheral T-Cell Lymphoma: Results of the Pivotal Phase II BELIEF (CLN-19) Study. J Clin Oncol 33 (23): 2492-9, 2015. [PUBMED Abstract]
- Fanale MA, Horwitz SM, Forero-Torres A, et al.: Five-year outcomes for frontline brentuximab vedotin with CHP for CD30-expressing peripheral T-cell lymphomas. Blood 131 (19): 2120-2124, 2018. [PUBMED Abstract]
Tratamiento del linfoma extraganglionar de células T-NK
El linfoma extraganglionar de células T citolíticas naturales (T-NK) de tipo nasal es un linfoma de crecimiento rápido caracterizado por necrosis extensa y angioinvasión, que suele presentarse en sitios extraganglionares, en especial, en la región nasal o paranasal.[1] Otros sitios extraganglionares son el paladar, la tráquea, la piel y el tubo digestivo. Es posible que también se presente con un síndrome hemofagocítico; antes, estos tumores se consideraban parte de un granuloma letal de línea media.[2] Por lo general, las células tumorales son linfocitos citolíticos naturales (NK) con inmunofenotipificación que muestra expresión de CD3 y CD56. En casi todos los casos, se detecta el virus de Epstein-Barr (VEB) en las células tumorales. La leucemia agresiva de células NK es un diagnóstico separado, pero relacionado, que antes se reconocía como un subconjunto de la leucemia de linfocitos granulares grandes (LGG), y se caracterizaba por tener compromiso neoplásico de células NK maduras en la sangre o compromiso de la médula con una evolución particularmente maligna y un pronóstico precario.[3] La enteropatía benigna de células NK (negativa para VEB) en la biopsia endoscópica se distingue del linfoma de células T-NK.[3] El linfoma extraganglionar de células NK de tipo nasal es infrecuente en los países occidentales. Este linfoma es más frecuente en Asia, donde representa del 3 % al 8 % de todos los casos de linfoma. La mayoría de los casos se presentan con compromiso nasal y enfermedad localizada. La enfermedad extranasal y en estadio avanzado (estadios III–IV) presenta un pronóstico precario.[4,5]
Opciones de tratamiento del linfoma extraganglionar de células T-NK
El tratamiento del linfoma extraganglionar de células T-NK localizado con compromiso nasal implica terapia de modalidad combinada con quimioterapia y radioterapia para aquellos que puedan recibir quimioterapia, o radioterapia sola para aquellos que no deben recibir quimioterapia. El tratamiento del linfoma extraganglionar de células T-NK nasal no localizado y de todos los casos con compromiso extranasal implica quimioterapia combinada con radioterapia o sin esta.[6] Debido a que el linfoma extraganglionar de células T-NK suele expresar la glicoproteína P, que confiere resistencia multifarmacológica y reduce la eficacia de los regímenes tradicionales a base de antraciclinas, por lo general, se incorpora asparaginasa en los regímenes quimioterapéuticos.[7,8] Se han utilizado varios regímenes de quimioterapia combinada con asparaginasa.
Evidencia (quimioterapia combinada con asparaginasa):
- En un estudio de fase II se incluyeron 28 pacientes con diagnóstico reciente de linfoma extraganglionar de células NK en estadio IV, en recaída o resistente al tratamiento. Los pacientes recibieron corticoesteroides, metotrexato, ifosfamida, L-asparaginasa y etopósido (SMILE).[9]
- La tasa de respuesta general después de 2 ciclos fue del 79 % (intervalo de confianza [IC] 95 %, 65–89 %) y la tasa de respuesta completa fue del 45 %. La tasa de supervivencia general (SG) a 1 año fue del 55 % (IC 95 %, 38–69 %).
- Se observó neutropenia de grado 4 en el 92 % de los pacientes e infecciones de grado 3 o 4 en el 61 % de los pacientes.[9]
- Una modificación del régimen SMILE (mSMILE) que incorpora la asparaginasa pegilada ha demostrado una toxicidad más baja.[10]
A pesar de que no hay estudios comparativos directos, este régimen se usa con más frecuencia en la práctica clínica, en pacientes con enfermedad en estadio avanzado o en combinación con radioterapia para pacientes con enfermedad localizada. Otros regímenes con asparaginasa que se han estudiado son gemcitabina, oxaliplatino y pegaspargasa (P-GEMOX);[10] gemcitabina, etopósido, pegaspargasa y dexametasona (GELAD);[11] y dexametasona, cisplatino, gemcitabina y pegaspargasa (DDGP).[12]A los pacientes que tal vez no toleren la asparaginasa, o que presentan reacciones a esta, se les puede administrar un régimen sin asparaginasa con radioterapia simultánea.[13][Nivel de evidencia C3]
- En un estudio retrospectivo (NCT02733458) se incluyeron 35 pacientes con diagnóstico reciente de linfoma extraganglionar de células T-NK en estadio III o IV, en recaída o resistente al tratamiento. Los pacientes recibieron P-GEMOX.[10]
- La tasa de respuesta general fue del 80,0 % y la tasa de respuesta completa fue del 51,4 %. La tasa de supervivencia sin progresión (SSP) a 3 años fue del 38,6 % y la tasa de SG a 3 años fue del 64,7 %.[10][Nivel de evidencia C3]
- En un estudio multicéntrico prospectivo (NCT02733458) se incluyeron 52 pacientes con diagnóstico reciente de linfoma extraganglionar de células T-NK en estadio IE/IIE que recibieron 2 ciclos de GELAD seguidos de radioterapia de intensidad modulada (50–56 Gy en 25–58 fracciones) y 2 cursos adicionales de GELAD.[11]
- Al cabo de una mediana de seguimiento de 32 meses, se estimó una tasa de SG a 4 años del 94,2 % (IC 95 %, 83,2–93,1 %), y una tasa de SSP a 4 años del 90,4 % (IC 95 %, 78,4–95,9 %).[11][Nivel de evidencia C3]
- La tasa de respuesta general fue del 94,2% y la tasa de respuesta completa fue del 92,3%.
- En un estudio retrospectivo se incluyeron 80 pacientes con diagnóstico reciente de linfoma extraganglionar de células T-NK (n = 48), resistente al tratamiento (n = 23) o en primera recaída (n = 9). Los pacientes recibieron DDGP.[12]
- La tasa de respuesta general fue del 91,3 % (IC 95 %, 85,0–96,3 %), y la tasa de respuesta completa fue del 60,0 % (IC 95 %, 48,8–71,3 %). La tasa de SSP a 2 años fue del 81,4 % (IC 95 %, 76,3-86,5 %) y la tasa de SG a 2 años fue del 87,1 % (IC 95 %, 83,4-91,4 %).[12][Nivel de evidencia C3]
- En un estudio de fase I/II en el que participaron 27 pacientes con diagnóstico reciente de enfermedad en estadio IE o IIE contiguo, se estudió el régimen sin asparaginasa DeVIC (dexametasona, etopósido, ifosfamida y carboplatino). Los pacientes recibieron 3 ciclos de DeVIC en la dosis recomendada de fase II y radioterapia simultánea en dosis de 50 Gy.[13]
- Al cabo de una mediana de seguimiento de 32 meses, la tasa de SG a 2 años fue del 78 % (IC 95 %, 57–89 %). La tasa de respuesta general fue del 81 % y la tasa de respuesta completa fue del 77 %.[13][Nivel de evidencia C3]
- El efecto tóxico no hematológico más común de grado 3 o superior fue la mucositis relacionada con la radiación, que se presentó en el 30 % de los pacientes.
La radioterapia es un componente esencial del tratamiento del linfoma extraganglionar de células T-NK localizado de tipo nasal, ya sea en monoterapia o como parte de una terapia de modalidad combinada.
Evidencia (radioterapia con quimioterapia o sin esta):
- En una revisión retrospectiva se incluyeron 1273 pacientes con enfermedad en estadio temprano. Los pacientes se estratificaron en un grupo de riesgo bajo y un grupo de riesgo alto según el estadio, la edad, la concentración de lactato–deshidrogenasa, el estado funcional y la invasión del tumor primario.
- Los pacientes de riesgo bajo evolucionaron mejor con radioterapia sola,[14] mientras que los pacientes de riesgo alto evolucionaron mejor con una estrategia de radioterapia combinada con quimioterapia.[15-17][Nivel de evidencia C3]
- En una revisión retrospectiva, se incluyó 303 pacientes sin tratamiento previo, de un consorcio internacional, quienes recibieron quimioterapia sin antraciclinas.[18]
- Las tasas de SG fueron idénticas (72−74 % a los 5 años) para los pacientes con enfermedad en estadio temprano que recibieron quimioterapia y radioterapia simultáneas o quimioterapia seguida de radioterapia.[18][Nivel de evidencia C3]
El uso de dosis más altas de radioterapia, superiores a 50 Gy, se relacionó con mejores desenlaces según informes anecdóticos.[17] La evolución muy maligna, con supervivencia breve y respuesta precaria a los tratamientos estándar, en especial, en los pacientes con enfermedad en estadio avanzado o presentación extranasal, ha llevado a algunos investigadores a recomendar la consolidación con trasplante de células madre periféricas autógeno o alogénico.[19-24][Nivel de evidencia C3]
Para los pacientes con enfermedad en recaída o resistente al tratamiento, las terapias dirigidas a la proteína de muerte programada 1 (PD-1) y el ligando 1 de la proteína de muerte celular programada (PD-L1) han demostrado resultados prometedores.
Evidencia (inmunoterapia):
- En un ensayo de fase II, se administró el anticuerpo anti-PD-L1 avelumab a 21 pacientes con enfermedad en recaída o resistente al tratamiento.[25]
- La tasa de respuesta completa fue del 24 % y la tasa de respuesta general fue del 38 %. Las respuestas se correlacionaron con la expresión tumoral de PD-L1.[25][Nivel de evidencia C3]
- El tratamiento con pembrolizumab, un anticuerpo anti-PD-1, produjo respuestas similares en pacientes con enfermedad en recaída o resistente al tratamiento.[26][Nivel de evidencia C3]
- En un estudio multicéntrico de fase II de un solo grupo (GEMSTONE-201 [NCT03595657]) se incluyeron 80 pacientes con linfoma extraganglionar de células T-NK en recaída o resistente al tratamiento. Los pacientes recibieron el anticuerpo monoclonal anti–PD-L1 sugemalimab.
- La tasa de respuesta objetiva fue del 44 % (IC 95 %, 33,6–56,6 %) y la tasa de respuesta completa fue del 35,9 %. La tasa de duración de la respuesta a 12 meses fue del 82,5 % (IC 95 %, 62,0–92,6 %).[27][Nivel de evidencia B3]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Tse E, Kwong YL: How I treat NK/T-cell lymphomas. Blood 121 (25): 4997-5005, 2013. [PUBMED Abstract]
- Rizvi MA, Evens AM, Tallman MS, et al.: T-cell non-Hodgkin lymphoma. Blood 107 (4): 1255-64, 2006. [PUBMED Abstract]
- Tang YT, Wang D, Luo H, et al.: Aggressive NK-cell leukemia: clinical subtypes, molecular features, and treatment outcomes. Blood Cancer J 7 (12): 660, 2017. [PUBMED Abstract]
- Suzuki R, Suzumiya J, Yamaguchi M, et al.: Prognostic factors for mature natural killer (NK) cell neoplasms: aggressive NK cell leukemia and extranodal NK cell lymphoma, nasal type. Ann Oncol 21 (5): 1032-40, 2010. [PUBMED Abstract]
- Qi SN, Li YX, Specht L, et al.: Modern Radiation Therapy for Extranodal Nasal-Type NK/T-cell Lymphoma: Risk-Adapted Therapy, Target Volume, and Dose Guidelines from the International Lymphoma Radiation Oncology Group. Int J Radiat Oncol Biol Phys 110 (4): 1064-1081, 2021. [PUBMED Abstract]
- Obama K, Tara M, Niina K: L-asparaginase-Based induction therapy for advanced extranodal NK/T-cell lymphoma. Int J Hematol 78 (3): 248-50, 2003. [PUBMED Abstract]
- Ando M, Sugimoto K, Kitoh T, et al.: Selective apoptosis of natural killer-cell tumours by l-asparaginase. Br J Haematol 130 (6): 860-8, 2005. [PUBMED Abstract]
- Yamaguchi M, Kwong YL, Kim WS, et al.: Phase II study of SMILE chemotherapy for newly diagnosed stage IV, relapsed, or refractory extranodal natural killer (NK)/T-cell lymphoma, nasal type: the NK-Cell Tumor Study Group study. J Clin Oncol 29 (33): 4410-6, 2011. [PUBMED Abstract]
- Ghione P, Qi S, Imber BS, et al.: Modified SMILE (mSMILE) and intensity-modulated radiotherapy (IMRT) for extranodal NK-T lymphoma nasal type in a single-center population. Leuk Lymphoma 61 (14): 3331-3341, 2020. [PUBMED Abstract]
- Wang JH, Wang L, Liu CC, et al.: Efficacy of combined gemcitabine, oxaliplatin and pegaspargase (P-gemox regimen) in patients with newly diagnosed advanced-stage or relapsed/refractory extranodal NK/T-cell lymphoma. Oncotarget 7 (20): 29092-101, 2016. [PUBMED Abstract]
- Zhu Y, Tian S, Xu L, et al.: GELAD chemotherapy with sandwiched radiotherapy for patients with newly diagnosed stage IE/IIE natural killer/T-cell lymphoma: a prospective multicentre study. Br J Haematol 196 (4): 939-946, 2022. [PUBMED Abstract]
- Zhang L, Li S, Jia S, et al.: The DDGP (cisplatin, dexamethasone, gemcitabine, and pegaspargase) regimen for treatment of extranodal natural killer (NK)/T-cell lymphoma, nasal type. Oncotarget 7 (36): 58396-58404, 2016. [PUBMED Abstract]
- Yamaguchi M, Tobinai K, Oguchi M, et al.: Phase I/II study of concurrent chemoradiotherapy for localized nasal natural killer/T-cell lymphoma: Japan Clinical Oncology Group Study JCOG0211. J Clin Oncol 27 (33): 5594-600, 2009. [PUBMED Abstract]
- Yang Y, Cao JZ, Lan SM, et al.: Association of Improved Locoregional Control With Prolonged Survival in Early-Stage Extranodal Nasal-Type Natural Killer/T-Cell Lymphoma. JAMA Oncol 3 (1): 83-91, 2017. [PUBMED Abstract]
- Yang Y, Zhu Y, Cao JZ, et al.: Risk-adapted therapy for early-stage extranodal nasal-type NK/T-cell lymphoma: analysis from a multicenter study. Blood 126 (12): 1424-32; quiz 1517, 2015. [PUBMED Abstract]
- Yamaguchi M, Suzuki R, Oguchi M, et al.: Treatments and Outcomes of Patients With Extranodal Natural Killer/T-Cell Lymphoma Diagnosed Between 2000 and 2013: A Cooperative Study in Japan. J Clin Oncol 35 (1): 32-39, 2017. [PUBMED Abstract]
- Vargo JA, Patel A, Glaser SM, et al.: The impact of the omission or inadequate dosing of radiotherapy in extranodal natural killer T-cell lymphoma, nasal type, in the United States. Cancer 123 (16): 3176-3185, 2017. [PUBMED Abstract]
- Kwong YL, Kim SJ, Tse E, et al.: Sequential chemotherapy/radiotherapy was comparable with concurrent chemoradiotherapy for stage I/II NK/T-cell lymphoma. Ann Oncol 29 (1): 256-263, 2018. [PUBMED Abstract]
- Liang R, Todd D, Chan TK, et al.: Treatment outcome and prognostic factors for primary nasal lymphoma. J Clin Oncol 13 (3): 666-70, 1995. [PUBMED Abstract]
- Cheung MM, Chan JK, Lau WH, et al.: Primary non-Hodgkin's lymphoma of the nose and nasopharynx: clinical features, tumor immunophenotype, and treatment outcome in 113 patients. J Clin Oncol 16 (1): 70-7, 1998. [PUBMED Abstract]
- Hausdorff J, Davis E, Long G, et al.: Non-Hodgkin's lymphoma of the paranasal sinuses: clinical and pathological features, and response to combined-modality therapy. Cancer J Sci Am 3 (5): 303-11, 1997 Sep-Oct. [PUBMED Abstract]
- Le Gouill S, Milpied N, Buzyn A, et al.: Graft-versus-lymphoma effect for aggressive T-cell lymphomas in adults: a study by the Société Francaise de Greffe de Moëlle et de Thérapie Cellulaire. J Clin Oncol 26 (14): 2264-71, 2008. [PUBMED Abstract]
- Au WY, Weisenburger DD, Intragumtornchai T, et al.: Clinical differences between nasal and extranasal natural killer/T-cell lymphoma: a study of 136 cases from the International Peripheral T-Cell Lymphoma Project. Blood 113 (17): 3931-7, 2009. [PUBMED Abstract]
- Yamaguchi M, Suzuki R, Oguchi M: Advances in the treatment of extranodal NK/T-cell lymphoma, nasal type. Blood 131 (23): 2528-2540, 2018. [PUBMED Abstract]
- Kim SJ, Lim JQ, Laurensia Y, et al.: Avelumab for the treatment of relapsed or refractory extranodal NK/T-cell lymphoma: an open-label phase 2 study. Blood 136 (24): 2754-2763, 2020. [PUBMED Abstract]
- Kwong YL, Chan TSY, Tan D, et al.: PD1 blockade with pembrolizumab is highly effective in relapsed or refractory NK/T-cell lymphoma failing l-asparaginase. Blood 129 (17): 2437-2442, 2017. [PUBMED Abstract]
- Huang H, Tao R, Hao S, et al.: Sugemalimab Monotherapy for Patients With Relapsed or Refractory Extranodal Natural Killer/T-Cell Lymphoma (GEMSTONE-201): Results From a Single-Arm, Multicenter, Phase II Study. J Clin Oncol 41 (16): 3032-3041, 2023. [PUBMED Abstract]
Tratamiento de los linfomas intestinales de células T monomórficos epiteliotrópicos y asociados a enteropatía
El linfoma de células T asociado a enteropatía (LTAE) y el linfoma intestinal de células T monomórfico epiteliotrópico son subtipos raros del linfoma periférico de células T (LPCT) que, en conjunto, representan menos del 5 % de los LPCT. El LTAE (a veces conocido como LTAE de tipo 1) es una complicación de la celiaquía y es más común en Europa. El linfoma intestinal de células T monomórfico epiteliotrópico (a veces conocido como LTAE de tipo 2) no se relaciona con la celiaquía y es más común en Asia. En la mayoría de los casos de estos dos subtipos de linfomas, se observan variantes patogénicas del gen SETD2 y, en menor medida, variantes patogénicas de STAT5B.[1,2] Debido a que la alimentación sin gluten previene el linfoma en los pacientes con celiaquía, este linfoma es muy infrecuente en los pacientes que reciben el diagnóstico de celiaquía en la niñez. El diagnóstico de celiaquía se suele establecer por la presencia de atrofia vellosa del intestino resecado. A menudo se requiere cirugía para el diagnóstico y para evitar la perforación durante el tratamiento.[3]
Opciones de tratamiento para los linfomas intestinales de células T monomórficos epiteliotrópicos y asociados a enteropatía
El tratamiento recomendado incluye CHO(E)P (ciclofosfamida, doxorrubicina, vincristina, etopósido y prednisona); sin embargo, la recaída es común y los desenlaces suelen ser precarios.[4-6] Las complicaciones del tratamiento incluyen hemorragia gastrointestinal, perforación del intestino delgado y fístulas enterocólicas. Los pacientes a menudo necesitan nutrición parenteral. Para obtener más información sobre la nutrición parenteral, consultar La nutrición en el tratamiento del cáncer. En el momento de la recaída se observan perforaciones intestinales multifocales y compromiso de vísceras abdominales. La consolidación con quimioterapia de dosis altas y rescate autógeno de células madre o trasplante alogénico de células madre a menudo se usa en el momento de la primera remisión o posterior.[4,7,8][Nivel de evidencia C3] La evidencia de este abordaje es anecdótica.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Veloza L, Cavalieri D, Missiaglia E, et al.: Monomorphic epitheliotropic intestinal T-cell lymphoma comprises morphologic and genomic heterogeneity impacting outcome. Haematologica 108 (1): 181-195, 2023. [PUBMED Abstract]
- Moffitt AB, Ondrejka SL, McKinney M, et al.: Enteropathy-associated T cell lymphoma subtypes are characterized by loss of function of SETD2. J Exp Med 214 (5): 1371-1386, 2017. [PUBMED Abstract]
- Egan LJ, Walsh SV, Stevens FM, et al.: Celiac-associated lymphoma. A single institution experience of 30 cases in the combination chemotherapy era. J Clin Gastroenterol 21 (2): 123-9, 1995. [PUBMED Abstract]
- Gale J, Simmonds PD, Mead GM, et al.: Enteropathy-type intestinal T-cell lymphoma: clinical features and treatment of 31 patients in a single center. J Clin Oncol 18 (4): 795-803, 2000. [PUBMED Abstract]
- Daum S, Ullrich R, Heise W, et al.: Intestinal non-Hodgkin's lymphoma: a multicenter prospective clinical study from the German Study Group on Intestinal non-Hodgkin's Lymphoma. J Clin Oncol 21 (14): 2740-6, 2003. [PUBMED Abstract]
- Di Sabatino A, Biagi F, Gobbi PG, et al.: How I treat enteropathy-associated T-cell lymphoma. Blood 119 (11): 2458-68, 2012. [PUBMED Abstract]
- Le Gouill S, Milpied N, Buzyn A, et al.: Graft-versus-lymphoma effect for aggressive T-cell lymphomas in adults: a study by the Société Francaise de Greffe de Moëlle et de Thérapie Cellulaire. J Clin Oncol 26 (14): 2264-71, 2008. [PUBMED Abstract]
- Sieniawski M, Angamuthu N, Boyd K, et al.: Evaluation of enteropathy-associated T-cell lymphoma comparing standard therapies with a novel regimen including autologous stem cell transplantation. Blood 115 (18): 3664-70, 2010. [PUBMED Abstract]
Tratamiento del linfoma de células T de crecimiento lento de tubo digestivo
En contraste con las formas de crecimiento rápido (agresivas) de linfoma de células T con compromiso intestinal, el linfoma de células T de crecimiento lento (indolente) de tubo digestivo a menudo tiene un comportamiento poco activo. Este tipo de linfoma es difícil de diferenciar de la enfermedad inflamatoria intestinal y otros trastornos autoinmunitarios con compromiso digestivo.[1,2]
El linfoma de células T de crecimiento lento de tubo digestivo suele diagnosticarse cuando múltiples biopsias de diferentes sitios exhiben clones concordantes en la prueba de reordenamiento del receptor de células T. Si bien el inmunofenotipo puede variar (suele ser CD4+, pero también puede ser CD8+ o CD4-/CD8-), por lo general el índice Ki-67 es muy bajo del 5 % al 10 %. A diferencia de otros linfomas intestinales, la región codificadora de Epstein-Barr en la tinción para el virus de Epstein-Barr virus suele ser negativa. Si bien en los informes iniciales de esta entidad poco frecuente se indicó una probabilidad baja de transformación a un proceso más maligno, se ha documentado la transformación a un linfoma de células T periféricas, sin otra indicación, y a otras formas de crecimiento más rápido.[3]
Opciones de tratamiento para el linfoma de células T de crecimiento lento de tubo digestivo
La respuesta a la quimioterapia multifarmacológica es limitada y muchos pacientes se pueden tratar con conducta expectante sola. En pocos estudios se han indicado alteraciones en la vía JAK/STAT o en los genes que participan en la modificación epigenética, que podrían servir como posibles dianas terapéuticas.[4]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Margolskee E, Jobanputra V, Lewis SK, et al.: Indolent small intestinal CD4+ T-cell lymphoma is a distinct entity with unique biologic and clinical features. PLoS One 8 (7): e68343, 2013. [PUBMED Abstract]
- Perry AM, Warnke RA, Hu Q, et al.: Indolent T-cell lymphoproliferative disease of the gastrointestinal tract. Blood 122 (22): 3599-606, 2013. [PUBMED Abstract]
- Sanguedolce F, Zanelli M, Zizzo M, et al.: Indolent T-Cell Lymphoproliferative Disorders of the Gastrointestinal Tract (iTLPD-GI): A Review. Cancers (Basel) 13 (11): , 2021. [PUBMED Abstract]
- Sharma A, Oishi N, Boddicker RL, et al.: Recurrent STAT3-JAK2 fusions in indolent T-cell lymphoproliferative disorder of the gastrointestinal tract. Blood 131 (20): 2262-2266, 2018. [PUBMED Abstract]
Tratamiento del linfoma hepatoesplénico de células T
El linfoma hepatoesplénico de células T es un subtipo raro de linfoma periférico de células T (LPCT) que comprende cerca del 1 % de los casos de LPCT. Este linfoma suele afectar a hombres jóvenes. El linfoma hepatoesplénico de células T está localizado en los sinusoides hepáticos y esplénicos, y en la superficie celular expresa el receptor de células T γ-δ.[1-3] Las anomalías cromosómicas características, como el isocromosoma 7q y la trisomía 8, también son indicadoras del diagnóstico.[4] Si bien en la mayoría de los casos las células neoplásicas expresan un receptor de células T γ-δ (linfoma hepatoesplénico de células T γ-δ), hay informes de expresión del receptor de células T α-β (linfoma hepatoesplénico de células T α-β).[5] Este linfoma tiene un pronóstico muy precario y una evolución clínica muy maligna.
Opciones de tratamiento del linfoma hepatoesplénico de células T
El linfoma hepatoesplénico de células T se trata con quimioterapia de inducción y consolidación con trasplante de células madre (TCM).[3,6]
Evidencia (quimioterapia de inducción y consolidación con TCM):
- En un metanálisis de 118 pacientes con linfoma hepatoesplénico de células T, se comparó el régimen CHOP (ciclofosfamida, doxorrubicina, vincristina y prednisona) con regímenes de inducción similares a CHOP.[7]
- Los regímenes diferentes a CHOP (que contienen citarabina, etopósido o derivados del platino) se relacionaron con mejores desenlaces, incluso una tasa de respuesta general del 82 % versus el 52 % (P = 0,006) y una mediana de supervivencia general (SG) de 36,5 versus 18 meses (P = 0,00014).
- La consolidación con TCM alogénico se relacionó con una mejora de la mediana de SG, de 33 meses versus 27 meses (P = 0,016) para el TCM autógeno.[7][Nivel de evidencia C3]
El uso de ICE (ifosfamida, carboplatino y etopósido) o IVAC (ifosfamida, etopósido y dosis altas de citarabina) produjo mejores respuestas cuando se comparó con CHOP en otros estudios más pequeños.[8][Nivel de evidencia D] Debido a las respuestas inadecuadas a los regímenes CHOP o similares a estos, muchos profesionales clínicos usan la quimioterapia ICE como terapia de inducción de primera línea, seguida de un TCM alogénico de consolidación en los pacientes que logran una primera remisión. Sin embargo, la eficacia de este abordaje es indeterminada.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Belhadj K, Reyes F, Farcet JP, et al.: Hepatosplenic gammadelta T-cell lymphoma is a rare clinicopathologic entity with poor outcome: report on a series of 21 patients. Blood 102 (13): 4261-9, 2003. [PUBMED Abstract]
- Chanan-Khan A, Islam T, Alam A, et al.: Long-term survival with allogeneic stem cell transplant and donor lymphocyte infusion following salvage therapy with anti-CD52 monoclonal antibody (Campath) in a patient with alpha/beta hepatosplenic T-cell non-Hodgkin's lymphoma. Leuk Lymphoma 45 (8): 1673-5, 2004. [PUBMED Abstract]
- Pro B, Allen P, Behdad A: Hepatosplenic T-cell lymphoma: a rare but challenging entity. Blood 136 (18): 2018-2026, 2020. [PUBMED Abstract]
- Travert M, Huang Y, de Leval L, et al.: Molecular features of hepatosplenic T-cell lymphoma unravels potential novel therapeutic targets. Blood 119 (24): 5795-806, 2012. [PUBMED Abstract]
- Macon WR, Levy NB, Kurtin PJ, et al.: Hepatosplenic alphabeta T-cell lymphomas: a report of 14 cases and comparison with hepatosplenic gammadelta T-cell lymphomas. Am J Surg Pathol 25 (3): 285-96, 2001. [PUBMED Abstract]
- Le Gouill S, Milpied N, Buzyn A, et al.: Graft-versus-lymphoma effect for aggressive T-cell lymphomas in adults: a study by the Société Francaise de Greffe de Moëlle et de Thérapie Cellulaire. J Clin Oncol 26 (14): 2264-71, 2008. [PUBMED Abstract]
- Klebaner D, Koura D, Tzachanis D, et al.: Intensive Induction Therapy Compared With CHOP for Hepatosplenic T-cell Lymphoma. Clin Lymphoma Myeloma Leuk 20 (7): 431-437.e2, 2020. [PUBMED Abstract]
- Voss MH, Lunning MA, Maragulia JC, et al.: Intensive induction chemotherapy followed by early high-dose therapy and hematopoietic stem cell transplantation results in improved outcome for patients with hepatosplenic T-cell lymphoma: a single institution experience. Clin Lymphoma Myeloma Leuk 13 (1): 8-14, 2013. [PUBMED Abstract]
Tratamiento de la leucemia o linfoma de células T en adultos
La leucemia o linfoma de células T en adultos (LLCTA) se debe a una infección por un retrovirus llamado virus linfotrópico humano de células T de tipo 1 (VLHT-1) y, con frecuencia, los pacientes presentan linfadenopatía, hipercalcemia, células leucémicas circulantes, compromiso óseo y cutáneo, hepatoesplenomegalia, progresión rápida y respuesta precaria a la quimioterapia combinada.[1,2] El VLHT-1 es endémico de Japón (en especial, en la isla meridional de Kyushu), África central, las islas del Caribe y algunas regiones de América Central y del Sur, Oriente Medio y Australia. Este retrovirus se propaga de manera primaria por contacto sexual o durante la lactancia materna.[3] La LLCTA se divide en 4 subtipos clínicos:[3]
- Subtipo agudo (evolución muy maligna y agresiva, con leucemia y compromiso extraganglionar o ganglionar, o sin este).
- Subtipo linfoma (evolución muy maligna y agresiva, con linfadenopatía, pero sin leucemia).
- Subtipo crónico (evolución de escasa malignidad, es decir, poco activa o indolente, con leucemia y linfadenopatía).
- Subtipo quiescente (evolución de escasa malignidad, es decir, poco activa o indolente y solo se observa leucemia).
Opciones de tratamiento para la leucemia o linfoma de células T en adultos
Las opciones de tratamiento de la LLCTA son las siguientes:
Terapias biológicas y dirigidas
Mogamulizumab
El anticuerpo monoclonal anti-CCR4 mogamulizumab actúa produciendo la lisis del clon de LLCTA y también reduce la población de células Treg inmunodepresoras, lo que mejora el efecto de la inmunoterapia mediada por células.[4] En ensayos de fase II de monoterapia en pacientes con LLCTA se observaron tasas de respuesta que oscilaron entre el 30 % y el 50 %.[5-7][Nivel de evidencia C3] En un estudio de fase II en el que se combinó mogamulizumab con quimioterapia combinada, 101 pacientes tuvieron una tasa de respuesta general del 65 % (intervalo de confianza [IC] 95 %, 55–75 %), una mediana de supervivencia sin progresión de 7,4 meses (IC 95 %, 5,7–9,1) y una mediana de supervivencia general (SG) de 16 meses (IC 95 %, 10,3–21,8).[8][Nivel de evidencia C3]
En una revisión retrospectiva se evaluó el mogamulizumab combinado con el régimen VCAP-AMP-VECP (vincristina, ciclofosfamida, doxorrubicina, prednisona; doxorrubicina, y ranimustina, prednisona; vindesina, etopósido, carboplatino, régimen de prednisona) y regímenes basados en CHOP (ciclofosfamida, doxorrubicina, vincristina y prednisona) versus quimioterapia sola. En la revisión se concluyó que la tasa de SG a 4 años fue del 46,3 % en los grupos de combinación con mogamulizumab, en comparación con el 20,6 % en el grupo de quimioterapia sola.[9][Nivel de evidencia C3] Los mejores resultados se observaron con los regímenes a base de CHOP. El mogamulizumab está disponible en los Estados Unidos, pero la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) no lo ha aprobado para el tratamiento de pacientes con LLCTA.
A menudo se evita el mogamulizumab en los pacientes que se van a someter a un TCM alogénico a partir de datos de Japón que mostraron un aumento del riesgo de enfermedad de injerto contra huésped (EICH) grave en los pacientes que recibieron mogamulizumab antes de un TCM alogénico.[10] La relevancia de estos hallazgos en otros países y el impacto de los diferentes regímenes profilácticos en la EICH en este entorno aún está por determinar.
Brentuximab vedotina
El brentuximab vedotina es un conjugado de un anticuerpo monoclonal y un fármaco dirigido a CD30 que es una opción de tratamiento para los pacientes con LLCTA cuyo tumor expresa CD30.[11] Los pacientes con LLCTA se incluyeron en un ensayo clínico de brentuximab vedotina en el que la mayoría de los pacientes tenían un linfoma anaplásico de células T grandes. No se pudo establecer un beneficio estadístico para el subgrupo de pacientes con LLCTA, que era muy pequeño.[11][Nivel de evidencia C3]
Lenalidomida
En un estudio multicéntrico de fase II (NCT01724177) de 26 pacientes con LLCTA en recaída, la tasa de respuesta general fue del 42 % (IC 95 %, 23–63 %) en los pacientes que recibieron el fármaco inmunomodulador lenalidomida.[12][Nivel de evidencia C3]
Valemetostat
El valemetostat es un inhibidor dual selectivo de EZH1 y EZH2, que son histonas–metiltransferasas importantes que participan en el plegamiento de la cromatina.[13] En un estudio multicéntrico de fase II (NCT04102150) se inscribieron 25 pacientes con LLCTA en recaída o resistente al tratamiento, 24 de los cuales habían recibido tratamiento previo con mogamulizumab.[14] Al cabo de una mediana de seguimiento de 6,5 meses, la tasa de respuesta general fue del 48 % (IC 90 %, 30,5–65 %). Hubo 5 remisiones completas y 7 remisiones parciales entre los pacientes que recibieron tratamiento previo intenso.[14][Nivel de evidencia C3] Se observaron respuestas en pacientes con LLCTA de tipos aguda, linfoma y crónica. Aunque está aprobado para su uso en Japón, la FDA no ha aprobado el valemetostat para su uso en los Estados Unidos.
Zidovudina e interferón α
La combinación de zidovudina e interferón α es activa contra la LLCTA, en especial, entre los pacientes que tienen los subtipos crónico y quiescente de esta enfermedad.[15,16] Se notificaron remisiones duraderas de 8 a 12 meses y tasas de respuesta del 20 % al 40 %; algunos pacientes habían presentado recaída tras la quimioterapia previa,[15,16] y algunos tenían los subtipos agudo y linfoma de la enfermedad.[17,18]
Quimioterapia citotóxica y trasplante de células madre alogénico
El subtipo de enfermedad aguda y el subtipo linfoma de la LLCTA responden poco a la quimioterapia citotóxica combinada y al TCM alogénico con una mediana de SG inferior a 1 año.[19-21] Menos del 10 % de los pacientes que recibieron terapia combinada estaban vivos después de 4 años en un estudio retrospectivo.[21] Se notificaron remisiones duraderas después de un TCM alogénico e incluso después de una infusión de linfocitos de donante subsiguiente en pacientes que presentaron recaídas después del trasplante.[22-24][Nivel de evidencia C3] En 815 pacientes sometidos a TCM alogénico en 2 revisiones retrospectivas, las tasas de SG a 3 años fueron del 36 % y del 26 %.[25,26][Nivel de evidencia C1]
La quimioterapia citotóxica de base para los pacientes con LLCTA en los Estados Unidos y Europa es el régimen CHOP o el régimen CHO(E)P (ciclofosfamida, doxorrubicina, vincristina, etopósido y prednisona). Se añadió el brentuximab vedotina al régimen CHOP en algunos casos esporádicos de pacientes que expresan CD30. En una serie de ensayos clínicos en Japón se estableció el régimen VCAP-AMP-VECP como tratamiento estándar de primera línea para los subtipos agudo y linfoma de la LLCTA.[2,27,28] En general, este régimen no se ha usado fuera de Asia ya que en un ensayo en el que se comparó VCAP-AMP-VECP versus CHOP-14 no se observó una mejora estadística de la SG (tasa de SG a 3 años, 24 vs. 13 %; P = no significativa).
El TCM alogénico se usa con frecuencia para los pacientes que logran la primera remisión o posteriores, aunque los resultados son en gran medida anecdóticos.[29,30]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Bangham CRM: HTLV-1 persistence and the oncogenesis of adult T-cell leukemia/lymphoma. Blood 141 (19): 2299-2306, 2023. [PUBMED Abstract]
- Cook LB, Phillips AA: How I treat adult T-cell leukemia/lymphoma. Blood 137 (4): 459-470, 2021. [PUBMED Abstract]
- Mehta-Shah N, Ratner L, Horwitz SM: Adult T-Cell Leukemia/Lymphoma. J Oncol Pract 13 (8): 487-492, 2017. [PUBMED Abstract]
- Sugata K, Yasunaga J, Miura M, et al.: Enhancement of anti-STLV-1/HTLV-1 immune responses through multimodal effects of anti-CCR4 antibody. Sci Rep 6: 27150, 2016. [PUBMED Abstract]
- Ishida T, Joh T, Uike N, et al.: Defucosylated anti-CCR4 monoclonal antibody (KW-0761) for relapsed adult T-cell leukemia-lymphoma: a multicenter phase II study. J Clin Oncol 30 (8): 837-42, 2012. [PUBMED Abstract]
- Phillips AA, Fields PA, Hermine O, et al.: Mogamulizumab versus investigator's choice of chemotherapy regimen in relapsed/refractory adult T-cell leukemia/lymphoma. Haematologica 104 (5): 993-1003, 2019. [PUBMED Abstract]
- Ureshino H, Kamachi K, Kimura S: Mogamulizumab for the Treatment of Adult T-cell Leukemia/Lymphoma. Clin Lymphoma Myeloma Leuk 19 (6): 326-331, 2019. [PUBMED Abstract]
- Yonekura K, Kusumoto S, Choi I, et al.: Mogamulizumab for adult T-cell leukemia-lymphoma: a multicenter prospective observational study. Blood Adv 4 (20): 5133-5145, 2020. [PUBMED Abstract]
- Shichijo T, Nosaka K, Tatetsu H, et al.: Beneficial impact of first-line mogamulizumab-containing chemotherapy in adult T-cell leukaemia-lymphoma. Br J Haematol 198 (6): 983-987, 2022. [PUBMED Abstract]
- Sugio T, Kato K, Aoki T, et al.: Mogamulizumab Treatment Prior to Allogeneic Hematopoietic Stem Cell Transplantation Induces Severe Acute Graft-versus-Host Disease. Biol Blood Marrow Transplant 22 (9): 1608-1614, 2016. [PUBMED Abstract]
- Horwitz S, O'Connor OA, Pro B, et al.: Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON-2): a global, double-blind, randomised, phase 3 trial. Lancet 393 (10168): 229-240, 2019. [PUBMED Abstract]
- Ishida T, Fujiwara H, Nosaka K, et al.: Multicenter Phase II Study of Lenalidomide in Relapsed or Recurrent Adult T-Cell Leukemia/Lymphoma: ATLL-002. J Clin Oncol 34 (34): 4086-4093, 2016. [PUBMED Abstract]
- Chihara D: Synthetic lethality in ATL. Blood 141 (10): 1096-1098, 2023. [PUBMED Abstract]
- Izutsu K, Makita S, Nosaka K, et al.: An open-label, single-arm phase 2 trial of valemetostat for relapsed or refractory adult T-cell leukemia/lymphoma. Blood 141 (10): 1159-1168, 2023. [PUBMED Abstract]
- Bazarbachi A, Plumelle Y, Carlos Ramos J, et al.: Meta-analysis on the use of zidovudine and interferon-alfa in adult T-cell leukemia/lymphoma showing improved survival in the leukemic subtypes. J Clin Oncol 28 (27): 4177-83, 2010. [PUBMED Abstract]
- Bazarbachi A, Suarez F, Fields P, et al.: How I treat adult T-cell leukemia/lymphoma. Blood 118 (7): 1736-45, 2011. [PUBMED Abstract]
- Cook LB, Rowan AG, Demontis MA, et al.: Long-term clinical remission maintained after cessation of zidovudine and interferon-α therapy in chronic adult T-cell leukemia/lymphoma. Int J Hematol 107 (3): 378-382, 2018. [PUBMED Abstract]
- Hodson A, Crichton S, Montoto S, et al.: Use of zidovudine and interferon alfa with chemotherapy improves survival in both acute and lymphoma subtypes of adult T-cell leukemia/lymphoma. J Clin Oncol 29 (35): 4696-701, 2011. [PUBMED Abstract]
- Yamada Y, Tomonaga M, Fukuda H, et al.: A new G-CSF-supported combination chemotherapy, LSG15, for adult T-cell leukaemia-lymphoma: Japan Clinical Oncology Group Study 9303. Br J Haematol 113 (2): 375-82, 2001. [PUBMED Abstract]
- Fukushima T, Miyazaki Y, Honda S, et al.: Allogeneic hematopoietic stem cell transplantation provides sustained long-term survival for patients with adult T-cell leukemia/lymphoma. Leukemia 19 (5): 829-34, 2005. [PUBMED Abstract]
- Katsuya H, Yamanaka T, Ishitsuka K, et al.: Prognostic index for acute- and lymphoma-type adult T-cell leukemia/lymphoma. J Clin Oncol 30 (14): 1635-40, 2012. [PUBMED Abstract]
- Itonaga H, Tsushima H, Taguchi J, et al.: Treatment of relapsed adult T-cell leukemia/lymphoma after allogeneic hematopoietic stem cell transplantation: the Nagasaki Transplant Group experience. Blood 121 (1): 219-25, 2013. [PUBMED Abstract]
- Cook LB, Fuji S, Hermine O, et al.: Revised Adult T-Cell Leukemia-Lymphoma International Consensus Meeting Report. J Clin Oncol 37 (8): 677-687, 2019. [PUBMED Abstract]
- Yoshimitsu M, Tanosaki R, Kato K, et al.: Risk Assessment in Adult T Cell Leukemia/Lymphoma Treated with Allogeneic Hematopoietic Stem Cell Transplantation. Biol Blood Marrow Transplant 24 (4): 832-839, 2018. [PUBMED Abstract]
- Ishida T, Hishizawa M, Kato K, et al.: Allogeneic hematopoietic stem cell transplantation for adult T-cell leukemia-lymphoma with special emphasis on preconditioning regimen: a nationwide retrospective study. Blood 120 (8): 1734-41, 2012. [PUBMED Abstract]
- Katsuya H, Ishitsuka K, Utsunomiya A, et al.: Treatment and survival among 1594 patients with ATL. Blood 126 (24): 2570-7, 2015. [PUBMED Abstract]
- Hermine O, Ramos JC, Tobinai K: A Review of New Findings in Adult T-cell Leukemia-Lymphoma: A Focus on Current and Emerging Treatment Strategies. Adv Ther 35 (2): 135-152, 2018. [PUBMED Abstract]
- Tsukasaki K, Utsunomiya A, Fukuda H, et al.: VCAP-AMP-VECP compared with biweekly CHOP for adult T-cell leukemia-lymphoma: Japan Clinical Oncology Group Study JCOG9801. J Clin Oncol 25 (34): 5458-64, 2007. [PUBMED Abstract]
- Bazarbachi AH, Reef D, Narvel H, et al.: Outcome of Stem Cell Transplantation in HTLV-1-Associated North American Adult T-Cell Leukemia/Lymphoma. Clin Hematol Int 5 (2-3): 78-91, 2023. [PUBMED Abstract]
- Tanase AD, Colita A, Craciun OG, et al.: Allogeneic Stem Cell Transplantation for Adult T-Cell Leukemia/Lymphoma-Romanian Experience. J Clin Med 9 (8): , 2020. [PUBMED Abstract]
Tratamiento de la leucemia prolinfocítica de células T
La leucemia prolinfocítica (LPL) es una forma rara de leucemia linfocítica caracterizada por un número excesivo de prolinfocitos en sangre que exhiben un fenotipo típico positivo para CD19, CD20 e inmunoglobulina de superficie y negativo para CD5.[1] Estos pacientes muestran esplenomegalia y una respuesta precaria a la quimioterapia de dosis bajas o altas.[2,3]
Opciones de tratamiento de la leucemia prolinfocítica de células T
La cladribina es un fármaco activo (tasa de remisión completa del 60 %) para los pacientes con LLP de células B de novo.[4][Nivel de evidencia C3] Se han observado respuestas anecdóticas con venetoclax.[5][Nivel de evidencia C3] El alemtuzumab, un anticuerpo monoclonal humanizado anti-CD52, se utilizó en 76 pacientes con LLP de células T después del fracaso de la quimioterapia previa (por lo general, pentostatina o cladribina). La tasa de respuesta fue del 51 % (intervalo de confianza 95 %, 40–63 %) y la mediana de tiempo hasta la progresión fue de 4,5 meses (intervalo, 0,1–45,4).[6][Nivel de evidencia C3] Estas tasas de respuesta han sido confirmadas por otros investigadores.[7] Los pacientes con leucemia linfocítica crónica (LLC) que presentan una transformación prolinfocitoide mantienen el fenotipo clásico de LLC y tienen un pronóstico más precario que los pacientes con LPL.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Staber PB, Herling M, Bellido M, et al.: Consensus criteria for diagnosis, staging, and treatment response assessment of T-cell prolymphocytic leukemia. Blood 134 (14): 1132-1143, 2019. [PUBMED Abstract]
- Rozman C, Montserrat E: Chronic lymphocytic leukemia. N Engl J Med 333 (16): 1052-7, 1995. [PUBMED Abstract]
- Melo JV, Catovsky D, Galton DA: The relationship between chronic lymphocytic leukaemia and prolymphocytic leukaemia. I. Clinical and laboratory features of 300 patients and characterization of an intermediate group. Br J Haematol 63 (2): 377-87, 1986. [PUBMED Abstract]
- Saven A, Lee T, Schlutz M, et al.: Major activity of cladribine in patients with de novo B-cell prolymphocytic leukemia. J Clin Oncol 15 (1): 37-43, 1997. [PUBMED Abstract]
- Boidol B, Kornauth C, van der Kouwe E, et al.: First-in-human response of BCL-2 inhibitor venetoclax in T-cell prolymphocytic leukemia. Blood 130 (23): 2499-2503, 2017. [PUBMED Abstract]
- Keating MJ, Cazin B, Coutré S, et al.: Campath-1H treatment of T-cell prolymphocytic leukemia in patients for whom at least one prior chemotherapy regimen has failed. J Clin Oncol 20 (1): 205-13, 2002. [PUBMED Abstract]
- Dearden CE, Matutes E, Catovsky D: Alemtuzumab in T-cell malignancies. Med Oncol 19 (Suppl): S27-32, 2002. [PUBMED Abstract]
Tratamiento del linfoma periférico de células T en recaída o resistente al tratamiento
Opciones de tratamiento del linfoma periférico de células T en recaída o resistente al tratamiento
Las opciones de tratamiento del linfoma periférico de células T en recaída o resistente al tratamiento son las siguientes:
- Quimioterapia combinada.
- ICE (ifosfamida, carboplatino y etopósido).[1,2]
- GEMOX (gemcitabina, oxaliplatino y dexametasona).[3]
- DHAP (dexametasona, dosis altas de citarabina y cisplatino).[4]
- ESHAP (etopósido, metilprednisolona, dosis altas de citarabina y cisplatino).[5,6]
- Hiper-CVAD (ciclofosfamida, vincristina, doxorrubicina y dexametasona).[7]
- Anticuerpos conjugados.
- Brentuximab vedotina (en pacientes positivos para CD30).
- Inhibidores de la histona–desacetilasa.
- Inhibidores de la dihidrofolato–reductasa.
- Pralatrexato.[11]
- Anticuerpos monoclonales anti-CD52.
- Alemtuzumab (solo disponible a través de un programa de distribución restringida).
- Trasplante de células madre.[12-16]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Jerkeman M, Leppä S, Kvaløy S, et al.: ICE (ifosfamide, carboplatin, etoposide) as second-line chemotherapy in relapsed or primary progressive aggressive lymphoma--the Nordic Lymphoma Group experience. Eur J Haematol 73 (3): 179-82, 2004. [PUBMED Abstract]
- Zelenetz AD, Hamlin P, Kewalramani T, et al.: Ifosfamide, carboplatin, etoposide (ICE)-based second-line chemotherapy for the management of relapsed and refractory aggressive non-Hodgkin's lymphoma. Ann Oncol 14 (Suppl 1): i5-10, 2003. [PUBMED Abstract]
- Shen QD, Wang L, Zhu HY, et al.: Gemcitabine, oxaliplatin and dexamethasone (GemDOx) as salvage therapy for relapsed or refractory diffuse large B-cell lymphoma and peripheral T-cell lymphoma. J Cancer 12 (1): 163-169, 2021. [PUBMED Abstract]
- Schmitz N, Truemper L, Bouabdallah K, et al.: A randomized phase 3 trial of autologous vs allogeneic transplantation as part of first-line therapy in poor-risk peripheral T-NHL. Blood 137 (19): 2646-2656, 2021. [PUBMED Abstract]
- Velasquez WS, McLaughlin P, Tucker S, et al.: ESHAP--an effective chemotherapy regimen in refractory and relapsing lymphoma: a 4-year follow-up study. J Clin Oncol 12 (6): 1169-76, 1994. [PUBMED Abstract]
- Mercadal S, Briones J, Xicoy B, et al.: Intensive chemotherapy (high-dose CHOP/ESHAP regimen) followed by autologous stem-cell transplantation in previously untreated patients with peripheral T-cell lymphoma. Ann Oncol 19 (5): 958-63, 2008. [PUBMED Abstract]
- Hapgood G, Stone JM, Zannino D, et al.: A phase II study of a modified hyper-CVAD frontline therapy for patients with adverse risk diffuse large B-cell and peripheral T-cell non-Hodgkin lymphoma. Leuk Lymphoma 60 (4): 904-911, 2019. [PUBMED Abstract]
- Iyer SP, Foss FF: Romidepsin for the Treatment of Peripheral T-Cell Lymphoma. Oncologist 20 (9): 1084-91, 2015. [PUBMED Abstract]
- Campbell P, Thomas CM: Belinostat for the treatment of relapsed or refractory peripheral T-cell lymphoma. J Oncol Pharm Pract 23 (2): 143-147, 2017. [PUBMED Abstract]
- O'Connor OA, Horwitz S, Masszi T, et al.: Belinostat in Patients With Relapsed or Refractory Peripheral T-Cell Lymphoma: Results of the Pivotal Phase II BELIEF (CLN-19) Study. J Clin Oncol 33 (23): 2492-9, 2015. [PUBMED Abstract]
- O'Connor OA, Pro B, Pinter-Brown L, et al.: Pralatrexate in patients with relapsed or refractory peripheral T-cell lymphoma: results from the pivotal PROPEL study. J Clin Oncol 29 (9): 1182-9, 2011. [PUBMED Abstract]
- Schmitz N, Lenz G, Stelljes M: Allogeneic hematopoietic stem cell transplantation for T-cell lymphomas. Blood 132 (3): 245-253, 2018. [PUBMED Abstract]
- Chen AI, McMillan A, Negrin RS, et al.: Long-term results of autologous hematopoietic cell transplantation for peripheral T cell lymphoma: the Stanford experience. Biol Blood Marrow Transplant 14 (7): 741-7, 2008. [PUBMED Abstract]
- Hamadani M, Ngoya M, Sureda A, et al.: Outcome of allogeneic transplantation for mature T-cell lymphomas: impact of donor source and disease characteristics. Blood Adv 6 (3): 920-930, 2022. [PUBMED Abstract]
- Mehta-Shah N, Kommalapati A, Teja S: Successful treatment of mature T-cell lymphoma with allogeneic stem cell transplantation: the largest multicenter retrospective analysis. [Abstract] Blood 136 (Suppl 1): A-624, 35-36, 2020.
- Sterling CH, Hughes MS, Tsai HL, et al.: Allogeneic Blood or Marrow Transplantation with Post-Transplantation Cyclophosphamide for Peripheral T Cell Lymphoma: The Importance of Graft Source. Transplant Cell Ther 29 (4): 267.e1-267.e5, 2023. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (05/15/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Clasificación celular del linfoma no Hodgkin periférico de células T
Se revisó la lista de subtipos de linfoma no Hodgkin periférico de células T para incluir el linfoma de células T de crecimiento lento (indolente) de tubo digestivo.
Tratamiento del linfoma de células T de crecimiento lento de tubo digestivo
Se agregó esta sección.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del linfoma no Hodgkin periférico de células T en adultos. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del linfoma no Hodgkin periférico de células T son:
- Eric J. Seifter, MD (Johns Hopkins University)
- Cole H. Sterling, MD (Johns Hopkins University)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del linfoma no Hodgkin periférico de células T. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/linfoma/pro/tratamiento-linfoma-periferico-celulas-t-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.