FDA aprueba niraparib como terapia de mantenimiento para cáncer recurrente de ovario
, por Equipo del NCI
El 27 de marzo, la Administración de Alimentos y Medicamentos (FDA) concedió la aprobación de niraparib (Zejula™) para algunas mujeres con cáncer avanzado de ovario.
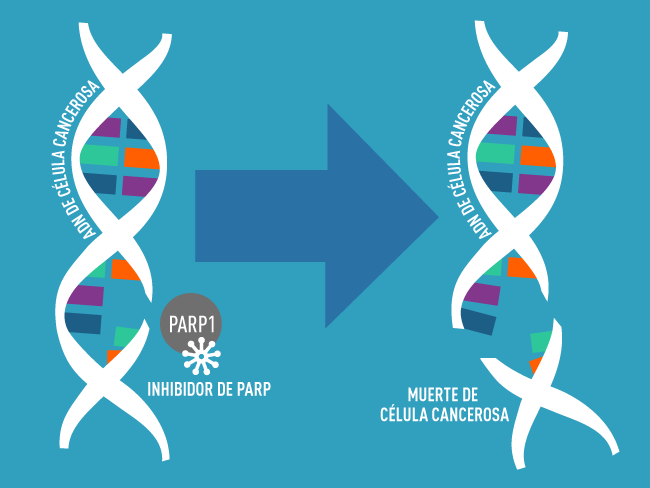
Niraparib pertenece a una clase de fármacos conocidos como inhibidores de la PARP [poli (ADP-ribosa) polimerasa], que funcionan como interruptores de la capacidad de las células cancerosas para reparar el daño al ADN. La aprobación hace que niraparib sea el tercer inhibidor de PARP aprobado por la FDA para el tratamiento del cáncer de ovario.
La aprobación abarca el uso de niraparib como terapia de mantenimiento en mujeres que ya han tenido recurrencia de cáncer epitelial seroso ovárico de alto grado, de trompas de Falopio o primario de peritoneo, pero han tenido una respuesta tumoral parcial o completa a la quimioterapia a base de platino.
Niraparib, que se toma como píldora, está aprobado para usarse si las pacientes tienen o no mutación de línea germinal o heredadas en los genes BRCA1 o BRCA2.
“La formulación y la aprobación de varios inhibidores de PARP han sido un adelanto importante en el tratamiento del cáncer de ovario", dijo la doctora Elise Kohn, jefa de Terapéutica del Cáncer Ginecológico de la División de Tratamiento y Diagnóstico de Cáncer del NCI.
Y la investigación sobre su uso está extendiéndose rápidamente a otros tipos de cáncer, continuó la doctora Kohn, incluso los cánceres de seno, próstata, páncreas y estómago.
“Es el comienzo de una nueva clase de sustancias: la clase de inhibidores de la reparación del ADN", dijo ella.
Tratamiento para cánceres con o sin mutaciones de BRCA
Esta es la primera aprobación de la FDA para niraparib. Fue aprobado teniendo como base un estudio aleatorizado de más de 550 pacientes que ya habían experimentado una recurrencia de cáncer epitelial seroso ovárico de alto grado, de trompas de Falopio o primario de peritoneo.
Todas las pacientes del estudio habían pasado por dos cursos por lo menos de tratamiento con quimioterapia a base de platino y su cáncer había respondido parcial o completamente al tratamiento más reciente. Las pacientes fueron asignadas aleatoriamente a recibir niraparib o un placebo. La métrica principal de efectividad fue el tiempo que vivieron las pacientes sin que avanzara su enfermedad.
El estudio incluyó dos cohortes de mujeres: las que tenían mutaciones de estirpe germinal en BRCA y las que no las tenían. Entre las mujeres que tenían mutaciones de estirpe germinal en BRCA, quienes recibieron niraparib tuvieron una mediana de supervivencia sin progresión de 21 meses, en comparación con 5,5 meses para las mujeres que recibieron el placebo. Entre las mujeres sin mutaciones en BRCA, la mediana de supervivencia sin progresión fue de 9,3 meses para quienes recibieron niraparib y 3,9 meses para quienes recibieron el placebo.
Algunos de los efectos secundarios más comunes en las pacientes que recibieron niraparib fueron la anemia, palpitaciones, náuseas y cansancio. El fármaco lleva consigo algunos efectos secundarios graves, incluso la formación de un síndrome mielodisplásico y leucemia mieloide aguda.
Los resultados de este estudio, que originalmente fueron publicados el año pasado en el New England Journal of Medicine, se concentraron en la supervivencia sin progresión, advirtió la doctora Kohn. “No sabemos si el tratamiento de mantenimiento con niraparib en esta situación prolongará la supervivencia en general. Tendremos que esperar a la maduración de estos datos".
Las mujeres con cáncer recurrente de ovario sensible al platino a menudo continúan recibiendo muchos otros esquemas de tratamiento durante el curso de su enfermedad, continuó la doctora Kohn, lo cual puede dificultar que se determine el efecto de un tratamiento sobre la supervivencia en general.
Siguientes pasos en la investigación
Ya que los inhibidores de PARP bloquean las células cancerosas para que reparen el ADN dañado, han demostrado ser especialmente efectivos contra las células cancerosas que ya tienen mecanismos defectuosos de reparación del ADN, como las que tienen mutaciones en BRCA.
Los otros dos inhibidores de PARP aprobados por la FDA, el olaparib (Lynparza®) y el rucaparib (Rubraca™), han sido aprobados para pacientes con enfermedad avanzada que han recibido tratamiento previo con al menos tres y dos esquemas de quimioterapia, respectivamente.
Pero ambos fármacos están aprobados como tratamiento más que como terapias de mantenimiento, y para mujeres con mutaciones nocivas de estirpe germinal en BRCA. El rucaparib está aprobado también para mujeres con mutaciones nocivas somáticas o no heredadas en BRCA. La FDA concedió una revisión prioritaria a olaparib para su uso como terapia de mantenimiento el mes pasado.
La doctora Kohn dijo que cuestiones de investigación adicional son la identificación de biomarcadores que puedan predecir quién tiene más probabilidad de beneficiarse de los inhibidores de la PARP o de otros inhibidores de reparación de ADN; los fármacos posiblemente efectivos para usarse en combinación con inhibidores de la PARP; los mecanismos de resistencia, y cómo pueden superarse estos mecanismos.
“Estas cuestiones pueden aplicarse al cáncer de ovario ahora”, añadió ella. “Pero a medida que se identifican nuevas indicaciones para esta nueva clase de sustancias, ellas se aplican también a otros tipos de cáncer".