Aprobaciones de la FDA - Temas y relatos
Noticias sobre aprobaciones recientes de terapias para el cáncer por parte de la Administración de Alimentos y Medicamentos (FDA). Incluyen comentarios de expertos sobre cómo la aprobación podría influir en el cuidado del paciente y en futuras investigaciones.
-
La Administración de Alimentos y Medicamentos aprueba el nivolumab inyectable, una opción a la infusión intravenosa
Varios oncólogos afirmaron que la forma inyectable de nivolumab, llamada Opdivo Qvantig, es más rápida y fácil de administrar, y es tan eficaz como la forma intravenosa. Se espera que pronto haya formas inyectables de otras inmunoterapias.
-
Se aprobaron medicamentos que amplían las opciones de tratamiento inicial para el mieloma múltiple
Las aprobaciones de Darzalex Faspro y Sarclisa por la FDA, que se combinan con triterapias estándar, deberían cambiar el tratamiento inicial de las personas con diagnóstico reciente de mieloma múltiple, incluso el de los pacientes que no pueden recibir un trasplante de células madre.
-
Exámenes de detección del cáncer colorrectal: ¿qué papel tendrá la biopsia líquida Shield?
La Administración de Alimentos y Medicamentos (FDA) aprobó hace poco la prueba Shield, una prueba de sangre para la detección primaria en las personas con riesgo promedio de cáncer colorrectal. ¿Cómo se integra con otras opciones de detección de la enfermedad, como la colonoscopia y las pruebas de materia fecal?
-
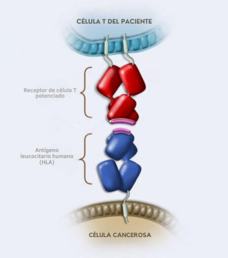
La Administración de Alimentos y Medicamentos aprueba una terapia celular modificada por ingeniería genética para el sarcoma sinovial avanzado
La Administración de Alimentos y Medicamentos (FDA) aprobó el afamitresgén autoleucel (Tecelra) para tratar el sarcoma sinovial metastásico, un cáncer que se origina en el tejido blando. La aprobación es para pacientes que ya recibieron quimioterapia y cuyos tumores tienen MAGE-A4. El afamitresgén autoleucel es la primera terapia de receptores de células T aprobada para el cáncer.
-
Más opciones de inmunoterapia aprobadas para el tratamiento del cáncer de endometrio
Las personas con cáncer de endometrio avanzado ahora tienen nuevas opciones de tratamiento aprobadas por la Administración de Alimentos y Medicamentos (FDA): pembrolizumab y durvalumab, junto con quimioterapia, para tratar los tumores con un cambio genético llamado alteración de la vía reparadora del ADN. La FDA también amplió los usos aprobados del dostarlimab para la enfermedad.
-
Se aprobó el tovorafenib para algunos niños con glioma de grado bajo
La Administración de Alimentos y Medicamentos (FDA) otorgó una aprobación acelerada del tovorafenib (Ojemda) para niños y adolescentes con glioma de grado bajo con cambios en el gen BRAF. En un estudio clínico pequeño, el medicamento achicó o eliminó por completo los tumores en casi el 70 % de los pacientes.
-
Se aprobó el alectinib como tratamiento adyuvante para el cáncer de pulmón
La FDA aprobó el alectinib (Alecensa) como terapia adyuvante para las personas con cáncer de pulmón positivo para ALK. En un estudio clínico, las personas que tuvieron cirugía y luego recibieron alectinib vivieron más tiempo sin que el cáncer volviera que quienes recibieron quimioterapia.
-
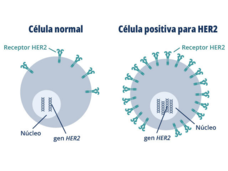
Se aprobó el uso del trastuzumab deruxtecán para tratar cualquier cáncer sólido con HER2
El trastuzumab deruxtecán (Enhertu) ahora se podrá usar para tratar cualquier cáncer sólido avanzado con concentraciones altas de la proteína HER2 (tumores positivos para HER2). La aprobación acelerada de la FDA se basó en los hallazgos de tres estudios clínicos.
-
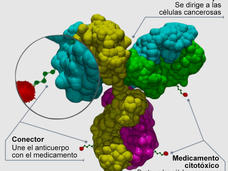
La aprobación de Elahere amplía las opciones de tratamiento para algunos cánceres de ovario avanzados
La Administración de Alimentos y Medicamentos (FDA) aprobó el mirvetuximab soravtansine-gynx (Elahere) para tratar a las personas con cáncer de ovario avanzado resistente al platino cuyos tumores producen la proteína FR-α en exceso. La aprobación definitiva se basó en los resultados de un estudio aleatorizado grande llamado MIRASOL, en el que se demostró que Elahere prolongó la supervivencia de estas personas.
-
Se aprobó la primera terapia con linfocitos infiltrantes tumorales para el melanoma avanzado
En un proceso que llevó más de tres décadas, la Administración de Alimentos y Medicamentos (FDA) aprobó el lifileucel (Amtagvi), el primer tratamiento del cáncer para el que se usan células inmunitarias llamadas linfocitos infiltrantes tumorales (LIT).
-
El repotrectinib amplía las opciones de tratamiento para el cáncer de pulmón con fusión de ROS1
Se publicaron los resultados del estudio clínico que llevó a que la Administración de Alimentos y Medicamentos (FDA) aprobara el repotrectinib (Augtyro) en 2023 para el cáncer de pulmón con fusiones de ROS1. El medicamento achicó los tumores en el 80 % de las personas que lo recibieron como tratamiento inicial.
-
Nueva aprobación de la enzalutamida para el cáncer de próstata no diseminado
La Administración de Alimentos y Medicamentos (FDA) otorgó una nueva aprobación para el uso de la enzalutamida (Xtandi). Ahora se podrá usar sola o en combinación con la leuprorelina para tratar el cáncer de próstata no metastásico con riesgo alto de recidiva después de la cirugía o la radioterapia.
-
El toripalimab es el primer medicamento de inmunoterapia aprobado para el cáncer de nasofaringe
La Administración de Alimentos y Medicamentos (FDA) aprobó el toripalimab (Loqtorz) a partir de los resultados de un estudio clínico grande en el que se demostró que añadirlo a la quimioterapia prolongó la supervivencia de las personas con cáncer de nasofaringe que volvió después del tratamiento inicial o se diseminó.
-
La Administración de Alimentos y Medicamentos modificó la aprobación del pembrolizumab para tratar el cáncer de estómago y el cáncer de la unión gastroesofágica
La Administración de Alimentos y Medicamentos (FDA) modificó la aprobación de 2021 para el uso del pembrolizumab (Keytruda) en combinación con el trastuzumab (Herceptin) y la quimioterapia para tratar el cáncer de estómago o el cáncer de unión gastroesofágica con HER2. La FDA también anunció una nueva aprobación del pembrolizumab para tratar los mismos cánceres sin HER2.
-
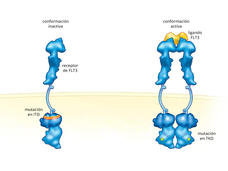
La aprobación del quizartinib añade una nueva opción para tratar la leucemia mieloide aguda, incluso en las personas mayores
Hay una nueva opción de tratamiento para las personas con leucemia mieloide aguda. El 20 de julio, la FDA aprobó el quizartinib (Vanflyta) combinado con quimioterapia como tratamiento de primera línea para la LMA que presenta un cambio específico en el gen FLT3.
-
Se aprobó un nuevo tratamiento inicial para algunos tipos de cáncer de próstata metastásicos
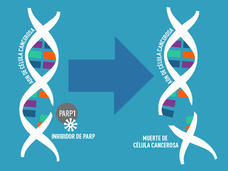
La Administración de Alimentos y Medicamentos (FDA) aprobó la combinación de la enzalutamida (Xtandi) con el talazoparib (Talzenna) para el cáncer de próstata metastásico resistente a la castración con alteraciones en 12 genes de reparación del ADN. La combinación de medicamentos, que inhibe tanto las actividades de reparación del ADN como las hormonas que estimulan el crecimiento tumoral, fue más eficaz que el tratamiento estándar en un estudio clínico grande.
-
Se aprobó la combinación de tucatinib con trastuzumab para el cáncer colorrectal avanzado
La Administración de Alimentos y Medicamentos (FDA) aprobó la combinación de tucatinib (Tukysa) con trastuzumab (Herceptin) para tratar el cáncer colorrectal avanzado positivo para HER2. La aprobación se basó en el estudio MOUNTAINEER, en el que casi el 40 % de los tumores de los participantes se achicaron tras recibir la combinación de medicamentos.
-
La aprobación del zanubrutinib mejora el tratamiento de la leucemia linfocítica crónica
La FDA aprobó el zanubrutinib (Brukinsa) para la leucemia linfocítica crónica o el linfoma linfocítico de células pequeñas, a partir de los resultados de dos estudios clínicos. En ambos estudios, el medicamento que bloquea una proteína llamada BTK fue más eficaz y causó menos efectos secundarios que otros tratamientos.
-
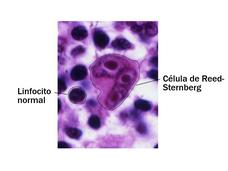
Se aprobó el brentuximab para el linfoma de Hodgkin de riesgo alto en niños y adolescentes
A partir de un estudio clínico del Grupo de Oncología Infantil que financió el NCI, la FDA aprobó el uso del medicamento brentuximab vedotina (Adcetris) en combinación con la quimioterapia para algunos niños y adolescentes con linfoma de Hodgkin.
-
Enhertu es la primera terapia dirigida al cáncer de pulmón con mutaciones en HER2
El 11 de agosto, la Administración de Alimentos y Medicamentos (FDA) otorgó la aprobación acelerada del trastuzumab deruxtecán (Enhertu) para adultos con CPCNP con cierta clase de mutación en el gen HER2. Cerca del 3 % de las personas con CPCNP tienen esta clase de mutación en HER2.