La aprobación del quizartinib añade una nueva opción para tratar la leucemia mieloide aguda, incluso en las personas mayores
, por Carmen Phillips
Las opciones de tratamiento para las personas con leucemia mieloide aguda (LMA), un cáncer de la sangre de crecimiento rápido, aumentaron una vez más con la nueva aprobación por parte de la Administración de Alimentos y Medicamentos (FDA).
El 20 de julio, la FDA aprobó el quizartinib (Vanflyta) combinado con quimioterapia como parte del tratamiento inicial de las personas con LMA que presentan un cambio específico en un gen llamado FLT3.
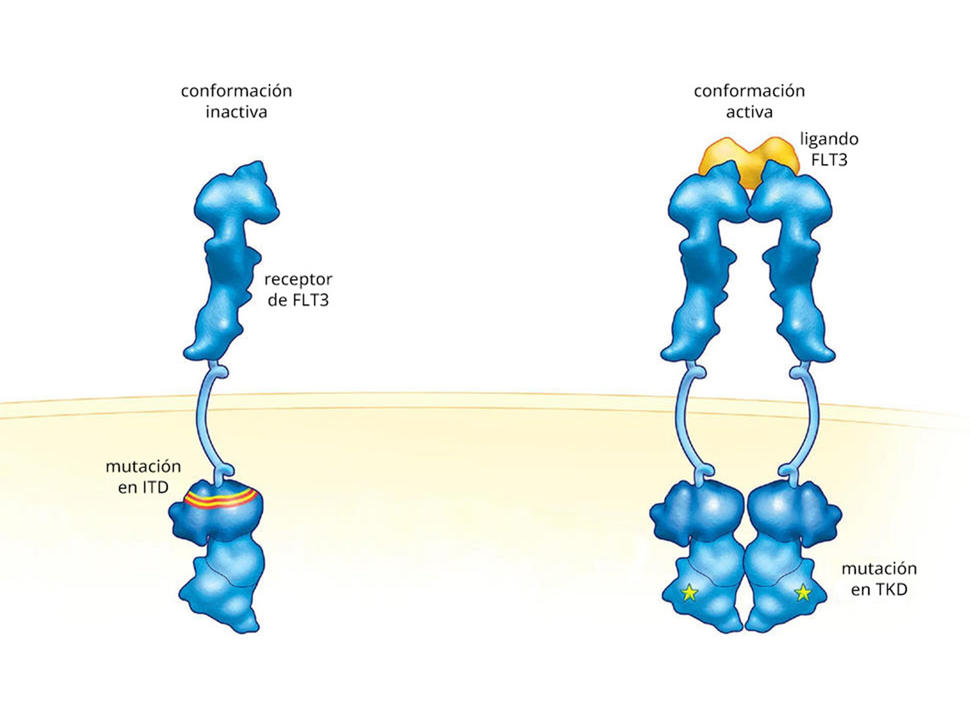
Los cambios genéticos en FLT3 son frecuentes en las personas que reciben un diagnóstico de LMA. La mutación en FLT3, conocida como duplicación interna en tándem (ITD), se incluye en la aprobación y está presente en cerca de una cuarta parte de las personas con un diagnóstico de este cáncer.
La aprobación de la FDA se basó en los resultados de un estudio clínico grande llamado QuANTUM-First. En el estudio se incluyó a más de 500 personas con esta forma específica de LMA. Los participantes que recibieron quizartinib y quimioterapia estándar vivieron más del doble de tiempo que los que recibieron solo el tratamiento estándar: una mediana de 32 meses frente a 15 meses. Los resultados del estudio se publicaron en mayo en la revista The Lancet.
La FDA también aprobó un análisis de sangre para identificar a los pacientes con la mutación ITD en FLT3. A estos análisis se les llama pruebas diagnósticas para selección terapéutica.
En muy pocos casos, el quizartinib causa alteraciones potencialmente mortales en el funcionamiento cardíaco. Por lo tanto, según la aprobación, el medicamento se debe recetar según las Estrategias de Evaluación y Mitigación de Riesgos (REMS), un programa de seguridad especial de la FDA.
La decisión de la FDA hace que el quizartinib sea el segundo medicamento dirigido a FLT3 aprobado como tratamiento inicial, o de primera línea, para las personas con LMA. El primero, la midostaurina (Rydapt), se aprobó en 2017. También se aprobó un tercer medicamento, el gilteritinib (Xospata), para tratar la LMA pero solo en las personas cuyo cáncer recidivó (volvió) después de un tratamiento anterior, lo que se llama tratamiento de segunda línea.
En general, los expertos en LMA coincidieron en que la aprobación del quizartinib ofrece una nueva opción importante para las personas cuyo cáncer presenta la mutación ITD en FLT3. Varios expertos señalaron que los resultados del estudio son muy notables porque en este se incluyeron a muchos participantes mayores de 60 años. Más de la mitad de los diagnósticos de LMA los reciben las personas de este grupo de edad.
En comparación, la aprobación de la midostaurina se basó en un estudio que no incluyó a ningún paciente mayor de 59 años.
Para las personas con la mutación ITD en FLT3, que incluye a los pacientes mayores, la nueva aprobación “es un gran avance”, afirmó uno de los investigadores principales del estudio, el doctor Harry Erba, del Instituto Oncológico de la Universidad Duke.
Según el doctor Erba, siempre que la persona esté bien como para recibir la quimioterapia intensiva incluida en el tratamiento, añadir quizartinib “debería ser el tratamiento estándar para los pacientes con LMA que presenta la mutación ITD en FLT3”.
Tratamiento de la leucemia mieloide aguda con mutaciones en FLT3
La leucemia mieloide aguda (LMA) es una de las formas de leucemia más malignas. Cuando la LMA presenta determinados cambios genéticos en FLT3, se vuelve aún más difícil de tratar. Estos cambios aumentan la probabilidad de que el cáncer vuelva después del tratamiento inicial y disminuyen la probabilidad de que responda a otros tratamientos.
La aprobación de la midostaurina en 2017 (en combinación con la quimioterapia) y el uso más temprano de trasplantes de células madre han ayudado a que las personas con LMA que tienen mutaciones en FLT3 vivan mucho más tiempo de lo que era posible antes, escribieron las doctoras Amanda Przespolewski y Elizabeth Griffiths en un editorial que acompañó los resultados del estudio en Lancet.
La FDA no incluyó restricciones de edad en la aprobación de la midostaurina. Pero debido a la escasez de datos sobre el uso de la midostaurina en personas de 60 o más años, las doctoras Przespolewski y Griffiths escribieron que “es posible que la mayoría de los pacientes se excluyan [de recibir] este tratamiento eficaz adicional”.
Aunque tanto la midostaurina como el quizartinib se dirigen a células cancerosas con mutaciones en FLT3, el quizartinib se diseñó para dirigirse en forma específica a células de LMA con la mutación ITD en FLT3. Por otro lado, la midostaurina y el gilteritinib también se dirigen a otra mutación en FLT3, conocida como dominio de tirosina-cinasas (TKD).
Aumento al doble de supervivencia general al agregar el quizartinib
En el estudio QuANTUM-First, que Daiichi-Sankyo (el fabricante del quizartinib) financió en parte, se inscribieron 539 adultos de 18 a 75 años de edad. Alrededor del 40 % de los participantes tenían 60 o más años. Muchos participantes también tenían mutaciones en otro gen llamado NPM1. El efecto negativo de la mutación ITD en FLT3 es más notable en las personas con LMA que también presenta mutaciones en NPM1, comentó el doctor Erba.
Las doctoras Przespolewski y Griffiths aplaudieron a quienes dirigieron el estudio por inscribir a “un grupo de pacientes más realista” que el de otros estudios de personas con LMA.
Los participantes del estudio que se asignaron al azar al grupo de quizartinib recibieron este medicamento junto con la quimioterapia como parte del proceso estándar de tratamiento en dos pasos. El primer paso se llama inducción y su objetivo es lograr la remisión de la LMA. El segundo paso se llama consolidación y es para ayudar a mantener esa remisión. Los otros participantes recibieron quimioterapia y un placebo con el mismo esquema.
El trasplante alogénico de células madre es una opción de terapia de consolidación para las personas con LMA. En las personas con mutaciones ITD en FLT3, estos trasplantes son una terapia de consolidación estándar si están sanas como para recibirlos, señaló el doctor Erba. Tanto en el grupo de quizartinib como en el del placebo, el número de participantes que recibieron trasplantes como terapia de consolidación fue similar.
Para evitar la recidiva de la enfermedad, los pacientes del grupo de quizartinib también siguieron tomando el medicamento hasta por 3 años, como terapia de mantenimiento.
Aunque la supervivencia general aumentó al doble en el grupo de quizartinib, la mejora en la supervivencia de los participantes de este grupo fue más considerable en las personas menores de 60 años.
Sin embargo, el doctor Erba comentó que el tratamiento con quizartinib tuvo otros beneficios clínicos importantes.
Por ejemplo, aunque los pacientes de ambos grupos presentaron tasas parecidas de remisión completa después de la terapia de inducción y la terapia de consolidación, las remisiones fueron mucho más prolongadas en las personas tratadas con quizartinib: una mediana de 38,6 meses frente a 12,4 meses.
El tratamiento con quizartinib también ayudó a las personas a vivir más tiempo con o sin un trasplante de células madre.
Por último, en un grupo de pacientes del estudio, el equipo de investigación usó una técnica sofisticada llamada secuenciación de última generación. Con esta técnica evaluaron si los participantes que habían logrado una remisión completa tenían en la médula ósea células leucémicas detectables con la mutación ITD en FLT3.
Cuando no se detectan estas células, se dice que no hay enfermedad residual medible (ERM).
Sin importar el tratamiento recibido, en general las personas sin ERM vivieron más tiempo que las personas con ERM. No queda claro cuánto más tiempo vivieron, porque no habían fallecido aún suficientes participantes sin ERM como para calcular una mediana de supervivencia general, mientras que para el grupo con ERM la mediana de supervivencia general fue de alrededor de 27 meses.
Según el doctor Erba, este hallazgo destaca el potencial de usar el estado de la ERM después de la terapia de inducción para guiar las decisiones de tratamiento posteriores.
El doctor Farhad Ravandi, especialista en el tratamiento de la LMA, del Centro Oncológico MD Anderson de la Universidad de Texas y que no participó en el estudio, estuvo de acuerdo. “La evaluación de la ERM mediante la [secuenciación de] última generación sensible es cada vez más importante en este y otros tipos de leucemia”, afirmó el doctor Ravandi.
Efectos secundarios y el programa de Estrategias de Evaluación y Mitigación de Riesgos
Las personas del grupo de quizartinib tenían más probabilidades que las del grupo de quimioterapia sola de presentar efectos secundarios graves relacionados con el tratamiento, sobre todo, grandes caídas en el recuento de glóbulos blancos. Y unas pocas más personas tratadas con quizartinib murieron durante los 2 primeros meses de tratamiento. La mayoría de las muertes fueron por infecciones.
La midostaurina suele provocar efectos secundarios gastrointestinales importantes, como náuseas y diarrea. Sin embargo, el doctor Erba explicó que en el estudio QuANTUM-First, las tasas de estos efectos secundarios fueron muy bajas en las personas tratadas con quizartinib.
Un efecto secundario relacionado con el corazón llamado intervalo QT prolongado fue más frecuente en las personas tratadas con quizartinib. Esto hizo que la FDA exigiera que los oncólogos usaran el proceso del programa de Estrategias de Evaluación y Mitigación de Riesgos (REMS) para recetar el medicamento. Este efecto secundario implica cambios en el sistema eléctrico del corazón que afectan su ritmo normal. En un porcentaje pequeño de las personas, este problema puede ser mortal.
En el estudio, alrededor del 2 % de las personas del grupo de quizartinib tuvieron formas más graves de la enfermedad en comparación con el 1 % del grupo de quimioterapia sola.
El doctor Erba comentó que, en estudios anteriores sobre el quizartinib, la prolongación del intervalo QT se observó en algunos pacientes que recibieron dosis más altas del medicamento. Pero indicó que con la dosis más baja que se usa en el estudio QuANTUM-First, y que la FDA aprobó, este problema es menos frecuente y que, cuando ocurre, suele ser menos grave.
Reconoció que, pasar por el proceso REMS, “podría impedir que [los oncólogos] receten el quizartinib”. “Pero creo que el beneficio de este medicamento es importante y debería compensar el paso adicional para cumplir el requisito de REMS”.
¿Qué medicamento dirigido a FLT3 se debería usar?
Ahora el desafío para los oncólogos es decidir qué medicamento dirigido a FLT3 usar y en qué pacientes.
La aprobación del quizartinib es solo para el tratamiento inicial de personas cuyos tumores tienen la mutación ITD en FLT3. Y aunque es posible usar la midostaurina en las personas con la mutación ITD o TKD, el doctor Ravandi cree que es probable que muchos oncólogos que suelen tratar la LMA den preferencia al tratamiento con quizartinib como primer tratamiento para los pacientes con la mutación ITD.
Además del hecho de que se dirige a esta mutación específica, el doctor Erba destacó otra razón clave para preferirla a la midostaurina. Cuando las personas con la mutación ITD tienen una recaída, a menudo es porque aparece la mutación TKD.
“Así que tiene sentido usar el quizartinib primero” y guardar el gilteritinib, que está aprobado como tratamiento de segunda línea específico para las situaciones en las que la recaída es por una mutación TKD, comentó.
También queda por resolver si los pacientes deben seguir con el tratamiento de mantenimiento con quizartinib durante 3 años. En el estudio clínico, la mediana de tiempo que los participantes tomaron el medicamento fue de solo 16 meses, y la mayoría lo dejó por los efectos secundarios.
El doctor Ravandi reconoció que el costo del tratamiento de mantenimiento y los efectos secundarios “preocupan”, pero afirmó que abogaría por que los pacientes siguieran tomando quizartinib durante todo el período de tratamiento, si fuera posible.
Agregó que, sin embargo, se trata de una decisión en la que, a medida que se realicen más estudios, “la evaluación mediante ERM quizás sea un factor decisivo”.