La terapia con células T y CAR ha sido aprobada para algunos niños y adultos jóvenes con leucemia
, por Equipo del NCI
El 30 de agosto, la Administración de Alimentos y Medicamentos (FDA) aprobó un tipo de inmunoterapia llamada terapia de células T y CAR para algunos niños y adultos jóvenes con una forma de leucemia linfoblástica aguda (LLA). El tratamiento, tisagenlecleucel (Kymriah™), es la primera terapia de células T y CAR en recibir aprobación de la FDA.
La leucemia linfoblástica aguda es el cáncer más común en niños de los Estados Unidos. La quimioterapia intensiva cura más de 89 % de los niños con LLA que surge en células B, la cual es el tipo predominante de LLA en niños. Pero hay pocas opciones de tratamiento para pacientes cuyos cánceres no responden al tratamiento o que pasan a remisión para después volver a recaer.
El tisagenlecleucel fue aprobado por la FDA y es producido por Novartis para pacientes hasta de 25 años de edad con LLA de células B que no responden al tratamiento o que han tenido recaída dos veces o más.
El tratamiento se ajusta a cada paciente al usar las células T del paciente, las cuales se modifican genéticamente para mejorar su capacidad para reconocer y atacar a las células cancerosas. El proceso se lleva cerca de 22 días y comprende el aislamiento de las células del paciente, manipulándolas genéticamente y haciendo que se multipliquen en el laboratorio, regresándolas después al centro en donde el paciente recibe tratamiento.
Altos índices de remisión con tisagenlecleucel
La aprobación de tisagenlecleucel se basó en un estudio clínico de muchos centros que incluyó a 63 niños y adultos jóvenes con LLA de células B que habían tenido una recaída o resistencia a tratamiento. A los tres meses de tratamiento, el índice general de remisión fue de 83 %.
El tratamiento fue probado inicialmente en la Universidad de Pensilvania en 2010 en adultos con leucemia linfocítica crónica (LLC) avanzada. En 2012, el Hospital Infantil de Filadelfia (CHOP) fue la primera institución en probar el tratamiento en niños con LLA. Desde entonces, el tratamiento ha sido evaluado en 13 centros médicos de Estados Unidos así como algunos en otros países.
"Estamos viendo índices generales de remisión mayores de 80 %, lo cual es una mejoría importante de los índices anteriores de éxito del tratamiento", dijo en una declaración el doctor Stephan Grupp, quien dirigió el estudio en el CHOP.
Otra terapia de células T y CAR, producida por Kite Pharma, se espera que será aprobada más tarde en este año para el tratamiento de algunos pacientes con linfomas. Con el éxito visto en cánceres hematológicos, los investigadores en el NCI y en otras organizaciones están ocupados en la preparación de formas de extender el uso de terapias de células T y CAR.
"Esperamos que el empuje detrás de la tecnología se incremente conforme seguimos investigando la capacidad de la terapéutica personalizada celular en cánceres hematológicos y tumores sólidos para ayudar a los pacientes con otros muchos tipos de cáncer", dijo en una declaración el doctor Carl June, del Centro Oncológico Abramson de la Universidad de Pensilvania, quien dirigió la preparación inicial de tisagenlecleucel.
Una terapia personalizada
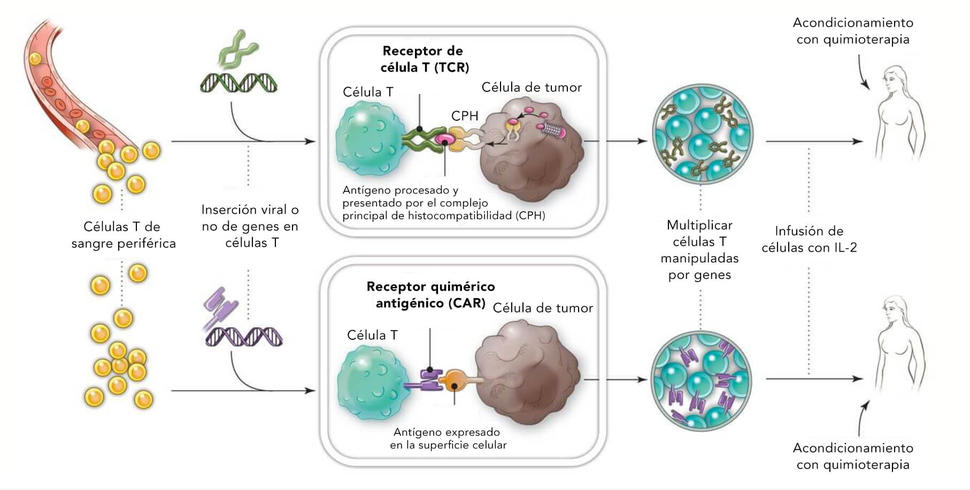
El primer paso en la creación de tisagenlecleucel es aislar las células T de la sangre de un paciente. Estas se envían a una planta procesadora de células. Allí, las células se manipulan genéticamente para que produzcan una proteína llamada receptor quimérico antigénico, o CAR, que permite a las células unirse a una proteína llamada CD19 en las células de tumores. Las células modificadas se hacen crecer o multiplicarse en cientos de millones de células y se regresan al médico del paciente.
Finalmente, después de que los pacientes se someten a quimioterapia de "depleción linfática", ellos reciben la infusión de las células inmunitarias manipuladas. Si el tratamiento funciona como se pretende, las células T y CAR seguirán multiplicándose, lo que aumentará la posibilidad de la terapia de erradicar el cáncer.
Control de efectos secundarios de las células T y CAR
Algunos pacientes en el estudio experimentaron efectos secundarios graves asociados con el tratamiento, y Novartis incluirá una "advertencia enmarcada" para alertar a los médicos de los riesgos posibles para la salud.
La infusión de células T y CAR puede causar efectos secundarios de inflamación—conocidos colectivamente como síndrome de liberación de citocinas (CRS)—que va de fiebres altas y síntomas leves como de influenza a disminución de la presión arterial que pone la vida en peligro, a fuga vascular y problemas renales. Además, eventos neurológicos, como confusión y convulsiones, son posibles también y pueden poner la vida en peligro.
En el estudio que llevó a la aprobación de la FDA, el CRS fue controlado con el uso del fármaco para la artritis tocilizumab (Actemra).
"Actemra parece mitigar los síntomas del síndrome de liberación de citocinas en la gran mayoría de los pacientes", dijo el doctor Christian Capitini, de la Escuela de Medicina y Salud Pública de la Universidad de Wisconsin, quien trató a los participantes en el estudio clínico en el American Family Children's Hospital de la Universidad de Wisconsin.
La FDA ha extendido ahora la aprobación a tocilizumab para tratar CRS grave o que pone la vida en peligro en pacientes mayores de 2 años de edad. En estudios clínicos que incluyen células T y CAR, 69 % de los pacientes que recibieron una o dos dosis de tocilizumab experimentaron una completa resolución del CRS en dos semanas, según la FDA.
"Los efectos secundarios neurológicos en pacientes parecen resolverse por sí solos", dijo el doctor Capitini. "Pero es algo en lo que debemos tener cuidado".
La FDA requiere que las instituciones que ofrecen tisagenlecleucel cuenten con un certificado para demostrar que tienen la pericia para tratar a pacientes y vigilarlos para efectos secundarios posibles. La certificación comprenderá, por ejemplo, la capacitación del personal para reconocer y manejar el CRS y eventos neurológicos.
Respuestas a preguntas, siguientes pasos para las células T y CAR
Los cuidados de seguimiento de pacientes con LLA que reciben células T y CAR incluye infusiones mensuales ambulatorias de inmunoglobulina para evitar infecciones. Los pacientes tienen un riesgo mayor de infecciones porque la CD19 está presente en las células B normales (lo mismo que las cancerosas), y estas células normales son también destruidas por la terapia de células T y CAR.
"Se necesita tener en cuenta muchas preguntas antes de que podamos proclamar los planteamientos inmunoterapéuticos del cáncer como un éxito incondicional", escribió el doctor Francis Collins, director de los NIH, en un artículo de blog sobre la aprobación de la FDA.
No obstante, añadió el doctor Collins, "estamos por iniciar algo prometedor".
El doctor Capitini asintió, indicando que muchos de los pacientes en el estudio que experimentaron remisión habían agotado las opciones de tratamiento antes de empezar la terapia con células T y CAR.
"La aprobación de la FDA es un acontecimiento para el campo, pero es solo el principio," dijo él. "Vamos a ver que las células T y CAR se prueban en diferentes tipos de cánceres. Y es probable que veremos que estas terapias se prueban al principio del proceso de tratamiento, y no cuando los pacientes han agotado ya las opciones de tratamiento".
NCI a la vanguardia de las células T y CAR y otras inmunoterapias celulares
Durante casi dos décadas, los investigadores del NCI han dirigido los esfuerzos del progreso en las terapias celulares para la investigación de cáncer —que ha puesto los fundamentos para la aprobación de tisagenlecleucel. Esta investigación incluye la formulación y pruebas de las terapias de células T y CAR y otras dos formas de transferencia adoptiva celular: terapias de receptor de células T (TCR) y linfocito infiltrador de tumores (TIL).
Los investigadores del NCI están actualmente llevando a cabo muchos estudios clínicos que evalúan las terapias de células T y CAR, TCR y TIL en niños y en adultos con cáncer. Algunos de estos estudios incluyen:
- Terapia de TCR en pacientes con cánceres relacionados con VPH
- Células T y CAR en pacientes con leucemias o linfomas con CD22
- TIL en pacientes con cáncer avanzado de pulmón de células no pequeñas
- Células T y CAR en linfomas con CD30
"La aprobación de la primera terapia de células T y CAR realmente es un acontecimiento para la inmunoterapia del cáncer", dijo el doctor William Dahut, director científico de investigación clínica en el Centro de Investigación Oncológica del NCI. "Nuestro enfoque en el NCI está en mejorar la eficacia de estas inmunoterapias celulares y en encontrar formas de hacerlas aplicables a tantos tipos de cáncer como sea posible".