Radiofármacos: la radioterapia en la era molecular
, por el Equipo del NCI
En los últimos 20 años, hubo una transformación total en el modo en que se tratan muchos tipos de cáncer. Las terapias dirigidas desactivan proteínas específicas en las células cancerosas que ayudan a que estas se formen, multipliquen y diseminen. Las inmunoterapias estimulan o inhiben el sistema inmunitario del cuerpo para ayudarlo a luchar contra el cáncer. Pero la cirugía, la quimioterapia y la radioterapia aún son los tratamientos de base tradicionales para la mayoría de los cánceres.
La radioterapia se usó por primera vez hace más de 100 años para tratar el cáncer. Alrededor de la mitad de los pacientes de cáncer todavía reciben radioterapia en algún momento del tratamiento. Hasta hace poco, la mayor parte de la radioterapia se administraba casi igual que hace 100 años: con haces de radiación externa para destruir los tumores dentro del cuerpo.
Aunque es eficaz, la radioterapia externa a veces causa daños no deseados. Incluso con los equipos modernos de radioterapia, "hay que pasar por el tejido normal para llegar al tumor", explicó el doctor Charles Kunos, del Programa de Evaluación de Tratamientos del Cáncer (CTEP) del NCI. Los efectos secundarios de la radioterapia dependen del área del cuerpo tratada. A veces incluyen pérdida del gusto, cambios en la piel, caída del cabello, diarrea y problemas sexuales.
Ahora los investigadores elaboran una nueva clase de medicamentos que se llaman radiofármacos (medicamentos radiactivos), que administran la radioterapia de forma directa y específica en las células cancerosas. En los últimos años, hubo una explosión de investigaciones y estudios clínicos para probar nuevos radiofármacos.
En estos estudios, se indicó que la radioterapia dirigida a las células podría disminuir el riesgo de los efectos secundarios del tratamiento a corto y largo plazo, y al mismo permitiría destruir depósitos de células cancerosas (aunque sean diminutos) en todo el cuerpo.
El doctor Kunos piensa que "transformarán la radiooncología en los próximos 10 a 15 años".
Aprovechar la afinidad natural
Administrar radiación de forma directa a las células no es un método nuevo. Desde los años cuarenta, se usa una terapia de yodo radiactivo para tratar algunos tipos de cáncer de tiroides. Es natural que el yodo se acumule en las células tiroideas. Es posible crear una versión radiactiva del yodo en el laboratorio. Cuando se toma en píldora o líquido, se acumula en las células cancerosas que hayan quedado después de la cirugía de tiroides y las destruye.
Más adelante, se aprovechó una afinidad (atracción) natural similar para elaborar medicamentos para tratar el cáncer que se disemina a los huesos. Un ejemplo es el radio Ra 223-dicloruro de radio (Xofigo), que se aprobó en 2013 para el tratamiento del cáncer de próstata metastásico. Cuando las células cancerosas se multiplican en el hueso, invaden el tejido óseo y lo destruyen. Entonces el cuerpo trata de reemplazar el hueso para reparar este daño. Este proceso se llama recambio óseo.
El doctor Kunos explicó que el elemento radiactivo radio "se parece a la molécula del calcio, así que se incorpora a las partes del cuerpo en donde más cambia el tejido de los huesos", como en las áreas donde crece el cáncer. Así es como el radio destruye las células cancerosas cercanas.
Todos estos compuestos radiactivos se dirigen a las células cancerosas sin ninguna ayuda. Los investigadores se preguntaron si podrían fabricar moléculas radiactivas para dirigirlas a otros tipos de cáncer.
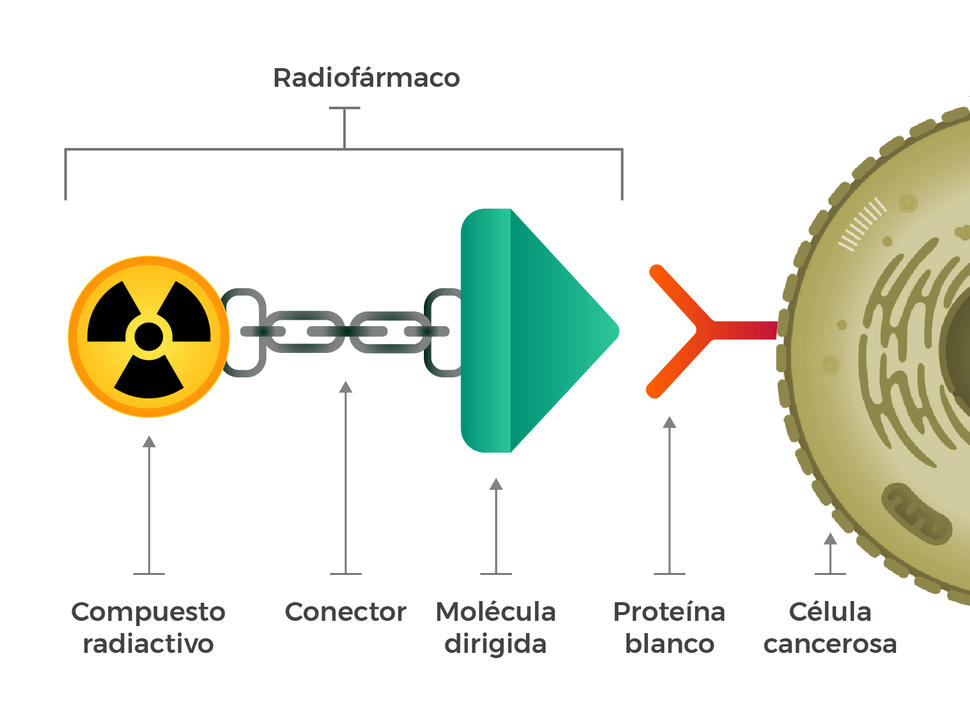
Pensaron en crear radiofármacos con tres componentes básicos: una molécula radiactiva, una molécula dirigida (que reconoce y se une en forma específica a las células cancerosas) y un conector que junta las dos moléculas. Esos compuestos se podrían inyectar, administrar por infusión, inhalar o ingerir para que circulen por la sangre.
La idea de unir una molécula dirigida al cáncer con una molécula que destruya las células cancerosas tampoco es nueva. Por ejemplo, ya se aprobaron para el tratamiento del cáncer varios conjugados anticuerpo-fármaco, que son anticuerpos ligados a medicamentos tóxicos que se unen a ciertas células cancerosas.
Pero los esfuerzos para elaborar estos medicamentos no tuvieron mucho éxito, explicó el doctor Kunos, porque acercar las toxinas a una célula cancerosa no es suficiente. Las toxinas deben pasar al interior de las células y quedarse adentro durante suficiente tiempo para producir daños. Muchas células cancerosas tienen o desarrollan mecanismos que enseguida expulsan las toxinas antes de que esto suceda.
Además, los radiofármacos funcionan mejor cuando los medicamentos logran entrar en las células. Pero no hace falta que entren en las células para que sean eficaces. Una vez que el radiofármaco se une a una célula cancerosa, el compuesto radiactivo se descompone de forma natural. Esta descomposición libera energía que daña el ADN de las células cercanas. Cuando el daño al ADN celular es irreparable, la célula muere. Las células cancerosas son sensibles, en particular, a los daños que produce la radiación en el ADN.
Según el tipo de compuesto radiactivo que se use, es posible que la energía penetre la célula unida al radiofármaco y también penetre las 10 a 30 células que la rodean. Esto aumenta la cantidad de células cancerosas que se destruyen con una sola molécula del radiofármaco.
A mediados de la década de 2010, la Administración de Alimentos y Medicamentos (FDA) aprobó dos radiofármacos dirigidos a moléculas en ciertas célula B para tratar a algunas personas con linfoma no Hodgkin, un tipo de cáncer de la sangre. Sin embargo, estos medicamentos nunca fueron de uso generalizado. Muy pocos médicos que tratan a pacientes de linfoma recibieron la capacitación para administrar estos tipos de compuestos radiactivos. Además, los radiofármacos tuvieron competencia de otros medicamentos más nuevos que no eran radiactivos.
Lo que cambió por completo este campo, dijo el doctor Jacek Capala, del Programa de Investigación sobre la Radiación del NCI, fue la aprobación del lutecio Lu 177-dotatate (Lutathera) por parte de la FDA en 2018 para tratar ciertos tumores cancerosos neuroendocrinos en el tubo digestivo.
"Entonces se demostró que también era posible tratar los tumores sólidos" con un radiofármaco elaborado desde cero, recalcó el doctor. En este caso, la terapia se dirigió a ciertos receptores hormonales que abundan en la superficie de las células de los tumores cancerosos neuroendocrinos.
El lutecio Lu 177-dotatate fue más eficaz para disminuir la multiplicación de los tumores cancerosos neuroendocrinos que cualquier otro medicamento anterior, explicó el doctor Aman Chauhan, de la Universidad de Kentucky, que dirige varios estudios clínicos nuevos del medicamento. El doctor Chauhan agregó que "este fue un enorme avance para nuestro campo".
Medicamentos a partir de sustancias que se usan para obtener imágenes
Hoy en día, los investigadores formulan radiofármacos y los prueban para tratar una variedad de cánceres, incluso el melanoma, el cáncer de pulmón, el cáncer colorrectal y la leucemia, comentó el doctor Capala. El doctor Chauhan agregó que es posible usar radiofármacos para tratar cualquier tumor que tenga una molécula en la superficie celular a la que se pueda apuntar el medicamento, además de suficiente sangre circulante para que el medicamento llegue al tumor.
Muchos de estos medicamentos nuevos son versiones modificadas de sustancias (compuestos) que se usan para obtener imágenes de medicina nuclear. En las pruebas con imágenes de medicina nuclear, como la tomografía por emisión de positrones (TEP), a veces se usan compuestos de radiactividad baja conectados a moléculas que se unen a sitios específicos (blancos) en la superficie de las células cancerosas. Mediante el uso de cámaras especializadas es posible llegar a observar depósitos diminutos de células cancerosas. Esto ayuda a calcular la diseminación del cáncer en el cuerpo.
Los investigadores ahora han adaptado el uso de estas moléculas dirigidas para transportar compuestos radiactivos más potentes o isótopos. Estos compuestos no solo ayudan a ver las células cancerosas sino que además las destruyen.
Estos radiofármacos se probaron primero en el cáncer de próstata. Casi en forma exclusiva en las células de la próstata, hay grandes cantidades de una proteína que se llama antígeno prostático específico de membrana (PSMA). Al fusionar una molécula que se une a la PSMA con un compuesto radiactivo que se usa para obtener imágenes por TEP, los científicos lograron observar depósitos tumorales diminutos de cáncer de próstata que no era posible detectar mediante técnicas convencionales.
En la actualidad, se evalúan varios tratamientos con radiofármacos dirigidos a la PSMA en estudios clínicos.
La mayoría de los cánceres de próstata son muy sensibles a la radioterapia y por lo general se usa la radioterapia externa para tratar la enfermedad, explicó el doctor Frank Lin, del Centro de Investigación Oncológica del NCI, quien dirige un estudio clínico de un radiofármaco dirigido a la PSMA en el Centro Clínico de los NIH.
En la mayoría de los hombres que reciben radioterapia como tratamiento inicial, el cáncer no recidiva (vuelve). Cuando recidiva, a veces el cáncer se disemina a distintas partes del cuerpo y hay muchos depósitos pequeños de células cancerosas en muchos órganos, explicó el doctor.
El doctor Lin señaló que "cuando el tumor se disemina de esa manera, ya no se puede tratar más con radioterapia de haz externo, porque solo es posible usar la radioterapia externa para enfocar y tratar una parte chica del cuerpo a la vez".
Contar con un radiofármaco dirigido a la PSMA es una manera mejor de administrar radioterapia en estos casos, ya que el radiofármaco entra en forma directa en sangre y circula ampliamente, adhiriéndose a las células del cáncer de próstata que se diseminaron por todo el cuerpo, explicó el doctor.
El doctor Lin agregó que una gran ventaja de contar con moléculas que se dirigen al mismo blanco para obtener imágenes y tratar las células cancerosas es que, al ver las imágenes, los médicos anticipan si es probable que el tratamiento sea eficaz.
Por ejemplo, en el estudio del doctor Lin, los hombres debían hacerse una TEP con un compuesto radiactivo para obtener imágenes antes del tratamiento. Si el compuesto radiactivo llega a las células cancerosas y la TEP lo detecta, entonces los investigadores suponen que el tratamiento con el radiofármaco también logrará encontrar esas células.
El doctor Chauhan comentó que "el desarrollo de técnicas de diagnóstico que se complementan con las terapias con medicamentos hace que este campo de investigación sea muy fascinante". "De esta manera podemos saber si el tratamiento llega justo a las células tumorales".
Transición a las terapias combinadas
Aunque el uso de los radiofármacos fue prometedor en los estudios iniciales, es improbable que eliminen por completo un tumor por sí solos, como en el caso de otros tipos de medicamentos para el cáncer.
El doctor Chauhan explicó que por ejemplo, el tratamiento con el lutecio Lu 177-dotatate achicó los tumores neuroendocrinos en más del doble de las personas. Pero el aumento no fue muy grande: 7 % sin el medicamento, cerca del 17 % después del tratamiento.
"Aún falta mucho que mejorar", añadió.
El uso de los radiofármacos en combinación con otras terapias tal vez sea una de las maneras de lograr esas mejoras. Algunos investigadores ahora están probando radiofármacos combinados con radiosensibilizadores, que son medicamentos que mejoran la acción de la radiación en las células cancerosas. Por ejemplo, el doctor Chauhan dirige un estudio clínico del lutecio Lu 177-dotatate combinado con el radiosensibilizador Triapine. Este medicamento impide que las células produzcan los compuestos necesarios para reparar el ADN después del daño debido a la radiación.
En otro estudio, el doctor Lin está probando el lutecio Lu 177-dotatate con un tipo de medicamento llamado inhibidor de PARP. Estos medicamentos, que ya están aprobados para el tratamiento de varios tipos de cáncer, como el cáncer de seno y de ovario, bloquean el proceso de reparación del ADN. El doctor explicó que "la radiación daña el ADN y el inhibidor de PARP evita que las células tumorales reparen el ADN después de la radioterapia".
Otros investigadores prueban combinar radiofármacos con inmunoterapia para tratar de reforzar la eficacia de estos medicamentos. El doctor Capala dijo que "en estudios recientes se demostró que los radiofármacos aumentan la respuesta de los tumores a la inmunoterapia".
También explicó que muchos tumores son "fríos". Es decir, las células inmunitarias no los reconocen o no funcionan bien en el microambiente tumoral.
Pero cuando la radioterapia destruye las células cancerosas, es posible que las proteínas y el ADN de esas células pasen al torrente sanguíneo donde las células inmunitarias las detectan. Esto tal vez permita que las células inmunitarias reconozcan y destruyan otras células cancerosas en todo el cuerpo. La radioterapia también hace que el microambiente tumoral sea más receptivo a las células inmunitarias, agregó el doctor Capala.
En conjunto, estos efectos quizás hagan que el tumor "frío" se vuelva "caliente": el tumor pasa a tener células inmunitarias abundantes y responde a los medicamentos de la inmunoterapia. En algunos estudios se intentó usar la radioterapia externa para generar este tipo de respuesta.
"Pero hay datos que indican que la quimioterapia funciona mejor si cada tumor y cada metástasis se expone a la radiación. La terapia con radiofármacos tiene una ventaja en este aspecto, porque una vez que entra en el cuerpo llega a todas las metástasis", explicó el doctor Capala.
También agregó que incluso tendría sentido combinar los radiofármacos con la radioterapia externa, siempre que el plan de tratamiento establezca la administración de una dosis de radiación general segura. Además, comentó que "la radioterapia externa dirigida a tumores grandes es muy eficaz y se podría combinar con la terapia con radiofármacos para tratar las metástasis".
Desafíos y advertencias
El campo de la terapia con radiofármacos aún se encuentra en sus inicios. Uno de los desafíos para el uso generalizado es que no hay suficientes médicos capacitados para administrar los radiofármacos.
"En los Estados Unidos, hay pocos médicos especializados en medicina nuclear", comentó el doctor Lin, quien está capacitado en medicina nuclear y oncología médica. "Además, creo que capacitamos solo a 70 u 80 personas nuevas por año".
Hasta el momento, la escasez de especialistas impide que los radiofármacos se usen con todo su potencial como tratamiento personalizado, explicó el doctor Capala. A diferencia de otros tipos de medicamentos para el cáncer, los médicos tienen la posibilidad de usar las imágenes para medir con exactitud el volumen de radiofármaco que llega al tumor, casi en tiempo real, y cambiar la dosis según sea necesario.
No obstante, este tipo de planificación del tratamiento requiere una experiencia multidisciplinaria que en general no existe y ha llevado a que los radiofármacos se usen más como una "quimioterapia radiactiva", con la misma dosis para todos, señaló el doctor. "Esto significa que muchos pacientes aún no reciben el tratamiento más óptimo", dijo el doctor Capala.
El doctor Chauhan agregó que también se necesitan estudios de seguridad a largo plazo. Las personas que reciben radioterapia externa tal vez tengan algunos efectos secundarios, llamados efectos tardíos (como la formación de segundos cánceres primarios) incluso meses o años después del tratamiento. Aunque hasta la fecha en las investigaciones no se observa una tasa alta de efectos tardíos por el tratamiento con radiofármacos, "son medicamentos muy nuevos, y debemos seguir siendo precavidos y vigilarlos", aclaró el doctor.
Facilitar la colaboración
Debido a que estos medicamentos son bastante nuevos, aunque hay estudios en curso, "apenas iniciamos el desarrollo de los radiofármacos", dijo el doctor Chauhan.
En 2019, para reforzar los estudios de nuevos radiofármacos prometedores, el NCI creó la Iniciativa para el Desarrollo de Radiofármacos (RDI) a fin de acelerar las pruebas clínicas de los nuevos medicamentos con potencial.
Algo que el NCI espera lograr con esta iniciativa es facilitar la creación de más estudios que usen combinaciones de medicamentos que producen diferentes compañías farmacéuticas que no colaborarían de otro modo, explicó el doctor Kunos, quien dirige la iniciativa. La preocupación sobre la propiedad intelectual y la desconfianza a veces frena los proyectos antes de que comiencen, puntualizó el doctor Kunos.
Agregó que "estos tipos de colaboraciones no existirían si el NCI no participa como intermediario imparcial". En la actualidad, solo hay cerca de 2 % de los estudios en fases tempranas patrocinados por el NCI que estudian radiofármacos, pero la iniciativa tal vez impulse un crecimiento exponencial en los próximos años, continuó el doctor.
El doctor Kunos aclaró que "no vamos a eliminar las máquinas ni los otros métodos que usamos en la radioterapia". "Pero como por naturaleza los radiofármacos se apuntan a un blanco, creemos que van a transformar la manera en que usamos la radioterapia".