Combinación de fármacos de inmunoterapia aprobada para cáncer metastático colorrectal
, por Equipo del NCI
El 10 de julio, la Administración de Alimentos y Medicamentos (FDA) aprobó la combinación de dos fármacos de inmunoterapia, ipilimumab (Yervoy) y nivolumab (Opdivo), para el tratamiento de algunos pacientes con cáncer metastático colorrectal que recibieron tratamiento previo con fármacos quimioterapéuticos convencionales.
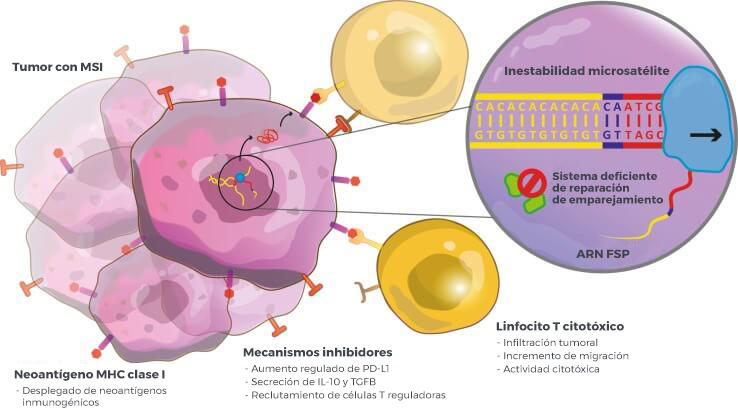
La aprobación acelerada abarca a pacientes de 12 años de edad y mayores cuyos tumores tienen una o dos características genéticas que impiden a las células reparar el ADN dañado: deficiencia en la reparación de errores de emparejamiento (dMMR) o inestabilidad microsatélite alta (MSI-H).
Los tumores que tienen alguna de esas dos características genéticas tienden a presentar índices altos de mutaciones en el ADN. Algunas de esas mutaciones pueden causar la producción de muchos antígenos anómalos que pueden ser atacados por las células inmunitarias.
Los investigadores han encontrado que varios de los inhibidores de puntos de control inmunitario son eficaces en pacientes con tumores con MSI-H o con dMMR, y ese descubrimiento condujo a las aprobaciones de la FDA.
En 2017, la FDA aprobó el inhibidor de puntos de control pembrolizumab (Keytruda) para el tratamiento de tumores con MSI-H o con dMMR, independientemente del lugar en donde comenzó el cáncer en el cuerpo. Esta fue la primera aprobación de la FDA basada únicamente en la presencia de una característica genética en un tumor.
La aprobación fue un paso de avance en el ámbito de la medicina de precisión, señaló el doctor James Gulley, jefe de la sección de inmunoterapia del Centro de Investigación Oncológica del NCI.
Unos meses después, la FDA aprobó nivolumab para pacientes con cáncer metastático colorrectal con MSI-H o con dMMR que empeora después de la quimioterapia.
Estudio CheckMate-142
La nueva aprobación de la FDA se basó en los resultados del estudio CheckMate-142, que fue financiado por Bristol-Myers Squibb, el fabricante de ipilimumab y de nivolumab.
El estudio clínico está probando el uso de nivolumab solo y en combinación con otros fármacos anticancerosos, incluido ipilimumab, en pacientes con cáncer metastático colorrectal con dMMR o con MSI-H que empeoró después del tratamiento de quimioterapia con fluoropirimidina y oxaliplatino o de quimioterapia con fluoropirimidina e irinotecán.
Entre los 82 pacientes del estudio que recibieron la inmunoterapia combinada, 3 presentaron respuestas completas y 35 presentaron respuestas parciales, con un índice de respuesta general de 46 %. Además, 89 % de las respuestas duraron 6 meses o más, de acuerdo con la FDA.
La declaración de la FDA señaló que el índice de la respuesta general de un grupo similar de 58 pacientes que había recibido nivolumab solo fue 28 %, y 67 % de quienes respondieron tuvieron respuestas que duraron 6 meses o más.
Los efectos secundarios más comunes en los pacientes que recibieron ipilimumab y nivolumab fueron cansancio, diarrea, fiebre, dolor osteomuscular y dolor abdominal. La inmunoterapia combinada tuvo un "perfil de seguridad controlable", escribieron los investigadores en un informe sobre el estudio CheckMate-142 de principios de este año.
Evaluación de las varias opciones de tratamiento para los pacientes
Si bien el estudio CheckMate-142 no incluyó a un grupo para probar pembrolizumab en el mismo tipo de pacientes, el doctor Gulley señaló que los niveles de respuesta en ambos fue similar (46 % con la combinación y 40 % con pembrolizumab solo); y más elevado que el nivel de respuesta de nivolumab solo (28 %).
"La inmunoterapia combinada es una importante opción adicional para los pacientes", dijo el doctor, destacando que pembrolizumab, como sustancia única, quizá tenga menos efectos secundarios que la combinación de los dos fármacos.
"No sabemos si hay pacientes que responderían con nivolumab e ipilimumab y que no habrían respondido con pembrolizumab, o viceversa", continuó el doctor Gulley.
El doctor puntualizó también que se deberán hacer estudios prospectivos para ver si pacientes con cáncer metastático colorrectal con dMMR o con MSI-H que no respondieron a los inhibidores de puntos de control, como pembrolizumab, que bloquea la proteína PD-1, habrían respondido a la adición de inhibidores de puntos de control, como ipilimumab, que actúa sobre la proteína CTLA-4.