Aprobación de la FDA para el linfoma avanzado permite el uso de segunda terapia con células T y CAR en el entorno clínico
, por Equipo del NCI
Apenas un mes después de la aprobación de la primera terapia del cáncer en la que se usan células inmunitarias que se obtienen de los pacientes y se someten a manipulación genética, la Administración de Alimentos y Medicamentos (FDA) acaba de autorizar una segunda terapia de este tipo.
La aprobación, que se anunció el 18 de octubre, cubre el uso de axicabtagén ciloleucel (Yescarta™) para pacientes con linfomas de células B grandes cuyo cáncer progresó después de recibir al menos dos regímenes de tratamiento previos. Los linfomas de células B grandes son el linfoma difuso de células B grandes (LDCBG), el tipo más común; el linfoma mediastínico primario de células B grandes; el linfoma de células B de grado alto; y el linfoma folicular transformado.
El descubrimiento de axicabtagén, una forma de inmunoterapia llamada terapia con células T y CAR fue de Steven Rosenberg, M.D., Ph.D. y sus colegas de la Unidad de Cirugía en el Centro de Investigación Oncológica (CCR) del NCI. Después se autorizó a una compañía privada, Kite Pharma, para continuar con el desarrollo y la comercialización de la terapia.
La aprobación de la primera terapia con células T y CAR —tisagenlecleucel (Kymriah™)— para uso en algunos niños y adultos con leucemia avanzada, se consideró como un acontecimiento histórico tanto para la atención de los pacientes como para la investigación sobre el cáncer.
Las potentes respuestas de los pacientes al axicabtagén que se observan en los estudios clínicos, junto con la aprobación nueva de la FDA, han intensificado aún más el optimismo por la terapia con células T y CAR.
“En términos de la atención oncológica, esto es revolucionario”, declaró en un comunicado de prensa Michael Bishop, M.D., quien dirige el Programa de Trasplante de Células Madre Hematopoyéticas en el Departamento de Medicina de la Universidad de Chicago. “Esto cambiará la forma en qué tratamos las neoplasias malignas hematológicas”.
El traslado rápido desde la formulación inicial de la terapia en el NCI hasta la aprobación de la FDA “es un logro importante”, afirmó James Kochenderfer, M.D., uno de los investigadores principales del CCR en los primeros estudios del NCI. “Este es un gran ejemplo de cómo las alianzas del NIH con la industria pueden funcionar”.
Décadas de investigación conducen a las aprobaciones de la terapia con células T y CAR
El tipo de inmunoterapia de más amplio uso es una clase de fármacos conocidos como inhibidores inmunitarios de puntos de control, que la FDA aprobó para el tratamiento de una variedad de cánceres sólidos y de la sangre.
Sin embargo, las células T con CAR no se parecen a los inhibidores de puntos de control ni a ninguna otra terapia aprobada para el cáncer.
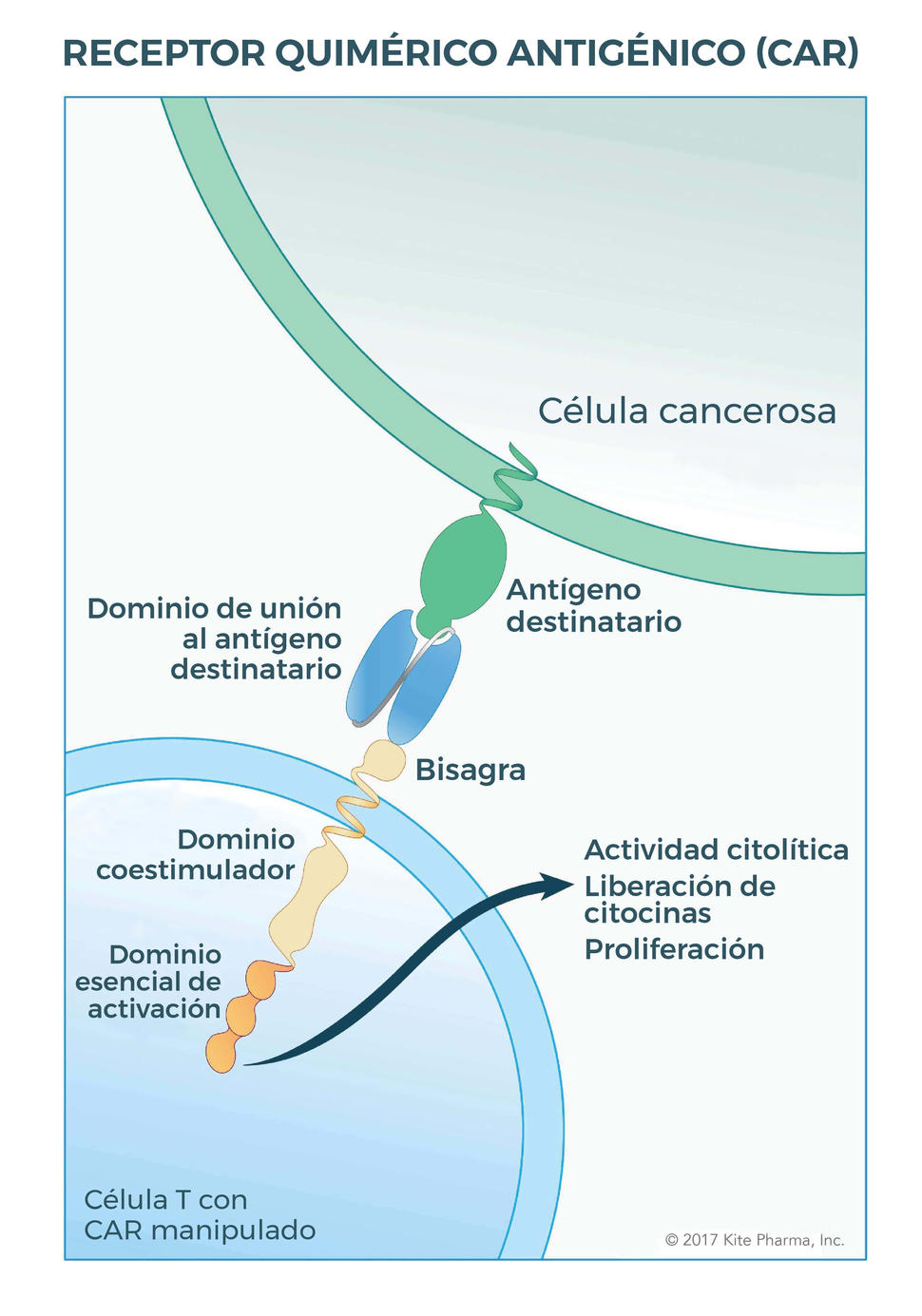
La terapia, que se administra solo una vez como tratamiento, utiliza las células inmunitarias del propio paciente. Después de que se extrae sangre del paciente, se separan las células T —las principales células destructoras del sistema inmunitario— y se manipulan para que expresen un tipo especial de receptor, llamado receptor quimérico antigénico o CAR. Por último, las células T manipuladas se producen en cantidades masivas en el laboratorio y luego se infunden en el paciente.
Bajo la conducción del doctor Rosenberg, los investigadores del NCI han trabajado en la manipulación genética de células inmunitarias como un posible tratamiento del cáncer durante casi tres décadas. En el NCI se llevaron a cabo muchos de los primeros estudios clínicos con seres humanos en los que se probaron las células T con CAR, además de tratamientos similares de inmunoterapia basados en células —conocidos de manera genérica como terapia celular adoptiva.
La forma inicial de axicabtagén se formuló en el NCI entre mediados y finales de la primera década de este siglo. Axicabtagén, de manera similar que tisagenlecleucel, se dirige a la proteína CD19, que a menudo se sobreexpresa en las células B cancerosas. Los componentes del receptor manipulado en las células T ayudan a estimular la capacidad de las células inmunitarias para destruir células cancerosas y extenderse por todo el cuerpo.
Después de que los CAR que se dirigen a CD19 demostraron ser prometedores en los estudios clínicos de fase inicial llevados a cabo en el NCI, el instituto autorizó que Kite Pharmaceuticals accediera a esta terapia como parte de un acuerdo más amplio de investigación para avanzar en la formulación de inmunoterapias celulares.
Hace poco Gilead Sciences, Inc. adquirió Kite, la compañía que patrocinó los estudios clínicos que sirvieron de base para la aprobación de axicabtagén.
Respuestas completas prolongadas con axicabtagén
Más de 100 pacientes con linfomas de células B grandes se inscribieron en el estudio que llevó a la aprobación, conocido como ZUMA-1. Todos los pacientes del estudio tenían enfermedad avanzada que progresó después de recibir al menos dos tratamientos previos. Aproximadamente 20 % de los pacientes ya se habían sometido a un trasplante de células madre.
Cerca de la mitad de los pacientes obtuvieron respuesta completa al tratamiento —es decir, su cáncer desapareció por completo. Además, casi 30 % de los pacientes presentaron respuesta parcial, es decir, alguna reducción en el grado de la enfermedad.
Según parece, para los pacientes que al comienzo presentaron una respuesta completa, los efectos son duraderos y en los datos más recientes se indica que la mayoría sigue sin indicios de cáncer durante por lo menos 6 meses. A pesar de esto, los efectos del tratamiento disminuyeron en un plazo de 6 meses en muchos de los pacientes que presentaron respuestas parciales.
Las potentes respuestas de los pacientes que se observaron en el estudio, junto con las de estudios más pequeños llevados a cabo en el NCI, demuestran que al usar la terapia de células T y CAR “las respuestas completas prolongadas son muy probables en linfoma” expresó el doctor Kochenderfer.
Según Gilead, los datos de un plazo más prolongado del estudio se presentarán en diciembre en una reunión de investigación.
Los efectos secundarios más comunes en los pacientes del estudio fueron concentraciones bajas de los glóbulos sanguíneos llamados neutrófilos (neutropenia) y de los glóbulos rojos (anemia). Sin embargo, cuando se usa la terapia con células T y CAR, los efectos secundarios más preocupantes son el síndrome de liberación de citocinas (CRS) —que de no controlarse con rapidez puede ser mortal— y los problemas neurológicos, como pérdida de memoria, convulsiones y confusión.
Casi 30 % de los pacientes presentaron un episodio neurológico grave, y 13 % presentaron CRS potencialmente peligroso. Ocurrieron tres muertes relacionadas con el tratamiento entre los pacientes del estudio.
Axicabtagén tiene un “recuadro negro” de advertencia sobre los riesgos del CRS y los episodios neurológicos. La FDA ahora exige que el personal de los hospitales que quieran ofrecer axicabtagén reciban capacitación y certificación especiales.
Debido a “la posibilidad de efectos secundarios graves, contar con un equipo especializado que sepa reconocer y tratar estos efectos tóxicos y que intente predecirlos es fundamental para administrar esta terapia”, destacó Julie Vose, M.D., Jefe de Hematología/Oncología en Nebraska Medicine.
Al comienzo, solo grupos pequeños de pacientes serán aptos para recibir axicabtagén
Según Kite y Gilead, se calcula que al principio solo 7500 pacientes con LDCBG por año serán aptos para el tratamiento.
Por este motivo, algunos expertos en linfoma advirtieron que es importante no exagerar el significado de esta aprobación para los pacientes en este momento.
“Anticipo que los médicos pasarán mucho más tiempo explicando a los pacientes con linfoma por qué no son aptos para recibir T-CAR que atendiendo a los pocos que sí son aptos”, publicó en Twitter John Leonard, M.D., de la Facultad de Medicina de Weill Cornell y el Hospital Presbiteriano de Nueva York en Nueva York.
De todas formas, la doctora Vose espera que, con el tiempo, la terapia esté disponible y se aplique como una opción de tratamiento más amplia.
“Aunque solo un número pequeño de pacientes cumplen con los criterios actuales [para axicabtagén],” explicó, “pronto se harán estudios clínicos adicionales que posiblemente aumenten el número de pacientes que son aptos para recibir esta terapia”.
Después de la aprobación de tisagenlecleucel, varios grupos de pacientes y médicos expresaron preocupación sobre su costo, que el fabricante, Novartis, fijó en $475 000. No obstante, en colaboración con los Centros de Servicios de Medicare y Medicaid, la compañía estableció un modelo basado en el desempeño para el reintegro: los pacientes solo pagarán si responden al tratamiento dentro del primer mes de recibirlo.
Gilead anunció que el costo de axicabtagén será de $373 000. Sin embargo, la compañía no adoptará el mismo modelo de pago basado en el desempeño que estableció Novartis.
Se debe prestar particular atención a los gastos del tratamiento, afirmó la doctora Vose, y “se exigirá un uso muy cuidadoso de la terapia solo para los pacientes más indicados”.
No solo un tratamiento exclusivo para linfoma
Se continúan perfeccionando las terapias con células T y CAR, es decir, se mejoran para que funcionen con mayor eficacia y sean más seguras, agregó el doctor Kochenderfer.
Señaló que los resultados iniciales en el primer grupo pequeño de pacientes con linfoma avanzado que se trató como parte de un estudio del NCI de un nuevo tipo de célula T con CAR dirigido a CD19, indican que el tratamiento en efecto tiene menor riesgo de efectos secundarios graves. No obstante, destacó que todavía se necesita más trabajo y que se deben tratar a más pacientes antes de que se pueda afirmar algo concreto sobre la seguridad de esta terapia.
A partir de la evidencia disponible, explicó el doctor Kochenderfer, hay una justificación convincente para probar las células T con CAR temprano en el curso de la enfermedad de los pacientes con linfoma.
La terapia de células T y CAR “no es solo un punto en el radar”, añadió. “Será un componente crucial de la terapia de linfoma durante mucho tiempo”.