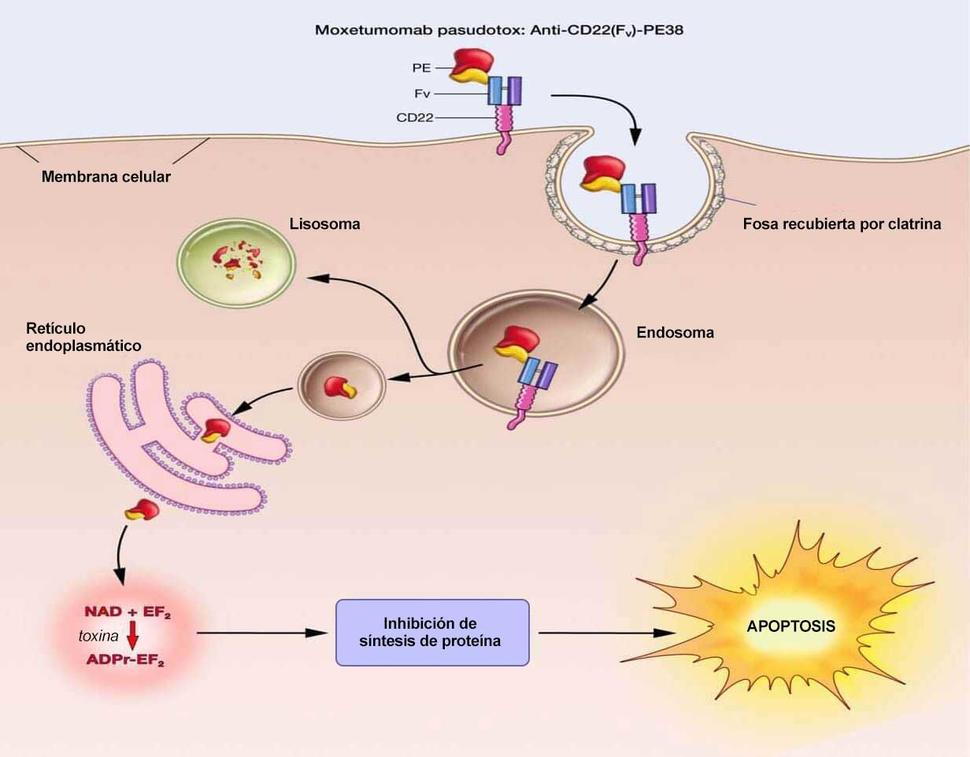
Moxetumomab aprobado por la FDA para leucemia de células pilosas
, por Equipo del NCI
La Administración de Alimentos y Medicamentos (FDA) de los EE. UU. aprobó moxetumomab pasudotox (Lumoxiti), un fármaco basado en una toxina bacteriana, para el tratamiento de algunos pacientes con leucemia de células pilosa (HCL). La aprobación cubre el uso de moxetumomab en pacientes con HCL que ya se han sometido a, al menos, dos líneas de tratamientos convencionales.
La decisión de la FDA convierte a moxetumomab en el primer tratamiento aprobado para este grupo de pacientes. La aprobación se basó en los hallazgos de un estudio clínico de 80 pacientes patrocinado por el fabricante del fármaco, MedImmune.
En el estudio, aproximadamente 30 % de los pacientes presentaron una desaparición completa del cáncer (respuesta completa), que duró por un largo período, y los efectos secundarios de la terapia fueron escasos y leves en su mayoría. En general, 75 % de los pacientes en el estudio presentaron respuesta parcial o respuesta completa.
Moxetumomab fue descubierto originalmente por el doctor Ira Pastan y sus colegas en el Centro de Investigación Oncológica (CCR) del NCI y, posteriormente, se otorgó la autorización a MedImmune/AstraZeneca para llevar a cabo la formulación clínica.
"Se trata de un ejemplo importante de investigación innovadora desde el punto de vista conceptual llevada a cabo en el NCI y que ha llegado a buenos términos prácticos con un socio comercial", dijo el doctor Tom Misteli, director del CCR. "Es el tipo de trabajo que se hace posible gracias a la capacidad que tenemos en el NCI de hacer investigaciones a largo plazo y de alto riesgo, incluso de cánceres tan poco comunes como la leucemia de células pilosas. Moxetumomab marcará la diferencia en las vidas de pacientes con esta enfermedad incurable".
Muchas personas a quienes se les diagnostica HCL lograrán una remisión con los tratamientos actuales, explicó el investigador principal del estudio, doctor Robert Kreitman, del Laboratorio de Biología Molecular del CCR.
"Pero, entre 30 y 40 % de estos pacientes sufrirán una recaída 5 a 10 años después de su primer tratamiento", continuó el doctor Kreitman.
A medida que los pacientes reciben tratamientos adicionales, y aunque logren otra remisión, la duración de esas remisiones se acorta más y más, y las toxicidades de los tratamientos comienzan a acumularse, explicó el doctor. Para estos pacientes, existen muy pocos tratamientos eficaces, lo cual hace que esta nueva aprobación sea tan importante.
"Moxetumomab representa un tratamiento prometedor sin quimioterapia para la HCL, lo cual responde a una necesidad médica de los pacientes que aún no estaba satisfecha", dijo el doctor Kreitman.
Moxetumomab incluye un recuadro de advertencia especial para médicos y pacientes sobre el riesgo de síndrome de extravasación capilar, en el cual fluidos y proteínas se fugan fuera de los vasos sanguíneos pequeños a los tejidos circundantes.
Hay más detalles disponibles sobre moxetumomab y el estudio clínico en el cual la FDA basó su aprobación en este artículo de junio de 2018 de Cancer CurrentsCancer Currents.