Tecartus es la primera terapia de células T con CAR aprobada para adultos con leucemia linfoblástica aguda
, por el Equipo del NCI
Los adultos con la forma más común de leucemia linfoblástica aguda (LLA), un tipo de cáncer de la sangre, suelen responder a los tratamientos iniciales, pero la enfermedad vuelve o el tratamiento no tiene ningún efecto. Ahora, estos pacientes cuentan con otra opción de tratamiento, un tipo de inmunoterapia llamada terapia de células T con CAR.
El 1 de octubre, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el uso de la terapia de células T con CAR brexucabtagén autoleucel (Tecartus) para adultos con leucemia linfoblástica aguda de células B precursoras (LLA-B) que es resistente al tratamiento o que recidivó (volvió). El brexucabtagén es la primera terapia de células T con CAR aprobada para adultos con LLA.
La aprobación se basó en los resultados de un estudio clínico pequeño de fases 1 y 2 llamado ZUMA-3 que incluyó a más de 50 adultos con LLA-B (recidivante o resistente al tratamiento) que recibieron brexucabtagén. A los 3 meses de recibir el tratamiento, más de la mitad de los participantes tuvieron remisión completa, es decir, no presentaban signos de cáncer. En muchos de los pacientes, esa respuesta duró más de 1 año.
“No hemos observado respuestas ni duraciones de respuesta como estas”, recalcó el investigador principal del estudio, el doctor y máster en Ciencias Bijal Shah, del Centro Oncológico Moffit.
Esta es la segunda aprobación que la FDA otorga para el uso de brexucabtagén. En agosto de 2020, se aprobó para tratar a algunos adultos con linfoma de células de manto.
Al igual que en estudios anteriores del brexucabtagén, la mayoría de los participantes tuvieron efectos secundarios, incluso tasas altas de una afección inflamatoria grave llamada síndrome de liberación de citocinas y problemas neurológicos. Dos participantes murieron por una reacción adversa al tratamiento.
Aunque los efectos secundarios suelen ser graves, los posibles beneficios del brexucabtagén los superan, indicó el doctor Shah. “Estos síndromes se presentarán, pero suelen desaparecer en [la mayoría de] los pacientes. Se aliviarán, y después del tratamiento, tendrán la posibilidad de una remisión”.
Un nuevo método para tratar la leucemia que no se va
La LLA-B se llama así porque se forma en las células B, que son un tipo de glóbulo blanco. Aunque es más frecuente en los niños, también afecta a los adultos.
En los últimos 20 años, los investigadores lograron aumentar mucho la supervivencia de los niños con LLA-B, en gran parte, porque modificaron y mejoraron los regímenes de quimioterapia.
Con algunos de esos mismos regímenes, “se mejoraron los resultados para los adolescentes y adultos jóvenes con LLA-B de hasta 39 años de edad”, comentó la doctora Shira Dinner, de la Facultad de Medicina Feinberg de la Universidad Northwestern, que no participó en el estudio ZUMA-3.
Sin embargo, añadió que en las personas mayores con LLA-B no tuvo este efecto favorable.
“Para los adultos de 40 años o más, el pronóstico sigue siendo malo”.
Aunque los adultos con LLA-B tienden a responder a otros medicamentos, incluso al blinatumomab (Blincyto) y al inotuzumab ozogamicina (Besponsa), el cáncer suele volver. La mediana de supervivencia general después del tratamiento con cualquiera de estos dos medicamentos es menor de 8 meses.
Aunque los resultados mejoraron con estas nuevas opciones de tratamiento, la doctora Dinner señaló que “una de las limitaciones de esos tratamientos, así como de las quimioterapias más tradicionales, es que la remisión sigue siendo muy breve”.
Cuando el cáncer vuelve después del tratamiento con estos medicamentos, el siguiente paso suele ser un trasplante de células madre. Pero este procedimiento no es una opción para muchos pacientes. Algunos “ya tuvieron un trasplante, no cuentan con un donante o no cumplen con los requisitos para recibir un trasplante por la edad u otros problemas médicos”, comentó la doctora Dinner.
“Para los pacientes sin la opción de un trasplante de células madre, [el brexucabtagén] podría ser una buena alternativa”, agregó la doctora Dinner.
El brexucabtagén se relacionó con resultados de supervivencia prometedores. Más de la mitad de los pacientes en el estudio de ZUMA-3 cuyos tumores respondieron al tratamiento seguían vivos 22 meses después, sin que se alcanzara la mediana de supervivencia.
“Todavía no puedo decir que [el brexucabtagén] sea un reemplazo para un trasplante de células madre, pero… en cuanto a la duración de la respuesta y los resultados de supervivencia hasta la fecha, es el tratamiento más prometedor que tenemos”, indicó la doctora Dinner.
Resultados del estudio ZUMA-3
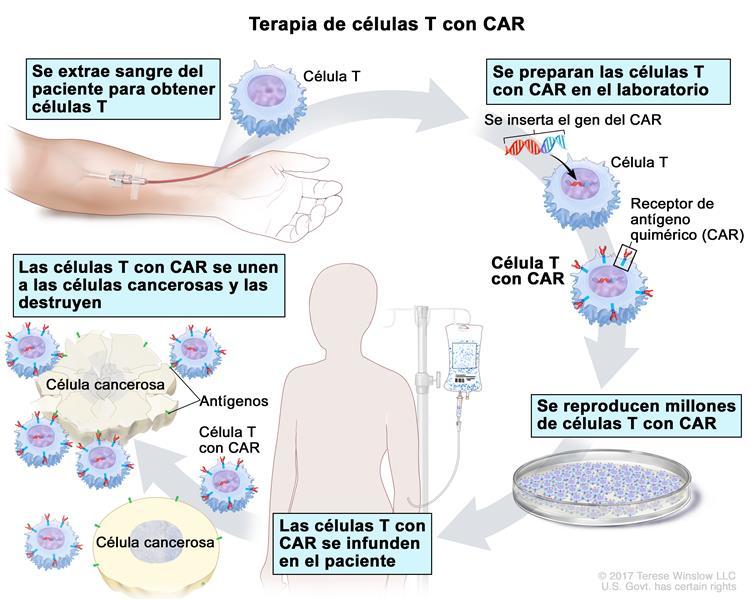
Al igual que otras terapias de células T con CAR aprobadas por la FDA, el brexucabtagén se elabora a partir de las células T del paciente. Estas células inmunitarias se extraen del paciente y se modifican para fabricar un receptor especial en la superficie de la célula mediante un proceso complejo. Este receptor ayuda a que las células T se dirijan a las células cancerosas para destruirlas.
De los pacientes que se inscribieron al comienzo del estudio, se lograron fabricar células T con CAR para todos, menos para 6 pacientes. La mediana de tiempo entre la obtención de las células T (mediante leucocitaféresis) y la producción de las células T con CAR fue de 13 días para los pacientes en los Estados Unidos y de 14,5 días para los pacientes en Europa.
Antes de recibir una infusión de brexucabtagén, todos los participantes recibieron quimioterapia de acondicionamiento.
Según Kite, el fabricante del brexucabtagén, que además financió el estudio de ZUMA-3, en una mediana de seguimiento de alrededor de 12 meses, el 65 % de los pacientes tuvieron una remisión completa después del tratamiento o una remisión completa sin que el recuento de glóbulos blancos volviera a ser normal. Kite informó que, entre los que lograron una remisión completa, más de la mitad no tuvieron signos de cáncer durante al menos 1 año.
Esto no significa que los pacientes se curaron por completo, advirtió la doctora Dinner. “Necesitaremos datos de seguimiento de estos pacientes a largo plazo” para determinar si el cáncer vuelve, aclaró.
El doctor Shah es optimista. Comentó que, después del tratamiento con brexucabtagén y un trasplante de células madre, “hay una posibilidad real de que el paciente se cure. Y para quienes no pueden [recibir un trasplante], de todos modos cuentan con muy buenas probabilidades de curarse, mucho más altas que nunca antes.
Casi todos los pacientes tuvieron efectos secundarios después de recibir brexucabtagén. El síndrome de liberación de citocinas, que causa fiebre intensa y otros síntomas similares a los de la gripe, se presentó en el 92 % de las personas tratadas con brexucabtagén y, de estas, el 26 % tuvo una forma grave de este síndrome. El 87 % de los participantes tuvieron efectos secundarios neurológicos, incluso temblor, confusión y encefalopatía. El 35 % de estos pacientes tuvieron efectos secundarios neurológicos graves.
“Cuando se presentan estos síntomas, es muy difícil que un adulto mayor los tolere”, señaló la doctora Dinner. “Por lo tanto, creo que [los efectos secundarios] son un factor importante que el médico debe considerar al explicar los riesgos y los beneficios [del brexucabtagén] a un paciente”.
Próximos pasos en el uso del brexucabtagén
Aunque los resultados de este estudio son prometedores, comentó la doctora Dinner, se necesitan más investigaciones para entender el lugar que esta terapia ocupará en las estrategias de tratamiento existentes.
“Debemos ser conscientes de que [la terapia de células T con CAR] es una técnica nueva y complicada”, indicó la doctora Dinner. Por ejemplo, los hospitales y los profesionales clínicos aún están aprendiendo cómo resolver “obstáculos de logística” de estos tratamientos.
De todas formas, añadió, “este es un gran avance”.
Según el doctor Shah, a partir de estos resultados alentadores para las personas con LLA-B recidivante o resistente al tratamiento, la terapia de células T con CAR se podría investigar como un tratamiento inicial, o de primera línea, para otros pacientes. Eso podría incluir a quienes tienen cáncer con un riesgo alto de no responder bien a los tratamientos de primera línea existentes.
También se podría usar el brexucabtagén u otras terapias de células T con CAR en otros pacientes con LLA. “Esta [aprobación] es solo para la leucemia linfoblástica aguda de células B precursoras”, comentó la doctora Dinner. “Así que, aún faltan opciones para tratar la leucemia linfoblástica aguda de células T, que es el tipo que tiene el 25 % de las personas con leucemia linfocítica aguda. Para esa enfermedad, se están formulando algunos tratamientos de células T con CAR”.