Enhertu es la primera terapia dirigida al cáncer de pulmón con mutaciones en HER2
, por el Equipo del NCI
Cada vez más, las personas con cáncer de pulmón reciben tratamientos que se concentran en cambios genéticos específicos en sus tumores (terapias dirigidas). Ahora los pacientes de cáncer de pulmón de células no pequeñas (CPCNP) tienen otra opción de terapia dirigida.
El 11 de agosto, la Administración de Alimentos y Medicamentos (FDA) otorgó la aprobación acelerada del trastuzumab deruxtecán (Enhertu) para adultos con CPCNP con cierta clase de mutación en el gen HER2 (llamada mutación “activadora”). Cerca del 3 % de las personas con CPCNP tienen esta clase de mutación en HER2.
Para recibir el tratamiento con Enhertu, los pacientes también deben tener un cáncer irresecable (que no es posible extirpar) o metastásico (que se diseminó a otras partes del cuerpo), y haber recibido uno o más tratamientos de cáncer.
El doctor y licenciado en Medicina Joel Neal, especialista en cáncer de pulmón e investigador en el Instituto Oncológico Stanford dijo que la aprobación era “muy esperada y emocionante”.
El doctor Neal agregó que “Hasta ahora, no había terapias dirigidas aprobadas por la FDA para el cáncer de pulmón con mutación en HER2".
La aprobación se basó sobre todo en los resultados de un estudio clínico de fase 2, llamado DESTINY-Lung02, en el que el tratamiento con Enhertu achicó los tumores de más de la mitad de los participantes del estudio. Todos los pacientes del estudio tenían CPCNP que había empeorado después de recibir otros tratamientos.
El doctor Bob T. Li, licenciado en Medicina y máster en Salud Pública, del Centro Oncológico Memorial Sloan Kettering, dijo que "Después de dos décadas de intentos fallidos en estudios clínicos, aprendimos más sobre la biología de HER2 en el cáncer de pulmón".
El doctor Li, que es el investigador principal de DESTINY-Lung02 y otros estudios de Enhertu, señaló que esas lecciones llevaron con el tiempo a la creación y aprobación de Enhertu.
Con la aprobación acelerada de la FDA, las empresas que elaboran Enhertu (AstraZeneca y Daiichi Sankyo) tienen que hacer otro estudio clínico para confirmar los beneficios del tratamiento, como la forma de mejorar el tiempo de vida de los pacientes sin que empeore el cáncer.
Pruebas para detectar las mutaciones en HER2
Junto con Enhertu, la FDA aprobó dos pruebas diagnósticas con fines terapéuticos para encontrar las mutaciones en el gen HER2: Guardant360 CDx, que usa una muestra de sangre, y Oncomine Dx Target Test, que usa una muestra de tejido del tumor.
El doctor Neal indicó que este tipo de prueba genética, que a menudo se llama prueba de biomarcadores, es "el primer paso fundamental" para tratar a las personas con cáncer de pulmón.
Afirmó que es más probable que las mujeres que nunca fumaron y que son de ascendencia asiática tengan una mutación en HER2 en los tumores de pulmón.
Sin embargo, todos los pacientes de CPCNP en estadio avanzado se deben hacer las pruebas de biomarcadores para detectar esta mutación en HER2 y otras mutaciones para las que hay terapias dirigidas, como las relacionadas con los genes EGFR, ALK y BRAF.
El doctor agregó que "Las pruebas en serie, como la secuenciación de última generación, ahora son el estándar de atención" para las personas con cáncer de pulmón en estadio avanzado.
El doctor Neal explicó que las mutaciones en HER2 observadas en el cáncer de pulmón activan la proteína HER2 todo el tiempo. Dijo que esto es un poco diferente al caso del cáncer de seno (mama) en el que los tumores a veces presentan concentraciones altas de la proteína HER2 debido a la sobrexpresión del gen.
Resultados del estudio DESTINY-Lung02
El estudio DESTINY-Lung02 se realizó en numerosos países y participaron 102 pacientes. La mitad de los participantes nunca habían fumado y el 79 % eran de origen asiático. Todos los participantes se asignaron al azar para recibir una de las dos dosis de Enhertu, administradas como infusión cada 3 semanas.
Los tumores se redujeron en 30 de 52 personas (58 %) que recibieron la dosis más baja, incluso en el caso de una persona, cuyos tumores desaparecieron por completo. Entre las personas con tumores que se achicaron, el tratamiento controló el cáncer durante una mediana de 9 meses.
El doctor Li y su equipo consideraron que la dosis más baja era óptima porque achicaba los tumores tanto como la dosis más alta y causaba menos efectos secundarios. La FDA aprobó el uso la dosis más baja de Enhertu.
El doctor Neal dijo que también es importante saber cuántos tumores de los participantes permanecieron del mismo tamaño (llamada enfermedad estable) mientras tomaban Enhertu.
Explicó que, a menos que cause demasiados efectos secundarios, los médicos suelen continuar con el tratamiento de cáncer de pulmón aunque el tamaño de los tumores siga igual o solo se achique un poco.
Todavía no se dispone del porcentaje de personas que tenían enfermedad estable en el estudio DESTINY-Lung02. Pero, en un estudio clínico anterior de Enhertu con personas que tenían CPCNP metastásico con mutación en HER2, el 37 % de los 91 participantes tenían enfermedad estable.
Efectos secundarios de Enhertu
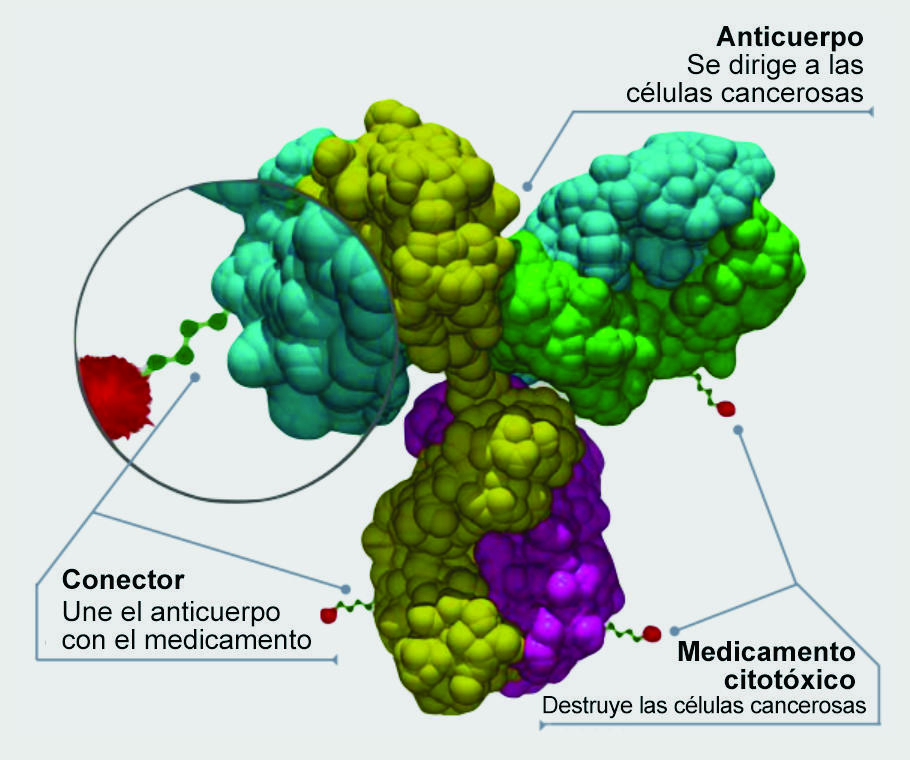
Enhertu es un tipo de medicamento que se conoce como conjugado anticuerpo-fármaco. La porción de anticuerpo se une a la proteína HER2 en la superficie de las células de cáncer de pulmón. Luego, un medicamento quimioterapéutico que se adhiere al anticuerpo entra a las células cancerosas y las destruye.
El doctor Neal explicó que, como “la parte del medicamento quimioterapéutico es muy potente, el perfil de efectos secundarios de este medicamento es, en su mayoría, similar a la quimioterapia”. Algunos ejemplos son náuseas, pérdida de cabello y recuentos bajos de glóbulos sanguíneos.
El doctor Li señaló que casi todos los efectos secundarios se parecen a los de la quimioterapia estándar, pero quizás no sean tan graves porque Enhertu se libera directamente en las células cancerosas.
Enhertu también incluye una advertencia sobre un efecto secundario potencialmente mortal llamado enfermedad pulmonar intersticial o neumonitis. En los estudios de Enhertu en personas con CPCNP y cáncer de seno (mama), alrededor del 12 % de los pacientes tuvieron enfermedad pulmonar intersticial o neumonitis.
El doctor Neal indicó que eso es más alto que lo que se observa con otras terapias dirigidas para el cáncer de pulmón.
El doctor Li comentó que “la mayoría del tiempo [la enfermedad pulmonar intersticial o neumonitis] es leve y reversible, pero a veces podría ser grave y potencialmente mortal”.
Añadió que, cuando el equipo de investigación mejoró la detección de los primeros síntomas de esta enfermedad y su tratamiento (en general con corticoesteroides), este efecto secundario se volvió menos grave.
El doctor Li agregó que hay muchos estudios en marcha sobre posibles tratamientos para el cáncer de pulmón con mutaciones en HER2 que son muy interesantes. En algunos, se buscan otros conjugados anticuerpo-fármaco que se unan a HER2 o nuevos medicamentos con micromoléculas que bloqueen la actividad de HER2. Dijo que, si se demuestra que son seguros y eficaces, estos medicamentos se podrían usar en secuencia o combinación con Enhertu.
Se aprobó el capmatinib para tratar el cáncer de pulmón con mutación en MET
El 10 de agosto, la FDA otorgó la aprobación completa para el uso del capmatinib (Tabrecta) para el tratamiento del CPCNP metastásico con una mutación en el gen MET llamada "omisión del exón 14". Alrededor del 3 % al 4 % de las personas con CPCNP tienen tumores con este tipo de mutación genética.
En 2020, la FDA otorgó la aprobación acelerada del capmatinib para tratar a los adultos con este tipo de cáncer. La aprobación completa se basa en los resultados de estudios nuevos que confirmaron los beneficios del tratamiento.
Según los nuevos hallazgos, el capmatinib achicó los tumores del 68 % de los pacientes que no recibieron ningún tratamiento de cáncer anterior y evitó que los tumores volvieran a crecer durante una mediana de 17 meses. Entre los que ya habían recibido uno o más tratamientos de cáncer, el capmatinib achicó los tumores el 44 % y los mantuvo bajo control durante cerca de 10 meses.
Los efectos secundarios más comunes del capmatinib, que se toma en pastilla dos veces al día, son edema (hinchazón), náuseas y dolor. También es posible que el capmatinib cause efectos secundarios graves y potencialmente mortales, como enfermedad pulmonar intersticial o neumonitis, toxicidad hepática y toxicidad pancreática. También podría causar daño grave a los bebés por nacer.
El doctor Neal explicó que la FDA aprobó además otro medicamento llamado tepotinib (Tepmetko) para las personas con CPCNP que presenta una mutación de omisión del exón 14 de MET.