Resultados prometedores del tarlatamab para algunas personas con cáncer de pulmón de células pequeñas
, por Elia Ben-Ari
Un nuevo tipo de medicamento de inmunoterapia dirigida achicó los tumores en una de cada tres personas con cáncer de pulmón de células pequeñas (CPCP), la forma más maligna del cáncer de pulmón, según los resultados de un estudio clínico. Estos son hallazgos alentadores porque el tratamiento del CPCP avanzado no tuvo mucho progreso, comentaron los expertos.
Muchas personas con CPCP responden al tratamiento inicial con quimioterapia e inmunoterapia. Pero el cáncer suele progresar a pesar del tratamiento adicional, y la mayoría de los pacientes mueren en pocas semanas o meses.
En el estudio clínico en fase temprana, se probaron dos dosis diferentes de un medicamento experimental llamado tarlatamab en las personas con CPCP cuyo cáncer había progresado tras recibir al menos dos tipos de tratamiento anteriores. Muchas personas en el estudio habían recibido al menos tres tratamientos distintos.
En el estudio, los tumores se achicaron en el 40 % de las personas que recibieron 10 mg de tarlatamab cada 2 semanas, y en alrededor del 32 % de las personas que recibieron una dosis de 100 mg de tarlatamab.
Además, en más de la mitad de los pacientes cuyos tumores se achicaron con el tarlatamab, el tratamiento mantuvo el cáncer bajo control durante al menos 6 meses, y en muchos casos durante 9 meses o más tiempo.
Este último hallazgo es en particular notable, señaló el doctor Anish Thomas del Centro de Investigación Oncológica del Instituto Nacional del Cáncer (NCI), que investiga el CPCP, pero que no participó en el estudio.
“Es probable que sea uno de los tratamientos más prometedores que se prueban para el cáncer de pulmón de células pequeñas en este momento”, destacó el doctor Thomas. Los nuevos hallazgos “dan esperanza a los pacientes y a quienes les ofrecen tratamiento, en especial, porque es una enfermedad tan agresiva para la que hubo muy pocos avances de tratamiento desde la década de los ochenta”, añadió.
Los resultados del estudio llamado DeLLphi-301 (financiado por Amgen, el fabricante del tarlatamab) se presentaron el 20 de octubre en la reunión anual de la Sociedad Europea de Oncología Médica (ESMO) en Madrid y se publicaron el mismo día en la New England Journal of Medicine (NEJM).
Los nuevos hallazgos “respaldan el uso del tarlatamab en estos pacientes que recibieron tratamiento anterior” mencionó el doctor y licenciado en Medicina Luis Paz-Ares, del Hospital Universitario 12 de Octubre en Madrid, que fue el investigador que coordinó el estudio y presentó los resultados en la reunión de la ESMO.
La doctora y licenciada en Medicina Pilar Garrido, del Hospital Universitario Ramón y Cajal en Madrid, que no participó en el estudio, pero que habló sobre este en la reunión de la ESMO, coincidió en que los hallazgos son “alentadores”. Sin embargo, subrayó que se necesita hospitalizar a los pacientes cuando reciben el medicamento por primera vez, debido a los posibles efectos secundarios graves, lo que presenta retos logísticos para administrarlo.
La doctora Garrido también señaló la necesidad de contar con más datos sobre la eficacia del tarlatamab para el CPCP que se diseminó al encéfalo, y de identificar un biomarcador para pronosticar qué pacientes responderán al medicamento.
Según el doctor Paz-Ares, el fabricante del tarlatamab ya inició un estudio clínico grande en el que se compara el tarlatamab con la quimioterapia estándar en las personas con CPCP que recidivó después de un tratamiento inicial.
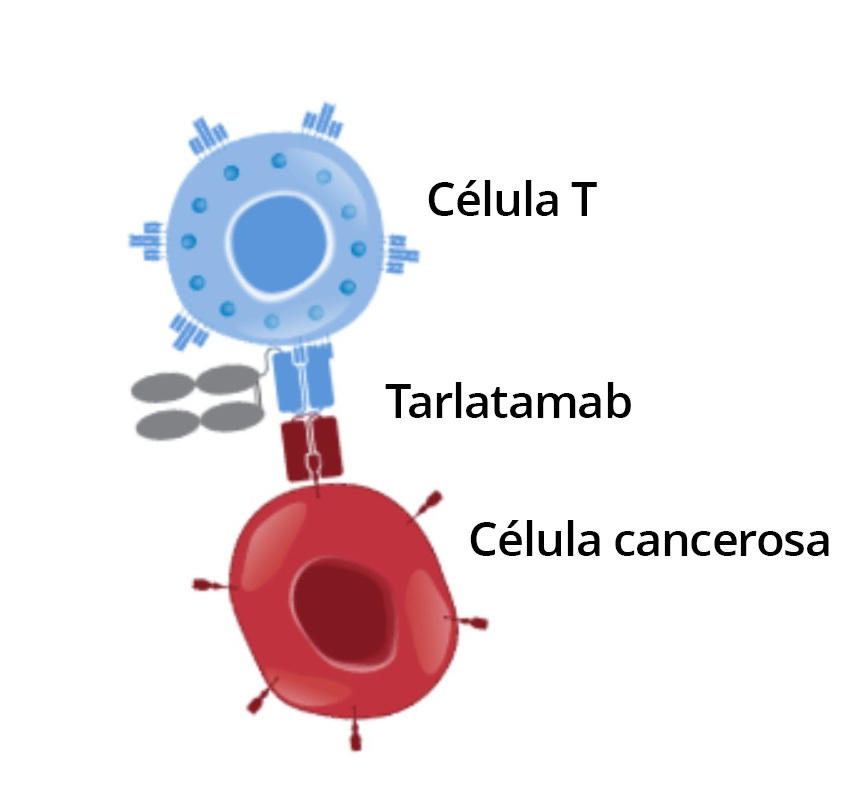
El tarlatamab usa las células T para destruir las células del cáncer de pulmón de células pequeñas
El tarlatamab es un tipo de inmunoterapia que se llama molécula biespecífica captadora de células T (BiTE). Estos medicamentos de dos brazos se unen de forma simultánea a las células tumorales y a células inmunitarias, llamadas células T. Esta unión acerca las células T a las células cancerosas, lo que permite que las células T reconozcan y destruyan las células cancerosas.
El brazo del tarlatamab dirigido a las células del cáncer de pulmón de células pequeñas se adhiere a una proteína llamada DLL3. En condiciones normales, esta proteína está en el interior de la célula, pero a menudo hay concentraciones altas en la superficie de las células de CPCP, donde el tarlatamab la reconoce.
Por este motivo, la DLL3 “es una diana muy atractiva en el CPCP”, señaló la doctora Garrido.
En el estudio se inscribió a más de 200 personas con CPCP avanzado o en estadio diseminado, que progresó o que ya no respondía al tratamiento. Todos los participantes habían recibido tratamiento anterior con quimioterapia, y muchos habían recibido además un inhibidor de puntos de control inmunitario, otro tipo de medicamento de inmunoterapia. Todos los participantes habían recibido al menos dos tratamientos anteriores, y un tercio de ellos también habían recibido tres o más tratamientos anteriores.
El equipo del estudio analizó la respuesta al tarlatamab en 100 participantes que recibieron 10 mg de tarlatamab mediante infusión cada 2 semanas, mientras que otros 88 participantes recibieron 100 mg cada 2 semanas. Además, para el análisis de los efectos secundarios se incluyó a 34 pacientes que recibían la dosis de 10 mg.
La tasa de respuesta del 40 % (es decir, de disminución del tamaño tumoral) que se observó en el grupo de 10 mg “superó con creces” la tasa de respuesta del 15 % que se observaba en el pasado con el tratamiento estándar para el CPCP que recidivó, indicaron el doctor Paz-Ares y sus colegas en la NEJM.
Es más, el 30 % de los pacientes que respondieron al medicamento tuvieron respuestas de al menos 9 meses de duración. Nos “emociona” este hallazgo, comentó el doctor Thomas, porque este cáncer en general es de crecimiento muy rápido.
La mediana de supervivencia de las personas que comenzaron a recibir 10 mg de tarlatamab fue de 14,3 meses, frente a los 6 a 12 meses de la mayoría de los tratamientos vigentes. Los investigadores aún vigilan a los participantes del estudio para conocer mejor los efectos secundarios del tarlatamab y la repercusión en el tiempo de supervivencia de las personas.
A partir de los resultados iniciales de DeLLphi-301, se usará la dosis menor (10 mg) de tarlatamab en los estudios clínicos futuros, dijo el doctor Paz-Ares.
Efectos secundarios comunes y potencialmente graves del tarlatamab
En general, los efectos secundarios del tarlatamab fueron “llevaderos”, indicó el doctor Paz-Ares, y solo alrededor del 3 % de los pacientes del estudio abandonaron el estudio por completo debido a los efectos secundarios. Por otra parte, en el 13 % de las personas del grupo de 10 mg y en el 29 % del grupo de 100 mg, se interrumpió el tratamiento por tiempo limitado, se disminuyó la dosis, o ambas cosas, a causa de los efectos secundarios.
El efecto secundario más común del tarlatamab fue el síndrome de liberación de citocinas, una respuesta potencialmente mortal en la que la inflamación se extiende por todo el cuerpo. La disminución del apetito, la fiebre y la anemia son efectos secundarios comunes, entre otros.
Casi un tercio de los pacientes presentaron efectos secundarios graves, como casos graves del síndrome de liberación de citocinas. Los efectos secundarios graves fueron más frecuentes en quienes recibieron dosis altas de tarlatamab.
La mayoría de los casos de síndrome de liberación de citocinas fueron “controlables y en general se administró tratamiento de apoyo”, como líquidos intravenosos y medicamentos para controlar la fiebre y la inflamación, explicó el doctor Paz-Ares. Sin embargo, una persona en el grupo de 10 mg murió por insuficiencia respiratoria provocada por el tratamiento.
Otro posible efecto secundario grave del tarlatamab es el síndrome de neurotoxicidad asociada a células inmunoefectoras (conocido como ICANS), que presenta una serie de trastornos neurológicos, como confusión grave, problemas de atención, temblor y debilidad muscular. El ICANS fue más común en los pacientes del grupo de tratamiento con 100 mg y llevó a que un paciente en cada grupo de dosificación abandonara el tratamiento.
Tanto el ICANS como el síndrome de liberación de citocinas se observan con frecuencia en las inmunoterapias que activan las células T para que destruyan las células cancerosas, como otras terapias BiTE y de células T con receptor quimérico para el antígeno (CAR-T).
Desafíos, inquietudes y preguntas pendientes
El doctor Thomas señaló que el estudio no se diseñó para comparar el tarlatamab con el tratamiento estándar para el CPCP. “Pero hay precedentes sólidos del rápido avance de la enfermedad con el tratamiento estándar”.
Otra cuestión, comentó, es que en la práctica clínica actual se indica que todos los pacientes con CPCP en estadio diseminado se deben tratar con quimioterapia y un inhibidor de puntos de control inmunitario en el momento del diagnóstico. Sin embargo, una de cada cuatro personas que participaron en el estudio no había recibido un inhibidor de puntos de control inmunitario. Por este motivo, sería útil saber cuán eficaz es el tarlatamab, en especial, para las personas cuyo cáncer recidivó a pesar de la inmunoterapia anterior, explicó.
También son preocupantes los posibles efectos secundarios. Ocurrieron algunos casos graves de síndrome de liberación de citocinas en el estudio; la mayoría después de recibir la primera o segunda dosis de tarlatamab. De cualquier manera, el riesgo por los efectos secundarios con las dosis iniciales “es una consideración importante”, señaló el doctor Thomas, porque hubo que hospitalizar a los pacientes durante un par de días como precaución tras recibir cada una de las primeras dos o tres infusiones de tarlatamab.
Además, las personas debían contar con un buen estado físico general para participar en el estudio, y la repercusión de los posibles efectos secundarios graves era mayor en quienes estaban más enfermos, añadió.
A causa de todos estos motivos, explicó el doctor Thomas, será importante conocer “la mejor manera de gestionar los efectos secundarios para que no sea necesario hospitalizar a los pacientes, al igual que las formas de anticipar, prevenir y tratar los efectos secundarios”.
Señaló también que algunos pacientes murieron a las 6 semanas de comenzar el tratamiento, antes de que el equipo de investigación pudiera evaluar si la causa se relacionaba con el empeoramiento del cáncer. Y “necesitamos entender mejor si estas primeras muertes fueron por los efectos secundarios”, dijo.
Por último, la doctora Garrido mencionó que otro desafío es identificar biomarcadores que pronostiquen qué pacientes tienen mayor probabilidad de responder al tarlatamab. El equipo de investigación informó que se consideró la DLL3 en las células tumorales como posible biomarcador, pero la respuesta de las personas no parecía vincularse con la presencia de la DLL3 en los tumores.
“Aunque hubo numerosos retos”, declaró la doctora Garrido, los resultados “ofrecen esperanzas renovadas para nuestros pacientes”.