La FDA modifica el uso aprobado de dos inhibidores de punto de control para cáncer de vejiga
, por Equipo del NCI
La Administración de Alimentos y Medicamentos (FDA) de los EE. UU. ha modificado la aprobación de los usos de dos fármacos de inmunoterapia para tratar a personas con la forma más común de cáncer de vejiga, carcinoma urotelial.
El año pasado, los fármacos—pembrolizumab (Keytruda) y atezolizumab (Tecentriq)—recibieron la aprobación para el tratamiento de pacientes con carcinoma urotelial sin tratamiento previo que se había diseminado más allá de la vejiga. Las aprobaciones de 2017 cubrían el uso de los fármacos para pacientes que, debido a otros factores médicos, no podían recibir el fármaco quimioterapéutico cisplatino, que es el tratamiento convencional para pacientes con cáncer avanzado de vejiga.
Aproximadamente la mitad de las personas a quienes se les diagnostica cáncer de vejiga que se ha diseminado no pueden recibir cisplatino, explicó la doctora Andrea B. Apolo, de la Unidad de Cánceres Genitourinarios (GMB) del Centro de Investigación Oncológica en el NCI.
Las aprobaciones del año pasado se basaron en los resultados de dos estudios clínicos pequeños en fase inicial. Sin embargo, el 20 de junio, la FDA anunció que los datos de dos estudios clínicos en curso más grandes indicaron que los pacientes con cáncer metastático de vejiga tratados con pembrolizumab o atezolizumab murieron antes que quienes fueron tratados con un esquema convencional de quimioterapia.
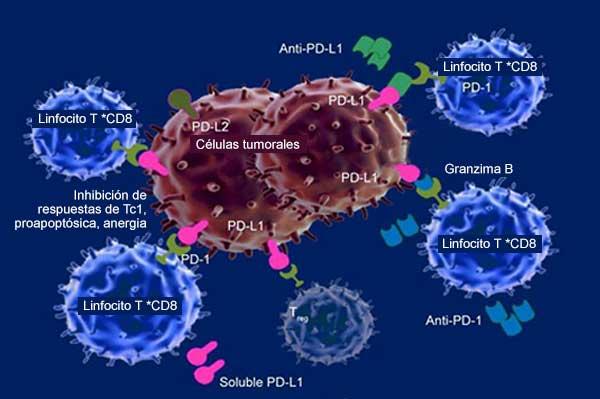
La supervivencia más limitada se observó específicamente en personas cuyas células tumorales tenían concentraciones muy bajas de la proteína PD-L1.
A consecuencia de los nuevos hallazgos, la FDA anunció que modificaría la etiqueta de información para ambos fármacos. De acuerdo con este cambio, pembrolizumab y atezolizumab deben usarse como tratamiento inicial, o de primera línea, solo en personas con cáncer metastático de vejiga que no pueden recibir quimioterapia con cisplatino y cuyos tumores tienen una alta concentración de PD-L1. La concentración de PD-L1 debe evaluarse con una prueba autorizada por la FDA.
La doctora Apolo señaló que, de acuerdo con los cambios en las indicaciones, los pacientes que no pueden tratarse con ninguna terapia que contenga platino aún pueden recibir uno de los fármacos de inmunoterapia, independientemente de la concentración de PD-L1.
Seguimiento a las aprobaciones aceleradas
Pembrolizumab y atezolizumab son inhibidores de punto de control inmunitario, y ambos están aprobados por la FDA para tratar pacientes con cáncer metastático de vejiga que siguió empeorando con tratamientos convencionales como combinaciones de fármacos quimioterapéuticos.
La ampliación de las aprobaciones de ambos fármacos como tratamientos de primera línea en 2017 fueron aprobaciones aceleradas, basándose en los hallazgos de estudios clínicos pequeños que indicaron que los tumores de algunos pacientes se habían reducido después del tratamiento. Sin embargo, debido a que en estos estudios no se hizo distribución al azar para comparar los fármacos con los tratamientos convencionales, no se pudo demostrar si los pacientes que recibieron los fármacos de inmunoterapia vivieron más tiempo.
De acuerdo con la aprobación acelerada, los fabricantes de los fármacos deben llevar a cabo un estudio más grande para confirmar que el fármaco realmente tiene beneficios significativos para los pacientes, como mayor supervivencia o mejor calidad de vida.
La FDA notificó que los análisis iniciales de los datos provenientes de estos dos estudios de confirmación, KEYNOTE-361 (pembrolizumab) e IMvigor 130 (atezolizumab), demostraron que los pacientes con una concentración baja de PD-L1 que recibieron solo el inhibidor de punto de control "presentaron una reducción en la supervivencia, en comparación con los pacientes que recibieron cisplatino o quimioterapia con carboplatino".
La concentración de PD-L1 se ha estudiado ampliamente como biomarcador de la respuesta al tratamiento con inhibidores de punto de control. La presencia de PD-L1 en las células tumorales influye en la disminución de la respuesta inmunitaria, y tanto pembrolizumab como atezolizumab impiden ese proceso. Varias aprobaciones de inhibidores de punto de control se han limitado a personas cuyos tumores presentan concentraciones elevadas de PD-L1.
Sin embargo, dijo la doctora Apolo, al basar la elección de tratamiento para estos pacientes en la concentración de PD-L1 se "coloca al oncólogo en la difícil posición de encontrar un laboratorio que pueda realizar el análisis adecuado de esa terapia específica". La doctora explicó que "cada uno de los análisis que se usan para evaluar atezolizumab y pembrolizumab estudia diferentes células, aún se está afinando el valor de corte del resultado "positivo" para cada análisis, y algunos pacientes quizá no tengan tejido disponible para las pruebas".
Asimismo, en el caso de los pacientes que no pueden recibir cisplatino, elegir un tratamiento basándonos en la concentración de PD-L1 en sus tumores "quizá elimine una opción de tratamiento viable y eficaz para algunos pacientes", dijo la doctora Apolo. "Basándose en los estudios notificados que llevaron a estas aprobaciones, aproximadamente 20 a 30 % de los pacientes con cáncer de vejiga que no pueden recibir cisplatino, y tienen una concentración baja de PD-L1, tuvieron respuestas durables a atezolizumab o a pembrolizumab".
De acuerdo con la FDA, se dejaron de inscribir en los estudios KEYNOTE-361 o IMvigor 130 a los pacientes con bajas concentraciones de PD-L1.
Evolución de la función de la inmunoterapia en el cáncer de vejiga
No nos sorprende que los pacientes que recibieron quimioterapia respondieron bien al tratamiento, dijo la doctora Apolo, quien preside la Unidad de Cáncer de Vejiga de GMB. La doctora explicó que la "quimioterapia es muy activa en pacientes con carcinoma urotelial".
De hecho, continuó la doctora Apolo, la evidencia proveniente de estudios previos sobre cáncer de vejiga ha demostrado que los índices con los que se encogen los tumores de los pacientes son más altos después del tratamiento de primera línea con quimioterapia que incluye cisplatino o carboplatino, en comparación con el índice de los pacientes que no pueden recibir cisplatino tratados en primera línea con un inhibidor de punto de control.
Sin embargo, los pacientes cuyos tumores sí responden a los inhibidores de punto de control tienden a mantener esas respuestas por largos períodos, dijo la doctora. Por lo tanto, la observación inicial en estos estudios fue que la prolongación de estas respuestas "se traduciría en una mejor supervivencia".
Aún no están disponibles los datos sobre si habrá mejoras en la supervivencia de los pacientes con concentración elevada de PD-L1 tratados solo con inhibidores de punto de control. Además, los estudios KEYNOTE-361 e IMvigor 130 tienen también grupos de tratamiento que están recibiendo el fármaco de inmunoterapia en combinación con quimioterapia, pero los datos sobre la eficacia para esos grupos aún no están disponibles tampoco.
La doctora Apolo recalcó que, en pacientes cuyos cánceres han empeorado después de la quimioterapia, "aún se considera que la inmunoterapia con inhibidores de punto de control [sola] es el tratamiento convencional".