La FDA aprueba dos pruebas que usan muestras de sangre para orientar el tratamiento del cáncer
, por el Equipo del NCI
La Administración de Alimentos y Medicamentos (FDA) aprobó dos biopsias líquidas que usan muestras de sangre para ayudar a orientar las decisiones de tratamiento de las personas con cáncer. Guardant360 CDx y FoundationOne Liquid CDx son pruebas elaboradas por distintas compañías que recibieron aprobaciones separadas.
Tradicionalmente, los médicos tomaban las decisiones sobre el tratamiento del paciente de cáncer según características como el órgano en donde comenzaba el cáncer, la diseminación del cáncer y la presencia de otras enfermedades. Ahora suelen contar con otra característica más para orientar el tratamiento: los cambios genéticos en el tumor.
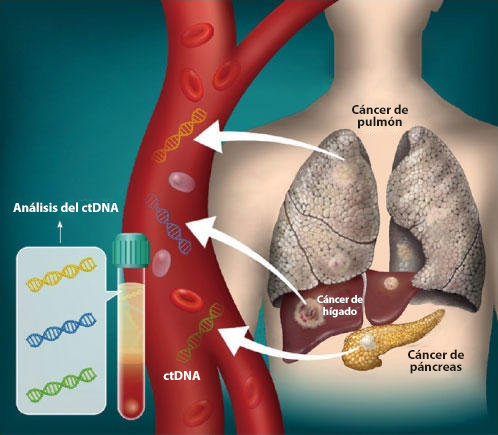
Algunos tratamientos, llamados terapias dirigidas e inmunoterapias, funcionan mejor contra los tumores con cambios genéticos específicos. Estas pruebas recién aprobadas identifican cambios genéticos, incluso mutaciones, al detectar el ADN que los tumores dispersan en la sangre (ADN tumoral circulante).
Esta información ayuda a los médicos a determinar si hay alguna terapia dirigida o inmunoterapia que funciona mejor para el paciente. El estudio de los cambios genéticos en el cáncer de un paciente se llama caracterización tumoral, análisis del perfil genómico o secuenciación tumoral.
Tanto Guardant360 CDx como FoundationOne Liquid CDx se aprobaron para el uso en personas con cualquier tipo de tumor sólido (por ejemplo, de pulmón, de próstata), pero no en personas con cánceres de la sangre. Aunque la FDA aprobó antes otras pruebas que usan muestras de sangre para detectar el ADN tumoral de una mutación en un solo gen, estas son las primeras pruebas de sangre aprobadas para detectar múltiples cambios genéticos relacionados con el cáncer.
Las biopsias líquidas a veces son una alternativa a la biopsia tradicional para la que se debe obtener una muestra de tejido tumoral mediante una aguja o cirugía. Se consideran menos invasivas y más rápidas que una biopsia de tejido tradicional.
“Aunque estas pruebas ya existían desde hace un tiempo, no sabemos cuán útiles serán en el entorno clínico”, comentó el doctor y licenciado en Medicina Ben Ho Park, del Centro Oncológico Vanderbilt-Ingram. Todavía se están descifrando muchos detalles sobre la forma de incorporar estas pruebas a la atención de rutina de las personas con cáncer. Falta determinar quiénes se deben hacer las pruebas y si las compañías de seguros privados cubren el costo.
Según el doctor Park, la aprobación de la FDA valida el uso de los resultados de una prueba de caracterización tumoral en sangre con el propósito de orientar la selección de terapias dirigidas.
Comentó que, “es fantástico que ahora hayamos superado ese obstáculo. Es genial para los pacientes [porque las pruebas] son más fáciles de conseguir”.
Pruebas diagnósticas con fines terapéuticos y caracterización tumoral general
La FDA aprobó Guardant360 CDx el 7 de agosto y FoundationOne Liquid CDx el 26 de agosto. Las aprobaciones se fundamentaron en datos de cientos de pacientes con una variedad de tipos de cáncer. Los datos indicaron que los resultados de ambas pruebas coincidieron con los de otras pruebas de caracterización tumoral cuya precisión estaba comprobada.
Ambas pruebas sirven para dos propósitos distintos: prueba diagnóstica con fines terapéuticos y caracterización tumoral general. Las pruebas diagnósticas con fines terapéuticos se usan para obtener información clave sobre el uso seguro y eficaz de un medicamento en particular. En este caso, las pruebas determinan si el tumor de un paciente tiene un cambio genético para el que hay un medicamento específico.
Guardant360 CDx, elaborada por Guardant Health, se aprobó como prueba diagnóstica con fines terapéuticos para el osimertinib (Tagrisso), un tratamiento del cáncer de pulmón. FoundationOne Liquid CDx, elaborada por Foundation Medicine, se aprobó como prueba diagnóstica con fines terapéuticos para tres tratamientos de cáncer de pulmón y un tratamiento de cáncer de próstata. Hay estudios clínicos en curso que examinan el uso de ambas como pruebas diagnósticas con fines terapéuticos para otras indicaciones.
Hay terapias dirigidas aprobadas por la FDA para algunos de los cambios genéticos adicionales que se detectan con las pruebas. Sin embargo, las pruebas no incluyen la designación de prueba diagnóstica para esos tratamientos.
| Indicaciones aprobadas de las pruebas diagnósticas Guardant360 CDx y FoundationOne Liquid CDx | |||
| Prueba | Tipo de cáncer | Cambio genético | Medicamento correspondiente |
| Guardant360 CDx | Cáncer de pulmón de células no pequeñas | Deleciones en el exón 19 de EGFR Mutación en L858R Mutación en T790M |
Osimertinib |
| FoundationOne Liquid CDx | Cáncer de pulmón de células no pequeñas | Deleciones en el exón 19 de EGFR Mutación en L858R |
Osimertinib Gefitinib Erlotinib |
| FoundationOne Liquid CDx | Cáncer de próstata | Alteraciones en BRCA1 y BRCA2 | Rucaparib |
Por ejemplo, FoundationOne Liquid CDx detecta una característica genética llamada inestabilidad microsatelital. El medicamento pembrolizumab (Keytruda) se aprobó para uso en pacientes con tumores que tienen esta característica, sin importar la parte del cuerpo donde haya comenzado el cáncer.
Las pruebas también se aprobaron para la caracterización tumoral general. Guardant360 CDx detecta cambios en más de 60 genes. FoundationOne Liquid CDx, por otra parte, identifica cambios en más de 300 genes, así como otras características genéticas que hacen que los tumores sean más sensibles al tratamiento con ciertas inmunoterapias.
Si una de estas pruebas de sangre detecta un cambio genético para el que hay un tratamiento, pero las indicaciones de la prueba diagnóstica no incluyen esa terapia dirigida, “no significa que ese medicamento no podría funcionar”, explicó el doctor Park. Agregó que “solo quiere decir que [la compañía] no completó el trámite [para obtener la aprobación] de prueba diagnóstica con fines terapéuticos” para ese medicamento en particular.
“Las indicaciones de uso como prueba diagnóstica con fines terapéuticos solo incluyen unos pocos cambios genéticos que corresponden a un tratamiento específico para el paciente”, comentó la doctora Ana Robles, experta en caracterización tumoral, de la Oficina para Investigaciones Clínicas y Proteómicas sobre el Cáncer del NCI. Agregó que, en otras palabras, “las normas reglamentarias no han avanzado al mismo ritmo que la ciencia”.
En algunos hospitales y centros oncológicos, los grupos de médicos de distintas especialidades se reúnen para examinar los resultados de las pruebas de caracterización tumoral de los pacientes. Estos grupos, llamados consejos de caracterización molecular tumoral, toman en cuenta los conocimientos y hallazgos de investigación más recientes para recomendar un tratamiento, comentó el doctor Park. Él es miembro del consejo de caracterización molecular del hospital donde trabaja, y analiza las pruebas de biopsia líquida para el cáncer de seno (mama).
Es posible que, a partir de los resultados de una de estas pruebas, el oncólogo recomiende una terapia dirigida que no se incluye en la indicación aprobada de la prueba diagnóstica.
Los resultados de estas pruebas también podrían ofrecer a los pacientes la oportunidad de inscribirse en estudios clínicos. En algunos estudios, la investigación se centra en pacientes cuyo cáncer tiene cambios genéticos específicos, en vez de guiarse por el tipo de cáncer.
¿Quién debería hacerse estas pruebas de sangre para la caracterización tumoral?
El uso de la caracterización tumoral, ya sea mediante el análisis de muestras de tejido o de sangre, se recomienda para pacientes de cáncer metastásico que ya no les queda otra opción de tratamiento estándar ni tienen la oportunidad de inscribirse en un estudio clínico para su tipo de cáncer, explicó el doctor Park.
Agregó que, aunque Guardant360 CDx y FoundationOne Liquid CDx se aprobaron para cualquier paciente con un tumor sólido, quizás haya determinadas situaciones para las que estas pruebas sean más adecuadas.
Por ejemplo, hay veces que es difícil hacer una biopsia de tejido sin peligro por la ubicación del tumor, como cuando está en el pulmón o el encéfalo. En ese caso, sería mejor que a la persona le hagan una prueba de sangre para la caracterización tumoral, comentó la doctora Robles.
Aunque se pueda llegar al tumor, a algunos pacientes no se les puede hacer la biopsia de tejido preferida, que es la biopsia por punción con aguja gruesa. Esto podría suceder si el paciente recibe tratamiento con anticoagulantes, no tiene suficiente tejido tumoral disponible o está demasiado enfermo para someterse a la biopsia.
“De nuevo, esa podría ser una situación en la que preferiríamos usar una biopsia líquida”, comentó el doctor Park.
Pero, indicó que, si es fácil y no hay peligro en llegar al tumor del paciente para hacer una biopsia por punción con aguja gruesa, entonces eso es preferible a una biopsia líquida.
Los pacientes deben averiguar si el seguro médico cubrirá el costo de los análisis. Medicare cubre ambas pruebas. Sin embargo, en las compañías de seguros privados, la cobertura de las pruebas de biopsia líquida varía según la compañía y el tipo de prueba que se usa. En muchos casos, el costo solo se cubre si la prueba se usó para detectar cambios genéticos que tienen aprobaciones para pruebas diagnósticas con fines terapéuticos. Sin embargo, las políticas de cobertura para las biopsias líquidas cambian de forma constante.
¿Tienen suficiente sensibilidad los análisis?
Cuando se elaboraron las biopsias líquidas por primera vez, la pregunta principal era, “si es que observamos [un cambio genético] en la sangre, ¿podemos confiar en que [este cambio también] está en el tumor?”, comentó la doctora Robles. Agregó que, ahora el consenso es que los cambios genéticos que se encuentran en la sangre representan con precisión los que están en el tumor.
Sin embargo, de todos modos, tal vez haya diferencias entre los resultados de los análisis de caracterización tumoral realizados en sangre y en tejido, explicó la doctora Robles. También aclaró que esas diferencias tal vez no se deban a la precisión de los análisis de sangre, sino a las características biológicas del tumor. Por ejemplo, algunos tumores no liberan tanto ADN en la sangre como otros.
La ubicación y el tamaño del tumor, y la presencia de más de un tumor, también influyen en la cantidad de ADN tumoral que se encuentra en la sangre, comentó el doctor Park.
Explicó que muchas veces no hay suficiente ADN tumoral en la sangre de un paciente para que los análisis detecten cambios genéticos de forma confiable. Añadió que, “en cierto modo, depende de la suerte de conseguir una muestra de sangre que, por casualidad, tiene ese ADN en suficiente cantidad”.
Así que, si en las pruebas de caracterización tumoral en sangre no se identifica ningún cambio genético, el doctor Park indicó que, en vez de considerarlo un resultado negativo, lo consideraría no concluyente.
Explicó que, si eso sucede, la FDA recomienda que al paciente se le realice una biopsia de tejido para detectar cambios genéticos.