FDA aprueba nuevo fármaco de inmunoterapia para cáncer de vejiga
, por Equipo del NCI
ACTUALIZACIÓN: El 8 de marzo de 2021, la compañía farmacéutica Roche retiró de forma voluntaria la indicación de uso del atezolizumab (Tecentriq) para tratar el cáncer de vejiga metastásico en personas que recibieron tratamiento anterior en los Estados Unidos. Esta decisión ocurrió después de que Astra Zeneca retiró de forma voluntaria la indicación de uso del durvalumab (Imfinzi) para tratar el cáncer de vejiga localmente avanzado o metastásico en personas en que este cáncer volvió o continuó en crecimiento a pesar de un tratamiento anterior.
Ambos medicamentos, que funcionan al inhibir la proteína PD-L1, recibieron la aprobación acelerada de la Administración de Alimentos y Medicamentos (FDA) a partir de las tasas de respuesta tumoral observadas en los estudios clínicos iniciales. Los estudios de confirmación no cumplieron con los criterios de valoración de mejora de supervivencia general necesarios para que los medicamentos recibieran la aprobación normal de la FDA. En la publicación a continuación, se describen los detalles del estudio del atezolizumab que llevó a la aprobación acelerada del medicamento.
La Administración de Alimentos y Medicamentos (FDA) aprobó el 18 de mayo el atezolizumab (Tecentriq®) para el tratamiento de algunos pacientes con carcinoma del urotelio, el tipo más común de cáncer de vejiga. El fármaco, el cual refuerza la respuesta inmunitaria del cuerpo contra el cáncer, es el primer tratamiento nuevo aprobado para cáncer de vejiga en dos décadas.
“Estas son noticias muy excitantes para pacientes con cáncer de vejiga”, dijo el doctor Piyush Agarwal, jefe de la Sección de Cáncer de Vejiga en el Centro de Investigación Oncológica (CCR) del NCI Unidad de Oncología Urológica, quien indicó que la aprobación abrirá “una ola de estudios clínicos nuevos” para pacientes con cáncer de vejiga. La FDA aprobó el atezolizumab para pacientes con carcinoma urotelial metastático o localmente avanzado que ha empeorado durante el tratamiento con quimioterapia de platino o después de este.
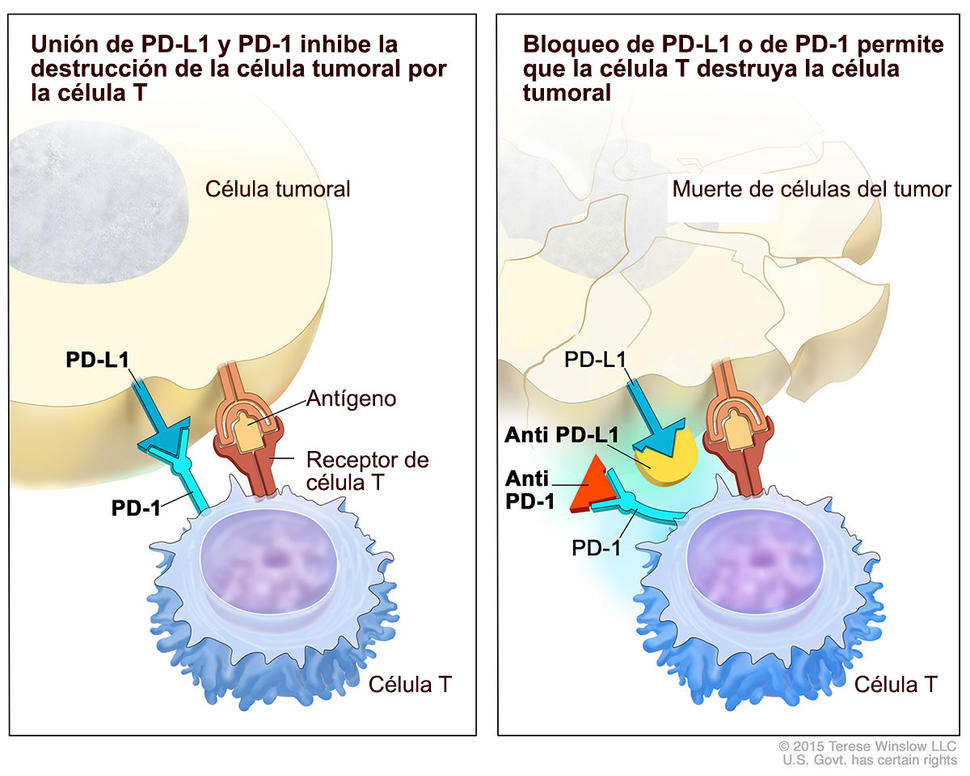
El atezolizumab pertenece a una clase de fármacos de inmunoterapia conocidos como inhibidores de puntos de control. El fármaco impide que una proteína llamada PD-L1, que se encuentra en algunas células tumorales, se una a otra proteína, PD-1, en las células inmunitarias. La unión de estas proteínas de “punto de control” suprime la respuesta inmunitaria. Al bloquear esta interacción, los inhibidores de punto de control “sueltan los frenos” en el sistema inmunitario y permiten que las células inmunitarias ataquen a los tumores.
“Atezolizumab es el primer inhibidor de PD-L1 aprobado por la FDA para cáncer, y esto sucede para el cáncer de vejiga”, dijo la doctora Andrea B. Apolo, quien es jefa de la Sección de Cáncer de Vejiga en la Unidad de Malignidades Genitourinarias del Centro de Investigación de Cáncer. Hasta ahora, añadió ella, los pacientes cuyos cánceres no respondieron a quimioterapia tenían muy pocas, si es que las tuvieron, opciones de tratamiento.
Evaluación de atezolizumab
La aprobación de atezolizumab estuvo basada en un estudio de 310 pacientes con carcinoma urotelial avanzado o metastático cuyos cánceres habían empeorado durante el tratamiento con quimioterapia con platino o en los doce meses de recibir quimioterapia que contenía platino, ya sea antes o después de cirugía. Todos los pacientes en el estudio recibieron atezolizumab.
Aproximadamente 15% de los pacientes tuvieron al menos un encogimiento parcial de sus tumores, y este efecto duró por lo menos desde 2,1 meses hasta más de 13,8 meses reportaron los autores del estudio.
Los efectos secundarios más comunes de tratamiento con atezolizumab fueron fatiga, disminución de apetito, náuseas, infección de vías urinarias, fiebre y constipación. La terapia puede también causar infección y efectos secundarios graves relacionados con el sistema inmunitario.
En el estudio, la expresión mayor de PD-L1 en tumores de pacientes estuvo asociada con el atezolizumab. Entre los participantes del estudio cuyos tumores fueron clasificados como “positivos” por expresión de PD-L1, 26% experimentaron una respuesta del tumor, en comparación con 9,5% de los participantes cuyos tumores fueron “negativos” por expresión de PD-L1.
Al mismo tiempo que aprobó atezolizumab, la FDA aprobó una prueba llamada Ventana PD-L1 (SP142), para medir la expresión de PD-L1 en las células inmunitarias que se infiltran en el tumor del paciente.
La doctora Apolo indicó que no se requiere que los pacientes se hagan la prueba para recibir atezolizumab, y advirtió que los pacientes cuyos tumores estén clasificados como faltos de expresión de PD-L1 podrían todavía responder a la terapia. “No pienso que estemos preparados para excluir a pacientes como candidatos al fármaco con base en los resultados de la prueba”, comentó ella.
Exploración de la respuesta inmunitaria
En la actualidad, uno de los tratamientos principales para cáncer de vejiga sin invasión del músculo es una terapia con base en lo inmunitario llamada BCG (bacilo de Calmette-Guérin). Los pacientes reciben una forma debilitada de la bacteria Mycobacterium bovis en una solución para estimular el sistema inmunitario contra el cáncer.
Aunque el BCG no es nuevo, los investigadores tienen todavía algunas cuestiones que no han recibido respuesta acerca de cómo funciona el tratamiento, indicó el doctor Agarwal.
“Es un tiempo excitante”, continuó el doctor Agarwal. “El tratamiento más efectivo para cáncer de vejiga ha sido una inmunoterapia. Con la introducción de más inmunoterapias, ahora tenemos la oportunidad de aprender más acerca de cómo funciona el BCG”.
Basándose en los resultados preliminares de estudios clínicos, los investigadores han sabido por varios años que los inhibidores de puntos de control son activos en algunos pacientes con cáncer de vejiga. El campo, explicó la doctora Apolo, ahora es tener en cuenta las formas de mejorar el índice de respuesta a las inmunoterapias y posiblemente para intensificar la respuesta inmunitaria en los pacientes.
Una estrategia que se está explorando en los estudios clínicos es evaluar combinaciones de inmunoterapias. Este planteamiento podría ser importante para pacientes cuyos cánceres no responden a sustancias solas o dejan de responder. Además, los estudios futuros tienen la probabilidad de explorar el uso de atezolizumab en estadios iniciales de la enfermedad, posiblemente como terapia de primera línea en enfermedad metastática, y hasta en estados iniciales de la enfermedad como enfermedad invasora del músculo y no, anotó la doctora Apolo.